摘要gydF4y2Ba
气道炎症和重塑是哮喘和其他呼吸疾病的重要病理生理特征。完整的上皮细胞层对维持肺稳态至关重要,这取决于细胞间粘附,而受损的呼吸道上皮是气道炎症的主要诱因。柯萨奇病毒腺病毒受体(CAR)在上皮细胞中高度表达,它调节细胞-细胞粘附的稳定性,促进免疫细胞经上皮迁移。然而,CAR对肺炎症的作用尚不清楚。在这里,我们研究CAR在介导对常见的空气过敏原,屋尘螨(HDM)的反应中的机制贡献。我们证明,在呼吸上皮中缺乏CAR的小鼠中给药HDM会导致支气管周围炎症细胞浸润减少,杯状细胞减少,促炎细胞因子释放减少。体外人肺上皮细胞分析证实,CAR缺失导致hdm依赖性炎症细胞因子释放和中性粒细胞迁移减少。上皮CAR耗竭也促进了GSK3β和TGF-β介导的平滑肌细胞增殖、基础基质生成和气道高反应性。我们的数据表明CAR通过白细胞招募和组织重构的双重功能来协调肺部炎症,这可能是未来炎症性肺病治疗发展的一个重要靶点。gydF4y2Ba
简介gydF4y2Ba
在气道中,一层简单的极化上皮细胞提供了物理保护屏障,并通过与免疫系统的持续通信,对环境伤害做出主要防御反应gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.越来越多的人认识到,免疫系统和上皮细胞的相互作用有助于驱动广泛的呼吸疾病的病理过程gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.上皮细胞排列在呼吸道上,其主要功能是保护呼吸道免受潜在病原体、感染/损伤的伤害,并促进气体交换。气管和支气管的上皮是假分层的,主要由三种主要细胞类型组成:纤毛细胞、杯状细胞和基底细胞。纤毛细胞促进黏液通过气道的运动,杯状细胞产生和分泌黏液,以捕获气道内的病原体和碎片。基底细胞是为了恢复上皮细胞层而在损伤后分化为上皮细胞类型的祖细胞gydF4y2Ba5gydF4y2Ba.完整的上皮细胞对维持肺稳态至关重要,这取决于细胞间粘附,而细胞间粘附是由细胞基底外侧表面的细胞连接调节的。细胞连接包括顶端紧密连接和更多的基底粘附连接,这是通过受体之间的蛋白-蛋白相互作用控制的,包括钙粘蛋白和连接粘附分子(JAM)家族分子,偶联到细胞质结合伙伴。e -钙粘蛋白是上皮细胞粘附连接的关键受体gydF4y2Ba2 +gydF4y2Ba-依赖的同型二聚体与相反的e -钙粘蛋白在邻近细胞上。e -钙粘蛋白的稳定部分由与细胞质衔接蛋白的相互作用控制;β连环蛋白和p120-catenin。这些复合物与紧密连接蛋白(包括闭塞蛋白和ZO-1)协同作用,以维持溶质的通过、气道上皮屏障的形成和完整性gydF4y2Ba6克ydF4y2Ba.在感染、过敏原暴露、污染和化学暴露的反应中,上皮完整性的丧失可引发气道炎症,在过敏原暴露的情况下,有助于致敏gydF4y2Ba7 gydF4y2Ba.gydF4y2Ba
柯萨奇病毒和腺病毒(Ad)受体(CAR)是JAM家族和免疫球蛋白超家族的成员,在反式细胞中通过同质相互作用发挥细胞-细胞粘附分子的作用。CAR最初被认为是柯萨奇病毒和Ad细胞结合的主要受体gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.然而,我们的工作和其他人在过去十年的工作已经证明CAR有助于稳定上皮细胞-细胞的粘附,作为粘附和紧密连接相关蛋白gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.靶向去除种系CAR会导致心脏衰竭导致早期胚胎死亡gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.在成年小鼠中,条件敲除CAR会导致与细胞间粘附有关的多种缺陷,包括肠道扩张、胰腺萎缩和完全性房室传导阻滞gydF4y2Ba19gydF4y2Ba.除了在反式中形成同型二聚体外,上皮CAR也被证明在反式中与JAM家族蛋白的其他成员结合,包括JAM- l、-A和-C,它们在白细胞(包括中性粒细胞和γδ T细胞)表面表达。这促进了白细胞经上皮迁移和激活gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.促炎细胞因子有助于白细胞的跨上皮迁移,也被证明调节JAM家族蛋白的定位和功能gydF4y2Ba23gydF4y2Ba.我们最近的研究表明,CAR在上皮细胞中的水平控制连接蛋白的动态,这部分是通过PKCδ磷酸化CAR - c端S290/T293来调节的gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.我们进一步将促炎细胞因子TNF定义为在体外和体内促进肺上皮细胞中磷酸化CAR的细胞因子,并证明这需要CAR在反式中同二聚体gydF4y2Ba15gydF4y2Ba.这些发现,结合其他证据,强调了上皮细胞作为肺部炎症主要调节因子的重要性,使CAR成为上皮细胞和免疫细胞之间相互作用的潜在调节因子。这反过来可能在哮喘和慢性阻塞性肺疾病(COPD)等肺部疾病的发生和进展中起作用。gydF4y2Ba
在这里,我们提出的证据表明上皮CAR通过免疫细胞浸润和组织重构的双重促进对肺过敏原诱导的炎症反应。我们的数据显示,car -缺陷的气道上皮细胞在屋尘螨(HDM)损伤后显著减少促炎细胞因子释放和支气管周围炎症,同时减少了屋尘螨诱导的组织重构。缺乏CAR的人支气管上皮细胞在HDM治疗后细胞因子释放减少,这导致了减少免疫细胞迁移和抑制成纤维细胞和平滑肌细胞增殖的双重作用。HDM诱导CAR在体外磷酸化,导致CAR在上皮细胞连接处的动态增加,并使CAR从力学敏感的结合伙伴小泡蛋白-1分离。CAR是触发细胞因子释放以促进中性粒细胞和γδ t细胞在HDM挑战时向肺募集,加剧组织重构所必需的。然而,我们也证明了在气道上皮细胞中消耗CAR会增强上皮细胞TGF-β的激活,导致基底基质沉积。我们假设由促炎因子诱导的CAR的磷酸化使细胞膜上的受体不稳定,并从上皮细胞诱导促炎因子,同时促进CAR免疫细胞的相互作用,以诱导组织水平的炎症。我们的数据表明CAR在促进肺炎症和维持肺组织稳态方面具有双重作用。gydF4y2Ba
结果gydF4y2Ba
CAR促进中性粒细胞和γδ t细胞肺浸润对HDM的反应gydF4y2Ba
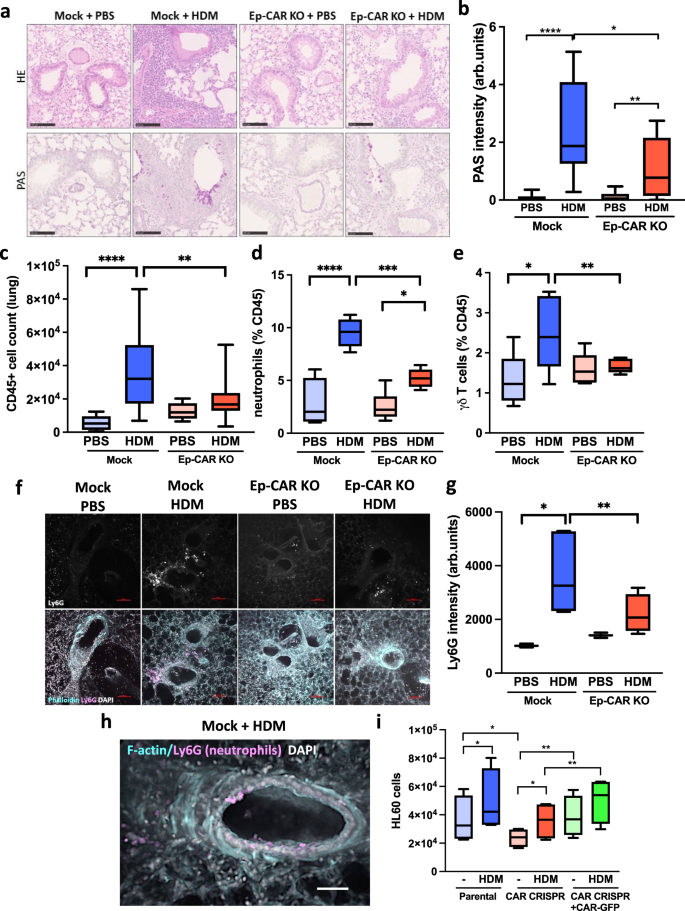
为了探索CAR在肺上皮稳态中的作用,我们通过将Scgb1a1-CreER小鼠与CAR交叉,特异性地从气道俱乐部细胞中删除CARgydF4y2Bafl / flgydF4y2Ba老鼠gydF4y2Ba19gydF4y2Ba(补充图。gydF4y2Ba1gydF4y2Ba).使用他莫昔芬治疗的小鼠肺切片免疫染色证实了气道上皮细胞CAR的缺失(补充图。gydF4y2Ba1 bgydF4y2Ba)和全肺提取物的qPCR(补充图。gydF4y2Ba1 cgydF4y2Ba).我们进一步证实,与用玉米油治疗的对照组小鼠相比,C57BL/6小鼠单独治疗他莫西芬不会导致肺部免疫细胞谱的改变(补充图。gydF4y2Ba1 d, egydF4y2Ba).为了分析上皮CAR在过敏原诱导炎症中的作用,我们用PBS或HDM治疗对照小鼠(Mock)或肺上皮CAR敲除小鼠(Ep-CAR KO) 5周,并分析支气管肺泡灌洗液(BAL)和肺组织内的免疫应答。HDM在Mock和Ep-CAR - KO小鼠的BAL中诱导了强烈的炎症反应(补充图。gydF4y2Ba2gydF4y2Ba),攻毒前后两组免疫细胞谱无变化(补充图。gydF4y2Ba两个罪犯gydF4y2Ba).然而,细胞浸润肺部和h&e染色组织的分析显示,与对照组相比,hdm挑战的Ep-CAR - KO小鼠的整体免疫细胞浸润明显减少(图1)。gydF4y2Ba1 a, cgydF4y2Ba).我们注意到,虽然它莫西芬单独没有诱导免疫反应(补充图。gydF4y2Ba1 d, egydF4y2Ba),在我们的组中没有小鼠同时使用他莫西芬和HDM,因此我们不能排除这些药物在Ep-CAR - KO小鼠免疫表型中联合作用的可能性。使用周期酸-希夫(PAS)检测多糖的附加染色显示,Ep-CAR - KO肺中的多糖水平显著降低,表明粘液产生减少(图。gydF4y2Ba1 a, bgydF4y2Ba)表明对HDM的组织炎症反应全面减少。gydF4y2Ba
一个gydF4y2BaH&E代表性图像(上)和定期酸-希夫染色(PAS;从指示动物和条件的FFPE肺切片。比例尺100 μm。gydF4y2BabgydF4y2Ba每组5只小鼠PAS染色定量。每只小鼠取1个肺叶进行PAS染色,分析6个气道/小鼠;代表3个独立实验gydF4y2BacgydF4y2BaCD45gydF4y2Ba+gydF4y2Ba指示条件下肺匀浆中的阳性细胞。gydF4y2BadgydF4y2Ba%的LYC6G + ve中性粒细胞和gydF4y2BaegydF4y2BaCD45中γδ Τ细胞的%gydF4y2Ba+gydF4y2Ba肺匀浆阳性人群。为gydF4y2Ba一部gydF4y2Ba,数据来自每只老鼠的一个叶,来自5只老鼠;代表3个独立实验。gydF4y2BafgydF4y2Ba精密肺切片(pcl)的典型共焦z投影。Ly6G染色(上面板),合并图像显示(actin =青色;Ly6G =红色;DAPI =蓝色)。比例尺100 μm。gydF4y2BaggydF4y2BaLy6G平均强度的定量(如gydF4y2BafgydF4y2Ba每组每个pcl从5个气道(每只老鼠一个pcl;每实验5只);三个独立的实验。gydF4y2BahgydF4y2Ba模拟hdm处理动物气道的代表性共聚焦z投影(青色= F-actin;Ly6G =红色;DAPI =蓝色))。gydF4y2Ba我gydF4y2BaHL60细胞对特定16HBE细胞±HDM上清液的反应;gydF4y2BangydF4y2Ba=每个细胞系/条件10个,4个独立实验。所有图表显示中位数(线),25/75百分位(框)和最小/最大值。采用Dunnett事后检验的单因素方差分析来检验统计学意义,(i)采用双向方差分析和Tukey事后检验除外。gydF4y2BaPgydF4y2Ba值*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;****gydF4y2BapgydF4y2Ba< 0.0001。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
CAR可与表达在中性粒细胞和γδ T细胞上的受体异质二聚,并介导免疫细胞的迁移。事实上,肺内CAR耗竭影响的免疫细胞分析显示,中性粒细胞和γδ T细胞显著减少。gydF4y2Ba1 d, egydF4y2Ba).Ep-CAR - KO动物的中性粒细胞浸润明显减少,冷冻肺切片Ly6G染色也证实了这一点(补充图。gydF4y2Ba2摄氏度gydF4y2Ba)和精密切割肺切片(PCLS)(图。gydF4y2Ba1 f, ggydF4y2Ba).值得注意的是,我们观察到高水平的中性粒细胞与HDM挑战的模拟动物气道上皮细胞共存。gydF4y2Ba1 hgydF4y2Ba).为了了解CAR是否在吸引免疫细胞到肺中起直接作用,我们使用CRISPR从16HBE人类支气管上皮细胞中耗尽CAR,随后通过稳定感染CAR- gfp生成拯救细胞系(补充图。gydF4y2Ba二维gydF4y2Ba).为了了解清除CAR是否会影响人类上皮细胞促炎因子的分泌,我们从hdm挑战的16HBE细胞系中收集上清,并分析HL60细胞(一种特征性的人类中性粒细胞模型细胞系)的能力gydF4y2Ba24gydF4y2Ba)对transwell试验中条件培养基的化学作用。来自亲代16HBE细胞的培养基受到HDM的挑战,导致HL60迁移显著增加(图。gydF4y2Ba1我gydF4y2Ba).我们注意到HDM仍然存在于这种条件培养基中,虽然不太可能是高度活性的,但我们不能排除这部分HDM在本试验中对中性粒细胞行为的其他贡献。值得注意的是,与亲代细胞相比,来自CAR- CRISPR细胞的培养基诱导的趋化反应显著降低,这种效应在表达CAR- gfp的CRISPR细胞中得到恢复(图1)。gydF4y2Ba1我gydF4y2Ba).这些数据表明,CAR在肺上皮内的表达通过调节分泌因子促进免疫细胞的募集,也可能通过与这些细胞表面受体的直接相互作用,如前所述。gydF4y2Ba
肺上皮CAR有助于细胞因子的分泌gydF4y2Ba
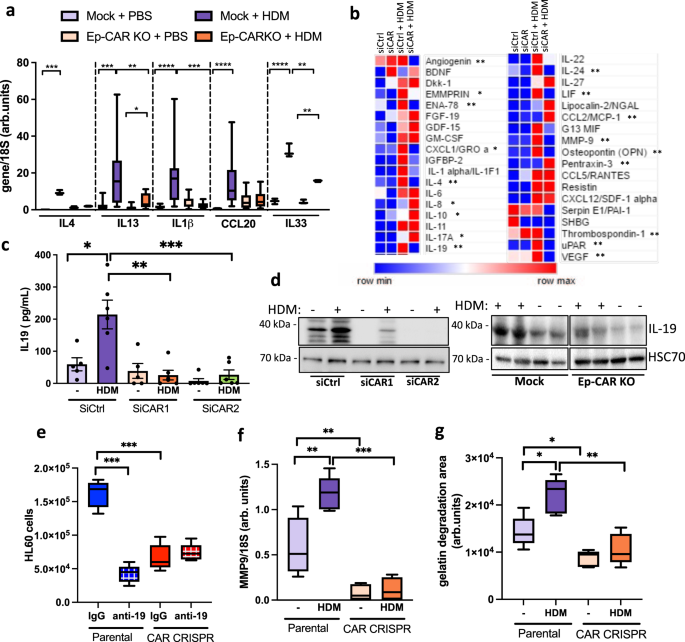
过敏反应的特征是分泌Th2细胞因子gydF4y2Ba25gydF4y2Ba.为了探索CAR是否在Th2反应中起作用,我们首先采用了一种候选方法,通过分析HDM刺激的Mock和Ep-CAR - KO小鼠肺中Th2相关细胞因子白细胞介素(IL)4、IL13、IL33、IL1β和CCL20的转录水平,因为这些细胞在哮喘中具有已知的功能gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.模拟动物在HDM刺激后显示出所有这些细胞因子的显著增加,而在Ep-CAR - KO小鼠中这种反应显著受损(图1)。gydF4y2Ba2gydF4y2Ba).为了评估具体来自上皮细胞的贡献,我们对培养中siccontrol或siCAR处理细胞的上清进行了细胞因子阵列分析。数据显示,与对照细胞相比,HDM刺激的CAR -贫细胞中几个分泌因子显著减少,包括CXCL1、IL-1α、IL-10、IL-17、IL-19、IL-24、MMP-9和LIF(图4)。gydF4y2Ba2 bgydF4y2Ba).在哮喘中被证明很重要的几个靶点(LIF1, IL-19, IL-4, MMP-10和−13)gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba随后用qPCR和ELISA进行验证。gydF4y2Ba3得了gydF4y2Ba).在显著改变的分子中,我们考虑了在HDM挑战下CAR -贫细胞中被差异调节的靶点,并将重点放在IL-19上,因为最近的报道显示该细胞因子水平与过敏性气道炎症呈正相关gydF4y2Ba29gydF4y2Ba以及典型Th2细胞因子IL-4和IL-13的增强gydF4y2Ba30.gydF4y2Ba.从体外和体内的上皮细胞中去除CAR后,验证了hdm诱导的IL-19水平的降低。gydF4y2Ba2 c, dgydF4y2Ba).我们进一步证明了IL-19水平降低在促进中性粒细胞招募方面的功能相关性,方法是用IL-19功能阻断抗体处理来自16HBE细胞的条件培养基。趋化性试验表明,在IL-19阻断抗体存在的情况下,hdm诱导的HL60细胞迁移显著减少,而CAR - CRISPR培养基对HL60迁移减少的影响不受影响(图1)。gydF4y2Ba2 egydF4y2Ba).有趣的是,来自该阵列的数据也显示了CAR -贫细胞中参与细胞外基质(ECM)重构的分泌蛋白的变化,包括MMP9或uPAR(图1)。gydF4y2Ba2 bgydF4y2Ba).用qPCR证实了CAR - CRISPR肺上皮细胞中MMP9转录物的减少(图。gydF4y2Ba2 fgydF4y2Ba),而其他基质基质蛋白水平则不受影响(补充图。gydF4y2Ba3 dgydF4y2Ba).HDM处理后,在没有CAR的情况下MMP9激活和分泌减少,使用明胶降解试验验证,因为明胶是MMP9的底物。与HDM处理过的亲代细胞相比,HDM处理过的CAR - CRISPR细胞中降解明胶的水平显著降低。gydF4y2Ba2 ggydF4y2Ba).这些发现表明CAR在上皮细胞对过敏原的反应中起作用,进而导致免疫细胞浸润和组织重构。gydF4y2Ba
一个gydF4y2Ba用qPCR方法检测特定动物组肺提取物中IL4、IL13、IL1b、CCL20和IL33转录本水平。数据来自3个独立的体内实验,每组5只小鼠。gydF4y2BabgydF4y2Ba16HBE siccontrol或siCAR细胞±HDM 24 h细胞因子阵列结果总结。星号表示CAR -贫细胞+HDM与对照细胞+HDM相比有显著变化gydF4y2BacgydF4y2BaELISA法测定16HBE细胞±HDM上清液中IL-19水平24 h。图中显示了来自6个重复的集合数据,代表3个独立实验。gydF4y2BadgydF4y2Ba16HBE裂解物的Western blotgydF4y2BacgydF4y2Ba或从Mock或Ep-CAR KO小鼠的全肺匀浆中检测IL-19和GADPH水平。每个实验代表4个。gydF4y2BaegydF4y2Ba在存在对照IgG或IL-19功能阻断抗体(anti-19)的特定细胞系上清液的作用下,HL60细胞的转运。每个条件下的数据来自3个样本;代表3个独立实验。gydF4y2BafgydF4y2BaqPCR检测指定细胞中MMP9转录物±HDM 24 h的水平。每个条件下4个样本的数据;代表3个独立实验。gydF4y2BaggydF4y2Ba荧光标记明胶被指定细胞±HDM降解。每个条件的数据来自15个样本;代表3个实验。所有图表显示中位数(线),25/75百分位(框)和最小/最大值。单因素方差分析与Dunnett事后检验检验统计显著性gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba;采用双向方差分析与Tukey的事后检验gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba.P值*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.0005;****gydF4y2BapgydF4y2Ba< 0.0001。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
CAR是支气管上皮单层完整的必要条件gydF4y2Ba
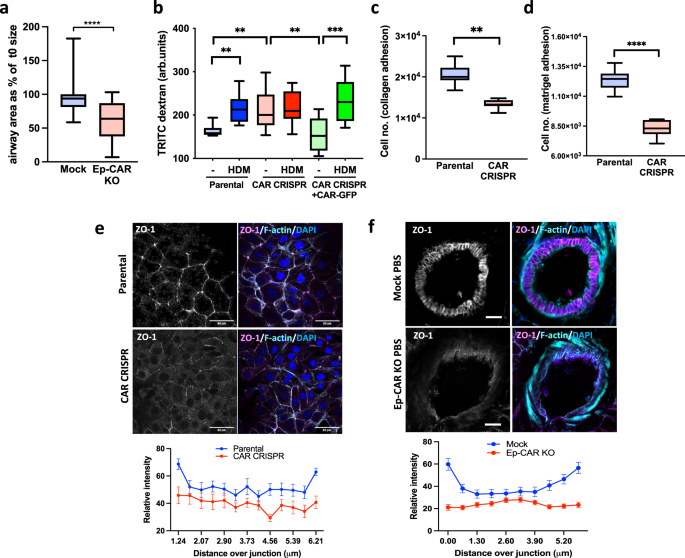
气道上皮形成了抵御环境损害的第一道结构屏障,包括沉积的空气过敏原,并有助于启动过敏性气道炎症和重塑。许多空气过敏原,包括HDM,已知会导致上皮细胞形态的改变,从而导致屏障完整性的损害gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.已知CAR可以控制上皮细胞和细胞的粘附,我们研究了从上皮细胞中消耗CAR是否会改变单层结构和完整性。对模拟小鼠和Ep-CAR - KO小鼠肺上皮层的分析表明,与PBS处理的模拟动物相比,HDM处理的模拟小鼠的上皮细胞高度显著增加。gydF4y2Ba4 a、bgydF4y2Ba).我们还观察到,与来自模拟动物的肺相比,在基础(PBS)条件下,Ep-CAR - KO肺的上皮高度显著增加,但HDM挑战没有改变(补充图。gydF4y2Ba4 a、bgydF4y2Ba).与模拟小鼠相比,Ep-CAR - KO小鼠在基础条件下的平均气道直径也减少了,这是在体外pcl中测量的,在meta -胆碱治疗后(图)。gydF4y2Ba3gydF4y2Ba)表明在上皮CAR缺失的情况下收缩力更高。为了了解这种形态的改变是否也与屏障完整性的改变相对应,通过分析trtc -葡聚糖在16HBE细胞系单分子膜上的传代来评估通透性。人类上皮细胞中CAR的缺失导致基底通透性增加,屏障完整性降低,在CAR水平恢复后,基底通透性恢复(图1)。gydF4y2Ba3 bgydF4y2Ba).有趣的是,从16HBE细胞中去除CAR也会减少I型胶原蛋白和基质的早期粘附。gydF4y2Ba3 c, dgydF4y2Ba),这表明CAR和整合素基粘附之间存在相互作用,正如我们之前在其他细胞类型中报道的那样gydF4y2Ba11gydF4y2Ba.进一步的分析表明CAR缺失后细胞-细胞粘附蛋白E-Cadherin或ZO-1的水平没有变化。gydF4y2Ba4摄氏度gydF4y2Ba),但ZO-1在体外和体内都定位错误(图。gydF4y2Ba3 e, fgydF4y2Bae -钙粘蛋白也是如此(补充图)。gydF4y2Ba4 d, egydF4y2Ba).综上所述,这些数据支持CAR通过维持最佳的细胞-细胞和细胞-基质粘附来维持基础上皮屏障的完整性。gydF4y2Ba
一个gydF4y2Ba模拟或Ep-CAR - KO小鼠的PCLS的气道直径受到0.5 g/ml的异胆碱作用15分钟。图表显示了15分钟后气道面积为起始大小的%,每组10只不同小鼠(每只小鼠1个pcl),每组35个气道。gydF4y2BabgydF4y2Ba特定细胞系的通透性测定显示trtc -葡聚糖通过细胞单层±HDM的水平。数据来自每个实验条件下的3口井:代表3个实验。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaI型胶原蛋白的粘附细胞数量gydF4y2BacgydF4y2Ba或人工基底膜gydF4y2BadgydF4y2Ba镀膜孔2小时后电镀。数据来自每个条件下的9口井:代表3次实验。gydF4y2BaegydF4y2BaZO-1(洋红色),F-actin(青色)和DAPI(蓝色)染色的特定细胞的代表性共聚焦图像。比例尺:50 μm。下图是细胞交界处ZO-1信号强度的定量线扫描分析。数据汇集自30个细胞每个条件代表3个独立实验。gydF4y2BafgydF4y2Ba模拟或Ep-CAR - KO小鼠固定pcl的代表性共聚焦图像,染色为ZO-1(品红色),F-actin(青色)和DAPI(蓝色)。比例尺:50 μm。每个条件下从50个细胞收集数据。每组分析3个不同小鼠的pcl;代表3个独立实验。所有图均显示25/75百分位的中位数(线)(框)和最小/最大值(e,f除外,其中表示±SEM。的数据进行了未配对的二尾学生t检验gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba;采用双向方差分析与Tukey的事后检验gydF4y2BabgydF4y2Ba.gydF4y2BaPgydF4y2Ba值* *gydF4y2BapgydF4y2Ba< 0.01;****gydF4y2BapgydF4y2Ba< 0.0001。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
HDM处理会导致连接处的磷酸化和CAR的运动增加gydF4y2Ba
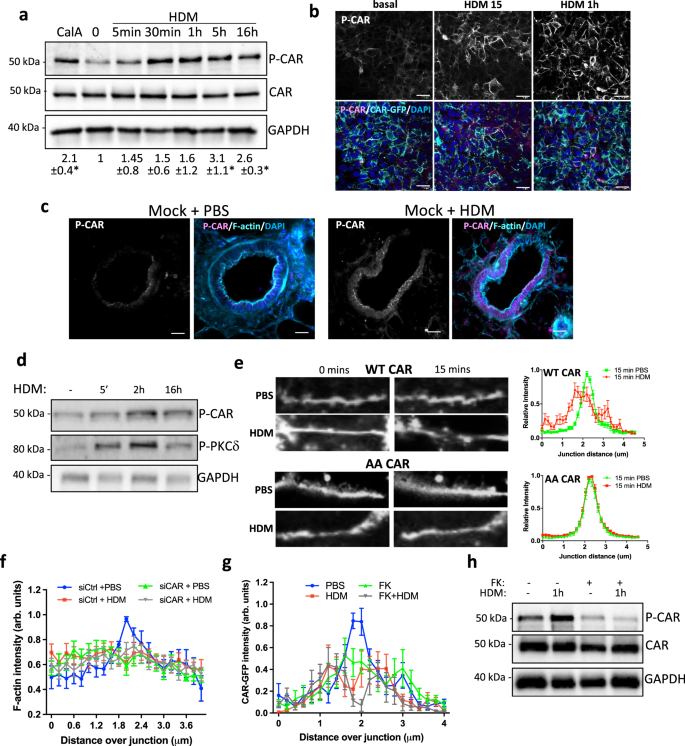
我们之前已经证明CAR细胞质域在T290/S293位点被磷酸化,这可以由促炎细胞因子触发,导致连接不稳定和白细胞迁移gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.为了支持我们之前的发现,对16HBE亲代细胞的分析显示,HDM存在时磷酸化car (P-CAR)增加,经Western blotting和免疫荧光证实(图1)。gydF4y2Ba4 a、bgydF4y2Ba).这在体外用HDM处理的模拟小鼠的PCLS中得到了进一步的证实。gydF4y2Ba4摄氏度gydF4y2Ba).我们之前已经证明PKCδ是T290/S293 P-CAR的激酶gydF4y2Ba14gydF4y2Ba我们的分析还表明,HDM处理增强了PKCδ的激活(图。gydF4y2Ba4 dgydF4y2Ba).为了测试HDM诱导的P-CAR是否改变了CAR在细胞中的行为,我们分析了用HDM处理的活细胞中细胞粘附时CAR的动力学。垂直于连接处的CAR的线扫描分析显示,在HDM处理后,细胞-细胞粘连处CAR的水平显著降低,与PBS相比,在同一时间点,HDM条件下CAR的强度更平坦(图1)。gydF4y2Ba4 egydF4y2Ba),这与hdm诱导的P-CAR促进CAR移动性的概念一致。重要的是,对CAR的T290/S293磷酸化死亡突变体(AACAR)的同样分析表明,该突变体在上皮细胞连接处高度稳定和紧密定位,不受HDM挑战的影响(图1)。gydF4y2Ba4 egydF4y2Ba).此外,在HDM缺失的情况下,16HBE细胞CAR的缺失导致上皮细胞-细胞粘连处皮质f -肌动蛋白丝的破坏。gydF4y2Ba4 fgydF4y2Ba).为了测试CAR迁移是否需要反式中的CAR同型二聚体,用纯化的Ad Type5纤维旋涡(FK)处理16HBE亲本细胞,该旋涡与CAR结合的亲和力高于CAR与自身结合的亲和力gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.FK处理导致CAR在基础条件下连接处的破坏。gydF4y2Ba4 ggydF4y2Ba)以及减少的hdm诱导的P-CAR(图。gydF4y2Ba4 hgydF4y2Ba).这些发现表明,CAR在HDM挑战时被磷酸化,这导致CAR在细胞-细胞粘附处被破坏,并随之降低连接稳定性。gydF4y2Ba
一个gydF4y2Ba用CalA处理16HBE CAR-GFP细胞5分钟或用HDM处理指定的时间。代表性的western blot检测CAR、T290/S293磷酸化CAR (P-CAR)和GAPDH。三个独立实验的pCAR量化如下所示。gydF4y2BabgydF4y2Ba用HDM处理过的CAR-GFP(绿色)16HBE细胞共聚焦图像。对细胞进行P-CAR(洋红色)和DAPI(蓝色)染色。代表3个独立实验。规模的酒吧;50毫米。gydF4y2BacgydF4y2Ba模拟小鼠±HDM治疗超过5周的plc共聚焦图像,固定并染色P-CAR(品红色),F-actin(青色)和DAPI(蓝色)。规模的酒吧;50毫米。gydF4y2BadgydF4y2Ba16HBE细胞经HDM处理指定时间,裂解后进行western blotting探针检测P-CAR和P-PKCδ。代表3个独立实验。gydF4y2BaegydF4y2BaPBS或HDM处理过的活体16HBE CAR-GFP或AACAR-GFP细胞共聚焦成像超过60分钟。显示0和15分钟的图像。CAR-GFP和AACAR-GFP在细胞-细胞连接处的折线图,每种条件下20个不同的连接处,代表3个独立实验。gydF4y2BafgydF4y2Ba表达lifeact-GFP的16HBE细胞经siccontrol或siCAR转染,PBS或HDM处理后成像1 h。图表显示了每一种条件下20个不同结的f -肌动蛋白强度,代表了3个独立实验。gydF4y2BaggydF4y2Ba用Ad5Fiberknob (FK)处理16HBE CAR-GFP细胞2.5小时,然后PBS或HDM处理1小时。图表显示了每种条件下20个不同连接的CAR-GFP强度,代表了3个独立实验。gydF4y2BahgydF4y2BaG中的细胞裂解并检测P-CAR和总CAR。所有值均为平均值±SEM。单因素方差分析与Dunnett事后检验检验统计显著性gydF4y2Ba一个gydF4y2Ba.gydF4y2BaPgydF4y2Ba值*gydF4y2BapgydF4y2Ba< 0.05。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
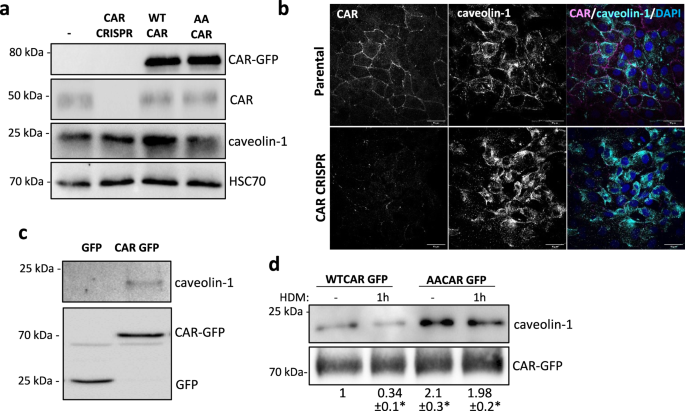
CAR与小洞穴蛋白-1形成络合物gydF4y2Ba
CAR先前已被证明与一些协调细胞-细胞粘附的细胞内蛋白质有关,包括MUPP-1、MAGI和LNXgydF4y2Ba10gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.然而,肺上皮细胞中介导car -依赖功能的潜在相互作用伙伴此前尚未以无偏的方式进行评估。为了解决这个问题,我们在重新表达CAR- bira的16HBE CAR CRISPR细胞中进行BioID,以捕获与CAR相互作用的蛋白质。生物素化蛋白的质谱分析显示超过700个car相关蛋白,包括许多以前报道的结合伙伴(补充图。gydF4y2Ba5 a、bgydF4y2Ba;补充数据gydF4y2Ba1gydF4y2Ba).数据集中代表性和富集程度最高的蛋白质是小泡蛋白-1,这是一种机械敏感的支架蛋白,发现于被称为小泡的膜微域内,以前报道过可以稳定细胞-细胞粘附gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.为了研究小洞穴蛋白-1是否参与了CAR-依赖的hdm诱导的上皮不稳定,我们分析了小洞穴蛋白-1在16HBE亲本、CRISPR和CAR过表达细胞中的表达和定位。CAR操作后总蛋白水平没有变化(图。gydF4y2Ba5gydF4y2Ba),但在hdm挑战的16HBE细胞中,细胞粘附处的小洞穴蛋白-1定位减少(图。gydF4y2Ba5 bgydF4y2Ba;补充图。gydF4y2Ba5度gydF4y2Ba).此外,在16HBE CAR - CRISPR细胞中,细胞粘附导致小泡蛋白-1丢失。gydF4y2Ba5 bgydF4y2Ba)进一步表明这两种蛋白质在这些亚细胞位点上相互合作。为了验证car -小洞穴蛋白-1复合物的形成,我们进行了CAR-GFP的免疫沉淀,然后探测小洞穴蛋白-1复合物。小洞穴蛋白-1存在于CAR的复合体中(图。gydF4y2Ba5度gydF4y2Ba),这在HDM挑战时被打乱(图。gydF4y2Ba5 dgydF4y2Ba).此外,在AACAR-GFP复合物中,小泡蛋白-1的水平高于WTCAR,并且该复合物在HDM处理中没有被破坏(图1)。gydF4y2Ba5 dgydF4y2Ba).这些数据表明,小泡蛋白-1结合CAR,可能有助于CAR对HDM的依赖反应,从而破坏上皮单分子层的机械完整性。gydF4y2Ba
一个gydF4y2Ba从16HBE亲本、CRISPR、CAR-GFP和AACAR-GFP细胞的裂解液中检测GFP、CAR、小洞穴蛋白-1和HSC70。代表3个独立实验(gydF4y2BabgydF4y2Ba16HBE亲本细胞和CAR CRISPR细胞的共聚焦图像,CAR(品红色),小洞穴蛋白-1(青色)和DAPI(蓝色)固定和染色。比例尺:50mm。gydF4y2BacgydF4y2Ba将表达GFP或CAR-GFP的16HBE细胞的裂解物进行GFP陷阱免疫沉淀、western blot和膜检测,以检测小洞穴蛋白-1、CAR-GFP和GFP。代表5个独立实验。gydF4y2BadgydF4y2Ba将表达CAR-GFP±HDM的16HBE细胞裂解1小时,进行GFP陷阱免疫沉淀、western blot和膜检测小泡蛋白-1和GFP。代表5个独立实验。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
CAR的上皮细胞耗竭导致气道收缩力增加gydF4y2Ba
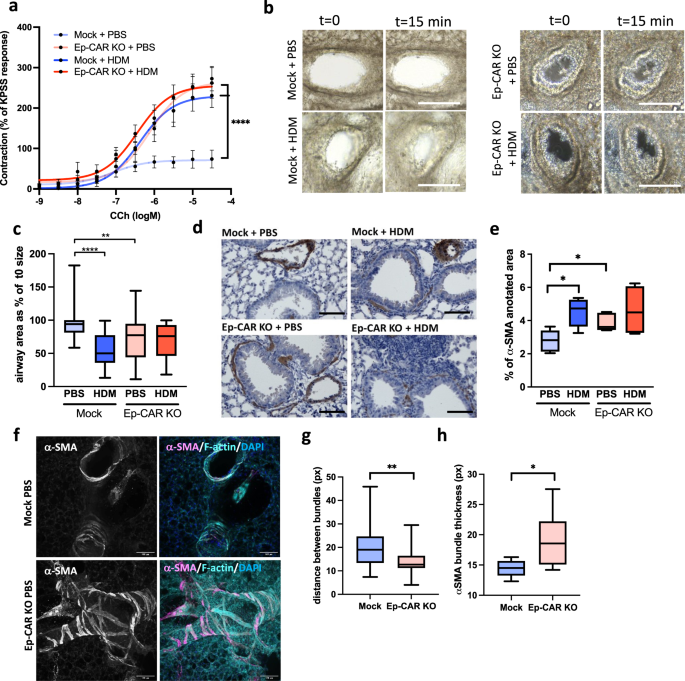
CAR促进上皮细胞的完整性和稳态,但也驱动屏障功能的不稳定和增强免疫细胞浸润后的hdm挑战。为了了解CAR在气道功能中的作用,我们用鼻内HDM治疗Mock和Ep-CAR KO小鼠超过5周,并使用两种互补方法评估气道收缩能力。首先,我们用Carbachol体外治疗解剖的气道以诱导收缩,并用肌电图分析反应。gydF4y2Ba6gydF4y2Ba).其次,我们分析了体外用甲胆碱处理的PCLS随着时间的推移诱导收缩(图。gydF4y2Ba6 b, cgydF4y2Ba).在两种实验条件下,用HDM治疗的小鼠气道收缩力增加,类似于哮喘中见的过敏原诱导的气道高反应性(AHR)gydF4y2Ba40gydF4y2Ba.然而,Ep-CAR - KO小鼠的气道在基础条件下收缩力增强,而HDM并没有进一步增强(图1)。gydF4y2Ba6 a - cgydF4y2Ba).以往的研究表明气道平滑肌(ASM)在支气管收缩气道中起重要作用gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.为了了解ASM表型是否可能与CAR衰竭气道中的AHR有关,我们对Mock和Ep-CAR KO小鼠肺切片中气道周围的α-SMA染色进行了量化。分析显示,模拟动物在HDM处理后α-SMA信号强度显著增加,Ep-CAR - KO肺中α-SMA水平的增加与HDM无关(图1)。gydF4y2Ba6 d, egydF4y2Ba).我们进一步通过染色固定PCLS和定量共焦图像更详细地描述了α-SMA组织(图。gydF4y2Ba6 fgydF4y2Ba).该分析的结果表明,在气道周围区域α-SMA束之间的距离显著缩短。gydF4y2Ba6克gydF4y2Ba),并伴随着α-SMA束厚度的增加(图。gydF4y2Ba6小时gydF4y2Ba).这些数据表明CAR作用于维持正常的气道上皮和平滑肌生理。为了研究CAR对ASM的影响,我们接下来研究了CAR是否调节α-SMA和结缔组织的组织。gydF4y2Ba
一个gydF4y2Ba将经PBS或HDM治疗5周的Mock和Ep-CAR - KO小鼠的气道解剖,安装在肌图上,并用卡巴醇(CCh)治疗。图显示CCh (1 nM ~ 30 μ M)收缩(mN)剂量的平均增加响应曲线,表示为高K的平均%gydF4y2Ba+gydF4y2Ba积极的控制(kps)。数据显示每组5只小鼠的5个气道,代表2个实验。gydF4y2BabgydF4y2Ba在0.5 g/ml的异胆碱作用15分钟前后的PCLS图像。比例尺:100mm。gydF4y2BacgydF4y2Ba图显示各实验组25个气道在甲胆碱治疗15分钟后气道面积占起始大小的%;每组5只小鼠;代表3个独立实验。gydF4y2BadgydF4y2Ba指示小鼠支气管代表性图像α-平滑肌肌动蛋白(SMA;棕色)和苏木精(细胞核;蓝色)。比例尺:50 μm。gydF4y2BaegydF4y2Ba定量25种不同气道及每种条件5只小鼠气道周围α-SMA强度;代表3个独立实验。gydF4y2BafgydF4y2Ba典型共聚焦z投影来自Mock和Ep-CAR - KO, PBS固定,a-SMA染色(品红色),Phalloidin染色(青色)和DAPI染色(蓝色)。比例尺:100mm。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba定量f -肌动蛋白束之间的距离(G)和α-SMA束的厚度,来自30个不同气道的图像,每个条件5只小鼠(1只pcl /小鼠),代表3个独立实验。所有图表显示中位数(线)与25/75百分位(框)和最小/最大值除gydF4y2Ba一个gydF4y2Ba其中表示均值±SEM。单因素方差分析与Dunnett事后检验检验统计显著性gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba;的数据进行了未配对的二尾学生t检验gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba;.gydF4y2BaPgydF4y2Ba值* *gydF4y2BapgydF4y2Ba< 0.01;****gydF4y2BapgydF4y2Ba< 0.0001。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
CAR的上皮耗竭诱导TGF-β依赖性气道重塑gydF4y2Ba
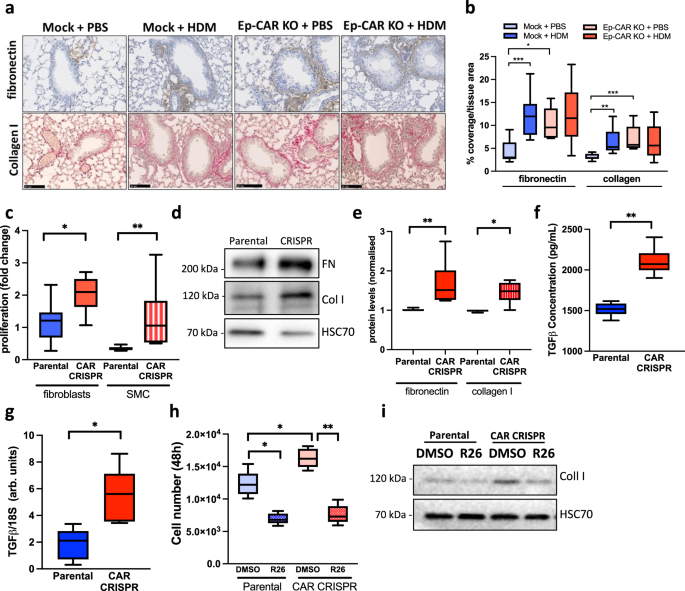
过敏性气道炎症与周围结缔组织和气道上皮细胞中ECM蛋白沉积的增加有关,已被认为对这种病理有积极作用gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.为了测试HDM和Ep-CAR - KO小鼠气道收缩能力的增强是否由于ECM重塑,我们定量检测了HDM攻毒和未攻毒小鼠肺部的胶原蛋白和纤维连接蛋白水平。数据显示,用HDM治疗的模拟小鼠的肺中胶原蛋白和纤维连接蛋白沉积显著增加(图。gydF4y2Ba7 a、bgydF4y2Ba).然而,在Ep-CAR - KO动物的基础水平上,这种增加也很明显,并且在HDM挑战时,水平没有改变(图。gydF4y2Ba7 a、bgydF4y2Ba).为了了解这些影响可能是如何介导的,我们用来自16HBE亲本和CAR - CRISPR的上清处理原代人肺成纤维细胞和气道平滑肌细胞,并评估其增殖超过48小时。与亲代对照相比,在CAR - CRISPR条件培养基中,两种细胞类型的增殖均显著增加。gydF4y2Ba7 cgydF4y2Ba).此外,对成纤维细胞和平滑肌细胞中I型胶原蛋白和纤维连接蛋白水平的Western blotting表明,CAR - CRISPR条件培养基刺激了两种ECM蛋白的沉积显著增加(图。gydF4y2Ba7 d, egydF4y2Ba).TGF-β是参与肺上皮-间质相互作用和ECM重塑的关键分泌蛋白之一gydF4y2Ba45gydF4y2Ba.因此,我们分析了16HBE亲本细胞和CAR CRISPR细胞分泌的活性TGF-β水平。该分析表明CAR - CRISPR细胞中活性TGF-β的显著增加(图1)。gydF4y2Ba7 fgydF4y2Ba通过qPCR检测,这些细胞中TGF-β1转录水平的升高反映了这一点(图1)。gydF4y2Ba7 ggydF4y2Ba).我们推测CAR - CRISPR细胞分泌TGF-β增加可能与成纤维细胞和平滑肌细胞增殖增加以及胶原蛋白和纤维连接蛋白合成增加有关。为了研究这一点,我们在TGF-β受体I型抑制剂R268712的存在下重复了这些实验。这两个实验的分析表明,阻断TGF-β信号可以抑制原代人气道平滑肌细胞的增殖和I型胶原的产生(图1)。gydF4y2Ba7小时,我gydF4y2Ba).总的来说,这些数据表明CAR的耗竭诱导TGF-β水平升高,进而驱动基质重构,并可能促进Ep-CAR - KO小鼠的基础气道收缩。gydF4y2Ba
一个gydF4y2Ba在特定条件下对小鼠肺切片进行纤维连接蛋白(抗体;棕色)和胶原蛋白(天狼星红色;粉色)染色。比例尺:100mm。gydF4y2BabgydF4y2Ba各实验组FFPE肺切片20条气道气道周围纤维连接蛋白和胶原蛋白染色定量分析每组5只小鼠(每只小鼠一个肺)代表3个独立实验。gydF4y2BacgydF4y2Ba用16HBE亲本细胞或CAR - CRISPR细胞上清处理48小时的原代人肺成纤维细胞和气道平滑肌细胞(SMC)增殖的量化。数据。gydF4y2BadgydF4y2Ba从原代人肺成纤维细胞中提取的裂解物gydF4y2BacgydF4y2Ba并检测纤维连接蛋白和I型胶原蛋白。gydF4y2BaegydF4y2Ba4个独立实验的量化数据如gydF4y2BadgydF4y2Ba.gydF4y2BafgydF4y2BaELISA法测定16HBE亲本细胞和CAR CRISPR细胞上清液中TGF-β的水平。每个条件3个重复,来自3个独立试验。gydF4y2BaggydF4y2Ba用qPCR检测16HBE亲本细胞和CAR CRISPR细胞中TGF-β转录水平。所示数据来自5个独立的实验。gydF4y2BahgydF4y2Ba在存在或不存在TGF-β抑制剂(R26)的情况下,用16HBE亲本细胞或CAR - CRISPR细胞的上清处理原代人气道SMC 48小时,定量其增殖情况。来自3个独立实验,每个实验每个条件3个重复。gydF4y2Ba我gydF4y2Ba从细胞中裂解出来gydF4y2BahgydF4y2Ba检测I型胶原蛋白和HSC70代表3个独立实验。所有图表显示中位数(线),25/75百分位(框)和最小/最大值。的数据进行了未配对的二尾学生t检验gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba;单因素方差分析与Dunnett事后检验检验统计显著性gydF4y2BabgydF4y2Ba;采用双向方差分析与Tukey的事后检验gydF4y2BahgydF4y2Ba.gydF4y2BaPgydF4y2Ba值*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.0005。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
CAR控制肺上皮中的GSK3β-TGF-β信号轴gydF4y2Ba
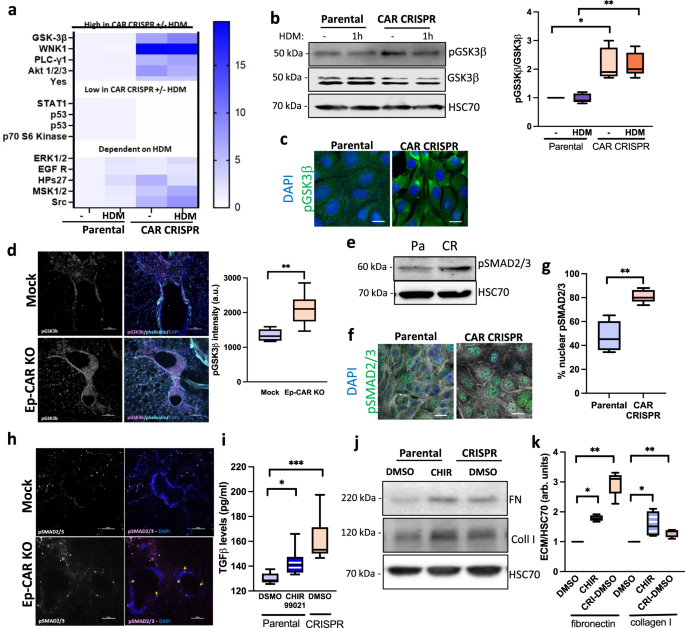
我们的数据表明,在CAR缺失的情况下,TGF-β激活增强,但其上游通路尚不清楚。为了确定CAR -贫细胞中潜在的信号变化,我们采用了一种无偏的方法,通过测定来自16HBE亲本细胞和CAR - CRISPR细胞的裂解液中>40人类激酶的活性,无论HDM处理过还是没有处理过。根据CAR的表达和HDM的存在与否,几个靶点被不同程度地调节(补充图。gydF4y2Ba6gydF4y2Ba,无花果。gydF4y2Ba8gydF4y2Ba).随后通过western blotting(包括pSTAT1, ERK1/2)对CAR -贫细胞中观察到的表型相关的一些关键靶点进行了验证。gydF4y2Ba6 b, cgydF4y2Ba)和GSK3β(图。gydF4y2Ba8 b, cgydF4y2Ba).特别值得注意的是GSK3β,它已被证明参与气道平滑肌肥大和气道纤维化gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba.在体外,CAR -贫细胞中磷酸化的Ser9位点增加,使GSK3β失活(图2)。gydF4y2Ba8 b, cgydF4y2Ba)和离体的plc(图。gydF4y2Ba8 dgydF4y2Ba)gydF4y2Ba48gydF4y2Ba.有人认为GSK3β活化作用于TGF-β下游促进纤维化gydF4y2Ba49gydF4y2Ba.然而,最近的证据表明,GSK3β可以通过长期暴露于TGF-β而失活gydF4y2Ba50gydF4y2Ba导致SMAD3的稳定,并通过正反馈循环和随后的纤维化增加TGF-β的释放gydF4y2Ba51gydF4y2Ba.这表明,这些途径在纤维化中的收敛比原来认为的要复杂得多gydF4y2Ba52gydF4y2Ba.我们对体外16HBE细胞和体外PCLS的分析表明,CAR耗竭后pSMAD2/3显著增加。gydF4y2Ba8情况gydF4y2Ba).为了研究GSK3β在其中的作用,我们用GSK3β抑制剂ir -9902处理细胞,这导致亲代16HBE细胞中TGF-β的产生增强,模拟CAR - CRISPR细胞中的表型(图1)。gydF4y2Ba8我gydF4y2Ba).正如之前报道的那样,GSK3β对16HBE亲代细胞的抑制也导致β-连环蛋白的积累gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,伴随pSMAD2/3的增加(补充图。gydF4y2Ba6 dgydF4y2Ba).此外,来自GSK3β的上清抑制了16HBE亲代细胞,导致原代肺成纤维细胞胶原蛋白和纤维连接蛋白合成增强(图。gydF4y2Ba8 hgydF4y2Ba).因此,GSK3-β:SMAD2/3信号轴的激活导致CAR缺失上皮细胞中活性TGF-β增强,进而增加ECM沉积,可能导致Ep-CAR KO小鼠的基础气道高度收缩。gydF4y2Ba
一个gydF4y2Ba从亲本和CAR CRISPR 16HBE细胞±HDM中提取的裂解物,使用人类磷酸激酶阵列进行分析。用标尺表示目标蛋白的磷酸化折叠变化。gydF4y2BabgydF4y2Ba细胞裂解物的代表性western blotgydF4y2Ba一个gydF4y2Ba检测pGSK3β、GSK3β和HSC70的表达。定量从三个独立的实验显示。gydF4y2BacgydF4y2Ba亲本细胞和CAR - CRISPR 16HBE细胞共聚焦图像,pGSK3β(绿色)和DAPI(蓝色)染色。比例尺:10mm。gydF4y2BadgydF4y2Ba模拟或Ep-CAR - KO小鼠PCLS的典型共聚焦z投影,pGSK3b(品红色)、F-actin(青色)和DAPI(蓝色)固定并染色。比例尺:100mm。右图显示了来自30个不同气道的pGSK3b的量化结果,这些气道来自每个条件下5只小鼠(1只PCLS/小鼠),代表了3个独立实验。gydF4y2BaegydF4y2Ba亲本和CAR CRISPR 16HBE细胞的裂解液检测pSMAD2/3和HSC70。gydF4y2BafgydF4y2BapSMAD2/3(绿色)和DAPI(蓝色)染色亲代和CAR CRISPR 16HBE细胞共聚焦图像;f -肌动蛋白用白色表示。gydF4y2BaggydF4y2Ba核pSMAD2/3的定量图像如gydF4y2BafgydF4y2Ba.每个条件每个实验10个视野量化,代表3个独立实验。gydF4y2BahgydF4y2Ba模拟小鼠和Ep-CAR - KO小鼠的plc共聚焦z投影,pSMAD2/3(洋红色)和DAPI(蓝色)染色。比例尺:100mm。gydF4y2Ba我gydF4y2Ba用GSK3β抑制剂CHIR99021处理的亲代和CAR CRISPR 16HBE细胞的裂解物,用ELISA法测定TGF-β水平。每个条件3个重复,来自3个独立试验。gydF4y2BajgydF4y2Ba从细胞中提取的裂解物gydF4y2Ba我gydF4y2Ba检测纤维连接蛋白,I型胶原蛋白和HSC70。gydF4y2BakgydF4y2Bawestern blots的量化gydF4y2BajgydF4y2Ba.从三个独立实验汇集的数据显示在右边。所有图表显示中位数(线),25/75百分位(框)和最小/最大值。的数据进行了未配对的二尾学生t检验gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba;单因素方差分析与Dunnett事后检验检验统计显著性gydF4y2Ba我gydF4y2Ba;采用双向方差分析与Tukey的事后检验gydF4y2BabgydF4y2Ba,gydF4y2BakgydF4y2Ba.显著性值为*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001。源数据以gydF4y2Ba源数据gydF4y2Ba文件。gydF4y2Ba
讨论gydF4y2Ba
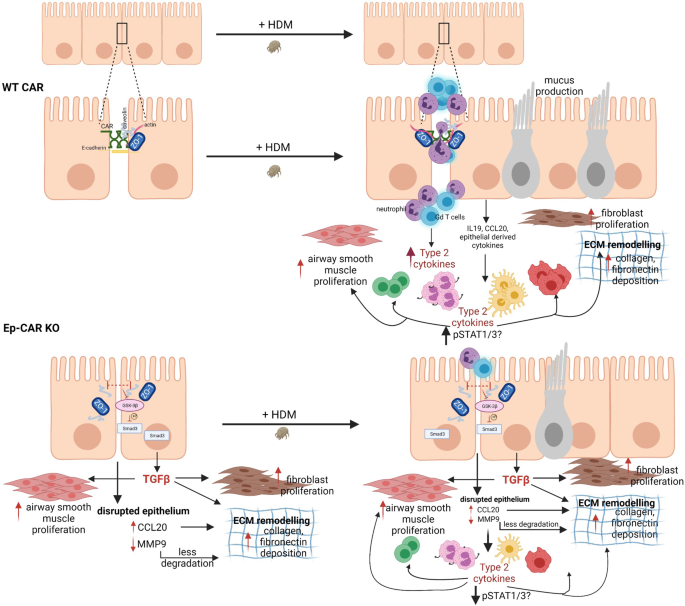
我们已经开发了一个体内模型,以探索CAR在肺上皮和介导炎症反应中的功能。我们的小鼠模型与体外人类细胞实验相结合,使我们能够定义和解剖CAR介导的信号,我们在图中总结了这一点。gydF4y2Ba9gydF4y2Ba.在基础生理条件下,CAR参与上皮细胞-细胞的反式粘附。在过敏原HDM的挑战下,CAR在细胞质区域内被磷酸化,导致CAR和细胞-细胞粘附的短暂不稳定,并触发上皮细胞促炎细胞因子的上调和释放。这导致增强的中性粒细胞和γδ t细胞募集到肺,这推动持续炎症和肺基质重构。从上皮细胞中消耗CAR通过抑制hdm诱导的细胞因子释放来防止hdm诱导的炎症。然而,CAR在非炎症条件下的完全耗尽也驱动基础信号程序,可能是由于持续的上皮屏障不稳定,促进基质沉积和基础条件下的高收缩。因此,CAR在调节上皮结构和促进气道炎症方面具有双重功能。gydF4y2Ba
我们的研究聚焦于HDM作为过敏性炎症的模型,因为这是与哮喘发展相关的最常见的风险因素gydF4y2Ba55gydF4y2Ba.有趣的是,Ep-CAR - KO小鼠对HDM的反应与对照组小鼠大致相当,但肺组织中特定的免疫细胞亚群没有增加。我们的数据强烈表明,这是由于在HDM刺激后,Ep-CAR - KO动物的肺上皮产生的关键的HDM诱导的促炎因子水平显著降低。这些因子包括IL-4、IL-13、IL-1β和IL-33。这种减少有望减少肺免疫细胞浸润,这确实是我们所观察到的。有趣的是,我们还观察到CAR - CRISPR细胞中IL-10的上调对HDM的反应。IL-10已被证明在肺中表现出免疫抑制特性,并减少Th2反应gydF4y2Ba56gydF4y2Ba这表明CAR - CAR的减少可能会促进积极减少炎症的因素。此外,由于CAR是在特定免疫细胞群表面表达的分子的直接受体,CAR的丢失也可能导致免疫细胞的组织整合和与上皮细胞的相互作用减少。最后,在Ep-CAR - KO小鼠中看到的基底胶原沉积增加可能进一步阻止有效的免疫细胞组织浸润和迁移。这些因素的结合很可能解释了我们在这里报告的缺乏组织水平免疫细胞浸润。gydF4y2Ba
HDM提取物可通过蛋白酶依赖性激活蛋白酶激活受体(PAR)家族蛋白直接作用于上皮细胞gydF4y2Ba57gydF4y2Ba,以及通过表皮生长因子受体(EGFR)gydF4y2Ba58gydF4y2Batoll样受体4 (TLR4)gydF4y2Ba59gydF4y2Ba.在所有情况下,由此产生的信号破坏上皮细胞的粘附和屏障的完整性,正如我们在这里也显示的。我们证明,HDM诱导CAR和PKCδ的磷酸化激活,可能是诱导这些受体下游的钙信号的结果。重要的是,我们证明了使用FK在反式中阻断CAR同型二聚体减少了这种hdm依赖性的磷酸化,并且我们之前已经证明了在体内给FK减少了CAR依赖性的炎症gydF4y2Ba15gydF4y2Ba这表明CAR必须正确定位并在细胞膜上接合,才能对这种信号作出反应。我们认为,过敏原诱导的CAR磷酸化导致该受体在细胞-细胞粘附中的运动增加,从而破坏连接的稳定,同时通过分泌促炎细胞因子吸引免疫细胞。因此,在膜上稳定CAR和防止hdm诱导的CAR磷酸化可能会显著减少hdm诱导的炎症,而不驱动Ep-CAR KO中所见的促纤维化信号程序。gydF4y2Ba
如前所述,我们的数据将CAR、e -钙粘蛋白和ZO-1放在一起gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba作为对HDM损伤的中央上皮应答器和HDM诱导的炎症信号的关键驱动程序。鉴于CAR已经被认为是一种重要的黏附受体,可能很难区分CAR的特定功能与CAR耗损后一般屏障损伤的更普遍影响。然而,与我们在Ep-CAR - KO小鼠中报道的一样,上皮特异性敲除E-Cadherin显示了类似的上皮形态受损和黏液蛋白水平增强,但E-Cadherin在基础条件下显示了肺泡间隙增加和嗜酸性粒细胞和树突状细胞水平增强gydF4y2Ba62gydF4y2Ba.这强有力地表明,在Ep-CAR - KO小鼠中看到的抗炎作用和增强的基底基质重塑不仅仅是由于上皮屏障缺陷,而是由于car对我们在这里描述的通路的特异性作用。有趣的是,最近的一项研究表明,乳腺癌细胞中CAR的缺失导致Akt和GSK3-β激酶的过度激活,导致TGF-β1诱导的上皮向间质转变gydF4y2Ba63gydF4y2Ba.虽然后一项研究是在ras转化的小鼠乳腺肿瘤细胞中进行的,但在支气管上皮细胞中描述的信号表型的相似性表明CAR在肺炎症和癌症中都具有保守的功能。本研究的数据表明,CAR -细胞中上皮细胞中TGF-β释放增强与ECM沉积增强相关,阻断这一途径会减少肺成纤维细胞产生的胶原蛋白。然而,也有一种可能是TGF-β的增加以一种自分泌的方式作用,以一种“类似emt”的方式促进上皮的不稳定。未来在Ep-CAR - KO小鼠体内针对该信号轴的实验将能够确定上皮和肺基质细胞行为的相对贡献。CAR的一个关键特征是这种受体能够结合到中性粒细胞和γδ T细胞表面的蛋白质上,这样做有助于免疫细胞经上皮迁移到炎症部位。CAR对免疫细胞浸润的作用在Ep-CAR - KO小鼠中也很明显,我们发现影响免疫细胞浸润的关键Th2细胞因子的分泌失调。虽然E-Cadherin肺上皮敲除小鼠的HDM挑战尚未得到研究,但迄今为止的证据表明,上皮细胞中的细胞粘附分子在调节肺稳态方面发挥着不同的功能。gydF4y2Ba
我们的研究还显示,在肺上皮细胞中,还有几个蛋白质可以与CAR复合。我们验证了小洞穴蛋白-1作为CAR的相互作用物,虽然尚不清楚这是由直接或间接结合介导的,但我们的数据强烈表明该复合体对CAR的磷酸化非常敏感。我们假设,这个复合物在质膜上与CAR结合起了支架其他分子的作用,并协助将机械信号从外界转译到细胞内的信号通路。有趣的是,小泡蛋白-1已被报道对维持人肺上皮细胞e -钙粘蛋白水平和屏障功能非常重要。小洞穴蛋白-1膜定位被HDM挑战破坏(我们的研究中也显示了后者),导致TSLP水平升高,TSLP是一种参与哮喘Th2反应的促过敏因子gydF4y2Ba38gydF4y2Ba.此外,小泡蛋白1敲除小鼠气道和实质中TGF-β依赖性胶原原纤维沉积逐渐增加gydF4y2Ba64gydF4y2Ba与我们在Ep-CAR - KO小鼠中报道的表型相似,进一步支持CAR和小泡蛋白-1之间在介导炎症反应方面的协同作用的概念。值得注意的是,我们还确定了机械响应转录因子YAP1作为car相关分子。YAP是肺发育的关键因素,与我们的研究相关,也被证明可以控制肺上皮中TGF-β的激活gydF4y2Ba65gydF4y2Ba.此外,最近一篇关于肺上皮特异性敲除YAP的报道显示上皮屏障形成中断和粘液分泌过多gydF4y2Ba66gydF4y2Ba,与Ep-CAR - KO小鼠的表型相似。综合这些发现,CAR作为一个关键的膜结合受体在支架参与上皮环境感知和反应的关键角色。除了小泡蛋白-1和YAP,我们还发现了几个与CAR复合的整合素受体亚基,这可能在CAR CRISPR细胞中观察到的ECM粘附缺陷中很重要。事实上,我们最近已经证明CAR可以与整合素复合,以控制它们在癌症环境下的激活状态gydF4y2Ba67gydF4y2Ba.内吞蛋白,包括VAMP-3、分选nexin-9和Rab23也在CAR复合物中富集;这些将是有趣的研究在未来作为潜在的媒介CAR交通和亚细胞定位在稳态和炎症条件下。gydF4y2Ba
总之,我们的研究证明CAR在维持肺稳态和增强过敏原诱导的炎症反应方面具有额外的功能。虽然完全去除CAR似乎会导致病理反应,但我们认为,剧烈操纵CAR功能、抑制hdm诱导的磷酸化并稳定细胞膜上的该受体可能为靶向慢性肺部疾病的炎症提供了新的机会。这将是未来值得探索的有趣可能性。gydF4y2Ba
方法gydF4y2Ba
本稿件中所有的研究都符合所有的伦理规范。在这项研究中使用动物得到了伦敦国王学院伦理审查委员会和英国内政部的批准。所有的动物都被安置在伦敦国王学院新亨特宿舍的生物支持单元(BSU)。所有实验在项目许可证号P9672569A和个人许可证号I0F9CA46A下进行。gydF4y2Ba
试剂和抗体gydF4y2Ba
使用了以下抗体:Anti-CAR (H300;1:200)来自圣克鲁斯科技公司。p-CAR刺gydF4y2Ba290gydF4y2Ba/爵士gydF4y2Ba293gydF4y2Ba多克隆抗体已被报道(14),由Perbioscience (Thermofisher)利用肽Ac- RTS (pT)AR(pS)YIGSNH-C开发,并在使用前进行了亲和纯化。Anti-phospho-ERK (T202 / Y204;1:1000)、抗erk(1:500)、抗磷pkc δ(1:500)和抗磷STAT1(1:1000)抗体均来自细胞信号学。抗小洞穴蛋白-1(1:500)、抗I型胶原蛋白(1:500)、抗α-SMA(1:1000)、抗lyc6g(1:400)、抗e -cadherin(1:500)和抗il19(1:250)抗体均来自Abcam。抗纤维连接蛋白(1:1000)、抗俱乐部(1:250)抗体抗hsc70(1:2000)抗体来自Sigma。抗zo -1(1:500)抗体来自Millipore。抗gfp(1:1000)抗体来自罗氏公司。抗磷ser9 GSK3β(1:50 00),抗GSK3β(1:40 00)和抗磷SMAD2/3(1:50 00)来自研发系统。抗鼠HRP(1:2000)和抗兔HRP(1:2000)来自DAKO。抗鼠剂568(1:400)、抗鼠剂488(1:400)、抗兔剂568(1:400)和phalloidin-647(1:500)均从Invitrogen公司获得。 CalyculinA, sodium orthovanadate and protease inhibitor cocktail 1 were obtained from Calbiochem. CAR and non-targeting siRNA were transfected using Dharmafect1 (Dharmacon). For Flow Cytometry analysis, we used the following antibodies: γδ TCR- Alexa421, CD45-PerCP Cy5, CD3-FITC, CD4-PE, B220 PECy7, CD8 APC Alexa657, NK1.1 APC-Cy7, Lyc6G Alexa 421, CD11c FITC, CD11b PE and Siglec F-Alexa700. All the antibodies were used at 1:50 and purchased from BioLegend except for Siglec F-Alexa700 which was from BD Biosciences (1:50). CHIR99021 and R268712 were from BioTechne. Calyculin A was obtained from Calbiochem. Adenovirus Type5 Fiberknob (FK) was produced and purified as previously described33gydF4y2Ba.屋尘螨提取物(HDM)含有gydF4y2BaDermatophagoides pteromyssimusgydF4y2Ba来自Citeq生物(02.01.85)。gydF4y2Ba
质粒gydF4y2Ba
完整长度和突变CAR慢病毒质粒在前面已经描述过gydF4y2Ba68gydF4y2Ba.磷酸化突变CAR结构是使用位点定向突变产生的,之前已经描述过gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.siCAR和非靶向对照siRNA池均来自Dharmacon。生物id实验在16HBE CAR CRISPR细胞中进行,这是一个带有TurboID标签的CAR的全长版本gydF4y2Ba69gydF4y2Ba插入pdz结合域和跨膜结构域之间的蛋白被克隆到pcDNA3.1骨架中。通过基于pcr的基因组装生成结构,整合TurboIDgydF4y2Ba2 gydF4y2Ba在跨膜结构域和细胞质尾部之间。选择这种策略是为了保留自由c端S/T-X-V基序,这是与pdz域相互作用所必需的。经过脯氨酸拉伸后,标签被插入到Lys285和Ser286之间,以减少对任何基本结构特征的干扰。CAR- CRISPR细胞的质膜定位和细胞间粘附的恢复表明CAR- turboid融合蛋白的适当成熟和运输。CAR CRISPR质粒位于GeneScript的pSpCas9 GFP载体中。使用两个不同的序列/质粒:CXADR CRISPR导向RNA1: ACGTAACATCTCGCACCTGA和CXADR CRISPR导向RNA 2: AGTACCTGCTAACCATGAAG。瞬时表达GFP的CRISPR细胞通过FACS分选富集,随后进行体培养,并通过qPCR、Western blotting和测序验证CAR的缺失。gydF4y2Ba
细胞培养和转染gydF4y2Ba
所有细胞系在标准条件下(37°C, 5% CO)保存gydF4y2Ba2 gydF4y2Ba和95%的湿度)。16HBE人类支气管上皮细胞是D. Gruenert教授(美国佛蒙特大学;gydF4y2Ba70gydF4y2Ba),并在I型胶原蛋白涂层组织培养瓶上生长。细胞在改良Eagle培养基(添加10%胎牛血清(FBS)的MEM (Gibco/ThermoFisher)、1%谷氨酰胺和1%青霉素/链霉素(Sigma-Aldrich)中培养。HEK 293T细胞(用于生产慢病毒)从ATTC购买,在添加10% FCS (Gibco/ThermoFisher)、1%谷氨酰胺和1%青霉素/链霉素(Sigma-Aldrich)的DMEM中培养。原代人肺成纤维细胞是Jenkins教授(英国帝国理工学院国家心肺研究所)赠送的礼物,在添加10% FCS (Gibco/ThermoFisher)、1%谷氨酰胺和1%青霉素/链霉素(Sigma-Aldrich)的DMEM中培养。气道平滑肌细胞是Woczcek博士(伦敦国王学院,英国)的礼物,如前所述,通过体外培养从支气管活组织组织中培养出来gydF4y2Ba71gydF4y2Ba.所有病例细胞均用0.05%胰蛋白酶- edta在PBS中继代培养。按照制造商说明使用lipofectamine3000 (ThermoFisher)对16HBE细胞进行转染。如前所述,使用WTCAR-GFP的慢病毒转导生成重表达CAR- gfp的16HBE CAR CRISPR细胞gydF4y2Ba14gydF4y2Ba.每个月对所有细胞进行支原体常规检测,结果均为阴性。gydF4y2Ba
RNA分离与逆转录聚合酶链反应(RT-PCR)gydF4y2Ba
RNA从细胞或肺组织中分离使用RNeasy Qiagen试剂盒(Qiagen;74004号猫)按照制造商的说明。在从肺组织中分离RNA的情况下,将肺叶切碎储存在Trizol中。然后用子弹搅拌机将组织分离。RNA用于cDNA合成,使用luncript RT SuperMix Kit (NEB;猫没有。E3010)。制备cDNA合成反应,由4µL的5X luncript RT SuperMix, 1µg的RNA和无核酸酶的水组成。使用热循环器,反应初始化为25°C的引物退火步骤2分钟,接着是55°C的cDNA合成步骤10分钟,以及95°C的热失活步骤1分钟。定量实时PCR (qPCR)使用QuantStudio 5 (Applied Biosystems/ThermoFisher)热循环器进行,首先将反应加热到95°C 1 min,然后在95°C下循环40次,持续10 s。 This was followed by an extension time of 30 s at 60 °C. The mouse probes were used as follows:Il4gydF4y2Ba(Mm00445259_m1),gydF4y2Ba使用Il13gydF4y2Ba(Mm00434204_m1),gydF4y2BaIl1bgydF4y2Ba(Mm00434228_m1),gydF4y2BaCcl20gydF4y2Ba(Mm01268754_m1),gydF4y2BaCxadrgydF4y2Ba(Mm00438355_m1)。使用了以下人体探针:gydF4y2BaMMP9gydF4y2Ba(Hs00957562_m1),gydF4y2BaMMP10gydF4y2Ba(Hs00233987_m1),gydF4y2BaMMP13gydF4y2Ba(Hs00942584_m1),gydF4y2BaLIF1gydF4y2Ba(Sc04122526_s1),gydF4y2BaIl19gydF4y2Ba(Hs00604657_m1),gydF4y2Ba转化生长因子β1gydF4y2Ba(Hs00998133_m1)和gydF4y2Ba18岁gydF4y2Ba(Hs03003631_g1)。gydF4y2Ba
GFP-TRAP免疫沉淀反应gydF4y2Ba
表达gfp标记蛋白的16HBE细胞在10厘米的培养皿中培养至100%融合。在500µl的冷GFP-trap缓冲液(50 mM Tris (pH 7.4), 150 mM NaCl, 1% NP40, 15 mM MgCl)前,用冰冷的PBS洗涤细胞3次gydF4y2Ba2 gydF4y2Ba, 10%甘油,1% Triton X-100, 5 mM EDTA含有蛋白酶和磷酸酶抑制剂鸡尾酒(1:100)。随后刮取细胞并在5000 ×离心gydF4y2BaggydF4y2Ba在4℃下放置10分钟。将1:1的gfp陷阱珠与对照琼脂糖树脂用IP裂解缓冲液洗涤三次。从细胞裂解物中提取的上清液加入珠中,在旋转器上4°C培养2 h。取50 μ l的上清液作为输入液。然后,用裂解缓冲液洗涤三次。在小球中加入含有β-巯基乙醇(1:100)的2×样品缓冲液,95°C煮5min,离心清除细胞碎片。取40 μl样品,进行Western blot分析。gydF4y2Ba
生物id下拉样品的LC-MS/MS分析gydF4y2Ba
在16HBE细胞中鉴定CAR蛋白相互作用物gydF4y2Ba72gydF4y2Ba.对于每种条件,使用Lipofectamine 3000 (Thermofisher)转染8个×15-cm-cell培养皿。转染后2 d,细胞用500 μ M生物素在培养基中孵育15 min,然后用PBS冲洗3次,立即收获。在每次复制中,从2个培养皿中提取的细胞被聚集、颗粒化并快速冷冻以备后续提取。用700 μl BioID裂解缓冲液(50 mM Tris pH 7.5;500毫米氯化钠;0.4% SDS;5毫米EDTA;德勤约1毫米;2% Triton X和1× PICS I)。样品在冰上孵育60分钟,其间混合管,然后超声处理。 To remove insoluble material the samples were centrifuged for 15 min at 4000 × ggydF4y2Ba8°C。将上清转移到新的试管中,与珠(MyoOne Streptavidin C1;一夜之间表达载体)。用磁架收集微珠,0.1%脱氧胆酸洗涤2次,洗涤8分钟;NP-40 1%;500毫米氯化钠;1 mM EDTA和50 mM HEPES pH 7.5在4℃,用250 mM LiCl, 0.5% NP-40, 0.5%脱氧胆酸,1 mM EDTA和10 mM Tris pH 8.1在4℃洗涤2次,用50 mM Tris pH 7.4和50 mM NaCl在4℃洗涤2次,在重新悬浮液前使用快速真空干燥。微珠在20 μl尿素缓冲液(6 M尿素,2 M硫脲,10 mM HEPES pH 8.0)中重悬,在10 mM DTT溶液中还原,然后用40 mM氯乙酰胺烷基化。样品首先用1µg内肽酶LysC (Wako, Osaka, Japan)消化4小时,在加入80µl 50 mM碳酸氢铵(pH 8.5)后,用1µg序列级胰蛋白酶(Promega)消化一夜。收集上清液,并与50 mM碳酸氢铵(pH 8.5)中额外珠洗的上清液结合。 Samples were acidified with formic acid and peptides were desalted using C18 columns.
肽段从C18色谱柱中洗脱,使用快速真空干燥,在3%乙腈/0.1%甲酸中重悬,并在20 cm反相色谱柱(ReproSil-Pur 1.9µm C18- aq树脂,Dr. Maisch GmbH)上分离,使用高效液相色谱系统(Thermo Scientific)上98 min梯度,250 nl/min流速增加乙腈浓度(从2%到60%)。肽在Q Exactive Plus仪器(ThermoFisher Scientific)上测量,在数据依赖模式下操作,在Orbitrap中进行全扫描(70 K分辨率;3×10gydF4y2Ba6克ydF4y2Ba离子计数目标;最大注射时间50 ms),其次是使用高能量碰撞解离的前10个MS2扫描(17.5 K分辨率,5 × 10gydF4y2Ba4 gydF4y2Ba离子计数目标;1.6 m/z隔离窗口;最大注射时间:250毫秒)。gydF4y2Ba
原始数据处理采用MaxQuant软件包(v1.6.3.4)。使用内部的Andromeda搜索引擎搜索MS2光谱,对照一个包含正向和反向序列的假人体UniProt数据库(human .2019-07),包括CAR-BirA结构的序列。研究包括蛋氨酸氧化和N端乙酰化的可变修饰,脱酰胺化(N和Q),生物素(K)和氨基甲基半胱氨酸的固定修饰。最小肽长度设置为7个氨基酸,最多允许有2个未裂解。对于肽和蛋白质以及位点鉴定,错误发现率(FDR)设置为1%。独特肽和剃刀肽被考虑用于定量。MS2识别在运行之间传递,使用“运行之间的匹配”功能,并使用内置算法计算IBAQ强度。对生成的proteinGroups文本文件进行过滤,以排除反向数据库命中、潜在污染物和仅按站点识别的蛋白质。使用Perseus软件(v1.6.2.1)进行统计数据分析。对Log2转换后的IBAQ值进行过滤,至少在一个组中筛选出至少3个有效值,缺失值用取自正态分布的随机低强度值进行估算。 Differences in protein abundance between CAR-BirA samples and control samples were calculated using two-sample Student’stgydF4y2Ba以及。在CAR-BirA组中富集并通过显著性截断(基于排列的FDR < 5%,至少识别出3个肽,至少4个MS/MS计数)的蛋白质被认为是CAR-BirA互作物。使用Cytoscape和ClueGO插件对car相关蛋白进行GO术语富集分析。gydF4y2Ba
质谱蛋白质组学数据已通过PRIDE合作伙伴存储库保存到ProteomeXchange联盟,数据集标识符为PXD029237gydF4y2Ba
西方墨点法gydF4y2Ba
细胞在含有蛋白酶和磷酸酶抑制剂的缓冲液(0.05 M Tris-HCl, 0.15 M NaCl, 1% Triton X-100, pH 7.2)中裂解。离心后,上清蛋白定量,用Laemmli缓冲液煮沸,SDS-PAGE分解,转移到硝化纤维素膜上。采用标准程序进行Western blotting。然后用ECL化学发光试剂盒(Bio-Rad Laboratories;cat.no。1705061)和成像(ChemiDoc成像系统,Bio-Rad实验室)。使用Image Lab (v5.2.1, Bio-Rad实验室)对印迹进行分析和处理。gydF4y2Ba
细胞粘附实验gydF4y2Ba
胶原蛋白(鼠尾I型,康宁;50 μg/ml)或Matrigel (BD Biosciences, 1:2稀释)在24孔板中培养,在37°C下覆盖表面1 h。1×10gydF4y2Ba3.gydF4y2Ba细胞被植入每一个孔中。让细胞在37°C下粘附不同时间(30分钟到2小时)。然后用PBS清洗细胞,然后用4%多聚甲醛(PFA/PBS)固定10分钟。PBS冲洗后,用DAPI和Alexa-Fluor 488 Phalloidin孵育细胞30分钟。最后用PBS清洗细胞。荧光图像是在Evos FL Auto 2荧光显微镜(Thermofisher)上获得的。使用4×空气物镜,使用相同的相机采集时间获得瓷砖扫描。使用斐济软件将瓦片编织成。tiff文件,通过核染色阈值化和自动计数获得总细胞计数。gydF4y2Ba
细胞增殖实验gydF4y2Ba
人源性成纤维细胞(HDF)或气道平滑肌(ASM)细胞被镀在24孔板上,在37°C 5% CO培养gydF4y2Ba2 gydF4y2Ba.第二天,细胞与不同上清液(16HBE, 16HBE CAR CRISPR,加或不加处理)孵育,孵育后24或48小时。然后用PBS清洗细胞,然后用4%的PFA/PBS固定10分钟。细胞核用DAPI染色,使细胞定量。细胞在Evos FL Auto 2荧光显微镜(Thermofisher)上成像。9×9瓷砖扫描使用10倍空气物镜和3.2 MP CMOS相机获得。前女友gydF4y2BacitgydF4y2Ba采用DAPI LED光立方进行处理。使用EVOS软件(v2)获取图像。使用斐济软件将瓦片编织成。tiff文件,通过核染色阈值化和自动计数获得总细胞计数。每个条件使用三个生物重复,计算每个条件的平均细胞数。gydF4y2Ba
Transepithelial迁移实验gydF4y2Ba
将16HBE亲代细胞、16HBE CAR CRISPR细胞或16HBE CAR CRISPR + CAR- gfp(拯救)细胞镀于24孔板。24 h后,加入HDM 24 h,用上清液按如下步骤喂入下腔。HL60细胞被植入6.5 mm Transwell细胞室(Corning, UK),每个细胞室有3万个细胞,孔为8.0 μm。下腔的培养基改为上清的16HBE细胞处理或未处理HDM如上所述。HL60细胞迁移6小时。6小时内通过Transwell转移的细胞用细胞追踪橙色染料(分子探针,英国)染色,并在Evos FL Auto 2荧光显微镜(Invitrogen)上获得荧光图像。瓷砖扫描使用4倍的空中物镜,使用相同的相机采集时间。使用斐济软件将瓦片编织成。tiff文件,通过核染色阈值化和自动计数获得总细胞计数。gydF4y2Ba
ELISA试验gydF4y2Ba
采用夹心ELISA法检测上清分析物。在细胞单层形成24小时后从孔中提取无细胞上清,保存在- 20°C,直到分析。使用IL-4 (D4050)、IL-19 (D1900)和TGF-β (Dy240-05)的ELISA试剂盒,均来自研发系统。在所有情况下,根据制造商的说明,并在Victor 1420多标签计数器(Perkin Elmer)上检测,定量浓度从每个板上的标准曲线绘制。gydF4y2Ba
右旋糖酐渗透性试验gydF4y2Ba
16HBE细胞(亲代或CAR - CRISPR或CAR - GFP保存)在0.4µm孔径的Transwell预涂胶原蛋白的上孔中以每孔10000个细胞的数量被覆盖在0.2 ml正常生长培养基中,下孔中为0.6 ml生长培养基。24小时后,检查孔是否形成完整的细胞单分子层。此时,将培养基从上、下孔中取出,代之以添加或不添加5mm EDTA的新鲜生长培养基,在37°C下孵育30分钟。在所有孔的上腔中加入10 μl trtc -葡聚糖溶液(20 KDa),放回培养箱中。孵育2 h后从下腔中取培养基100 μl。然后使用荧光板读取器测量培养基荧光。gydF4y2Ba
明胶降解试验gydF4y2Ba
为了分析明胶降解,使用Abcam试剂盒:明胶降解测定试剂盒(可替代酶谱法),按照制造商的说明。简单地说,16HBE细胞(亲代或CAR CRISPR)被镀(1 × 10gydF4y2Ba6克ydF4y2Ba细胞/条件)和血清饥饿。24 h后,加入HDM(2.5µg/mL)或PBS孵育24 h。然后用试剂盒提供的100 μ L细胞裂解缓冲液裂解细胞。制备标准曲线,然后将明胶酶底物混合物添加到每个样品和阳性对照孔中。在动力学模式下,37°C, 1-2 h,测量ex/em 490/520 nm的荧光。gydF4y2Ba
细胞因子和磷激酶抗体阵列gydF4y2Ba
细胞用HDM (2.5 μg/mL)或PBS作为对照处理24小时,然后按照制造商的说明进行蛋白质组分析器人类XL细胞因子阵列分析(R&D Systems, Inc.)。对于激酶阵列分析,16HBE细胞或16HBE CAR CRISPR细胞电镀过夜。第二天,细胞被血清饥饿过夜,然后用HDM (2.5 μg/mL)或PBS作为对照处理24小时,然后进行人磷酸激酶抗体阵列(R&D Systems;ARY003B)按照制造商的说明。后一种方法的数据显示为每一行(代表一个不同的细胞因子/分子),按比例显示该分子的最小(最小值,深蓝色)和最大(最大值,红色)密度读数,这意味着每一行在绝对值方面独立于其他行。由于在阵列上所表示的每个分子的水平差异非常大,因此数据以这种方式呈现,并提供了评估和显示不同条件下每个目标的表达水平的相对变化的方法gydF4y2Ba
免疫荧光和共聚焦显微镜gydF4y2Ba
将涂有涂层的覆盖玻片上的细胞镀上,24 h后用PBS洗涤,用4% PFA固定在PBS中10分钟,用0.2% TritonX-100渗透10分钟。细胞与一抗孵育过夜,适当的二抗和Phalloidin结合Alexafluor 568或633 1小时。使用FluorSave (Millipore)将细胞安装在载玻片上。共聚焦显微镜使用尼康A1R倒置共聚焦激光扫描显微镜,60倍油物镜,激光激发波长为488 nm(用于GFP或Alexafluor-488), 561 nm(用于Alexafluor-568)和633 nm(用于Alexafluor-633和cy5)。图像从尼康元素软件(尼康)导出,以便在ImageJ软件(美国国家卫生研究院,贝塞斯达,MD,美国)中进行进一步分析。gydF4y2Ba
在活细胞成像实验中,细胞被镀到玻璃底的Ibidi室(Ibidi, Germany)上,并形成完整的单分子层。然后使用60x油镜在尼康A1R倒置共聚焦显微镜(尼康UK)上使用488 nm激光激发每分钟对细胞成像一次,该显微镜配有加热到37℃、5% CO的湿化环境室gydF4y2Ba2 gydF4y2Ba和PFS激活。在最终浓度为2.5 μg/mL的成像介质中加入HDM,每分钟立即恢复一次成像,持续60分钟。所有图片都被保存为。nd2f我les and analysed in NIS Elements software (Nikon) or exported as tif files for presentation. Analysis of live cell junctional dynamics was performed using ImageJ. Individual cell–cell junctions were randomly selected from the final frames of movies using a defined ROI (90 in total per condition and cell type). Images were acquired as described above. In ImageJ, lines of 20 µm in length and 1 µm in width were drawn perpendicular to junctions identified using the specified protein in the relevant figures. Lines were aligned so that the 10 µm point was at the centre of junctions. The intensity values of each channel were exported and the individual data values for the specified proteins for each cell were normalised to control cell values. The resultant graphs show a peak of intensity where the junctional protein forms a sharp, defined line at the cell–cell contact point. Flatter traces without peaks indicate loss or dispersion of the protein of interest from the junction.
car缺陷小鼠的生成gydF4y2Ba
Scgb1a1-CreER购自The Jackson Laboratory。这些小鼠表达一种他莫西芬诱导形式的cre重组酶gydF4y2BaScgb1a1gydF4y2Ba在细支气管非纤毛俱乐部细胞中诱导cre重组酶活性。这些小鼠与携带floxed等位基因的小鼠杂交gydF4y2Ba车gydF4y2Ba(B6; 129 s2-cxadrtm1.1ics)(19)。C57BL/6小鼠(027株)购于Jackson Laboratories。腹腔内给药他莫西芬(Sigma)诱导Cre的肺上皮表达和切除gydF4y2Ba车gydF4y2Ba.他莫西芬的剂量为75 mg /kg小鼠体重,连续6天,并在他莫西芬治疗结束2周后取出肺进行验证。他莫西芬在玉米油(西格玛)中稀释。对照组小鼠(模拟,未产生KO)腹腔注射玉米油。所有小鼠都是在6到12周龄之间使用的。gydF4y2Ba
室内尘螨(HDM)致敏剂gydF4y2Ba
对于室内尘螨(HDM)免疫敏化方案,6-8周雌性C57BL/6小鼠(模拟或肺Ep-CAR - KO)分别用异氟烷麻醉,并分别给予25 μg(总蛋白)的HDM提取物(Citeq Biologics;1 mg/ml溶解在PBS中的蛋白重溶液)或25 μl PBS鼻内每周5次,连续5周。对照组小鼠给予PBS 25 μl。小鼠在最后的HDM或PBS剂量后24小时被扑杀。在相关的情况下,HDM在最初注射三苯氧胺3周后首次给动物服用。我们注意到,我们在雄性和雌性C57BL/6对照小鼠中进行了初步的特征描述实验,发现与雌性相比,在HDM挑战后,雄性在BAL和组织中的免疫细胞群具有更高的可变性。虽然我们不确定这其中的原因(也没有在文献中看到过专门的报道),但我们认为使用混合性别群体的未知混杂因素可能会使数据的解释具有挑战性,因此我们选择在雌性小鼠中进行后续所有实验。gydF4y2Ba
细胞恢复和流式细胞术gydF4y2Ba
支气管肺泡灌洗(BAL):用400 μl PBS冲洗气道3次,离心后上清保存于−80℃作进一步分析,细胞重悬于500 μl完全培养基(RPMI, 10% FCS, 2 mM l -谷氨酰胺,100 U/ml青霉素/链霉素)(GIBCO, Life Technologies)中。在添加0.15 mg/ml胶原酶(D型;Roche)和25 μg/ml DNase (Type 1;罗氏)在37°C 1小时。然后将组织通过70 μm筛(BD Bioscience),洗涤,并在1ml完全培养基中重悬。在1ml完全培养基中。溶解200 μl全血中的红细胞,其余白细胞洗涤2次,再用1ml全液重悬。洗净细胞,用兔血清(Sigma-Aldrich)孵育20分钟,然后在PBS中5% FCS / 1% BSA染色细胞外抗原,4°C孵育30分钟。使用Fix/Perm试剂盒(eBioscience;88-8824-00),然后进行细胞内抗原染色。 Detection was done using Attune NxT flow cytometer (ThermoFisher Scientific) and the resulting data were analysed using FlowJo software (Tree Star, Ashland, Ore). Flow cytometry gating conditions are provided in Supplementary Fig.7 gydF4y2Ba.gydF4y2Ba
小鼠离体气道的线肌图gydF4y2Ba
分别用玉米油(Mock)、他莫昔芬(Ep-CAR - KO)、屋尘螨(HDM)攻毒和不攻毒小鼠左肺、右上、下叶支气管解剖5周。分离的支气管在5ml含生理盐溶液(PSS;118毫米氯化钠;4.7毫米氯化钾;1.2毫米KH2PO4;1.2毫米MgSO4;25毫米NaHCO3;2.5毫米氯化钙;0.003毫米ETDA.Na2.2H2O;11mm葡萄糖全Sigma-Aldrich)灌注羧基(氧+ 5% CO)gydF4y2Ba2 gydF4y2Ba),拉伸到适当的静止张力(1-2 mN)。高钾生理盐溶液(KPSS;用KCl等渗置换NaCl)作为阳性对照。对卡巴醇(Sigma-Aldrich)的累积浓度反应(10gydF4y2Ba−9gydF4y2Ba-10年gydF4y2Ba−6gydF4y2BaM以0.5 log10的间隔进行)。测量每个浓度下收缩张力(mN)的增加,并将数据归一化为KPSS响应。gydF4y2Ba
体外精密肺切片gydF4y2Ba
体外肺切片取自小鼠,在最后一次PBS或HDM剂量后24小时内,根据之前发表的方案进行调整gydF4y2Ba73gydF4y2Ba.简单地说,老鼠被CO人道地杀死了gydF4y2Ba2 gydF4y2Ba吸入后颈椎脱位。打开胸腔,小心地暴露气管,在那里做一个小切口,以容纳20Gx1.25导管(SURFLO静脉导管)的插入。肺用2%低熔化琼脂糖(Fisher)在HBSS (Gibco)中制备充气,然后将肺、心脏和气管一起切除,在PBS中洗涤,分离肺叶。然后将单个裂片嵌入4%的低熔点琼脂糖中,在冰上凝固。用莱卡VT1200S振动器切割200μm厚切片,清洗后在添加10%胎牛血清(FBS)和抗生素的DMEM/F-12培养基中孵育。pcl在分离后至少12天仍能存活(并具有mch反应性)。制备肺切片,如果用于固定免疫荧光,则在制备当天用4% PFA固定。gydF4y2Ba
精密肺切片成像gydF4y2Ba
PFA离体固定肺片在室温封闭溶液中孵育1小时:含0.1% triton X-100、0.1%叠氮化钠和2%牛白蛋白(BSA)的PBS,然后在4℃1:100兔抗e - cadherin(细胞信号转导)封闭溶液中孵育一夜。体外肺切片在PBS中清洗,然后与Alexa-Fluor 488山羊-兔IgG (Thermo Scientific;1:500)和Alexa-Fluor 568 Phalloidin (Thermo Scientific;1:500)和DAPI,在PBS中清洗,并在尼康Eclipse Ti2旋转盘共聚焦显微镜上成像,20X物镜。gydF4y2Ba
为了进行实时成像,pcl在生长培养基中放置一夜,分离后24小时使用,并在HBSS+溶液中使用增加剂量的MCH(乙酰-β-甲基胆碱氯化,西格马)处理,从100 mg/mL到500 mg/mL。pcl在24孔板的HBSS+中孵育30分钟,37℃与MCH,使用Life Technologies EVOS FL Auto显微镜每隔30秒成像,以测量MCH对支气管收缩的反应。PCLS在4℃下固定于4%多聚甲醛中过夜,然后进行免疫染色。pcl在分离后可存活12天,对甲氨胆碱有反应。gydF4y2Ba
组织处理与分析gydF4y2Ba
小鼠在牺牲后提取肺,切除后用4%多聚甲醛固定24小时,然后在石蜡包埋前转移到70%乙醇中。每个石蜡包埋或冷冻标本均取10 m厚切片。然后用组织切片进行不同的染色,包括苏木素和伊红或周期性酸-希夫(PAS)染色以显示杯状细胞。DAB染色进行免疫组化。石蜡包埋切片在95°C下熔化2 h,然后在二甲苯2 × 10 min、100%乙醇2 × 5min、70%乙醇1x5min和50%乙醇1x5min的浸玻片中脱蜡。用柠檬酸钠缓冲液(0.0874 M钠gydF4y2BacitgydF4y2Ba加0.0126 M柠檬酸,pH 6),在95°C的高压锅中孵育20分钟。内源性过氧化物酶活性在过氧化氢(3% TBS)中孵育10分钟进行DAB染色。用TBS洗涤组织3×,用TBS-1% bsa -1% fbs阻断液室温孵育1 h,阻断非特异性结合。将一抗添加到组织中,在4°C下放置一夜。TBS冲洗3次后,组织与荧光或酶标二抗室温孵育1 h。用于荧光的组织用Fluorsave溶液(Millipore)安装。加入DAB显影液达20分钟(Dako)后可见DAB染色。然后用苏木精反染色1 s。最后,在DPX安装前,组织用分级醇和二甲苯脱水。gydF4y2Ba
使用病理切片扫描仪(Hamamatsu)对肺切片进行成像,并使用Definiens Tissue studio 2.7 (Definiens, Munich)进行分析。根据各肺的气道形态进行人工标注,以确定感兴趣区域(ROI),并根据αSMA、胶原和纤维连接蛋白阳性着色阈值计算每个ROI中IHC染色区域的百分比。gydF4y2Ba
统计分析和再现性gydF4y2Ba
数据表示为均数±均数标准误差(SEM)。所有统计检验均采用Prism软件包(GraphPad软件)进行。两组比较时采用学生t检验进行统计学分析。方差分析(ANOVA)采用Dunnett多重比较事后检验进行单因素方差分析的多重比较,采用Tukey事后检验进行双因素方差分析的多重比较。在GraphPad Prism中使用正态性和对数正态性分析对数据集的分布进行常规测试。在我们的研究中,我们观察了正态分布数据。有统计学意义的值取*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001;****gydF4y2BapgydF4y2Ba< 0.0001,并在具体的数字和实验中分配,如图所示。根据图例进行了多次独立实验,结果相似。来自单个图像或实验的数据可以代表所有实验的总体结果。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
完整的生物id分析数据集在补充数据中提供gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
BioID质谱蛋白质组学数据已通过PRIDE伙伴存储库和数据集标识符保存到ProteomeXchange联盟gydF4y2BaPXD029237gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba都提供了这张纸。gydF4y2Ba
参考文献gydF4y2Ba
Tam, A., Wadsworth, S., Dorscheid, D., Man, S. F. & Sin, D.气道上皮:不仅仅是一个结构屏障。gydF4y2Ba其他。放置和。说。gydF4y2Ba5gydF4y2Ba, 255 - 273(2011)。gydF4y2Ba
肠粘膜屏障在健康与疾病中的作用。gydF4y2Ba启Immunol Nat。gydF4y2Ba9gydF4y2Ba, 799 - 809(2009)。gydF4y2Ba
Zen, K. & Parkos, C. A.白细胞-上皮相互作用。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba15gydF4y2Ba, 557 - 564(2003)。gydF4y2Ba
Zen, K.等人。中性粒细胞通过紧密连接的迁移是由上皮柯萨奇和腺病毒受体和中性粒细胞上的连接粘附分子样蛋白之间的粘附作用介导的。gydF4y2Ba摩尔。杂志。细胞gydF4y2Ba16gydF4y2Ba, 2694 - 2703(2005)。gydF4y2Ba
Hewitt, R. J. & Lloyd, c.m .气道上皮细胞景观对免疫反应的调节。gydF4y2Ba启Immunol Nat。gydF4y2Ba21gydF4y2Ba, 347 - 362(2021)。gydF4y2Ba
尤克塞尔,奥贾兰,M. &伊尔马兹,O. e .钙粘蛋白:防御和功能障碍之间呼吸屏障的重要功能分子。gydF4y2Ba前面的杂志。gydF4y2Ba12gydF4y2Ba720227(2021)。gydF4y2Ba
哮喘患者气道重塑中上皮细胞的作用。gydF4y2BaProc。。Thorac。Soc。gydF4y2Ba6克ydF4y2Ba, 678 - 682(2009)。gydF4y2Ba
许瑞敏,徐瑞敏,李丽萍。人类和小鼠对C亚群腺病毒和B亚群柯萨奇病毒的细胞受体。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba94gydF4y2Ba, 3352 - 3356(1997)。gydF4y2Ba
伯格尔森,J. M.等。柯萨奇B病毒和腺病毒2、5共同受体的分离gydF4y2Ba科学gydF4y2Ba275gydF4y2Ba, 1320 - 1323(1997)。gydF4y2Ba
Excoffon, K. J, Hruska-Hageman, A, Klotz, M, Traver, G. L. & Zabner, J.柯萨奇B病毒和腺病毒受体(CAR)的pdz结合域在细胞粘附和生长中的作用。gydF4y2Baj .细胞科学。gydF4y2Ba117gydF4y2Ba, 4401 - 4409(2004)。gydF4y2Ba
Farmer, C., Morton, p.e, Snippe, M., Santis, G. & Parsons, M.柯萨奇腺病毒受体(CAR)通过激活p44/42 MAPK调节整合素功能。gydF4y2Ba实验细胞Res。gydF4y2Ba315gydF4y2Ba, 2637 - 2647(2009)。gydF4y2Ba
Honda, T.等。在发育中的小鼠大脑中,作为细胞粘附分子的柯萨奇病毒腺病毒受体蛋白。gydF4y2BaMol. Brain Res。gydF4y2Ba77gydF4y2Ba19-28(2000)。gydF4y2Ba
侯赛因,F.等人。CAR在5型腺病毒存在的情况下调节e -钙粘蛋白的动力学。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba6克ydF4y2Bae23056(2011)。gydF4y2Ba
Morton, p.e., Hicks, A, Nastos, T, Santis, G. & Parsons, M. CAR通过控制E-cadherin运输调节上皮细胞连接的稳定性。gydF4y2Ba科学。代表。gydF4y2Ba3.gydF4y2Ba2889(2013)。gydF4y2Ba
莫顿,p.e.等。TNFα促进car -依赖的白细胞在上皮单分子层的迁移。gydF4y2Ba科学。代表。gydF4y2Ba26321(2016)。gydF4y2Ba
陈建伟,陈建伟等。柯萨奇病毒和腺病毒受体的心肌细胞特异性缺失导致胚胎左心室增生和窦房瓣膜异常。gydF4y2Ba中国保监会,Res。gydF4y2Ba98gydF4y2Ba, 923 - 930(2006)。gydF4y2Ba
多纳,a.a.等人。柯萨奇病毒-腺病毒受体(CAR)对早期胚胎心脏发育至关重要。gydF4y2Baj .细胞科学。gydF4y2Ba118gydF4y2Ba, 3509 - 3521(2005)。gydF4y2Ba
阿瑟,D. R.等人。柯萨奇病毒和腺病毒受体是心肌细胞发育所必需的。gydF4y2Ba《创世纪》gydF4y2Ba42gydF4y2Ba, 77 - 85(2005)。gydF4y2Ba
Pazirandeh, A.等。柯萨奇病毒和腺病毒受体(Car)基因失活后成年小鼠的多种表型gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba6克ydF4y2Bae20203(2011)。gydF4y2Ba
Verdino, P., Witherden, D. A., Havran, W. L. & Wilson, I. A. CAR和JAML的分子相互作用招募中央细胞信号转换器PI3K。gydF4y2Ba科学gydF4y2Ba329gydF4y2Ba, 1210 - 1214(2010)。gydF4y2Ba
韦伯等。中性粒细胞来源的JAML抑制急性炎症时肠上皮损伤的修复。gydF4y2Ba粘膜Immunol。gydF4y2Ba7 gydF4y2Ba, 1221 - 1232(2014)。gydF4y2Ba
威瑟登等人。连接粘附分子JAML是上皮- γ - T细胞激活的共刺激受体。gydF4y2Ba科学gydF4y2Ba329gydF4y2Ba, 1205 - 1210(2010)。gydF4y2Ba
Satsu, H.等人。激活的巨噬样THP-1细胞通过肿瘤坏死因子- α诱导肠上皮Caco-2单层细胞凋亡和坏死细胞死亡gydF4y2Ba实验细胞Res。gydF4y2Ba.gydF4y2Ba312gydF4y2Ba, 3909 - 3919(2006)。gydF4y2Ba
Babatunde, k.a.等人。分化HL-60中性粒细胞样细胞的趋化性和蜂群。gydF4y2Ba科学。代表。gydF4y2Ba11gydF4y2Ba778(2021)。gydF4y2Ba
调节Th2细胞免疫对哮喘治疗的作用。gydF4y2Ba前面。Immunol。gydF4y2Ba12gydF4y2Ba637948(2021)。gydF4y2Ba
海金克,i.h.等人。上皮细胞功能障碍是哮喘发展的主要驱动因素。gydF4y2Ba过敏gydF4y2Ba75gydF4y2Ba, 1902 - 1917(2020)。gydF4y2Ba
Osei, E. T, Brandsma, C. A, Timens, W., Heijink, i.h. & Hackett, T. L.关于白细胞介素-1信号在哮喘和COPD发病机制中的作用的最新观点。gydF4y2Ba欧元。和。J。gydF4y2Ba55gydF4y2Ba, 1900563(2020)。gydF4y2Ba
Saikumar Jayalatha, a.k, Hesse, L., Ketelaar, m.e, Koppelman, g.h.和Nawijn, m.c. IL-33/IL-1RL1通路在哮喘中的中心作用:从发病到干预。gydF4y2Ba制药。其他。gydF4y2Ba225gydF4y2Ba107847(2021)。gydF4y2Ba
翁玉红,陈文云,林玉玲,王金云,张明生,阻断IL-19信号通路可改善过敏原诱导的气道炎症。gydF4y2BaImmunol前面。gydF4y2Ba10gydF4y2Ba968(2019)。gydF4y2Ba
黄,F.等。IL-17A和IL-4/IL-13增强气道上皮细胞中IL-19的表达:哮喘的重要意义gydF4y2Baj .过敏中国。Immunol。gydF4y2Ba121gydF4y2Ba, 1415 - 1421(2008)。gydF4y2Ba
Kuruvilla, m.e, Lee, F. E. & Lee, G. B.了解哮喘表型、内型和疾病机制。gydF4y2Ba中国。启过敏Immunol。gydF4y2Ba56gydF4y2Ba, 219 - 233(2019)。gydF4y2Ba
弗雷,A.等。不仅仅是一个障碍:气道上皮细胞在哮喘发病机制中的免疫功能。gydF4y2Ba前面。Immunol。gydF4y2Ba11gydF4y2Ba761(2020)。gydF4y2Ba
柯比,我,等人。腺病毒5型纤维旋钮蛋白DG环的突变取消了与其细胞受体CAR的高亲和力结合。gydF4y2Baj .性研究。gydF4y2Ba73gydF4y2Ba, 9508 - 9514(1999)。gydF4y2Ba
张玉波,张玉波,张玉波,张玉波。腺病毒与人细胞受体CAR结合机制的结构分析。gydF4y2Ba科学gydF4y2Ba286gydF4y2Ba, 1579 - 1583(1999)。gydF4y2Ba
Sollerbrant, K.等。柯萨奇病毒和腺病毒受体(CAR)与含有PDZ结构域的蛋白麻木蛋白配体x (LNX)形成复合物。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 7439 - 7444(2003)。gydF4y2Ba
Coyne, c.b, Voelker, T, Pichla, s.l. & Bergelson, J. M.柯萨奇病毒和腺病毒受体在紧密连接内与多pdz结构域蛋白-1 (MUPP-1)相互作用。gydF4y2Ba生物。化学。gydF4y2Ba279gydF4y2Ba, 48079 - 48084(2004)。gydF4y2Ba
Miotti, S.等人。卵巢癌细胞中同时表达小腔蛋白-1和e -钙粘蛋白可通过抑制src相关激酶稳定粘附连接。gydF4y2Ba点。j .分册。gydF4y2Ba167gydF4y2Ba, 1411 - 1427(2005)。gydF4y2Ba
哈克特,T. L.等。小泡蛋白-1控制气道上皮屏障功能。gydF4y2BaImplic。哮喘。j .和。细胞摩尔。生物。gydF4y2Ba49gydF4y2Ba, 662 - 671(2013)。gydF4y2Ba
Galbiati, F.等。小泡蛋白-1的表达通过将-连环蛋白招募到小泡膜结构域来抑制Wnt/ -连环蛋白/ leaf -1信号的传递。gydF4y2Ba生物。化学。gydF4y2Ba275gydF4y2Ba, 23368 - 23377(2000)。gydF4y2Ba
哮喘患者气道高反应性的机制:过去、现在和未来。gydF4y2Ba中国。Exp。过敏gydF4y2Ba45gydF4y2Ba, 706 - 719(2015)。gydF4y2Ba
张志刚,张志刚。哮喘气道平滑肌的病理生理学和治疗。gydF4y2Baj:杂志。(1985)gydF4y2Ba114gydF4y2Ba, 834 - 843(2013)。gydF4y2Ba
Lauzon, a.m. & Martin, J. G.气道高反应性;平滑肌作为主要演员。gydF4y2BaF1000ResgydF4y2Ba5gydF4y2Ba,gydF4y2Bahttps://doi.org/10.12688/f1000research.7422.1gydF4y2Ba(2016)。gydF4y2Ba
罗伊斯,谭磊,柯克,a.a.a,唐明良。细胞外基质成分对气道上皮细胞和成纤维细胞结构的影响:哮喘患者气道重塑的意义。gydF4y2Ba安。过敏哮喘Immunol。gydF4y2Ba102gydF4y2Ba, 238 - 246(2009)。gydF4y2Ba
里维斯,S. R.等。哮喘气道上皮细胞差异调节成纤维细胞表达的细胞外基质成分。gydF4y2Baj .过敏中国。Immunol。gydF4y2Ba134gydF4y2Ba, 663 - 670(2014)。e661。gydF4y2Ba
转化生长因子- β:健康和疾病中呼吸系统的主调节因子。gydF4y2Ba点。j .和。细胞摩尔。生物。gydF4y2Ba54gydF4y2Ba, 647 - 655(2016)。gydF4y2Ba
卡普尔,M.等人。小鼠成纤维细胞中的gsk -3 β通过内皮素-1依赖机制控制伤口愈合和纤维化。gydF4y2Baj .中国。Investig。gydF4y2Ba118gydF4y2Ba, 3279 - 3290(2008)。gydF4y2Ba
邓华等。抑制糖原合成酶激酶-3 β对气道平滑肌肥大是足够的。gydF4y2Ba生物。化学。gydF4y2Ba283gydF4y2Ba, 10198 - 10207(2008)。gydF4y2Ba
方,x等。糖原合成酶激酶3被蛋白激酶A磷酸化和失活。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba97gydF4y2Ba, 11960 - 11965(2000)。gydF4y2Ba
杰弗斯等人。糖原合成酶激酶3 - β与9-ING-41抑制减缓肺纤维化的进展。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba18925(2019)。gydF4y2Ba
张杰等。通路串扰使细胞能够解释tgf - β持续时间。gydF4y2BaNPJ系统。医学杂志。:gydF4y2Ba.gydF4y2Ba4 gydF4y2Ba, 18(2018)。gydF4y2Ba
拉尔,h等人。心肌成纤维细胞糖原合成酶激酶-3 -调节缺血心脏的心室重构和功能障碍。gydF4y2Ba循环gydF4y2Ba130gydF4y2Ba, 419 - 430(2014)。gydF4y2Ba
Piersma, B, Bank, R. A. & Boersema, M.纤维化信号:tgf - β, WNT和YAP/TAZ收敛。gydF4y2Ba前面。地中海。gydF4y2Ba2 gydF4y2Ba59(2015)。gydF4y2Ba
Kazi, A.等人。GSK3的抑制上调了-连环蛋白和c-Myc以消除kras依赖性肿瘤。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba5154(2018)。gydF4y2Ba
黄娟,郭晓霞,李伟,张宏。通过GSK3抑制剂激活Wnt/ β -连环蛋白信号直接向人脂肪干细胞分化为功能性肝细胞。gydF4y2Ba科学。代表。gydF4y2Ba7 gydF4y2Ba40716(2017)。gydF4y2Ba
Gandhi, V. D., Davidson, C., Asaduzzaman, M., Nahirney, D. & Vliagoftis, H.室内尘螨与气道上皮细胞的相互作用:在过敏性气道炎症中的作用。gydF4y2Ba咕咕叫。过敏哮喘代表。gydF4y2Ba13gydF4y2Ba, 262 - 270(2013)。gydF4y2Ba
IL-10:不断发展的概念。gydF4y2Baj .过敏中国。Immunol。gydF4y2Ba101gydF4y2Ba, 293 - 297(1998)。gydF4y2Ba
Cho, H. J.等。屋尘螨提取物通过人气道上皮细胞蛋白酶激活受体2激活顶部Cl(-)通道。gydF4y2Baj .细胞生物化学gydF4y2Ba109gydF4y2Ba, 1254 - 1263(2010)。gydF4y2Ba
hejink, i.h, van Oosterhout, A. & Kapus, A.表皮生长因子受体信号通路有助于室内尘螨诱导的上皮屏障功能障碍。gydF4y2Ba欧元。和。J。gydF4y2Ba36gydF4y2Ba, 1016 - 1026(2010)。gydF4y2Ba
Hammad, H.等人。屋尘螨变应原通过toll样受体4触发气道结构细胞诱发哮喘。gydF4y2Ba地中海Nat。gydF4y2Ba15gydF4y2Ba, 410 - 416(2009)。gydF4y2Ba
Tan, H. T.等。紧密连接、粘蛋白和炎症体相关分子在嗜酸性、混合性和中性粒细胞性实验性哮喘小鼠中表达差异。gydF4y2Ba过敏gydF4y2Ba74gydF4y2Ba, 294 - 307(2019)。gydF4y2Ba
董,h.m.等。细胞外热休克蛋白90 α通过激活RhoA/MLC信号介导hdm诱导的支气管上皮屏障功能障碍。gydF4y2Ba和。Res。gydF4y2Ba18gydF4y2Ba111(2017)。gydF4y2Ba
Post, S.等。肺上皮细胞特异性e -钙粘蛋白敲除模型的特性:对阻塞性肺病理的影响。gydF4y2Ba科学。代表。gydF4y2Ba8gydF4y2Ba13275(2018)。gydF4y2Ba
Nilchian, A.等。在乳腺癌中,cxadr介导的AKT抑制信号体在紧密连接处的形成控制上皮-间质可塑性。gydF4y2Ba癌症Res。gydF4y2Ba79gydF4y2Ba47-60(2019)。gydF4y2Ba
Le Saux, O.等人。小窝蛋白-1在肺基质重塑和力学性能中的作用。gydF4y2Ba点。j .杂志。肺细胞摩尔。gydF4y2Ba295gydF4y2BaL1007-L1017(2008)。gydF4y2Ba
Isago, H.等人。YAP和TAZ的上皮表达是肺发育过程中依次需要的。gydF4y2Ba点。j .和。细胞摩尔。生物。gydF4y2Ba62gydF4y2Ba, 256 - 266(2020)。gydF4y2Ba
Hicks-Berthet, J.等。Yap/Taz抑制杯状细胞命运维持肺上皮内稳态。gydF4y2Ba细胞的代表。gydF4y2Ba36gydF4y2Ba109347(2021)。gydF4y2Ba
Owczarek, C.等。CAR与整合素协同作用促进肺癌细胞粘附和侵袭。gydF4y2Ba前面。肿瘤防治杂志。gydF4y2Ba12gydF4y2Ba829313(2022)。gydF4y2Ba
Pike, R., ortizz - zapater, E., Lumicisi, B., Santis, G. & Parsons, M. KIF22协调CAR和EGFR动态促进癌细胞增殖。gydF4y2Ba科学。信号。gydF4y2Ba11gydF4y2Ba,gydF4y2Bahttps://doi.org/10.1126/scisignal.aaq1060gydF4y2Ba(2018)。gydF4y2Ba
布隆,t.c.等。TurboID在活细胞和生物体中的高效接近标记。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 880 - 887(2018)。gydF4y2Ba
Gruenert, d.c., Basbaum, c.b . & Widdicombe, J. H.在无血清条件下长期培养正常和囊性纤维化上皮细胞。gydF4y2BaVitr。细胞Dev。杂志。gydF4y2Ba26gydF4y2Ba, 411 - 418(1990)。gydF4y2Ba
Mahn, k等人。sarco/内质网Ca2+ atp酶(SERCA)表达减少有助于支气管哮喘气道重塑。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba106gydF4y2Ba, 10775 - 10780(2009)。gydF4y2Ba
鲁道夫,F.等。titin-BioID敲入小鼠肌肌结构-功能关系的解构。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba3133(2020)。gydF4y2Ba
Akram, K. M.等人。精确切割肺切片肺泡发生的实时成像显示了上皮细胞的动态行为。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba1178(2019)。gydF4y2Ba
确认gydF4y2Ba
作者感谢英国医学研究委员会(MR/S009191/1和R151002,都给M.P.), DZHK(给M.G.)和英国MRC和哮喘中心(G1000758)给G.W.的资助。G.S.感谢生物医学研究中心Guy ' s & St Thomas ' NHS基金会信托基金和伦敦国王学院以及一位感谢患者的经济支持。我们还要感谢Ismael Ranz在FACS分析方面的协助,Claudia Owczarek博士在组织处理方面的协助,Mark Rigby博士(尼康英国)在图像分析方面的协助,以及Janine Fröhlich对BioID实验的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
M.P, G.S.和e.o.z构思了这项研究。e.o.z在D.C.B.和J.R.的协助下进行了大部分实验,进行了体外pcs成像,V.L.H.进行了co-IP和免疫荧光分析,L.B.R.进行了他莫西芬对照实验,流式细胞术和细胞恢复,F.V、p.m.、M.K.和M.G.都进行了BioID数据的分析,IP-M分析了IHC图像的量化,T.J.A.M.和G.W.进行了肌图实验。M.P.和e.o.z撰写了这篇论文,征求了所有作者的意见。所有作者审阅并通过了最终论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Jonas Fuxe, Katherine Excoffon和其他匿名审稿人对这项工作的同行评议做出的贡献。gydF4y2Ba同行审查报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
奥尔蒂斯-萨帕特,E.巴格利,哥伦比亚特区,埃尔南德斯,路易斯安那州gydF4y2Baet al。gydF4y2Ba上皮柯萨奇病毒腺病毒受体促进屋尘螨诱导的肺部炎症。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba6407(2022)。https://doi.org/10.1038/s41467-022-33882-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33882-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba