摘要gydF4y2Ba
嗜铬细胞瘤(PC)和副神经节瘤(PG)是罕见的与自主神经相关的神经内分泌肿瘤。在这里,我们使用单核RNA-seq和大体积组织基因表达数据来描述PCPG和正常肾上腺组织的细胞组成,细化肿瘤基因表达亚型,并进行临床和基因型关联。我们确认了7种具有显著基因型和临床相关性的PCPG基因表达亚型。基因突变的肿瘤gydF4y2BaVHLgydF4y2Ba, sdh编码基因(gydF4y2BaSDHxgydF4y2Ba)或gydF4y2BaMAML3gydF4y2Ba-融合的特征是低氧诱导因子信号和新血管生成。PCPG浸润淋巴细胞少,巨噬细胞多。虽然肿瘤细胞在转录上类似于成熟的染色质细胞,但早期染色质和成神经细胞标记物也是一些PCPG亚型的特征。转移性的基因表达谱gydF4y2BaSDHxgydF4y2Ba相关PCPG提示这些肿瘤细胞增殖升高,非肿瘤性许旺细胞样细胞数量减少gydF4y2BaGPR139gydF4y2Ba是一个潜在的治疗目标。因此,我们的研究结果阐明了PCPG的不同转录程序和细胞组成,并确定了潜在临床意义的生物标志物。gydF4y2Ba
简介gydF4y2Ba
嗜铬细胞瘤(PC)和副神经节瘤(PG)分别是罕见的肾上腺髓质或肾上腺外副神经节神经内分泌肿瘤。大多数PG发生于轴旁交感神经的分布。一个亚群,称为“头颈PG”(HN-PG)或“副交感PG”,出现于副神经节,与迷走神经或舌咽神经有关,例如,来自颈动脉体的氧感应主细胞(血管球细胞)gydF4y2Ba1克ydF4y2Ba.由染色质组织产生的交感PCPG释放“战斗或逃跑”激素(如肾上腺素或去甲肾上腺素),如果不及时治疗,会引起高血压、出汗、心悸、头痛以及严重的心血管疾病等症状gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba.尽管所有PCPG都有转移潜力gydF4y2Ba4gydF4y2Ba,转移只发生在10-20%的患者中gydF4y2Ba5gydF4y2Ba.临床需要生物标志物来预测患者的转移进展。转移性PCPG的治疗包括手术、放疗、化疗、放射性药物和酪氨酸激酶抑制剂gydF4y2Ba6gydF4y2Ba但没有一例治愈,中位生存期约为6年gydF4y2Ba7gydF4y2Ba.改进的治疗方法将依赖于对分子和细胞疾病特征的更好理解。gydF4y2Ba
PCPG在遗传、转录、DNA甲基化、生化和代谢等方面具有异质性gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.高达40%的PCPG是遗传性的,涉及超过20个PCPG易感基因,而由体细胞突变或基因融合引起的散发性疾病占另外30-40%的病例gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.早期的微阵列分析将PCPG分为两组;即簇1 (C1)和簇2 (C2)gydF4y2Ba9gydF4y2Ba后面会进一步描述gydF4y2Ba10gydF4y2Ba.C1 PCPG是去甲肾上腺素能性和伪缺氧性的,包括缺氧诱导因子(hif)在常氧条件下的稳定gydF4y2Ba8gydF4y2Ba.涉及C1 PCPG的基因包括gydF4y2BaEPAS1gydF4y2Ba(编码HIF-2α亚基),HIF调控因子包括gydF4y2BaVHLgydF4y2Ba而且gydF4y2BaEGLN1gydF4y2Ba(编码PHD2),以及克雷布斯循环基因如琥珀酸脱氢酶亚基(gydF4y2BaSDHA-DgydF4y2Ba),gydF4y2Ba跳频gydF4y2Ba等gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.克雷布斯循环中的这些突变导致代谢中间体(如琥珀酸盐、富马酸盐)的积累和2-羟戊二酸依赖的双加氧酶的抑制,包括hif调节脯氨酸羟化酶和DNA和组蛋白去甲基化酶gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.C2肿瘤是分化良好的肾上腺素能肿瘤,典型表现为激酶信号基因的种系或体细胞突变(例如:gydF4y2Ba受潮湿腐烂gydF4y2Ba,gydF4y2BaNF1gydF4y2Ba,gydF4y2Ba极品gydF4y2Ba),gydF4y2BaTMEM127,gydF4y2Ba以及myc结合伙伴gydF4y2Ba马克斯gydF4y2Ba10gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.另外一个与体细胞相关的“wnt信号”簇gydF4y2BaMAML3gydF4y2Ba-fusion是最近才定义的gydF4y2Ba15gydF4y2Ba.PCPG基因型与疾病外显率、转移风险和治疗靶点相关gydF4y2Ba21gydF4y2Ba.gydF4y2Ba
除了肿瘤细胞本身,PCPG中的基质细胞和免疫细胞可能对了解肿瘤生物学和治疗很重要gydF4y2Ba22gydF4y2Ba.假性缺氧驱动促血管生成程序,C1肿瘤高度血管化,血管模式不规则gydF4y2Ba23gydF4y2Ba.除了组织形态学、体RNA基因表达分析和组织中选择蛋白质染色的推断外,对这些肿瘤中的正常细胞类型知之甚少。此外,通过大量PCPG对免疫细胞进行分析,在很大程度上局限于在泛癌症分析的背景下,从大量RNA数据中进行的计算机预测gydF4y2Ba24gydF4y2Ba.gydF4y2Ba
在本文中,我们将单核RNA-seq (snRNA-seq)应用于广泛选择的PCPG基因型,以识别肿瘤的基质细胞和免疫细胞组成,分别比较肿瘤和正常肾上腺组织中肿瘤细胞和正常细胞的转录谱,以及推断细胞-细胞信号。此外,大量的大块组织基因表达数据被用于确认肿瘤基因型-亚型之间的关联,验证PCPG基因表达亚型中细胞类型标志物的相对表达,并识别转移性和非转移性PCPG之间差异表达的基因和基因集。gydF4y2Ba
结果gydF4y2Ba
单核RNA-seq在冷冻PCPG肿瘤中的应用gydF4y2Ba
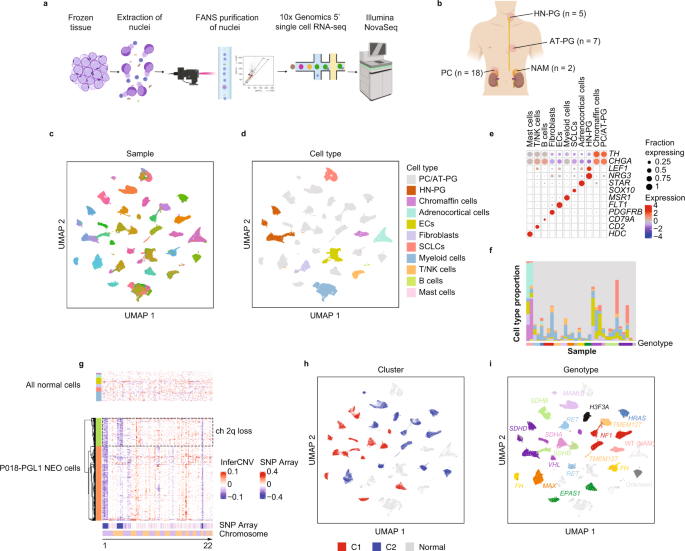
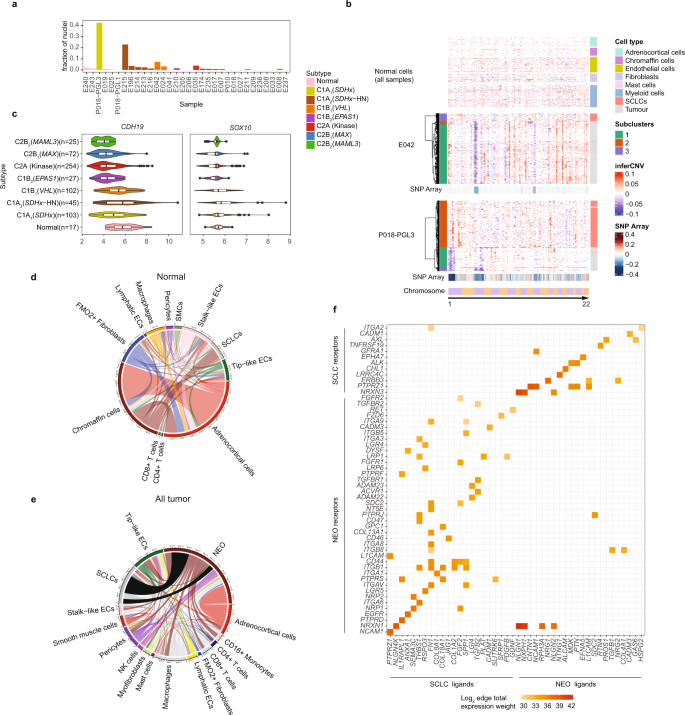
为了在单细胞分辨率下探索PCPG和正常肾上腺髓质(NAM),我们对32个冷冻肿瘤或健康正常肾上腺髓质(NAM)组织应用了基于液滴的snRNA-seq(图)。gydF4y2Ba1gydF4y2Ba)(见方法)。样本包括18个PC和7个腹胸PG (AT-PG), 5个HN-PG和2个NAM组织(图。gydF4y2Ba1 bgydF4y2Ba).PCPG代表13个已知的体细胞或种系PCPG驱动基因,均为原发肿瘤(补充数据gydF4y2Ba1克ydF4y2Ba).3个肿瘤来自发展为转移性疾病的患者(E205, PC,gydF4y2BaEPAS1gydF4y2Ba;E206,电脑,gydF4y2BaEPAS1gydF4y2Ba;E235,电脑,gydF4y2BaMAML3gydF4y2Ba2例肿瘤具有局部侵袭性特征(E007,gydF4y2BaTMEM127gydF4y2Ba;E025 AT-PG,gydF4y2BaSDHAgydF4y2Ba).两个肿瘤是来自同一患者的同步PG (P018, PGL1和PGL3,gydF4y2BaSDHBgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba描述单核分离、荧光激活核分选(FANS)和5 '化学工作流程的示意图,使用10x平台从冷冻组织开始(由BioRender.com创建)。gydF4y2BabgydF4y2Ba用snRNA-seq分析的肿瘤解剖位置和样本量(由BioRender.com创建)。gydF4y2BacgydF4y2BaUMAP聚类来自所有样本的所有核,由样本着色(单个颜色-样本键未显示,nSamples = 32)。gydF4y2BadgydF4y2Ba根据细胞类型着色的所有样品的所有核的UMAP聚类。ECs:内皮细胞;SCLCs:雪旺细胞样细胞。(nnucleus = 109,238)。gydF4y2BaegydF4y2Ba注释UMAP聚类中主要细胞类型标记的表达。表达式尺度= z -得分与均值的标准差。gydF4y2BafgydF4y2Ba单个样品中检测到的细胞类型的相对比例(细胞类型按面板着色)gydF4y2BadgydF4y2Ba).gydF4y2BaggydF4y2Ba通过基因表达推测NEO和非NEO细胞类型的拷贝数gydF4y2BaSDHBgydF4y2Ba-相关AT-PG (P018-PGL3)(底部面板;橙色和绿色为肿瘤亚克隆的肿瘤细胞),上面板;所有肿瘤和NAM组织的非肿瘤细胞类型,细胞类型按面板着色gydF4y2BadgydF4y2Ba).推论cnv尺度=修改表达式,SNP阵列尺度=对数比。gydF4y2BahgydF4y2Ba所有样本中所有NEO核的UMAP聚类,由已知相关PCPG基因表达亚型(C1/C2)着色和标记(ncores = 109,238)。gydF4y2Ba我gydF4y2BaUMAP聚类,NEO核用PCPG基因型标记和着色(ncores = 109,238)。gydF4y2Ba
质量过滤后(见方法和补充图)。gydF4y2Ba1克ydF4y2Ba),来自32个样品的109,238个核通过UMAP聚类(图。gydF4y2Ba1 cgydF4y2Ba).基质细胞和免疫细胞的细胞核按细胞系聚集,这表明技术上的差异最小,而肿瘤细胞(NEO)的细胞核按患者样本聚集(图。gydF4y2Ba1 c, dgydF4y2Ba).处理批次对样本的标注没有表现出明显的批效应,无法解释UMAP聚类模式(补充图。gydF4y2Ba2gydF4y2Ba).应用样本批量校正(见方法)导致NEO细胞共聚类(补充图。gydF4y2Ba3 gydF4y2Ba);然而,它也导致PCPG基因型之间预期的转录差异消失。因此,采用未经校正的数据进行下游分析。gydF4y2Ba
基质细胞和免疫细胞通过与FANTOM5参考基因的相似性(见方法)和细胞类型标记基因进行鉴定。gydF4y2Ba1 egydF4y2Ba).广泛的细胞系包括成纤维细胞、内皮细胞(ECs)、雪旺细胞样细胞(sclc)、髓系细胞、肥大细胞、T/NK细胞、B细胞和肾上腺皮质细胞。肿瘤内基质细胞和免疫细胞的贡献是可变的,占总细胞核的0.5至76.7%(图2)。gydF4y2Ba1 fgydF4y2Ba、补充数据gydF4y2Ba2gydF4y2Ba).下面描述了对正常细胞的更详细的分析。NEO和正常染色质细胞用gydF4y2BaTHgydF4y2Ba而且gydF4y2BaCGHAgydF4y2Ba表达式(无花果。gydF4y2Ba1 egydF4y2Ba).副交感神经HN-PG表达NEO细胞gydF4y2BaNRG3gydF4y2Ba而且gydF4y2BaLEF1gydF4y2Ba后者被确定为HN-PG中的癌症检查点gydF4y2Ba25gydF4y2Ba.在不相关的细胞类型中,低水平检测到染色质相关mRNA转录物可能是由环境RNA解释的;一个已知的基于液滴协议的技术产物。试图从生物信息学上去除这种人工制品是不成功的,因此仔细检查感兴趣的基因以确认细胞类型的特异性(见方法)。gydF4y2Ba
通过非整倍性推断(InferCNV)证实了NEO细胞,显示出与snp阵列数据(如有)一致的染色体丢失特征,以及PCPG肿瘤抑制驱动基因的杂合度丢失,包括gydF4y2BaVHLgydF4y2Ba(chr3p),gydF4y2BaNF1gydF4y2Ba(chr17q),gydF4y2BaTMEM127gydF4y2Ba(chr2q)和gydF4y2BaSDHBgydF4y2Ba(chr1p)(补充图。gydF4y2Ba4gydF4y2Ba).在一些PCPG肿瘤中发现伴有额外染色体改变的亚克隆NEO细胞群(如P018-PGL1, P018-PGL3, E210, E209, E196, E208)(补充图)。gydF4y2Ba4gydF4y2Ba).例如P018-PGL1涉及之前SNP-array检测到的亚克隆ch2q丢失gydF4y2Ba26gydF4y2Ba约25%的细胞被snRNA-seq改变(图。gydF4y2Ba1克gydF4y2Ba).gydF4y2Ba
NEO细胞的UMAP聚类与基因型或PCPG亚型广泛一致(图2)。gydF4y2Ba1 hgydF4y2Ba).例如,来自肿瘤的NEO细胞,其驱动基因涉及gydF4y2Ba马克斯gydF4y2Ba,gydF4y2BaMAML3 -gydF4y2Ba融合,gydF4y2BaNF1gydF4y2Ba,gydF4y2BaSDHDgydF4y2Ba通常由各自的基因型共聚,而两个gydF4y2Ba跳频gydF4y2Ba-突变的PC在患者间具有更大的异质性(补充图。gydF4y2Ba5gydF4y2Ba).有趣的是,对于两个同步主PG (P018 - PGL1和PGL3),我们之前报道了基于相似的染色体拷贝数改变的进化收敛gydF4y2Ba26gydF4y2Ba.来自PGL1和PGL3的NEO细胞通过UMAP紧密共聚,表明这些同步肿瘤也具有高度相似的转录谱(补充图)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
整合snRNA-seq与大体积组织基因表达数据验证PCPG亚型gydF4y2Ba
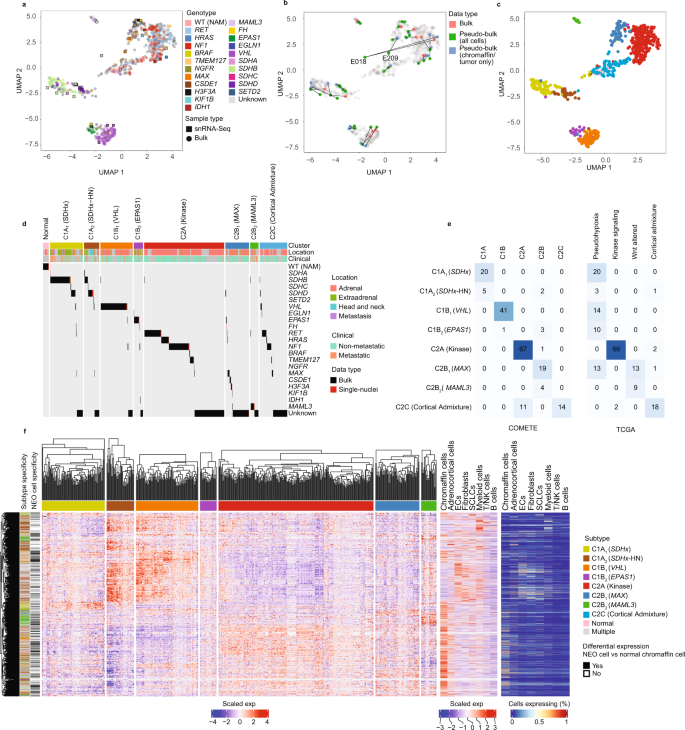
尽管snRNA-seq可用于识别PCPG之间的基因型关联,但基因型间有限的生物重复数量限制了该方法在更广泛的PCPG人群中的推广。因此,我们试图将我们的snRNA-seq数据与大量已发表的微阵列和RNA-seq数据(gydF4y2BangydF4y2Ba= 735个样本)(补充数据gydF4y2Ba3 gydF4y2Ba).在去除低质量样本后,对数据进行协调以去除平台和数据集偏差(见方法和补充图)。gydF4y2Ba6gydF4y2Ba).UMAP用于聚类合并的大体积组织和“伪大体积”snRNA-seq数据(仅合并总细胞或NEO细胞)(图2)。gydF4y2Ba2gydF4y2Ba).研究或数据类型均未观察到重大偏倚(补充图。gydF4y2Ba6gydF4y2Ba).在32个snRNA-seq分析的样本中,有14个样本有匹配的大组织RNA数据。在配对数据中,伪体snRNA-seq和散装组织样本共聚类,而不一致的对仅通过聚类伪体NEO细胞来解决(去除正常细胞的贡献),例如PC肿瘤E018 (gydF4y2Ba受潮湿腐烂gydF4y2Ba)及E209 (gydF4y2Ba马克斯gydF4y2Ba),分别表示。gydF4y2Ba2 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba所有散装组织和snRNA-seq伪散装样品的UMAP投影。每个点代表一个个体样本,按基因型着色(nBulk = 735, n-snRNA = 32) (WT (NAM):野生型正常肾上腺髓质)。gydF4y2BabgydF4y2BaUMAP突出了配对的散装组织和伪散装snRNA-seq之间的关系(仅NEO和所有细胞)。用snRNA-seq分析的样本中有14/32有大量组织基因表达数据。颜色表示数据类型,来自相同示例的数据点用线条连接起来。(nBulk = 735, n-snRNA = 32)gydF4y2BacgydF4y2BaUMAP表示一致聚类确定的肿瘤亚型,根据每组的亚型着色gydF4y2BadgydF4y2Ba(nBulk = 735, n-snRNA = 32)。gydF4y2BadgydF4y2BaPCPG亚型和基因驱动突变包括大体积组织和伪大体积snRNA-seq样本。注释条表示肿瘤亚型和原发肿瘤的解剖位置。驱动突变、原发肿瘤解剖位置和转移状态来源于公开的元数据。正常代表正常的肾上腺组织。gydF4y2BaegydF4y2Ba本研究的PCPG亚型与comte先前进行的PCPG亚型工作的交叉gydF4y2Ba10gydF4y2Ba(左面板)和TCGA(右面板)组gydF4y2Ba15gydF4y2Ba.细胞数和颜色强度表示重叠样本的数量。gydF4y2BafgydF4y2BaPCPG亚型特异性DE基因,(通过大体积组织一亚型与其余比较确定,(绝对log2FC > 0.5, BH adj。gydF4y2BaPgydF4y2Ba-value < 0.05)和交叉肿瘤特异性基因表达(由伪膨大NEO细胞(一种亚型)决定)gydF4y2Ba与gydF4y2BaNAM染色质细胞比较,绝对log2FC > 0.5, BH adj。gydF4y2BaPgydF4y2Ba-value < 0.05)。左图:DE大块组织RNA数据(nGenes = 4367, nSamples = 628)中发现基因的基因表达热图(z得分,均值标准差)。最左边的注释栏显示了按相关子型进行颜色编码的DE基因。黑条表示基因在NEO和NAM铬酸铬细胞比较中是否为DE(至少在一种情况下,某个基因在>1比较中显著)。右图:snRNA-seq数据显示DE PCPG亚型基因在非肿瘤细胞类型中的表达。左图显示伪批量数据的z分数比例表达,右图显示表达该基因的细胞比例。gydF4y2Ba
UMAP聚类显示与PCPG驱动基因显著相关(图2)。gydF4y2Ba2 a, dgydF4y2Ba补充数据gydF4y2Ba4gydF4y2Ba).共识聚类确定了9种PCPG亚型,但基于UMAP邻近性及其与激酶信号通路的关联,合并了两个共识聚类(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).两个大块组织数据集以前用于亚型发现(COMETE和TCGA)gydF4y2Ba10gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,可以比较PCPG子类型注释(图。gydF4y2Ba2 egydF4y2Ba).亚型大致一致,但在我们的分析中观察到分辨率增加。为了保持连续性,我们采用C1/C2命名法,并为每个亚型分配一个指标PCPG驱动基因或通路:C1AgydF4y2Ba1克ydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba), C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba接下来,C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba), C1BgydF4y2Ba2gydF4y2Ba(gydF4y2BaEPAS1gydF4y2Ba), C2A(激酶),C2BgydF4y2Ba1克ydF4y2Ba(gydF4y2Ba马克斯gydF4y2Ba)和C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba).gydF4y2Ba
C1组或“假缺氧”组分为四个亚型。根据现有的临床注释,C1AgydF4y2Ba1克ydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba)肿瘤以AT-PG为主(69%),并富集于gydF4y2BaSDHBgydF4y2Ba而且gydF4y2BaSDHDgydF4y2BaFisher(氏)Benjamini-Hochberg (BH)试验;gydF4y2BaPgydF4y2Ba-value < 0.001)。C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba-HN)包括了大量数据集中的所有HN-PG肿瘤,尽管HN-PG仍然只是该组肿瘤的少数(26%,8/31)。C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba-HN)也富集于gydF4y2BaSDHDgydF4y2Ba-突变体(Fisher 's test BH-adj。gydF4y2BaPgydF4y2Ba-value < 0.001)。临床注释显示两种C1A转移性PCPG富集gydF4y2Ba1克ydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba)及C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba-HN)子类型(Fisher的精确测试BH-adj。gydF4y2BaPgydF4y2Ba-value < 0.001,补充表gydF4y2Ba1克ydF4y2Ba).gydF4y2Ba
彗星C1B星团被分裂为C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)及C1BgydF4y2Ba2gydF4y2Ba(gydF4y2BaEPAS1gydF4y2Ba),后者充实gydF4y2BaEPAS1gydF4y2Ba-突变体(Fisher 's test BH adj;gydF4y2BapgydF4y2Ba< 0.001),与gydF4y2BaEPAS1 -gydF4y2Ba具有不同基因表达谱的突变型PCPGgydF4y2Ba27gydF4y2Ba.一个gydF4y2Ba跳频gydF4y2Ba-突变PCPG (E211)聚集到C1BgydF4y2Ba2gydF4y2Ba(gydF4y2BaEPAS1gydF4y2Ba)及另一条(E210)至C2BgydF4y2Ba2gydF4y2Ba(gydF4y2Ba马克斯gydF4y2Ba).在E211案例中gydF4y2Ba跳频gydF4y2Ba种系变异(gydF4y2Ba跳频gydF4y2Bac.700 A > G)先前与fh缺陷性PC有关gydF4y2Ba28gydF4y2Ba和chr1q的损失(包括gydF4y2Ba跳频gydF4y2Ba基因座)通过snRNA-seq进行推断(补充图。gydF4y2Ba7gydF4y2Ba).的gydF4y2Ba跳频gydF4y2Ba拼接位点变体(gydF4y2Ba跳频gydF4y2Ba, c.268-2A), E210病例也被报道为致病性变异gydF4y2Ba17gydF4y2Ba.更改的证据gydF4y2Ba跳频gydF4y2Ba在E210中发现rna剪接,包括外显子5表达的缺失gydF4y2Ba跳频gydF4y2Ba尽管snRNA-seq没有发现臂级chr1q损失(补充图。gydF4y2Ba7gydF4y2Ba).观察到的亚型聚类gydF4y2BaFH -gydF4y2Ba变种人是意料之外的gydF4y2Ba跳频gydF4y2Ba缺失PCPG被认为与gydF4y2BaSDHxgydF4y2Ba缺乏PCPGgydF4y2Ba29gydF4y2Ba.我们的数据表明gydF4y2Ba跳频gydF4y2Ba-缺陷PCPG可能比先前描述的更加异质性,尽管在这些肿瘤中不能排除其他驱动基因的参与。gydF4y2Ba
与先前的研究一致,C2A(激酶)亚型与激酶信号通路相关的基因有关(例如,gydF4y2BaNF1gydF4y2Ba,gydF4y2Ba受潮湿腐烂gydF4y2Ba,gydF4y2Ba极品gydF4y2Ba,gydF4y2BaTMEM127gydF4y2Ba).C2B (COMETE)或WNT-altered (TCGA)亚型重叠,但在我们的分析中,这些肿瘤分为两组;异构C2BgydF4y2Ba1克ydF4y2Ba(gydF4y2Ba马克斯gydF4y2Ba的子类型gydF4y2Ba马克斯gydF4y2Ba,gydF4y2BaCSDE1gydF4y2Ba,gydF4y2BaH3F3AgydF4y2Ba变种人和许多没有报告的司机;和C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)由11个中的10个组成gydF4y2BaMAML3gydF4y2Bafusion-positive电脑。的C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)亚型与转移性疾病呈正相关,与具有侵袭性临床特征的WNT-altered (TCGA)亚型一致gydF4y2Ba15gydF4y2Ba,但在我们的分析中未达到统计学意义(Fisher精确检验BH-adj, P-value <0.05)(补充表gydF4y2Ba1克ydF4y2Ba).最后,C2C亚型与TCGA肾上腺皮质混合物组重叠gydF4y2Ba15gydF4y2Ba并包括NAM样本(大块组织和snRNA-seq分析)。因此,snRNA-seq在NAM组织中检测到大量的肾上腺皮质细胞(占所有细胞的29-44%)。考虑到这些样本中肾上腺皮质细胞的混杂性质,C2C亚型在进一步分析中被忽略,因此我们得出结论,可能存在7种真正的PCPG基因表达亚型。gydF4y2Ba
差异表达(DE)分析应用于大块组织数据,采用一种亚型与休息结构(Log2FC > 0.5, BH-adj。gydF4y2BaPgydF4y2Ba-value < 0.05)。gydF4y2Ba2 fgydF4y2Ba、补充数据gydF4y2Ba5gydF4y2Ba).许多亚型DE基因在snRNA-seq检测到的基质细胞和免疫细胞中过表达,表明这些细胞在PCPG中富集,如下文所述。为了鉴定NEO细胞特异性基因,使用snRNA-seq数据对比伪膨大NEO细胞(结合来自多个PCPG亚型样本的细胞核)和伪膨大NAM嗜铬细胞(loggydF4y2Ba2gydF4y2BaFC > 0.5, BH-adj。gydF4y2BaPgydF4y2Ba-value < 0.05)(补充数据gydF4y2Ba6gydF4y2Ba).NEO细胞和NAM嗜铬细胞之间有439 - 2256个基因为DE,在所有PCPG亚型比较中有38个基因为常见DE。gydF4y2Ba
PCPG肿瘤微环境以促血管生成细胞类型为主gydF4y2Ba
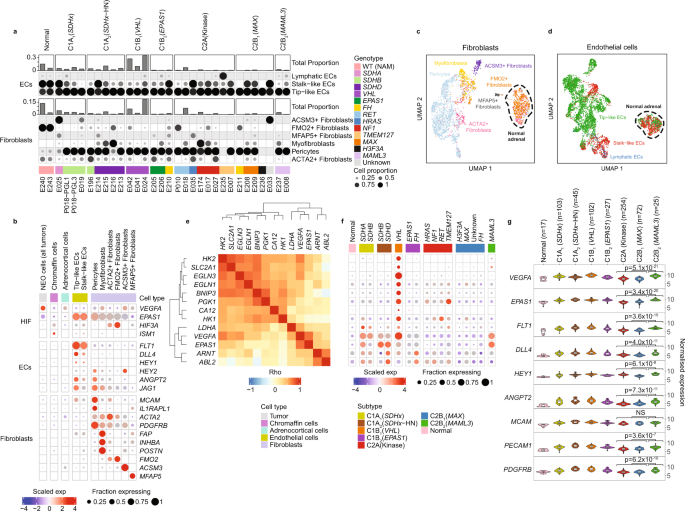
为了进一步剖析PCPG中基质细胞和免疫细胞类型的身份和功能状态,我们使用了监督分类,使用了来自两个已发表的癌症数据集的细胞类型参考gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba(见方法)。PCPG肿瘤中基质细胞亚群的频率和比例如图所示。gydF4y2Ba3gydF4y2Ba及补充资料gydF4y2Ba2gydF4y2Ba和图中顶部的细胞类型标记基因。gydF4y2Ba3 bgydF4y2Ba.gydF4y2Ba
一个gydF4y2BaPCPG中成纤维细胞和EC细胞的监督分类和计数。每个样本中成纤维细胞和ECs的比例(上图)以及组成每个主要细胞类型的功能亚型(下图)。gydF4y2BabgydF4y2Ba在每个功能细胞亚群中表达感兴趣的DE细胞类型/通路标记基因的点图。排名靠前的DE基因分别与肿瘤和NAM组织的成纤维细胞和ec形成对比,此外还有促血管生成基因gydF4y2BaEPAS1gydF4y2Ba,gydF4y2BaVEGFAgydF4y2Ba还有抗血管生成基因gydF4y2BaISM1gydF4y2Ba,gydF4y2BaHIF3AgydF4y2Ba在NEO和NAM组织正常染色质细胞之间发现DE。点状图显示不同细胞类型和NAM组织的多瘤合并细胞核表达。所示的嗜铬细胞仅来自NAM组织。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba的UMAP重新聚类gydF4y2BacgydF4y2Ba成纤维细胞(nCells = 2901)和gydF4y2BadgydF4y2BasnRNA-seq分析所有肿瘤和正常样本的ECs (nCells = 5430)。细胞核根据细胞亚型分类着色。gydF4y2BaegydF4y2BaNEO细胞中hif相关基因的Spearman-rank相关性研究。gydF4y2BafgydF4y2Ba在PCPG样本(来自肿瘤的NEO细胞结合进行基因型/亚型分析)中描述的基因的伪体表达(gydF4y2BaegydF4y2Ba).gydF4y2BaggydF4y2Ba血管生成基因标记物的大体积组织基因表达gydF4y2BaEPAS1gydF4y2Ba而且gydF4y2BaVEGFAgydF4y2Ba在PCPG子类型内(nSamples = 645)(每个箱线图的上下铰链分别对应于第一和第三四分位数,并标记中值。须分别延伸至不大于上下铰链四分位范围1.5倍的最大值和最小值。超过晶须范围的值被认为是异常值,并单独绘制)。WT (NAM):野生型正常肾上腺髓质。差异基因表达采用经验贝叶斯调节的limma法测定gydF4y2BatgydF4y2Ba-统计数据,并使用Benjamini-Hochberg (BH)校正对FDR进行了调整。gydF4y2Ba
成纤维细胞和ECs的UMAP聚类在这些肿瘤细胞和NAM组织中显示出明显的转录差异(图。gydF4y2Ba3 c, dgydF4y2Ba).在肿瘤中检测到肌成纤维细胞(占所有细胞的0.02-1.49%),但在NAM组织中未检测到肌成纤维细胞。肿瘤与nam相关成纤维细胞之间的DE基因(log2FC > 0.5, BH adj.;gydF4y2BaPgydF4y2Ba-value < 0.05)包括在内gydF4y2BaFAPgydF4y2Ba,gydF4y2BaINHBAgydF4y2Ba而且gydF4y2BaPOSTNgydF4y2Ba这些基因在肌成纤维细胞中相应表达(图。gydF4y2Ba3 bgydF4y2Ba、补充数据gydF4y2Ba6gydF4y2Ba).平滑肌肌动蛋白(gydF4y2BaACTA2gydF4y2Ba)表达的成纤维细胞在肿瘤组织(0.35 ~ 2.44%)和NAM组织(0.34 ~ 2.5%)中均有表达。一些成纤维细胞形成离散的UMAP簇,但在已发表的癌症文献中未被归类为细胞类型。NAM组织中大部分成纤维细胞(73-74%)表达gydF4y2BaFMO2gydF4y2Ba这是健康皮肤中的一种成纤维细胞标志gydF4y2Ba32gydF4y2Ba.包括另外两个成纤维细胞种群gydF4y2BaACSM3 -gydF4y2Ba在两个pcpg中检测到表达细胞(E025, SDHA/C1A)gydF4y2Ba1克ydF4y2Ba;E033,未知驱动/C2Bi)和gydF4y2BaMFAP5gydF4y2Ba-表达细胞在肿瘤和NAM组织中发现频率较低。gydF4y2Ba
与新生血管一致,gydF4y2BaFLT1gydF4y2Ba-表达ECs在PCPG中丰富,主要由gydF4y2BaDLL4gydF4y2Ba-表达尖状细胞(0.049-23.83%)。表达了对血管形成很重要的周细胞gydF4y2BaMCAMgydF4y2Ba而且gydF4y2BaILRAPL1gydF4y2Ba是肿瘤中占主导地位的成纤维细胞(0.06-14.32%)。gydF4y2Ba3 a, bgydF4y2Ba).肿瘤与NAM ECs之间的DE (log2FC > 0.5, BH adj.;gydF4y2BaPgydF4y2Ba-value < 0.05)也反映了PCPG促血管生成的特征,TIE2受体配体过表达gydF4y2BaANGPT2gydF4y2Ba还有凝血因子gydF4y2BaVWFgydF4y2Ba(无花果。gydF4y2Ba3 bgydF4y2Ba、补充数据gydF4y2Ba6gydF4y2Ba).对肿瘤和nam衍生的尖状或柄状EC亚群的独立分析显示,DE基因的大量重叠(36.8%)与EC亚群无关(补充数据)gydF4y2Ba7gydF4y2Ba,补充图。gydF4y2Ba8gydF4y2Ba),提示一种常见的肿瘤相关EC计划。gydF4y2Ba
Pro-angiogenic因素gydF4y2BaVEGFAgydF4y2Ba在NEO细胞中过表达,在gydF4y2BaVHLgydF4y2Ba-突变的肿瘤,与较高数量的ECs检测一致gydF4y2BaVHLgydF4y2Ba-突变PCPG与其他PCPG相比(gydF4y2BaTgydF4y2Ba-test FDR < 0.05)gydF4y2Ba3 a, bgydF4y2Ba、补充数据gydF4y2Ba8gydF4y2Ba).gydF4y2BaVEGFAgydF4y2Ba高度相关gydF4y2BaEPAS1gydF4y2Ba所有PCPG中NEO细胞的表达(Spearman-rank相关)gydF4y2BaρgydF4y2Ba= 0.72)。gydF4y2Ba3 egydF4y2Ba),而NEO细胞来自gydF4y2BaVHL -gydF4y2Ba突变体表现出额外的HIF靶基因的表达,包括gydF4y2BaHK1gydF4y2Ba,gydF4y2BaHk2, ca12, scl2a1gydF4y2Ba(GLUT1)(图。gydF4y2Ba3 fgydF4y2Ba).有趣的是,血管生成抑制剂gydF4y2BaISM1gydF4y2Ba33gydF4y2Ba而且gydF4y2BaHIF3AgydF4y2Ba34gydF4y2Ba与NAM染色质细胞相比,所有PCPG亚型的NEO细胞中均低表达(补充数据gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
出乎意料的是,hif相关基因gydF4y2BaVEGFAgydF4y2Ba而且gydF4y2BaEPAS1gydF4y2Ba在C2B中过表达gydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)肿瘤,而在gydF4y2BaEPAS1gydF4y2Ba而且gydF4y2Ba跳频gydF4y2Ba-突变体,后者通常被认为是假缺氧的(图。gydF4y2Ba3 f, ggydF4y2Ba).虽然在C2B中检测到相对较少的ec和周细胞gydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)肿瘤的snRNA-seq, ECs的标记物(gydF4y2BaFLT1gydF4y2Ba,gydF4y2BaANGPT2gydF4y2Ba,gydF4y2BaHEY1gydF4y2Ba,gydF4y2BaDLL4)gydF4y2Ba周细胞(gydF4y2BaMCAMgydF4y2Ba)在C2B中过表达gydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)与大体积组织数据中的其他C2亚型相比(图。gydF4y2Ba3 ggydF4y2Ba) (BH-adj。gydF4y2BaPgydF4y2Ba< 0.001)。C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)因此,PCPG可能具有促血管生成的特征。gydF4y2Ba
PCPG中的免疫细胞浸润以巨噬细胞为主gydF4y2Ba
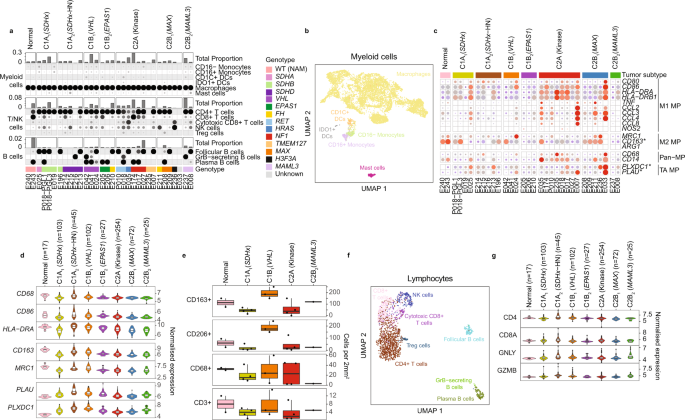
在免疫细胞方面,髓系细胞是PCPG中的主要白细胞(范围0.06-31.05%,平均7.42%,所有细胞),这与先前的研究一致,表明PCPG中有丰富的单核细胞gydF4y2Ba35gydF4y2Ba.snRNA-seq检测到的大多数骨髓细胞被分类为巨噬细胞(占总骨髓细胞的94%),少量CD16+(1.9%)和CD16−(2.5%)单核细胞,IDO1+(1%)和CD1C+(1.9%)树突状细胞和肥大细胞(gydF4y2BaTPSAB1gydF4y2Ba(图)(3%)。gydF4y2Ba4 a、bgydF4y2Ba、补充数据gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaPCPG中免疫细胞组分的监督分类。每个样本中每种主要免疫细胞类型的比例(上图)和构成每种主要细胞类型的功能亚群(下图)。gydF4y2BabgydF4y2Ba来自所有snRNA-seq样本的髓细胞UMAP重新聚类。细胞核根据其分类的功能细胞亚群(nCells = 7977)着色。gydF4y2BacgydF4y2BaPCPG和NAM组织中巨噬细胞中巨噬细胞(MP)标记基因snRNA-seq的表达。(助教:肿瘤相关)gydF4y2BadgydF4y2Ba通过免疫组织化学染色检测到的肿瘤内白细胞计数,用于典型巨噬细胞标记物(CD163, CD206, CD68)和T细胞标记物(CD3) (nSamples = 645,每个箱线图的上下铰链分别对应于第一和第三四分位数,并标记中位数。须分别延伸至不大于上下铰链四分位范围1.5倍的最大值和最小值。超过晶须范围的值被认为是异常值,并单独绘制)。gydF4y2BaegydF4y2Ba与肿瘤和NAM巨噬细胞相比,DE表达的巨噬细胞的大块组织表达(nSamples = 14,箱形图按每组解释gydF4y2BadgydF4y2Ba).gydF4y2BafgydF4y2Ba所有snRNA-seq样本中T/B细胞的UMAP重聚(nCells = 2140)。gydF4y2BaggydF4y2BaT/NK细胞标志物在不同亚型间的大体积组织基因表达。dc树突状细胞,NK细胞自然杀伤细胞。WT (NAM)野生型正常肾上腺髓质(nSamples = 645,箱形图按面板解释gydF4y2BadgydF4y2Ba).gydF4y2Ba
巨噬细胞是已知的表现出显著的可塑性在光谱的极化状态。可视化典型巨噬细胞标记基因,包括所谓的M1和M2标记,显示肿瘤之间存在相当大的异质性(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).在大体积组织基因表达数据中,肿瘤为C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba-HN)和C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)亚型的巨噬细胞标志物表达较高(图;gydF4y2Ba4 dgydF4y2Ba).为了进一步验证我们的免疫组化观察结果,我们对12个匹配的肿瘤和2个正常的肾上腺组织进行了CD68、CD163和CD206染色(图2)。gydF4y2Ba4 egydF4y2Ba,补充表gydF4y2Ba2gydF4y2Ba)(见方法)。与髓质相比,肾上腺皮质中CD163+和CD206+细胞更为丰富,这解释了这些M2巨噬细胞标记物在NAM体积组织基因表达数据和NAM组织巨噬细胞中snRNA-seq的相对高表达。gydF4y2Ba9gydF4y2Ba).在PCPG肿瘤中,瘤内CD163+和CD206+细胞最多gydF4y2BaVHLgydF4y2Ba-突变体PCPG(图;gydF4y2Ba4 egydF4y2Ba)与其他子类型相比。gydF4y2Ba
与正常肾上腺巨噬细胞相比,肿瘤相关巨噬细胞中基因过度表达gydF4y2BaPLXDC1gydF4y2Ba而且gydF4y2BaPLAUgydF4y2Ba(log2FC > 0.5;gydF4y2BaPgydF4y2Ba-value < 0.05)(补充数据gydF4y2Ba7gydF4y2Ba,无花果。gydF4y2Ba4摄氏度gydF4y2Ba).PLXDC1是多能因子PEDC的跨膜受体,具有重要的抗血管生成和抗肿瘤功能gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.PLAU是一种丝氨酸蛋白酶,对组织重塑和血管生成有重要作用gydF4y2Ba38gydF4y2Ba.就像我们在大量基因表达数据中对典型巨噬细胞亚型基因表达的观察一样,gydF4y2BaPLXDC1gydF4y2Ba而且gydF4y2BaPLAUgydF4y2Ba在C1A中表达最高gydF4y2Ba2gydF4y2Ba(HN-PGL)和C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)子类型(图gydF4y2Ba4 dgydF4y2Ba).gydF4y2Ba
通过snRNA-seq分析,淋巴细胞在肿瘤免疫细胞中所占比例要小得多(范围0.02-8.93%,平均2.3%)。12个PCPG的CD3 IHC染色证实T细胞数量相对较低(平均= 5个/mm)gydF4y2Ba2gydF4y2Ba)与CD163+巨噬细胞(平均= 105个/mm)相比gydF4y2Ba2gydF4y2Ba)(图。gydF4y2Ba4 fgydF4y2Ba,补充表gydF4y2Ba2gydF4y2Ba).snRNA-seq显示T细胞表型占优势gydF4y2BaCD4gydF4y2Ba用少量细胞毒性T细胞表达细胞(gydF4y2BaCD8AgydF4y2Ba,gydF4y2BaGZMBgydF4y2Ba)、NK细胞(gydF4y2BaNCAM1gydF4y2Ba(CD56),gydF4y2BagngydF4y2Ba)和t调节细胞(gydF4y2BaFOXP3gydF4y2Ba)检测到(图;gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2Ba10gydF4y2Ba、补充数据gydF4y2Ba2gydF4y2Ba).B细胞形成三个不同的簇:滤泡的(gydF4y2BaMS4A1gydF4y2Ba)、GZMB+和浆细胞(gydF4y2BaFCRL5gydF4y2Ba)(图。gydF4y2Ba4 egydF4y2Ba).淋巴细胞标记在大体积组织数据的询问没有显示显着的差异PCPG亚型,但先天细胞标记gydF4y2BaGLNYgydF4y2Ba和细胞溶解标记物gydF4y2BaGZMBgydF4y2BaC2B略有升高gydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)及C1AgydF4y2Ba2gydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba-HN)肿瘤以及其他PCPG亚型的偶尔异常病例(图2)。gydF4y2Ba4 fgydF4y2Ba).gydF4y2Ba
许旺细胞样细胞(sclc)和NEO细胞推定的旁分泌信号gydF4y2Ba
PCPG、成神经细胞瘤和NAM组织中含有被称为支撑细胞的雪旺样细胞,通过免疫组化染色检测到SOX10和S100gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.在小鼠和人类中,染色质细胞被认为来自多能性神经嵴细胞,称为雪旺细胞前体(SCPs),也表达这些标记gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.PCPG中的支撑细胞是前体还是终分化在我们的数据中无法确认,因此我们将其描述为许旺细胞样而不是SCPs。gydF4y2Ba
一些C1 PCPG中有大量sclc(范围0-22.9%,平均6.8%),但在C2 PCPG中不常见(范围0-3.89%,平均0.85%),尽管亚型之间没有统计学意义(图2)。gydF4y2Ba5gydF4y2Ba).对snRNA-seq数据的推断cnv分析显示,PCPG中的sclc表面上是二倍体(图2)。gydF4y2Ba5 bgydF4y2Ba),与先前使用IHC等正交方法的观察结果一致gydF4y2Ba44gydF4y2Ba流式细胞术gydF4y2Ba45gydF4y2Ba.gydF4y2BaCDH19gydF4y2Ba是通过sclc和RNA原位杂交(ISH)靶向表达的gydF4y2BaCDH19gydF4y2BaAT-PG肿瘤(P018-PGL3)中显示纺锤状细胞染色,用免疫组化方法与S100 +细胞形态相似(补充图。gydF4y2Ba11gydF4y2Ba).gydF4y2BaCDH19gydF4y2Ba而且gydF4y2BaSOX10gydF4y2Ba体组织数据中的表达支持C1 PCPG亚型中存在更多sclc的趋势。C1BgydF4y2Ba2gydF4y2Ba(gydF4y2BaEPAS1gydF4y2Ba)通过snRNA-seq检测,PCPG的sclc较少gydF4y2BaSOX10gydF4y2Ba/gydF4y2BaCDH19gydF4y2Ba在大体积组织数据中的表达(图;gydF4y2Ba5度gydF4y2Ba).gydF4y2Ba
一个gydF4y2BasnRNA-seq在PCPG肿瘤中检测到的所有细胞中sclc的比例。gydF4y2BabgydF4y2Ba两种PCPG肿瘤(E042, P018-PGL3)中NEO和SCLC群体的推断拷贝数和聚类(下图;簇状肿瘤细胞和sclc,上面板;非肿瘤细胞类型,排除所有肿瘤和正常组织的sclc)。推论cnv尺度=修改表达式,SNP阵列尺度=对数比。gydF4y2BacgydF4y2BaSCLC标记基因的表达gydF4y2BaCDH19gydF4y2Ba而且gydF4y2BaSOX10gydF4y2Ba在大体积组织数据(nSamples = 645)中,每个箱线图的下铰和上铰分别对应于第一和第三四分位数,并标记中值。须分别延伸至不大于上下铰链四分位范围1.5倍的最大值和最小值。超过晶须范围的值被认为是异常值,并单独绘制)。NATMI平均边总表达权重的弦图显示了在所有细胞类型之间推断信号总量的平均值gydF4y2BadgydF4y2Ba、NAM样本及gydF4y2BaegydF4y2Ba, PCPG肿瘤标本。gydF4y2BafgydF4y2Basclc表达的配体和受体及其已知靶受体和配体在肿瘤细胞上的平均边总表达量。与其他正常细胞相比,sclc的配体和受体在log2FC > 3, BH adj。gydF4y2BaPgydF4y2Ba-value < 0.05)。gydF4y2Ba
为了研究PCPG中的细胞-细胞通信,我们使用NATMI方法推断细胞-细胞相互作用gydF4y2Ba46gydF4y2Ba,根据受体-配体相互作用的平均边总表达权对受体-配体基因对进行排序(补充数据gydF4y2Ba9gydF4y2Ba).在NAM组织中,正常染色质细胞和sclc之间的受体-配体相互作用占总边缘的8%。gydF4y2Ba5 dgydF4y2Ba)和12%的PCPG中NEO细胞与sclc之间的边缘(图。gydF4y2Ba5 egydF4y2Ba).受体和配体在SCLCs中显著过表达(log2FC > 3, BH adj.)。gydF4y2BaPgydF4y2Ba-value < 0.05)与NATMI结果交叉,以确定sclc与NEO细胞之间的顶级基因-基因对(图5)。gydF4y2Ba5 fgydF4y2Ba).配体-受体对反映已知的雪旺细胞功能,包括gydF4y2BaLGI4gydF4y2Ba-gydF4y2BaADAM22 / ADAM23gydF4y2Ba,gydF4y2BaGDNF-RETgydF4y2Ba47gydF4y2Ba,gydF4y2BaFGF2gydF4y2Ba-gydF4y2BaFGFR1 / FGFR2gydF4y2Ba48gydF4y2Ba.WNT (gydF4y2BaRSPO3-LGR4 / LGR5就)gydF4y2Ba和TGFB信号(gydF4y2BaTGFB2-TGFBR1gydF4y2Ba)。受体在SCLCs中过表达的例子包括gydF4y2BaERBB3gydF4y2Ba(肿瘤配体gydF4y2BaNRG1gydF4y2Ba,gydF4y2BaNRG2gydF4y2Ba)和GDNF受体1编码gydF4y2BaGFRA1gydF4y2Ba(配体gydF4y2BaNCAM1gydF4y2Ba).gydF4y2Ba
PCPG表现出不同的染色质细胞分化模式gydF4y2Ba
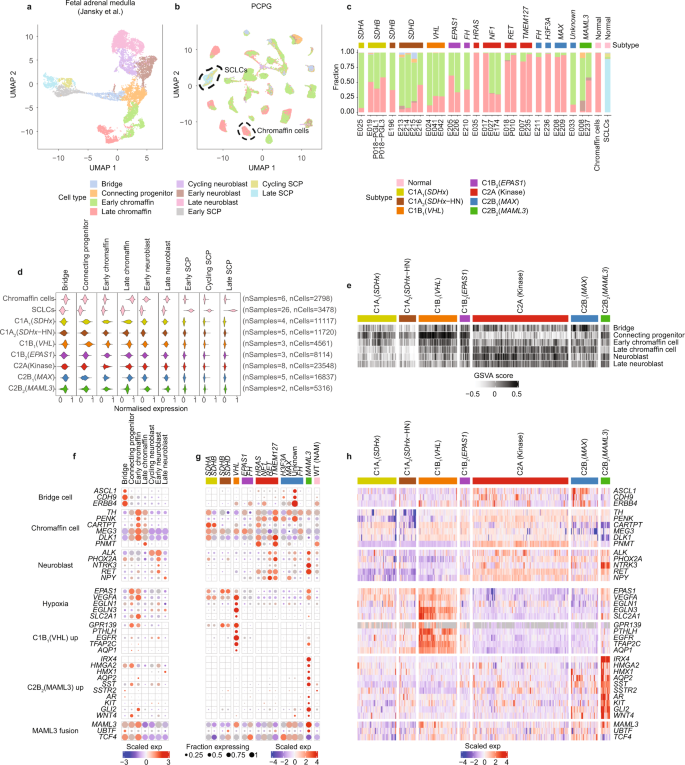
PCPG表达不同的染色质相关基因,表明细胞分化或发育起源的不同状态。为了确定PCPG在早期发育过程中与交感肾上腺细胞的相似性,我们使用了已发表的七个发育时间点的正常人类胎儿肾上腺组织的snRNA-seq数据集gydF4y2Ba49gydF4y2Ba.Jansky等人鉴定了肾上腺髓质细胞类型,包括scp(周期,晚期)、桥细胞、连接祖细胞、染色质细胞(早期和晚期)和成神经细胞群(早期、周期和晚期)(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, UMAP投影显示胎儿肾上腺髓质snrna序列(nSamples = 17, nCells = 10,739),先前由Jansky等人发表。gydF4y2Ba49gydF4y2Ba.gydF4y2BabgydF4y2Ba根据细胞类型分类(nSamples = 30,非肿瘤性细胞= 81213,非nSCLCs = 3335)和成人肾上腺髓质(nSamples = 2,非染色质细胞= 2798,非nSCLCs = 143)对PCPG细胞群的UMAP进行着色。黑色虚线显示正常的嗜铬细胞和SCLC细胞类型。gydF4y2BacgydF4y2BaNEO细胞或正常细胞(PCPG和NAM结合)属于正常胎儿肾上腺细胞类型。gydF4y2BadgydF4y2Ba基于Jansky等人鉴定的基因集,对NEO细胞、正常染色质细胞和sclc进行snRNA-seq基因模块评分(nSamples = 32, nCells = 87,489)gydF4y2Ba49gydF4y2Ba.gydF4y2BaegydF4y2BaGSVA评分使用PCPG大组织数据中PCPG亚型的胎儿肾上腺基因集。gydF4y2BafgydF4y2Ba正常胎儿细胞数据中胎儿肾上腺细胞和PCPG亚型标记物的snRNA-seq基因表达。gydF4y2BaggydF4y2Ba相同基因的表达情况(gydF4y2BafgydF4y2Ba),但在PCPG亚型的NEO细胞中(NEO细胞根据基因型和亚型谱进行汇总)。gydF4y2BahgydF4y2Ba大块组织基因表达(gydF4y2BangydF4y2Ba= 628个样本),显示相同的基因(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba).gydF4y2Ba
我们使用两种方法将NEO细胞与正常胎儿肾上腺细胞进行比较。首先,我们应用了一种监督细胞分类方法,类似于用于分类基质细胞和免疫细胞(图2)。gydF4y2Ba6 b, cgydF4y2Ba、补充数据gydF4y2Ba10gydF4y2Ba).正如预期的那样,几乎所有(99%)成年NAM嗜铬细胞被归类为晚期嗜铬细胞,95%的sclc被归类为SCPs(89%为晚期SCPs)。大部分来自C1 PCPG的NEO细胞被归类为早期染色质细胞(范围38-92%,平均66%)。相比之下,来自C2A(激酶)和C2B的NEO细胞gydF4y2Ba1克ydF4y2Ba(gydF4y2Ba马克斯gydF4y2Ba)肿瘤大多被归类为晚期染色质细胞,只有两个除外gydF4y2BaNF1gydF4y2Ba-突变PC (E027, E174)和一个未知基因驱动的PC (E033),主要由归类为早期染色质细胞的NEO细胞组成。的C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2BaPC具有较高比例的早期染色质细胞(平均56%),而神经母细胞(范围5-17%)和连接祖细胞(范围1-9%)是较小的亚群。gydF4y2Ba跳频gydF4y2Ba-突变体呈发散性,其中一例(E210)主要由早期染色质细胞组成(62%),另一例(E211)主要由晚期染色质细胞组成(92%)。gydF4y2Ba
第二种方法涉及计算细胞类型标记基因集的模块得分(见方法)。使用Jansky等鉴定的基因集计算NEO细胞中的细胞类型模块评分,并通过PCPG亚型绘制NEO细胞的数据。gydF4y2Ba6 dgydF4y2Ba、补充数据gydF4y2Ba11gydF4y2Ba).同样的基因集也被用于基因集方差分析(GSVA),计算个体样本在大体积组织数据中的富集分数(图。gydF4y2Ba6 egydF4y2Ba).我们的snRNA-seq数据(仅NEO细胞)和大体积组织数据分别显示了所选交感肾上腺细胞类型标记物的表达(图2)。gydF4y2Ba6 f, ggydF4y2Ba).gydF4y2Ba
在C1亚型中观察到早期染色质基因的富集,与细胞分类方法一致。C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)肿瘤也有连接祖细胞基因集的富集;代表瞬时细胞群连接桥,在受孕后7-8周检测到嗜铬酸盐和成神经细胞类型gydF4y2Ba49gydF4y2Ba.正如预期的那样,C2A(激酶)肿瘤对晚期染色质细胞有更高的模块评分并表达gydF4y2BaPNMTgydF4y2Ba编码将去甲肾上腺素转化为肾上腺素的酶,以及神经母细胞标记物gydF4y2Ba受潮湿腐烂gydF4y2Ba而且gydF4y2BaNPYgydF4y2Ba.值得注意的是,gydF4y2BaNPYgydF4y2Ba在PCPG C1亚型中表达较低,但在C1B中保留gydF4y2Ba2gydF4y2Ba(gydF4y2BaEPAS1gydF4y2Ba)肿瘤。C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba) PCPG细胞染色质标记物低表达gydF4y2BaCARTPTgydF4y2Ba而且gydF4y2BaDLK1gydF4y2Ba但早期神经母细胞标志物的高表达包括gydF4y2Ba碱性gydF4y2Ba,gydF4y2Ba受潮湿腐烂,gydF4y2Ba而且gydF4y2BaNTRK3gydF4y2Ba.PCPG的一个子集有桥细胞标记的表达(gydF4y2BaASCL1gydF4y2Ba,gydF4y2BaCDH9gydF4y2Ba,gydF4y2BaERBB4gydF4y2Ba),包括C2B的肿瘤gydF4y2Ba1克ydF4y2Ba亚型,例如,肿瘤带有gydF4y2BaH3F3AgydF4y2Ba突变(E326)和另一个没有已知基因驱动的突变(E033)gydF4y2Ba50gydF4y2Ba.gydF4y2Ba
与HIF-2α对交感神经和副交感神经组织发育的重要性一致gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2BaEPAS1gydF4y2Ba而且gydF4y2BaVEGFAgydF4y2Ba在连接桥祖细胞和早期染色质细胞中过表达(图;gydF4y2Ba6 f, ggydF4y2Ba).值得注意的是,与NEO细胞相比,PCPG亚型之间的许多其他基因DE在发育的交感肾上腺细胞类型中要么未被检测到,要么表达非常低。例如,C1BgydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba) DE基因包括gydF4y2BaPTHLHgydF4y2Ba,gydF4y2BaTFAP2C,gydF4y2Ba而且gydF4y2BaAQP1gydF4y2Ba在胎儿和成人嗜铬细胞中均低表达。如前所述,C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba) PCPG过表达Wnt和Hedgehog通路基因包括gydF4y2BaGLI2gydF4y2Ba而且gydF4y2BaWNT4gydF4y2Ba15gydF4y2Ba这些在正常细胞类型中也低表达。C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)肿瘤独特地过表达几种转录因子,包括gydF4y2BaHMX1gydF4y2Ba,gydF4y2BaHMGA2gydF4y2Ba,gydF4y2BaIRX4gydF4y2Ba25gydF4y2Ba还有水通道蛋白gydF4y2BaAQP2gydF4y2Ba,生长抑素配体(gydF4y2Ba风场gydF4y2Ba)配体及其同源受体gydF4y2BaSSTR2gydF4y2Ba后者在C1B中表达非常低gydF4y2Ba1克ydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)肿瘤。值得注意的是,gydF4y2BaMAML3gydF4y2Ba还有融合伴侣基因gydF4y2BaUBTFgydF4y2Ba而且gydF4y2BaTCF4gydF4y2Ba在桥、连接祖细胞和早期染色质细胞类型中均有表达。gydF4y2Ba
细胞受体被确定为PCPG肿瘤的假定治疗靶点gydF4y2Ba
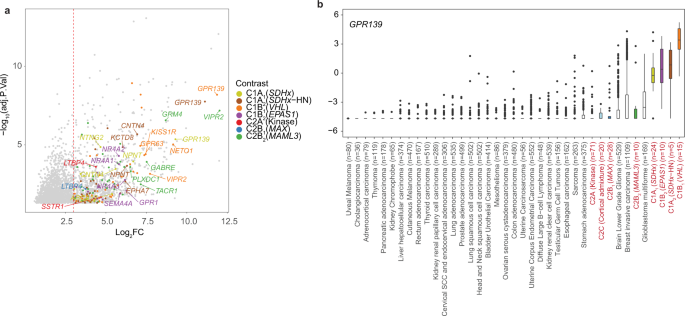
在NEO细胞中大量过表达的基因编码细胞表面受体;一类有吸引力的治疗或诊断(治疗)靶点(图。gydF4y2Ba7一个gydF4y2Ba、补充数据gydF4y2Ba6gydF4y2Ba).在酪氨酸激酶中,gydF4y2Ba表皮生长因子受体gydF4y2Ba是否被C1A过表达gydF4y2Ba2gydF4y2Ba(gydF4y2BaVHLgydF4y2Ba)肿瘤和一些C1AgydF4y2Ba1克ydF4y2Ba(gydF4y2BaSDHxgydF4y2Ba)肿瘤,而gydF4y2Ba工具包gydF4y2Ba在C2B中高度表达gydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)亚型。gydF4y2Ba表皮生长因子受体gydF4y2Ba中也描述过过度表达gydF4y2BaVHLgydF4y2Ba-相关肾细胞癌gydF4y2Ba53gydF4y2Ba.雄激素受体(gydF4y2Ba基于“增大化现实”技术gydF4y2Ba)和g蛋白偶联受体gydF4y2BaVIPR2gydF4y2Ba在C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)肿瘤。孤g蛋白偶联受体gydF4y2BaGPR139gydF4y2BaC1 PCPG表达受限。在发育中的胎儿肾上腺snrna seq数据中,gydF4y2BaGPR139gydF4y2Ba在连接祖细胞和早期染色质细胞中表达,但在晚期染色质细胞中不表达(图2)。gydF4y2Ba6 fgydF4y2Ba).通过对比分析TCGA泛癌基因表达数据证实gydF4y2BaGPR139gydF4y2Ba在PCPG亚群中高表达,同时在中枢神经系统恶性肿瘤和乳腺腺癌亚群中也高表达(图2)。gydF4y2Ba7 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba火山图显示显著DE基因(adj;gydF4y2BapgydF4y2Ba-value < 0.05),根据PCPG亚型对比伪膨大的NEO细胞和NAM嗜铬细胞(补充数据gydF4y2Ba5gydF4y2Ba).只有编码细胞表面受体的基因被着色,每个PCPG亚型的顶部受体被标记。虚线表示用于选择受体基因的log2三倍变化阈值。gydF4y2BabgydF4y2Ba的表达gydF4y2BaGPR139gydF4y2BaTCGA泛癌症数据集中的32种癌症类型的10211个肿瘤。PCPG由它们各自的子类型着色。WT (NAM):野生型正常肾上腺髓质(每个箱线图的上下铰分别对应第1、3个四分位数,并标记中值。须分别延伸至不大于上下铰链四分位范围1.5倍的最大值和最小值。超过晶须范围的值被认为是异常值,并单独绘制)。gydF4y2Ba
与转移性PCPG相关的转录模式gydF4y2Ba
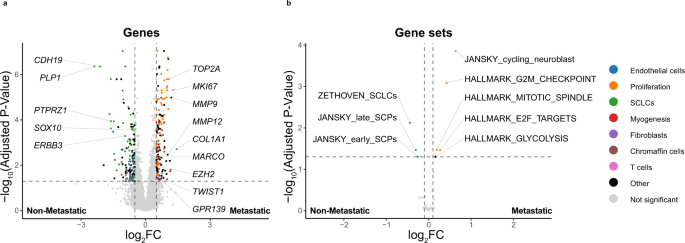
临床注释可用于大体积组织基因表达数据,使转移性(gydF4y2BangydF4y2Ba= 52)和非转移性PCPG (gydF4y2BangydF4y2Ba= 330)。考虑到PCPG亚型之间的显著转录异质性和C1A中更高的转移性疾病率(gydF4y2BaSDHxgydF4y2Ba)亚型,C1A (gydF4y2BaSDHxgydF4y2Ba)肿瘤分析独立于非gydF4y2BaSDHxgydF4y2Ba肿瘤。有趣的是,转移性和非转移性C1A之间共有299个基因是DE (gydF4y2BaSDHxgydF4y2Ba)肿瘤(Log2FC > 0.5, BH-adj.;gydF4y2BaPgydF4y2Ba-value < 0.05)。gydF4y2Ba8gydF4y2Ba),而非-中DE基因只有47个gydF4y2BaSDHxgydF4y2Ba两种分析中只有3个基因重叠(补充图。gydF4y2Ba13gydF4y2Ba、补充数据gydF4y2Ba12gydF4y2Ba).GSVA也使用MSigDb标记基因集以及基质细胞、免疫细胞和胎儿肾上腺细胞基因集进行gydF4y2Ba49gydF4y2Ba(无花果。gydF4y2Ba8 bgydF4y2Ba,补充表gydF4y2Ba3 gydF4y2Ba).在非gydF4y2BaSDHxgydF4y2Ba转移性肿瘤和非转移性肿瘤之间没有显著的基因集。转移性C1A (gydF4y2BaSDHxgydF4y2Ba)肿瘤细胞周期相关基因集升高(Hallmark G2M, E2F靶标,有丝分裂纺锤体;(Log2Fold > 1.0, BH-adjustedgydF4y2BaPgydF4y2Ba-value < 0.05)和过表达的典型增殖标志物(gydF4y2BaMKI67gydF4y2Ba,gydF4y2BaTOP2AgydF4y2Ba)(图。gydF4y2Ba8gydF4y2Ba).相反,SCLC和SCP基因集和雪旺细胞标记基因(gydF4y2BaCDH19gydF4y2Ba,gydF4y2BaSOX10gydF4y2Ba转移性C1A (gydF4y2BaSDHxgydF4y2Ba)组(图gydF4y2Ba8 a、bgydF4y2Ba).其他基因在转移性C1A中过表达(gydF4y2BaSDHxgydF4y2Ba)肿瘤中含有胶原蛋白(gydF4y2BaCOL1A1gydF4y2Ba,gydF4y2BaCOL6A3gydF4y2Ba);在我们的snRNA-seq数据中,成纤维细胞和偶尔的NEO细胞中过度表达(补充图。gydF4y2Ba12gydF4y2Ba、补充数据gydF4y2Ba12gydF4y2Ba)、金属蛋白酶(gydF4y2BaMMP9gydF4y2Ba,gydF4y2BaMMP12gydF4y2Ba在snRNA-seq数据中,EMT转录因子在所有细胞中均低水平表达gydF4y2BaTWIST1gydF4y2Ba以及多梳阻遏器gydF4y2BaEZH2gydF4y2Ba,在NEO和间质细胞类型中表达不同(补充图。gydF4y2Ba12gydF4y2Ba).巨噬细胞标记gydF4y2Ba马可gydF4y2Ba而且gydF4y2BaCD68gydF4y2Ba转移性C1A过表达(gydF4y2BaSDHxgydF4y2Ba)肿瘤。有趣的是,细胞表面受体gydF4y2BaGPR139gydF4y2Ba转移性C1A也过表达(gydF4y2BaSDHxgydF4y2Ba)肿瘤。gydF4y2Ba
一个gydF4y2Ba描述非转移性和转移性PCPG之间DE基因的火山图(BH-adj。gydF4y2BaPgydF4y2Ba-value < 0.05, loggydF4y2Ba2gydF4y2Bafc > 0.5)。gydF4y2BabgydF4y2Ba对比非转移性和转移性PCPG,观察到基因集的差异GSVA评分gydF4y2BaPgydF4y2Ba-value < 0.05, loggydF4y2Ba2gydF4y2BaFC > 0.1)仅在C1A (gydF4y2BaSDHxgydF4y2Ba)样品。在面板gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba基因符号和通路是基于生物过程或细胞类型关联的颜色编码。gydF4y2Ba
讨论gydF4y2Ba
在这项研究中,我们证实了PCPG驱动基因和肿瘤区室和非肿瘤区室的转录程序之间有很强的关联。重要的是,我们的分析提高了PCPG分型的分辨率,识别出与罕见PCPG驱动基因相关的不同PCPG簇,包括gydF4y2BaEPAS1gydF4y2Ba(C1BgydF4y2Ba2gydF4y2Ba),gydF4y2Ba跳频gydF4y2Ba(C1BgydF4y2Ba2gydF4y2Ba, C2BgydF4y2Ba1克ydF4y2Ba),gydF4y2BaMAML3 -gydF4y2Ba融合(C2BgydF4y2Ba2gydF4y2Ba)以及副交感神经gydF4y2BaSDHxgydF4y2BaHN-PG (C1AgydF4y2Ba2gydF4y2Ba)gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.由hif通路失调驱动的血管生成是PCPG的主要特征,我们在单细胞分辨率下描述了这些特征。我们证实PCPG肿瘤细胞与正常的染色质细胞相似;然而,它们可能具有异质转录谱,表达早期染色质和成神经母细胞的标记,以及在成人或胎儿染色质细胞中不表达的基因。此外,通过使用大量的大块组织基因表达数据,我们探索了转移性和非转移性PCPG的差异表达,识别出诊断或治疗性生物标志物,为进一步研究提供重要线索。gydF4y2Ba
与hif通路激活一致,肿瘤gydF4y2BaVEGFAgydF4y2BaPCPG中可见丰富的血管细胞类型。gydF4y2BaVHLgydF4y2Ba-突变PCPG表现出最强的HIF靶基因诱导,与VHL的典型HIF调节功能一致。一起失去的gydF4y2BaVHLgydF4y2Ba肿瘤细胞中的基因座(补充图。gydF4y2Ba4gydF4y2Ba),这些发现支持其在PCPG中经典的肿瘤抑制功能,之前由于与其他VHL综合征肿瘤相比,PCPG中独特的基因型-表型关联而受到质疑gydF4y2Ba54gydF4y2Ba.独特的是,我们发现gydF4y2BaVEGFAgydF4y2Ba而且gydF4y2BaEPAS1gydF4y2Ba在gydF4y2BaMAML3gydF4y2Ba融合阳性PCPG,这挑战了普遍持有的观点,即hif通路激活仅限于C1 PCPG。hif通路激活的机制gydF4y2BaMAML3gydF4y2Ba融合阳性PCPG尚不清楚。MAML3是NOTCH信号的转录共激活因子,尽管NOTCH信号可以诱导gydF4y2BaEPAS1gydF4y2Ba表达式gydF4y2Ba55gydF4y2Ba,损失gydF4y2BaMAML3gydF4y2Ba编码n端NOTCH结构域的外显子1是一个循环蛋白gydF4y2BaMAML3 -gydF4y2Ba熔合,使NOTCH诱导gydF4y2BaEPAS1gydF4y2Ba似乎不太可能。gydF4y2BaMAML3gydF4y2Ba-融合功能也可能依赖于5 ' -融合伙伴基因,包括gydF4y2BaUBTFgydF4y2Ba一种参与RNA聚合酶1核发生的核仁转录因子和转录因子gydF4y2BaTCF4gydF4y2Ba15gydF4y2Ba.值得注意的是,如gydF4y2BaEPAS1gydF4y2Ba而且gydF4y2BaVEGFAgydF4y2Ba在肾上腺和肾上腺外副神经节的早期发育中表达gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2BaNEO细胞的转录谱可能至少部分地反映了早期的发育程序,而不是gydF4y2BaMAML3gydF4y2Ba-融合诱导hif通路激活。显然,需要进一步的实验来确定两者之间的潜在联系gydF4y2BaMAML3gydF4y2Ba-融合和PCPG中的hif通路。gydF4y2Ba
在PCPG中仍然需要可靠的转移进展的临床生物标志物。至于PCPG亚型,C1A (gydF4y2BaSDHxgydF4y2Ba)及C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)亚型有较高的发展转移性疾病的倾向gydF4y2Ba15gydF4y2Ba.形态学特征,免疫组化染色,基因表达,体细胞基因突变(主要是gydF4y2Ba叔gydF4y2Ba启动子和gydF4y2BaATRXgydF4y2Ba突变)以及其他特征已被提出用于风险分层gydF4y2Ba7gydF4y2Ba.我们对转移性PCPG中细胞周期和增殖相关标志物的观察与报道的Ki67染色升高与转移风险增加之间的关系完全一致gydF4y2Ba56gydF4y2Ba.同样,转移性PCPG中支持细胞数量减少gydF4y2Ba57gydF4y2Ba与在大体积组织基因表达数据中观察到的较低的SCLC标记基因表达一致。在转移性PCPG中过表达的其他基因包括与组织重塑和EMT相关的基因,这也与之前的研究一致gydF4y2Ba58gydF4y2Ba.大多数PCPG中极低的T细胞浸润可能预示着免疫检查点抑制剂的疗效有限,这与迄今为止在PCPG患者中观察到的对这些药物的适度反应一致gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba.巨噬细胞在PCPG中丰富,但其表达谱高度异质性,巨噬细胞标记物在具有新血管生成特征的PCPG肿瘤中表达最高,尽管在所有假缺氧亚型中并不普遍,包括相当一部分C1A (gydF4y2BaSDHxgydF4y2Ba)组。需要在更大的系列中进行进一步的免疫组化染色,以消除PCPG内巨噬细胞浸润的相对空间背景以及与转移表型的潜在关联。gydF4y2Ba
重要的是,我们发现了有希望的生物标志物,可能为转移性PCPG的未来治疗策略提供信息。酪氨酸激酶和HIF-2α抑制剂已被提出用于假缺氧性PCPG的治疗gydF4y2Ba61gydF4y2Ba,因此,类似的原理可以推广到C2BgydF4y2Ba2gydF4y2Ba(gydF4y2BaMAML3gydF4y2Ba)肿瘤,这些肿瘤更容易发生转移性疾病。g蛋白偶联受体是一类很有吸引力的治疗靶点gydF4y2BaGPR139gydF4y2Ba表达方式相当新颖。GPR139合成激动剂和拮抗剂已经被确定,因此直接药理干预是可行的gydF4y2Ba62gydF4y2Ba.或者,可以使用放射性核素标记的小分子、多肽或靶向GPR139或其他已识别的细胞表面受体的抗体,类似于靶向SSTR2gydF4y2Ba68gydF4y2BaPCPG中的Ga-DOTATATEgydF4y2Ba63gydF4y2Ba.最后,由于治疗策略的制定通常始于生物标志物蛋白表达的组织病理学评估,我们的发现可能会扩大病理学家在PCPG诊断工作中适用的新兴生物标志物列表。gydF4y2Ba
方法gydF4y2Ba
患者样本gydF4y2Ba
研究是根据Peter MacCallum癌症中心人类研究伦理委员会批准的一项议定书和国家卫生和医学研究委员会根据1975年赫尔辛基宣言(1983年修订)制定的指导方针进行的。所有患者都提供了书面知情同意书,同意将其鉴定的生物标本用于研究目的。提供样品不提供任何补偿。根据各自机构审查委员会(IRB)批准的方案收集患者样本。根据奥斯汀卫生、墨尔本卫生和莫纳什卫生批准的协议,提供患者样本的组织包括维多利亚癌症生物库(gydF4y2BangydF4y2Ba= 4)、Peter MacCallum癌症中心(gydF4y2BangydF4y2Ba= 4),根据北悉尼当地卫生区批准的协议,Kolling研究所神经内分泌肿瘤库(gydF4y2BangydF4y2Ba= 8),国立卫生研究所(gydF4y2BangydF4y2Ba= 10)、科罗拉多大学(gydF4y2BangydF4y2Ba= 1),德克萨斯大学圣安东尼奥健康科学中心(gydF4y2BangydF4y2Ba= 2)、塔夫茨医疗中心(gydF4y2BangydF4y2Ba= 1)、Palacky大学(gydF4y2BangydF4y2Ba= 2)。(详见补充数据)gydF4y2Ba1克ydF4y2Ba患者和样本信息)。gydF4y2Ba
Single-nuclei RNA-seq (sn)gydF4y2Ba
snRNA-seq使用“Frankenstein”协议执行(dx.doi.org/10.17504/protocols.io.bqxymxpw)gydF4y2Ba64gydF4y2Ba.简单地说,在BD FACSaria 2仪器上,用4′,6-二氨基-2-苯基吲哚(DAPI)对来自冷冻组织的核进行荧光激活核分选(FANS),每个样品分选3000到10000个核。选择二倍体和四倍体群体来解释肿瘤PCPG细胞的基因组复制gydF4y2Ba15gydF4y2Ba.立即使用10x铬单细胞5 '库和凝胶珠试剂盒(PN-1000002,遵循制造商的建议(10x Genomics,美国)处理风扇排序的细胞核。处理后,snRNA-seq文库在Illumina Nova-Seq 6000 (Illumina, USA)上使用150 bp对端测序进行多批测序。每个肿瘤对895 - 4822个细胞进行测序,每个细胞可获得约5800个独特序列读取,达到接近饱和的覆盖率。scRNA-seq二进制基调用(BCL)文件被解复用并使用BCLtoFastq转换为FASTQ文件。gydF4y2Ba
snRNA-seq原始数据分析gydF4y2Ba
FASTQ序列数据与自定义hg19 (GRCh37, CellRanger参考基因组版本3.0.0,构建GRCh37.p13)“pre-mRNA”参考进行比对,以考虑映射到外显子(mRNA)和内含子(未剪接的pre-mRNA)区域的读取。这个自定义引用的创建如下所示:gydF4y2Bahttps://support.10xgenomics.com/single-cell-gene-expression/software/pipelines/3.0/advanced/referencesgydF4y2Ba.采用cellranger计数(v3.0.2)进行对齐和UMI计数。gydF4y2Ba
snRNA-seq数据经过质量控制和数据过滤(见补充图)。gydF4y2Ba1克ydF4y2Ba对于质量控制指标和阈值)。为了检测可能包含来自两个或多个细胞的RNA的条形码(即双重序列),使用Scrublet(版本0.2.1)对每个样本的原始计数进行“双重序列分数”注释。gydF4y2Ba65gydF4y2Ba.分数在每个样本内归一化到原始分数的中位数绝对偏差(MAD)。当Scrublet MAD值<2时,从进一步分析中去除潜在的双态条形码。gydF4y2Ba
进一步的质量控制筛选是在主要细胞类型的背景下进行的(由UMAP聚类决定),以解释主要细胞系内转录活性的范围。从cell Ranger为每个样本过滤的细胞表达矩阵合并到单个矩阵中,并使用Seurat R包(版本3.2.3)进行处理。gydF4y2Ba66gydF4y2Ba.在每个样本中,如果线粒体基因超过中位数绝对偏差(MAD)值5,细胞就被过滤掉。对数比例的基因计数和总计数归一化为MAD值,并根据scMatch的原始注释选择每个条形码的过滤阈值,因为观察到某些免疫细胞类型在snRNA-seq数据集中具有显著较低的总RNA计数。B细胞、T细胞、肥大细胞或NK细胞的MAD评分阈值为−4,其他所有细胞类型的MAD评分阈值为−2.5。gydF4y2Ba
然后使用SCTransform方法将过滤后的细胞表达矩阵归一化,在方差稳定转换(VST)模型中以线粒体基因计数百分比作为非正则化潜变量gydF4y2Ba67gydF4y2Ba.然后使用Seurat的CellCycleScoring函数对细胞进行细胞周期阶段评分,以在数据中减少每个细胞的UMI总计数的影响后提供细胞周期分类。然后重复SCTransform, G2M和S期评分作为额外的非正则化潜在变量。gydF4y2Ba
均匀流形近似投影(UMAP)聚类gydF4y2Ba
根据剩余方差阈值1.3选择可变基因。主成分分析(PCA)然后执行结果缩放表达式值。使用Seurat FindNeighbors函数和“Annoy”方法构造共享最近邻(SNN)图,使用前20个主成分(pc),余弦距离度量,最近邻居数为20gydF4y2Ba68gydF4y2Ba.使用Seurat FindClusters函数和Louvain算法从SNN图中识别聚类,分辨率参数设置为0.8。UMAP值是使用uwot R包(0.1.8版本)从前20台pc中计算出来的,其中余弦距离度量和n.neighbors设置为20。对于单元类型特定的UMAP值,在每个子集中重复PCA,并且使用前30个pc代替相同的参数。gydF4y2Ba
和谐批次校正gydF4y2Ba
Seurat R包使用带有默认参数的日志归一化方法对原始读取计数进行归一化。然后使用方差稳定变换方法选择前3000个变量最多的特征。结果子集被缩放和居中,并使用默认参数进行主成分分析(PCA)。为了改善样本或患者特异性批效应,使用患者标识符作为分组变量,将Harmony R包(v0.1.0)应用于Seurat对象。所得到的Harmony嵌入用于UMAP降维、邻居查找和聚类查找,前20维分辨率为0.5。gydF4y2Ba
基质细胞和免疫细胞类型的分类gydF4y2Ba
使用scMatch根据原始计数按单元格类型注释每个单元格条形码,最初使用FANTOM5参考数据集,通过在每个集群中获取最常见的单元格注释,将每个UMAP集群折叠为一个单元格类型gydF4y2Ba69gydF4y2Ba.细胞类型标签(在更精细的细胞亚型分析之前)也基于已知细胞类型的基因标记进行了细化/整理,这些基因标记解释了FANTOM5数据集中细胞类型的潜在缺失(例如,染色质细胞和sclc未被表示)。主要的基质细胞和免疫细胞类型随后使用两个与癌症相关的scRNA-seq参考数据集重新分类gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba(GEO加入号GSE131907和GSE146771)。来自GSE146771的每百万转录记录和来自GSE131907的计数用Seurat的LogNormalize函数归一化,默认参数通过取每个细胞类型的平均值坍塌为基因表达中心。在与scMatch类似的方法中,使用高度可变基因子集上的斯皮尔曼相关性对每个质心对细胞进行评分。在最终的SCTransform VST模型中,通过对各自组内的剩余方差进行排序,并选择前3000个基因,分别为免疫细胞类型和所有其他非免疫正常细胞类型选择可变基因。来自GSE131907的质心用于标记成纤维细胞、内皮细胞和B细胞亚型。利用GSE146771的质心标记T细胞、NK细胞和髓系细胞亚型。那些与任何参考细胞类型不匹配但无法通过其他方法识别的独特簇,根据这些簇的标记基因进行手工标记。gydF4y2Ba
从snRNA-seq推断拷贝数变化gydF4y2Ba
inferCNV R包(版本1.2.1)(gydF4y2Bahttps://github.com/broadinstitute/inferCNVgydF4y2Ba)用于估计基于基因表达的细胞特异性拷贝数谱。所有样本中的肾上腺皮质细胞、染色质细胞、内皮细胞、成纤维细胞和髓系细胞被用作推断cnv的参考细胞类型。独立处理sclc和肿瘤细胞,与参考二倍体正常细胞类型进行比较。为了将inferCNV与其他拷贝数方法进行比较,匹配的Affymetrix Cytoscan HD微阵列数据可用于12个样本gydF4y2Ba26gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.原始CEL文件数据(GEO接入ID: GSE61594, GSE94378)使用rawcopy R包工作流程进行处理gydF4y2Ba70gydF4y2Ba.gydF4y2Ba
大体积组织RNA基因表达纲要的创建gydF4y2Ba
微阵列数据gydF4y2Ba
原始微阵列数据来自7个GEO接入(GSE2841、GSE19422、GSE19987、GSE39716、GSE50442、GSE51081和GSE67066)和1个ArrayExpress接入(e - mtable -733)。Affymetrix数组从affy R包(版本1.62.0)中使用ReadAffy函数读入R(版本4.0.4),然后使用鲁棒多阵列平均(RMA)进行标准化gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba.安捷伦双色数组读入R使用读。limma R包中的maimages函数(3.42.0版本)gydF4y2Ba73gydF4y2Ba.然后使用backgroundCorrect (with method = ' normexp ', offset = 5), normalizeWithinArrays (with method = '黄土'),normalizeBetweenArrays和avereps函数对表达式值进行归一化。为了获得与Affymetrix数组具有可比性分布的表达式值,使用偏移量为−2的表达式值(“A”值)而不是表达式比率。gydF4y2Ba
通过取每个基因的平均探针表达值,将阵列探针表达值分解为每个HGNC基因符号的单个值。使用Bioconductor提供的AnnotationDbi R包(版本1.46.1)将基因符号匹配到探针上gydF4y2Ba74gydF4y2Ba.gydF4y2Ba
大块组织RNA-seq数据gydF4y2Ba
使用HTSEQ-count对TCGA PCPG队列进行量化的RNA-seq值从NCI基因组数据共享(GDC)网站下载gydF4y2Ba15gydF4y2Ba,gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba.RNA-seq计数从我们以前的出版物使用和数据处理如上所述gydF4y2Ba50gydF4y2Ba.先前研究的原始大体积组织RNA-seq数据现在可以在下面snRNA-seq的相同接入下获得。gydF4y2Ba
合并大块组织RNA-seq和微阵列数据gydF4y2Ba
Microarray和RNA-seq数据集合并成一个协调的表达矩阵(补充图)。gydF4y2Ba6gydF4y2Ba).首先,将所有微阵列数据集合并到包含所有基因的单个矩阵中。表达式值然后使用归一化进行分位数归一化。分位数函数来自preprocessCore R包(版本1.46)gydF4y2Ba77gydF4y2Ba.然后使用preprocessCore中的normalize.quantiles.use.target函数以微阵列数据集的分位数分布作为目标分布对RNA-seq计数进行分位数归一化。通过使用limma R包中的removeBatchEffect函数,使用每个基因不缺值的样本分别拟合线性模型,并将样本基因型作为协变量,从而去除批效应gydF4y2Ba73gydF4y2Ba.在线性模型中,未标注基因型的样本被设为零权重。去除批效应后,从分析中去除重复样品。gydF4y2Ba
PCPG大体积组织转录组的聚类gydF4y2Ba
使用ConsensusClusterPlus R包(1.5版)对合并后的表达式矩阵进行半监督聚类gydF4y2Ba78gydF4y2Ba.使用余弦距离度量进行聚类,只有在所有样本中没有缺失值且表达值以均值为中心的基因中,mad超过3个的基因在中位数变异系数之上。使用ConsensusClusterPlus函数(pItem=0.7, clusterAlg = ' hc ', distance = ' pearson ', innerLinkage = ' ward)执行共识聚类。D2 ', finalLinkage = ' ward。D2”,代表= 1000,maxK = 12, corUse = ' pairwise.complete.obs’,种子= 1)。最初的聚类尝试确定了一个与批次(GSE19987和GSE2841)相关的聚类,但没有任何基因型。该聚类没有明显的基因特征,且显著高于平均归一化未标度标准误差(NUSE),因此在重复合并过程之前将这些样本从分析中移除。根据模糊聚类对的比例停止显著变化的点,选择了9个初始共识聚类数。此外,还发现了一个与正常肾上腺皮质细胞和混合基因型(C2C)相关的簇。由于这是批效应去除模型中的一个混杂因素,批次效应去除过程被重复第三次,最初分配给聚类C2C的样本权重为零,以提高性能。两个与激酶基因型(C2A)相关的聚类后来根据它们在UMAP空间和共同基因型中的接近性合并,产生最后的8个PCPG聚类。 UMAP values were calculated using the umap function from the uwot R package using the same distance matrix as the clustering analysis (n_epochs = 1000, min_dist = 0.1, metric = ‘cosine’, nn_method = ‘annoy’, n_neighbors = 15)79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba.gydF4y2Ba
伪散装snRNA-seq样本投影到散装组织UMAPgydF4y2Ba
将每个样本的单核rna序列计数求和以生成伪体表达谱。这些也包括作为一个单独的RNA-seq批次。设计了一种将新样本投影到现有UMAP投影中的过程,以比较所有细胞与仅NEO细胞的伪体分析的聚类性能。首先,使用与批量微阵列合并过程相同的分位数目标分布对伪批量样本进行分位数归一化。由原线性模型拟合中表达值的平均值减去新样品相应基因型的系数,计算新样品批次的系数。然后从分位数归一化表达式值中减去批系数。然后使用k-nearest-neighbors imputation从最终的体表达矩阵中获取体矩阵中15个最近邻的平均值(cos距离),从大容量聚类分析的高变量基因列表中的新样本中输入任何缺失的基因。然后,生成的表达式矩阵以均值为中心,并使用uwot R包中的umap_transform函数(使用原始批量汇编中的umap模型)将其投射到原始umap模型上。gydF4y2Ba
大块组织差异基因表达分析gydF4y2Ba
大块组织差异基因表达分析使用r中的limma和edgeR包进行。大块组织的DE分析使用分位数归一化大块基因表达简表。线性模型适用于基因型和肿瘤亚型。对于转移性与非转移性分析,我们假设任何恶性病例的注释都对应于转移性表型,以符合当前的命名法。在建模前去除没有恶性/转移状态临床数据的样本,并将亚型和转移性建模为单一模型因素。在每个模型中都将批作为一个因素,以防止批效应的混淆。gydF4y2Ba
利用对比法估计每个基因的对比系数和标准误差。拟合函数与log-fold-change值,t-statistics与对应gydF4y2BapgydF4y2Ba值由经验贝叶斯方法计算,易贝叶斯函数使用limma-trend方法。在每个对比中,对组块和基因重复这一过程,以便每个基因的系数与所有组一起计算,而不缺少该基因的值,因为并非每个基因在最终表达矩阵中都由来自每个基因型或聚类组的样本表示。gydF4y2BaPgydF4y2Ba-值,然后调整多次测试,以控制错误发现率使用BH方法。gydF4y2Ba
使用GSVA计算批量数据的基因集富集分数gydF4y2Ba81gydF4y2Ba.所使用的基因集包括分子特征数据库标记基因集gydF4y2Ba82gydF4y2Ba,胎儿肾上腺细胞型特异性基因集gydF4y2Ba49gydF4y2Ba(补充数据gydF4y2Ba11gydF4y2Ba)和来自基质细胞和免疫细胞类型的基因集,使用我们的snRNA-seq数据(log2FC > 3,gydF4y2BaPgydF4y2Ba< 0.05,补充数据gydF4y2Ba13gydF4y2Ba).为了在基因集水平上确定DE,使用标准limma管道对GSVA评分进行建模,并按照上述转移性与非转移性分析的描述构建设计矩阵。gydF4y2Ba
伪体差异基因表达分析gydF4y2Ba
在每个肿瘤和正常肾上腺样本的宽间质和免疫细胞类型水平上建立伪批量表达谱。对于肿瘤亚型和正常肾上腺亚型的比较,如果在一个聚类样本中有<10个肿瘤亚型,则去核。少量被归类为正常嗜铬细胞的肿瘤样本核也被移除。DE分析采用标准limma工作流程进行。肿瘤亚型和细胞类型被建模为一个单一的设计基质因素,性别被作为第二个因素,以防止患者性别的混淆。对肿瘤和正常样本进行各亚型和细胞类型的对比。细胞类型特异性基因签名通过伪体DE进行鉴定,将每个主要细胞类型簇(每个样本聚集)与所有其他非肿瘤细胞类型(log2FC > 3,gydF4y2BaPgydF4y2Ba< 0.05)(补充数据gydF4y2Ba13gydF4y2Ba).为了解释环境RNA效应,估计了来自原始样本的细胞类型之间的相关性,并将原始样本建模为数据中的随机效应。对单个样本中细胞类型之间的基因表达进行检查,以排除来自同一样本中不相关细胞类型的潜在环境RNA相关的任何基因。例如,与肿瘤细胞核中的相同细胞类型相比,肾上腺皮质特征基因在许多正常肾上腺细胞类型中过度表达。对肾上腺皮质相关基因进行事后筛选,比较肿瘤和正常分析。gydF4y2Ba
对每个样本在细胞亚型水平上聚合的伪体积谱进行了额外的肿瘤与正常组织比较,其中肿瘤和正常组织(柄状内皮细胞、尖状内皮细胞、巨噬细胞)中都有足够的细胞亚型(>300个细胞核)的代表(补充数据)gydF4y2Ba7gydF4y2Ba).每个亚型的伪体表达谱在每个样本中聚合,去除细胞数量低于50个的样本。每种肿瘤亚型的巨噬细胞也进行了1- rest比较。gydF4y2Ba
通过将sclc与包括NEO细胞在内的所有其他细胞(log2FC > 3和调整后的BH)进行比较,确定了sclc特异性的受体和配体gydF4y2BapgydF4y2Ba< 0.05)。在每种非肿瘤细胞类型(每个样本聚集)与所有其他细胞类型之间进行额外的比较,以便识别细胞类型特异性的基因签名(log2FC > 3,gydF4y2BaPgydF4y2Ba< 0.05)(补充数据gydF4y2Ba13gydF4y2Ba).热图和点图使用ComplexHeatmap R包(版本2.6.2)生成。gydF4y2Ba
差异细胞类型丰度gydF4y2Ba
采用Speckle R包检测不同肿瘤亚型和基因型之间细胞类型丰度的差异是否有统计学意义。getTransFormedProps函数用于计算每个肿瘤样本的logit转换细胞类型比例。为了检验肿瘤基因型之间的差异,以肿瘤基因型为模型因子构建设计矩阵。对于亚型比较,以肿瘤亚型为模型因子设计矩阵。使用螺旋桨将每个亚型和基因型与所有其他亚型和基因型进行比较。tt函数。gydF4y2Ba
细胞-细胞信号的NATMI分析gydF4y2Ba
在NATMI分析之前,将Seurat归一化表达值转换为cpm,然后按细胞亚型和样本分组(gydF4y2Bahttps://github.com/asrhou/NATMIgydF4y2Ba).使用默认设置在每个示例上运行带有建议依赖项版本的NATMI ExtractEdges的python 3版本。然后将预测的配体-受体相互作用读入R进行进一步分析。为了保持细胞-细胞连接以进行进一步分析,配体和受体都需要在> - 10细胞中表达。如果受体或配体检出率<0.1,连接也被过滤掉。去除配体和受体为同一基因的簇自分泌信号和相互作用,以进行数据展示和解释。此外,至少两个样本中未见的相互作用被去除。gydF4y2Ba
TCGA泛癌数据中的基因表达可视化gydF4y2Ba
使用TCGAbiolinks R包从基因组数据共享中下载3级基因表达计数。使用edgeR R包将原始计数TMM归一化并转换为log2 CPM。对于肿瘤的比较,为log2 cpmgydF4y2BaGPR139gydF4y2Ba然后根据TCGA条形码对定义为“原发实体瘤”、“转移性”、“附加-新原发”或“复发性实体瘤”的样本进行绘图gydF4y2Ba15gydF4y2Ba.对于正常组织的比较,对于TCGA条形码定义为“实体组织正常”的样本,与前面提到的PCPG队列中的肿瘤类型相比,绘制log2 cpm。gydF4y2Ba
以胎儿肾上腺为参照的PCPG NEO细胞分类gydF4y2Ba
胎儿肾上腺髓质snRNA-seq数据(nSamples = 17)先前生成和预处理gydF4y2Ba49gydF4y2Ba作为Seurat对象从(gydF4y2Bahttps://adrenal.kitz-heidelberg.de/developmental_programs_NB_viz/gydF4y2Ba).这些数据使用UMAP提供的坐标进行可视化。该数据集被用作分类来自PCPG的NEO细胞和sclc (nSamples = 30)、来自成人NAM的正常嗜铬细胞和sclc(本研究)的参考。使用与使用Seurat FindVariableFeatures函数识别的胎儿肾上腺数据中3000个最易变基因相同的方法对基质细胞和免疫细胞进行监督分类。gydF4y2Ba
snRNA-seq和大体积组织基因表达数据中的胎儿细胞基因模块评分gydF4y2Ba
从Jansky等人的补充数据中下载了胎儿肾上腺髓质细胞群的细胞类型特异性基因集gydF4y2Ba49gydF4y2Ba(补充数据gydF4y2Ba10gydF4y2Ba).使用Seurat中默认参数的AddModuleScore函数计算PCPG核的基因特征评分。简而言之,该函数根据基因表达程序的平均表达量对单个细胞进行评分,并减去一组(100)个对照基因的聚合表达量。GSVA (v1.38.2)用于计算大块基因表达纲要中大块组织基因表达谱的基因集得分。gydF4y2Ba
原位杂交gydF4y2Ba
对于RNAscope®ISH, 20ZZ探针(Hs-CDH19)靶向456-1527个核苷酸gydF4y2BaCDH19gydF4y2Ba(GenBank登录NM_021153.3)由Advanced Cell Diagnostics (ACD, Newark, CA)设计和制造。将4微米厚的福尔马林固定石蜡包埋肿瘤组织切片安装在带正电荷的Superfrost®玻片上。RNAscope®ISH检测使用RNAscope®2.5 HD assay - brown检测试剂盒(ACD),按照制造商的方法进行。切片简单脱蜡,然后使用预处理1、2和3溶液进行目标检索,分别在RT下10分钟,在100-104℃下15分钟和在40℃下30分钟,用dH冲洗gydF4y2Ba2gydF4y2BaO每一步之间。为了探针杂交,载玻片用培养皿孵育gydF4y2BaCDH19gydF4y2Ba探针(或RNAscope®ISH阳性对照探针PPIB(亲环素B))在HybEZ™烘箱中40°C孵育2小时,然后进行一系列信号放大步骤,包括用特定的放大溶液孵育。在RT下使用预混合DAB溶液进行信号检测10分钟。玻片用苏木精反染2min,脱水后装片盖玻片。使用Olympus BX51荧光显微镜(Olympus, Tokyo, Japan)获取图像。gydF4y2Ba
免疫组织化学与免疫细胞评分gydF4y2Ba
使用3,3 ' -二氨基联苯胺(DAB)对FFPE组织切片进行免疫组化(IHC),使用市售抗体。抗体和抗原检索方法详见补充表gydF4y2Ba4gydF4y2Ba.S100的染色使用Leica- bond -3自动染色平台(Leica Micro systems, Mount Waverley, Victoria, Australia)。所有其他的染色都是手动进行的。免疫细胞评分由病理学专家(AJG)完成。为了确定炎症细胞计数,尽量避免血液外渗区域和纤维化区域。仅统计肿瘤内的炎性细胞(即循环或边缘炎性细胞未计数)。CD206还用于毛细血管中边缘中性粒细胞染色,因此被忽略。同样,基质中CD206阳性中性粒细胞被忽略。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本研究中产生的snRNA-seq以及大组织RNA-seq数据已存入欧洲基因组-表型组档案(EGA),登录代码为EGAS00001005861/gydF4y2BaEGAD00001008403gydF4y2Ba.这些数据在有限的访问下可用,因为它可能基于患者的基因型进行识别。研究人员可以通过EGA向墨尔本大学研究数据访问委员会(DAC)申请获得访问权限。委员会会尽量在所有申请递交后十天内作出回应,并在不超过四周内作出最终决定。一旦发展谘询委员会原则上批准了申请,各机构之间将相互同意并执行数据传输协议,然后数据将通过EGA提供。其余数据可在文章和补充信息中查阅。复制本研究中提供的数字所需的原始数据可从figshare (gydF4y2Bahttps://doi.org/10.6084/m9.figshare.21080476gydF4y2Ba).本研究中使用的公开可用的微阵列数据集可从基因表达Omnibus(登录号)获得gydF4y2BaGSE131907gydF4y2Ba30.gydF4y2BaGSE146771gydF4y2Ba31gydF4y2Ba,gydF4y2BaGSE2841gydF4y2Ba9gydF4y2Ba,gydF4y2BaGSE19422gydF4y2Ba83gydF4y2Ba,gydF4y2BaGSE19987gydF4y2Ba84gydF4y2Ba,gydF4y2BaGSE39716gydF4y2Ba85gydF4y2Ba,gydF4y2BaGSE50442gydF4y2Ba85gydF4y2Ba,gydF4y2BaGSE51081gydF4y2Ba86gydF4y2Ba,gydF4y2BaGSE67066gydF4y2Ba)gydF4y2Ba87gydF4y2Ba和ArrayExpress(登录号gydF4y2Bae - mtab - 733gydF4y2Ba)gydF4y2Ba58gydF4y2Ba.此外,公开可用的Affymetrix Cytoscan HD阵列数据可从基因表达Omnibus获得gydF4y2BaGSE61594gydF4y2Ba50gydF4y2Ba.而且gydF4y2BaGSE94378gydF4y2Ba26gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
用于数据分析的代码可在gydF4y2Bahttps://github.com/UMCCR-RADIO-Lab/snRNA-seq-atlas-of-pheochromocytoma-and-paragangliomagydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Williams, m.d. & Tischler, a.s.更新自世界卫生组织头颈部肿瘤分类第四版:副神经节瘤。gydF4y2Ba头。脖子分册。gydF4y2Ba11gydF4y2Ba, 88-95(2017)。gydF4y2Ba
泽琳卡,T.等人。嗜铬细胞瘤心血管并发症高发。gydF4y2Ba霍恩。金属底座。Res。gydF4y2Ba44gydF4y2Ba, 379-384(2012)。gydF4y2Ba
贷款人,J. W., Eisenhofer, G., Mannelli, M. & Pacak, K.嗜铬细胞瘤。gydF4y2Ba《柳叶刀》gydF4y2Ba366gydF4y2Ba, 665-675(2005)。gydF4y2Ba
劳德,r.v,治村,r.y, Klöppel, G. &罗赛,J.;gydF4y2BaWHO对内分泌器官肿瘤的分类gydF4y2Ba.第4版,10 (IARC出版社,2017)。gydF4y2Ba
阿亚拉-拉米雷斯,等人。嗜铬细胞瘤和交感副神经节瘤患者恶性和总生存的临床危险因素:原发肿瘤大小和原发肿瘤位置作为预后指标。gydF4y2Baj .中国。性。金属底座。gydF4y2Ba96gydF4y2Ba, 717-725(2011)。gydF4y2Ba
诺尔廷,S.等人。嗜铬细胞瘤和副神经节瘤的个性化治疗。gydF4y2BaEndocr。牧师gydF4y2Ba.gydF4y2Bahttps://doi.org/10.1210/endrev/bnab019gydF4y2Ba(2021)。gydF4y2Ba
Dahia, P. L. M., Clifton-Bligh, R., Gimenez-Roqueplo, A. P., Robledo, M. & Jimenez, C.遗传内分泌肿瘤:当前的最先进技术和研究机会:转移性嗜色细胞瘤和副神经节瘤:MEN2019研讨会论文集。gydF4y2BaEndocr。遗传代数。癌症gydF4y2Ba27gydF4y2Ba, t41-t52(2020)。gydF4y2Ba
艾森霍夫,G.等人。在去甲肾上腺素和肾上腺素产生的遗传和散发性嗜铬细胞瘤中不同的基因表达谱:von Hippel-Lindau综合征中缺氧驱动的血管生成途径的激活。gydF4y2BaEndocr。遗传代数。癌症gydF4y2Ba11gydF4y2Ba, 897-911(2004)。gydF4y2Ba
Dahia, P. L.等。嗜铬细胞瘤中hif1 α调控环连接缺氧和线粒体信号。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba1克ydF4y2Ba, 72-80(2005)。gydF4y2Ba
Burnichon, N.等。综合基因组分析揭示嗜铬细胞瘤和副神经节瘤的体细胞突变。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba20.gydF4y2Ba, 3974-3985(2011)。gydF4y2Ba
Letouze, E.等。SDH突变在副神经节瘤中建立了高甲基化表型。gydF4y2Ba癌症细胞gydF4y2Ba23gydF4y2Ba, 739-752(2013)。gydF4y2Ba
艾森霍夫,G.等人。嗜铬细胞瘤儿茶酚胺代谢组学和分泌表型。gydF4y2BaEndocr。遗传代数。癌症gydF4y2Ba18gydF4y2Ba, 97-111(2011)。gydF4y2Ba
饶,J. U.等。利用非靶向和靶向代谢组学研究嗜铬细胞瘤和副神经节瘤肿瘤代谢物基因型特异性差异。gydF4y2Baj .中国。性。金属底座gydF4y2Ba.gydF4y2Bahttps://doi.org/10.1210/jc.2014-2138gydF4y2Ba(2014)。gydF4y2Ba
Buffet, A. Burnichon, N. Favier, J. & Gimenez-Roqueplo, A. P.嗜铬细胞瘤和副神经节瘤20年遗传学研究综述。gydF4y2Ba最好的Pr. Res. cline。性。金属底座。gydF4y2Ba34gydF4y2Ba, 101416(2020)。gydF4y2Ba
菲什拜因,L.等人。嗜铬细胞瘤和副神经节瘤的综合分子特征。gydF4y2Ba癌症细胞gydF4y2Ba31gydF4y2Ba, 181-193(2017)。gydF4y2Ba
Burnichon, N.等。SDHA是导致副神经节瘤的抑癌基因。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba19gydF4y2Ba, 3011-3020(2010)。gydF4y2Ba
卡斯特罗-维加,L. J.等。FH的生殖系突变赋予恶性嗜铬细胞瘤和副神经节瘤的易感性。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba23gydF4y2Ba, 2440-2446(2014)。gydF4y2Ba
Selak, m.a.等人。琥珀酸通过抑制hif -脯氨酸羟化酶将TCA循环功能障碍与肿瘤发生联系起来。gydF4y2Ba癌症细胞gydF4y2Ba7gydF4y2Ba, 77-85(2005)。gydF4y2Ba
肖,M.等。富马酸盐和琥珀酸对α - kg依赖性组蛋白和DNA去甲基酶的抑制作用,这些组蛋白和DNA去甲基酶在FH和SDH肿瘤抑制基因突变中积累。gydF4y2BaDev的基因。gydF4y2Ba26gydF4y2Ba, 1326-1338(2012)。gydF4y2Ba
科米诺-门德斯等人。外显子组测序确定MAX突变是遗传性嗜铬细胞瘤的原因之一。gydF4y2BaNat,麝猫。gydF4y2Ba43gydF4y2Ba, 663-667(2011)。gydF4y2Ba
贷款人,J. W. M.等。嗜铬细胞瘤和副神经节瘤的遗传学、诊断、管理和未来研究方向:欧洲高血压学会内分泌高血压工作组的立场声明和共识。gydF4y2Baj .高血压gydF4y2Ba38gydF4y2Ba, 1443-1456(2020)。gydF4y2Ba
Jimenez, C., Fazeli, S. & Roman-Gonzalez, A.嗜铬细胞瘤和副神经节瘤的抗血管生成治疗。gydF4y2BaEndocr。遗传代数。癌症gydF4y2Ba27gydF4y2Ba, r239-r254(2020)。gydF4y2Ba
Favier, J. Plouin, P. F., Corvol, P. & Gasc . M.嗜铬细胞瘤的血管生成和血管结构:恶性肿瘤的独特特征。gydF4y2Ba点。j .分册。gydF4y2Ba161gydF4y2Ba, 1235-1246(2002)。gydF4y2Ba
索尔松,V.等人。癌症的免疫图景。gydF4y2Ba免疫力gydF4y2Ba48gydF4y2Ba, 812 - 830。e814(2018)。gydF4y2Ba
Smestad, J. A. & Maher, L. J.携带SDHx, VHL或MAML3基因改变的副神经节瘤的第三主调控分析。gydF4y2BaBMC癌症gydF4y2Ba19gydF4y2Ba, 619(2019)。gydF4y2Ba
Flynn, A.等人。表兄妹而非双胞胎:综合征性神经内分泌肿瘤的瘤内和瘤间异质性。gydF4y2Baj .分册。gydF4y2Ba242gydF4y2Ba, 273-283(2017)。gydF4y2Ba
Fliedner, s.m.等人。低氧诱导因子2突变相关副神经节瘤属于离散性假性低氧亚簇。gydF4y2Ba瘤形成gydF4y2Ba18gydF4y2Ba, 567-576(2016)。gydF4y2Ba
里克特,S.等人。代谢组引导基因组学鉴定嗜铬细胞瘤和副神经节瘤中异柠檬酸脱氢酶、富马酸水合酶和琥珀酸脱氢酶基因的致病变异。gydF4y2Ba麝猫。地中海gydF4y2Ba.gydF4y2Bahttps://doi.org/10.1038/s41436-018-0106-5gydF4y2Ba(2018)。gydF4y2Ba
卡斯特罗-维加,L. J.等。多组学分析定义了嗜铬细胞瘤和副神经节瘤的核心基因组改变。gydF4y2BaCommun Nat。gydF4y2Ba6gydF4y2Ba, 6044(2015)。gydF4y2Ba
Kim, N.等人。单细胞RNA测序显示转移性肺腺癌的分子和细胞重编程。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 2285(2020)。gydF4y2Ba
张,L.等。单细胞分析为结肠癌骨髓靶向治疗机制提供信息。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 442 - 459。e429(2020)。gydF4y2Ba
Tabib, T., Morse, C., Wang, T., Chen, W. & Lafyatis, R. SFRP2/DPP4和FMO1/LSP1定义了人类皮肤中的主要成纤维细胞群。gydF4y2Baj .投资。北京医学。gydF4y2Ba138gydF4y2Ba, 802-810(2018)。gydF4y2Ba
向,W.等。Isthmin是一种抑制小鼠肿瘤生长的新型血管生成抑制剂。gydF4y2Baj .细胞。摩尔。地中海。gydF4y2Ba15gydF4y2Ba, 359-374(2011)。gydF4y2Ba
Makino, Y., Kanopka, A., Wilson, W. J., Tanaka, H. & Poellinger, L.抑制性PAS结构域蛋白(IPAS)是低氧诱导因子-3 α位点的低氧诱导剪接变体。gydF4y2Ba生物。化学。gydF4y2Ba277gydF4y2Ba, 32405-32408(2002)。gydF4y2Ba
Farhat, n.a.等人。嗜铬细胞瘤和副神经节瘤的一种以前未被认识的单核细胞成分。gydF4y2BaEndocr。病理学研究。gydF4y2Ba30.gydF4y2Ba, 90-95(2019)。gydF4y2Ba
Cheng, G.等。PLXDC1和PLXDC2作为多功能因子PEDF跨膜受体的鉴定。gydF4y2BaElifegydF4y2Ba3 gydF4y2Ba, e05401(2014)。gydF4y2Ba
张淑霞,张淑霞。色素上皮衍生因子(PEDF)的抗肿瘤作用:对癌症治疗的意义。本文着重。gydF4y2BaJ.临床经验。癌症Res。gydF4y2Ba35gydF4y2Ba, 4(2016)。gydF4y2Ba
Mahmood, N., Mihalcioiu, C. & Rabbani, S. A.尿激酶型纤溶酶原激活物(uPA)及其受体(uPAR)的多方面作用:诊断、预后和治疗应用。gydF4y2Ba前面。肿瘤防治杂志。gydF4y2Ba8gydF4y2Ba, 24(2018)。gydF4y2Ba
Miettinen, M.等人。sox10 -不仅是施万瘤和黑素细胞瘤的标记物,也是软组织肌上皮细胞瘤的标记物:5134例肿瘤的系统分析。gydF4y2Ba点。J.外科。gydF4y2Ba39gydF4y2Ba, 826-835(2015)。gydF4y2Ba
Schroder, H. D. & Johannsen, L.嗜铬细胞瘤和副神经节瘤支持细胞中S-100蛋白的演示。gydF4y2Ba组织病理学gydF4y2Ba10gydF4y2Ba, 1023-1033(1986)。gydF4y2Ba
弗兰,A.等。多能外周神经胶质细胞产生肾上腺髓质的神经内分泌细胞。gydF4y2Ba科学gydF4y2Ba357gydF4y2Ba,gydF4y2Bahttps://doi.org/10.1126/science.aal3753gydF4y2Ba(2017)。gydF4y2Ba
Kastriti, m.e.等人。朱克坎氏器官的大部分嗜铬细胞和副神经节的部分交感神经元都是由雪旺细胞前体产生的。gydF4y2Ba前面。摩尔。>。gydF4y2Ba12gydF4y2Ba, 6(2019)。gydF4y2Ba
Kameneva等人。人类胚胎的单细胞转录组学鉴定了多种交感细胞谱系,对成神经细胞瘤起源具有潜在意义。gydF4y2BaNat,麝猫。gydF4y2Ba53gydF4y2Ba, 694-706(2021)。gydF4y2Ba
sdh缺陷副神经节瘤中SOX10和SDHB的免疫组化染色表明支撑细胞不是肿瘤。gydF4y2BaEndocr。病理学研究。gydF4y2Ba31gydF4y2Ba, 307-309(2020)。gydF4y2Ba
Douwes Dekker, P. B., Corver, W. E., Hogendoorn, P. C., van der Mey, A. G. & Cornelisse, C. J.多参数DNA流分选显示头颈部副神经节瘤支撑细胞室中存在二倍体和SDHD野生型基因保留:主细胞是唯一的肿瘤成分。gydF4y2Baj .分册。gydF4y2Ba202gydF4y2Ba, 456-462(2004)。gydF4y2Ba
侯,R, Denisenko, E, Ong, H. T, Ramilowski, J. A. & Forrest, A. R. R.使用NATMI预测细胞对细胞通信网络。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 5011(2020)。gydF4y2Ba
威尔逊,e.r.,德拉-弗洛拉努内斯,G,韦弗,m.r.,弗里克,L. R. &费尔特里,M. L.雪旺细胞相互作用期间的外周神经系统的发展。gydF4y2BaDev。一般人gydF4y2Ba.gydF4y2Bahttps://doi.org/10.1002/dneu.22744gydF4y2Ba(2020)。gydF4y2Ba
碱性成纤维细胞生长因子在周围神经再生中的作用。gydF4y2Ba阿娜特。Embryol。gydF4y2Ba204gydF4y2Ba, 171-177(2001)。gydF4y2Ba
杨斯基等人。单细胞转录组分析提供了深入了解成神经细胞瘤的发育起源。gydF4y2BaNat,麝猫。gydF4y2Ba53gydF4y2Ba, 683-693(2021)。gydF4y2Ba
Flynn, A.等人。嗜铬细胞瘤的基因组图谱。gydF4y2Baj .分册。gydF4y2Ba236gydF4y2Ba, 78-89(2015)。gydF4y2Ba
田,H., Hammer, R. E., Matsumoto, A. M., Russell, D. W. & McKnight, S. L.缺氧应答转录因子EPAS1对儿茶酚胺稳态和胚胎发育期间心脏衰竭的保护至关重要。gydF4y2BaDev的基因。gydF4y2Ba12gydF4y2Ba, 3320-3324(1998)。gydF4y2Ba
马西亚斯等人。HIF-2alpha对颈动脉体发育和功能至关重要。gydF4y2BaElifegydF4y2Ba7gydF4y2Ba,gydF4y2Bahttps://doi.org/10.7554/eLife.34681gydF4y2Ba(2018)。gydF4y2Ba
斯塔姆,G.等人。肾细胞癌(RCC)中EGFR和erbB-2基因的同时过表达与去分化和转移相关。gydF4y2BaInt。j .癌症gydF4y2Ba69gydF4y2Ba, 17-22(1996)。gydF4y2Ba
von Hippel-Lindau肿瘤抑制蛋白。gydF4y2Ba为基础。癌症生物学。gydF4y2Ba2gydF4y2Ba, 91-109(2018)。gydF4y2Ba
穆特维,a.p.等。Notch信号在多种肿瘤细胞类型中促进hif2 α驱动的缺氧反应。gydF4y2Ba致癌基因gydF4y2Ba37gydF4y2Ba, 6083-6095(2018)。gydF4y2Ba
木村等人。病理分级用于预测嗜铬细胞瘤和副神经节瘤的转移。gydF4y2BaEndocr。遗传代数。癌症gydF4y2Ba21gydF4y2Ba, 405-414(2014)。gydF4y2Ba
Lloyd, R. V., Blaivas, M. & Wilson, B. S.嗜铬粒蛋白和S100蛋白在正常和异常肾上腺髓组织中的分布。gydF4y2Ba拱门。病理学研究。实验室地中海。gydF4y2Ba109gydF4y2Ba, 633-635(1985)。gydF4y2Ba
Loriot, C.等。在SDHB基因突变引起的转移性嗜铬细胞瘤和副神经节瘤中,上皮细胞向间质细胞转变被激活。gydF4y2Baj .中国。性。金属底座。gydF4y2Ba97gydF4y2Ba, e954-e962(2012)。gydF4y2Ba
Naing, A.等人。派姆单抗在晚期罕见癌症患者中的2期研究。gydF4y2Baj . Immunother。癌症gydF4y2Ba8gydF4y2Ba,gydF4y2Bahttps://doi.org/10.1136/jitc-2019-000347gydF4y2Ba(2020)。gydF4y2Ba
罗德里格斯,R. R., Rizwan, S., Alhamad, K. &芬利,G. G.免疫治疗恶性嗜铬细胞瘤/副神经节瘤:一例报告。gydF4y2BaJ.医学病例代表。gydF4y2Ba15gydF4y2Ba, 172(2021)。gydF4y2Ba
Toledo, R. & Jimenez, C.恶性嗜铬细胞瘤和副神经节瘤治疗的最新进展:专注于酪氨酸激酶和缺氧诱导因子抑制剂。gydF4y2BaF1000ResgydF4y2Ba7gydF4y2Ba,gydF4y2Bahttps://doi.org/10.12688/f1000research.13995.1gydF4y2Ba(2018)。gydF4y2Ba
Vedel, L., Nohr, a.c., Gloriam, D. E. & Brauner-Osborne, H.孤儿GPR139 G蛋白偶联受体的药理学和功能。gydF4y2Ba基本的中国。制药。Toxicol。gydF4y2Ba126gydF4y2Ba(增刊6),35-46(2020)。gydF4y2Ba
詹森等人。[68Ga]-DOTATATE PET/CT在sdhb相关转移性嗜铬细胞瘤和副神经节瘤定位中的优势gydF4y2Ba中国。癌症Res。gydF4y2Ba21gydF4y2Ba, 3888-3895(2015)。gydF4y2Ba
刘,等。重编程路线图揭示人诱导滋养层干细胞的途径。gydF4y2Ba自然gydF4y2Ba586gydF4y2Ba, 101-107(2020)。gydF4y2Ba
Wolock, S. L., Lopez, R. & Klein, A. M. Scrublet:单细胞转录组数据中细胞双序列的计算识别。gydF4y2Ba细胞系统。gydF4y2Ba8gydF4y2Ba, 281 - 291。e289(2019).
斯图尔特,T.等人。单细胞数据的全面集成。gydF4y2Ba细胞gydF4y2Ba177gydF4y2Ba, 1888 - 1902。e1821(2019).
Hafemeister, C. & Satija, R.使用正则化负二项回归的单细胞RNA-seq数据归一化和方差稳定。gydF4y2Ba基因组医学杂志。gydF4y2Ba20.gydF4y2Ba, 296(2019)。gydF4y2Ba
RcppAnnoy: ' Rcpp '绑定' Annoy ',一个近似最近邻居库v. 0.0.14(2019)。gydF4y2Ba
Hou, R., Denisenko, E. & Forrest, a . R. R. scMatch:使用参考数据集的单细胞基因表达谱注释工具。gydF4y2Ba生物信息学gydF4y2Ba35gydF4y2Ba, 4688-4695(2019)。gydF4y2Ba
Mayrhofer, M. Viklund, B. & Isaksson, A. Rawcopy:改进的Affymetrix数组拷贝数分析。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 36158(2016)。gydF4y2Ba
Irizarry, R. A.等人。高密度寡核苷酸阵列探针水平数据的探索、归一化和总结。gydF4y2Ba生物统计学gydF4y2Ba4gydF4y2Ba, 249-264(2003)。gydF4y2Ba
Gautier, L., Cope, L., Bolstad, B. M. & Irizarry, R. A. Affymetrix基因芯片数据在探针级别的Affymetrix基因芯片数据的affy -分析。gydF4y2Ba生物信息学gydF4y2Ba20.gydF4y2Ba, 307-315(2004)。gydF4y2Ba
Ritchie, m.e.等人,limma为rna测序和微阵列研究的差异表达分析提供了动力。gydF4y2Ba核酸测定。gydF4y2Ba43gydF4y2Ba, e47-e47(2015)。gydF4y2Ba
AnnotationDbi: Bioconductor v. 1.46.1(2021)中基于sqlite注释的操作。gydF4y2Ba
Anders, S, Pyl, P. T. & Huber, W. htseq -一个用于处理高通量测序数据的Python框架。gydF4y2Ba生物信息学gydF4y2Ba31gydF4y2Ba, 166-169(2015)。gydF4y2Ba
格罗斯曼,R. L.等。朝着癌症基因组数据的共同愿景迈进。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba375gydF4y2Ba, 1109-1112(2016)。gydF4y2Ba
预处理函数集合v. 1.46.0(2019)。gydF4y2Ba
Wilkerson, m.d. & Hayes, d.n. ConsensusClusterPlus:一个具有置信度评估和项目跟踪的类发现工具。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 1572-1573(2010)。gydF4y2Ba
McInnes, L., Healy, J. & Melville, J. Umap:统一流形近似和投影降维。预印在gydF4y2Bahttps://arxiv.org/abs/1802.03426gydF4y2Ba(2018)。gydF4y2Ba
uwot:统一流形近似和投影(UMAP)降维方法v. 0.1.8(2020)。gydF4y2Ba
Hanzelmann, S., Castelo, R. & Guinney, J. GSVA:微阵列和RNA-seq数据的基因集变异分析。gydF4y2BaBMC Bioinforma。gydF4y2Ba14gydF4y2Ba, 7(2013)。gydF4y2Ba
Liberzon等人。分子特征数据库(MSigDB)标记基因集收集。gydF4y2Ba细胞系统。gydF4y2Ba1克ydF4y2Ba, 417-425(2015)。gydF4y2Ba
Lopez-Jimenez, E.等人。研究来源:转录谱分析揭示了SDHB和vhl相关嗜铬细胞瘤中不同的伪缺氧特征。gydF4y2Ba摩尔。性。gydF4y2Ba24gydF4y2Ba, 2382-2391(2010)。gydF4y2Ba
秦勇,等。TMEM127的种系突变使人易患嗜铬细胞瘤。gydF4y2BaNat,麝猫。gydF4y2Ba42gydF4y2Ba, 229-233(2010)。gydF4y2Ba
Shankavaram, U.等人。基因型和肿瘤位点决定假缺氧嗜铬细胞瘤和副神经节瘤的表达谱。gydF4y2Ba瘤形成gydF4y2Ba15gydF4y2Ba, 435-447(2013)。gydF4y2Ba
秦,等。hif1 α和hif2 α对嗜铬细胞表型特征和肿瘤细胞增殖的相反影响:来自myc相关因子X的见解gydF4y2BaInt。j .癌症gydF4y2Ba135gydF4y2Ba, 2054-2064(2014)。gydF4y2Ba
埃弗内普尔,L.等。在嗜铬细胞瘤和副神经节瘤中Contactin 4的表达与恶性行为相关。gydF4y2Baj .中国。性。金属底座。gydF4y2Ba103gydF4y2Ba, 46-55(2018)。gydF4y2Ba
确认gydF4y2Ba
我们感谢维多利亚癌症生物库提供患者样本。Peter MacCallum癌症中心的流式细胞仪和高级组织学和显微镜中心的工作人员,以及墨尔本大学癌症研究中心的临床基因组学平台的工作人员,感谢他们对生成原始数据的支持。感谢Brian Fritz和10x Genomics为研究贡献的试剂。我们感谢Harry Perkins癌症研究所的Alistair Forrest和Rui Hou对NATMI分析的帮助,以及Alicia Oschlack对数据分析的有益建议。这项工作得到了PMF基金会和国家卫生与医学研究项目赠款(APP1108032, RCB, RWT)的支持。RWT得到了维多利亚州癌症机构职业中期奖学金(TP828750)的支持。A.Pa和A.F.由墨尔本大学约瑟夫·赫尔曼信托基金会资助。K.P.得到了美国国立卫生研究院NICHD的校内研究计划的支持。P.L.M.D.是Robert Tucker Hayes肿瘤学杰出主席,由NIH/NIGMS (GM114102), NIH/NCI (CA264248),神经内分泌肿瘤研究基金会资助。L.F.得到ACS MRSG-15-063-01的部分支持。 A.S.T. was supported by the Neuroendocrine Tumor Research Foundation and Paradifference Foundation.
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
R.W.T.构思了这项研究。m.z., l.m., a.p., b.b., s.b., a.f.和F.J.R.进行了实验和数据分析。A.S.T.和A.J.G.进行了病理复查和分析。a.h., j.a.m., z.f., s.g., l.f., p.l.m.d., r.j.h., r.c.b.和K.P.提供物质支持,招募患者或整理临床数据。M.Z, a.p., b.b., s.b.和R.W.T.撰写了手稿。所有作者编辑并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Bianca Mostert, Susanne Schlisio和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Zethoven, M., Martelotto, L., Pattison, A.。gydF4y2Baet al。gydF4y2Ba嗜铬细胞瘤和副神经节瘤的单核和大组织基因表达分析将疾病亚型与肿瘤微环境联系起来。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6262(2022)。https://doi.org/10.1038/s41467-022-34011-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-34011-3gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba