摘要gydF4y2Ba
化疗可引起肿瘤免疫逃避,但机制不明确。在本研究中,我们证明化疗显著提高了骨肉瘤组织中CD47的表达水平,这与患者死亡率呈正相关。我们发现,巨噬细胞在化疗反应中分泌白介素-18,进而上调肿瘤细胞中l -氨基酸转运体2 (LAT2)的表达,从而大幅增加亮氨酸和谷氨酰胺的摄取,这是mTORC1的两种有效刺激因子。亮氨酸水平的增加和谷氨酰胺水解增强激活了mTORC1和随后的c- myc介导的CD47转录。LAT2缺失或用LAT抑制剂治疗肿瘤细胞可下调CD47,增强肿瘤细胞的巨噬细胞浸润和吞噬作用,并使小鼠骨肉瘤对阿霉素治疗敏感。这些发现揭示了巨噬细胞和肿瘤细胞之间的相互调节,在肿瘤免疫逃避中起着关键作用,并强调了干预lat2介导的氨基酸摄取以改善癌症治疗的潜力。gydF4y2Ba
简介gydF4y2Ba
骨肉瘤是最常见的原发性骨恶性肿瘤。自20世纪70年代以来,化疗的引入显著提高了骨肉瘤患者的总体生存期。目前,骨肉瘤的根治性手术联合新辅助和辅助化疗已成为规范化的治疗方法gydF4y2Ba1gydF4y2Ba.顺铂、阿霉素、甲氨蝶呤和异环磷酰胺的组合化疗方案已经使用了几十年gydF4y2Ba2 gydF4y2Ba.尽管化疗显著提高了疗效,但骨肉瘤的临床预后仍不理想。约三分之一的骨肉瘤患者对化疗药物反应不佳,容易发生复发和转移性疾病,5年生存率仅为5-20%gydF4y2Ba3.gydF4y2Ba.化疗耐药和免疫逃避已成为骨肉瘤治疗的主要挑战,需要更有效的策略来提高患者的生存期gydF4y2Ba4 gydF4y2Ba.gydF4y2Ba
癌细胞逃避免疫监视的能力在癌症复发和转移中起着至关重要的作用gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba.虽然化疗药物通过刺激免疫系统根除肿瘤细胞gydF4y2Ba7 gydF4y2Ba在美国,越来越多的证据显示,化疗后的肿瘤对抗肿瘤免疫的抵抗力增强gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba9克ydF4y2Ba.巨噬细胞是骨肉瘤中最丰富的免疫细胞类型gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba它们的密度和临床结果之间的关系仍然是矛盾的gydF4y2Ba12克ydF4y2Ba,gydF4y2Ba13克ydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.对化疗前骨肉瘤标本的分析显示,巨噬细胞密度增加与转移抑制和转移无进展生存期延长有关gydF4y2Ba13克ydF4y2Ba,gydF4y2Ba14gydF4y2Ba而化疗后标本的研究显示,与没有转移的骨肉瘤患者相比,有转移的骨肉瘤患者肿瘤中有更多的巨噬细胞gydF4y2Ba15gydF4y2Ba.这些结果表明,在骨肉瘤化疗过程中,癌细胞通过一些未知的机制加强了对巨噬细胞免疫监视的逃避。gydF4y2Ba
CD47是一种有效的巨噬细胞免疫检查点,其表达是介导癌细胞逃避先天免疫的主要机制gydF4y2Ba16gydF4y2Ba.肿瘤细胞上的CD47可与巨噬细胞上的信号调节蛋白α (sipri α)配体结合,从而抑制巨噬细胞的吞噬作用gydF4y2Ba16gydF4y2Ba.在骨肉瘤中,CD47在癌细胞中的表达水平通常高于周围正常组织gydF4y2Ba17 gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.CD47表达高与骨肉瘤患者生存率差相关gydF4y2Ba19gydF4y2Ba.通过抑制CD47激活肿瘤相关巨噬细胞增强了巨噬细胞介导的肿瘤细胞清除,抑制了小鼠骨肉瘤的生长和肺转移gydF4y2Ba17 gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.CD47阻断剂在晚期血液癌患者中显示出有希望的活性gydF4y2Ba22gydF4y2Ba目前正在设计临床试验,以评估CD47抑制是否增强骨肉瘤患者的其他免疫疗法的活性gydF4y2Ba18gydF4y2Ba.然而,骨肉瘤细胞中CD47的表达是否在化疗反应中受到调控,从而促进肿瘤免疫逃避,目前尚不清楚。gydF4y2Ba
癌细胞需要充足的营养来维持它们的快速生长和增殖。氨基酸转运蛋白对维持癌细胞的高水平代谢和蛋白质合成至关重要gydF4y2Ba23gydF4y2Ba.因此,在许多原发性人类肿瘤以及各种癌症细胞系中,已经观察到通过上调特定转运体来增强氨基酸的吸收gydF4y2Ba24gydF4y2Ba.l型氨基酸转运体(LATs)构成主要的钠gydF4y2Ba+gydF4y2Ba中性氨基酸,如谷氨酰胺和亮氨酸的非依赖性运输系统gydF4y2Ba25gydF4y2Ba.到目前为止,已经发现了四种LAT1 (LAT1, LAT2, LAT3和LAT4),阻断LAT1已成为癌症治疗中一个有吸引力的策略gydF4y2Ba25gydF4y2Ba.然而,氨基酸摄取与肿瘤免疫检查点调节之间的关系尚不清楚。gydF4y2Ba
在本研究中,我们发现化疗后骨肉瘤中CD47上调,且这种上调与患者死亡率相关。从机制上讲,化疗促进巨噬细胞白细胞介素(IL)−18的分泌,从而上调肿瘤细胞中LAT2的表达,从而增强谷氨酰胺和亮氨酸的摄取,以及mTOR活性依赖的CD47表达,以促进肿瘤免疫。gydF4y2Ba
结果gydF4y2Ba
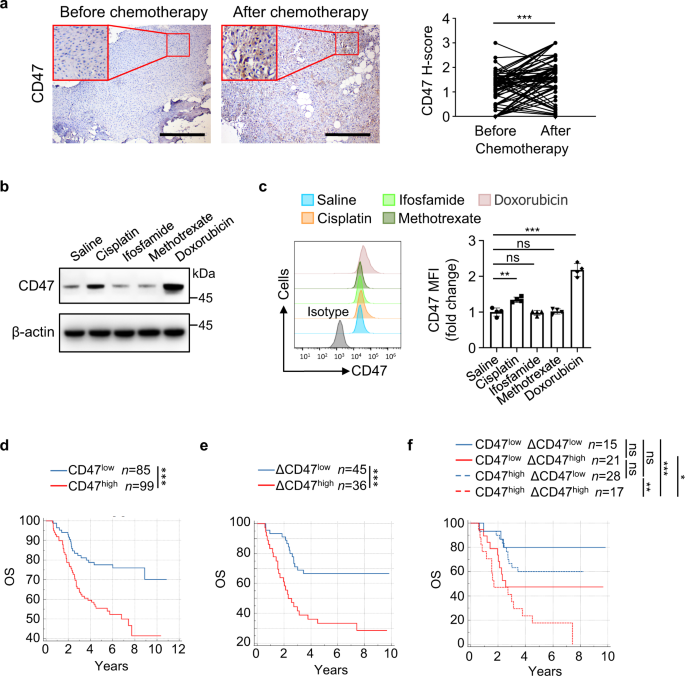
骨肉瘤化疗诱导CD47上调,与患者预后不良有关gydF4y2Ba
免疫检查点的表达在治疗后经常发生变化gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.为了确定化疗是否改变了CD47的表达,我们进行了免疫组化(IHC)分析,评估了81例骨肉瘤患者化疗前后配对标本中的CD47蛋白水平。如图所示。gydF4y2Ba1gydF4y2Ba,化疗后骨肉瘤标本中CD47 (H-score)的表达明显高于化疗前配对标本,提示化疗促进了骨肉瘤中CD47的表达。接下来,我们用顺铂、异环磷酰胺、甲氨蝶呤或阿霉素(骨肉瘤最常用的四种化疗药物)治疗来自人类骨肉瘤(HOS)的小鼠肿瘤,检测到顺铂或阿霉素治疗小鼠肿瘤中CD47 mRNA和蛋白水平明显上调(图)。gydF4y2Ba1 bgydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba).通过流式细胞术检测绿色荧光蛋白(GFP)标记的HOS细胞上CD47的表达,验证了这一发现(图1)。gydF4y2Ba1 cgydF4y2Ba).这些数据表明,含有阿霉素或顺铂的化疗上调了骨肉瘤细胞中CD47的表达。gydF4y2Ba
一个gydF4y2Ba同一患者配对骨肉瘤标本化疗前后CD47表达的免疫组化分析(CD47 H-score) (gydF4y2BangydF4y2Ba= 81名患者)。比例尺,400 μm。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaGFP后静脉注射顺铂或阿霉素每2天,静脉注射异环磷酰胺或甲氨蝶呤每4天gydF4y2Ba+gydF4y2BaHOS肿瘤生长14天。gydF4y2BabgydF4y2BaWestern blot分析HOS肿瘤第22天CD47的表达。gydF4y2BacgydF4y2Ba流式细胞术分析CD47蛋白在GFP中的表达gydF4y2Ba+gydF4y2Ba第22天肿瘤的HOS细胞(左;gydF4y2BangydF4y2Ba=每组4只)。测定抗cd47中位荧光强度(MFI)(右)。gydF4y2BadgydF4y2Ba按化疗前标本中CD47表达分层的骨肉瘤患者总生存期(OS) Kaplan-Meier曲线CD47高表达(CD47gydF4y2Ba高gydF4y2Ba): CD47 H-score > 0.9;低CD47表达(CD47gydF4y2Ba低gydF4y2Ba): CD47 h评分≤0.9。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2BaΔCD47每个患者的H-score为化疗前标本的CD47 H-score减去化疗后配对标本的CD47 H-score。gydF4y2BaegydF4y2Ba按ΔCD47表达分层的骨肉瘤患者总生存期(OS) Kaplan-Meier曲线。高ΔCD47表达式(ΔCD47 .gydF4y2Ba高gydF4y2Ba): ΔCD47 H-score > 0.8;低ΔCD47表达(ΔCD47gydF4y2Ba低gydF4y2Ba): ΔCD47 H-score≤0.8。gydF4y2BafgydF4y2Ba按化疗前标本中CD47表达和ΔCD47表达分层的骨肉瘤患者总生存期(OS) Kaplan-Meier曲线低CD47表达和低ΔCD47表达(CD47gydF4y2Ba低gydF4y2BaΔCD47gydF4y2Ba低gydF4y2Ba): CD47 H-score≤0.9,ΔCD47 H-score≤0.8;低CD47表达和高ΔCD47表达(CD47gydF4y2Ba低gydF4y2BaΔCD47gydF4y2Ba高gydF4y2Ba): CD47 H-score≤0.9,ΔCD47 H-score > 0.8;CD47高表达和ΔCD47低表达(CD47gydF4y2Ba高gydF4y2BaΔCD47gydF4y2Ba低gydF4y2Ba): CD47 H-score > 0.9, ΔCD47 H-score≤0.8;高CD47表达和高ΔCD47表达(CD47gydF4y2Ba高gydF4y2BaΔCD47gydF4y2Ba高gydF4y2Ba): CD47 H-score > 0.9, ΔCD47 H-score > 0.8。数据以平均值±标准差表示。ns,不重要。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,成对双尾学生gydF4y2BatgydF4y2Ba测试(gydF4y2Ba一个gydF4y2Ba),单因素方差分析(gydF4y2BacgydF4y2Ba)或对数秩检验(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba).实验进行了三次,结果相似(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
我们接下来根据CD47在骨肉瘤患者中的表达来评估化疗的结果。与之前的研究一致gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba, CD47高表达(CD47gydF4y2Ba高gydF4y2Ba)化疗前总生存期(OS)和无病生存期(DFS)均短于CD47低表达组(CD47低表达组)gydF4y2Ba低gydF4y2Ba)(图。gydF4y2Ba1 dgydF4y2Ba和补充图。gydF4y2Ba1 bgydF4y2Ba).值得注意的是,CD47表达高上调的患者(ΔCD47gydF4y2Ba高gydF4y2Ba与低CD47表达上调的患者(ΔCD47)相比,患者的总生存期(OS)和无病生存期(DFS)更短gydF4y2Ba低gydF4y2Ba)(图。gydF4y2Ba1 egydF4y2Ba和补充图。gydF4y2Ba1 cgydF4y2Ba).根据化疗前CD47表达水平和化疗后CD47表达上调水平,我们进一步将所有患者分为4组,发现化疗前CD47表达水平和化疗后CD47表达上调水平均高的患者(CD47gydF4y2Ba高gydF4y2BaΔCD47gydF4y2Ba高gydF4y2Ba)在所有这些患者组中生存时间最短(图。gydF4y2Ba1 fgydF4y2Ba和补充图。gydF4y2Ba1 dgydF4y2Ba).这些结果强烈提示骨肉瘤化疗诱导肿瘤细胞CD47表达上调,与患者预后不良有关。gydF4y2Ba
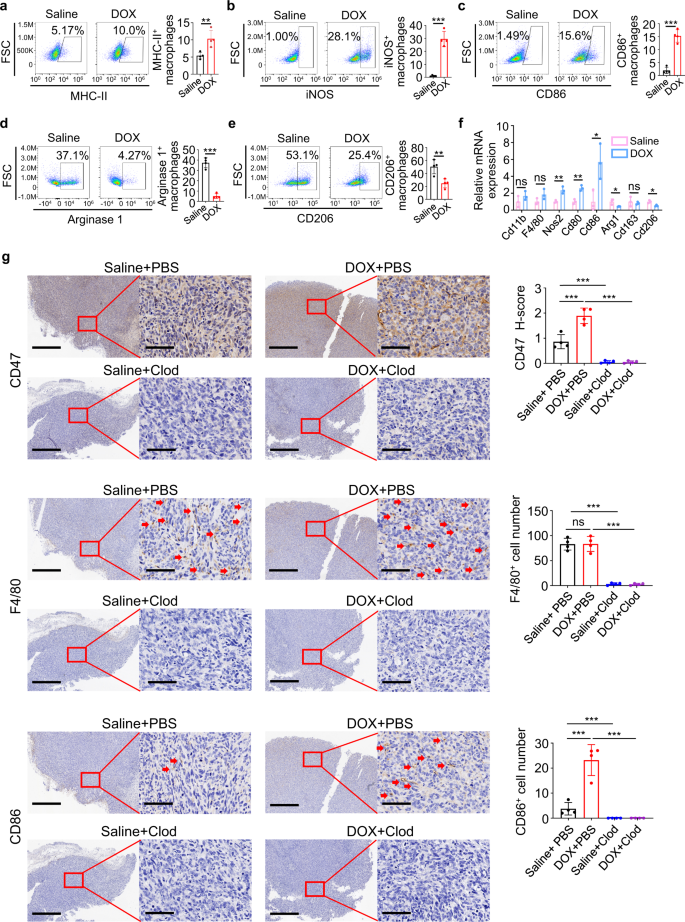
骨肉瘤中阿霉素诱导的CD47上调依赖于肿瘤相关巨噬细胞的激活gydF4y2Ba
为了确定化疗诱导骨肉瘤中CD47上调的机制,我们使用阿霉素对不同骨肉瘤细胞系进行了广泛的治疗时间和剂量处理,但令人惊讶的是,阿霉素并没有明显改变骨肉瘤癌细胞中CD47的表达(补充图。gydF4y2Ba2 a -gydF4y2Ba),提示阿霉素诱导骨肉瘤细胞中CD47上调是肿瘤微环境依赖性的。gydF4y2Ba
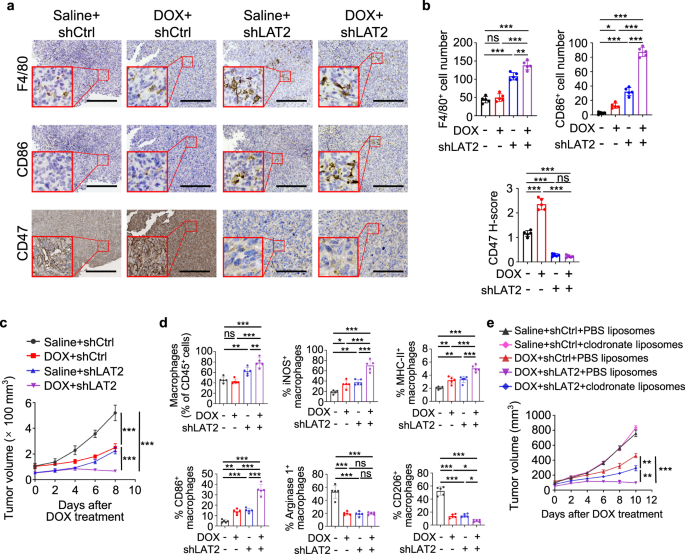
肿瘤微环境中的免疫细胞在肿瘤发生和肿瘤细胞对治疗的反应中起着重要作用gydF4y2Ba5gydF4y2Ba,gydF4y2Ba12克ydF4y2Ba.此外,巨噬细胞是骨肉瘤中最丰富的免疫细胞gydF4y2Ba11gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba通常被极化为经典激活的肿瘤抑制巨噬细胞(M1)和交替激活的肿瘤促进巨噬细胞(M2),对肿瘤细胞活力的影响相反gydF4y2Ba31gydF4y2Ba.流式细胞术分析显示,阿霉素治疗没有改变骨肉瘤肿瘤中骨髓来源的抑制细胞、树突状细胞、自然杀伤细胞(NK)、B细胞或整体巨噬细胞的百分比。gydF4y2Ba2我gydF4y2Ba).然而,阿霉素治疗上调了M1标志物MHC-II、诱导型一氧化氮合酶(iNOS)和CD86(图1)。gydF4y2Ba2 a - cgydF4y2Ba), M2标记Arginase 1和CD206下调(图。gydF4y2Ba2 d, egydF4y2Ba)肿瘤相关巨噬细胞。实时荧光定量PCR分析证实阿霉素增强了M1标记的表达gydF4y2BaNos2gydF4y2Ba,gydF4y2BaCd80gydF4y2Ba而且gydF4y2BaCd86gydF4y2BaM2标记的简化表达gydF4y2Ba__arg1gydF4y2Ba而且gydF4y2BaCd206gydF4y2Ba而不改变一般的巨噬细胞标志物,如gydF4y2BaCD11bgydF4y2Ba或gydF4y2BaF4/80gydF4y2Ba(无花果。gydF4y2Ba2 fgydF4y2Ba).这些结果表明,阿霉素治疗激活巨噬细胞具有m1孔性,这通常被认为引起主要的免疫促进作用。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba流式细胞术分析MHC-II (gydF4y2Ba一个gydF4y2Ba),进气阀打开(gydF4y2BabgydF4y2Ba)、CD86 (gydF4y2BacgydF4y2Ba)、精氨酸酶1 (gydF4y2BadgydF4y2Ba)和CD206 (gydF4y2BaegydF4y2Ba)表达gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba第22天HOS肿瘤中的巨噬细胞采自每2天静脉注射阿霉素(DOX)的小鼠(gydF4y2BangydF4y2Ba=每组4只)。gydF4y2BafgydF4y2Ba实时荧光定量PCR分析HOS肿瘤中相关基因的表达,如(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)第22天(gydF4y2BangydF4y2Ba=每组3只)。gydF4y2BaggydF4y2Ba免疫组化抗体染色显示,在第22天,在氯膦酸盐(Clod)脂质体或磷酸盐缓冲盐(PBS)脂质体的存在下,经生理盐水或阿霉素(DOX)处理的HOS肿瘤的连续切片显示抗体。比例尺分别为800 μm和80 μm。左侧显示有代表性的IHC图像。免疫组化染色定量分析见右图(gydF4y2BangydF4y2Ba=每组4只)。数据以平均值±标准差表示。ns不显著。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,未配对双尾学生gydF4y2BatgydF4y2Ba测试(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba)或单因素方差分析(gydF4y2BaggydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
基因表达综合(GEO)数据集分析表明gydF4y2BaCD47gydF4y2Ba表达与M1标记正相关gydF4y2BaCD80gydF4y2Ba(补充图。gydF4y2Ba2 ngydF4y2Ba)和M1在肿瘤浸润免疫细胞中的丰度(补充图。gydF4y2Ba2 ogydF4y2Ba).在产生有效治疗方法的治疗应用研究(TARGET)骨肉瘤队列中,高gydF4y2BaCD47gydF4y2Ba表达也显示出较高的M1丰度(补充图。gydF4y2Ba2 pgydF4y2Ba).为了确定CD47上调是否需要阿霉素激活的巨噬细胞,我们使用氯膦酸盐脂质体清除小鼠巨噬细胞。巨噬细胞标记物F4/80的免疫组化染色和CD11b的流式细胞术分析证实了肿瘤中巨噬细胞的成功清除gydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba2 ggydF4y2Ba和补充图。gydF4y2Ba2问gydF4y2Ba).值得注意的是,氯膦酸盐脂质体治疗降低了骨肉瘤中基础CD47的表达和阿霉素诱导的CD47上调(图。gydF4y2Ba2 ggydF4y2Ba和补充图。gydF4y2Ba2 rgydF4y2Ba).gydF4y2Ba
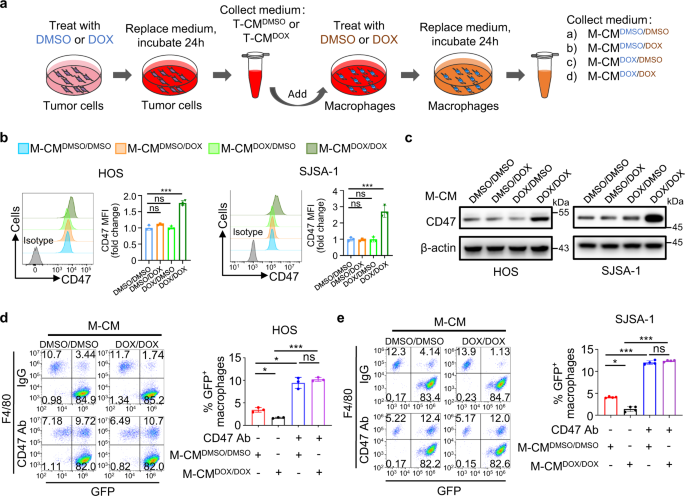
我们将肿瘤细胞与巨噬细胞共培养,方法是将它们播撒到同一个培养孔中,使它们的细胞与细胞相互接触(直接共培养),或者将巨噬细胞播撒到transwell装置的上嵌件中,与肿瘤细胞在较低的孔板中(间接共培养)。阿霉素治疗在这两种情况下诱导了相似水平的CD47上调,这表明阿霉素上调CD47表达主要是由巨噬细胞分泌的可溶性因子引起的(补充图)。gydF4y2Ba3gydF4y2Ba).为了确定肿瘤细胞中巨噬细胞依赖性CD47上调的机制,我们通过以下步骤生成巨噬细胞条件培养基:用DMSO或阿霉素处理HOS细胞24小时,然后用无血清培养基再次更新24小时,生成DMSO处理的肿瘤条件培养基(T-CM)gydF4y2BaDMSO溶液gydF4y2Ba)或阿霉素治疗的肿瘤条件培养基(T-CMgydF4y2Ba阿霉素gydF4y2Ba).接下来,thp -1细胞来源的巨噬细胞用DMSO或阿霉素存在的肿瘤条件培养基处理24小时,然后用无血清培养基刷新24小时,产生4种巨噬细胞条件培养基(M-CM)(图1)。gydF4y2Ba3gydF4y2Ba).在阿霉素处理的肿瘤条件培养基(M-CM)存在的情况下,我们只检测到在与阿霉素处理的巨噬细胞的条件培养基(M-CM)孵育后,HOS、SJSA-1和U-2 OS细胞中CD47表达的明显诱导gydF4y2Ba阿霉素和强力霉素gydF4y2Ba)(图。gydF4y2Ba3 b, cgydF4y2Ba和补充图。gydF4y2Ba3 b, cgydF4y2Ba).值得注意的是,CD47的上调伴随着HOS和SJSA-1细胞的巨噬细胞吞噬被抑制。gydF4y2Ba3 d, egydF4y2Ba这种抑制作用在与抗cd47抗体孵育后被消除,显著增强了HOS和ssa -1细胞的吞噬作用(图。gydF4y2Ba3 d, egydF4y2Ba).这些结果表明,阿霉素联合阿霉素处理的骨肉瘤细胞释放的因子激活巨噬细胞,而巨噬细胞又通过分泌可溶性因子上调肿瘤细胞中CD47的表达抑制巨噬细胞吞噬。gydF4y2Ba
一个gydF4y2Ba巨噬细胞条件培养基(M-CM)的产生示意图。用DMSO或阿霉素(DOX)处理HOS细胞,生成DMSO处理的肿瘤条件培养基(T-CM)gydF4y2BaDMSO溶液gydF4y2Ba)或dox处理的肿瘤条件培养基(T-CMgydF4y2Ba阿霉素gydF4y2Ba).用T-CM处理thp -1细胞来源的巨噬细胞gydF4y2BaDMSO溶液gydF4y2Ba或T-CMgydF4y2Ba阿霉素gydF4y2Ba在DMSO或DOX的存在下产生四种M-CMgydF4y2BaDMSO / DMSO溶液gydF4y2BaT-CMgydF4y2BaDMSO溶液gydF4y2Ba和DMSO溶液;M-CMgydF4y2BaDMSO /阿霉素gydF4y2BaT-CMgydF4y2BaDMSO溶液gydF4y2Ba阿霉素;M-CMgydF4y2Ba阿霉素/ DMSO溶液gydF4y2BaT-CMgydF4y2Ba阿霉素gydF4y2Ba和DMSO溶液;M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2BaT-CMgydF4y2Ba阿霉素gydF4y2Ba和阿霉素。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba用M-CM处理HOS或ssa -1细胞gydF4y2BaDMSO / DMSO溶液gydF4y2Ba, M-CMgydF4y2BaDMSO /阿霉素gydF4y2Ba, M-CMgydF4y2Ba阿霉素/ DMSO溶液gydF4y2Ba,或者M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba24 h。gydF4y2BabgydF4y2Ba用同型对照或抗CD47抗体(左)流式细胞术检测细胞表面CD47的表达。测定抗cd47中位荧光强度(MFI)(右;gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BacgydF4y2BaWestern blot分析肿瘤细胞中CD47的表达。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba基于流式细胞术的体外巨噬细胞吞噬检测HOS (gydF4y2BadgydF4y2Ba)或ssa -1 (gydF4y2BaegydF4y2Ba)细胞在IgG或抗CD47抗体(CD47 Ab)的存在下4小时(gydF4y2BangydF4y2Ba= 3个独立实验的HOS细胞和gydF4y2BangydF4y2Ba= ssa -1细胞的4个独立实验)。用M-CM预处理HOS或ssa -1细胞gydF4y2BaDMSO / DMSO溶液gydF4y2Ba或M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba24 h。巨噬细胞定义为F4/80gydF4y2Ba+gydF4y2Ba(用PE标记)事件,肿瘤细胞为GFPgydF4y2Ba+gydF4y2Ba.F4/80gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba事件代表巨噬细胞吞噬了肿瘤细胞。数据以平均值±标准差表示。ns不显著。*gydF4y2BaPgydF4y2Ba< 0.05, * * *gydF4y2BaPgydF4y2Ba< 0.001,单因素方差分析(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba).实验进行了三次,结果相似(gydF4y2BacgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
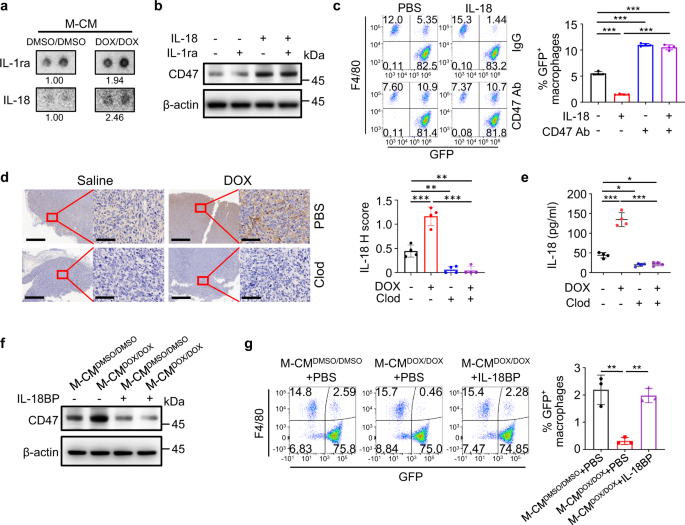
巨噬细胞分泌的IL-18诱导骨肉瘤细胞中CD47的表达gydF4y2Ba
为了确定导致CD47上调的巨噬细胞分泌因子,我们对CD47高表达或低表达的骨肉瘤患者的GEO数据进行了基因集富集分析(GSEA)分析。京都基因与基因组百科全书(KEGG)“细胞因子-细胞因子受体相互作用”基因集中的基因在CD47高表达亚群中显著富集(补充图。gydF4y2Ba4gydF4y2Ba).细胞因子M-CM含量分析gydF4y2Ba阿霉素和强力霉素gydF4y2Ba显示IL-1ra和IL-18水平升高(图。gydF4y2Ba4gydF4y2Ba).用IL-1ra和IL-18治疗HOS表明,只有IL-18可以诱导CD47的表达(图。gydF4y2Ba4 bgydF4y2Ba), IL-18处理可诱导HOS和SJSA-1细胞中CD47 mRNA和蛋白的上调(图。gydF4y2Ba4 bgydF4y2Ba和补充图。gydF4y2Ba4罪犯gydF4y2Ba)伴随这些细胞的吞噬抑制,而这种抑制被CD47抗体逆转(图4)。gydF4y2Ba4摄氏度gydF4y2Ba和补充图。gydF4y2Ba4 egydF4y2Ba).与这些体外研究结果一致的是,阿霉素治疗诱导肿瘤组织中IL-18的上调,并通过氯膦酸酯脂质体介导的巨噬细胞的减少而被抑制。gydF4y2Ba4 d, egydF4y2Ba).有趣的是,在骨肉瘤细胞系中,白细胞介素-18受体1 (IL18R1)的mRNA表达水平明显高于fob1.19正常成骨细胞细胞系(补充图。gydF4y2Ba4 fgydF4y2Ba),这意味着骨肉瘤细胞对IL-18比正常骨细胞更敏感。这些结果表明,阿霉素诱导的巨噬细胞激活增加了骨肉瘤细胞中IL-18的分泌,进而增强了CD47的表达。顺铂,而不是异环磷酰胺或甲氨蝶呤,也能增加巨噬细胞条件培养基和肿瘤中IL-18的含量(补充图。gydF4y2Ba5 a、bgydF4y2Ba),观察这些药物在体外和体内对肿瘤细胞中CD47上调的影响(图。gydF4y2Ba1 b, cgydF4y2Ba和补充无花果。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba5度gydF4y2Ba)与诱导的IL-18水平相关。gydF4y2Ba
一个gydF4y2BaM-CM细胞因子分析gydF4y2BaDMSO / DMSO溶液gydF4y2Ba或M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba通过使用人类细胞因子阵列。TAM-CM中细胞因子含量升高的代表性图像gydF4y2Ba阿霉素和强力霉素gydF4y2Ba所示。数字表示由平均斑点像素密度决定的相对细胞因子表达。gydF4y2BabgydF4y2BaWestern blot分析血清饥饿4小时的HOS细胞中CD47蛋白,然后用指示的细胞因子(每种细胞因子40 ng/ml)处理24小时。gydF4y2BacgydF4y2Ba以流式细胞术为基础的体外巨噬细胞介导的HOS细胞吞噬试验,在IgG或抗CD47抗体(CD47 Ab)的存在下持续4小时(gydF4y2BangydF4y2Ba= 4个独立实验)。用PBS或IL-18 (40 ng/ml)预处理HOS细胞24 h。巨噬细胞定义为F4/80gydF4y2Ba+gydF4y2Ba(用PE标记)事件,肿瘤细胞为GFPgydF4y2Ba+gydF4y2Ba.F4/80gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba事件代表巨噬细胞吞噬了肿瘤细胞。gydF4y2BadgydF4y2Ba第22天,在氯膦酸盐(Clod)脂质体或磷酸盐缓冲盐(PBS)脂质体存在下,经生理盐水或阿霉素(DOX)处理的HOS肿瘤连续切片中IL-18表达的免疫组化分析(gydF4y2BangydF4y2Ba=每组4只)。比例尺分别为800 μm和80 μm。gydF4y2BaegydF4y2Ba经生理盐水、阿霉素(DOX)、氯膦酸钠(Clod)脂质体或PBS脂质体处理的HOS肿瘤第22天匀浆中IL-18浓度的ELISA分析(gydF4y2BangydF4y2Ba=每组4只)。gydF4y2BafgydF4y2BaM-CM处理HOS细胞的Western blot分析gydF4y2BaDMSO / DMSO溶液gydF4y2Ba或M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba在IL-18BP (2.5 μg/ml)存在或不存在的情况下作用24 h。gydF4y2BaggydF4y2Ba基于流式细胞术的体外巨噬细胞吞噬试验。用M-CM处理HOS细胞gydF4y2BaDMSO / DMSO溶液gydF4y2Ba, M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba,或M-CM的组合gydF4y2Ba阿霉素和强力霉素gydF4y2BaIL-18BP作用24 h (gydF4y2BangydF4y2Ba= 3个独立实验)。巨噬细胞定义为F4/80gydF4y2Ba+gydF4y2Ba(用PE标记)事件,肿瘤细胞为GFPgydF4y2Ba+gydF4y2Ba事件。F4/80gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba事件代表巨噬细胞吞噬了肿瘤细胞。数据以平均值±标准差表示。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,单因素方差分析(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
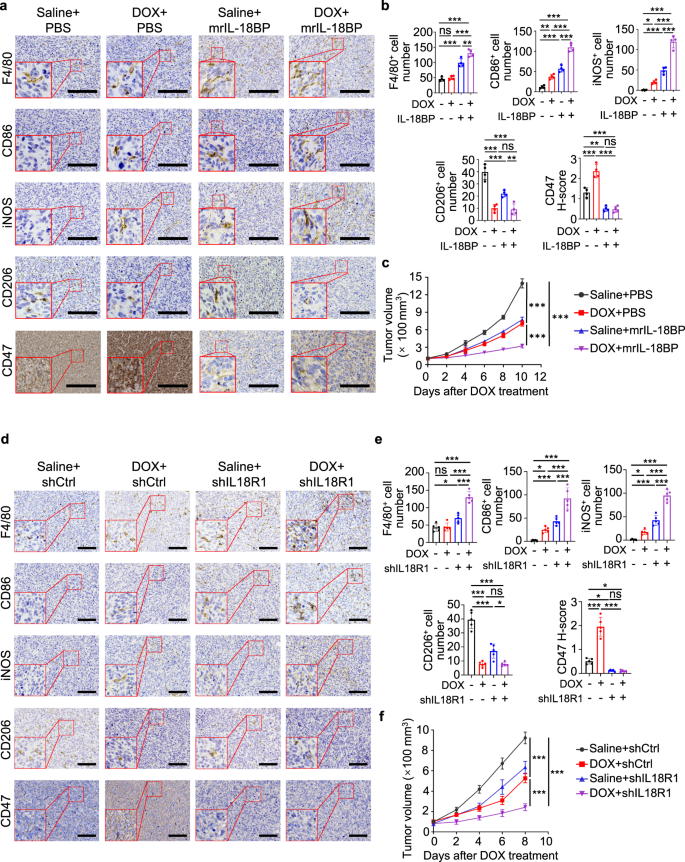
接下来,我们通过添加IL-18的天然拮抗剂IL-18结合蛋白(IL-18BP)来中和IL-18的活性,IL-18BP结合IL-18的亲和力明显高于IL-18RgydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba到M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba.IL-18BP治疗可改善HOS细胞中巨噬细胞诱导的CD47表达(图。gydF4y2Ba4 fgydF4y2Ba和补充图。gydF4y2Ba6gydF4y2Ba),巨噬细胞对HOS细胞的吞噬作用相应恢复(图。gydF4y2Ba4 ggydF4y2Ba).巨噬细胞中IL-18表达的缺失(补充图。gydF4y2Ba6 bgydF4y2Ba)显示IL-18BP对HOS和SJSA-1肿瘤细胞的作用类似(补充图。gydF4y2Ba6汉英gydF4y2Ba).对hos来源的肿瘤组织的分析表明,阿霉素增加了巨噬细胞的活化,伴随m1极性、IL-18分泌和CD47表达(图1)。gydF4y2Ba5 a、bgydF4y2Ba和补充图。gydF4y2Ba7一个gydF4y2Ba).小鼠瘤内注射IL-18BP大大降低了基础CD47的表达,并抑制了阿霉素诱导的CD47上调(图。gydF4y2Ba5 a、bgydF4y2Ba和补充图。gydF4y2Ba7一个gydF4y2Ba).重要的是,与单一治疗相比,IL-18BP和阿霉素联合治疗显著增加了巨噬细胞浸润和激活的m1极性巨噬细胞(图。gydF4y2Ba5 a、bgydF4y2Ba),结果显著抑制肿瘤生长(图。gydF4y2Ba5度gydF4y2Ba).此外,在HOS和ssa -1细胞中敲除IL18R1(补充图。gydF4y2Ba7 bgydF4y2Ba)显示IL-18BP对抑制CD47表达的作用类似(图。gydF4y2Ba5 d, egydF4y2Ba和补充图。gydF4y2Ba7 c, dgydF4y2Ba),增强巨噬细胞的浸润和活化(图。gydF4y2Ba5 d, egydF4y2Ba和补充图。gydF4y2Ba7 c, dgydF4y2Ba)和抑制肿瘤生长(图。gydF4y2Ba5 fgydF4y2Ba和补充图。gydF4y2Ba7 egydF4y2Ba).这些结果表明,阿霉素增强的M1巨噬细胞激活增加了IL-18的分泌和CD47的表达,并抑制了巨噬细胞的吞噬作用。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2BaHOS荷瘤小鼠分别用生理盐水或阿霉素(DOX)治疗,并加入或不加入小鼠重组IL-18BP。gydF4y2Ba一个gydF4y2Ba代表性免疫组化图像,显示第22天HOS肿瘤连续切片中F4/80、CD86、iNOS、CD206和CD47的表达。比例尺,200 μm。gydF4y2BabgydF4y2Ba的量化统计分析gydF4y2Ba一个gydF4y2Ba(gydF4y2BangydF4y2Ba=每组4只)。gydF4y2BacgydF4y2BaHOS细胞在小鼠体内的肿瘤生长(gydF4y2BangydF4y2Ba=每组4只)。在指定的时间点测量肿瘤体积。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba在肿瘤生长14天后,使用生理盐水或阿霉素(DOX)治疗带有或没有IL18R1缺失的小鼠HOS肿瘤。gydF4y2BadgydF4y2Ba代表性免疫组化图像,显示第22天HOS肿瘤连续切片中F4/80、CD86、iNOS、CD206和CD47的表达。比例尺,300 μm。gydF4y2BaegydF4y2Ba的量化统计分析gydF4y2BadgydF4y2Ba(gydF4y2BangydF4y2Ba=每组5只)。gydF4y2BafgydF4y2BaHOS细胞在小鼠体内的肿瘤生长(gydF4y2BangydF4y2Ba=每组5只)。在指定的时间点测量肿瘤体积。数据以平均值±标准差表示。ns不显著。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,单因素方差分析(gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba)或双向方差分析(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
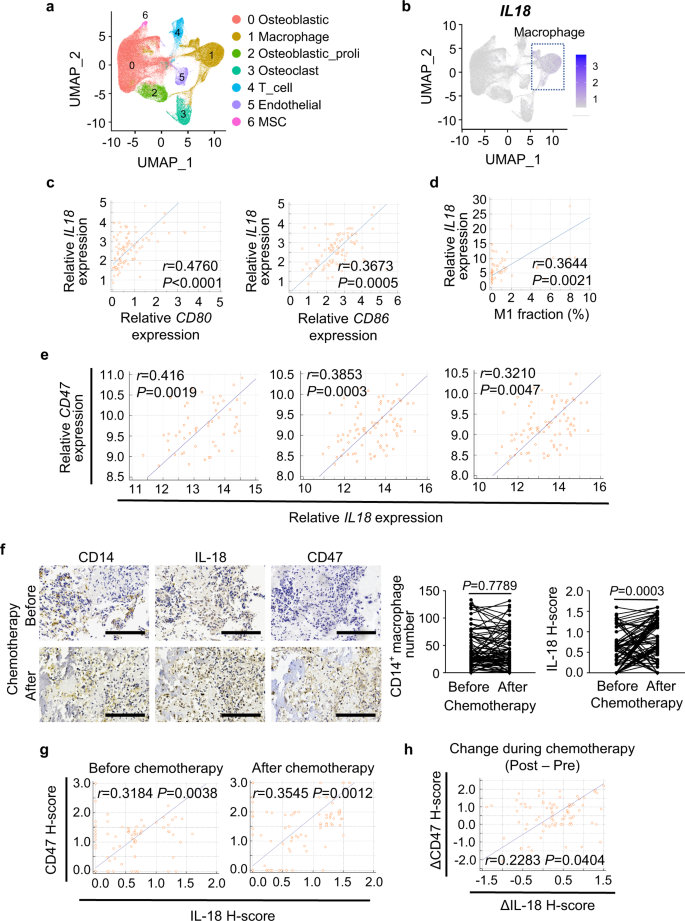
为了检验这一发现的临床相关性,我们分析了在化疗后收集的11个骨肉瘤肿瘤的GSE152048单细胞RNA-seq数据。在7个无偏聚类分组细胞簇中(图。gydF4y2Ba6gydF4y2Ba补充图。gydF4y2Ba8 gydF4y2Ba和补充表gydF4y2Ba1gydF4y2Ba),gydF4y2BaIL18gydF4y2Ba主要在巨噬细胞中表达(图。gydF4y2Ba6 bgydF4y2Ba).在TARGET骨肉瘤队列中,gydF4y2BaIL18gydF4y2Ba表达与M1标记正相关gydF4y2BaCD80gydF4y2Ba而且gydF4y2BaCD86gydF4y2Ba(无花果。gydF4y2Ba6摄氏度gydF4y2Ba)和M1在肿瘤浸润免疫细胞中的丰度(图。gydF4y2Ba6 dgydF4y2Ba).此外,我们观察到正相关gydF4y2BaCD47gydF4y2Ba而且gydF4y2Ba地震-gydF4y2Ba在三个不同GEO队列的骨肉瘤患者中,gydF4y2Ba6 egydF4y2Ba).骨肉瘤患者化疗前后配对标本的免疫组化染色显示,化疗后IL-18显著升高,但巨噬细胞总数无明显变化(图1)。gydF4y2Ba6 fgydF4y2Ba).此外,化疗前后骨肉瘤标本中IL-18和CD47的表达存在相关性(图1)。gydF4y2Ba6克gydF4y2Ba),化疗引起的CD47表达变化也与化疗诱导的IL-18的变化相关(图。gydF4y2Ba6小时gydF4y2Ba).这些结果揭示了巨噬细胞分泌的IL-18水平与CD47表达之间的临床相关性,以及化疗通过上调IL-18分泌对CD47表达增强的影响。gydF4y2Ba
一个gydF4y2Ba统一流形近似和投影(UMAP)图,显示7种主要细胞类型(gydF4y2BangydF4y2Ba= 11例骨肉瘤患者样本)。MSC,间充质干细胞。gydF4y2BabgydF4y2BaUMAP图显示的表达谱gydF4y2BaIL18gydF4y2Ba基因(gydF4y2BangydF4y2Ba= 11例骨肉瘤患者样本)。gydF4y2BacgydF4y2Ba散点图显示之间的相关性gydF4y2BaIL18gydF4y2BaM1巨噬细胞标志物(gydF4y2BaCD80gydF4y2Ba而且gydF4y2BaCD86gydF4y2Ba)基因在骨肉瘤患者中的表达gydF4y2BangydF4y2Ba= 86名患者)。日志gydF4y2Ba2 gydF4y2Ba(TPM + 1)值进行计算和可视化。gydF4y2BadgydF4y2Ba散点图显示之间的相关性gydF4y2BaIL18gydF4y2Ba骨肉瘤患者中免疫细胞M1巨噬细胞的基因表达和百分率gydF4y2BangydF4y2Ba= 69名患者)。M1巨噬细胞分数用CIBERSORT计算。gydF4y2BaegydF4y2Ba散点图显示之间的相关性gydF4y2BaIL18gydF4y2Ba而且gydF4y2BaCD47gydF4y2Ba骨肉瘤患者GSE21257基因表达(左;gydF4y2BangydF4y2Ba= 53例),GSE33382(中;gydF4y2BangydF4y2Ba= 84例)、GSE30699(右;gydF4y2BangydF4y2Ba= 76名患者)。gydF4y2BafgydF4y2Ba具有代表性的免疫组化图像显示,同一患者化疗前后标本中CD14、IL-18和CD47表达。比例尺,200 μm。免疫组化量化CD14和IL-18表达的对比分析见右图。对81对配对标本进行分析(gydF4y2BangydF4y2Ba= 81名患者)。gydF4y2BaggydF4y2Ba散点图显示化疗前(左)和化疗后(右)骨肉瘤标本中IL-18和CD47表达的相关性。gydF4y2BahgydF4y2Ba散点图显示化疗期间IL-18和CD47表达变化的相关性。ΔIL-18/ΔCD47每个患者的h评分为化疗前标本的IL-18/CD47 h评分减去配对化疗后标本的h评分。数据以平均值±标准差表示。皮尔逊相关检验(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba)或成对的双尾学生gydF4y2BatgydF4y2Ba测试(gydF4y2BafgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
氨基酸转运体lat2介导的氨基酸摄取是骨肉瘤细胞中il -18诱导CD47表达的必要条件gydF4y2Ba
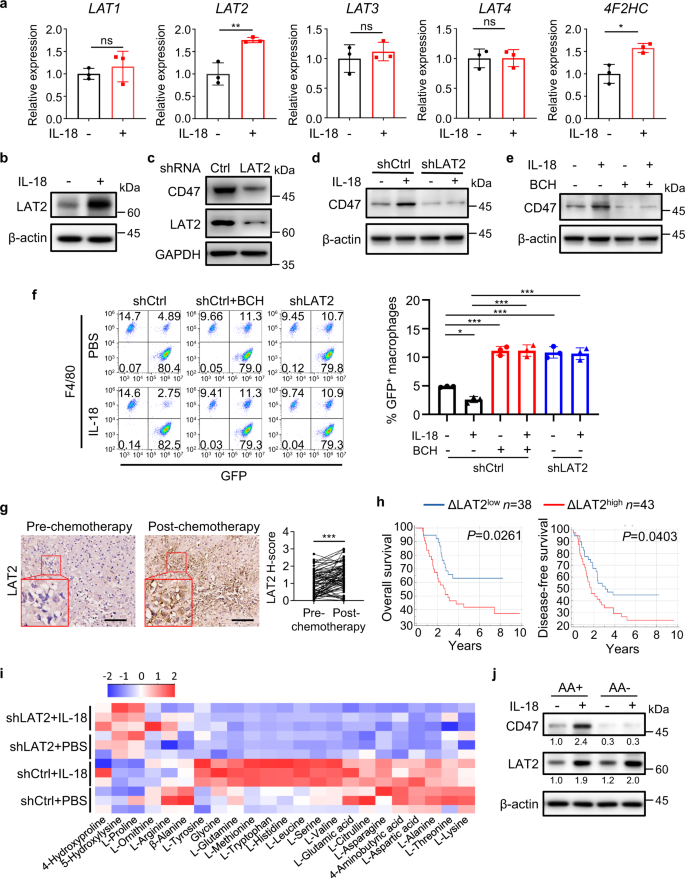
TARGET骨肉瘤数据的GSEA分析显示,CD47高表达患者的细胞代谢,包括氨基酸代谢丰富(补充图。gydF4y2Ba9gydF4y2Ba).此外,有报道称IL-18通过上调NK细胞上氨基酸转运体LAT1的表达来促进亮氨酸的吸收gydF4y2Ba35gydF4y2Ba.IL-18处理显著上调了mRNA表达水平gydF4y2BaLAT2gydF4y2Ba,但不gydF4y2BaLAT1gydF4y2Ba,gydF4y2BaLAT3gydF4y2Ba,或gydF4y2BaLAT4gydF4y2Ba,在HOS细胞中。gydF4y2Ba7一个gydF4y2Ba)以及LAT2蛋白在这些细胞中的表达(图。gydF4y2Ba7 bgydF4y2Ba和补充图。gydF4y2Ba9 bgydF4y2Ba).LAT2与4F2抗原重链(4F2hc)糖蛋白结合,形成功能性异源二聚体gydF4y2Ba25gydF4y2Ba的mRNA表达gydF4y2Ba4 f2hcgydF4y2Ba白细胞介素-18也会增加(图。gydF4y2Ba7一个gydF4y2Ba).通过表达LAT2 shRNA, LAT2的缺失显著降低了基底细胞(图。gydF4y2Ba7 cgydF4y2Ba和补充图。gydF4y2Ba9 cgydF4y2Ba)和il -18诱导的CD47在HOS细胞中的表达(图。gydF4y2Ba7 dgydF4y2Ba).与此一致的是,用2-氨基二环-(2,2,1)庚烷-2-羧酸(BCH) (LAT的一种特异性抑制剂)处理HOS、SJSA-1和U-2 OS细胞也会减少il -18诱导的CD47表达(图1)。gydF4y2Ba7 egydF4y2Ba和补充图。gydF4y2Ba9 d, egydF4y2Ba).此外,LAT2衰竭(图。gydF4y2Ba7 fgydF4y2Ba和补充图。gydF4y2Ba9 fgydF4y2Ba)或BCH治疗(图。gydF4y2Ba7 fgydF4y2Ba和补充图。gydF4y2Ba9 fgydF4y2Ba)解除了il -18抑制的巨噬细胞吞噬HOS的作用。BCH治疗也可以消除il -18抑制的SJSA-1细胞的巨噬细胞吞噬作用(补充图。gydF4y2Ba9克gydF4y2Ba).这些结果表明,LAT2在il -18上调CD47表达以及随后抑制巨噬细胞吞噬作用中是不可或缺的。gydF4y2Ba
一个gydF4y2Ba用IL-18 (40 ng/ml)或PBS处理HOS细胞24小时,实时荧光定量PCR分析指示基因(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BabgydF4y2BaWestern blot分析IL-18或PBS处理24 h后HOS细胞中LAT2的表达。gydF4y2BacgydF4y2BaWestern blot分析shCtrl或shLAT2 HOS细胞中CD47和LAT2的表达。gydF4y2BadgydF4y2BaWestern blot分析用PBS或IL-18处理的shCtrl或shLAT2 HOS细胞24小时。gydF4y2BaegydF4y2BaWestern blot分析在BCH存在或不存在的情况下,用PBS或IL-18处理HOS细胞24小时。gydF4y2BafgydF4y2Ba流式细胞术分析按指示处理后shCtrl HOS细胞或shLAT2 HOS细胞的巨噬细胞吞噬。巨噬细胞定义为F4/80gydF4y2Ba+gydF4y2Ba(用PE标记)事件,肿瘤细胞为GFPgydF4y2Ba+gydF4y2Ba事件。F4/80gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba事件代表巨噬细胞吞噬了肿瘤细胞(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BaggydF4y2Ba同一患者配对骨肉瘤标本化疗前后LAT2表达(LAT2 H-score)免疫组化分析(gydF4y2BangydF4y2Ba= 81名患者)。gydF4y2BahgydF4y2Ba骨肉瘤患者按ΔLAT2表达分层的总生存期(左)和无病生存期(右)Kaplan-Meier曲线。高ΔLAT2表达式(ΔLAT2 .gydF4y2Ba高gydF4y2Ba): ΔLAT2 H-score > 0.45;低ΔLAT2表达(ΔLAT2gydF4y2Ba低gydF4y2Ba): ΔLAT2 H-score < 0.45。ΔLAT2每个患者的H-score为化疗前标本的LAT2 H-score减去配对化疗后标本的LAT2 H-score。gydF4y2Ba我gydF4y2Ba热图显示在PBS或IL-18刺激下shCtrl或shLAT2 HOS细胞中氨基酸的相对浓度(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BajgydF4y2BaWestern blot分析IL-18或PBS在无氨基酸(AA−)或充足氨基酸(AA+)培养基中处理缺乏氨基酸的HOS细胞21小时。数据以平均值±标准差表示。ns,不重要。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,未配对双尾学生gydF4y2BatgydF4y2Ba测试(gydF4y2Ba一个gydF4y2Ba),单因素方差分析(gydF4y2BafgydF4y2Ba),成对双尾学生gydF4y2BatgydF4y2Ba测试(gydF4y2BaggydF4y2Ba)或对数秩检验(gydF4y2BahgydF4y2Ba).实验进行了三次,结果相似(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2BajgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
类似于IL-18治疗,M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba同时也增加了HOS细胞中LAT2的表达,这被巨噬细胞中IL-18的消耗所阻断(补充图。gydF4y2Ba9小时gydF4y2Ba).对骨肉瘤患者化疗前后配对标本的免疫组化分析显示,化疗显著增加了LAT2的表达(图。gydF4y2Ba7 ggydF4y2Ba).LAT2表达高上调的患者(ΔLAT2gydF4y2Ba高gydF4y2Ba)显示总体生存率和无病生存率较差(图。gydF4y2Ba7小时gydF4y2Ba).此外,LAT2的表达与IL-18的表达呈正相关(补充图。gydF4y2Ba10gydF4y2Ba)以及CD47的表达(补充图。gydF4y2Ba10 bgydF4y2Ba)对化疗前后骨肉瘤标本的影响。化疗后LAT2表达的变化(ΔLAT2 H-score)与IL-18的变化(ΔIL-18 H-score)呈正相关(补充图)。gydF4y2Ba10 cgydF4y2Ba),化疗增加的CD47表达变化(ΔCD47 H-score)也与LAT2的变化呈正相关(补充图。gydF4y2Ba10 dgydF4y2Ba).这些结果揭示了LAT2表达与IL-18/CD47表达之间的临床相关性。gydF4y2Ba
为了确定氨基酸在IL-18诱导的CD47表达中的作用,我们量化了HOS细胞中的细胞内氨基酸,发现IL-18处理大大增加了各种氨基酸的吸收,包括谷氨酰胺(Gln)和亮氨酸(Leu),而这种增加被LAT2耗尽所抵消(图2)。gydF4y2Ba7我gydF4y2Ba).值得注意的是,剥夺细胞培养基中不影响il -18诱导的LAT2表达的氨基酸,阻断了il -18上调的CD47在HOS、SJSA-1和U-2 OS细胞中的表达(图1)。gydF4y2Ba7 jgydF4y2Ba和补充图。gydF4y2Ba11 a, bgydF4y2Ba).这些结果表明,在骨肉瘤细胞中,lat2介导的氨基酸摄取是il -18诱导CD47表达的必要条件。gydF4y2Ba
il -18增强和lat2介导的谷氨酰胺和亮氨酸的摄取通过激活mTORC1/c-Myc轴促进CD47的表达gydF4y2Ba
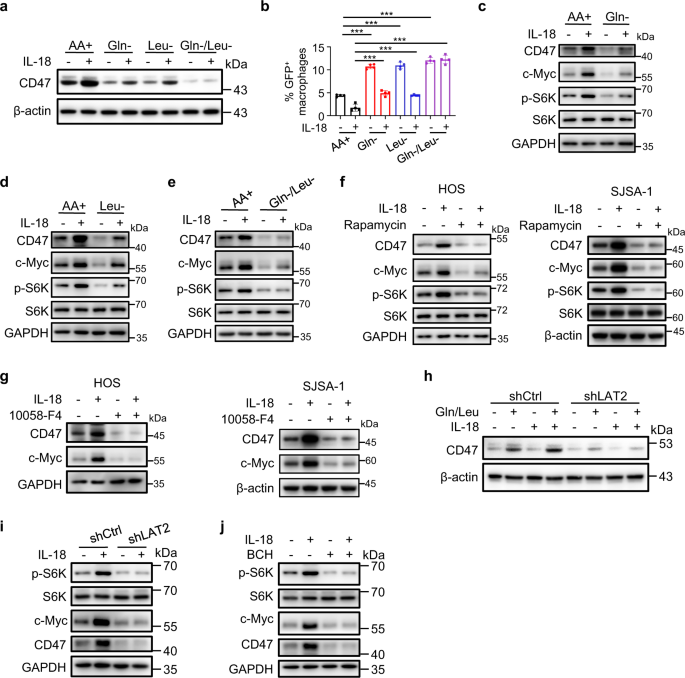
为了确定哪些氨基酸是IL-18诱导CD47上调所必需的,我们从培养基中去除了9种氨基酸,它们在HOS细胞中的浓度在IL-18处理后上调。Gln和Leu的缺失抑制了il -18诱导的CD47的表达(图。gydF4y2Ba8gydF4y2Ba和补充图。gydF4y2Ba12个一个gydF4y2Ba),并减轻了il -18诱导的吞噬抑制(图。gydF4y2Ba8 bgydF4y2Ba和补充图。gydF4y2Ba12 bgydF4y2Ba).此外,在IL-18缺失或存在的情况下,氨基酸剥夺-抑制CD47表达可通过补充Gln或Leu而消除。gydF4y2Ba12 cgydF4y2Ba).剥夺Gln或Leu也抑制了il -18诱导的SJSA-1和U-2 OS细胞CD47的表达(补充图。gydF4y2Ba12 d, egydF4y2Ba).这些数据表明,Gln和Leu是诱导il -18依赖性CD47表达以及随后CD47介导的巨噬细胞吞噬抑制的必要和充分条件。gydF4y2Ba
一个gydF4y2BaWestern blot分析用PBS或IL-18 (40 ng/ml)在氨基酸充足的培养基(AA+)或缺乏指示氨基酸的培养基中处理HOS细胞24小时。Gln-,培养基缺乏谷氨酰胺;亮氨酸,中等缺乏亮氨酸;Gln-/Leu-,中缺乏谷氨酰胺和亮氨酸。gydF4y2BabgydF4y2Ba基于流式细胞术的体外巨噬细胞吞噬试验。PBS或IL-18 (40 ng/ml)分别在氨基酸充足的培养基(AA+)、中缺亮氨酸(Leu-)、中缺谷氨酰胺(Gln-)、中缺谷氨酰胺和亮氨酸(Gln-/Leu-)中处理HOS细胞24 h (gydF4y2BangydF4y2Ba= 4个独立实验)。巨噬细胞定义为F4/80gydF4y2Ba+gydF4y2Ba(用PE标记)事件,肿瘤细胞为GFPgydF4y2Ba+gydF4y2Ba事件。F4/80gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba事件代表巨噬细胞吞噬了肿瘤细胞。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2BaWestern blot分析经PBS或IL-18 (40 ng/ml)处理的HOS细胞在氨基酸充足(AA+)或缺乏谷氨酰胺(Gln-)的培养基中gydF4y2BacgydF4y2Ba)、亮氨酸(低浓缩铀,gydF4y2BadgydF4y2Ba)或谷氨酰胺和亮氨酸(Gln-/Leu-,gydF4y2BaegydF4y2Ba) 24小时。gydF4y2BafgydF4y2BaWestern blot分析HOS(左)或SJSA-1(右)细胞在存在或不存在雷帕霉素(25 nM)的情况下,用PBS或IL-18 (40 ng/ml)处理24小时。gydF4y2BaggydF4y2BaWestern blot分析在10058-F4 (100 μM)存在或不存在的情况下,用PBS或IL-18 (40 ng/ml)处理HOS(左)或SJSA-1(右)细胞24小时。gydF4y2BahgydF4y2BaWestern blot分析缺乏氨基酸的shCtrl或shLAT2 HOS细胞,然后加入指示的氨基酸,在IL-18刺激下或不刺激21小时。gydF4y2Ba我gydF4y2BaWestern blot分析用PBS或IL-18处理的shCtrl或shLAT2 HOS细胞24小时。gydF4y2BajgydF4y2BaWestern blot分析在BCH存在或不存在的情况下,用PBS或IL-18处理HOS细胞24小时。数据以平均值±标准差表示。***gydF4y2BaPgydF4y2Ba< 0.001,单因素方差分析(gydF4y2BabgydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
已有研究报道谷氨酰胺水解和亮氨酸可激活哺乳动物雷帕霉素复合物1靶点(mTORC1)。gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2BamTORC1下游效应子c-Myc通过直接与CD47启动子结合诱导CD47表达gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.正如预期的那样,补充Gln或Leu到缺乏氨基酸的HOS细胞中增加了mTORC1底物p70 S6激酶(S6K)的磷酸化,并以剂量依赖性的方式增加了c-Myc的表达水平(补充图。gydF4y2Ba12 fgydF4y2Ba).值得注意的是,IL-18处理也增强了S6K的磷酸化和c-Myc的表达,而这种增强在培养基中去除Gln或Leu后减弱(图。gydF4y2Ba8汉英gydF4y2Ba).同样,巨噬细胞中IL-18的减少减少了M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba-诱导的S6K磷酸化和c-Myc在HOS细胞中的表达(补充图gydF4y2Ba12克gydF4y2Ba).所有这些结果都表明,Gln/ leu激活的mTORC1/c-Myc轴介导il -18诱导的CD47表达。为了进一步支持这一观点,用mTORC1抑制剂雷帕霉素治疗HOS、SJSA-1和U-2 OS细胞(图5)。gydF4y2Ba8 fgydF4y2Ba和补充图。gydF4y2Ba13gydF4y2Ba)或c-Myc抑制剂10058-F4(图。gydF4y2Ba8 ggydF4y2Ba和补充图。gydF4y2Ba13 bgydF4y2Ba)大大降低了il -18诱导的CD47表达。此外,雷帕霉素(补充图。gydF4y2Ba13 c, dgydF4y2Ba)或10058-F4(补充图gydF4y2Ba13 e, fgydF4y2Ba)治疗消除了il -18抑制的巨噬细胞吞噬HOS和SJSA-1细胞。c-Myc的缺失也降低了il -18诱导的CD47表达(补充图。gydF4y2Ba13克gydF4y2Ba)和HOS细胞的吞噬抑制(补充图。gydF4y2Ba13小时gydF4y2Ba).相反,c-Myc过表达克服了Gln/Leu耗竭的影响,诱导CD47的表达(补充图。gydF4y2Ba14个gydF4y2Ba),降低HOS细胞的吞噬能力(补充图。gydF4y2Ba14 bgydF4y2Ba).这些结果表明il -18增强了Gln和Leu的摄取,激活了mTORC1/c-Myc轴,这是il -18诱导CD47表达和抑制巨噬细胞吞噬所必需的。gydF4y2Ba
通过LAT2的耗尽进一步检测了LAT2在CD47氨基酸依赖性调控中的作用,即使在IL-18存在的情况下,LAT2也会阻断Gln和leu诱导的CD47表达(图1)。gydF4y2Ba8 hgydF4y2Ba).此外,损耗(图。gydF4y2Ba8我gydF4y2Ba)或抑制(图。gydF4y2Ba8 jgydF4y2Ba)极大地降低了基础和il -18增强的mTORC1激活和c-Myc表达。c-Myc的过表达克服了LAT2的抑制作用,从而诱导CD47的表达(补充图。gydF4y2Ba14摄氏度gydF4y2Ba),降低HOS细胞的吞噬能力(补充图。gydF4y2Ba14 dgydF4y2Ba).这些结果表明,lat2介导的Gln和Leu的摄取对于il -18诱导的mTORC1激活和c-Myc表达导致CD47上调是必不可少的。gydF4y2Ba
然后我们在HOS细胞中测试了阿霉素联合MYC敲除治疗的抗肿瘤作用。c-Myc的减少大大降低了肿瘤组织中基础的和阿霉素诱导的CD47表达(补充图。gydF4y2Ba15一个gydF4y2Ba).与阿霉素单独治疗或MYC耗竭相比,MYC耗竭联合阿霉素治疗可大大抑制肿瘤生长。gydF4y2Ba15 bgydF4y2Ba),巨噬细胞浸润增加,M1表型巨噬细胞激活增强(补充图。gydF4y2Ba15摄氏度gydF4y2Ba).这些数据表明,c-Myc抑制可使骨肉瘤对阿霉素治疗敏感。gydF4y2Ba
LAT2抑制可使骨肉瘤对阿霉素治疗敏感gydF4y2Ba
为了确定lat2介导的氨基酸摄取在阿霉素诱导的骨肉瘤免疫逃避中的作用,我们将lat2缺失的HOS细胞皮下注射到裸鼠体内,并用阿霉素治疗荷瘤小鼠。与我们体外实验的观察结果一致(图。gydF4y2Ba7 dgydF4y2Ba), LAT2的缺失大大降低了肿瘤组织中基础和阿霉素诱导的CD47表达(图。gydF4y2Ba9 a、bgydF4y2Ba).与阿霉素单独治疗或LAT2耗竭相比,LAT2耗竭联合阿霉素治疗可大大抑制肿瘤生长(图。gydF4y2Ba9 cgydF4y2Ba和补充图。gydF4y2Ba16一个gydF4y2Ba),巨噬细胞浸润增加,M1表型巨噬细胞激活增强(图。gydF4y2Ba9 a, b, dgydF4y2Ba和补充图。gydF4y2Ba16 bgydF4y2Ba).值得注意的是,使用氯膦酸酯脂质体消耗巨噬细胞降低了联合治疗的疗效。gydF4y2Ba9 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba小鼠在shCtrl或shLAT2 HOS肿瘤生长14天后,每隔一天用生理盐水或阿霉素(DOX)治疗。gydF4y2Ba一个gydF4y2Ba第22天,在肿瘤连续切片上用F4/80、CD86或CD47抗体染色的具有代表性的免疫组化图像。比例尺,150 μm。gydF4y2BabgydF4y2Ba样本免疫组化定量结果的统计分析(gydF4y2Ba一个gydF4y2Ba) (gydF4y2BangydF4y2Ba=每组5只)。gydF4y2BacgydF4y2Ba小鼠肿瘤生长的测量(gydF4y2BangydF4y2Ba=每组5只)。在指定的时间点测量肿瘤体积。gydF4y2BadgydF4y2Ba流式细胞术分析CD45细胞中MHC-II、iNOS、CD86、精氨酸酶1和CD206的表达gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba第17天肿瘤巨噬细胞(gydF4y2BangydF4y2Ba=每组5只)。gydF4y2BaegydF4y2BashCtrl HOS细胞或shLAT2 HOS细胞在治疗后产生的肿瘤体积(gydF4y2BangydF4y2Ba=每组5只)。阿霉素、阿霉素。数据以平均值±标准差表示。ns不显著。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,单因素方差分析(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba)或双向方差分析(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
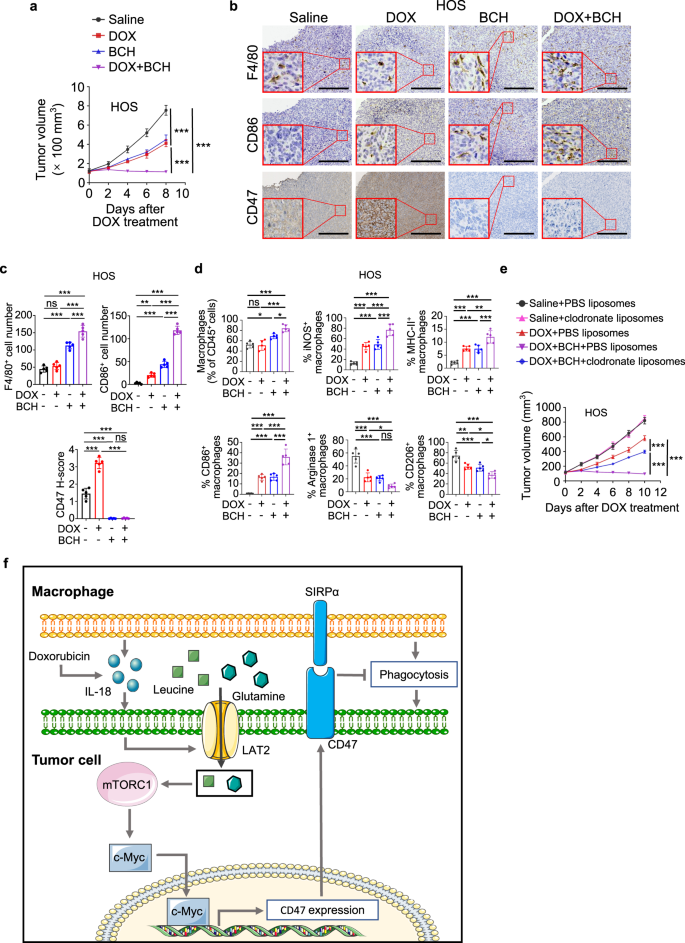
与LAT2耗尽的结果一致,BCH联合治疗使HOS-和sjsa -1源性肿瘤对阿霉素治疗敏感(图。gydF4y2Ba10gydF4y2Ba和补充图。gydF4y2Ba17 a、bgydF4y2Ba).正如预期的那样,BCH显著下调了基础和阿霉素诱导的CD47表达(图。gydF4y2Ba10 b, cgydF4y2Ba和补充图。gydF4y2Ba17摄氏度gydF4y2Ba).BCH联合治疗似乎增强了巨噬细胞的招募,并促进巨噬细胞向M1表型的激活(图。gydF4y2Ba10个罪犯gydF4y2Ba和补充图。gydF4y2Ba17 d, egydF4y2Ba).巨噬细胞的减少一致否定了联合治疗的疗效(图。gydF4y2Ba10 egydF4y2Ba和补充图。gydF4y2Ba17 fgydF4y2Ba).这些数据表明,抑制LAT2可通过增加巨噬细胞吞噬使骨肉瘤对阿霉素治疗敏感。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2BaHOS荷瘤小鼠在肿瘤孵育14天后同时给予阿霉素(DOX)和BCH治疗。gydF4y2Ba一个gydF4y2Ba小鼠肿瘤生长的测量(gydF4y2BangydF4y2Ba=每组5只)。在指定的时间点测量肿瘤体积。gydF4y2BabgydF4y2Ba第22天,在肿瘤连续切片上用F4/80、CD86或CD47抗体染色的具有代表性的免疫组化图像。比例尺,150 μm。gydF4y2BacgydF4y2Ba样本免疫组化定量结果的统计分析gydF4y2BabgydF4y2Ba(gydF4y2BangydF4y2Ba=每组5只)。gydF4y2BadgydF4y2Ba流式细胞术分析CD45细胞中MHC-II、iNOS、CD86、精氨酸酶1和CD206的表达gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba第17天肿瘤巨噬细胞(gydF4y2BangydF4y2Ba=每组5只)。gydF4y2BaegydF4y2BaHOS细胞在小鼠体内的肿瘤生长(gydF4y2BangydF4y2Ba=每组5只)。腹腔注射阿霉素(DOX),静脉注射脂质体和BCH。在指定的时间点测量肿瘤体积。gydF4y2BafgydF4y2Ba图解模型显示化疗诱导的巨噬细胞上调的肿瘤细胞CD47表达。数据以平均值±标准差表示。ns不显著。*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001,双向方差分析(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba)或单因素方差分析(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).实验进行了三次,结果相似(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba).具体信息请参见源数据文件gydF4y2BaPgydF4y2Ba值。源数据作为源数据文件提供。gydF4y2Ba
考虑到BCH治疗后CD47蛋白水平的急剧下降(图。gydF4y2Ba7 gydF4y2Bae和gydF4y2Ba10 b, cgydF4y2Ba和补充图。gydF4y2Ba17摄氏度gydF4y2Ba),可以想象BCH的抗肿瘤效果将与CD47抗体治疗相当。正如预期的那样,动物研究表明BCH和CD47抗体治疗表现出相似水平的肿瘤生长抑制(补充图。gydF4y2Ba17 ggydF4y2Ba).此外,阿霉素联合CD47抗体治疗在骨肉瘤中诱导的抗癌效果与阿霉素联合BCH治疗诱导的效果相当(补充图。gydF4y2Ba17 ggydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
肿瘤是由多种细胞组成的异质复杂组织,其中免疫细胞在肿瘤发生中起着双重作用。细胞毒免疫细胞和吞噬免疫细胞是监测和消灭癌细胞的重要机制,这一点已经得到证实gydF4y2Ba16gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.化疗药物可通过诱导巨噬细胞上的“吃我”信号钙网蛋白,促进巨噬细胞介导的恶性细胞清除gydF4y2Ba21gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,巨噬细胞向抗肿瘤表型M1倾斜gydF4y2Ba7 gydF4y2Ba.然而,我们从人类患者和小鼠模型中获得的结果显示了化疗激活免疫反应的副作用。化疗激活肿瘤相关巨噬细胞分泌IL-18,进而诱导骨肉瘤细胞中LAT2的表达和LAT2介导的Gln和Leu的摄取。增强的Gln/Leu摄取刺激mTORC1/c-Myc信号的激活,以促进CD47的表达,导致骨肉瘤细胞巨噬细胞吞噬抑制(图。gydF4y2Ba10 fgydF4y2Ba).因此,我们揭示了化疗后骨肉瘤中CD47上调的调控机制,这导致了先天免疫逃逸,并与骨肉瘤患者的不良预后有关。我们的发现强调了免疫细胞在获得性耐化疗中的作用gydF4y2Ba27gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.在三阴性乳腺癌细胞中,化疗直接诱导缺氧诱导因子(HIF)依赖的CD47富集gydF4y2Ba9克ydF4y2Ba.然而,在骨肉瘤细胞中,HIF-1α和HIF-2α的表达水平在阿霉素治疗后没有明显增加(补充图。gydF4y2Ba18一个gydF4y2Ba),提示hif介导的信号通路在骨肉瘤中诱导CD47上调的作用不明显,调控CD47表达的机制可能与肿瘤类型相关。gydF4y2Ba
作为CD47/ sip α通路的关键部分,在阿霉素处理的HOS条件培养基(T-CM)中,thp -1来源的巨噬细胞和骨髓来源的巨噬细胞中的sip α表达没有被阿霉素明显上调gydF4y2Ba阿霉素gydF4y2Ba;补充图。gydF4y2Ba18 bgydF4y2Ba).然而,阿霉素治疗小鼠肿瘤相关巨噬细胞中SIRPα的表达增加(补充图。gydF4y2Ba18 cgydF4y2Ba),提示肿瘤微环境中巨噬细胞周围细胞分泌的可溶性因子增强了SIRPα的表达。这些结果也表明,肿瘤细胞中CD47表达的增强和肿瘤相关巨噬细胞中SIRPα的上调都在肿瘤免疫逃避中起作用,而阻断CD47的上调对阿霉素治疗的增敏有效。gydF4y2Ba
目前有两种靶向CD47的癌症治疗策略,包括中断CD47/SIRPα的结合和在转录、翻译和翻译后水平下调CD47的表达gydF4y2Ba44gydF4y2Ba.由于CD47在红细胞中的高表达,临床应用抗CD47抗体和CD47靶向SIRPα-Fc融合蛋白的主要副作用是由于CD47介导的红细胞吞噬导致贫血gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba.虽然设计新的抗体和给药策略可以在一定程度上减少副作用,但抗体是否能在有效性和安全性之间达到平衡,还需要在临床中进行验证。RRx-001抑制CD47转录,临床无明显的血液学或全身毒性,提示使用小分子抑制剂下调肿瘤CD47表达可避免血液学副作用gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.在这里,我们发现了一种以前未报道的通过抑制LAT2来减少CD47表达的治疗策略,并强调了LAT2小分子抑制剂(如BCH)在消除CD47介导的肿瘤逃避方面的潜力。gydF4y2Ba
胰腺癌中LAT2高表达与总生存率差相关gydF4y2Ba50gydF4y2Ba.此外,LAT2调节gln依赖性mTOR激活,降低胰腺癌化疗敏感性gydF4y2Ba50gydF4y2Ba.在本研究中,我们发现巨噬细胞分泌的IL-18上调了肿瘤细胞中LAT2,从而增强了Gln和Leu的摄取,从而上调CD47抑制巨噬细胞吞噬作用。肿瘤细胞中LAT2的缺失或抑制可解除il -18诱导的巨噬细胞吞噬抑制,提高抗肿瘤免疫。这一发现强调了LAT2在肿瘤微环境中细胞通讯和免疫细胞与肿瘤细胞相互调节中的作用。gydF4y2Ba
在许多癌症中,氨基酸的摄取和代谢异常上调,以满足肿瘤细胞快速生长和增殖的需求。因此,靶向氨基酸代谢正成为一种有吸引力的癌症治疗策略gydF4y2Ba23gydF4y2Ba.此外,越来越多的证据表明肿瘤氨基酸代谢与癌症免疫之间存在联系gydF4y2Ba51gydF4y2Ba.肿瘤细胞通过选择性转运体的高表达,在细胞外氨基酸方面胜过T细胞,从而损害T细胞的功能和肿瘤免疫gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba.Gln阻断剂诱导肿瘤代谢重编程,增强肿瘤特异性免疫,并与t细胞免疫检查点抑制剂治疗协同作用gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.在本研究中,我们观察到骨肉瘤细胞的巨噬细胞吞噬能力因Gln和Leu缺失而增加,揭示了氨基酸在巨噬细胞介导的肿瘤免疫中的作用。gydF4y2Ba
LAT2在肿瘤相关巨噬细胞中的表达远低于骨肉瘤组织中的肿瘤细胞(补充图。gydF4y2Ba18 dgydF4y2Ba).肿瘤相关巨噬细胞中几乎检测不到LAT2的表达,提示BCH对巨噬细胞的影响是最小的。一致地,BCH治疗不直接影响体外肿瘤细胞的巨噬细胞吞噬(补充图。gydF4y2Ba18 egydF4y2Ba).这些结果提示BCH治疗对巨噬细胞的功能没有明显的直接改变。gydF4y2Ba
总之,我们揭示了化疗诱导的巨噬细胞吞噬抑制的关键机制,这是由il -18诱导的和lat2依赖的CD47上调介导的。这一调节使癌细胞免疫逃逸。抑制lat2介导的骨肉瘤细胞中CD47的上调可增强巨噬细胞的吞噬作用,使肿瘤细胞对化疗增敏。因此,这些发现在概念上促进了我们对化疗耐药机制的理解,并提供了一种吸引人的方法使癌细胞对化疗敏感。gydF4y2Ba
方法gydF4y2Ba
我们的研究符合所有相关的道德规范。人体研究获浙江大学医学院第二附属医院人体研究伦理委员会批准。动物研究获中国农科院动物伦理委员会批准(2018-009)。gydF4y2Ba
人骨肉瘤组织样本gydF4y2Ba
本研究纳入了2006年至2014年间在华南农业大学骨科肌肉骨骼肿瘤中心确诊的骨肉瘤患者进行免疫组化分析。这些患者接受了由阿霉素、顺铂和大剂量甲氨蝶呤组成的化疗方案,其中一些患者还接受了异环磷酰胺。收集化疗前后福尔马林固定、石蜡包埋的骨肉瘤组织块。详细的IHC程序描述如下。在人体组织切片中含有出血和明显坏死的区域排除在病理分析之外。184例患者纳入最终分析,其中103例为化疗前标本,81例为化疗前后配对标本。所有患者的临床特征汇总于补充表gydF4y2Ba2 gydF4y2Ba.所有患者均获得书面知情同意。没有参与者补偿。gydF4y2Ba
抗体gydF4y2Ba
本研究中使用的所有抗体的信息见补充表gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
氨基酸培养基的制备gydF4y2Ba
为了研究氨基酸饥饿和补食对肿瘤细胞的直接影响,制备了氨基酸缺乏和充足的培养基。无氨基酸(AA−)培养基采用杜尔贝科改性鹰培养基(DMEM)粉末制备(D9800-27,美国生物生命科学),gydF4y2BadgydF4y2Ba-葡萄糖(4.5 g/L,与市售DMEM浓度相同)和碳酸氢钠(3.7 g/L,与市售DMEM浓度相同),并添加10%胎牛血清(FBS)。通过在AA -培养基中添加适当的氨基酸,制备氨基酸充足(AA+)培养基,使其氨基酸组成和含量与市售DMEM相同。含有单一氨基酸(Gln或Leu)的培养基由AA -培养基中加入与AA+培养基中相同浓度的单个氨基酸制备而成。缺乏单一氨基酸(Gln或Leu)或其组合(Gln和Leu)的培养基通过向AA -培养基中添加氨基酸来制备,不包括单个氨基酸(氨基酸组成和含量与AA+培养基相同)。本研究所用氨基酸见补充表gydF4y2Ba4 gydF4y2Ba.gydF4y2Ba
条件培养基的制备gydF4y2Ba
用DMSO或1 μM阿霉素(S1208, Selleck Chemicals)处理HOS细胞24 h。再用无血清培养基更换上清24小时,收集肿瘤条件培养基。用320 nM的PMA处理THP-1细胞;P1585, Sigma) 6 h后获得巨噬细胞。实验前,将去除thp -1的巨噬细胞血清饥饿4小时,在肿瘤条件培养基存在的情况下用DMSO或阿霉素处理。24小时后,将培养上清替换为无血清培养基,收集肿瘤相关巨噬细胞条件培养基24小时。gydF4y2Ba
细胞培养与刺激gydF4y2Ba
人骨肉瘤细胞系U-2 OS (SCSP-5030)、MG63 (TCHu124)、MNNG/HOS (TCHu167;人成骨细胞细胞系hFOB1.19 (GNHu14)、人单核细胞细胞系THP-1 (TCHu 57)和人胚胎肾细胞系293T (GNHu17)均取自中国科学院《细胞集》。人骨肉瘤细胞系143B (CRL-8303)来自美国类型培养集合。人骨肉瘤细胞系SJSA-1 (GDC0257)来源于中国类型培养中心。常规检查所有细胞系支原体污染,并用DNA短串联重复基因分型进行鉴定。293T、MG63、HOS和143B细胞在含10%胎牛血清和5% CO的DMEM中培养gydF4y2Ba2 gydF4y2BaU-2 OS、SJSA-1和THP-1细胞培养在RPMI 1640培养基中,hFOB1.19细胞培养在DMEM/F-12培养基中。gydF4y2Ba
标准氨基酸饥饿,肿瘤细胞培养在无氨基酸培养基。标准饥饿时间为3小时,除非另有说明。当需要时,将细胞上清液替换为含有单一氨基酸(Gln或Leu)的培养基21小时。在单一氨基酸或多种氨基酸饥饿条件下,将细胞在缺乏单一氨基酸(Gln或Leu)或其组合(Gln和Leu)的培养基中培养24 h。人IL-18 (40 ng/ml;生物原),人IL-1α (40 ng/ml;PeproTech),人类CXCL12 (40 ng/ml;PeproTech)或小鼠IL-18 (40 ng/ml;PeproTech)治疗后,在指示时间点细胞因子刺激前,细胞被血清饥饿4小时。抑制剂,包括10058-F4 (100 μM; Selleck Chemicals), rapamycin (25 nM; Selleck Chemicals) and 2-amino-2-norbornanecarboxylic acid (BCH; 25 mM; Sigma-Aldrich) were added 1 h prior to cytokine stimulation. The macrophage-conditioned medium was used to stimulate tumor cells that were serum-starved for 4 h prior to conditioned medium exposure. IL-18BP (2.5 μg/ml; PeproTech) was added into macrophage-conditioned medium 1 h prior to conditioned medium stimulation to neutralize IL-18.
巨噬细胞与骨肉瘤细胞的共培养gydF4y2Ba
直接共培养:1 × 10gydF4y2Ba6克ydF4y2Ba将THP-1细胞接种到六孔板中,经PMA极化为上述巨噬细胞。彻底清洗后,取3 × 10gydF4y2Ba5gydF4y2BaHOS细胞在同一培养孔中加入指定时间。gydF4y2Ba
间接共培养:1 × 10gydF4y2Ba6克ydF4y2Ba将THP-1细胞接种到六孔transwell装置(0.4 μm孔径,BD Biosciences)的上部插入物中,经PMA极化为上述巨噬细胞。彻底清洗后,巨噬细胞与3 × 10共培养gydF4y2Ba5gydF4y2Ba六孔板的HOS细胞指示时间。gydF4y2Ba
蛋白质组分析器人体细胞因子阵列试验gydF4y2Ba
M-CM中的细胞因子和趋化因子gydF4y2BaDMSO / DMSO溶液gydF4y2Ba或M-CMgydF4y2Ba阿霉素和强力霉素gydF4y2Ba根据蛋白质组分析器人类细胞因子阵列试剂盒(ARY005B, R&D Systems)的协议进行测量。使用超灵敏的荧光/化学发光成像系统Chemi Scope 6300 (CLiNX科学仪器,上海,中国)对靶向蛋白进行可视化。gydF4y2Ba
使用慢病毒感染产生稳定细胞gydF4y2Ba
用于敲除人类LAT2表达的慢病毒shRNA (pHBLV-shLAT2)购自瀚恒生物科技(上海,中国)。成熟的反义序列为5 ' -CCAATGTCGCTTATGTCACTGCAAT-3 '。含慢病毒的靶向人MYC shRNA (pGMLV-shMYC)购自genome editech(中国上海)。成熟的反义序列为5 ' - GGAAGAAATCGATGTTGTTTC-3 '。IL18R1 shRNA质粒(pGV248-shIL18R1)和IL18 shRNA质粒(pGV248-shIL18)购自genchemhem (Shanghai, China)。成熟的反义序列分别为5 ' -ACGTCTTCACAAGAGGAAT-3 '和5 ' - tcctgataacatcaaggaat -3 '。pGV248-shIL18R1或pGV248-shIL18与慢病毒包装质粒共转染293T细胞,使用Hieff反式脂质体转染试剂(YEASEN;中国上海),分别。对于HOS细胞中LAT2、MYC或IL18R1的敲除,我们用携带pHBLV-shLAT2、pGMLV-shMYC或pGV248-shIL18R1的慢病毒分别用7 μg/ml聚苯乙烯(H9268, Sigma)感染HOS细胞。对于IL-18敲除THP-1细胞,我们用携带pGV248-shIL18的慢病毒(8 μg/ml聚苯乙烯)感染THP-1细胞。 After infection for 24 h, the medium was replaced with fresh medium, and 3 or 1 µg/ml puromycin (A1113802, Gibco) was used to select infected HOS cells or THP-1 cells, respectively. Lentivirus with noneffective shRNA (pHBLV-shCtrl, pGMLV-shCtrl, pGV248-shCtrl) provided by the manufacturer was used during the knockdown study as a control. The antisense sequence was 5’-TTCTCCGAACGTGTCACGT-3’.
将人MYC的编码序列克隆到表达载体pGMLV (genome editech, Shanghai, China)中。将质粒(MYC,或空对照)转染293T细胞,用含慢病毒的培养基上清液用7 μg/ml聚苯醚感染HOS细胞。感染细胞采用嘌呤霉素(3µg/ml)法筛选。我们构建了GFP表达(GFPgydF4y2Ba+gydF4y2Ba) HOS细胞使用相同的方法。gydF4y2Ba
细胞内氨基酸含量的测定gydF4y2Ba
用提取液(乙腈:甲醇= 1:1,含同位素标记内标混合物)从HOS细胞中提取代谢物。配制了标准溶液。采用安捷伦1290 Infinity II系列超高效液相色谱(UHPLC)系统(Agilent Technologies),配备Waters ACQUITY UPLC BEH Amide柱,进行UHPLC分离。质谱分析使用Agilent 6460三四极质谱仪(Agilent Technologies)进行,配备AJS电喷雾电离(AJS- esi)接口。使用Agilent MassHunter工作站软件(B.08.00, Agilent Technologies)进行目标氨基酸的数据采集和定量。最终氨基酸浓度归一化为总蛋白质含量(补充数据gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2 gydF4y2Ba).gydF4y2Ba
定量实时聚合酶链反应gydF4y2Ba
用RNAiso试剂(Takara)提取总RNA。使用cDNA合成试剂盒(Takara)实现反转录。用基因特异性引物和SYBR预混物Ex Taq测定mRNA水平gydF4y2BaTMgydF4y2Ba包(豆类)。数据采集采用Real-Time PCR软件(2.4版本)。表达结果归一化至β-actin水平。Primers来自PrimerBankgydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba或从OriGene购买,详见补充表gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
免疫印迹gydF4y2Ba
使用RIPA裂解缓冲液(89901,赛默飞世尔科学)添加蛋白酶抑制剂(78438,赛默飞世尔科学)和磷酸酶抑制剂(78420,赛默飞世尔科学)获得总细胞蛋白提取物。用BCA蛋白检测试剂盒(23227,赛默飞世尔科学公司)检测提取的蛋白质样本的浓度。等量的蛋白质提取物用SDS‐PAGE分离,然后电印迹到聚偏二氟乙烯膜(ISEQ00010,默克Millipore)上,然后用5%牛血清白蛋白(BSA)阻断1小时,并与一抗(如所示)在4℃下孵育过夜。第二天,清洗膜,与适当的酶联二抗在4℃孵育2小时。使用Bio‐Rad XRS化学发光检测系统(数量一软件v4.6.9)或Amersham检测免疫反应带gydF4y2BaTMgydF4y2BaImageQuantgydF4y2BaTMgydF4y2Ba800 Western Blot成像系统(ImageQuant 800 Control软件v2.0.0)。gydF4y2Ba
酶联免疫吸附试验(ELISA)gydF4y2Ba
使用ELISA检测试剂盒(ab216165, Abcam)检测小鼠肿瘤组织匀浆中IL-18的含量,使用ELISA检测试剂盒(ab215539, Abcam)根据制造商说明检测巨噬细胞条件培养基中IL-18的含量。采用SoftMax Pro v7.1软件进行数据采集。gydF4y2Ba
流式细胞术和荧光激活细胞分选(FACS)gydF4y2Ba
用刀片机械切割肿瘤,然后在添加IV型胶原酶的RPMI 1640培养基(2mg /ml;Sigma), DNase (0.1 mg/ml;Sigma),透明质酸酶(0.1 mg/ml;Sigma)和BSA (2 mg/ml;σ)。为了获得单细胞,细胞悬浮液通过100 μm过滤器。用细胞刮刀收集附着在培养板上的细胞。表面蛋白染色,细胞与抗体在室温下孵育20分钟。细胞内蛋白染色:用Fix/Perm溶液(BD Biosciences)固定细胞,然后用Perm/Wash缓冲液(BD Biosciences)清洗细胞,在室温下黑暗环境下细胞内染色20分钟。对于流式细胞术分析的活/死区分,用Zombie Aqua™固定活力试剂盒(Biolegend)或Zombie UV™固定活力试剂盒(Biolegend)对细胞进行染色。 Flow cytometry analyses were performed using Beckman Coulter CytoFLEX LX and CytExpert v2.4 software, and flow data were analyzed using FlowJo v10. For FACS, Beckman MoFlo Astrios EQs and Summit v6.3.1 software were used.
免疫荧光(IF)和免疫组化gydF4y2Ba
IF染色时,细胞镀于24孔板,用磷酸盐缓冲盐水(PBS)冲洗,在4%甲醛中室温固定15分钟,然后在0.05% Triton X-100在PBS中渗透10分钟,然后在室温下10% BSA阻塞20分钟。细胞在4°C含抗体的阻断缓冲液中孵育过夜。PBS冲洗细胞,室温下与Alexa Fluor 555标记的驴抗兔IgG孵育2 h。用PBS冲洗细胞,用显微镜(DMi8,徕卡)捕捉高分辨率图像。gydF4y2Ba
免疫组化染色时,将福尔马林固定的石蜡包埋的人骨肉瘤组织或小鼠异种移植瘤标本切成5 μm厚的连续切片,在4℃下与抗体孵育过夜。然后用酶标二抗孵育,DAB显像,苏木精反染。图像采集使用显微镜(徕卡)和徕卡应用套件X v3.7.4软件。gydF4y2Ba
在随机选择的5个视野中进行免疫组化分析。利用ImageJ(1.8.0版本)软件量化阳性染色细胞百分比,计算CD47、LAT2、HIF-1α或HIF-2α的半定量组织学评分(H-score)。对于IL-18, h评分通过估计阳性染色区域的百分比来计算。染色强度评分从1到3。最终H-score计算公式为:H-score =(低%)× 1 +(中%)× 2 +(高%)× 3。根据各个显微镜视野的阳性染色计数CD14、F4/80、CD86、iNOS或CD206阳性细胞。利用X-Tile软件确定Kaplan-Meier分析人骨肉瘤标本h评分的最佳临界值gydF4y2Ba58gydF4y2Ba.gydF4y2Ba
骨髓源性巨噬细胞的分离gydF4y2Ba
用PBS将8周大的BALB/c母鼠长骨中的骨髓细胞冲洗出来。分离后,细胞经红细胞裂解(BD Bioscience)去除红细胞,在添加10%胎牛血清(FBS)、1%青霉素/链霉素和50 ng/ml CSF1 (Novoprotein)的RPMI 1640培养基中培养7天。gydF4y2Ba
吞噬作用分析gydF4y2Ba
实验前24小时,将骨髓来源的巨噬细胞置于24孔组织培养板中,培养皿中加入添加50 ng/ml CSF1 (Novoprotein)的完整RPMI 1640培养基。将HOS细胞悬浮于PBS (5 μ M工作液)中,37℃光下20分钟,用含FBS的原染色量的5倍冲洗2次,然后共培养,使HOS细胞稳定表达GFP或用CFSE(生物素)标记。巨噬细胞血清饥饿2小时后加入GFPgydF4y2Ba+gydF4y2Ba或CSFEgydF4y2Ba+gydF4y2BaHOS细胞。按图例中所示的方法处理HOS细胞。巨噬细胞和肿瘤细胞在37°C共培养4 h。共培养过程中按图例添加抗cd47抗体和对照大鼠IgG抗体(Bio X细胞)。在流式细胞术的吞噬实验中,巨噬细胞与HOS细胞的比例为1:4。共培养后采集细胞,用PE-conjugated F4/80 (Biolegend)染色,鉴定巨噬细胞,流式细胞仪检测。吞噬率测定为GFP之和gydF4y2Ba+gydF4y2Ba或CSFEgydF4y2Ba+gydF4y2Ba巨噬细胞占总巨噬细胞的百分比。在免疫荧光吞噬实验中,巨噬细胞与等量的GFP共培养gydF4y2Ba+gydF4y2BaHOS细胞。然后,如前所述,将全部细胞与pe偶联的F4/80孵育,随后使用荧光显微镜(DMi8, Leica)成像。肿瘤吞噬率以吞噬GFP阳性的巨噬细胞的百分比来评估gydF4y2Ba+gydF4y2Ba细胞。gydF4y2Ba
体内实验gydF4y2Ba
小鼠被安置在21±2°C, 12小时暗光循环,免费饮水和辐照食物。房屋环境无病原体,湿度在45 - 65%之间。所有使用BALB/c裸鼠的实验过程均按照中华农学院动物伦理委员会批准的指导方针进行。最大肿瘤大小(1500毫米)gydF4y2Ba3.gydF4y2Ba)的道德委员会所允许的。5周龄BALB/c雌性裸鼠,每只皮下注射2 × 10gydF4y2Ba6克ydF4y2BaHOS细胞,GFPgydF4y2Ba+gydF4y2BaHOS细胞、shCtrl HOS细胞、shLAT2和shIL18R1 HOS细胞悬浮于100 μl PBS中第0天。2周后按小鼠平均肿瘤体积分组治疗。阿霉素(5毫克/公斤;Selleck Chemicals)和顺铂(6 mg/kg;Selleck Chemicals)静脉注射四次,每2天,除非另有说明。异环磷酰胺(240毫克/公斤;Selleck Chemicals)和甲氨蝶呤二钠(240 mg/kg, Selleck Chemicals)静脉给药3次,每4天。为了降低甲氨蝶呤二钠的毒性,叶酸(50 mg/kg;Selleck Chemicals)在每剂量甲氨蝶呤二钠24 h后腹腔给药。在IL-18中和试验中,小鼠IL-18BP (25 μg/kg; 122-BP, RD Systems) or normal saline was intratumorally injected for two cycles, with three days per cycle and a two-day interval between cycles. Mouse IL-18BP injection was initiated 1 day prior to first doxorubicin treatment. For macrophage depletion, 200 μL clodronate liposomes (Liposoma B.V.) or PBS liposomes (Liposoma B.V.) were administered through the caudal vein 3 days prior to tumor injection and every 4 days (seven times in total). BCH was administered intravenously at 200 mg/kg per mouse the day after the first doxorubicin treatment, then every 2 days, four times. Intraperitoneal injections of CD47 mAb (Bio X cell) at a dose of 10 mg/kg was initiated the day after the first doxorubicin treatment, then every 2 days for four times. 2 × 106克ydF4y2BaSJSA-1细胞,GFPgydF4y2Ba+gydF4y2Ba第0天皮下注射SJSA-1细胞、shCtrl SJSA-1细胞和shIL18R1 SJSA-1细胞。肿瘤生长2周后腹腔注射阿霉素(5 mg/kg) 5次/ 3天。在第一次阿霉素治疗后静脉注射BCH (200 mg/kg),然后每2天静脉注射BCH 7次。氯膦酸酯脂质体于肿瘤注射前3天经尾静脉给药,每4天给药,共9次。在指定的时间测量肿瘤,用π/6 ×长×宽公式计算肿瘤体积gydF4y2Ba2 gydF4y2Ba.gydF4y2Ba
GEO和TARGET数据分析gydF4y2Ba
本研究的结果部分来自TARGET和GEO数据集:GSE21257、GSE30699、GSE33382和GSE152048的数据分析。使用GSEA软件进行GSEAgydF4y2Ba59gydF4y2Ba.CIBERSORT用于估计混合免疫细胞群中M1巨噬细胞的丰度gydF4y2Ba60gydF4y2Ba.对于单细胞分析,数据集成、细胞聚类和注释的主要处理步骤是使用基于r的包Seurat执行的gydF4y2Ba61gydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
使用GraphPad Prism(版本7)、Medcalc(版本19)或统计产品和服务解决方案(SPSS;版本23)统计软件。的值gydF4y2BaPgydF4y2Ba< 0.05为差异有统计学意义。数据中的所有错误条表示SD。使用Kaplan-Meier方法进行生存估计,使用log-rank检验计算统计差异。相关分析采用Pearson相关检验。未配对或成对的双尾学生gydF4y2BatgydF4y2Ba用检验比较两组间的差异。采用单因素方差分析和Tukey多重比较检验来比较多组间的差异。采用双向方差分析和Tukey多重比较检验比较肿瘤生长曲线之间的差异。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
图中使用的公开数据。gydF4y2Ba6 a、bgydF4y2Ba和补充图。gydF4y2Ba6gydF4y2Ba在GEO数据库中是否有登录号gydF4y2BaGSE152048gydF4y2Ba.图中使用的公开数据。gydF4y2Ba6 c, dgydF4y2Ba和补充无花果。gydF4y2Ba2 pgydF4y2Ba而且gydF4y2Ba7一个gydF4y2Ba由TARGET [gydF4y2Bahttps://ocg.cancer.gov/programs/targetgydF4y2Ba]计划,phs000468,其他数据可在gydF4y2Bahttps://portal.gdc.cancer.gov/projectsgydF4y2Ba.图中使用的公开数据。gydF4y2Ba6 egydF4y2Ba和补充图。gydF4y2Ba4gydF4y2Ba在GEO数据库中是否有登录号gydF4y2BaGSE21257gydF4y2Ba,gydF4y2BaGSE30699gydF4y2Ba,gydF4y2BaGSE33382gydF4y2Ba.补充图中使用的公开数据。gydF4y2Ba2 n, ogydF4y2Ba在GEO数据库中是否有登录号gydF4y2BaGSE30699gydF4y2Ba.其余数据在文章中,gydF4y2Ba补充信息gydF4y2Ba或源数据文件。gydF4y2Ba源数据gydF4y2Ba都提供了这张纸。gydF4y2Ba
参考文献gydF4y2Ba
邓明伟,邓明伟,张志强,张志强,张志强。骨肉瘤的翻译生物学研究。gydF4y2BaNat。启癌症gydF4y2Ba14gydF4y2Ba, 722 - 735(2014)。gydF4y2Ba
Isakoff, m.s., Bielack, s.s., Meltzer, P. & Gorlick, R.骨肉瘤:当前的治疗和合作的成功途径。gydF4y2Baj .中国。肿瘤防治杂志。gydF4y2Ba33gydF4y2Ba, 3029 - 3035(2015)。gydF4y2Ba
廖,y。et al。靶向自噬是克服骨肉瘤耐药和减少骨肉瘤转移的一种很有前途的治疗策略。gydF4y2BaInt。j .杂志。gydF4y2Ba55gydF4y2Ba, 1213 - 1222(2019)。gydF4y2Ba
骨肉瘤治疗疗效和耐药的靶向分子机制:当前和未来策略综述。gydF4y2BaInt。j·摩尔。科学gydF4y2Ba.gydF4y2Ba21gydF4y2Ba6885(2020)。gydF4y2Ba
加耶夫斯基,T. F.,施赖伯,H. & Fu, Y.-X。肿瘤微环境中的先天和适应性免疫细胞。gydF4y2BaImmunol Nat。gydF4y2Ba14gydF4y2Ba, 1014 - 1022(2013)。gydF4y2Ba
韦斯利,医学博士,克肖,m.h.,施赖伯,r.d.和史密斯,m.j.对癌症的天然先天和适应性免疫。gydF4y2Ba为基础。启Immunol。gydF4y2Ba29gydF4y2Ba, 235 - 271(2011)。gydF4y2Ba
Bracci, L., Schiavoni, G., Sistigu, A.和Belardelli, F.细胞毒性化疗的免疫机制:设计新颖和合理的癌症联合治疗的意义。gydF4y2Ba细胞死亡是不同的。gydF4y2Ba21gydF4y2Ba15 - 25(2014)。gydF4y2Ba
张鹏,苏德明,张德明。,Liang, M. & Fu, J. Chemopreventive agents induce programmed death-1-ligand 1 (PD-L1) surface expression in breast cancer cells and promote PD-L1-mediated T cell apoptosis.摩尔。Immunol。gydF4y2Ba45gydF4y2Ba, 1470 - 1476(2008)。gydF4y2Ba
萨曼塔,d等人。化疗诱导CD47/CD73/PDL1免疫逃避型三阴性乳腺癌细胞富集。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba115gydF4y2BaE1239-E1248(2018)。gydF4y2Ba
牛,J.等。利用生物信息学策略识别骨肉瘤潜在治疗靶点和免疫细胞浸润特征。gydF4y2Ba前面。肿瘤防治杂志。gydF4y2Ba10gydF4y2Ba1628(2020)。gydF4y2Ba
周勇等。晚期骨肉瘤瘤内异质性和免疫抑制微环境的单细胞RNA景观。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba6322(2020)。gydF4y2Ba
巨噬细胞与癌症的治疗耐药。gydF4y2Ba癌症细胞gydF4y2Ba27gydF4y2Ba, 462 - 472(2015)。gydF4y2Ba
Buddingh, E. P.等。肿瘤浸润性巨噬细胞与高级别骨肉瘤的转移抑制相关:巨噬细胞激活剂治疗的一个基本原理。gydF4y2Ba中国。癌症Res。gydF4y2Ba17 gydF4y2Ba, 2110 - 2119(2011)。gydF4y2Ba
Gomez-Brouchet, A.等。cd163阳性肿瘤相关巨噬细胞和cd8阳性细胞毒性淋巴细胞是骨肉瘤患者治疗分层的有力诊断标志物:对法国OS2006 3期试验活检的免疫组化分析gydF4y2BaOncoimmunologygydF4y2Ba6克ydF4y2Bae1331193(2017)。gydF4y2Ba
Han, Y.等。肿瘤相关巨噬细胞通过激活COX-2/STAT3轴促进骨肉瘤的肺转移和诱导上皮-间质转变。gydF4y2Ba癌症。gydF4y2Ba440 - 441gydF4y2Ba, 116 - 125(2019)。gydF4y2Ba
冯,M.等。吞噬检查点成为癌症免疫治疗的新靶点。gydF4y2BaNat。启癌症gydF4y2Ba19gydF4y2Ba, 568 - 586(2019)。gydF4y2Ba
莫汉蒂,S.等。纳米粒子增强MRI可以监测骨肉瘤巨噬细胞对CD47单抗免疫治疗的反应。gydF4y2Ba细胞死亡说。gydF4y2Ba10gydF4y2Ba36(2019)。gydF4y2Ba
吉尔,J. & Gorlick, R.推进骨肉瘤的治疗。gydF4y2BaNat,启中国。肿瘤防治杂志。gydF4y2Ba18gydF4y2Ba, 609 - 624(2021)。gydF4y2Ba
Dancsok, A. R.等。肿瘤相关巨噬细胞和巨噬细胞相关免疫检查点在肉瘤中的表达gydF4y2BaOncoimmunologygydF4y2Ba9克ydF4y2Ba, 1747340(2020)。gydF4y2Ba
徐,肯尼迪。et al。CD47阻断剂抑制异种骨移植模型中人骨肉瘤的肿瘤进展。gydF4y2BaOncotargetgydF4y2Ba6克ydF4y2Ba, 23662 - 23670(2015)。gydF4y2Ba
Mohanty, S., Aghighi, M., Yerneni, K., Theruvath, J. L.和Daldrup-Link, H. E.提高骨肉瘤治疗的疗效:联合药物关闭癌细胞“不要吃我”信号和打开癌细胞“吃我”信号。gydF4y2Ba摩尔。杂志。gydF4y2Ba13克ydF4y2Ba, 2049 - 2061(2019)。gydF4y2Ba
安塞尔,s.m.等。CD47阻滞剂TTI-621在复发或难治性恶性血液病患者中的I期研究。gydF4y2Ba中国。癌症Res。gydF4y2Ba27gydF4y2Ba, 2190 - 2199(2021)。gydF4y2Ba
氨基酸转运蛋白的研究进展:健康与疾病研究的新观点。gydF4y2Ba趋势生物化学科学。gydF4y2Ba43gydF4y2Ba, 752 - 789(2018)。gydF4y2Ba
Bröer, s作为癌症治疗靶点的氨基酸转运蛋白:为什么,哪里,何时,如何。gydF4y2BaInt。j·摩尔。科学gydF4y2Ba.gydF4y2Ba21gydF4y2Ba6156(2020)。gydF4y2Ba
l型氨基酸转运与癌症:靶向mTORC1通路抑制肿瘤形成。gydF4y2Ba点。j .癌症Res。gydF4y2Ba5gydF4y2Ba, 1281 - 1294(2015)。gydF4y2Ba
无疑,>。et al。非小细胞肺癌放化疗后PD-L1表达和CD8 T细胞浸润的动态变化gydF4y2Ba肺癌gydF4y2Ba136gydF4y2Ba30-36(2019)。gydF4y2Ba
萨迪克等人。IL4I1是一种代谢免疫检查点,可激活AHR并促进肿瘤进展。gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 1252 - 1270(2020)。gydF4y2Ba
陈杰等。接受同步放化疗的宫颈癌患者中ifn介导反应和肿瘤免疫原性的异质性。gydF4y2Ba中国。癌症Res。gydF4y2Ba27gydF4y2Ba, 3990 - 4002(2021)。gydF4y2Ba
吉尔,J. & Gorlick, R.推进骨肉瘤的治疗。gydF4y2BaNat,启中国。肿瘤防治杂志。gydF4y2Ba18gydF4y2Ba, 609 - 624(2021)。gydF4y2Ba
田凯,齐伟,颜庆庆,吕明,宋东。糖酵解免疫相关基因构建的信号位点可以预测骨肉瘤患者的预后。gydF4y2BaInvestig。联合国毒品gydF4y2Ba40gydF4y2Ba, 818 - 830(2022)。gydF4y2Ba
Mantovani, A., Marchesi, F., Malesci, A., Laghi, L. & Allavena, P.肿瘤相关巨噬细胞作为肿瘤治疗靶点。gydF4y2BaNat,启中国。肿瘤防治杂志。gydF4y2Ba14gydF4y2Ba, 399 - 416(2017)。gydF4y2Ba
诺维克等人。白细胞介素-18结合蛋白:Th1细胞因子反应的一种新型调节剂。gydF4y2Ba免疫力gydF4y2Ba10gydF4y2Ba, 127 - 136(1999)。gydF4y2Ba
Kim, S. H.等。IL-18结合蛋白六种自然存在的异构体的结构要求抑制IL-18。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba97gydF4y2Ba, 1190 - 1195(2000)。gydF4y2Ba
Terme, M.等。癌症诱导的免疫抑制:il -18诱导的免疫消融NK细胞。gydF4y2Ba癌症Res。gydF4y2Ba72gydF4y2Ba, 2757 - 2767(2012)。gydF4y2Ba
Almutairi, s.m.等人。白介素-18上调氨基酸转运蛋白,促进自然杀伤细胞中氨基酸诱导的mTORC1激活。gydF4y2Ba生物。化学。gydF4y2Ba294gydF4y2Ba, 4644 - 4655(2019)。gydF4y2Ba
Mossmann, D., Park, S. & Hall, M. N. mTOR信号和细胞代谢在癌症中是相互决定的。gydF4y2BaNat。启癌症gydF4y2Ba18gydF4y2Ba, 744 - 757(2018)。gydF4y2Ba
Durán, R. V.等。谷氨酰胺水解激活Rag-mTORC1信号。gydF4y2Ba摩尔。细胞gydF4y2Ba47gydF4y2Ba, 349 - 358(2012)。gydF4y2Ba
凯西,s.c.等人。MYC通过CD47和PD-L1调节抗肿瘤免疫反应。gydF4y2Ba科学gydF4y2Ba352gydF4y2Ba, 227 - 231(2016)。gydF4y2Ba
Loftus, R. M.等。氨基酸依赖性的cMyc表达对小鼠NK细胞代谢和功能反应至关重要。gydF4y2BaCommun Nat。gydF4y2Ba9克ydF4y2Ba2341(2018)。gydF4y2Ba
沃尔德曼,A. D.弗里茨,J. M.和勒纳多,M. J.癌症免疫治疗指南:从T细胞基础科学到临床实践。gydF4y2Ba启Immunol Nat。gydF4y2Ba20.gydF4y2Ba, 651 - 668(2020)。gydF4y2Ba
von Roemeling, C. A.等人。治疗性调节胶质母细胞瘤的吞噬作用可以激活先天和适应性抗肿瘤免疫。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba1508(2020)。gydF4y2Ba
Alspach, E, Lussier, D. M. & Schreiber, R. D.干扰素γ及其在促进和抑制自发和治疗性癌症免疫中的重要作用。gydF4y2Ba冷泉哈布。教谕。医学杂志gydF4y2Ba.gydF4y2Ba11gydF4y2Baa028480(2019)。gydF4y2Ba
Abiko, K.等。肿瘤细胞上的PD-L1在腹水中被诱导,并通过CTL功能障碍促进卵巢癌的腹膜扩散。gydF4y2Ba中国。癌症Res。gydF4y2Ba19gydF4y2Ba, 1363 - 1374(2013)。gydF4y2Ba
Yu W.-B。,Ye, Z.-H., Chen, X., Shi, J.-J. & Lu, J.-J. The development of small-molecule inhibitors targeting CD47.药物。今天gydF4y2Ba26gydF4y2Ba, 561 - 568(2021)。gydF4y2Ba
Sikic, b.i.等。抗cd47抗体Hu5F9-G4在晚期癌症患者中的首次人体I期临床试验。gydF4y2Baj .中国。肿瘤防治杂志。gydF4y2Ba37gydF4y2Ba, 946 - 953(2019)。gydF4y2Ba
奥尔登堡,P. A.等。CD47在红细胞上作为自我标记的作用。gydF4y2Ba科学gydF4y2Ba288gydF4y2Ba, 2051 - 2054(2000)。gydF4y2Ba
阿德瓦尼等人。Hu5F9-G4和利妥昔单抗对非霍奇金淋巴瘤CD47的阻断作用。gydF4y2Ba心血管病。j .地中海gydF4y2Ba379gydF4y2Ba, 1711 - 1721(2018)。gydF4y2Ba
Cabrales, P. RRx-001作为一种双小分子检查点抑制剂,通过下调癌细胞上的CD47和单核/巨噬细胞上的SIRP-α。gydF4y2BaTransl。肿瘤防治杂志。gydF4y2Ba12克ydF4y2Ba, 626 - 632(2019)。gydF4y2Ba
Oronsky, B.等。RRx-001是CD47- SIRPα检查点通路的下调因子,不会引起贫血或血小板减少。gydF4y2Ba当今专家。药物金属底座。ToxicolgydF4y2Ba.gydF4y2Ba17 gydF4y2Ba, 355 - 357(2021)。gydF4y2Ba
冯,M.等。LAT2调节谷氨酰胺依赖性mTOR激活,促进胰腺癌糖酵解和化疗耐药。gydF4y2Baj . Exp。中国。癌症Res: CRgydF4y2Ba37gydF4y2Ba274(2018)。gydF4y2Ba
王伟,邹伟。氨基酸及其转运蛋白在T细胞免疫和癌症治疗中的作用。gydF4y2Ba摩尔。细胞gydF4y2Ba80gydF4y2Ba, 384 - 395(2020)。gydF4y2Ba
卞,杨,等。癌症SLC43A2改变了T细胞的蛋氨酸代谢和组蛋白甲基化。gydF4y2Ba自然gydF4y2Ba585gydF4y2Ba, 277 - 282(2020)。gydF4y2Ba
里昂,r。d。等人。谷氨酰胺阻断诱导不同代谢程序克服肿瘤免疫逃避。gydF4y2Ba科学gydF4y2Ba366gydF4y2Ba, 1013 - 1021(2019)。gydF4y2Ba
Byun, j。et al。抑制谷氨酰胺利用与免疫检查点抑制剂协同作用,促进抗肿瘤免疫。gydF4y2Ba摩尔。细胞gydF4y2Ba80gydF4y2Ba, 592 - 606(2020)。gydF4y2Ba
Spandidos, A., Wang, X., Wang H. & Seed, B. PrimerBank:用于基因表达检测和定量的人类和小鼠PCR引物对资源。gydF4y2Ba核酸Res。gydF4y2Ba38gydF4y2BaD792-D799(2010)。gydF4y2Ba
斯潘迪多斯等人。一组经过实验验证的引物聚合酶链式反应定量小鼠转录物丰度。gydF4y2BaBMC基因组学gydF4y2Ba9克ydF4y2Ba633(2008)。gydF4y2Ba
王晓霞,种子b.a。基因表达定量分析PCR引物库。gydF4y2Ba核酸Res。gydF4y2Ba31gydF4y2Bae154(2003)。gydF4y2Ba
Camp, R. L., doled - filhart, M. & Rimm, D. L. X-tile:用于生物标志物评估和基于结果的切点优化的新生物信息学工具。gydF4y2Ba中国。癌症Res。gydF4y2Ba10gydF4y2Ba, 7252 - 7259(2004)。gydF4y2Ba
Subramanian, A.等。基因集富集分析:一种解释全基因组表达谱的基于知识的方法。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba102gydF4y2Ba, 15545 - 15550(2005)。gydF4y2Ba
纽曼,a.m.等人。从组织表达谱中对细胞子集的稳健枚举。gydF4y2BaNat方法。gydF4y2Ba12克ydF4y2Ba, 453 - 457(2015)。gydF4y2Ba
Butler, A., Hoffman, P., Smibert, P., Papalexi, E. & Satija, R.跨不同条件、技术和物种整合单细胞转录组数据。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 411 - 420(2018)。gydF4y2Ba
确认gydF4y2Ba
本研究得到国家自然科学基金项目(81872173 - z.y;浙江省自然科学基金项目(LD21H160002至z.y)、浙江省卫生厅医药卫生科技计划项目(WKJ-ZJ-1821至z.y)、中国博士后科学基金项目(2021M692792至z.w)。数据gydF4y2Ba3.gydF4y2Ba一个和gydF4y2Ba10 fgydF4y2Ba从Servier Medical Art (gydF4y2Bahttp://smart.servier.com/gydF4y2Ba),根据创意共同归属3.0通用许可(gydF4y2Bahttps://creativecommons.org/licenses/by/3.0/gydF4y2Ba).gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
Z.Y.和Zenan W.构思和设计了这项研究。Z.L.和S.L.提供了重要的科学信息。B.L Zenan W。,S.L W.L,詹W,白雪,w.c. W .,, t.c., H.Z, E.Y,林文泽,莫莱森X.C, J.Z.进行了实验。泽南·w撰写了草稿。Z.Y, Z.L和S.L.修改了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行审查报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
王铮,李乙,李乙,李S。gydF4y2Baet al。gydF4y2Ba通过lat2介导的氨基酸摄取代谢控制CD47表达促进肿瘤免疫逃避。gydF4y2BaNat CommungydF4y2Ba13克ydF4y2Ba6308(2022)。https://doi.org/10.1038/s41467-022-34064-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-34064-4gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba