摘要gydF4y2Ba
骨细胞活化对细菌诱导的骨溶解的影响仍然是难以捉摸的。在这里,我们表明基质嵌入骨细胞受到细菌病原体相关分子模式(PAMPs)的刺激,通过myd88调控的信号通路直接驱动骨吸收。缺乏MYD88的小鼠,主要是在骨细胞中,可以防止由颅骨注射细菌PAMPs引起的骨溶解,并抵抗由口服引起的牙槽骨吸收gydF4y2Ba牙龈卟啉单胞菌(PggydF4y2Ba)感染。相反,在骨细胞中靶向恢复MYD88的小鼠表现出炎性细胞浸润的骨溶解。在体外实验中,细菌PAMPs诱导骨细胞中细胞因子RANKL的表达显著高于成骨细胞。机制上,骨细胞MYD88通路的激活通过增加转录因子CREB和STAT3与RANKL的结合来上调RANKLgydF4y2BaRanklgydF4y2Ba通过抑制CREB/CREB结合蛋白和STAT3的k48泛素化。全身给药MYD88抑制剂可防止颌骨丢失gydF4y2BaPggydF4y2Ba借牙周炎。这些发现揭示骨细胞直接调控骨感染中的炎性骨溶解,提示骨细胞中的MYD88和下游RANKL调节因子是牙周炎和骨髓炎中骨溶解的治疗靶点。gydF4y2Ba
简介gydF4y2Ba
宿主-微生物群的相互作用在先天免疫系统的激活中起着重要作用。然而,尽管这种相互作用的失调是导致广泛的免疫介导疾病的原因gydF4y2Ba1gydF4y2Ba,骨细胞-微生物群相互作用对骨骼和免疫细胞激活的影响尚不清楚。骨细胞寿命长,功能多,是嵌入骨基质中数量最多的骨细胞。它们是由骨表面的成骨细胞分化而来的终分化细胞gydF4y2Ba2 gydF4y2Ba.在骨髓炎中,据报道gydF4y2Ba金黄色葡萄球菌gydF4y2Ba在小鼠和人类骨骼的骨细胞腔隙-管系统中定植gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba这意味着细菌可以直接与被细菌感染的骨细胞相互作用。然而,尚不清楚细菌病原体是否在体内直接刺激骨细胞,如果是这样,骨细胞上的先天免疫受体类型用于响应特定的细菌病原体相关分子模式(PAMPs)。此外,虽然已知骨细胞会产生各种细胞因子和信号分子以响应外界刺激gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7 gydF4y2Ba在体内,骨细胞来源的炎症介质对骨稳态和免疫细胞调节的影响在很大程度上仍未确定。另一方面,先前对核因子-κB配体(RANKL)骨细胞选择性受体激活因子的研究gydF4y2BaTnfsf11gydF4y2Ba基因缺陷小鼠证明骨细胞的基本特征之一是在骨重塑过程中通过直接向骨表面的破骨细胞前体提供RANKL来控制破骨细胞的形成gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.骨细胞来源的RANKL对骨破坏的重要性也在牙周炎的小鼠模型中被提出gydF4y2Ba11 gydF4y2Ba,但骨细胞上的受体和口腔细菌诱导RANKL表达引起牙槽骨溶解的下游信号通路尚未被确定。gydF4y2Ba
toll样受体(Toll-like receptor, TLRs)是一类模式识别受体家族,参与宿主防御入侵细菌病原体的初始阶段gydF4y2Ba12gydF4y2Ba.髓系分化初级反应88 (MYD88)是除TLR3外所有TLRs下游信号的重要连接蛋白。TLR-MYD88通路的激活向下游NF-kB和MAPK通路发出信号,导致促炎细胞因子的产生gydF4y2Ba13gydF4y2Ba.先前的细胞培养研究表明,细菌PAMPs刺激TLR2和TLR4可诱导成骨细胞中RANKL的表达gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.然而,TLR-MYD88信号通路在成骨细胞谱系细胞中调节破骨细胞形成和骨吸收的体内作用仍未确定。因此,骨感染中骨细胞活化的病理后果从未在体内研究过。此外,TLR-MYD88通路在骨细胞中调控RANKL表达的潜在分子机制尚不清楚。因此,揭示细菌激活骨细胞对骨骼的影响,并确定细菌激活骨细胞导致RANKL表达的分子途径,可以为治疗与骨感染(如牙周炎和骨髓炎)相关的骨溶解提供重要意义,因为骨细胞是最丰富的主要产生RANKL的骨细胞gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.此外,发现骨细胞中调节RANKL表达的新分子可能会导致新的治疗策略,用于治疗因破骨细胞生成增加而导致的过度骨吸收,如发生在骨质疏松症和类风湿关节炎中。gydF4y2Ba
在这里,我们证明了MYD88的靶向缺失,主要是在骨细胞中,完全保护了pamps驱动的小鼠骨溶解模型中的骨破坏。值得注意的是,骨细胞中MYD88的选择性恢复足以引起模型中的骨溶解和炎症。在体外实验中,当TLR2和TLR4激动剂刺激骨细胞时,骨细胞表达RANKL的能力明显高于其前体细胞成骨细胞。MYD88通路的激活通过激活cAMP响应元件结合蛋白(CREB)和转录信号传导激活因子3 (STAT3),并增强这些转录因子的蛋白稳定性,诱导骨细胞中RANKL的表达。E3泛素连接酶F-box和富亮氨酸重复蛋白19 (FBXL19)以及PDZ和LIM结构域2 (PDLIM2)分别参与CREB/CREB结合蛋白(CBP)和STAT3蛋白降解机制。翻译,管理MYD88抑制剂防止牙槽骨损失的小鼠口腔感染gydF4y2BaPorphyromonas gingivalisgydF4y2Ba(gydF4y2BaPggydF4y2Ba).这些发现表明骨细胞是骨中的关键细菌传感器,在骨感染中通过将MYD88信号整合到RANKL调控机制中直接调控骨溶解。因此,目前的研究揭示了MYD88通路在骨骼系统中的功能,并为开发治疗感染性骨溶解的新方法提供了遗传学基础,这些新方法针对骨细胞中的MYD88和下游rankl调节分子。gydF4y2Ba
结果gydF4y2Ba
骨细胞和成熟成骨细胞中MYD88的靶向缺失可防止PAMPs诱导的颅骨骨溶解gydF4y2Ba
为了确定骨细胞和成熟成骨细胞中TLR2/4-MYD88信号的激活是否会影响PAMPs引起的骨吸收,我们使用牙质基质蛋白1 (gydF4y2BaDmp1gydF4y2Ba)gydF4y2BacregydF4y2Ba在这些细胞中确认TLR2, TLR4和MYD88表达后,启动子被激活(补充图。gydF4y2Ba1gydF4y2Ba).我们也确认了gydF4y2BaDmp1-CregydF4y2Ba无明显脱靶原因gydF4y2BaMyd88gydF4y2Ba免疫和造血组织中的基因缺失可能是RANKL和炎症介质的来源(补充图。gydF4y2Ba2 gydF4y2Ba).gydF4y2Ba
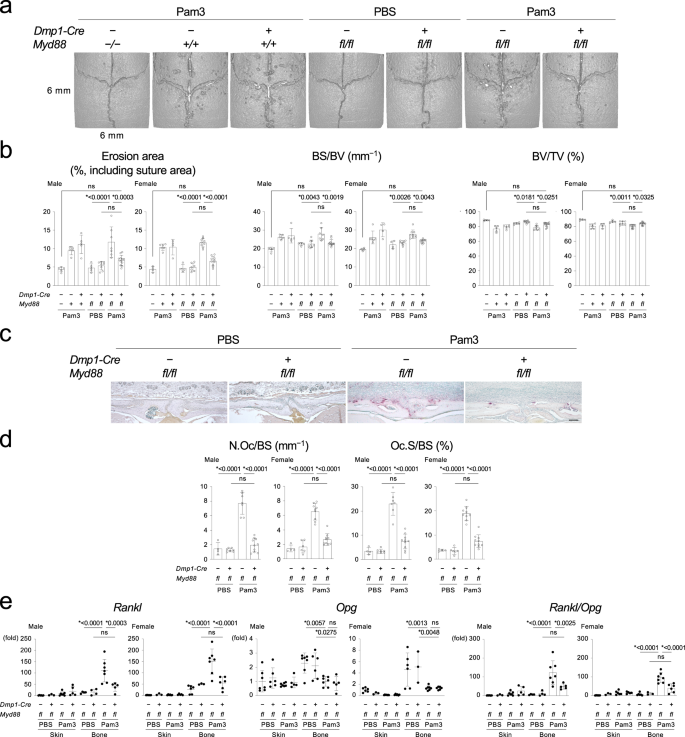
为了诱导骨溶解,Pam3CSK4(以下简称Pam3)或gydF4y2Ba大肠杆菌gydF4y2Ba(gydF4y2Ba大肠杆菌gydF4y2Ba)来源的脂多糖(LPS)注射到gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba老鼠。显微ct分析显示gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba与对照组相比,小鼠表现出明显的骨溶解减少gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba雌雄小鼠(图;gydF4y2Ba1 a, bgydF4y2Ba和补充图。gydF4y2Ba3 a, bgydF4y2Ba).TRAP染色显示小鼠破骨细胞数量减少gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba老鼠(图。gydF4y2Ba1 c, dgydF4y2Ba和补充图。gydF4y2Ba3 c, dgydF4y2Ba).表达水平gydF4y2BaRanklgydF4y2Ba在骨组织中被下调了gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba而骨保护素(OPG, osteoprotegerin, OPG)编码于小鼠体内gydF4y2BaTnfrsf11bgydF4y2Ba基因水平比较,导致的降低gydF4y2BaRankl /功能gydF4y2Ba比率,一个评估骨中破骨细胞形成的参数(图。gydF4y2Ba1 egydF4y2Ba和补充图。gydF4y2Ba3 egydF4y2Ba).Pam3下降gydF4y2Ba功能gydF4y2Ba无论是否存在MYD88缺失(图2)。gydF4y2Ba1 egydF4y2Ba).此外,gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠被保护防止骨溶解和减少破骨细胞形成时,他们受到挑战gydF4y2Ba金黄色葡萄球菌gydF4y2Ba-衍生脂磷酸(LTA)gydF4y2BaPggydF4y2Ba-衍生的LPS,或活的gydF4y2BaPggydF4y2Ba(补充图。gydF4y2Ba−4 hgydF4y2Ba,补充图。gydF4y2Ba5−dgydF4y2Ba).骨细胞和成熟成骨细胞中RANKL缺失gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaRanklgydF4y2Bafl / flgydF4y2Ba在颅骨注射模型中,小鼠阻止骨侵蚀和破骨细胞形成(补充图。gydF4y2Ba6 a -gydF4y2Ba).相反,白细胞介素-1受体(IL-1R)缺失gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaIl1r1gydF4y2Bafl / flgydF4y2Ba小鼠没有修复骨侵蚀或增加破骨细胞生成gydF4y2BaRanklgydF4y2Ba表达式(补充图gydF4y2Ba7 jgydF4y2Ba).总之,这些结果表明,骨细胞和成熟成骨细胞中TLR2/4-MYD88-RANKL轴的激活是PAMPs诱导的骨溶解的原因。股骨骨特性无明显变化gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba生理条件下的小鼠(补充图;gydF4y2Ba8gydF4y2Ba)表明,当骨细胞/成熟成骨细胞MYD88通路被细菌激活时,该通路对骨吸收很重要。gydF4y2Ba
一个gydF4y2Ba头颅的显微ct图像。每组雄性小鼠的代表性图像(gydF4y2BangydF4y2Ba≥5 /组)。gydF4y2BabgydF4y2Ba颅骨侵蚀面积、BS/BV及BV/TV (gydF4y2BangydF4y2Ba男性= 5,5,5,5,8,7,11,gydF4y2BangydF4y2Ba女性= 4,6,4,4,7,9,10)。gydF4y2BacgydF4y2Ba颅骨TRAP染色。每组雄性小鼠的代表性图像(gydF4y2BangydF4y2Ba≥4 /组)。比例尺= 100 μm。gydF4y2BadgydF4y2Ba颅骨表面破骨细胞的组织形态学分析(gydF4y2BangydF4y2Ba男性= 4,7,7,10gydF4y2BangydF4y2Ba女性= 4,6,9,10)。gydF4y2BaegydF4y2BaqPCR分析gydF4y2BaRanklgydF4y2Ba(gydF4y2BangydF4y2Ba= 6、3、7、5、4、4、7、5gydF4y2BangydF4y2Ba= 6, 3, 6, 5, 6, 3, 7, 6女),gydF4y2Ba功能gydF4y2Ba(gydF4y2BangydF4y2Ba= 7、6、7、5、7、6、7、5gydF4y2BangydF4y2Ba女性= 6、3、7、6、6、3、7、6),其比例(gydF4y2BangydF4y2Ba= 6、3、7、5、4、4、7、5gydF4y2BangydF4y2Ba= 6、3、6、5、6、3、7、6(女性))。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2BaPam3 = Pam3CSK4。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba数据以均数±标准差表示。*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。Ns =不显著。每个数据点代表一只生物学上独立的老鼠。源数据作为源数据文件提供。gydF4y2Ba
骨细胞和成熟成骨细胞中MYD88的靶向缺失可防止牙周炎中的牙槽骨吸收gydF4y2Ba
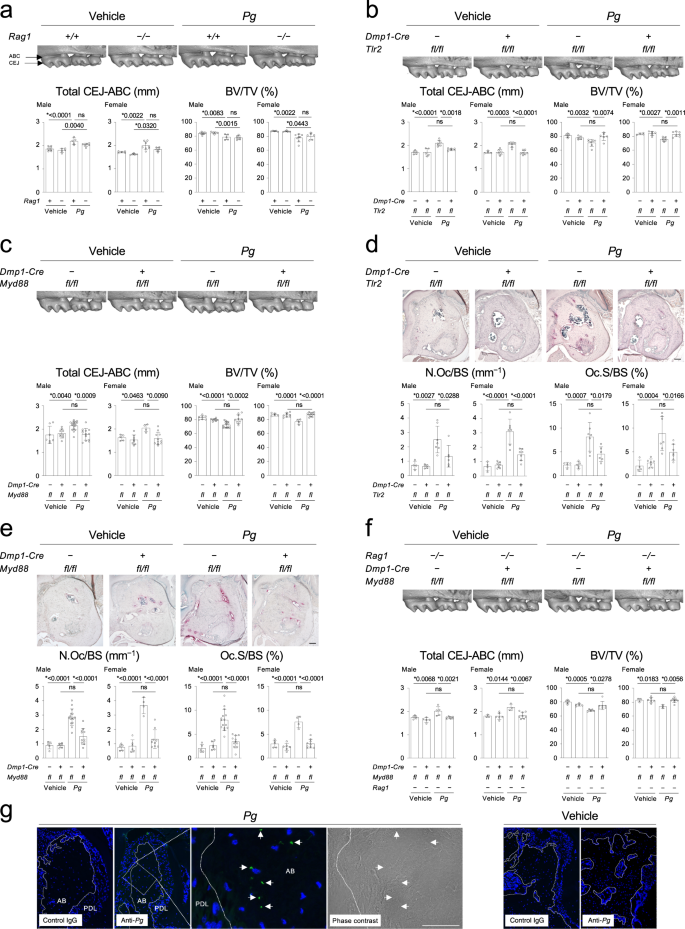
T和B淋巴细胞是众所周知的牙周炎RANKL的细胞来源gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.因此,这些细胞在口腔引起的牙槽骨丢失中起着重要作用gydF4y2BaPggydF4y2Ba对感染情况进行调查。值得注意的是,缺乏rag1的小鼠(gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba),缺乏T/B淋巴细胞对牙槽骨丢失没有明显的保护作用(图。gydF4y2Ba2gydF4y2Ba).接下来,我们研究了骨细胞和成熟成骨细胞中的TLR2-MYD88轴是否直接控制gydF4y2BaPggydF4y2Ba-诱导的牙槽骨丢失,因为已知TLR2信号在口腔中被激活gydF4y2BaPggydF4y2Ba牙周炎模型gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba和牙槽骨骨细胞/成熟成骨细胞表达TLR2和MYD88(补充图)。gydF4y2Ba9gydF4y2Ba).我们发现两者gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaTlr2gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠感染gydF4y2BaPggydF4y2Ba牙槽骨嵴(ABC)与牙槽牙釉质连接(CEJ)之间的距离缩短,牙槽牙槽缺失gydF4y2BaPggydF4y2Ba来华的gydF4y2BaTlr2gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠,分别(图;gydF4y2Ba2 b, cgydF4y2Ba).这种减少伴随着牙槽骨表面破骨细胞形成的抑制(图。gydF4y2Ba2 d, egydF4y2Ba).同时,gydF4y2BaRanklgydF4y2Ba牙槽骨组织水平降低gydF4y2BaPggydF4y2Ba来华的gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaTlr2gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠(补充图;gydF4y2Ba9 b, cgydF4y2Ba).支持以前的报告gydF4y2Ba11 gydF4y2Ba,牙槽骨丢失和破骨细胞形成增加被阻塞gydF4y2BaPggydF4y2Ba来华的gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaRanklgydF4y2Bafl / flgydF4y2Ba小鼠(补充图;gydF4y2Ba9 d, egydF4y2Ba).的gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba老鼠在gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba背景显示牙槽骨受到保护(图;gydF4y2Ba2 fgydF4y2Ba),但缺乏IL-1R信号通路对牙槽骨丢失无影响(补充图。gydF4y2Ba9 fgydF4y2Ba).总之,这些结果表明,骨细胞和成熟成骨细胞中TLR2-MYD88-RANKL轴的激活是牙周炎中牙槽骨吸收的原因gydF4y2BaPggydF4y2Ba.此外,数据表明骨细胞和成熟成骨细胞是RANKL的主要来源gydF4y2BaPggydF4y2Ba在牙周炎模型中,来自T/B淋巴细胞的RANKL对破骨细胞的生成影响不大。重要的是,gydF4y2BaPggydF4y2Ba在牙槽骨的骨细胞腔隙-管腔系统中发现了这种成分。gydF4y2Ba2 ggydF4y2Ba),提示骨细胞中的TLR2-MYD88轴直接被激活gydF4y2BaPggydF4y2Ba-来源的PAMPs诱导RANKL表达,导致牙槽骨吸收。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba上图:右侧上颌骨的显微ct图像。每组雄性小鼠的代表性图像(gydF4y2BangydF4y2Ba≥5 /组)。颊侧图。下:右上颌磨牙与右第二磨牙下牙槽BV/TV的CEJ-ABC总距离。gydF4y2Ba一个gydF4y2BangydF4y2Ba男性= 8、5、5、6。gydF4y2BangydF4y2Ba女性= 5,5,8,6。gydF4y2BabgydF4y2BangydF4y2Ba男性= 5,5,7,6。gydF4y2BangydF4y2Ba女性= 4,6,7,7。gydF4y2BacgydF4y2BaCEJ-ABC:gydF4y2BangydF4y2Ba男性= 7、9、17、13gydF4y2BangydF4y2Ba女性= 5、8、4、11BV /电视:gydF4y2BangydF4y2Ba男性= 7、8、16、10gydF4y2BangydF4y2Ba女性= 5、8、4、11gydF4y2BafgydF4y2BangydF4y2Ba男性= 5,5,5,7。gydF4y2BangydF4y2Ba女性= 3,6,3,8。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba上:牙槽骨的TRAP染色。每组雄性小鼠的代表性图像(gydF4y2BangydF4y2Ba≥4 /组)。比例尺= 100 μm。下:牙槽骨表面破骨细胞的组织形态学分析。gydF4y2BadgydF4y2BangydF4y2Ba男性= 4,5,7,6。gydF4y2BangydF4y2Ba女性= 4,7,7,7。gydF4y2BaegydF4y2BangydF4y2Ba男性= 5、6、15、11gydF4y2BangydF4y2Ba女性= 5、6、4、9。gydF4y2BaggydF4y2Ba免疫荧光图像gydF4y2BaPggydF4y2Ba在牙槽骨中检测到的成分(绿色,箭头所示)。细胞核:DAPI(蓝色)。AB =牙槽骨。牙周韧带。来自三个独立实验的代表性图像。比例尺bar = 100µm。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaPggydF4y2Ba=gydF4y2BaPorphyromonas gingivalisgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba数据以均数±标准差表示。*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。Ns =不显著。每个数据点代表一只生物学上独立的老鼠。源数据作为源数据文件提供。gydF4y2Ba
骨细胞和成熟成骨细胞中MYD88的靶向恢复足以引起骨溶解gydF4y2Ba
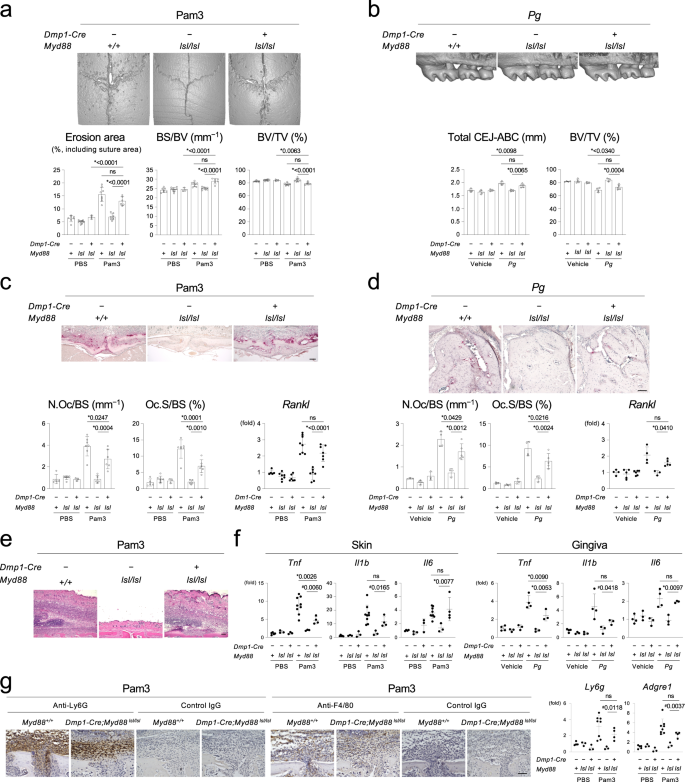
骨细胞和成骨细胞是已知的表达炎症细胞因子gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.因此,我们假设这些细胞中MYD88通路的细菌激活可能足以引起炎性骨溶解。我们雇佣了gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba在小鼠中,MYD88只有在gydF4y2BaCregydF4y2Ba曝光gydF4y2Ba29gydF4y2Ba并证实了gydF4y2BaDmp1-CregydF4y2Ba显示无法检测gydF4y2BaMyd88gydF4y2Ba免疫细胞和造血组织中的基因修复(补充图。gydF4y2Ba10gydF4y2Ba).的gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba小鼠注射Pam3或感染gydF4y2BaPggydF4y2Ba显示骨溶解相当gydF4y2BaMyd88gydF4y2Ba+/+gydF4y2Ba老鼠(图。gydF4y2Ba3 a, bgydF4y2Ba).在两种骨溶解模型中,破骨细胞诱导和gydF4y2BaRanklgydF4y2Ba在骨组织中观察到隆起gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba老鼠(图。gydF4y2Ba3 c, dgydF4y2Ba).H&E染色显示注射pam3的颅骨有大量炎症细胞浸润gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba老鼠(图。gydF4y2Ba3 egydF4y2Ba).注射pam3后,颅上皮损炎性细胞因子表达水平升高gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba小鼠和牙龈的gydF4y2BaPggydF4y2Ba来华的gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba与老鼠相比gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba用Pam3或gydF4y2BaPggydF4y2Ba,分别(图;gydF4y2Ba3 fgydF4y2Ba).皮损的免疫组化染色和qPCR分析显示,颅骨皮损为pam3注射gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba小鼠含有大量Ly6G或F4/80阳性的免疫细胞(图。gydF4y2Ba3 ggydF4y2Ba).这些结果表明,骨细胞和成熟成骨细胞中MYD88通路的特异性激活足以触发破骨细胞的骨吸收,并通过招募炎症细胞(主要是中性粒细胞和巨噬细胞)来促进骨表面的炎症。gydF4y2Ba
一个gydF4y2Ba上图:头颅的显微ct图像。每组注射Pam3CSK4的雄性小鼠的代表图像(gydF4y2BangydF4y2Ba≥6 /组)。底部:侵蚀区(gydF4y2BangydF4y2Ba= 7, 10, 3, 8, 8, 6), bs / bv (gydF4y2BangydF4y2Ba= 7,9,3,8,8,6), BV/TV (gydF4y2BangydF4y2Ba= 7, 9, 3, 8, 8, 6)的头颅。gydF4y2BabgydF4y2Ba上图:右侧上颌骨的显微ct图像。每组雄性小鼠接种的代表图像gydF4y2BaPggydF4y2Ba(gydF4y2BangydF4y2Ba≥3 /组)。颊侧图。下:右上颌磨牙与右第二磨牙下牙槽BV/TV的CEJ-ABC总距离。gydF4y2BangydF4y2Ba= 4,4,3,4,3,5。gydF4y2BacgydF4y2Ba上图:颅骨的TRAP染色。每组注射Pam3CSK4的雄性小鼠的代表图像(gydF4y2BangydF4y2Ba≥5 /组)。比例尺= 100 μm。左下:颅骨表面破骨细胞的组织形态学分析。gydF4y2BangydF4y2Ba= 5,7,3,7,5,6。右下:qPCR分析gydF4y2BaRanklgydF4y2Ba在颅骨组织中。gydF4y2BangydF4y2Ba= 5,7,6,8,7,7。gydF4y2BadgydF4y2Ba上:牙槽骨的TRAP染色。每组雄性小鼠接种的代表图像gydF4y2BaPggydF4y2Ba(gydF4y2BangydF4y2Ba≥3 /组)。比例尺= 100 μm。左下:牙槽骨表面破骨细胞的组织形态学分析。gydF4y2BangydF4y2Ba= 3,4,3,4,3,5。右下:qPCR分析gydF4y2BaRanklgydF4y2Ba在牙槽骨组织中。gydF4y2BangydF4y2Ba= 4,5,6,4,3,5。gydF4y2BaegydF4y2Ba冠状线和矢状线交叉处皮肤组织的H&E染色。每组注射Pam3CSK4的雄性小鼠的代表图像(gydF4y2BangydF4y2Ba≥3 /组)。比例尺= 100 μm。gydF4y2BafgydF4y2Ba头颅和牙龈皮肤组织炎症因子的qPCR分析。皮肤gydF4y2Ba肿瘤坏死因子gydF4y2Ba而且gydF4y2BaIl1bgydF4y2Ba(gydF4y2BangydF4y2Ba= 5,3,3,9,3,4).皮肤gydF4y2Ba白细胞介素6gydF4y2Ba(gydF4y2BangydF4y2Ba= 4,3,3,9,3,4).牙龈gydF4y2Ba肿瘤坏死因子,Il1bgydF4y2Ba,gydF4y2Ba白细胞介素6gydF4y2Ba(gydF4y2BangydF4y2Ba= 4,3,3,4,3,3)。gydF4y2BaggydF4y2Ba左:颅骨皮肤组织中性粒细胞和巨噬细胞的免疫组化染色。来自三个独立实验的代表性图像,结果相似。比例尺= 100 μm。右图:头皮皮肤组织中巨噬细胞和中性粒细胞标记基因的qPCR分析。gydF4y2BaLy6ggydF4y2Ba(gydF4y2BangydF4y2Ba= 4,3,3,8,3,4)。gydF4y2BaAdgre1gydF4y2Ba(gydF4y2BangydF4y2Ba= 5, 3, 3, 8, 3, 4)。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba来自雄性小鼠的数据。雌性小鼠也有类似的结果。Pam3 = Pam3CSK4。gydF4y2BaPggydF4y2Ba=gydF4y2BaPorphyromonas gingivalisgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba数据以均数±标准差表示。*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对时< 0.05gydF4y2BatgydF4y2Ba-test被使用(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba).ns =方差分析不显著。每个数据点代表一只生物学上独立的老鼠。源数据作为源数据文件提供。gydF4y2Ba
骨细胞对PAMPs的反应中RANKL的表达量明显高于成骨细胞gydF4y2Ba
骨细胞和成骨细胞都是RANKL用于破骨细胞形成的细胞来源gydF4y2Ba30.gydF4y2Ba.为了研究骨细胞的RANKL诱导能力是否与成骨细胞不同,通过胶原酶和EDTA连续消化,从10周龄小鼠颅骨中分离出骨细胞富集细胞群(Ocy)和成骨细胞富集细胞群(Ob)gydF4y2Ba31gydF4y2Ba接着是造血细胞的耗竭(补充图。gydF4y2Ba11得了gydF4y2Ba).硬化素阳性细胞的百分比相当于体内骨细胞的百分比gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba与Ob相比,Ocy中角化蛋白阳性细胞污染小,骨细胞标记基因和硬化蛋白表达明显增高,说明Ocy中骨细胞高度富集(补充图)。gydF4y2Ba11 d-fgydF4y2Ba).同样,Ob.中成骨细胞高度富集gydF4y2BaDmp1-CregydF4y2Ba在报告小鼠的骨细胞和成骨细胞中都有活性gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,我们发现它会耗尽MYD88、TLR2和RANKL,并恢复MYD88,对Ocy具有显著的特异性(补充图。gydF4y2Ba11 ggydF4y2Ba).gydF4y2Ba
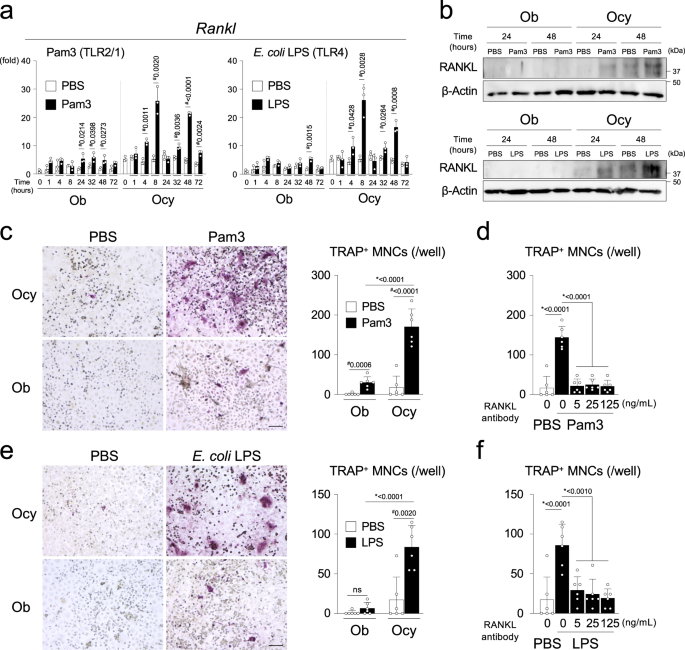
用Pam3刺激Ocy,gydF4y2Ba大肠杆菌gydF4y2BaLPS, Pam2CSK4,热杀灭gydF4y2BaPggydF4y2Ba,或gydF4y2BaPggydF4y2Ba培养上清,但不培养鞭毛蛋白gydF4y2Ba鼠伤寒沙门氏菌gydF4y2Ba(FLA-ST)或单链RNA, RANKL蛋白或mRNA的表达量显著高于ObgydF4y2BaRanklgydF4y2Ba据报道,Ocy的水平更高gydF4y2Ba9gydF4y2Ba(无花果。gydF4y2Ba4 a、bgydF4y2Ba和补充图。gydF4y2Ba12个一个gydF4y2Ba).的gydF4y2BaRanklgydF4y2BaOcy的诱导速度比Ob快。值得注意的是Pam3的刺激,gydF4y2Ba大肠杆菌gydF4y2BaLPS或Pam2CSK4引起双相gydF4y2BaRanklgydF4y2Ba海拔在8和48小时达到峰值。MYD88的基因缺失和药理学阻断取消了Ocy中RANKL mRNA和蛋白质的诱导(补充图。gydF4y2Ba12个罪犯gydF4y2Ba).Ocy与骨髓来源的破骨细胞前体共培养gydF4y2BaMyd88gydF4y2Ba−−/gydF4y2Ba在Pam3或gydF4y2Ba大肠杆菌gydF4y2BaLPS比Ob以rankl依赖的方式引起更明显的破骨细胞形成(图。gydF4y2Ba四氟gydF4y2Ba).当RANKL被中和抗体阻断时,Ocy共培养中破骨细胞相关基因的表达增加被抑制。gydF4y2Ba12 egydF4y2Ba).这些刺激不诱导可溶性RANKL的形成(补充图。gydF4y2Ba12 fgydF4y2Ba).这些数据表明,在细菌PAMPs存在的情况下,骨细胞比其前体成骨细胞具有更大的支持破骨细胞发生的能力,并提示骨细胞MYD88通路的激活通过诱导膜结合形式的RANKL来驱动骨吸收。考虑到这一发现gydF4y2BaDmp1-CregydF4y2Ba在Ocy中选择性地删除和恢复MYD88,可以想象,骨细胞中的MYD88通路而不是成骨细胞中的MYD88通路在颅骨骨溶解过程中PAMPs诱导的破骨细胞形成中起主要作用gydF4y2BaPggydF4y2Ba驱动牙周炎模型。gydF4y2Ba
一个gydF4y2BaqPCR分析gydF4y2BaRanklgydF4y2BaPam3CSK4 (100 ng/mL)刺激的成骨细胞富集细胞群(Ob)和成骨细胞富集细胞群(Ocy),gydF4y2Ba大肠杆菌gydF4y2BaLPS (100 ng/mL),或PBS每24小时。PBS处理0 h后,取Ob的平均表达量为1。来自五个独立实验的代表性数据,每个实验有三个重复,结果相似(gydF4y2BangydF4y2Ba= 3)。gydF4y2BabgydF4y2Ba用Pam3CSK4刺激的Ob和Ocy细胞裂解液对RANKL进行Western印迹,gydF4y2Ba大肠杆菌gydF4y2BaLPS或PBS。来自五个独立实验的代表性图像,结果相似。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba共培养骨髓来源的m - csf依赖巨噬细胞gydF4y2BaMyd88gydF4y2Ba−−/gydF4y2Ba从野生型分离的Ob或Ocy雄性小鼠(gydF4y2BaMyd88gydF4y2Ba+/+gydF4y2Ba) C57BL/6 J雄性小鼠。Pam3CSK4刺激细胞,gydF4y2Ba大肠杆菌gydF4y2BaLPS或PBS,持续7天。gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2BaTRAP +多核细胞(MNCs)的形成及每孔TRAP + MNCs的数量。代表性图像及数据(gydF4y2BangydF4y2Ba= 6/组),三个独立实验的结果相似。比例尺= 100 μm。gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba在RANKL中和抗体存在和不存在7天的情况下,每孔TRAP + MNCs的数量。三个独立实验的代表性数据均有相似结果(gydF4y2BangydF4y2Ba= 6 /组)。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2BaPam3 = Pam3CSK4。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba数据以均数±标准差表示。gydF4y2Ba一个gydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对< 0.05gydF4y2BatgydF4y2Ba以及。gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对< 0.05gydF4y2BatgydF4y2Ba以及。*gydF4y2BapgydF4y2Ba采用Tukey-Kramer检验,单因素方差分析< 0.05。Ns =与不显著gydF4y2BatgydF4y2Ba以及。gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。源数据作为源数据文件提供。gydF4y2Ba
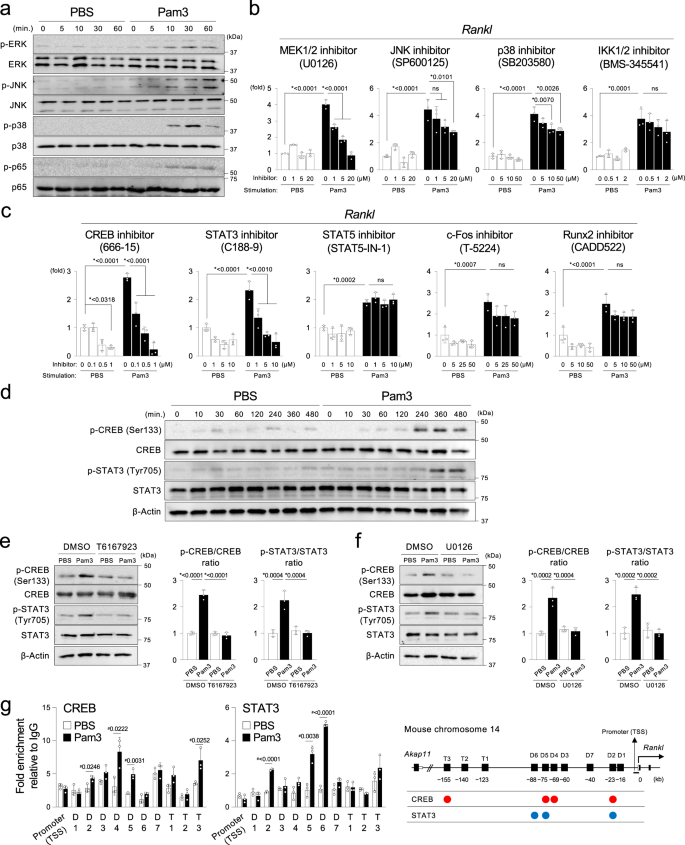
MYD88-ERK通路激活CREB和STAT3调节骨细胞中RANKL的诱导gydF4y2Ba
TLR2信号仅由MYD88介导,而TLR4信号同时由MYD88和toll样受体适配器分子1 (TICAM1,也称为TRIF)介导。gydF4y2Ba39gydF4y2Ba.为了研究MYD88通路在Ocy中诱导RANKL的机制,我们使用Pam3来激活Ocy。Pam3刺激增加了Ocy中ERK、JNK、p38和NF-kB p65的磷酸化水平(图2)。gydF4y2Ba5gydF4y2Ba)晚8小时。非细胞毒性剂量的MEK抑制剂,而不是JNK, p38,或IKK抑制剂,抑制治疗gydF4y2BaRanklgydF4y2Ba在pam3刺激的Ocy中以剂量依赖的方式表达到基础水平(PBS处理,不含抑制剂)。gydF4y2Ba5 bgydF4y2Ba),表明ERK信号通路起主导作用gydF4y2BaRanklgydF4y2BaOcy中MYD88下游的转录。ERK信号的具体影响gydF4y2BaRanklgydF4y2Ba在转染MEK1/2 sirna的MLO-Y4细胞中证实了诱导作用。gydF4y2Ba13 a、bgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaPam3CSK4或PBS刺激Ocy磷酸化(p)和总ERK, JNK, p38和NF-kB p65蛋白的Western印迹。Min . =分钟。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaqPCR分析gydF4y2BaRanklgydF4y2Ba.在Pam3CSK4或PBS刺激8小时之前,用浓度增加的抑制剂或载体(DMSO)预处理Ocy 2小时。来自三个具有相似结果的独立实验的代表性数据,每个实验有三个重复(gydF4y2BangydF4y2Ba= 3)。gydF4y2BadgydF4y2BaPam3CSK4或PBS刺激Ocy磷酸化(p)和总CREB和STAT3蛋白的Western印迹。Min . =分钟。gydF4y2BaegydF4y2Ba左图:磷酸化(p)和总CREB和STAT3蛋白的Western印迹。用MYD88抑制剂T6167923(20µM)或载体(DMSO)预处理Ocy 2小时,然后用Pam3CSK4或PBS刺激8小时。右图:使用ImageJ对p-CREB/CREB和p-STAT3/STAT3比值的密度分析。gydF4y2BafgydF4y2Ba左图:磷酸化(p)和总CREB和STAT3蛋白的Western印迹。用MEK1/2抑制剂U0126(20µM)或载体(DMSO)预处理Ocy 2小时,然后用Pam3CSK4或PBS刺激8小时。右图:使用ImageJ对p-CREB/CREB和p-STAT3/STAT3比值的密度分析。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba图表由三个独立实验的数据(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaggydF4y2Ba用Pam3CSK4或PBS刺激Ocy 8小时,CUT & RUN检测CREB和STAT3。诱导CREB和STAT3结合到gydF4y2BaRanklgydF4y2Ba启动子和增强子相对于同型对照IgGs进行qPCR定量(折叠富集)。来自三个具有相似结果的独立实验的代表性数据,每个实验有三个重复(gydF4y2BangydF4y2Ba= 3)。该图显示了鼠标gydF4y2BaRanklgydF4y2BaPam3CSK4刺激Ocy的启动子和增强子位点以及CREB和STAT3的结合位点。转录起始位点。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaPam3 = Pam3CSK4。gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba来自三个以上独立实验的代表性图像。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba数据以均数±标准差表示。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。Ns =不显著。gydF4y2BaggydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对< 0.05gydF4y2BatgydF4y2Ba以及。源数据作为源数据文件提供。gydF4y2Ba
RanklgydF4y2Ba转录受多种转录因子(tf)的结合控制,包括CREB、STAT3/5、c-Fos和Runx2,以刺激和细胞类型特异性的方式与10种调控增强子结合gydF4y2Ba40gydF4y2Ba.增加gydF4y2BaRanklgydF4y2BaCREB和STAT3抑制剂减弱了表达,但STAT5、c-Fos或Runx2抑制剂没有减弱(图2)。gydF4y2Ba5度gydF4y2Ba),表明CREB和STAT3是关键的转录因子gydF4y2BaRanklgydF4y2BaMYD88和ERK下游的诱导。CREB和STAT3的关键作用gydF4y2BaRanklgydF4y2Ba在转染CREB或STAT3 sirna的MLO-Y4细胞中验证了这种调控。gydF4y2Ba13 c, dgydF4y2Ba).与结果一致,Pam3处理增强了CREB和STAT3的磷酸化水平(图。gydF4y2Ba5 dgydF4y2Ba).存在剂量依赖的相关性gydF4y2BaRanklgydF4y2Ba在Pam3缺失的情况下,CREB抑制剂对骨细胞的抑制作用表明,CREB的组成性激活对于维持骨细胞的基础RANKL水平很重要。我们发现T6167923或U0126处理和MYD88通路的遗传消融阻断了CREB和STAT3的磷酸化,证实MYD88- erk通路激活了pam3刺激的Ocy中的CREB和STAT3(图3)。gydF4y2Ba5 e, fgydF4y2Ba,补充图。gydF4y2Ba13 egydF4y2Ba).最后,CUT & RUN实验表明Pam3增加了CREB和STAT3与D2/D4/D5/T3和D2/D5/D6增强子的结合gydF4y2BaRanklgydF4y2Ba分别为基因(图;gydF4y2Ba5克gydF4y2Ba).同样的,gydF4y2Ba大肠杆菌gydF4y2BaLPS激活ERK-CREB/STAT3通路增加gydF4y2BaRanklgydF4y2Ba表达式(补充图gydF4y2Ba14模拟gydF4y2Ba).总之,这些结果表明,由MYD88-ERK通路介导的CREB和STAT3激活可以早期调节gydF4y2BaRanklgydF4y2BaPam3刺激Ocy诱导8 h。gydF4y2Ba
FBXL19和PDLIM2通过骨细胞中的CREB/CBP和STAT3泛素化调节RANKL的表达gydF4y2Ba
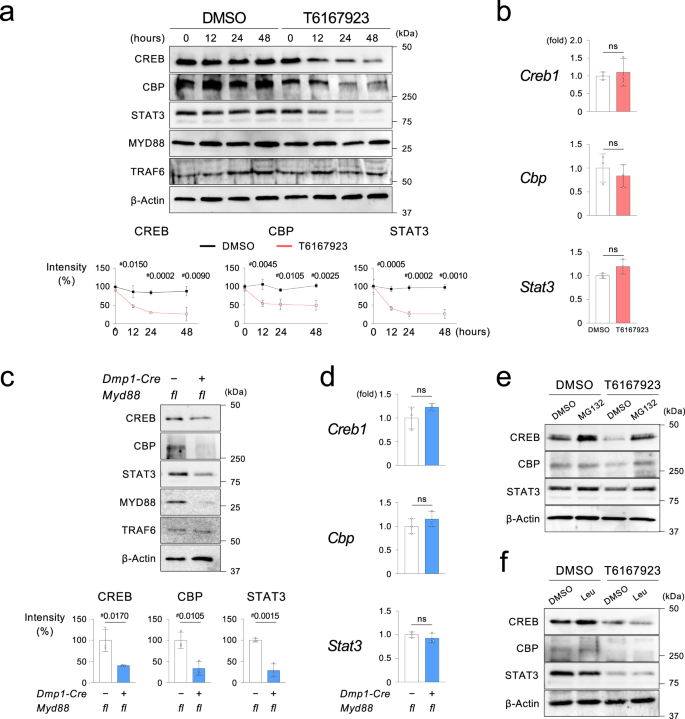
接下来,我们试图确定Pam3增加的机制gydF4y2BaRanklgydF4y2Ba8小时后的转录。我们发现,通过T6167923阻断MYD88通路可显著降低12小时后Ocy中的CREB、CBP和STAT3蛋白,但不影响mrna(图2)。gydF4y2Ba6 a、bgydF4y2Ba).类似地,MYD88的基因缺失抑制了Ocy中这些tf的蛋白水平,但不抑制mRNA水平(图2)。gydF4y2Ba6 c, dgydF4y2Ba).在MG132存在的情况下,CREB、CBP和STAT3蛋白水平的恢复,而不是leupeptin的存在,表明这些tf的不稳定是由泛素-蛋白酶体途径介导的(图。gydF4y2Ba6 e, fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba野生型Ocy中CREB、CBP和STAT3蛋白的Western blotting (gydF4y2BaMyd88gydF4y2Ba+ l +gydF4y2Ba)雄性老鼠。每24 h用T6167923或DMSO处理Ocy。图表显示了0小时时相对于dmso处理的Ocy的蛋白带强度(%)。图表由三个独立实验的数据(gydF4y2BangydF4y2Ba= 3)。β -肌动蛋白归一化。gydF4y2BabgydF4y2BaqPCR分析gydF4y2BaCreb1gydF4y2Ba,gydF4y2Ba海关与边境保护局gydF4y2Ba,gydF4y2BaStat3gydF4y2Ba在男性gydF4y2BaMyd88gydF4y2Ba+ l +gydF4y2BaOcy与T6167923 (20 μ M)处理48小时。T6167923每24 h加入培养。来自三个具有相似结果的独立实验的代表性数据,每个实验有三个重复(gydF4y2BangydF4y2Ba= 3)。gydF4y2BacgydF4y2Ba从Ocy中分离得到的指示蛋白的Western blottinggydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba雄性老鼠。图表显示了蛋白质带的强度gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba老鼠相对于那些来自gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Baβ-肌动蛋白标准化小鼠(%)。图表由三个独立实验的数据(gydF4y2BangydF4y2Ba= 3)。gydF4y2BadgydF4y2BaqPCR分析gydF4y2BaCreb1gydF4y2Ba,gydF4y2Ba海关与边境保护局gydF4y2Ba,gydF4y2BaStat3gydF4y2Ba在Ocy从gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba雄性老鼠。来自三个独立实验的代表性数据,每个实验有三个重复(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2BaOcy中CREB、CBP和STAT3蛋白的Western blotting分析gydF4y2BaMyd88gydF4y2Ba+ l +gydF4y2Ba雄性老鼠。用蛋白酶体抑制剂MG132 (1 μM)或溶酶体抑制剂leupeptin (100 μM)处理Ocy 3 h,再用T6167923 (20 μM)处理Ocy 48 h。每24 h加入MG132、leupeptin和T6167923。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba数据以均数±标准差表示。gydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对< 0.05gydF4y2BatgydF4y2Ba以及。Ns =不显著。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba来自三个以上独立实验的代表性图像。源数据作为源数据文件提供。gydF4y2Ba
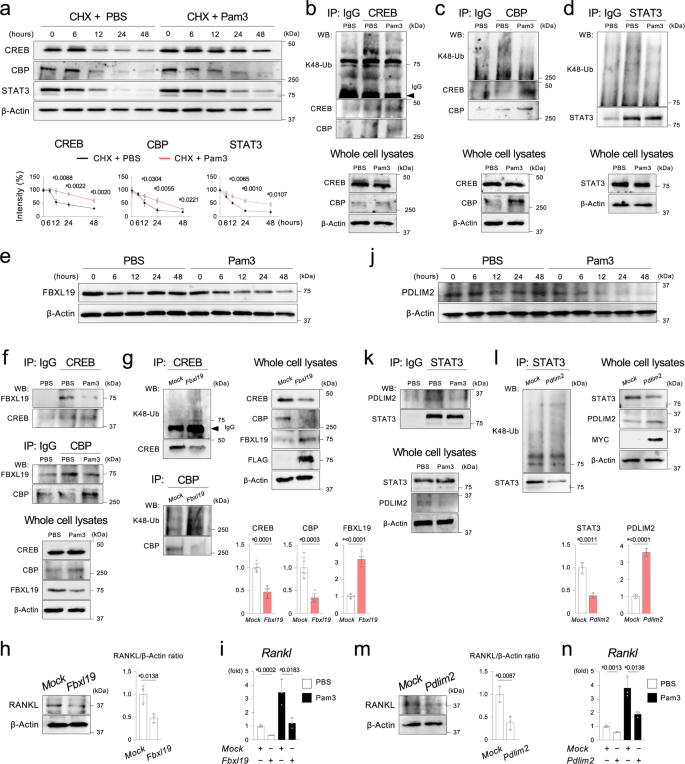
相反,Pam3激活增加了CREB、CBP和STAT3蛋白的稳定性,而它们的mRNA水平没有变化(图2)。gydF4y2Ba7一个gydF4y2Ba和补充图。gydF4y2Ba15gydF4y2Ba).Pam3刺激后CREB、CBP和STAT3赖氨酸(K) 48泛素化的降低证实泛素-蛋白酶体途径控制MYD88下游这些tf的稳定性(图。gydF4y2Ba7罪犯gydF4y2Ba).进一步,我们研究了Ocy中CREB、CBP和STAT3的泛素连接酶。F-box和富亮氨酸重复蛋白19 (FBXL19)是一种E3泛素连接酶,可泛素化CBPgydF4y2Ba41gydF4y2Ba.我们发现,刺激MYD88通路后,Ocy中FBXL19蛋白不稳定,而不是mRNA不稳定。gydF4y2Ba7 egydF4y2Ba和补充图。gydF4y2Ba16一个gydF4y2Ba).因此,我们研究了Pam3对含FBXL19和CREB/CBP分子配合物形成的影响。CREB和CBP与FBXL19形成分子复合物,Pam3刺激减少了复合物的形成(图。gydF4y2Ba7 fgydF4y2Ba).FBXL19在骨细胞IDG-SW3细胞中的慢病毒过表达增加了CREB和CBP的k48泛素化,并降低了这些蛋白水平(图2)。gydF4y2Ba7 ggydF4y2Ba).事实上,FBXL19过表达抑制了骨细胞IDG-SW3细胞中的RANKL蛋白和mRNA水平(图2)。gydF4y2Ba7小时,我gydF4y2Ba).相反,是撞倒gydF4y2BaFbxl19gydF4y2BaCREB和CBP蛋白升高,RANKL蛋白和mRNA上调,CREB和CBP泛素化降低(补充图。gydF4y2Ba16中gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaPam3CSK4或PBS刺激Ocy中CREB、CBP和STAT3蛋白的降解动力学用环己亚胺(CHX, 10 μM)和Pam3CSK4/PBS处理Ocy,每24 h处理一次。图表显示蛋白带的强度相对于那些在0小时(%)。β-肌动蛋白归一化。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2BaCREB、CBP和STAT3免疫沉淀(IP)后k48泛素化蛋白的Western印迹。用Pam3CSK4或PBS刺激Ocy 48 h。gydF4y2BaegydF4y2BaPam3CSK4或PBS刺激Ocy中FBXL19的Western印迹。gydF4y2BafgydF4y2Ba对FBXL19进行CREB和CBP IP检测,Western blotting。Pam3CSK4或PBS刺激48小时后。gydF4y2BaggydF4y2BaCREB或CBP IP后k48泛素化蛋白的Western blotting。使用过表达flag标记小鼠FBXL19的分化IDG-SW3细胞的细胞裂解液。图表显示了CREB、CBP和FBXL19蛋白带在全细胞裂解物中对抗β-肌动蛋白的相对强度。gydF4y2BahgydF4y2Ba左图:使用过表达flag标记小鼠FBXL19的分化IDG-SW3细胞裂解液对RANKL进行Western印迹。右图:β-Actin归一化后RANKL蛋白的相对水平。gydF4y2Ba我gydF4y2BaqPCR分析gydF4y2BaRanklgydF4y2Ba用Pam3CSK4或PBS刺激过表达flag标记小鼠FBXL19的分化IDG-SW3细胞48小时。gydF4y2BajgydF4y2BaPam3CSK4或PBS刺激Ocy中PDLIM2的Western印迹。gydF4y2BakgydF4y2BaSTAT3的IP,然后进行PDLIM2的Western blotting。Pam3CSK4或PBS刺激48小时后。gydF4y2BalgydF4y2BaSTAT3 IP后k48泛素化蛋白的Western印迹。使用过表达myc标记的小鼠PDLIM2的分化IDG-SW3细胞的细胞裂解液。图表显示了STAT3和PDLIM2蛋白条带对β-肌动蛋白在全细胞裂解物中的相对强度。gydF4y2Ba米gydF4y2Ba左图:使用过表达myc标记的小鼠PDLIM2的分化IDG-SW3细胞的细胞裂解液进行RANKL的Western印迹。右图:β-Actin归一化后RANKL蛋白的相对水平。gydF4y2BangydF4y2BaqPCR分析gydF4y2BaRanklgydF4y2Ba用Pam3CSK4或PBS刺激过表达myc标记小鼠FBXL19的分化IDG-SW3细胞48小时。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba,gydF4y2BangydF4y2BaPam3 = Pam3CSK4。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba图表由三个独立实验的数据(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba我gydF4y2Ba,gydF4y2BangydF4y2Ba来自三个具有相似结果的独立实验的代表性数据,每个实验有三个重复(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba数据以均数±标准差表示。gydF4y2Ba#gydF4y2BapgydF4y2Ba双尾未配对< 0.05gydF4y2BatgydF4y2Ba以及。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba来自三个以上独立实验的代表性图像。源数据作为源数据文件提供。gydF4y2Ba
PDLIM2是E3泛素连接酶,可调节STAT3降解gydF4y2Ba42gydF4y2Ba.我们发现,刺激MYD88通路可使Ocy中的PDLIM2蛋白和mRNA不稳定。gydF4y2Ba7 jgydF4y2Ba和补充图。gydF4y2Ba17一个gydF4y2Ba).STAT3与PDLIM2形成复合物,Pam3刺激减少了Ocy中复合物的形成(图。gydF4y2Ba7 kgydF4y2Ba).慢病毒过表达PDLIM2增加了骨细胞IDG-SW3细胞中STAT3的k48泛素化,降低了STAT3蛋白水平(图2)。gydF4y2Ba7 lgydF4y2Ba).过表达PDLIM2的IDG-SW3骨细胞中RANKL蛋白和mRNA水平降低(图2)。gydF4y2Ba7 m, ngydF4y2Ba).相比之下,gydF4y2BaPdlim2gydF4y2Baknockdown蛋白增加STAT3蛋白,RANKL蛋白和mRNA升高,同时降低STAT3的泛素化(补充图。gydF4y2Ba17中gydF4y2Ba).gydF4y2Ba
甲状旁腺激素(PTH)刺激骨细胞蛋白激酶A (PKA)诱导creb介导gydF4y2BaRanklgydF4y2Ba表达式gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.然而,PKA抑制没有抑制gydF4y2BaRanklgydF4y2BaPam3诱导(补充图。gydF4y2Ba18一个gydF4y2Ba).此外,Pam3刺激不会增加CRTC2的结合,CRTC2是CREB的辅激活剂,对pth诱导的RANKL表达至关重要gydF4y2Ba43gydF4y2Ba,gydF4y2BaRanklgydF4y2Ba增强子,说明的机制gydF4y2BaRanklgydF4y2BaPam3的诱导作用与甲状旁腺激素不同。gydF4y2Ba18 bgydF4y2Ba).已知IL-6和TNF-ɑ增加骨细胞中RANKL的表达gydF4y2Ba23gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.IL-6的中和作用,但TNF-ɑ未被部分抑制gydF4y2BaRanklgydF4y2BaPam3诱导(补充图。gydF4y2Ba18 cgydF4y2Ba),表明pamps驱动gydF4y2BaRanklgydF4y2Ba骨细胞的上调主要由TLR直接激活调控,但骨细胞源性细胞因子以自分泌或旁分泌方式增强其作用。因此,结果表明,在Ocy中,CREB、CBP和STAT3的k48泛素化是诱导MYD88下游RANKL表达的另一个关键机制,其中FBXL19和PDLIM2在泛素化过程中发挥关键作用。gydF4y2Ba
MYD88抑制剂可预防牙周炎中的牙槽骨丢失gydF4y2Ba
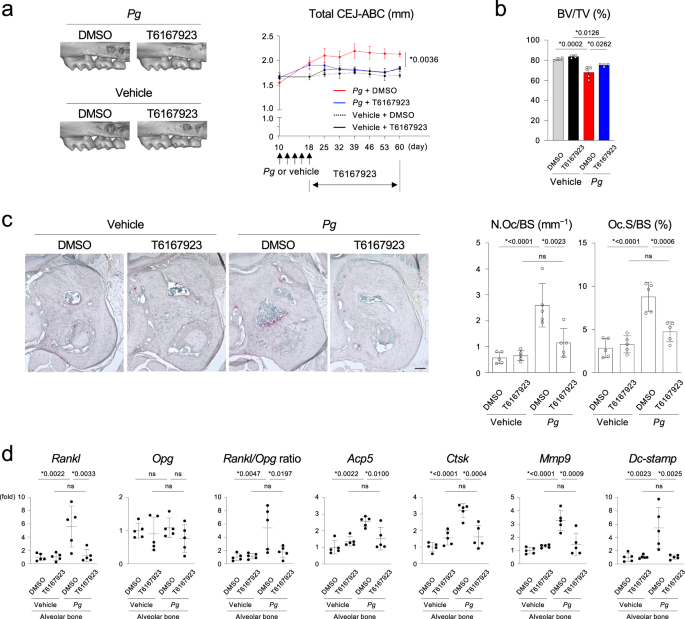
我们测试了myd88特异性抑制剂对牙周炎的治疗影响。我们发现T6167923可以全身给药gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba对感染野生型小鼠牙槽骨CEJ-ABC距离的增加和BV/TV的降低具有保护作用gydF4y2BaPggydF4y2Ba(无花果。gydF4y2Ba8 a、bgydF4y2Ba).这些保护作用伴随着牙槽骨表面破骨细胞形成的减少和破骨细胞相关基因在牙槽骨中的表达的减少(图。gydF4y2Ba8 c, dgydF4y2Ba).这些数据表明,MYD88的药理抑制作用可以抑制体内由牙周炎引起的破骨细胞诱导和牙槽骨吸收,从而表明MYD88可能是治疗细菌感染引起的骨质丢失的靶点,包括牙周炎。gydF4y2Ba
一个gydF4y2Ba左:右上颌骨的显微ct图像gydF4y2BaPorphyromonas gingivalisgydF4y2Ba(gydF4y2BaPggydF4y2Ba)或载体接种的野生型C57BL/6 J雄性小鼠,给予T6167923或DMSO。颊侧图。每组雄性小鼠的代表性图像。右:右上颌磨牙CEJ-ABC总距离。gydF4y2BabgydF4y2Ba右上颌第二磨牙下方的牙槽BV/TV。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2BaPggydF4y2Ba+ dmso (gydF4y2BangydF4y2Ba= 5),gydF4y2BaPggydF4y2Ba+ t6167923 (gydF4y2BangydF4y2Ba= 4),车辆+ DMSO (gydF4y2BangydF4y2Ba= 4),车辆+ T6167923 (gydF4y2BangydF4y2Ba= 4)。gydF4y2BacgydF4y2Ba左:牙槽骨TRAP染色。每组雄性小鼠的代表性图像(gydF4y2BangydF4y2Ba= 5 /组)。比例尺= 100 μm。右图:牙槽骨表面破骨细胞的组织形态学分析。gydF4y2BadgydF4y2Ba牙槽骨破骨细胞相关基因的qPCR分析(gydF4y2BangydF4y2Ba= 5 /组)。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba数据以均数±标准差表示。*gydF4y2BapgydF4y2BaTukey-Kramer检验,单因素方差分析< 0.05。Ns =不显著。每个数据点代表一只生物学上独立的老鼠。源数据作为源数据文件提供。gydF4y2Ba
讨论gydF4y2Ba
与骨感染相关的骨溶解机制尚不清楚。此外,细菌感染引发的myd88介导的骨细胞宿主防御系统是否以及如何影响骨骼仍不清楚。目前的研究表明,骨细胞通过直接将MYD88通路激活整合到负责破骨细胞形成的RANKL诱导机制中,主要控制细菌诱导的骨溶解。模式识别受体TLR2和TLR4在骨细胞识别细菌PAMPs中起着核心作用。通过这些受体,MYD88通路将感染信号转化为骨吸收信号。我们的数据还表明,骨细胞MYD88通路对骨吸收的影响出现在病理环境中,而不是生理环境中。我们建立了一种从成年小鼠颅骨中分离富骨细胞和富骨细胞的改进方法。使用这种方法,我们发现当PAMPs刺激骨细胞时,骨细胞表达的RANKL量明显高于成骨细胞,并且10 kbgydF4y2BaDmp1gydF4y2Ba与成骨细胞相比,启动子对骨细胞具有高度特异性。因此,从颅骨骨溶解和牙槽骨丢失中抢救gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠被解释为骨细胞中的TLR-MYD88信号轴主要调节口腔和颅面区骨感染的骨溶解。此外,gydF4y2BaDmp1-CregydF4y2Ba骨细胞特异性表明骨细胞是细菌诱导骨吸收机制中RANKL的主要来源。gydF4y2Ba
来自骨细胞的RANKL已被证明在生理性和病理性骨吸收中起关键作用gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.但人们对其在骨感染中的作用知之甚少。此外,在体外实验中,细菌PAMPs可增加小鼠新生儿颅骨成骨细胞和骨细胞MLO-Y4细胞系中RANKL的表达gydF4y2Ba14gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,这些研究从未直接比较骨细胞和成骨细胞之间RANKL诱导的潜力。我们发现MYD88通路的激活在骨细胞富集细胞群中比在骨细胞富集细胞群中更能促进RANKL mRNA和蛋白的表达。考虑到骨细胞是骨中最丰富的细胞,骨细胞富集的细胞具有更高的RANKL诱导能力,这可能是我们得出骨细胞在细菌骨感染中破骨细胞形成中起主导作用这一结论的基础。gydF4y2Ba
当受到细菌病原体刺激时,骨细胞调节造血和分泌多种炎症因子gydF4y2Ba4gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba.然而,这种骨细胞来源的因子在体内对骨的影响尚未确定。令我们惊讶的是,gydF4y2BaDmp1-Cre; Myd88gydF4y2Balsl / lslgydF4y2Ba小鼠发现,MYD88通路的骨细胞选择性恢复足以引发和发展骨表面的炎症和骨溶解,这表明当受到细菌PAMPs刺激时,骨细胞转化为强大的炎症细胞,不仅提供RANKL,还提供促炎的“骨细胞因子”和“骨趋化因子”。因此,在骨感染性疾病中,“骨细胞炎症”可能调节免疫细胞和破骨细胞祖细胞向骨表面的迁移。中性粒细胞和巨噬细胞的协同激活可能是促进骨表面炎症病变发展所必需的。确定哪些骨细胞来源的炎症介质在招募中性粒细胞和巨噬细胞到骨表面方面发挥关键作用,以及炎症骨细胞是否参与骨细胞骨溶解机制,将是很有趣的。详细的时间课程研究gydF4y2BaDmp1-Cre; Myd88gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaDmp1-Cre; Myd88gydF4y2Balsl / lslgydF4y2Ba小鼠将确定受骨细胞来源的炎症介质(包括RANKL)严重影响的炎症和骨吸收阶段(例如,起始、进展或建立)。总之,目前的研究提供了骨细胞是骨吸收和炎症的直接细胞介质的遗传证据。因此,骨细胞可能是阻止破骨细胞祖细胞和炎症细胞向骨表面迁移的细胞靶点。gydF4y2Ba
从机制上看,MYD88通路的激活增加了CREB和STAT3的磷酸化水平,而阻断这些tf可以防止细胞凋亡gydF4y2BaRanklgydF4y2Ba骨细胞诱导。这些数据显示了CREB和STAT3在脑卒中中的关键作用gydF4y2BaRanklgydF4y2Ba骨细胞的调节。已知CREB调节gydF4y2BaRanklgydF4y2Ba在成骨样MC3T3-E1细胞中通过结合D2, D4和D5增强子来转录gydF4y2Ba40gydF4y2Ba.我们的数据显示,在骨细胞富集的细胞群中,Pam3除了促进D2、D4和D5增强子外,还促进CREB与T3增强子的结合。T3最初被鉴定为T细胞特异性机制gydF4y2BaRanklgydF4y2Ba转录gydF4y2Ba56gydF4y2Ba.CREB与T3结合对于骨细胞特异性机制可能很重要gydF4y2BaRanklgydF4y2Ba归纳。类似地,STAT3对gydF4y2BaRanklgydF4y2Ba在ST2小鼠间质细胞系中通过结合D4、D5和D6增强子来转录gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba.我们发现,在骨细胞富集的细胞群中,Pam3刺激可激发STAT3与D2、D5和D6增强子的结合。因此,STAT3与D2结合的增加可能参与了更稳健的机制gydF4y2BaRanklgydF4y2Ba骨细胞诱导优于成骨细胞诱导。全基因组比较骨细胞和其他细胞类型(包括成骨细胞和T细胞)之间响应Pam3时CREB和STAT3结合位点的变化,将确定新的骨细胞特异性gydF4y2BaRanklgydF4y2Ba转录机制。gydF4y2Ba
更大的gydF4y2BaRanklgydF4y2Ba骨细胞富集细胞的诱导能力也可能与CREB、CBP和STAT3蛋白稳定性的增加有关。我们发现MYD88通路通过CREB/CBP和STAT3的k48泛素化及其蛋白酶体降解调节RANKL表达。FBXL19是一种F-box蛋白,在Skp1-Cul1-F-box蛋白(SCF) E3泛素连接酶复合物中调控CBP、Rac1/3、RhoA和IL-33R的泛素化gydF4y2Ba41gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba.我们的数据显示,CREB是骨细胞中FBXL19的泛素化靶点,FBXL19通过CREB和CBP调节骨细胞RANKL的产生。PDLIM2是STAT3的E3泛素连接酶,在T细胞和巨噬细胞功能中发挥重要作用gydF4y2Ba42gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba.然而,它在骨骼系统中的作用仍然未知。我们发现PDLIM2在骨骼系统中的关键作用是通过靶向STAT3泛素化来控制骨细胞中的RANKL。MYD88通路的激活减少了骨细胞富集细胞中含有CREB/CBP和FBXL19的分子复合物的形成,同时减少了CREB/CBP的泛素化。同样,它减少了PDLIM2与STAT3的相互作用,减少了STAT3的泛素化。这些结果表明,CREB/CBP和STAT3与它们的泛素连接酶相互作用的减少是促进CREB/CBP和STAT3蛋白稳定性的主要原因,这是细菌炎症骨细胞中RANKL诱导的原因。MYD88通路激活后FBXL19和PDLIM2蛋白水平的下调可能是减少这些分子相互作用的潜在机制。由于过表达FBXL19或PDLIM2会抑制骨细胞中的RANKL,因此阻止FBXL19和PDLIM2蛋白的减少或增加这些泛素连接酶的稳定性将是抑制骨细胞中RANKL的策略。FBXL19降解受fbxw17介导的泛素化和cbp介导的乙酰化调控gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba.控制这些FBXL19降解的机制可能是抑制骨感染中破骨细胞生成的一种方法。需要揭示PDLIM2降解和mRNA转录的调控机制,以确定通过PDLIM2抑制RANKL的策略。由于MYD88信号通路激活NF-kB通路,NF-kB p65是PDLIM2的另一个泛素化靶点gydF4y2Ba65gydF4y2Ba,在pam3刺激的骨细胞中,pdlim2介导的p65泛素化也可能降低,从而上调促炎基因表达。总之,我们的数据表明FBXL19和PDLIM2在骨细胞中调控MYD88下游的RANKL诱导,这表明这些泛素连接酶是骨感染中骨溶解的治疗靶点。gydF4y2Ba
值得注意的是,在骨细胞富集的细胞群中,Pam3激活MYD88通路可在12小时后增加CREB、CBP和STAT3蛋白的稳定性。因为gydF4y2BaRanklgydF4y2Ba在Pam3刺激后8和48小时,CREB、CBP和STAT3的表达达到峰值,其稳定性的增加可能与Pam3刺激后的凋亡有关gydF4y2BaRanklgydF4y2Ba晚期诱导。相反,CREB和STAT3磷酸化增加8小时,导致它们结合到gydF4y2BaRanklgydF4y2Ba增强子,很可能是造成gydF4y2BaRanklgydF4y2Ba早期诱导。骨细胞来源的炎症因子(如IL-6)对这些tf稳定性的旁分泌或自分泌作用需要进行研究,以确定除了MYD88途径之外的信号通路是否分别通过FBXL19和PDLIM2调节CREB/CBP和STAT3的降解。我们的数据表明,通过抑制剂或siRNA处理单独抑制CREB或STAT3可有效抑制pam3诱导gydF4y2BaRanklgydF4y2Ba表明CREB和STAT3共同调节骨细胞中RANKL的转录。有趣的是,Pam3注射减少了gydF4y2Ba功能gydF4y2Ba与MYD88缺失无关,表明不依赖MYD88的OPG抑制机制,最有可能发生在成骨细胞中gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba,在骨感染时与骨细胞RANKL合作促进骨溶解。最终,这些通过Pam3识别的诱导RANKL表达的分子机制需要在活细菌刺激的骨细胞中验证。gydF4y2Ba
在gydF4y2BaPggydF4y2Ba-相关牙周炎、T细胞和B细胞是RANKL的潜在来源gydF4y2Ba19gydF4y2Ba,gydF4y2Ba71gydF4y2Ba.然而,在牙槽骨损失中未发现明显的挽救gydF4y2BaPggydF4y2Ba这表明来自这些淋巴细胞的RANKL对小鼠中破骨细胞的形成并不是至关重要的gydF4y2BaPggydF4y2Ba-诱导牙周炎模型。相比之下,两者gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba;gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba而且gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaRanklgydF4y2Bafl / flgydF4y2Ba小鼠的牙槽骨溶解表现出显著的拯救,从而证实骨细胞是RANKL的主要来源gydF4y2BaPggydF4y2Ba全身的牙周炎。这些发现表明,无论参与牙槽骨丢失的免疫细胞类型如何,骨细胞都是RANKL的主要和直接来源,负责由骨细胞驱动的破骨细胞形成gydF4y2BaPggydF4y2Ba感染。重要的是,我们来自rag1缺陷小鼠的数据表明,骨细胞中的RANKL诱导独立于T和B细胞的激活gydF4y2BaPggydF4y2Ba牙周炎。在结扎诱导的牙周炎模型中,研究骨细胞RANKL在破骨细胞生成中所需要的程度将是有趣的gydF4y2BaHgydF4y2Ba17细胞对牙周韧带细胞和成骨细胞的RANKL表达有重要的诱导作用gydF4y2Ba72gydF4y2Ba.gydF4y2Ba
在此之前,gydF4y2BaPggydF4y2Ba在小鼠和人类中,是否显示出侵入上皮细胞和牙周韧带细胞以刺激炎症反应导致牙周炎gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba.我们的研究表明骨细胞腔隙-管系统可以包庇gydF4y2BaPggydF4y2Ba组件,以及热杀伤gydF4y2BaPggydF4y2Ba而且gydF4y2BaPggydF4y2Ba培养上清增加gydF4y2BaRanklgydF4y2Ba骨细胞富集细胞的表达。这些结果表明gydF4y2BaPggydF4y2Ba来源于骨细胞的病原体直接与骨细胞相互作用刺激gydF4y2BaRanklgydF4y2Ba在体内通过TLR2-MYD88途径表达。致病成分gydF4y2BaPggydF4y2Ba可通过口腔局部血液循环系统到达骨细胞。因此,检查它是否存活将是很有趣的gydF4y2BaPggydF4y2Ba侵入并存活于牙槽骨的腔隙-管隙。作为gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠感染gydF4y2BaPggydF4y2Ba显示从牙槽骨丢失抢救和gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba小鼠感染gydF4y2BaPggydF4y2Ba我们认为,细菌PAMPs直接激活牙槽骨细胞是牙周骨丢失的病理机制,MYD88通路可能是牙周病的治疗和预防靶点。事实上,在本研究中,MYD88抑制剂治疗阻止了由药物引起的牙槽骨丢失的进展gydF4y2BaPggydF4y2Ba.最终,骨细胞特异性药物输送系统将需要开发,因为全身MYD88抑制将增加宿主对细菌感染的易感性,并损害宿主免疫系统的细菌清除gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba.gydF4y2Ba
虽然我们已经证明了骨细胞MYD88通路在骨感染中的关键作用,但目前的研究存在局限性。最近的报告显示gydF4y2BaDmp1-CregydF4y2Ba在Ai9/14报告小鼠的骨细胞和成熟成骨细胞中都有活性gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.然而,以前的研究并没有直接比较gydF4y2BaDmp1-CregydF4y2Ba-介导的原代骨细胞与成骨细胞之间的靶向基因重组效率。我们发现gydF4y2BaDmp1gydF4y2Ba通过直接比较Ocy和Ob之间MYD88、RANKL和TLR2蛋白的缺失/恢复效率,启动子对骨细胞具有高度特异性。这种差异可能是由于检测敏感性的差异。Ai9/14小鼠可能对微量的gydF4y2BaCregydF4y2Ba不足以删除其他柔性转基因的表达gydF4y2Ba79gydF4y2Ba.另外,gydF4y2BaDmp1-CregydF4y2Ba骨细胞特异性是否表现在靶向结构、靶基因、骨类型和位置或骨化类型依赖的方式上gydF4y2Ba79gydF4y2Ba.的显著选择性gydF4y2BaDmp1-CregydF4y2Ba对于颅骨骨细胞,gydF4y2BaDmp1-CregydF4y2Ba是最可靠的gydF4y2BaCregydF4y2Ba目前涉及破骨细胞和免疫细胞的骨细胞研究的驱动力,因为不像gydF4y2BaSost-CregydF4y2Ba10gydF4y2Ba,对造血祖细胞分化为破骨细胞、T/B淋巴细胞或髓系细胞表现出很少或没有脱靶活性。在目前的研究中,1)Ocy对细菌PAMPs具有更强的RANKL诱导能力,这可以在IDG-SW3细胞中得到重现(补充图。gydF4y2Ba19gydF4y2Ba), 2)越大gydF4y2BaDmp1-CregydF4y2Ba3)骨细胞是骨中最丰富的细胞类型,这一事实可能是得出骨细胞在骨感染中调节骨溶解起关键作用的结论的依据。然而,我们从成骨细胞中分离骨细胞的方法仍然不理想和不完善,并且从颅骨中分离出的Ocy和Ob群体明显是异质性的。因此,我们的研究结果可以解释为,骨细胞和成熟成骨细胞中的MYD88通路,但主要是骨细胞中的通路,在口腔和颅面区pamps驱动的骨溶解机制中发挥着重要作用。这一解释得到了数据的支持gydF4y2BaOsteocalcin-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba在Ocy和Ob中缺乏MYD88的小鼠表现出与在gydF4y2BaDmp1-CregydF4y2Ba;gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba小鼠(补充图;gydF4y2Ba20.gydF4y2Ba).明确的骨细胞特异性的未来发展gydF4y2BaCregydF4y2Ba需要老鼠。也可以想象骨细胞TLR-MYD88-RANKL轴影响骨溶解的程度取决于病原体和骨感染的部位。我们的研究不排除T/B细胞或其他细胞RANKL来源的可能,例如malpgydF4y2Ba80gydF4y2Ba在细菌引发骨吸收的机制中。重要的是,在CAR细胞、骨骼肌细胞和经皮质血管周围细胞的子集中,MYD88可能的缺失/恢复gydF4y2BaDmp1-CregydF4y2Ba需要在解释我们的发现时加以考虑gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba81gydF4y2Ba.尤其值得关注的是,研究CAR细胞是否是骨感染中破骨细胞诱导的关键RANKL供应商。gydF4y2Ba
总之,我们的研究确定了MYD88通路在骨骼系统中的作用,并揭示了骨细胞是嵌入在骨骼中的细菌传感器,可以转化为产生RANKL的炎症细胞。我们还发现,细菌刺激的骨细胞,在某种程度上也可能是细菌刺激的成熟成骨细胞,具有通过RANKL诱导和炎症细胞募集直接独立地触发和发展骨溶解的能力(补充图)。gydF4y2Ba21gydF4y2Ba).这些对骨细胞的研究表明,骨细胞是通过RANKL介导的破骨细胞形成和骨吸收的中心调节因子。由于骨细胞MYD88通路的激活是细菌感染引起炎性骨溶解的重要原因,因此靶向骨细胞中的MYD88信号通路和下游RANKL调控机制将是牙周炎和骨髓炎中骨破坏的一种治疗策略。同样,关节炎患者的骨骼破坏是由MYD88突变引起的gydF4y2Ba82gydF4y2Ba也许能从同样的治疗策略中获益。gydF4y2Ba
方法gydF4y2Ba
研究批准gydF4y2Ba
所有突变小鼠系和实验程序都得到了印第安纳大学医学院机构动物护理和使用委员会(IACUC)和印第安纳大学机构生物安全委员会(IBC)的批准。gydF4y2Ba
老鼠gydF4y2Ba
C57BL / 6 J,gydF4y2BaMyd88gydF4y2Bafl / flgydF4y2Ba,gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba,gydF4y2BaRanklgydF4y2Bafl / flgydF4y2Ba,gydF4y2BaIl1r1gydF4y2Bafl / flgydF4y2Ba,gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba,gydF4y2BaMyd88gydF4y2Ba−−/gydF4y2Ba,gydF4y2BaTlr2gydF4y2Ba−−/gydF4y2Ba,gydF4y2BaTlr4gydF4y2Balps-de / lps-delgydF4y2Ba,gydF4y2BaDmp1-CregydF4y2Ba,gydF4y2BaOsteocalcin-CregydF4y2Ba小鼠来自Jackson实验室(Bar Harbor, ME, USA)。gydF4y2BaTlr2gydF4y2Bafl / flgydF4y2Ba小鼠由博士提供。罗哈斯,哈丁,还有Boom。所有小鼠都在特异性无病原体(SPF)条件下饲养gydF4y2BaMyd88gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaMyd88gydF4y2Balsl / lslgydF4y2Ba这些小鼠在SPF级条件下饲养,并使用高压灭菌饲料和酸化水(pH值2.3至2.8)。gydF4y2Ba
CregydF4y2Ba重组分析gydF4y2BaMyd88gydF4y2Ba基因组DNA PCRgydF4y2Ba
使用DNeasy血液和组织试剂盒(Qiagen)分离基因组DNA。10ng DNA用于PCR反应。gydF4y2Ba
Pam3CSK4颅骨注射,gydF4y2Ba大肠杆菌gydF4y2Ba有限合伙人,gydF4y2Ba金黄色葡萄球菌gydF4y2Ba英国网球协会,gydF4y2BaPggydF4y2Ba有限合伙人gydF4y2Ba
Pam3CSK4,gydF4y2Ba金黄色葡萄球菌gydF4y2Ba英国网球协会,gydF4y2BaPggydF4y2Ba将LPS(100µg, 20µL PBS/只)每隔一天注射于10 ~ 11周龄小鼠的头颅,共注射3次(注射第一天=第1天),第6天用qPCR检测基因表达。第7天用显微ct和组织形态学检查骨骼。第7天采用苏木精-伊红(H&E)染色和免疫组化染色检测头皮皮损。超纯脂多糖gydF4y2Ba大肠杆菌gydF4y2Ba(100µg, 20µL PBS/只)每隔一天注射一次,共2次。第4天用qPCR检测小鼠,第5天用显微ct和组织形态学检测小鼠。冠状线和矢状线的交点被用作注射的参考位置。gydF4y2Ba
在体外gydF4y2BaPggydF4y2Ba文化gydF4y2Ba
PggydF4y2Ba(ATCC 33277)在羊血琼脂板上培养,并进一步在添加酵母提取物(5 g/L)、血红素(5 mg/L)和甲萘醌(50 mg/L)的胰蛋白酶大豆肉汤中培养,在37°C的厌氧条件下(AnaeroPack, Mitsubishi)。密度gydF4y2BaPggydF4y2Ba用600 nm处的吸光度测定。离心后,收集上清液,通过0.2µm过滤器过滤。gydF4y2BaPggydF4y2BaPBS洗净,70℃热杀菌1小时,悬浮在上面的培养基中。没有直播gydF4y2BaPggydF4y2Ba通过培养热杀菌证实了吗gydF4y2BaPggydF4y2Ba.gydF4y2BaPggydF4y2Ba上清液和热杀灭gydF4y2BaPggydF4y2Ba每次实验都是新鲜出炉的。gydF4y2Ba
灯心草注射液活gydF4y2BaPggydF4y2Ba
PggydF4y2Ba(2 × 10gydF4y2Ba9gydF4y2Ba10 ~ 11周龄小鼠颅骨注射CFU (20 μ L生长介质/只),每日5次(注射第一天=第1天),第6天分析骨组织。gydF4y2Ba
活的口服接种gydF4y2BaPggydF4y2Ba
10 ~ 11周龄小鼠在饮用水中加入磺胺嘧啶(200 mg磺胺甲恶唑和40 mg甲氧苄氨嘧啶/5 mL)预处理7天,以减少共生口腔菌群数量。用不含硫磺胺的水间隔3天后(第10天),2 × 10gydF4y2Ba9gydF4y2BaCFU的gydF4y2BaPggydF4y2Ba(ATCC 33277)以50µL 2%羧甲基纤维素(CMC)/PBS接种于麻醉小鼠的整个牙龈组织,每隔一天接种一次,连续注射5次。对照组小鼠单独接种对照物(2% CMC)。用免疫荧光染色法检测小鼠agydF4y2BaPggydF4y2Ba最后一次接种后第7天进行qPCR和组织形态测定,42天进行显微ct扫描。gydF4y2Ba
MicroCT分析gydF4y2Ba
颅骨组织(Pam3CSK4第7天,gydF4y2Ba金黄色葡萄球菌gydF4y2Ba英国网球协会,gydF4y2BaPggydF4y2Ba有限合伙人。第6天直播gydF4y2BaPggydF4y2Ba.第五天gydF4y2Ba大肠杆菌gydF4y2Ba将LPS用4%多聚甲醛(PFA)固定24 h,用70%乙醇浸泡后用Skyscan1176 (Bruker)扫描,扫描条件为:x射线能量50 kV,像素尺寸8.43 μm,旋转步长0.3°,曝光时间926 ms。扫描数据用NRecon软件(Bruker)重构,动态范围0 ~ 0.18。利用CTVox软件(Bruker)基于体绘制方法绘制三维图像。用ImageJ (NIH)测量位于冠状线和矢状线交点中心的6 × 6mm颅骨区域的骨侵蚀面积(包括缝线)(约713片)为像素,并除以总像素数。采用CTAnalyser (Bruker)在6 × 6 mm区域定量骨表面/骨体积(BS/BV)和骨体积/组织体积(BV/TV),阈值为48。用Skyscan1176扫描上颌骨(末次接种后42 d),动态范围为0 ~ 0.22。创建三维图像,使用DataViewer (Bruker)将咬合平面与横切面对齐。利用CTAnalyser重建的二维图像测量右上颌三磨牙下12个尖牙的牙槽骨嵴(ABC)与牙槽牙釉质交界处(CEJ)的总距离。采用右上颌第二磨牙下两颊根间的10片牙槽骨进行BV/TV定量,阈值为65。在体显微ct扫描颌骨时,小鼠用异氟醚麻醉,用CTAnalyser测量CEJ-ABC距离,旋转步长0.6°,阈值为40。gydF4y2Ba
H&E染色及组织形态学分析gydF4y2Ba
颅骨和上颌用4% PFA固定24 h, EDTA (0.5 M, pH 7.2)脱钙,石蜡包埋。在冠状面切割6个μm切片,进行H&E和抗酒石酸酸性磷酸酶(TRAP)染色。采用Bioquant Osteo软件盲法测定右上颌第一磨牙下冠状线与矢状线交叉前后3mm的颅骨表面或近牙根与颊根之间的牙槽骨表面的破骨细胞/骨面(N.Oc/BS)和破骨细胞/骨面(Oc.S/BS)数量。gydF4y2Ba
免疫组化和免疫荧光染色gydF4y2Ba
石蜡切片用10 μg/mL蛋白酶K (Gold Biotechnology)在37℃下处理10 min,提取抗原,用3% H淬灭内源性过氧化物酶gydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba/ PBS的解决方案。用产生二抗的动物种2%血清阻断后,切片用抗MYD88 (LS-C357983, LSBio)、TLR2 (NB100-56720, Novus)、TLR4 (ab13867, Abcam)、F4/80(克隆A3-1, Bio-Rad)、Ly-6G (sc-53515, Santa Cruz Biotechnology)或gydF4y2BaPggydF4y2Ba(DMAB9447,创新诊断)过夜在4°C。M.O.M试剂盒(矢量实验室)用于抗gydF4y2BaPggydF4y2Ba抗体PBS清洗后,切片用生物素化二抗(Vector Laboratories)在室温下孵育60分钟,并用vecastain®Elite ABC-HRP Kit (Vector Lab)处理。用ImmPACT DAB (Vector Lab)显色后,切片用甲基绿或苏木精反染。为gydF4y2BaPggydF4y2Ba成分检测采用Alexa Fluor 488偶联二抗(Invitrogen), DAPI (Thermo Fisher)反染。gydF4y2Ba
成骨细胞和骨细胞富集细胞群的分离gydF4y2Ba
无菌解剖10 ~ 11周龄C57BL/6 J雄性小鼠颅骨,切成3 × 3 mm小片。如参考文献所述,混合的骨块被连续消化。gydF4y2Ba31gydF4y2Ba.ⅰ型胶原酶(300 U/mL, Worthington生化)α-MEM (Thermo Fisher)和EDTA (5 mM, pH = 7.4;ACROS Organics)在不含Ca和mg的Hank’s平衡盐溶液(HBSS, Thermo Fisher)中添加1% BSA (Research Product International)。所有消化步骤均在3.5 mL溶液中进行,6孔板在5% CO的条件下以170 RPM旋转gydF4y2Ba2 gydF4y2Ba37°C。每次消化后,收集消化液,用HBSS冲洗骨片两次,然后将消化液和HBSS组合为单一组分(F)。组合细胞悬液在500 g下旋转5 min,重悬于添加10%胎牛血清和1%青霉素/链霉素(P/S)的α-MEM中(赛默飞世尔),然后每个组分培养48 h。为了进行机制研究,使用CD45 +细胞衰竭试剂盒(Invitrogen)从混合的F1−4细胞和F6−9细胞中去除造血细胞。为了更好地分离骨细胞和成骨细胞,F5被排除在实验之外。从F1-4和F6-9中纯化的cd45阴性细胞分别被认为是成骨细胞富集细胞群(Ob)和成骨细胞富集细胞群(Ocy)。Ob和Ocy悬浮在α-MEM上,播种在100 mm培养皿上。48 h后,去除未附着的死细胞,在8孔载玻片(1 × 10gydF4y2Ba4gydF4y2Ba每孔细胞),6孔板(1.0 × 10gydF4y2Ba5克ydF4y2Ba每孔细胞)或60mm培养皿(5.0 × 10gydF4y2Ba5克ydF4y2Ba细胞)进行进一步的研究,包括Ocy和Ob的验证,比较gydF4y2BaDmp1-CregydF4y2BaOcy与Ob的特异性(补充图;gydF4y2Ba11 dgydF4y2Ba),以及RANKL在Ocy中的调控机制的研究。Ocy在涂有鼠尾I型胶原蛋白的培养皿上培养(细胞应用)。gydF4y2Ba
免疫荧光染色分析Ocy和Ob中硬化蛋白和角化蛋白的表达gydF4y2Ba
Ocy和Ob以1 × 10的密度在8孔腔室载玻片(康宁)上接种,涂有或不涂有I型胶原蛋白gydF4y2Ba4gydF4y2Ba每孔细胞。将细胞用4%的PFA在室温(RT)下PBS固定10分钟,然后用PBS轻轻洗涤5分钟三次。在RT下用0.2% Triton X-100在PBS中渗透10分钟,用PBS洗涤5分钟三次后,用2% BSA/PBS和2%驴或山羊血清(Sigma-Aldrich)在RT下孵育30分钟。抗硬化蛋白抗体(R&D systems, AF1589)或抗角化蛋白抗体(Abcam, ab128304)在4℃下轻轻摇晃过夜。PBS洗涤后,用Alexa Fluor®594驴抗山羊抗体或Alexa Fluor®594山羊抗兔子抗体(Thermo Fischer)在rt下孵育1小时。用正常山羊或兔子IgG作阴性对照。用Alexa Fluor 488 phalloidin (Invitrogen, A12379)观察f -肌动蛋白。用4′,6-二氨基-2-苯基吲哚(DAPI)染色细胞核。荧光图像采用BZ-X800显微镜(Keyence,大阪,日本)获得。计算硬化蛋白或角化蛋白阳性细胞的百分比(阳性细胞的数量除以细胞总数),并在每个孔的五个随机区域中平均。gydF4y2Ba
刺激Ob和OcygydF4y2Ba
用Pam3CSK4 (100 ng/mL)、Pam2CSK4 (100 ng/mL)、超纯脂多糖(LPS)刺激Ob和OcygydF4y2Ba大肠杆菌gydF4y2Ba(100 ng/mL)、FLA-ST (100 ng/mL)或单链RNA (100 ng/mL) (InvivoGen)。gydF4y2Ba
RNA隔离gydF4y2Ba
RNA采用RiboZol RNA提取试剂(VWR)提取。取位于冠状线和矢状线交点中心的颅骨骨组织(6 × 6mm)和颅骨皮肤组织(6 × 6mm)进行RNA提取。采用上颌腭侧牙龈组织(1 × 3 mm)和上颌下颌骨组织(包括磨牙)进行RNA提取。除去软组织后,颅骨和颌骨组织在液氮中快速冷冻,然后使用组织粉碎机(Cellcrusher Limited)粉碎成粉末。用组织研磨机(赛默费雪公司)将牙龈组织均质。Ob和Ocy经移液均质。gydF4y2Ba
反向转录-定量PCR (qPCR)分析gydF4y2Ba
用Ribozol (VWR)分离总RNA,用高容量cDNA逆转录试剂盒(Life Technologies)逆转录1µg RNA。qPCR采用PowerUp SYBR Green master mix进行,qantstudio设计分析软件(赛默飞世尔)进行分析。本研究使用的qPCR引物见补充表gydF4y2Ba1gydF4y2Ba.用相对标准曲线法计算相对基因表达水平。的表达水平归一化gydF4y2BaGapdhgydF4y2Ba除了图9I和9m,其中由gydF4y2Baβ肌动蛋白gydF4y2Ba用于归一化。gydF4y2Ba
体外破骨细胞形成gydF4y2Ba
骨髓细胞取自10至12周大的股骨和胫骨gydF4y2BaMyd88gydF4y2Ba−−/gydF4y2Ba老鼠。用红细胞裂解缓冲液(eBioscience)裂解红细胞后,骨髓细胞在含有10%胎牛血清和P/S的α-MEM中孵育3小时,使基质细胞粘附在培养皿上。收集非贴壁细胞,在10 cm培养皿中接种,在M-CSF (25 ng/mL, PeproTech)存在下孵育2天,以获得骨髓来源的M-CSF依赖性巨噬细胞(BMMs)作为破骨细胞前体细胞。在添加10% FBS和P/S的α-MEM中以2.0 × 10的密度在48孔板上培养Ob和OcygydF4y2Ba3 gydF4y2Ba细胞/孔培养24 h,然后以2.0 × 10的密度播种BMMsgydF4y2Ba4gydF4y2Ba细胞/。8 h后,用100ng /mL Pam3CSK4或Pam3CSK4刺激共培养细胞gydF4y2Ba大肠杆菌gydF4y2Ba在25 ng/mL M-CSF存在的LPS中(第1天)。含有M-CSF的培养基每48小时更换一次,Pam3CSK4或gydF4y2Ba大肠杆菌gydF4y2Ba每24小时向培养物中添加LPS。TRAP阳性(+)细胞在第7天用TRAP染色试剂盒(Sigma-Aldrich)观察,超过3个核的TRAP +细胞计数为破骨细胞(TRAP + MNCs)。gydF4y2Ba
Ocy的抑制剂治疗gydF4y2Ba
U0126、SP600125、SB203580 (Cell Signaling Technology, CST)、BMS-345541 (Sigma-Aldrich)、666-15、C188-9、STAT5-IN-1、T-5224、CADD522、H-89 (Med Chem Express)和T6167923 (Aobious)用于阻断特定的分子或激酶。环己亚胺(APExBIO)用于阻断蛋白质合成。所有抑制剂均在TLR激动剂刺激前2小时加入。gydF4y2Ba
西方墨点法gydF4y2Ba
用冰冷的PBS清洗细胞,用含有蛋白酶抑制剂鸡尾酒(P8340, Sigma-Aldrich)和磷酸酶抑制剂(P0044和P5726, Sigma-Aldrich)的NP-40裂解缓冲液(150 mM NaCl, 1% NP-40, 25 mM Tris-HCl (pH7.4), 5 mM EDTA, 10%甘油,2.5 mM热磷酸钠,1 mM β-甘油磷酸酯)在冰上裂解细胞。用BCA蛋白测定试剂盒(赛默飞世尔)测定蛋白质浓度。蛋白质在Laemmli缓冲液中煮沸5分钟。在7.5或10%的聚丙烯酰胺凝胶上分离每巷10至15微克蛋白质,转移到硝化纤维膜上进行Western blotting分析。用5%脱脂脱脂牛奶在含有Tween-20的tris缓冲盐水溶液(TBST)中阻塞后,用含有一抗的Can Get Signal溶液(TOYOBO)在4℃下孵育一夜,然后用相应的HRP偶联二抗(CST)孵育。使用SuperSignal West Dura或Femto化学发光衬底(Thermo Fisher)检测波段,并使用Celvin S 320+化学发光成像仪(Biostep)进行可视化。为了进行定量比较,样品来自同一实验,并并行处理印迹。本研究中使用的一抗列在补充表中gydF4y2Ba2 gydF4y2Ba.gydF4y2Ba
慢病毒转导IDG-SW3细胞的研究gydF4y2Ba
IDG-SW3细胞(由印第安纳大学Lynda Bonewald提供)在33℃培养gydF4y2BaogydF4y2BaC存在IFN-γ (50 U/mL, Gibco)。慢病毒含有老鼠gydF4y2BaFbxl19gydF4y2Ba、鼠标gydF4y2BaPdlim2gydF4y2Ba、鼠标gydF4y2BaFbxl19gydF4y2BashRNA,或鼠标gydF4y2BaPdlim2gydF4y2BashRNA和阴性对照慢病毒购自GeneCopoeia。1.0 × 10gydF4y2Ba5克ydF4y2Ba将IDG-SW3细胞接种在大鼠尾I型胶原蛋白涂层的60mm培养皿上,并在聚brene(8µg/mL)存在下以5的感染倍数(MOI)感染慢病毒。72 h后开始嘌呤霉素筛选(5µg/mL)。37℃扩增培养耐嘌呤霉素IDG-SW3细胞gydF4y2BaogydF4y2BaC在缺乏IFN-γ的情况下28天分化成成熟的骨样细胞,然后用Pam3CSK4刺激。gydF4y2Ba
siRNA转染MLO-Y4细胞gydF4y2Ba
MLO-Y4细胞(由印第安纳大学Lynda Bonewald提供)接种于6孔板上,涂有大鼠尾I型胶原蛋白(5 × 10gydF4y2Ba4gydF4y2Ba在添加2.5%胎牛血清、2.5%小牛血清和1% P/S的α-MEM中培养,温度为37℃,温度为5% CO2。使用TransIT-X2®动态传递系统(Mirus)转染sirna(每个25 nM)。24 h后,将培养基更换为不含抗生素的培养基。将TransIT-X2中siRNAs或对照siRNAs的复合物添加到培养基中。siRNA转染48 h后,收集细胞进行qPCR分析。gydF4y2Ba
Immuno-coprecipitationgydF4y2Ba
用冰冷的PBS清洗细胞两次,用NP-40裂解缓冲液裂解细胞。用蛋白A/ g - plus -琼脂糖(Santa Cruz Biotechnology)预清除后,300µg总蛋白与1µg抗cbp抗体(#7389,CST)、抗creb抗体(#9197,CST)和抗stat3抗体(#12640,CST)在4℃孵育过夜,然后与20µL蛋白A/ g - plus -琼脂糖孵育3小时。将析出的琼脂糖用裂解液洗涤三次后,在Laemmli缓冲液中重悬,煮沸5min。样品进行SDS-PAGE,然后进行Western blotting。gydF4y2Ba
用核酸酶(CUT & RUN)测定目标下的裂解和释放gydF4y2Ba
所有步骤均按照制造商的方案(CUT & RUN检测试剂盒,CST)进行。简单来说就是2 × 10gydF4y2Ba5克ydF4y2Ba将Ocy细胞重悬于洗涤缓冲液(20 mM HEPES-NaOH pH 7.5, 150 mM NaCl, 0.5 mM亚精胺和蛋白酶抑制剂鸡尾酒)中,加入刀豆素a磁珠,然后在室温下旋转10分钟。将细胞-珠缀合物重悬于200µL含有2µg抗cbp (#7389, CST)、抗creb (#9197, CST)、抗stat3 (#12640, CST)、抗crtc2 (MAB6338, R&D)一抗或兔IgG (# 66362, CST)的地黄皂苷缓冲液(2.5%地黄皂苷溶液清洗缓冲液)中,在4°C旋转过夜,重悬于250µL抗体缓冲液和7.5µL pagg - mnase酶(# 57813,CST)中,然后在4°C旋转1小时。用洋地黄苷缓冲液清洗后,将150µL含有氯化钙的洋地黄苷缓冲液冷冻gydF4y2Ba2 gydF4y2Ba加入,并在冰上孵育30分钟,然后加入150µL含有5 nggydF4y2Ba酿酒酵母gydF4y2Ba用于样品归一化的插入DNA。37°C孵育15分钟后,样品在16000 g下在4°C下离心2分钟。将试管置于磁架上,收集上清液。使用DNA纯化缓冲液和旋转柱(#14209,CST)纯化DNA。qPCR采用补充表中的引物gydF4y2Ba3 gydF4y2Ba来定量DNA的数量gydF4y2BaRanklgydF4y2Ba启动子和增强子区域。对每个抗体使用%输入法计算数据,并表示为相对于同型对照(兔IgG)的倍数富集。gydF4y2Ba
ELISAgydF4y2Ba
用小鼠sRANKL预包被ELISA试剂盒(Biogems)测定细胞培养上清中可溶性RANKL水平。荧光强度用SpectroMax i3采集,用SoftMax Pro6 (Molecular Devices)分析。gydF4y2Ba
体内MYD88抑制剂给药gydF4y2Ba
从最后一天开始,每隔一天腹腔注射T6167923 (40 mg/kg)gydF4y2BaPggydF4y2Ba接种至分析之日。gydF4y2Ba
统计数据gydF4y2Ba
双尾学生的gydF4y2BatgydF4y2Ba-test用于比较两组之间的均值。使用单向方差分析和Tukey-Kramer事后检验来比较三个或三个以上组之间的均值。gydF4y2BapgydF4y2Ba< 0.05被认为是显著的。采用GraphPad Prism软件进行统计分析。对男性和女性组进行独立分析,以检测性别二态性。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的所有数据均可在本文及其补充信息文件中获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Ruff, W. E., Greiling, t.m.和Kriegel, m.a.宿主-微生物群在免疫介导疾病中的相互作用。gydF4y2BaNat. Rev.微生物。gydF4y2Ba18gydF4y2Ba, 521-538(2020)。gydF4y2Ba
罗布林,A. G. & Bonewald, L. F.骨细胞:新见解。gydF4y2Ba年Rev.物理。gydF4y2Ba82gydF4y2Ba, 485-506(2020)。gydF4y2Ba
de Mesy Bentley, K. L.等。在小鼠骨髓炎模型中,金黄色葡萄球菌在活皮质骨小管中变形、增殖和迁移的证据。gydF4y2Ba挖骨者。Res。。j。Soc。骨矿商。Res。gydF4y2Ba32gydF4y2Ba, 985-990(2017)。gydF4y2Ba
杨德强等。对金黄色葡萄球菌深层骨感染的新见解:骨细胞的参与。gydF4y2BaMbiogydF4y2Ba9gydF4y2Ba, e00415-e00418(2018)。gydF4y2Ba
de Mesy Bentley, K. L., MacDonald, A., Schwarz, E. M. & Oh, I.慢性骨髓炎合并骨细胞亚微米小管内金黄色葡萄球菌变形:一例报告。gydF4y2BaJBJS案例连接gydF4y2Ba8gydF4y2Ba, e8(2018)。gydF4y2Ba
周敏,李松生,李建军,李志强。促炎性细胞因子与骨细胞的关系。gydF4y2Ba咕咕叫。Osteoporos。代表。gydF4y2Ba17gydF4y2Ba, 97-104(2019)。gydF4y2Ba
Kitaura, H.等。骨细胞相关细胞因子调节破骨细胞形成和骨吸收。gydF4y2BaInt。理学。gydF4y2Ba21gydF4y2Ba, 5169(2020)。gydF4y2Ba
熊,J.等。基质嵌入细胞控制破骨细胞的形成。gydF4y2BaNat,地中海。gydF4y2Ba17gydF4y2Ba, 1235-1241(2011)。gydF4y2Ba
Nakashima, T.等。骨细胞通过RANKL表达调节骨稳态的证据。gydF4y2BaNat,地中海。gydF4y2Ba17gydF4y2Ba, 1231-1234(2011)。gydF4y2Ba
熊,J.等。骨细胞,而不是成骨细胞或衬细胞,是骨重塑中破骨细胞形成所需的RANKL的主要来源。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba10gydF4y2Ba, e0138189(2015)。gydF4y2Ba
格雷夫斯,d.t.等人。骨细胞通过RANKL的表达在健康和糖尿病小鼠实验性牙周炎中发挥重要作用。gydF4y2Baj .中国。Periodontol。gydF4y2Ba45gydF4y2Ba, 285-292(2018)。gydF4y2Ba
Kawai, T. & Akira, S.模式识别受体在先天免疫中的作用:toll样受体的最新进展。gydF4y2BaImmunol Nat。gydF4y2Ba11 gydF4y2Ba, 373-384(2010)。gydF4y2Ba
O 'Neill, L. A. & Bowie, A. G.五口之家:toll样受体信号转导中含有tir结构域的适配器。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba7 gydF4y2Ba, 353-364(2007)。gydF4y2Ba
卡塞姆,A.等。牙龈卟啉单胞菌通过激活成骨细胞中的toll样受体2,增强RANKL (NF-kappaB配体受体激活因子),从而刺激骨吸收。gydF4y2Ba生物。化学。gydF4y2Ba290gydF4y2Ba, 20147-20158(2015)。gydF4y2Ba
佐藤,N.等。MyD88而不是TRIF在脂多糖、二酰基脂肽和il -1诱导的破骨细胞发生中是必不可少的。gydF4y2Ba实验,医学。gydF4y2Ba200gydF4y2Ba, 601-611(2004)。gydF4y2Ba
Tang Y.等。牙根卟啉单胞菌脂多糖通过小鼠成骨细胞诱导RANKL的方式不同于大肠杆菌脂多糖。gydF4y2Baj . Endod。gydF4y2Ba37gydF4y2Ba, 1653-1658(2011)。gydF4y2Ba
于,K.等。脂多糖通过激活ERK1/2信号通路增加IL-6的分泌,从而上调MLO-Y4细胞中RANKL基因的表达。gydF4y2Ba细胞生物。IntgydF4y2Ba41gydF4y2Ba, 84-92(2017)。gydF4y2Ba
马尔科姆,J.等。IL-33通过诱导RANKL加重牙周病。gydF4y2Baj .凹痕。Res。gydF4y2Ba94gydF4y2Ba, 968-975(2015)。gydF4y2Ba
韩,x等。牙龈卟啉单胞菌感染相关牙周骨吸收依赖于NF-kappaB配体受体激活剂。gydF4y2Ba感染。Immun。gydF4y2Ba81gydF4y2Ba, 1502-1509(2013)。gydF4y2Ba
Burns, E., Bachrach, G., Shapira, L. & Nussbaum, G.前沿:TLR2是对牙龈卟啉单胞菌的先天反应所必需的:激活导致细菌持续存在,TLR2缺乏减弱诱导的牙槽骨吸收。gydF4y2Baj . Immunol。gydF4y2Ba177gydF4y2Ba, 8296-8300(2006)。gydF4y2Ba
帕帕多普洛斯等人。巨噬细胞特异性TLR2信号通路介导病原体诱导的tnf依赖性炎症性口腔骨质丢失gydF4y2Baj . Immunol。gydF4y2Ba190gydF4y2Ba, 1148-1157(2013)。gydF4y2Ba
Pesce Viglietti, a.i.等。流产布鲁氏菌入侵骨细胞调节连接蛋白43和整合素表达,并通过NF-kappaB配体受体激活剂和肿瘤坏死因子α分泌诱导破骨细胞形成。gydF4y2Ba感染。Immun。gydF4y2Ba84gydF4y2Ba, 11-20(2016)。gydF4y2Ba
高木,R.等。S100A9在骨细胞样细胞中通过MAPKs和STAT3信号通路增加IL-6和RANKL的表达。gydF4y2Ba生物医学。Res Int。gydF4y2Ba2020gydF4y2Ba, 7149408(2020)。gydF4y2Ba
Bost, K. L.等。金黄色葡萄球菌感染小鼠或人成骨细胞诱导高水平的白细胞介素-6和白细胞介素-12的产生。gydF4y2Baj .感染。说。gydF4y2Ba180gydF4y2Ba, 1912-1920(1999)。gydF4y2Ba
万豪,I.等人。成骨细胞在金黄色葡萄球菌骨髓炎和感染人骨组织的小鼠模型中表达炎症细胞因子白细胞介素-6。gydF4y2Ba点。j .分册。gydF4y2Ba164gydF4y2Ba, 1399-1406(2004)。gydF4y2Ba
成骨细胞对细菌病原体的反应:以前不被重视的骨形成细胞在宿主防御和疾病进展中的作用。gydF4y2BaImmunol。Res。gydF4y2Ba30.gydF4y2Ba, 291-308(2004)。gydF4y2Ba
石松,张欣。金黄色葡萄球菌与成骨细胞的相互作用(综述)。gydF4y2Ba其他实验。地中海gydF4y2Ba3 gydF4y2Ba, 367-370(2012)。gydF4y2Ba
万豪,I.等人。成骨细胞在金黄色葡萄球菌骨髓炎和感染的人骨组织的小鼠模型中产生单核细胞趋化蛋白-1。gydF4y2Ba骨gydF4y2Ba37gydF4y2Ba, 504-512(2005)。gydF4y2Ba
Gais, P.等人。前沿:MyD88在脓毒性腹膜炎炎症反应和器官损伤中的分化细胞特异性功能。gydF4y2Baj . Immunol。gydF4y2Ba188gydF4y2Ba, 5833-5837(2012)。gydF4y2Ba
Ono, T., Hayashi, M., Sasaki, F. & Nakashima, T. RANKL生物学:骨代谢,免疫系统,以及其他。gydF4y2BaInflamm。回复。gydF4y2Ba40gydF4y2Ba, 2(2020)。gydF4y2Ba
斯特恩,a.r.等人。从骨骼成熟和衰老小鼠长骨中分离和培养原代骨细胞。gydF4y2Ba生物学技术gydF4y2Ba52gydF4y2Ba, 361-373(2012)。gydF4y2Ba
穆斯塔法,A.等。小鼠腓骨作为机械负荷功能适应研究的合适骨。gydF4y2Ba骨gydF4y2Ba44gydF4y2Ba, 930-935(2009)。gydF4y2Ba
汤普森,M. L., Jimenez-Andrade, J. M. & Mantyh, P. W.衰老小鼠皮质骨细胞硬化蛋白免疫反应性增加,关节软骨软骨细胞减少。gydF4y2BaJ.组织化学gydF4y2Ba64gydF4y2Ba, 179-189(2016)。gydF4y2Ba
Koide, M.等。骨小梁中硬化蛋白的表达被破骨细胞下调。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba, 13751(2020)。gydF4y2Ba
Lim, J., Burclaff, J., He, G., Mills, J. C. & Long, F.无意中靶向Dmp1-Cre揭示了Bmpr1a信号在成年小鼠胃肠道间质中的关键作用。gydF4y2Ba骨Res。gydF4y2Ba5克ydF4y2Ba, 16049(2017)。gydF4y2Ba
张杰,林德昌。间充质间质细胞的cre-重组酶转基因通常用于靶向成骨细胞谱系。gydF4y2Ba挖骨者。Res。。j。Soc。骨矿商。Res。gydF4y2Ba31gydF4y2Ba, 2001-2007(2016)。gydF4y2Ba
卡拉季奇等人。体外和体内方法研究骨细胞生物学。gydF4y2Ba骨gydF4y2Ba54gydF4y2Ba, 296-306(2013)。gydF4y2Ba
王,j.s.,等。Sp7及其靶基因骨分泌素对骨细胞树突形成的控制。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 6271(2021)。gydF4y2Ba
张晓明,上松平,武内,等。病原体识别与先天免疫。gydF4y2Ba细胞gydF4y2Ba124gydF4y2Ba, 783-801(2006)。gydF4y2Ba
Onal, M., St John, H. C., Danielson, a . L. & Pike, J. W.删除远端Tnfsf11 RL-D2增强子,有助于成骨细胞中pth介导的RANKL表达,导致小鼠高骨量表型。gydF4y2Ba挖骨者。Res。。j。Soc。骨矿商。Res。gydF4y2Ba31gydF4y2Ba, 416-429(2016)。gydF4y2Ba
魏,J.等。creb结合蛋白的泛素化和去泛素化调节组蛋白乙酰化和肺部炎症。gydF4y2BaSci的信号gydF4y2Ba10gydF4y2Ba(2017)。gydF4y2Ba
田中,T.等。PDLIM2通过STAT3的降解抑制T辅助17细胞的发育和肉芽肿性炎症。gydF4y2Ba科学。信号gydF4y2Ba4gydF4y2Ba, ra85(2011)。gydF4y2Ba
Wein, m.n.等人。SIKs控制骨细胞对甲状旁腺激素的反应。gydF4y2BaCommun Nat。gydF4y2Ba7 gydF4y2Ba, 13176(2016)。gydF4y2Ba
傅,Q., Jilka, R. L., Manolagas, S. C. & O 'Brien, C. A.甲状旁腺激素刺激NFkappa B配体受体激活因子,并通过camp反应元件结合蛋白的蛋白激酶A激活抑制骨保护素表达。gydF4y2Ba生物。化学。gydF4y2Ba277gydF4y2Ba, 48868-48875(2002)。gydF4y2Ba
吴,问周,X。,,,,y & Kang f . il - 6提高osteocyte-mediated osteoclastogenesis体外通过促进JAK2和RANKL活动。gydF4y2Ba细胞杂志。物化学gydF4y2Ba41gydF4y2Ba, 1360-1369(2017)。gydF4y2Ba
Marahleh, A.等。TNF-alpha直接增强骨细胞RANKL表达,促进破骨细胞形成。gydF4y2BaImmunol前面。gydF4y2Ba10gydF4y2Ba, 2925(2019)。gydF4y2Ba
奥尔森,m.a.等人。使用计算屏幕发现myd88依赖信号通路的小分子抑制剂。gydF4y2Ba科学。代表。gydF4y2Ba5克ydF4y2Ba, 14246(2015)。gydF4y2Ba
梅里韦瑟,D.等。载脂蛋白A-I模拟物缓解cox依赖性炎症性肠病模型中的肠道炎症gydF4y2Baj .中国。投资gydF4y2Ba129gydF4y2Ba, 3670-3685(2019)。gydF4y2Ba
Shoji-Matsunaga, A.等人。骨细胞通过RANKL表达调节正畸力介导的牙齿运动。gydF4y2Ba科学。代表。gydF4y2Ba7 gydF4y2Ba, 8753(2017)。gydF4y2Ba
藤原,Y.等人。骨细胞产生的RANKL (NFkappaB配体受体激活剂)是小鼠雌激素缺乏引起的B细胞增加和骨质丢失所必需的。gydF4y2Ba生物。化学。gydF4y2Ba291gydF4y2Ba, 24838-24850(2016)。gydF4y2Ba
Piemontese, M., Xiong, J., Fujiwara, Y., Thostenson, J. D. & O 'Brien, C. A.糖皮质激素过量引起的皮质骨损失需要骨细胞产生RANKL,并与小鼠OPG表达减少有关。gydF4y2Ba点。j .杂志。性。金属底座。gydF4y2Ba311gydF4y2Ba, e587-e593(2016)。gydF4y2Ba
熊,J.等。骨细胞来源的RANKL是由饮食缺钙引起的骨吸收增加的关键介质。gydF4y2Ba骨gydF4y2Ba66gydF4y2Ba, 146-154(2014)。gydF4y2Ba
Kim, H. N.等。骨细胞RANKL是随年龄增长的皮质骨丢失所必需的,并由衰老诱导。gydF4y2Ba江森自控的洞察力gydF4y2Ba5克ydF4y2Ba, e138815(2020)。gydF4y2Ba
肖,M.等。骨细胞通过IL-19调节中性粒细胞的发育:一种治疗中性粒细胞减少症的有效细胞因子。gydF4y2Ba血gydF4y2Ba137gydF4y2Ba, 3533-3547(2021)。gydF4y2Ba
佐藤,等人。骨细胞调节初级淋巴器官和脂肪代谢。gydF4y2Ba细胞金属底座。gydF4y2Ba18gydF4y2Ba, 749-758(2013)。gydF4y2Ba
Bishop, K. A., Coy, H. M., Nerenz, R. D., Meyer, M. B. & Pike, J. W.小鼠Rankl的表达在T细胞中由c-Fos通过指定T细胞控制区的远端调控增强子簇调控。gydF4y2Ba生物。化学。gydF4y2Ba286gydF4y2Ba, 20880-20891(2011)。gydF4y2Ba
Kim, S., Yamazaki, M., Shevde, N. K. & Pike, J. W.通过蛋白激酶A激活剂forskolin和跨膜糖蛋白130激活细胞因子oncostatin M对核因子- kappab配体受体激活剂的转录控制是通过多个远端增强子施加的。gydF4y2Ba摩尔。性。gydF4y2Ba21gydF4y2Ba, 197-214(2007)。gydF4y2Ba
Bishop, K. A., Meyer, M. B. & Pike, J. W.一种新的远端增强子介导细胞因子诱导小鼠RANKl基因表达。gydF4y2Ba摩尔。性。gydF4y2Ba23gydF4y2Ba, 2095-2110(2009)。gydF4y2Ba
赵,J.等。F-box蛋白fbxl19介导的IL-33受体的泛素化和降解限制了肺部炎症。gydF4y2BaImmunol Nat。gydF4y2Ba13gydF4y2Ba, 651-658(2012)。gydF4y2Ba
赵,J.等。SCF E3连接酶F-box蛋白复合物SCF(FBXL19)通过介导Rac1泛素化和降解调节细胞迁移。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba27gydF4y2Ba, 2611-2619(2013)。gydF4y2Ba
魏,J.等。RhoA泛素化和降解的新机制:SCF(FBXL19) E3连接酶和Erk2的作用gydF4y2BaBiochim Biophys。学报gydF4y2Ba1833gydF4y2Ba, 2757-2764(2013)。gydF4y2Ba
董,S.等。F-box蛋白复合物FBXL19通过介导Rac3泛素化和降解调节tgfbeta1诱导的E-cadherin下调。gydF4y2Ba摩尔。癌症gydF4y2Ba13gydF4y2Ba, 76(2014)。gydF4y2Ba
Skaar, J. R. Pagan, J. K. & Pagano, M. SCF泛素连接酶靶向治疗。gydF4y2BaNat. Rev. Drug Disco。gydF4y2Ba13gydF4y2Ba, 889-903(2014)。gydF4y2Ba
李,L.等。肺泡巨噬细胞中ROS抑制PDLIM2促进肺肿瘤的发生。gydF4y2Ba江森自控的洞察力gydF4y2Ba6gydF4y2Ba, e144394(2021)。gydF4y2Ba
Tanaka, T., Grusby, M. J. & Kaisho, T. pdlim2介导的通过核内封存和p65亚基降解的转录因子NF-kappaB激活的终止。gydF4y2BaImmunol Nat。gydF4y2Ba8gydF4y2Ba, 584-591(2007)。gydF4y2Ba
Tanaka, T., Soriano, m.a., Grusby, m.j. SLIM是一种负调控STAT信号的核泛素E3连接酶。gydF4y2Ba免疫力gydF4y2Ba22gydF4y2Ba, 729-736(2005)。gydF4y2Ba
魏,J.等。组蛋白乙酰转移酶CBP通过乙酰化和稳定其F-box蛋白亚基促进SCF FBXL19泛素E3连接酶的功能。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba32gydF4y2Ba, 4284-4292(2018)。gydF4y2Ba
董,S.等。SCF FBXW17 E3泛素连接酶调节FBXL19的稳定性和细胞迁移。gydF4y2BaJ.细胞生物化学gydF4y2Ba122gydF4y2Ba, 326-334(2021)。gydF4y2Ba
Tsukasaki, M.等。OPG生产在哪里发生?gydF4y2Ba细胞的代表。gydF4y2Ba32gydF4y2Ba, 108124(2020)。gydF4y2Ba
考利,K. M.等。成骨细胞局部产生骨保护素抑制骨吸收。gydF4y2Ba细胞的代表。gydF4y2Ba32gydF4y2Ba, 108052(2020)。gydF4y2Ba
Belibasakis, G. N., Reddi, D. & Bostanci, N.牙龈卟啉单胞菌诱导t细胞中的RANKL。gydF4y2Ba炎症gydF4y2Ba34gydF4y2Ba, 133-138(2011)。gydF4y2Ba
Tsukasaki, M.等。骨损伤T细胞对口腔微生物群的宿主防御。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 701(2018)。gydF4y2Ba
科伦坡,A. V., da Silva, C. M., Haffajee, A. &科伦坡,A. P. V.荧光原位杂交鉴定慢性牙周炎患者人沟上皮细胞内口腔物种。gydF4y2BaJ.牙周治疗gydF4y2Ba.gydF4y2Ba42gydF4y2Ba, 236-243(2007)。gydF4y2Ba
Rudney, J. D., Chen, R. & Sedgewick, G. J.放线菌、牙龈卟啉单胞菌和连翘丹宁菌是人类口腔细胞内多微生物胞内菌群的组成部分。gydF4y2Baj .凹痕。Res。gydF4y2Ba84gydF4y2Ba, 59-63(2005)。gydF4y2Ba
张伟,鞠俊杰,李志强,李志强,李志强。牙龈卟啉单胞菌感染对牙周炎小鼠破骨细胞骨吸收和成骨细胞骨形成的影响。gydF4y2BaBMC口服。健康gydF4y2Ba14gydF4y2Ba, 89(2014)。gydF4y2Ba
前川,T.等。牙龈卟啉单胞菌操纵补体和TLR信号,以解除细菌清除炎症和促进生态失调。gydF4y2Ba细胞宿主微生物gydF4y2Ba15gydF4y2Ba, 768-778(2014)。gydF4y2Ba
Burns, E., Eliyahu, T., Uematsu, S., Akira, S. & Nussbaum, G.牙龈卟啉单胞菌的tlr2依赖性炎症反应与MyD88无关,而MyD88是清除感染所必需的。gydF4y2Baj . Immunol。gydF4y2Ba184gydF4y2Ba, 1455-1462(2010)。gydF4y2Ba
Takeuchi, O., Hoshino, K.和Akira, S.前沿:tlr2缺陷小鼠和myd88缺陷小鼠对金黄色葡萄球菌感染高度敏感。gydF4y2Baj . Immunol。gydF4y2Ba165gydF4y2Ba, 5392-5396(2000)。gydF4y2Ba
谢永林,谢永林,谢永林。小鼠骨疾病研究的cre模型。gydF4y2Ba咕咕叫。Osteoporos。代表。gydF4y2Ba16gydF4y2Ba, 466-477(2018)。gydF4y2Ba
Yu, W.等。骨髓成脂前体在骨重塑和病理性骨丢失中促进破骨细胞形成。gydF4y2Baj .中国。投资。gydF4y2Ba131gydF4y2Ba, e140214(2021)。gydF4y2Ba
鲁特,S. H.等。血管周围骨祖细胞与长骨的经皮质通道有关。gydF4y2Ba干细胞gydF4y2Ba38gydF4y2Ba, 769-781(2020)。gydF4y2Ba
西科拉,K. A.等。严重关节炎患儿生殖系功能获得性骨髓分化主要反应基因-88 (MYD88)突变gydF4y2BaJ.过敏临床。Immunol。gydF4y2Ba141gydF4y2Ba, 1943-1947 e1949(2018)。gydF4y2Ba
确认gydF4y2Ba
t.y., m.k.和Y.U.感谢印第安纳大学牙科学院组织学中心的Tianli Zhu协助样本制备。这项工作得到了国家老龄化研究所(P01AG039355)和国家牙科和颅面研究所(R01DE025870, R01DE025870- 06s1, R21DE030561)对Y.U.的支持gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
T.Y.和Y.U.构想了总体假设并设计了实验方案。t.y., m.k., a.a.p.d., r.u.和Y.U.进行了实验。M.P.和L.F.B.有助于建立一种分离原代成骨细胞富集和骨细胞富集细胞群的方法。emg有助于评估数据质量和再现性。r.r.r、C.V.H和W.H.B.创造并提供了TLR2条件敲除小鼠。t.y., m.k., m.p., l.f.b., e.m.g., Y.U.对实验数据进行了解释。T.Y.和Y.U.撰写了手稿,所有作者都审阅并讨论了手稿。纽约大学监督了这项研究。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Marc Wein和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
吉本,T, Kittaka, M, Doan, A.A.P.gydF4y2Baet al。gydF4y2Ba骨细胞通过MYD88信号直接调控细菌性骨感染中的骨溶解。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6648(2022)。https://doi.org/10.1038/s41467-022-34352-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-34352-zgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba