摘要
构建具有微调配位环境的单原子催化剂是实现令人满意的催化性能的一种有前途的策略。在此,通过一个简单的煅烧温度控制策略,CeO2成功制备了配位环境可控的负载铂单原子催化剂。实验和理论分析结果表明,Pt原子在Pt上存在单原子1/首席执行官2在550°C (Pt/CeO2-550)主要分布在CeO边缘位置2Pt-O配位数为ca.5,而在800°C制备的那些(Pt/CeO2-800)主要位于CeO上的Ce畸变取代位点2具有Pt-O配位数的平台ca.4.Pt /首席执行官2-550和Pt/CeO2-800与不同的Pt1首席执行官2配位环境中CO氧化和NH的活性呈现反转趋势3.由于它们在反应物活化和H2结果表明,Pt单原子催化剂在不同目标反应中的催化性能可以通过优化其局部配位结构来最大化。
简介
近年来,不同类型的单原子催化剂因其相对于纳米团簇/颗粒催化剂具有较高的原子利用效率、独特的电子态或更高的稳定性而被应用于许多与能源和环境相关的反应中1,2,3.,4,5,6,7.随着该领域研究的深入,人们发现通过调节单原子催化剂的氧化态或配位环境,可以显著提高单原子催化剂在热催化和电催化等特定载体上的性能8,9,10,11,12,13,14 gydF4y2Ba.在这些单原子催化材料中,Pt单原子(Pt1)催化剂负载在稀土金属氧化物CeO上2催化剂系统是最受欢迎的催化剂系统之一,已被广泛研究用于消除环境污染物和能量转换15,16,17,18,19.
近年来,各种合成方法被用于制备具有更好催化性能的铂单原子18,19,20..例如,通过在铂上形成稳定的羟基1/首席执行官2催化剂采用水热处理在750℃时,CO对Pt的氧化活性1/首席执行官2可以大大提高20..Ma等报道了调制Pt1/首席执行官2磷酸(PO)43−)可以增加Pt的价态,促进反应物吸附和氢气外溢,从而提高苯乙烯加氢的催化活性21.Jeong等人在CeO上调整了Pt单原子的氧化态2采用氢还原法最大限度地提高CO、CH的催化活性4,和NO氧化22.同时,对铂的合成也进行了大量的实验和理论研究1CeO的催化剂2提供最优的协调环境或构建合理的Pt1首席执行官2结构模型,有助于更好地理解反应机理,揭示铂单原子催化剂不同催化性能的起源23,24,25,26,27,28.例如,Jiang等人成功地合成了一种Pt1/首席执行官2不对称铂催化剂1- o4该催化剂的CO氧化活性明显高于具有对称Pt结构的参考催化剂1- o4配置27.Wang等报道了CO-Pt1- o3.是Pt1催化剂负载在氧等离子体预处理的CeO上2,以及这样的Pt1与常规铂相比,其CO氧化活性更高,抗烧结性能更好1/首席执行官2催化剂28.到目前为止,还没有关于Pt单原子在CeO上的局部配位环境精确调优的全面报道2支持在不同催化反应中调节其活性,同时揭示其内在的构效关系。在此,我们提出了一种通过控制Pt/CeO的煅烧温度来微调Pt单原子精确位置的简单策略2采用简易初湿浸渍法(IWI)制备催化剂。Pt单原子在Pt上1/首席执行官2不同温度下煅烧的催化剂配位环境不同。通过系统的实验表征、催化性能测试和基于密度泛函理论(DFT)的Pt模拟1/首席执行官2催化剂,它清楚地揭示了CeO2具有局部配位结构的铂单原子在CO氧化与NH氧化等不同氧化反应中表现出明显不同的催化行为3.氧化,这在未来单原子催化的实际应用中需要考虑。
结果
构建Pt1不同的协调环境
尽量减少纯CeO的潜在结构变化2支撑后再沉积Pt,接着再煅烧,得到CeO2在800℃空气中预煅烧12 h,得到预稳定结构。此外,据报道,铂的沉积对稳定CeO有积极作用2支持29.如补充图所示。1和表1纯粹的CeO2支持和CeO2负载Pt催化剂的比表面积和孔隙结构基本相同,表明催化剂的结构结构没有明显变化2催化剂制造过程中的支持。
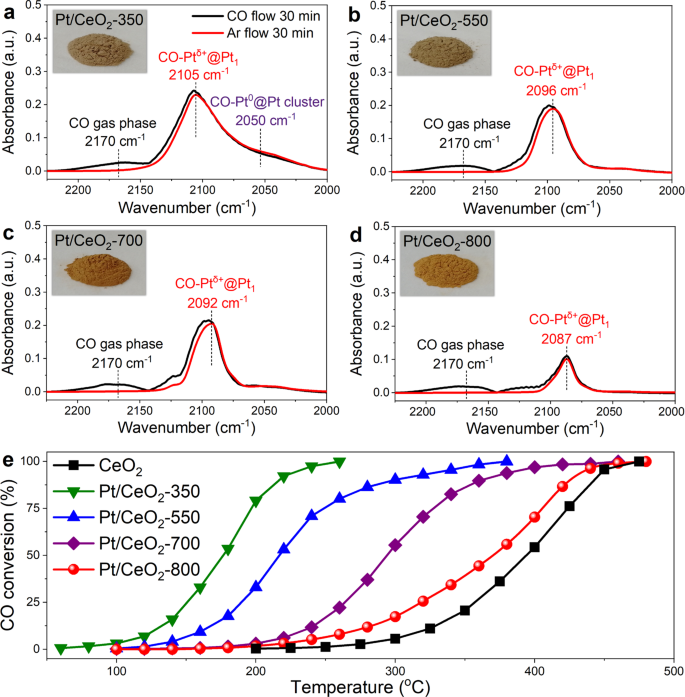
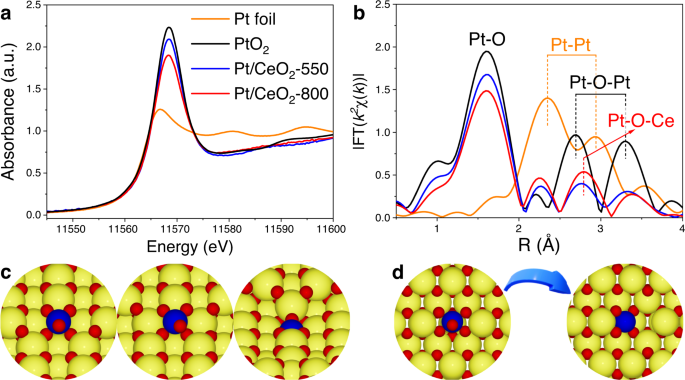
目的:测定Pt/CeO上Pt物种的状态2在25°C时,首次进行了CO吸附的原位DRIFTS(图。1).CO吸附在离子铂单位点(CO-Ptδ+@Pt1)在2087-2105 cm处观察到−1.Pt /首席执行官2-350,宽波段ca.2050厘米−1归因于CO吸附在Pt团簇的金属Pt位点上(CO-Pt0@Pt集群)也被检测到。虽然Pt物种上Pt/CeO2-550年,Pt /首席执行官2-700, Pt/CeO2-800主要以单原子形式存在,CO-Pt的单调红移δ+@Pt1随着焙烧温度的升高,铂单原子的局部配位环境或氧化态不同。根据前人的研究,CO在Pt上的红外光谱中心呈线性吸附1CeO支持2通常在2085到2105厘米之间−124,27,30.,31.9厘米−1红外波段红移(2096 ~ 2087 cm)−1)对CO吸附的影响可以认为是一个显著的变化,表明Pt在550 ~ 800℃的温度范围内具有显著的变化1Pt/CeO上的局部结构2-550和Pt/CeO2-800年。此外,Pt/CeO2在不同温度下焙烧的催化剂呈现不同的颜色(从深棕色到金棕色),表明铂的不同状态1以及物种(插入图中的照片。1模拟).
CO氧化是评价Pt-CeO催化氧化性能的常用探针反应2基催化剂和许多其他催化剂体系32,33,34.反过来,在Pt-CeO的局部结构的差异2催化剂可以通过其相应的CO氧化活性来反映27,35.如图所示。1 e随着煅烧温度的升高,CO对Pt/CeO的氧化活性增强2催化剂单调减少。Pt/CeO上存在Pt簇2-350(无花果。1)很好地解释了它最好的CO氧化活性,作为Pt集群- ceo2界面位点被认为是CO氧化最活跃的物种30.,36,37,38.虽然Pt物种上Pt/CeO2-550年,Pt /首席执行官2-700, Pt/CeO2-800均为Pt单原子形式,CO对Pt/CeO的氧化活性差异显著2-550年,Pt /首席执行官2-700, Pt/CeO2-800表明在这三种催化剂上成功地生成了不同状态的Pt单原子。
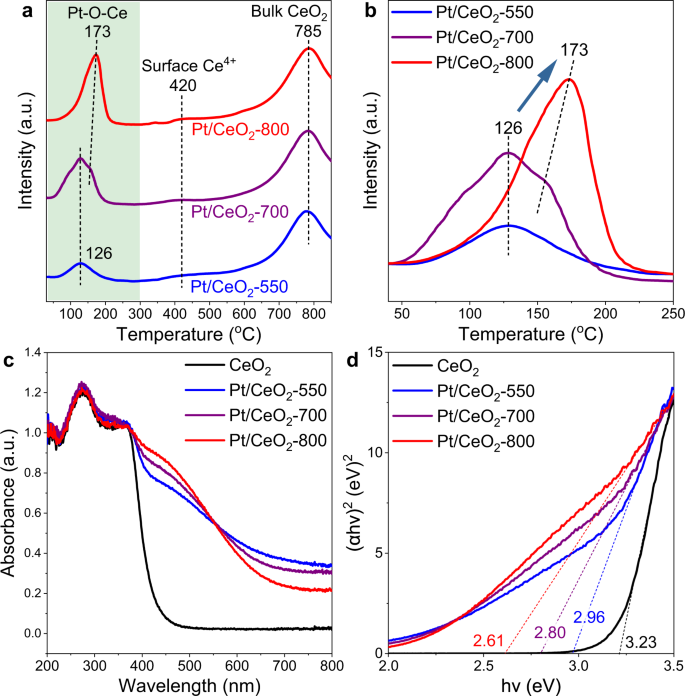
H2-TPR技术是评价Pt物种分散和Pt- o - ce相互作用对Pt/CeO的强度的有力工具2基于催化剂39,40.在这里,H2- Pt/CeO的tpr资料2-550年,Pt /首席执行官2-700年,Pt /首席执行官2-800,研究Pt单原子与CeO的相互作用2支持(无花果。2 a, b).H2-消耗峰值集中在150°C附近,可能归因于Pt-O-Ce结构的减少,而H2-消费高峰在ca.420和785℃可归因于表面Ce的还原4 +品种和散装CeO2分别41.有趣的是,当煅烧温度从550℃增加到800℃时,H2Pt - o - ce结构还原的-消耗峰随强度的增强向较高温度(126°C→173°C)移动,表明Pt - o - ce相互作用强度不同,Pt单原子在Pt/CeO上的位置不同2- x的催化剂。Pt /首席执行官2-700时,Pt/CeO中Pt单体原子应处于Pt种的混合状态2-550和Pt/CeO2-800年。基于CO氧化评价结果,Pt/CeO2-800催化剂的CO氧化活性与纯CeO非常相似2支持。因此,H2Pt/CeO在较高还原温度下Pt - o - ce物种的-消耗峰2-800表明催化剂上的Pt单原子可能已经迁移到CeO的表面晶格中2分离出的Pt原子与CeO形成了强键合2通过更多的Pt-O-Ce键。
紫外-可见光谱分析研究了Pt单原子与CeO的相互作用2支持。如图所示。2摄氏度在CeO上,400nm以下的波段2和Pt /首席执行官2-X催化剂(X = 550, 700,和800)可归因于O2 p→Ce4 f过渡42.有趣的是,Pt沉积后,在400 ~ 600 nm处,在吸收尾或Urbach尾处观察到一个额外的强吸收,这与缺陷堆积引起的带隙涂抹有关43.Pt /首席执行官2-X催化剂,这种吸收尾可能是由于高度分散的Pt引起的结构紊乱。此外,随着焙烧温度的升高,400 ~ 600 nm处的吸收强度也相应增强,表明Pt/CeO2高温焙烧的催化剂表面结构紊乱,表面缺陷较多,可能是Pt单原子迁移到CeO的结果2晶格和Pt与CeO之间更强的互动2支持44,45.在Pt/CeO表面形成较多的缺陷2甲醇吸附实验的原位DRIFTS进一步证实了-800(补充图。2),其中光带为1034厘米−1属于两个Ce上的桥接甲氧基4 +Pt/CeO上有氧空位的阳离子2-800表现出比原始CeO更高的强度2和Pt /首席执行官2-550年46.利用Davis和Mott方程计算了间接带隙,进一步理解了Pt与CeO的相互作用2在Pt/CeO内部提供支持2-X催化剂(图;二维和表1)43,47.Pt/CeO的带隙2-X催化剂远低于CeO催化剂2支持(3.23 eV),表明在CeO的价带和导带之间插入了金属能级2以及通过Pt-O-Ce连接产生的强相互作用48.Pt/CeO的带隙较低2-800 (2.61 eV)2-550 (2.96 eV)和Pt/CeO2-700 (2.80 eV)很好地支持了Pt/CeO上Pt - o - ce相互作用更强的观点2-800催化剂。
Pt单原子的位置和配位环境
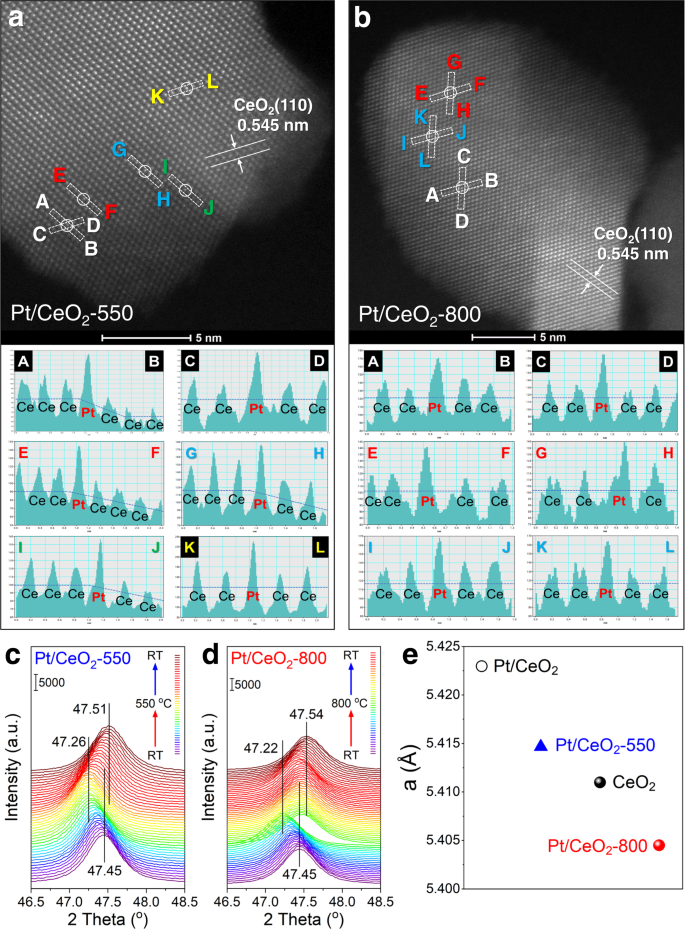
Pt/CeO的AC-HAADF-STEM图像2-550和Pt/CeO2-800,以确定Pt物种的位置(图;3.).首席执行官2支架可选择性地暴露(110)晶面。正如预期的那样,在Pt/CeO上没有发现可识别的Pt簇2-550和Pt/CeO2-800,只有明亮的点分配到孤立的Pt原子。高分辨率EDS作图结果表明,Pt物种在Pt/CeO上均处于高度分散状态2-550和Pt/CeO2-800(补充图。3.).此外,两种催化剂上分离出的Pt单原子都能很好地与CeO上的Ce柱相匹配2(110)飞机。基于原位DRIFTS对CO吸附的结果,对CO氧化活性进行了评价2-TPR和UV-Vis光谱,可以推断Pt原子在Pt/CeO上2-550和Pt/CeO2-800应该处于不同的状态,包括位置和协调环境。考虑到AC-HAADF-STEM图像只是投影图,Pt单原子在Pt/CeO上2-550和Pt/CeO2-800可能位于Ce在CeO上的不同取代位点或外延生长位点2支持,这使得Pt单原子处于不同的状态,但都在CeO的Ce列中观察到2(110)飞机。借助AC-HAADF-STEM图像的线剖面(图。3 a, b和补充图。4), Pt/CeO上Pt单原子的不同位置2-550和Pt/CeO2-800可以很好地识别。Pt /首席执行官2-550时,Pt原子主要分布在CeO表面的边缘或台阶位置2, Pt原子在Pt/CeO上2-800个可能位于CeO上的Ce取代位点2平台(例如,嵌入到CeO的表面晶格中2).
AC-HAADF-STEM图像和一个Pt /首席执行官2-550年和bPt /首席执行官2-800 (Pt/CeO的额外线轮廓2-800可以在补充图中找到。4).原位XRD谱图为cPt /首席执行官2-550年和dPt /首席执行官2-800;ePt/CeO的细化晶格参数2(未经煅烧),标准CeO2Pt /首席执行官2-550和Pt/CeO2-800由里特维尔德精炼得到。
为了进一步揭示Pt原子在CeO上的位置2在此基础上,设计了两组原位XRD实验,在样品加热(至550或800℃)和冷却过程中连续收集XRD图谱(补充图)。5和无花果。3 c, d).在测量之前,CeO2用硝酸铂溶液浸渍的粉末在120°C的空气中干燥30分钟以去除多余的H2O(记为Pt/CeO2).在煅烧过程中得到Pt/CeO2-550时,XRD峰在加热阶段从RT到550℃向较低的角度移动,在冷却阶段向较高的角度移动,这应该分别与晶格的膨胀和晶格的收缩有关49.在煅烧过程中得到Pt/CeO2-800,在加热阶段(< 620℃),由于CeO的晶格膨胀,XRD峰的角度也降低了2也然而,Pt/CeO的XRD峰突然转向高角度2-800在更高的温度ca.620°C,这应该是O2形成Ce面2O3.高温下的物种50.裸CeO的XRD峰2在加热和冷却阶段,支持度的变化趋势与Pt/CeO相似2-550和Pt/CeO2-800催化剂(补充图;6).在550℃和800℃焙烧后,Pt/CeO的XRD衍射峰出现2催化剂不同程度地向更高的角度转移。考虑到CeO2在800°C下焙烧12 h时,Pt/CeO的衍射峰发生了位移2是由于CeO的晶格扩张还是收缩2Pt物种诱导51.通过对Pt/CeO的XRD图谱进行Rietveld细化2Pt /首席执行官2-550, Pt/CeO2-800, CeO的细化点阵参数2对这些样品进行了计算(图;3 e).未焙烧Pt/CeO的晶格参数变化明显2和Pt /首席执行官2-550略高于标准CeO2参考,这可能是由于Pt沉积对CeO的扰动效应2表面。有趣的是,当焙烧温度升高到800℃时,观察到晶格参数急剧下降,这可能与离子半径较小的Pt离子(Ce4 += 0.970 Å, Ce3 += 1.280 Å, Pt4 += 0.625 Å, Pt2 += 0.800 Å)和进一步扭曲43,52,与此前的报道一致,Pt2 +可能会扩散到CeO2高温煅烧过程中的晶格43.原位x射线衍射结果进一步表明,Pt原子可能已合并到CeO的表面晶格中2Pt/CeO内部的平台2-800催化剂。
通过x射线吸收光谱(XAS)分析进一步阐明了Pt/CeO上Pt单原子的价态和配位环境2- x的催化剂。如图所示。4和补充图。7一个,白线为Pt-L的强度(近边缘区域的强吸收)3.给Pt/CeO的XANES2铂箔催化剂的催化活性高于铂箔催化剂的催化活性,而PtO催化剂的催化活性低于铂箔催化剂的催化活性2,表示Pt/CeO上Pt属在0 ~ +4之间的中间价态2- x的催化剂。有趣的是,Pt-L的白线强度3.XANES对Pt/CeO2催化剂随焙烧温度的升高而单调降低,表明铂价态相应降低。进行XANES线性组合拟合,进一步确定Pt物种的平均价态(补充图。8、表1及补充表1).正如预期的那样,Pt在Pt/CeO上形成2-800的价态(2.7±0.1)明显低于Pt/CeO的价态2-550(3.4±0.1),这进一步得到了Pt 4f XPS结果的支持2 +在Pt/CeO上创建物种2-800与Pt/CeO相比2-550(补充表2和补充图。9).
为了进一步揭示Pt/CeO上Pt单原子的局部配位结构2-550和Pt/CeO2-800催化剂,进行EXAFS曲线拟合,结果在R空间和k空间(无花果。4 b,补充图。7 b,补充图。10及补充表3.).Pt - o - Pt和Pt - Pt配位壳的缺失以及Pt - o和Pt - o - ce配位壳的单独观测进一步证明了Pt/CeO上Pt单原子的形成2-550和Pt/CeO2-800年。尽管Pt /首席执行官2-800确实显示Pt-O的配位数(CN)较低Pt -O= 4.4±0.3)高于Pt/CeO2-550 (CNPt -O= 5.1±0.4),Pt - o - ce在Pt/CeO上的CN较高2-800 (CNPt -O -Ce= 4.2±0.3),高于Pt/CeO2-550 (CNPt -O -Ce= 3.7±0.3),进一步验证了Pt/CeO内部形成了更多Pt - o - ce键2-800,可通过拉曼光谱进一步证明。11).如上所述,对于Pt/CeO2-550时,Pt单原子主要位于CeO的边缘或台阶位置2(110),没有引起CeO的晶格收缩2(无花果。4摄氏度).相比之下,对于Pt/CeO2-800, CeO晶格显著收缩2支持度可能与Pt原子加入到CeO的表面晶格有关2(110)。Pt原子取代了CeO表面的Ce位2(110)在理想模型中,CNPt -O应该是6,比CN高Pt -OPt /首席执行官2-800 (CNPt -O= 4.4±0.3)。然而,由于Pt2 +具有较小离子半径的物种(ca.0.800 Å)比Ce4 +(ca.0.970 Å),在Pt/CeO上发生了Pt单原子从六配位到方平面类配位的显著重构2-800来平衡空间和电荷,从而导致CN的降低Pt -O从6到4(图;4 d和补充图。12).类似的Pt单原子重建也被报道发生在CeO2(111)26.
Pt配位环境的DFT计算1
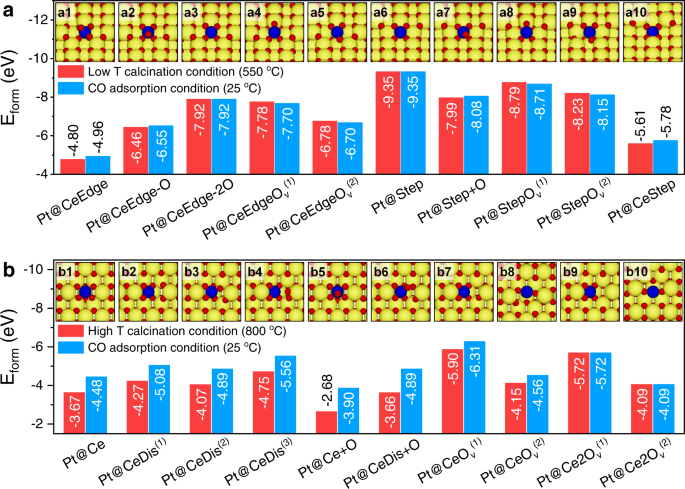
验证了Pt/CeO上Pt单原子的位置和配位环境的猜想2-550和Pt/CeO2-800,进行DFT计算。Pt /首席执行官2-550,基于实验证据表明Pt单原子主要位于CeO的边缘/台阶位置或附近2(110)曲面,提出了10种构型(图。5 a1-a10和补充图。13).其中,构建了边缘位置的一个Ce原子被一个Pt原子取代的5种构型(图。5 a1-a5).在Pt@CeEdge构型中,Pt取代了边缘位置的Ce原子,与6个氧原子配位形成八面体Pt - o6(无花果。5 a1和补充图。13).一旦Pt@CeEdge上的一个或两个O原子被移除,Pt@CeEdge构型就演变成Pt@CeEdge-O或Pt@CeEdge-2O(图2)。5就是和补充图。13 b, c),其中Pt与5或4个氧原子配位形成Pt - o5或者方形平面Pt-O4,分别。进一步去除另一个氧原子导致Pt@CeEdgeO的形成v(1)(无花果。5 a4和补充图。13 d)或Pt@CeEdgeOv(2)(无花果。5 a5和补充图。13 e)3.协调。此外,还构造了Pt原子位于或靠近阶跃位置的另外5种构型。在Pt@Step的构型中,Pt原子在CeO的台阶上被吸附2(110)表面用Pt-O4协调(图。5 a6和补充图。13 f).与Pt@CeEdge配置类似,如图所示。5 a7-a9和补充图。13胃肠道,增加或去除O原子后,得到三个新的构型(Pt@Step+O, Pt@StepOv(1)和Pt@StepOv(2)).Pt取代Ce阶跃原子(Pt - o4协调)也被提出(图;5 a10和补充图。13 j).
为了比较Pt结构的相对稳定性,在550℃,0.21 atm O的煅烧条件下计算了上述结构的形成能2压力)和CO吸附实验的条件(25°C, 10−20自动取款机啊2压力)。如图所示。5,两种条件下各构型的形成能相似,表明Pt1/首席执行官2煅烧后和CO吸附过程的结构基本相同。此外,除了Pt@CeEdge和Pt@CeStep外,其余8种结构均表现出较低的形成能,表明孤立的Pt原子可以稳定地锚定在CeO的边缘或阶跃位置2(110)可能的o -协调环境。
Pt /首席执行官2-800,表征结果表明Pt原子取代了CeO表面的Ce位2(110), Pt的10种构型1在首席执行官2(110)提出阶地(图;5 b和补充图。14 gydF4y2Ba).最简单的构型是Pt取代了CeO上的Ce2(110)表面没有任何O原子排列的变化(图。5 b1和补充图。14个),形成不对称的Pt-O5-like coordination (Pt@Ce)。然而,Pt-O5结构可能会转变为Pt@CeDis的扭曲配置(1)在离子弛豫过程中不增强对称性(图;5 b2和补充图。14 b),从而形成Pt-O4平面坐标。另外两个扭曲的配置(Pt@CeDis(2)和Pt@CeDis(3))。Pt@CeDis(2)类似于Pt@CeDis(1)一个O原子移向Pt的顶端,形成Pt - O5配置(图。5 b3和补充图。14摄氏度).在Pt@CeDis(3)构型中,一个O原子向附近的O原子位移形成O原子2物种(图。5 b4和补充图。14 d),得到与Tang等人提出的结构相似的结构。25.通过在Pt@Ce和Pt@CeDis的Pt上增加一个额外的O原子,Pt@Ce+O的两种构型(图。5 b5和补充图。14 e)和Pt@CeDis+O(图;5 b6和补充图。14 f),并形成Pt-O6协调和Pt-O5分别协调。当从Pt@CeDis中去除一个O原子时,在Pt原子附近构造了两个O空位的构型,称为Pt@CeOv(1)(无花果。5 b7和补充图。14 g)及Pt@CeOv(2)(无花果。5 b8和补充图。14小时),从而形成Pt-O4协调和Pt-O3.分别协调。从Pt@CeO中进一步去除一个O原子v(1)和Pt@CeOv(2)会形成两个O空位的构型,记作Pt@Ce2Ov(1)(无花果。5 b9和补充图。14我)及Pt@Ce2Ov(2)(无花果。5 b10和补充图。14 j),分别。
在煅烧条件和CO吸附条件下,计算了上述构型的形成能(图2)。5 b).Pt@CeDis(1), Pt@CeDis(3), Pt@CeOv(1)和Pt@Ce2Ov(1)在10种构型中形成能最低。此外,这四种构型中的Pt原子都在Pt - o中4协调。根据H2-TPR,拉曼光谱,和XAS分析,CNPt -OPt /首席执行官2-550高于Pt/CeO2-800(5.1对4.4)因此,Pt1Pt/CeO上的物种2-550应该在Pt-O4 +x(x> 0)配位,显性Pt1/首席执行官2Pt/CeO内的配置2-550可以是Pt@CeEdge-O或Pt@Step+O + CNPt -O的5。值得注意的是,由于高T煅烧条件与CO氧化条件下氧的化学势相差较大(−0.41 eV),因此Pt的生成能存在明显差异1除了有两个氧空位的情况(图。5 b9-b10),其中Pt1生成能与氧化学势无关。相比之下,在低T煅烧条件和CO氧化条件下,氧的化学势几乎没有差异(−0.08 eV),从而产生几乎相同的Pt1两种条件下的地层能(图;5).
确认Pt1/首席执行官2Pt/CeO内的配置2-550和Pt/CeO2-800,进行CO吸附计算。如补充图所示。15一个,用于Pt/CeO内的Pt@CeEdge-O2-550, CO得到一个O原子形成CO2在结构(离子)弛豫期间,从而形成Pt@CeEdge-2O的构型。CO吸附在Pt@CeEdge-2O上的拉伸频率为2047 cm−1,具有结合能(EB)为−0.36 eV。当CO得到另一个O原子时,CO-Pt@CeEdgeOv(1)(EB=−1.99 eV)或CO-Pt@CeEdgeOv(2)(EB=−2.17 eV),伸展频率分别为2006和1949 cm−1,(补充图。15 b, c).与Pt@CeEdge-O的情况类似,CO吸附会在Pt@Step+O上吸附一个O原子形成Pt@Step(补充图)。15 d).CO-Pt@Step的拉伸频率为2012 cm−1(EB=−0.38 eV)。进一步去除CO-Pt@Step上的另一个O原子,就形成了CO-Pt@StepOv(1)(EB=−1.99 eV)和CO-Pt@StepOv(2)(EB=−2.34 eV),显示2012和1921 cm的拉伸频率−1,(补充图。15个e, f).
Pt /首席执行官2-800时,在Pt@CeDis中发现CO不能与Pt原子结合(1),但可以结合在Pt原子附近的Ce原子上(EB=−0.39 eV), CO拉伸频率为2102 cm−1(补充图。16一个).据Tang等报道。25, CO吸附在Pt@CeDis上(3)结构可以与附近的O原子反应,从而生成Pt@CeOv(1)配置。有趣的是,在本研究中发现,吸附的CO可以从Pt - o中拉出Pt原子4平面构型Pt@CeOv(1)形成CO-Pt-O3.(补充图。16 b,EB=−1.33 eV)。Pt@CeDis的重建(3)在CO吸附条件下进行了演示,详见附图。17.此外,CO在Pt@Ce2O上的吸附v(1)被发现相当虚弱(EB=−0.07 eV)。因此,Pt@CeDis(3)和Pt@CeOv(1)是最有可能的Pt1/首席执行官2Pt/CeO内的配置2-800年。考虑到Pt@CeO的形成能较低v(1)与Pt@CeDis相比(3)(无花果。5 b), Pt@CeOv(1)应该是Pt/CeO的主要配置吗2-800年。Pt@CeO的形成v(1)Pt/CeO内的配置2Pt/CeO的紫外-可见光谱也支持-8002-800具有较高的表面结构紊乱(图;2摄氏度).
基于原位DRIFTS CO吸附结果表明CO在Pt/CeO上的拉伸频率2-550高于Pt/CeO2-800,可以得出结论,Pt@CeEdge-O是Pt/CeO中的主要配置2-550,吸附CO的拉伸频率较高(2047 cm−1)比CO-Pt@CeOv(1)在Pt /首席执行官2-800(2022厘米−1).此外,计算得到的EB的CO-Pt@CeOv(1)(−1.33 eV)高于CO-Pt@CeEdge-2O(−0.36 eV),这得到了CO- tpd结果的很好支持,表明Pt/CeO对CO的吸附2-800催化剂确实比Pt/CeO催化剂强2-550催化剂(补充图18).Bader charge分析在Pt@CeEdge-O和Pt@CeO上进行v(1)进一步评价铂的电子结构1网站。如补充图所示。19, Pt@CeEdge-O中的Pt原子代表Pt/CeO2-550催化剂的Bader电荷(+1.55)高于Pt@CeO催化剂v(1)(+0.75)代表Pt/CeO2-800催化剂,可能是CN较高的结果Pt -OPt原子在Pt@CeEdge-O。这些结果与XPS和XANES分析结果一致,表明Pt/CeO中存在Pt单原子2-550催化剂的价态高于Pt/CeO催化剂2-800催化剂。
CO对Pt/CeO的氧化机理2-550和Pt/CeO2-800年
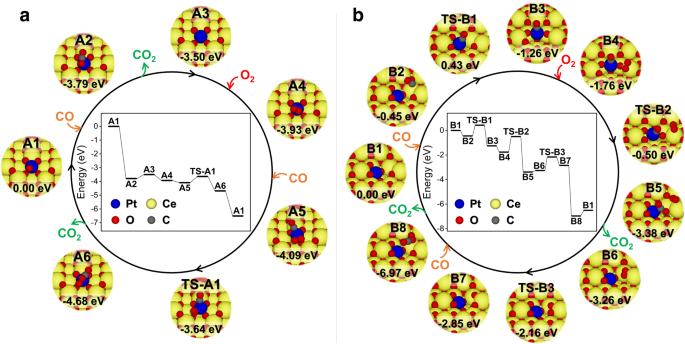
了解CO对Pt/CeO不同氧化活性的基本原理2-550和Pt/CeO2-800, CO氧化机理在Pt@CeEdge-O和Pt@CeOv(1)采用DFT计算进行研究。如图所示。6,在Pt@CeEdge-O (Pt/CeO的主要配置2-550)时,CO首先吸附Pt (A1)上的O原子形成CO2吸附在表面(A2),反应能为−3.79 eV。的有限公司2从表面解吸,解吸能为0.29 eV,形成Pt@CeEdge-2O构型(A3), O2吸附能为−0.43 eV (A4)。发现另一种CO与O共吸附2吸附能=−0.16 eV)在Pt原子上形成A5构型。在活化势垒为0.45 eV的TS-A1跃迁态后,构型A5可以转变为A6(反应能=−0.59 eV), CO可以从吸附的O中吸附一个O原子2形成CO2.的有限公司2随后从表面解吸,解吸能为−1.82 eV,得到原始的Pt@CeEdge-O结构。
如图所示。6 b,网址:Pt@CeOv(1), CO吸附在具有氧空位(B1)的Ce原子上形成构型B2,吸附能为−0.45 eV。吸附的CO可以与Pt反应,将其拉上来形成CO - Pt - o3.协调(B3)。该过程为放热反应,反应能为- 0.81 eV,但不是自发的,激活势垒为0.88 eV (TS-B1)。然后,阿2能吸附在附近的Ce原子(B4)上,吸附能为−0.50 eV。吸附的CO可与晶格O反应生成CO2(B5),反应能为−1.62 eV,活化势垒为1.26 eV (TS-B2)。解吸后CO2(解吸能= 0.12 eV),构型为B6,有两个氧空位,吸附O2分子形成了。O2在克服1.10 eV的激活势垒(TS-B3)后,可以解离并填充这两个氧空位(B7)。另一个CO可以与一个解离的O原子反应,形成物理吸附的CO2分子(B8)。这一步放热很高,反应能为−4.12 eV, CO2能以0.46 eV的解吸能量解吸,形成原来的Pt@CeOv(1)结构(B1)。
对比上述两种CO氧化机制,可以得出CO的氧化需要三个步骤,在Pt@CeO上具有相当大的激活势垒v(1)(Pt/CeO的主导结构2-800),而Pt@CeEdge-O上只有一个屏障相对较低(Pt/CeO上的主导结构)2-550),很好地解释了为什么Pt/CeO2-800的CO氧化活性明显低于Pt/CeO2-550年。动态储氧能力(OSC)试验结果进一步证实了O2Pt/CeO上的CO能更好地激活和消耗吗2-550比Pt/CeO2-800(补充图。20.),很好地支持了DFT计算结果,即CO氧化和O2Pt/CeO解离(A5→TS-A1→A6)2-550只需要克服比Pt/CeO低得多的激活势垒2-800 (B4→TS-B2→B5和B6→TS-B3→B7)。较低的表观活化能E一个)对Pt/CeO进行CO氧化2-550 (43 kJ∙mol−1)而不是Pt/CeO2-800 (52 kJ∙mol−1)(补充图21)也应该是反应物更有效活化的结果。
Pt/CeO的稳定性2-550和Pt/CeO2在反应条件下对-800进行了两轮CO氧化活性测试,并与Pt团簇和纳米颗粒催化剂在CeO上进行了比较2.Pt/CeO的CO氧化活性几乎没有变化2-550和Pt/CeO2在500°C的两轮测试中,-800(两者的活性都低于Pt团簇和纳米颗粒催化剂)(补充图。22),表明Pt具有较高的稳定性1本文研究了CO氧化气氛下的催化剂。考虑到汽车尾气中不可避免的水蒸气存在,两种催化剂的CO氧化也在湿条件下进行。如补充图所示。23Pt /首席执行官2-550仍表现出高于Pt/CeO的CO氧化活性2潮湿条件下-800。
NH3.Pt/CeO的氧化行为2-550和Pt/CeO2-800年
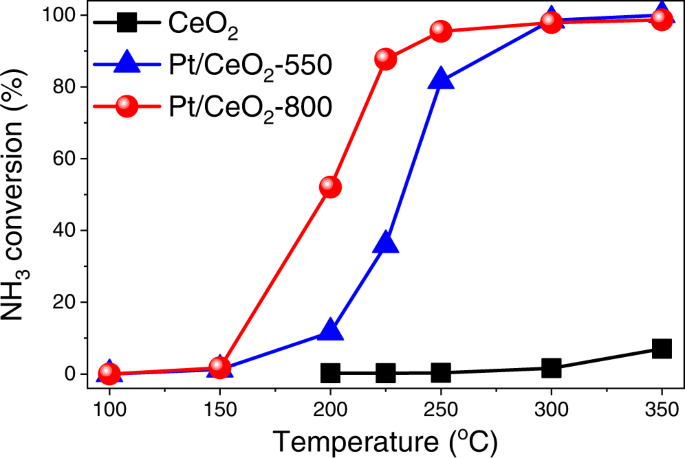
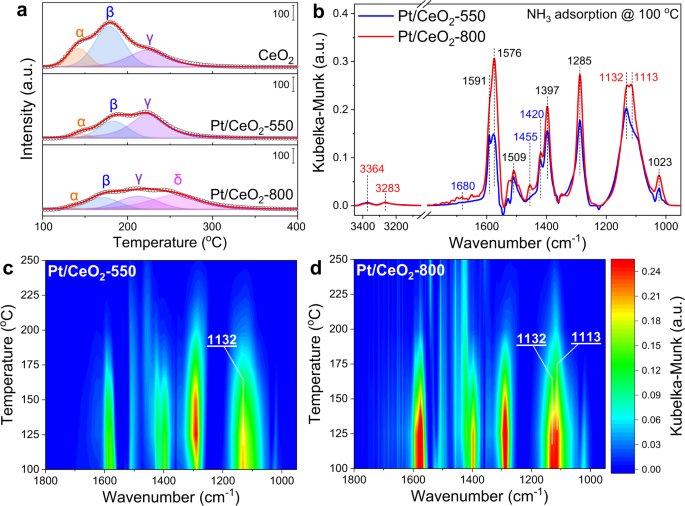
如前文所述,通过简单控制煅烧温度,成功地在CeO上构建了具有不同配位环境的Pt单原子2.已经证明Pt单原子具有CNPt -O的ca.5关于Pt/CeO2-550比Pt/CeO更能催化CO氧化2-800带CNPt -O的ca.4.进一步评价Pt/CeO的催化性能2-550和Pt/CeO2-800在其他氧化反应中为NH3.氧化反应是一种研究相对较少但在排放控制领域很重要的催化氧化反应53,54,作为探针反应。如图所示。7,与CO氧化反应中观察到的趋势相反,令人惊讶的是,Pt/CeO2-800表现出较好的NH3.氧化性能优于Pt/CeO2-550年。北半球3.Pt/CeO的氧化反应2-800的N值甚至略高2而对Pt/CeO的选择性较低2-550,特别是在350°C(补充图。24),这种差异主要是由于氮等非选择性氧化产物的生成减少所致2哦,不,不2在Pt/CeO的高温下2-800(补充图。25).北半球3.CeO氧化活性2Pt /首席执行官2-550和Pt/CeO2-800也在H2O.加入5% H2O到原料气,Pt/CeO2-800仍然表现出更好的NH3.氧化活性高于Pt/CeO2-550(补充图。26).
揭示NH较高的内在原因3.Pt/CeO的氧化活性2-800年,NH3.-TPD首先用于研究NH3.纯CeO的吸附能力2支持和Pt/CeO2催化剂(图。8).三个NH3.-解吸峰值在ca.Pt/CeO的温度分别为130、170和220°C2-550(表示为峰α, β和γ)与在CeO上观察到的相似2支持,这可能是由于NH的解吸3.吸附在CeO上的物种2吸附强度弱(α和β)或强(γ)的位点和Pt位点55.有趣的是,Pt/CeO的γ峰2-550的相对强度明显高于CeO2支持,表明Pt单原子与CeO相互作用2支持可以为更强的NH产生额外的站点3.吸附。更重要的是,关于Pt/CeO2-800,一个新的密集NH3.-解吸峰(δ)明显,可归因于NH3.在Pt/CeO上与Pt单原子或与Pt原子相邻的Ce原子结合较强的种2-800与另一种独特的配位环境(即Pt原子取代Ce位置的CeO2(110)平台)。由于NH有限3.Pt/CeO的转化率低于150°C2-550和Pt/CeO2-800, NH3.两种催化剂的氧化活性主要与NH有关3.强烈吸附在Pt位(峰γ和δ)上的种。详见补充表4,由NH的反褶积结果3.-TPD剖面,NH比例高得多3.在Pt/CeO上观察到较强吸附在Pt位上的种2-800年。假设NH接近零阶3.在北半球3.氧化反应(补充图27),即NH的吸附量3.在所研究的温度制度下,将强烈决定NH3.Pt/CeO的氧化活性2-550和Pt/CeO2-800催化剂。更强地吸附NH3.Pt/CeO上的物种2-800催化剂可能是其在nhh中具有较高催化性能的主要原因之一3.氧化反应。
进一步研究Pt/CeO的表面酸度2-550和Pt/CeO2-800, NH的原位漂移3.在100℃时进行吸附(图;8 b).在1113、1132、3283和3364厘米处的条带−1可以分配给NH吗3.吸附在路易斯酸位点上。频带在1420和1680厘米处−1可以归因于NH4+与Brønsted酸位点结合55,56.其他波段分别为1023、1285、1397、1509、1576和1591厘米−1可归为吸附nhh氧化生成的硝酸盐3.57,58.考虑到同一位最初的CeO2Pt/CeO的支持和Pt装载2-550和Pt/CeO2-800催化剂,Pt/CeO上的硝酸盐带更密集2-800表示吸附NH3.该催化剂具有独特的局部表面微结构,能更好地活化和氧化。NH的原位漂移3.同时进行了吸附-解吸实验,以进一步评价Pt/CeO表面酸位点的强度2-550和Pt/CeO2-800(无花果。8 c, d).结果表明,NH3.位于1113-1132厘米的条带−1Pt /首席执行官2-800比Pt/CeO更密集2-550,在温度升高过程中Ar流动也表现出更高的稳定性。铂的形成1Pt/CeO上不同配置的站点2-550和Pt/CeO2-800应该是NH强度明显的原因3.吸附在这两种催化剂上。根据DFT计算,NH的吸附能较高3.在Pt@CeOv(1)(EB=−1.10 eV)比Pt@CeEdge-O (EB=−0.73 eV)28),进一步证实了这一观点。此外,还发现NH3.在两种结构上都能优先吸附在与Pt原子相邻的Ce原子上,而不是直接吸附在Pt单原子上。
评价吸附nhh的反应性3.Pt /首席执行官2-550和Pt/CeO2-800催化剂,原位漂移O2与预吸附的nhh反应3.在175°C下进行(补充图。29).不出所料,更多的NH3.吸附在Lewis酸位点(1067、1105和1132 cm)−1)在Pt/CeO上观察2-800比Pt/CeO2-550, 175°C。随着O2, NH3.吸附在Brønsted酸位点(1424/1435和1650 cm)上的种−1)几乎没有反应。相反,NH3.配位于Lewis酸位点的物种能与O2,这样的NH3.Pt/CeO上的物种2-800催化剂比Pt/CeO催化剂消耗快得多2-550(补充图。30.).
为了更好地揭示高NH的内在原因3.Pt/CeO的氧化活性2-800, DFT计算用于机理研究。值得注意的是NH的整体化学计量反应3.氧化是
涉及许多步骤,充分考虑这些步骤超出了本工作的范围。相反,我们诉诸于对最初反应的考虑
来提供一些关于NH的见解3.氧化过程。在上述反应中,N后还有两个H原子(H*)吸附在催化剂表面2解吸。H2由-OH基团形成的O分子随后可以解吸,并产生表面氧空位,可通过O的吸附和解离来修复2.有关机制及其能量学的更多细节可以在补充图中找到。31而且32的简化图,如图所示。9抓住我们论点的要点。
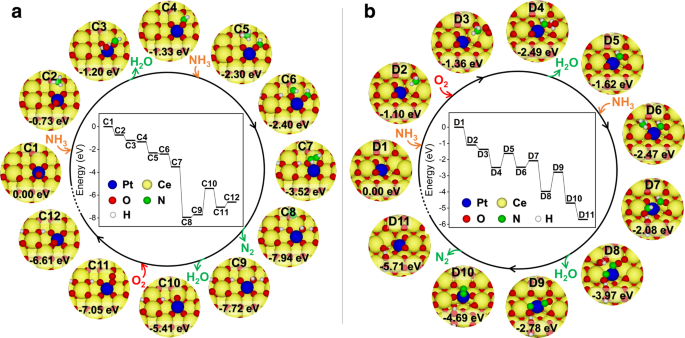
在Pt@CeEdge-O(图;9)、NH3.氧化开始于NH的吸附3.在靠近Pt原子的Ce原子上,在上层平台(C2)上。两个N-H键解离后,生成的H原子与Pt上方的O原子结合形成H2O (C3),然后从表面解吸,留下-NHO基团(C4)。然后,吸附第二个NH3.在相同的Ce原子上可以发生分子(C5)。在第二个NH的两个N-H键解离后3.分子和由此产生的H原子扩散,形成两个-NHO基团(C6),然后它们可以相互反应生成N2H2吸附在表面(C7)。随后,N2在两个N-H键(C8)解离后形成,然后从表面解吸,留下四个H原子在催化剂(C9)上。其次是第二个H的形成和解吸2O分子,从而产生一个氧空位(C10)。氧的吸附可以填补空位2(C11)。重建后,得到了原来的结构,在上面的阶地上增加了两个H原子(C12)。
在Pt@CeO上也观察到了类似的过程v(1)(图;9 b).NH的氧化3.在Pt@CeOv(1)开始于NH的吸附3.在与Pt原子相邻的Ce原子上有一个氧空位(D2),随后共吸附O2形成D3构型。在两个N-H键和O2分子,一个H2形成O分子(D4),可从表面脱附-NHO基团(D5)。然后是第二个NH3.分子可以吸附在Pt原子(D6)附近的另一个Ce原子上。在第二个NH的两个N-H键解离后3.分子中,在Pt@CeO上形成了两个-NHO基团v(1)(D7)。这两个-NHO基团中的两个H原子可以与表面的O原子重新结合形成第二个H2O (D8)可以从表面脱吸,留下两个-NO基团和一个氧空位(D9)。形成的N2从这两个-NO基团可以从表面解吸(D10)。经过表面结构重构后,催化剂可以恢复到初始构型,在催化剂平台上增加两个H原子2(110)表面(D11)。
当比较上述两种反应机理时,可以观察到Pt@CeO上-NHO或-NO基团中的N原子v(1)(代表Pt /首席执行官2-800催化剂)与Pt原子配位,可以减弱Pt - o键的强度,从而促进第二氢的形成(D7→D8)和解吸(D8→D9)2O分子。第二个H的解吸能2O形成于Pt@CeOv(1)为1.19 eV,远低于Pt@CeEdge-O,代表Pt/CeO2在-550催化剂(2.31 eV)上,-NHO和-NO基团中的N原子与Ce原子配位。对于NH3.在Pt@CeEdge-O和Pt@CeO上氧化v(1),第二个H的解吸2O分子(分别为C9→C10和D8→D9)为速率限制步骤。因此,第二个H的解吸能较低2O分子Pt@CeOv(1)是NH高得多的主要原因之一吗3.Pt/CeO具有氧化活性2-800年。
讨论
不同配位环境的Pt单原子催化剂2采用简单的煅烧温度控制策略,对支架进行了精细制备。当焙烧温度从350℃提高到800℃时,Pt团簇首先分散为Pt单原子,然后与CeO相互作用更强的Pt单原子2通过Pt-O-Ce键形成。与Pt/CeO不同2-550催化剂中Pt单原子主要位于CeO的边缘位置2为Pt/CeO提供支持2-800催化剂下,Pt单原子主要结合到CeO表面晶格中2进一步进行结构重构,在CeO上形成方平面式的协调环境2露台。虽然Pt单原子在Pt/CeO上2-800催化剂对O的激活能力较弱,在CO氧化反应中催化活性有限2, NH的表面酸性增强3.H的吸附/活化和易脱附2反应过程中产生的O使Pt/CeO2-800表现出更高的NH3.氧化活性高于Pt/CeO2-550年。结果表明,精确控制Pt单原子的配位环境有利于提高其在不同氧化反应中的催化性能。这项工作可以为单原子催化剂的局部配位环境的灵活调整提供有益的见解,从而更有效地应用于不同的目标反应。
方法
催化剂制备
之前被用作支持,商业CeO2(高比表面积氧化铈用BET比表面积为ca.120米2/g)在800℃空气中预焙烧12 h,以尽量减少其在后续催化剂制备过程中可能发生的结构变化。为CeO做准备2负载Pt催化剂,1.00 wt.% Pt使用Pt(NO3.)2作为前体加载到预处理过的CeO上2采用早期湿浸渍法(IWI)进行支撑。Pt(NO3.)2在首席执行官2,湿粉在120℃空气中干燥1 h。然后,将得到的粉末在350、550、700或800℃的空气中焙烧2小时。所得催化剂记为Pt/CeO2-X, X℃为煅烧温度。采用电感耦合等离子体-光学发射光谱法(ICP-OES)测定了所选催化剂中铂的实际质量负载。不出所料,Pt/CeO2-550 (0.92 wt.%)和Pt/CeO2-800 (0.90 wt.%)显示出几乎相同的铂负载,非常接近于标称铂负载(1.00 wt.%)。
特征
用N测定比表面积和孔体积2使用Micromeritics asa -2020分析仪在−196°C进行物理吸附。每次测试前,样品在300°C下脱气4小时。采用Brunauer-Emmett-Teller法计算比表面积,采用解吸等温线BJH法确定孔隙体积和孔径分布。
在配备液氮冷却汞镉碲化(MCT)探测器的Thermo Nicolet iS50 FTIR光谱仪上进行了原位漫反射红外傅里叶变换光谱(In situ DRIFTS)研究。在每次测试中,将50 mg催化剂粉末放置在DRIFTS单元(PIKE Technologies DiffusIR)中,压制并安装。催化剂首先在300℃空气中预处理1小时。然后,催化剂逐步冷却至室温。在此过程中,采集目标温度下的背景光谱,进行不同实验(如CO吸附25℃,甲醇吸附25℃,NH吸附100/125/150/175/200/225/250℃)3.吸附/解吸,175℃为NH3.氧化)。适用于CO吸附,甲醇吸附,或nhh3.吸附/解吸/氧化实验中,原料气为1% CO、15%甲醇或500 ppm NH3.和/或5 vol% O2(使用时),分别用Ar作平衡。总流速控制在83.33 mL∙min−1.光谱采集范围为400 ~ 4000 cm−1分辨率为4厘米−1100次扫描。
H2-温度程序还原(H2-TPR)在Quantachrome Autosorb-iQ仪器上进行。一般情况下,30mg样品装入u型石英管反应器中,400℃空气预处理1 h。当样品在空气中冷却至室温时,进气切换到10 vol% H2与Ar平衡(30 mL∙min−1).然后,将反应器线性加热至900°C,升温速率为10°C∙min−1.H的信号2消耗量由热导率检测器(TCD)监测。H2气体混合物中的O水分被一个充满液态N的冷阱除去2才能进入TCD。
在岛津UV-2401 PC仪上以扩散模式采集紫外-可见(UV-Vis)光谱。贝索4作为参比,光谱采集范围为200 ~ 800 nm。在整个实验过程中,样品都暴露在室温空气中。
采用FEI Titan Cubed G2 60-300像差校正S/TEM仪,在300kv加速电压下采集原子分辨率像差校正的高角度环形暗场扫描透射电镜(AC-HAADF-STEM)图像。观察在HAADF模式下进行,该模式允许z -对比度成像。Titan电子显微镜上的探针收敛角为22 mrad, HAADF探测器的角度范围为79.5 ~ 200 mrad。为了制备TEM样品,将适量的样品粉末分散在乙醇中,然后滴在3mm TEM Mo网格上。利用SuperX系统在Titan电子显微镜上获得了STEM模式下的能谱(EDS)元素映射图像。
原位XRD实验在Rigaku SmartLab SE XRD仪上进行,该仪器配备了高速1D硅条探测器(D/teX Ultra 250, Rigaku, Japan)和原位细胞(Reactor X, Rigaku, Japan)。x射线由铜源产生,管的工作功率为2.2 kW (Cu Kα)。附加PXRD参数如下:测角仪半径= 300 mm,入射和接收Soller狭缝= 2.5°,长度限制狭缝= 10 mm,接收狭缝Ni滤波器缓解Cu Kβ信号。样品的温度由石英样品架(样品压口尺寸:13 × 20 × 0.4 mm)从下面的红外加热来控制,细胞中的气体成分由一组质量流量控制器(Brooks 5850e, Brooks Instrument, Hatfield, PA, USA)控制。在实验过程中,干燥空气流过原位细胞(100 mL∙min−1).样品在25°C下保存5分钟,然后在整个升温、保存和冷却步骤中连续进行XRD扫描。更详细地说,样品从25°C加热到目标温度(550或800°C),升温速率为2°C∙min−1,在目标温度(550或800°C)下保持2 h,最后以2°C∙min的速率冷却至25°C−1.XRD扫描从25°到50°,扫描速率为2°C∙min−1,步长为0.01°。
ICP-OES测量使用Optima 8300仪器(PerkinElmer)进行。入射功率为13000 W,铂检测波长为265.945 nm。
Pt L的XAS3.荧光模式下的-edge在布鲁克海文国家实验室国家同步加速器光源II (NSLS-II)的光束线7-BM QAS上测量。该束流提供的x射线能量范围为4.7 ~ 31 keV。它的单色仪配备了Si(111)通道切割晶体,并在连续扫描模式下运行。典型的扫描时间为30秒,每个样品扫描40次。在整个实验过程中,样品都暴露在室温空气中。利用Demeter软件包对XAS数据进行分析,包括x射线吸收近缘结构(XANES)和扩展x射线吸收精细结构(EXAFS)。
x射线光电子能谱(XPS)在VG CLAM 4 MCD分析仪上采集。在分析之前,样品在制备室(10−5Torr) 0.5 h。将样品放入3 × 10−9Torr)进行进一步分析。用C1s线在284.6 eV处校准结合能(BE)。
在雷尼绍激光拉曼光谱仪(Renishanplc)上采集拉曼光谱+激光光束。发射线为532 nm,输出功率为10 mW。在整个实验过程中,样品都暴露在室温空气中。
采用在线质谱仪(hidden Analytical, HPR20 R&D)在固定床石英管流反应器中进行co -温度程序解吸(CO-TPD)。质荷比(米/z)的28用于监测CO。在每个测试中,100 mg样品在300℃的空气中预处理1小时,然后在30℃的CO中饱和。然后,在石英管反应器中引入Ar,去除弱吸附的CO。最后,样品以10°C∙min的速率线性加热至300℃−1在流动的氩。
在2% CO/4% O的交替脉冲条件下,采用多脉冲实验方法测定了动态储氧容量2总流速为100 mL∙min−1.在测试前,所有样品在300°C的空气中预处理1小时。单次循环1 min, CO/ O为30 s2循环开关由自动质量流量控制器(MFC)控制。盐含量值由平均CO计算2通过在线质谱仪(hidden Analytical, HPR20 R&D)检测在一个周期(30 s + 30 s)内形成。
NH3.-程序升温解吸(NH3.-TPD)在固定床石英流反应器中进行,与在线Thermo Nicolet iS10 FTIR光谱仪连接,该光谱仪配备2 m径长气体电池(200 mL体积)。在每个测试中,100 mg样品在200°C下用纯Ar预处理1小时,然后用NH饱和3.在100°C。然后在石英管反应器中再次引入Ar,去除弱吸附的NH3..最后,将样品以10°C∙min的速率线性加热至500°C−1(100 mL∙min−1).
基于密度泛函理论(DFT)的计算细节
DFT计算使用维也纳从头算模拟包(VASP)进行。59,采用投影增强波(PAW)60,61平面波基集。广义梯度近似(GGA)以Perdew-Burke-Ernzerhof (PBE)的形式使用。62与DFT-D3校正一起起作用63描述电子交换相关。用U = 5ev的DFT + U法计算ce5f轨道64被用来恰当地描述CeO的电子结构2.平面波膨胀的电子动能截止值为500 eV。为CeO建模2(110)面,5层4 × 3 CeO2采用优化后的晶格常数5.479 Å构造了(110)平板,即每层有12个Ce原子和24个O原子。为阶梯式CeO建模2(110)面,一块两倍大的板子被去掉,顶着CeO的一半2层来创建步骤。15 Å沿表面法线方向增加的真空用于沿表面法线方向解耦周期性图像。考虑到超级单体的大小,布里渊带的采样点在带中心,使用σ = 0.1 eV的高斯涂抹进行结构松弛。所有的电子周期都收敛到10−5电动汽车。所有的结构都被放松以使应力最小化,直到作用在每个原子上的所有力都小于10−2电动汽车/ A。
为了寻找Pt原子在表面的最佳位置,用Pt原子取代了各种表面Ce原子。为了模拟Pt原子在O-空位旁边的情况,移除了Pt附近的一个或两个O原子来创建一个场景。为了模拟Pt原子与5个或6个O原子配位的情况,在Pt原子上加1个O原子。对于台阶表面,还考虑了Pt原子吸附在台阶位置的情况。
评价了铂的相对形成能1Pt的形成能1/首席执行官2被定义为
在哪里\ ({F }_{{{{{{{\ rm {Pt}}}}}}} _ {1} / {{{{{rm \ {CeO}}}}}} _ {2}} \)而且F \ ({} _ {{{{{{rm \ {CeO}}}}}} _ {2}} \)Pt1/首席执行官2系统和CeO2表面。系统的自由能定义为
在哪里\ \ (E),F \ ({} _ {{{{{{rm \ {Vib}}}}}}} \),\ ({PV} \)分别为总能量(由DFT计算)、振动对自由能的贡献、压力和体积变化对自由能的贡献。两者之间的区别\ ({PV} \)Pt项1/首席执行官2干净的CeO2表面很小,可以忽略不计。在这项工作中,差异在F \ ({} _ {{{{{{rm \ {Vib}}}}}}} \)Pt之间1/首席执行官2干净的CeO2表面不包括计算可行性,如20 Pt1/首席执行官2考虑了具有大型模拟超级单体的构型。然而,由于所考虑的铂的形成能之间存在较大差异,因此这种贡献预计发挥的作用较小1/首席执行官2构型,如所见。\ ({N} _ {X} \)而且\({\μ}_ {X} \)是X所考虑的体系中的原子和化学势X原子(X =Ce, O,或Pt)。由于Ce与Ce原子在体积CeO中处于平衡状态2(也就是说,如果Ce原子从表面移动,它们会去到散装CeO2),\({\μ }_{{{{{{\ rm {Ce}}}}}}} \)而且\({\μ}_ {{{{{rm \ {O}}}}}} \)不是独立的
在哪里\ ({E }_{{{{{{{\ rm {CeO}}}}}}} _ {2}} \)每个CeO的总能量是多少2单位。因为氧和氧处于平衡状态2表面周围的储层,温度下氧的化学势\ (\ {{{{T}}}} \)分压\ (p {} _ {{{{{{rm \ {O}}}}}} _ {2}} \)计算为
在哪里\ ({E} _ {{{{{rm \{合计 }}}}}}^{{{{{{\ rm {O}}}}}} _ {2}} \)而且\ ({E} _ {{{{{rm \{零点 }}}}}}^{{{{{{\ rm {O}}}}}} _ {2}} \)是O的总能量和零点能量2用DFT计算分子,\ ({k} _ {B} \)是玻尔兹曼常数,\ ({p} ^ {o} \)是否有参考压力\({\波浪号{\μ}}_ {O} (T, p {} ^ {O}) \)是否可以从实验数据中计算出与温度有关的部分65,66.由于Pt在煅烧过程开始时经常沉积在表面,因此在煅烧过程中或煅烧后都没有储层,因此Pt的化学势近似为分离出的Pt原子的总能量。
CO在铂上的吸附能1/首席执行官2计算为
在哪里\ ({E} _ {{{{{{rm \{有限公司 }}}}}}-{{{{{{\ rm {Pt}}}}}}} _ {1} / {{{{{rm \ {Ce }}}}}}{{{{{\ rm {O}}}}}} _ {2}} \),\ ({E }_{{{{{{{\ rm {Pt}}}}}}} _ {1} / {{{{{rm \ {Ce }}}}}}{{{{{\ rm {O}}}}}} _ {2}} \)而且\ (E {} _ {{{{{{rm \{有限公司}}}}}}}\)为CO吸附构型的总能量,Pt1/首席执行官2一个分离的CO分子,在一个15 × 15 × 15的立方Å内进行评估3.框,分别。使用Phonopy代码中实现的有限差分方法计算CO拉伸频率(使用0.01 Å位移,电子周期收敛到10−6eV)67.研究发现,对吸附的CO分子周围约30个原子施加位移足以获得聚合的CO拉伸频率。
由于这里的研究涉及到大量的配置的吸附反应物及其中间体的CO氧化和NH适当的考虑3.Pt@CeO上的氧化v(1)在计算可行性方面,Pt@CeEdge-O是一位CeO2(110)板坯采用4层4 × 3 CeO2(110),即每层12个Ce和24个O原子,用于Pt@CeO上的研究v(1).一位首席执行官2(110)板坯用5层1 × 3 CeO2(230)阶梯表面,即每层12个Ce和24个O原子,用于Pt@CeEdge-O上的CO氧化研究。一位首席执行官2(110)板坯采用4层6 × 3 CeO2(110)去除50%的顶层,在Pt@CeEdge-O模型中创建步骤,用于NH3.氧化研究。用微动弹性带(NEB)和爬升图像(CI-) NEB方法测定反应的过渡态(TS)68,69.
催化活性试验
CO氧化和NH3.在固定床石英管反应器中考察了催化剂的氧化活性。样品(40-60目)与SiC混合以减小热效应(质量比为1:10)。CO氧化活性测试的反应物为1% CO, 1% O25% H2O(如果使用)在Ar平衡。总流速为83.33 mL∙min−1重量每小时空速(WHSV)为400,000 mL∙g猫−1·h−1.出口气体由在线质谱仪(hidden Analytical, HPR20 R&D)检测。质荷比(米/z)的28和44用于监测CO和CO2,分别。对NH3.氧化活性测试,反应物由500ppm nhh组成3., 5% o2, 5% H2O(如果使用)在Ar平衡。WHSV控制在200,000 mL∙g猫−1·h−1.NH的浓度3.不,不2,和N2使用Thermo Nicolet iS10 FTIR光谱仪测量出口气体中的O,该光谱仪配备2 m径长、200 mL体积的气体电池。所有反应均在稳态条件下进行。CO氧化反应中CO的转化,以及NH3.换算和N2NH选择性3.氧化反应由下式确定:
在反应动力学研究中,为避免传热传质效应,采用CO或NH测定反应速率3.样品(40-60目)在测试前与SiC混合以最小化热效应(质量比为1:20)。对于CO氧化反应,原料气由1% CO和1% O组成2在Ar平衡。WHSV控制在800,000 mL∙g猫−1·h−1400,000 mL∙g猫−1·h−1Pt /首席执行官2−550和Pt/CeO2−800,分别。对NH3.氧化反应时,原料气由500ppm nhh组成3.5% O2在Ar平衡,WHSV为600,000 mL∙g猫−1·h−1.
数据可用性
源数据提供了这篇论文。
参考文献
刘,L. & Corma, A.用于多相催化的金属催化剂:从单原子到纳米团簇和纳米颗粒。化学。牧师。118, 4981-5079(2018)。
Kaiser, s.k, Chen, Z., Faust Akl, D., Mitchell, S. & Pérez-Ramírez, J.元素周期表上的单原子催化剂。化学。牧师。120, 11703-11809(2020)。
Lang, R.等。基于金属-氧化物相互作用的单原子催化剂。化学。牧师。120, 11986-12043(2020)。
卢,Y.等。单原子Ir-on-MgAl上CO氧化活性配合物的鉴定2O4催化剂。Catal Nat。2, 149-156(2019)。
王,J.等。催化一氧化碳氧化MgAl2O4负载铱单原子:配体构型和位置几何。期刊。化学。C125, 11380-11390(2021)。
梁,J.-X。et al。Ir中的双金属活性位点1/ FeO说x单原子催化剂:水气转换反应的氧化还原机理。Angew。化学。Int。艾德。59, 12868-12875(2020)。
陈,Y.等。确定Pt作为单原子和纳米颗粒支持FeO的尺寸效应x对于水气变换反应。ACS Catal。8, 859-868(2018)。
Yin, P.等。具有精确n配位的单钴原子作为优良氧还原反应催化剂。Angew。化学。Int。艾德。55, 10800-10805(2016)。
潘,Y.等。调节单原子Fe-N配位结构xCy苯氧化的催化位点。Commun Nat。10, 4290(2019)。
黄,D.等。配位数对单原子铂催化剂催化性能的影响。ACS Catal。11, 5586-5592(2021)。
徐毅,等。揭示了Pt单原子局部配位环境与催化选择性的关系。Nano。20., 6865-6872(2020)。
张勇,焦磊,杨伟,谢超,姜海林。高选择性CO用MOFs合理制备低配位单原子Ni电催化剂2减少。Angew。化学。Int。艾德。60, 7607-7611(2021)。
张,J.等。调整单原子催化剂中的配位环境以实现高效的氧还原反应。j。化学。Soc。141, 20118-20126(2019)。
杨,W.等。配位环境对单原子铁催化剂动力学和热力学稳定性的影响。理论物理。化学。化学。理论物理。22, 3983-3989(2020)。
张,S.等。单点铂催化剂上正己烷重整机理的探讨。j。化学。Soc。142, 16533-16537(2020)。
肖勇,李海华,谢凯。在介孔CeO扭曲表面激活晶格氧2单晶用于高效和持久的CO催化氧化。Angew。化学。Int。艾德。60, 5240-5244(2021)。
刘,等。揭示了单个铂原子在单分子水平上的催化动力学。国家科学院学报美国119, e2114639119(2022)。
陈,L.-N。et al。利用单点Pt高效甲醇制氢1/首席执行官2催化剂。j。化学。Soc。141, 17995-17999(2019)。
蒋,Z.等。在CeO上稳定铂原子2金属-载体相互作用诱导界面变形的氧空位:机理及应用。达成。Catal。B278, 119304(2020)。
聂,L.等。单原子Pt/CeO表面晶格氧的活化2用于低温CO氧化。科学358, 1419(2017)。
Ma, Y.等人。裁剪的接近铂单原子的CeO2使用磷可以提高氢化活性。ACS Catal。9, 8404-8412(2019)。
郑,H.等。控制铂单原子的氧化态,使催化活性最大化。Angew。化学。Int。艾德。59, 20691-20696(2020)。
布鲁克斯等人。催化材料中的最大贵金属效率:原子分散的表面铂。Angew。化学。Int。艾德。53, 10525-10530(2014)。
王,C.等。铈负载单原子铂上CO氧化的水介导Mars-van Krevelen机制1催化剂。ACS Catal。7, 887-891(2017)。
唐勇,王永光,王永光。李军。铂的理论研究1@CeO2CO氧化单原子催化剂。期刊。化学。C121, 11281-11289(2017)。
苏,Y.-Q。et al。预测负载单原子催化剂稳定性的理论方法。ACS Catal。9, 3289-3297(2019)。
蒋,D.等。在单原子铂中剪裁铂的局部环境1/首席执行官2低温CO氧化催化剂。Angew。化学。Int。艾德。60, 26054-26062(2021)。
Wan, W.等。氧等离子体功能化的高稳定活性铂单原子2表面:纳米结构和过氧效应。Angew。化学。Int。艾德。61, e202112640(2022)。
李俊杰、赖猷、陈晓霞、金天杰、金德华、李俊杰如何与首席执行官互动2高温还原和氧化环境下Pt/CeO热稳定性提高的原因2与CeO相比2.期刊。化学。C120, 25870-25879(2016)。
Pereira-Hernández, x.i.等。调优Pt-CeO2高温气相合成提高晶格氧还原性的相互作用。Commun Nat。10, 1358(2019)。
陈,J.等。表面工程协议,以获得原子分散的Pt/CeO2具有高活性、稳定的CO氧化催化剂。ACS维持。化学。Eng。6, 14054-14062(2018)。
Gänzler, a.m.等。揭示了低温CO氧化Pt/CeO的不同反应途径2和Pt / Al2O3.通过空间解析结构-活性相关性。期刊。化学。列托人。10, 7698-7705(2019)。
Freund,周宏儒。,Meijer, G., Scheffler, M., Schlögl, R. & Wolf, M. CO oxidation as a prototypical reaction for heterogeneous processes.Angew。化学。Int。艾德。50, 10064-10094(2011)。
乔,B.等。Pt单原子催化CO氧化1/ FeO说x.Nat,化学。3., 634-641(2011)。
柯,J.等。强局部配位结构对亚纳米PtO的影响xCeO集群2低温CO氧化纳米线。ACS Catal。5, 5164-5173(2015)。
吕,Y.,汤普森,C., Kunwar, D., Datye, a.k. & Karim . a.m . CeO高CO氧化活性的起源2负载铂纳米颗粒:较弱的CO结合或易于氧气从载体转移?化学。猫。化学。121726-1733(2020)。
魏,D.-Y。et al。CO氧化过程中铂-铈界面氧活化和反应的原位拉曼观测。j。化学。Soc。143, 15635-15643(2021)。
Gänzler, a.m.等。调优Pt/CeO2界面通过原位改变Pt颗粒大小。ACS Catal。8, 4800-4811(2018)。
高勇,王伟,常胜,黄伟。CeO的形态效应2Pt/CeO的制备、金属-载体相互作用和催化性能2催化剂。化学。猫。化学。5, 3610-3620(2013)。
Tan, W.等。将缺陷工程铈上高度稳定的铂单位点转化为用于车辆排放控制的稳健铂簇。环绕。科学。抛光工艺。55, 12607-12618(2021)。
Tan, W.等。调谐单原子铂1首席执行官2高效CO和C催化剂3.H6氧化:氧化铈对铂结构演化的尺寸效应。ChemNanoMat6, 1797-1805(2020)。
朱,C.等。CeO的晶体面效应2{110}和CeO2{100}光催化CO2还原:氧缺陷和羟基的协同作用。ACS维持。化学。Eng。8, 14397-14406(2020)。
Bugrova, t.a.等人。对Pt/CeO中Pt物种形成的认识2催化剂:处理条件和金属载体相互作用的影响。Catal。今天375, 36-47(2021)。
Yaghoubi, H.等。可见光驱动光催化剂:未掺杂TiO中间隙态诱导能隙的影响2纳米粒子。ACS Catal。5, 327-335(2015)。
胡勇,宋晓霞,姜生,魏春华。pt掺杂tio2增强光催化活性2没有x紫外和可见光照射下的氧化:晶格Pt的协同效应4 +和表面PtO。化学。Eng。J。274, 102-112(2015)。
吴铮,李敏,马林斯,欧佛伯里,邵世华。探索CeO的表面位置2通过甲醇吸附和解吸具有明确表面平面的纳米晶体。ACS Catal。2, 2224-2234(2012)。
Masui, T.等。用反胶束制备氧化铈(IV)超细颗粒的表征。化学。板牙。9, 2197-2204(1997)。
Pastor-Pérez, L., Ramos-Fernández, E. V. & Sepúlveda-Escribano, A. CeO的影响2Pt/CeO行为的合成方法2催化水气转换反应。Int。j . Hydrog。能源44, 21837-21846(2019)。
Parvulescu, V. I. & Tiseanu, C. CeO的局部结构2兼首席执行官2-ZrO2铕发光探测纳米粒子。Catal。今天253, 33-39(2015)。
Ma, R, Jahurul Islam, M, Amaranatha Reddy, D. & Kim, T. K. CeO转型2变成一个混合阶段的CeO2/ Ce2O3.通过液相脉冲激光烧蚀增强光催化活性。陶瓷。Int。42, 18495-18502(2016)。
D 'Angelo, a.m.,韦伯斯特,n.a.s. & Chaffee, a.l.在cu掺杂的pro - ceo中的空位生成和氧气摄取2材料使用中子和原位x射线衍射。Inorg。化学。55, 12595-12602(2016)。
穆克里,B. D., Waghmare, U. V. & Hegde, M. S.铂离子掺杂TiO2: Pt催化活性高2 +Ti中存在氧化物离子空位4 +1−xPt2 +xO2−x与铂相比4 +Ti中无氧化离子空位4 +1−xPt4 +xO2.化学。板牙。25, 3822-3833(2013)。
王,F.等。解决纳米γ-Al上单原子银分散的难题2O3.高催化性能的表面。Commun Nat。11, 529(2020)。
Pignet, T. & Schmidt, L. D. NH动力学3.对Pt, Rh和Pd的氧化。j . Catal。40, 212-225(1975)。
刘峰,单伟,连忠,刘俊,何辉。铁的智能表面改性2O3.通过我们x显著促进NO的选择性催化还原x与北半球3..达成。Catal。B230, 165-176(2018)。
王,F.等。Al的纳米效应2O3.在Ag / Al2O3.氨的选择性催化氧化催化剂。ACS Catal。8, 2670-2682(2018)。
Tan, W.等。气相硫酸化氧化铈-氧化锆固溶体,用于生成高效和SO2耐NH3.-SCR催化剂去除NO。j .风险。板牙。388, 121729(2020)。
王,F.等。对H2Ag/Al预处理2O3.氨选择性氧化的催化剂。ACS Catal。9, 1437-1445(2019)。
Kresse, G. & Furthmüller, J.使用平面波基集的金属和半导体从头算总能量计算的效率。第一版。板牙。科学。6, 15-50(1996)。
Blöchl, p.e.投影增波法。理论物理。启B50, 17953-17979(1994)。
Kresse, G. & Joubert, D.从超软赝势到投影增强波方法。理论物理。启B59, 1758-1775(1999)。
裴杜,柏克,K. &恩泽霍夫,M.广义梯度近似简化。理论物理。启。77, 3865-3868(1996)。
Grimme, S. Antony, J., Ehrlich, S. & Krieg, H. 94元素H-Pu的密度泛函色散校正(DFT-D)从头算参数化的一致性和准确性。j .化学。理论物理。132, 154104-154122(2010)。
普拉塔,Márquez, a.m.s and Sanz, j.f .传播:改进密度泛函理论+UCeO描述2包括o2p电子的贡献。j .化学。理论物理。136, 041101(2012)。
路透,K. & Scheffler, M. RuO的组成和结构2(110)表面呈O形2和CO环境:对CO催化形成的影响2.理论物理。启B68, 045407(2003)。
蔡斯,m.w.等。NIST-JANAF热化学表(国家标准与技术研究所标准参考数据计划,1985)。
多哥,A. & Tanaka, I.材料科学中的第一性原理声子计算。可控硅。板牙。108, 1-5(2015)。
汉克尔曼,G. & Jonsson, H.改进的切线估计在微推弹性带方法中寻找最小能量路径和鞍点。j .化学。理论物理。113, 9978-9985(2000)。
汉克尔曼,G., Uberuaga, B. P. & Jonsson, H.一种用于寻找鞍点和最小能量路径的爬升图像轻推弹性带方法。j .化学。理论物理。113, 9901-9904(2000)。
确认
这项工作得到了由F.L., t.r.和s.h.获得的国家科学基金会拨款(CHE - 1955343)和中佛罗里达大学(UCF)的启动基金(F.L.)的支持。s.x感谢UCF卓越博士后项目(P3)的支持。本研究使用了国家同步加速器光源II的光束线7-BM (QAS),这是美国能源部(DOE)科学办公室的用户设施,由布鲁克海文国家实验室根据合同编号为DOE科学办公室运营。DE-SC0012704。DFT计算使用了中佛罗里达大学高级研究计算中心和极限科学与工程发现环境(XSEDE)的计算资源。
作者信息
作者及隶属关系
贡献
F.L.构思了这个想法,指导了这个项目,并指导了手稿的写作和修改。W.T.设计了实验,分析了数据,并撰写了手稿。S.X.进行了实验并分析了数据。d.l., d.a., s.h.和T.R.负责DFT的计算。W.D.进行了原位XRD分析。M.W.和K.L.对AC-HAADF-STEM进行了表征和数据分析。F.G.和L.D.提供了实验资源。L.M.和S.E.进行了XAS测量。所有作者讨论了结果并对手稿进行了评论。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然通讯感谢陈荣和其他匿名审稿人对本工作的同行评议所作的贡献。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
源数据
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
谭伟,谢寿,乐,丁。et al。微调铂单原子在铈上的局部配位环境可以控制催化反应。Nat Commun13, 7070(2022)。https://doi.org/10.1038/s41467-022-34797-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-022-34797-2