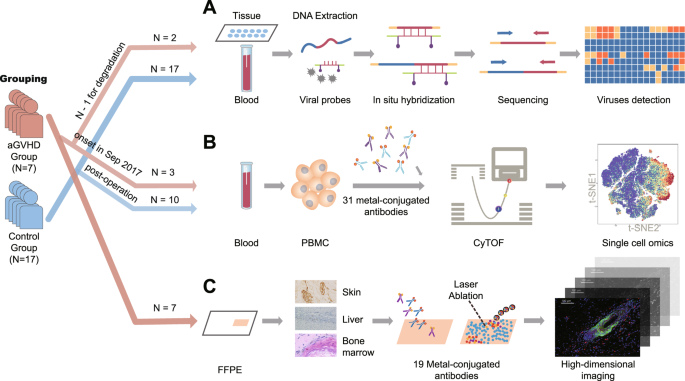
摘要
急性移植物抗宿主病(aGVHD)是一种罕见但严重的肝移植并发症。它是由移植后不久移植物中供体免疫细胞对宿主的激活引起的,但致病因素尚不清楚。在这里,我们发现供体T细胞的人T细胞嗜淋巴病毒I型(htlv1)感染与lt后的aGVHD高度相关。从7名aGVHD患者和17名对照组患者的发现队列中,htlv1在外周血和组织样本中的存在,通过杂交探针(TargetSeq)、大规模细胞术(CyTOF)和多重免疫组织学(IMC)进行了评估。我们所有7例aGVHD患者IMC均显示可检测到HTLV-1 Tax信号。我们基于Y染色体特异性遗传标记EIF1AY识别供体来源的细胞。因此,我们证实了CD4的存在+税+EIF1AY+T细胞与税收+CD68+EIF1AY+抗原呈递细胞,提示HTLV-1感染供体免疫细胞。在400名患者的独立队列中,我们证实HTLV-1流行与aGVHD发病率相关,而对照病毒中没有显示出显著的相关性。因此,我们的发现为肝移植相关aGVHD的病因病理学提供了新的见解,并提高了在移植前预防aGVHD的可能性。
介绍
移植物抗宿主病(GVHD)是指宿主的主要组织相容性复合体(MHC)激活移植物中的供体免疫细胞,从而对宿主组织和器官造成的免疫损伤。1,2.这是一种比典型排斥反应更强烈的排斥反应,破坏宿主的皮肤和粘膜屏障,导致严重感染,最终致命的感染性休克。从发病到死亡,病程可在两周以内3..一般来说,GVHD可分为急性(aGVHD)和慢性(cGVHD)两种类型,这取决于疾病是在移植后第100天之前还是之后出现4.与接受造血干细胞移植(HSCT)患者aGVHD的高发生率(20-80%)相反5,6,实体器官移植(如肝移植)的发病率要低得多(0.1-2%)。7.然而,伴有aGVHD的LT患者的死亡率高达80-100%8,而移植受者在一年内的总体死亡率为9.4%9.在各种实体器官移植中,GVHD发病率低,死亡率高。然而,目前还缺乏理论来解释这一问题10.
20多年前,供体来源的T细胞被确定为GVHD的主要原因11.大量供体来源的T细胞的引入导致了HSCT患者GVHD的高发5,6而LT患者只接受了一小部分供体免疫细胞。当移植肝时,109−1010供者来源的免疫细胞被转移到受体体内,包括T细胞、B细胞、自然杀伤细胞(NK细胞)和单核细胞12.在某些情况下,这些细胞可以在手术后3到100天在受体的外周血和骨髓中检测到,这与aGVHD的发病时间相匹配13.任何将存活的异基因淋巴细胞转移到受者体内的移植都有发生GVHD的潜在风险,例如输血相关的GVHD14,15.
aGVHD发展的关键过程是抗原提呈细胞(APC)与相应的宿主MHC或小组织相容性抗原(miH)肽激活供体来源T细胞上的T细胞受体(TCR)16.捐赠者CD8+单独的T细胞可以通过识别MHC类I分子的差异诱导GVHD,而CD4+T细胞通过识别MHC II类分子诱导GVHD10,17,18.T细胞是引起靶组织细胞死亡的主要效应因子,由各种细胞毒性作用介导10.作为一种致病性和嗜t细胞的人逆转录病毒,人t细胞嗜淋巴病毒I型(HTLV-1)可以感染CD4并使CD4细胞永生化+T细胞19,20..在在猕猴、兔子和人化小鼠中建立的不同HTLV-1感染动物模型中,该病毒可导致致命的CD4+t细胞扩张21,22,23.值得注意的是,骨髓-肝脏-胸腺(BLT)小鼠模型容易发生aGVHD,这与血液中HTLV-1 RNA水平升高有关21.HLA匹配在HSCT前进行,以避免大量供体来源的T细胞攻击宿主,而HLA匹配在肝移植中不是强制性的。一般来说,即使HLA在供体和受体之间不匹配,在LT中供体淋巴细胞的比例也太小,无法诱导aGVHD。此外,HLA不匹配与LT结果或排异率无关24,25.在HSCT中,组织损伤和GVHD似乎是相互的因果关系26,27,28.然而,在lt中,没有常规化疗引起的组织损伤,触发和诱导供体来源的T细胞扩增以发展aGVHD的危险因素仍然未知,这是我们的重点。
在本研究中,我们假设病毒感染在LT中发挥了扩大供体来源的T细胞的作用,这可能被aGVHD过程中严重的真菌和细菌感染所掩盖。从2015年到2020年,在我们中心的3763例肝移植受者中,确定了7例aGVHD患者为DCD(循环性死亡后供体)受者。因此aGVHD的发生率为0.18%(7/ 3763)。为了揭示与发展aGVHD相关的隐源性感染,我们设计了一种针对8种非嗜肝病毒的鸡尾酒探针。结果,在所有7例aGVHD患者中均明确发现HTLV-1感染。此外,多重免疫组织学(IMC)结果证实了供体来源的CD4+T细胞因HTLV-1感染而增加。此外,大规模细胞术(CyTOF)和IMC结果的联合分析表明agvhd特异性Tax+CD68+APCs吸收HTLV-1并传递病毒和免疫信号。因此,我们的研究表明HTLV-1参与了aGVHD的整个过程。
结果
HTLV-1仅在肝移植后aGVHD患者中发现
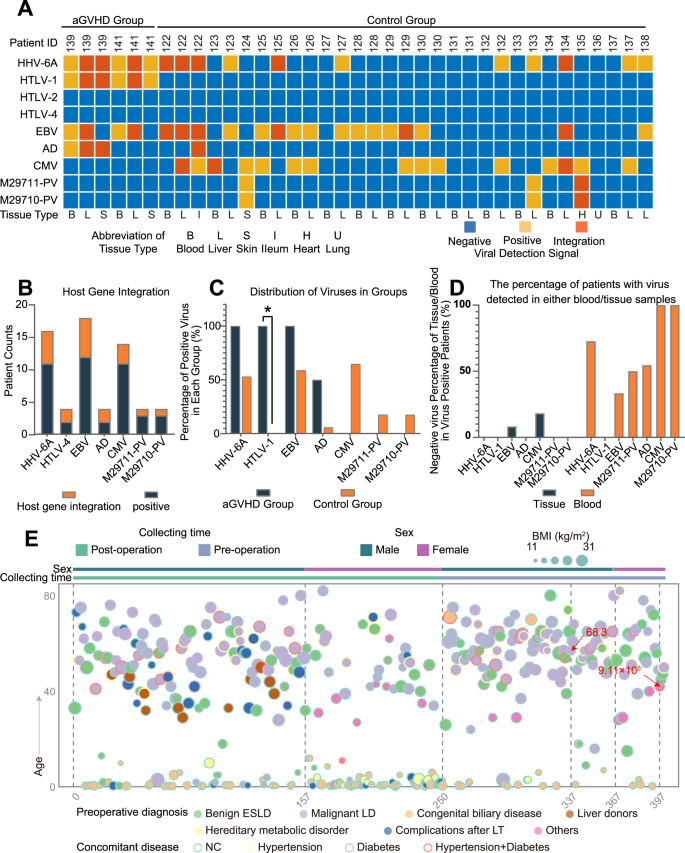
为了揭示与aGVHD发展相关的隐基因感染,我们采用TargetSeq检测了aGVHD组的两名患者(ID139和ID141)和对照组的17名患者的样本中的病毒感染(图2)。1).详细的患者信息和分组原则在方法和材料中描述(表S1).在aGVHD组中,由于样本收集的限制,仅获得了两名患者的外周血、皮肤或肝脏活检组织(图2)。2).同样,从对照组采集外周血和疾病相关病变组织标本,包括肝组织、感染部位组织和肝肿瘤肺转移灶(图2)。2和表S1).TargetSeq使我们能够确定病毒(HHV-6A、HTLV-1、HTLV-2、HTLV-4、EBV、腺病毒、巨细胞病毒和细小病毒-1)的存在,特别是病毒是否处于潜伏感染阶段29.潜伏感染是指病毒DNA已经整合到宿主基因组中,病毒在人体内实现持续性和终生感染,并参与各种并发症的发病机制的一种方式30..在aGVHD组和对照组中,HTLV-2和HTLV-4均未检测到,因此被排除在后续分析之外(图2)。2).在所有aGVHD样本中检测到HHV-6A和HTLV-1,而在部分aGVHD样本中检测到EBV和腺病毒(图2)。2).在139例患者的肝活检组织和皮肤组织中均发现HTLV-1、HHV-6A和腺病毒的病毒宿主基因整合,而EBV仅在肝活检组织中存在整合。同时,仅在141例患者的肝活检组织中检测到HTLV-1、HHV-6A和EBV的病毒宿主基因整合(图2)。2 a, B).通过Fisher精确检验比较各组间病毒的存在,并采用Benjamini-Hochberg校正(图2)。2摄氏度).与对照组相比,aGVHD组HTLV-1阳性患者的百分比显著升高(经调整后)p值= 0.0406)(图2摄氏度).在aGVHD样品中均未检测到细小病毒1和巨细胞病毒。此外,在对照组患者的外周血或组织样本中未检测到HTLV-1,这与aGVHD组相比,该病毒在所有样本中均被检测到(图2)。2a c d).虽然在aGVHD组的所有样本中都检测到HHV-6A,但在对照组中也存在HHV-6A。aGVHD组与对照组之间HHV-6A感染率无明显差异(图2)。2, C).因此,这些结果初步提示了HTLV-1感染与aGVHD发生的相关性。此外,一些病毒在组织感染患者的外周血中未被检测到,这表明同时对组织和外周血进行病毒筛查可能更可靠(图2)。二维).
一个热图描述了来自aGVHD组的2名患者和对照组的17名患者的每个样本中病毒或病毒/宿主整合的检测情况。阴性、阳性和宿主整合结果分别标记为蓝色、黄色和红色。B统计病毒感染病例数和宿主整合数。C计算并比较aGVHD组(N= 2),对照组(N= 17)。所有p数值采用Fisher精确检验计算,并采用Benjamini-Hochberg校正。*p= 0.0406。D在外周血或组织样本中检测到病毒的患者百分比。E热图描述了验证队列中400例患者的基本临床信息,包括年龄、体重指数(BMI)、样本收集时间、术前诊断和伴随疾病。两名HTLV-1感染患者用红色箭头标记,并标注病毒载量。(良性ESLD:良性终末期肝病,恶性LD:恶性肝病,肝移植术后并发症,NC:无伴发疾病。)
为了进一步调查HTLV-1在我们中心的流行情况,验证我们关于HTLV-1感染和aGVHD过程的假设,我们对400例患者进行了独立队列研究,包括肝手术患者、肝移植受者和肝移植供体(表2)S2),于2021年1月至2021年6月进行RT-PCR检测HTLV-1感染。共有2例患者HTLV-1阳性,其中1例为移植供体,1例为肝部分切除术后患者(图2)。2 e).值得注意的是,HTLV-1阳性供体的受体没有感染,因为供体的病毒载量低于可引起病毒感染的最低负荷(9 × 104)31.另1例htlv -1阳性合并丙型肝炎患者因急性肝衰竭术后2天死亡。在该队列的400例患者中,没有人被诊断为aGVHD,也没有HTLV-1阳性受体。因此,我中心无aGVHD患者HTLV-1患病率为0.5%,95%置信区间为[0.01%,1.93%],与报道的0.1% ~ 1%的患病率相吻合32.考虑到这一点,这两种罕见疾病同时出现是巧合的可能性小于10−4使用二项概率计算,提示HTLV-1感染应与LT后aGHVD发展密切相关。
agvhd特异性循环免疫细胞(Tax+CD68+)在外周血中发现APCs特征
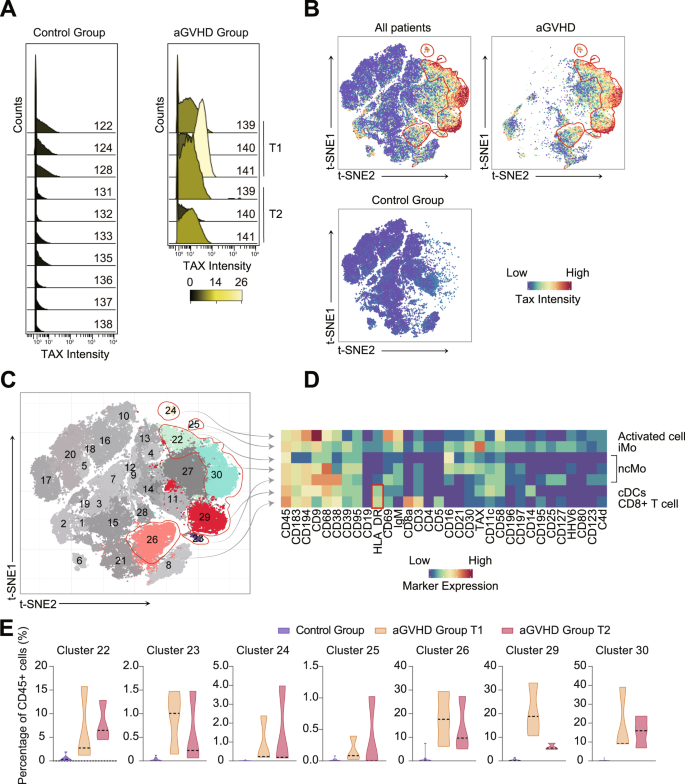
由于HTLV-1与aGVHD之间的关系在统计学上得到了支持,因此我们进行了一系列探索性实验,以进一步揭示其潜在的生物学机制。采用大规模细胞术(CyTOF)对来自aGVHD的pmcs进行系统和深入的表型分析(N= 3)和控制(N= 10)患者(图;1 b).在两个不同的时间点从aGVHD患者和一次对照组患者中收集样本。CyTOF面板,包括31个金属同位素标记的抗体(表S4),旨在获得外周血中白细胞的整体概况。该小组包含30个谱系标记,用于区分显著的白细胞亚群和一个标记,用于在细胞水平上追踪HTLV-1感染。主要是一种针对Tax蛋白的金属标记抗体,一种HTLV-1特异性RNA转录增强剂33,34,也被列入了讨论小组。为了表征免疫细胞亚群的表型,采用t分布随机邻居包埋分析在Cytofkit中生成二维图谱35.每个样品至少5 × 103.白细胞(CD45+细胞)进行后续数据分析(图;S1).结果显示,6个aGVHD样本中Tax蛋白信号均为阳性,而对照组10个样本中Tax蛋白信号均为阴性。信号强度的正负比高达50(图。3).
一个这两个直方图显示了CD45中htlv -1特异性Tax信号的强度+数量(图。S1)两组PBMC样本。在aGVHD组中,在发病至死亡之间的T1和T2两个时间点收集3例aGVHD患者的pbmc。对照组10例患者接受肝移植,并在术后并发症发生的一个时间点采集其pbmc。aGVHD患者的pbmc显示高水平的HTLV-1 Tax表达。B对CD45进行t-SNE降维+细胞探索患者间的异质性。色标表示Tax的arcsin变换信号强度。通过手动门控(红圈)标记具有积极Tax表达式的集群,主要出现在aGVHD组中。C表型图和t-SNE描述了30个自动识别的聚类结果。aGVHD组显示与对照组不同的集群分布。税收+亚种群用空心红圈标记(表S6).D热图描绘了七税细胞标记物的中位表达+亚种。的HLA-DR+亚种群由一个中空的红色矩形标记。颜色条表示蛋白质的arcsin变换信号强度。E百分比的七税+CD45亚群+比较aGVHD组和对照组的细胞。税+以aGVHD组为主。(中间单核细胞:iMo;非经典单核细胞:ncMo;常规树突状细胞:cDC;CD8+T细胞)。
在无花果。3 b,每个点代表一个细胞,颜色表示Tax蛋白的表达水平。aGVHD组和对照组之间免疫细胞的空间分布不同,提示这些患者的免疫反应不同(图。3 b).然后,我们根据表面标记物的表达与表型将免疫细胞聚成30个簇35(无花果。3 c).aGVHD组和对照组之间的主要不同聚类是Tax+CD68+集群(图。3 b而且S2).根据TargetSeq的结果,HTLV-1感染应该与LT、Tax后aGHVD的发展密切相关+仅在aGVHD组的22-26 #和29-30#细胞中检测到细胞。3 b, C).Tax的细胞表型+集群在表中列出S6.簇23#、25#、29#和30#被分类为CD3−CD19−CD11c+CD123−细胞。其中Cluster 29#为HLA-DR+细胞,可以定义为传统的树突状细胞(cDC细胞)。树突状细胞(DC),构成单核吞噬细胞系统(MPS),被认为是最有效的apc36.因为CD68是人类单核细胞和巨噬细胞的选择性标记物,簇22#,23#和30# (CD3−CD19−CD14−CD16+HLA-DR−CD68+)被认为是非经典单核细胞37.25#簇为中间单核细胞(CD3−CD19−CD14+CD11c+CD16+CD68+).簇24# (CD3−CD19−CD14−CD16−CD11c−CD123−HLA-DR−CD68+)表达CD38等活化标记38和CD6939这表明这些细胞被高度激活。同时,星团26# (CD19 .−CD14−CD3+CD8+税+)的特征是税务+CD8+T细胞(图;3 c, D,而且S2).表型从aGVHD组聚集到7 Tax的细胞数量是对照组的10到100倍+集群(图。3 e).22#, 26#和29-30 #簇的百分比超过5%,在aGVHD样本的白细胞中占据较高比例。长期以来,树突状细胞、单核细胞和巨噬细胞一直被认为是循环和组织中的抗原提呈细胞40,41,42.APC与抗原反应,向CD4呈递MHC II沟槽结合肽+T细胞拥有相同的等位基因,引发免疫反应43.我们的CyTOF结果显示agvhd特异性免疫细胞亚群,尤其是Tax+CD68+装甲运兵车。
“三阳性T细胞”证实为皮肤切片供体来源的T细胞
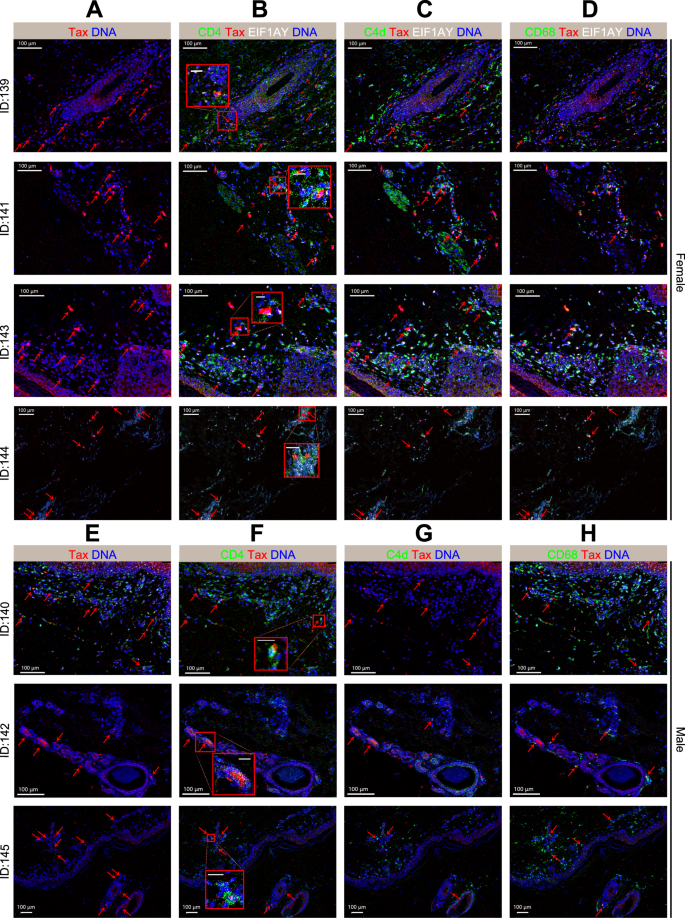
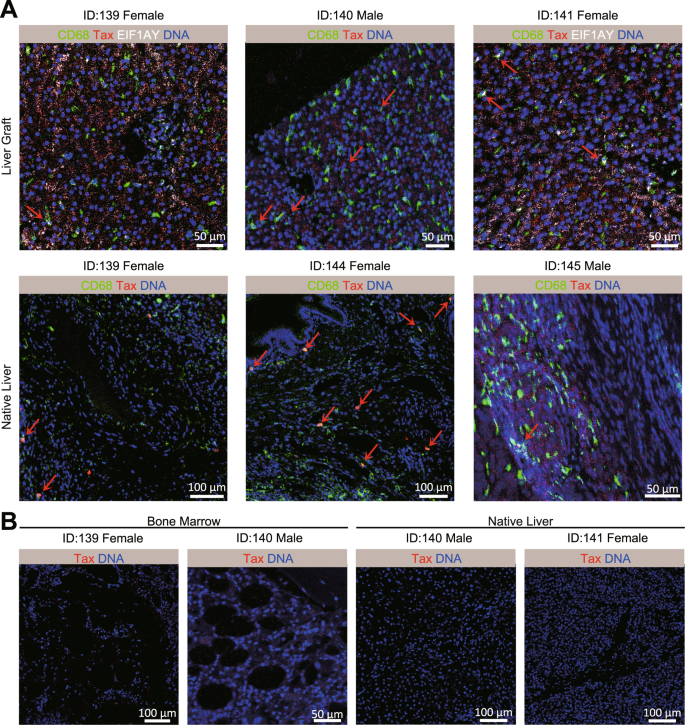
下面对税收进行分析+免疫细胞亚群在外周血中的分布,进一步应用IMC研究Tax的空间分布+免疫细胞是aGVHD的靶器官之一(图2)。1 c).设计了一个由19个金属同位素标记抗体组成的IMC面板,以获得皮肤病变中免疫细胞的整体概况,并揭示HTLV-1与免疫细胞之间的相互作用(表2)S5).该小组包含两个结构蛋白标记物,13个免疫细胞标记物,一个HTLV-1特异性标记物(Tax蛋白)和一个Y染色体标记物,用于跟踪细胞来源。对aGVHD组所有7例患者的皮损进行IMC。其中4例女性患者(ID139、ID141、ID143、ID144)接受男性供体肝脏。因此,由位于Y染色体上的相应基因表达的真核翻译起始因子1AY -linked (EIF1AY)被靶向用于跟踪女性受体样本中供体来源的细胞44.EIF1AY信号显示在女性样本上(图2)。4模拟),但对男性样本没有影响(图。4种情况).此外,我们还对2例aGVHD患者(ID144和ID145)和2例对照组的血清进行了ELISA检测,aGVHD患者的HTLV-1抗体滴度比对照组高30 ~ 100倍(图2)。S3).
来自7例aGVHD患者的两个独立染色皮肤组织的代表性IMC图像显示,Tax(红色)、DNA(蓝色)和不同的免疫反应标记物重叠。每列显示的通道为:一个税收(红色)/DNA(蓝色);BCD4(绿色)/Tax(红色)/EIF1AY(白色)/DNA(蓝色);CC4d(绿色)/Tax(红色)/EIF1AY(白色)/DNA(蓝色);DCD68(绿色)/Tax(红色)/EIF1AY(白色)/DNA(蓝色)。E税收(红色)/DNA(蓝色);FCD4(绿色)/Tax(红色)/DNA(蓝色);GC4d(绿色)/Tax(红色)/DNA(蓝色);HCD68(绿色)/Tax(红色)/DNA(蓝色)。红色箭头指示多重信号重叠位置,红色方框显示放大的CD4+带有Tax信号的T细胞。景观视图比例尺= 100 μm,放大视图比例尺= 20 μm。
皮肤组织切片中各种免疫细胞与HTLV-1的相互作用如图所示。4.感兴趣区域(ROI)定义为光学显微镜下选择的表皮-真皮交界处淋巴细胞丰富的区域。在aGVHD组每个患者的标本切片中,在细胞核、细胞质和细胞外空间(分泌蛋白)检测到Tax蛋白信号,证实HTLV-1病毒蛋白存在于目标器官,包括皮肤和肝脏。此外,图。4 bCD4、EIF1AY和Tax蛋白信号叠加。在女性受者的所有皮肤切片中都可以发现三重重叠信号(图2)。4罪犯).税收+CD4+细胞也表达CD3,所以Tax+CD4+细胞被定义为CD4+T细胞(图;S4,S5).CD4、EIF1AY、Tax蛋白信号叠加显示aGVHD的效应T细胞为“三阳性T细胞”,为供体来源和htlv -1感染CD4+T细胞。无花果。4 c、G在浸润皮损的免疫细胞中显示大量C4d表达,并显示Tax和C4d蛋白共表达。C4d由抗原-抗体反应激活,是器官移植后抗体介导的体液排斥反应的重要标志物,也有报道在GVHD发生后出现45,46,47.这可能是aGVHD进展过程中病毒感染和免疫排斥相互作用的标志48.另外,图中CD68、Tax、EIF1AY的重叠信号。4 d H提示存在供体来源的apc,这与已发表的文献一致49,50,51.此外,我们的结果表明,在CD8中没有检测到Tax的表达+皮肤中的T细胞或B细胞(图。S6).12个谱系标记的单信号图像如图所示。S4,S5,S7,S8.因此,通过标记EIF1AY和Tax, IMC结果再现了HTLV-1与其他免疫细胞,特别是供体来源细胞在aGVHD发病过程中的相互作用。
为了充分展示发现队列中多种方法评估的HTLV-1检测结果,表中列出了HTLV-1的阳性率和特异性检测信息1和表S1.通过跟踪临床记录,我们整合了发现队列中所有24例患者的HHV-6A、EBV、腺病毒、巨细胞病毒和细小病毒-1的PCR检测结果,并对两组进行统计学分析(表2)1).经Fisher精确检验,并经Benjamini-Hochberg校正,对照组与aGVHD组HTLV-1检测阳性率差异有统计学意义(调整后)p值< 0.0001)。四种方法交叉验证了所有且只有7例aGVHD患者感染了HTLV-1。
CD68+aGVHD患者皮肤切片中单核吞噬细胞亚群
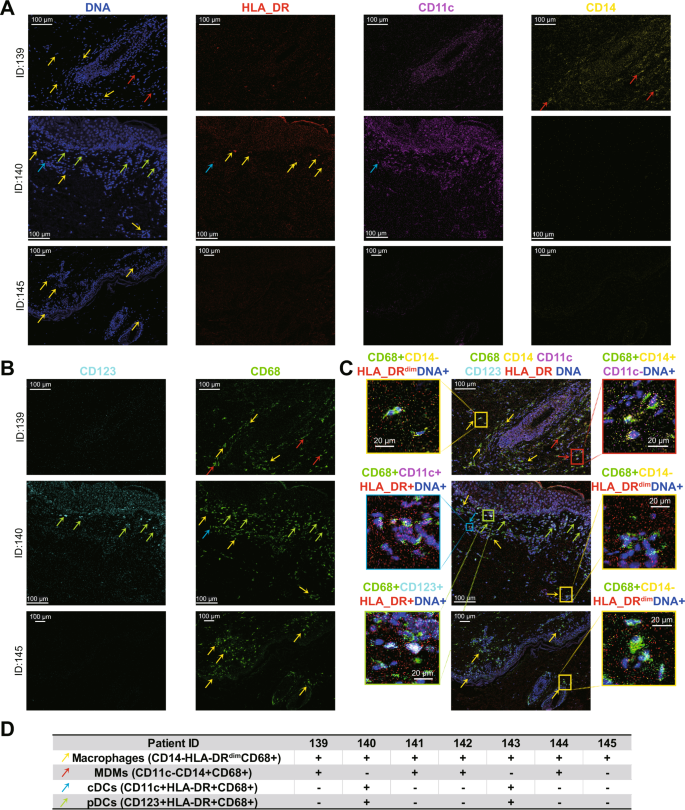
税后认定+CD68+通过IMC检测所有aGVHD患者皮肤病变部位APCs的特征,进一步揭示htlv1感染在aGVHD中的作用。皮肤中的主要apc是组织单核吞噬细胞(MNP)亚群,这是两个突出的家族,dc和组织巨噬细胞40.DC又分为常规DC (cDC)和浆细胞样DC (pDC)。cdc、pDCs、单核细胞来源的巨噬细胞(MDM)和组织驻留巨噬细胞分别表达CD11c+HLA-DR+CD68+, CD123+HLA-DR+CD68+, CD14+CD11c−CD68+,和CD14-CD11c−CD68+细胞52,53.IMC在皮损中发现的四种MNPs的表型和分布由三位具有代表性的患者(ID139, ID140和ID145,图。5 a - c).7例GVHD患者的HLA-DR、CD14、CD123、CD68、CD11c单色图像显示核信号如图所示。S7而且S8.DNA、HLA-DR、CD14、CD123、CD68、CD11c的信号及其合并面板如图所示。5 a - c.7例aGVHD患者的MNP表型总结见图。5 d.7例aGVHD患者皮肤切片中均存在巨噬细胞,4例患者(ID139、ID141、ID 142、ID144)存在MDMs, 2例患者(ID140、ID143)皮肤切片中仅存在cdc和pDCs。此外,一些MNPs表达Tax蛋白(图2)。4 d H),这表明它们吸收了HTLV-1,并向外传播病毒和信号。可见aGVHD患者中发现的MNP细胞种类繁多,主要为dc和巨噬细胞,部分为Tax细胞+CD68+与外周血中agvhd特异性细胞亚群一致。皮肤切片的IMC结果再现了抗原提呈反应,并显示了先前在外周血中检测到的、可能迁移到组织中的apc。
来自3名aGVHD患者(ID139、140和145)的两个独立染色皮肤组织的代表性IMC图像显示了7个单一信号一个DNA(蓝色),HLA-DR(红色),CD11c(紫色),CD14(黄色),BCD123(浅蓝色),CD68(绿色)。C七个标记叠加信号。在每一列的图像中显示相同的标记。红色、黄色、绿色和蓝色箭头分别指向单核细胞来源的巨噬细胞(MDM)、巨噬细胞、浆细胞样树突状细胞(pDC)和常规树突状细胞(cDC)。红色、黄色、绿色、蓝色框分别为MDMs、巨噬细胞、pDC、cDC的放大多信号重叠位置。景观视图比例尺= 100 μm,放大视图比例尺= 20 μm。D每一列为每位患者皮肤切片中的单核吞噬细胞(MNP)鉴定。每一行是一个MNP的综合表型,符号+/−表示该MNP在每个患者的皮肤切片中存在/不存在。每一行显示的通道为:巨噬细胞(CD14−CD11c−CD68+);MDM (CD14+CD11c−CD68+);疾病预防控制中心(CD11c+HLA-DR+CD68+);pDC (CD123+HLA-DR+CD68+).
肝脏切片中的HTLV-1特异性信号表明HTLV-1要么是供体来源的,要么是受体预先存在的
为了追踪HTLV-1的来源,我们进一步通过IMC检测移植肝和受者自身肝脏中Tax蛋白的表达。在接受男性捐赠者器官(ID139)的女性患者的肝活检(肝移植)中,在CD68中检测到Tax蛋白+EIF1AY+细胞,这证实了供者来源的HTLV-1感染从肝移植(图;6,4 d而且S9).在原生肝脏(ID139、ID144和ID145)中,在CD68上检测到Tax蛋白+细胞在原生肝脏部分,表明在这些患者中存在预先存在的HTLV-1感染(图。6).对于ID140和ID141患者,肝移植上Tax蛋白信号呈阳性(图14)。6),但在原生肝脏上呈阴性(图。6 b),提示手术后感染HTLV-1,可能是供体来源。在骨髓切片或其他肝组织中未发现HTLV-1感染。6 b).这些结果初步揭示了病毒感染途径,无论是供体来源或受体预先存在。
讨论
在本研究中,我们通过预先合成的TargetSeq、CyTOF和IMC,从所有agvhd诊断患者的外周血样本、新鲜组织切片、福尔马林固定和石蜡包埋(FFPE)组织切片中检测htlv1 cDNA和htlv1特异性Tax蛋白。HTLV-1感染与aGVHD发生之间的关联已通过统计分析确定。此外,CyTOF发现了agvhd特异性循环税+CD68+免疫细胞,包括单核细胞和树突状细胞。综合分析CyTOF和IMC结果,重现了lt后aGVHD期间的抗原呈递反应。皮肤中部分MNPs(主要是DCs、MDMs和巨噬细胞)共表达Tax和CD68蛋白。它解释了APCs从外周血迁移到皮肤损伤,在此过程中,它们携带HTLV-1并传递病毒和免疫信号。最重要的是,我们通过IMC发现了致病的宿主靶向T细胞,即“三阳性T细胞”。我们的结果证实了供体来源CD4的存在+这些发现将aGVHD的发生与病毒感染联系起来,为aGVHD的防治提供了新的视角。
HTLV-1是一种类似于HIV的高致病性病毒,但由于其地理分布和潜伏期长,HTLV-1没有得到足够的重视20..与HIV引起T细胞死亡相反,HTLV-1可以有效地感染T细胞,维持它们的生长,并通过Tax蛋白诱导的kappa b特异性蛋白使它们永生19,20..HTLV-1 Tax蛋白的表达诱导T细胞促进因子IL-2、IL-4、IL-6、T细胞端粒酶、Tax/rex mRNA的表达增强,T细胞凋亡因子Bim(促凋亡蛋白)的表达降低,导致T细胞过度增殖(一般为CD4)+以及IL-2R和IL-2基因的无限表达19,20..HTLV-1感染引起的T细胞无限增殖作用于人体免疫系统,成为排斥反应的增强剂54,55.因此,HTLV-1病毒感染可能会扩大T细胞,可能对宿主和供体都是如此,导致宿主对移植物和移植物对宿主排斥的潜在趋势。
HTLV-1感染的确认和预防取决于移植的围手术期准备。当含有原病毒的细胞数量超过9 × 10时,就会发生病毒感染431.由于HTLV-1的低感染率和地域限制,许多移植中心没有常规筛查HTLV-1,导致忽视了病毒感染。在我们的研究中,无论HTLV-1感染源(供体来源、既往病史或输血)如何,供体T细胞都会扩增。致命的CD4+T细胞的扩增被认为是aGVHD发生和发展的基础。因此,我们的数据表明,捐赠者、受者和血液供应源应在手术前进行严格的HTLV-1感染检测,以防止器官受者中T细胞的无序增殖。本研究初步揭示了肝移植后aGVHD患者HTLV-1病毒感染的特异性,因此更广泛的多中心研究HTLV-1与aGVHD之间的关系将是有益的。简化HTLV-1感染的诊断策略和抗逆转录病毒治疗将对lt后aGVHD的预防和治疗发挥积极作用。同时,它解释了人类各种病毒危害之一,并呼吁对病毒相关淋巴细胞疾病进行更多的研究。
方法
伦理、分组原则和人体样本采集
本研究由上海交通大学医学院仁济医院伦理审查委员会批准(临床试验注册号:KY2019074)。所有患者样本均在IRB监督下知情同意获得。
将DCD接受者分为aGVHD组和对照组。aGVHD组由7名在2015年至2020年期间被诊断为aGVHD的患者组成。对照组由17名受者组成,包括移植后排斥反应患者(N= 4)、移植后感染患者(N= 3),移植后正常恢复受者(N= 4)、术前患者(N= 6)。对于aGVHD、移植后排斥反应或移植后感染的患者,在疾病进展期间收集样本。术前采集术前对照患者标本。本研究评估的患者id、临床信息和分组列在表中S1.在2021年1月至2021年6月期间招募了400例独立队列患者,包括肝脏手术患者、受体和肝移植捐赠者(表2)S2).
对于TargetSeq检测,从aGVHD组的2例患者(ID139和ID141)和对照组的17例患者中收集新鲜样本,包括受皮疹影响的皮肤、外周血以及肝脏、肠、心室壁和肺的活检组织(表1)S1).
为了进行CyTOF和后续分析,我们从3名aGVHD患者(ID139, ID 140和ID 141)和对照组的10名患者(包括移植后排斥反应患者(N= 4)、移植后感染患者(N= 3),以及移植后正常康复患者(N= 3)。aGVHD组在发病和死亡之间的两个不同时间点收集pbmc。对照组只收集一次pbmc。
IMC的标本是来自7例aGVHD患者的天然肝脏、皮损、肝活检(移植组织)和骨髓的FFPE切片(表2)S1).自体肝脏的FFPE切片是在移植手术期间收集的,其他标本是在aGVHD进展期间收集的。
TargetSeq非嗜肝病毒的检测
新鲜样本(N= 37)来自aGVHD患者和对照组患者,包括皮肤病变、外周血以及肝脏、肠道、心室壁和肺的活检组织(表S1).RNA由Pre-NAT全自动系统(PerkinElmer, Massachusetts, USA)提取。靶向非嗜肝病毒的捕获探针(TargetSeq, iGeneTech, Beijing, China)是基于液相芯片的RNA探针(图2)。1).靶向病毒包括人类疱疹病毒6a (HHV-6A)、eb病毒(EBV)、腺病毒、细小病毒-1、巨细胞病毒(CMV)、HTLV-1、HTLV-2和HTLV-4。根据从NCBI GenBank数据库中获得的每个病毒的全基因组序列,设计探针板用于靶区测序(表2)S3).对于RNA病毒,以逆转录合成的cDNA为模板设计探针。TargetSeq能够捕获目标病毒的全长序列和相应的基因组整合区域。
RT-PCR检测HTLV-1
采用Pre-NAT全自动系统(PerkinElmer, Massachusetts, USA)采集外周血,提取RNA。HTLV-1 RNA检测采用人t细胞淋巴瘤病毒1型(HTLV-1)探针qRT-PCR试剂盒(亚吉生物,中国上海),按照试剂盒说明书在ABI 7500实时PCR系统(赛默飞世尔科技,美国加州)中进行。每个反应混合液中含有10 μL缓冲液、2 μL酶混合液、2 μL正反引物混合液、1uL探针溶液和5 μL标本。热循环参数为:50℃逆转录30 min, 94℃预变性10 min, 94℃15 s, 60℃1 min,循环40次。
抗体制备
本研究中使用的抗体及相应的生产商和浓度列于表中S4和表S5.金属偶联抗体购买或使用Maxpar ×10抗体标记试剂盒制备(Fluidigm Sciences, San Francisco, USA)。偶联后,将抗体储存在Candor PBS抗体稳定液(Candor Bioscience, Wangen, Germany)中4℃。
用于大规模细胞术检测的pmcs的制备和染色
用Ficoll-Paque PLUS (Amersham Biosciences, Piscataway, USA)进行密度梯度离心分离pbmc(图2)。1 b).淋巴细胞提取后,用顺铂(5 μM)悬浮液处理细胞,用多聚甲醛(PFA;终浓度1.6%)。细胞用30种抗表面蛋白的金属同位素偶联抗体鸡尾酒染色S4).表面蛋白染色后,用转录因子渗透试剂盒(eBioscience, Santiago, USA)处理细胞,然后在室温下用抗tax抗体染色30分钟(表2)S4).细胞核用1:4000稀释后的1ml染色191红外/193Ir DNA插入器(Fluidigm Sciences,旧金山,美国)与Maxpar Perm-S Buffer (Fluidigm Sciences,旧金山,美国)在4°C过夜。
用于IMC检测的aGVHD组织切片的制备
组织切片取自仁济医院的宿主肝脏、皮肤、骨髓活检和移植肝活检的FFPE组织块(图2)。1 c).组织载玻片在二甲苯(Adamas-beta,上海,中国)中脱蜡,并在分级乙醇(Adamas-beta,上海,中国)系列中再水化。然后,将它们在95°C的预热回收溶液(R&D Systems, Boston, USA)中孵育30分钟,冷却至室温。然后用3% BSA (Macklin, Shanghai, China)在DPBS (Gibco, San Francisco, USA)中在室温下阻塞组织切片45分钟。抗原提取后,用含有19个金属同位素标记抗体的抗体鸡尾酒培养组织载玻片(表2)S5)针对免疫细胞标记物和Tax,在4°C的湿润室中过夜。对于核染色,每个切片在室温下用100µL 1:60稀释染色30分钟191红外/193Ir DNA插入器(Fluidigm Sciences, San Francisco, USA)与DPBS。
海量细胞仪检测及后续分析
在Helios (Fluidigm, San Francisco, USA)上采集数据后,用4个标准EQ珠进行归一化(图2)。1 b).在CytoBank在线平台(www.cytobank.org).用一系列门选择单细胞和CD45+如图所示。S1.设置降维参数,利用R包Cytofkit应用表型图进行降维35.为了减小测量中的噪声,我们选择了尺度因子为5的ArcSinh变换作为变换方法。
IMC检测及后续分析
使用Hyperion激光扫描模块(Fluidigm, San Francisco, USA)与Helios细胞仪耦合获得图像(图2)。1 c).Fluidigm的CyTOF v6.7软件生成a.m mcd文件和a.txt文件。使用MCD Viewer v1.0软件进行图像处理和可视化。
ELISA的文章
在诊断aGVHD后采集患者(ID:144和145)血清样本。血液样本离心5分钟,分离血清。血清保存于-80℃。所有样品均采用HTLV-I ELISA试剂盒(KNUDI,中国泉州)进行检测。所有操作均按照试剂盒说明书进行,并使用微量滴度板阅读器(BioTek, Winooski, USA)在450nm处测量光密度。
统计分析
采用Fisher精确检验检验组间HTLV-1阳性率的差异,采用Benjamini-Hochberg调整控制假发现率。的调整p值<0.05为有统计学意义。在无花果。S3,采用Mann-Whitney检验计算组间HTLV-1阳性率的差异。
报告总结
有关研究设计的进一步资料,请参阅自然组合报告摘要链接到这篇文章。
数据可用性
本研究的TargetSeq和CyTOF探测数据集可在Zenodo (https://doi.org/10.5281/zenodo.7333323而且https://doi.org/10.5281/zenodo.7333412).原始图像文件可在Zenodo (https://doi.org/10.5281/zenodo.7333438).源数据提供了这篇论文。
参考文献
Paczesny, S., Hanauer, D., Sun, Y. & Reddy, P.急性GVHD生物学的新观点。骨髓移植。45, 1-11(2010)。
维索基,C. A., Panoskaltsis-Mortari, A., Blazar, B. R. & Serody, J. S.白细胞迁移与移植物抗宿主病。血105, 4191-4199(2005)。
金,G. Y.等。实体器官移植相关移植物抗宿主病的皮肤病学表现:一项系统综述。j。专科学校北京医学。78, 1097(2018)。
舒尔曼,h.m.等人。慢性移植物抗宿主综合征。一项对20名西雅图患者的长期临床病理研究。点。j .地中海。69, 204-217(1980)。
Axt, L.等。异基因造血细胞移植后激素难治性移植物抗宿主病的结局、危险因素和治疗的回顾性单中心分析。骨髓移植。54, 1805-1814(2019)。
张丽娟,余娟,魏伟。移植物抗宿主病靶向免疫治疗的研究进展。前面。Immunol。9, 1087(2018)。
陈晓斌,杨娟,徐明强,温铁峰,闫丽宁。肝移植后急性移植物抗宿主病治疗失败4例。世界J.胃肠醇。18, 84-89(2012)。
Perri, R.等人。肝移植后移植物抗宿主病:需要一种新的方法。肝脏Transpl。13, 1092-1099(2007)。
多尔金,n.h.等人。受体功能状态对1年肝移植结果的影响。移植世界。9, 145-157(2019)。
蔡泽,R. & Blazar, B. R.急性移植物抗宿主病-生物学过程,预防和治疗。心血管病。j .地中海。377, 2167-2179(2017)。
登哈恩,J. M.等人。移植物抗宿主病相关的人小组织相容性抗原的鉴定。科学268, 1476-1480(1995)。
Schlitt, H. J., Raddatz, G., Steinhoff, G., Wonigeit, K. & Pichlmayr .人肝脏移植物中的Passenger淋巴细胞及其移植后的潜在作用。移植56, 951-955(1993)。
Hahn, A. B. & Baliga, P.肝移植后疑似移植物抗宿主病外周嵌合的快速分析方法。肝脏Transpl。6, 180-184(2000)。
输血相关移植物抗宿主病:简要回顾。内科杂志。代表。10, 98-102(2018)。
输血相关移植物抗宿主病。Br。j . Haematol。117, 275-287(2002)。
主要组织相容性复合体:理解移植物抗宿主病的模型。血122, 1863-1872(2013)。
Matte-Martone, C., Liu, J., Jain, D., McNiff, J. & Shlomchik, W. D. CD8+而不是CD4+ T细胞需要与靶组织同源相互作用才能介导GVHD,而CD4+和CD8+ T细胞都需要与白血病直接接触才能介导GVL。血111, 3884-3892(2008)。
Kawase, T.等。高危HLA等位基因错配组合导致严重急性移植物抗宿主病及其分子机制血110, 2235-2241(2007)。
Greene, W. C., Bohnlein, E. & Ballard, D. W. HIV-1, htlv1和正常t细胞生长:转录策略和惊喜。Immunol。今天10, 272-278(1989)。
科芬,j.m. HTLV-1的发现,第一个致病的人类逆转录病毒。国家科学院学报美国112, 15525-15529(2015)。
Galli, V.等人。人T细胞白血病病毒1型orf-I在人源化小鼠CD4(+)细胞致命增殖中的重要作用J.Virol。93, e00565-19(2019)。
古田,R.等人。人t细胞白血病病毒1型感染体内多系造血细胞。公共科学图书馆Pathog。13, e1006722(2017)。
马光勇,Yasunaga, J. & Matsuoka, M. HBZ在HTLV-1发病中的多重功能和作用。Retrovirology13, 100-110(2016)。
莫罗索,V.等人。供体和受体HLA/KIR基因型不能预测肝移植结果。Transpl。Int。24, 932-942(2011)。
Yagci, G.等人。供体变量对丙型肝炎原位肝移植结果的影响。移植。Proc。40, 219-223(2008)。
移植物抗宿主病发病机制的研究进展。Br。j . Haematol。187, 563-572(2019)。
费舍尔,J. C.等。RIG-I/MAVS和STING信号通路在辐照和免疫介导的组织损伤中促进肠道完整性。科学。Transl。地中海。9, eaag2513(2017)。
Zeiser, R., Penack, O., Holler, E. & Idzko, M.移植物抗宿主病中激活先天免疫的危险信号。J. Mol. Med。89, 833-845(2011)。
弗雷泽等人。HIV-1感染的毒力和发病机制:一个进化的观点。科学343, 1243727(2014)。
人T细胞白血病病毒1型:持久性和发病机制。为基础。启Immunol。36, 43-71(2018)。
Sobata, R.等人。估计输血传播的人t淋巴病毒1型感染(TT-HTLV-1)所需的感染病毒载量和白细胞减少对预防TT-HTLV-1的有效性。Vox唱歌。109, 122-128(2015)。
张玉斌等。首次献血者1型和2型人t淋巴病毒感染的血清流行率和人口统计学决定因素——美国,2000-2009年j .感染。说。209, 523-531 (2014)
博克斯,M.等。HTLV-1税务交互组。Retrovirology5, 76(2008)。
Brauweiler, A., Garrus, J. E. Reed, J. C. & Nyborg, J. K. HTLV-I税收蛋白对Bax基因表达的抑制:对病毒感染细胞凋亡抑制的影响。病毒学231, 135-140(1997)。
陈,H.等。Cytofkit:用于集成海量细胞仪数据分析管道的生物导体包。公共科学图书馆第一版。医学杂志。12, e1005112(2016)。
Iberg, C. A., Jones, A. & Hawiger, D.树突状细胞作为外周耐受的诱导物。Immunol趋势。38, 793-804(2017)。
伊克巴尔,A. J.等人。人CD68启动子GFP转基因小鼠体内单核细胞向巨噬细胞分化的分析。血124, e33-44(2014)。
Malavasi, F.等。ADP核糖环化酶/CD38基因家族在生理病理中的进化与功能杂志。牧师。88, 841-886(2008)。
齐格勒,S. F.,拉姆斯德尔,F. &奥尔德森,m.r.活化抗原CD69。干细胞12, 456-465(1994)。
卡瑟姆,S. W.,哈尼法,M. &卡普兰,D. H.皮肤中的抗原提呈细胞。为基础。启Immunol。35, 469-499(2017)。
Iliev, D. B, Thim, H., Lagos, L., Olsen, R. & Jorgensen, J. B.抗原呈递细胞在头肾和脾脏的归巢-鲑鱼头肾宿主不同的APC类型。前面。Immunol。4, 56-60(2013)。
巨噬细胞的抗原呈递功能。免疫。2, 395-428(1984)。
安东尼,我,等人。MHC-II抗原提呈机制和B7检查点配体显示与急性髓系白血病母细胞HLA-DR表达相关的独特模式。免疫生物学226, 152049(2021)。
王,W.等。染色体y编码抗原与性别不匹配干细胞移植中急性移植物抗宿主病相关血供订购。2, 2419-2429(2018)。
Ali, s.a., Shah, V, McKinnon, R, Van Harn, M. & Janakiraman, N. C4d在肝移植物抗宿主病中的频繁表达:诊断和区分急性和慢性形式的潜在线索。Transpl。Immunol。23, 77-80(2010)。
Ma, Q.等人。补体成分C3在人t细胞活化和皮肤GVHD中介导Th1/Th17极化。骨髓移植。49, 972-976(2014)。
Zhang, P. L, Wilkerson, M. L. & Schworer, C. M. C4d染色是BMT后结肠活检中识别慢性GVHD的有价值的标记物。骨髓移植。42, 209-211(2008)。
Saarloos, M. N, Koenig, R. E. & Spear, G. T.感染人T细胞白血病病毒(HTLV)伴HTLV- i相关脊髓病/热带痉挛性麻痹症患者血浆补体片段iC3b和C4d水平升高,但Bb不升高。j .感染。说。172, 1095-1097(1995)。
Kazama, T., Miyazawa, M., Tsuchiya, S. & Horii, A.移植后移植物抗宿主病尸检病例中骨髓巨噬细胞谱系细胞增殖、严重胸腺萎缩和可能来自供体的髓外造血。骨髓移植。18, 437-441(1996)。
van Balen, P.等人。同种异体干细胞移植前由清髓性(非清髓性)调节引起的组织损伤导致真皮巨噬细胞招募而没有活跃的t细胞相互作用。前面。Immunol。9, 331(2018)。
德口等人。t淋巴细胞介导的皮肤病中抗原呈递细胞的分布和数量的比较:湿疹性皮炎、牛皮癣、扁平苔藓和移植物抗宿主病中的CD1a+、因子XIIIa+和CD68+细胞。拱门。北京医学。Res。294, 297-302(2002)。
罗德斯,J. W.等。人肛门生殖单核细胞来源的树突状细胞和朗格林+cDC2是主要的HIV靶细胞。Commun Nat。12, 2147(2021)。
Mair, F. & Liechti, T.人树突状细胞和单核细胞的综合表型。Cytom。部分99, 231-242(2021)。
马力诺,李志强,李志强,等。T淋巴细胞的异体识别和异体移植排斥反应。前面。Immunol。7, 94-100(2016)。
伦,A.等。外周血t细胞活化及可溶性IL-2受体对肝移植急性排斥反应的诊断价值中国。詹。学报320, 69-78(2002)。
确认
我们感谢何志明教授(美国加州大学洛杉矶分校)的指导,感谢魏齐医生和郑杰医生(上海第十人民医院病理科)对我们进行免疫组化的帮助,感谢纪勇教授(复旦大学附属中山医院)对我们进行病理诊断。感谢苏文琼博士和王爱婷女士(上海交通大学)的技术支持。本研究得到国家自然科学基金(81871448)的资助。基金受益人:X.D.
作者信息
作者及隶属关系
贡献
概念化,C.S.和Y.L.;方法学,c.s.y l.b w和q.x;调查,Y.L.和C.S.;形式分析;写作-原稿,C.S.和Y.L.;写作——回顾&编辑合著,X.D, J.Z, Y.Q, Y.D, Z.Z.和新墨西哥州;可视化,Y.L.;资源,c.s., t.l.和z.z;资金收购,X.D, J.Z,和q.x。监督,X.D和q.x
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然通讯感谢Andrew Harman, Defu Zeng和其他匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
源数据
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
沈超,李勇,王B。et al。HTLV-1感染供体来源的T细胞可能促进肝移植后急性移植物抗宿主病。Nat Commun13, 7368(2022)。https://doi.org/10.1038/s41467-022-35111-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-022-35111-w