摘要gydF4y2Ba
我们在原生5-HT1A受体和环状排列GFP的基础上开发了一个基因编码血清素(5-HT)传感器家族(sDarken)。sDarken 5-HT传感器在未结合状态下是亮的,并在5-HT结合时减弱其荧光。对血清素具有不同亲和力的传感器变体被设计用于增加血清素动态成像的通用性。体外和体内实验表明,高时间和空间分辨率成像血清素动态的可行性。如图所示,所设计的传感器表现出优异的膜表达,具有高特异性和优越的信噪比,检测内源性血清素释放,适用于双光子体内成像。gydF4y2Ba
简介gydF4y2Ba
越来越多的证据表明,血清素(5-HT),一种激素和神经递质,不仅参与各种不同的生理和中枢神经系统功能,而且还参与精神疾病的发展和表现,如焦虑和抑郁。虽然抑郁症的单胺假说早在20世纪50年代就已经被提出,但5-羟色胺对这些精神疾病发展的贡献仍然需要更详细地阐明。缺乏相关知识的一个原因是没有工具能够以高时间和空间分辨率测量5-HT的释放。直到最近,血清素浓度主要是通过微透析和随后的HPLC定量来测量的,这是一种具有低时间和空间分辨率的侵入性技术gydF4y2Ba1克ydF4y2Ba.为了克服这些缺点,快速扫描循环伏安法(FSCV)和安培法被用作高时间分辨率测量血清素浓度的替代方法gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.FSCV测量碳纤维电极表面的氧化还原电流,以得出关于电极尖端氧化或还原分析物的结论。然而,由于几种电化学活性物质可以在重叠电位下氧化或还原,血清素的FSCV缺乏特异性gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
此外,使用这些技术既不可能在更大范围内监测血清素动态,也不可能实现单细胞甚至突触分辨率gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba.作为一种神经调节剂,血清素不仅通过点对点的突触传递起作用,而且还通过体积传递起作用。5 -羟色胺能细胞发射、5 -羟色胺释放、突触与体积传输、再摄取和基础5 -羟色胺水平之间的直接关系还没有被很好地理解,在5 -羟色胺释放能够在清醒的、有行为的动物体内实时成像之前,这些问题仍将没有答案gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
在过去的几年中,基因编码传感器已经被开发出来,并成为成像神经元活动的通用工具,特别是用于成像不同神经递质的释放,如谷氨酸、多巴胺、去甲肾上腺素、乙酰胆碱和最近的血清素gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.大多数基因编码传感器使用特定的g蛋白偶联受体(GPCR)作为融合到环状排列荧光蛋白的传感部分。另一种传感器设计基于质周结合蛋白(PBP),这种蛋白已被开发用于测量谷氨酸、乙酰胆碱和γ-氨基丁酸(GABA)等神经递质。gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.最近,通过乙酰胆碱传感器的定向进化,获得了基于pbp的5-HT传感器(iSeroSnFR)gydF4y2Ba13gydF4y2Ba.在这项工作中,我们扩展了现有的工具箱,以克服可用传感器的限制。gydF4y2Ba
结果gydF4y2Ba
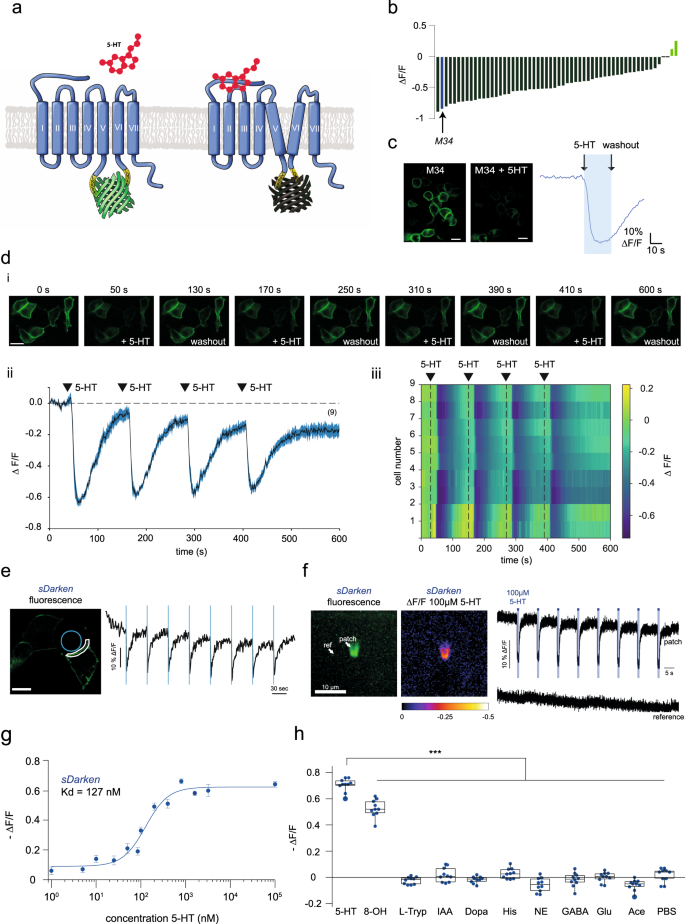
我们设计了基因编码血清素传感器的不同变体,以高时间和空间分辨率对血清素动态进行成像。我们决定使用本地人类的5-HTgydF4y2Ba1gydF4y2Ba与其他5-HT受体亚型相比,该受体(UniProt: P08908)由于其对5-HT的高亲和力而被用作传感支架gydF4y2Ba14gydF4y2Ba.我们最初的传感器设计是基于最近描述的基因编码多巴胺传感器dLight1gydF4y2Ba8gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba).DRD1, 5-HT跨膜结构域的序列比对gydF4y2Ba2gydF4y2Ba和5 -gydF4y2Ba1gydF4y2Ba以确定cpGFP的最佳插入位置(补充图。gydF4y2BaS1gydF4y2Ba).在所有变体中,原生5-HT的第三个细胞内环gydF4y2Ba1gydF4y2Ba受体被环状排列形式的GFP (cpGFP)所取代,也用于GCaMP6mgydF4y2Ba15gydF4y2Ba,这意味着也包括了在GCaMP6m工程过程中引入的突变(AS 65, 75, 87, 92, 115, 118, 250)。cpGFP被LSSLE (linker1)和LPDQL (linker2)插入到原代5-HT的F224和R337之间gydF4y2Ba1gydF4y2Ba受体(补充图。gydF4y2BaS1gydF4y2Ba).从这个初始变体开始,我们对连接子残基进行了诱变,以改变5-HT传感器的特性。在第一个优化步骤中,我们随机突变连接子1的第4和第5位的氨基酸,以及连接子2的第1和第2位的氨基酸。gydF4y2BaS1gydF4y2Ba).总的来说,我们测量并分析了224个突变体的文库(详见补充图)。gydF4y2BaS2gydF4y2Ba)在人胚胎肾(HEK)细胞中。有趣的是,除了两种突变体(M24, M27),大多数突变体在血清素结合时荧光减弱。gydF4y2Ba1 bgydF4y2Ba).因此,我们决定继续优化变暗传感器(即5-HT结合时荧光减弱)。gydF4y2Ba
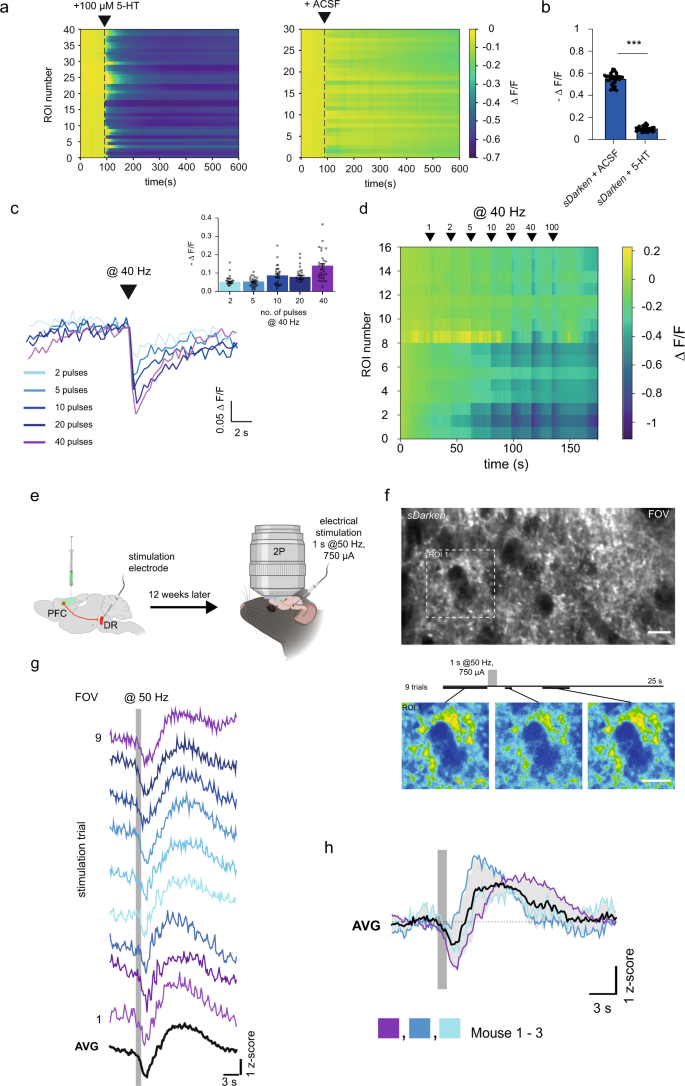
a设计原则gydF4y2BasDarkengydF4y2Ba.gydF4y2BabgydF4y2Ba连接子变异筛选结果。条形图显示了应用5 -羟色胺后的荧光变化。蓝条代表突变体M34。gydF4y2BacgydF4y2Ba突变体M34的表达(gydF4y2BasDarkengydF4y2Ba)在HEK细胞中。比例尺20µm。应用800 nM 5-HT前后的荧光。在800 nM 5-HT作用下,表达HEK细胞的传感器变体M34具有代表性的荧光痕迹。实验至少重复了三次。gydF4y2BadgydF4y2Ba(i) wash - in反复应用5-HT的代表性图像序列。(ii)示例荧光测量,在两个培养皿中的9个示例细胞中重复应用5 μ M 5- ht。5-HT的应用可导致荧光的可逆还原。未进行基线校正。(iii)所有分析roi的热图。第一帧中的比例尺适用于之后的所有帧。比例尺20µm。gydF4y2BaegydF4y2Ba例如5-HT笼化痕迹(405 nm,激光功率:90%,漂白时间:90 ms,间隔:50 s)gydF4y2BasDarkengydF4y2Ba响应。蓝圈表示未解冻区)。白线表示用于分析的膜部分。sDarken的荧光信号。ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba部分膜(白线)随时间变化的值(示范试验)。蓝色条表示未脱色(即漂白)间隔。5-HT的反复释放导致sDarken的ΔF/F值降低。gydF4y2BafgydF4y2Ba快速5-HT应用于一个由外而外的补丁。代表图像来自转染48小时后含有sdarkken的外外补丁(左)。荧光强度在斑块中发生变化。5-HT洗脱后荧光恢复明显慢于活化。没有进行背景/基线校正。gydF4y2BaggydF4y2Ba测量不同5-HT浓度的剂量反应曲线。组数据gydF4y2BangydF4y2Ba至少2个重复= 20个,显示平均值和±SEM。gydF4y2BahgydF4y2Ba应用5 -羟色胺、相关物质或神经递质后的荧光变化(如未另行提及,浓度10µM (gydF4y2BangydF4y2Ba= 10)。方框表示25%到75%的百分比。方框中间的那条线代表中间值。单因素方差分析多重比较,***gydF4y2BapgydF4y2Ba< 0.001, 5-HT血清素,8-OH 8-OHDPAT, L-Tryp色氨酸,IAA 5-羟基吲哚乙酸,多巴胺,His组氨酸,NE去甲肾上腺素,GABA谷氨酸,Ace乙酰胆碱,PBS磷酸盐缓冲液。gydF4y2Ba
突变体M34是最有希望的候选者,具有优异的膜运输性能以及荧光的显著下降(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.71±0.01,均值±SEM,gydF4y2BangydF4y2Ba= 15)。gydF4y2Ba1 b, cgydF4y2Ba,辅助电影gydF4y2Ba1克ydF4y2Ba).基于我们的血清素传感器M34的特殊特性,即血清素结合后荧光减弱,我们将其命名为sDarken(血清素变暗5-HT)gydF4y2Ba1gydF4y2Bareceptor-based传感器)。gydF4y2Ba
sDarken的体外表征gydF4y2Ba
由于体内应用需要稳健的响应和光稳定性,我们研究了传感器对5-HT重复刺激的响应(图2)。gydF4y2Ba1 d-fgydF4y2Ba).可重复激活sDarken(图;gydF4y2Ba1 d-fgydF4y2Ba,辅助电影gydF4y2Ba2gydF4y2Ba).我们通过5-HT笼子实验验证了我们的发现。重复的光诱发5-HT释放导致荧光降低(图。gydF4y2Ba1 egydF4y2Ba).此外,超快5-HT应用于表达sDarken的HEK细胞的外部斑块,在重复应用后显示出稳定的响应幅度(图2)。gydF4y2Ba1 fgydF4y2Ba).gydF4y2Ba
不出所料,sDarken对血清素有很高的亲和力gydF4y2BaKgydF4y2BadgydF4y2Ba127±20.7 nM(平均值±SEM,gydF4y2BangydF4y2Ba= 10)(图gydF4y2Ba1克gydF4y2Ba)和sDarken因此能够可靠地检测100 nM和1µM之间的血清素浓度。sDarken对结构相似物质或其他神经递质的生理浓度没有显示出任何显著的反应。gydF4y2Ba1 hgydF4y2Ba).5-羟色胺的应用比选择性5-羟色胺的应用更有效gydF4y2Ba1gydF4y2Ba与5-羟色胺相比,激动剂8-OHDPAT诱导的sDarken荧光下降显著降低(5-HT = 0.7−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.02,8-ohdpat = 0.53−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.02,gydF4y2BapgydF4y2Ba< 0.001)。然而,无论是应用血清素前体l -色氨酸还是其降解产物5-羟吲哚乙酸(5-HIAA)都没有引起任何实质性的传感器响应(L-Tryp−0.02−Δ)gydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.01,5-hiaa 0.02−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.02)。接下来,我们测试了其他单胺,如多巴胺、组胺和去甲肾上腺素(NE)是否会导致sDarken的荧光下降。多巴胺、组胺和NE的应用均未引起任何荧光变化(多巴胺0.03−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.01,组胺−0.06−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.05,Δe−0.02−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.02)。此外,抑制性神经递质GABA没有引起明显的荧光变化(GABA−0.02−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.01)。同样,最丰富的兴奋性神经递质谷氨酸没有引起任何反应(谷氨酸0.00−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.01)。对于乙酰胆碱也是如此,因为它没有诱导sDarken的荧光减少(乙酰胆碱−0.07−Δ)gydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.01)。对其他神经递质和类似物质的反应与仅应用PBS无显著差异(0.02−ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba±0.02)(图gydF4y2Ba1 hgydF4y2Ba).gydF4y2Ba
与此相反,选择性5-HT1A拮抗剂WAY-100635 (WAY)的应用阻断了对5-HT的反应。正如预期的那样,WAY的应用也逆转了最初应用5-HT引起的荧光减弱,并表现得像一种逆激动剂(补充图。gydF4y2BaS3gydF4y2Ba).为了评估sDarken是否对pH变化敏感,在不同的pH缓冲液中评估了sDarken的荧光,有5 -羟色胺存在(补充图。gydF4y2BaS4gydF4y2Ba).此外,我们还分析了sdarkken在不同pH值(pH 6 ~ 8)缓冲溶液中的荧光变化。在pH 6 ~ 8范围内,sdarkken对pH变化的响应差异很小。在pH 6.8 ~ 7.4范围内,sdarkken的荧光无显著性差异。此外,不同pH值下的剂量响应曲线显示,pH变化对亲和度和动态范围影响不大(补充图。gydF4y2BaS4gydF4y2Ba).gydF4y2Ba
总之,在体外实验中,sdarkken对亚微摩尔5-HT浓度表现出了强劲而巨大的信号变化,对其他神经递质和类似物质没有可检测到的反应。gydF4y2Ba
细胞内信号通路gydF4y2Ba
由于5-HT的第三个细胞内环被取代gydF4y2Ba1gydF4y2Ba受体被cpGFP干扰时,G蛋白的天然偶联和激活将被中断gydF4y2Ba8gydF4y2Ba.的确,我们发现了这一点gydF4y2BaβγgydF4y2BaG蛋白偶联的内整流钾通道(GIRK)的介导开放被取消(补充图。gydF4y2BaS5gydF4y2Ba).此外,其他G蛋白偶联途径(即GgydF4y2Ba问gydF4y2Ba-信令和GgydF4y2Ba年代gydF4y2Ba-信号通路)显示血清素结合时没有激活(补充图。gydF4y2BaS6gydF4y2Ba而且gydF4y2BaS7gydF4y2Ba).综上所述,第三个细胞内环与cpGFP的交换破坏了G蛋白的结合,因此sDarken不会触发内源性信号通路的激活。gydF4y2Ba
动态范围和亲和度gydF4y2Ba
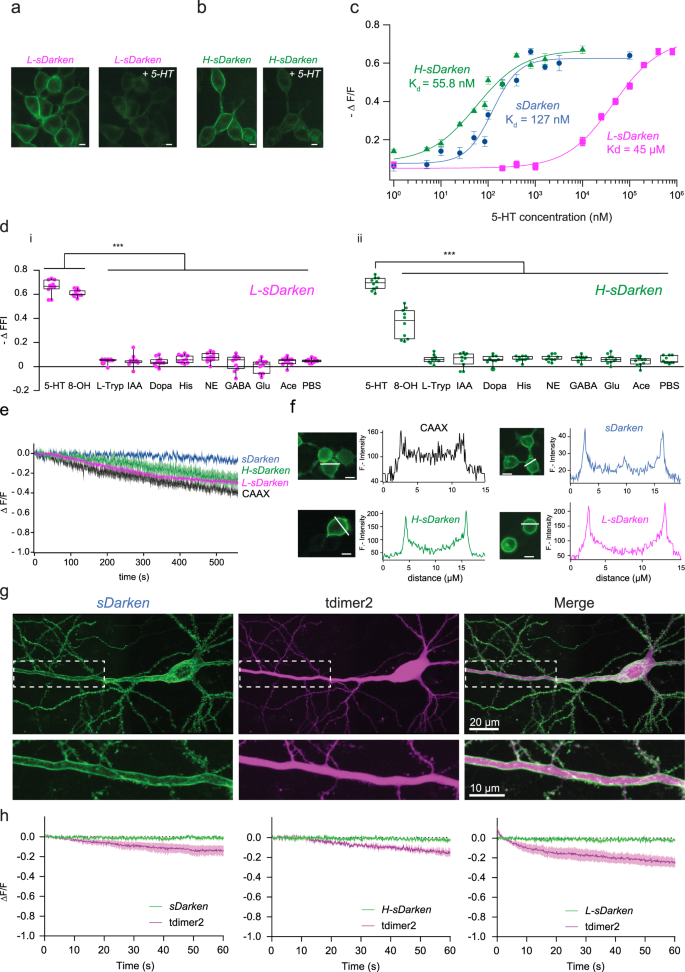
根据研究问题的不同,体内应用将需要对5-HT具有不同亲和力的不同5-HT传感器:对于检测体积传输,使用对5-HT具有非常高亲和力的传感器将是有益的,而对于检测5-HT在血清素能突触释放的高频爆发,使用具有较低亲和力的传感器将是有利的。因此,我们研究了sDarken结合袋内的突变是否可用于修改其对5-HT的亲和力。我们对5 -羟色胺结合袋内保守的天冬氨酸和丝氨酸残基进行了位点定向取代,以获得低亲和版本的sDarkengydF4y2Ba16gydF4y2Ba.介绍并研究了D82N、D116N、S198A的所有可能组合。所有突变对血清素的亲和力都较低,D116N似乎特别有希望。正如已经看到的最初的sdarken传感器设计,D116N的表达仅限于膜(图2)。gydF4y2Ba2gydF4y2Ba),而滴定曲线显示血清素的亲和力降低了1000倍(gydF4y2BaKgydF4y2BadgydF4y2Ba45±4.6µM)gydF4y2BaKgydF4y2BadgydF4y2Ba127±20.7 nM)gydF4y2Ba2摄氏度gydF4y2Ba及辅助影片gydF4y2Ba3.gydF4y2Ba- - - - - -gydF4y2Ba5克ydF4y2Ba).D116N变体的检测范围在100µM到1 mM之间(Supplementary MoviesgydF4y2Ba3.gydF4y2Ba- - - - - -gydF4y2Ba5克ydF4y2Ba),因此变体被命名为低亲和力斯达克(l -斯达克)。gydF4y2Ba
一个gydF4y2Ba的表达gydF4y2BaL-sDarkengydF4y2BaHEK细胞。应用160 μ M 5-HT前后的荧光。比例尺10µm。gydF4y2BabgydF4y2Ba的表达gydF4y2BaH-sDarkengydF4y2BaHEK细胞。应用800 nM 5-HT前后的荧光变化。比例尺10µm。gydF4y2BacgydF4y2Ba剂量反应曲线gydF4y2BasDarkengydF4y2Ba,gydF4y2BaL-sDarkengydF4y2Ba而且gydF4y2BaH-sDarkengydF4y2Ba测量对不同5-HT浓度的反应。组数据gydF4y2BangydF4y2Ba= 20,共3个重复。误差柱表示±SEM。gydF4y2BadgydF4y2Ba的荧光变化gydF4y2BaL-sDarkengydF4y2Ba应用血清素(160µM),类似物质或神经递质,如果没有不同的说明,应用10µM (gydF4y2BangydF4y2Ba= 10)。8-ohdpat 300µm。的荧光变化gydF4y2BaH-sDarkengydF4y2Ba5 -羟色胺、类似物质或神经递质(如未不同提及)的应用10µM (gydF4y2BangydF4y2Ba= 10)。方框表示25%到75%的百分比。方框中间的那条线代表中间值。单因素方差分析多重比较,***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BaegydF4y2Ba光稳定性的测量。连续照射蓝光(1.8 mW/mm)时的归一化荧光gydF4y2Ba2gydF4y2Ba)在表达传感器变体或eGFP-CAAX的HEK细胞中培养10分钟。gydF4y2BafgydF4y2Ba荧光强度分布沿白线测量在一个例子细胞。比例尺10µm。gydF4y2BaggydF4y2Ba双光子图像(a的最大强度投影gydF4y2BazgydF4y2Ba表达sDarken(绿色)和红色细胞质荧光团tdimer2(洋红色)的CA1神经元。插入图显示沿根尖树突的Darken膜局部表达的放大视图。gydF4y2BahgydF4y2Ba时间历程gydF4y2BasDarkengydF4y2Ba,gydF4y2BaH-sDarkengydF4y2Ba,gydF4y2BaL-sDarkengydF4y2Batdimer2荧光信号在连续2光子激发1 min时成像。gydF4y2Ba
为了提高对血清素的敏感性,我们决定用cpGFP的超级文件夹版本交换cpGFPgydF4y2Ba17gydF4y2Ba.超级折叠器cpGFP的优点是即使与蛋白质融合也能正确折叠。在不同的生物传感器中,即GCaMP, ZngydF4y2Ba2 +gydF4y2Ba和电压传感器)的cpGFP与superfolder变体的交换提高了灵敏度,动态范围,亮度和光稳定性gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.因此,我们假设使用cpGFP的超级文件夹变体会增加初始荧光,并可能降低gydF4y2BaKgydF4y2BadgydF4y2Ba值gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.cpGFP与超级折叠器cpGFP的替代提高了灵敏度,并产生了一个明亮和光稳定的传感器,在膜中表达良好。与sdarkken和l - sdarkken类似,superfolder sdarkken在5-HT作用下会降低其荧光强度(图2)。gydF4y2Ba2 bgydF4y2Ba及辅助影片gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).事实上,与原始的sdarkken相比,cpGFP与超级文件夹cpGFP的亲和度增加了两倍,达到57 nM(57.3±13.9 nM)。gydF4y2Ba2摄氏度gydF4y2Ba),而信号振幅保持不变(图;gydF4y2Ba2摄氏度gydF4y2Ba).从现在起,我们将这种高亲和力变体命名为H-sDarken。与最初的sDarken相似,对其他神经递质或物质没有明显的反应gydF4y2BaL -gydF4y2Ba对于H-sDarken(图。gydF4y2Ba二维gydF4y2Ba和补充图。gydF4y2BaS8gydF4y2Ba).此外,没有观察到L-sDarken和H-sDarken内源性细胞内信号通路的激活(补充图)。gydF4y2BaS5gydF4y2Ba- - - - - -gydF4y2BaS9gydF4y2Ba).gydF4y2Ba
光稳定性和膜表达gydF4y2Ba
由于sDarken是一种基因编码的传感器,它在与血清素结合时降低其荧光,因此记录过程中的光稳定性是长期成像的先决条件。与膜靶向表达的eGFP (CAAX-motif)相比,所有三种传感器变体都表现出相似甚至更高的光稳定性(图3)。gydF4y2Ba2 egydF4y2Ba).一般来说,sDarken在未结合状态下具有较高的基线荧光,使其易于在背景和自身荧光下检测到(补充图。gydF4y2BaS10agydF4y2Ba).接下来,我们分析了sdarkken的膜转运和表达。eGFP的膜靶向表达与5-HT传感器变体之间没有明显差异(补充图。gydF4y2BaS10bgydF4y2Ba).所有这三种变体在膜上表达同样良好,没有显示出任何值得注意的细胞内聚集(图。gydF4y2Ba2 fgydF4y2Ba).此外,我们想知道长期暴露于血清素是否会诱导我们的传感器永久内化,但事实证明并非如此(补充图。gydF4y2BaS11gydF4y2Ba).gydF4y2Ba
接下来,我们用双光子显微镜验证了sDarken及其变体H-sDarken和L-sDarken在哺乳动物海马神经元中的表达和性能。我们通过单细胞电穿孔在有机型海马切片培养的CA1锥体神经元中分别表达三种sdarkken变体和细胞质红色荧光蛋白tdimer2。转染后几天,所有三种传感器变体都显示出强烈的,沿生长树突室的膜局部表达(图2)。gydF4y2Ba2 g hgydF4y2Ba).这一表达谱表明,三种sDarken变体可以作为轴突突触点对点血清素释放事件的报告者,也可以作为突触后树突和棘的点对点血清素释放事件的报告者。鉴于sDarken是一个负响应传感器,因此在非配体束缚状态下是明亮的,我们评估了它在连续双光子激发下1分钟的光稳定性。在整个成像过程中,所有三种sDarken变体都显示出稳定的荧光信号(sDarken为基线的99.99%,L-sDarken为99.98%,H-sDarken为99.98%),而tdimer2在这些条件下显示出轻微的漂白(图2)。gydF4y2Ba2 hgydF4y2Ba及辅助影片gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
传感器的动力学gydF4y2Ba
接下来,我们描述了5-HT传感器变体的时间特征。为了实现配体的快速应用和去除,我们使用了膜贴片荧光测定法结合快速,压电驱动的溶液交换gydF4y2Ba19gydF4y2Ba.用贴片移液管切除来自表达sdarken的HEK细胞的外膜贴片,并放置在压电安装的双管theta-glass移液管前,该移液管允许在含有5-HT的溶液和不含5-HT的溶液之间进行亚毫秒切换(补充图)。gydF4y2BaS12gydF4y2Ba和补充方法)。传感器显示在斑块的圆顶区域有一个明亮而稳定的荧光信号(图。gydF4y2Ba1 fgydF4y2Ba及辅助电影gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
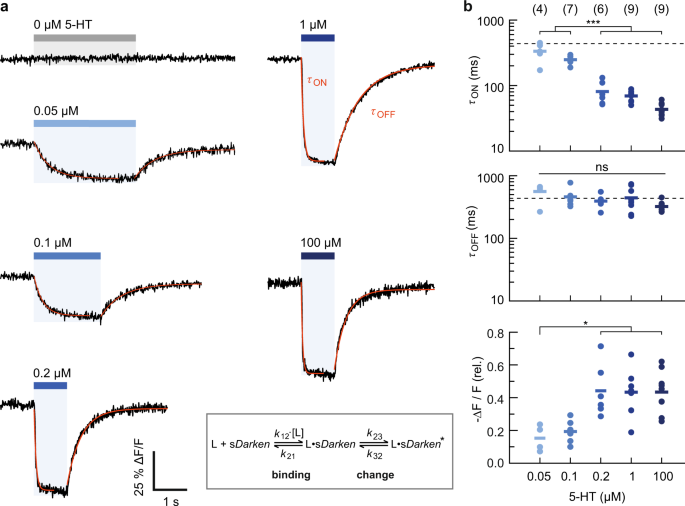
5-HT的反复应用导致了sDarken的特征信号响应(图。gydF4y2Ba1 e, fgydF4y2Ba).高浓度(100 μM 5-HT)导致荧光强度迅速明显下降(ON),去除5-HT后荧光强度恢复较慢(OFF)(图2)。gydF4y2Ba3 a, bgydF4y2Ba及辅助电影gydF4y2Ba10gydF4y2Ba).贴片的稳定性,传感器的高光稳定性,以及高信噪比,允许在延长的时间内重复测量(图。gydF4y2Ba1 fgydF4y2Ba).信号减弱ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba单个斑块的范围为0.26 ~ 0.62(0.43±0.13,mean±sd,gydF4y2BangydF4y2Ba= 9个补丁;无花果。gydF4y2Ba3gydF4y2Ba).最大信号变化与全细胞数据(100µM 5-HT, Δ)一致gydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.64±0.02),而在一些贴片中看到的较小变化可能归因于未暴露在溶液中但与贴片移液管玻璃表面接触的传感器群。应用不含5-HT的细胞外溶液没有引起任何信号变化(gydF4y2BangydF4y2Ba= 6个补丁;无花果。gydF4y2Ba3gydF4y2Ba).gydF4y2Ba
的反应gydF4y2BasDarkengydF4y2Ba增加5-HT浓度,如所示。gydF4y2Ba一个gydF4y2Ba斑块荧光测量痕迹显示平均扫描6-8次。ON和OFF时间常数由单指数拟合(红线)确定。gydF4y2BabgydF4y2BaON动力学随5-HT浓度的增加而加快(上),OFF动力学与浓度无关(中;的意思是gydF4y2BaτgydF4y2Ba从gydF4y2Ba虚线表示)。信号变化与gydF4y2BaKgydF4y2BadgydF4y2Ba~100 nM(下)。括号中给出的补丁数量,表示为交叉;采用方差分析/ Tukey-Kramer程序进行统计检验,*gydF4y2BapgydF4y2Ba< 0.5, ***gydF4y2BapgydF4y2Ba< 0.001。实验、分析和模型(插图)见附注和图。gydF4y2BaS12gydF4y2Ba.gydF4y2Ba
对sdarkken的活化和失活动力学进行单指数拟合(详见“方法”)。对于100 μM 5-HT的应用,我们得到了gydF4y2BaτgydF4y2Ba在gydF4y2Ba= 43.5±9.7 ms,接近成像的时间分辨率(91 fps),而失活则相当缓慢(gydF4y2BaτgydF4y2Ba从gydF4y2Ba= 323±61.5 ms,平均值±sd;gydF4y2BangydF4y2Ba= 9个补丁;无花果。gydF4y2Ba3 bgydF4y2Ba和补充图。gydF4y2Ba向gydF4y2Ba).为了进行比较,我们测量了谷氨酸传感器SF-iGluSnFR的激活/失活动力学(补充图。gydF4y2Ba向gydF4y2Ba),结果显示,在添加1 mM谷氨酸时,荧光增强更快,而且失活动力学也更快(gydF4y2BaτgydF4y2Ba< 20 ms;补充图。gydF4y2Ba向gydF4y2Ba),与先前的报告相符gydF4y2Ba20.gydF4y2Ba.这证实了测定的sDarken失活动力学不受配体冲洗的限制。gydF4y2Ba
我们还描述了传感器动力学的浓度依赖性(图。gydF4y2Ba3.gydF4y2Ba).在50和100 nM (~gydF4y2BaKgydF4y2BadgydF4y2Ba),活化动力学与较高的5-HT浓度相比显著减缓;相反,在整个浓度范围内,失活动力学没有明显变化(图2)。gydF4y2Ba3 bgydF4y2Ba).在低浓度条件下,表观ON动力学趋向于OFF动力学。5-HT浓度<200 nM时,信号变化减弱,与预期一致(图2)。gydF4y2Ba3 bgydF4y2Ba).gydF4y2Ba
所观察到的动力学行为符合三态体系,即5-HT结合后发生构象变化,最终导致sDarken的荧光强度下降(图2)。gydF4y2Ba3.gydF4y2Ba和补充图。gydF4y2BaS14系列gydF4y2Ba):在高5-HT浓度下,观察到的ON动力学主要反映了传感器的构象变化,而在较低浓度下,5-HT结合成为速率限制。该模型的拟合结果表明,反应动力学可以用gydF4y2BakgydF4y2Ba12gydF4y2Ba> 3 × 10gydF4y2Ba7gydF4y2Ba米gydF4y2Ba−1gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,gydF4y2BakgydF4y2Ba12gydF4y2Ba/gydF4y2BakgydF4y2Ba21gydF4y2Ba~ 1-2 × 10gydF4y2Ba6gydF4y2Ba米gydF4y2Ba−1gydF4y2Ba,gydF4y2BakgydF4y2Ba23gydF4y2Ba~ 20秒gydF4y2Ba−1gydF4y2Ba而且gydF4y2BakgydF4y2Ba32gydF4y2Ba= 4秒gydF4y2Ba−1gydF4y2Ba,分别见补充图。gydF4y2BaS14系列gydF4y2Ba).gydF4y2Ba
与sdarkken相比,l - sdarkken变体表现出更慢的ON和更快的OFF动力学(gydF4y2BaτgydF4y2Ba在gydF4y2Ba= 95.3±17.8 msgydF4y2BaτgydF4y2Ba从gydF4y2Ba100 μM 5-HT = 156.0±27.0 ms;平均值±sd,gydF4y2BangydF4y2Ba= 4个补丁)(补充图gydF4y2BaS15agydF4y2Ba),与其亲和力低相一致。h - sdarkken显示出与原始sdarkken相似的特征(gydF4y2BaτgydF4y2Ba在gydF4y2Ba= 57.2±19.3 ms和gydF4y2BaτgydF4y2Ba从gydF4y2Ba= 324.8±48.5 ms, 1 μM 5-HT mean±sd,gydF4y2BangydF4y2Ba= 4个补丁)(补充图gydF4y2BaS15bgydF4y2Ba).gydF4y2Ba
有机型海马切片培养的2-光子成像gydF4y2Ba
为了评估传感器报告HEK细胞中血清素结合的能力,我们将血清素浴应用于海马神经元。正如预期的那样,沿着树突和单个脊柱测量,所有三种变体都显示出强烈的亮度变暗,证实了神经元组织中传感器的功能。gydF4y2Ba
为了模拟最常用的体内基因传递方法,我们用编码sDarken的重组腺相关病毒载体病毒转导了有机型海马培养物的CA1区域。注射rAAV后2 ~ 3周,传感器强烈表达,并显示出显著的膜定位(图2)。gydF4y2Ba2 g hgydF4y2Ba而且gydF4y2Ba4得了gydF4y2Ba).然后,我们在对照条件(假)和5 -羟色胺应用后进行长时间2-光子光栅扫描,测量荧光信号。gydF4y2Ba4中gydF4y2Ba及辅助影片gydF4y2Ba11gydF4y2Ba而且gydF4y2Ba12gydF4y2Ba).再次,单独的2光子激发并没有引起显著的传感器光漂白,而应用10µM血清素导致在体细胞和神经细胞水平上检测到的荧光强烈下降(图。gydF4y2Ba4 d, egydF4y2Ba).在另外的实验中,我们通过单细胞电穿孔在单个CA1锥体神经元中表达传感器。所有三种传感器变体在树突棘和轴突末端均表现出强烈的膜定位表达。gydF4y2Ba4 fgydF4y2Ba)和浴中5 -羟色胺的应用导致树突和脊柱的荧光明显下降(图。gydF4y2Ba4 f, ggydF4y2Ba).gydF4y2Ba
一个gydF4y2BasDarkengydF4y2Ba海马有机型切片培养中锥体神经元的表达与表现。CA1神经元表达的双光子图像(单平面)gydF4y2BasDarkengydF4y2Ba左为基线状态,右为10 μ M 5-HT浴后。gydF4y2BabgydF4y2Ba荧光强度分布图gydF4y2BasDarkengydF4y2Ba沿着虚线测量gydF4y2Ba一个gydF4y2Ba.时间历程gydF4y2BasDarkengydF4y2Ba控制条件下(左)和10 μ M 5-HT浴后(右)的信号成像。gydF4y2BacgydF4y2Ba归一化荧光强度分布沿虚线从gydF4y2Ba一个gydF4y2Ba.gydF4y2BadgydF4y2Ba量化的gydF4y2BasDarkengydF4y2Ba对照条件下(左)和10 μ M 5-HT浴后(右)的体细胞荧光变化(Sham:−0.032±0.013 ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba+ 5-ht:−0.73±0.014 ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba).gydF4y2BaegydF4y2Ba量化的gydF4y2BasDarkengydF4y2Ba对照条件下(左)和10 μ M 5-HT浴后(右)neuropil荧光变化(Sham:−0.026±0.003 ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba+ 5-ht:−0.78±0.007 ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba).gydF4y2BafgydF4y2Ba表达与表现gydF4y2BasDarkengydF4y2Ba(及其变体)在亚细胞神经元区室中对血清素浴应用的反应。白色箭头表示轴突末端。gydF4y2BaggydF4y2Ba标准化量化gydF4y2BasDarkengydF4y2Ba,gydF4y2BaH-sDarkengydF4y2Ba而且gydF4y2BaL-sDarkengydF4y2Ba10 μ M 5-HT浴后树突和刺的荧光变化gydF4y2BasDarkengydF4y2Ba而且gydF4y2BaH-sDarkengydF4y2Ba高亲和突变体为200 μ M 5-HTgydF4y2BaL-sDarkengydF4y2Ba(变暗的树突:0.41±0.02,gydF4y2BangydF4y2Ba= 5单元格;暗刺:0.44±0.04;gydF4y2BangydF4y2Ba= 5单元格;gydF4y2BaH-sDarkengydF4y2Ba树突:0.38±0.04,gydF4y2BangydF4y2Ba= 5单元格;gydF4y2BaH-sDarkengydF4y2Ba脊柱:0.46±0.06,gydF4y2BangydF4y2Ba= 4单元格;gydF4y2BaL-sDarkengydF4y2Ba树突:0.58±0.04,gydF4y2BangydF4y2Ba= 4单元格;gydF4y2BaH-sDarkengydF4y2Ba脊柱:0.60±0.03,gydF4y2BangydF4y2Ba= 5单元格)。图表显示单个数据点(灰色填充的圆圈)和平均值(黑色填充的圆圈)±SEM。gydF4y2Ba
综上所述,这些实验证明了sDarken选择性定位于海马神经元质膜的能力,对血清素的反应及其在双光子显微镜下的实用性。gydF4y2Ba
脑切片内源性释放成像gydF4y2Ba
接下来,我们研究了sDarken在新皮层脑组织中的表现。我们通过AAV注射在小鼠前额叶皮层神经元特异性突触素启动子下表达sDarken (pAAV8-hSyn-sDarken)。我们准备了表达sdarkken的小鼠前额叶皮层边缘下(Il)区域的急性脑切片。外源性5 -羟色胺(100µM)的雾化应用引起了sDarken荧光信号的可靠下降(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba= 0.41±0.01),而吸ACSF只引起可忽略不计的反应(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba= 0.01±0.008)(图gydF4y2Ba5 a、bgydF4y2Ba);这也适用于l - sdarkken(补充图。gydF4y2BaS16gydF4y2Ba).我们还测量了sDarken对内源性血清素释放的反应。为此,我们用电(40 Hz刺激)诱发血清素的释放,并通过光子显微镜成像传感器动态(图。gydF4y2Ba5 dgydF4y2Ba).即使是单个脉冲也能引起可检测到的荧光变化(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.042±0.004[1个脉冲]),响应幅值随着脉冲次数的增加而增加(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.05±0.006[2个脉冲],ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.05±0.006[5个脉冲],ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.08±0.01[10个脉冲],ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.076±0.001[20个脉冲],ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba=−0.13±0.01[40次脉冲])gydF4y2Ba5 c, dgydF4y2Ba).总之,这些体外实验表明,sDarken具有足够的灵敏度来检测内源性血清素的释放。gydF4y2Ba
一个gydF4y2BaWt小鼠前额皮质注射pAAV8-Syn-Darken。注射3周后制备脑切片,用光子显微镜和CMOS相机成像。左面板雾化应用100 μ M 5-HT,gydF4y2BangydF4y2Ba= 4片40个roi。右面板ACSF雾化应用,gydF4y2BangydF4y2Ba= 3片30个roi。gydF4y2BabgydF4y2Ba从数据定量的荧光下降后,扑扑应用gydF4y2Ba一个gydF4y2Ba, 100 μ m 5-ht,gydF4y2BangydF4y2Ba= 4片40rois ACSF,gydF4y2BangydF4y2Ba3片= 30个roi,均值和±SEM为未配对的双尾gydF4y2BatgydF4y2Ba测试,* * *gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BacgydF4y2Ba在视野中放置双极刺激电极,发送@40 Hz的电脉冲(0.2 ms, 750µA)。用于不同脉冲数的电刺激的单个迹线插入对指示脉冲数的荧光响应的量化。gydF4y2BangydF4y2Ba4片= 27个roi,均值和±SEM。gydF4y2BadgydF4y2Ba所分析roi随脉冲数增加的热图。gydF4y2BaegydF4y2Ba实验装置示意图:立体定向注入AAV-Syn-gydF4y2BasDarkengydF4y2Ba进入前额叶皮层(PFC),在PFC上方植入颅窗,并在中缝背侧(DR)植入刺激电极。12周后麻醉固定头小鼠,用2-光子成像在体成像。由BioRender.com创建。gydF4y2BafgydF4y2Ba上面板:在体表达的代表图像gydF4y2BasDarkengydF4y2Ba在PFC(约200微米深)。下面板:实验时间轴,9个连续的50 Hz电刺激,持续1秒(750µA, 0.1 ms/脉冲),间隔20秒。下面的伪彩色图像描述了电刺激前后荧光的变化。gydF4y2BaggydF4y2Ba代表gydF4y2BazgydF4y2Ba-响应9个单独电刺激(灰色条)的全视野(FOV)瞬态评分和平均值(AVG)。gydF4y2BahgydF4y2Ba的平均水平gydF4y2BazgydF4y2Ba- 3只小鼠对9种电刺激(灰色条)的反应瞬态评分,以及所有3只小鼠的总平均值(AVG)。gydF4y2Ba
活体2光子成像gydF4y2Ba
为了确定sDarken是否可以检测体内血清素动态,我们在麻醉小鼠和清醒小鼠的PFC中使用了2光子(2P)成像,因为PFC接受来自中缝背核(DR)的密集投射,DR是血清素能系统的主要核gydF4y2Ba21gydF4y2Ba.在PFC中注射sdarkken,在PFC的背侧植入颅窗,在DR中放置刺激电极(图2)。gydF4y2Ba5 egydF4y2Ba).sDarken在PFC的皮层浅层和深层、神经膜以及体中均有稳定表达(图2)。gydF4y2Ba5 fgydF4y2Ba).我们记录了麻醉小鼠DR电刺激过程中的5-HT瞬态(图2)。gydF4y2Ba5 fgydF4y2Ba).50赫兹的电刺激在单次试验中引起了强烈的反应(图。gydF4y2Ba5克gydF4y2Ba及辅助电影gydF4y2Ba13gydF4y2Ba).在电刺激开始后,荧光立即明显下降,随后荧光持续增加,然后恢复到基线强度(图2)。gydF4y2Ba5克,gydF4y2Ba).在几个个体中可靠地检测到电刺激引发的血清素动态(图。gydF4y2Ba5 hgydF4y2Ba).gydF4y2Ba
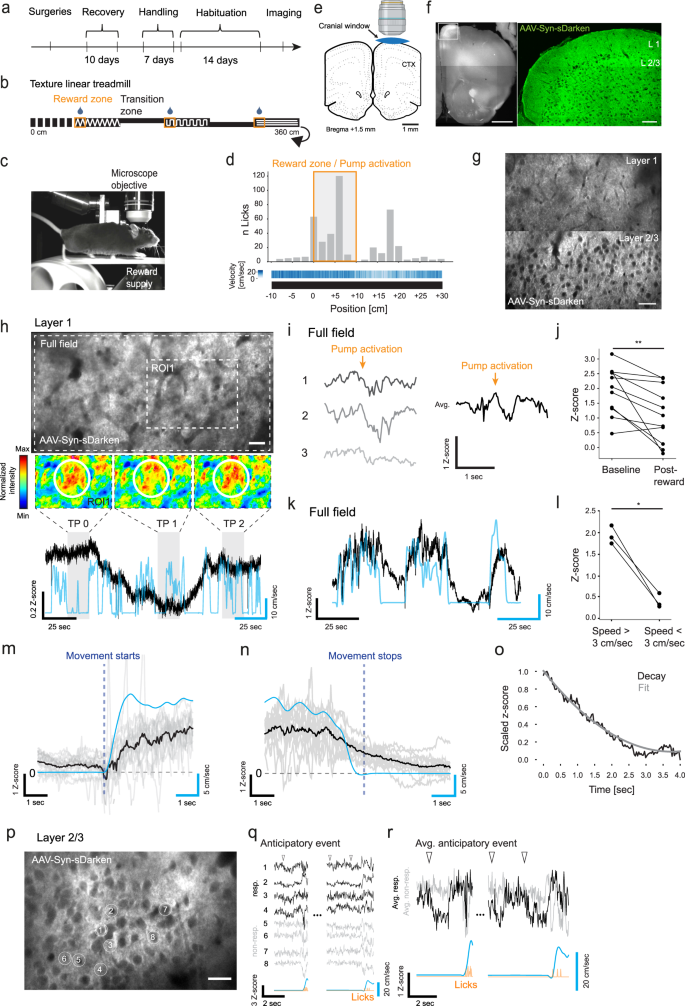
接下来,我们想评估sDarken检测清醒动物体内自然发生的5-HT动态的能力。再次,在PFC中注射sdarkken,并在PFC背侧植入颅窗进行2P成像。为此,我们建立了一个奖励范式(图2)。gydF4y2Ba6 a egydF4y2Ba).老鼠被训练在一个线性跑步机上(360厘米)跑步,当它们在行走表面上的特定纹理标记的三个指定奖励区域舔食后,就会得到燕麦牛奶奖励。gydF4y2Ba6 bgydF4y2Ba).小鼠学习了这种模式,表现为在奖励区域内舔舐次数的增加。gydF4y2Ba6 dgydF4y2Ba).sdarkken在PFC不同皮层层表达(图2)。gydF4y2Ba6 eggydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba时间安排。gydF4y2BabgydF4y2Ba线性跑步机的描述。奖励位置由橙色方框表示。gydF4y2BacgydF4y2Ba固定头部动物在直线跑步机上跑步的表征图像。gydF4y2BadgydF4y2Ba老鼠在空间箱(灰色条)上的舔次数(gydF4y2BangydF4y2Ba= 2)。热图表示空间箱的平均速度。gydF4y2BaegydF4y2Bapfc上方的颅窗示意图,由BioRender.com创建。gydF4y2BafgydF4y2Ba皮层aav - syn - sdarkken表达的组织学图像。左图:同侧半球概览(比例尺= 1mm)。右图:图层1和图层2/3的放大(比例尺= 100µm)。gydF4y2BaggydF4y2Baaav - syn - sdarkken在PFC第1层(上)和第2/3层(下)表达的双光子成像视场(比例尺= 50µm)。gydF4y2BahgydF4y2Ba大图像显示的平均强度投影gydF4y2BasDarkengydF4y2BaPFC中树突层的表达(比例尺= 100 μm)。小图像显示ROI1在不同时间间隔(TP0-TP2)的16色强度投影。黑色痕迹显示荧光描述为gydF4y2BazgydF4y2Ba-score,蓝色轨迹显示鼠标速度。gydF4y2Ba我gydF4y2Ba三种典型的全场荧光变化对奖赏的反应。在一只动物身上平均追踪11个奖励事件。gydF4y2BajgydF4y2Ba平均的量化gydF4y2BazgydF4y2Ba-得分为(中位数= 2.76,gydF4y2BangydF4y2Ba在一只动物中= 11个奖励事件)和奖励后(中位数= 2.10,gydF4y2BangydF4y2Ba= 11)。gydF4y2BaPgydF4y2Ba< 0.01, Wilcoxon配对符号秩检验。gydF4y2BakgydF4y2Ba黑色示踪全场变暗荧光,蓝色示踪小鼠速度。gydF4y2BalgydF4y2Ba在跑步(速度>3 cm/s)和休息(速度<3 cm/s)期间的平均荧光定量(跑步:平均= 1.94;休息:均值= 0.42;gydF4y2BangydF4y2Ba= 3只老鼠)。gydF4y2BaPgydF4y2Ba< 0.05,成对gydF4y2BatgydF4y2Ba测试。gydF4y2Ba米gydF4y2Ba灰色痕迹单一荧光痕迹(gydF4y2BangydF4y2Ba= 16)与运动开始有关(gydF4y2BangydF4y2Ba= 3)。黑色痕迹显示平均痕迹。gydF4y2BangydF4y2Ba灰色迹线表示单一荧光迹线(gydF4y2BangydF4y2Ba= 18)与运动停止有关(gydF4y2BangydF4y2Ba= 3)。黑色痕迹显示平均痕迹。gydF4y2BaogydF4y2Ba黑色痕迹显示运动停止后最小-最大缩放平均荧光衰减。灰色线表示荧光衰减的二次多项式拟合gydF4y2Ba从gydF4y2Ba= 1.24秒)。gydF4y2BapgydF4y2BaPFC中细胞层2/3的平均强度投影(比例尺25µm)。gydF4y2Ba问gydF4y2BaZgydF4y2Ba响应(黑色)和无响应roi(灰色)在寻求奖励行为(橙色)和开始运动(浅蓝色)之前的荧光痕迹评分。gydF4y2BargydF4y2Ba响应ROI 1-4(黑色)和未响应ROI 5-8(灰色)的平均z分数。gydF4y2Ba
有趣的是,在第1层中,我们注意到局部5 -羟色胺动态发生独立于运动或奖励(图。gydF4y2Ba6小时gydF4y2Ba).局部事件持续几秒到几分钟,包括较小的5-HT释放瞬变。这些数据表明,sDarken足够敏感,可以检测不同时间尺度上自然发生的血清素动态。我们期望在奖励传递过程中观察到全局(全视野)5-HT瞬变,但这种效应仅在三分之一的动物中可见。在这个实验中,动物的荧光在个体试验中下降(5-HT增加),11个奖励事件的定量显示荧光从基线显著下降(图。gydF4y2Ba6 i, jgydF4y2Ba).在数据分析过程中,我们注意到所有动物的整体5-HT动态与运动有很强的相关性(gydF4y2BangydF4y2Ba= 3;无花果。gydF4y2Ba6k, l) agydF4y2Ba运动速度的降低与荧光的减少(前脑5-HT的增加)相关,反之,当动物增加运动速度时,荧光的增加(5-HT的减少)是明显的(图。gydF4y2Ba6 m, ngydF4y2Ba).比较跑步和休息时的整体sdarkken荧光显示,当动物停止时,荧光明显下降(图2)。gydF4y2Ba6 l-ogydF4y2Ba).与跑步相关的血清素动态表现在第二个范围内,gydF4y2BaτgydF4y2Ba从gydF4y2Ba= 1.24 s(图;gydF4y2Ba6 ogydF4y2Ba).为了更详细地探索血清素的动态,我们还分析了皮层2/3层的血清素动态(图2 - 3)。gydF4y2Ba6 pgydF4y2Ba及辅助电影gydF4y2Ba14gydF4y2Ba).在一些选定的roi中,5 -羟色胺的局部变化(释放量增加)伴随着奖赏(舔)(图。gydF4y2Ba6 p-rgydF4y2Ba),而在其他情况下,荧光没有明显的预期变化。我们的实验表明,sDarken可以用2p显微镜检测清醒动物在不同时间尺度上自然发生的血清素动态。gydF4y2Ba
讨论gydF4y2Ba
我们开发了三种不同的基因编码5-HT传感器变体(sDarken),这将使血清素在体外和体内的动态成像成为可能。原始的sDarken对5-HT具有很高的亲和力(gydF4y2BaKgydF4y2BadgydF4y2Ba127 nM)和快速开关动力学(gydF4y2BaτgydF4y2Ba在gydF4y2Ba= 43.5±9.7 ms angydF4y2BaτgydF4y2Ba从gydF4y2Ba= 323±61.5 ms),使其适用于检测血清素动态具有高时间和空间分辨率。作为sDarken的补充,另外两个传感器变体H-sDarken和L-sDarken扩展了现有的工具箱。H-sDarken对血清素和(KgydF4y2BadgydF4y2Ba= 57 nM)和与原始sDarken相似的动力学。L-sDarken对5 -羟色胺的亲和力较低(gydF4y2BaKgydF4y2BadgydF4y2Ba45±4.6µM),在动力学上稍慢,但在动力学上较快。快速关闭动力学将有助于避免5-HT的缓冲,并将以高时间分辨率解决5-HT释放事件gydF4y2Ba3.gydF4y2Ba.一些研究假设突触间隙内的神经递质浓度可以达到毫摩尔浓度(>1 mM),而突触外的浓度预计在高nM到低µM范围内gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.sDarken变体对5 -羟色胺的亲和力在这个生理范围内,我们的实验表明,sDarken可以检测内源性5 -羟色胺在体外和体内的释放。所有传感器变体结合血清素具有高特异性,而其他神经递质不引起传感器的荧光变化。这些特性使sDarken成为现有血清素传感器的理想补充(表gydF4y2Ba1克ydF4y2Ba),扩大了血清素动态成像的工具箱。gydF4y2Ba
sDarken家族成员L-sDarken具有亲和力低、时间分辨率快的特点,可能适用于点对点释放位点的研究。相比之下,H-sDarken将更适合检测细胞外体积传输(表gydF4y2Ba1克ydF4y2Ba).gydF4y2Ba
与其他最近开发的5-HT传感器(GRAB . ht)相比gydF4y2Ba5 -gydF4y2Ba、PsychLight2和iSeroSnFR)gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba26gydF4y2Basdarkken具有较高的灵敏度和相对较快的动力学(表gydF4y2Ba1克ydF4y2Ba).尽管抓住gydF4y2Ba5 -gydF4y2Ba和PsychLight2使用类似的设计策略,即引入或替换IL3,使用不同的血清素受体作为传感部分,连接器和插入位点产生具有不同特性的传感器。例如,与PsychLight和sDarken相比,GRAB传感器不能完全替代ICL3,这可能会导致下游信号的剩余激活gydF4y2Ba3.gydF4y2Ba.在某些研究应用中,这可能需要对不良副作用进行控制。sDarken是唯一的血清素传感器,它在未结合状态下是明亮的,并在血清素结合时减弱其荧光。与传统的神经递质传感器相比,sDarken具有与eGFP膜表达相当的亮度。这种优越的亮度将有利于成像一般。此外,h - sdarkken的亮度比eGFP高三倍,这与超级文件夹变体的特性一致gydF4y2Ba17gydF4y2Ba.我们的实验也显示了sdarkken在2P成像中的潜力,以及它优越的膜表达、亮度和稳定性。动力学特性,结合优越的亮度和光稳定性,将在解决亚细胞结构方面具有优势。在未来,针对突触的特异性靶向可以实现高分辨率的血清素释放成像,即使是在突触末端。gydF4y2Ba
现有的血清素传感器要么基于5-HT2受体gydF4y2Ba10gydF4y2Ba,gydF4y2Ba26gydF4y2Ba或者在突变的周质结合蛋白上gydF4y2Ba大肠杆菌gydF4y2Ba13gydF4y2Ba而sDarken基于5-HT1A受体。5-HT1A受体是抗焦虑药、抗抑郁药和抗精神病药的主要靶点。sDarken可以以类似psychlight的方式使用gydF4y2Ba26gydF4y2Ba以确定能够与5-HT1A受体结合的化合物,这可能有助于寻找精神疾病的治疗策略。gydF4y2Ba
在DR的体内电刺激引起PFC中5-HT水平的过度短暂增加(荧光的初始下降),随后荧光的短暂增加,这很可能是由于DR的自抑制引起的gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.gydF4y2Ba
同样的双相现象也在用psychLight2(另一种基于GPCR的血清素传感器)在DR和前额叶皮层进行的足底休克实验中观察到gydF4y2Ba26gydF4y2Ba.在DR中血清素能神经元的纤维光度测定记录,当作为一个群体研究时,也显示出对足底休克的双相反应,然而,这些反应特性被认为起源于解剖学上不同的亚群体gydF4y2Ba29gydF4y2Ba.最近的单细胞分辨率微型成像令人印象深刻地显示,对情绪刺激(如奖励或足底电击)的不同反应类型(激活或抑制)甚至存在于解剖学定义的投射中gydF4y2Ba30.gydF4y2Ba.这种异质性可能是我们在PFC中观察到的双相反应的一个解释。gydF4y2Ba
另一种解释可能是,双相反应是一种回路现象,由DR内的自抑制或由PFC到DR的自上而下的投影(负反馈机制的激活)介导,因为PFC中的双相血清素动态仅在体内明显,而在体外电刺激时只观察到血清素水平的增加。此外,由于距离中缝正中(MR)很近,我们不能排除电刺激也激活MR血清素能神经元,这可能有助于PFC的双相反应gydF4y2Ba31gydF4y2Ba.此外,电刺激可能导致5 -羟色胺的过度释放,随之而来的是5 -羟色胺在突触中的储存消耗,导致5 -羟色胺能张力的长期下降。gydF4y2Ba
不仅可以用sDarken检测到人工(电)诱发的血清素释放,还可以看到血清素动态的先天变化。众所周知,血清素的释放与奖励预期和交付有关gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba但我们在奖励范式中获得的结果是模棱两可的:只有一只动物(在两只成功学习了奖励范式的动物中)在奖励过程中可以看到血清素短暂性(荧光减少)的轻微而显著的增加。然而,在所有动物中,5-HT动力学和运动之间的强相关性是明显的。这一观察结果很好地符合前脑中的血清素与行为抑制、等待有关的概念gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,以及5-HT释放时运动的普遍抑制gydF4y2Ba29gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.似乎血清素可以将动物的行为状态从积极的觅食/奔跑转变为抑制运动gydF4y2Ba38gydF4y2Ba.总的来说,动物表现出一种混合策略来获得奖励。在一些试验中,老鼠在奖励传递期间停止奔跑,而其他动物在舔食期间继续奔跑。此外,由于我们观察到运动对血清素动态的强烈调节,因此很难分离出仅与奖励相关的血清素瞬变。动物不同的行为策略使得对黑氏信号的解读变得复杂,这可能代表了动物内部状态的差异。血清素是正在进行的内部活动和传入的外部感觉信号的强大调节器gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba从这个角度来看,观察到的血清素动态也可能作为皮层活动的增益控制。gydF4y2Ba
有趣的是,我们观察到局部热点,其中5-HT动态在较慢的时间尺度(分钟)上被调制,独立于奖励或运动。目前,我们还不知道这些局部事件是如何编码的。进一步的研究必须揭示,这些局部事件是否可能是PFC-DR动机系统的一部分,在具有挑战性的情况下调节与努力相关的行为gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.gydF4y2Ba
我们的实验证明了sDarken通过活体2P成像在生理和行为相关时间尺度(秒)上成像自然发生的血清素动态的能力。我们特意决定使用2P成像,因为与光纤光度法相比,2P成像对荧光传感器的信噪比和灵敏度有很高的要求,因为可能存在运动伪影、血流动力学和成像深度gydF4y2Ba3.gydF4y2Ba.另一方面,光纤测光是基于时间相关的单光子计数,是一种检测发射光的超灵敏工具gydF4y2Ba2gydF4y2Ba然而,它缺乏细胞分辨率。使用sDarken,在2P成像的单次试验中甚至可以检测到血清素的释放,快速的脱色率可以精确测量体内血清素的瞬态。我们的实验揭示了血清素体积传输的强烈空间变异,表现在小的局部火锅中,其中血清素的动态在奖励交付之前是明显的预期性的。对大脑皮层中多巴胺的释放也有类似的观察gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
未来的实验将揭示黑化是否也允许在树突、单棘或轴突上可视化血清素的释放。在有机型培养中的测量和体内细胞分辨率的2P测量表明,使用sDarken也可以实现亚细胞分辨率,即扣孔和突触。gydF4y2Ba
显然,神经递质传感器蛋白的表达可以扭曲它们的扩散/再摄取动力学和它们通过缓冲分析物引起的信号(见例,参考。gydF4y2Ba44gydF4y2Ba).这些影响可以通过选择具有理想亲和范围的变体(sDarken, L-sDarken,或H-sDarken)并尽可能保持低表达水平来避免。sDarken家族的强荧光和大信号变化在这方面特别有帮助。同时,低表达水平会减少与天然5-HT1A或其他受体分别组装成同源二聚体或异源二聚体的可能性,或减少与其他支架蛋白的相互作用。其他生物传感器利用与sDarken相同的设计原理,没有显示出对内源性5-HT受体信号的任何显著影响gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
sDarken家族提供三种变体,结合细胞和分子特异性,具有高特异性、宽动态范围、高亲和力(nM-mM)和改进的时间分辨率。由于其高特异性和光稳定性,它们非常适合研究行为动物的血清素动态。gydF4y2Ba
我们认为,斯达克家族将扩大基因编码血清素传感器的可用工具箱。sDarken将允许研究5-羟色胺在行为和不同大脑状态中的瞬态和血清素动态。设计的传感器变体将极大地促进对5-HT神经传递的一般理解。我们期待未来传感器性能的进一步改进和具有不同荧光团的传感器的开发。gydF4y2Ba
方法gydF4y2Ba
我们的研究符合所有相关的道德法规,并已获得地方当局的批准:Freie Hansestadt Bremen, Senatorin für Gesundheit, Frauen und Verbraucherschutz和LANUV Germany。gydF4y2Ba
克隆gydF4y2Ba
pN1-GCaMP6m-XC为刘晓东(Addgene质粒# 111543;gydF4y2Bahttp://n2t.net/addgene:111543gydF4y2Ba;RRID:Addgene_111543)和sfGFP-N1是Michael Davidson和Geoffrey Waldo的礼物(Addgene质粒# 54737;gydF4y2Bahttp://n2t.net/addgene:54737gydF4y2Ba;RRID: Addgene_54737)。DNA片段使用CloneAmp HiFi聚合酶(Clonetech)进行PCR扩增,引物(Thermo Fischer Scientific)含有约20 bp的悬吊物,这些悬吊物与质粒生成所需的其他PCR产物末端互补。gydF4y2Ba
然后使用InFusion克隆(Clonetech)方法生成质粒,并使用Nucleo Bond Xtra Midi Kit (Macherey Nagel)进行纯化。为了验证正确的组装和DNA序列,使用LGC基因组学提供的标准引物(CMV-F, EGFP-C1-R)进行Sanger测序。在Linker序列随机突变的实验中,使用了引物(Primers),其中包含用于InFusion反应的悬垂物和在特定突变位点选择的NNK三联体(N =任意碱基,K = G或T)。产品使用GeneJet质粒Mini Prep Kit (Thermo scientific)进行纯化。gydF4y2Ba
细胞培养gydF4y2Ba
人胚胎肾293 (HEK293)细胞(tsA201细胞,ATTC)和稳定表达GIRK1/2亚单位HEK293(来自Dr. Andy Tinker (UCL London, UK)的细胞)在DMEM (TSA细胞:DMEM, FBS 10%,青霉素/链霉素10,000 U/ml;GIRK1/2细胞:DMEM, FBS 10%,青霉素/链霉素10,000 U/ml, G418 400µg/ml) 25厘米gydF4y2Ba2gydF4y2Ba在37°C和CO的温度下烧瓶gydF4y2Ba2gydF4y2Ba浓度为5%。用3µg/ml PEI和0.5µg质粒DNA转染细胞,孵育18 -24 h后记录。gydF4y2Ba
成像实验中,将细胞分裂到60 mm²的培养皿中,在达到60-70%合流后,转染18-24小时,然后用PEI记录(3µg DNA与10µl PEI 1µg/µl在150µl DMEM中,孵卵15分钟)。gydF4y2Ba
HEK细胞的特性gydF4y2Ba
HEK细胞成像gydF4y2Ba
成像前用PBS冲洗细胞。成像was performed at an upright LNscope from Luigs&Neumann using a 40x water immersion objective (LUMPLFLN40xW, Olympus).
视频用CMOS相机(Hamamatsu)以1hz的帧率录制2分钟。gydF4y2Ba
神经递质和药物直接应用于重力驱动灌注系统。gydF4y2Ba
视频在ImageJ {Schneider:2012dw中进行分析。在细胞膜周围选择roi。测量每个时间点的平均灰度(荧光)值。通过减去背景荧光来校正得到的值。数据归一化到第一帧,通过将所有平均值除以相应的基础荧光(gydF4y2BaFgydF4y2Ba基地gydF4y2Ba)的细胞。获取ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba值时,我们减去基线荧光先前(gydF4y2BaFgydF4y2Ba0gydF4y2Ba)到配体的应用,并在配体应用后荧光(gydF4y2BaFgydF4y2Ba).gydF4y2Ba
对于滴定曲线,数据用Hill函数在Igor Pro(waveemetrics)中进行拟合。gydF4y2Ba
为了更好地与现有的正向传感器进行比较,我们报告了典型的荧光减少gydF4y2BasDarkengydF4y2Ba作为正值gydF4y2BaKgydF4y2BadgydF4y2Ba情节和激动剂特异性。gydF4y2Ba
血清素的释放gydF4y2Ba
HEK293T细胞在35mm培养皿中播种,随后用三种5-HT传感器变体中的一种进行转染(即:gydF4y2BaL-sDarkengydF4y2Ba,gydF4y2BasDarkengydF4y2Ba,gydF4y2BaH-sDarkengydF4y2Ba).转染24小时后进行成像。为此,用PBS和100µM的npec -cage - 5 -羟色胺(Cat。第3991号,Tocris)被添加到这道菜中。表达5-HT变体的HEK293T细胞在激光扫描共聚焦Zeiss LSM 880上成像。我们使用488 nm激光对5-HT传感器变体的荧光成像。成像使用×60油浸物镜(LD LCI Plan-Apochromat ×63/1.2),成像速度为0.93 Hz。我们使用405nm激光在90%功率下对npec -牢笼-血清素进行解笼。通过LSM的ZEN软件手动选择漂白区域(即笼化区域)。漂白时间设置为90 ms,两次漂白时间间隔设置为50 s。gydF4y2Ba
电生理学gydF4y2Ba
对于GIRK频道录音本机5-HTgydF4y2Ba1gydF4y2Ba受体和5-HT传感器变体在稳定表达GIRK1/2亚基的HEK293细胞中表达。转染后细胞在暗室条件下培养并记录。避免转染的原生5-HT的过度激活和内化gydF4y2Ba1gydF4y2Ba转染前将含有DMEM的受体5-HT替换为透析的DMEM。在测量前2-3小时将转染的细胞转移到包覆15毫米的聚l-溶血素(0.001%)中。膜片钳只使用分离的细胞进行记录。如前所述,测量和分析了girk介导的K+电流gydF4y2Ba45gydF4y2Ba.外部溶液为:20mm NaCl, 120mm KCl, 2mm CaClgydF4y2Ba2gydF4y2Ba, 1mm MgClgydF4y2Ba2gydF4y2Ba, 10毫米HEPES-KOH, pH 7.3 (KOH)。贴片移液管(2 - 5兆欧姆)填充内部溶液:100mm天冬氨酸钾,40mm KCl, 5mm MgATP, 10mm HEPES-KOH, 5mm NaCl, 2mm EGTA, 2mm MgClgydF4y2Ba2gydF4y2Ba, 0.01 mM GTP, pH 7.3 (KOH)。gydF4y2Ba
在实验操作期间,使用反式照明红光(590 nm)或蓝光滤光片(450 nm)观察细胞。用EPC10 USB放大器(HEKA)对HEK293细胞进行全细胞膜片钳记录。电流以10 kHz进行数字化,并使用内部10 kHz三极贝塞尔滤波器(滤波器1)与EPC10 USB放大器的2.9 kHz四极贝塞尔滤波器(滤波器2)串联进行滤波。串联电阻部分补偿在70 - 90%之间。漏电流和电容电流通过使用p/4方法从- 60到- 70 mV的超极化脉冲来减去。此外,50赫兹的噪音被嗡嗡虫过滤器抵消了。电流响应用Igor Pro (waveemetrics)软件进行量化。gydF4y2Ba
GPCR化验gydF4y2Ba
为了分析Gα细胞内信号级联(即Gq和Gs)通过5-HT结合到5-HT传感器变体的潜在激活,我们使用了两种类似的方法。首先,HEK293T细胞在35mm培养皿中播种,随后用三种5-HT传感器变体中的一种和jRCaMP或CNG-jRCaMP转染过夜。为了分析潜在的gq通路激活,我们记录了5-HT刺激期间的jRCaMP荧光,因为gq通路的激活会导致细胞内Ca的增加gydF4y2Ba2 +gydF4y2Ba的水平。作为阳性对照,我们随后用ATP刺激细胞,这导致细胞内Ca2+水平上升。为了分析潜在的gs通路激活,我们记录了HEK293tsa细胞内的jRCaMP荧光,在5-HT刺激期间,HEK293tsa细胞与环状核苷酸门控离子通道(CNG)共转染(由凯撒研究中心基因工程核心设施的Reinhard Seifert博士提供)。cng驱动CagydF4y2Ba2 +gydF4y2Ba结合cAMP时流入。因此,gs通路的激活会通过腺苷酸环化酶的激活来增加cAMP的产生,进而导致细胞内Ca的增加gydF4y2Ba2 +,gydF4y2Ba通过jRCaMP荧光的增加来测量。作为阳性对照,我们用Forskolin刺激细胞,激活腺苷酸环化酶,从而增加细胞内cAMP水平。gydF4y2Ba
不同pH值对荧光的影响gydF4y2BasDarkengydF4y2Ba
首先,HEK293T细胞在35mm培养皿中接种,随后用sdarkken转染。使用Luigs&Neumann公司的40倍水浸物镜(LUMPLFLN40xW,奥林巴斯),在直立式LNscope上进行成像。第二天细胞在PBS中成像(详细描述见上文),设置不同的pH值(6.0-8.0;0.2步),含有或不含10µM的5-HT。此外,HEK293T细胞表达gydF4y2BasDarkengydF4y2Ba测试了5-HT在不同pH环境下的荧光变化。在PBS中设置不同的pH值(6.2-7.8;0.4步)PBS + 100 μ M 5-HT,也设置为相同的pH值,洗涤。ΔgydF4y2BaFgydF4y2Ba/F的计算方法如(HEK细胞成像)所述。为了分析前后差异,我们从5- ht洗井开始后的5秒平均值(秒70-75)减去5- ht洗井开始前的5秒平均值(秒20-25)。gydF4y2Ba
视频用CMOS相机(Hamamatsu)以1hz的帧率录制。为了评估pH值的变化是否会引起传感器的荧光变化,我们在改良的林格缓冲液(140 mM NaCl, 3.5 mM KCl, 0.5 mM NaH)中洗涤gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 0.5 mM MgSOgydF4y2Ba4gydF4y2Ba, 1.5毫米氯化钙,10毫米HEPES, 2毫米NaHCOgydF4y2Ba3.gydF4y2Ba, 5 mM葡萄糖)按随机顺序设置为4个不同的pH值(6.8,7.0,7.2,7.4),作为连续试验。每次试验数据都归一化到第一帧。评估pH值对传感器剂量-响应曲线的影响,我们测量了7种不同浓度(10 nM, 50 nM, 100 nM, 200 nM, 400 nM, 1 μM, 10 μM)和4种不同pH值(6.8,7.0,7.2,7.4)的荧光变化(ΔF/F)。滴定曲线数据在GraphPadPrism(9.3.1)中进行拟合,并与Hill slope进行特定的绑定。gydF4y2Ba
快速膜片钳荧光法动力学表征gydF4y2Ba
5-HT传感器(gydF4y2BasDarkengydF4y2Ba)动力学分析通过快速配体应用于外膜补丁结合荧光成像,即通过快速膜片钳荧光测量。gydF4y2Ba
传感器表达式和膜片钳程序gydF4y2Ba
HEK 293T细胞(DSMZ(德国微生物和细胞培养集),#ACC 635)在DMEM中添加8% FBS, 37°C和5% COgydF4y2Ba2gydF4y2Ba在塑料(PET-G)封面上。24-48 h后,用聚乙烯亚胺25000与0.3 μg DNA / ml培养基进行转染。表达48小时后,使用标准膜片钳程序拉取膜片。简而言之,膜片移液管(3-4 MΩ电阻)从硼硅酸盐玻璃(G150TF-4,华纳仪器)中取出,并填充内部溶液(122 mM CsCl, 2 mM NaCl, 2 mM MgClgydF4y2Ba2gydF4y2Ba, 10毫米EGTA, 10毫米HEPES, pH值7.2)。将贴壁细胞的覆盖物置于(138 mM NaCl, 1.5 mM KCl, 1.2 mM MgCl)的外部溶液中gydF4y2Ba2gydF4y2Ba, 2.5 mM CaClgydF4y2Ba2gydF4y2Ba, 10毫米HEPES, pH 7.3)。使用微操作器(Patchstar, scientiica)和Axopatch 200B膜片钳放大器(结合Digidata 1550 a /D转换器和pClamp 10.7软件;所有分子设备)细胞附着,然后建立全细胞配置,以去除由外而外的补丁。实验在22-25°C下进行,外部贴片电压箝位至−70 mV。电阻通常≥1 GΩ,并在整个实验过程中进行监测。pClamp和A/D转换器用于产生配体应用的电压脉冲,并触发单相机帧的采集。化学品,包括5-羟色胺盐酸盐和谷氨酸盐,购自Sigma。采用pAAV SFiGluSnFR进行对照实验。A184V (Addgene #106199)gydF4y2Ba46gydF4y2Ba.gydF4y2Ba
快速配体应用和成像gydF4y2Ba
快速配体的应用和去除是通过定位在一个压电驱动的双筒前的外部补丁gydF4y2BaΘ-gydF4y2Ba玻璃吸管。移液器从硼硅酸盐玻璃(外径2.0 mm,内径1.40 mm,隔距0.2 mm, Warner Instruments)中取出,破碎产生直径约150 μm的尖端,并安装到压电驱动器(P842.20, Physik Instrumente)上。横向位移由短电压阶跃触发(0.7 ms内3 V斜坡),由电源(E505.10, Physik Instrumente)放大,并以1 kHz滤波。使用注射泵(每通道0.2-0.4 ml/min),平行浴灌注~3-5 ml/min。细胞外溶液0.5×和细胞外溶液1×之间的交换电流(图;gydF4y2BaS10gydF4y2Ba).通常情况下,5-HT在随后的6-8次扫描中应用1秒。对于较低浓度,应用时间增加到4秒。gydF4y2Ba
在反向显微镜(DMi8, Leica)上进行Epifluorescence成像,×40物镜(HCX PL FL L 40x/0.60 CORR XT)。绿色荧光被激发使用470 nm LED (Thorlabs)和470/40 nm激发滤波器,结合495 nm二向色镜和525/50 nm发射滤波器(全部Chroma)。焦平面的光强为~10.4 mW/mmgydF4y2Ba2gydF4y2Ba.使用MicroManager2.0使用EMCCD相机(Evolve 512 delta, Photometrics)获取图像。单个帧的采集由pClamp 10.7(分子器件)触发的TTL脉冲(预序列/频闪模式)控制。5-HT传感器成像(图2)gydF4y2Ba1 egydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2BaS11gydF4y2Ba,gydF4y2Ba向gydF4y2Ba),有效帧率为91 Hz,曝光时间为10 ms,增益设置为50,裁剪到9 × 16像素的区域。SFiGluSnFR(A184VgydF4y2Ba11gydF4y2Ba)在5 ms的曝光时间和194 Hz的有效帧率下测量反应。gydF4y2Ba
数据分析gydF4y2Ba
独立转染后重复多次实验。ImageJ 1.53c (gydF4y2Ba47gydF4y2BaRasband W./NIH)提取膜贴片的一个确定区域(9-16像素椭圆形)和邻近区域的荧光强度进行背景相减。数据转移到Clampfit 7 (Molecular Devices),基线校正(线性调整),并取平均值进行进一步分析。荧光的变化,gydF4y2BaΔFgydF4y2Ba/gydF4y2BaFgydF4y2Ba(%),时间常数为单指数拟合,gydF4y2BaτgydF4y2Ba在gydF4y2Ba而且gydF4y2BaτgydF4y2Ba从gydF4y2Ba(无花果。gydF4y2Ba3 bgydF4y2Ba)通过使用ProFit 7.0 (Quantumsoft)进行最小二乘拟合,从平均轨迹(通常是6-8次扫描)确定。单指数拟合提供了对所有轨迹的合理描述,尽管在某些情况下可以看到轻微的慢相。这些慢相通常出现在ON和OFF动力学中,在不同贴片之间变化,可能反映了贴片移液管中的灌注不均匀。使用Excel (Microsoft)和Statistica 13.3 (StatSoft)进行统计分析。所有数据集均呈正态分布(Shapiro-Wilk检验,gydF4y2BapgydF4y2Ba< 0.05)。单向方差分析(gydF4y2BapgydF4y2Ba< 0.05),然后使用Tukey-Kramer事后测试程序来比较多达五种情况(图。gydF4y2Ba3 bgydF4y2Ba).使用Welch 's进行两两比较gydF4y2BatgydF4y2Ba测试(图。gydF4y2BaS15gydF4y2Ba).动力学模型计算(图;gydF4y2BaS14系列gydF4y2Ba)使用ProFit 7.0 (Quantumsoft)执行。gydF4y2Ba
切片培养的制备和转基因的传递gydF4y2Ba
如前所述,在出生后5-7天制备Wistar大鼠的有机型海马切片。简单地说,用组织刀将解剖的海马切成400 μm的薄片,放在多孔膜上(Millicell CM, Millipore)。培养在37°C, 5% COgydF4y2Ba2gydF4y2Ba在含有80% MEM (Sigma M7278), 20%热灭活马血清(Sigma H1138),补充1mm l -谷氨酰胺,0.00125%抗坏血酸,0.01 mg/ml胰岛素,1.44 mM氯化钙的培养基中gydF4y2Ba2gydF4y2Ba, 2 mM MgSOgydF4y2Ba4gydF4y2Ba和13毫米gydF4y2BadgydF4y2Ba葡萄糖。培养基中未添加抗生素。gydF4y2Ba
对于有机型切片中的质粒传递,如前所述,通过在DIV 15和20之间的单细胞电穿孔转染单个CA1锥体细胞gydF4y2Ba48gydF4y2Ba.质粒pAAV-syn-gydF4y2BasDarkengydF4y2Ba, pAAV-syn-H-sDarken和pAAV-syn-LgydF4y2Ba-sDarkengydF4y2Ba均稀释至50 ng/µl, pCI-syn-tdimer2质粒稀释至10 ng/µl。所有质粒在k -葡萄糖酸盐基溶液中稀释,该溶液包括(单位为mM): 135 k -葡萄糖酸盐,10 HEPES, 0.2 EGTA, 4 NagydF4y2Ba2gydF4y2Ba-ATP, 0.4 Na-GTP, 4 MgClgydF4y2Ba2gydF4y2Ba, 3抗坏血酸,10 NagydF4y2Ba2gydF4y2Ba-磷酸肌酸,pH 7.2, 295 mOsm/kg。使用Axoporator 800 A(分子器件)以50 Hz的频率提供25个超极化脉冲(−12 V, 0.5 ms)。在电穿孔过程中,切片保持在预热的(37°C) HEPES缓冲溶液(mM): 145 NaCl, 10 HEPES, 25gydF4y2BadgydF4y2Ba-葡萄糖,2.5 KCl, 1 MgClgydF4y2Ba2gydF4y2Ba和2个CaClgydF4y2Ba2gydF4y2Ba(pH值7.4,无菌过滤)。gydF4y2Ba
对于以病毒载体为基础的有机型海马切片培养转导,编码raav8 - synn - darken的AAV颗粒在视觉引导(斜照明)下使用Picospritzer III (Parker)压力注入(20 PSI/2-2.5 bar, 50 ms持续时间)到DIV 3-5之间的CA1锥体层。切片培养再在培养箱中维持2-3周以允许结构表达。gydF4y2Ba
双光子显微镜在有机型海马切片培养gydF4y2Ba
所有有机型海马切片培养实验均在室温(21 - 23℃)DIV 21 - 23之间进行。将切片浸泡在人工脑脊液(ACSF)中,ACSF由(mM): 135 NaCl, 2.5 KCl, 4 CaCl组成gydF4y2Ba2gydF4y2Ba, 4 MgClgydF4y2Ba2gydF4y2Ba, 10 Na-HEPES, 12.5gydF4y2BadgydF4y2Ba-葡萄糖,1.25 NaHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba(pH 7.4)在定制的双光子成像装置,该装置基于奥林巴斯BX51WI显微镜,由修改版的ScanImage 3.8控制。两个可调谐的脉冲Ti:蓝宝石激光器(MaiTai DeepSee, Spectra Physics)由电光调制器(350-80,Conoptics)控制,调谐到930和1040 nm,分别用于激发Darken(及其变体)和tdimer2。发射光子通过物镜(LUMPLFLN 60XW, ×60, 1.0 NA, Olympus)和通过油浸冷凝器(数值孔径1.4,Olympus)通过光电倍增管(H7422P-40SEL, Hamamatsu)进行检测。使用560 DXCR二向色镜和525/50和607/70发射滤波器(Chroma Technology)分离绿色和红色荧光。激发光被短通滤波器(ET700SP-2P, Chroma)阻挡。gydF4y2Ba
可视化gydF4y2BasDarkegydF4y2Ban荧光变化,盐酸5 -羟色胺(Tocris, UK)在浓度为10µM的浴液中应用gydF4y2BasDarkengydF4y2Ba而且gydF4y2BaH-sDarkengydF4y2Ba200 μ M用于gydF4y2BaL-sDarkengydF4y2Ba.用于事后分析gydF4y2BasDarkengydF4y2Ba我们沿着表达树突和棘的延伸绘制ROI,并测量血清素应用前后获得的最大强度投影图像的荧光值。5 -羟色胺后荧光值除以5 -羟色胺前(基线)荧光值,得到归一化荧光变化值。gydF4y2Ba
的相对变化gydF4y2BasDarkengydF4y2Ba(及其变体)荧光(ΔgydF4y2BaFgydF4y2Ba/gydF4y2BaFgydF4y2Ba0gydF4y2Ba)在实时成像实验中,我们比较了前40帧(1帧= 128 ms)的平均相对荧光值与后40帧的平均相对荧光值(假和+5-HT条件下)。在7.8 Hz下总共获得470帧(128 × 128像素)。我们从细胞体细胞膜和辐射层神经膜的荧光信号中选择了ROIs。在ImageJ中进行分析gydF4y2Ba47gydF4y2Ba.gydF4y2Ba
病毒生产gydF4y2Ba
8血清型腺病毒(AAV8-hSyn-sDarken)在室内产生。hek - t细胞在AAV无辅助系统(Agilent)的帮助下转染,三天后用AAVanced™浓缩试剂(System Biosciences)收集并浓缩病毒。gydF4y2Ba
急性脑切片成像gydF4y2Ba
急性脑切片实验中,C57BL/ 6j小鼠经静脉注射氯胺酮(0,12 mg/g)和木lazin (0,016 mg/kg)深度麻醉后置于立体定向框架中。编码rAAV8-syn-的AAV粒子gydF4y2BasDarkengydF4y2Ba或rAAV8 -gydF4y2BaL-sDarkengydF4y2Ba),用定制的玻璃移液管(AP: 1.7 mm;ML: 0.3 mm;DV:−2.2 mm,−2.0 mm - 1.8 mm)。术后小鼠皮下注射卡泊芬(2 mg/g)镇痛。注射病毒三周后,小鼠被斩首并切除大脑。用振动器(7000 SMZ, Campden Instruments)在含87 mM NaCl、2.5 mM KCl、75 mM蔗糖、1.25 mM NaH的冰冷含氧解剖溶液中切割300 μ m PFC冠状切片gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 25毫米NaHCOgydF4y2Ba3.gydF4y2Ba, 7 mM MgClgydF4y2Ba2gydF4y2Ba, 0.5 CaClgydF4y2Ba2gydF4y2Ba, 20 mM D(+)-葡萄糖,用5% CO起泡gydF4y2Ba2gydF4y2Ba, 95% hgydF4y2Ba2gydF4y2BaO.切片在36°C含氧剥离液中恢复30分钟,并在含有124 mM NaCl、2.5 mM KCl、1.25 mM NaH2PO4、2 mM MgSO的36°C含氧ACSF中孵育1小时gydF4y2Ba4gydF4y2Ba, 26毫米NaHCOgydF4y2Ba3.gydF4y2Ba2.5 mM aclgydF4y2Ba2,gydF4y2Ba10 mM D(+)-葡萄糖,4 mM l -抗坏血酸,用5% CO起泡gydF4y2Ba2,gydF4y2Ba95% HgydF4y2Ba2gydF4y2BaO.随后将切片保存于加氧ACSF中,并在RT中保存至实验开始。gydF4y2Ba
成像切片被转移到一个记录室,连续灌注室内回火含氧ACSF。测量在直立奥林巴斯显微镜下进行,使用×40水浸物镜(LUMPLFLN40xW)。用CMOS相机(Hamatsu)以5 Hz的帧率和0.1 s的曝光时间录制视频。gydF4y2Ba
测量的反应gydF4y2BasDarkengydF4y2Ba使用定制的硼硅酸盐玻璃移液管(哈佛仪器,直径~ 2-4微米)将外源性血清素10 μ M 5-HT施加。成像…的反应gydF4y2BasDarkengydF4y2Ba到内源性血清素释放,使用双极刺激电极电刺激前额皮质内的5-HT终端(Lohmann Research Equipment, Dortmund, Germany)。通过同步大脑软件(德国多特蒙德罗曼研究设备)控制的四通道刺激发生器(STG 4004,多通道系统,Reutlingen,德国)施加750 μ A @40 Hz的刺激脉冲,脉冲数量增加(1,2,5,10,20,40,80,100)。gydF4y2Ba
活体双光子成像gydF4y2Ba
病毒注射颅窗电极植入gydF4y2Ba
病毒注射和植入颅窗和电极小鼠被麻醉并固定在立体定向框架上。体温由啮齿动物加热垫(WPI)控制,眼睛由眼药膏(Bepanthen®,拜耳)保护。应用利多卡因后,颅骨顶部的真皮层呈圆形被切除。使用磷酸(OptiBondgydF4y2BaTMgydF4y2BaFL瓶套件,Kerr),然后用光固化双组分基底(OptiBond)覆盖头骨gydF4y2BaTMgydF4y2BaFL瓶套件,可儿)。用4毫米圆形开颅术暴露PFC,并小心移除硬脑膜。在注射AAV-Syn-sDarken时,病毒被装入装有NanoFil针(NF35BV,世界精密仪器公司)的微升注射器(Hamilton)。将注射器放入大脑的四个位置,将病毒注入PrL (AP + 2.7 mm;ML±0.25 mm;DV−0.3 mm)以及ACC (AP + 1.6 mm;ML±0.25 mm;DV−0.4 mm)。使用四通道微控制器(SYS-Micro4, World Precision Instruments)在每个位置注射250 nl病毒(100 nl/min),并让其扩散5分钟,然后慢慢取出注射器。在完成病毒注射后,开颅术用4毫米的盖片覆盖(厚度为1),并用光固化复合材料(GRADIA®DIRECT Flo, GC Europe)密封。 Following the window implantation, the tip of a bipolar twisted platinum electrode (PlasticOne) was stereotactically placed into the dorsal raphe nucleus (AP −4.7 mm; ML ± 0.0 mm; DV −2.2 mm) and fixed with the light-curable composite. Finally, a metal bar (Luigs and Neumann) for head-fixation was added and the whole skull covered in light-curable composite. After surgery mice were placed in a heating chamber and allowed to wake up. Buprenorphine was administered for 3 days post-surgery.
头部固定小鼠的体内成像gydF4y2Ba
手术后10天,小鼠被处理并习惯了5天的奖励(燕麦牛奶)。接下来,小鼠习惯于线性跑步机(Luigs和Neumann),头固定,并学习在线性跑步机上(360厘米)每圈3个奖励区域(10厘米)与奖励的接收相关联,为期两周。随后,当小鼠在跑步机上自愿运动并在学习奖励区接受奖励时,获得了显示sDarken荧光变化的时间间隔。购买一个定制的Thorlaps双光子显微镜,连接一个钛蓝宝石80 MHz变色龙Ultra II双光子激光器(Coherent, Inc.),并配备一个8 kHz激振谐振扫描仪(LSK。GR08/M, Thorlabs), GaAsP PMT (Thorlabs)和×16水浸物镜(尼康)。每个视场为118.45 μ m × 62.93 μ m,像素为1024 × 512。通过ThorImageLS软件(Thorlabs)以每秒30.3帧的速度进行采集。在第二个成像阶段,在麻醉小鼠中缝背电刺激时,记录了sdarkken荧光的变化。为此,用异氟醚麻醉小鼠,头固定在×20水浸泡物镜下(1.0 N/ a,蔡司)。使用同一定制Thorlaps显微镜以30.3帧/秒的速度获得视场尺寸为121.45 × 60.74 μ m,像素为1024 × 512的时间间隔。在每个成像过程中,使用隔离脉冲刺激器(型号2100,a - m系统)通过先前植入的双极扭曲铂电极,以50 Hz的750µa电流(100µs脉冲1 s)重复电刺激,间隔20秒。gydF4y2Ba
活体成像数据分析gydF4y2Ba
在电刺激和奖励学习任务中获得的数据使用定制的Python脚本进行分析。对数据进行去趋势和过滤后gydF4y2BazgydF4y2Ba-score的计算公式如下:gydF4y2Ba\(=\frac{x-\mu}{\sigma}\)gydF4y2Ba,即gydF4y2BaxgydF4y2Ba是原始荧光,gydF4y2BaµgydF4y2Ba均值和gydF4y2BaσgydF4y2Ba标准差(补充图;gydF4y2Ba肌力gydF4y2Ba).为了分析电刺激,请使用gydF4y2BazgydF4y2Ba对每个时间间隔内单个刺激的得分值取平均值,以生成每个动物的平均值。此外,由单个动物的所有平均值组成的大平均值被生成。为了分析与奖励相关的反应,使用了一只动物的全场荧光。的gydF4y2BazgydF4y2Ba提取11个奖励事件相关时间窗−1.5和+2.5 s(共3.5 s)的-分数荧光并取平均值。为了量化,将平均基线值中值与奖励后平均值中值进行比较。基线值定义为奖励交付前6个数据点的平均值(−0.2到0秒)。增产后的数值定义为+0.5 - +0.7 s的时间窗的平均值。为了分析荧光的速度调制,对每只小鼠的所有与运行速度大于3厘米/秒相关的数据点进行平均,并与运行速度小于3厘米/秒相关的数据点进行比较。这是对所有表现出长时间跑步(至少有一个超过10秒的跑步序列)的小鼠所做的。移动停止被定义为鼠标运行至少4秒的序列,停止运行,然后在4秒内不启动另一个运行序列。对所有表现出长时间跑步的小鼠进行运动停止,然后取平均值。对于衰减分析,使用Python Scikit-Learn包中的MinMaxScaler对运动停止后4秒内的平均荧光进行min-max缩放。对曲线和tau进行二次多项式拟合gydF4y2Ba1/2gydF4y2Ba是确定。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本研究中产生的所有数据均可免费向通讯作者索取。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
所有用于分析的自定义代码均可根据要求提供。gydF4y2Ba
参考文献gydF4y2Ba
Chaurasia, C. S.等。AAPS-FDA研讨会白皮书:微透析原理、应用和监管前景。gydF4y2Ba制药。ResgydF4y2Ba.gydF4y2Ba24gydF4y2Ba, 1014-1025(2007)。gydF4y2Ba
王,Y., DeMarco, E. M., Witzel, L. S. & Keighron, J. D.使用光纤光度法研究神经元电路的最新进展。gydF4y2Ba杂志。物化学。Behav。gydF4y2Ba201gydF4y2Ba, 173113(2021)。gydF4y2Ba
萨巴蒂尼,B. L.和田,L.成像神经递质和神经调质动力学体内遗传编码指标。gydF4y2Ba神经元gydF4y2Ba108gydF4y2Ba, 17-32(2020)。gydF4y2Ba
凯尔,B. M.等。优化快速扫描循环伏安法的时间分辨率。gydF4y2BaACS化学。>。gydF4y2Ba3.gydF4y2Ba, 285-292(2012)。gydF4y2Ba
Petrovic, J., Walsh, P. L., Thornley, K. T., Miller, C. E. & Wightman, R. M.小鼠肾上腺切片中化学物质传输的实时监测。gydF4y2Ba内分泌学gydF4y2Ba151gydF4y2Ba, 1773-1783(2010)。gydF4y2Ba
Takmakov, P., McKinney, C. J., Carelli, R. M. & Wightman, R. M.仪器快速扫描循环伏安法结合电生理学在自由运动动物的行为实验。gydF4y2Ba启科学。Instrum。gydF4y2Ba82gydF4y2Ba, 074302(2011)。gydF4y2Ba
冯,J.等。一种基因编码荧光传感器,用于快速和特异性的体内检测去甲肾上腺素。gydF4y2Ba神经元gydF4y2Ba102gydF4y2Ba745. e8 - 761。e8(2019)。gydF4y2Ba
Patriarchi, T.等。设计基因编码传感器的多巴胺动态超快神经元成像。gydF4y2Ba科学gydF4y2Ba360gydF4y2Ba, eaat4422(2018)。gydF4y2Ba
孙,F.等。一种基因编码的荧光传感器能够快速和特异性地检测苍蝇、鱼和老鼠体内的多巴胺。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba481. e19 - 496。e19(2018)。gydF4y2Ba
Wan, J.等。用来测量血清素动态的基因编码传感器。gydF4y2BaNat。>。gydF4y2Ba24gydF4y2Ba, 746-752(2021)。gydF4y2Ba
马文,J. S.等。谷氨酸神经传递荧光探针的优化。gydF4y2BaNat方法。gydF4y2Ba10gydF4y2Ba, 162-170(2013)。gydF4y2Ba
马文,J. S.等。一种用于GABA体内成像的基因编码荧光传感器。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba, 763-770(2019)。gydF4y2Ba
安格,e.k.等。通过机器学习的选择性和敏感血清素传感器的定向进化。gydF4y2Ba细胞gydF4y2Ba183gydF4y2Ba, 1986 - 2002。e26(2020)。gydF4y2Ba
尼科尔斯,D. E. &尼科尔斯,C. D.血清素受体。gydF4y2Ba化学。牧师。gydF4y2Ba108gydF4y2Ba, 1614-1641(2008)。gydF4y2Ba
陈,t.w。et al。用于成像神经元活动的超灵敏荧光蛋白。gydF4y2Ba自然gydF4y2Ba499gydF4y2Ba, 295-300(2013)。gydF4y2Ba
Ho, B. Y., Karschin, A., Branchek, T., Davidson, N. & Lester, H. A.保守的天门冬氨酸和丝氨酸残基在配体结合和5-HT1A受体功能中的作用:位点定向突变研究。gydF4y2Ba2月。gydF4y2Ba312gydF4y2Ba, 259-262(1992)。gydF4y2Ba
Pedelacq, j。,Cabantous, S., Tran, T., Terwilliger, T. C. & Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein.生物科技Nat。》。gydF4y2Ba24gydF4y2Ba, 79-88(2006)。gydF4y2Ba
St-Pierre, F.等人。用超快荧光电压传感器高保真光学报告神经元电活动。gydF4y2BaNat。>。gydF4y2Ba17gydF4y2Ba, 884-889(2014)。gydF4y2Ba
Pollok, S. & Reiner, A.亚单位选择性iGluR拮抗剂可以通过阻断脱敏增强异体受体反应。gydF4y2Ba美国国家科学院院刊gydF4y2Ba.gydF4y2Ba117gydF4y2Ba, 25851-25858(2020)。gydF4y2Ba
Helassa, N.等人。超快谷氨酸传感器检测Schaffer侧支突触的高频释放。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, 5594-5599(2018)。gydF4y2Ba
谢乐达,P. Puig, M. V. & Artigas, F. 5 -羟色胺对皮层神经元和网络的调节。gydF4y2Ba前面。中国。>。gydF4y2Ba7gydF4y2Ba, 25(2013)。gydF4y2Ba
布宁,M. A. &怀特曼,R. M. 5-羟色胺(5-羟色胺)神经元释放和摄取的定量评估:突触外传导的研究。gydF4y2Baj . >。gydF4y2Ba18gydF4y2Ba, 4854-4860(1998)。gydF4y2Ba
布宁,M. A., Prioleau, C., Mailman, R. B. & Wightman, R. M.大鼠脑中缝背侧和黑质网状释放和摄取5-羟色胺的速率。gydF4y2Baj . Neurochem。gydF4y2Ba70gydF4y2Ba, 1077-1087(1998)。gydF4y2Ba
Green, a.r., Heal, d.j. & Vincent, n.d.单次和重复电休克对大鼠脑皮层切片释放5-羟色胺和去甲肾上腺素的影响。gydF4y2BaBr。j .杂志。gydF4y2Ba92gydF4y2Ba, 25-30(1987)。gydF4y2Ba
Dzubay, J. A. & Jahr, C. E.攀爬纤维-浦肯野细胞突触间隙外突触释放谷氨酸的浓度。gydF4y2Baj . >。gydF4y2Ba19gydF4y2Ba, 5265-5274(1999)。gydF4y2Ba
董,C.等。利用工程生物传感器发现迷幻药物。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 2779 - 2792。e18(2021)。gydF4y2Ba
莫克勒,D. J.等。在意识清醒的大鼠中,电刺激背侧和中位raphé核后海马背侧血清素神经元的释放。gydF4y2Ba海马体gydF4y2Ba8gydF4y2Ba, 262-273(1998)。gydF4y2Ba
Trulson, M. E. & Frederickson, C. J.小鼠大脑切片体外记录中缝背核、中缝中缝和苍白缝中含血清素神经元电生理和药理特性的比较:自身受体的作用。gydF4y2BaBrain Res. Bull。gydF4y2Ba18gydF4y2Ba, 179-190(1987)。gydF4y2Ba
Ren, J.等。解剖学定义和功能独特的中缝背血清素子系统。gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 472 - 487。e20.(2018).gydF4y2Ba
帕奎莱特,g.e.等。情绪突出行为中中缝背核血清素神经元的单细胞活性和网络特性。gydF4y2Ba神经元gydF4y2Bahttps://doi.org/10.1016/j.neuron.2022.05.015gydF4y2Ba(2022)。gydF4y2Ba
穆泽雷,A.,斯考托-洛马塞,S.,伯纳德,J.-F.。,Soiza-Reilly, M. & Gaspar, P. Conditional anterograde tracing reveals distinct targeting of individual serotonin cell groups (B5-B9) to the forebrain and brainstem.大脑结构。功能。gydF4y2Ba221gydF4y2Ba, 535-561(2016)。gydF4y2Ba
Cohen, J. Y., Amoroso, M. W. & Uchida, N.血清素能神经元在多个时间尺度上发出奖励和惩罚信号。gydF4y2BaeLifegydF4y2Ba4gydF4y2Ba, e06346(2015)。gydF4y2Ba
马蒂亚斯,罗特姆,E, Dugué, g.p.和Mainen, Z. f血清素神经元的活动模式与认知灵活性。gydF4y2BaeLifegydF4y2Ba6gydF4y2Ba, 365(2017)。gydF4y2Ba
刘,Z.等。中缝背神经元通过5-HT和谷氨酸发出奖赏信号。gydF4y2Ba神经元gydF4y2Ba81gydF4y2Ba, 1360-1374(2014)。gydF4y2Ba
迪肯,J. F. & Graeff, F. G. 5-HT和防御机制。gydF4y2Baj . Psychopharmacol。gydF4y2Ba5克ydF4y2Ba, 305-315(1991)。gydF4y2Ba
库尔斯,罗伯特,A. C. &罗宾斯,T. W.情绪和行为控制过程的色氨酸能调节。gydF4y2BaCogn趋势。科学。gydF4y2Ba12gydF4y2Ba, 31-40(2008)。gydF4y2Ba
Seo, C.等。强烈的威胁使中缝背血清素神经元进入一种矛盾的运作模式。gydF4y2Ba科学gydF4y2Ba363gydF4y2Ba, 538-542(2019)。gydF4y2Ba
Correia, p.a.等。5 -羟色胺神经元的相位光遗传激活对运动的瞬时抑制和长期促进。gydF4y2BaeLifegydF4y2Ba6gydF4y2Ba, 365(2017)。gydF4y2Ba
Azimi, Z.等。色氨酸能输入对视觉皮层中持续和诱发活动的可分离增益控制。gydF4y2BaeLifegydF4y2Ba9gydF4y2Ba, e53552(2020)。gydF4y2Ba
Jancke, D., Herlitze, S., Kringelbach, M. L. & Deco, G.弥合单一受体类型活动和全脑动力学之间的差距。gydF4y2Ba2月J。gydF4y2Ba289gydF4y2Ba, 2067-2084(2022)。gydF4y2Ba
Lottem, E, Lörincz, M. L. & Mainen, Z. F.中缝背5 -羟色胺神经元的光遗传激活可快速抑制嗅觉皮层中自发而非气味诱发的活动。gydF4y2Baj . >。gydF4y2Ba36gydF4y2Ba, 7-18(2016)。gydF4y2Ba
典狱长,m.r.等。前额叶皮层-脑干神经元投影,控制对行为挑战的反应。gydF4y2Ba自然gydF4y2Ba492gydF4y2Ba, 428-432(2012)。gydF4y2Ba
多巴胺和血清素信号在动机相关行为中的短暂和持续影响。gydF4y2Ba精神病学中国。>。gydF4y2Ba74gydF4y2Ba, 91-98(2020)。gydF4y2Ba
吴志伟,陈志伟,陈志伟。谷氨酸荧光指示物对神经递质扩散和摄取的影响。gydF4y2BaeLifegydF4y2Ba9gydF4y2Ba, e54441(2020)。gydF4y2Ba
Masseck, O. A.等。脊椎动物视蛋白能够持续和高度敏感的快速控制焦虑回路中的Gi/o信号。gydF4y2Ba神经元gydF4y2Ba81gydF4y2Ba, 1263-1273(2014)。gydF4y2Ba
马文,J. S.等。谷氨酸传感器iGluSnFR的稳定性、亲和性和色度变异。gydF4y2BaNat方法。gydF4y2Ba15gydF4y2Ba, 936-939(2018)。gydF4y2Ba
施耐德,C. A.,拉斯班德,W. S.和Eliceiri, K. W. NIH图像到ImageJ: 25年的图像分析。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 671-675(2012)。gydF4y2Ba
韦格特,杰,吉,C. E. & Oertner, T. G.神经元的单细胞电穿孔。gydF4y2Ba冷泉港。ProtocgydF4y2Ba.gydF4y2Bahttps://doi.org/10.1101/pdb.prot094904gydF4y2Ba(2017)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Andy Tinker博士(伦敦大学学院,英国)提供了稳定表达GIRK1和GIRK2亚基的HEK细胞。pAAV.CAG.SF-iGluSnFR。A184V是L. Looger的礼物(Addgene质粒#106199)。我们也感谢Reinhard Seifert(波恩凯撒研究中心基因工程核心设施),他慷慨地提供了CNG通道。cpGFP来自:pN1-GCamp6m XC(添加基因号#111543,存款人:刘晓东)。pAAV.Syn.NES.jRCaMP1a.WPRE。SV40是Douglas Kim & GENIE项目的礼物(Addgene质粒# 100848)。pAAV-Syn-ChrimsonR-tdT是Edward Boyden的礼物(Addgene质粒# 5917)。A.R.由NRW-Rückkehrprogramm和德国研究协会(DFG RE 3101/3-1)资助。o.am是由德国Forschungsgemeinschaft (DFG MA 4692/6-1和- Projektnummer 122679504 - SFB 874)资助。 J.S.W. received funding for this project by the DFG (SPP 1926, WI4485-3/2, FOR2419, WI4485-2/2, and SFB935, B8). M.F. was supported by funding from the European Research Council (ERC-CoG MicroSynCom 865618).
资金gydF4y2Ba
由Projekt DEAL启动和组织的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
O.A.M.构想并监督了这个项目。M.K.开发并优化了所有传感器和变体。M.K.与l.w., s.b., k.r., J. Gerdey, J. Groß, p.g., k.c.c., N.M. sDarken及其HEK细胞和脑切片的变异特征。由s.p., T.Z.和A.R.的监督下进行了外贴测量,A.R.也建立了动力学模型。海马切片培养中的2-光子测量由M.P.进行,并由j.s.w.m. Müller监督,M. Mittag在M.F.的监督下进行体内2-光子实验并进行分析。所有作者对数据分析和手稿的写作都做出了同样的贡献。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人对本工作的同行评审所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
库比施克,M., Müller, M., Wallhorn, L.。gydF4y2Baet al。gydF4y2Ba下一代基因编码的血清素荧光传感器。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 7525(2022)。https://doi.org/10.1038/s41467-022-35200-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-35200-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba