摘要gydF4y2Ba
生物分子组装成凝聚体是细胞内空间组织和许多细胞功能调节的基本过程。绘制和表征生物分子的相行为对于理解凝聚系统的组装机制和开发针对生物分子凝聚系统的治疗策略至关重要。描述相分离系统的一个中心概念是相图。相图通常是从对参数空间的不同部分进行采样的大量单独测量中构建的。然而,即使在微孔板中进行,该过程也很慢,吞吐量低,需要大量的样品消耗。为了解决这一挑战,我们在这里提出了一种组合液滴微流控平台,称为PhaseScan,用于快速和高分辨率获取多维生物分子相图。利用这个平台,我们描述了各种条件下广泛系统的相行为,并证明这种方法可以定量描述小分子对生物分子相变的影响。gydF4y2Ba
简介gydF4y2Ba
许多细胞蛋白质和核酸分子具有分解成稠密的液体冷凝相和缺乏生物分子的稀相的能力gydF4y2Ba1gydF4y2Ba.这种液-液相分离(LLPS)过程已成为描述活细胞中生物冷凝物形成的基本机制gydF4y2Ba2gydF4y2Ba.凝析系统,如应力颗粒,旁斑和核体是由LLPS形成的,并组织和划分细胞空间gydF4y2Ba3.gydF4y2Ba.它们充当生化反应的微反应器gydF4y2Ba4gydF4y2Ba,对基因表达、信号传递和代谢调节等一系列生理过程都至关重要gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.凝缩形成蛋白也与蛋白质错误折叠疾病密切相关,包括运动神经元疾病gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,癌症发病机制gydF4y2Ba11gydF4y2Ba以及传染病gydF4y2Ba12gydF4y2Ba使它们成为治疗干预的有吸引力的目标gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba
相分离,现在已经建立了数百个细胞蛋白质gydF4y2Ba15gydF4y2Ba,可由环境条件的变化引发,如离子强度、pH值、温度、分子拥挤度和小分子的存在gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.考虑到细胞相分离对蛋白质浓度等参数的高度敏感性,在体外分析中考虑冷凝物组分的细胞浓度是很重要的gydF4y2Ba22gydF4y2Ba.由于这种对物理化学参数的敏感性,有很大的潜力以靶向的方式调节蛋白质的相分离,许多相分离蛋白及其复合物作为治疗人类疾病的一类新的药物靶点受到了广泛的关注gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.然而,要以高保真度、准确性和吞吐量来量化LLPS系统中调节相分离行为的物理参数仍然具有挑战性gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
相分离系统的一个中心概念是相图gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.相图通过确定化学空间中相边界的位置,监测相分离区和混合区之间的转变位置,总结了冷凝物的相行为gydF4y2Ba27gydF4y2Ba.随着溶液条件的变化,LLPS系统相边界的变化为驱动蛋白质凝结的热力学过程和调节它们的因素提供了深刻的见解gydF4y2Ba17gydF4y2Ba.然而,考虑到经历LLPS的蛋白质种类繁多,以及调节其行为的环境条件,需要能够快速和高分辨率表征LLPS相图的实验方法。通常,这些是通过时间密集的方法产生的,包括逐步组合试剂,在显微镜观察个别条件之前,在溶液条件中产生必要的变化。值得注意的是,尽管相图经常用于探测LLPS系统的行为,但当手动进行时,这样的实验只能探索有限的条件集和/或提供蛋白质相空间的粗粒度图像gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.gydF4y2Ba
为了应对这一挑战,我们在这里描述了一种液滴微流控方法PhaseScan,该方法能够快速、自动生成不同的LLPS溶液条件,用于蛋白质LLPS行为的高分辨率评估。芯片实验室微流控系统,特别是基于微液滴的形式,为提高生化实验的分析吞吐量、并行化和小型化提供了一种有效的手段。迄今为止,这些平台已被用于探测蛋白质相行为gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba通过浓缩或蒸发含有微孔或微滴的稀释均匀的蛋白质溶液,使系统变得足够浓缩以进入相分离状态。通过浓缩溶液启动相分离意味着盐和缓冲液也被浓缩,这使得在完全生理条件下探测相图或在没有化学或物理维度相互依赖的情况下绘制相图具有挑战性。gydF4y2Ba
我们的目标是通过组合液滴微流体来克服这些挑战,快速生成大量独立的微室,每个微室都可以被视为研究蛋白质LLPS的离散环境。这种方法允许探测的独特条件的数量远远超过替代微流控方法,其中分析成分是被动混合和由流控设备本身划分的。这种格式限制了不同溶液条件的数量,这些条件可以通过可能和实际操作的流体网络的程度和复杂性来分析gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.相比之下,PhaseScan在液滴封装期间以组合方式改变输入溶液条件,允许快速生成任意数量的相分离微环境,以在广泛的化学空间内映射LLPS行为。我们通过获取各种相分离蛋白的相图以及它们由分子拥挤、盐浓度和核酸浓度调节来演示PhaseScan平台的操作。然后,我们研究并比较了小分子对蛋白质相分离的影响。最后,我们展示了三维相图的获取,展示了我们的平台在蛋白质相分离背景下对化学空间进行并行、多维分析的潜力。gydF4y2Ba
结果与讨论gydF4y2Ba
PhaseScan平台工作原理gydF4y2Ba
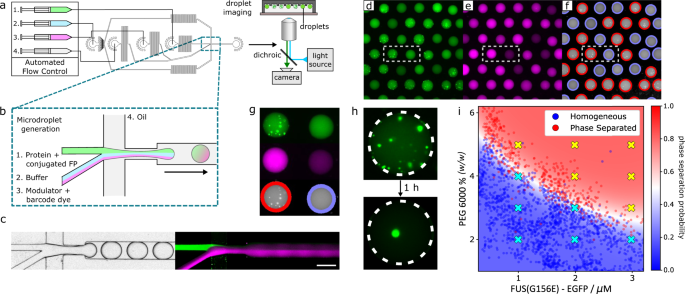
首先,我们实现了微液滴生成和成像的工作流程(图2)。gydF4y2Ba1gydF4y2Ba).作为一个模型系统,我们使用了一种egfp标记的肉瘤融合蛋白突变体G156E (FUS)gydF4y2BaG156EgydF4y2Ba),一种与肌萎缩性侧索硬化症(ALS)病理有关的蛋白质,此前已被证明是相分离的gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.相分离是由聚乙二醇(PEG)分子拥挤引起的,如前所述gydF4y2Ba9gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba液滴由自动注射泵控制的流聚焦微流体装置产生,然后通过荧光显微镜在井中成像。gydF4y2BabgydF4y2Ba在液滴形成的交界处,水溶液在液滴形成前在层流下结合。gydF4y2BacgydF4y2Ba左图为液滴产生的Brightfield显微镜图像,右图为液滴产生的组合荧光图像,显示了FUS的EGFP(绿色)和Alexa647(品红)条形码的荧光gydF4y2BaG156EgydF4y2Ba和PEG。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba被捕获的微液滴的荧光显微镜图像,EGFP和Alexa647荧光对应于FUSgydF4y2BaG156EgydF4y2Ba和PEG浓度。gydF4y2BafgydF4y2Ba根据EGFP荧光分布将液滴分类为相分离(红色轮廓)或均匀(蓝色轮廓)。gydF4y2BaggydF4y2Ba相分离(左)和均匀(右)微滴成像根据EGFP(上)和Alexa647荧光(中)和随后的相分离分类(下)。图像对应于(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba).gydF4y2BahgydF4y2Ba液态凝析液随着时间的推移以微滴的形式合并。gydF4y2Ba我gydF4y2BaEGFP-FUS相图gydF4y2BaG156EgydF4y2Bavs. PEG 6000浓度,50 mM Tris pH 7.4, 150 mM KCl。散点图中的红色和蓝色数据点分别对应于相分离或均匀的单个微液滴。热图对应于相分离的概率,由在液滴散点图上训练的SVM分类器确定。gydF4y2BaNgydF4y2Ba= 2754滴。黄色和青色十字对应相分离和均匀的行为,由人工移液实验确定。源数据作为源数据文件提供。此图的部分内容已得到Geiger等人的许可。gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
含有蛋白质、缓冲液和调制器PEG的水溶液以不同比例在芯片上混合,然后封装在体积约700 pL的油包水微室中,分散在不混溶的氟化油连续相中(图2)。gydF4y2Ba1 bgydF4y2Ba).由于层流作用,液滴形成前水溶液混合不明显gydF4y2Ba36gydF4y2Ba,并且通过添加生物相容的聚甘油基三块表面活性剂来防止液滴的聚结(见方法,液滴生成)。gydF4y2Ba37gydF4y2Ba.通过自动注射泵系统控制程序,改变水溶液的相对流速,同时保持总流速恒定。这使得在一定的化学空间内形成含有蛋白质和聚乙二醇浓度的液滴。为了确定下游分析中每个液滴中存在的蛋白质和聚乙二醇的数量,这些成分的浓度通过特定的荧光团进行条形码编码(图2)。gydF4y2Ba1 b, cgydF4y2Ba).为付gydF4y2BaG156EgydF4y2Ba,该信息由其EGFP标签提供,而PEG浓度则由预混合到PEG起始溶液中的Alexa647染料条形码编码(参见方法,液滴生成)。gydF4y2Ba
随后,液滴被收集在PDMS重力阱装置中,该装置利用液滴密度较低(与周围石油相比)来固定位于流室顶部的微井中的液滴gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.每个实验收集了大约2600个液滴,液滴的生成发生在一个时间尺度上,允许至少两次重复的流动程序,以确保扫描全范围的条件,然后根据每个条形码荧光团的荧光波长进行epifluorescence显微镜成像(图2)。gydF4y2Ba1 d, egydF4y2Ba).根据条形码荧光强度,通过与已知荧光团浓度的校准测量相比较,以每液滴为基础确定相应的蛋白质或聚乙二醇浓度(见补充说明)gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
然后,根据通过蛋白EGFP标签观察到的冷凝物的存在与否,将液滴分为相分离的或均匀的(见补充说明)gydF4y2Ba7gydF4y2Ba和补充图。gydF4y2Ba10gydF4y2Ba).数字gydF4y2Ba1 g fgydF4y2Ba演示了包含EGFP-FUS的相分离的均匀液滴的代表图像的分配gydF4y2BaG156EgydF4y2Ba,红色或蓝色轮廓分别表示相分离或均匀的液滴分类。通常,我们的算法的假阳性和假阴性分类误差之和小于分类液滴总数的4%,尽管这个值略有变化,这取决于所讨论系统的冷凝物荧光的信噪比。gydF4y2Ba
我们观察到凝析物随时间的合并(图。gydF4y2Ba1 hgydF4y2Ba),以及光漂白(FRAP)实验后片外荧光恢复(见补充说明)gydF4y2Ba1gydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba)证实了在PhaseScan实验中形成的冷凝物的液体性质。通过将确定的浓度和相分离的存在或不存在作为每个液滴基础上的散点图,产生了相图(图2)。gydF4y2Ba1我gydF4y2Ba).相边界的位置和相分离的概率作为EGFP-FUS的函数gydF4y2BaG156EgydF4y2Ba然后,通过对相分离或均匀液滴的散点图种群进行训练的支持向量机(SVM)算法确定PEG浓度(图2)。gydF4y2Ba1我gydF4y2Ba,见方法、液滴检测和相图生成)。值得注意的是,只有具有足够吞吐量的技术才允许使用统计方法以这里演示的方式全面和连续地描述相行为。gydF4y2Ba
我们观察到液滴可以根据FUS的浓度稳健地分为相分离区域或均匀区域gydF4y2BaG156EgydF4y2Ba和PEG显示出与以前的研究极好的一致性gydF4y2Ba9gydF4y2Ba.评估FUS的相行为gydF4y2BaG156EgydF4y2Ba液滴封装显著改变,在相同的条件下,相分离的存在或不存在,通过手动移液实验,在大体积中证实是相同的。gydF4y2Ba1我gydF4y2Ba,补充说明gydF4y2Ba2gydF4y2Ba和补充图。gydF4y2Ba2gydF4y2Ba).重要的是,尽管本文描述的相分离系统的特点是使用荧光团标记的蛋白质,但这并不是PhaseScan平台运行的先决条件,因为液滴中冷凝物的存在可以通过亮场显微镜观察到,如其他地方所示gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba33gydF4y2Ba并在补充图中。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
为了测试条形码染料是否影响相边界,研究了FUS的相行为gydF4y2BaG156EgydF4y2Ba被评估为Alexa546和Alexa647染料浓度的函数(见补充注gydF4y2Ba3.gydF4y2Ba和补充图。gydF4y2Ba3.gydF4y2Ba).没有观察到显著的影响,此处使用的条形码浓度(<6 μM,见方法,液滴生成)的相分离倾向保持不变。gydF4y2Ba
相分离体系表现为动态的,凝析液滴在成核后由于生长、聚结和奥斯特瓦尔德成熟而不断演化gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.为了测试这些过程是否影响PhaseScan测量的准确性,生成了三次同质FUS相分离的相图,液滴生成持续进行,但每次重复测量的数据采集间隔为30分钟。重复间的差异可忽略不计(见补充注)gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba4gydF4y2Ba),证明这里描述的PhaseScan协议(滴产生和成像之间的>5分钟)允许液滴产生和测量之间有足够的时间,以准确和可重复地评估平衡相边界位置。这与之前的研究结果一致,即>100 nL液滴内凝聚形成的特征时间尺度小于1分钟gydF4y2Ba41gydF4y2Ba.gydF4y2Ba
我们还研究了液滴大小影响相边界位置的可能性,因为液滴体积有调节成核驱动凝析液增长动态的倾向gydF4y2Ba41gydF4y2Ba.同型FUS的相图gydF4y2BaG156EgydF4y2Ba使用两种不同大小的液滴记录冷凝物,平均体积为0.33和1.1 nL,其中包括PhaseScan实验中使用的典型液滴体积0.65 nL(见补充说明)gydF4y2Ba5gydF4y2Ba和补充图。gydF4y2Ba5gydF4y2Ba).这些相图之间没有观察到差异,加上上述PhaseScan输出中缺乏时间依赖性,表明PhaseScan实验报告了相边界的平衡位置,对液滴体积不敏感。gydF4y2Ba
值得注意的是,就所调查的独特条件的数量而言,PhaseScan技术提供的通量比手动实验高几个数量级,每次实验可分析>2500个液滴。试剂的消耗是最小的,每次实验使用的储备蛋白溶液小于2 μL,尽管我们发现有效的操作最少需要10 μL的工作容量(见方法,液滴生成)。此外,数据生成速度快,液滴生成和收集需要~5分钟。这与基于液滴收缩研究LLPS的微流控方法形成了鲜明对比,后者可能需要几个小时的实验时间。gydF4y2Ba
PhaseScan可推广到一系列相分离系统gydF4y2Ba
在验证了PhaseScan系统的操作之后,我们试图利用我们的平台来研究一系列相分离系统,并测试该方法对同型和异型冷凝系统的通用性。gydF4y2Ba
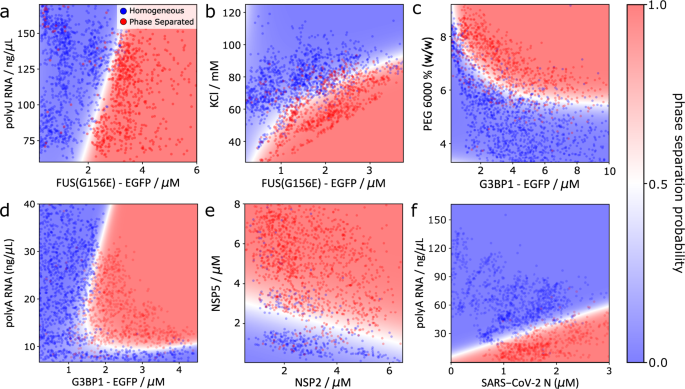
由于核酸凝聚是相分离的核糖核蛋白颗粒的一个决定性特征,我们开始制作egfp标记FUS凝聚的相图gydF4y2BaG156EgydF4y2Ba在polyU RNA存在的情况下(图;gydF4y2Ba2gydF4y2Ba).如前所述gydF4y2Ba42gydF4y2Ba,在低FUS比例下,未检测到相分离gydF4y2BaG156EgydF4y2Ba相对于RNA,相分离然后发生在较高的FUSgydF4y2BaG156EgydF4y2Ba浓度。值得注意的是,相边界看起来高度线性,这与研究表明凝聚形成和蛋白质- rna凝聚是通过电荷中和发生的一致gydF4y2Ba42gydF4y2Ba因此,这种凝结以RNA与蛋白质的离散比例发生。gydF4y2Ba
一个gydF4y2Baegfp标记FUS的相图gydF4y2BaG156EgydF4y2Bavs. polyU RNA浓度。gydF4y2BaNgydF4y2Ba= 2096滴。gydF4y2BabgydF4y2BaFUS相位图gydF4y2BaG156EgydF4y2Ba凝结是蛋白质和盐浓度的函数。gydF4y2BaNgydF4y2Ba= 2625滴。gydF4y2BacgydF4y2Baegfp标记的G3BP1与PEG 6000浓度的相图。gydF4y2BaNgydF4y2Ba= 2549滴。gydF4y2BadgydF4y2BapolyA rna介导的相分离G3BP1的相图。gydF4y2BaNgydF4y2Ba= 3077滴。gydF4y2BaegydF4y2Ba轮状病毒蛋白NSP2和NSP5的凝聚-凝聚相图。gydF4y2BaNgydF4y2Ba= 1672滴。gydF4y2BafgydF4y2BapolyA rna介导的sars - cov - 2n蛋白相分离的相图。gydF4y2BaNgydF4y2Ba= 1599滴。散点图中的红色和蓝色数据点分别对应于相分离或均匀的单个微液滴。热图对应于相分离的概率,由在液滴散点图上训练的SVM分类器确定。源数据作为源数据文件提供。gydF4y2Ba
接下来,我们生成了FUS相分离的相图gydF4y2BaG156EgydF4y2Ba作为KCl浓度的函数(图;gydF4y2Ba2 bgydF4y2Ba).与之前的研究结果一致,FUSgydF4y2BaG156EgydF4y2Ba观察到在高蛋白和低盐浓度下具有相分离的增加倾向。分析离子强度对凝聚体系相分离倾向的影响,可以从机理上深入了解驱动LLPS的分子水平相互作用,例如,通过阐明相分离受静电相互作用的影响程度gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.因此,我们设想相位扫描可以实现相分离过程的快速、高分辨率的机理分析。gydF4y2Ba
为了证明PhaseScan系统对其他相分离蛋白的适用性,我们接下来描述了egfp标记的G3BP1的众筹驱动相分离,G3BP1是形成应力颗粒所需的支架蛋白(图2)。gydF4y2Ba2摄氏度gydF4y2Ba)gydF4y2Ba45gydF4y2Ba.正如预期的那样,G3BP1的相分离存在于高浓度的PEG分子拥挤物中,这种效果在更高的蛋白质浓度下增强。gydF4y2Ba
然后,我们应用PhaseScan分析来研究可重入相行为,这是LLPS领域的一个中心概念。核糖核蛋白凝聚体的形成主要是由蛋白质和RNA之间有利的静电相互作用驱动的。然而,当RNA与蛋白质的比例足够高时,电荷倒置会导致凝聚态解离和重入相转变为均匀的单相状态gydF4y2Ba42gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.在PhaseScan实验中,通过改变G3BP1和polyA RNA的混合比例,我们观察到合成凝聚物冷凝物的重入相行为(图2)。gydF4y2Ba二维gydF4y2Ba).当G3BP1浓度为1.8 μM时,当RNA浓度在7 ~ 40 ng/μL范围内变化时,体系进入和脱离相分离状态。这一观察显示了相位扫描技术的力量,在一次实验中准确地描述了可重入相变。gydF4y2Ba
然后,我们通过研究轮状病毒蛋白NSP2和NSP5的凝结,分析了相分离蛋白-蛋白凝聚体的形成。gydF4y2Ba2 egydF4y2Ba).这些蛋白质是无膜病毒复制工厂(即病毒质)的关键成分;最近的研究表明,LLPS为病毒质构建提供了一种机制gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.与这些发现一致,并支持最近的一项研究,该研究表明NSP2和NSP5在体内和体外都有凝聚gydF4y2Ba12gydF4y2Ba,我们观察到NSP2和NSP5以浓度依赖的方式凝结,发生LLPS所需的NSP5相对于NSP2的NSP2依赖阈值。gydF4y2Ba
最后,我们探讨了人类冠状病毒SARS-CoV-2 (sars - cov - 2n)核衣壳蛋白的相分离(图2)。gydF4y2Ba2 fgydF4y2Ba).根据先前的发现gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,我们以依赖rna的方式观察相分离。当polyA RNA浓度低于25 ng/μL时,通常均匀的sars - cov - 2n蛋白相分离,而当RNA浓度高于65 ng/μL时,无相分离。相边界的确切位置根据sars - cov - 2n浓度的不同而不同,蛋白质浓度越高,相分离需要相应的RNA浓度越高。这些结果与前人通过人工实验发现的sars - cov - 2n的相分离可以由RNA的存在驱动,但过多的核酸浓度会导致冷凝物溶解的研究结果一致gydF4y2Ba50gydF4y2Ba.gydF4y2Ba
总之,这些实验表明,相位扫描方法适用于广泛的冷凝系统。该方法可用于描述全长蛋白质的同源和异型相分离,包括观察蛋白质- rna凝聚物中的重入相分离行为。PhaseScan还可以描述由蛋白质-蛋白质结合物驱动的相分离,以及短肽序列的LLPS,我们通过检查脯氨酸-精氨酸二肽(PR)的相分离来证明这一点。gydF4y2Ba25gydF4y2Ba与polyU RNA(补充图;gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
相分离小分子调制的观察gydF4y2Ba
接下来,我们将我们的平台应用于研究小分子对相分离的影响。人们对识别调节LLPS的化合物非常感兴趣,因为凝结物形成过程与广泛的疾病有关,包括神经退行性疾病和癌症gydF4y2Ba14gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.这项工作的关键是提供高分辨率相图,以准确量化小分子调制器对相分离平衡的影响。此外,为了高通量筛选候选药物,必须快速获得特定药物-蛋白质组合的相图。PhaseScan平台汇集了这些功能,并能够快速自动生成不同的溶液条件,用于蛋白质相行为变化的高分辨率评估。gydF4y2Ba
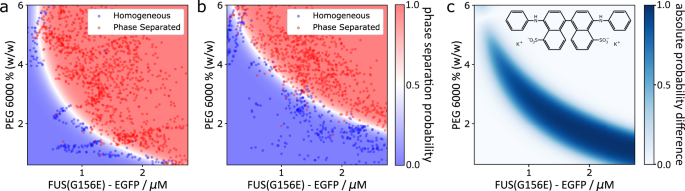
为了建立PhaseScan系统对探测小分子化合物的影响的适用性,我们首先确定了FUS的调制gydF4y2BaG156EgydF4y2Ba通过小分子4,4 ' -二苯胺-1,1 ' -联萘-5,5 ' -二磺酸(bis-ANS)相分离,这种化合物最近被证明是各种相分离蛋白的有效调制器,包括FUS低复杂性结构域gydF4y2Ba53gydF4y2Ba.为此,我们修改了微液滴发生器,以允许在PhaseScan实验中添加第四种溶液成分(补充图)。gydF4y2Ba7gydF4y2Ba),在这种情况下,它包含小分子调制器bisans。除了egfp标记的FUS外,该溶液以恒定的流速注入PhaseScan实验中gydF4y2BaG156EgydF4y2Ba在不同流速下,PEG和缓冲溶液,以实现每个液滴中小分子的等浓度(见方法,液滴生成)。Bis-ANS的浓度为1 mM (1% DMSO),并在芯片上稀释10倍,使液滴的最终浓度为100µM (0.1% DMSO)。作为对照,我们在没有bis-ANS的情况下进行了实验,但在缓冲液中添加了1% DMSO(即液滴中含有0.1% DMSO)。如图所示。gydF4y2Ba3 a, bgydF4y2Ba,在bis-ANS存在的情况下,相边界的位置明显向较低的蛋白质和较低的PEG浓度移动,这与之前在FUS的LCD上的观察结果一致gydF4y2Ba53gydF4y2Ba.由支持向量机导出的热图的微分图量化了相边界的移动(图2)。gydF4y2Ba3 cgydF4y2Ba),从而为定量评估化学调制器对相行为的影响提供了一种手段。gydF4y2Ba
一个gydF4y2Baegfp标记的FUS相图gydF4y2BaG156EgydF4y2Ba与PEG 6000浓度的差异。gydF4y2BaNgydF4y2Ba= 1616滴。gydF4y2BabgydF4y2Baegfp标记的FUS相图gydF4y2BaG156EgydF4y2Ba与PEG 6000浓度的差异。gydF4y2BaNgydF4y2Ba= 2559滴。gydF4y2BacgydF4y2Ba双- ans的分子结构和同型FUS相图±双- ans的微分相图。散点图中的红色和蓝色数据点分别对应于相分离或均匀的单个微液滴。热图对应于相分离的概率,由在液滴散点图上训练的SVM分类器确定。源数据作为源数据文件提供。gydF4y2Ba
总之,PhaseScan方法提供了小分子添加后蛋白质LLPS行为变化的高分辨率评估。这一特征是重要的,因为许多候选分子的影响可能是微妙的,并且从naïve候选小组中识别潜在命中将需要较高的分析分辨率。PhaseScan以最小的样本消耗快速实现这一目标,有望高效扩大高含量文库筛选。gydF4y2Ba
生成多维相图gydF4y2Ba
已经证实,多种环境因素可以触发或调节生物分子相分离。对这些效应的研究通常局限于二维(2D)化学空间的分析,这主要是因为如果手动研究多个参数,则必须进行大量不切实际的单独实验。由于PhaseScan平台能够自动和高通量生成广泛的溶液条件,我们试图扩展平台,使多维化学空间的研究超越传统的二维相图在一个单一的实验。gydF4y2Ba
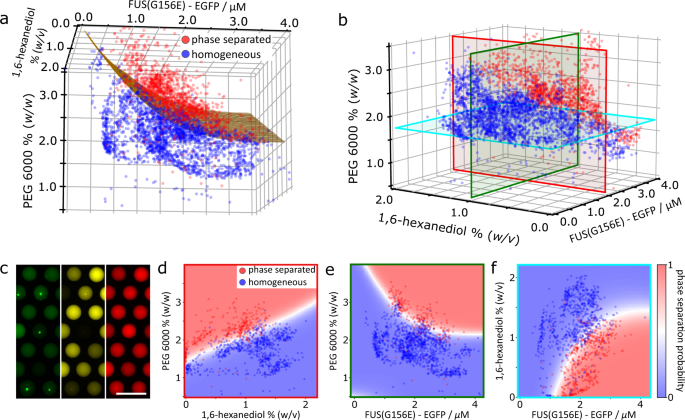
为了证明这一点,我们在FUS上进行了三维(3D)参数空间相位扫描实验gydF4y2BaG156EgydF4y2Ba.我们包括了1,6-己二醇(1,6- hd),这是一种已知能干扰LLPS行为的小分子,已被广泛用于探测凝析体系gydF4y2Ba19gydF4y2Ba.除了egfp标记的FUS之外,它还作为第四种成分添加到PhaseScan混合中gydF4y2BaG156EgydF4y2Ba, PEG和缓冲溶液(补充图。gydF4y2Ba7)gydF4y2Ba.在液滴生成、捕获和成像(约7500个液滴)之后,使用三种条形码各自的相对浓度来确定FUS的浓度gydF4y2BaG156EgydF4y2Ba, PEG和1,6- hd存在于每滴中。这一测量与每个液滴的分类相结合,包含相分离或均匀的蛋白质,以构建系统的三维相图(图2)。gydF4y2Ba4 a、bgydF4y2Ba,辅助电影gydF4y2Ba1gydF4y2Ba).与之前一样,egfp标记FUS的浓度gydF4y2BaG156EgydF4y2Ba分别用EGFP标记和添加Alexa647染料进行条形码,而1,6- hd浓度则通过添加Alexa546进行条形码(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Baegfp标记FUS的三维相图gydF4y2BaG156EgydF4y2BaPEG 6000和1,6- hd浓度。gydF4y2BaNgydF4y2Ba= 3904滴。gydF4y2BacgydF4y2Ba与FUS相对应的EGFP(绿色)、Alexa546(黄色)和Alexa647(红色)荧光捕获微滴的Epifluorescence显微镜图像gydF4y2BaG156EgydF4y2Ba以及1,6- hd和PEG浓度。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba三维相位图的2D切片,轮廓颜色分别对应于(b)所示的红、绿、蓝平面。散点图中的红色和蓝色数据点分别对应于相分离或均匀的单个微液滴。热图对应于相分离的概率,由在液滴散点图上训练的SVM分类器确定。源数据作为源数据文件提供。gydF4y2Ba
正如在前面所示的2D相图中观察到的,并且在3D相图的投影中很明显(图。gydF4y2Ba4 d-fgydF4y2Ba),在高蛋白和PEG浓度下有利于相分离。正如预期的那样,在较高浓度的1,6- hd下,相分离减少了,因为已知1,6- hd通过竞争疏水相互作用来破坏蛋白质冷凝物,而疏水相互作用通常驱动蛋白质LLPS。值得注意的是,分子拥挤和1,6- hd对相分离的拮抗作用作为蛋白质浓度的函数同时可见(图2)。gydF4y2Ba4比gydF4y2Ba).我们提出,在一次实验中评估相分离的多个调制器的能力提供了一种简单的、高分辨率的方法,可以用最小的样品消耗(<6 μL的蛋白质溶液)来研究相分离的机制方面。gydF4y2Ba
生物分子凝聚改变了我们对细胞生物学的理解。因此,控制和调节相分离的参数的物理化学特性对于提高对蛋白质相行为的理解至关重要,包括对LLPS现象的治疗调节。本文提出的PhaseScan平台为通过微液滴技术的应用快速和高分辨率获取LLPS相图提供了基础。我们已经证明,PhaseScan方法适用于广泛的相分离系统,从凝聚多肽,人类蛋白和病毒蛋白,并提供了一个有用的工具,使相分离过程的快速,高分辨率的机制分析。PhaseScan进一步能够提供高分辨率的相图,以精确量化小分子调节剂对相分离平衡的影响,这是药物筛选工作中必不可少的特征。相位扫描允许在单个实验中探索高维化学空间,包括小分子调制的影响,以最小的样品消耗。gydF4y2Ba
我们设想,微流控平台,如这里提出的,可以在LLPS平衡的定量中找到许多应用,例如,筛选候选小分子,用于相分离行为的治疗调节。此外,与上游集成的自动化样品处理微孔板gydF4y2Ba54gydF4y2Ba,可以实现多种药物-蛋白质组合的快速筛选。我们注意到,由于我们在这里使用了相对较低的液滴生成速率(~30 Hz),未来的实验可以通过将高频液滴生成与快速显微镜技术相结合来实现更高的分析吞吐量。这种方法开辟了一条通往高分辨率和高通量探索蛋白质和核酸相行为在丰富的各种条件下。gydF4y2Ba
方法gydF4y2Ba
材料gydF4y2Ba
所有的试剂和化学品都以最高纯度购买。Tris作为缓冲试剂,KCl来自Fisher Scientific。PolyU和PolyA RNA,分子量范围为800-1000 kDa,从Sigma Aldrich购买,为冻干粉。香港理工大学gydF4y2BaOne hundred.gydF4y2BaRNA从Biomers购买,作为冻干粉,在使用前溶解到1mg /mL的mQ水中。1,6- hd从Santa Cruz Biotechnology购买。Bis-ANS从Invitrogen购买,溶解后在DMSO (Sigma Aldrich)中制成原液。Alexa546和Alexa647羧酸从Thermo Fisher获得。peg4000和6000来自Sigma Aldrich。蛋白质生产的细节(FUSgydF4y2BaG156EgydF4y2Ba-EGFP, G3BP1-GFP, NSP2/5, sars - cov - 2n和(PR)gydF4y2Ba25gydF4y2Ba均在gydF4y2Ba补充信息gydF4y2Ba.gydF4y2Ba
滴一代gydF4y2Ba
注射泵(neMESYS模块,Cetoni)用于控制流向微流控装置的蛋白质、缓冲液和相分离触发溶液。将用于蛋白质样品的注射器(Hamilton 1710)和管材(PTFE, 0.012 " ID × 0.030 " OD, col - parmer)预充FC-40油,然后将小工作体积的蛋白质样品(10-20 μL)吸入管材。将3 μM的Alexa647和Alexa 546羧酸溶液分别预混合到相分离触发器和相分离调制器(如果使用)溶液中作为荧光条形码。水流速被配置为根据预编程的流动剖面自动变化,总水流量为60 μL/h,以产生所需的液滴组分浓度。采用含1% w/v氟表面活性剂(RAN Biotechnologies)的FC-40油,恒流量为100 μL/h。产生的液滴通过油管转移到一个单独的微流体装置中,在那里它们被困在浮动液滴阵列中gydF4y2Ba38gydF4y2Ba.在足够的液滴产生时间(5分钟)后,关闭水相流,使用油流将多余的液滴从阵列设备中冲洗出来。在一些实验中,几个液滴捕捉装置按顺序连接以捕获所需数量的液滴。gydF4y2Ba
蛋白的生产gydF4y2Ba
付家gydF4y2BaG156EgydF4y2Ba-EGFP的表达和纯化取自Patel等gydF4y2Ba9gydF4y2Ba.简而言之,利用杆状病毒系统在Sf9昆虫细胞(表达系统,Cat#94-001 F)中进行重组蛋白的生产gydF4y2Ba55gydF4y2Ba.该蛋白由c端EGFP与n端麦芽糖结合蛋白(MBP)标签和c端六聚二糖(HisgydF4y2Ba6gydF4y2Ba)标记。表达MBP-FUS-EGFP的细胞gydF4y2BaG156EgydF4y2Ba他的gydF4y2Ba6gydF4y2Ba感染后72小时采集,离心,然后在50 mM Tris-HCl (pH 7.4), 1 M KCl, 5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,1 mM DTT, 10 mM咪唑,补充无edta蛋白酶抑制剂鸡尾酒组III (Calbiochem)和0.25 U/mL苯并酶(由德累斯顿马克斯普朗克分子细胞生物学和遗传学研究所(MPI-CBG)的蛋白质表达设施提供)。细胞裂解后,使用剪切均质器(微流体),使用镍-硝酸-三乙酸(Ni-NTA)柱(machery - nagel),用固定金属离子亲和层析(IMAC)纯化蛋白质。用裂解液对色谱柱进行清洗。洗脱用50 mM Tris-HCl (pH 7.4), 1 M KCl, 5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,500mm咪唑。他的gydF4y2Ba6gydF4y2Ba用3C-His蛋白解去MBP标签gydF4y2Ba6gydF4y2Ba精密切割蛋白酶(由MPI-CBG的蛋白表达设备提供,德累斯顿)。使用Superdex 200 pg 26/600色谱柱(GE Healthcare),通过尺寸排除色谱(SEC)进一步纯化蛋白质。将含有该蛋白质的等份快速冷冻并在-80°C保存。蛋白质储存在50 mM Tris-HCl (pH 7.4), 500 mM KCl, 1 mM二硫苏糖醇(DTT), 5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油。gydF4y2Ba
G3BP1-GFP的表达和纯化如Guillén-Boixet等所述。gydF4y2Ba45gydF4y2Ba.简单地说,重组HisgydF4y2Ba6gydF4y2Ba-GFP-G3BP1-MBP使用杆状病毒表达系统在昆虫细胞中表达并纯化(表达系统,Cat#94-001 F)gydF4y2Ba55gydF4y2Ba.在含有50 mM Tris-HCl (pH 7.5), 1 M KCl, 2 mM EDTA, 2 mM DTT和1x含EDTA蛋白酶抑制剂鸡尾酒(Roche)的缓冲液中进行裂解(乳化剂- c5, Avestin)后,使用直链淀粉树脂(New England Biolabs)通过亲和层析纯化蛋白质,并通过其MBP标记从细胞裂解液的上清中捕获蛋白质。然后用Ni-NTA树脂(Qiagen)对样品进行IMAC处理。用含20mm咪唑的不含edta的裂解缓冲液清洗色谱柱。蛋白随后用250 mM咪唑从Ni-NTA柱中洗脱。他的gydF4y2Ba6gydF4y2BaMBP标签在4°C的透析步骤中用presision蛋白酶分离。使用HiLoad 16/600 Superdex 200 pg (GE Healthcare)在Akta etan体系上,在50 mM Tris-HCl (pH 7.5), 300 mM KCl, 1 mM DTT缓冲液中进一步纯化该蛋白。将含有该蛋白质的等份快速冷冻并在-80°C保存。gydF4y2Ba
从轮状病毒A(株RF)中产生的NSP2是c端HisgydF4y2Ba6gydF4y2Ba-标记蛋白(NSP2-HisgydF4y2Ba6gydF4y2Ba)在BL21(DE3)gydF4y2Ba大肠杆菌gydF4y2Ba用pET-28b-NSP2结构进行转换,如前所述gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba.在24°C的Luria Bertani (LB)培养基中添加1% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)葡萄糖,一旦达到光密度(ODgydF4y2Ba600gydF4y2Ba),诱导后14 h收获。细胞球在50 mM Tris-HCl (pH 8)、300 mM NaCl中重悬,加入100 μg/mL鸡蛋溶菌酶(Sigma)、0,5% Tween 20和完全蛋白酶抑制剂(Roche), DNAseI处理(10 μg/mL, Roche) 15分钟,然后在15,000 ×离心20分钟澄清裂解液gydF4y2BaggydF4y2Ba4°C。澄清的裂解液装载在5 mL His-Trap HP色谱柱上(GE Healthcare),然后进行洗涤步骤,用0.5 M咪唑、20 mM HEPES-Na (pH 7.5)洗脱。将洗脱后的峰组分合并,用10 mM HEPES-Na (pH 7.5)稀释,并使用CaptoImpRes SP柱通过离子交换色谱(IEX)步骤纯化(GE Healthcare)。在Superdex 200 10 × 300 GL色谱柱(GE Healthcare)上,用25 mM HEPES-Na, pH 7.5, 150 mM NaCl预平衡,用SEC进一步解析洗脱的峰组分。将纯化的蛋白质等分快速冷冻并储存在-80°C下供后续使用。将10 μM NSP2与1 μM Atto488-NTA染料(Sigma)预孵育5分钟,获得纯化的his标记NSP2蛋白。在孵育后,蛋白质立即被使用。gydF4y2Ba
从轮状病毒A(株RF)中重组的NSP5在BL21(DE3)中作为n端链标记蛋白产生gydF4y2Ba大肠杆菌gydF4y2Ba用pET-28b-NSP5结构进行转换,如前所述gydF4y2Ba12gydF4y2Ba.用1 mM IPTG诱导培养(LB培养基中含NSP2),在37℃下表达6 h。对NSP2进行如上所述的酶解后,在变性条件下纯化蛋白,然后进行如上所述的再折叠gydF4y2Ba58gydF4y2Ba.简单地说,将洗涤过的包涵体溶解在6m盐酸胍中,然后对含有蛋白质的部分进行逐级透析后的复折叠方案。重新折叠后,含nsp5的组分使用CaptoQ ImpRes色谱柱通过IEX进一步纯化(GE Healthcare)。在Superdex 200 10 × 300色谱柱(GE Healthcare)上使用SEC进一步解析集中的峰分数。将纯化后的蛋白质组分混合,用液氮进行alialib和速冻,并在-80°C保存以备后续使用。gydF4y2Ba
在SARS-CoV-2核衣壳(N)蛋白纯化中,用pOCC102-His制备杆状病毒gydF4y2Ba6gydF4y2Ba- mbp - 3c -核衣壳构建,如前所述利用FlexiBAC方法。N编码序列来源于SARS-CoV-2谱系B (GenBank: MN908947.3)gydF4y2Ba59gydF4y2Ba然后对昆虫细胞表达进行密码子优化。然后将杆状病毒与内部Sf9昆虫细胞表达系统(由蛋白质表达设备MPI-CBG提供)结合使用。gydF4y2Ba55gydF4y2Ba.简单地说,0.5 L Sf9细胞(~10gydF4y2Ba6gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba)感染2% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)杆状病毒上清液,随后在27°C和85 rpm条件下培养72 h。300 ×离心获得细胞微球gydF4y2BaggydF4y2Ba5分钟,常规在液氮中闪冻,然后在-80°C保存。对于细胞裂解,Sf9颗粒解冻并重悬于50 mL冷裂解缓冲液(1 M NaCl, 50 mM NagydF4y2BaxgydF4y2BaHgydF4y2BaxgydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 20mm咪唑,5% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,4 mM MgClgydF4y2Ba2gydF4y2Ba, 1 mM DTT, 1×完全蛋白酶抑制剂,1 U mLgydF4y2Ba1gydF4y2BaDNase I, pH 7.4)并通过LM20微流态器(15,000 psi, 4°C)。超离心(70000 ×gydF4y2BaggydF4y2Ba, 4°C, 30 min),获得的上清液通过0.45 μ m过滤器,并在室温下在ÄKTA纯25 m色谱系统(Cytiva)上进行三步FPLC纯化。过滤后的细胞裂解液首先通过,在5 mL mingydF4y2Ba−1gydF4y2Ba,通过NigydF4y2Ba2+gydF4y2Ba预平衡5ml HisTrap HP柱(Cytiva)的NTA树脂。接着用40 mL咪唑洗涤缓冲液(150 mM NaCl, 50 mM Na)进行洗涤gydF4y2BaxgydF4y2BaHgydF4y2BaxgydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 20mm咪唑,5% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,pH 7.4),咪唑梯度洗脱超过50 mL,达到300 mM咪唑,在其他相同的缓冲条件下。在整个过程中收集1.5 mL的部分,并对在280 nm处吸收强度高的部分进行SDS聚丙烯酰胺电泳分析,随后将其合并。浓缩后,加入400 mM NaCl, 150 mM Arg-HCl (pH 7.4)和300 mM海藻糖以防止聚集,通过反复离心(4000 ×gydF4y2BaggydF4y2Ba, 25°C, 3 min),在30 kDa截止过滤柱中至~5 mL,用500µg 3c蛋白酶消化纯化的蛋白质(内部纯化;蛋白纯化设备MPI-CBG),在0.5 mM DTT的存在下,在25°C下超过1小时,以去除MBP溶解性标签。在将反应混合物稀释至最终NaCl浓度~150 mM时,将蛋白质通过预平衡的5 mL HiTrap Heparin HP色谱柱(Cytiva)的肝素偶联树脂。接下来是用40 mL肝素洗涤缓冲液(150 mM NaCl, 50 mM Na)的洗涤步骤gydF4y2BaxgydF4y2BaHgydF4y2BaxgydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 5% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,pH 7.4)和超过50 mL的高盐梯度洗脱,最终达到1 M NaCl和pH 7.4,在其他类似的缓冲条件下。假设蛋白质含量高的部分再次进行分析,随后进行汇总。再加入700 mM NaCl, 150 mM Arg-HCl (pH 7.4)和300 mM海藻糖以防止聚集,并通过反复离心(4000 ×gydF4y2BaggydF4y2Ba, 25°C, 3分钟)在一个30 kDa截止过滤柱~2毫升。然后将浓缩液通过0.2 μ m自旋过滤器,以0.5 mL min的降低流速通过SEC分解gydF4y2Ba−1gydF4y2Ba增加10/300 GL色谱柱(~24 mL色谱柱体积;Cytiva),在SEC缓冲液(50 mM NagydF4y2BaxgydF4y2BaHgydF4y2BaxgydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 300mm NaCl, 5% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)甘油,1mm DTT, pH 7.4),这也构成了最终的储存缓冲液。在SEC之后,分析和混合的馏分再次浓缩,如上所述,在这种情况下为~200µL。使用ND-1000分光光度计(Thermo Scientific)在280 nm处测定蛋白质浓度(摩尔消光系数ε ~43,900 M)gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba基于260 ~ 280 nm的吸收比(得到的值为~0.56;比值≥0.7表示核酸污染)。随后制备5 μ L等分,在液氮中快速冷冻,并在-80°C保存。gydF4y2Ba
(公关)gydF4y2Ba25gydF4y2Ba该肽含有25个脯氨酸-精氨酸重复序列。n端标记的PR25是通过与胺反应性的AlexaFluor546 (Sigma Aldrich)反应得到的。(PR)gydF4y2Ba25gydF4y2Ba实验使用10%标记肽和90%未标记肽的混合物进行。gydF4y2Ba
器件设计与制造gydF4y2Ba
用于液滴生成的PDMS(康宁)设备和用于液滴收集和成像的多层井设备是在SU-8 (Microchem)模具上生产的,该模具通过前面描述的光刻工艺制造gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba.该设备的设计是用AutoCAD (AutoDesk)绘制的,然后打印在掩模(微光刻)上。面膜的图案是通过紫外线曝光而转移的gydF4y2Ba63gydF4y2Ba到抛光硅片上涂有50微米厚的SU8-3050光刻胶层(Microchem)。使用丙二醇甲基醚乙酸酯(PGMEA;σ)。采用氮气吹干和95°C烘烤的方法对SU-8型晶片(即母片)进行干燥。master被放置在一个塑料培养皿中,作为聚二甲基硅氧烷(PDMS;Sylgard184,道康宁)铸造。将PDMS碱和交联剂以10:1的比例混合,在60°C下烘烤2小时聚合。用手术刀从培养皿中切下PDMS装置,在乙醇浴中超声清洗15分钟。PDMS复制品和玻片均在氧等离子炉(30秒,40%功率,Femto, Diener Electronics)中激活,然后进行粘接。用1% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)三氯(1H,1H,2H,2H-全氟辛基)硅烷(Sigma)在HFE-7500 (fluorchem)中浸泡1分钟,然后用氮气干燥,在95°C的热板上加热10分钟。gydF4y2Ba
成像gydF4y2Ba
捕获的微滴使用AxioObserver D1显微镜(蔡司),配备5×空气物镜(蔡司)和高灵敏度相机(Evolve 512, Photometrics, Metamorph 6.3图像采集软件)成像,除图中的数据外。gydF4y2Ba二维gydF4y2Ba这是通过对流动下的液滴进行成像获得的,使用配备了用于同时多波长成像的二向色滤波器的显微镜。使用适当的滤波器组进行EFGP、Alexa Fluor 546和Alexa Fluor 647检测(分别为Chroma Technology 49002、49004和49006)。荧光通道之间最小的串扰被观察到,在图像处理和校准过程中被消除(见补充说明)gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
液滴检测和相图生成gydF4y2Ba
使用定制编写的Python脚本(Python版本3.8,SVM算法是scikit-learn Python库的一个组件)分析获取的图像。代表性数据和其他详细信息提供在gydF4y2Ba补充信息gydF4y2Ba(补充无花果。gydF4y2Ba9gydF4y2Ba而且gydF4y2Ba10gydF4y2Ba).简单地说,液滴在图像中被拟合成圆圈。非圆形液滴或错误检测被过滤并去除。从拟合的圆形区域,计算总强度并归一化以获得单位体积的强度(使用拟合的直径计算),并通过与已知条形码浓度获得的校准图像进行比较转换为浓度(参见补充说明)gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba9gydF4y2Ba).液滴被分类为相分离或均匀,根据存在或不存在至少三个连接像素的强度高于算法定义的阈值强度。代表性的分类输出显示在补充图中。gydF4y2Ba10gydF4y2Ba.液滴分类和条形码浓度然后结合在每个液滴的基础上产生相图。然后在液滴数据集上训练支持向量机算法,以在相关相空间上产生相分离的概率图。gydF4y2Ba
统计和再现性gydF4y2Ba
每个相图的样本量为>1500个液滴。通过自举分析,此样本量导致两次采样重复生成SVM相位图的差异<3%(见补充说明)gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba4gydF4y2Ba).在对捕获的微液滴进行图像分析时,由于液滴重叠或接触,数据被排除在外,导致无法对液滴进行定量分析。此过程的示例显示在补充图中。gydF4y2Ba10gydF4y2Ba.在实验和结果评估期间,研究人员并没有对分配盲目。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本文提供了源数据,并可在FigShare存储库中获得,登录代码为10.6084/m9.figshare.21405129。gydF4y2Ba
代码的可用性gydF4y2Ba
为研究开发的自定义Python脚本可在GitHub上获得gydF4y2Bahttps://github.com/rqi14/PhaseScangydF4y2Ba
参考文献gydF4y2Ba
Boeynaems, s等。蛋白质相分离:细胞生物学的一个新阶段。gydF4y2Ba细胞生物学趋势。gydF4y2Ba28gydF4y2Ba, 420-435(2018)。gydF4y2Ba
海曼,A. A.,韦伯,C. A. & Jülicher, F.生物学中的液-液相分离。gydF4y2Ba细胞发育生物学年鉴。gydF4y2Ba30.gydF4y2Ba, 39-58(2014)。gydF4y2Ba
陈志伟,陈志伟,陈志伟。液相凝结在细胞生理和疾病中的应用。gydF4y2Ba科学gydF4y2Ba.gydF4y2Ba357gydF4y2Ba, 6357 (2017)gydF4y2Ba
巴纳尼,S. F.,李,H. O.,海曼,A. A. &罗森,M. K.生物分子凝聚:细胞生物化学的组织者。gydF4y2Ba细胞生物学。gydF4y2Ba18gydF4y2Ba, 285-298(2017)。gydF4y2Ba
Sokolova, E.等。通过凝聚细胞裂解液形成的无膜原细胞的转录率增强。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 11692-11697(2013)。gydF4y2Ba
金,t.h.等人。FMRP和CAPRIN1的磷酸化依赖相分离概述了翻译和去乙酰化的调控。gydF4y2Ba科学gydF4y2Ba365gydF4y2Ba, 825-829(2019)。gydF4y2Ba
Riback, J. A.等。应力触发的相分离是一种适应性的、进化调谐的反应。gydF4y2Ba细胞gydF4y2Ba168gydF4y2Ba, 1028 - 1040。e19(2017)。gydF4y2Ba
Boeynaems, s等。C9orf72二肽重复序列的相分离扰动了应激颗粒动力学。gydF4y2Ba摩尔。细胞gydF4y2Ba65gydF4y2Ba1044 - 1055. - e5(2017)。gydF4y2Ba
帕特尔等人。疾病突变加速了ALS蛋白FUS的液固相变。gydF4y2Ba细胞gydF4y2Ba162gydF4y2Ba, 1066-1077(2015)。gydF4y2Ba
村上,T.等。ALS/FTD突变诱导FUS液滴和可逆水凝胶向不可逆水凝胶的相变损害了RNP颗粒的功能。gydF4y2Ba神经元gydF4y2Ba88gydF4y2Ba, 678 - 690(2015)。gydF4y2Ba
布沙尔,J. J.等。肿瘤抑制因子SPOP的癌症突变会破坏活性、相分离区室的形成。gydF4y2Ba摩尔。细胞gydF4y2Ba72gydF4y2Ba, 19-36。e8(2018).
盖革,F.等人。液-液相分离是轮状病毒复制工厂形成的基础。gydF4y2BaEMBO J。gydF4y2Bahttps://doi.org/10.15252/EMBJ.2021107711gydF4y2Ba(2021)。gydF4y2Ba
生物分子凝聚物激起了药物发现的好奇心。gydF4y2BaNat. Rev.药物发现gydF4y2Bahttps://doi.org/10.1038/d41573-019-00069-wgydF4y2Ba(2019)。gydF4y2Ba
惠勒,R. J.等。在治疗神经退行性疾病中调节蛋白质驱动的液-液相分离的小分子。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/721001gydF4y2Ba(2019)。gydF4y2Ba
李,Q.等。LLPSDB:体外液-液相分离蛋白质数据库。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, d320-d327(2020)。gydF4y2Ba
Alberti, S., Gladfelter, A. & Mittag, T.研究液-液相分离和生物分子凝聚的考虑和挑战。gydF4y2Ba细胞gydF4y2Ba176gydF4y2Ba, 419-434(2019)。gydF4y2Ba
Riback, J. A.等。细胞内相分离的成分依赖热力学。gydF4y2Ba自然gydF4y2Bahttps://doi.org/10.1038/s41586-020-2256-2gydF4y2Ba(2020)。gydF4y2Ba
Braun, m.k.等人。多价盐诱导蛋白质溶液中的重入相行为:阴离子Cl -与no3 -的强烈作用。gydF4y2Ba期刊。化学。BgydF4y2Ba122gydF4y2Ba, 11978-11985(2018)。gydF4y2Ba
Kroschwald, S., Maharana, S. & Simon, a .己二醇:一种用于研究无膜隔室材料特性的化学探针。gydF4y2Ba重要的gydF4y2Bahttps://doi.org/10.19185/matters.201702000010gydF4y2Ba(2017)。gydF4y2Ba
诺特,T. J.,克雷格斯,T. D. &鲍德温,A. J.无膜细胞器可以熔化核酸双工,并作为生物分子过滤器。gydF4y2BaNat,化学。gydF4y2Ba8gydF4y2Ba, 569-575(2016)。gydF4y2Ba
诺特,T. J.等。无序nuage蛋白的相变产生对环境敏感的无膜细胞器。gydF4y2Ba摩尔。细胞gydF4y2Ba57gydF4y2Ba, 936-947(2015)。gydF4y2Ba
Farahi, N., Lazar, T., Wodak, S. J., Tompa, P. & Pancsa, R.从液-液相分离数据库整合数据突出了LLPS驱动剂的浓度和剂量敏感性。gydF4y2BaInt。理学。gydF4y2Ba22gydF4y2Ba, 3017(2021)。gydF4y2Ba
治疗学——如何治疗相分离相关疾病。gydF4y2Ba紧急情况。上面。生命科学。gydF4y2Bahttps://doi.org/10.1042/ETLS20190176gydF4y2Ba(2020)。gydF4y2Ba
艾伯提,S. & Dormann, D.疾病中的液-液相分离。gydF4y2Ba为基础。启麝猫。gydF4y2Ba53gydF4y2Ba, 171-194(2019)。gydF4y2Ba
克拉姆瑟,J. U., Kapfer, S. C. & Krauth, W.二维活性物质的热力学相。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 5045(2018)。gydF4y2Ba
布拉查,D.等人。利用光寡聚种子在活细胞中绘制局部和全局液相行为。gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 1467 - 1480。e13(2018)。gydF4y2Ba
Brangwynne, C. P., Tompa, P. & Pappu, R. V.胞内相变的聚合物物理。gydF4y2BaNat。物理。gydF4y2Ba11gydF4y2Ba, 899-904(2015)。gydF4y2Ba
Yang, P.等。G3BP1是一个可调开关,触发相分离来组装应力颗粒。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba325 - 345. - e28(2020)。gydF4y2Ba
佩斯基特,T. R.等人。病理性亨廷顿外显子1聚集背后的液相到固相转变。gydF4y2Ba摩尔。细胞gydF4y2Ba70gydF4y2Ba, 588-58(2018)。gydF4y2Ba
柯普,m.r.g.等。微流控收缩液滴浓缩器,用于蛋白质溶液的分析物检测和相分离。gydF4y2Ba分析的化学。gydF4y2Ba92gydF4y2Ba, 5803-5812(2020)。gydF4y2Ba
泰勒,N.等。利用微流体技术对基于细胞器的RNA/蛋白质液相进行生物物理表征。gydF4y2Ba软物质gydF4y2Ba12gydF4y2Ba, 9142-9150(2016)。gydF4y2Ba
Celetti, G.等人。fg -核孔蛋白的液态模拟核孔复合物的渗透屏障特性。gydF4y2BaJ.细胞生物学。gydF4y2Bahttps://doi.org/10.1083/jcb.201907157gydF4y2Ba(2020)。gydF4y2Ba
布雷默,A.米塔格,T. &海曼,M.大分子液-液相分离的微流控表征。gydF4y2Ba芯片实验室gydF4y2Ba20.gydF4y2Ba, 4225-4234(2020)。gydF4y2Ba
selimoviic, E., Gobeaux, F. & Fraden, S.使用微流体绘制和操作温度-浓度相图。gydF4y2Ba芯片实验室gydF4y2Ba10gydF4y2Ba, 1696-1699(2010)。gydF4y2Ba
Li, P.等。用微流体快速测定生物分子液-液相分离的相图。gydF4y2Ba分析的化学。gydF4y2Ba94gydF4y2Ba, 687-694(2022)。gydF4y2Ba
宋,H., Tice, J. D. & Ismagilov, r.f.微流体系统控制反应网络的时间。gydF4y2BaAngew。化学。Int。艾德。gydF4y2Bahttps://doi.org/10.1002/anie.200390203gydF4y2Ba(2003)。gydF4y2Ba
格雷斯蒂,J. J.等。滴基微流体定向进化的超高通量筛选。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 4004-4009(2010)。gydF4y2Ba
Labanieh, L., Nguyen, T. N., Zhao, W. & Kang, D. K.浮动液滴阵列:用于液滴捕获、实时分析和回收的超高通量设备。gydF4y2Ba机器gydF4y2Ba6gydF4y2Ba, 1469-1482(2015)。gydF4y2Ba
Sagui, C., Stinson O 'gorman, D. & Grant, M.相分离系统中的成核,生长和粗化。gydF4y2Ba扫描Microsc。gydF4y2Ba12gydF4y2Ba, 3-8(1998)。gydF4y2Ba
马奎西,J. A. &罗斯。相变动力学:奥斯特瓦尔德成熟理论。gydF4y2Baj .化学。理论物理。gydF4y2Ba79gydF4y2Ba, 4710(1983)。gydF4y2Ba
Linsenmeier, M.等人。微流体液滴中合成无膜细胞器的动力学研究。gydF4y2BaAngew。化学。Int。艾德。gydF4y2Ba58gydF4y2Ba, 14489-14494(2019)。gydF4y2Ba
Banerjee, P. R., Milin, A. N., Moosa, M. M., Onuchic, P. L. & Deniz, A. A.可重入相变驱动核糖核蛋白液滴动态亚结构形成。gydF4y2BaAngew。化学。Int。艾德。gydF4y2Ba56gydF4y2Ba, 11354-11359(2017)。gydF4y2Ba
Krainer, G.等人。蛋白质的重入液体冷凝相通过疏水和非离子相互作用得以稳定。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 1-14(2021)。gydF4y2Ba
王,J.等。一种控制朊病毒样RNA结合蛋白相分离驱动力的分子语法。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 688 - 699。e16(2018).
Guillén-Boixet, J.等。rna诱导的G3BP构象切换和聚类通过凝聚驱动应力颗粒组装。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 346 - 361。e17(2020)。gydF4y2Ba
波兹,B. &肖特,J.通过重入相变的生化计时。gydF4y2BaJ. Mol.生物学。gydF4y2Ba433gydF4y2Ba, 166794(2021)。gydF4y2Ba
尼科利奇,J.等。内格里体是具有液体细胞器特性的病毒工厂。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 1-12(2017)。gydF4y2Ba
Guseva, S.等人。麻疹病毒的核蛋白和磷酸蛋白形成类似液体的相分离腔室,促进核衣壳组装。gydF4y2Ba科学。睡觉。gydF4y2Ba6gydF4y2Ba, eaaz7095(2020)。gydF4y2Ba
Perdikari, t.m.等人。SARS - CoV - 2核衣壳蛋白相‐与RNA和人hnRNPs分离。gydF4y2BaEMBO J。gydF4y2Ba39gydF4y2Ba, e106478(2020)。gydF4y2Ba
Lu, S.等。SARS-CoV-2核衣壳磷蛋白与RNA和膜相关的M蛋白形成互斥冷凝物。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 502(2021)。gydF4y2Ba
制药初创公司围绕凝析油进行联合。gydF4y2Ba生物科技Nat。》。gydF4y2Ba39gydF4y2Ba, 123-125(2021)。gydF4y2Ba
克莱因,i.a.等。核凝析液中癌症疗法的划分。gydF4y2Ba科学(1979)gydF4y2Ba368gydF4y2Ba, 1386-1392(2020)。gydF4y2Ba
巴宾查克,W. M.等人。小分子作为蛋白质液-液相分离的有效双相调节剂。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 5574(2020)。gydF4y2Ba
朗威尔,s.a. & Fordyce, p.m. MicrIO:一种用于自动化微流体输入输出的开源自动采样器和分数收集器。gydF4y2Ba芯片实验室gydF4y2Ba20.gydF4y2Ba, 93-106(2020)。gydF4y2Ba
Lemaitre, R. P., Bogdanova, A., Borgonovo, B., Woodruff, J. B. & Drechsel, D. N. FlexiBAC:一种用于蛋白质表达、分泌和蛋白水解处理的多功能、开源杆状病毒载体系统。gydF4y2Ba生物科技BMC》。gydF4y2Ba19gydF4y2Ba, 1-11(2019)。gydF4y2Ba
Borodavka, A., Dykeman, E. C., Schrimpf, W. & Lamb, d.c. .蛋白质介导的RNA折叠控制轮状病毒基因组片段之间的序列特异性相互作用。gydF4y2BaElifegydF4y2Ba6gydF4y2Ba,(2017)。gydF4y2Ba
好极了,J. P. K.等。轮状病毒RNA伴侣置换和RNA退火的结构基础。gydF4y2Ba国家科学院学报美国gydF4y2Ba118gydF4y2Ba, 1-10(2021)。gydF4y2Ba
Martin, D., Ouldali, M., Ménétrey, J. & Poncet, D.轮状病毒非结构蛋白NSP5的结构组织。gydF4y2BaJ. Mol.生物学。gydF4y2Ba413gydF4y2Ba, 209-221(2011)。gydF4y2Ba
吴,F.等。中国与人类呼吸道疾病相关的新型冠状病毒。gydF4y2Ba自然gydF4y2Ba579gydF4y2Ba, 265-269(2020)。gydF4y2Ba
麦克唐纳,J. C.等。聚二甲基硅氧烷微流体系统的制备。gydF4y2Ba电泳gydF4y2Ba21gydF4y2Ba, 27-40(2000)。gydF4y2Ba
阿特,W. E.等。基于无酶DNA电路的数字传感与分子计算。gydF4y2BaACS NanogydF4y2Bahttps://doi.org/10.1021/acsnano.0c00628gydF4y2Ba(2020)。gydF4y2Ba
马祖蒂斯,L.等人。使用液滴微流体进行单细胞分析和分选。gydF4y2BaProtoc Nat。gydF4y2Ba8gydF4y2Ba, 870-891(2013)。gydF4y2Ba
查拉,P. K., Kartanas, T., Charmet, J. & Knowles, T. P. J.使用快速晶圆规模led光刻模式制造的微流控器件。gydF4y2BaBiomicrofluidicsgydF4y2Ba11gydF4y2Ba, 014113(2017)。gydF4y2Ba
确认gydF4y2Ba
导致这些结果的研究获得了来自EPSRC(奖励RG90413, W.E.A.)、罗亚尔奖学金(N.A.E.)、克里希南-昂奖学金(R.Q.)、三一学院(剑桥荣誉三一-亨利·巴洛奖学金;剑桥信托基金(荣誉国际奖学金;R.Q.),欧洲研究委员会在欧盟地平线2020框架计划下通过Marie skodowska - curie资助MicroSPARK(协议编号:841466;G.K.)、剑桥大学赫切尔·史密斯基金(G.K.)、沃尔夫森学院青年研究奖学金(G.K.)、美国温斯顿·丘吉尔基金会(T.J.W.)、哈丁杰出研究生奖学金计划(T.J.W.)、惠康信托基金亨利·惠康奖学金218651/Z/19/Z (J.N.A)、惠康信托基金[213437/Z/18/Z] (A.B.)、加拿大卫生研究所(基金会赠款和加拿大老年神经退行性疾病联合会赠款)(P.StGH.)、美国阿尔茨海默病协会Zenith Grant ZEN-18-529769 (P.St.G.-H.),安大略省阿尔茨海默病研究主席(P.St.G.-H.),惠康信托合作奖203249/Z/16/Z (P.St.G.-H.)根据欧盟第七框架计划(FP7/2007-2013),欧洲研究委员会通过ERC授予PhysProt(协议编号:T.P.J.K.)。337969;以及弗朗西斯和奥古斯都纽曼基金会(T.P.J.K.)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
W.E.A, G.K.和T.P.J.K.构思了这项研究。W.E.A N.A.E。,R.Q K.D, T.J.W J.A。j . .。y . x进行实验。R.Q.和w.e.a开发了分析工具。T.M.F J.G.-B。,A.B., D.K., S.A. and P.St.G.-H. provided materials. W.E.A. and G.K. wrote the original draft, all authors reviewed and edited the paper.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
这项工作中有关微液滴中相分离大分子的封装和分析的部分已经由剑桥企业有限公司提交的专利出版物(申请号GB2021051243W,出版物号WO2021234410A1)的主题,剑桥大学的全资子公司,W.E.A, g.k., t.j.w., R.Q.和T.P.J.K.是发明者。T.P.J.K.和p.s.g.h。是创始人,w.e.a., g.k.t.j.w.和R.Q.是过渡生物有限公司的顾问和/或员工。其余作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Peter Tompa和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Arter, w.e., Qi, R., Erkamp, N.A.gydF4y2Baet al。gydF4y2Ba生物分子凝聚相图与组合微滴平台。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba7845(2022)。https://doi.org/10.1038/s41467-022-35265-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-35265-7gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba