摘要gydF4y2Ba
宽视场荧光成像是研究大规模生物动力学不可缺少的工具。有限的空间带宽积和强烈的光扩散使得传统的实现方法无法在三维上高分辨率地映射荧光生物分布。我们介绍了一种基于光学散光结合荧光源定位的体积宽视场荧光显微镜,覆盖5.6×5.6×0.6 mmgydF4y2Ba3.gydF4y2Ba体积成像。提出了两种备选配置,利用多焦点照明或点发射器的稀疏定位,在此无缝集成在一个系统中。我们展示了小鼠皮质微循环在毛细管分辨率下的实时体积测绘,而不使用颅窗,从而同时传递两个大脑半球的定量灌注信息。进一步研究急性缺血性卒中后脑血管网络的形态和功能变化,从而在亚秒尺度上观察并发侧支募集事件。因此,报道的技术为跨尺度生物动力学的非或微创成像提供了丰富的无与伦比的可能性。gydF4y2Ba
介绍gydF4y2Ba
活体荧光成像以其优异的分子特异性和灵敏度,广泛应用于生物学研究和医学诊断。在该技术的众多实施例中,宽视场荧光成像可以在大(厘米尺度)视场(FOV)上实现千赫兹(kHz)帧率。然而,深度信息的缺乏对许多需要光学切片和定量能力的应用造成了重大限制gydF4y2Ba1gydF4y2Ba。荧光分子断层扫描允许检测和定量荧光信号在三维(3D)的深层组织。然而,它需要长时间的断层扫描,并且空间分辨率很差,在活体组织中通常为1毫米或更低gydF4y2Ba2gydF4y2Ba。相反,扫描活体共聚焦gydF4y2Ba3.gydF4y2Ba和多光子gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba显微镜可以在3D中以受限的视场和/或缓慢的体积速率为代价获得衍射限制的光学分辨率,这使得这些技术不适合在大范围(例如,整个皮层)上研究快速生物动力学。虽然平行激发/检测策略,如光片显微镜gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,旋转盘共聚焦显微镜gydF4y2Ba9gydF4y2Ba结构照明显微镜gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba可以在保持较大视场的同时大大提高2D帧率,但深度分辨能力依赖于样品/物镜的机械轴向扫描,因此在厘米级视场成像时不可避免地呈现低体积率。相反,一些微型的荧光显微镜设计最近被引入到实时的宽视场成像中gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba。这些技术同样局限于平面(2D)成像,信号沿深度集成,从而影响量化。此外,颅骨为小鼠大脑的高分辨率成像提供了一个重要的屏障。因此,现有的光学显微镜方法通常涉及高度侵入性,例如安装颅窗,颅骨变薄或侵入性植入。gydF4y2Ba
提出了几种先进的方法,使荧光显微镜具有快速的体积切片能力。一个简单的解决方法就是加一个电gydF4y2Ba18gydF4y2Ba或听觉上gydF4y2Ba19gydF4y2Ba可调透镜前的物镜,可以提供轴向扫描速率几千赫在有限的有效数值孔径的代价。在保持衍射限制性能的同时,通过将物镜与第二物镜相匹配并结合驱动倾斜/阶梯镜,引入了无像差远程聚焦gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。另一种方法是基于散光,该方法首先应用于超分辨率显微镜(例如3D随机光学重建显微镜),通过在成像光路中插入弱聚焦圆柱形透镜gydF4y2Ba22gydF4y2Ba。除了圆柱透镜外,还有点扩散函数(PSF)设计的相位掩模,如双螺旋gydF4y2Ba23gydF4y2Ba和四足动物gydF4y2Ba24gydF4y2Ba,将深度信息编码到PSF形状中。一种类似的策略被称为“双平面”探测,通过用两个探测器创建两个稍微分开的焦平面gydF4y2Ba25gydF4y2Ba。细长的“v形”双光束照明也被报道从“图像对”的位移中检索z坐标。gydF4y2Ba26gydF4y2Ba。然而,这些方法大多是作为传统点扫描显微镜的附加模块,因此无论如何都受到成像速度相对较慢的困扰。gydF4y2Ba
总而言之,在大视场上具有高空间分辨率的实时三维荧光成像仍然是一个未满足的需求。在这里,我们展示了通过多焦点照明或荧光发射器稀疏分布产生的局部荧光源的基于散像的成像导致具有高时空分辨率的体积宽视场荧光显微镜。然后,我们展示了新开发的技术在缺血性卒中中研究侧支血管募集的临床前体内应用,这对梗死的严重程度、治疗效果和恢复有重要影响gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba。gydF4y2Ba
结果gydF4y2Ba
集成三维宽视场荧光显微镜系统和表征gydF4y2Ba
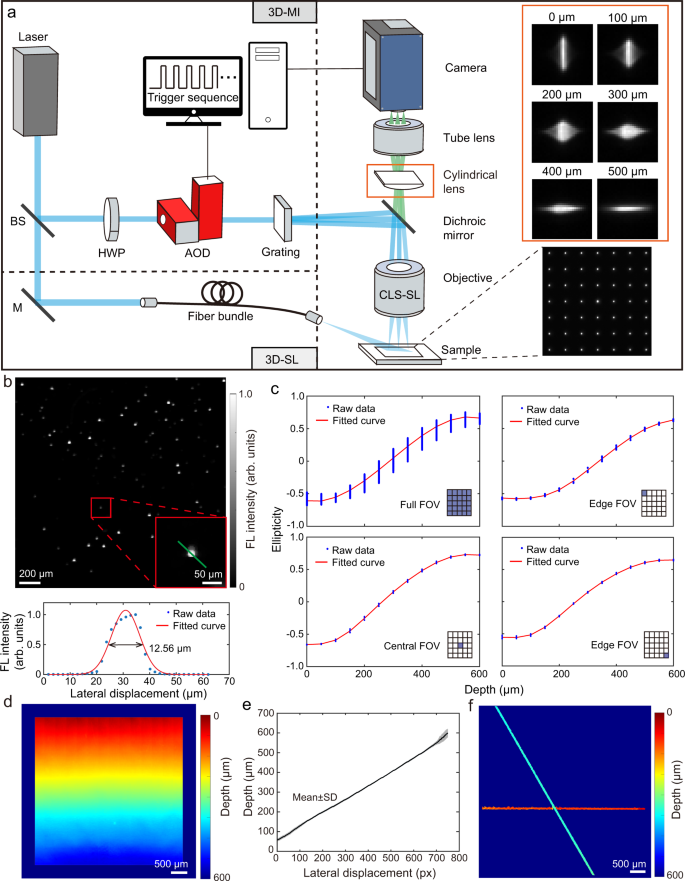
提出的两种3D宽视场荧光显微镜的实现共享相同的检测路径,而不同的照明路径(图2)。gydF4y2Ba1gydF4y2Ba)。对于稀疏定位(SL)方法,将激光束耦合到商用光纤束中以提供外延照明。多焦点照明(MI)方法使用一束结构激光束作为“点阵”图案投射到样品表面。声光偏转器(AOD)和高速相机的同步确保快速扫描,帧率高达40hz,跨越5.6 × 5.6 mmgydF4y2Ba2gydF4y2Ba横向视场。在物镜和管状透镜之间插入特制的8200mm长筒形透镜,形成两个微距焦平面,有效深度范围约为600 μm。注意,圆柱透镜的焦距是根据显微镜的放大倍率来选择的,这最终决定了有效深度范围。校准后,根据拉长的PSF计算荧光发射器的深度信息(图1)。gydF4y2Ba1gydF4y2Ba(右面板)。关于实验设置的更多细节在在线方法中提供。gydF4y2Ba
一个gydF4y2Ba两种空间定位方法的原理图,分别基于单个荧光发射器的多焦点照明(MI)或稀疏定位(SL)。gydF4y2BabgydF4y2Ba通过计算沿绿线高斯拟合后荧光珠的强度分布的半最大值全宽度(FWHM)的横向分辨率表征。gydF4y2BacgydF4y2Ba整个视场(289个照明点)和对应的子区域(选取5个照明点)的PSF椭圆度随深度的代表性校准曲线。gydF4y2BadgydF4y2Ba倾斜显微镜载玻片沿轴向线性深度梯度的三维荧光图像。gydF4y2BaegydF4y2Ba沿轴向穿过视场的平均线轮廓。数据以mean±SD表示。gydF4y2BafgydF4y2Ba两根间隔约260 μm的交叉管的三维荧光图像。BS分束器,M反射镜,AOD声光偏转器,HWP半波片,FL荧光,FOV视场,SD标准差。gydF4y2Ba
该系统的横向分辨率被表征随机分布的荧光珠在平板显微镜载玻片。根据沿单个磁珠的高斯拟合线轮廓,系统的横向分辨率为12.6 μm,由激发光斑大小决定(图6)。gydF4y2Ba1 bgydF4y2Ba)。为了建立PSF形状与深度信息之间的关系,从不同的轴向位置获得了荧光显微镜载玻片的三维图像堆栈。随后,利用拟合的PSF椭圆度随深度的变化曲线进行标定。然而,由于成像系统的像差,校准曲线呈现出较大的波动,特别是对于大视场(图1)。gydF4y2Ba1 cgydF4y2Ba)。为了提高深度估计的精度,通过将整个视场划分为25个子区域,每个子区域都有一个局部校准文件,生成了空间变化的“PSF形状到深度”校准文件(图1)。gydF4y2Ba1 cgydF4y2Ba)。结果表明,在~600 μm的整个深度范围内,各子区域的校准曲线波动得到了较好的抑制。根据深度校准文件,通过对提供连续变化深度的倾斜荧光载玻片进行成像来表征系统的轴向分辨率(图2)。gydF4y2Ba1 dgydF4y2Ba)。采用该方法,拟合深度与沿深度梯度的侧向位移之间的近似线性关系证实了准确的深度估计(图1)。gydF4y2Ba1 egydF4y2Ba)。深度估计精度以整个深度范围内的平均标准差(SD)为特征,计算结果为5.5 μm。通过在uv固化胶中嵌入荧光珠成像,进一步验证了轴向分辨精度。通过使用电动平台沿z轴以10 μm步长移动模体,估计深度与珠子的轴向位移呈近似线性关系(补充图2)。gydF4y2Ba1gydF4y2Ba)。通过对两个轴向尺寸约为260 μm的交叉微流控通道进行成像,验证了该系统的实际三维成像性能。实验估计的深度差为239.2±31.3 μm。gydF4y2Ba1 fgydF4y2Ba)。gydF4y2Ba
体内经颅脑微循环制图gydF4y2Ba
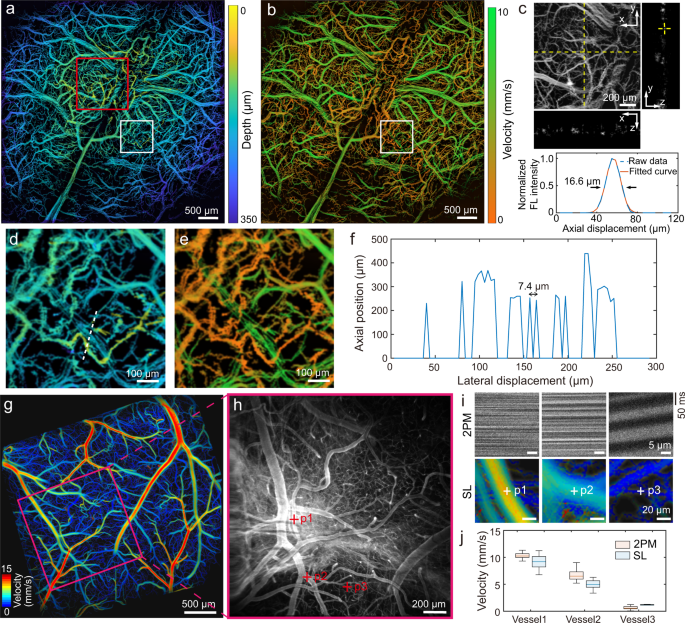
通过对去头皮小鼠的大脑微循环进行经颅成像,证明了体内3D成像能力。为了进行SL成像,将荧光珠静脉注射到裸鼠体内。注射后以每秒200帧(fps)的速度记录一系列宽视场图像,总持续时间为3.5分钟。通过在所有三个维度上跟踪它们的轨迹,绘制出高分辨率的深度分辨脑微循环图,连续地对单个流动的珠子进行定位。gydF4y2Ba2gydF4y2Ba及辅助电影gydF4y2Ba1gydF4y2Ba)。正如预期的那样,由于小鼠头骨和大脑的曲率,该地图显示出固有的深度梯度。此外,颅血管和脑血管是根据其相对深度分配的颜色来区分的。颅骨血管的~150 μm深度变化与先前报道的该年龄小鼠颅骨厚度一致gydF4y2Ba29gydF4y2Ba。血流速度图进一步证实了这一点。gydF4y2Ba2 bgydF4y2Ba),这是在定位过程中提取的固有副产品,其中颅骨血管的速度明显低于脑血管。红色方框表示的ROI的最大强度投影(MIP)。gydF4y2Ba2gydF4y2Ba)及其所选切片的侧视图如图所示。gydF4y2Ba2摄氏度gydF4y2Ba。实际轴向分辨率由毛管沿深度方向的PSF决定,其大小约为16.6 μm(图6)。gydF4y2Ba2摄氏度gydF4y2Ba,底部)。深度图和速度图之间的良好对应关系在图中展开的视图中进一步得到了细致的体现。gydF4y2Ba2gydF4y2Bad, e.在理想条件下,SL方法的横向分辨率由光子预算和像素大小决定。沿着图中所示的白线绘制的线轮廓。gydF4y2Ba二维gydF4y2Ba结果表明,横向位移为7.4 μm的两个相邻特征可以明确区分(图2)。gydF4y2Ba2 fgydF4y2Ba),即在1.5倍放大倍率下,其11 μ m × 11 μ m相机像素尺寸与有效像素尺寸非常相似。我们使用线扫描双光子显微镜(2PM)验证了所提出的方法的速度测量,该方法在颅窗实施后在同一只小鼠中进行(图2)。gydF4y2Ba2 g hgydF4y2Ba)。在两种方法之间观察到良好的对应关系(图2)。gydF4y2Ba2 i, jgydF4y2Ba)与SL能够经颅测量和优越的可扩展性平行速度测量跨大视场。gydF4y2Ba
一个gydF4y2Ba彩色编码微血管深度图。gydF4y2BabgydF4y2Ba对应的彩色编码血液流速图。gydF4y2BacgydF4y2Ba红色方块ROI的放大视图gydF4y2Ba一个gydF4y2Ba黄色虚线表示x-z和y-z截面视图切片的位置。在z方向上的线轮廓是用底部的原始数据拟合的高斯函数绘制的。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba中显示的白色方形roi的扩展视图gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba。gydF4y2BafgydF4y2Ba信号轮廓沿白色虚线表示在gydF4y2BadgydF4y2Ba。gydF4y2BaggydF4y2Ba用SL方法重建小鼠颅窗的彩色编码速度图。gydF4y2BahgydF4y2Ba中紫色方形ROI的强度图gydF4y2BaggydF4y2Ba用双光子显微镜(2PM)捕获。gydF4y2Ba我gydF4y2Ba三种选定血管的红细胞血流动态图和相应的血流速度图(用红叉标记)gydF4y2BahgydF4y2Ba),分别以2PM及SL捕获。gydF4y2BajgydF4y2Ba测量速度为2PM (gydF4y2BangydF4y2Ba= 166)和SL法(gydF4y2BangydF4y2Ba= 547, 526和8(分别为容器1,容器2和容器3)。在箱线图中,最小值和最大值显示为须的边界,而中位数为25gydF4y2BathgydF4y2Ba百分位和75gydF4y2BathgydF4y2Ba百分位数显示为框的中间、顶部和底部线。显示了来自一只鼠标的代表性数据。gydF4y2Ba
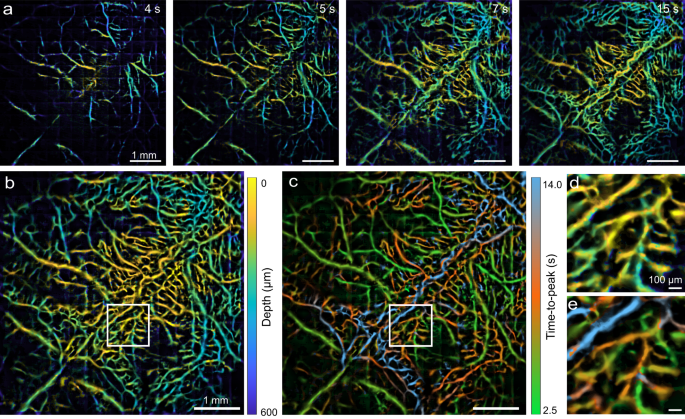
虽然SL方法能够实现高空间分辨率,但由于要处理数千个连续帧才能呈现出一幅高质量的复合图像,因此其时间分辨率受到限制。另一个先决条件是单个荧光发射器在血流中的稀疏分布,以避免PSF重叠,这建立了注射造影剂的最佳浓度范围。一般来说,SL图像的质量取决于记录的荧光发射器源的数量,可以通过更高密度的流动珠(可能会损害定位精度)和/或更长的记录持续时间(更多帧)来增加荧光发射器源的数量。在给定的200 Hz摄像机帧率下,不同记录时间重构的SL图像对比如图所示。gydF4y2Ba2gydF4y2Ba。相比之下,MI方法利用多焦点照明和快速扫描方案方便了图像采集。为了展示MI方案的成像速度优势,我们用Cy5.5荧光染料记录小鼠脑灌注动态。与先前报道的平面(2D)心肌梗死成像策略相比gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,由于PSF增大,信噪比较低。因此,将AOD扫描频率和高速相机帧率设置为2.25 kHz,在时间分辨率和信噪比之间折衷,采用15 × 15个扫描位置,得到3D复合图像的有效体积率为10 Hz。延时深度图(图1)gydF4y2Ba3gydF4y2Ba)描绘血管灌注序列,深部皮质血管(绿色)在4秒前出现,而更浅层的血管(黄色)在5秒后出现。延时图像序列的叠加(最大投影)揭示了典型颅骨和脑血管之间的深度差异(图2)。gydF4y2Ba3 bgydF4y2Ba)。这一结果也与先前的报道一致,即静脉注射造影剂后首先灌注的是脑血管gydF4y2Ba30.gydF4y2Ba。根据峰值时间(TTP)常数进一步绘制灌注动力学图(图2)。gydF4y2Ba3 cgydF4y2Ba),与图3中的深度图高度相关。gydF4y2Ba3 bgydF4y2Ba(另见图5中的扩展视图)。gydF4y2Ba3 d, egydF4y2Ba)。gydF4y2Ba
缺血性脑卒中后小鼠脑灌注变化的研究gydF4y2Ba
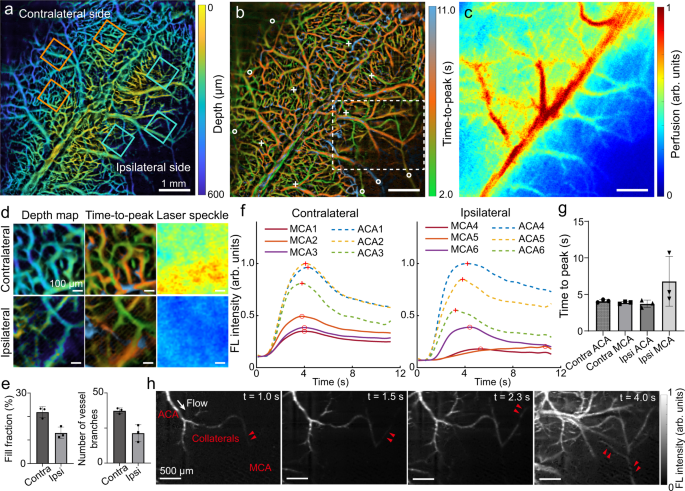
高容量成像率和厘米尺度视场的毛细血管水平分辨率使心肌梗死技术成为研究健康和疾病(如缺血性中风)脑血流动力学变化的理想选择。通过静脉注射Cy5.5获得C57BL/6J小鼠缺血后的深度图和TTP图(图5)。gydF4y2Ba4 a、bgydF4y2Ba)。为了比较,我们还对同一只小鼠进行了激光散斑对比成像(LSCI)。gydF4y2Ba4摄氏度gydF4y2Ba)。为了评估大脑中动脉(MCA)闭塞后血管网络的形态学变化,我们从对侧(健康)和同侧(梗死)两侧选择了3对ROI。gydF4y2Ba4gydF4y2Ba)。代表性roi的放大视图证实了MI方法与LSCI相比具有优越的空间分辨能力(图2)。gydF4y2Ba4 dgydF4y2Ba)。自动进行血管分割和分析,以量化所选roi内的血管填充分数和血管分支数(图2)。gydF4y2Ba4 egydF4y2Ba)。同侧显示两个读数明显减少(配对样本t检验,双面,gydF4y2BapgydF4y2Ba= 0.09为填充分数gydF4y2BapgydF4y2Ba= 0.07为血管分支数)。虽然这里的差异不具有统计学意义,但是根据配对样本的Cohen’s d计算出对应的有效大小分别为1.84和2.00,这构成了组间的显著差异。除了结构变化外,还从延时图像堆栈中提取了位于两个半球MCA和大脑前动脉(ACA)的roi (5 × 5像素)的时间荧光灌注模式(图2)。gydF4y2Ba4 fgydF4y2Ba)。对TTP的统计分析显示,与对侧mca相比,同侧mca具有更高的均值和SD值,而ACAs也受到梗死的影响,且TTP的变化更高(图2)。gydF4y2Ba4 ggydF4y2Ba)。有趣的是,该方法的有效时间分辨率为100 ms,可以实时观察快速侧支募集的经颅皮质范围gydF4y2Ba28gydF4y2Ba通过来自邻近ACA的额外血流通过侧支血管进入阻塞的MCA(图2)。gydF4y2Ba4 hgydF4y2Ba及辅助电影gydF4y2Ba2gydF4y2Ba)。由于时空分辨率和视场有限,其他显微工具无法进行此类观察,因此之前的研究主要集中在中风后数小时至数天内侧支血管发展的血管密度、直径和弯曲度变化的静态记录gydF4y2Ba31gydF4y2Ba。由于高体积率和MI成像策略固有的散射抑制,通过同时提供两个大脑半球的定量灌注信息,可以在空间和时间上检查快速侧支招募事件。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba基于3D散光的MI方法捕获的颜色编码深度TTP图与激光散斑对比成像捕获的平面(2D)皮质灌注图的比较。在对侧(健康)和同侧(梗死)以实线方阵表示对称地选择三对roi(基于上矢状窦)。gydF4y2BadgydF4y2Ba从所选的ROI对之一扩展深度视图,峰值时间和灌注图像。gydF4y2BaegydF4y2Ba在所选ROI对中填充分数和血管分支数的定量比较(gydF4y2BangydF4y2Ba= 3)用mean±SD表示(配对样本t检验,双侧)。gydF4y2BafgydF4y2Ba位于两个半球ACAs(用白色十字表示)和mca(用白色圆圈表示)的选定区域的时间灌注谱。gydF4y2BaggydF4y2Ba峰值时间统计分析(gydF4y2BangydF4y2Ba= 3)。数据以mean±SD表示。gydF4y2BahgydF4y2Ba通过MI方法获得的代表性延时图像描绘了通过旁路侧支血管从邻近ACA到闭塞MCA的额外血流补偿。在3只小鼠身上独立重复实验,结果相似。gydF4y2Ba
讨论gydF4y2Ba
本研究利用光学散光实现了具有局部荧光源的深度分辨宽视场荧光显微镜,该荧光源可以通过多点荧光发射器的多焦点照明(MI)或稀疏定位(SL)产生。虽然SL方法可以获得更高的空间分辨率,但受源定位精度的限制,它的时间分辨率较低,因为渲染高分辨率复合图像需要数千帧。相比之下,MI方法只需要对成像视场进行快速光栅扫描,更适合研究毫秒级的快速生物动力学,如皮质灌注。更重要的是,与基于单一发射器定位的方法不同,MI对造影剂的类型/大小及其体内浓度没有严格要求,因为稀疏网格照明模式避免了相邻发射器之间的串扰,因此允许该方法具有更广泛的适用性。gydF4y2Ba
光学像散的轴向(深度)分辨率是由PSF的椭圆度及其在深度查找表上的投影决定的。因此,轴向分辨率最终受到图像信噪比的限制。当位于不同深度的不同发射器共享相同的横向坐标时,可能会出现轴向定位不准确。然而,我们的技术极大地减轻了这一挑战,因为SL方法基于荧光发射器的高水平空间稀疏性,而MI方法利用灌注动力学引起的时间稀疏性。虽然荧光团的时空稀疏性是该方法性能的核心,但由于大脑中的许多动态过程具有空间和/或时间稀疏性,因此它可以潜在地应用于各种样品。这不仅适用于血液动力学和血液循环,也适用于神经活动和信号。例如,当神经元峰值的平均频率为5赫兹时,大脑某些区域中超过90%的神经元实际上保持沉默,即它们每10秒或更长时间出现一次峰值gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba。因此,如果MI方法即将应用于神经元活动成像,例如在钙敏感荧光染料或蛋白质的帮助下gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,重大的时间变化预计只会同时发生在非常小的体素部分。gydF4y2Ba
请注意,存在许多替代方法来提取PSF形状(例如,二维椭圆高斯拟合)gydF4y2Ba22gydF4y2Ba或者基于相量的方法gydF4y2Ba36gydF4y2Ba),其中深度查找表是基于该不对称PSF的两个轴的轴差或商(定义为椭圆度)构建的。然而,在体内研究中,由于随机光子散射,来自生物组织深处理想点源的PSF不可避免地会模糊。由于与其他方法相比,椭圆性对散射特性的变化表现出最高的鲁棒性(补充说明)gydF4y2Ba1gydF4y2Ba和补充图。gydF4y2Ba3.gydF4y2Ba),用于建立连接像散PSF与深度的校准曲线。直观地说,散射会对PSF的两个轴产生类似的模糊效果。椭圆度度量通过考虑商而不是依赖于单轴长度来有效地抵消散射引起的模糊。作为一种附加措施,可以结合从散射介质中收集的目标的局部校准曲线(查找表)来进一步减轻散射影响。gydF4y2Ba
值得一提的是,对于光学成像中深度信息的编码,也存在其他的PSF工程方法gydF4y2Ba37gydF4y2Ba。其中有四足动物gydF4y2Ba24gydF4y2Ba和双螺旋PSFgydF4y2Ba23gydF4y2Ba是超分辨定位显微镜中应用的两种很有前途的策略。然而,当成像不透明组织与大视场(例如,bbb10 1毫米),后者的方法遭受明显的场相关像差gydF4y2Ba38gydF4y2Ba。此外,使用四足体和双螺旋PSF方法实现多焦点照明具有挑战性,因为需要额外的间距来分隔探测器上的点对,这反过来又限制了相位掩模的直径和结构,导致低信噪比和时间分辨率。相反,通过在物镜和管状透镜之间插入低功率圆柱形透镜而不牺牲信号,就可以很容易地实现像散PSF(图1)。gydF4y2Ba1gydF4y2Ba)。虽然像散PSF也受到视场相关像差的影响,但通过将整个视场划分为不同的子区域,并为每个区域建立局部查找表,可以优化深度计算(图2)。gydF4y2Ba1 cgydF4y2Ba)。gydF4y2Ba
从更广泛的角度来看,其他技术正在出现,可以在大(厘米尺度)视场上实现微循环的3D成像。例如,光声断层扫描(OAT)通过检测由吸收短光脉冲产生的高频声波振动,实现了具有高时间分辨率的大规模体积成像gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba。OAT的空间分辨率是由声衍射决定的(通常在几百微米的范围内),这对于在毛细尺度上分辨精细结构是不够的。另一方面,采用聚焦光束的光声显微镜(OAM)可以获得与光学显微镜相当的高空间分辨率,但却受到典型逐点扫描实现的时间分辨率限制gydF4y2Ba41gydF4y2Ba。一般来说,光声成像采用复杂的脉冲纳秒激光源,与基于荧光的方法相比,成本更低。新兴的超声定位显微镜(ULM)技术利用单个微泡或纳米液滴散射体的定位,同样实现了1/10超声波长范围内的超分辨率成像,并利用与软生物组织中的光子相比超声波的微小散射,深入渗透到啮齿动物的大脑中gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。然而,与建议的光学定位方法相比,ULM提供了较差的空间分辨率,在经颅成像时,严重的颅骨声像差进一步损害了空间分辨率。此外,与SL情况类似,ULM存在图像质量和帧率之间的直接权衡,而MI方法避免了这一点。由于ULM通常依靠超声波束成形一次选择单个/多个冠状面切片,因此这种方法在皮层主要部分的3D实时成像能力受到限制。在横向视图中快速捕获大部分皮层活动的能力对于涉及监测大规模脑动力学的一些应用至关重要,例如本工作所证明的缺血性中风后侧枝招募。gydF4y2Ba
我们应用了新开发的体积宽视场荧光显微镜技术,在大视场上以高分辨率可视化缺血性中风事件,同时提供了其他光学方式无法获得的两个大脑半球的定量灌注信息。侧支募集作为梗死区域的替代血液供应,在卒中中具有重要意义,因为它决定了梗死的严重程度、治疗效果和恢复gydF4y2Ba27gydF4y2Ba。然而,对于像2PM这样的传统荧光显微镜技术来说,侧支血管是一个具有挑战性的目标,这种技术通常涉及高度侵入性的开颅手术,视场限制在几百微米,因此缺乏全局功能信息gydF4y2Ba45gydF4y2Ba。由于光散射造成的空间分辨率较差,像LSCI这样基于平面(2D)散斑的方法无法区分单个侧支血管gydF4y2Ba31gydF4y2Ba。相反,多普勒光学相干断层扫描提取血流信息,而准确的速度估计依赖于A扫描的密集采样和先验多普勒角gydF4y2Ba46gydF4y2Ba。在我们的实验中,大规模、经颅高时间分辨率的心肌梗死方法能够细致地揭示侧支募集现象及其独特的灌注模式。gydF4y2Ba
综上所述,我们提出了一种基于散光PSF的宽视场体积荧光显微镜技术,并展示了其在小鼠皮质微循环经颅成像中的应用。通过使用两种可选的荧光源定位方法,我们在毛细血管水平分辨率下对脑血管网络进行了实时3D大规模成像,同时进一步揭示了与脑血流方向和速度有关的功能信息。这使得在急性缺血性中风小鼠模型中观察到以前未记载的并发侧枝招募事件在亚秒尺度上发生,并具有全场功能信息。该技术具有无与伦比的高时空分辨率和大视场,为大规模生物动力学的非或微创成像提供了丰富的可能性。gydF4y2Ba
方法gydF4y2Ba
体积宽视场荧光显微镜装置gydF4y2Ba
我们提出了两种可能的实现散光为基础的三维宽视场荧光显微镜使用多焦点照明(MI)或稀疏定位(SL)的点发射器。事实上,这两种方法可以无缝集成在一个系统中,它们共享相同的检测路径,但在照明路径上有所不同(图2)。gydF4y2Ba1gydF4y2Ba)。根据所选择的荧光团,使用473 nm (fpyl -473-1000 led, Frankfurt laser Company, Germany)或660 nm (gem 660 - 500 mW, laser Quantum, USA)波长的连续波(CW)激光源进行荧光激发。对于SL方法,激光束被耦合到一个商用光纤束中,以提供外延照明。在MI的情况下,首先使用由两个消色差双光束(ACN254-050-A和AC254-200-A, Thorlabs, USA)组成的4倍光束扩展器扩展光束。在进入二维声光偏转器(2D AOD, dtsx -400-532, AA光电,法国)之前,准直光束随后被引导到半波片(AHWP10M-600, Thorlabs,美国)以调整偏振方向,该偏转器提供高达95 kHz的扫描速率,在2.29°角度范围内具有15位角度精度。光束通过二维AOD后,通过分束光栅(DE-R 243, Holoeye Photonics AG, Germany)将光束分成17 × 17个0.3°夹角的光束。这些光束通过二向镜(F38-663, Semrock,美国)反射,并通过物镜(CLS-SL, EFL = 70 mm, Thorlabs,美国)聚焦,在5.6 × 5.6 mm的视场范围内将多焦照明图案投射到样品上gydF4y2Ba2gydF4y2Ba。对于光检测路径,使用相同物镜收集后向散射荧光,用管状透镜(AF micro-Nikkor 105 mm, Nikon, Japan)聚焦,用长通滤光片(FGL695, Thorlabs, USA)滤光,然后进入CMOS相机(pco)的传感器平面。dimax S1, PCO AG,德国)。这款高速相机在1008 × 1008像素的全像素分辨率下具有高达4.4 kHz的快速帧率。使用Camware软件(版本4.12,PCO AG,德国)进行图像采集。在物镜和筒形透镜之间插入一个8200mm焦距的弱聚焦圆柱形透镜以引入像散。通过来自数字I/O卡(NI-PCle 6536b, National Instrument, USA)的外部触发信号实现AOD和相机的同步,实现跨视场的快速3D成像。gydF4y2Ba
系统特性和深度校准gydF4y2Ba
为了表征成像系统的横向分辨率,将橙色荧光珠(460/594 nm, 1-5 μm, cosphere, USA)随机分布在玻璃盖上,根据Nyquist-Shannon采样定理,采用120 × 120步长3.3 μm的扫描步长,在473 nm激励下进行MI成像。提取随机选取的弹珠的强度分布图,并用高斯函数进行拟合。横向分辨率由拟合曲线的半最大值全宽度(FWHM)决定。为了校准像散PSF与深度(即z坐标)之间的投影,采用步长为50 μm的商用电动平台(TDC001, Thorlabs, USA)控制z位置,获取荧光载片的图像堆栈。随后,建立了像散PSF与z坐标之间的联系。gydF4y2Ba
图像重建gydF4y2Ba
为了渲染SL显微镜图像,首先通过减去整个原始图像堆栈的平均强度(背景)来增强每个捕获帧。采用自适应阈值,通过计算连通分量区域的质心来定位每帧中荧光发射体的横向位置。从原始图像中提取每个中心子区域,然后通过迭代二维椭圆高斯拟合计算PSF的轴长gydF4y2Ba22gydF4y2Ba:gydF4y2Ba
在哪里gydF4y2Ba\ \ ()gydF4y2Ba是高度;gydF4y2Ba\ \ (x)gydF4y2Ba和gydF4y2Ba\ (y \)gydF4y2Ba是横向坐标;gydF4y2Ba\ ({x} _ {0} \)gydF4y2Ba和gydF4y2Ba\ ({y} _ {0} \)gydF4y2Ba是中心位置;gydF4y2Ba\ ({w} _ {x} \)gydF4y2Ba和gydF4y2Ba\ ({w} _ {y} \)gydF4y2Ba表示PSF的宽度gydF4y2Ba\ (c \)gydF4y2Ba对应于噪声级。根据PSF的椭圆度和通过定义的椭圆度的深度校准曲线估计轴向位置gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba
在超分辨率显微镜中,通常使用两个PSF轴的长度来搜索最佳匹配深度gydF4y2Ba22gydF4y2Ba。这里选择PSF椭圆度进行深度检索,因为在这种情况下,校准曲线在不同散射条件下的保真度比基于单轴长度或像散PSF两轴差的估计更高。gydF4y2Ba3.gydF4y2Ba)。Simpletracker算法gydF4y2Ba49gydF4y2Ba然后应用该方法识别连续帧中的同一颗头,并根据它们的位置建立轨迹。Simpletracker的参数是根据实际帧速率来选择的,以减少由于流动的荧光珠密度过大而产生的错误轨迹。同时,根据帧率和空间位移计算每个像素处的流速。通过叠加视场内的所有三维轨迹,最终绘制出三维定位图像。同样,通过叠加每个像素点的平均速度来重建流速图。gydF4y2Ba
MI图像重建包括三个步骤。第一步是在每一帧中定位多焦点照明模式。由于成像视场上的荧光团分布可能不均匀,如果在单点水平上进行定位,则可能会在原始图像中丢失一些照明点。相反,用均匀荧光载玻片记录照明图案的所有扫描位置,并作为信号提取的参考。随后,通过在预记录位置周围搜索具有自适应阈值的局部最大值来定位记录帧中每个照明点的位置,然后提取中心子区域。为了最小化与场相关的误差,每个原始图像被划分为25个子区域,并具有已知的照明坐标。第二步,根据之前建立的深度校准文件,利用轴向位置值计算PSF的椭圆度。在第三步中,通过应用数字针孔来抑制相邻发射器和失焦光之间的串扰,检索每个扫描帧中每个点的信号强度。最后的复合3D图像,然后得到叠加所有过滤帧扫描与AOD。所有数据分析均使用定制的MATLAB (MathWorks, MATLAB R2019b, USA)程序进行。gydF4y2Ba
血管分割与分析gydF4y2Ba
先前报道的血管分割和分析算法名为PostProGUIgydF4y2Ba50gydF4y2Ba用于量化小鼠脑缺血后对侧和同侧血管网络的变化(补充图2)。gydF4y2Ba4 gydF4y2Ba)。从重建的两脑半球对称位置的三维脑图像MIP中选择3对感兴趣区域。为了避免人为偏置,所有roi都经过固定的预处理流水线,包括2倍线性插值、图像引导滤波和弗朗吉滤波以增强对比度。然后,基于Otsu算法实现图像的自动阈值二值化,然后进行血管骨架化处理gydF4y2Ba51gydF4y2Ba。具体而言,对分割后的二值图像进行形态学细化,计算血管中心线,生成二值化后的图像。随后,只要检测到两个以上的非零相邻像素,就可以识别连接不同血管分支的分支点。这些分支点的移除会自动将连接的血管划分为血管分支。血管分支识别后,计算填充分数(血管总面积除以图像总面积)、血管分支数等高级形态学参数,进一步进行统计分析。gydF4y2Ba
激光散斑对比成像gydF4y2Ba
使用商用激光散斑对比成像(LSCI)系统(FLPI, Moor Instrument, UK)监测脑卒中后皮质灌注并验证血流量减少。使用MoorFLPI软件(版本4.0,Moor Instrument, UK)在32色调色板中任意单元生成LSCI图像,然后使用手动选择的特征和MI方法与重建图像进行共配准gydF4y2BaimregdemonsgydF4y2Ba函数。gydF4y2Ba
扫描双光子显微术gydF4y2Ba
双光子成像采用定制显微镜gydF4y2Ba52gydF4y2Ba配备可调谐飞秒激光器(美国相干公司变色龙发现NX)。采用16×水浸物镜(CFI75 LWD 16X W, NA = 0.8, Nikon, Japan)进行体内验证。利用ScanImage (r3.8.1, Janelia Research Campus)实现了galvo反射镜与荧光采集的同步。gydF4y2Ba53gydF4y2Ba。采用压电电机驱动的线性工作台对样品进行z轴扫描。然后用光电倍增管(H9305-03,滨松,日本)收集通过带通滤光片(FF01-475/64-25, Semrock,美国)的后向散射荧光光子。测量速度时,采用平行于气流方向的线扫描生成测速图。基于氡变换估计红细胞的运动速度gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba。gydF4y2Ba
幽灵的准备gydF4y2Ba
在660 nm的激发下,制备了两个模型来评估MI方法的深度估计精度。在倾斜的显微镜载玻片上覆盖一层薄薄的Cy5.5染料,用AOD在45 × 45的位置上进行光栅扫描。另一个幻影由两个单通道微流控芯片(内径为50 μm, microfluidic ChipShop,德国)组成,沿轴向(深度)方向重叠约260 μm。同样,以45 × 45的位置对照明图案进行光栅扫描,重建三维复合图像,如图像重建部分所述。gydF4y2Ba
为了验证SL方法估计的深度,将直径为1-5 μm的橙色荧光珠(460/594 nm, cosphere,美国)与uv固化胶(NOA61, Thorlabs,美国)混合,并倒入显微镜载玻片上,使其在不同深度上有效分布。随后将幻体暴露在紫外线下10分钟。通过平移幻像,收集SL图像堆栈gydF4y2BazgydF4y2Ba轴的步长为10 μm,采用电动工作台(MLJ150, Thorlabs, USA)。gydF4y2Ba
活体动物实验gydF4y2Ba
两只胸腺裸foxn1nu小鼠(Envigo BMS b.v.,荷兰)用于健康大脑微循环的体内成像。用异氟醚(5%诱导,1.5%维持)麻醉小鼠,分别以0.2 L/min和0.8 L/min的流量在氧气和医用空气的混合物中麻醉。为了减少皮下注射镇痛药(丁丙诺啡,0.1 mg/kg)后皮肤的严重光散射,切除了两只小鼠的头皮。在SL显微镜下,将与幻象实验相同的橙色荧光珠在磷酸盐缓冲盐水中100 μL溶液缓慢注射到裸鼠(12周龄,雌性)的尾静脉中,以200 Hz的帧率宽视场记录3.5 min。MI显微镜下,给8周龄雌性裸鼠注射50 μL(浓度为2 mg/ml)的Cy5.5荧光染料。然后以2.25 kHz AOD扫描频率和相机采集速率采集图像,对应于15 × 15个扫描位置时10 Hz的有效复合帧率。脑卒中研究,诱导局灶性脑缺血gydF4y2Ba56gydF4y2Ba。1只雌性和2只雄性C57BL/6J小鼠(6-7周龄,Envigo BMS b.v.,荷兰)腹腔麻醉芬太尼(0.05 mg/kg体重;辛替尼,辛替尼卡),咪达唑仑(5毫克/公斤体重;Dormicum,罗氏)和美托咪定(0.5 mg/kg体重;Domitor, Orion Pharma)。在麻醉下,将小鼠固定在立体定向框架中,在整个手术过程中使用反馈调节加热系统将体温保持在37°C。头皮去除后,玻璃微移液管(校准为15 mm/μL;助理编号555/5;将Hoechst, Sondheim-Rhoen, Germany)插入MCA管腔,然后用纯化的人α -凝血酶注射液(1 μL, HCT-0020, Haematologic Technologies Inc., USA)诱导MCA闭塞。在形成稳定的血块后移管。 The mouse was subsequently imaged with LSCI and MI microscopy, respectively.
使用C57BL/6J小鼠(10周龄,雌性,Envigo BMS b.v.,荷兰)进行2PM血流速交叉验证。采用芬太尼(0.05 mg/kg体重)、咪达唑仑(5 mg/kg体重)和美托咪定(0.5 mg/kg体重)混合麻醉动物。用牙钻(Bien-Air)在初级体感觉皮层上行直径3.5 mm的开颅手术,然后植入3 × 3 mm的玻璃盖盖和钛头板。成像阶段采用异氟醚诱导麻醉,麻醉参数与上述相同。在静脉注射100 μL级联蓝(2.5% v/v, D1976, Thermofisher, USA)后,首先用2PM在800 nm处收集小鼠脑血管的解剖图像堆栈。流速测量在三个血管分支上进行,根据血管造影图像选择。随后用SL技术对同一只小鼠进行荧光珠注射后成像。实验结束后,所有小鼠都在深度麻醉下被安乐死。gydF4y2Ba
动物被安置在通风的笼子里,在一个温度控制的房间里,12小时的暗/光循环。温度保持在22℃,相对湿度保持在50%。提供颗粒食品(3437PXL15, Cargill)和水。所有动物实验均按照瑞士联邦动物保护法进行,并经苏黎世州兽医局批准(许可证ZH165/2019和ZH161/2018)。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究发现的主要数据可在正文或补充信息中找到。图1原始数据gydF4y2Ba1gydF4y2Bab, c,gydF4y2Ba2gydF4y2Bac jgydF4y2Ba4 gydF4y2Bae、g和附图。gydF4y2Ba1 bgydF4y2Ba,gydF4y2Ba二维gydF4y2Ba,gydF4y2Ba3 a, cgydF4y2Ba在源数据文件中提供。图像重建前的原始数据集太大,无法公开共享,但应通讯作者的要求,它们可用于研究目的。gydF4y2Ba源数据gydF4y2Ba都提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
支持本研究结果的代码可根据通讯作者的要求提供。gydF4y2Ba
参考文献gydF4y2Ba
Pirovano, G, Roberts, S., Kossatz, S. & Reiner, T.光学成像模式:临床前研究和临床设置的原理和应用。gydF4y2Baj .诊断。地中海。gydF4y2Ba61gydF4y2Ba中文信息学报,1419-1427(2020)。gydF4y2Ba
nziachristos, V., Tung, C.-H.。,Bremer, C. & Weissleder, R. Fluorescence molecular tomography resolves protease activity in vivo.Nat,地中海。gydF4y2Ba8gydF4y2Ba, 757-761(2002)。gydF4y2Ba
Hell, S. & Stelzer, E. H. 4倍焦共聚焦荧光显微镜的性质。gydF4y2BaJOSA一gydF4y2Ba9gydF4y2Ba(1992)。gydF4y2Ba
霍顿,n.g.等。完整小鼠大脑皮层下结构的体内三光子显微镜研究。gydF4y2BaNat。光子学gydF4y2Ba7gydF4y2Ba, 205-209(2013)。gydF4y2Ba
Denk, W., Strickler, J. H. & Webb, W. W.,双光子激光扫描荧光显微镜。gydF4y2Ba科学gydF4y2Ba248gydF4y2Ba, 73-76(1990)。gydF4y2Ba
Boido, D.等。同一动物感官反应的介观和显微成像。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1-13(2019)。gydF4y2Ba
Keller, P. J, Schmidt, A. D, Wittbrodt, J. & Stelzer, E. H.用扫描光片显微镜重建斑马鱼早期胚胎发育。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 1065-1069(2008)。gydF4y2Ba
西尔维斯特里,L.等。用于全鼠脑定量体积显微镜的通用自动聚焦。gydF4y2BaNat方法。gydF4y2Ba,gydF4y2Ba18gydF4y2Ba, 953-958(2021)。gydF4y2Ba
Tanaami等人。高速1帧/毫秒扫描共聚焦显微镜,配有微透镜和尼普科夫圆盘。gydF4y2Ba达成。选择。gydF4y2Ba41gydF4y2Ba, 4704-4708 (2002)gydF4y2Ba
约克,a.g.等。通过多焦点结构照明显微镜,在活的多细胞生物中分辨率翻倍。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba中文信息学报,749-754(2012)。gydF4y2Ba
陈,Z.等。高速大视场多焦照明荧光显微镜。gydF4y2Ba激光光子学gydF4y2Ba14gydF4y2Ba, 19900070(2020)。gydF4y2Ba
陈志强,周强,陈志强,陈志强。基于超快大视场多焦照明显微镜的大脑皮层微循环成像。gydF4y2Baj . BiophotonicsgydF4y2Ba13gydF4y2Ba, e202000198(2020)。gydF4y2Ba
斯科特,b.b.等人。用头戴式大视场显微镜观察转基因GCaMP大鼠的皮质动力学。gydF4y2Ba神经元gydF4y2BaOne hundred.gydF4y2Ba, 1045 - 1058。e1045(2018)。gydF4y2Ba
莱曼,D.等。自由行为小鼠神经活动的大规模细胞分辨率成像。预印在gydF4y2Bahttps://www.biorxiv.org/content/10.1101/2021.01.15.426462v1gydF4y2Ba(2021)。gydF4y2Ba
Scherrer, J, Lynch, G. F, Zhang, J. J. & Fee, M. S.一种新型光学设计,可实现轻量化和大视场头戴式显微镜。预印在gydF4y2Bahttps://www.biorxiv.org/content/10.1101/2021.09.03.458947v1gydF4y2Ba(2022)。gydF4y2Ba
郭,C.等。lfov:一种大视场,单细胞分辨率,用于自由行为动物神经动力学的有线和无线成像的微型显微镜。预印在gydF4y2Bahttps://www.biorxiv.org/content/10.1101/2021.11.21.469394v1gydF4y2Ba(2021)。gydF4y2Ba
Aidukas, T., Harvey, A. R.和Konda, P. C. IngydF4y2Ba显微镜、组织病理学和分析学gydF4y2Ba。MTu4A。2(美国光学学会,2018)。gydF4y2Ba
Jabbour, J. M.等。使用电可调透镜的共聚焦显微镜中的光学轴向扫描。gydF4y2Ba生物医学。选择快递。gydF4y2Ba5gydF4y2Ba, 645-652(2014)。gydF4y2Ba
Mermillod-Blondin, A, McLeod, E.和Arnold, C. B.高速变焦成像与可调声学梯度折射率透镜。gydF4y2Ba选择列托人。gydF4y2Ba33gydF4y2Ba[j], 2008。gydF4y2Ba
Botcherby, E. J., Juškaitis, R., Booth, M. J. & Wilson, T.,一种用于显微镜远程聚焦的光学技术。gydF4y2Ba选择,Commun。gydF4y2Ba281gydF4y2Ba[j], 2011 - 12。gydF4y2Ba
Yang, B.等。大溪-高分辨率、大成像体积、多视点单物镜光片显微镜。gydF4y2BaNat方法。gydF4y2Ba19gydF4y2Ba, 461-469(2022)。gydF4y2Ba
黄斌,王伟,贝茨,M.,庄新。基于随机光学重建显微镜的三维超分辨率成像。gydF4y2Ba科学gydF4y2Ba319gydF4y2Ba中文信息学报,810-813(2008)。gydF4y2Ba
帕瓦尼,s.r.p.等。三维,单分子荧光成像超越衍射极限,使用双螺旋点扩散函数。gydF4y2Ba国家科学院学报gydF4y2Ba106gydF4y2Ba, 2995-2999(2009)。gydF4y2Ba
Shechtman, Y., Sahl, S. J., Backer, A. S.和Moerner, W.三维成像的最佳点扩展函数设计。gydF4y2Ba理论物理。启。gydF4y2Ba113gydF4y2Ba中文信息学报,133902(2014)。gydF4y2Ba
朱特,m.f.等。厚样品的三维亚100纳米分辨率荧光显微镜。gydF4y2BaNat方法。gydF4y2Ba5gydF4y2Ba, 527-529(2008)。gydF4y2Ba
Song, A.等。使用立体成像技术的神经元体积双光子成像(vTwINS)。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 420-426(2017)。gydF4y2Ba
Shuaib, A., Butcher, K., Mohammad, A. A., Saqqur, M. & Liebeskind, D. S.急性缺血性中风的侧支血管:一个潜在的治疗靶点。gydF4y2Ba柳叶刀神经。gydF4y2Ba10gydF4y2Ba, 909-921(2011)。gydF4y2Ba
侧枝循环。gydF4y2Ba中风gydF4y2Ba34gydF4y2Ba中文信息学报,2279-2284(2003)。gydF4y2Ba
尹,J.等。利用波前整形散射头盖骨的光遗传调控细胞信号通路。gydF4y2Ba科学。代表。gydF4y2Ba5gydF4y2Ba, 1-7(2015)。gydF4y2Ba
Kalchenko, V., israel, D., Kuznetsov, Y.和Harmelin, A.经颅光学血管成像(TOVI)在小鼠大脑皮层血流动力学中的应用。gydF4y2Ba科学。代表。gydF4y2Ba4 gydF4y2Ba, 1-7(2014)。gydF4y2Ba
Wang, J.等。多模态动态成像检测雷帕霉素增加局灶性脑缺血后的侧支循环。gydF4y2Ba开展gydF4y2Ba9gydF4y2Ba, 4923(2019)。gydF4y2Ba
绍汉姆,S.,奥康纳,D.,和塞格夫,R.,大脑有多沉默:神经科学中是否存在“暗物质”问题?gydF4y2BaJ.比较物理。一个gydF4y2Ba192gydF4y2Ba, 777-784(2006)。gydF4y2Ba
Barth, A. L. & Poulet, J. F.新皮层稀疏放电的实验证据。gydF4y2Ba趋势>。gydF4y2Ba35gydF4y2Ba, 345-355(2012)。gydF4y2Ba
钱阳,等。一种基因编码的近红外荧光钙离子指示器。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba, 171-174(2019)。gydF4y2Ba
陈,Z.等。小鼠全脑感觉反应的多模态无创功能神经光子成像(Sci. 24/2022)。gydF4y2Ba放置科学。gydF4y2Ba9gydF4y2Ba中文信息学报,2270151(2022)。gydF4y2Ba
Martens, K. J, Bader, A. N., Baas, S., Rieger, B.和Hohlbein, J.基于相位的3D单分子定位显微镜(pSMLM-3D):使用标准cpu的MHz定位率算法。gydF4y2Baj .化学。理论物理。gydF4y2Ba148gydF4y2Ba, 123311(2018)。gydF4y2Ba
von Diezmann, A, Shechtman, Y. & Moerner, W.用于超分辨率成像和单粒子跟踪的单分子三维定位。gydF4y2Ba化学。牧师。gydF4y2Ba117gydF4y2Ba, 7244-7275(2017)。gydF4y2Ba
von Diezmann, A., Lee, M. Y., Lew, M. D.和Moerner, W.在三维单分子定位显微镜中校正场相关像差的纳米级精度。gydF4y2Ba视神经节gydF4y2Ba2gydF4y2Ba, 985-993(2015)。gydF4y2Ba
Deán-Ben, X., Gottschalk, S., Mc Larney, B., Shoham, S.和Razansky, D.用于体内动力学多尺度成像的先进光声方法。gydF4y2Ba化学。Soc。牧师。gydF4y2Ba46gydF4y2Ba, 2158-2198(2017)。gydF4y2Ba
陈,Z.等。纳米药物在实体瘤中的灌注和生物分布的同步荧光和体积光声断层扫描。gydF4y2Ba生物医学。选择快递。gydF4y2Ba10gydF4y2Ba中文信息学报,5093-5102(2019)。gydF4y2Ba
等。双波长混合光声超声生物显微镜用于大范围脑血管网络的功能成像。gydF4y2Baj . BiophotonicsgydF4y2Ba11gydF4y2Ba, e201800057(2018)。gydF4y2Ba
Errico, C.等。用于深度超分辨率血管成像的超快超声定位显微镜。gydF4y2Ba自然gydF4y2Ba527gydF4y2Ba, 499-502(2015)。gydF4y2Ba
克里斯滕森-杰弗里斯等人。超分辨率超声成像。gydF4y2Ba超声医学。生物学。gydF4y2Ba46gydF4y2Ba中文信息学报,865-891(2020)。gydF4y2Ba
董峰等。闪烁声纳米液滴实现快速超分辨率超声成像。gydF4y2BaACS NanogydF4y2Ba15gydF4y2Ba, 16913-16923(2021)。gydF4y2Ba
Nishimura, N., Rosidi, N. L., Iadecola, C.和Schaffer, C. B.闭塞单个皮质穿透性小动脉后侧支血流的限制。gydF4y2Baj . Cereb。血液流动。金属底座。gydF4y2Ba30.gydF4y2Ba, 1914-1927(2010)。gydF4y2Ba
Akamatsu, Y.等。2型糖尿病小鼠脑卒中后,脑膜侧支血流受损导致预后不良。gydF4y2Baj . >。gydF4y2Ba35gydF4y2Ba中文信息学报,3851-3864(2015)。gydF4y2Ba
布朗,t.a.等人。线粒体类核的超分辨率荧光成像揭示了它们的空间范围、界限和膜相互作用。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba31gydF4y2Ba, 4994-5010(2011)。gydF4y2Ba
Feld, L. G., Shynkarenko, Y., Krieg, F., Rainò, G. & Kovalenko, M. V.超分辨率光学显微镜中的钙钛矿量子点:强光致发光闪烁的影响。gydF4y2Ba光学材料gydF4y2Ba9gydF4y2Ba, 2100620(2021)。gydF4y2Ba
Simpletracker.m。gydF4y2BaGitHubgydF4y2Ba,gydF4y2Bahttps://github.com/tinevez/simpletrackergydF4y2Ba(2019)。gydF4y2Ba
PostProGUI。gydF4y2BaGitHubgydF4y2Ba,gydF4y2Bahttps://github.com/razanskylab/PostProGUIgydF4y2Ba(2021)。gydF4y2Ba
Bankhead, P, Scholfield, C. N, McGeown, J. G. & Curtis, T. M.基于小波和边缘定位改进的快速视网膜血管检测与测量。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Ba, e32435(2012)。gydF4y2Ba
Mayrhofer, j.m.等。用于体内研究的超柔性双光子显微镜的设计与性能。gydF4y2Ba生物医学。选择快递。gydF4y2Ba6gydF4y2Ba, 428 - 4237(2015)。gydF4y2Ba
Pologruto, t.a., Sabatini, b.l.和Svoboda, K. ScanImage:操作激光扫描显微镜的灵活软件。gydF4y2Ba生物医学。Eng。gydF4y2Ba2gydF4y2Ba, 1-9(2003)。gydF4y2Ba
Drew, P. J, Blinder, P., Cauwenberghs, G., Shih, A. Y. & Kleinfeld, D.利用Radon变换从时空图像中快速确定粒子速度。gydF4y2Ba计算神经科学。gydF4y2Ba29gydF4y2Ba, 5-11(2010)。gydF4y2Ba
巴雷特,m.j.等人。芯片:用于细胞和血流动力学双光子图像分析的可扩展工具箱。gydF4y2BaNeuroinformgydF4y2Ba16gydF4y2Ba, 145-147(2018)。gydF4y2Ba
El Amki, M.等。中性粒细胞阻塞脑毛细血管是缺血性脑卒中无血流的主要原因。gydF4y2Ba细胞的代表。gydF4y2Ba33gydF4y2Ba中文信息学报,108260(2020)。gydF4y2Ba
致谢gydF4y2Ba
dr承认来自美国国立卫生研究院(UF1-NS107680和R01-NS126102)和瑞士国家科学基金会(310030_192757)的资助。S.W.承认来自瑞士国家科学基金会(310030_192757,PP00P3_170683)和UZH CRPP卒中的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
q.z和z.c设想了实验系统并进行了实验。Q.Z, z.c和y.l进行数据分析和可视化。M.E.A, c.g., J.D.和M.R.对动物实验和结果的解释做出了贡献。B.W.和S.W.提供脑卒中模型并指导动物实验。dr参与了实验的设计和规划,并监督了这项工作。所有作者都对稿件的撰写和修改做出了贡献。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
周强,陈忠,刘永华。gydF4y2Baet al。gydF4y2Ba三维宽视场荧光显微镜用于经颅皮层微循环制图。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 7969(2022)。https://doi.org/10.1038/s41467-022-35733-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-35733-0gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba