摘要
与锂离子电池相比,采用无机固态电解质的锂金属电池(LMBs)具有更高的能量含量,被认为是有前途的二次电池系统。然而,LMB的性能对于商业化仍然不理想,主要是由于无机固态电解质无法阻止锂枝晶的扩展。这里,使用ag涂层的Li6.4拉3.Zr1.7助教0.3O12(LLZTO)无机固体电解质与银碳中间层的结合,我们证明了稳定的界面工程实验室规模LMBs的生产。通过实验测量和计算模型,我们证明了层间策略有效地调节了锂剥离/电镀,并防止了固态电解质颗粒中的枝晶渗透。通过将表面工程的LLZTO与锂金属负极、高压正极和离子液体电解质溶液在袋电池结构中耦合,我们报告了在1.6 mA/cm下的800次循环225°C,无需施加外部压力。该电池的初始放电容量约为3毫安时/厘米2且放电容量保持在85%左右。
简介
随着碳中和成为可持续发展的一个紧迫问题,锂离子电池(lib)的发展,一项电动汽车和智能电网电力存储系统的关键技术,已经引起了人们的极大兴趣。为了突破锂电池的极限,全固态锂电池因其高能量密度(~ 900wh /L)和安全性而备受关注1,2,3.,4.特别是,使用锂金属作为阳极可以大大提高能量密度;无机固体电解质的不易燃特性,可以防止因热冲击或短路而引起的潜在火灾危险,即使在大尺寸电池中也是如此2.
石榴石结构氧化物固体电解质(Li7拉3.Zr2O12(LLZO原型)由于具有较高的离子电导率(~1 mS/cm @ 25°C)和良好的还原稳定性而被广泛应用5,6,7,8,9,10.然而,有很多障碍阻碍了它的实际实施,包括树突穿透固体电解质11,12,13,14,15.人们尝试了几种方法来缓解这一问题,如涂覆有机/无机层以保护界面并增加润湿性,修改界面纳米结构以降低局部电流密度,以及化学处理以去除电解质表面的原生层16,17,18,19,20..采用熔融锂或金属镀膜材料增强锂润湿性可以有效降低初始界面电阻,但固态锂金属电池的长期循环性能不理想,临界电流密度主要在1.5 mA/cm以下2,低于实际工况18,19,20..报道了高电流密度(~10 mA/cm)下,对称Li||Li电池结构中高孔隙度、致密、层状石榴石型结构阻碍Li枝晶的形成2),但当Li金属负极与s - s正极耦合时,这种效应会减弱21.研究还表明,石榴石的酸处理通过同时去除天然氧化层和增加界面接触面积,大大提高了对Li金属枝晶的稳定性,但只有在高温(60°C)下才能证明长期循环。22.
在无机固体电解质和负极之间引入碳基中间层已被证明可以有效地抑制枝晶的扩展。使用Ag-C复合夹层和硫化物固体电解质,在60°C和3.4 mA/cm的高电流密度下,袋电池的可逆性可达1000次左右2外部压力为2兆帕23.结果表明,夹层的关键作用是引导锂离子在夹层与集电极之间的沉积/溶出。因此,在充放电循环中,可以有效地防止Li金属沉积物与固体电解质之间的直接接触(通常导致电流分布不均匀)以及由此产生的Li枝晶穿透固体电解质。然而,由于Ag-C复合材料的混合离子-电子导电性质会促进Li在固体电解质与Ag-C复合材料界面处的沉积/溶出,其对Li沉积部位的调控机制尚不清楚。
在本研究中,我们首次探讨了在碳基夹层存在的情况下,较好的Li向集热器沉积的热力学原因。然后,我们在掺ta的LLZO (LLZTO)上加入了Ag- c复合材料夹层,并在LLZTO表面溅射了一层纳米厚的Ag层。这种固态电解质/层间策略应用于袋电池水平,使用锂金属负极,高压正极和离子液体为基础的液体电解质溶液。该单层实验室规模的袋式电池以1.6 mA/cm的速度有效循环800次2和25°C,无需施加外部压力,提供约3毫安时/厘米的初始放电容量2显示出约85%的放电能力。
结果
层间对Li沉积部位的调节作用
中间层的主要作用是诱导锂金属从固体电解质中分离,防止锂金属与固体电解质直接接触,抑制枝晶穿透。最近使用硫化物电解质的研究表明,碳基层可以达到这一目的,但对这一机制仍然缺乏基本的了解23.因此,在将碳基复合材料应用到LLZTO上之前,我们试图阐明(通过建模和实验测量)中间层存在时Li沉积行为,并确定碳基中间层是否可以调节与LLZTO接触的Li沉积位点。
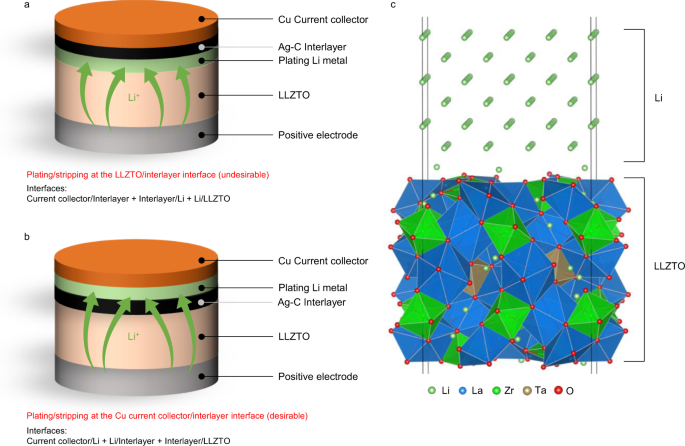
数字1一个,b说明了充电过程中Li沉积的两种可能情况。Li既可以沉积在固体电解质与夹层之间,也可以沉积在夹层与集电极之间。没有额外的驱动力,李+从固体电解质中输送的离子应被还原并镀在固体电解质与层间之间(图。1),因为碳基夹层的电子-离子混合导电性质。然而,相反,观察到Li沉积发生在电流集电极和层间的界面(图2)。1 b)23.这表明还原后的锂离子穿过层间并在集电极附近被镀。为了了解这种Li输运背后的驱动力,我们进行了DFT计算,以评估热力学上有利于Li沉积的位置。
如图所示。1一个,b,充电后电池组件的内部排列随镀锂位置的不同而不同,导致每种配置的界面不同。以LLZTO为固体电解质,Cu作为集流剂,石墨碳(C)夹层为例,存在LLZTO/C界面和C/Cu界面两个Li沉积位点。如果Li被镀在LLZTO和中间层之间(图。1)、LLZTO/Li、Li/C、C/Cu为接口。另一方面,如果Li被镀在层间和电流集电极之间(图。1 b),细胞内的界面为LLZTO/C、Li/C和Li/Cu。因此,通过比较界面总能,我们可以预测热力学上有利的锂沉积位点。为了评估界面能,我们为每个界面建立了原子模型,如图所示。1 c,对于LLZTO/Li界面,以及附着力的功(\ ({W} _{{广告}}\))进行相应的计算(界面建模过程请参见“方法”部分)。补充表2总结了计算得到的各种界面的粘附能。根据这些粘附能,我们可以比较两种情况下界面粘附能的总和,并预测较好的Li沉积位置(补充表)3.).例如,在石墨夹层和Cu或Fe(代表不锈钢(SUS)集流器)的情况下,我们的密度泛函理论(DFT)计算表明,后一种情况(图。1 b)为更有利的状态~0.51 J/m2或~0.98 J/m2,分别。值得注意的是,使用李6PS5Cl固体电解质也有相同的趋势(Cu集流体侧有利沉积~0.2 J/m)2),证实了最近的实验观察23.这表明,除非Li在层间的输运存在动力学障碍,否则在热力学上有利于Li沉积的位置是在集电体和层间之间。充电期间,李+在固体电解质与混合离子-电子导电中间层的界面处,从固体电解质中输送的离子会被还原。与电荷速率相比,如果Li在层间的输运动力学较慢,则Li会在LLZTO/C界面被镀,尽管这在热力学上是不利的。也就是说,锂在层间的输运速度要快于从阴极侧流入的速度,这与充电速率有关。在这方面,碳基夹层有助于Li输运。根据我们的NEB计算,锂离子沿碳表面扩散的活化势垒低至0.25 eV(补充图)。3.),表明Li可能通过碳基夹层快速扩散。因此,提高锂离子在层间的输运动力学对实现快速充放电至关重要。值得注意的是,上述讨论对于理想界面接触是有效的;任何缺陷,如在实际情况下可能发生的缺陷或杂质,都可能通过改变附着能(\ ({W} _{{广告}}\))的接口。
上述计算分析表明,碳基中间层的使用可以保护LLZTO/Li界面。在这种理解的鼓舞下,我们尝试在LLZTO表面上使用Ag-C夹层,以防止Li和LLZTO之间的直接接触。为了进行概念验证,我们制作了一个实验室规模的电池,将Ag-C复合材料附着在一个厚的LLZTO颗粒上(厚度约为350 μm),并在充电后检查了Li沉积部位(制作过程请参阅“方法”部分)。死后非原位扫描电子显微镜(SEM)测量和分析(图。2)的结果表明,锂离子可以穿透Ag-C层间,并在Ag-C层间和集电体之间镀上,表明层间策略可以成功应用于石榴石型氧化物固体电解质。
Ag-C复合材料与LLZTO的集成
在前一节中,我们证明了Ag-C中间层可以有效地调节Li沉积位点。此外,为了在单元水平上实现竞争能量密度,我们尝试将Ag-C复合材料集成到薄(<100 μm)带铸LLZTO上。然而,我们发现在某些情况下,将Ag-C中间层清洁转移到~100 μm厚的带铸LLZTO上具有挑战性,转移过程缺乏再现性。如图所示。3时,部分Ag-C(黑色部分电极)往往未附着在LLZTO(浅粉色部分电极)上,导致表面分层且不均匀。即使在冷等静压(CIP)后,我们也经常观察到层间的部分脱离。我们观察到Ag-C复合材料与LLZTO的粘附性较弱。DFT计算结果表明:\ ({W} _{{广告}}\)), LLZTO与碳的差为−0.33 J/m2,低于LLZTO/Li界面(−0.71 J/m)2).施加明显更高的压力可能是增强韧性硫化物固体电解质或坚固的厚氧化物颗粒的附着力的有效方法,其中固体电解质和Ag-C可以承受高应力。然而,薄的LLZTO胶带非常脆;因此,确定一种提高LLZTO与AgC复合材料之间附着力的替代方法势在必行。
为了在层间和固体电解质之间实现良好的连接界面,我们尝试在界面处引入额外的一层作为粘合剂。除了绑定之外,这一层还需要具备以下特征。首先,在充放电过程中不应阻碍Li扩散,因为Li扩散缓慢可能会导致固体电解质与层间镀Li。它还应该与LLZTO和Ag-C中间层具有化学和电化学稳定性。考虑到这些标准,我们决定采用Ag,它最近被证明可以促进Li形核,并使Li在Li - Ag合金中快速扩散17,24.
接下来,我们研究了Ag是否能增强LLZTO与Ag- c复合材料之间的粘附性。我们的DFT计算表明,Ag层可以增强层间与固体电解质之间的附着力。例如,\ ({W} _{{广告}}\)Ag-C复合材料(石墨模型)与LLZTO的差为−0.33 J/m2(无花果。3 b),但Ag与LLZTO和Ag- c复合材料的界面更为良好。计算得到LLZTO与Ag、Ag与Ag- c复合材料之间的粘接功分别为- 0.80和- 0.56 J/m2,分别(图;3 b和补充图。4).
为了实验证明Ag的作用,我们通过溅射在带铸LLZTO上引入了约200nm厚的Ag层。然后,将Ag-C复合材料转移到ag涂层的LLZTO上。与理论预测一致,我们直观地观察到中间层向LLZTO的均匀转移(图。3).与Ag-C转移到原始LLZTO磁带(图。3),显示出明显的差异,表明Ag成功地结合了LLZTO和Ag- c复合材料。通过剥离试验进一步量化增强附着力,如图所示。3 c.未添加Ag层时,LLZTO与Ag- c层间剥离强度约为10 mN/mm,添加Ag层后剥离强度可提高至180 mN/mm。
Ag与LLZTO结合强度的增加主要是由于电子相互作用的增加。为了检查界面上的电荷分布行为,我们进行了差分电荷密度分析。
在哪里\({\ρ }_{{{{{{{\ rm {diff }}}}}}}}\)界面形成时电荷密度是否重新分布,,\({\ρ }_{{{{{{{\ rm{接口 }}}}}}}}\),\({\ρ }_{{{{{{{\ rm{衬底 }}}}}}}}\),\({\ρ }_{{{{{{{\ rm{电影 }}}}}}}}\)分别为界面、衬底和薄膜结构的电荷密度。根据\({\ρ }_{{{{{{{\ rm {diff }}}}}}}}\)在LLZTO/Ag和LLZTO/Ag- c界面上,LLZTO/Ag界面转移了大量的电荷。5),这可能是增强附着力的原因。这些结果表明,Ag通过增加电子相互作用,成功地促进了LLZTO与AgC间层的结合。
锂金属电池组装及电化学储能表征
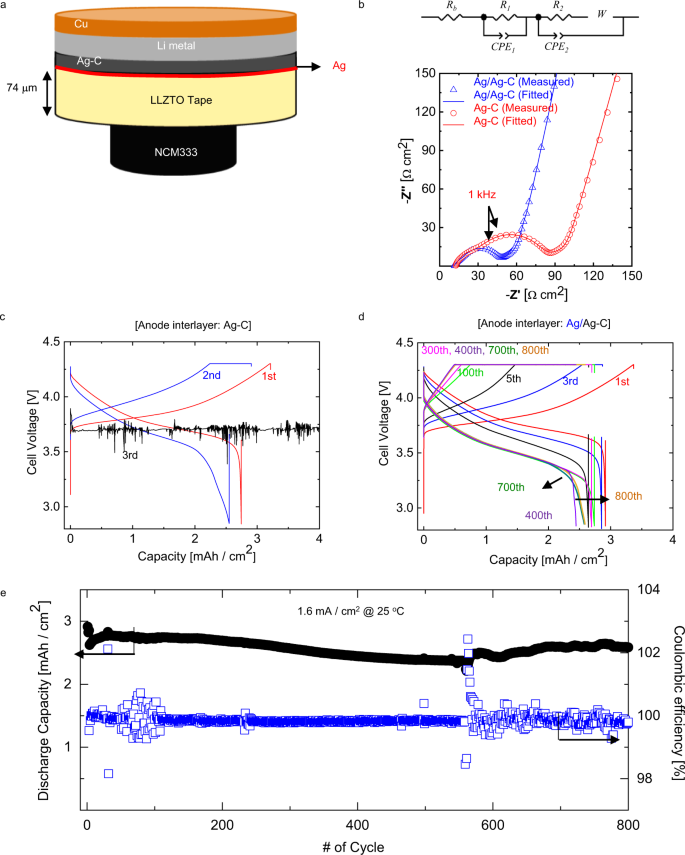
在证实Ag层可以增强界面结合的基础上,我们制作了一个Ag层和Ag- c中间层的电池来研究电池性能。电化学电池由厚的LLZTO颗粒(~350 μm)和薄的LLZTO胶带(<100 μm)组装而成。数字4显示了用LLZTO颗粒制造的单元配置示意图。我们还使用了离子液体(IL)为基础的电解质溶液,以促进固态电解质和正极之间的润湿和降低界面阻抗。此外,锂金属最初放置在负极以提高容量保持。如补充图所述。6,无阳极(即负极仅为Cu集流器)电池表现出56%的低库仑效率和小于2.0 mAh/cm的低放电容量2即使在第一次循环0.3 mA/cm后2操作。在电池制造过程中,任何预先存在的韧性Li都可能在250 MPa CIP下扩散到Ag-C夹层中,从而填充夹层中固有的空隙或孔隙。这可能有助于Ag-C层间的渗滤式Li传输途径,并有助于在电池运行期间在没有堆栈压力的情况下维持传输途径和界面接触。如图所示。4 b,在1.6 mA/cm时,未观察到明显的容量退化和短路2操作。值得注意的是,没有施加外部压力,电池在25°C下工作。死后非原位扫描电镜图像和EDS(图。4摄氏度)表明,在Ag- c /LLZTO界面上,即使在第100次循环后,Ag仍以层状形式存在,但由于循环过程中Ag粒子对锂- Ag合金形成的热力学偏好,一些Ag粒子分布在Li金属中23,24.Ag扩散到Li中已有文献报道23,25.研究人员将这种现象归因于锂- ag合金化引起的化学势变化25.根据他们的估计,Ag中的化学势变化预计要比Li中的化学势变化大得多。因此,在充电过程中,涂层层和Ag- c层间的Ag原子向被镀金属Li迁移,形成Li - Ag合金相。从理论结果来看,这表明在层间和集电极之间发生了可逆的Li沉积和溶出,避免了Li与LLZTO的接触。此外,在较长的周期内,阳极层间与集流器之间的界面保持完整。
为了阐明Ag中间层对薄LLZTO带电化学性能的影响,我们制作了一个由74 μm厚、3.2 mAh/cm的LLZTO组成的圆柱形实验室规模的电池2ncm333基正极和离子液体基电解质添加剂,如图所示。5.因为使用LLZTO胶带的主要问题是LLZTO与Ag-C中间层之间的接触(图2)。3.一个,b),通过电化学阻抗谱(EIS)测量研究了界面电阻的变化。数字5 b显示,EIS数据的复阻抗图由两条在高频区域略有重叠的抑止弧、Warburg阻抗和低频区域的电容线(阻塞区)组成26,27,28.等效电路,如图所示。5 b实现了对实验阻抗谱的定量分析。欧姆电阻(Rb),整体界面阻力(Rct=R1+R2)和Warburg抵抗(WR)采用复非线性最小二乘(CNLS)拟合方法进行评价;数值见补充表4.没有剧烈的变化Rb和WR对于两种细胞(即有和没有Ag涂层的LLZTO);Rct,与阴极-阳极界面电荷转移反应有关,从66.4 cm显著减小到32.5 Ω cm2当Ag存在于LLZTO表面时。假设Ag存在时,阴极界面动力学不变,则阴极界面动力学降低Rct是由于负极与LLZTO界面的有效面积增加,阳极与LLZTO的结合增强,从而改善了负极与LLZTO界面的电荷转移动力学。
相应的,充放电曲线(图;5 c, d)表明,当电流密度为1 mA/cm时,不含Ag的电池失效2而Ag层的电池能够在1.6 mA/cm的高电流密度下工作2无短路。在不添加离子液体电解质添加剂的Li|Ag- c /Ag/LLZTO/Ag/Ag- c |Li对称电池上进行恒流循环试验,证实了Ag/Ag- c中间层的短路耐受能力。具有Ag/Ag- c中间层的对称电池以1.6 mA/cm的速度循环2无短路,而没有夹层的电池在0.4 mA/cm处短路2,详见补充图。7.此外,在循环过程中,过电位逐渐增大,降低了图中电池充电过程中的高压恒流平台。5 d.这可能与负极/固体电解质界面的物理降解有关,源于循环或Ag扩散到Li金属时体积变化引起的局部应力。尽管如此,我们的夹层可以成功地保护LLZTO免受枝晶穿透,使初始面积放电容量约为3毫安时/厘米2放电容量在1.6 mA/cm循环800次后保持85%左右2Li|Ag-C/Ag/LLZTO/IL|NCM333细胞25°C(图5 e).循环稳定性也可以归因于LLZTO/Ag界面的化学稳定性。在我们的从头算分子动力学(AIMD)模拟(补充图。8),明确表明LLZTO/Li .9Ag)4LLZTO与Ag/AgC之间的界面在40 ps后仍保持完整,表明LLZTO与Ag/AgC之间的界面具有一定的化学稳定性。此外,假设Li|Ag- c /Ag/LLZTO/IL|NCM333电池配置为电池组中的一个单元电池,我们计算出能量密度约为680 Wh/L(补充表5).
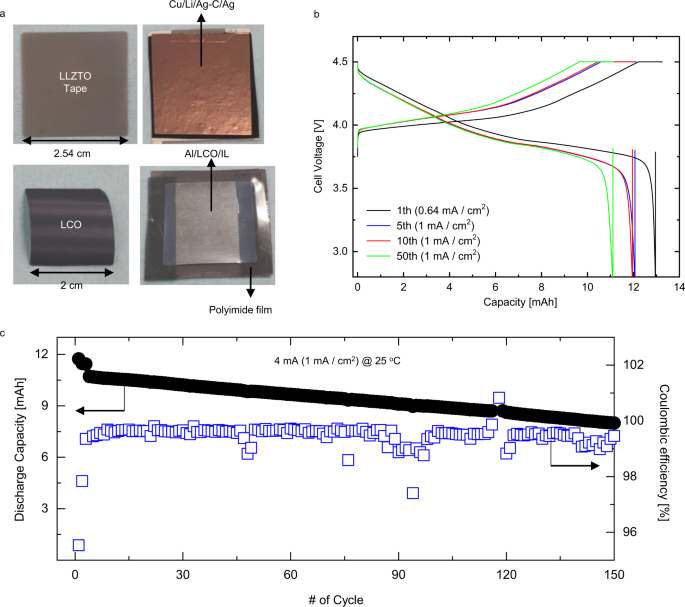
我们还使用3.2 mAh/cm组装并测试了Li|Ag- c /Ag/LLZTO/IL|LCO电池2在4.5 V (vs. Li/Li .)的高充电电压下,lco基正极和大面积薄带固体电解质(面积2.53 cm × 2.53 cm,厚度74 μm)进行了实验研究+),以证明其在更实际情况下的适用性。如图所示。6,我们用了4厘米2正极制备12毫安时的电池,在25°C下测试。图的充放电曲线。6 b显示该电池的初始放电容量约为13 mAh(对应于~3.2 mAh/cm)2电极面积为4厘米2) 0.64 mA/cm2在4.5 V断电的情况下。电池在1ma /cm时的平均放电电压2为3.93 V (vs. Li/Li+).数字6摄氏度显示了Li|Ag- c /Ag/LLZTO/IL|LCO细胞的长期循环性能。该电池的初始放电容量约为12毫安时,并在4ma (1 mA/cm)下进行150次循环后,放电容量保持约65%2)和25°C。
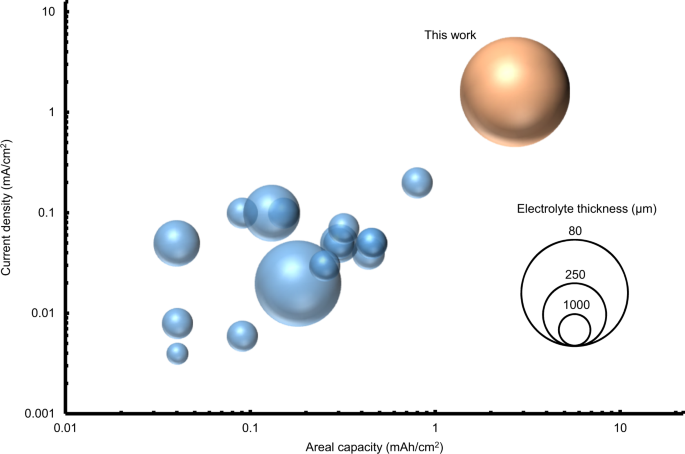
我们相信,所提出的层间策略可以有效地开发使用无机固态电解质的锂电池。此外,在固态电解质/正极界面上使用il基电解质,可以在25°C下操作,而无需施加任何外部压力。特别地,对于Li|Ag- c /Ag/LLZTO/IL|NCM333电池,我们报道的初始面放电容量约为3 mAh/cm2在1.6 mA/cm的电压下,800次循环后放电容量保持约85%2(无花果。5 e).如图所示,这种电池性能扩展了实验室规模电池在25°C下使用固态氧化物固体电解质进行长期循环测试的最先进水平。7及补充表629,30.,31,32,33,34,35,36,37,38,39,40,41,42,43,44.
综述了目前已报道的llzo基电池的面容量和工作电流密度。完整的电池,这是可逆循环至少100次在室温下,提出。附加细节,如电池配置和可逆周期的数量总结在补充表6.
讨论
电池中的电化学反应发生在电解液和电极之间的界面上。由于碳材料是一种混合的电子-离子导体,Ag-C复合中间层可以被认为是一个电极。因此,如果在负极处使用碳材料作为中间层,则固体电解质与中间层的界面处会发生氧化还原反应。由于碳的锂离子存储能力有限,充电过程中从电解液中输送的锂离子(由正极活性材料提供)有望在早期还原为锂金属。如果Li停留在固体电解质/层间界面,由于Li在固体电解质附近生长,层间无法阻止枝晶穿透。然而,我们已经证明了Li可以在层间和电流集电极之间的界面被镀。由于还原反应发生在固体电解质/层间界面,Li金属从固体电解质/层间界面运输到层间/负极界面。从热力学角度看,理论计算的界面黏附能决定了各界面上的Li稳定性差可能是Li输运的驱动力(图2)。1一个和b).我们的分析确定了以下条件,以确保Li沉积在负极一侧:电流集电极和夹层之间的界面附着力应该很弱(大\ ({W} _{{广告}}\)),而层间与固体电解质之间应强(小\ ({W} _{{广告}}\)).
蠕变是Li变形的主要机理,已被广泛报道45,46,47由于同源温度较高(\ (T / {T} _ {M} \),\ ({T} _ {M} \)为室温下锂金属的熔化温度)(0.66)。充电过程中固体电解质/层间界面的持续Li还原导致持续的应力产生。当Li完全填满Ag-C中间层中的孔隙和空隙后,这种应力驱动Li向负极挤压。通过这种方法,固体电解质可以防止枝晶渗透,因为Li不会在固体电解质/层间界面生长。在放电过程中,整个过程是反向的。固体电解质附近的锂金属首先被氧化为锂离子,形成锂空位。然后,将锂金属变形,以填补空缺。在整个充放电过程中,固体电解质与Ag-C中间层保持接触,避免了由于镀Li和脱Li过程中的高机械应力导致的形貌突变。在这种机制下,电荷电流密度的增加会导致Li在固体电解质/层间界面处快速积累,从而导致严重的应力积聚。因此,在高电流密度下保证循环稳定性需要满足两个条件:(1)Li在层间的输运足够快,以迅速消除应力;(2)固体电解质与层间的粘附足够强,以承受局部应力。 Therefore, a careful design of the interlayer morphology with optimized microstructure, pore structure, and tortuosity would enhance the Li transport kinetics through the interlayer.
综上所述,采用ag包覆的LLZTO、Ag-C复合中间层和用il基电解质添加剂润湿的ncm330基正极制备了准全固态锂电池。理论计算表明,Ag-C中间层可以调节Li向负极侧的沉积,防止Li与LLZTO的直接接触,有效抑制枝晶穿透。溅射Ag层用于提高LLZTO与层间的粘附性。我们提出的无机固态电解质的层间策略表面工程可以建立一个单层实验室规模的Li|Ag- c /Ag/LLZTO/IL|NCM333袋电池,其初始放电容量约为3 mAh/cm2在1.6 mA/cm的频率下,800次循环后,放电容量保持约85%225°C,无需施加外部压力。我们还计算出Li|AgC/Ag/LLZTO/IL|NCM333电池作为单单元电池的预计能量密度为680 Wh/L。我们相信,目前的结果为开发使用无机固态电解质的实用LMBs提供了有价值的见解。
方法
材料
LLZTO(李6.4拉3.Zr1.7助教0.3O12)粉末是由锂的前体混合物合成的2有限公司3.(>99.0%, ChemPoint),路易斯安那州2O3.(莫利矿业98.6%),Ta2O5(99.99%, Sigma-Aldrich)和ZrO2(98%, Zircoa Inc.)使用固态反应方法。混合粉末在950℃空气中焙烧5小时,然后在1200℃焙烧5小时,得到LLZTO粉末。然后使用行星磨机(粉7,弗里奇,德国)在空气中用氧化锆球以300转/分的速度球磨10分钟。球磨重复12次,每隔5分钟。
为了制造致密的球团,LLZTO粉末(100 g)在石墨模具中以3 kpsi的速度热压,然后在1100°C在Ar气氛中以300°C/h的加热速率烧结2 h。根据x射线衍射(XRD)数据计算出LLZTO的理论密度,球团的相对密度估计为>98%。在空气中使用激光切割机将颗粒切割成(直径14 mm,厚度360µm)。接下来,在己烷中进行超声波清洗10分钟,并在800℃的干燥空气中热处理1小时。最后,使用抛光机(LaboForce-3, Struers)将颗粒表面抛光至~350微米的厚度。
采用带铸法制备了电解质薄膜。将LLZTO粉末添加到甲苯和异丙醇的混合溶剂中,然后混合约1小时。鱼油、聚乙烯醇丁醛和邻苯二甲酸丁酯苄酯被添加到浆液中作为粘合剂和分散剂。将所得到的浆料作为薄膜在聚酯薄膜片上除去,然后在120°C下干燥1小时。固体电解质带在1100℃下烧结2 h。
XRD谱图见补充图1揭示颗粒和磁带都有立方石榴石结构。因此,350 μ m厚的颗粒和74 μ m厚的胶带固体电解质的材料性能没有显著差异。
对LLZTO表面进行酸处理,只需在干燥的房间(露点-60°C)以25°C以1:10的重量比(颗粒:酸溶液)将圆盘浸入含有1 M HCl溶液(蒸馏水)的玻璃瓶中,浸泡20分钟即可。为了防止酸溶液中由于Li的释放而造成浓度的局部变化或防止电解质与玻璃容器的紧密接触,在质子化过程中,容器以大约60 rpm的速度在瓶辊中滚动。然后我们除去溶液,用乙醇清洗圆盘,并在干燥的房间里烘干。
电池组装和电化学测量
我们使用了准全固态电池。在每个准全固态电池中,离子液体和固体氧化物电解质(LLZTO)分别用作阴极和阳极电解质。首先,通过射频溅射(SNTEK, 16-SN-055)在LLZTO表面镀上一层200纳米厚的Ag层,Ag靶(99.99%)。溅射温度为22℃,工作压力为5mtorr,功率为150 W,高纯度Ar气体流量为40 sccm。
采用炭黑粉(99.7%,平均粒径为38 nm,朝日碳)和银纳米颗粒(D50 = 60 nm)混合制备了10 μm厚的不锈钢箔表面Ag- c涂层。23.银和炭黑粉末在n -甲基吡啶烷酮(Sigma-Aldrich)中以1:3的重量比与7%重量比的聚偏氟乙烯(Solvay)作为粘结剂进行混合,使用搅拌机(Thinky Corporation, AR-100)持续搅拌(1000 rpm) 30分钟。然后用丝网打印机将所得的浆液涂在SUS箔上,在80°C的空气中干燥20分钟。涂层Ag-C层进一步在100°C真空下干燥12 h。在250 MPa低温等静压(CIP)条件下,Ag-C层作为阳极层附着在酸处理的LLZTO表面。剥去SUS箔后,一层Li金属箔(99.99%,20微米厚,Honjo metal Co., Ltd)通过250 MPa CIP附着在Ag-C表面。市售(李1 + x(倪0.33有限公司0.33锰0.33)1−xO2(NCM333,负载能力:3.2 g/cc,活性物质:96 wt%;厚度:50 μm;三星SDI)和LiCoO2(LCO,负载能力:4.22 g/cc,活性物质:97.6% wt;厚度:46 μm;采用三星SDI作为阴极和集流剂,铝箔(9 μm箔,Nippon foil Mfg。Co., LTD)作为接收。使用n -甲基- n -丙基吡啶双(氟磺酰)酰亚胺(Pyr13FSI, 99.9%,水分< 20ppm,关东化学株式会社)离子液体与2 M双(氟磺酰)酰亚胺锂(LiFSI, 99.9%,水分< 10ppm)盐混合作为阴极。阴极溶液(相对于阴极的20 wt%)在干燥的房间(露点-60°C)中渗透到阴极中,然后保持真空状态2小时。当用Kimwipes清除阴极表面的残留溶液时,阴极吸收溶液的量为~7 wt%。我们将离子液体浸透的阴极放在LLZTO的阴极一侧的单层袋式电池中,然后在真空(750 Torr)下密封电池。
恒电位器(Solartron, SI 1255 FRA)与恒电位器(Solartron, SI 1287 ECI)在25°C下进行恒电位器电化学阻抗谱(PEIS)测量,恒电位器模式开路,频率范围为0.1 Hz至10 kHz,交流扰动为10 mV。所有PEIS数据每十年记录10个频率。在进行PEIS测量之前,将细胞保持在开路电位下10分钟。
采用Toscat-3100电池循环仪(Toyo System)测量了准全固态电池在25℃下的充放电曲线。电池在2.8-4.3 V (vs. Li/Li)和2.8-4.5 V (vs. Li/Li)的电位范围内以恒流-恒压(CV)充电和CV放电模式循环+),分别下载NCM333和LCO。我们对每个样本的5个cell进行评估,以确保数据的可靠性。
此外,利用恒电位交流阻抗谱和Hebb-Wagner极化法测量了对称电池(Au | LLZTO|Au)中350 μ m厚的颗粒状固体电解质和74 μ m厚的带状固体电解质的离子电导率和电子电导率。在25°C外加0.5 V电压的直流极化条件下,用稳态电流估算了LLZTO颗粒和胶带的电导率。为了数据的可靠性,我们为每种电解质评估了五个对称电池。详见补充表1和补充图。2,颗粒和胶带电解质具有几乎相同的离子电导率,电化学稳定窗口可达6 V vs. Li/Li+,离子迁移数(\ ({t} _{{{李 }}^{+}}=\)~ 1)。
所有电化学测试均在恒温环境箱中进行(温度误差:±1°C, Shin Cooperation)。
物理化学特征
我们使用SU-8030 FE-SEM(日立)和能量色散x射线能谱仪(EDS),加速电压为5 kV,工作距离为8 mm,检查了阳极和LLZTO电解质之间界面的截面微观结构。在样品制备过程中,循环电池在一个充满ar的手套箱中被拆卸,在移除阴极后,与Ag/Ag- c /Li阳极接触的LLZTO横截面使用负载锁定室安装到样品架上,以避免空气暴露。
采用拉伸强度试验机(AGS-X,岛津)测定剥离强度,评价LLZTO与中间层之间的粘附强度。在250 MPa条件下,用CIP将阳极夹层附着在经过酸处理的LLZTO表面,以100 mm/min的横头速度拉动SUS箔,测量剥离强度。
计算的细节
所有密度泛函理论(DFT)计算均采用维也纳从头算模拟包(VASP)进行。48.用Perdew-Burke-Ernzerhof参数化的自旋极化广义梯度近似处理交换相关能49.我们使用了在VASP中实现的带有平面波基集的投影增广波赝势50.为了描述van der Waals相互作用,除了金属结构外,采用了Grimme等人提出的DFT-D3色散校正51.所有涉及板几何的计算都使用了400 eV的动能截止值,并进行了结构优化,直到剩余力收敛在0.02 eV/Å以内。为了模拟部分无序LLZTO的原子结构,我们首先生成了各种无序结构并使用Ewald求和pymatgen包52筛选30个能耗最低的建筑。在这里,两个Li位点的Li占位率(24d, 96 h)设置为Awaka等人报道的值。53.然后,我们对筛选的结构进行DFT计算,以确定能量最低的结构。
建立了足够厚真空板(>15 Å)的界面模型来描述LMBs中的各种界面。为了在两种不同材料之间生成界面,首先为每种材料确定最稳定的表面。特别是,根据Canepa等人的工作,具有zr差配置的(100)表面用于LLZTO。54Fe、Cu、Ag选择(111)表面。此外,(100)和(001)表面分别用于锂和石墨。然后,我们对大块结构进行劈裂,形成两个表面板模型。在这里,进行了收敛试验,以确定板的厚度。最后,通过对齐两块表面板形成界面。由于板坯模型的点阵参数不同,我们允许点阵有轻微的角度变形(<3°)或伸长或收缩(<5%),以保证点阵的相容性。所有接口构建过程都使用pymatgenpython包52.
界面结构松弛分两步进行:首先优化两表面之间的距离;然后,将其中一个表面结构横向移动,以确定两个表面结构之间最稳定的对齐。附着能(\ ({W} _{{广告}}\)),通过比较界面结构和孤立表面结构的能量得到。
在哪里\ \ ()是界面面积。\ ({E }_{{{{{{{\ rm{接口 }}}}}}}}\),\ ({E }_{{{{{{{\ rm{衬底 }}}}}}}}\),\ ({E }_{{{{{{{\ rm{电影 }}}}}}}}\)分别为界面、衬底和薄膜结构的能量计算。
采用从头算分子动力学(AIMD)模拟方法观察了界面的结构演化。从上述方法生成的界面模型开始,我们首先通过缓慢加热(0 K到300 K 2 ps)来稳定界面。平衡后,在300k的NVT集成下进行了40 ps的生产运行。
内计算55对碳表面Li扩散的能垒进行了评价。沿扩散路径生成7个中间图像,并进行结构松弛以确定能量分布。
报告总结
有关研究设计的进一步资料,请参阅自然组合报告摘要链接到这篇文章。
数据可用性
本研究中产生或分析的数据可根据合理要求从相应作者处获得。
参考文献
Krauskopf, T., Richter, f.h., Zeier, W. G. & Janek, J.固体电池中锂金属阳极的物理化学概念。化学。牧师。120, 7745-7794(2020)。
于晓霞,王胜。固态电解质对锂电池化学性能的影响。纳特·脱线牧师。2, 1-16(2017)。
赵,Q.,斯大林,S.,赵,c - z。为安全、能量密集的电池设计固态电解质。纳特·脱线牧师。5, 229-252(2020)。
Famprikis, T., Canepa, P., Dawson, J. A., Islam, M. S. & Masquelier, C.电池用无机固态电解质基础知识。Nat。板牙。18, 1278-1291(2019)。
Murugan, R., Thangadurai, V. & Weppner, W.石榴石型锂的快速锂离子传导7拉3.Zr2O12.Angew。化学。Int。艾德。46, 7778-7781(2007)。
赵宁等。固体石榴石电池。焦耳3., 1190-1199(2019)。
Jalem, R.等人。石榴石型锂离子动力学中的协同迁移机制7拉3.Zr2O12.化学。板牙。25, 425-430(2013)。
萨姆森,A. J.,霍夫斯泰特,K., Bag, S. & Thangadurai, V.锂填充石榴石型锂的鸟瞰图7拉3.Zr2O12用于先进全固态锂电池的陶瓷电解质。能源环境。科学。12, 2957-2975(2019)。
Miara, L. J., Richards, W. D., Wang, Y. E. & Ceder, G.锂石榴石阳离子掺杂剂和电解质|阴极界面相的第一性原理研究。化学。板牙。27, 4040-4047(2015)。
Meier, K., Laino, T. & Curioni, A.固态电解质:揭示锂离子在四方和立方LLZO中的传导机制第一性原理计算。期刊。化学。C。118, 6668-6679(2014)。
Krauskopf, T., Mogwitz, B., Rosenbach, C., Zeier, W. G. & Janek, J.锂金属和锂- mg合金阳极在LLZO型固体电解质上扩散限制的温度和压力函数。能量脱线。9, 1902568(2019)。
克劳斯科普夫,T.等人。石榴石型固体电解质Li上锂金属阳极的快电荷转移动力学6.25艾尔0.25拉3.Zr2O12.能量脱线。10, 2000945(2020)。
Kasemchainan, J.等人。在锂阳极固体电解质电池中,临界剥离电流会导致镀层上形成枝晶。Nat。板牙。18, 1105-1111(2019)。
宁,Z.等。锂阳极固体电解质电池中电镀诱导开裂的可视化。Nat。板牙。20., 1121-1129(2021)。
Ping, W.等。石榴石基固态电池的可逆短路行为。能量脱线。10, 2000702(2020)。
徐,H.等。李3.全固态锂金属电池的n -改性石榴石电解质,工作温度为40℃。Nano。18, 7414-7418(2018)。
金,S.等。通过石榴石型固体电解质,层间化学在锂金属生长中的作用。能量脱线。10, 1903993(2020)。
陈,Y.等。SnO转化反应形成纳米复合材料中间层2Li/石榴石/Li循环稳定性。J.电源来源420, 15-21(2019)。
Shi, K.等。高压全固态锂金属电池超稳定导电复合界面的原位构建。Angew。化学。Int。艾德。59, 11784-11788(2020)。
霍,等。一种用于无枝晶固体锂金属电池的柔性电子屏蔽界面。Commun Nat。12, 176(2021)。
Hitz, g.t.等人。可扩展的三层锂石榴石电解质结构中的高速率锂循环。板牙。今天22, 50-57(2019)。
金,S.等。高能量和耐用的锂金属电池采用石榴石型固体电解质,具有定制的锂金属兼容性。Commun Nat。13, 1883(2022)。
李,Y.-G。et al。由银碳复合阳极实现的高能长循环全固态锂金属电池。Nat。能源5, 299-308(2020)。
Jin, S.等。高可逆锂金属阳极的固溶基金属合金相。j。化学。Soc。142, 8818-8826(2020)。
金世勇,李娟。固体电池多孔混合离子电子导体夹层。能源板牙。阿德.2021,https://doi.org/10.34133/2021/1519569(2021)。
李,D, Kato, Y, Kobayakawa, K, Noguchi, H. & Sato, Y. LiNi的制备及电化学特性1/3锰1/3有限公司1/3O2涂有金属氧化物涂层。J.电源来源160, 1342-1348(2006)。
陈晓明,饶志强,李志强,李志强,李志强。锂离子动力学对层状锂(Ni)阴极性能的影响1/3有限公司1/3锰1/3阿)2.j . Electrochem。Soc。151, a1324(2004)。
黄,Z.-D。et al。微观多孔,互连单晶LiNi1/3有限公司1/3锰1/3O2锂离子电池正极材料。j .板牙。化学。21, 777 - 10784(2011)。
韩,F.等。界面工程使全陶瓷锂电池成为可能。焦耳2, 497-508(2018)。
邵,Y.等。绘制软界面:石榴石型固态锂电池的有效界面改性策略。ACS Energy Lett。3., 1212-1218(2018)。
Luo, W.等。通过锗层降低石榴石结构固态电解质和锂金属阳极之间的界面电阻。放置板牙。29, 1606042(2017)。
Ohta, S., Kobayashi, T., Seki, J. & Asaoka, T.全固态锂离子电池与石榴石型氧化物电解质的电化学性能。J.电源来源202, 332-335(2012)。
陈,S.等。全固态电池在室温下使用石榴石基电解质,具有有限的锂金属阳极。放置板牙。33, 2002325(2021)。
刘,B.等。石榴石固体电解质保护锂金属电池。ACS达成。板牙。接口9, 18809-18815(2017)。
阮,Y.等。石榴石型固态锂电池的三维交联亲石和电子绝缘界面工程。放置功能。板牙。31, 2007815(2021)。
陈,C.等。用于室温固态电池的硅阳极和石榴石电解质之间的可持续界面。ACS达成。板牙。接口10, 2185-2190(2018)。
Lan, W.等。意识到李7拉3.Zr2O12石榴石具有高Li+导电性和致密微结构,通过Ga/Nb双替代锂固态电池的应用。持续能源燃料。4, 1812-1821(2020)。
田,杨,等。李6.75拉3.Zr1.75助教0.25O12@amorphous李3.用于固态锂金属电池的OCl复合电解质。储能线。14, 49-57(2018)。
张俊,李俊,翟海华,谭刚,唐旭。高性能固态锂电池软电解质/金属锂界面的一步法加工。ACS达成。能源板牙。3., 6139-6145(2020)。
杜贝,R.等人。与锑建立更好的锂石榴石固体电解质/金属锂界面。能量脱线。11, 2102086(2021)。
杨,L.等。用于锂金属固态电池的高导电石榴石陶瓷的高效互补偿锂损耗策略。ACS达成。板牙。接口13, 56054-56063(2021)。
傅,K. K.等。石榴石电解质锂金属电池:超薄,高效,人工固态电解质/金属锂界面。科学。睡觉。3., e1601659(2017)。
李,X.等。锶锑共掺锂的合理设计7拉3.Zr2O12固态锂电池电解液膜。j .合金。化合物。794, 347-357(2019)。
霍,等。原位形成的锂2有限公司3.无枝晶固态电池的快速酸处理。纳米能量61, 119-125(2019)。
陈,Y.等。固态电池中锂金属的Coble蠕变沉积和剥离。自然578, 251-255(2020)。
王哲,等。3D固态锂金属电池。化学6, 2878-2892(2020)。
LePage, W. S.等。锂力学:应变率和温度的作用以及对锂金属电池的影响。j . Electrochem。Soc。166, a89(2019)。
Kresse, G. & Furthmüller, J.使用平面波基集从头算总能量计算的有效迭代方案。理论物理。启B54, 11169-11186(1996)。
裴杜,柏克,K. &恩泽霍夫,M.广义梯度近似简化。理论物理。启。77, 3865-3868(1996)。
Blöchl, p.e.投影增波法。理论物理。启B50, 17953-17979(1994)。
格里姆,埃利希,S. & Goerigk .色散校正密度泛函理论中阻尼函数的影响。j .第一版。化学。32, 1456-1465(2011)。
Ong, s.p.等。Python Materials Genomics (pymatgen):一个用于材料分析的健壮的开源Python库。第一版。板牙。科学。68, 314-319(2013)。
Awaka, J.等人。快速锂离子导电立方锂的晶体结构7拉3.Zr2O12.化学。列托人。40, 60-62(2010)。
Canepa, P.等人。颗粒形貌和锂在锂表面的偏析7拉3.Zr2O12固体电解质。化学。板牙。30., 3019-3027(2018)。
Henkelman, G., Uberuaga, B. P. & Jónsson, H.一种用于寻找鞍点和最小能量路径的爬升图像轻推弹性带方法。j .化学。理论物理。113, 9901-9904(2000)。
确认
这项工作得到三星电子有限公司的资金支持。
作者信息
作者及隶属关系
贡献
j.s.k.和G.Y.构思和设计了整个实验,分析了数据,并撰写了手稿。j.s.k.和S.K.完成了所有的电化学实验。G.Y.对阳极-固体电解质界面的粘附能进行了DFT计算。S.S., n.y.和S.S.制备了AgC阳极夹层,并测量了LLZTO和AgC夹层之间的剥离强度。R.K.检测了LLZTO与AgC夹层界面的截面微观结构。m.b.、z.s.和J.C.制备了带铸LLZTO电解液。D.I.监督了研究,讨论了结果,并对手稿进行了评论。所有作者都参与了讨论,并为实验设计提供了建设性意见。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然通讯感谢其他匿名审稿人对本工作的同行评审所作的贡献。同行评审报告是可用的。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
金,JS。,Yoon, G., Kim, S.et al。基于层间策略的无机固态电解质表面工程用于开发长循环准全固态锂电池。Nat Commun14, 782(2023)。https://doi.org/10.1038/s41467-023-36401-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-023-36401-7