摘要gydF4y2Ba
间充质干/间质细胞(MSCs)分布在身体的所有组织中。虽然这些细胞以产生结缔组织和骨骼而闻名,但它们也显示出免疫调节特性。由于培养扩张型间充质干细胞越来越多地用于治疗炎症,特别是危及生命的免疫疾病,因此迫切需要对间充质干细胞生物学有更多的了解。虽然体外研究为其免疫调节能力提供了充分的证据,但尚不清楚间充质干细胞的组织定殖是否对其抑制/抵消体内免疫病理演变的能力至关重要。为了解决这个问题,我们采用了由供体富含脾细胞的全mhc不匹配造血干细胞移植引起的小鼠暴发性免疫介导炎症,急性移植物抗宿主病(aGvHD)模型。aGvHD诱导病变内皮层内e-选择素的表达,通过强制表达HCELL(一种CD44糖型,是一种有效的e-选择素配体)来实现系统性管理的宿主来源间充质干细胞的组织特异性募集。与接受HCELL的小鼠相比gydF4y2Ba−gydF4y2BaMSCs, HCELL的受体gydF4y2Ba+gydF4y2BaMSCs增加了agvhd影响部位的MSC嵌入,减少了白细胞浸润,降低了全身炎症细胞因子水平,更好的组织保存,并显著提高了生存率。机制研究表明,HCELL/CD44在MSC表面的连接通过诱导MSC分泌多种有效的免疫调节分子,包括IL-10,显著增强了MSC的免疫调节活性。这些发现表明间充质干细胞在原位中和免疫病理,并强调CD44参与释放间充质干细胞免疫生物学特性,维持/建立组织免疫稳态的作用。gydF4y2Ba
简介gydF4y2Ba
免疫系统最具挑战性的任务与其说是对给定的抗原产生反应,不如说是避免过度反应,以免产生强烈的免疫病理反应。为了避免在免疫“战场”中危及生命的组织破坏,免疫反应性必须通过同步免疫静止来平衡,从而重新建立免疫稳态。理想情况下,免疫稳态效应细胞将被天然地嵌入受影响的组织中,在不触发全身免疫抑制的情况下,局部抑制过度的炎症反应。gydF4y2Ba
间充质干/间质细胞gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba成体干细胞/祖细胞分布在身体的每个器官和组织中。在成年哺乳动物中,这些细胞最容易从脂肪组织和骨髓中获得,但也可以从脐带和牙髓等其他组织中获得。虽然这些细胞以骨细胞、脂肪细胞和软骨细胞的祖细胞而闻名,但大量体外研究表明,培养扩张的间充质干细胞具有强大的免疫调节特性gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba.MSC的免疫调节活性是通过多种分泌分子介导的(如转化生长因子-β (TGFβ),吲哚胺2,3 -双加氧酶(IDO),一氧化氮(NO)和前列腺素EgydF4y2Ba2gydF4y2Ba(铂族元素gydF4y2Ba2gydF4y2Ba))以及通过细胞与细胞的直接接触gydF4y2Ba2gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.这些特性提出了一个假设,即如果原位(即受感染组织内)存在足够数量/密度的间充质干细胞,以抑制炎症效应物的危及生命的影响,那么面对丰富的免疫反应性的组织完整性可以保持。然而,尽管临床前和临床研究提供了令人信服的证据,MSCs介导免疫调节gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba在美国,我们缺乏关于MSC组织浸润是否是这种效应的关键,以及微环境成分是否触发了这种MSC生物学的知识。获得这一知识的一个主要障碍是间充质干细胞缺乏细胞迁移的分子效应。因此,当系统给药时,培养扩张的间充质干细胞不能有效地外渗到炎症部位,因此不能在解剖学上定位所需的部位gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
循环细胞的外渗严重依赖于它们能够以足够的强度粘附在血管内皮细胞上,以克服血流的剪切力。这一过程主要是由一种被称为“选择素”的凝集素家族调控的,它与一种被称为“唾液化Lewis X”(sLe)的四糖决定因素结合gydF4y2BaXgydF4y2Ba;CD15s)。该结构由末端型2乳糖胺(即,半乳糖(Gal) β(1,4)-连接到n -乙酰氨基葡萄糖(GlcNAc)),含有唾液酸(NeuAc)和焦点(Fuc)取代:NeuAc-α(2,3)-Gal-β(1,4)-[Fuc-α(1,3)]-GlcNAc-α1- r。骨髓间充质干细胞本身缺乏sLe的表现gydF4y2BaXgydF4y2Ba,因此不表达内皮选择素“e -选择素”(CD62E)的配体。gydF4y2Ba17gydF4y2Ba.然而,间充质干细胞一致表达CD44,这是一种糖蛋白,以透明质酸(HA)的主要受体而闻名。gydF4y2Ba18gydF4y2Ba.值得注意的是,MSC CD44被末端唾液化的2型乳酸胺修饰gydF4y2Ba19gydF4y2Ba,仅缺乏与GlcNAc连接的α(1,3)-中心点的存在,从而完成sLe的形成gydF4y2BaxgydF4y2Ba行列式。CD44被红斑狼疮修饰gydF4y2BaXgydF4y2Ba被称为造血细胞E-/ l -选择素配体(HCELL)。gydF4y2Ba19gydF4y2Ba,一种CD44糖变异,是一种高效的e -选择素配体。因此,α(1,3)-外集中修饰的MSC CD44强化HCELL表达,编程MSC迁移到含有e -选择素的内皮层gydF4y2Ba20.gydF4y2Ba.重要的是,间充质干细胞具有β1整合素VLA-4的特征,在没有趋化因子信号的情况下,HCELL与血管e -选择素的接合导致VLA-4的直接激活;随后激活的VLA-4与其内皮配体VCAM-1结合,导致牢固的阻滞和外渗gydF4y2Ba21gydF4y2Ba.由于e -选择素和VCAM-1的表达都是由促炎细胞因子TNF-α和IL-1诱导的,因此,这两种分子始终存在于免疫病理部位的内皮床中gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba在美国,同时表达HCELL和vra -4的血源性细胞被诱导到炎症部位。gydF4y2Ba
为了研究早期免疫介导的组织破坏的损伤部位内的MSC定植是否会产生免疫调节,我们采用了一种高度可重复性的小鼠免疫病理模型:供体脾细胞富集的全mhc不匹配的异基因造血干细胞移植(异基因hsct /S)诱导致命的急性移植物抗宿主病(aGvHD)。我们分析了移植后早期系统给予未修饰的宿主型小鼠AdMSCs(“UmAdMSCs”,即HCELL)的影响gydF4y2Ba−gydF4y2BamAdMSCs)和聚焦宿主型AdMSCs(“FucmAdMSCs”,即HCELL)gydF4y2Ba+gydF4y2BamAdMSCs对组织免疫病理和宿主生存的影响。我们的研究结果表明,HCELL的管理gydF4y2Ba+gydF4y2BamAdMSCs导致aGvHD中mAdMSCs定向招募到病变组织,相应抑制炎症浸润,逆转血清促炎:抗炎细胞因子的比例,阻止/预防免疫病理,从而提高生存率。机制研究表明,小鼠或人间充质干细胞表面CD44的连接,无论是通过HCELL结合到e -选择素,还是通过CD44结合到其天然配体透明质酸(HA),通过触发MSC分泌多种免疫抑制分子,增强了MSC的免疫调节。这些发现揭示了组织定植间充质干细胞作为免疫稳态的关键效应因子的细胞生物学,表明CD44参与释放间充质干细胞的免疫调节活性,并为如何利用内皮细胞e-选择素显示的病理生理显示来预防和/或逆转免疫病理提供了基本的新见解。gydF4y2Ba
结果gydF4y2Ba
aGvHD靶组织微血管内e -选择素表达上调gydF4y2Ba
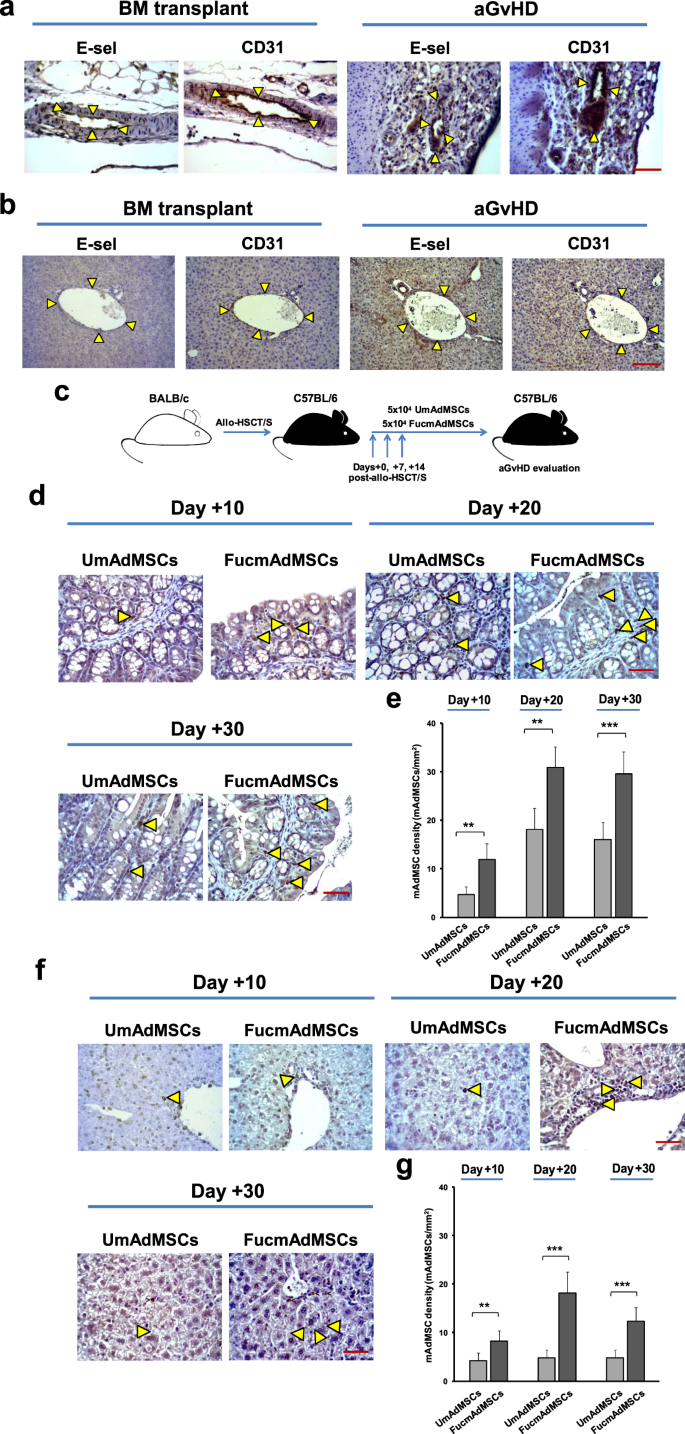
通过免疫组织化学方法评估健康C57BL/6小鼠皮肤、肝脏和肠道样本中血管e -选择素的表达(H-2gydF4y2BabgydF4y2Ba),以及来自移植mhc错配BALB/c (H-2 . c)的C57BL/6小鼠gydF4y2BadgydF4y2Ba)有供体脾细胞(“异基因hsct /S”组)或不含脾细胞(“异基因hsct”组)的骨髓。在没有aGvHD的小鼠(健康C57BL/6小鼠和“只接受骨髓”即不添加供体脾细胞的异基因hsct小鼠)中,在皮肤、肝脏或肠道血管中未观察到明显的e -选择素染色。然而,在异基因hsct /S小鼠(所有小鼠都出现了红亮的aGvHD,并在移植后14天内死亡)中,肠道中的微血管(图。gydF4y2Ba1gydF4y2Ba)、肝脏(图;gydF4y2Ba1 bgydF4y2Ba)和皮肤(补充图。gydF4y2Ba1gydF4y2Ba)一致显示e -选择素,在连续切片中与内皮标志物CD31共定位。值得注意的是,肠道和肝脏中e -选择素的表达强度均高于皮肤。gydF4y2Ba
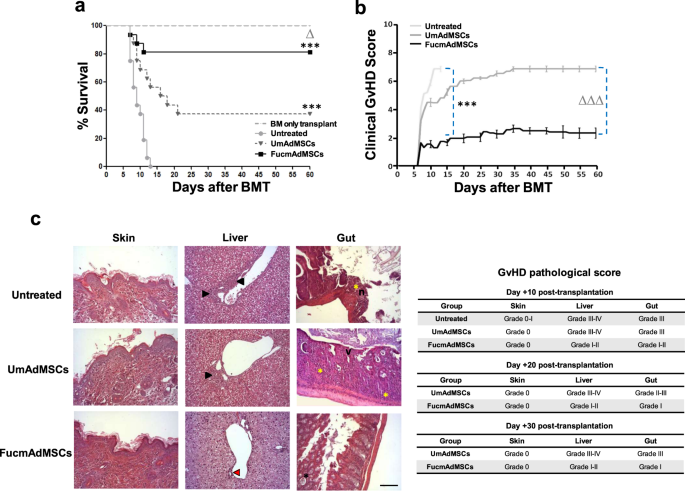
一个gydF4y2BaC57BL/6肠连续切片免疫组化染色,或gydF4y2BabgydF4y2Ba与骨髓移植小鼠(无aGvHD)相比,持续aGvHD小鼠肝脏中显示e -选择素和内皮标记物CD31(箭头分隔)共定位(放大倍率×400,比例尺:50 μm) (gydF4y2BangydF4y2Ba每组= 5只小鼠)。结果具有代表性gydF4y2BangydF4y2Ba= 5个独立的实验。gydF4y2BacgydF4y2Ba异基因hsct /S后mAdMSCs给药的实验方案示意图。gydF4y2BadgydF4y2Ba小肠切片,或者gydF4y2BafgydF4y2Ba肝脏显示来自持续aGvHD的受体C57BL/6小鼠,给予gfp -转基因madmscs未修饰(UmAdMSCs)或ftvii修饰(FucmAdMSCs)。采用抗GFP ABC比色免疫组化法检测GFP的表达。移植后第10、20和30天,两组治疗动物的小肠和肝脏的代表性图像显示GFP浸润gydF4y2Ba+gydF4y2BamAdMSCs(放大倍率×200,比例尺100 μm)。箭头表示渗透绿色荧光蛋白gydF4y2Ba+gydF4y2Ba分别在肠固有层和肝门静脉区发现mAdMSCs。柱状图代表绝对的GFPgydF4y2Ba+gydF4y2BamAdMSC渗透计算在内gydF4y2BaegydF4y2Ba小肠,或者gydF4y2BaggydF4y2Ba肝脏相对于1毫米计数的平均值±标准差gydF4y2Ba2gydF4y2Ba(gydF4y2BangydF4y2Ba每组= 5只小鼠)。绿色荧光蛋白gydF4y2Ba+gydF4y2Ba与UmAdMSCs相比,FucmAdMSCs受体的mAdMSCs浸润明显增加,**gydF4y2BapgydF4y2Ba< 0.01或***gydF4y2BapgydF4y2Ba< 0.001, resgydF4y2BapgydF4y2Ba主观上采用单因素方差分析,采用Tukey多重比较检验。gydF4y2Ba
Systemically-administered带有HCELLgydF4y2Ba+gydF4y2BamAdMSC在受aGvHD影响的组织中定植,但在淋巴器官中不定植gydF4y2Ba
与培养扩增的小鼠骨髓来源MSCs一样,培养扩增的mAdMSCs本身缺乏sLe的表达gydF4y2BaxgydF4y2Ba,相应的,不与e -选择素结合gydF4y2Ba24gydF4y2Ba.如先前报道的,利用聚焦转移酶VII (FTVII)外聚焦化mAdMSCs通过安装sLe显示产生强大的e -选择素结合gydF4y2BaxgydF4y2Ba对CD29、CD44、CD49d、CD73、CD90、CD105、CD106和CD166等特征标志物的表达没有影响,对细胞分化为脂肪细胞、软骨细胞或成骨细胞的能力也没有影响gydF4y2Ba17gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
为了分析强制HCELL表达对mAdMSC组织定植的影响,我们使用了受体型GFPgydF4y2Ba+gydF4y2BamAdMSCs在全身给药后追踪实质分布。为此,异基因hsct /S小鼠接受5 × 10gydF4y2Ba4gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2Ba移植后第0天、+7天和+14天静脉注射mAdMSCs,无论是否外聚焦(FucmAdMSCs)(示意图见图)。gydF4y2Ba1 cgydF4y2Ba).绿色荧光蛋白gydF4y2Ba+gydF4y2Ba然后通过免疫组织化学方法在受体小鼠的肠系膜和外周淋巴结、脾脏、皮肤、肝脏和肠道中鉴定mAdMSCs。在移植后的任何时间点,在任何淋巴组织或皮肤中均未检测到FucmAdMSCs和UmAdMSCs。然而,早在hsct后第10天(+ 10天),外聚焦的mAdMSC显示出明显的肠向性,在肠固有层的FucmAdMSC浸润比接受UmAdMSCs的小鼠高3倍。肠浸润稳定增加,在hsct后+20天趋于稳定(图。gydF4y2Ba1 d, egydF4y2Ba).同样,用FucmAdMSCs处理的动物在+10、+20和+30天获得的肝脏的组织学分析显示,GFP的数量显著增加gydF4y2Ba+gydF4y2Ba与接受UmAdMSCs的小鼠相比,肝门静脉周围区域的细胞减少了(图2)。gydF4y2Ba1 f, ggydF4y2Ba).gydF4y2Ba
强制mAdMSC在aGvHD靶点内定植可以提高生存率,降低aGvHD的临床和组织病理学严重程度,并显著减少T细胞和中性粒细胞病变浸润gydF4y2Ba
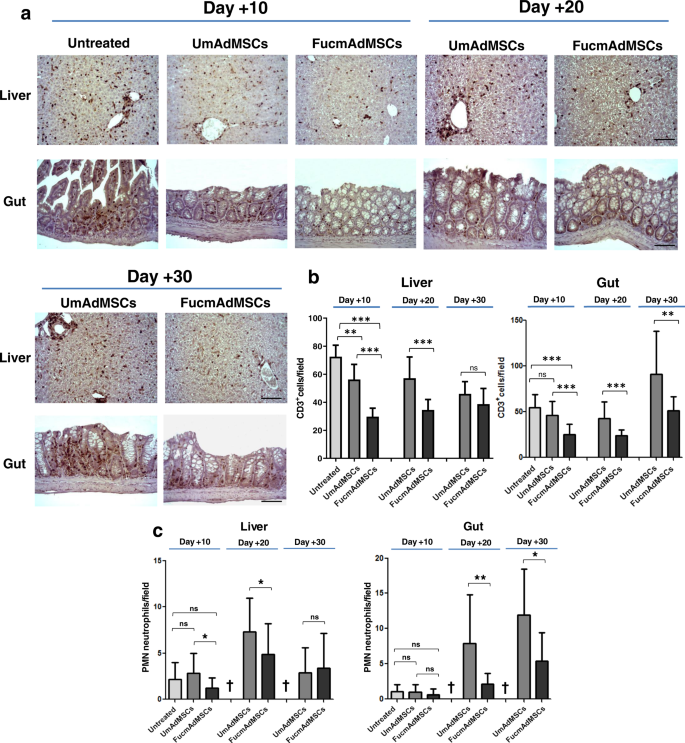
为了评估aGvHD靶点内增强的mAdMSC组织浸润是否会影响免疫介导的组织损伤,我们在接受异基因hsct和异基因hsct /S的动物中评估临床结果和组织组织学,没有或有静脉输注5 × 10gydF4y2Ba4gydF4y2Ba移植后第0、+7和+14天,接收人类型的UmAdMSC或FucmAdMSCs。异基因hsct组(即“仅移植BM组”)的小鼠没有发生aGvHD,而接受无mAdMSC的异基因hsct /S组(“未治疗组”)的小鼠表现出快速的aGvHD发展,导致所有小鼠在移植后14天内死亡(图2)。gydF4y2Ba2gydF4y2Ba).移植后早期注射UmAdMSCs的异基因hsct /S小鼠与未注射mAdMSCs的小鼠相比,agvhd相关的死亡率显著降低(gydF4y2BapgydF4y2Ba< 0.001),但与接受UmAdMSCs的患者相比,灌注FucmAdMSCs的患者具有明显的生存优势(82%对38%的生存率,gydF4y2BapgydF4y2Ba< 0.05)。如图所示。gydF4y2Ba2 bgydF4y2Ba,经fucmadmsc治疗组动物的生存率显著提高,与临床aGvHD评分的持续降低相关,显著低于接受UmAdMSCs或未接受mAdMSCs的小鼠(gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2Ba
C57BL/6受体小鼠经尾静脉1 × 10静脉移植gydF4y2Ba7gydF4y2Ba骨髓细胞(“骨髓仅移植”)或1 × 10gydF4y2Ba7gydF4y2Ba1.5 × 10富集的骨髓细胞gydF4y2Ba7gydF4y2Ba供体脾细胞诱导aGvHD(“异基因hsct /S”)。+0、+7、+14天同种异体hsct /S受体小鼠静脉输注5 × 10gydF4y2Ba4gydF4y2BamAdMSCs,无论是未修饰的(“UmAdMSCs”小鼠)还是ftvii修饰的mAdMSCs(“FucmAdMSCs”小鼠)。在同一时期,另一组异基因hsct /S小鼠接受等量的盐水溶液(“未处理”小鼠)。gydF4y2Ba一个gydF4y2Ba不同组受体C57BL/6的Kaplan-Meier生存曲线为(gydF4y2BangydF4y2Ba=每组16只)。给予HCELL的所有hsct /S小鼠的存活率gydF4y2Ba+gydF4y2BamAdMSCs(“FucmAdMSCs”)明显高于异基因hsct /S“未处理”组(即未使用mAdMSCs) (***)gydF4y2BapgydF4y2Ba< 0.001)或与接受UmAdMSCs的异基因hsct /S小鼠(gydF4y2BaΔgydF4y2BapgydF4y2Ba< 0.05),采用Log-rank (mantle - cox)检验。gydF4y2BabgydF4y2Ba每个实验组的临床aGvHD评分采用由5个临床个体评分(体重减轻、姿势、活动、皮毛纹理和皮肤完整性(最大指数= 10))组成的综合评分系统进行评估。HCELL给药的异基因hsct /S小鼠临床aGvHD评分gydF4y2Ba+gydF4y2Ba与“未处理”组相比,mAdMSCs(“FucmAdMSCs”)显著减少(***gydF4y2BapgydF4y2Ba< 0.001)或与注射UmAdMSCs的小鼠(gydF4y2BaΔΔΔgydF4y2BapgydF4y2Ba< 0.001),采用Tukey多重比较检验进行单因素方差分析。gydF4y2BacgydF4y2Ba在移植后+10天,通过苏木精和伊红(H&E)染色,评估不同实验组小鼠皮肤、肝脏和肠道远端区域的组织病理学aGvHD评分。在皮肤中,未发现明显的组织病理学病变。在肝脏中,未治疗组和umadmscs治疗组的> - 50%的胆管(黑色箭头)周围可发现炎症浸润,而在fucmadmscs治疗组的肝脏中,75-50%的胆管(红色箭头)未受影响。在肠道方面,在未处理组和umadmscs处理组中可以发现中度绒毛萎缩(v)、局灶性粘膜溃疡(n)和炎症浸润(黄色星号),在FucmAdMSCs肠道中可以发现轻度炎症浸润和/或隐窝上皮细胞凋亡(黑色星号)。不同器官的H&E染色图像(放大倍率×200,比例尺:100 μm)具有代表性gydF4y2BangydF4y2Ba每组8只。gydF4y2Ba
从+10天开始,通过aGvHD靶器官的组织病理学分级来测量GvHD病理评分。尽管移植后早期小鼠皮肤未发现明显病变,但肝脏和肠道的组织学分析显示,治疗组之间aGvHD的严重程度存在显著差异。未治疗组和umadmsc治疗组的肝脏表现出广泛的上皮损伤,大量的门脉周围炎症浸润和大部分胆管破坏(III-IV级aGvHD),而fucmadmsc治疗组的小鼠仅表现出轻微的肝损伤(I-II级)(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).此外,未处理小鼠或接受UmAdMSCs的小鼠的小肠同样表现出局灶性粘膜溃疡和中度绒毛萎缩(III级),而接受FucmAdMSCs的小鼠的小肠只有分散的单个凋亡细胞和有限的绒毛萎缩(I-II级)。值得注意的是,在移植后的晚些时候(+20和+30天),与umadmsc治疗的小鼠相比,接受FucmAdMSCs治疗的小鼠在肝脏和小肠中显示出更少的agvhd相关损伤(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
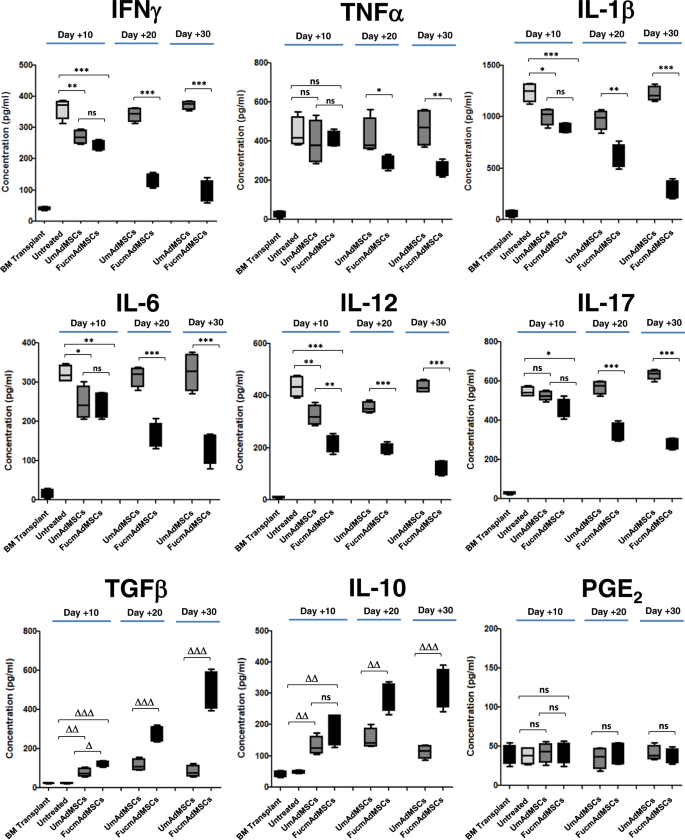
考虑到T细胞浸润量与agvhd影响器官病变严重程度之间的相关性gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,我们分析了CD3水平gydF4y2Ba+gydF4y2Ba异基因hsct /S后不同时间点存活动物皮肤、肝脏和肠道内的T细胞。未接受mAdMSCs的小鼠肝脏在+10天的肝门静脉三联内显示出大量和广泛的炎性T细胞浸润,这明显高于两个mAdMSCs治疗组(gydF4y2BapgydF4y2Ba< 0.001),在fucmadmsc处理的小鼠中观察到最低水平(图。gydF4y2Ba3 a, bgydF4y2Ba).值得注意的是,hsct /S后10-20天后,CD3gydF4y2Ba+gydF4y2Ba与umadmsc治疗组相比,接受FucmAdMSCs治疗的动物肝脏中的T细胞计数显著降低(gydF4y2BapgydF4y2Ba< 0.001)。在hsct后较长时间(+30天),存活的umadmsc治疗动物肝脏中的T细胞负担显著降低,显示出与fucmadmsc治疗组相似的水平。在+10和+20天存活小鼠的肠固有层中也观察到浸润T细胞数量减少的相同趋势,尽管umadmsc处理的小鼠与fucmadmsc处理的小鼠相比,肠道中浸润T细胞的数量始终较高(gydF4y2BapgydF4y2Ba< 0.01)。然而,有趣的是,在madmsc处理的小鼠中,肠道T细胞浸润在+20天和+30天之间增加到高于+10天和+20天的水平,但与UmAdMSC相比,fucmadmsc处理的小鼠的浸润始终较少(图2)。gydF4y2Ba3 a, bgydF4y2Ba).gydF4y2Ba
在异基因hsct /S后10天、20天或30天后,从患有持续aGvHD的动物(未治疗或用任何一种mAdMSCs治疗)中分离出组织。gydF4y2Ba一个gydF4y2BaCD3gydF4y2Ba+gydF4y2Ba采用标准抗cd3 ABC比色免疫组化法检测T细胞炎症浸润。CD3的代表性图像gydF4y2Ba+gydF4y2Ba不同组小鼠肝脏和肠道内T细胞浸润(放大倍率×200,比例尺:100 μm)。gydF4y2BabgydF4y2Ba柱状图描述了T细胞的绝对数量(CD3gydF4y2Ba+gydF4y2Ba单元),以相对于10个高功率场计数的每个高功率场的平均值±SD表示(放大倍率×200) (gydF4y2BangydF4y2Ba每组= 5只小鼠)。与未处理的小鼠相比,接受UmAdMSCs和FucmAdMSCs的小鼠的T细胞浸润显著减少,接受FucmAdMSCs的小鼠的T细胞浸润最低(**gydF4y2BapgydF4y2Ba< 0.01或***gydF4y2BapgydF4y2Ba< 0.001),采用Tukey多重比较检验进行单因素方差分析。gydF4y2BacgydF4y2Ba根据分叶状核的特征性形态外观,在组织切片上鉴定pmn。绝对PMN计数表示为相对于10个高功率场计数的每个高功率场的平均值±标准差(放大倍率×400) (gydF4y2BangydF4y2Ba每组= 5只小鼠)。如星号所示,接受UmAdMSCs的小鼠与接受FucmAdMSCs的小鼠在PMN浸润程度上有统计学差异,*gydF4y2BapgydF4y2Ba< 0.05或**gydF4y2BapgydF4y2Ba< 0.01, resgydF4y2BapgydF4y2Ba主观上采用单因素方差分析,采用Tukey多重比较检验。gydF4y2Ba
除了T细胞浸润水平外,agvhd影响器官中中性粒细胞数量的增加也是疾病严重程度的高度预测因素gydF4y2Ba28gydF4y2Ba.因此,我们分析了接受异基因hsct /S的存活小鼠肝脏和肠道中中性粒细胞的浸润(图2)。gydF4y2Ba3 cgydF4y2Ba).在+10天,未治疗组、umadmsc处理组和fucmadmsc处理组小鼠的肝脏和肠道出现少量中性粒细胞浸润,与预期的中性粒细胞减少一致(即,植入前)。然而,在+20天,umadmsc处理的小鼠肝脏和肠道中中性粒细胞浸润显著,而fucmadmsc处理的小鼠中中性粒细胞浸润稀疏,特别是在肠道中(gydF4y2BapgydF4y2Ba< 0.01)。在+30天与+20天相比,与观察到的浸润T细胞相似,存活小鼠肝脏中中性粒细胞浸润减少,但肠道中浸润增加。然而,与UmAdMSCs治疗的小鼠相比,接受FucmAdMSCs治疗的小鼠在这些器官中显示出更低的中性粒细胞数量。在移植后+20天和+30天接受FucmAdMSCs的动物,肠道mAdMSCs数量的增加与肠道T细胞和中性粒细胞负担的降低之间存在密切的线性负相关关系(T细胞和中性粒细胞的Pearson相关系数分别为−0.574和−0.897)。重要的是,在任何治疗组之间,外周血白细胞计数没有显著差异(值×10gydF4y2Ba3.gydF4y2Ba(1)未处理的淋巴细胞为1.63 +/−0.21,中性粒细胞为0.24 +/−0.12;(2) umadmsc处理的1.78 +/−0.59淋巴细胞和0.38 +/−0.17中性粒细胞;(3) fucmadmsc处理1.97 +/−0.80淋巴细胞和0.30 +/−0.22中性粒细胞),表明观察到的淋巴细胞和中性粒细胞组织浸润水平的差异不是由于造血植入水平的变化。gydF4y2Ba
在aGvHD小鼠中给予FucmAdMSC显著改变了促炎和抗炎细胞因子的血浆水平gydF4y2Ba
除了组织内深刻的细胞变化,与其他结果一致gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,我们观察到接受异基因hsct /S而不输注mAdMSC的小鼠(即未经治疗的动物)在移植后+10天血浆促炎细胞因子IFNγ、TNFα、IL-1β、IL-6、IL-12和IL-17水平显著升高,而抗炎细胞因子TGFβ和IL-10水平较低(图2)。gydF4y2Ba4gydF4y2Ba).重要的是,与未处理的小鼠相比,UmAdMSCs或FucmAdMSCs的促炎介质大幅减少,在接受FucmAdMSCs的小鼠中,TNFα、IL-1β、IL-6、IL-12和IL-17的水平显著降低。血浆PGE浓度gydF4y2Ba2gydF4y2Ba,一种由间充质干细胞释放的抗炎因子gydF4y2Ba8gydF4y2Ba,在任何治疗组中都没有变化,但接受mAdMSCs的小鼠抗炎细胞因子TGFβ和IL-10水平增加,而接受FucmAdMSCs的小鼠抗炎细胞因子水平明显更高。因此,与接受UmAdMSCs治疗的小鼠相比,接受fucmadmsc治疗的小鼠表现出更持久和更深刻的促炎细胞因子血浆水平的抑制,而抗炎细胞因子则表现出更高和更持续的增加。gydF4y2Ba
促炎因子IFNγ、TNFα、IL-1β、IL-6、IL-12和IL-17以及抗炎分子TGFβ、IL-10和PGE的血浆浓度gydF4y2Ba2gydF4y2Ba在移植后+10、+20、+30天用ELISA法测定。数据以平均值±标准差表示gydF4y2BangydF4y2Ba每组= 5只。如图所示,在给予FucmAdMSCs后,所有检测的炎性细胞因子的血浆水平均显著降低(*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001),而抗炎细胞因子TGFβ和IL-10水平显著升高(gydF4y2BaΔgydF4y2BapgydF4y2Ba< 0.05,gydF4y2BaΔΔgydF4y2BapgydF4y2Ba< 0.01,gydF4y2BaΔΔΔgydF4y2BapgydF4y2Ba< 0.001),采用Tukey 's multi单因素方差分析gydF4y2BapgydF4y2Bale-comparisons测试。gydF4y2Ba
e -选择素或HA的HCELL/CD44连接分别增强了madmsc诱导的对丝裂原刺激的脾细胞增殖的抑制,并促进了小鼠和人MSCs免疫调节分子的产生gydF4y2Ba
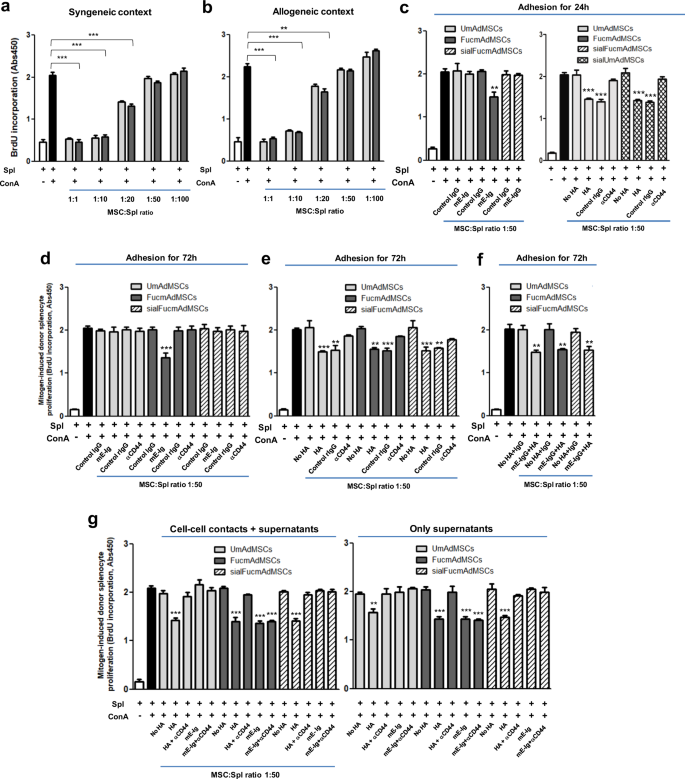
为了分析外聚修饰本身是否影响mAdMSCs的免疫调节特性,我们评估了UmAdMSCs和FucmAdMSCs抑制丝裂原诱导的同基因和异基因小鼠T细胞增殖的能力。为此,在不同数量的两种mAdMSCs存在的情况下,用刀豆蛋白A (ConA)刺激有反应的脾细胞,比例从1:1到1:100 MSC:脾细胞。与UmAdMSCs或FucmAdMSCs共孵育显著抑制丝裂原刺激的脾细胞增殖,比例从1:1到1:20呈剂量依赖关系,两种类型的mAdMSCs均具有相同的抑制作用(图2)。gydF4y2Ba5gydF4y2Ba)和异体环境(图。gydF4y2Ba5 bgydF4y2Ba).这些发现表明,madmsc介导的对有丝分裂原诱导的T细胞增殖的抑制不受外聚焦化过程和由此产生的CD44焦点安装的影响。gydF4y2Ba
一个gydF4y2Ba来自C57BL/6的脾细胞(Spl)(同基因上下文)或gydF4y2BabgydF4y2Ba用刀豆蛋白A (ConA)在C57BL/6小鼠中不同比例的未修饰的(UmAdMSCs)或ftvii修饰的AdMSCs (FucmAdMSCs)的存在下刺激BALB/C小鼠(异基因环境)。通过加入BrdU测定丝裂原诱导的应答者脾细胞增殖。在mAdMSCs存在时,应答者脾细胞的增殖明显受到抑制(**gydF4y2BapgydF4y2Ba< 0.01或***gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba用ConA在UmAdMSCs、FucmAdMSCs或唾液酸酶处理的UmAdMSCs (sialUmAdMSCs)存在的情况下刺激BALB/C脾细胞,这些UmAdMSCs均来自C57BL/6小鼠,MSC:脾细胞比例为1:50(异体环境)gydF4y2BacgydF4y2Bae -选择素(mE-Ig)(左)或透明质酸(HA)(右)24小时,或gydF4y2BadgydF4y2Ba之前用mE-Ig培养72小时,gydF4y2BaegydF4y2Ba哈,或gydF4y2BafgydF4y2Ba两种配体,然后分别保存在含有mE-Ig, HA或两者的孔中。作为对照,通过唾液酸酶处理madmadmscs (sialFucmAdMSCs),或通过在阻断抗cd44抗体的存在下培养,阻断mAdMSC对HA的粘附,可以消除e -选择素的粘附。应答者脾细胞增殖明显受到抑制(*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01,或***gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2BaggydF4y2Ba分析了HA-或me - ig -连接的UmAdMSCs、FucmAdMSCs或sialFucmAdMSCs(右)与连续存在相同类型mAdMSCs(左)的条件培养基对脾细胞增殖的抑制作用。如右图所示,仅存在上清液时,增殖明显受到抑制(***gydF4y2BapgydF4y2Ba< 0.001)。数据采用单因素方差分析,采用Tukey多重比较检验。gydF4y2Ba
观察到的更高的mlr抑制作用与MSCs:脾细胞比例的增加相一致,这表明agvhd影响的组织中MSC定植的增加(在给予FucmAdMSCs后观察到)(见图。gydF4y2Ba1 e, ggydF4y2Ba))可以单独帮助改善炎症。然而,除了MSC定植增加之外,我们还推断自HCELLgydF4y2Ba+gydF4y2BaMSCs在外渗过程中参与e -选择素,HCELL连接可能影响FucmAdMSCs的免疫生物学。因此,我们对mAdMSC/ cona刺激的脾细胞(“cona -脾细胞”)共培养进行了体外有丝分裂实验,使用mAdMSCs与mE-Ig嵌合体或同型对照人IgG1孵育24小时后再引入脾细胞,并在共培养期间分别保持与mE-Ig嵌合体或IgG1的接触。如图所示。gydF4y2Ba5度gydF4y2Ba(左),在有丝分裂实验中,MSC: cona -脾细胞1:50的比例,FucmAdMSCs(即HCELLgydF4y2Ba+gydF4y2Ba与未暴露于mE-Ig的FucmAdMSCs相比,与mE-Ig孵育24小时的mAdMSCs更能完全抑制供体T细胞增殖。重要的是,通过唾液酸酶处理FucmAdMSCs(“sialFucmAdMSCs”,即HCELL),消除e选择素粘附,可以消除这种效应gydF4y2Ba−gydF4y2Ba),表明观察到的增强的抗增殖作用与HCELL参与e -选择素的能力直接相关。为了确定CD44连接本身是否触发这种免疫调节作用,我们使用先前在常规CD44配体HA存在下培养24小时的UmAdMSCs进行了有丝分裂实验,并在与cona -脾细胞共培养期间继续暴露于HA。如图所示。gydF4y2Ba5度gydF4y2Ba(右),CD44与HA的连接诱导了类似的抗增殖作用,并且,与CD44接合的特异性一致,UmAdMSC(即HCELL)没有增强gydF4y2Ba−gydF4y2BamAdMSC)抗有丝分裂活性存在的mE-Ig。gydF4y2Ba
为了进一步评估e -选择素介导的HCELL连接或ha介导的CD44连接在MSC免疫生物学中的作用,我们使用cona -脾细胞和HCELL进行了体外有丝分裂实验gydF4y2Ba+gydF4y2BamAdMSCs或HCELLgydF4y2Ba−gydF4y2Ba先前在输入e -选择素和HA存在或不存在的情况下孵育72小时的mAdMSCs(图。gydF4y2Ba5 d-fgydF4y2Ba).将e-选择素或HA预孵育时间从24小时延长到72小时,并没有进一步增强相关的msc介导的抗增殖作用。然而,UmAdMSCs或sialFucmAdMSCs(均为HCELLgydF4y2Ba−gydF4y2Ba只有在CD44介导的HA连接后,mAdMSCs才显示出更好的抗有丝分裂作用(这种作用在阻断抗小鼠CD44抗体的存在下被取消)(图。gydF4y2Ba5 egydF4y2Ba),在HA或e -选择素参与后,FucmAdMSCs表现出显著的抗有丝分裂作用,这些作用分别被功能阻断的抗cd44单抗处理或唾液酸酶处理所取消(图。gydF4y2Ba5 d, egydF4y2Ba);HA暴露的MSCs同样增强了FucmAdMSCs和UmAdMSCs的抗有丝分裂作用,这一事实表明,通过外聚修饰生成HCELL并不影响CD44结合HA的能力,因此,HA或e -选择素的HCELL参与增强了MSC免疫调节。重要的是,无论是UmAdMSCs还是FucmAdMSCs,同时与两种配体(即mE-Ig和HA)预孵育并没有增加MSC对淋巴细胞增殖的免疫调节作用(图2)。gydF4y2Ba5 fgydF4y2Ba),而且,唾液酸酶处理的FucmAdMSCs (sialFucmAdMSCs)和唾液酸酶处理的UmAdMSCs (sialUmAdMSCs)在ha介导的CD44连接后,与ha -连接的FucmAdMSCs或未用唾液酸酶处理的UmAdMSCs相比,并没有显示出增强的抗有丝分裂作用(图。gydF4y2Ba5度gydF4y2Ba,对吧)。这后一个结果表明,与报道的其他细胞类型的结果相反gydF4y2Ba31gydF4y2Ba, MSCs的CD44(末端2型乳酸胺)的原生唾液化并不抑制其与HA的结合。总之,这些结果表明CD44蛋白的连接,无论是通过e -选择素的HCELL还是通过HA的CD44/HCELL,都释放了MSC抗有丝分裂的作用。gydF4y2Ba
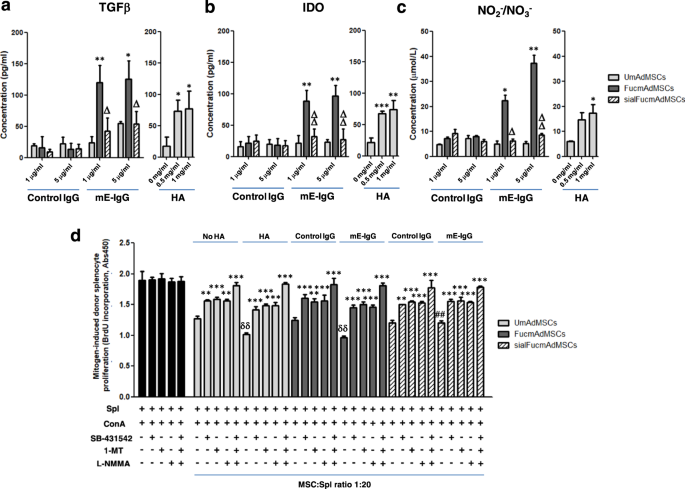
为了确定MSC-淋巴细胞-细胞接触是否是观察到的MSC CD44/HCELL连接的抗增殖作用所必需的,我们获得了HCELL上清gydF4y2Ba−gydF4y2BamAdMSCs和HCELLgydF4y2Ba+gydF4y2BamAdMSCs与HA或e -选择素接触,并测试条件介质对丝裂原诱导的脾细胞增殖的影响。如图所示。gydF4y2Ba5克ydF4y2Bag,从ha连接的UmAdMSCs或ha连接的sialFucmAdMSCs中获得的上清液,以及从ha连接或e -选择素连接的FucmAdMSCs中获得的上清液,在每种情况下都能显著抑制丝裂原诱导的脾细胞增殖(图2)。gydF4y2Ba5克gydF4y2Ba(图右),其程度与连续存在间充质干细胞时观察到的相似。gydF4y2Ba5克gydF4y2Ba(左)。这些结果表明,MSCs的分泌产物可以抑制脾细胞增殖。因此,为了阐明相关的分子效应,我们分析了TGFβ、IDO、硝酸盐/亚硝酸盐(如一氧化氮(NO)代谢物)、PGE的上清水平gydF4y2Ba2gydF4y2Ba和IL-10,据报道它们都介导免疫抑制。如图所示。gydF4y2Ba6 a - cgydF4y2Ba和补充图。gydF4y2Ba2gydF4y2Ba在每种情况下,HCELL通过e -选择素和CD44通过HA参与mAdMSCs,都能显著提高TGFβ、IDO和NO代谢产物的水平(图2)。gydF4y2Ba6 a - cgydF4y2Ba);但IL-10和PGE水平明显降低gydF4y2Ba2gydF4y2Ba对小鼠AdMSCs的影响不受CD44/HCELL连接的影响(补充图。gydF4y2Ba2 a, bgydF4y2Ba).为了进一步分析TGFβ、IDO和NO对观察到的mAdMSC抗增殖作用的贡献,我们在这些分子抑制剂的存在下,以mAdMSC:脾细胞1:20的比例进行了体外mMSC:脾细胞共培养(图2)。gydF4y2Ba6 dgydF4y2Ba)和1:10(补充图。gydF4y2Ba3.gydF4y2Ba),不论是否预先与HA或e-选择素孵育。添加SB-431542 (TGFβ抑制剂),1-甲基- dl -色氨酸(IDO抑制剂),或NgydF4y2BaGgydF4y2Ba-一甲基- l-精氨酸(iNOS抑制剂)在每个病例中都显著挽救了丝裂原刺激的脾细胞的增殖,同时使用所有三种抑制剂导致增殖完全恢复(图。gydF4y2Ba6 dgydF4y2Ba).总的来说,这些结果表明,msc分泌的分子许可mAdMSC对激活的脾细胞的免疫调节作用。gydF4y2Ba
将UmAdMSCs或FucmAdMSCs在37℃不同浓度的e -选择素(mE-Ig)或透明质酸(HA)中培养24 h,收集培养上清液。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba抗炎分子水平gydF4y2Ba一个gydF4y2BaTGFβ,gydF4y2BabgydF4y2Ba被罩,gydF4y2BacgydF4y2Ba无代谢物(如NOgydF4y2Ba2gydF4y2Ba−gydF4y2Ba/不gydF4y2Ba3.gydF4y2Ba−gydF4y2Ba)用ELISA技术测定。通过CD44或HCELL的连接,每个分子的水平都显著增加(*gydF4y2BapgydF4y2Ba< 0.05或**gydF4y2BapgydF4y2Ba< 0.01);用唾液酸酶(“sialFucmAdMSCs”)处理的FucmAdMSCs取消了与mE-Ig的HCELL连接,与暴露于e -选择素的FucmAdMSCs培养物中发现的水平相比,抗炎分子水平相应降低(gydF4y2BaΔgydF4y2BapgydF4y2Ba< 0.05或gydF4y2BaΔΔgydF4y2BapgydF4y2Ba< 0.01)。gydF4y2BadgydF4y2Ba将每个分子的抑制剂引入到BALB/c脾细胞和C57BL/6 UmAdMSCs、FucmAdMSCs或sialFucmAdMSCs (MSC:脾细胞比例为1:20)的共培养中(MSC:脾细胞比例为1:20),之前粘附于HA或mE-Ig 72小时。通过减去无ConA时脾细胞基底增殖水平,计算丝裂原诱导的脾细胞增殖。添加SB-431542 (TGFβ抑制剂),1-甲基- dl -色氨酸(1-MT) (IDO抑制剂),或NgydF4y2BaGgydF4y2Ba-单甲基- l-精氨酸(L-NMMA) (iNOS抑制剂)导致应答者脾细胞增殖显著增加(**gydF4y2BapgydF4y2Ba< 0.01或***gydF4y2BapgydF4y2Ba< 0.001)。与无HA或e -选择素的相同条件相比,脾细胞增殖明显降低,gydF4y2BaδδgydF4y2BapgydF4y2Ba< 0.01,或与相同条件下使用FucmAdMSCs相比增加,gydF4y2Ba# #gydF4y2BapgydF4y2Ba分别< 0.01。所有数据均以均数±标准差表示gydF4y2BangydF4y2Ba= 3个独立实验,采用Tukey 's多重比较检验进行单因素方差分析。gydF4y2Ba
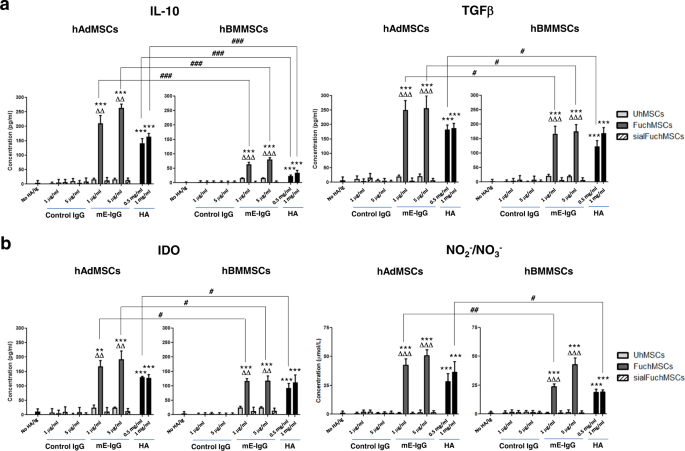
为了分析在小鼠间充质干细胞中观察到的CD44/HCELL连接的免疫调节作用是否也是人类间充质干细胞(hMSCs)的特征,我们测量了CD44/HCELL连接HCELL后分泌的抗炎分子水平gydF4y2Ba+gydF4y2Ba(即,外聚焦)和HCELLgydF4y2Ba−gydF4y2BahMSCs来源于脂肪组织(hAdMSCs)和骨髓(hBMMSCs)。引人注目的是,正如在小鼠间质干细胞中观察到的那样,HCELL或CD44分别与e -选择素或HA连接后,hAdMSCs和hBMMSCs均产生明显更高水平的TGFβ、IDO和NO代谢产物(图2)。gydF4y2Ba7 a、bgydF4y2Ba).然而,与小鼠间充质干细胞形成鲜明对比的是,CD44/HCELL结扎也极大地促进了来自骨髓和脂肪组织来源的人间充质干细胞抗炎细胞因子IL-10的产生(图2)。gydF4y2Ba7一个gydF4y2Ba).值得注意的是,在CD44/HCELL分别与HA或e -选择素连接的刺激下,hAdMSCs中所有分析的免疫调节分子的产生都比hBMMSCs高得多,特别是IL-10(图2)。gydF4y2Ba7 a、bgydF4y2Ba和表gydF4y2Ba1gydF4y2Ba).事实上,在hAdMSCs中,当分析参与/不参与e -选择素或HA的hMSCs中IL-10水平的比值(即,FuchAdMSCs/UhAdMSCs接触e -选择素或UhAdMSCs接触HA /UhAdMSCs不接触HA的比值)时,IL-10的产生通过HCELL(通过e -选择素)或CD44(通过HA)的参与提高了10倍;此外,在CD44/HCELL结扎后,脂肪来源的hMSCs的IL-10产量始终比骨髓来源的hMSCs高3倍(表4)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
来自脂肪组织(hAdMSCs)或骨髓(hBMMSCs)的人间充质干细胞被聚焦(“Fuc”:FuchAdMSCs或FuchBMMSCs)或缓冲处理(未修饰(“U”):UhAdMSCs或UhBMMSCs),并在不同浓度的e -选择素(mE-Ig)或透明质酸(HA)存在下,在37℃下培养3天。采集培养上清液,ELISA检测gydF4y2Ba一个gydF4y2Ba抗炎分子白细胞介素-10 (IL-10)和TGFβ的水平,或gydF4y2BabgydF4y2BaIDO和NO代谢产物(如NOgydF4y2Ba2−gydF4y2Ba/不gydF4y2Ba3−gydF4y2Ba).在无HA或有对照IgG培养的细胞作为阴性对照。此外,作为评估e -选择素结合特异性的对照,FuchAdMSCs或FuchBMMSCs用唾液酸酶(“sialFuchAdMSCs”或“sialFuchBMMSCs”)处理以切割sLe末端唾液酸gydF4y2BaxgydF4y2Ba(从而取消了与e -选择素的结合)。如图所示,hMSC与e -选择素或HA共孵育后,所分析的免疫调节分子水平显著增加(**gydF4y2BapgydF4y2Ba< 0.01或***gydF4y2BapgydF4y2Ba< 0.001);在与e -选择素共孵育的唾液FuchMSCs中,免疫调节分子的水平没有上升(与FuchMSCs相比,gydF4y2BaΔΔgydF4y2BapgydF4y2Ba< 0.01或gydF4y2BaΔΔΔgydF4y2BapgydF4y2Ba分别< 0.001)。拱形条形线反映了hAdMSCs和hBMMSCs与HA或e -选择素共同孵育后的上清液中免疫调节分子水平的比较:值得注意的是,所有分析的免疫调节分子的上清液水平均显著升高(差异为gydF4y2Ba#gydF4y2BapgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BapgydF4y2Ba< 0.01,或gydF4y2Ba# # #gydF4y2BapgydF4y2Ba脂肪来源的hMSCs与骨髓来源的hMSCs相比,差异< 0.001,IL-10最为显著(gydF4y2Ba# # #gydF4y2BapgydF4y2Ba< 0.001)。数据以平均值±标准差表示gydF4y2BangydF4y2Ba= 3个独立实验,采用Tukey 's多重比较检验进行单因素方差分析。gydF4y2Ba
为了进一步分析CD44/HCELL分别与HA/ e -选择素结合的功能影响,我们研究了CD44/HCELL的连接是否影响mAdMSC与纤维连接蛋白的粘附,纤维连接蛋白是细胞外基质的关键成分之一,其表达因炎症而显著上调gydF4y2Ba32gydF4y2Ba.细胞对纤维连接蛋白的粘附是由β1整合素介导的,主要是整合素vra -4和vra -5,这两种整合素在所有间充质干细胞上都有特征性表达。如补充图所示。gydF4y2Ba4gydF4y2Ba, mAdMSCs暴露于HA或e -选择素,随后分析纤维连接蛋白结合。先前暴露于e -选择素的FucmAdMSCs,或先前暴露于HA的UmAdMSCs和FucmAdMSCs,显著上调了β1整合素介导的对小鼠纤连蛋白(mFN)的粘附,而用唾液酸酶(sialFucmAdMSCs)处理FucmAdMSCs,或用β1功能阻断的HMβ1-1抗体处理madmadmscs,则显著抑制了这种作用。因此,除了诱导免疫调节剂的释放,CD44/HCELL连接激活VLA-4/ vra -5介导的纤维连接蛋白粘附,促进炎症部位的细胞定植。gydF4y2Ba
讨论gydF4y2Ba
当被触发时,免疫系统必须有足够的效力来积极防御刺激剂/病原体,但同时,也必须受到约束,以防止破坏宿主本身。尽管对免疫疾病的病理生物学进行了数十年的研究,但我们对组织微环境的原生成分如何以特定部位的方式改善或预防免疫病理的知识仍然有限。在“系统性”免疫疾病中,受影响靶器官内局灶性组织保留的存在反映了那些相关的未受影响部位的免疫稳态的存在/持久性,即,在解剖相邻节段出现明显炎症时,本地组织完整性的保存表明,原位微环境存在足够数量/密度的免疫调节细胞元件,以抑制炎症效应因子的作用。理想情况下,这些免疫静止效应物将广泛分布在所有组织中,并在局部炎症环境的保证下发挥作用。gydF4y2Ba
一个潜在的细胞效应的免疫稳态是MSC。身体的每个组织都含有一个MSC储存库,但MSC在原位的分布不能被分析/表征,因为没有唯一识别这些细胞的表面标记。尽管如此,间充质干细胞可以从组织中利用,随后培养扩大用于治疗目的。然而,在血管内给药时,这些培养扩张的间充质干细胞大部分被困在肺的传入血管中并迅速清除gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba这促使人们有必要制定策略来优化它们在受影响组织中的积累。实现其在免疫病理过程治疗中的全部潜力的另一个障碍是,血管给药的间充质干细胞不能有效地定植炎症部位,因为这些细胞本身缺乏细胞迁移的效应物,如e -选择素配体,可以引导它们在受影响的内皮床外渗gydF4y2Ba17gydF4y2Ba.因此,为了在免疫介导的组织损伤的发生/发展过程中对mAdMSCs的损伤插层进行编程,我们在全身给药之前强制在mAdMSCs上表达强效e-选择素配体HCELL。由于供体脾细胞富集的完全mhc不匹配移植小鼠可重复触发aGvHD,这是一种强烈的免疫病理过程,我们推断,引导MSCs迁移到早期aGvHD组织损伤的解剖部位将揭示MSC组织定植是否能促进和/或保持免疫稳态。gydF4y2Ba
先前对aGvHD小鼠模型的研究报道,早期输注mAdMSCs(移植后0、+7和+14天)的小鼠比移植后+14、+21和+28天的小鼠显示出更少的aGvHDgydF4y2Ba35gydF4y2Ba.接受受体型HCELL静脉注射gydF4y2Ba+gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2Ba或带有HCELLgydF4y2Ba−gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2Ba在移植后早期aGvHD动物的mAdMSCs中,免疫组化研究一致显示,在接受HCELL的动物中,MSCs招募到aGvHD影响的部位增加gydF4y2Ba+gydF4y2BaAdMSCs与接受HCELL的AdMSCs比较gydF4y2Ba−gydF4y2BaAdMSCs。HCELL的组织驻留增加gydF4y2Ba+gydF4y2BaAdMSCs与进化中的aGvHD严重程度显著减弱相关,与接受HCELL的动物相比,AdMSCs显著提高了动物存活率gydF4y2Ba−gydF4y2BaAdMSCs(以及未接受MSCs的患者(“未治疗”))。值得注意的是,与移植后早期给药HCELL相比gydF4y2Ba−gydF4y2BaAdMSCs, HCELL的管理gydF4y2Ba+gydF4y2BaAdMSCs增加了MSC在肠道和肝实质内的驻留,并显著增加了MSC向肠固有层的趋向性。我们在接受任何一种AdMSCs的小鼠淋巴组织中都没有检测到MSC的浸润,这表明agvhd影响的组织本身的MSC浸润,而不是淋巴组织定植的增强,引起了观察到的免疫调节作用。虽然小鼠接受了HCELLgydF4y2Ba+gydF4y2BaAdMSCs并不是完全没有疾病,观察到病变谱低得多:组织学分析显示HCELL的管理gydF4y2Ba+gydF4y2Ba与接受HCELL的小鼠相比,AdMSCs显著减弱了aGvHD损伤,尤其是胃肠道和肝脏内的损伤gydF4y2Ba−gydF4y2BaAdMSCs和未治疗小鼠。此外,HCELL的管理gydF4y2Ba+gydF4y2BaAdMSCs可持久抑制aGvHD,而HCELLgydF4y2Ba−gydF4y2BaAdMSCs仅产生部分和短暂的预防/逆转aGvHD的能力。gydF4y2Ba
aGvHD的免疫病理是由靶组织内的免疫反应性供体效应T细胞驱动的,这一过程甚至发生在淋巴细胞减少期和植入前gydF4y2Ba23gydF4y2Ba.正如预期的那样,对患有持续aGvHD的动物肝脏和肠道内T细胞浸润的分析显示,这些细胞在移植后早期明显存在。与未处理小鼠的T细胞浸润水平相比,HCELLgydF4y2Ba−gydF4y2BaAdMSCs导致这些器官中T细胞浸润的适度减少。然而,在接受HCELL的小鼠中gydF4y2Ba+gydF4y2Ba移植后10天和20天AdMSCs的T细胞浸润较低,组织损伤程度明显降低。值得注意的是,中性粒细胞浸润的模式与T细胞的模式相同:在中性粒细胞植入后(即+10天后),在接受HCELL的小鼠中观察到明显较低的肠道和肝脏浸润gydF4y2Ba+gydF4y2BaAdMSCs。agvhd靶器官内中性粒细胞浸润水平较低与预后较好相关gydF4y2Ba28gydF4y2Ba,因为这些细胞直接(例如,通过释放ROS)和通过促进T细胞活化间接地促进组织损伤gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
效应免疫细胞渗透到组织中与前炎性细胞因子的释放有关,这些细胞因子在受影响的器官中具有有害作用,并在免疫介导的疾病(如aGvHD)的病理生理学中起着至关重要的作用gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.我们在这里观察到,与未治疗的小鼠相比,接受mAdMSC治疗的小鼠显示出几种促炎细胞因子的血浆水平显著降低,但这种影响在接受HCELL治疗的小鼠中并不持续gydF4y2Ba−gydF4y2BaAdMSCs(即umadmsc处理小鼠的促炎细胞因子水平下降,然后在+30天逐渐增加到未处理动物的水平)(图。gydF4y2Ba4gydF4y2Ba).相比之下,用HCELL处理的动物gydF4y2Ba+gydF4y2BaAdMSCs在促炎介质的血浆水平上显示出显著和长期的下降,这些小鼠的抗炎细胞因子IL-10和TGFβ的血浆水平显著增加(图2)。gydF4y2Ba4gydF4y2Ba),每一种都能有效抑制淋巴细胞增殖并促进耐受性gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba.特别是,IL-10水平的增加本身就可以极大地抑制免疫反应性,因为这种细胞因子最初被认为是“细胞因子合成抑制因子”(CSIF)。gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,具有多效性作用,不仅能降低多种促炎细胞因子的产生,还能抑制T细胞增殖,降低抗原提呈细胞上MHC分子和共刺激分子的表达gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba;事实上,已知IL-10通过其在免疫抑制中的强大作用,在面对病原体的夸大宿主免疫反应时介导组织保存,从而建立宿主-病原体免疫平衡,导致感染潜伏期gydF4y2Ba49gydF4y2Ba.IL-10在HCELL治疗后介导免疫调节中的作用gydF4y2Ba+gydF4y2Ba间充质干细胞值得进一步研究。此外,除了观察到的抗炎细胞因子血浆水平升高外,MSC管理减少促炎细胞因子水平的能力也有助于促进组织保存,通过降低免疫应答性和减少(细胞因子驱动的)内皮粘附分子诱导(介导免疫效应细胞招募到炎症部位)来限制免疫病理的全身扩展gydF4y2Ba50gydF4y2Ba.需要进一步的研究来评估系统给药HCELL所观察到的有益作用的程度gydF4y2Ba+gydF4y2BaMSCs是由于促炎剂水平的抑制与血浆抗炎剂水平的增加,以及特定药物与其组合的相对影响。gydF4y2Ba
我们的结果表明,MSC-淋巴细胞-细胞接触对于有丝分裂原诱导的淋巴细胞增殖的MSC衰减并不是强制性的。事实上,从HCELL中获得的上清液gydF4y2Ba+gydF4y2BaAdMSCs和HCELLgydF4y2Ba−gydF4y2Ba分别与e-选择素或HA预孵育后的AdMSCs,将丝裂原诱导的脾细胞增殖同样降低到与MSC持续接触时观察到的水平(图2)。gydF4y2Ba5克ydF4y2Ba).这些结果表明,MSCs的分泌产物促进了所观察到的抗增殖特性。TGFβ、IL-10、IDO、NO代谢产物及PGE表达分析gydF4y2Ba2gydF4y2Ba表明HCELL通过e -选择素或HA或CD44通过HA的体外参与,在每种情况下都能显著提高两种小鼠的TGFβ、IDO和NO代谢物水平(图2)。gydF4y2Ba6gydF4y2Ba)和人间充质干细胞(图gydF4y2Ba7gydF4y2Ba).有趣的是,小鼠间充质干细胞中HCELL或CD44的结扎并没有直接增加IL-10的产生。gydF4y2Ba2gydF4y2Ba).这些数据表明,在接受间充质干细胞的小鼠中观察到的IL-10血浆水平的升高可能是继发性的,这可能是由于间充质干细胞在支持/上调表达该细胞因子的其他细胞类型(如单核细胞、巨噬细胞、树突状细胞、B细胞和T细胞亚群)中产生IL-10的间接作用所致。gydF4y2Ba47gydF4y2Ba据报道,MSCs的这种功能本身就足够强大,可以在各种情况下驱动免疫调节gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.相反,HCELL或CD44在人间充质干细胞中的连接直接显著地促进IL-10的产生gydF4y2Ba(gydF4y2Ba以及TGFβ, IDO和硝酸盐/亚硝酸盐)(图。gydF4y2Ba7gydF4y2Ba).这些发现与先前研究报告的MSC免疫调节机制的物种特异性变异(如人类MSCs增加IDO的产生或小鼠MSCs持续表达iNOS)一致gydF4y2Ba54gydF4y2Ba).此外,已知来自同一哺乳动物不同组织来源的间充质干细胞在免疫调节特性上存在差异。在此,我们的数据表明,在HCELL或CD44参与后,脂肪来源的人间充质干细胞比骨髓来源的人间充质干细胞有更高的这些因子的产生,并且,值得注意的是,脂肪来源的人间充质干细胞产生IL-10的诱导最深刻(图4)。gydF4y2Ba7gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba).通过静息(即未经细胞因子处理的)人MSCs(或小鼠MSCs)直接产生IL-10的研究此前未见报道gydF4y2Ba55gydF4y2Ba,并且根据一些研究报道,与人骨髓来源的MSCs相比,人脂肪来源的MSCs可以显著增加抗炎细胞因子,特别是IL-10,这可能是这些细胞比骨髓来源的MSCs具有更高的免疫调节活性的一个因素gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba.有趣的是,人类脂肪来源的间质干细胞中观察到的IL-10的大量产生也可能反映了这种细胞因子在脂肪组织中的非免疫功能,因为新数据表明IL-10可以通过限制脂肪细胞的能量利用和产热作用来促进“代谢综合征”gydF4y2Ba58gydF4y2Ba.gydF4y2Ba
e -选择素与FucmAdMSCs接触后,TGFβ、IDO和NO的产生增加,这表明在体内炎症部位的血管床上与e -选择素接触后,HCELLgydF4y2Ba+gydF4y2BamAdMSCs通过增加抗炎分子的释放,在炎症环境中发挥免疫静止作用gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba.这种机制,加上观察到的原位MSC组织密度较高,是观察到的具有暴发性免疫反应的小鼠临床结果改善的基础。此外,独立于e -选择素/HCELL相互作用,MSC CD44与其同源配体HA的接合同样促进TGFβ、IDO和NO的产生。因此,一旦渗出并定位于组织实质,MSC的免疫调节特性将通过CD44与HA的相互作用而释放出来,HA是细胞外基质的组成部分,其表达本身在免疫反应/炎症部位上调gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,并且本身与免疫调节作用有关gydF4y2Ba65gydF4y2Ba.因此,本研究的结果为炎症环境中的分子如何增强MSC作为免疫稳态效应因子的能力提供了新的机制视角。此外,这些数据表明,在细胞输注之前,MSC CD44/HCELL与配体(如HA/ e -选择素)的接合可以被利用来增强给药MSCs抑制体内免疫病理的能力。我们实验室未来的实验将专注于解开CD44/HCELL连接所触发的特定下游信号级联。重要的是,我们观察到HCELL的参与gydF4y2Ba+gydF4y2Ba含有e -选择素的mAdMSC,或与HA接合的mAdMSC CD44/HCELL,在每种情况下都会触发β1整合素介导的粘附性,从而在没有外源性趋化因子刺激的情况下增强mAdMSC与纤维连接蛋白的结合gydF4y2Ba21gydF4y2Ba.因此,在进入组织实质后,先前HCELL与e -选择素的结合或HCELL/CD44与HA的接合可以促进mAdMSCs在相关炎症微环境中的附着。gydF4y2Ba
目前对病理性免疫反应性和一般免疫介导疾病的治疗主要是药理学的。目前迫切需要新的治疗方法来改善患者的预后,因为目前的药物会产生广谱免疫抑制,并与严重的不良反应相关。理想情况下,治疗性免疫调节应仅集中在免疫病理的部位,从而建立解剖学上的局灶性免疫稳态并保持全身免疫保护。我们的研究结果表明,间充质干细胞的器官/组织插层对原位免疫介导的炎症过程的病理后果产生了难解性。因此,炎症诱导的e -选择素在受影响部位的内皮床内的表达可用于临床,以实现系统给予e -选择素配体的免疫调节间充质干细胞在所需解剖位置的高效组织滞留。因此,而不是拮抗e -选择素的生物活性(例如,通过使用抗e -选择素单抗或sLe的模拟药gydF4y2BaXgydF4y2Ba)或其表达(例如,通过使用生物制剂阻断TNF或IL-1作用)gydF4y2Ba66gydF4y2Ba,病理生理内皮e -选择素显示可作为开启炎症性疾病免疫调节细胞治疗新时代的门户。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
BALB / c (2gydF4y2BadgydF4y2Ba)和C57BL/6J (H-2gydF4y2BabgydF4y2Ba)受体小鼠购自Envigo,而转基因C57BL/6-Tg (cagg - egfp)的β-actin-GFP小鼠购自Jackson实验室。所有动物实验程序均由穆尔西亚大学(穆尔西亚,西班牙)机构动物护理和使用委员会批准,并根据我们机构的指导方针(批准协议A13150201)进行。gydF4y2Ba
间充质干细胞的分离与培养gydF4y2Ba
小鼠AdMSCs (mAdMSCs)、人AdMSCs (hAdMSCs)和人BMMSCs (hBMMSCs)分别从小鼠附睾脂肪垫、人脂肪抽吸物和骨髓中分离。简而言之,来自C57BL/6或C57BL/6- tg (cagg - egfp)小鼠的mAdMSCs,或来自健康人类供体的hAdMSCs和hbmscs (gydF4y2BangydF4y2Ba每个来源= 3个),在DMEM低葡萄糖培养基(Gibco)中添加15%胎牛血清(Gibco)、1% l -谷氨酰胺(Lonza)、100 U/ml青霉素和100 μg/ml链霉素(Lonza)(完全培养基)。培养传代3-4的间充质干细胞用于实验。Virgen de la Arrixaca大学医院(穆尔西亚,西班牙)机构审查委员会批准了用于获取和处理所有人体样本的规程。根据需要,根据《赫尔辛基宣言》的指导方针获得捐赠者的书面知情同意。gydF4y2Ba
aGvHD小鼠模型gydF4y2Ba
完全mhc不匹配的异基因hsct是通过将供体BALB/c小鼠的骨髓细胞移植到10周大的C57BL/6受体中进行的,之前接受过潜在致死剂量为10 Gy的照射,分为两组,每组剂量为5 Gy,间隔24小时(−1天和+0天)。第0天以1 × 10静脉移植受体小鼠gydF4y2Ba7gydF4y2Ba来自供体小鼠的骨髓细胞,或不含(即aGvHD未发育)或含1.5 × 10gydF4y2Ba7gydF4y2Ba供体脾细胞诱导aGvHD。给予mAdMSC治疗的小鼠静脉输注5 × 10gydF4y2Ba4gydF4y2Ba移植后第0、+7和+14天,接收人类型的UmAdMSC或FucmAdMSCs。每天监测移植后动物的生存,而临床aGvHD使用评分系统进行评估,该评分系统生成由体重减轻、姿势、活动、皮肤完整性和皮毛纹理的个人评分组成的复合aGvHD评分。gydF4y2Ba
focusyltransferase VII治疗gydF4y2Ba
小鼠AdMSCs来源于C57BL/6小鼠,mhc错配HSCT的受体品系,而hAdMSCs和hbmscs是从健康的人类供体中分离出来的。利用α(1,3)-连接特异性focusyltransferase VII (FTVII;从研发系统获得),存在捐助者焦点底物(GDP-焦点;Sigma Aldrich): MSCs以2 × 10重悬gydF4y2Ba7gydF4y2Ba在汉克平衡盐溶液(HBSS)组成的FTVII反应缓冲液(不含钙)中,37°C孵育60分钟gydF4y2Ba2 +gydF4y2Ba和毫克gydF4y2Ba2 +gydF4y2Ba) (Lonza)含有20 mM HEPES (Lonza), 0.1%人血清白蛋白(HSA) (Grifols), 30 μg/ml FTVII (R&D Systems),和1 mM GDP-焦点(聚焦修饰,“FucmAdMSCs”)。对照组由单独用反应缓冲液处理的间充质干细胞组成(即,未修饰的间充质干细胞,“UmAdMSCs”或“UhAdMSCs”和“uhbmscs”)。通过HECA452抗体(10 μg/ml, BD Biosciences, Cat#555946)染色和小鼠e - seltin -human Fc嵌合体(mE-Ig;5 μg/ml, R&D Systems, Cat#575-ES-100)通过流式细胞术和western blot结合。gydF4y2Ba
丝裂原增殖试验gydF4y2Ba
在丝裂原增殖实验中,通过40 μ M尼龙细胞过滤器(Becton Dickinson)从C57BL/6和BALB/c小鼠脾细胞悬液中分离脾细胞,然后用含有0.83%氯化铵的红细胞裂解缓冲液(0.01 M Tris-HCl缓冲液pH 7.5)分离脾细胞。诱导脾细胞增殖,1 × 10gydF4y2Ba5克ydF4y2Ba脾细胞重悬于添加10%胎牛血清(增殖培养基)的RPMI 1640培养基(Sigma Aldrich)中,用10 μg/ml刀豆素A (ConA)处理。为了评估对脾细胞增殖的影响,将间充质干细胞重新悬浮在完全培养基中,并以MSC:脾细胞的比例降低(从1:1到1:100)与脾细胞一起在孔中播种。MSC:脾细胞共培养3天后,用ELISA BrdU比色试剂盒(Roche Diagnostics)检测脾细胞增殖。简而言之,测定前16 h在井中加入BrdU标记试剂。然后,细胞被固定,DNA变性,并与抗brdu - pod抗体孵育。洗涤后加入底物,测定吸光度。在一些实验中,UmAdMSCs和FucmAdMSCs,或FuchAdMSCs和fuchbmscs,用来自的唾液酸酶处理gydF4y2Ba霍乱弧菌gydF4y2Ba(0.1 U/ml, Roche Diagnostics)去除末端唾液酸(即sialUmAdMSCs和sialFucmAdMSCs,或sialFuchAdMSCs和sialFuchBMMSCs)。如所示,用不同浓度的mE-Ig嵌合体或透明质酸(HA,来自鸡梳;Sigma Aldrich) 24小时或72小时。简单地说,mE-Ig或HA被固定在板上。ha涂层板与3% BSA在DMEM培养基中孵育,以阻断非特异性相互作用。随后,将mAdMSCs或hMSCs培养于含有2 mM CaCl的HBSS培养基组成的细胞粘附介质中gydF4y2Ba2gydF4y2Ba、10 mM HEPES、0.2% BSA和1 mM丙酮酸钠(mE-Ig),或分别含有10 mM HEPES、0.2% BSA和1 mM丙酮酸钠的DMEM培养基(HA)。为了阻断CD44/HCELL与HA的相互作用,使用纯化的大鼠抗小鼠CD44抗体(克隆KM114, 10 μg/ml, Santa Cruz Biotechnology, Cat#sc-18882)。在一些实验中,用e -选择素和/或HA接种的mAdMSCs培养72小时,然后在持续的e -选择素和/或HA与小鼠脾细胞(MSC:脾细胞比例为1:20)共培养72小时,并在ConA存在下评估脾细胞增殖情况。为了研究不同抗炎分子在mAdMSCs免疫抑制特性中的作用,TGFβ抑制剂SB-431542(终浓度(Cf) = 10 μM), IDO抑制剂1-甲基- dl -色氨酸(Cf = 1 μM)或iNOS抑制剂NgydF4y2BaGgydF4y2Ba-单甲基- l-精氨酸(Cf = 1 mM)(均来自Sigma Aldrich)在与脾细胞共培养开始时添加。为了分析e -选择素/HA连接HCELL/CD44对免疫调节分子产生的影响,将hAdMSCs和hBMMSCs与e -选择素或HA连接72小时,清洗,在MSC:T细胞1:20的比例下与人外周血T细胞共培养72小时,同时存在植物血凝素(PHA, Sigma Aldrich)和用于免疫调节分子分析的上清液。最后,为了评估CD44/HCELL结扎后mAdMSCs的β1整合素依赖性粘附,96孔板上涂有10 μg/ml小鼠纤维连接蛋白(mFN) (Abbexa),在4℃下孵育过夜,在37℃下用3% BSA在PBS中堵塞2小时。将先前暴露于e -选择素(5 μg/ml)或HA (1 mg/ml)的UmAdMSCs、FucmAdMSCs或sialFucmAdMSCs在37°C下1小时后,用5 mM EDTA在PBS中分离,用2,7-双(羧乙基)-5(6)-羧荧光素-乙酰氧基甲酯(BCECF-AM;Sigma Aldrich),添加到mfn涂层孔中,并在37°C下粘附1小时。为了评估β1整合素介导的mFN粘附的特异性和功能,先前将一些UmAdMSCs或FucmAdMSCs与阻断抗β1抗体(克隆HMβ1-1, 10 μg/ml, BioLegend, Cat#102201)在4℃下孵育20分钟,或暴露于1 mM MnClgydF4y2Ba2gydF4y2Ba在R/T处分别维持1 min。最后,用PBS洗涤去除未结合的细胞,用0.1% SDS在PBS中溶解粘附细胞。然后使用荧光微孔板阅读器(Tecan)定量粘附程度。gydF4y2Ba
组织病理学分析gydF4y2Ba
由一名对治疗组不知情的病理学家在肝脏、肠道(结肠)和皮肤的至少两个远处区域分析aGvHD的组织病理学变化。采集各器官标本,在4%中性缓冲甲醛中固定24 h,处理后石蜡包埋。取3 μm厚切片,采用标准苏木精-伊红染色(H&E)进行常规组织病理学分析。皮肤组织病理学病变分级如下:0级(正常),I级(表皮基底细胞轻度空泡变性),II级(分散的个体凋亡表皮基底细胞和海绵样病变),III级(真皮-表皮交界处分离)和IV级(弥漫性严重溃疡,表皮广泛破坏)。肠道评分系统为:0级(正常),I级(分散的单个凋亡细胞和炎症细胞浸润),II级(隐窝上皮细胞凋亡,绒毛变钝,隐窝爆炸),III级(局灶性粘膜溃疡和中度绒毛萎缩),IV级(弥漫性和严重的粘膜溃疡)。肝切片组织病理学改变分为:0级(正常)、I级(上皮损伤,胆管受累≤25%)、II级(上皮损伤,胆管受累25-49%)、III级(上皮损伤,胆管受累50-74%)、IV级(上皮损伤,胆管受累≥75%)。此外,在H&E染色切片上根据其形态特征(核节段)鉴定出多形核中性粒细胞(PMNs)。对所有器官切片进行标准间接ABC免疫组化染色。简单地说,在脱蜡、复水、抗原遮盖和过氧化物酶阻断后,切片与多克隆兔抗cd3抗体(1:500,Agilent Technologies, Cat# A0452)在37℃下孵育1小时。在其他实验中,为了检测移植的表达gfp的mAdMSCs的分布,切片用多克隆鸡抗gfp抗体(1:4000,Aves Labs, Cat#GFP-1020)孵育。 Analysis of endothelial E-selectin (1:100, Abcam, Cat#ab18981) and CD31 (1:100, Abcam, Cat#ab28364) co-localization was performed on sequential sections. After washing, sections were incubated with a secondary anti-rabbit labeled polymer (EnVision®, Agilent Dako) for 20 min at 37 °C. Finally, immunolabeling was revealed using 3-3′-diaminobencidine (DAB) and counterstained with hematoxylin. Positive reaction was identified as a dark-brown precipitated with a membrane or cytoplasmic pattern for CD3, E-selectin, and CD31 or GFP staining, respectively. Histopathologic and immunohistochemical analysis was performed using a standard light microscope (Zeiss Axio A10, Carl Zeiss).
细胞因子和一氧化氮的定量gydF4y2Ba
小鼠IFN-γ, IL-1β, TNF-α, TGFβ, IL-10, IL-12, IL-6, IL-17, PGEgydF4y2Ba2gydF4y2Ba采用ELISA法(RayBiotech, Diaclone, bioNova Cientifica, Elabscience, Cusabio Biotech)定量测定动物血浆或培养上清液中的IDO。人TGFβ、IDO和IL-10 ELISA试剂盒购自RayBiotech和Elabscience。使用改良的Griess试剂(Parameter™总一氧化氮和硝酸盐/亚硝酸盐测定,R&D Systems)检测培养上清液中的一氧化氮。简单地说,所有的硝酸盐通过硝酸还原酶转化为亚硝酸盐,总亚硝酸盐通过Griess反应检测。样品和标准品按照制造商的说明一式三份进行分析。gydF4y2Ba
统计数据gydF4y2Ba
数据以均数±标准差表示。独立实验重复次数用图例表示gydF4y2BangydF4y2Ba表示体外实验的重复数或每个实验组使用的动物数。组间比较采用单因素方差分析,随后采用Tukey事后比较检验。使用Kaplan-Meier估计绘制生存曲线,并使用Mantel-Cox log-rank检验进行统计分析。相关性采用Pearson相关系数确定。gydF4y2BaPgydF4y2Ba值<0.05为有统计学意义。使用GraphPad prism 5.0进行统计分析并生成图形。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据可根据要求从通讯作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Pittenger, m.f.等人。间充质干细胞视角:细胞生物学到临床进展。gydF4y2BaNPJ回复。地中海。gydF4y2Ba4gydF4y2Ba, 22(2019)。gydF4y2Ba
卡普兰,A. I. &丹尼斯,J. e间充质干细胞作为营养介质。gydF4y2BaJ.细胞生物学。gydF4y2Ba98gydF4y2Ba, 1076-1084(2006)。gydF4y2Ba
比较骨髓、脂肪组织和出生相关组织间充质基质细胞的免疫调节特性。gydF4y2Ba前面。Immunol。gydF4y2Ba6gydF4y2Ba, 560(2015)。gydF4y2Ba
Puissant, B.等人。人脂肪组织来源的成体干细胞的免疫调节作用:与骨髓间充质干细胞的比较。gydF4y2BaBr。j . Haematol。gydF4y2Ba129gydF4y2Ba, 118-129(2005)。gydF4y2Ba
西山Z,保新H,辛娜Z.,军R.人脂肪和骨髓间充质干细胞对T淋巴细胞作用的比较。gydF4y2Ba细胞生物。Int。gydF4y2Ba37gydF4y2Ba, 11-18(2013)。gydF4y2Ba
Sotiropoulou, P. A., Perez, S. A., Gritzapis, A. D., Baxevanis, C. N. & Papamichail, M.人类间充质干细胞和自然杀伤细胞之间的相互作用。gydF4y2Ba干细胞gydF4y2Ba24gydF4y2Ba, 74-85(2006)。gydF4y2Ba
Stappenbeck, T. S. & Miyoshi, H.间质干细胞在组织再生和伤口修复中的作用。gydF4y2Ba科学gydF4y2Ba324gydF4y2Ba, 1666-1669(2009)。gydF4y2Ba
Yañez, R., Oviedo, A., Aldea, M., Bueren, J. A. & Lamana, M. L.前列腺素E2在脂肪和骨髓组织来源的间充质基质细胞的免疫抑制特性中起关键作用。gydF4y2BaExp. Cell Res。gydF4y2Ba316gydF4y2Ba, 3109-3123(2010)。gydF4y2Ba
加卢等人。间充质基质细胞凋亡诱导体内受体介导的免疫调节。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba9gydF4y2Ba, eaam7828(2017)。gydF4y2Ba
Cho, D. I.等。ANGPTL4的抗炎活性促进巨噬细胞极化诱导心脏修复。gydF4y2Ba江森自控的洞察力gydF4y2Ba4gydF4y2Ba, e125437(2019)。gydF4y2Ba
Galipeau, J. & Sensebe, L.间充质基质细胞:临床挑战和治疗机会。gydF4y2Ba细胞干细胞gydF4y2Ba22gydF4y2Ba, 824-833(2018)。gydF4y2Ba
寇,X.等。Fas/Fap-1/Cav-1复合物调节间充质干细胞中IL-1RA的分泌,以加速伤口愈合。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba10gydF4y2Ba, eaai8524(2018)。gydF4y2Ba
Manieri, n.a.等。粘膜移植间充质干细胞通过促进血管生成刺激肠道愈合。gydF4y2Baj .中国。Investig。gydF4y2Ba125gydF4y2Ba, 3606-3618(2015)。gydF4y2Ba
诺塔,A. J.,斐伯,W. E.间充质间质细胞的免疫调节特性。gydF4y2Ba血gydF4y2Ba110gydF4y2Ba, 3499-3506(2007)。gydF4y2Ba
Lemos, D. R. & Duffield, J. S.组织驻留间充质基质细胞:对组织特异性抗纤维化治疗的影响。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba10gydF4y2Ba, eaan5174(2018)。gydF4y2Ba
Ankrum, J. & Karp, J. M.间充质干细胞治疗:前进两步,后退一步。gydF4y2Ba趋势、医学。gydF4y2Ba16gydF4y2Ba, 203-209(2010)。gydF4y2Ba
萨克斯坦等人。CD44的体外糖基工程程序的人多能间充质间质细胞运输到骨。gydF4y2BaNat,地中海。gydF4y2Ba14gydF4y2Ba, 181-187(2008)。gydF4y2Ba
Aruffo, A., Stamenkovic, I., Melnick, M., Underhill, c.b. & Seed, B. CD44是透明质酸的主要细胞表面受体。gydF4y2Ba细胞gydF4y2Ba61gydF4y2Ba, 1303-1313(1990)。gydF4y2Ba
在糖科学中实现Koch的假设:HCELL, GPS和转化糖生物学。gydF4y2Ba糖生物学gydF4y2Ba26gydF4y2Ba, 560-570(2016)。gydF4y2Ba
糖基转移酶程序化立体取代(GPS)创建HCELL:为细胞迁移设计路线图。gydF4y2BaImmunol。牧师。gydF4y2Ba230gydF4y2Ba, 51-74(2009)。gydF4y2Ba
强迫造血细胞E-和l -选择素配体(HCELL)表达启动人间充质干细胞的跨内皮迁移。gydF4y2Ba国家科学院学报美国gydF4y2Ba108gydF4y2Ba, 2258-2263(2011)。gydF4y2Ba
斯隆,J. P.诺顿,J.骨髓移植病理。gydF4y2Ba组织病理学gydF4y2Ba22gydF4y2Ba, 201-209(1993)。gydF4y2Ba
比林汉姆原则的修订:淋巴细胞迁移在急性移植物抗宿主病中的中心作用。gydF4y2Ba医学杂志。血液骨髓移植。gydF4y2Ba12gydF4y2Ba, 2-8(2006)。gydF4y2Ba
Garcia-Bernal, D.等人。脂肪间充质间质细胞的外集中修饰改变了它们的分泌组谱。gydF4y2Ba前面。细胞培养。医学杂志。gydF4y2Ba8gydF4y2Ba, 584074(2020)。gydF4y2Ba
Abdi, R.等人。小鼠MSC上HCELL的表达许可胰脏变性,并赋予NOD小鼠自身免疫性糖尿病的持久逆转。gydF4y2Ba干细胞gydF4y2Ba33gydF4y2Ba, 1523-1531(2015)。gydF4y2Ba
Beilhack, A.等。急性移植物抗宿主病早期事件的体内分析揭示了t细胞亚群的连续浸润。gydF4y2Ba血gydF4y2Ba106gydF4y2Ba, 1113-1122(2005)。gydF4y2Ba
维索基,C. A., Panoskaltsis-Mortari, A., Blazar, B. R. & Serody, J. S.白细胞迁移与移植物抗宿主病。gydF4y2Ba血gydF4y2Ba105gydF4y2Ba, 4191-4199(2005)。gydF4y2Ba
Socié, G.等。凋亡细胞和浸润中性粒细胞在人胃肠道移植物抗宿主病中的预后价值:TNF和Fas表达gydF4y2Ba血gydF4y2Ba103gydF4y2Ba, 50-57(2004)。gydF4y2Ba
罗柏,R. J.等。i型ifns控制移植后GVHD和GVL反应。gydF4y2Ba血gydF4y2Ba118gydF4y2Ba, 3399-3409(2011)。gydF4y2Ba
Burman, a.c.等。ifnγ差异控制特发性肺炎综合征和胃肠道GVHD的发展。gydF4y2Ba血gydF4y2Ba110gydF4y2Ba, 1064-1072(2007)。gydF4y2Ba
斯凯顿,曾春华,曾春华,Nocks, A. & Stamenkovic, I.糖基化对细胞表面和可溶性CD44结合透明质酸具有刺激和抑制作用。gydF4y2BaJ.细胞生物学。gydF4y2Ba140gydF4y2Ba, 431-446(1998)。gydF4y2Ba
Barilla, M. L. & Carsons, S. E.纤维连接蛋白片段及其在炎症性关节炎中的作用。gydF4y2Ba风湿性关节炎。gydF4y2Ba29gydF4y2Ba, 252-265(2000)。gydF4y2Ba
Uccelli, A. & Prockop, D. J.为什么间充质干细胞(MSCs)治疗自身免疫性疾病?gydF4y2Ba咕咕叫。当今。Immunol。gydF4y2Ba22gydF4y2Ba, 768-774(2010)。gydF4y2Ba
冯·巴尔,L.等。人体间充质间质细胞治疗后的组织分析表明,长期移植有限,没有异位组织形成。gydF4y2Ba干细胞gydF4y2Ba30.gydF4y2Ba, 1575-1578(2012)。gydF4y2Ba
Yañez, R.等。脂肪组织来源的间充质干细胞具有体内免疫抑制特性,可用于控制移植物抗宿主病。gydF4y2Ba干细胞gydF4y2Ba24gydF4y2Ba, 2582-2591(2006)。gydF4y2Ba
齐格勒,T. R.等。调节方案和角化细胞生长因子对小鼠异基因骨髓移植中谷胱甘肽氧化还原状态的调节。gydF4y2Ba移植gydF4y2Ba72gydF4y2Ba, 1354-1362(2001)。gydF4y2Ba
施瓦布等人。肠道细菌易位募集的中性粒细胞通过组织损伤增强移植物抗宿主病。gydF4y2BaNat,地中海。gydF4y2Ba20.gydF4y2Ba, 648-654(2014)。gydF4y2Ba
希尔,G. R.等。全身照射和急性移植物抗宿主病:胃肠道损伤和炎症因子的作用gydF4y2Ba血gydF4y2Ba90gydF4y2Ba, 3204-3213(1997)。gydF4y2Ba
急性移植物抗宿主病的病理生理学。gydF4y2Ba内科杂志。肿瘤防治杂志。gydF4y2Ba21gydF4y2Ba, 149-161(2003)。gydF4y2Ba
Taga, K. & Tosato, G. IL-10抑制人T细胞增殖和IL-2产生。gydF4y2Baj . Immunol。gydF4y2Ba148gydF4y2Ba, 1143-1148(1992)。gydF4y2Ba
Fox, f.e., Ford, h.c., Douglas, R, Cherian, S. & Nowell, p.c. TGF-beta可以通过旁分泌和自分泌机制抑制人t淋巴细胞增殖的证据。gydF4y2Ba细胞。Immunol。gydF4y2Ba150gydF4y2Ba, 45-58(1993)。gydF4y2Ba
费奥伦蒂诺,D. F.,邦德,M. W. &莫斯曼,T. R.两种类型的小鼠T辅助细胞。Th2克隆分泌一种抑制Th1克隆产生细胞因子的因子。gydF4y2Ba实验,医学。gydF4y2Ba170gydF4y2Ba, 2081-2095(1989)。gydF4y2Ba
维埃拉等人。人细胞因子合成抑制因子cDNA克隆的分离与表达:与eb病毒开放阅读框BCRFI的同源性gydF4y2Ba国家科学院学报美国gydF4y2Ba88gydF4y2Ba, 1172-1176(1991)。gydF4y2Ba
Saraiva, M,维埃拉,P. & O 'Garra, A.白介素-10的生物学和治疗潜力。gydF4y2Ba实验,医学。gydF4y2Ba217gydF4y2Ba, e20190418(2020)。gydF4y2Ba
Fiorentino, d.f.等人。IL-10作用于抗原提呈细胞,抑制Th1细胞产生细胞因子。gydF4y2Baj . Immunol。gydF4y2Ba146gydF4y2Ba, 3444-3451(1991)。gydF4y2Ba
Macatonia, S. E., Doherty, T. M., Knight, S. C. & O 'Garra, A. IL-10对树突细胞诱导的T细胞增殖和ifn - γ产生的差异影响。gydF4y2Baj . Immunol。gydF4y2Ba150gydF4y2Ba, 3755-3765(1993)。gydF4y2Ba
库伯,K. N.布朗特,D. G.和莱利,E. M. IL-10:感染免疫的主要调节因子。gydF4y2Baj . Immunol。gydF4y2Ba180gydF4y2Ba, 5771-5777(2008)。gydF4y2Ba
de Waal Malefyt, R.等。白介素10 (IL-10)和病毒IL-10通过下调II类主要组织相容性复合物表达,降低单核细胞的抗原提呈能力,从而强烈降低抗原特异性的人T细胞增殖。gydF4y2Ba实验,医学。gydF4y2Ba174gydF4y2Ba, 915-924(1991)。gydF4y2Ba
Belkaid, Y.等。白细胞介素(IL)-10在皮肤愈合后利什曼原虫持续存在中的作用和抗IL-10受体抗体对无菌治愈的治疗潜力。gydF4y2Ba实验,医学。gydF4y2Ba194gydF4y2Ba, 1497-1506(2001)。gydF4y2Ba
Uccelli, A., Moretta, L. & Pistoia, V.间充质干细胞在健康和疾病中的作用。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba8gydF4y2Ba, 726-736(2008)。gydF4y2Ba
阿加瓦尔,S. & Pittenger, M. F.人间充质干细胞调节异体免疫细胞反应。gydF4y2Ba血gydF4y2Ba105gydF4y2Ba, 1815-1822(2005)。gydF4y2Ba
纳贾尔,等人。骨髓间充质基质细胞在T细胞反应中诱导增殖、细胞动力学和分子变化:IL-10/CD210轴的重要性gydF4y2Ba干细胞Rev. RepgydF4y2Ba11gydF4y2Ba, 442-452(2015)。gydF4y2Ba
巴顿,P.等。人间充质干细胞诱导T细胞无能并通过TH2途径下调T细胞异基因反应:与组织工程人类心脏瓣膜相关gydF4y2Ba组织中。gydF4y2Ba12gydF4y2Ba, 2263-2273(2006)。gydF4y2Ba
Ren, G.等人。间充质干细胞介导免疫抑制机制的物种变异。gydF4y2Ba干细胞gydF4y2Ba27gydF4y2Ba, 1954-1962(2009)。gydF4y2Ba
Jin, P.等。干扰素- γ和肿瘤坏死因子- α使骨髓基质细胞均匀极化为Th1表型。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 26345(2016)。gydF4y2Ba
Melief, S. M., Zwaginga, J. J., fibe, W. E. & Roelofs, H.脂肪组织来源的多能基质细胞比骨髓来源的基质细胞具有更高的免疫调节能力。gydF4y2Ba干细胞转化。地中海。gydF4y2Ba2gydF4y2Ba, 455-463(2013)。gydF4y2Ba
瓦伦西亚,J.等。来自同一供体的人骨髓和脂肪组织来源的间充质基质细胞免疫调节能力的比较分析。gydF4y2BaCytotherapygydF4y2Ba18gydF4y2Ba, 1297-1311(2016)。gydF4y2Ba
Rajbhandari, P.等人。IL-10信号重塑脂肪染色质结构以限制产热和能量消耗。gydF4y2Ba细胞gydF4y2Ba172gydF4y2Ba, 218 - 233。e217(2018).
Groh, m.e., Maitra, B., Szekely, E. & Koc, o.n.人间充质干细胞需要单核细胞介导的激活来抑制异源性T细胞。gydF4y2BaExp。内科杂志。gydF4y2Ba33gydF4y2Ba, 928-934(2005)。gydF4y2Ba
Meisel, R.等人。人骨髓基质细胞通过吲哚胺2,3-双加氧酶介导的色氨酸降解抑制异基因t细胞反应。gydF4y2Ba血gydF4y2Ba103gydF4y2Ba, 4619-4621(2004)。gydF4y2Ba
佐藤,K.等。一氧化氮在间充质干细胞抑制t细胞增殖中起关键作用。gydF4y2Ba血gydF4y2Ba109gydF4y2Ba, 228-234(2007)。gydF4y2Ba
Lim, J. Y.等。产生il -10的1型调节性T细胞增强间充质干细胞在胶原诱导关节炎中的免疫调节作用gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 26851(2016)。gydF4y2Ba
Petrey, a.c. & de la Motte, c.a.透明质酸,一种重要的炎症调节剂。gydF4y2Ba前面。Immunol。gydF4y2Ba5克ydF4y2Ba, 101(2014)。gydF4y2Ba
蒋东,梁俊杰,杨晓明,杨晓明。透明质酸在人类疾病中的免疫调节作用。gydF4y2Ba杂志。牧师。gydF4y2Ba91gydF4y2Ba, 221-264(2011)。gydF4y2Ba
蒋,D.等。toll样受体和透明质酸对肺损伤及修复的调控。gydF4y2BaNat,地中海。gydF4y2Ba11gydF4y2Ba, 1173-1179(2005)。gydF4y2Ba
罗维,J. B. &沃德,P. A.体内碳水化合物-蛋白质相互作用的治疗抑制。gydF4y2Baj .中国。Investig。gydF4y2Ba99gydF4y2Ba, 822-826(1997)。gydF4y2Ba
确认gydF4y2Ba
我们非常感谢萨尔瓦多教授Martínez提供的β-actin-GFP转基因C57BL/6-Tg(cagg - egfp)小鼠。本研究由Salud Carlos III研究所(ISCIII)通过项目“PI13/00184”(由欧洲区域发展基金(ERDF)共同资助)、I+D+I 2013-2016西班牙国家计划项目“RD12/0019/0001”、“RD12/0019/0023”和“RD16/0011/0001”的西班牙细胞治疗网络(TerCel) RETICS子项目支持,由ISCIII资助并由ERDF“una manera de hacer Europa”共同创立。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
R.S D.G.-B。,一个ndJ.M.M. conceptualized the study. D.G.-B., M.B., A.M.G.-H., M.L.L., J.M.M., and R.S. designed the study protocol, and D.G.-B., A.I.G.-G., M.C.A., and R.Y. conducted all the experiments. C.M.M. conducted and analyzed all aGvHD histopathology experiments. D.G.-B., R.Y., and C.M.M. analyzed data. R.S. developed the conditions for surface exofucosylation of live cells and provided essential reagents and protocols. D.G.-B., J.M.M., and R.S. supervised all research, reviewed all data, and wrote the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
根据美国国立卫生研究院的政策和程序,Brigham & Women ' s Hospital已将有关细胞表面聚糖工程的知识产权分配给R.S.。R.S.的所有权利益经过审查,并由Brigham & Women ' s Hospital和Partners HealthCare根据其利益冲突政策进行管理。所有其他作者都宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
García-Bernal, D.布朗凯,M. Martínez, C.M.gydF4y2Baet al。gydF4y2Ba强制间充质干细胞组织定植抵消免疫病理。gydF4y2Banpj再生医学gydF4y2Ba7gydF4y2Ba, 61(2022)。https://doi.org/10.1038/s41536-022-00258-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41536-022-00258-zgydF4y2Ba