摘要gydF4y2Ba
肿瘤细胞表现出比正常细胞更大的代谢可塑性,具有生存和增殖的选择性优势,其机制尚不明确。在这里,我们证明了正常肝细胞的葡萄糖剥夺诱导perk介导的果糖-1,6-二磷酸酶1 (FBP1) S170磷酸化,将FBP1四聚体转化为单体,并暴露其核定位信号进行核易位。重要的是,核FBP1结合PPARα并作为蛋白磷酸酶发挥作用,去磷酸化组蛋白H3T11并抑制PPARα介导的β-氧化基因表达。相比之下,FBP1 S124是gydF4y2BaOgydF4y2Ba-GlcNAcylated过表达gydF4y2BaOgydF4y2Ba有关gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖转移酶在肝细胞癌细胞中的作用,导致FBP1 S170磷酸化的抑制和肿瘤生长的β-氧化增强。此外,FBP1 S170磷酸化与肝细胞癌标本中β-氧化基因表达及患者生存时间呈负相关。这些发现强调了FBP1在正常细胞和肿瘤细胞中通过直接染色质调节基因调控的不同作用,并强调了其蛋白磷酸酶功能在肿瘤生长中的失活。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你所在的机构访问gydF4y2Ba
访问选项gydF4y2Ba
订阅《自然》+gydF4y2Ba
立即在线访问《自然》和其他55种《自然》杂志gydF4y2Ba
29.99美元gydF4y2Ba
每月gydF4y2Ba
订阅期刊gydF4y2Ba
获得1年的完整期刊访问权限gydF4y2Ba
99.00美元gydF4y2Ba
每期只要8.25美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba
增值税稍后将在结帐时添加。gydF4y2Ba
税务计算将在结账时完成。gydF4y2Ba
买条gydF4y2Ba
在ReadCube上获得时间限制或全文访问。gydF4y2Ba
32.00美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba

数据可用性gydF4y2Ba
支持本研究结果的ChIP-seq数据已根据登录代码保存在基因表达集合(GEO)中gydF4y2BaGSE207844gydF4y2Ba.人类HCC数据来源于TCGA研究网络:gydF4y2Bahttp://xena.ucsc.edu/gydF4y2Ba.来自此资源的数据集支持这项研究的发现,可在以下链接:gydF4y2Bahttps://xenabrowser.net/datapages/?dataset=TCGA.LIHC.sampleMap%2FHiSeqV2&host=https%3A%2F%2Ftcga.xenahubs.net&removeHub=https%3A%2F%2Fxena.treehouse.gi.ucsc.edu%3A443gydF4y2Ba.支持本研究结果的所有其他数据均可根据合理要求从通讯作者处获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
李晓霞,王勇,王秀林,吕哲。代谢酶和代谢产物对染色质和基因表达的调控。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 563-578(2018)。gydF4y2Ba
薛文德,李志强,李志强,等。乙酰辅酶a代谢在染色质调控中的时空控制。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba43gydF4y2Ba, 61-74(2018)。gydF4y2Ba
王毅,等。KAT2A结合α-KGDH复合物起组蛋白H3琥珀酰转移酶的作用。gydF4y2Ba自然gydF4y2Ba552gydF4y2Ba, 273-277(2017)。gydF4y2Ba
徐,D.等。代谢酶在癌症和其他病理中非规范功能的演变景观。gydF4y2Ba细胞金属底座。gydF4y2Ba33gydF4y2Ba, 33-50(2021)。gydF4y2Ba
陆正哲,亨特,T.代谢激酶兼作蛋白激酶。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba43gydF4y2Ba, 301-310(2018)。gydF4y2Ba
Dasgupta, S.等人。代谢酶PFKFB4激活转录辅激活因子SRC-3导致乳腺癌。gydF4y2Ba自然gydF4y2Ba556gydF4y2Ba, 249-254(2018)。gydF4y2Ba
徐,D.等。糖异生酶PCK1磷酸化INSIG1/2进行脂肪生成。gydF4y2Ba自然gydF4y2Ba580gydF4y2Ba, 530-535(2020)。gydF4y2Ba
刘,R.等。胆碱激酶α 2作为蛋白激酶促进脂滴的脂解。gydF4y2Ba摩尔。细胞gydF4y2Ba81gydF4y2Ba, 2722-2735 e2729(2021)。gydF4y2Ba
鲍丽丽,巴杜尔,李志强,李志强,李志强。非受体蛋白酪氨酸磷酸酶在免疫细胞信号转导中的作用。gydF4y2Ba免疫。gydF4y2Ba25gydF4y2Ba, 473-523(2007)。gydF4y2Ba
蛋白质酪氨酸磷酸酶:从基因到功能再到疾病。gydF4y2Ba细胞生物学。gydF4y2Ba7gydF4y2Ba, 833-846(2006)。gydF4y2Ba
Tejwani, g.a.果糖二磷酸酶活性调控。gydF4y2Ba放置Enzymol。遗传代数。Mol。Biol。gydF4y2Ba54gydF4y2Ba, 121-194(1983)。gydF4y2Ba
黄阳,P.等。果糖-1,6-二磷酸酶2通过抑制线粒体生物发生来抑制肉瘤的进展。gydF4y2Ba细胞金属底座。gydF4y2Ba31gydF4y2Ba, 174-188 e177(2020)。gydF4y2Ba
李,B.等。果糖-1,6-二磷酸酶抗肾癌进展。gydF4y2Ba自然gydF4y2Ba513gydF4y2Ba, 251-255(2014)。gydF4y2Ba
Li, F.等。FBP1的缺失会破坏肝脏代谢,并通过肝脏星状细胞衰老分泌组促进肿瘤的发生。gydF4y2Ba细胞生物学。gydF4y2Ba22gydF4y2Ba, 728-739(2020)。gydF4y2Ba
廖,K.等。多梳信号和果糖- 1,6 -二磷酸酶之间的反馈电路使肝和肾肿瘤发生。gydF4y2Ba癌症Res。gydF4y2Ba80gydF4y2Ba, 675-688(2020)。gydF4y2Ba
李欣,钱欣,吕志。ACSS2的局部组蛋白乙酰化促进溶酶体生物发生和自噬的基因转录。gydF4y2Ba自噬gydF4y2Ba13gydF4y2Ba, 1790-1791(2017)。gydF4y2Ba
杨,W.等。erk1 /2依赖的磷酸化和PKM2的核转位促进Warburg效应。gydF4y2Ba细胞生物学。gydF4y2Ba14gydF4y2Ba, 1295-1304(2012)。gydF4y2Ba
柯红梅,张玉平,李斯康,王宁。果糖-1,6-二磷酸酶与果糖- 6-磷酸、AMP和镁络合的晶体结构。gydF4y2Ba国家科学院学报美国gydF4y2Ba87gydF4y2Ba, 5243-5247(1990)。gydF4y2Ba
斯劳森,C. &哈特,g.w.。gydF4y2BaOgydF4y2Ba-GlcNAc信号:癌细胞生物学的意义。gydF4y2BaNat. Rev. CancergydF4y2Ba11gydF4y2Ba, 678-684(2011)。gydF4y2Ba
费雷尔,C. M.索迪,V. L.和雷吉纳托,M. J.。gydF4y2BaOgydF4y2Ba- glc酰化在癌症生物学中的作用:连接代谢和信号。gydF4y2BaJ. Mol.生物学。gydF4y2Ba428gydF4y2Ba, 3282-3294(2016)。gydF4y2Ba
范,W.和埃文斯,R. ppar和ERRs:线粒体代谢的分子介质。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba33gydF4y2Ba, 49-54(2015)。gydF4y2Ba
麦肯纳,N. J,兰兹,R. B. & O 'Malley, B. W.核受体辅调节:细胞和分子生物学。gydF4y2BaEndocr。牧师。gydF4y2Ba20.gydF4y2Ba, 321-344(1999)。gydF4y2Ba
Mukherji, A., Kobiita, A. & Chambon, P.将小鼠的喂养转移到休息阶段会产生代谢变化,这本身会使外周生物钟改变12小时。gydF4y2Ba国家科学院学报美国gydF4y2Ba112gydF4y2Ba, e6683-e6690(2015)。gydF4y2Ba
无疑,J.-Y。,Fromm, H. J. & Honzatko, R. B. Crystal structures of fructose 1,6-bisphosphatase: mechanism of catalysis and allosteric inhibition revealed in product complexes.生物化学gydF4y2Ba39gydF4y2Ba, 8565-8574(2000)。gydF4y2Ba
Rossetto, D., Avvakumov, N. & Cote, J.组蛋白磷酸化:涉及不同核事件的染色质修饰。gydF4y2Ba表观遗传学gydF4y2Ba7gydF4y2Ba, 1098-1108(2012)。gydF4y2Ba
德努,J. M., Stuckey, J. A., Saper, M. A. & Dixon, J. E.蛋白质去磷酸化的形式和功能。gydF4y2Ba细胞gydF4y2Ba87gydF4y2Ba, 361-364(1996)。gydF4y2Ba
沃尔顿,K. M. &迪克森,J. E.蛋白质酪氨酸磷酸酶。gydF4y2Ba为基础。学生物化学启。gydF4y2Ba62gydF4y2Ba, 101-120(1993)。gydF4y2Ba
Metzger, E.等人。组蛋白H3在苏氨酸11处的磷酸化建立了一个新的转录调控染色质标记。gydF4y2Ba细胞生物学。gydF4y2Ba10gydF4y2Ba, 53-60(2008)。gydF4y2Ba
杨,W.等。PKM2磷酸化组蛋白H3,促进基因转录和肿瘤发生。gydF4y2Ba细胞gydF4y2Ba150gydF4y2Ba, 685-696(2012)。gydF4y2Ba
杨伟,卢正哲,核PKM2调控Warburg效应。gydF4y2Ba细胞周期gydF4y2Ba12gydF4y2Ba, 3154-3158(2013)。gydF4y2Ba
Carracedo, A. Cantley, L. C. & Pandolfi, P. P.癌症代谢:脂肪酸氧化在聚光灯下。gydF4y2BaNat. Rev. CancergydF4y2Ba13gydF4y2Ba, 227-232(2013)。gydF4y2Ba
科贝,C. & Feron, O.癌细胞代谢和线粒体:TCA循环燃料的营养可塑性。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1868gydF4y2Ba, 7-15(2017)。gydF4y2Ba
Du, L.等。β-Catenin诱导PD-L1的转录表达促进胶质母细胞瘤免疫逃避。gydF4y2Ba实验,医学。gydF4y2Bahttps://doi.org/10.1084/jem.20191115gydF4y2Ba(2020)。gydF4y2Ba
钱,X.等。PRPS六聚体转化为单体通过ampk介导的磷酸化抑制核苷酸合成响应能量应激。gydF4y2Ba癌症。gydF4y2Ba8gydF4y2Ba, 94-107(2018)。gydF4y2Ba
钱,X.等。PTEN通过去磷酸化和抑制自磷酸化的PGK1来抑制糖酵解。gydF4y2Ba摩尔。细胞gydF4y2Ba76gydF4y2Ba, 516-527 e517(2019)。gydF4y2Ba
钱,X.等。KDM3A感知氧可用性,调节pgc -1α介导的线粒体生物发生。gydF4y2Ba摩尔。细胞gydF4y2Ba76gydF4y2Ba, 885-895 e887(2019)。gydF4y2Ba
Olsson, m.h, Sondergaard, c.r, Rostkowski, M. & Jensen, j.h. PROPKA3:经验p中内部和表面残留的一致处理gydF4y2BaKgydF4y2Ba一个gydF4y2Ba预测。gydF4y2Baj .化学。理论第一版。gydF4y2Ba7gydF4y2Ba, 525-537(2011)。gydF4y2Ba
Maier, J. A. et al. ff14SB:从ff99SB提高蛋白质侧链和骨架参数的准确性。gydF4y2Baj .化学。理论第一版。gydF4y2Ba11gydF4y2Ba, 3696-3713(2015)。gydF4y2Ba
李,X.等。核PGK1缓解adp依赖的CDC7抑制,促进DNA复制。gydF4y2Ba摩尔。细胞gydF4y2Bahttps://doi.org/10.1016/j.molcel.2018.09.007gydF4y2Ba(2018)。gydF4y2Ba
郑毅,等。分泌和gydF4y2BaOgydF4y2Ba-GlcNAcylated MIF与人EGF受体结合并抑制其激活。gydF4y2Ba细胞生物学。gydF4y2Ba17gydF4y2Ba, 1348-1355(2015)。gydF4y2Ba
郑毅,等。ras诱导和细胞外信号调节激酶1和2磷酸化依赖的蛋白酪氨酸磷酸酶(PTP)-PEST的PIN1异构化促进了PTP-PEST的FAK去磷酸化。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba31gydF4y2Ba, 4258-4269(2011)。gydF4y2Ba
徐,D.等。果糖激酶A的蛋白激酶活性通过磷酸化p62来指定肿瘤细胞的抗氧化反应。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Ba, eaav4570(2019)。gydF4y2Ba
赵,Z.等。通过PAQR3和HUWE1的协同作用,肝脏PPARα功能受多泛素化和蛋白酶体介导的降解控制。gydF4y2Ba肝脏病学gydF4y2Ba68gydF4y2Ba, 289-303(2018)。gydF4y2Ba
李,J. H.等。egfr磷酸化的磷酸果糖激酶1血小板亚型促进PI3K的激活。gydF4y2Ba摩尔。细胞gydF4y2Ba70gydF4y2Ba, 197-210 e197(2018)。gydF4y2Ba
李,X.等。核易位的ACSS2促进溶酶体生物发生和自噬的基因转录。gydF4y2Ba摩尔。细胞gydF4y2Ba66gydF4y2Ba, 684-697 e689(2017)。gydF4y2Ba
McDonagh, B., Sakellariou, G. K., Smith, N. T., Brownridge, P. & Jackson, M. J.差异半胱氨酸标记和全球无标记蛋白质组学揭示了骨骼肌衰老过程中代谢状态的改变。gydF4y2BaJ.蛋白质组ResgydF4y2Ba13gydF4y2Ba, 5008-5021(2014)。gydF4y2Ba
关,K. L. & Dixon, J. E.蛋白质-酪氨酸-磷酸酶催化通过半胱氨酸-磷酸中间体进行的证据。gydF4y2Ba生物。化学。gydF4y2Ba266gydF4y2Ba, 17026-17030(1991)。gydF4y2Ba
杨,W.等。核PKM2调节EGFR激活时β-catenin的转激活。gydF4y2Ba自然gydF4y2Ba480gydF4y2Ba, 118-122(2011)。gydF4y2Ba
李,X.等。酮己激酶- c到酮己激酶-A的剪接开关驱动肝细胞癌的形成。gydF4y2Ba细胞生物学。gydF4y2Ba18gydF4y2Ba, 561-571(2016)。gydF4y2Ba
确认gydF4y2Ba
本研究由中华人民共和国科学技术部(2021YFA0805600, D.X.;20120yfa0803300, z.l),国家自然科学基金(92157113,82072630,D.X.;82173114, Z.W.;82188102和82030074,z.l),浙江省自然科学基金发现项目(LQ22H160023, z.w),浙江省自然科学基金重点项目(LD22H160002, D.X.;LD21H160003, z.l)、浙江大学科研基金(188020*194221901/029,z.l)、浙江省创新创业领军团队引进计划(2019R01001, z.l)。z.l是王宽成特聘主席。作者在这项工作中没有得到具体的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Z.L.概念化了代谢酶的蛋白磷酸酶活性。z.l和D.X.构思设计了该研究,并撰写了手稿;Z.W、d.x.x和z.l获得资金支持并监督研究;郑永文、孟良、沈良、傅顺生、洪辉、杨东、桂伟、李伟文、杨善、李良、彭正忠、白丹进行了实验和统计分析。Y.X、X.Q、d.g.、J.F.和M.Z.审阅并编辑了手稿;杨敏、洪杰、晓荣、荣勇、洪林等进行了肽蛋白对接分析。Yan M., Liu T.和Liang T.提供肝癌样本和IHC染色支持。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
Z.L.拥有Signalway Biotechnology (Pearland, TX)的股份,该公司提供了识别FBP1 pS170的兔抗体。Z.L对这家公司的兴趣与它被选中供应这些试剂无关。其余作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然细胞生物学gydF4y2Ba感谢Lars Zender和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展数据gydF4y2Ba
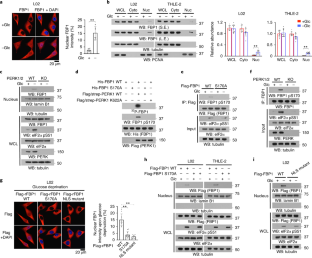
图1在正常人肝细胞中,PERK激活在葡萄糖剥夺条件下促进FBP1的核易位。gydF4y2Ba
bgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,使用指定抗体进行免疫印迹分析。gydF4y2Ba(一)gydF4y2Ba分别对表达Flag-FBP1或Flag-FBP2的L02细胞进行糖剥夺或不剥夺2小时的处理。进行免疫荧光和DAPI染色(上)。葡萄糖剥夺后FBP1/2的核分布强度如图所示(较低)。每个独立实验至少分析了n = 50个细胞,并显示了代表性数据。数据为均数±标准差,**P < 0.0001为双尾StudentgydF4y2BatgydF4y2Ba测试。gydF4y2Ba(b)gydF4y2Ba分别对表达Flag-FBP1或Flag-FBP2的L02细胞进行糖剥夺或不剥夺2小时的处理。制备了核组分。gydF4y2Ba(c)gydF4y2Ba用GSK2656157 (10 μM)、SP600125 (20 μM)、SB203580 (10 μM)对L02细胞进行预处理30 min后,再用或不用葡萄糖剥夺处理2 h。制备了核组分。SP600125、SB203580和GSK2656157分别阻断了c-Jun n端激酶(JNKs)磷酸化的c-Jun、p38磷酸化的MAP激酶活化蛋白激酶2 (MAPK/APK2)和perk磷酸化的eIF2α。gydF4y2Ba(d)gydF4y2Ba用2- dg (25 mM)处理或不使用PERK1/2敲除的mef 2小时。制备了核组分。gydF4y2Ba(e)gydF4y2Ba表达Flag-PERK1 WT或K622A激酶死亡突变体的L02细胞经糖剥夺或不糖剥夺2小时处理。制备了核组分。gydF4y2Ba(f)gydF4y2Ba表达Flag-PERK1 WT或K622A激酶死亡突变体的L02细胞分别用或不用2- dg (25 mM)处理2小时。制备了核组分。所有实验均独立重复3次,结果相似。gydF4y2Ba
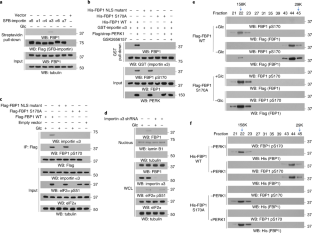
扩展数据图2 PERK的FBP1 pS170拆卸FBP1四聚体并暴露NLS。gydF4y2Ba
A d g h kgydF4y2Ba,使用指定抗体进行免疫印迹分析。gydF4y2Ba(一)gydF4y2Ba表达Flag-PERK1的L02细胞分别用或不用葡萄糖剥夺(2 h)或2- dg (25 mM, 2 h)处理。用抗flag抗体进行免疫沉淀分析。gydF4y2Ba(b)gydF4y2Ba将纯化的PERK1和纯化的His-FBP1混合进行体外磷酸化实验。液相色谱-串联质谱/质谱(LC-MS/MS)分析了与FBP1 +1电荷肽169-GSATML-174相匹配的蛋白酶片段,其m/z为675.24536 Da (+3.44 mmu/+5.1 ppm),表明FBP1 Ser 170被磷酸化。XCorr评分为1.81。gydF4y2Ba(c)gydF4y2Ba对不同物种的FBP1 S170肽序列进行比对。gydF4y2Ba(d, e)gydF4y2Ba表达Flag-FBP1的L02细胞经糖剥夺或不糖剥夺2 h处理(gydF4y2BadgydF4y2Ba).免疫印迹分析(gydF4y2BadgydF4y2Ba)和免疫组化(IHC)分析HCC组织(d)与抗fbp1 pS170抗体进行,存在或不存在肽阻断S170磷酸化。gydF4y2Ba(f)gydF4y2Ba从Huh7细胞中纯化的Flag-streptavidin -PERK1 WT和K622A经SDS-PAGE分析。gydF4y2Ba(g)gydF4y2Ba在GSK2656157 (10 μM)存在或不存在的条件下,对L02细胞进行规定时间的葡萄糖剥夺处理。gydF4y2Ba(h, i, k)gydF4y2Ba用2- dg (25 mM)处理或不处理表达上述Flag-FBP1蛋白的L02细胞2小时。制备核馏分(gydF4y2BahgydF4y2Ba,gydF4y2BakgydF4y2Ba).免疫荧光及DAPI染色(gydF4y2Ba我gydF4y2Ba)(左)。2-DG处理后FBP1的核分布强度如图所示(右)。每个独立实验至少分析了n = 50个细胞,并显示了代表性数据。数据为均数±标准差,**P < 0.0001为双尾StudentgydF4y2BatgydF4y2Ba测试。gydF4y2Ba(j)gydF4y2Ba不同种FBP1的17 ~ 30个氨基酸排列一致。gydF4y2Ba(左)gydF4y2Ba盒子中的NLS埋在FBP1四聚体二聚体的界面中。S106显示在白色方框中。gydF4y2Ba(m)gydF4y2Ba建立了排除尺寸色谱分析的分子量校准标准。gydF4y2Ba
图3过表达OGT在HCC细胞中抑制O-GlcNAcylation和FBP1的核转位。gydF4y2Ba
A-d f g i-kgydF4y2Ba,使用指定抗体进行免疫印迹分析。gydF4y2Ba(一)gydF4y2Ba分别对表达Flag-rFBP1的L02和Huh7细胞进行糖剥夺或不剥夺2小时的处理。制备了核组分。gydF4y2Ba(b)gydF4y2Ba分别对表达Flag-rFBP1的THLE-2和Hep3B细胞进行糖剥夺或不剥夺2小时的处理。制备了核组分。gydF4y2Ba(c)gydF4y2Ba表达Flag-rFBP1的L02和Huh7细胞分别用或不用2- dg (25 mM)处理2小时。制备了核组分。gydF4y2Ba(d)gydF4y2Ba表达Flag-rFBP1的THLE-2和Hep3B细胞分别用2- dg (25 mM)处理2 h。制备了核组分。gydF4y2Ba(e)gydF4y2Ba通过质谱鉴定的Huh7细胞FBP1免疫沉淀物的精选肽命中显示。gydF4y2Ba(f)gydF4y2Ba收获表达Flag-rFBP1的L02、THLE-2、Hep3B和Huh7细胞进行免疫沉淀分析。gydF4y2Ba(g)gydF4y2Ba表达Flag-FBP1的Huh7细胞分别用或不用葡萄糖剥夺或2- dg (25 mM)处理2小时。用所示抗体进行免疫沉淀和免疫印迹分析。gydF4y2Ba(h)gydF4y2Ba使用TCGA数据集分析正常肝组织和HCC组织中OGT的表达水平。正常样本:最小值,8.9311;最大,11.1164;中位数10.11875;HCC样本:最小值为8.9688;最大,12.8082;中位数是10.7801。水平线表示中位数,方框限制表示第25和第75百分位。采用双尾未配对学生t检验进行统计分析。gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba(我)gydF4y2Ba用所示抗体对所示细胞系进行免疫印迹分析。gydF4y2Ba(j)gydF4y2Ba表达OGT shRNA的Hep3B细胞分别经糖剥夺或不糖剥夺2小时处理。制备了核组分。使用指定抗体进行免疫印迹分析。gydF4y2Ba(k)gydF4y2Ba表达Myc-OGT的THLE-2细胞经糖剥夺或不糖剥夺处理2小时。制备了核组分。所有实验均独立重复3次,结果相似。gydF4y2Ba
图4 HCC细胞中ogt介导的FBP1 S124 O-GlcNAcylation抑制FBP1的核转位。gydF4y2Ba
cgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,使用指定抗体进行免疫印迹分析。gydF4y2Ba(一)gydF4y2Ba一个gydF4y2Ba在体外gydF4y2Ba将纯化的OGT与纯化的His-FBP1蛋白混合进行o - glna酰化试验。LC-MS/MS分析表明S124为O-GlcNAcylated。质谱分析表明,FBP1 Ser 124在m/z 795.33734 Da (+0.67 mmu/+0.85 ppm)与+1电荷肽122-DGSSNI-127相匹配,经O-GlcNAcylated。XCorr评分为1.46。gydF4y2Ba(b)gydF4y2Ba对不同物种的FBP1 S124肽序列进行比对。gydF4y2Ba(c)gydF4y2Ba标记的Flag-FBP1蛋白在Huh7和Hep3B细胞中表达。使用所示抗体进行免疫沉淀和免疫印迹分析。gydF4y2Ba(d)gydF4y2Ba表达上述Flag-rFBP1蛋白和/或Myc-OGT的L02细胞经糖剥夺或不糖剥夺2小时处理。使用所示抗体进行免疫沉淀和免疫印迹分析。gydF4y2Ba(e)gydF4y2Ba用2- dg (25 mM)处理或不处理表达Flag-rFBP1蛋白和/或Myc-OGT的L02细胞2小时。使用所示抗体进行免疫沉淀和免疫印迹分析。gydF4y2Ba(f)gydF4y2Ba表达相应Flag-rFBP1蛋白的Huh7细胞分别用或不用2- dg (25 mM)处理2小时。制备了核组分。使用所示抗体进行免疫沉淀和免疫印迹分析。所有实验均独立重复3次,结果相似。gydF4y2Ba
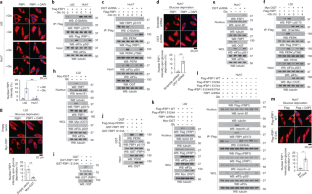
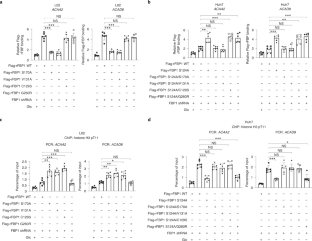
图5 perk磷酸化的FBP1与PPARα相互作用。gydF4y2Ba
C-n p qgydF4y2Ba,用所示抗体进行免疫印迹或/和免疫沉淀分析。gydF4y2Ba(一)gydF4y2Ba对表达Flag-FBP1的L02和Huh7细胞进行糖剥夺或不剥夺2小时的处理。采用抗Flag抗体进行免疫沉淀试验,Flag- fbp1免疫沉淀用Flag肽洗脱,SDS-PAGE分离,考马斯亮蓝染色。gydF4y2Ba(b)gydF4y2Ba通过质谱鉴定的L02细胞FBP1免疫沉淀物的精选肽命中显示。gydF4y2Ba(c)gydF4y2Ba表达Flag-FBP1的THLE-2和Hep3B细胞(gydF4y2BacgydF4y2Ba)或带或不带PERK1/2敲除的mef (d)分别用或不用葡萄糖剥夺2小时进行处理。gydF4y2Ba(e, f, g)gydF4y2BaL02 (gydF4y2BaegydF4y2Ba)或Huh7 (gydF4y2BaggydF4y2Ba)构建内源性FBP1缺失并重新表达Flag-rFBP1蛋白的细胞。对指示的L02细胞分别进行或不进行葡萄糖剥夺2小时的处理。制备核馏分(gydF4y2BafgydF4y2Ba).gydF4y2Ba(h i)gydF4y2Ba表达上述Flag-FBP1蛋白的L02细胞分别经或不经葡萄糖剥夺处理2小时。gydF4y2Ba(问我)gydF4y2Ba一个gydF4y2Ba在体外gydF4y2Ba通过将纯化的PERK1与指示的细菌纯化的GST-FBP1蛋白在ATP存在下混合1小时进行激酶测定。pbs清洗的GST- fbp1偶联珠与纯化的His-PPARα孵育,然后进行GST下拉试验。gydF4y2Ba(k, l)gydF4y2Ba内源性fbp1耗竭的Huh7 (gydF4y2BakgydF4y2Ba)或L02 (gydF4y2BalgydF4y2Ba)构建重组表达Flag-FBP1蛋白的细胞。gydF4y2Ba(m)gydF4y2Ba内源性FBP1缺失的L02细胞和指示Flag-FBP1蛋白的重建表达,分别用或不用葡萄糖剥夺2小时进行处理。gydF4y2Ba(n)gydF4y2Ba用GSK2656157 (10 μM)预处理或不加GSK2656157预处理L02细胞30 min,再加或不加葡萄糖剥夺处理2 h。gydF4y2Ba(o)gydF4y2Ba计算确定的结合模式的FBP1(卡通灰色)结合PPARα(表面青色)。FBP1上的V131显示为绿色,PPARα的残基显示为洋红色。gydF4y2Ba(p)gydF4y2Ba用上述质粒转染的L02细胞分别进行糖剥夺或不剥夺2小时的处理。gydF4y2Ba
图6核FBP1抑制ppar α介导的β-氧化。gydF4y2Ba
b, dgydF4y2Ba,使用指定抗体进行免疫印迹分析。gydF4y2Ba(f)gydF4y2Ba数据为3个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.01;**gydF4y2BaPgydF4y2Ba< 0.001;***gydF4y2BaPgydF4y2Ba< 0.0001的双尾学生gydF4y2BatgydF4y2Ba测试;备注:双尾学生不显著gydF4y2BatgydF4y2Ba测试。gydF4y2Ba(模拟)gydF4y2BaHuh7 (gydF4y2Ba一个gydF4y2Ba)或L02 (gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)细胞内源性FBP1缺失,并在缺失的情况下重新表达指示的Flag-rFBP1蛋白(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)或存在(gydF4y2BabgydF4y2Baβ-半乳糖苷酶和ppre驱动的荧光素酶报告基因分别在低糖(0.5 mM)和无低糖(0.5 mM)条件下处理12 h (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba).测定指示基因的相对mRNA水平(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba).PPRE荧光素酶的相对活性显示(n = 6) (b)gydF4y2Ba13gydF4y2Bac -油酸12小时,并处理与或不葡萄糖剥夺2小时。数量gydF4y2Ba13gydF4y2BaC-oleic acid-derivedgydF4y2Ba13gydF4y2BaCgydF4y2Ba2gydF4y2Ba柠檬酸和gydF4y2Ba13gydF4y2BaCgydF4y2Ba2gydF4y2Ba-琥珀酸的含量由质谱分析测定(gydF4y2BadgydF4y2Ba).gydF4y2Ba(e, f)gydF4y2BaHuh7的耗氧率(OCR) (gydF4y2BaegydF4y2Ba)或L02 (gydF4y2BafgydF4y2Ba)检测内源性FBP1缺失的细胞和指示Flag-rFBP1蛋白的重建表达。gydF4y2Ba(g)gydF4y2BaL02细胞经葡萄糖剥夺处理4 h。进行ChIP分析。使用集成基因组浏览器软件显示所选FBP1-和ppar α-相关基因区域的峰值可视化。(gydF4y2BahgydF4y2Ba)将FBP1和PPARα的结合位点分成一系列大小为10kb的bin。计算每个bin的峰值分数,并转换为(score + 1)的自然对数。绘制散点图来显示这些箱子的配对峰值分数(来自FBP1 ChIP-seq和PPARα ChIP-seq)之间的相关性。R是Pearson相关系数。gydF4y2Ba(我)gydF4y2Ba对齐排名最高gydF4y2Ba新创gydF4y2Ba在FBP1(上)或PPARα(下)ChIP峰值位置的+/−50 bp内发现结合基序。gydF4y2Ba(j)gydF4y2Ba葡萄糖剥夺2小时后,L02细胞的线粒体和过氧化物体β-氧化基因在fbp1靶向基因集中显著富集。gydF4y2BaPgydF4y2Ba-值通过超几何试验计算。所有实验均独立重复3次,结果相似。gydF4y2Ba
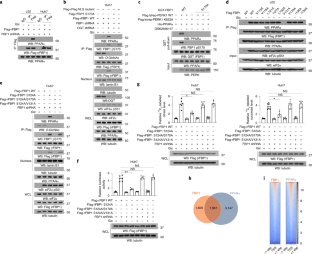
扩展数据图7 FBP1去磷酸化H3 pT11。gydF4y2Ba
A b g j kgydF4y2Ba,用所示抗体进行免疫印迹或/和免疫沉淀分析。gydF4y2Ba(a, b)gydF4y2Ba一个gydF4y2Ba在体外gydF4y2Ba将纯化的PERK1与纯化的His-FBP1蛋白在ATP存在下混合1小时,进行激酶测定。pbs洗涤his - fbp1偶联珠与纯化的组蛋白H3孵育,组蛋白H3免疫沉淀与来自Huh7细胞的抗磷酸化组蛋白抗体(gydF4y2Ba一个gydF4y2Ba)或组蛋白H3 pT11肽(gydF4y2BabgydF4y2Ba)gydF4y2Ba在体外gydF4y2Ba脱磷酸作用分析。gydF4y2Ba(c)gydF4y2Ba纯化的s170磷酸化FBP1对合成的组蛋白H3 pT11肽的酶动力学图。gydF4y2Ba(d, e)gydF4y2Ba分子动力学模拟和对接分析显示,FBP1在S170磷酸化或未磷酸化的情况下结构发生改变(gydF4y2BadgydF4y2Ba)和组蛋白H3 pT11肽对接到s170磷酸化FBP1的催化结构域。磷酸化的T11在FBP1 C129附近(gydF4y2BaegydF4y2Ba).gydF4y2Ba(f)gydF4y2Ba测定纯化的FBP1蛋白的相对糖异生活性。数据为3个独立实验的平均值±标准差。***gydF4y2BaPgydF4y2Ba< 0.0001。NS:对双尾学生来说不显著gydF4y2BatgydF4y2Ba测试。gydF4y2Ba(g)gydF4y2Ba纯化的GST-PRK1(左)或His-PKM2蛋白(右)与组蛋白H3多肽在[γ-存在下孵育gydF4y2Ba32gydF4y2BaP] ATP。进行放射自显像分析。gydF4y2Ba(h)gydF4y2Ba在组蛋白pT11肽催化过程中检测共价FBP1磷酸半胱氨酸中间体的工作流程。gydF4y2Ba(我)gydF4y2Ba在质谱分析之前,用或不用25 mM NEM标记perk1磷酸化的FBP1突变体WT或C129S 30分钟。给出了具有代表性的肽段提取色谱图和裂解图。m/z 533.94934 Da (+4.52 mmu/+ 8.46 ppm)(左)、834.42633 Da(−0.39 mmu/−0.46 ppm)(中)和763.91479 Da (+0.5 mmu/+0.65 ppm)(右)的Tryptic片段分别与NEM-unlabeled Cys129 (Mascot score: 25)(左)、NEM-labeled Cys129 (Mascot score: 83)(中)和NEM-unlabeled C129S (Mascot score: 90)(右)进行+3荷电(左)、+2荷电(中)、+2荷电(右)128-DSLVSVGTIFGIYR-141肽的配对。gydF4y2Ba(j, k)gydF4y2BaL02 (gydF4y2BajgydF4y2Ba)或Huh7 (gydF4y2BakgydF4y2Ba)对内源性FBP1缺失的细胞和标志Flag-rFBP1蛋白的重建表达进行分析。gydF4y2Ba(左)gydF4y2Ba图中显示了指示的FBP1突变体及其功能变化。所有实验均独立重复3次,结果相似。gydF4y2Ba
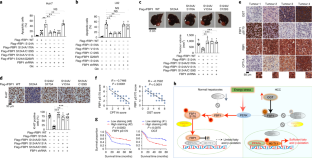
图8抑制FBP1蛋白磷酸酶活性促进肿瘤细胞存活和肝脏肿瘤生长。gydF4y2Ba
A-c h j k l mgydF4y2Ba,用指定抗体进行免疫印迹和免疫组化分析。(gydF4y2Bac d g I kgydF4y2Ba)数据为3个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.01, **gydF4y2BaPgydF4y2Ba< 0.001;***gydF4y2BaPgydF4y2Ba< 0.0001;备注:双尾学生不显著gydF4y2BatgydF4y2Ba测试。gydF4y2Ba(a, b)gydF4y2BaHuh7 (gydF4y2Ba一个gydF4y2Ba)或L02 (gydF4y2BabgydF4y2Ba)具有内源性FBP1缺失和指示Flag-rFBP1蛋白重建表达的细胞用低糖(0.5 mM)处理24小时。gydF4y2Ba(cgydF4y2Ba- - - - - -gydF4y2Bag)gydF4y2Ba内源性FBP1缺失和标志Flag-rFBP1蛋白重建表达的Huh7细胞分别用或不用低糖(0.5 mM)和GW9578 (500 nM)处理24小时以检测凋亡情况(gydF4y2BacgydF4y2Ba)或皮下注射到无腺BALB/c裸鼠(每组n = 6) (gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba).肿瘤大小(gydF4y2BadgydF4y2Ba),卷(gydF4y2BaegydF4y2Ba)和权重(gydF4y2BafgydF4y2Ba)。进行TUNEL试验(gydF4y2BaggydF4y2Ba).在10个显微镜视野下定量观察凋亡细胞。gydF4y2Ba(h, j)gydF4y2Ba对肿瘤组织进行免疫组化分析。有代表性的图像显示。白色方框内的区域在右边以较高的放大倍率显示(gydF4y2BahgydF4y2Ba).gydF4y2Ba(我)gydF4y2Ba将PPARα缺失和未缺失的Huh7细胞皮下注射到无胸腺BALB/c裸鼠(每组n = 6个)(左)。计算肿瘤大小(中)和体积(右)。gydF4y2Ba(k)gydF4y2Ba对30例人HCC和匹配的非肿瘤组织样本进行了免疫组化染色。两种情况的代表性图像显示。下图为放大倍数下的白框区域。采用Mann-Whitney U检验(双尾)比较HCC和匹配的非肿瘤肝样本的免疫组化染色评分。gydF4y2Ba(l, m)gydF4y2Ba具有代表性的2例人HCC与匹配的非肿瘤组织样本的免疫印迹分析(gydF4y2BalgydF4y2Ba)或四个不同的HCC样本(gydF4y2Ba米gydF4y2Ba)。gydF4y2Ba(n)gydF4y2Ba用所示抗体对人HCC样本进行免疫组化染色,并进行相关性分析。采用Pearson相关检验(双尾)(n = 40)。注意,一些样本的分数是重叠的。实验至少独立地重复了两次,得到了相似的结果。gydF4y2Ba
补充信息gydF4y2Ba
补充表gydF4y2Ba
补充表1-5。gydF4y2Ba
源数据gydF4y2Ba
图1 .来源数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图1 .来源数据gydF4y2Ba
统计源数据。gydF4y2Ba
图2 .来源数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图3 .源数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图3 .源数据gydF4y2Ba
统计源数据。gydF4y2Ba
图4 .来源数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图4 .来源数据gydF4y2Ba
统计源数据。gydF4y2Ba
图5 .来源数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图6 .来源数据gydF4y2Ba
统计源数据。gydF4y2Ba
图7 .来源数据gydF4y2Ba
统计源数据。gydF4y2Ba
图1 .源数据扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图1 .源数据扩展数据gydF4y2Ba
扩展数据图1的统计源数据。gydF4y2Ba
图2 .扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图2 .扩展数据gydF4y2Ba
扩展数据的统计源数据图2。gydF4y2Ba
图3 .扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图4 .扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图5 .源数据扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图6 .源数据扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图6 .源数据扩展数据gydF4y2Ba
扩展数据的统计源数据图6。gydF4y2Ba
图7 .源数据扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图7 .源数据扩展数据gydF4y2Ba
扩展数据的统计源数据图7。gydF4y2Ba
图8 .源数据扩展数据gydF4y2Ba
未加工的WBs。gydF4y2Ba
图8 .源数据扩展数据gydF4y2Ba
扩展数据的统计源数据图8。gydF4y2Ba
权利和权限gydF4y2Ba
根据与作者或其他权利持有人签订的出版协议,《自然》杂志或其许可方对本文拥有独家权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王震,李敏,姜浩,李敏。gydF4y2Baet al。gydF4y2Ba果糖-1,6-双磷酸酶1作为蛋白磷酸酶去磷酸化组蛋白H3,抑制ppar α调控的基因转录和肿瘤生长。gydF4y2BaNat细胞生物学gydF4y2Ba24gydF4y2Ba, 1655-1665(2022)。https://doi.org/10.1038/s41556-022-01009-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41556-022-01009-4gydF4y2Ba
这篇文章被引用gydF4y2Ba
代谢磷酸酶是蛋白质的兼职gydF4y2Ba
自然细胞生物学gydF4y2Ba(2022)gydF4y2Ba
