摘要
截至2022年5月,全球已经有超过5亿人感染了严重急性呼吸综合征2型冠状病毒(SARS-CoV-2),导致2019冠状病毒病(COVID-19)大流行。纳米技术在抗击SARS-CoV-2的各个方面都发挥了关键作用,其中最深刻的是两种基于纳米技术的高效信使RNA疫苗的成功研制。尽管mRNA疫苗对原始的SARS-CoV-2毒株具有显著的疗效,但新出现的SARS-CoV-2变种已经带来了几波新的大流行浪潮,使迅速结束这场大流行的希望变得渺茫。因此,应该提出新的策略来应对现有和新出现的SARS-CoV-2变种所带来的危机。在这里,我们从生物学和免疫学的角度讨论了SARS-CoV-2变体,以及合理设计和开发新型和潜在的基于纳米技术的策略,以对抗现有的和未来可能的SARS-CoV-2变体。从抗击SARS-CoV-2变体的战斗中吸取的经验教训和制定的设计战略也可以激发创新,开发基于纳米技术的战略,以应对其他全球传染病及其未来变体。
主要
由严重急性呼吸综合征2型冠状病毒(SARS-CoV-2)引起的2019年冠状病毒病(COVID-19)大流行已经感染了全球数百万人。为了应对这一前所未有的危机,来自不同学科的科学家合作制定了各种策略。其中,疫苗是预防SARS-CoV-2感染的最有效策略,因为我们自身的免疫系统是抵御新病毒株感染的最重要防线1,2,3..到目前为止,基于不同技术的几种疫苗,包括信使RNA、蛋白质亚基、腺病毒载体疫苗和全细胞灭活病毒疫苗,已在世界范围内部署4.虽然大多数疫苗的保护效果为50-80%,但两种基于脂质纳米颗粒(LNP)的mRNA疫苗来自Moderna5和Pfizer-BioNTech6(mRNA-1273和BNT162b2)显示出更大的保护功效,分别为94.1%和95%。这两种信使rna疫苗是目前应用最广泛的,证明了纳米技术在应对COVID-19大流行中的关键作用7.
随着许多地区大规模推出COVID-19疫苗,COVID-19病例数量随着时间的推移显著下降。然而,新出现的SARS-CoV-2变种引发的新一波COVID-19,给全球公共卫生带来了新的风险。到目前为止,世界卫生组织(世卫组织)已经指定了五种值得关注的SARS-CoV-2变种:B.1.1.7 (Alpha)、B.1.351 (Beta)、P.1 (Gamma)、B.1.617.2 (Delta)和B.1.1.529 (Omicron)8.越来越多的证据表明,这些新的变异增加了传播力和毒性,同时降低了中和性,使它们更加麻烦和危险9.临床数据显示,目前部署的几种疫苗对这些新变异的保护效力明显较低。因此,由现有和新出现的SARS-CoV-2变种引起的危机增加了对新策略的需求。
SARS-CoV-2变种
SARS-CoV-2变种的出现令人担忧
SARS-CoV-2是一种约29千碱基的单链阳性RNA病毒,突变率为每月2个单字母突变,由于具有校对能力,与其他RNA病毒相比,突变率相对较慢(图2)。1)10,11.然而,由于它的迅速传播,已经有超过4000个变种被报道12.目前,对某些变异的主要担忧是它们有能力阻碍疫苗或以前感染产生的免疫力13.世卫组织按照关注和行动需求增加的顺序对变量进行了排名:监测中的变量、感兴趣的变量(VOI)和关注的变量(VOC)。VOI和VOC是根据预测或已知的影响遗传性、疾病严重程度、免疫逃逸、治疗和诊断逃逸的遗传变化进行分类的。一旦这些预测在全球范围内体现出来,变体就被重新归类为VOC。目前,五种变体被认为是VOC,两种被认为是VOI(表1).
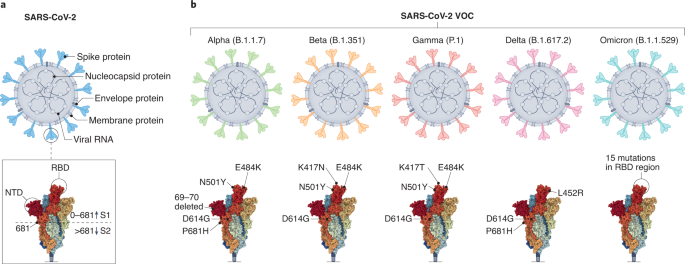
一个, SARS-CoV-2的结构,显示主要成分,包括S蛋白、核衣壳蛋白、包膜蛋白、膜蛋白和病毒RNA。RBD和NTD在S蛋白中的位置被突出显示。b, SARS-CoV-2 VOC。给出了每个变体中的关键s蛋白突变。蛋白质数据库ID:7 dwz.
虽然大多数变异菌株都带有几种突变,但研究最多、最令人担忧的突变位于SARS-CoV-2 spike (S)蛋白中14.S蛋白由> 1200个氨基酸组成,但只有一个小的25个氨基酸伸展介导其受体结合结构域(RBD)和宿主细胞的血管紧张素转换酶2 (ACE2)受体之间的相互作用。在所有VOC中,都注意到在这个相互作用区域及其周围的突变。1 b)15.此外,RBD突变对抗体中和病毒的能力影响最大16.在早期出现的变体中,即在Omicron之前,S蛋白中<3%的残基发生了突变,然而这少数突变被怀疑严重降低了中和抗体的功能17,18.
SARS-CoV-2变种正在加剧大流行
为了确定变异是如何影响流感大流行的,研究机构和政府需要收集有关变异传播的流行病学数据,以及关于接种疫苗和以前感染过的人的血清样本如何有效中和特定变异的实验室数据12.虽然体外试验在各个研究中通常产生类似的趋势,但它们可能不一致,因为不同的研究使用不同的细胞和假病毒系统14,19,20..此外,虽然t细胞反应被认为发挥了至关重要的保护作用,但在解决病毒免疫逃避的研究中很少考虑到它们。与负责产生抗体的表位相反,t细胞表位位于S蛋白的全长。这表明病毒突变对细胞免疫的影响有限11.
疫苗和以前的感染所提供的免疫是如何对抗新的VOCs的,这是非常有趣的。值得注意的突变包括D614G、N501Y、K417N、E484K、L452R和P681H。其中,L452R和E484K突变可以显著降低抗体的中和能力,并帮助逃避先前来自受感染或接种过疫苗的个体血清的免疫16,17,21.虽然研究最多的是RBD区域,但n端结构域(NTD)也有潜在的抗体中和靶点15.这也许可以解释为什么Beta和Gamma菌株在与免疫血清进行测试时表现出不同的特征,即使它们具有相同的RBD突变22.此外,重要的是要考虑到同一变体中的一些常见突变可以协同诱导更严重的影响16.
目前,感染或接种疫苗后具有高滴度中和抗体的血清能够中和当前所有的VOCs20.,23,24.如果如前所述,由现有疫苗或以前的感染引起的高滴度中和抗体可以防止感染所有变体,那么下一个需要解决的重要问题是免疫力下降。疫苗诱导了高滴度的病毒特异性中和抗体,正如预期的那样,随着时间的推移而下降13,16.例如,关于BNT162b2 mRNA疫苗保护持续时间的数据表明,中和抗体水平在接种后的前3个月内迅速下降,随后逐渐下降。结论是,尽管接种BNT162b2 6个月后体液反应显著降低,但即使面对Delta变异,它仍然在预防严重疾病方面相当有效(临床试验编号)NCT04368728)25,26,27.
B.1.1.529 Omicron变体于2021年11月26日被指定为VOC,是最后一个成为头条新闻的变体。Omicron之所以受到关注,是因为它有30多个s蛋白突变,其中15个位于RBD,并且传播迅速28,29,30.,31.此外,Omicron在其RNA依赖的RNA聚合酶和主要蛋白酶中具有突变,这两者都是抗病毒干预的靶标31.虽然这些突变中的大多数已经在以前的菌株中分别被记录下来,并增强了病毒传播和免疫逃避,但它们在单一菌株中同时出现并伴随着新的突变是令人担忧的。因此,Omicron显示出了一种增强的能力,可以逃避之前由疫苗或自然感染建立的免疫,并可以逃避大量的单克隆抗体治疗29,32,33,34.
纳米技术解决方案应对SARS-CoV-2变种挑战
SARS-CoV-2通过其S蛋白与宿主细胞上表达的ACE2受体结合来感染。SARS-CoV-2变异体传播的增加和抗体中和性的降低与其S蛋白的突变密切相关。因此,靶向变体的S蛋白抑制与ACE2受体的相互作用可能是最直接和最有前途的策略。纳米技术提供了各种解决方案,包括纳米颗粒(NP)疫苗诱导的中和抗体、工程中和抗体和基于ace2的纳米诱饵。
利用np基疫苗诱导中和抗体
越来越多的证据表明,疫苗是减缓SARS-CoV-2传播的最有效解决方案。与成熟且广泛应用的减毒活疫苗或灭活疫苗相比,基于np的疫苗,特别是mRNA-LNP疫苗35,36,具有模块化、快速制造和高效等主要优势37.事实上,Moderna在序列选择后的63天内启动了基于lnp的mRNA疫苗(mRNA-1273)的I期临床试验。
很多关于疫苗有效性的讨论都围绕着T滤泡辅助细胞(T跳频)细胞。它们是CD4细胞的一个独特子集+生发中心(GC)反应发展所需的T细胞,促进免疫球蛋白类转换、亲和成熟和b细胞长期记忆持久性38.因此,抗原特异性T跳频细胞对于持续的、广泛的保护性抗体反应的发展至关重要。已知核苷修饰的mRNA-LNP疫苗可诱导高水平的抗原特异性T跳频和GC B细胞39.有趣的是,mRNA-LNP疫苗在T病毒感染方面优于灭活病毒疫苗、佐剂蛋白疫苗和活病原体感染跳频细胞丰度和诱导长寿血浆和记忆B细胞40.这表明,这是由编码的mRNA产生强大而持续的抗原,以及mRNA和LNPs本身引起的辅助作用所驱动的41.LNP配方中的可电离脂质在肌注给药后推动引流淋巴结中早期细胞因子的产生,最重要的是通过白细胞介素-6信号传导。这种白细胞介素-6浓度的快速峰值对于诱导下游效应因子驱动T跳频和GC响应41.尽管LNP中的mRNA已被修饰以减少病原体识别受体的感觉,但它产生的细胞因子反应在某种程度上支持T的生成跳频细胞。T跳频-细胞分化过程如下:(1)启动naïve CD4+T细胞在脾脏或引流淋巴结通过抗原呈递树突状细胞,(2)T跳频(3)抗原依赖的T细胞和B细胞重新定位到卵泡形成GCs (4) GC T跳频细胞为B细胞提供必要的信号,并驱动高亲和力B细胞克隆的选择和记忆B细胞的产生38.SARS-CoV-2抗原最初的树突状细胞呈递可以来源于加工过的活病毒抗原的呈递,也可以来源于疫苗mRNA中编码的抗原。对于SARS-CoV-2感染,激活T跳频在非严重感染患者的血液中和感染SARS-CoV-2后恒河猴的淋巴结中检测到细胞。重要的是,升高的激活循环T跳频水平和疾病严重程度低。这些抗原特异性循环T跳频据报道,感染后细胞至少持续6个月38.
尽管这些mRNA疫苗对原始的SARS-CoV-2毒株有很高的疗效,但由于病毒S蛋白的多种突变,它们对新出现的SARS-CoV-2变体的疗效有所降低。因此,已经开发或提出了几种策略来更新当前的mRNA-LNP疫苗或创建新的mRNA-LNP疫苗(图2)。2),旨在诱导更高水平的中和抗体,从而更有效地结合突变的S蛋白,并随后中和SARS-CoV-2变体。注射后,mRNA- lnps被抗原提呈细胞内化,mRNA被核糖体翻译成s蛋白抗原(图2)。2 b)42.由此产生的s蛋白抗原随后被降解为抗原片段以激活CD8+T细胞;同时,分泌的s蛋白抗原的内吞作用激活CD4细胞+T细胞和B细胞产生中和抗体。鉴于疫苗引发的免疫力下降是疫苗对SARS-CoV-2变体效力下降的主要原因之一,通过第三剂现有疫苗加强剂量来增强疫苗引发的免疫力是解决这一问题最直接和最广泛提出的策略。因此,美国食品和药物管理局批准对18岁及以上的人进行单次加强剂量的辉瑞或Moderna mRNA疫苗。最近的研究表明,对实体器官移植受者注射第三剂辉瑞公司的BNT162b2或Moderna公司的mRNA-1273疫苗,可大大提高疫苗对SARS-CoV-2抗体的免疫原性43,44这表明增强剂量对抗SARS-CoV-2变种的潜力很大。事实上,在另一项研究中,BNT162b2疫苗的第三次加强剂量大大增加了SARS-CoV-2以及Beta和Delta变体的中和程度和广度45.尽管目前这种高传染性的Omicron突变变体很流行,但三分之一或更多的加强剂量的mRNA-1273或BNT162b2疫苗仍可能诱导针对Omicron的强中和抗体,并提供对它的保护,尽管效果有所降低46,47,48.
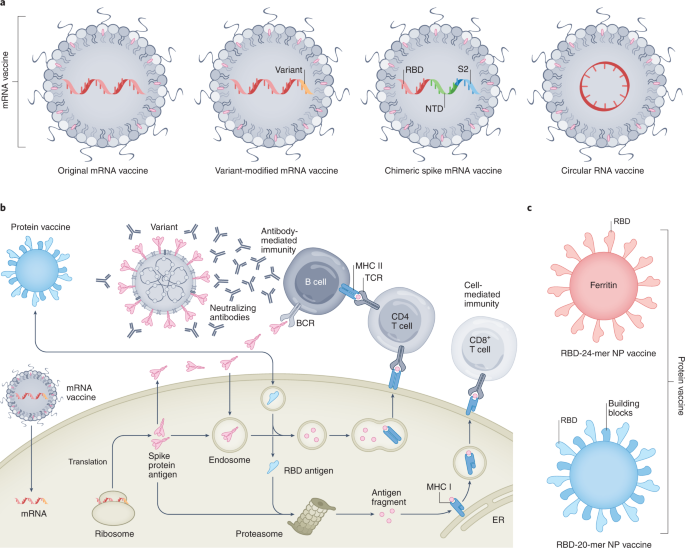
一个原始np基mRNA疫苗及其衍生物,包括变异修饰mRNA疫苗、嵌合spike mRNA疫苗和环状RNA疫苗。b,通过mRNA和蛋白质疫苗诱导免疫。在给药后,mRNA- lnps被抗原提呈细胞内化,其中mRNA被核糖体翻译成s蛋白抗原。由此产生的s蛋白抗原经蛋白酶体处理,产生抗原片段,通过与MHC I类蛋白相互作用在细胞表面以激活CD8+T细胞。同时,分泌的s蛋白抗原被内吞,随后在核内体中降解,并通过与MHC II类蛋白相互作用呈现在细胞表面以激活CD4+T细胞。两个CD4+T细胞和分泌的抗原可以刺激B细胞产生中和抗体。同样,蛋白质疫苗也可以通过将抗原直接引入细胞来诱导免疫。TCR, t细胞受体;ER,内质网;BCR, b细胞受体。c两种蛋白NP疫苗分别含有24个和20个RBD单位。RBD-24-mer NP疫苗使用铁蛋白NPs作为支架,RBD-20-mer NP疫苗使用辅助蛋白作为构建块。
Moderna提出的另一项应对SARS-CoV-2变种的策略是开发更新的mRNA疫苗49.为此,已开发出一种改良版的原型mRNA-1273疫苗,命名为mRNA-1273.351,包含Beta变体S蛋白的遗传序列(图。2)50.虽然第三剂量同时使用mRNA-1273和mRNA-1273.351引起了对变体的中和滴度的增加,但后者似乎在数值上产生了对Beta变体的中和抗体滴度。SARS-CoV-2的S蛋白包含主要的免疫原结构域,包括RBD、NTD和亚基2 (S2)。51,52.编码来自SARS-CoV和SARS-CoV-2的RBD、NTD和S2的嵌合S mRNA疫苗产生了针对新出现的SARS-CoV-2变体的有效中和抗体,而不是编码S蛋白的全长53.关于目前两种mRNA疫苗的一个问题是需要极低的储存温度54这极大地限制了疫苗的广泛应用。解决这一问题的一种尝试是开发一种基于lnp的环状RNA疫苗。2)55.将含有SARS-CoV-2变体rbd (Delta和Omicron)的环状RNA疫苗接种于小鼠和猴子,显示出对Delta和Omicron等变体的有效保护。与线性RNA疫苗相比,环状RNA疫苗具有特殊的环状结构,不易被核酸酶降解,因此具有更高的稳定性。rna - lnps冻干是另一种可能的解决方案,尽管一些人认为该过程过于昂贵和耗时37.此外,最近有人提出,核酸疫苗可能隐藏了序列中重叠开放阅读框(orf)上编码的“搭便车”蛋白。例如,据报道,还有其他orf与SARS-CoV-2 S序列重叠。因此,需要筛选编码的序列,以排除可能改变临床结果的不希望的肽的翻译。这种核酸疫苗的并发症可以通过使用传统的疫苗平台或蛋白质疫苗来避免56.
除了基于lnp的疫苗外,还研究了新型蛋白NP疫苗用于对抗SARS-CoV-2变体(图2)。2 b).通过将24个排序酶a标记的rbd附着在铁蛋白表面,研制了RBD-24-mer NP疫苗(图)。2摄氏度)57.Sortase A被用作连接剂,通过Sortase A反应将RBD和铁蛋白支架结合在一起58.铁蛋白被用作支架,因为它能够自组装成八面体颗粒,颗粒表面包含三重轴,允许各种病毒抗原有序显示59.鉴于RBD抗体已被证明可以交叉中和SARS-CoV、SARS-CoV-2和蝙蝠冠状病毒60基于RBD的疫苗可能会引发针对SARS-CoV-2及其变体的RBD的交叉中和抗体。用RBD-24-mer NP疫苗对猕猴免疫后,产生了极高滴度的抗传染性更强或抗中和性更强的SARS-CoV-2变种(包括Alpha、Beta和Gamma)的中和抗体。类似地,使用计算设计的自组装蛋白NP制备了另一种由20个SARS-CoV-2 RBD亚基组成的蛋白NP疫苗(标记为RBD-20 mer NP疫苗)。2摄氏度)61,62.将RBD-20-mer NP疫苗接种于非人类灵长类动物,产生了针对一系列人类免疫缺陷病毒和水疱性口炎病毒伪SARS-CoV-2变种的强中和抗体。上述两种蛋白NP疫苗使用rbd作为免疫原,而在另一项研究中63,采用合理设计的高免疫原性七磷酸重复2缺失甘氨酸封顶(S2GΔHR2) S2构建蛋白NP疫苗。该蛋白疫苗(记为SApNP)是通过S2GΔHR2 S和其他蛋白基构建块的自组装而构建的63,64.用SApNP疫苗免疫小鼠可产生有效的中和抗体,这些抗体能够以相同的效力中和原始的SARS-CoV-2及其变体(Alpha、Beta、Gamma和Delta)。此外,针对模块化疫苗平台的设计,还描述了几种基于颗粒的抗原展示策略65,66,67.其中,标签/捕手平台代表了一种多功能和高效的技术。这是一种分裂蛋白偶联系统,用于在溶液中混合时将疫苗抗原共价锚定在病毒或衣壳样颗粒上。据报道,该系统可以实现NP表面的完整和均匀装饰,并对显示的抗原产生高抗体滴度65.
用工程中和抗体靶向变异S蛋白
除了用疫苗诱导的中和抗体靶向变异体S蛋白外,还可以用工程中和抗体直接靶向变异体S蛋白。虽然在免疫功能低下的个体中生产疫苗诱导的中和抗体可能被证明是低效的,但工程中和抗体的应用可以解决这个问题。然而,大多数针对SARS-CoV-2的高效常规抗体对新出现的SARS-CoV-2变体的疗效明显较低。一种解决方案可能是开发针对这些变体的高效纳米体。纳米体是源自骆驼单链抗体的抗原结合结构域,比传统抗体更小(15 kDa vs 50 kDa),使它们能够结合传统抗体通常无法到达的病毒表位68.纳米体可以通过低成本但高效的微生物生产来大规模制造。同时,纳米体的高稳定性使它们能够在雾化过程中存活,允许它们通过吸入给药,这是一种非常有吸引力的给药途径,用于对付各种呼吸道病毒69,70.特别是,单体纳米体可以很方便地设计成多价纳米体缀合物,通常表现出更好的疗效71,72.
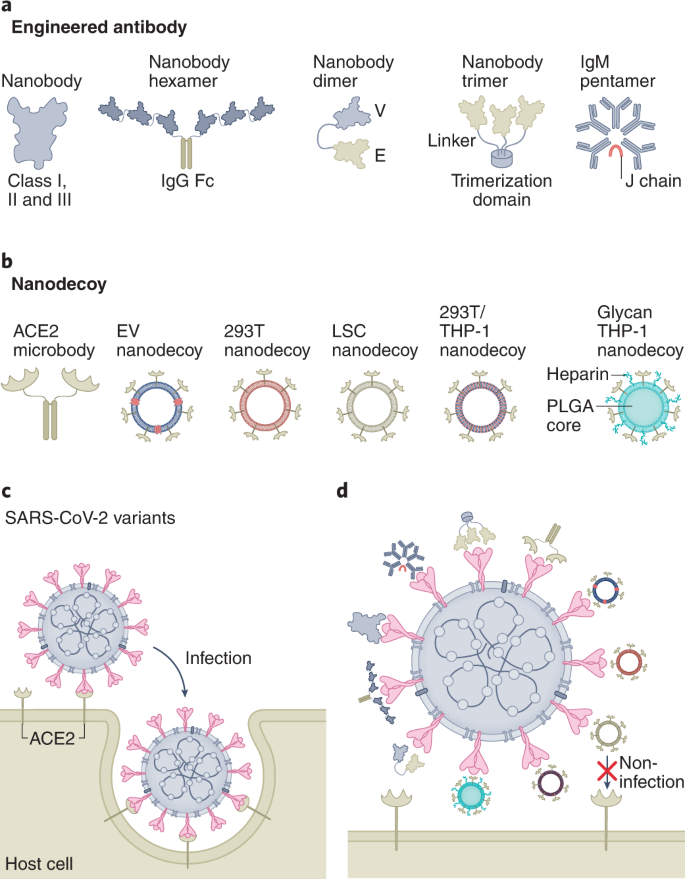
为了靶向变体的S蛋白,产生了三类纳米体(I, II和III)(图。3)73.一项机理研究表明,这些纳米体通过多种机制中和SARS-CoV-2变体。I类纳米体是SARS-CoV-2的超有效中和剂,靶向ACE2结合位点并破坏病毒与ACE2受体的结合。II类纳米体特别有趣,因为它们与高度保守的S蛋白表位结合,对VOCs保持强大的结合活性。III类纳米体通过识别传统抗体通常无法获得的独特表位,使用了与其他类别不同的中和机制。通过将单体纳米体改造成多价纳米体,可以进一步提高单体纳米体的效能。美洲驼纳米体六聚体(链接的同型三聚体)是一种蛋白质偶联物,由6个纳米体组成,对SARS-CoV-2变体表现出超高的中和活性,而纳米体的单体形式无法中和某些变体(图2)。3)74.进一步分析表明,多价羊驼纳米体六聚体可能通过促进ACE2结合域的亲和力、同时与多个S结合、阻断ACE2与RBD的结合或识别传统抗体通常难以接近的保守表位来有效中和SARS-CoV-2变体。类似地,由靶向两个独立的RBD表位的纳米体V和E组成的纳米体二聚体在很大程度上抑制了SARS-CoV-2变体的逃逸(图2)。3)75,76.在机制上,纳米体二聚体诱导并稳定RBD三聚体与所有RBD的“向上”构象,防止它们与ACE2受体结合。更重要的是,RBD的这种活性构象进一步触发了它们的过早裂解,不可逆地使S蛋白的细胞融合能力失活。这些研究特别有趣,因为它们表明,在设计良好的纳米结构上显示对SARS-CoV-2变体无效的中和纳米体,可能会产生一种对变体超有效的多价纳米体NP。
考虑到SARS-CoV-2及其变体S蛋白的三聚体结构,有理由推测与S蛋白几何结构匹配的纳米体三聚体可能与S蛋白具有极高的结合亲和力。为了探索这种可能性,通过使用适当的免疫中性连接剂将三个纳米体偶联到免疫中性胶原XVIII制备了纳米体三聚体(图2)。3)77.正如预期的那样,用Re6B06开发的纳米体三聚体在中和SARS-CoV-2方面的效力是单体纳米体的1万倍。与此同时,用Re9F06制备的纳米体三聚体能够在低至5.8 pM的浓度下中和Beta变体。除了纳米体策略,解决传统抗体(igg)对抗变异的有限效率的另一个解决方案是开发有效的免疫球蛋白M (IgM)中和抗体。合理设计的IgM五聚体(IgM-14),一种由五个免疫球蛋白二聚体(十个结合位点)组成的蛋白质偶联物,在连接链(J链)的存在下组装,有效地中和了三种VOCs: Alpha, Gamma和Beta(图2)。3)78.在小鼠中,单剂量鼻内给药IgM五聚体可预防Gamma和Beta变体,而IgG1单克隆抗体(CoV2-14) IgG-14无效。
以ace2为基础的纳米诱饵靶向变体S蛋白
一种被广泛研究的对抗SARS-CoV-2及其变体的纳米策略是制备ACE2受体修饰的诱饵NPs。尽管不断进化,但所有SARS-CoV-2变体都是通过其S蛋白与细胞上表达的ACE2受体相互作用进入细胞的。因此,诱饵NPs的ACE2受体与SARS-CoV-2变体的S蛋白之间的强相互作用可以确保基于ACE2的纳米诱饵对病毒的隔离不受病毒突变的影响。由两个ACE2融合到一个IgG Fc结构域组成的ACE2微体在体外抑制SARS-CoV-2伪病毒的进入,并保护K18-hACE2转基因小鼠免受SARS-CoV-2感染引起的体重减轻(图2)。3 b)79.除了基于ace2的纳米假体外,直接从COVID-19患者血浆中分离的循环表达ace2的细胞外囊泡(ev)在体外也能有效抑制SARS-CoV-2变体的感染(图2)。3 b)80.在一个成熟的人ACE2 (hACE2)转基因COVID-19小鼠模型中,在第6天监测时,鼻内联合使用EV纳米诱饵和SARS-CoV-2可提高受感染小鼠的存活率。EV纳米诱饵具有较强的抗病毒作用,其机制主要有两方面:一是EV表面存在的蛋白质可能进一步阻碍SARS-CoV-2进入宿主细胞表面;二是EV的多个ACE2与SARS-CoV-2 S蛋白协同结合,可促进EV纳米诱饵与病毒的结合亲和力。
另一种广泛应用的制备ace2基纳米诱饵的方法是从富含ace2的细胞中构建膜NPs。例如,基于293T膜的ACE2纳米诱饵对SARS-CoV-2和D614G变体伪型病毒都表现出优异的隔离能力(图2)。3 b)81.重要的是,在hace2表达小鼠模型中,在病毒暴露前4小时和8小时吸入含有293T纳米诱饵和透明质酸的配方可有效抑制SARS-CoV-2伪型病毒的感染。这种由293T纳米诱饵和黏附赋形剂透明质酸组成的可吸入配方的一个主要优势是,293T纳米诱饵在肺(SARS-CoV-2的主要靶器官)中的停留时间显著延长。类似的293T纳米诱饵也被描述为阻止SARS-CoV-2及其变体的感染82.
如上所述,无论病毒突变如何,ACE2都是人类细胞的病毒受体。因此,ACE2纳米诱饵已经显示出对SARS-CoV-2的有效性83,84被认为对SARS-CoV-2变种具有类似的疗效。为了构建基于细胞膜的ACE2纳米诱饵,使用了ACE2高表达的人肺球形细胞(LSC)系(图2)。3 b)85.在小鼠中,在SARS-CoV-2模拟病毒感染后1天吸入LSC纳米诱饵显示肺部有明显积聚,从第2天到第6天加速清除肺部的SARS-CoV-2模拟病毒。此外,在一个在第0天受到SARS-CoV-2挑战的非人灵长类动物模型中,在第2、3、4和5天吸入四剂量的LSC纳米诱饵,大大增强了病毒的清除,并在第8天分析时减轻了肺损伤。几种机制可能是LSC纳米诱饵感染后治疗效果的原因。由于并非所有病毒都在病毒暴露后1 - 2天被宿主细胞内化,纳米诱饵可以阻止剩余的病毒进入细胞。此外,内吞大小的纳米诱饵也可以结合细胞内病毒,减少进一步感染。为了进一步增强纳米诱饵对抗SARS-CoV-2的能力,可以使用混合细胞膜。例如,通过融合来自基因工程的表达ace2的293T细胞和表达细胞因子受体的人髓系单核THP-1细胞的细胞膜,已经开发出了293T/THP-1纳米诱饵(图2)。3 b)86.在本设计中,纳米诱饵的ACE2和细胞因子受体同时隔离SARS-CoV-2和相关炎症因子,包括白细胞介素-6和粒细胞-巨噬细胞集落刺激因子。上述所有的细胞膜纳米诱饵都具有中空的球形结构。然而,也可以引入聚合物核心来促进纳米诱饵的形成和ACE2受体的显示。例如,通过将富含ace2的THP-1细胞膜包覆在聚乳酸-乙醇酸制成的聚合物芯上制备的THP-1纳米诱饵对SARS-CoV-2表现出出色的隔离能力,并保护细胞免受病毒感染87.此外,在THP-1纳米诱饵的表面引入肝素(标记为糖基THP-1纳米诱饵)可以进一步增强THP-1纳米诱饵的隔离能力(图。3 b)88.
除了这些基于细胞膜的纳米诱饵外,ACE2受体模拟物编码的mRNA NPs能够在原位生成可溶性ACE2诱饵,有效抑制SARS-CoV-2与ACE2受体的结合89,90.尽管几种可溶性ACE2(重组)诱饵已经进入临床试验,并显示出对SARS-CoV-2的隔离效果91,92在美国,较短的半衰期可能会限制它们疗效的进一步提高93.ACE2除了作为SARS-CoV-2的受体外,还在肾素-血管紧张素系统中发挥关键作用94.因此,关于可溶性ACE2诱饵的外源性管理的一个担忧是由于肾素-血管紧张素系统下调而降低血压和炎症的可能性95,96.尽管一些基于ACE2的纳米诱饵已被证明能够对抗SARS-CoV-2及其变体,但使用对病毒具有更高结合亲和力的工程ACE2受体可以进一步提高其性能97,98,99,One hundred.,101.这些基于ace2的纳米诱饵的一个主要限制是由于其半衰期短,需要重复临床给药。此外,在许多研究中,通过与SARS-CoV-2共同使用纳米诱饵或在病毒暴露之前立即使用纳米诱饵来评估纳米诱饵的抗病毒功效。然而,在实际的临床应用中,情况并非如此,因为无法预测一个人何时会被感染。相比之下,一项研究表明,LSC纳米诱饵的管理85病毒暴露后1 - 2天仍可有效隔离病毒并减轻肺损伤,显示出其作为临床感染后治疗的强大潜力。所有SARS-CoV-2变体都以与原始SARS-CoV-2株相同的方式感染宿主细胞,通过结合ACE2受体(图2)。3 c).上述两种策略(工程中和抗体和基于ace2的纳米诱饵)都证明了通过与SARS-CoV-2变体的S蛋白强烈结合来抑制其感染的有效性,使其成为对抗SARS-CoV-2变体的有吸引力的策略(图2)。3 d).
对抗SARS-CoV-2变体的潜在纳米技术策略
基于纳米技术的非特异性物理失活变异体
具有内在杀病毒能力的抗病毒纳米材料在抗击当前和未来的COVID-19大流行方面非常有价值。与大多数呼吸道病毒一样,SARS-CoV-2被磷脂双分子层膜覆盖,这对其结构完整性和细胞进入至关重要。杀病毒的纳米材料,如聚合物表面活性剂和成孔肽,可以直接破坏膜,从而杀死病毒102,103,104.例如,NanoViricides正在开发一种使用配体修饰的聚合胶束的局部纳米杀菌剂,它可以结合病毒糖蛋白,然后破坏其脂质包膜。另外,Starpharma公司的Viraleze是一种含有负电荷的萘二磺酸盐改性聚(l -赖氨酸)SPL7013树突状分子的抗病毒鼻喷雾剂,可以建立一个物理屏障来捕获和灭活病毒。原则上,SPL7013作为硫酸肝素模拟物,与S蛋白上的硫酸肝素蛋白聚糖结合基序强烈结合,从而阻断病毒-宿主相互作用。在一项临床前研究中,研究表明,在接触SARS-CoV-2之前或之后使用Viraleze可以使99.9%以上的SARS-CoV-2失活105.由于这些纳米材料通过物理损伤或抑制病毒发挥作用,它们对非常广泛的病毒有效,包括SARS-CoV-2及其变体。
基于纳米技术的变体空间捕获
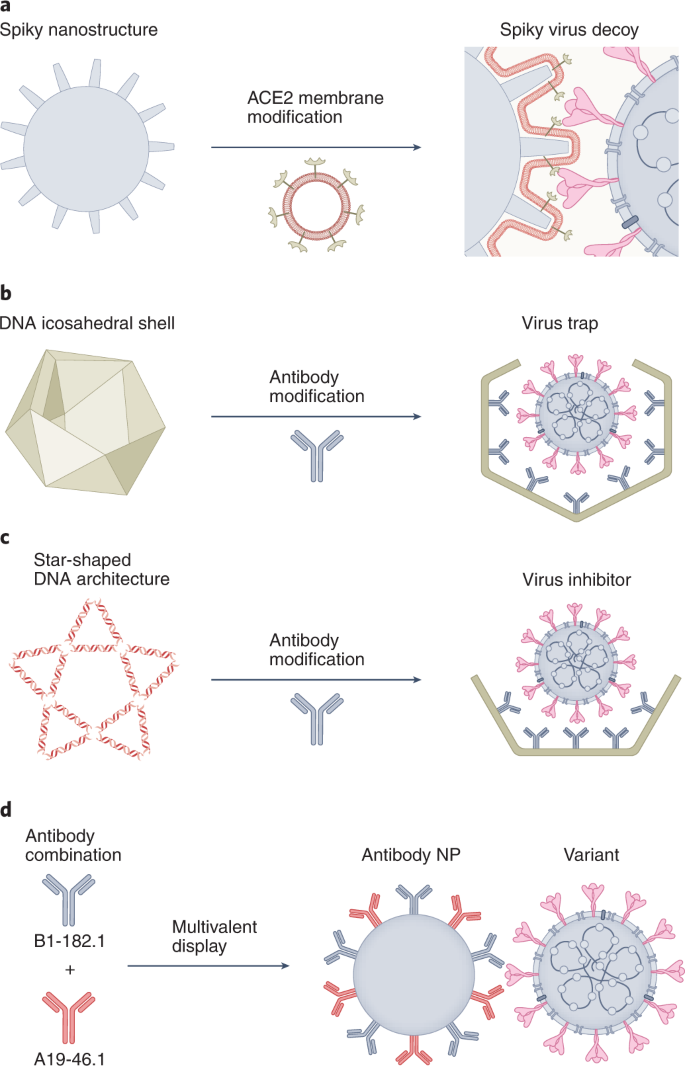
如上所述,基于ace2的纳米诱饵已被证明可以有效地结合和固定SARS-CoV-2。由于纳米结构与地形相匹配,病毒可以诱导多价相互作用并最大限度地结合106,几何匹配的地形和富含ace2的膜涂层的组合可能是一种有前途的策略,以设计对抗变体的下一代纳米诱饵(图。4).作为诱饵的替代品,病毒特异性的结合物,如DNA适体和抗体,可以被修改,以产生具有病毒匹配几何形状的定制纳米结构,以实现多价相互作用(图2)。4 b, c)107,108.利用DNA折纸技术精确构建几何定义的三维物体109在美国,基于dna的纳米结构已被设计用于捕获病毒。例如,通过模仿病毒衣壳中的对称结构,构建了一个自组装的二十面体DNA壳,其内部由病毒特异性结合物功能化,以捕获整个病毒并防止感染108.尽管这种纳米壳已被证明可以捕获其他传染性病毒,但只要简单地切换病毒结合剂,就可以快速定制它,以对抗SARS-CoV-2及其变体103.然而,二十面体几何结构和包膜病毒之间的结构不匹配可能会减少多价相互作用。为了解决这一问题,可以使用与S蛋白几何形状匹配的纳米体三聚体结合剂来增加DNA纳米壳对SARS-CoV-2变体的结合亲和力(图2)。3).
基于纳米技术的变异免疫中和
SARS-CoV-2中和单克隆抗体(mab)可以为COVID-19患者提供有效的治疗保护,但最近发现一些已获授权的单克隆抗体对循环变异,特别是Omicron变异的中和效力降低110.基于纳米技术的低温电子显微镜是了解单抗中和机制和结合表位的重要工具,有助于发现靶向高度保守的SARS-CoV-2表位的广谱单抗和中和SARS-CoV-2变体的超强单抗111,112.为了防止病毒逃逸和增加对变体的覆盖,针对S糖蛋白上多个脆弱性位点的两个或多个单克隆抗体的组合比单一抗体更受欢迎113.因此,将这些单克隆抗体合理组装为同时针对两个或多个非重叠表位的多特异性抗体是一种有前途的方法,可以诱导对当前和未来变体的广泛交叉保护(图2)。4 d)112,114由于互补中和和降低突变逃逸的风险。特别是,纳米技术可以在单克隆抗体的非共价组装或化学偶联中发挥积极作用115,116.例如,作为显示多价抗原的替代方法,自组装铁蛋白可以被修饰以显示具有高价度的抗体片段,以实现更广泛的中和和更强的亲和力。
基于纳米技术的变异治疗药物
抗炎药和广谱抗病毒药物(例如核苷类似物和蛋白酶抑制剂)在降低发病率和死亡率方面仍然是针对变异的有希望的治疗选择,例如目前用于治疗COVID-19患者的地塞米松、瑞德西韦和Paxlovid (nirmatrelvir和ritonavir)117,118,119.将已获许可或正在进行临床试验的药物用于其他病毒,提供了一种经济高效的治疗解决方案120,121.然而,为了维持临床有效浓度,高剂量、反复给药小分子药物是必要的,这可能会导致严重的不良反应118.NPs是这些治疗药物很有前途的药物传递载体,配方纳米药物有望实现被动/主动靶向,延长循环时间和减少副作用122,123,124.例如,一些NPs优先聚集在巨噬细胞中,这为将地塞米松靶向于这些过度激活的免疫细胞以抑制与COVID-19相关的异常炎症反应提供了可能性125.除了小分子治疗药物外,能精确干扰促炎信号或病毒复制的np激活核酸药物是对抗COVID-19的另一个有力工具126.值得注意的是,通过将多种治疗方式集成到一个纳米系统中,可以进一步提高对抗SARS-CoV-2及其变体的有效性。例如,上述的杀病毒纳米材料可以装载广谱抗病毒药物,以实现协同效应103.
前景
虽然最初的SARS-CoV-2引发了当前的大流行,但由SARS-CoV-2 S蛋白持续突变产生的新出现的SARS-CoV-2变体加剧并延长了大流行。尽管目前占主导地位的Omicron变种增强了病毒传播和免疫逃避,但与之前的COVID-19浪潮相比,它导致的住院率和死亡率较低28,127,128.然而,关于严重程度的结论应仔细评估,因为全球人口已经经历了几次COVID-19浪潮,许多国家的疫苗接种率很高,特别是在脆弱的老年人群中。使问题更加复杂的是,在一些国家很难确定已经感染的人口比例129.目前,似乎增加原始mRNA疫苗可以增强中和抗体,并可能在给药后不久防止Omicron感染46,47.具体来说,从感染中恢复或最近接种了mRNA疫苗剂量的个体在中和活性方面有显著提高29,130.然而,一些人声称变种特异性疫苗是有必要的。为此,目前的两家mRNA疫苗生产商(Moderna131和Pfizer-BioNTech132)和强生公司(Johnson & Johnson)133已经宣布了开发新的Omicron变种特异性疫苗的计划。因此,美国食品和药物管理局(fda)表示,它正在制定规则,以加速审查针对特定变异的更新疫苗12.
利用基于纳米技术的新型策略靶向SARS-CoV-2变体的突变S蛋白,为对抗SARS-CoV-2变体带来了巨大的希望。利用疫苗诱导中和抗体是最有效的靶向变异S蛋白,抑制病毒感染的方法。人们利用各种技术开发了各种各样的疫苗,其中一些显示出高保护效力的疫苗已在世界范围内使用。然而,当面对新出现的SARS-CoV-2变种时,这些疫苗的保护效力下降了。与传统疫苗相比,基于纳米技术的疫苗仍然能够保护个人免受SARS-CoV-2变体的影响,因为它们本来就很有效;此外,它们可以方便、快速地更新,以提高它们对SARS-CoV-2变种的疗效。我们预计,它们极高的疗效和较短的生产周期将在实施下一代SARS-CoV-2变种疫苗方面发挥关键作用。
工程中和抗体提供了另一种方法来靶向变异的S蛋白,特别是当疫苗引起的中和抗体由于免疫反应受损而不足时。虽然大量能够中和SARS-CoV-2的工程单体中和抗体不能中和新出现的SARS-CoV-2变体,但在纳米平台上多价展示这些抗体可以显著提高其中和活性。未来的工作可以集中于开发能够同时结合到S蛋白不同位点的多价抗体纳米平台,旨在有效地靶向不同的变体,而不需要调整平台。基于ACE2的纳米诱饵的开发被认为是一种理想的策略来靶向这些变体的S蛋白,因为所有的变体都与ACE2受体具有很高的结合亲和力,而不管它们是否持续突变。因此,一种有效的基于ace2的用于SARS-CoV-2的纳米诱骗剂应该对当前和未来的SARS-CoV-2变体也有效,具有成为所有变体的通用平台的巨大潜力。值得注意的是,尽管最新的Omicron变种比其他循环变异多了几倍的突变,但它仍然通过ACE2受体感染宿主细胞。有可能,各种直接捕获变体或在其表面精确显示中和抗体或ACE2受体的纳米结构(例如DNA折纸)可以用于制备基于纳米技术的新型治疗方法,以对抗SARS-CoV-2变体。尽管COVID-19大流行仍在持续,但由于SARS-CoV-2变种在全球迅速传播,我们预计纳米技术提供的进步和创新可以提供多种方法,加速结束大流行。
参考文献
Florindo, H. F.等。免疫介导的新冠病毒治疗方法。Nanotechnol Nat。15, 630-645(2020)。
唐哲,等。应对COVID-19的材料科学视角。纳特·脱线牧师。5, 847-860(2020)。
唐哲,等。纳米技术在COVID-19治疗中的洞察。纳米今天36, 101019(2021)。
Sadarangani, M., Marchant, A. & Kollmann, T. R.疫苗诱导的预防人类COVID-19的免疫机制。Nat. Rev. Immunol。21, 475-484(2021)。
巴登,L. R.等。mRNA-1273 SARS-CoV-2疫苗的有效性和安全性。心血管病。j .地中海。384, 403-416(2021)。
波拉克等人。BNT162b2 mRNA COVID-19疫苗的安全性和有效性。心血管病。j .地中海。383, 2603-2615(2020)。
Kirtane, A. R.等。全球传染病的纳米技术方法。Nanotechnol Nat。16, 369-384(2021)。
跟踪SARS-CoV-2变种。谁https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/(2022)。
克劳斯,p.r.等人。SARS-CoV-2变体和疫苗。心血管病。j .地中海。385, 179-186(2021)。
冠状病毒正在变异——这有关系吗?自然585, 174-178(2020)。
威廉姆斯,T. C. & Burgers, W. A. SARS-CoV-2的进化和疫苗:值得关注的原因?和出版的《柳叶刀》杂志上。地中海。9, 333-335(2021)。
卞,L.等。SARS-CoV-2变异对疫苗效力和应对策略的影响。专家版本疫苗20., 365-373(2021)。
Cohn, B. A., Cirillo, P. M., Murphy, C. C., Krigbaum, N. Y.和Wallace, A. W. 2021年SARS-CoV-2疫苗保护和美国退伍军人的死亡。科学375, 331-336(2022)。
霍夫曼,等人。SARS-CoV-2变体B.1.351和P.1逃脱中和抗体。细胞184, 2384 - 2393。e2312(2021)。
刘,C.等。疫苗和恢复期血清对SARS-CoV-2 B.1.617的中和作用降低。细胞184, 4220 - 4236。e4213(2021)。
卢卡斯,C.等。循环SARS-CoV-2变异对mRNA疫苗诱导免疫的影响自然600, 523-529(2021)。
格里尼,A. J.等。将逃脱不同类型抗体结合的SARS-CoV-2 RBD的突变映射。Commun Nat。12, 4196(2021)。
COG-UK Mutation Explorer (COG-UK, 2021);https://sars2.cvr.gla.ac.uk/cog-uk/
Planas, D.等人。传染性SARS-CoV-2 B.1.1.7和B.1.351变异对中和抗体的敏感性。Nat,地中海。27, 917-924(2021)。
崔,A.等人。血清中mRNA-1273对SARS-CoV-2变体的中和活性。j .性研究。95, e01313-01321(2021)。
Jangra, S.等。SARS-CoV-2峰值E484K突变降低抗体中和。柳叶刀的微生物2, e283-e284(2021)。
Dejnirattisai, W.等。SARS-CoV-2 P.1株抗体逃避。细胞184, 2939 - 2954。e2939(2021)。
刘,J.等。bnt162b2可中和B.1.617和其他SARS-CoV-2变体。自然596, 273-275(2021)。
Stamatatos, L. et al. mRNA疫苗接种可增强SARS-CoV-2感染引起的交叉变异中和抗体。科学372, 1413-1418(2021)。
莱文,e.g.等人。对BNT162b2 COVID-19疫苗的免疫体液反应在6个月内减弱。心血管病。j .地中海。385, e84(2021)。
托马斯,S. J.等。BNT162b2 mRNA COVID-19疫苗6个月的安全性和有效性心血管病。j .地中海。385, 1761-1773(2021)。
Scott, J., Richterman, A. & Cevik, M. COVID-19疫苗接种:免疫力下降的证据被夸大了。英国人。地中海。J。374, n2320(2021)。
Karim, S. S. a . & Karim, Q. a . Omicron SARS-CoV-2变种:COVID-19大流行的新篇章。《柳叶刀》398, 2126-2128(2021)。
Cameroni, E.等人。广泛中和抗体克服SARS-CoV-2 Omicron抗原转移。自然602, 664-670(2022)。
施密特,F.等。SARS-CoV-2 Omicron变种的血浆中和。心血管病。j .地中海。386, 599-601(2021)。
Takashita, E.等。抗新冠病毒Omicron变体抗体和抗病毒药物的疗效。心血管病。j .地中海。386, 995-998(2022)。
Rössler, A., Riepler, L., Bante, D., von Laer, D. & Kimpel, J. SARS-CoV-2 Omicron变体中和来自接种疫苗和康复者的血清。心血管病。j .地中海。386, 698-700(2022)。
Altarawneh, H. N.等。预防以前感染SARS-CoV-2的Omicron变种。心血管病。j .地中海。386, 1288-1290(2022)。
VanBlargan, l.a等。传染性SARS-CoV-2 B.1.1.529 Omicron病毒未被治疗性单克隆抗体中和。Nat,地中海。28, 490-495(2022)。
埃利亚,你等人。脂质纳米粒传递SARS-CoV-2 hfc偶联受体结合域mRNA疫苗的设计ACS Nano15, 9627-9637(2021)。
埃利亚,你等人。脂质纳米颗粒RBD-hFc mRNA疫苗可保护hACE2转基因小鼠免受致命的SARS-CoV-2感染。Nano。21, 4774-4779(2021)。
Kon, E. Elia, U. & Peer, D.设计最佳mRNA脂质纳米颗粒疫苗的原则。咕咕叫。当今。Biotechnol。73, 329-336(2022)。
Baumjohann, D. & Fazilleau, N.抗原依赖的T滤泡辅助细胞的多步分化及其在SARS-CoV-2感染和接种中的作用。欧元。j . Immunol。51, 1325-1333(2021)。
Pardi, N.等人。核苷修饰的mRNA疫苗诱导强效T滤泡辅助细胞和生发中心B细胞应答。实验,医学。215, 1571-1588(2018)。这项研究证明了改良的mRNA-LNP疫苗如何诱导高效和持久的中和抗体反应.
莱德尔,K.等人。SARS-CoV-2 mRNA疫苗可促进与中和抗体产生相关的强效抗原特异性生发中心反应。免疫力53, 1281 - 1295。e1285(2020)。
Alameh M.-G。et al。脂质纳米颗粒通过诱导强大的T滤泡辅助细胞和体液反应来增强mRNA和蛋白质亚单位疫苗的功效。免疫力54, 2877 - 2892。e2877(2021)。
Teijaro, J. R. &法伯,D. L. COVID-19疫苗:免疫激活模式和未来挑战。Nat. Rev. Immunol。21, 195-197(2021)。
Kamar, N.等人。在实体器官移植受者中接种三剂信使rna COVID-19疫苗。心血管病。j .地中海。385, 661-662(2021)。
霍尔,V. G.等。在移植受者中第三剂量mRNA-1273疫苗的随机试验心血管病。j .地中海。385, 1244-1246(2021)。
法尔西,a.r.等人。BNT162b2疫苗中和SARS-CoV-2心血管病。j .地中海。385, 1627-1629(2021)。
Nemet, I.等人。第三,BNT162b2疫苗对SARS-CoV-2 Omicron感染的中和作用。心血管病。j .地中海。386, 492-494(2021)。这项研究表明,第三次剂量确实会在给药后不久引起Omicron中和抗体.
Pajon, R.等人。rna -1273增强疫苗接种后的SARS-CoV-2 Omicron变体中和。心血管病。j .地中海。386, 1088-1091(2022)。
吴,M.等。三剂疫苗可产生抗欧米克隆的中和抗体。《柳叶刀》399, 715-717(2022)。
COVID-19: Moderna计划增加剂量以对抗变异。英国人。地中海。J。372, n232(2021)。
崔,A.等人。SARS-CoV-2变体mRNA疫苗增强剂在健康成年人中的安全性和免疫原性:中期分析Nat,地中海。27, 2025-2031(2021)。
杨勇,杜丽娟,SARS-CoV-2刺突蛋白:诱导持续中和抗体的关键靶点。钙信号。目标。其他。6, 95(2021)。
Lan, J.等。SARS-CoV-2刺突受体结合域与ACE2受体结合的结构。自然581, 215-220(2020)。
马丁内斯等人。嵌合突刺mRNA疫苗对小鼠sarbecvirus攻击具有保护作用。科学373, 991-998(2021)。
肖,杨,等。新兴信使rna技术:递送策略和生物医学应用。化学。Soc。牧师。51, 3828-3845(2022)。
Qu, L.等。针对SARS-CoV-2及其新变体的环状RNA疫苗。细胞185, 1-17(2022)。本报告介绍了针对SARS-CoV-2及其变体的环状RNA疫苗.
Beaudoin, C. A., Bartas, M., Volná, A., pezinka, P. & Blundell, T. L. DNA/RNA疫苗中是否存在隐藏基因?前面。Immunol。13, 801915(2022)。
Saunders, K. O.等。针对大流行和新生冠状病毒的中和抗体疫苗。自然594, 553-559(2021)。本研究为研制新型冠状病毒疫苗提供了一个有前景的蛋白质纳米颗粒平台.
Saunders, K. O.等。通过工程B细胞成熟靶向选择hiv特异性抗体突变。科学366, eaay7199(2019)。
豪泽,K. V.等。铁蛋白纳米颗粒H2流感疫苗在健康成人中的安全性和免疫原性:一期试验Nat,地中海。28, 383-391(2022)。
李,D.等。SARS-CoV-2感染增强和中和抗体的体内外功能细胞184, 4203 - 4219。e4232(2021)。
沃尔斯,a.c.等。受体结合域纳米颗粒疫苗诱导广泛保护性sarbecvirus免疫。细胞184, 5432-5447(2021)。
沃尔斯,a.c.等。设计的SARS-CoV-2蛋白纳米颗粒疫苗诱导有效中和抗体反应细胞183, 1367 - 1382。e1317(2020)。
他,L.等人。单组分、自组装、蛋白质纳米颗粒呈现受体结合结构域和稳定峰值,可作为SARS-CoV-2疫苗的候选疫苗。科学。睡觉。7, eabf1591(2021)。
张,Y.-N。et al。COVID-19纳米颗粒候选疫苗对SARS-CoV-2变体产生广泛中和抗体反应的机制科学。睡觉。7, eabj3107(2021)。
鸟纲,K.-L。,Goksøyr, L. & Sander, A. F. Advantages and prospects of Tag/Catcher mediated antigen display on capsid-like particle-based vaccines.病毒12, 185(2020)。
Janitzek, C. M.等人。基于vlp的HPV和胎盘疟疾组合疫苗设计的概念验证研究。科学。代表。9, 5260(2019)。
布伦,K. D.和豪沃思,M.微粒疫苗模块化构建的新路线和机会:粘、点击和粘。前面。Immunol。9, 1432(2018)。
纳米体:天然单域抗体。为基础。学生物化学启。82, 775-797(2013)。
Vanlandschoot, P.等人。Nanobodies®:对抗病毒的新弹药。抗病毒Res。92, 389-407(2011)。
Detalle, L.等。ALX-0171的生成和表征,一种治疗呼吸道合胞病毒感染的新型治疗性纳米体。Antimicrob。代理Chemother。60, 6-13(2016)。
向,Y.等。多功能和多价纳米体可有效中和SARS-CoV-2。科学370, 1479-1484(2020)。
肖夫,等人。超高效合成纳米体通过稳定非活性Spike来中和SARS-CoV-2。科学370, 1473-1479(2020)。
孙,D.等。有效的中和纳米体通过靶向多样化和保守的表位来抵抗SARS-CoV-2的收敛性循环变体。Commun Nat。12, 4676(2021)。
徐杰,等。来自骆驼老鼠和大羊驼的纳米体可以中和SARS-CoV-2变体。自然595, 278-282(2021)。
Koenig,中国。et al。结构引导的多价纳米体阻断SARS-CoV-2感染并抑制突变逃逸。科学371, eabe6230(2021)。
Saelens, X. & Schepens, B.单域抗体起作用。科学371, 681-682(2021)。
Güttler, T.等。高效、耐高温、耐突变纳米体中和SARS-CoV-2EMBO J。40, e107985(2021)。
Ku, Z.等。鼻内注射IgM可广泛预防SARS-CoV-2变体。自然595, 718-723(2021)。
Tada, T.等。含有单一免疫球蛋白Fc结构域的ACE2微体是一种有效的SARS-CoV-2抑制剂。细胞的代表。33, 108528(2020)。
El-Shennawy, L.等人。循环表达ace2的细胞外囊泡阻断了广泛的SARS-CoV-2菌株。Commun Nat。13405(2022)。
张,H.等。用于抑制SARS-CoV-2的可吸入纳米捕集剂。国家科学院学报美国118, e2102957118(2021)。
王,C.等。从富含ace2的细胞中提取的膜纳米颗粒可以阻止SARS-CoV-2感染。ACS Nano15, 6340-6351(2021)。
王哲,等。吸入ace2工程微流体微球用于气管内中和COVID-19和平静细胞因子风暴。事5, 336-362(2021)。
谢峰,等。富含棕榈酰化ACE2的工程细胞外囊泡作为COVID-19治疗。放置板牙。33, 2103471(2021)。
李,Z.等。细胞模拟纳米诱饵可以中和SARS-CoV-2,并减轻COVID-19非人灵长类动物模型中的肺损伤。Nat。Nanotechnol.16, 942-951(2021)。本研究描述了一种对SARS-CoV-2具有感染后治疗作用的纳米诱饵.
饶,L.等。诱饵纳米颗粒通过同时吸附病毒和炎症细胞因子来预防COVID-19。国家科学院学报美国117, 27141-27147(2020)。
张q等。细胞纳米海绵抑制SARS-CoV-2的传染性。Nano。20., 5570-5574(2020)。
Ai, x,等等。细胞纳米海绵表面聚糖修饰促进SARS-CoV-2抑制。j。化学。Soc。143, 17615-17621(2021)。
李,M.等。通过类脂纳米组件分泌表达SARS-CoV-2的mrna编码的截断ACE2变体。放置板牙。33, 2101707(2021)。
Kim, J., Mukherjee, A., Nelson, D., Jozic, A. & Sahay, G.使用mRNA纳米疗法快速生成循环和粘膜诱饵ACE2,用于SARS-CoV-2的潜在治疗。预印在bioRxivhttps://doi.org/10.1101/2020.07.24.205583(2020)。
Zoufaly, A.等。人重组可溶性ACE2在重症COVID-19中的应用。和出版的《柳叶刀》杂志上。地中海。8, 1154-1158(2020)。
蒙蒂尔,V.等人。使用临床级可溶性人ACE2抑制工程人类组织中的SARS-CoV-2感染。细胞181, 905 - 913。e907(2020)。
Haschke等人。重组人血管紧张素转换酶2在健康人体内的药代动力学和药效学中国。Pharmacokinet。52, 783-792(2013)。
罗梅罗,C. A.奥里亚斯,M. & Weir, M. R.新型RAAS激动剂和拮抗剂:临床应用和争议。内分泌。11, 242-252(2015)。
南,a.m.等。胎儿编程和血管紧张素-(1-7)轴:回顾实验和临床数据。中国。科学。133, 55-74(2019)。
Warner, F. J, Rajapaksha, H., Shackel, N. & Herath, C. B. ACE2:从肝脏疾病的保护到COVID-19的传播。中国。科学。134, 3137-3158(2020)。
Chan, K. K.等。工程人ACE2优化与SARS冠状病毒2的刺突蛋白结合。科学369, 1261-1265(2020)。
格拉斯哥,A.等。ACE2受体诱捕器能有效中和SARS-CoV-2。国家科学院学报美国117, 28046-28055(2020)。
Chan, K. K., Tan, T. J. C, Narayanan, K. K.和Procko, E.一种用于SARS-CoV-2的工程诱饵受体广泛结合蛋白S序列变体。科学。睡觉。7, eabf1738(2021)。
Higuchi, Y.等。ACE2受体工程化疗法克服了SARS-CoV-2的突变逃逸。Commun Nat。12, 3802(2021)。
张,L.等。工程ACE2诱饵减轻SARS-CoV-2变体引起的肺损伤和死亡。Nat,化学。医学杂志。18, 342-351(2022)。
杰克曼,J. A.等。使用脑穿透抗病毒肽治疗寨卡病毒感染。Nat。板牙。17, 971-977(2018)。
纳米技术提供了用抗病毒药物对抗COVID-19大流行的替代方法。生物科技Nat。》。39, 1172-1174(2021)。
尹宝强,全永永,Sut, T. N., Cho, N.-J. & Jackman, J. A. Stopping membrane-enveloped viruses with nanotechnology strategies: toward antiviral drug development and pandemic preparedness.ACS Nano15, 125-148(2021)。
保罗,J. R. A.等。1%阿斯托德聚钠鼻喷雾剂配方对K18-hACE2小鼠SARS-CoV-2鼻挑战的保护作用。病毒13, 1656(2021)。
聂,C.等。用于抑制病毒的具有几何匹配形貌的尖刺纳米结构。Nano。20., 5367-5375(2020)。
权,P. S.等。设计师DNA架构为病毒感知和抑制提供了精确和多价空间模式识别。Nat,化学。12, 26-35(2020)。
Sigl, C.等。用于病毒捕获的可编程二十面体外壳系统。Nat。板牙。20., 1281-1289(2021)。本研究证明了利用DNA结构捕获病毒的可能性.
Saccà, B. &尼迈耶,C. M. DNA折纸:折叠DNA的艺术。Angew。化学。Int。艾德。51, 58-66(2012)。
礼来公司的Regeneron抗体疗法输给了欧米克隆。爱尔兰时报(2021年12月14日);https://www.irishtimes.com/business/health-pharma/eli-lilly-regeneron-antibody-therapies-lose-out-against-omicron-1.4755091
Du, S.等。SARS-CoV-2 B.1.351中和抗体的结构为针对相关变体的鸡尾酒设计提供了见解。细胞Res。31, 1130-1133(2021)。
王,L.等。抗多种高传染性SARS-CoV-2变体的超高效抗体。科学373, eabh1766(2021)。
Dussupt, V.等。通过单克隆抗体组合对SARS-CoV-2变体的低剂量体内保护和中和。Immunol Nat。22, 1503-1514(2021)。
De Gasparo, R.等人。双特异性IgG可以中和SARS-CoV-2变体,防止小鼠逃逸。自然593, 424-428(2021)。
Szijj, P. & Chudasama, V.化学生成双特异性抗体的复兴。化学。5, 78-92(2021)。
Shatz, W.等人。铁蛋白作为天然蛋白质支架:构建多价铁蛋白- fab缀合物。LCGC增刊。37, 30-35(2019)。
白格尔,J. H.等。瑞德西韦治疗covid -19最终报告。心血管病。j .地中海。383, 1813-1826(2020)。
康复协作小组在COVID-19住院患者中使用地塞米松。心血管病。j .地中海。384, 693-704(2020)。
COVID-19:辉瑞公司报告称,对有严重疾病风险的患者,paxlovid的有效率为89%。英国人。地中海。J。375, n2713(2021)。
Saul, S. & Einav, S.针对新病毒的旧药物:对抗COVID-19的重新利用方法。ACS感染。说。6, 2304-2318(2020)。
曹艳。缺氧- vegf -血管通透性对新冠肺炎患者的影响。探索1, 20210051(2021)。
Anselmo, a.c. & Mitragotri, S.临床中的纳米颗粒:COVID-19疫苗后的更新。Bioeng。Transl。地中海。6, e10246(2021)。
赵,Z.等。甘草酸纳米颗粒作为COVID-19治疗的抗病毒和抗炎药。ACS达成。板牙。接口13, 20995-21006(2021)。
刘杰,万敏,里昂,程杰,胡铁云。纳米药物治疗巨噬细胞功能障碍:减弱严重感染细胞因子风暴的潜在策略。开展10, 9591-9600(2020)。
Lammers, T.等人。治疗COVID-19的地塞米松纳米药物。Nanotechnol Nat。15, 622-624(2020)。
韩旭,米切尔,梅杰,聂国强。用于治疗性RNA递送的纳米材料。事3., 1948-1975(2020)。
Bhattacharyya, R. P. & Hanage, W. P.在推断SARS-CoV-2 Omicron变体的内在严重程度方面的挑战。心血管病。j .地中海。386, e14(2022)。
Ulloa, a.c., Buchan, s.a., Daneman, N. & Brown, K.A.加拿大安大略省SARS-CoV-2欧米克隆变异严重程度的估计。《美国医学会杂志》327, 1286-1288(2022)。
尼隆,J. &考林,B. J.欧米克隆严重程度:温和但不温和。《柳叶刀》399, 412-413(2022)。
普廉姆,J. R. C.等。在南非,与Omicron出现相关的SARS-CoV-2再感染风险增加。科学376, eabn4947(2022)。
Moderna宣布初步助推器数据和更新战略,以解决欧米克隆变种。业务线https://www.businesswire.com/news/home/20211220005253/en/Moderna-Announces-Preliminary-Booster-Data-and-Updates-Strategy-to-Address-Omicron-Variant(2021)。
辉瑞和BioNTech提供欧米克隆变种的最新进展。辉瑞https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-provide-update-omicron-variant(2021)。
强生公司将评估其针对新的Omicron COVID-19变种的COVID-19疫苗。强生公司https://www.jnj.com/johnson-johnson-to-evaluate-its-covid-19-vaccine-against-new-omicron-covid-19-variant(2021)。
奥特曼,D. M.博伊顿,R. J. &比尔,R.对SARS-CoV-2变种的免疫力的担忧。科学371, 1103-1104(2021)。
Tregoning, J. S., Flight, K. E., Higham, S. L., Wang, Z. & Pierce, B. F. COVID-19疫苗研究进展:病毒、疫苗和变异与疗效、有效性和逃逸。Nat. Rev. Immunol。21, 626-636(2021)。
王,P.等。SARS-CoV-2变异P.1对抗体中和的抗性增强。细胞宿主微生物29, 747 - 751。e744(2021)。
Mlcochova, P.等人。SARS-CoV-2 B.1.617.2 Delta变体复制和免疫逃避。自然599, 114-119(2021)。
威廉等人。疫苗血清和单克隆抗体降低了SARS-CoV-2 Omicron变体的中和作用。预印在MedRxivhttps://www.medrxiv.org/content/10.1101/2021.12.07.21267432v4(2021)。
安德鲁斯等人。针对Omicron (B.1.1.529)变种的COVID-19疫苗有效性。心血管病。j .地中海。386, 1532-1546(2022)。
加强对Omicron (B.1.1.529)的准备:成员国的技术简报和优先行动(2021);https://www.who.int/docs/default-source/coronaviruse/2022-01-21-global-technical-brief-and-priority-action-on-omicron-sars-cov-2-variant.pdf?sfvrsn=f3ac8bc3_9&download=true©施普林格自然。
COVID-19加强疫苗:我们知道什么,谁在做什么。英国人。地中海。J。374, n2082(2021)。
基钦,D.等人。Ad26.COV2。S突破感染诱导高滴度的抗欧米克隆和其他SARS-CoV-2变种的中和抗体。病房代表。3., 100535(2022)。
Wink, P. L.等。在巴西南部首次发现SARS-CoV-2 Lambda (C.37)变体。感染。控制医院流行病.1 - 2(2021)。
Messali, S.等人。意大利新SARS-CoV-2 B.1.621谱系的群集和病毒分离物对BNT162b2疫苗的敏感性。J.医学病毒。93, 6468-6470(2021)。
确认
作者得到了美国METAvivor早期职业研究者奖(No. 2018A020560, W.T.)、部门基础科学家补助金(No. 2420 BPA075, W.T.)、Khoury创新奖(No. 2020A003219, W.T.)、Gillian Reny Stepping Strong创伤创新突破创新者奖(No. 113548, W.T.)、纳米技术基金会(No. 2022A002721, W.T.)、Farokhzad家族杰出主席基金会(No. 018129, W.T.)的支持。美国AHA合作科学奖(No. 2018A004190, W.T.),以色列创新管理局(Kamin-Corona;D.P.),美国国立卫生研究院(NIH)主任新创新者奖(DP2 TR002776, M.J.M.),科学界面的巴勒斯惠康基金职业奖(CASI;M.J.M.),美国国立卫生研究院(NCI R01 CA241661, NCI R37 CA244911和NIDDK R01 DK123049, M.J.M.),美国国家科学基金会职业奖(CBET-2145491, M.J.M.)和约兰人类基因组研究所(E.K.)。
作者信息
作者及隶属关系
相应的作者
道德声明
相互竞争的利益
D.P.声明以下竞争性财务利益:D.P.从以下实体收取许可费(他是发明者的专利)、投资、咨询(或在科学咨询委员会或董事会)、演讲(并收取费用)或在TAU为以下实体进行赞助研究:ART Biosciences、BioNtech SE、EPM Inc.、Earli Inc.、Kernal Biologics、Merck、Newphase Ltd.、NeoVac Ltd.、RiboX Therapeutics、Roche、SirTLabs Corporation、Teva Pharmaceuticals Inc.。其他作者宣称没有利益竞争。
同行评审
同行评审信息
自然纳米技术感谢Tony Hu和Pere Santamaria对本工作的同行评审所作的贡献。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
关于本文
引用本文
黄,X,今,E,韩,X。et al。基于纳米技术的对抗SARS-CoV-2变种的策略。Nanotechnol Nat。17, 1027-1037(2022)。https://doi.org/10.1038/s41565-022-01174-5
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41565-022-01174-5