摘要
自然杀伤(NK)细胞由一种独特的先天淋巴样细胞组成,具有识别和消除病毒感染细胞和肿瘤细胞的内在能力。NK细胞具有多种细胞毒性机制和通过细胞因子产生调节免疫反应的能力,在抗癌免疫中发挥着关键作用。这一作用在近20年前被阐明,当时作为免疫治疗剂的NK细胞在治疗晚期白血病患者中表现出了安全性和有效性。近年来,随着嵌合抗原受体(CAR)工程的过继T细胞治疗的成功以及将细胞转化为强大抗肿瘤武器的技术的进步,人们对NK细胞作为免疫治疗候选细胞的兴趣呈指数级增长。基于NK细胞的治疗方法的发展策略侧重于通过共刺激信号、检查点抑制和细胞因子装甲来增强NK细胞的效力和持久性,并旨在通过CAR的表达或使用接合因子分子来重定向NK细胞对肿瘤的特异性。在临床中,第一代NK细胞疗法已经取得了令人鼓舞的疗效和显著的安全性,从而激发了持续创新的巨大热情。在这篇综述中,我们描述了增强NK细胞细胞毒性和寿命的各种方法,评估挑战和机遇,并反思从临床中吸取的经验教训将如何指导下一代NK细胞产品的设计,这些产品将解决每种癌症的独特复杂性。
简介
采用工程免疫效应物的过继细胞疗法是治疗治疗方案有限的血液病和实体恶性肿瘤的一种有前途的新方法1,2,3.,4,5,6,7,8,9.自体嵌合抗原受体(CAR) T细胞疗法该药物率先进入临床转化和商业化,对侵袭性B细胞恶性肿瘤患者有显著改善,在许多病例中产生了长期持续的缓解。然而,尽管取得了这些成功,挑战依然存在。CAR - T细胞疗法的复杂制造过程增加了成本,延长了静脉到静脉的时间,因此对于那些由于疾病迅速发展而急需治疗的患者来说是一个障碍。此外,对患者自身细胞作为来源材料的要求限制了资格,因为许多患者经常经过大量预处理和治疗lymphopenic,并且可能没有足够的细胞来产生可行的产品。在临床中,CAR - T细胞相关的细胞因子释放综合征(CRS)和神经毒性是另一个值得关注的问题,需要住院患者监测。鉴于这些限制,人们对探索现成的、可以普遍应用的细胞来源越来越感兴趣。由于T细胞通过T细胞受体(TCR)识别并介导一种针对非我的反应,CAR - T细胞在免疫系统中的应用同种异体的设置需要额外的基因编辑步骤来移除TCR以降低风险移植物抗宿主病(GvHD)。另一方面,自然杀伤细胞(NK)以人类白细胞抗原(HLA)不受限制的方式识别它们的目标,因此不存在这些风险,使它们成为通用细胞免疫治疗的有吸引力的候选者10.NK细胞效应功能由一系列复杂的激活和抑制受体控制,这些受体可以区分健康细胞和“应激”细胞11.受体-配体接触产生的累积线索决定了NK细胞是否传递“杀死”或“不杀死”信号。健康细胞通过识别自我主要组织相容性复合体(MHC) I类分子,结合抑制杀手细胞免疫球蛋白样受体(KIRs)是阻止NK细胞功能的信号。相比之下,通过缺失自我识别机制,NK细胞攻击异常的自我细胞,如肿瘤细胞,这些细胞下调MHC I类分子的表达,试图逃避T细胞的反应,并上调由DNA损伤或恶性转化等应激诱导的激活配体12,13,14,15,16.
这些不同的属性为NK细胞的异体治疗应用提供了独特的优势。随着创新策略的加速发展和允许更深入的生物学研究的新一代技术的出现,各种NK细胞产品可以设计用于癌症治疗。在这篇综述中,我们描述了NK细胞的这些独特特性是如何用于过继NK细胞免疫治疗的,并概述了不断发展的工程策略,以增强NK细胞的效力和持久性,以及通过下一代CAR分子、工程化TCR和与细胞接合物的预络合,将NK细胞的特异性重定向到肿瘤。最后,我们对未来的挑战和机遇进行了展望,因为我们面对实体肿瘤并保护免疫效应细胞免受肿瘤微环境内的抑制压力,同时还设计了监测和减轻无意安全问题的策略。
NK细胞的生物学特性
尽管工程T细胞免疫疗法取得了成功1,2,3.,4,5,6,7,8在美国,临床效益仅限于一小部分患者和少数适应症,因此凸显了对新策略的需求。利用先天免疫来扩大抗肿瘤反应的范围是一个有吸引力的选择。在先天免疫系统中,NK细胞是特化的免疫效应细胞,被怀疑在肿瘤免疫监测中起作用10在临床前和临床研究中观察到,低NK细胞活性与增加癌症易感性和更高的转移风险相关17,18,19.NK细胞由CD34发展而来+骨髓中的祖细胞,尽管尚不清楚它们是来自一组独特的前体细胞,还是来自同时产生T淋巴细胞、B淋巴细胞和髓系细胞的多能祖细胞20..与T细胞和NKT细胞不同,NK细胞缺乏克隆型TCR和负责信号转导的相关CD3复合物的表达。NK细胞通常根据表面蛋白CD56和CD16: CD56的相对表达分为两类明亮的CD16低/ -(免疫调节,细胞因子产生)和CD56昏暗的CD16+(细胞毒性)21.然而,最近在高参数细胞术和单细胞蛋白质基因组学方面的进展导致人们认识到,NK细胞实际上可能表现出更大的表型异质性,超出了这两个亚群,从而产生具有不同功能特性的不同细胞群22.
NK细胞具有很强的细胞毒性,在与靶标形成免疫突触后,通过释放溶细胞颗粒和细胞毒性细胞因子引起强烈的反应23.此外,它们可以通过Fc识别抗体包裹的细胞rm \({\{\伽马}}{\ rm {RIIIA}} \)(CD16)受体和触发抗体依赖性细胞毒性(ADCC)和细胞因子的产生24.NK细胞也被描述为“免疫调节”,因为它们能够产生一系列细胞因子和趋化因子,通过这些细胞因子和趋化因子帮助形成B细胞和T细胞的反应,并影响树突状细胞、巨噬细胞和中性粒细胞的功能11.这种广泛的属性揭示了与NK细胞功能相关的复杂生物机制网络,并支持NK细胞在免疫治疗中的价值。
NK细胞的记忆功能
早期研究报告了NK细胞在巨细胞病毒感染小鼠模型中的记忆样反应25,26这种行为通常与先天免疫细胞无关。在这些研究中26,27当IL-12和IL-18组合刺激小鼠NK细胞时,获得了以IFN产生增加为特征的功能性表型\ (rm{\伽马}}{\ \).有趣的是,在静息期后,这些细胞能够在细胞因子刺激或激活受体的参与下重新激活,并表现出增强的IFN\ (rm{\伽马}}{\ \)类似于适应性免疫细胞记忆性质的反应。后来,托德·费尼格(Todd Fehniger)的研究小组假设,人类的NK细胞也应该被赋予类似记忆的特性。与这一假设一致,他们的研究表明,用IL-12、IL-15和IL-18预激活的人类NK细胞,然后休息1-3周,能够在增强的IFN驱动下产生强大的反应\ (rm{\伽马}}{\ \)在随后暴露于细胞因子或K562白血病细胞后产生28.从那时起,更多的研究小组在各种免疫环境中描述了类似的记忆功能,包括对人类这种反应的观察29,30..
NK细胞来源和供体选择
在癌症患者中,NK细胞通常表现为功能失调的表型,其特征是基因表达谱的改变和细胞毒功能的降低31,32,从而降低了自体NK细胞治疗应用的可行性。此外,自体制造平台很麻烦,如果患者不能提供足够的细胞进行下游加工和工程,可能会限制其可访问性。
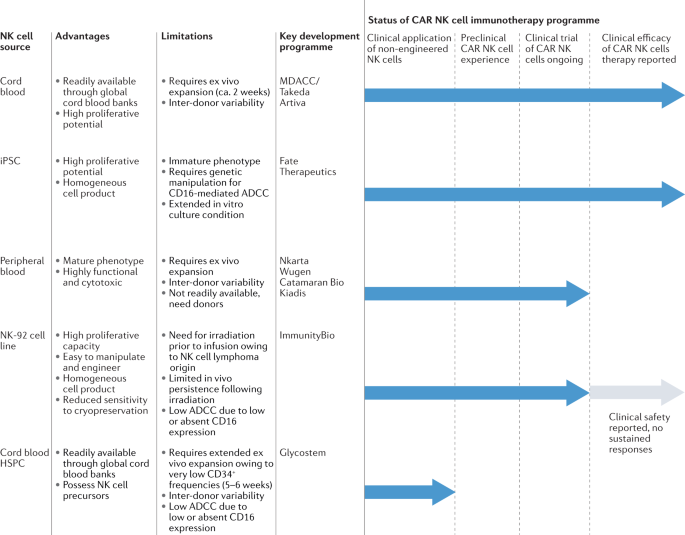
由于异基因NK细胞不会引起GvHD,目前的NK细胞治疗方案主要依赖于异基因来源,以避免与自体方法相关的负担。NK细胞有多种来源(图2)。1),即外周血单个核细胞28,29,30.,脐带血28,29,30.,33,34,35,36,37永垂不朽的细胞系38,39,40、造血干细胞和祖细胞33,34,41而且诱导多能干细胞(万能)42,43.所有来源都可以提供有临床意义的细胞剂量,适用于CAR受体工程,并已过渡到人体研究。然而,它们具有独特的优势和挑战,并且可能具有不同的潜在转录、表型和功能特性44.
NK-92是首个获得美国食品和药物管理局(FDA)临床试验新药批准的基于NK细胞的免疫疗法,是一种均质、永生化NK淋巴瘤细胞系,可在体外扩增以实现大细胞数量38(表1).NK-92细胞缺乏大多数KIRs的表达,因此不太可能被抑制,这使得它们对细胞治疗有吸引力38.然而,它们的癌变来源引起了安全问题,并且在患者给药前需要对nk -92衍生细胞产品进行照射,这反过来又会对其在体内的长期持久性和整体治疗潜力产生负面影响37.另一个缺点是,由于缺乏CD16的表达,NK-92细胞缺乏通过ADCC介导细胞杀伤的能力。
NK细胞也可以来源于CD34+祖细胞体外分化33.在首次人体临床试验中,Dolstra等人在接受过继转移HSPC-NK细胞的轻度残留疾病阳性急性髓系白血病(AML)老年患者中显示了临床疗效34.尽管初步结果令人鼓舞,但在更大的患者群体和各种适应症中探索HSPC-NK细胞的安全性和有效性的临床研究将有助于确定这些细胞的潜在临床应用范围。未来的工作还需要解决HSPC-NK细胞是否可以有效地改造以实现增强的肿瘤特异性。
由于诱导多能干细胞具有克隆生长和高膨胀能力,以及体外分化能力,可以制造大量同质NK细胞产品,因此对NK细胞来说是一种有吸引力的来源。一个潜在的缺点是ipsc来源的NK细胞通常表达低水平的内源性CD16,尽管这可以通过基因工程缓解45.另一个可能的问题是,诱导多能干细胞可能含有与其起源的体细胞组织一致的DNA甲基化特征46.这种“表观遗传记忆”可能会影响与供体细胞不同的特定细胞系的发育,因此,在使用iPSC平台时应该考虑到这一点47.尽管如此,越来越多的基因工程iPSC-NK细胞候选细胞正在出现在临床前研究中,其中一些已经过渡到临床试验48,49,50,51.在I/II期试验中,表达CAR的iPSC-NK细胞在复发或难治性(R/R)弥漫性大B细胞淋巴瘤患者中表现出令人鼓舞的结果,无论是单药治疗还是联合cd20靶向药物治疗43,49.
原代NK细胞可从外周血中获得(PB-NK细胞)28,29,30.,36或者来自脐带血(CB-NK细胞)33,34,35,37.CB-NK细胞可以通过血库冷冻,而PB-NK细胞需要apheresis健康捐赠者和特定捐赠者的收集在Dario Campana于2005年领导的工作中,PB-NK细胞作为第一次成功将CAR构建物交付到NK细胞的平台。52),今天,PB-NK细胞为目前临床测试中的各种产品提供了基础(表1).脐带血NK细胞在car重定向抗肿瘤细胞毒性和临床活性方面有良好的记录,由我们的团队首创35,37.在我们的研究中,我们证明了基因工程脐带血来源的CD19- car NK细胞对抗R/R CD19的有效临床疗效+淋巴系统恶性肿瘤的I/II期临床试验37.
来自所有这些来源的NK细胞已被证明具有过继细胞治疗应用的优点和缺点。来源材料的多种选择为治疗策略的设计提供了一定程度的通用性,使平台能够专门针对每个患者群体和疾病指征的需求进行定制。
值得注意的是,供体间的差异性可能会影响NK细胞的分布,从而影响临床结果。因此,全面了解产品特性对于定义具有更强效力和持久性的生物标志物至关重要。从免疫学的角度来看,当跨越HLA-KIR基因型边界给药时,供体来源的NK细胞可能是有利的,因为HLA-KIR配体差异可能有助于克服肿瘤免疫逃避。在基于NK细胞的免疫治疗的早期,该领域认识到,在HLA单倍型不匹配的移植物与KIR配体不相容的受者中,移植后AML复发的概率显著降低53.尽管kil - hla基因型的供体选择仍然是一个积极研究的领域54,55,56,57有证据表明,这种方法在T细胞缺失的异基因造血干细胞移植(alloHSCT)中具有潜在的好处。58,59,60,61,62,63,64,65,66.需要进一步的工作来确定这一策略是否能成功地应用到NK细胞治疗管道中。
增强NK细胞的适应性和抗肿瘤功能
嵌合抗原受体
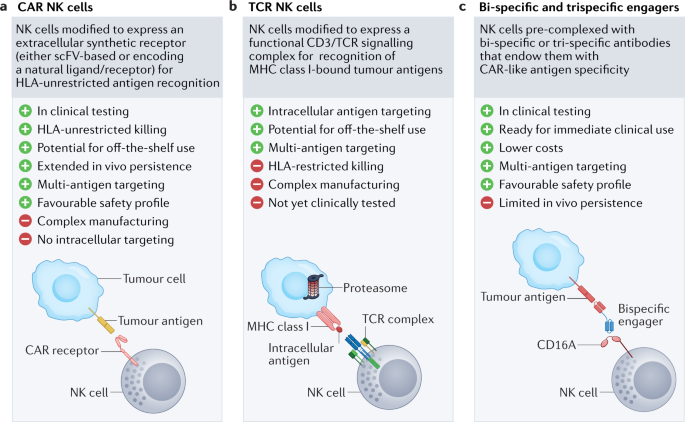
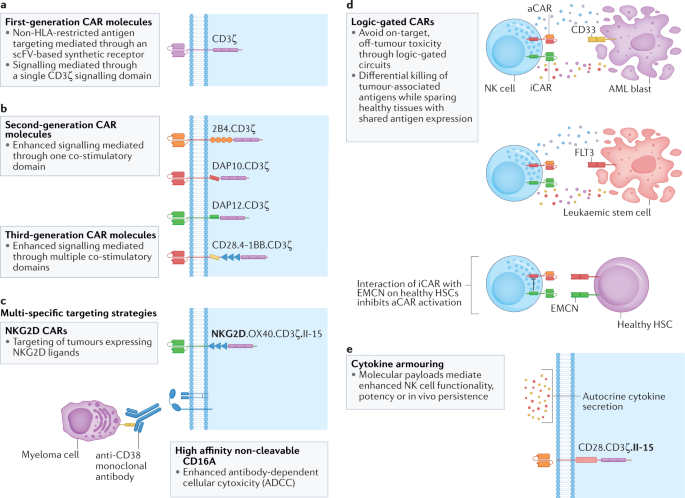
嵌合抗原受体(CARs)是合成的融合蛋白,包括细胞外抗原识别域和触发细胞激活的细胞内信号部分。最常见的是,来自所需抗体的单链可变片段(scFv)用于抗原结合域,尽管也构建了许多由天然细胞受体的细胞外部分组成的CAR模式,利用受体-配体相互作用的自然特异性67,68,69.CARs可以在免疫效应细胞上表达,目的是重新编程它们对特定目标的特异性(图。2).car工程T细胞疗法是第一个出现的,各种产品开发用于免疫肿瘤学应用1,2,3.,4,5,6,7,8.此后,该领域不断扩大,NK细胞也被整合到基因工程管道中70,71.car通常是为T细胞设计的(包括CD3\ (rm{\ζ}}{\ \)和T细胞共刺激分子)已被用于生成CAR - NK细胞,研究表明,这些细胞可以有效和特异性地靶向肿瘤,同时保持理想的安全性37(无花果。3).
一个,b|嵌合抗原受体(CAR)分子从简单的第一代设计在过去二十年中发生了巨大的发展276(面板一个),转至第二代52,277,278和第三代39,279加入共刺激分子的CARs(面板)b),最后,现代CAR设计类似于模块化系统,包括优化的细胞外域用于目标识别,细胞内共刺激分子用于有效的自然杀伤(NK)细胞激活,以及增加的有效载荷可增强NK细胞功能。c- - - - - -e目前的策略利用了CAR信号和功能的核心原理,并提供了创新的方法来提高肿瘤识别和增强细胞活化,使用复杂的结构设计来靶向多种肿瘤抗原69,280(面板c),提供细胞因子支持35,37(面板e)并激活辅助细胞毒性通路。集成逻辑门控电路,指导选择性杀伤靶向恶性细胞,同时保留健康组织,可能会提高安全性90,92,93(面板d).aCAR,激活嵌合抗原受体;急性髓系白血病;DAP12, dna激活蛋白12;EMCN Endomucin;HLA,人白细胞抗原;造血干细胞;iCAR,抑制性嵌合抗原受体;scFV,单链可变片段。
在这些令人鼓舞的结果的激励下,人们对基于与NK细胞生物学相关的激活信号设计CARs越来越感兴趣(图2)。3 b).这种方法的例子包括dnax激活蛋白12 (DAP12)和DAP10,它们已被用于取代CD3\ (rm{\ζ}}{\ \)在一些研究中72,73,74,75,76.这些连接蛋白是细胞内信号结构域,通过募集PI3K起作用,并与激活分子如NKp44有关,激活KIRs (KIR2DS和KIR3DS)和NKG2C(参考文献)。72,76).类似于CD3rm \({\{\ζ}},\)DAP12还含有免疫酪氨酸激活基序(ITAMs),一旦磷酸化,启动级联信号,最终释放细胞毒颗粒和促炎细胞因子,如TNFα和IFNγ72.DAP10虽然不具有ITAM结构域,但已被证明可以通过NKG2D-DAP10轴的信号传导诱导NK细胞的强杀伤活性76.
在过去的几年里,CAR - T细胞的行为,一旦锚定在细胞表面,已经引起了相当大的兴趣,特别是在观察到,在某些情况下,CAR - T细胞表现出独立于抗原接合的基础活化水平的升高,称为主音的信号77,78,79,80,81.尽管研究仍在继续探索这一现象的潜在原因,但已有报道称CARs可能通过CD3与TCR-CD3复合体结合\ (rm{\ζ}}{\ \)结构域和可能增强T细胞激活82,83.最近,研究表明,存在于一些CAR框架中的CD28跨膜结构域介导CAR与内源性CD28的异二聚,从而触发T细胞激活84,85.这些观察结果表明CARs在细胞膜上不是静止的,而是倾向于与内源性受体相互作用。尽管我们对这些受体在NK细胞中的关联还知之甚少,但可以想象的是,CARs可能与NK细胞膜上的许多激活受体中的任何一个形成协同伙伴关系,从而导致协同激活。
努力也集中在完善基于car的策略,这是由这种疗法的临床转化所激发的,这促使人们对克服患者所经历的挑战的方法进行了研究。基于car的细胞治疗的一个关键障碍是抗原逃逸,肿瘤通过抗原丢失或下调逃避免疫反应的过程。人们采用了各种策略来解决这个问题。靶向多种抗原是一种可行的方法,既增加了肿瘤检测的严格性,又延长了治疗的益处(图。3 c).这通常是通过表达一个双顺子结构来实现的,它编码两个独立的CAR(每个CAR针对肿瘤上的不同抗原,并连接到两个独立的信号内域),或者表达一个含有双特异性识别域的CAR,每个CAR串联针对不同的抗原,并连接到一个信号内域86.双car方法提供了更大的设计灵活性,适应信号域和受体格式的组合。每个CAR可以格式化为在目标交战时提供激活和共刺激信号。另外,反式-信号格式将这两种信号分开,并需要与两种抗原接触才能完全激活。对于双特异性CAR,抗原结合部分连接到单个受体,通常是第二代或第三代CAR87,88.在任何一种方法中,对抗原密度、膜定位和蛋白质结构的考虑都是重要的,以确保两种CARs在免疫突触上有效地结合它们的目标。尽管这些基于car的创新方法大多集中在T细胞上,但预计这些系统也可以应用于NK细胞是合理的。
改善car介导的激活控制的策略也已被探索,特别是关注于最小化由靶向、非肿瘤作用引起的毒性。通过使用逻辑门控CAR,促进选择性靶向已被证明可以缓解CAR - T细胞环境下的一些问题89,90,91,92,93(无花果。3 d).最近的一项研究初步发现,当应用“或”和“非”时,控制CAR - NK活性是可行的。逻辑的CAR基因电路法92,93.在这项工作中,该团队通过二价CAR靶向AML细胞上的FLT3和/或CD33,并使用抑制性CAR与健康造血干细胞(hsc)上的抗原结合,并诱导“NOT信号”以防止细胞死亡92,93.
基于car的方法的一个关键限制是,在大多数情况下,检测能力仅限于表面蛋白。细胞内抗原,以多肽- hla复合体的形式出现,通过TCR自然检测。工程NK细胞表达TCR可以允许检测这些肽(图。2 b).tcr引导的NK-92细胞最近已被证明能够介导成功的抗肿瘤反应94.虽然需要进一步的研究来验证这种方法的临床适用性,但一个潜在的优势是,由于NK细胞不具有内源性TCR,在TCR工程T细胞中已经报道了错配问题95这可能不是一个问题。然而,一个缺点是NK细胞不具备T细胞中发现的完整信号机制,因此可能会损害通过合成TCR被有效激活的能力。
NK细胞接合物
NK细胞还可以通过接合子被引导到肿瘤部位,接合子通过触发NK细胞上的激活受体来引发强烈的NK细胞介导的抗肿瘤反应,同时将靶抗原结合到肿瘤细胞上96,97,98,99,One hundred.(无花果。2摄氏度).其他NK接合剂策略包括三特异性和四特异性设计,旨在通过靶向肿瘤上的多种抗原或通过交联细胞因子部分来支持NK的扩张和存活来增强抗肿瘤作用101,102,103,104,105.细胞接合物的使用绕过了工程的需要,不需要载体介导的基因转移,因此代表了一种更简单、成本更低的制造过程,可以提供能够诱导car样活性的产品。
在使用NK细胞接合物靶向血液系统和实体性恶性肿瘤时,各种临床前研究显示了有希望的结果96,97,98,99,One hundred.,101,102,103,104,105,106.最近的研究表明,通过在AML细胞上使用一种靶向CLEC12A的三特异性分子,并通过人源化抗cd16单域抗体和IL-15激活NK细胞,可以对原发性患者来源的AML细胞产生强大的NK细胞介导反应(参考文献)。105).此外,一种靶向两种NK激活受体(CD16和NKp46)的三功能激活因子被证明可以驱动强大的抗肿瘤反应,最终在临床前模型中实体性和转移性恶性肿瘤的设置中有效控制体内肿瘤生长106.
最近,我们的小组证明,当与AFM13(一种双特异性接合物,在NK细胞上结合CD16和在白血病或淋巴瘤靶上结合CD30)复合时,tb -NK细胞表现出增强的CD30杀伤+肿瘤细胞,导致car样反应One hundred..此后,我们将这种方法应用于R/R CD30的临床治疗+霍奇金淋巴瘤和非霍奇金淋巴瘤(NHL) (NCT04074746;107))。随着越来越多的策略过渡到临床试验,评估负载接合体的NK细胞抗肿瘤作用的持久性,并确定是否需要多种治疗来获得持续的治疗益处,也将非常重要。
细胞因子钢筋
尽管CAR和TCR工程技术寻求通过基因重定向其特异性来增强NK细胞功能,但也有一些举措旨在有效地激发NK细胞在体外和/或体内,以维持最佳的抗肿瘤功能和持久性。据描述,新分离的NK细胞与已引物的NK细胞相比具有较低的细胞溶解能力108.解决这一限制的一种方法是细胞因子介导的激活,目前正在研究各种方法29,One hundred.,109,110,111,112,113,114.结合IL-2、IL-15和IL-21补充NK细胞的体外扩增表明,这些细胞因子增强了细胞毒功能,支持高增殖率,同时保持细胞处于健康、未耗尽的状态115.
现在已经很清楚,当在IL-12/15/18存在的情况下培养时,PB-NK细胞转变为一种称为细胞因子诱导的记忆样NK细胞的表型29.细胞因子诱导的记忆样NK细胞在移植前和移植后R/R复发髓系肿瘤患者中均显示出临床疗效29,30..工程记忆类NK细胞表达CAR增强抗肿瘤反应,导致抗NK耐药恶性肿瘤的效力增加111,112.此外,在我们自己使用NK细胞接合剂AFM13的临床试验中,用IL-12/15/18预激活NK细胞以诱导记忆程序,从而增强了对CD30的反应+淋巴瘤One hundred.(无花果。2摄氏度) (NCT04074746(参考。107))。
虽然这些数据强烈地表明了细胞因子启动的优势,但持续的体外刺激使NK细胞“细胞因子成瘾”,并导致在缺乏体内细胞因子支持的情况下注入这些细胞时,持久性下降115.为了避免这一问题,并仍然利用细胞因子激活的好处,该领域已经转向了基因工程,通过修改NK细胞来产生细胞因子,以支持细胞效力、增殖和持久性(图2)。3 e).这种自分泌支持已经引起了极大的兴趣,car工程NK细胞正在出现,并伴有补充的细胞因子信号35,37,48,49.细胞因子装甲可以编程,使可溶性细胞因子释放到环境中,或以膜结合的形式设计,以诱导细胞对细胞相互作用的反应116.以可溶性形式,由工程NK细胞产生的细胞因子可以介导旁观者效应,从而激活肿瘤微环境(TME)中存在的其他免疫效应细胞,如T细胞或髓系细胞,从而潜在地进一步增强抗肿瘤反应117.我们的团队以及其他团队已经证明,在临床前模型中,与CAR单独相比,il -15装甲CAR NK细胞在体内表现出更好的持久性35,48,49.这些发现在CD19患者的临床研究中得到了证实+淋巴样恶性肿瘤,治疗一年后,我们在其中许多人体内检测到CAR - NK细胞循环37.对于每种细胞因子装甲方法,重要的是确定最佳的细胞因子剂量策略,以支持增强功能和持久性,但不会通过诱导代谢衰竭而损害NK细胞的功能,如先前报道的那样118.
克服免疫抑制
TME由严酷的代谢景观组成,其特征是免疫抑制代谢物、葡萄糖和氨基酸剥夺、缺氧和酸性的异质混合,这些因素共同阻止了有效的抗肿瘤免疫。特别是在实体肿瘤中,缺氧是免疫细胞功能障碍的常见驱动因素。研究表明,在缺氧的TME中,NK细胞功能受损,部分原因是抑制细胞如骨髓来源的抑制细胞(MDSCs)、调节性T细胞(T注册细胞)和M2巨噬细胞,以及缺氧对NK细胞功能的直接影响119,120,121,122.据报道,抑制NK细胞中的缺氧反应性HIF1a信号可以增强NK细胞的效力并释放NK细胞介导的抗肿瘤功能123.
肿瘤通常表现出异常的代谢行为,导致高水平的乳酸,重要营养物质的消耗和有毒分解代谢产物,腺苷和活性氧浓度的增加109.此外,不受控制的增殖,功能失调的血管和免疫抑制细胞亚群的存在导致免疫效应细胞冒险进入TME的悲惨命运。为了克服代谢性免疫抑制的不利影响,目前的策略主要集中在两个领域:改变肿瘤的代谢构成或修改免疫细胞中的基因表达程序,以保护它们免受TME中的抑制性代谢物的影响(图2)。4).研究表明,血液中乳酸脱氢酶(LDH)和TME的高水平与黑色素瘤患者的不良预后和检查点治疗的低反应有关124.虽然仍处于临床前阶段,糖酵解抑制剂和乳酸脱氢酶阻滞剂可能提供有利地调节TME的机会。最近的一项研究表明,用乳酸脱氢酶A (LDHA)抑制剂GSK2837808A治疗患者来源的黑色素瘤细胞,在体内和体外都能改善T细胞的抗肿瘤细胞毒性125.TME中的乳酸水平也可以通过靶向其转运蛋白MCT1和MCT4而降低,正如阿斯利康的AZD3965化合物所示,目前正在临床研究中(NCT01791595)。126))。
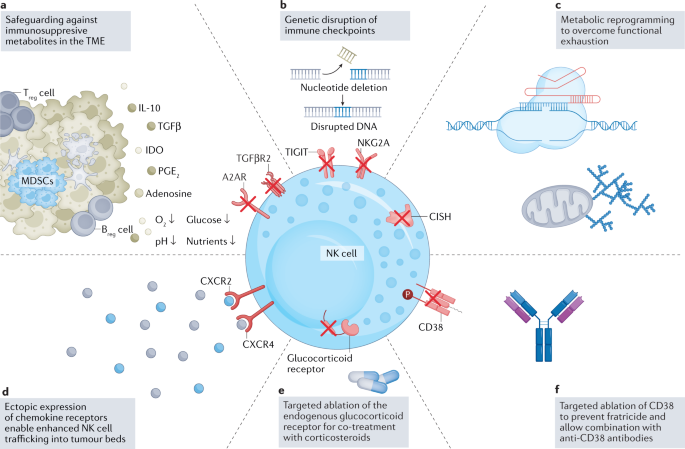
一个- - - - - -f恶性肿瘤微环境(TME)严重损害免疫细胞功能134.目前的策略是利用工程工具来破坏TME(面板)中的抑制信号一个),并通过趋化因子受体的异位表达改善免疫细胞归巢到肿瘤床(面板d).显示了通过基因工程靶向的自然杀伤(NK)细胞相关途径的选择。包括靶向消除抑制检查点的基因工程策略156,164,167,168(面板b, c)以及细胞外受体的破坏,这些受体感知抑制性刺激,包括TGFβ140,141和腺苷135(面板一个)在临床前已被证明可以有效地靶向途径来增强NK细胞的代谢适应性和持久性,目前正在努力将这些发现推进到临床。内源性受体的消融允许组合治疗方法,例如通过使免疫细胞抵抗皮质类固醇诱导的免疫抑制(小组)e),这是先前在严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)定向细胞毒性T淋巴细胞(ctl)中建立的原则。281.敲除CD38(面板f)使NK细胞对cd38介导的兄弟自相残杀具有抗性,这使得NK细胞和抗cd38靶向单克隆抗体的组合策略在治疗多发性骨髓瘤的背景下成为可能50.B注册细胞,调节B细胞;MDSC,髓源性抑制细胞;NKG2A, CD94/NK 2族成员A受体;含免疫球蛋白和ITIM结构域的T细胞免疫受体TIGIT;T注册调节性T细胞。
腺苷是ATP代谢的副产物,通过外核苷酶CD39和CD73的活性产生。在TME的缺氧条件下,作为缺氧驱动的嘌呤能信号通路的一部分,这些酶的表达上调,导致细胞外腺苷的积累,而细胞外腺苷又作为TME中T细胞和NK细胞功能的负调节因子,抑制其代谢和效应功能127,128,129,130.有趣的是,腺苷有助于激活抑制细胞,如T注册细胞,M2巨噬细胞和MDSCs,都是TME内的常驻种群。克服腺苷介导免疫抑制的治疗策略包括通过小分子抑制剂或拮抗抗体阻断肿瘤细胞上的CD73,这两种方法目前都在临床研究中(NCT04148937)。131), NCT03454451(参考。132)和NCT03616886(参考。133))。此外,在临床前研究中,在CAR - T细胞和CAR - NK细胞中删除腺苷A2A受体的基因编辑已经显示出提高这些细胞效力和抗肿瘤功效的希望134,135,136,137(无花果。4).
TGFβ信号是TME内免疫抑制的另一种机制,对NK细胞功能有有害影响。tgf β诱导的miR-27a-5p在体内外均可改善NK细胞毒性138.此外,配备高亲和显性阴性TGFβ受体的NK细胞可以抵抗TGFβ的作用并保持其效力139.同样,我们的研究小组通过靶向删除TGFβ受体,成功地使CB-NK细胞对TGFβ信号通路免疫(TGFBR2)140.我们随后提供的体内证据表明,在胶质母细胞瘤小鼠模型中,TGFβ信号通路的中断可保护NK细胞的细胞毒性141.
当我们试图调节TME中的免疫代谢时,重要的是实现生理平衡,因为一些代谢物是正常代谢的重要组成部分。尽管许多策略仍在开发中,但涉及TME调节和NK细胞工程的联合方法可能会降低免疫抑制,并支持强大的免疫细胞活性。
检查点中断
肿瘤已经进化出复杂的机制来逃避免疫监测,包括免疫检查点的参与,这可能会以与T细胞相似的方式抑制NK细胞。为了将阻断T细胞相关免疫检查点PD1和CTLA4的临床成功转化为现实,几个研究小组已经探索了在NK细胞环境下调节这些调节回路的潜力142,143,144,145,146,147,148,149(无花果。4 b).尽管一些研究指出了它们作为功能抑制因子的作用,但它们在NK细胞生物学中的整体相关性仍存在争议146,150.有可能,支持NK细胞激活的信号网络构成了一个更微妙的画面,其中这些主要是T细胞标记与其他各种NK细胞调节因子协同作用151.其他已被调查的监管机构包括TIM3(参考文献。152,153), T细胞免疫受体与免疫球蛋白和ITIM结构域(TIGIT)136,153,154,155,156和LAG3(参考。157),他们的靶向使用单克隆抗体已被证明在体外逆转肿瘤诱导的NK功能障碍。
抑制性KIRs是NK细胞功能的有效负调节因子,当与HLA I类配体接触时,可以覆盖任何伴随的激活信号。鉴于其在抑制NK细胞功能方面的突出作用,抑制性KIRs引起了相当大的兴趣。Lirilumab是一种抗pankir2d抗体,其作用是通过阻断这些抑制性KIRs,使NK细胞感知到的多种且通常相反的信号信号转向净激活158.然而,在两项早期临床试验中,Lirilumab未能引起有临床意义的反应159,160.这些结果的一个潜在原因可能源于抑制KIRs在NK细胞教育和诱导中的重要作用许可.在这一假设下,由于Lirilumab持续阻断KIR而导致的长时间KIR抑制可能会对NK细胞功能产生负面影响161,162.
与KIR分子类似,CD94/NK 2族成员A受体(NKG2A)是另一种显著的NK细胞负调节因子,当其与同源配体HLA-E结合时,可抑制NK细胞的细胞毒性。Monalizumab特异性地破坏了这种相互作用,并导致先前治疗的复发或转移性头颈部鳞状细胞癌患者与西妥昔单抗联合使用时,有希望达到31%的客观缓解率163.Monalizumab目前正在针对其他实体肿瘤进行测试,包括结直肠癌和非小细胞肺癌以及异基因造血干细胞移植后。
这些方法的共同点是依赖单克隆抗体来调节患者的免疫细胞,由于单克隆抗体在体内的半衰期有限,这种策略需要多次输注。随着基因编辑能力的进步,可以稳定地修改NK细胞,以调节增强NK细胞效应功能的生物机制。一个例子是抑制性受体NKG2A的遗传破坏,这导致在接种HLA-E的异种移植小鼠模型中具有更好的肿瘤控制+肿瘤164(无花果。4 b).此外,在开创性工作的基础上,建立了CIS(细胞因子诱导的含sh2蛋白)作为NK细胞功能的关键负调节因子165,166,我们和其他人成功地改造了NK细胞167,168缺乏这种细胞内细胞因子检查点。由此产生的CAR - NK细胞表现出增强的代谢适应性和增强的抗肿瘤活性(图。4摄氏度).
这些研究预示了靶向遗传扰动调节NK细胞生物学的潜力。展望未来,我们预计无偏倚的高通量发现方法将以更系统的方式阐明特定遗传干预的功能后果,最终为下一代NK细胞免疫疗法的设计提供信息。
促进NK细胞向肿瘤的转运
NK细胞进入并穿透肿瘤床的能力是有效抗肿瘤免疫的关键前提,并与改善临床结果有关169,170,171,172,173.与其他免疫细胞类似,NK细胞通过TME中分泌的趋化因子受体及其同源配体的动态相互作用被引导到肿瘤位点174,175,176,177.近年来,越来越多的工作研究了如何调节这些相互作用来增强对肿瘤的有效归巢。而早期的研究主要集中在扩张性诱导的趋化因子受体上调178,179以及瞬态转染方法180,181由于内化和降解,趋化因子的表达迅速丧失182导致越来越多地采用基因工程策略来稳定地为NK细胞配备异位趋化因子受体182,183(无花果。4 d).今天,现有的研究提供了令人鼓舞的临床前证据,支持调节趋化因子受体以增强NK细胞在包括多发性骨髓瘤在内的广泛难以治疗的肿瘤中向肿瘤床的运输184,185,胶质母细胞瘤182,肾细胞癌183,胰导管腺癌186和卵巢癌187.
尽管取得了这些进展,但仍存在三个重要障碍。首先,趋化梯度依赖于足够的肿瘤灌注,微血栓诱导的循环缺陷可能需要增加肿瘤微灌注的策略182.其次,TME中趋化因子的释放遵循不同的肿瘤特异性动力学,瘤内趋化因子水平可能需要人为提高以吸引工程NK细胞179.最近的工作通过使用装载CXCL16的间皮靶向抗体融合蛋白局部增加趋化因子浓度来解决这一问题,CXCL16在肿瘤细胞接触时在TME中被切割186.此外,最近的工作强调了辐射诱导的CXCL8的应用,以增强NK细胞向肿瘤的迁移188.最后,趋化因子-受体的相互作用可能是环境特异性的,根据所讨论的特定肿瘤类型,促进或废除NK细胞归巢,正如之前观察到的那样184,185.未来的研究将需要解决这些重要问题,并最终验证总体有希望的发现是否能在人体内趋化因子复杂和动态相互作用的背景下占上风。
临床经验
CAR - T细胞疗法已经导致了显著的临床结果,一些患者在CAR - T细胞持续存在的情况下实现了长达十年的缓解1,2,3.,4,5,6,7,8,9.这种新形式的细胞免疫疗法也显示出治疗各种癌症的潜力,推动了越来越多的新策略的发展,以这些成功为基础189,190,191.CAR - T细胞的经验阐明了成功开发安全有效的细胞疗法的许多要求,也揭示了与耐药机制和免疫效应细胞持久性障碍相关的关键挑战192,193.从CAR - T细胞的临床过程中获得的知识促成了新的细胞治疗方式的出现。在过去的十年中,该领域已经看到NK细胞成为一种强大的新型治疗候选者,具有生物学特性,可能有助于克服基于T细胞的方法的一些局限性。一个值得注意的发现是,早期临床数据表明,NK细胞非常适合用于异基因治疗,因为目前正在进行的临床研究尚未报告重大不良事件194.尽管安全性结果令人鼓舞,但还需要进一步的研究来阐明异基因NK细胞是否能够长期持久地逃避受体T细胞的排斥反应。越来越多的临床研究表明,来自外周血单个核细胞、脐带血、iPSCs、HSPCs和细胞系的NK细胞在治疗血液恶性肿瘤方面是安全有效的28,29,30.,33,34,37,39,48,49.此外,我们已经了解到,与T细胞类似,NK细胞很容易受到基因改造,许多临床候选细胞已被设计成更精确地靶向肿瘤(通过表达CAR),并增加持久性(通过细胞因子装甲)。此外,不断努力增强运输到肿瘤部位(通过趋化因子受体编辑)(图。4 d)和屏蔽TME中的抑制因子(通过检查点抑制,代谢重编程(图。4)和耐缺氧)可能会提高临床效益。NK细胞也可能分化为一种记忆样表型,自然地延长NK细胞功能的持久性,并在再次遇到抗原时赋予回忆抗肿瘤反应的能力。记忆NK细胞目前正在进行治疗白血病的临床评估。此外,与参与分子预复合物的记忆类NK细胞提供了一种替代方法,可以在不需要长时间制造的情况下实现类似car的特异性One hundred.在临床中,这种策略正在推动与CAR - T细胞和CAR - NK细胞相似的反应。重要的是,无论采用何种方法,NK细胞疗法始终表现出良好的安全性,迄今为止,未观察到CRS或GvHD。
尽管已经取得了巨大的进展,并且在很短的时间内NK细胞已经成为免疫肿瘤学的重要工具,但大多数报道的成功仅限于血液系统恶性肿瘤,就像CAR - T细胞最初的功能一样。然而,挑战也一直存在。并不是所有的患者都对NK细胞疗法有反应,有些患者最终会复发。肿瘤耐药和复发的机制是什么?肿瘤细胞,以及同样的治疗性NK细胞,在它们相互作用的过程中进化了吗?了解影响患者反应的生物学基础对回答这些问题至关重要。在当前单细胞多组学能力的时代,我们已经准备好将这些挑战视为机遇(方框)1).通过基因组学、蛋白质组学和表观基因组学分析相结合的方法来探究治疗进化,可能会提供有价值的见解,以了解永久性地“损伤”NK细胞进入一种对肿瘤的衰竭和低反应性状态,就像之前在T细胞中观察到的那样195,196.事实上,我们也可能发现代谢重编程的表观遗传根源,导致生物能量储备低和持久性降低。一旦这些机制被阐明,制定策略来逆转它们的作用并挽救细胞功能,或识别拦截有害相互作用的有利基因编辑,将在最大限度地提高细胞免疫疗法的效益方面发挥关键作用。此外,实施联合治疗方法可能为实现协同效应和提高工程过继NK细胞疗法的疗效提供了一种策略(表2)2).整合抗体或小分子抑制剂以防止代谢物驱动的免疫抑制,或阻断检查点和免疫抑制机制(图2)。4 b,e),例如,可能会导致多方面的结果:增强CAR - NK细胞功能,阻碍TME中抑制细胞的信号,并支持其他免疫效应细胞的功能197,198,199.最后,改造NK细胞使其对cd38介导的兄弟杀体具有耐药性,将使NK细胞为基础的治疗方法与抗cd38单克隆抗体相结合,并使NK细胞免疫治疗进入多发性骨髓瘤的早期治疗50(无花果。4 f).
尽管许多临床试验仍处于早期阶段,但通过迭代过程,我们将能够直接从患者那里了解每种癌症造成的障碍是什么,并将这些信息带回实验室,在那里治疗方法可以进一步细化为应对现实生活挑战的适用解决方案。从这些研究中获得的知识将作为建立未来临床研究的基础,在我们前进并瞄准实体肿瘤时,对取得成功至关重要。通过细胞工程策略和联合治疗方法,实体肿瘤的NK细胞过继治疗还需要解决和克服与肿瘤运输不良和免疫抑制TME中有限的持久性和效应功能相关的挑战。
确保NK细胞治疗的基因组保真度
鉴于对基础NK细胞免疫生物学的新见解产生的广泛范围和加速速度,我们预计新型工程细胞产品将会增加。因此,建立筛选和表征产物的平台以识别脱靶核酸酶活性引起的非预期遗传改变越来越重要。随着该领域的进展,一些基因组变化可能在不经意间导致致癌突变的担忧继续在背景中回荡。为了解决这一需求,美国国立卫生研究院(NIH)启动了体细胞基因组工程(SCGE)计划,其主要任务有两个:第一,为研究人员提供财政援助,以促进基因组编辑技术向临床的转移;第二,支持开发更全面的分析方法,以调查使用这些工具可能导致的潜在不良生物效应200.此外,还开发了各种研究基因组编辑保真度的平台,如GUIDE-Seq201, CIRCLE-Seq202和rhampSeq203这依赖于测序技术来公正地识别基因组中可能发生双链断裂的位点。此外,非预期的基因重排可以通过线性放大介导的高通量全基因组易位测序(LAM-HTGTS)等方法来阐明。204.随着这些工具的不断发展和新工具的开发,在细胞治疗开发中实施此类分析将至关重要,以确保更好地了解细胞产品(如工程NK细胞疗法)的安全性和有效性。
结束语
工程细胞免疫疗法继续经历巨大的增长,不同的模式迅速从临床前研究进入临床试验。最近关于转甲状腺素淀粉样变患者肝细胞体内编辑的报道是细胞和基因治疗领域的最新前沿205.在相关的努力中,一种使用脂质纳米颗粒实现T细胞靶向体内CAR转染的方法已经被开发出来,用于生成成纤维细胞激活蛋白(FAP)重定向的CAR - T细胞,以靶向心肌损伤背景下的心脏重塑206,207.此外,最近的研究表明,重定向到CD3、CD8和CD4的Nipah慢病毒载体可以特异性地将治疗基因(如CAR和TCR)传递到体内的T细胞群208.这些技术创新为现成的个性化治疗提供了一种新方法,其中靶向病毒载体易于获得,可根据需要给患者使用,从而绕过了大量体外制造的要求,降低了成本并加快了治疗交付。可以想象,靶向体内编辑也可以应用于肿瘤细胞,推动修改,以恢复它们对抗肿瘤药物的敏感性或消除耐药机制。虽然目前的研究主要集中在CAR - T细胞治疗,但体内工程也可能适用于基于NK细胞的治疗,例如增强内源性NK细胞的功能和持久性,或增加肿瘤对NK细胞介导的细胞毒性的敏感性。
随着该领域继续快速创新,重要的是要了解与这些各种基因编辑策略相关的潜在安全风险,因为与可能的脱靶效应相关的担忧非常相关。最近,由于染色体异常、治疗相关的AML/骨髓增生异常综合征(MDS)或注入的CAR - T细胞产品的恶性转化,多个正在进行的细胞治疗试验停止209证明这些担忧是正确的,并提醒人们密切研究工程产品安全性的重要性。此外,至关重要的是,细胞治疗项目实施系统筛选产品的管道,以评估可能导致有害影响的潜在不需要的基因修饰。利用诸如NIH的SCGE计划等资源,可以提供启动这些行动所需的初步支持。
尽管基于NK细胞的免疫疗法被定位为一种安全的现成抗肿瘤疗法,但重要的问题仍然悬而未决。阐明决定NK细胞效力和持久性的关键参数将是重要的,因为该领域正在发展解决每种疾病适应症具体挑战的方法。此外,与使用共刺激信号、细胞因子装甲和与其他治疗方式结合相关的决定将在最大限度地延长过继转移NK细胞的寿命和益处方面发挥作用。最后,开发和实施NK细胞扩增和冷冻保存的最佳方法将是至关重要的,以确保高产品质量的持续性。从逻辑上讲,新兴的NK细胞治疗项目要想取得成功,就必须建立由研究人员、临床医生和监管官员组成的多学科团队结构,共同勾勒出临床转化的整体路径。
参考文献
莫德,s.l.等。b细胞淋巴母细胞白血病儿童和青年患者的Tisagenlecleucel。心血管病。j .地中海。378, 439-448(2018)。
舒斯特,s.j.等。Tisagenlecleucel治疗成人复发或难治性弥漫性大b细胞淋巴瘤。心血管病。j .地中海。380, 45-56(2019)。
尼拉普,s.s.等人。Axicabtagene ciloleucel CAR - t细胞治疗难治性大b细胞淋巴瘤。心血管病。j .地中海。377, 2531-2544(2017)。
Park, J. H.等。CD19 CAR治疗急性淋巴细胞白血病的长期随访。心血管病。j .地中海。378, 449-459(2018)。
June, C. H., O 'Connor, R. S., Kawalekar, O. U., Ghassemi, S. & Milone, M. C. CAR - T细胞免疫治疗人类癌症。科学359, 1361-1365(2018)。
王,M.等。KTE-X19 CAR - t细胞治疗复发或难治性套细胞淋巴瘤。心血管病。j .地中海。382, 1331-1342(2020)。
Munshi, n.c.等人。伊卡布甲素治疗复发难治性多发性骨髓瘤。心血管病。j .地中海。384, 705-716(2021)。
Raje, N.等人。抗bcma CAR - t细胞治疗复发或难治性多发性骨髓瘤bb2121心血管病。j .地中海。380, 1726-1737(2019)。
梅伦霍斯特,J. J.等。10年白血病缓解,CD4持续+CAR - T细胞。自然602, 503-509(2022)。这篇具有里程碑意义的文章报道了CD19-CAR - T细胞在输注后的持续缓解和体内持久性超过10年,因此强调了使用基因工程T细胞实现的临床反应的长期持久性.
只是,K.-J。et al。人类癌症的自然杀伤细胞介导免疫监测。Semin。Immunol。31, 20-29(2017)。
拉尼尔,L. L.在钢丝上:自然杀伤细胞的激活和抑制。Immunol Nat。9, 495-502(2008)。
Joncker, N. T, Fernandez, N. C, Treiner, E., Vivier, E. & Raulet, D. H. NK细胞的反应性与自我mhc I类抑制受体的数量相称:变阻器模型。j . Immunol。182, 4572-4580(2009)。这项研究阐明了NK细胞反应性的本质,它依赖于抑制和激活信号信号的整合,以确保对异常细胞的自我耐受和免疫监测.
Joncker, N. T., Shifrin, N., Delebecque, F. & Raulet, D. H.成熟的自然杀伤细胞在暴露于改变的MHC环境时重置其反应性。实验,医学。207, 2065-2072(2010)。
Burshtyn, d.n.等人。杀手细胞抑制剂受体招募酪氨酸磷酸酶HCP。免疫力4, 77-85(1996)。
横山,W. M. &金,S.自然杀伤细胞如何找到自我来实现耐受性?免疫力24, 249-257(2006)。
Brodin, P., Lakshmikanth, T., Johansson, S., Kärre, K. & Höglund, P.教育过程中抑制输入的强度定量调节单个自然杀伤细胞的功能响应性。血113, 2434-2441(2009)。
Imai, K., Matsuyama, S., Miyake, S., Suga, K. & Nakachi, K.外周血淋巴细胞的自然细胞毒活性与癌症发病率:一项针对普通人群的11年随访研究。《柳叶刀》356, 1795-1799(2000)。
Guerra, N.等。在自发性恶性肿瘤模型中,nkg2d缺陷小鼠在肿瘤监测方面存在缺陷。免疫力28, 571-580(2008)。
López-Soto, A., Gonzalez, S., Smyth, M. J. & Galluzzi, L. NK细胞转移的控制。癌症细胞32, 135-154(2017)。
Abel, a.m., Yang, C, Thakar, m.s. & Malarkannan, S.自然杀伤细胞:发育、成熟和临床应用。前面。Immunol。9, 1869(2018)。
装饰板材,黄永发。et al。脐带血自然杀伤细胞的特征:移植和新生儿感染的意义。Pediatr。Res。57, 649-655(2005)。
斯特劳斯-阿尔比等人。人类NK细胞库的多样性反映了免疫体验并与病毒易感性相关。科学。Transl。地中海。7, 297ra115-297ra115(2015)。
Prager, I. & Watzl, C.自然杀伤细胞介导的细胞毒性机制。j . Leukoc。医学杂志。105, 1319-1329(2019)。
王伟,Erbe, a.k, Hank, J. A., Morris, Z. S. & Sondel, p.m. NK细胞介导的抗体依赖性细胞毒性在癌症免疫治疗中的应用。前面。Immunol。6, 368(2015)。
O’leary, J. G., Goodarzi, M., Drayton, D. L. & von Andrian,自然杀伤细胞介导的T细胞和B细胞独立适应性免疫。Immunol Nat。7, 507-516(2006)。这项开创性的研究表明,NK细胞可以在抗原再暴露时介导持久的回忆反应,建立了NK细胞自适应记忆的概念.
孙建昌,孙建昌,孙建昌,孙建昌。自然杀伤细胞的适应性免疫特征。自然457, 557-561(2009)。这篇重要的文章揭示了自我更新的“记忆”NK细胞亚群,当转移到幼稚动物身上时,可以经历二次扩张,并引发强烈的适应性免疫反应.
库珀,m.a.等。细胞因子诱导的记忆类自然杀伤细胞。国家科学院学报美国106, 1915-1919(2009)。这项工作开创了细胞因子诱导的记忆类NK细胞的概念,当转移到naïve宿主时,会引起强烈的回忆反应.
罗梅等人。细胞因子激活诱导人类记忆类NK细胞。血120, 4751-4760(2012)。
罗梅等人。细胞因子诱导的记忆样自然杀伤细胞对髓系白血病表现出增强的反应。科学。Transl。地中海。8, 357ra123(2016)。
夏皮罗,r.m.等人。移植后复发时注入的供体记忆样NK细胞的扩增、持久性和疗效j .中国。Investig。https://doi.org/10.1172/JCI154334(2022)。
普拉托诺娃等人。肺癌肿瘤内NK细胞表型和功能的深刻协调改变。癌症Res。71, 5412-5422(2011)。
孙,C.等。NKG2A高表达有助于NK细胞衰竭,预测肝癌患者预后不良。Oncoimmunology6, e1264562(2017)。
Spanholtz, J.等人。脐带血cd34阳性细胞用于过继癌症免疫治疗的功能性人类自然杀伤细胞的高对数级扩增。《公共科学图书馆•综合》5, e9221(2010)。
Dolstra, H.等人。脐带血CD34移植成功+老年急性髓系白血病患者的造血干细胞和祖细胞来源的NK细胞。中国。癌症Res。23, 4107-4118(2017)。
刘,E.等。经工程改造表达IL-15和cd19靶向CAR的脐带血NK细胞显示出长期持久性和强大的抗肿瘤活性。白血病32, 520-531(2018)。这篇文章报道了car修饰的NK免疫疗法在cd19阳性血液恶性肿瘤患者中的首次成功临床应用.
Berrien-Elliott, m.m.等人。对供体记忆样NK细胞的多维分析揭示了白血病过继免疫治疗后与反应的新关联。癌症。10, 1854-1871(2020)。
刘,E.等。car转导的自然杀伤细胞在cd19阳性淋巴肿瘤中的应用心血管病。j .地中海。382, 545-553(2020)。
锣,黄永发。,Maki, G. & Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells.白血病8, 652-658(1994)。
唐,等。CAR - NK-92细胞的首次人体临床试验:CD33-CAR - NK-92细胞在复发难治性急性髓系白血病患者中的安全性试验点。癌症保留区。8, 1083-1089(2018)。
张,C.等。嵌合抗原受体工程NK-92细胞:一种现成的细胞疗法,用于靶向消除癌细胞和诱导保护性抗肿瘤免疫。前面。Immunol。https://doi.org/10.3389/fimmu.2017.00533(2017)。
Hoogstad-van Evert, J. S.等人。脐带血CD34+在NOD/SCID/IL2Rg中,祖细胞来源的NK细胞有效地杀死卵巢癌球形瘤和腹腔肿瘤零老鼠。Oncoimmunology6, e1320630(2017)。
Knorr, d.a.等。从人类多能干细胞中提取自然杀伤细胞用于癌症治疗。干细胞转化。地中海。2, 274-283(2013)。
李杨,Hermanson, d.l., Moriarity, b.s. & Kaufman, d.s.人类ipsc来源的自然杀伤细胞与嵌合抗原受体工程增强抗肿瘤活性。细胞干细胞23, 181 - 192。e5(2018)。这篇文章展示了第一代成功的ipsc衍生CAR NK细胞.
戈登森,B. H.等人。脐带血和ipsc来源的自然杀伤细胞在细胞毒活性和KIR谱上表现出关键差异。前面。Immunol.11,https://doi.org/10.3389/fimmu.2020.561553(2020)。
朱,H.等。具有高亲和力不可切割CD16a的多能干细胞来源的NK细胞介导改善的抗肿瘤活性。血135, 399-410(2020)。
金,K.等。诱导多能干细胞的表观遗传记忆。自然467, 285-290(2010)。
Bar-Nur, O., Russ, H. A., Efrat, S. & Benvenisty, N.人胰岛β细胞诱导多能干细胞的表观遗传记忆和优先谱系特异性分化。细胞干细胞9, 17-23(2011)。
古德里奇,J. P.等。FT596:翻译第一个多抗原靶向现成的CAR-NK细胞,具有工程持久性,用于B细胞恶性肿瘤的治疗。血134, 301-301(2019)。
Bachanova, V.等人。FT596是一种首创的、多抗原靶向的、现成的ipsc衍生CD19 CAR - NK细胞治疗复发/难治性b细胞淋巴瘤的安全性和有效性。血138, 823(2021)。
古德里奇,J. P.等。摘要1550:FT576路径首次临床试验:翻译一种多功能多抗原特异性现成NK细胞治疗多发性骨髓瘤。癌症Res。81, 1550(2021)。
斯特拉蒂,P.等人。FT516是一种现成的自然杀伤(NK)细胞疗法,来源于表达高亲和力、不可切割CD16 (hnCD16)的克隆主诱导多能干细胞(iPSC)系,用于复发/难治性(R/R) b细胞淋巴瘤(BCL)患者(患者)的I期试验初步结果。j .中国。肿瘤防治杂志。39, 7541-7541(2021)。
Imai, C., Iwamoto, S. & Campana, D.原代自然杀伤细胞的基因修饰克服抑制信号并诱导白血病细胞特异性杀伤。血106, 376-383(2005)。本文描述了第一代成功的CAR NK细胞使用41bb共刺激cd19定向合成CAR.
Ruggeri, L.等人。供体自然杀伤细胞在不匹配造血移植中的作用。科学295, 2097-2100(2002)。这项开创性的工作表明,同种异体NK细胞具有强大的移植物抗白血病作用,并在T细胞耗尽的hla单倍同源异体移植(tcd - haploo - allohsct)的受者中预防GvHD。.
Ruggeri, L.等人。自然杀伤细胞在hla不匹配造血干细胞移植中的作用。血94, 333-339(1999)。
戴维斯,s.m.等。非亲缘供体不匹配造血移植中KIR配体不相容的评价。杀手免疫球蛋白样受体。血One hundred., 3825-3827(2002)。
Ruggeri, L.等人。急性髓系白血病单倍同源造血移植中缺失自我的供体自然杀伤细胞异体识别:挑战其预测价值。血110, 433-440(2007)。
ci尿素,s.o.等。使用供者来源的扩增nk细胞减少移植后复发。白血病36, 155-164(2022)。
徐,K. C.等。KIR和HLA基因型预测急性髓性白血病HLA同源同胞造血干细胞移植预后改善血105, 4878-4884(2005)。
Verheyden, S., Schots, R., Duquet, W. & Demanet, C.定义的供体激活自然杀伤细胞受体基因型可防止相关hla相同造血干细胞移植后白血病复发。白血病19, 1446-1451(2005)。
Venstrom, J. M.等人。hla - c依赖通过供体激活KIR2DS1预防白血病复发。心血管病。j .地中海。367, 805-816(2012)。
布德罗,j.e.等。KIR3DL1/HLA-B亚型控制造血细胞移植后急性髓性白血病复发。j .中国。肿瘤防治杂志。35, 2268(2017)。
Schetelig, J.等人。体外验证KIR2DS1/ kir3dl1造血细胞供体知情选择模型失败。血135, 1386-1395(2020)。
Beelen, D. W.等。基因型抑制性杀手免疫球蛋白样受体配体不相容增强了未修饰异基因造血干细胞移植在髓系白血病患者中的长期抗白血病作用。血105, 2594-2600(2005)。
Bishara, A.等人。HLA I类NK表位的抑制性KIR基因在单倍体不匹配的同种异体干细胞移植物中的有益作用可能被导致GVHD的供体异源反应性T细胞所掩盖。组织抗原63, 204-211(2004)。
Schaffer, M., Malmberg, K. J., Ringdén, O., Ljunggren, H. G. & Remberger, M.在ir配体不匹配的不相关异基因造血干细胞移植中增加感染相关死亡率。移植78, 1081-1085(2004)。
Mehta, R. S. & Rezvani, K.我们能否与KIR基因分型进行更好的匹配或不匹配?内科杂志。点。Soc。内科杂志。建造。程序。2016, 106-118(2016)。
施密特,A.等人。基于三聚体april的car结合域的合理设计能够有效靶向多发性骨髓瘤。血供订购。3., 3248-3260(2019)。
莱瓦斯,A.等人。nkg2d - car转导的自然杀伤细胞有效靶向多发性骨髓瘤。血癌;11, 146(2021)。
张,Y. H.等。具有NKG2D特异性的嵌合受体增强了自然杀伤细胞的激活和杀伤肿瘤细胞。癌症Res。73, 1777-1786(2013)。
Biederstädt, A. & Rezvani, K.设计下一代CAR-NK免疫疗法。Int。j .内科杂志。114, 554-571(2021)。
Daher, M. & Rezvani, K.以CAR- NK细胞为重点的新型CAR-based疗法的前景:在与癌症的竞赛中,CAR-工程T细胞之外还有什么。癌症迪斯科11, 45-58(2021)。
Lanier, L. L., Corliss, B. C., Wu, J., Leong, C. & Phillips, J. H.免疫受体DAP12具有酪氨酸为基础的激活基序,参与激活NK细胞。自然391, 703-707(1998)。这篇开创性的文章通过与杀伤细胞免疫球蛋白样受体(KIR)家族分子交联,阐明了DAP12作为激活NK细胞免疫受体的作用.
赵,R.等。dnax激活蛋白10共刺激增强了嵌合抗原受体T细胞的抗肿瘤功效。Oncoimmunology8, e1509173(2018)。
吴,Y. Y.等。表达带有DAP12信号域的NKG2D CAR的T细胞在有效消除肿瘤的同时刺激细胞因子的降低。摩尔。其他。29, 75-85(2021)。
Töpfer, K.等。基于dap12活化嵌合抗原受体的NK细胞肿瘤免疫治疗。j . Immunol。194, 3201(2015)。
Billadeau, D. D., Upshaw, J. L., Schoon, R. A., Dick, C. J. & Leibson, P. J. NKG2D-DAP10通过syk独立调控途径触发人类NK细胞介导的杀伤。Immunol Nat。4, 557-564(2003)。这篇文章揭示了激活NKG2D-DAP10免疫受体识别复合物的作用,它可以以不依赖syk的方式诱导NK细胞介导的杀伤.
Frigault, m.j.等人。鉴定嵌合抗原受体介导T细胞的组成或诱导增殖。癌症Immunol。Res。3., 356-367(2015)。
Long, A. H.等4-1BB共刺激改善了由嵌合抗原受体的紧张性信号诱导的T细胞衰竭。Nat,地中海。21, 581-590(2015)。这篇重要的文章阐述了抗原无关的紧张性CAR信号的原理,它可以诱导T细胞衰竭,损害抗肿瘤疗效.
渡边,N.等人。微调CAR间隔可以提高t细胞的效力。Oncoimmunology5, e1253656(2016)。
马蒙金等人。来自嵌合抗原受体(CARs)的紧张性4-1BB信号因fas介导的凋亡而损害T细胞的扩张。j . Immunol.196(增刊1),143.7(2016)。
Feucht, J.等。CAR激活电位的校准指导替代T细胞命运和治疗效力。Nat,地中海。25, 82-88(2019)。
布里奇曼,J. S.等。cd3 -基嵌合抗原受体介导T细胞活化独联体- - -反式信号机制:对过继细胞治疗的受体结构优化的影响。中国。Exp Immunol。175, 258-267(2014)。
布里奇曼,J. S.等。含有CD3ζ跨膜结构域的嵌合抗原受体的最佳抗原反应依赖于受体并入内源性TCR/CD3复合物。j . Immunol。184, 6938-6949(2010)。
穆勒,Y. D.等人。CD28跨膜结构域介导与CD28的嵌合抗原受体异二聚。前面。Immunol。12, 639818(2021)。
Savoldo, B.等人。CD28共刺激改善淋巴瘤患者嵌合抗原受体修饰T细胞的扩增和持久性。j .中国。投资。121, 1822-1826(2011)。
Cronk, R. J., Zurko, J. & Shah, N. N.双特异性嵌合抗原受体T细胞治疗B细胞恶性肿瘤和多发性骨髓瘤。癌症12, 2523(2020)。
Zah, E.等人。系统优化的BCMA/CS1双特异性CAR-T细胞可有效控制异质性多发性骨髓瘤。Commun Nat。11, 2283(2020)。
Shah, n.n.等。双特异性抗cd20、抗cd19 CAR - T细胞治疗复发性B细胞恶性肿瘤:1期剂量增加和扩大试验Nat,地中海。261569-1575(2020)。
Wallstabe, L.等人。在晚期微生理学3D肿瘤模型中,ROR1-CAR - T细胞对肺癌和乳腺癌有效。江森自控的洞察力https://doi.org/10.1172/jci.insight.126345(2019)。
Srivastava, S.等人。逻辑门控ROR1嵌合抗原受体表达挽救T细胞介导的对正常组织的毒性,并实现选择性肿瘤靶向。癌症细胞35, 489 - 503。e8(2019)。
赵,J. H.等。在人类CAR免疫细胞中设计先进的逻辑和分布式计算。Commun Nat。12, 792(2021)。
加里森,B. S.等。FLT3 OR CD33 NOT EMCN逻辑门控CAR-NK细胞治疗(sent -202)用于精确靶向AML。血138(增刊。1), 2799(2021)。
冈萨雷斯等人。LB028:开发逻辑门控CAR-NK细胞以降低靶向介导的健康组织毒性癌症Res。81, lb028(2021)。
Mensali, N.等人。NK细胞经tcr修饰后可以杀死癌细胞。EBioMedicine40, 106-117(2019)。
Shao, H.等。利用荧光共振能量转移技术检测转基因T细胞中的TCR错配。摩尔。杂志。代表。37, 3951-3956(2010)。
威尔尼克,A.等人。通过CD16×33双特异性杀伤细胞接合器和ADAM17抑制,体外靶向自然杀伤细胞治疗急性髓系白血病。中国。癌症Res。19, 3844-3855(2013)。
Vallera, d.a.等人。异二聚体双特异性单链可变片段抗体抗EpCAM和CD16诱导有效的抗体依赖性细胞对人癌细胞的细胞毒性。癌症Biother。Radiopharm。28, 274-282(2013)。
格里森,m.k.等人。CD16xCD33双特异性杀伤细胞接合器(BiKE)激活NK细胞对抗原发性MDS和MDSC CD33+目标。血123, 3016-3026(2014)。
Schmohl, J., Gleason, M., Dougherty, P., Miller, J. S. & Vallera, D. A.异二聚体双特异性单链可变片段(scFv)杀伤接合物(BiKEs)增强nk细胞对CD133的活性+结直肠癌细胞。目标。肿瘤防治杂志。11, 353-361(2016)。
Kerbauy, L. N.等。将AFM13(一种双特异性CD30/CD16抗体)与细胞因子激活的血液和脐带血来源的NK细胞结合,可促进CAR-like反应对抗CD30+恶性肿瘤。中国。癌症Res。27, 3744-3756(2021)。
Reusch, U.等人。一种新的四价双特异性TandAb (CD30/CD16A)有效地招募NK细胞裂解CD30+肿瘤细胞。马伯6, 727-738(2014)。
施莫尔,J. U.等人。四特异性单链抗体通过插入IL-15作为交联剂提供NK细胞介导的ADCC和自我维持刺激。Oncotarget7, 73830-73844(2016)。
Vallera, d.a.等人。IL15三特异性杀伤接合物(TriKE)使自然杀伤细胞对CD33特异+目标同时也诱导持久性,体内扩张,增强功能。中国。癌症Res。22, 3440-3450(2016)。
施莫尔,J. U.等人。抗cd133三特异性分子诱导NK扩增和驱动抗体依赖细胞介导的细胞毒性的工程。治疗癌症。49, 1140(2017)。
Arvindam,美国等。一种针对CLEC12A的三特异性杀伤分子有效诱导nk细胞介导的AML细胞杀伤。白血病35, 1586-1596(2021)。
Gauthier, L.等人。靶向NKp46的多功能自然杀伤细胞接合物触发保护性肿瘤免疫。细胞177, 1701 - 1713。e16天(2019)。该报告概述了一种新型的三特异性NK细胞接合分子,该分子将两个NK细胞激活受体CD16和NKp46与特定的肿瘤抗原交联.
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04074746(2020)。
Bryceson, Y. T., March, M. E., Ljunggren, H. G. & Long, E. O.静息NK细胞受体之间的协同作用对自然细胞毒性和细胞因子分泌的激活。血107, 159-166(2006)。
罗萨里奥,等人。基于il -15的ALT-803复合物增强了fc γ riiia触发的NK细胞反应和B细胞淋巴瘤的体内清除。中国。癌症Res。22, 596-608(2016)。
德拉姆,C.等人。促炎细胞因子IL-2, IL-15和IL-21调节成熟的人类自然杀伤细胞受体。关节炎。9, r125(2007)。
Gang, M.等。car修饰的记忆样NK细胞对NK耐药淋巴瘤表现出强烈的反应。血136, 2308-2318(2020)。
董,H.等。针对细胞内NPM1c衍生的新表位的工程记忆类NK car对急性髓系白血病表现出强大的活性和特异性。血136, 3-4(2020)。
Lasek, W., zagoddon, R. & Jakobisiak, M.白介素12:仍然是肿瘤免疫治疗的有前途的候选人?癌症Immunol。Immunother。63, 419-435(2014)。
McMichael, E. L.等。IL-21增强自然杀伤细胞对西妥昔单抗包被的胰腺肿瘤细胞的反应。中国。癌症Res。23, 489-502(2017)。
治疗应用:临床中的自然杀伤细胞。血液学2013, 247-253(2013)。
安东,o.m.等。反式完整的IL-15Rα-IL-15复合物从提呈细胞到NK细胞的内吞作用有利于增殖信号传导。国家科学院学报美国117, 522-531(2020)。
细胞因子诱导的记忆样自然杀伤细胞用于癌症免疫治疗。干细胞Res. Ther。12, 592(2021)。
Felices, M.等人。持续使用IL-15治疗会通过代谢缺陷耗尽人类NK细胞。江森自控的洞察力https://doi.org/10.1172/jci.insight.96219(2018)。
Sarhan, D.等。适应性NK细胞抵抗IL37驱动的调节性t细胞抑制。癌症Immunol。Res。6, 766-775(2018)。
Nuñez, s.y.等。人M2巨噬细胞通过分泌TGF-β和参与CD85j限制NK细胞效应功能。j . Immunol。200, 1008-1015(2018)。
Tumino, N.等人。实体性和血液系统恶性肿瘤中MDSC和NK细胞的相互作用:对造血干细胞移植的影响。前面。Immunol。https://doi.org/10.3389/fimmu.2021.638841(2021)。
Zalfa, C. & Paust, S.肿瘤微环境中自然杀伤细胞与髓源性抑制细胞的相互作用及其对癌症免疫治疗的影响。前面。Immunol。https://doi.org/10.3389/fimmu.2021.633205(2021)。
倪,J.等。肿瘤浸润NK细胞的单细胞RNA测序显示,抑制转录因子HIF-1α可释放NK细胞活性。免疫力52, 1075 - 1087。e8(2020)。
Van Wilpe, S.等人。乳酸脱氢酶:抗肿瘤免疫功能减弱的标志。Oncoimmunology9, 1731942(2020)。
Cascone, T.等。肿瘤糖酵解增加是免疫系统抵抗过继T细胞治疗的特征。细胞金属底座。27, 977 - 987。e4(2018)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT01791595(2013)。
Jin, D.等。肿瘤细胞上CD73损害抗肿瘤t细胞反应:肿瘤诱导免疫抑制的一种新机制癌症Res。70, 2245-2255(2010)。
斯塔格,J.等。抗cd73抗体治疗抑制乳腺肿瘤的生长和转移。国家科学院学报美国1071547-1552(2010)。
Allard, B., Longhi, M. S., Robson, S. C. & Stagg, J.外核苷酶CD39和CD73:新的检查点抑制剂靶点。Immunol。牧师。276, 121-144(2017)。
佩罗特等人。靶向CD39/CD73免疫抑制途径的阻断抗体在联合癌症治疗中释放免疫反应。细胞的代表。27, 2411 - 2425。e9(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04148937(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03454451(2018)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03616886(2018)。
杨,A.等人。CD73和A2AR腺苷信号通路的共同抑制提高了抗肿瘤免疫应答。癌症细胞30., 391-403(2016)。
杨,A.等人。A2AR腺苷信号通路抑制肿瘤微环境中自然杀伤细胞的成熟。癌症Res。78, 1003(2018)。
Lupo, K. & Matosevic, S. 123利用靶向TIGIT和CD73的诱导性、响应性遗传结构改造的自然杀伤细胞,以缓解GBM微环境中的免疫抑制。j . Immunother。癌症8, a74-a75(2020)。
Giuffrida, L.等。CRISPR/Cas9介导的腺苷A2A受体缺失增强了CAR - T细胞的功效。Commun Nat。12, 3236(2021)。
金,T.-D。et al。人microRNA-27a*靶向Prf1和GzmB表达调节nk细胞的细胞毒性。鲜血,j。Am。Soc。内科杂志。118, 5476-5486(2011)。
Yvon, E. S.等人。表达显性阴性TGF-β受体的脐带血自然杀伤细胞:对胶质母细胞瘤过继免疫治疗的意义。Cytotherapy19, 408-418(2017)。
Daher, M.等。TGF-β/SMAD信号通路作为骨髓增生异常综合征中NK细胞功能障碍和免疫逃避的中介血130, 53-53(2017)。
Shaim, H.等人。靶向αv整合素/TGF-β轴提高了对抗胶质母细胞瘤干细胞的自然杀伤细胞功能。j .中国。Investig。https://doi.org/10.1172/JCI142116(2021)。
Stojanovic, A, Fiegler, N, Brunner-Weinzierl, M. & Cerwenka, A. CTLA-4由活化的小鼠NK细胞表达,并抑制NK细胞IFN-γ的产生以响应成熟的树突细胞。j . Immunol。192, 4184-4191(2014)。
Russick, J.等人。人肺肿瘤微环境中的自然杀伤细胞具有免疫抑制功能。j . Immunother。癌症8, e001054(2020)。
Sanseviero, E.等人。抗ctla -4激活瘤内NK细胞,并与il - 15/IL15Rα复合物联合增强肿瘤控制。癌症Immunol。Res。7, 1371-1380(2019)。
法官,S. J.等。在不同条件下,小鼠和人NK细胞中PD-1表达极低。j .中国。Investig。130, 3051-3068(2020)。
Judge, S. J., Murphy, W. J. & Canter, R. J.描述功能失调的NK细胞:评估衰竭、无能和衰老的临床相关性。前面。细胞的感染。Microbiol。10, 49-49(2020)。
戴维斯,Z.等。低密度PD-1表达在静息的人自然杀伤细胞移植后具有功能性并上调。血供订购。5, 1069-1080(2021)。
徐,J.等。NK细胞在PD-1/PD-L1阻断介导的免疫治疗中的作用j .中国。Investig。128, 4654-4668(2018)。
董,W.等。抗PD-L1抗体对抗PD-L1阴性肿瘤的作用机制确定了表达PD-L1的NK细胞作为细胞溶解效应物。癌症。9, 1422-1437(2019)。
Newman, J. & Horowitz, A. NK细胞从白血病细胞中夺取PD1。Nat. Rev. Immunol。21, 345-345(2021)。
威尔克,A. J.等。重症COVID-19患者外周血免疫反应的单细胞图谱Nat,地中海。26, 1070-1076(2020)。
da Silva, i.p.等。Tim-3阻断逆转晚期黑色素瘤nk细胞衰竭癌症Immunol。Res。2, 410-422(2014)。
法卡斯等人。Tim-3和TIGIT是人膀胱癌中易受效应器功能障碍影响的自然杀伤细胞。j . Immunol。200, 124.114(2018)。
Chauvin,人类。et al。TIGIT阻断il - 15刺激逆转cd155介导的黑色素瘤nk细胞功能障碍中国。癌症Res。26, 5520-5533(2020)。
Sarhan, D.等。TIGIT低表达的适应性NK细胞天生对骨髓来源的抑制细胞具有抗性。癌症Res。76, 5696-5706(2016)。
张q等。阻断检查点受体TIGIT可以防止NK细胞衰竭,并引发有效的抗肿瘤免疫。Immunol Nat。19, 723-732(2018)。
阿里,A.等。LAG-3调节自然杀伤细胞免疫调节功能。j . Immunol。202, 76.77(2019)。
科尔特,H. E.等人。抗kir抗体增强自然杀伤细胞的抗淋巴瘤活性作为单一疗法和联合抗cd20抗体。血123, 678-686(2014)。
Vey, N.等人。Lirilumab(抗kir单克隆抗体,mAb)在老年急性髓系白血病(AML)患者中维持治疗的随机2期试验:Effikir试验结果血130, 889-889(2017)。
Vey, N.等人。Lirilumab(抗杀手免疫球蛋白样受体抗体KIR2D;实体瘤和恶性血液病患者的IPH2102)。Oncotarget9, 17675-17688(2018)。
金,S.等。宿主主要组织相容性复合体I类分子对自然杀伤细胞的授权。自然436, 709-713(2005)。这项开创性的工作提出了NK细胞“许可”的概念,通过抑制受体和自我mhc分子的相互作用,NK细胞获得了功能能力和自我耐受性.
金,S.等。HLA等位基因决定人类自然杀伤细胞反应性和效力的差异。国家科学院学报美国105, 3053-3058(2008)。
André, P.等。抗- nkg2a单抗是一种检查点抑制剂,通过释放T细胞和NK细胞来促进抗肿瘤免疫。细胞175, 1731 - 1743。e13(2018)。
Kamiya, T., Seow, s.v ., Wong, D., Robinson, M. & Campana, D.阻断抑制性受体NKG2A的表达克服肿瘤对NK细胞的抵抗。j .中国。Investig。129, 2094-2106(2019)。
Delconte, R. B.等。CIS是NK细胞介导的肿瘤免疫的有效检查点。Immunol Nat。17, 816-824(2016)。这篇重要的文章确定了细胞内NK细胞检查点CIS,它负调控IL-15信号.
Delconte, R. B.等。由内源性稳态信号引起的NK细胞启动被CIS调节。前面。Immunol。https://doi.org/10.3389/fimmu.2020.00075(2020)。
Daher, M.等。靶向细胞因子检查点增强装甲脐带血CAR-NK细胞的适应性。血137, 624-636(2021)。
朱,H.等。在人ipsc来源的NK细胞中,通过删除CISH的代谢重编程促进体内持久性和增强抗肿瘤活性。细胞干细胞27, 224 - 237。e6(2020)。
Coca, S.等。结直肠癌患者肿瘤内自然杀伤细胞的预后意义。癌症79, 2320-2328(1997)。
Ishigami, S.等。胃癌瘤内自然杀伤细胞的预后价值。癌症88, 577-583(2000)。
维勒加斯,F. R.等。鳞状细胞肺癌患者肿瘤浸润自然杀伤细胞亚群CD57的预后意义肺癌35, 23-28(2002)。
Donskov, F. & von der Maase, H.免疫参数对转移性肾细胞癌长期生存的影响。j .中国。肿瘤防治杂志。24, 1997-2005(2006)。
Geissler, K.等。肾癌肿瘤浸润免疫细胞的免疫标记。Oncoimmunology4, e985082(2015)。
Wendel, M., Galani, i.e., Suri-Payer, E. & Cerwenka, A.肿瘤中自然杀伤细胞的积累依赖于IFN-γ和CXCR3配体。癌症Res。68, 8437-8445(2008)。
Mlecnik, B.等人。生物分子网络重建确定与结直肠癌生存相关的t细胞归巢因子。胃肠病学138, 1429-1440(2010)。
Park, M. H, Lee, J. S. & Yoon, J. H.肿瘤细胞CX3CL1的高表达与良好的预后和肿瘤浸润CD8的增加相关+T细胞,自然杀伤细胞,以及乳腺癌中的树突状细胞。J.外科医生。106, 386-392(2012)。
Castriconi, R.等人。指导人类组织中自然杀伤细胞迁移和保留的分子机制。前面。Immunol。9, 2324(2018)。
Levy, E. R., Clara, J. A., Reger, R. N., Allan, D. S. J. & Childs, R. W. RNA-seq分析揭示了CCR5是CRISPR基因编辑调节体内NK细胞转运的关键靶点。癌症https://doi.org/10.3390/cancers13040872(2021)。
Wennerberg, E., Kremer, V., Childs, R. & Lundqvist, A. cxcl10诱导过继转移的人类自然杀伤细胞向实体肿瘤迁移导致体内肿瘤生长退化。癌症Immunol。Immunother。64, 225-235(2015)。
Somanchi, s.s., Somanchi, A. Cooper, L. J. N. & Lee, D. A.通过趋化因子受体CCR7的trogocytosis体外扩增的人类自然杀伤细胞的工程淋巴结归巢。血119, 5164-5172(2012)。
卡尔斯滕等人。具有高亲和力CD16和CCR7的高效基于mrna的人类NK细胞基因工程增强了利妥昔单抗诱导的ADCC对抗淋巴瘤,并靶向NK细胞向淋巴结相关趋化因子CCL19的迁移。前面。immunol。7, 105(2016)。
Müller, N.等。用egfrviii特异性嵌合抗原受体修饰的NK细胞过表达CXCR4,改善CXCL12/ sdf -1α分泌胶质母细胞瘤的免疫治疗。j . Immunother。38, 197(2015)。
克莱默,V.等人。人类NK细胞表达CXCR2的基因工程改善了向肾细胞癌的迁移。j . ImmunoTher。癌症5, 73(2017)。
庞泽塔等人。多发性骨髓瘤通过改变趋化因子微环境损害效应自然杀伤细胞的骨髓定位。癌症Res。75, 4766-4777(2015)。
Bonanni, V., Antonangeli, F., Santoni, A. & Bernardini, G.靶向CXCR3提高过继转移活化自然杀伤细胞的抗骨髓瘤疗效。j . ImmunoTher。癌症7, 290(2019)。
李,J.等。一种旨在改善过继nk细胞治疗的抗体在小鼠模型中抑制胰腺癌进展。癌症Immunol。Res。7, 219(2019)。
吴燕燕,郑志刚,王世峰,王晓明。CXCR1表达对提高CAR-NK细胞在腹膜异种移植小鼠中的抗癌效果的影响。摩尔。其他。溶瘤16, 75-85(2020)。
Walle, T.等。放疗通过CXCL8调节自然杀伤细胞依赖的抗肿瘤免疫反应。科学。睡觉。8, eabh4050(2022)。
Larson, R. C. & Maus, M. V. CAR - T细胞机制和功能的最新进展和发现。Nat. Rev. Cancer21, 145-161(2021)。
斯特纳,R. C. & R. M. CAR-T细胞疗法:目前的局限性和潜在的策略。血癌;11, 69(2021)。
Gill, S. & Brudno, J. N. CAR - t细胞治疗血液系统恶性肿瘤:临床作用,毒性和未解问题。点。Soc。中国。肿瘤防治杂志。建造。书https://doi.org/10.1200/EDBK_320085(2021)。
Shah, N. N. & Fry, T. J. CAR - T细胞治疗的耐药性机制。Nat. Rev. clinin。肿瘤防治杂志。16, 372-385(2019)。
CAR-T失败:除了抗原丢失和T细胞。血137, 2567-2568(2021)。
Biederstädt, A. & Rezvani, K.如何使用先发制人的过继细胞免疫疗法治疗高风险急性髓系白血病。血https://doi.org/10.1182/blood.2021012411(2022)。
Abdel-Hakeem, m.s.等人。在消除慢性抗原刺激后,耗尽的T细胞的表观遗传瘢痕会阻碍记忆分化。Immunol Nat。22, 1008-1019(2021)。本文阐明了由于持续的表观遗传瘢痕,耗尽的T细胞亚群如何在消除抗原刺激后无法恢复其全部功能能力.
耶茨,K. B.等。CD8的表观遗传瘢痕+人类慢性感染治愈后,T细胞仍持续衰竭。Immunol Nat。22, 1020-1029(2021)。本报告证明了在慢性抗原刺激解决后,耗尽的T细胞表观遗传特征的固定性质.
Biederstädt, A.等。SUMO通路抑制靶向一种侵袭性胰腺癌亚型。肠道69, 1472-1482(2020)。
库马尔,S.等人。通过TAK-981靶向胰腺癌:一种在临床前模型中激活免疫系统并阻止癌细胞周期进展的sumo化抑制剂。肠道https://doi.org/10.1136/gutjnl-2021-324834(2022)。
Demel, u.m.等人。活化的SUMOylation限制MHC I类抗原的呈递,使癌症中的免疫逃避。j .中国。Investig。https://doi.org/10.1172/JCI152383(2022)。
Saha, K.等。国立卫生研究院体细胞基因组编辑计划。自然592, 195-204(2021)。本报告列出了NIH SCGE联盟的目标和范围.
蔡世强等。GUIDE-seq能够通过CRISPR-Cas核酸酶对脱靶切割进行全基因组分析。生物科技Nat。》。33, 187-197(2015)。
蔡世强等。CIRCLE-seq:一种高灵敏度的体外筛选全基因组CRISPR-Cas9核酸酶脱靶的方法。Nat方法。14, 607-614(2017)。
Dobosy, J. R.等。RNase h依赖PCR (rhPCR):改进特异性和单核苷酸多态性检测使用阻断的可切割引物。生物科技BMC》。11, 80(2011)。
Hu, J.等。通过线性扩增介导的高通量全基因组易位测序检测哺乳动物基因组DNA双链断裂。Protoc Nat。11, 853-871(2016)。
吉尔莫,J. D.等人。CRISPR-Cas9体内基因编辑治疗转甲状腺素淀粉样变。心血管病。j .地中海。385, 493-502(2021)。这项开创性的工作证明了体内CRISPR-Cas9基因编辑的首次成功临床应用.
Aghajanian, H.等。用工程T细胞靶向心脏纤维化。自然573, 430-433(2019)。
留里克,J. G.等。CAR - T细胞在体内产生治疗心脏损伤。科学375, 91-96(2022)。这项研究首次成功地使用含有CAR-编码mRNA的cd5定向脂质纳米颗粒在体内工程CAR- T细胞.
Bender, R. R., Muth, A., Schneider, I. C., Maisner, A. & Buchholz, C. J.开发一种工程尼帕病毒糖蛋白为基础的慢病毒载体系统,重定向到细胞表面受体选择。摩尔。其他。23, s2(2015)。
米克尔斯韦特,K. P.等。输注piggybac修饰CD19嵌合抗原受体T细胞后产物性淋巴瘤的研究血138, 1391-1405(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT02742727(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT00995137(2009)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT01974479(2013)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT02892695(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03056339(2017)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03824951(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03690310(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05020678(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04245722(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04639739(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04887012(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04796675(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04796688(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05379647(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05336409(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04023071(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03692767(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03824964(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT02944162(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05008575(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05215015(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05092451(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03559764(2018)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03940833(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05008536(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05182073(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04614636(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04623944(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03415100(2018)。
肖,L.等。NKG2D CAR mrna工程自然杀伤细胞在结直肠癌患者中的过继转移。摩尔。其他。27, 1114-1125(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05213195(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05247957(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT02839954(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03383978(2017)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03692663(2018)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03692637(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04630769(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03940820(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03931720(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT03941457(2019)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04551885(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04847466(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT05194709(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://ClinicalTrials.gov/show/NCT04324996(2020)。
Wu, L.等人,来那度胺增强利妥昔单抗治疗的CD20的自然杀伤细胞和单核细胞介导的抗体依赖性细胞毒性+肿瘤细胞。中国。癌症Res。14, 4650-4657(2008)。
Tai, Y. T.等。免疫调节药物来那度胺(CC-5013, IMiD3)增强抗cd40 sgn -40诱导的多发性骨髓瘤细胞毒性:临床意义癌症Res。65, 11712-11720(2005)。
纳哈斯,m.r.等。低甲基化剂改变急性髓系白血病(AML)的免疫微环境,增强树突状细胞/AML疫苗的免疫原性。Br。j . Haematol。185, 679-690(2019)。
希克斯,K. C.等。肿瘤细胞和NK细胞的表观遗传启动增强了抗pd - l1抗体avelumab对多种癌细胞类型诱导的抗体依赖性细胞毒性。OncoImmunology7, e1466018(2018)。
梁怡良等。NK细胞增强卵巢癌溶瘤腺病毒的细胞毒性。摩尔。其他。溶瘤16, 289-301(2020)。
Marotel, M., Hasim, m.s, Hagerman, A. & Ardolino, M. NK细胞在溶瘤病毒治疗中的两面。细胞因子生长因子。牧师。56, 59-68(2020)。
Cichocki, F.等人。GSK3抑制促进NK细胞成熟,增强其抗肿瘤活性。癌症Res。77, 5664-5675(2017)。
Parameswaran, R.等。抑制GSK3可恢复AML患者的NK细胞毒性。Commun Nat。7, 11154(2016)。
van Hall, T.等人。Monalizumab:抑制新型免疫检查点NKG2A。j . Immunother。癌症7263(2019)。
Yalniz, f.f.等人。Lirilumab联合或不联合阿扎胞苷治疗骨髓增生异常综合征患者的初步试验。中国。淋巴瘤骨髓瘤。18, 658 - 663。e2(2018)。
Bachier, C.等。NKX101是一种异基因CAR自然杀伤(NK)细胞疗法,用于复发/难治性(R/R)急性髓系白血病(AML)或高风险骨髓增生异常综合征(MDS)患者的一期研究。血136, 42-43(2020)。
Pinz, K. G.等。使用抗cd4 CAR NK-92细胞靶向t细胞恶性肿瘤。Oncotarget8, 112783-112796(2017)。
罗曼斯基,A.等。CD19-CAR工程NK-92细胞足以克服b细胞恶性肿瘤中的NK细胞耐药。细胞生物学。20., 1287-1294(2016)。
你,f等人。CD7嵌合抗原受体修饰的NK-92MI细胞系靶向t细胞急性淋巴母细胞白血病。点。癌症保留区。9, 64-78(2019)。
徐颖,等。2B4共刺激结构域增强抗cd5嵌合抗原受体工程自然杀伤细胞对T细胞恶性肿瘤的细胞毒能力。j .内科杂志。肿瘤防治杂志。12, 49(2019)。
Martín, e.m.等。探讨NKG2D和BCMA-CAR NK-92在多发性骨髓瘤过继细胞治疗中的应用。中国。淋巴瘤,骨髓瘤。19, e24-e25(2019)。
蒋,H.等。嵌合抗cd138基因转染增强自然杀伤细胞的活化和杀伤多发性骨髓瘤细胞。摩尔。杂志。8, 297-310(2014)。
韩,J.等。靶向野生型EGFR和EGFRvIII的car工程NK细胞增强了对胶质母细胞瘤和患者来源的胶质母细胞瘤干细胞的杀伤。科学。代表。5, 11483(2015)。
Chu, J.等。cs1特异性嵌合抗原受体(CAR)工程自然杀伤细胞增强体外和体内抗人类多发性骨髓瘤的抗肿瘤活性。白血病28, 917-927(2014)。
陈凯辉等。利用抗cd5嵌合抗原受体临床前靶向侵袭性t细胞恶性肿瘤。白血病31, 2151-2160(2017)。
陈凯辉等。新型抗cd3嵌合抗原受体靶向侵袭性T细胞恶性肿瘤。Oncotarget7, 56219-56232(2016)。
Vallera, d.a.等人。在体内和体外,使用B7-H3三特异性杀伤因子,nk细胞介导的靶向各种实体肿瘤。癌症https://doi.org/10.3390/cancers12092659(2020)。
库珀,L. J.等。t细胞克隆对CD19具有特异性:对移植物抗b系白血病效应的选择性增强。血101, 1637-1644(2003)。
Imai, C.等。具有4-1BB信号传导能力的嵌合受体对急性淋巴细胞白血病具有强烈的细胞毒性。白血病18, 676-684(2004)。
Maher, J., Brentjens, R. J., Gunset, G., Rivière, I. & Sadelain, M.单嵌合TCRζ/CD28受体诱导的人t淋巴细胞毒性和增殖。生物科技Nat。》。20., 70-75(2002)。
舒伯特,>。et al。靶向CD19的第三代CAR - T细胞具有良好的安全性,并可能提高CAR - T细胞在治疗患者中的持久性。血134, 51-51(2019)。
比约达尔等人。摘要1539年:开发了现成的B7H3嵌合抗原受体NK细胞疗法,广泛适用于许多实体肿瘤。癌症Res。81, 1539(2021)。
Basar, R.等人。用于过继细胞治疗的抗糖皮质激素SARS-CoV-2 T细胞的生成。细胞的代表。https://doi.org/10.1016/j.celrep.2021.109432(2021)。
Shalem, O.等人。人类细胞中CRISPR-Cas9基因敲除筛选。科学343, 84-87(2014)。
王涛,魏俊杰,Sabatini, D. M. & Lander, E. S.利用CRISPR-Cas9系统进行人类细胞遗传筛选。科学343, 80-84(2014)。
Manguso, R. T.等。体内CRISPR筛选确定Ptpn2为癌症免疫治疗靶点。自然547, 413-418(2017)。
帕特尔,S. J.等。肿瘤免疫治疗必需基因的鉴定。自然548, 537-542(2017)。
潘,D.等。一种主要的染色质调节器决定了肿瘤细胞对T细胞介导的杀伤的抗性。科学359, 770-775(2018)。
尚,W.等。全基因组CRISPR筛选确定FAM49B是肌动蛋白动力学和T细胞激活的关键调节因子。国家科学院学报115, e4051(2018)。
伊什祖卡,J. J.等。肿瘤中ADAR1的缺失克服了对免疫检查点封锁的抵抗。自然565, 43-48(2019)。
劳森,k.a.等人。癌症的功能基因组图谱——T细胞固有的杀伤逃避。自然586, 120-126(2020)。
谢弗,等人。基因组级筛选确定调节肿瘤细胞对自然杀伤细胞反应的因素。Nat,麝猫。53, 1196-1206(2021)。本报告使用了一种结合全基因组CRISPR筛选和多种癌细胞系筛选的正交方法来破译癌症类型特异性对NK细胞的脆弱性.
Ting, P. Y.等。Guide Swap在人类原代细胞中实现基因组规模的聚合CRISPR-Cas9筛选。Nat方法。15, 941-946(2018)。
Shifrut, E.等。原代人类T细胞的全基因组CRISPR筛选揭示了免疫功能的关键调节因子。细胞175, 1958 - 1971。e15(2018)。
王,D.等。CAR - T细胞和癌症干细胞的CRISPR筛选揭示了细胞疗法的关键依赖关系。癌症。11, 1192-1211(2021)。
罗斯,t.l.等人。细胞免疫疗法基因组工程中的集合敲入靶向。细胞181, 728 - 744。e21(2020)。
莱古特等人。T细胞增殖合成驱动因子的基因组尺度筛选。自然603, 728-735(2022)。
确认
作者感谢莫耶斯在本手稿准备期间提供编辑支持。A.B.获德国研究基金会资助,担任Walter Benjamin博士后研究员(464778766)。这项工作在一定程度上得到了德克萨斯大学MD安德森癌症中心登月计划、莎莉·库珀·默里捐赠基金、安和克拉伦斯·卡扎洛夫妇的慷慨支持以及莉达·希尔慈善基金会的慷慨捐助;通过CPRIT (RP160693)的资助,对抗癌症梦之队研究基金(资助号:su2a - aacr - dt -29-19),美国国立卫生研究院(NIH)的资助(1 R01 CA211044-01, 5 P01CA148600-03和P50CA100632-16),脑癌卓越研究专业计划(SPORE)资助(P50CA127001)和NIH MD安德森癌症中心的资助(CA016672)。SU2C研究经费由美国癌症研究协会管理,该协会是SU2C的科学合作伙伴。
作者信息
作者及隶属关系
贡献
作者对文章的各个方面都作了同样的贡献。
相应的作者
道德声明
相互竞争的利益
K.R.和德克萨斯大学MD Anderson癌症中心与武田制药和affemed GmbH存在机构财务利益冲突。K.R.参与了gemab, AvengeBio, virrogin Biotech, GSK, Bayer, Navan Technologies和Caribou Biosciences的科学顾问委员会。其余作者声明没有竞争利益。
同行评审
同行评审信息
自然评论癌症感谢E. Vivier和P. Andre、A. Cerwenka和S. Gill对这项工作的同行评议所作的贡献。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
术语表
- 自体嵌合抗原受体(CAR) T细胞疗法
-
一种患者特异性细胞疗法,患者自身的T细胞经过基因改造以表达嵌合抗原受体。
- Lymphopenic
-
血液中淋巴细胞数量低于正常水平
- 同种异体的设置
-
过继细胞疗法是由从同一物种的不同个体获得的物质产生的治疗环境。
- 移植物抗宿主病
-
(GvHD)。一种潜在的致命疾病,由免疫抑制的受体的异基因T细胞对宿主组织的反应引起,可在过继细胞治疗或异基因造血干细胞移植后发生。
- 杀手细胞免疫球蛋白样受体
-
(吉珥)。一个多态激活和抑制性跨膜蛋白家族,通过与主要组织相容性复合物I类分子的相互作用调节自然杀伤细胞的发育和功能。
- 诱导多能干细胞
-
(万能)。由成体体细胞重编程形成胚胎样多能干细胞状态的细胞,能够自我更新并分化成起源于三个胚层(内胚层、中胚层和外胚层)的组织。
- Apheresis
-
这一过程允许从血液中收集特定成分,如白细胞,通过分离细胞和可溶性部分,保留感兴趣的部分,并将剩余部分返回循环。
- 嵌合抗原受体
-
(汽车)。基因工程的细胞表面受体被设计用来识别肿瘤细胞上的特定蛋白质。
- 主音的信号
-
由嵌合抗原受体以不依赖配体的方式介导的本构信号。
- 逻辑的
-
源自电子学的术语,指的是布尔策略的实现,即对一个或多个输入信号执行逻辑函数以生成单个输出信号。
- 许可
-
在成熟的自然杀伤(NK)细胞中受抑制受体和自我主要组织相容性复合物I类分子相互作用驱动的教育过程,增强NK细胞对激活信号的反应。
权利和权限
关于本文
引用本文
Laskowski, T.J, Biederstädt, A. & Rezvani, K.抗肿瘤过继细胞免疫治疗中的自然杀伤细胞。Nat Rev癌症22, 557-575(2022)。https://doi.org/10.1038/s41568-022-00491-0
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41568-022-00491-0
这篇文章被引用
l -犬尿氨酸通过促进铁下垂诱导胃癌微环境中NK细胞的丢失
实验与临床癌症研究杂志(2023)
多价适配器蛋白专门针对携带通用嵌合抗原受体到ErbB2 (HER2)表达癌症的NK细胞
癌症免疫学,免疫治疗(2023)
嵌合抗原受体(CARs)-自然杀伤(NK)细胞作为黑素瘤治疗的新方法的抗癌特性
BMC癌症(2022)
NK细胞和实体瘤:治疗潜力和持续障碍
分子癌症(2022)
自然杀伤细胞在临床开发中作为非工程化、工程化和联合疗法
血液学与肿瘤学杂志(2022)