摘要
很少有代谢物能比乙酰辅酶a(乙酰辅酶a)在细胞代谢中发挥更核心和更多功能的作用。乙酰辅酶a在营养分解代谢过程中产生,为三羧酸循环提供燃料,是脂肪酸和类异戊二烯生物合成的基本组成部分。它还作为赖氨酸乙酰化反应的底物作为信号代谢物,使蛋白质功能的调节能够响应乙酰辅酶a的可用性。近年来,在新的小鼠模型、体内稳定同位素示踪方法和改进的乙酰辅酶a测量方法(包括特定亚细胞区室)的支持下,我们对正常生理学和癌症中乙酰辅酶a代谢的理解取得了令人兴奋的进展。针对乙酰辅酶a代谢酶的努力也在取得进展,一种针对乙酰辅酶a合成的治疗剂获得了美国食品和药物管理局的批准。在这篇综述中,我们概述了乙酰辅酶a参与的主要代谢途径的调控和癌症相关性。我们进一步讨论了在正常组织和肿瘤中乙酰辅酶a代谢的最新进展,以及在治疗上靶向这些途径的潜力。最后,我们对可能影响癌症生物学的乙酰辅酶a代谢的新兴节点进行了评论。
这是订阅内容的预览,通过你所在的机构访问
访问选项
访问《自然》和其他54种《自然》杂志
获取Nature+,我们最超值的在线订阅
每月29.99美元
随时取消
订阅这本杂志
收到12个印刷问题和在线访问
每年189.00美元
每期只要15.75美元
租或购买这篇文章
只要这篇文章,只要你需要它
39.95美元
价格可能受当地税收的影响,在结账时计算



参考文献
沃尔什,C. T.,涂,B. P.和唐杨。八个运动稳定,但热力学激活分子的动力细胞代谢。化学。牧师。118, 1460-1494(2018)。
Sugden, m.c. & Holness, m.j.在丙酮酸脱氢酶复合物水平上调节葡萄糖氧化机制的最新进展。点。j .杂志。性。金属底座。284, e855-e862(2003)。
Adina-Zada, A.等。乙酰辅酶a对生物素依赖酶丙酮酸羧化酶的变构调节。物化学。Soc。反式。40, 567-572(2012)。
马丁,W. F.比基因更古老:乙酰辅酶a途径和起源。前面。Microbiol。11, 817(2020)。
Currie, E., Schulze, A., Zechner, R., Walther, T. C. & Farese, R. V. Jr .细胞脂肪酸代谢与癌症。细胞金属底座。18, 153-161(2013)。
Batchuluun, B, Pinkosky, S. L. & Steinberg, G. R.脂肪生成抑制剂:治疗的机遇和挑战。Nat. Rev.药物发现21, 283-305(2022)。
Longo, J., van Leeuwen, J. E., Elbaz, M., Branchard, E. & Penn, L. Z.精准医疗时代他汀类药物作为抗癌药物。中国。癌症Res。26, 5791-5800(2020)。
瓦桑,K,沃纳,M. &钱德尔,n.s.线粒体代谢作为癌症治疗的靶点。细胞金属底座。32, 341-352(2020)。
在癌症中丙酮酸脱氢酶复合物/丙酮酸脱氢酶激酶(PDC/PDK)轴的治疗靶向。国立肿瘤研究所。https://doi.org/10.1093/jnci/djx071(2017)。
Jonas, m.c, Pehar, M. & Puglielli, L. AT-1是内质网膜乙酰辅酶a转运体,对细胞活力至关重要。细胞科学。123, 3378-3388(2010)。
薛文德,李志强,李志强,等。乙酰辅酶a代谢在染色质调控中的时空控制。学生物化学的发展趋势。科学。43, 61-74(2018)。
Rohrig, F. & Schulze, A.脂肪酸合成在癌症中的多重作用。Nat. Rev. Cancer16, 732-749(2016)。
坎贝尔,S. L. &韦伦,K. E.癌症中传递到细胞核的代谢信号。摩尔。细胞71, 398-408(2018)。
Srere, p.a. & Bhaduri, A.将放射性柠檬酸盐掺入脂肪酸。Biochim。Biophys。学报59, 487-489(1962)。
Bhaduri, A. & sere, P. A.柠檬酸碳与脂肪酸的结合。Biochim。Biophys。学报70, 221-230(1963)。
金属,C. M.等。IDH1还原谷氨酰胺代谢介导缺氧下脂肪生成。自然481, 380-384(2011)。
马伦,a.r.等人。还原羧化支持线粒体缺陷的肿瘤细胞的生长。自然481, 385-388(2011)。
怀斯,D. R.等。缺氧促进异柠檬酸脱氢酶依赖的羧化α -酮戊二酸到柠檬酸,以支持细胞的生长和活力。国家科学院学报美国108, 19611-19616(2011)。
库马尔,A.等人。NaCT/SLC13A5在营养受限的条件下促进柠檬酸盐的输入和代谢。细胞的代表。36, 109701(2021)。
刘,等。哺乳动物中葡萄糖醋酸盐的产生及与线粒体代谢的耦合。细胞175, 502 - 513。e13(2018)。
Vysochan, A, Sengupta, A, Weljie, a.m, Alwine, J. C. & Yu, Y. acss2介导的乙酰辅酶A合成对人巨细胞病毒感染是必要的。国家科学院学报美国114, e1528-e1535(2017)。
Trefely, S., Lovell, C. D., Snyder, N. W. & Wellen, K. E.区室化酰基辅酶a代谢及其在染色质调节中的作用。摩尔。金属底座。38, 100941(2020)。
赵,S.等。atp -柠檬酸裂解酶控制葡萄糖-醋酸盐代谢开关。细胞的代表。17, 1037-1052(2016)。
赵,S.等。膳食果糖通过微生物源性醋酸酯促进肝脏脂肪生成。自然579, 586-591(2020)。
Choudhary, C., Weinert, B. T., Nishida, Y., Verdin, E. & Mann, M.赖氨酸乙酰化的生长景观连接代谢和细胞信号。细胞生物学。15, 536-550 (2014)
韦伦,K. E.等。atp -柠檬酸裂解酶连接细胞代谢与组蛋白乙酰化。科学324, 1076-1080(2009)。
李,J. V.等。akt依赖性代谢重编程调节肿瘤细胞组蛋白乙酰化。细胞金属底座。20., 306-319(2014)。这项研究表明,AKT依赖的ACLY S455位点磷酸化促进了葡萄糖限制下乙酰辅酶a生成和组蛋白乙酰化的维持,磷酸化的AKT S473与人类肿瘤中的组蛋白乙酰化水平相关.
高桥,H., McCaffery, J. M. Irizarry, R. a . & Boeke, J. D.核胞溶乙酰辅酶(合成酶)是组蛋白乙酰化和全局转录所必需的。摩尔。细胞23, 207-217(2006)。
Sivanand, S.等人。ACLY生成核乙酰辅酶a促进同源重组。摩尔。细胞67, 252 - 265。e6(2017)。
Mews, P.等人。乙酰辅酶a合成酶调节组蛋白乙酰化和海马记忆。自然546, 381-386(2017)。
布鲁苏,V.等。通过核乙酰辅酶a合成酶2重新捕获乙酸,可防止在氧气和血清限制期间组蛋白乙酰化的损失。细胞的代表。18, 647-658(2017)。
黄,Z.等。ACSS2通过选择性调节脂质代谢相关基因促进全身脂肪的储存和利用。国家科学院学报美国115, e9499-e9506(2018)。
李,X.等。核易位的ACSS2促进溶酶体生物发生和自噬的基因转录。摩尔。细胞66, 684 - 697。e9(2017)。
门多萨等人。组蛋白上醋酸盐从赖氨酸贮存位点到赖氨酸激活位点的酶促转移。科学。睡觉。8, eabj5688(2022)。
叶,C. &涂,B. P.沉入表观基因组:组蛋白作为影响细胞代谢的存储库。性趋势。金属底座。29, 626-637(2018)。
Sutendra, G.等。核丙酮酸脱氢酶复合物对乙酰辅酶A和组蛋白乙酰化的产生很重要。细胞158, 84-97(2014)。
Nagaraj, R.等。线粒体TCA循环酶的核定位是哺乳动物合子基因组激活的关键步骤。细胞168, 210 - 223。e11(2017)。
陈,J.等。丙酮酸脱氢酶复合物的区室化活性维持前列腺癌的脂肪生成。Nat,麝猫。50, 219-228(2018)。
Zervopoulos, S. D.等。mfn2驱动的线粒体到核系带允许线粒体丙酮酸脱氢酶复合物的非典型核进入途径。摩尔。细胞82, 1066 - 1077。e7(2022)。
Madiraju, P., Pande, s.v ., Prentki, M. & Madiraju, s.r .线粒体乙酰肉碱为核组蛋白乙酰化提供乙酰基。表观遗传学4, 399-403(2009)。
Duvel, K.等人。mTOR复合物下游代谢基因调控网络的激活。摩尔。细胞39, 171-183(2010)。
Porstmann, T.等人。SREBP活性受mTORC1调控,并有助于akt依赖的细胞生长。细胞金属底座。8, 224-236(2008)。
DeBose-Boyd, R. A. & Ye, J. SREBPs在脂质代谢、胰岛素信号等方面的研究。学生物化学的发展趋势。科学。43, 358-368(2018)。
古,a.m.等人。MYC癌基因与固醇调节元件结合蛋白合作,调节肿瘤生长所必需的脂肪生成。细胞金属底座。30., 556 - 572。e5(2019)。
舒格,Z. T.等。乙酰辅酶a合成酶2促进醋酸盐的利用和维持癌细胞生长在代谢应激下。癌症细胞27, 57-71(2015)。这项工作表明,ACSS2在无脂和缺氧条件下上调,促进乙酸依赖的DNL和支持肿瘤生长.
近藤,A.等。细胞外酸性pH激活固醇调节元件结合蛋白2,促进肿瘤进展。细胞的代表。18, 2228-2242(2017)。
李,Z.等。乙酰辅酶a合成酶2:肥胖诱导骨髓瘤发生的关键链接。细胞金属底座。33, 78 - 93。e7(2021)。
宁,Z.等。USP22通过稳定肝细胞癌PPARgamma调节脂质组积累。Commun Nat。13, 2187(2022)。
Odera, J. O.等。NRF2/ACSS2轴介导饮酒对食管鳞癌的代谢作用物化学。J。477, 3075-3089(2020)。
科默福德,s.a.等。肿瘤的醋酸依赖。细胞159, 1591-1602(2014)。这项研究发现,ACSS2对于脂质合成和组蛋白乙酰化的乙酸捕获至关重要,缺乏ACSS2的小鼠表现出较低的肝脏肿瘤负担.
Mashimo, T.等人。醋酸酯是人类胶质母细胞瘤和脑转移的生物能量底物。细胞159, 1603-1614(2014)。这项对人类胶质母细胞瘤的追踪研究揭示了肿瘤中的醋酸盐氧化.
张松,何娟,贾志勇,闫志,杨杰。乙酰辅酶a合成酶2促进肾癌的发生,提示肾细胞癌患者预后不良。Urol。肿瘤防治杂志。36, 243. e9 - 243。e20(2018)。
孙,L.等。乙酰辅酶a合成酶2表达降低促进肝细胞癌转移,预测预后差。癌症科学。108, 1338-1346(2017)。
Bae, J. M.等。乙酰辅酶a合成酶2下调是结直肠癌肿瘤进展和侵袭性的代谢标志。国防部,病理学研究。30., 267-277(2017)。
陈,Y.等。ACLY:乳腺癌复发的生物标志物。病理学研究。Pract >,216, 153076(2020)。
徐毅,等。ACLY和与免疫微环境相关的基因组的鉴定和综合分析揭示了在肝细胞癌中的预后意义。癌细胞Int。21, 409(2021)。
魏,X.等。靶向ACLY通过抑制PI3K-AKT通路和激活AMPK-ROS通路来抑制卵巢癌肿瘤生长和获得性顺铂耐药。前面。肿瘤防治杂志。11, 642229(2021)。
王,J.等。ACLY低表达与急性髓系白血病预后良好相关。j . Transl。地中海。17, 149(2019)。
怀特,P. J.等。BCKDH激酶和磷酸酶通过调节atp -柠檬酸裂解酶整合BCAA和脂质代谢。细胞金属底座。27, 1281 - 1293。e7(2018)。
Berwick, d.c., Hers, I., Heesom, K. J., Moule, S. K. & Tavare, J. M. atp -柠檬酸裂解酶作为蛋白激酶B (Akt)底物在原代脂肪细胞中的鉴定。生物。化学。277, 33895-33900(2002)。
盖,P. S., Cohen, P. & Hardie, d.g.大鼠乳腺atp -柠檬酸裂解酶被环amp依赖性蛋白激酶磷酸化。2月。109, 205-208(1980)。
Potapova, i.a., El-Maghrabi, m.r., Doronin, S. V. & Benjamin, W. B.重组人ATP:柠檬酸裂解酶的camp依赖性蛋白激酶磷酸化取消了柠檬酸对酶的同向变构调节并增加了酶活性。ATP的变构激活:磷酸化糖的柠檬酸裂解酶。生物化学39, 1169-1179(2000)。
盖,P. S., Cohen, P. & Hardie, D. G.泌乳大鼠乳腺ATP柠檬酸(pro-3S)裂解酶的纯化和理化性质及其可逆磷酸化的研究。欧元。学生物化学j。114, 399-405(1981)。
彭提亚拉,S. N. & Benjamin, W. B.草酰乙酸和磷酸化对atp -柠檬酸裂解酶活性的影响。生物化学34, 10961-10969(1995)。
兰甘纳坦,N. S., Srere, P. A. & Linn, T. C.磷酸和去磷酸atp柠檬酸裂解酶的比较。拱门。物化学。Biophys。204, 52-58(1980)。
胡晓明,杨晓明,杨晓明。磷酸化对大鼠肝脏atp -柠檬酸裂解酶动力学特性的影响。Biochim。Biophys。学报844, 233-239(1985)。
凯雷尔,A.等。乙酰辅酶a代谢支持多步胰腺肿瘤发生。癌症。9, 416-435(2019)。这项研究表明,在胰腺癌的遗传模型中,胰腺中缺乏ACLY的小鼠显示出受损的腺泡-导管化生和减少胰腺肿瘤的形成.
mTORC2-AKT信号转导至atp -柠檬酸裂解酶驱动棕色脂肪生成和新生脂肪生成。Commun Nat。11, 575(2020)。
Covarrubias, A. J.等。Akt-mTORC1信号通路调控Acly整合代谢输入控制巨噬细胞激活。Elife5, e11612(2016)。
Senapati, P.等人。高胰岛素血症在三阴性乳腺癌中促进异常组蛋白乙酰化。表观遗传学染色质12, 44(2019)。
Basappa, J.等人。ACLY是PIP2/PIP3和Lyn在急性髓系白血病中的新信号靶点。Heliyon6, e03910(2020)。
McCubrey, J. A.等。GSK-3作为癌症治疗干预的潜在靶点。Oncotarget5, 2881-2911(2014)。
Hughes, K., Ramakrishna, S., Benjamin, W. B. & Woodgett, J. R.多功能atp -柠檬酸裂解酶激酶作为糖原合成酶激酶-3的α亚型的鉴定。物化学。J。288, 309-314(1992)。
林,R.等。乙酰化稳定atp -柠檬酸裂解酶促进脂质生物合成和肿瘤生长。摩尔。细胞51, 506-518(2013)。
张,C.等。Cullin3-KLHL25泛素连接酶靶向ACLY降解抑制脂质合成和肿瘤进展。Dev的基因。30., 1956-1970(2016)。
Hallows, W. C., Lee, S. & Denu, J. M. Sirtuins去乙酰化并激活哺乳动物乙酰辅酶a合成酶。国家科学院学报美国103, 10230-10235(2006)。
Akella, n.m., Ciraku, L. & Reginato, m.j.火中浇油:己糖胺生物合成途径在癌症中的新兴作用。BMC医学杂志。17, 52(2019)。
Ciraku, L.等人。O-GlcNAc转移酶通过cdk5依赖的ACSS2磷酸化调节胶质母细胞瘤醋酸酯代谢。致癌基因41, 2122-2136(2022)。
Hardie, d.g. & Pan, d.a.脂肪酸合成和由amp活化蛋白激酶氧化的调节。物化学。Soc。反式。30., 1064-1070(2002)。
平科斯基,S. L.等。长链脂肪酸酰基辅酶a酯通过变构控制AMPK β a1亚型调节代谢。Nat,金属底座。2, 873-881(2020)。
拉里,J. S. V.等。通过磷酸化或抑制剂ND-654抑制乙酰辅酶a羧化酶可抑制脂肪生成和肝细胞癌。细胞金属底座。29, 174 - 182。e5(2019)。本研究使用ACC具有组成性活性的小鼠模型和ACC抑制剂来揭示ACC依赖的脂肪生成促进HCC.
富勒顿,医学博士等人。Acc1和Acc2中的单一磷酸化位点调节脂质稳态和二甲双胍的胰岛素敏化作用。Nat,地中海。19, 1649-1654(2013)。
German, N. J.等。癌症中PHD3的损失使代谢依赖于通过ACC2失活的脂肪酸氧化。摩尔。细胞63, 1006-1020(2016)。
布朗西,R. W.,布恩,A. N.,埃利奥特,J. E., Kulpa, J. E. & Lee, W. M.乙酰辅酶a羧化酶的调控。物化学。Soc。反式。34, 223-227(2006)。
Longo, J.等。甲羟戊酸途径是t(4;14)阳性多发性骨髓瘤的一个可操作的脆弱性。白血病35, 796-808(2021)。
Moon, S. H. et al. p53抑制甲羟戊酸通路介导肿瘤抑制。细胞176, 564 - 580。e19(2019)。
free - pastor, W. A.等。突变p53通过甲羟戊酸途径破坏乳腺组织结构。细胞148, 244-258(2012)。
Trefely, S.等人。亚细胞代谢途径动力学是通过校正人工收获后代谢揭示的。摩尔。金属底座。30., 61-71(2019)。
Trefely, S.等人。定量亚细胞酰基辅酶a分析显示不同的核代谢和异亮氨酸依赖性组蛋白丙酸化。摩尔。细胞82, 447 - 462。e6(2022)。本文报道了一种严格的方法的发展,定量酰基辅酶a酯在亚细胞区室,包括线粒体,细胞质和核.
腺泡细胞可塑性与胰腺导管腺癌的发展。胃肠醇。乙醇。14, 296-304(2017)。
麦格雷戈,G. H.等。针对他汀介导的氧化应激代谢反应产生协同抗肿瘤反应。癌症Res。80, 175-188(2020)。
Longo, J.等。可操作的固醇调节反馈环调节前列腺癌的他汀类药物敏感性。摩尔。金属底座。25, 119-130(2019)。
潘德拉,A.等。立即使用两种批准的药物来靶向代谢甲羟戊酸途径及其恢复性反馈回路。癌症Res。74, 4772-4782(2014)。
姜伟,胡建文,何旭荣,金文林,何晓云。他汀类药物:一种新的抗癌药物。J.临床经验。癌症Res。40, 241(2021)。
鲍尔,D. E. Hatzivassiliou, G.,赵,F., Andreadis, C. & Thompson, C. B. ATP柠檬酸裂解酶是细胞生长和转化的重要组成部分。致癌基因24, 6314-6322(2005)。
Hatzivassiliou, G.等人。ATP柠檬酸裂解酶抑制可抑制肿瘤细胞生长。癌症细胞8, 311-321(2005)。这项研究表明,使用RNA干扰或抑制剂靶向ACLY可以抑制肿瘤生长.
米吉塔,T.等人。ATP柠檬酸裂解酶:非小细胞肺癌的激活和治疗意义。癌症Res。68, 8547-8554(2008)。
米勒,K. D.等。用过渡态模拟物靶向ACSS2抑制三阴性乳腺癌的生长。癌症Res。81, 1252-1264(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03808558(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT02223247(2017)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT02980029(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03032484(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03179904(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT05118776(2022)。
斯托克韦尔,B. R.等。铁下垂:一种调节细胞死亡的联系代谢,氧化还原生物学,和疾病。细胞171, 273-285(2017)。
雷国强,庄丽丽,甘波。铁下垂症在癌症中的易感位点。Nat. Rev. Cancer22, 381-396(2022)。
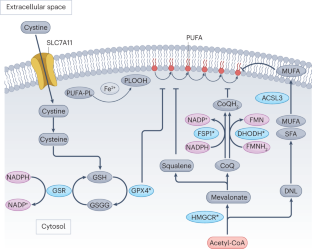
Bersuker, K.等。CoQ氧化还原酶FSP1与GPX4平行作用抑制铁下垂。自然575, 688-692(2019)。
毛,C.等。dhodh介导的铁下垂防御在癌症中是一个可靶向的脆弱性。自然593, 586-590(2021)。
Garcia-Bermudez, J.等人。角鲨烯在胆固醇营养不良淋巴瘤中的积累可以防止细胞氧化死亡。自然567, 118-122(2019)。
瑞斯曼,E.等人。从头脂肪生成通过促进膜脂饱和来保护癌细胞免受自由基和化疗的影响。癌症Res。70, 8117-8126(2010)。
塔莱比,A.等人。持续的srebp -1依赖的脂肪生成是braf靶向治疗抵抗的关键中介。Commun Nat。9, 2500(2018)。
蒋晓霞,刘志刚,刘志刚。铁下垂病的病理机制、生物学研究进展。细胞生物学。22, 266-282(2021)。
刘,J. Y.和Wellen, K. E.在理解代谢产物作为癌症进展的信号分子方面的进展。咕咕叫。当今。细胞生物。63, 144-153(2020)。
伊佐,L. T., Affronti, H. C. & Wellen, K. E.癌症表观遗传学与代谢的双向关系。为基础。癌症生物学。5, 235-257(2021)。
李晓霞,王勇,王秀林,吕哲。代谢酶和代谢产物对染色质和基因表达的调控。细胞生物学。19, 563-578(2018)。
高,X.等。醋酸盐作为表观遗传代谢物在缺氧条件下促进脂质合成。Commun Nat。7, 11960(2016)。
Torrini, C.等人。乳酸是一种表观遗传代谢物,驱动胶质母细胞瘤模型系统的生存。摩尔。细胞82, 3061 - 3076。e6(2022)。
里奥斯·加西亚等人。乙酰辅酶a羧化酶1依赖蛋白乙酰化控制乳腺癌转移和复发。细胞金属底座。26, 842 - 855。e5(2017)。
Lu, M.等。acot12依赖的乙酰辅酶a改变通过上皮-间质转化的表观遗传诱导驱动肝细胞癌转移。细胞金属底座。29, 886 - 900。e5(2019)。
李,J. V.等。乙酰辅酶a促进胶质母细胞瘤细胞黏附并通过Ca迁移2 +-NFAT信号。Dev的基因。32, 497-511(2018)。
Geeraerts, X.等。肿瘤微环境中的巨噬细胞代谢不均匀。细胞的代表。37, 110171(2021)。
Baardman, J.等人。巨噬细胞ATP柠檬酸裂解酶缺乏稳定动脉粥样硬化斑块。Commun Nat。11, 6296(2020)。
不,J. T.等。乳酸支持巨噬细胞极化的代谢-表观遗传链接。科学。睡觉。7, eabi8602(2021)。
de Goede, K. E.等。骨髓特异性Acly缺失改变巨噬细胞在体外和体内表型而不影响肿瘤生长。癌症13, 3054(2021)。
刘,M.等。CpG对巨噬细胞的代谢重布线增强了对癌细胞的清除,并克服了肿瘤表达cd47介导的“不要吃我”信号。Immunol Nat。20., 265-275(2019)。
张,C. H.等。好氧糖酵解对T细胞效应功能的转录后控制。细胞153, 1239-1251(2013)。
彭,M.等。好氧糖酵解通过表观遗传机制促进辅助性T细胞1分化。科学354, 481-484(2016)。
乔杜里等人。细胞内乙酰辅酶a增强抗肿瘤CD8+ T细胞的治疗效果。癌症Res。82, 2640-2655(2022)。
赖因菲尔德,b.i.等。肿瘤微环境中细胞程序化的营养分配。自然593, 282-288(2021)。
邱,J.等。在葡萄糖限制期间,醋酸盐促进T细胞效应功能。细胞的代表。27, 2063 - 2074。e5(2019)。
李,J.等。脂肪酸代谢调节剂,乙酰辅酶a羧化酶1,控制T细胞免疫。j . Immunol。192, 3190-3199(2014)。
Mayers, J. R. & Vander Heiden, M. G.先天和后天:什么决定肿瘤代谢表型?癌症Res。77, 3131-3134(2017)。
Shah, p.a., Patil, R. & Harrison, s.a. nafld相关肝细胞癌:日益增长的挑战。肝脏病学https://doi.org/10.1002/hep.32542(2022)。
布罗德菲尔德,洛杉矶等。脂肪诱导非转化肝细胞的葡萄糖代谢,促进肝肿瘤的发生。癌症Res。81, 1988-2001(2021)。
桑吉内托,等人。肝细胞癌发生发展中的脂质代谢。癌症12, 1419(2020)。
Calvisi, d.f.等。AKT-mTORC1-RPS6信号通路诱导的脂肪生成增加,促进人肝细胞癌的发展。胃肠病学140, 1071-1083(2011)。
Lambert, J. E, Ramos-Roman, M. A, Browning, J. D. & Parks, E. J.非酒精性脂肪肝患者体内脂肪生成增加是一个明显的特征。胃肠病学146, 726-735(2014)。
Park, G., Jung, S., Wellen, K. E. & Jang, C.非酒精性脂肪性肝病中肠道微生物群和饮食碳水化合物之间的相互作用。Exp、Mol、Med。53, 809-822(2021)。
托多利克,J.等。炎症促进果糖刺激的脂肪生成。Nat,金属底座。2, 1034-1045(2020)。
张哲,等。丝氨酸分解代谢产生肝脏NADPH并支持肝脏脂肪生成。Nat,金属底座。3., 1608-1620(2021)。
Yenilmez, B.等人。在肥胖小鼠中,肝细胞选择性atp -柠檬酸裂解酶耗竭对转录因子SREBP1c的反常激活和从头脂肪生成。生物。化学。298, 102401(2022)。
莫罗,mr .等人。抑制atp -柠檬酸裂解酶可改善NASH、肝纤维化和血脂异常。细胞金属底座。34, 919 - 936。e8(2022)。
王,Q.等。废除肝脏atp -柠檬酸裂解酶保护脂肪肝和改善瘦素受体缺陷小鼠高血糖。肝脏病学49, 1166-1175(2009)。
Beigneux, a.p.等。小鼠atp -柠檬酸裂解酶缺乏症。生物。化学。279, 9557-9564(2004)。
Abu-Elheiga, L.等人。缺乏乙酰辅酶a羧化酶1的突变小鼠胚胎死亡。国家科学院学报美国102, 12011-12016(2005)。
原田,N.等。肝脏从头脂肪生成存在于肝脏特异性acc1缺陷小鼠中。细胞生物学。27, 1881-1888(2007)。
金,C. W.等。乙酰辅酶a羧化酶抑制减少肝脏脂肪变性,但提高血浆甘油三酯在小鼠和人类:一项床边到实验室的研究。细胞金属底座。26, 576(2017)。
萨维奇,d.b.等人。乙酰辅酶a羧化酶1和2的反义寡核苷酸抑制剂逆转饮食诱导的肝脏脂肪变性和肝脏胰岛素抵抗。j .中国。投资。116, 817-824(2006)。
哈里曼,G.等。ND-630抑制乙酰辅酶a羧化酶可减少大鼠肝脏脂肪变性,改善胰岛素敏感性,并调节血脂异常。国家科学院学报美国113, e1796-e1805(2016)。
周,J. D.等。遗传抑制肝乙酰辅酶a羧化酶活性增加肝脏脂肪和改变全球蛋白质乙酰化。摩尔。金属底座。3., 419-431(2014)。
纳尔逊,m.e.等人。抑制肝脏脂肪生成通过增加抗氧化防御和促进细胞存活来促进肝脏肿瘤的发生。Commun Nat。8, 14689(2017)。
李文杰,李文杰,李文杰,李文杰。支链氨基酸。为基础。启杂志。81, 139-164(2019)。
Neinast, m.d.等人。支链氨基酸全身代谢命运的定量分析。细胞金属底座。29, 417 - 429。e4(2019)。
梅耶斯,J. R.等人。循环支链氨基酸的升高是人类胰腺腺癌发展的早期事件。Nat,地中海。20., 1193-1198(2014)。
李,J. T.等。bcat2介导的BCAA分解代谢对胰腺导管腺癌的发展至关重要。细胞生物学。22, 167-174(2020)。
Sakers, A. De Siqueira, M. K. Seale, P. & Villanueva, C. J.健康与疾病中的脂肪组织可塑性。细胞185, 419-446(2022)。
Lengyel, E., Makowski, L., DiGiovanni, J. & Kolonin, m.g.癌症是一种脂肪:脂肪组织和肿瘤之间的串扰。趋势癌症4, 374-384(2018)。
朱,Q.等。脂肪细胞间充质转化有助于乳腺肿瘤的进展。细胞的代表。40, 111362(2022)。
Seki, T.等人。通过冷改变的整体代谢,棕色脂肪介导的肿瘤抑制。自然608, 421-428(2022)。
费尔南德斯等人。脂肪细胞ACLY促进饮食碳水化合物处理,维持女性代谢稳态。细胞的代表。27, 2772 - 2784。e6(2019)。
Smith, U. & Kahn, B. B.脂肪组织调节胰岛素敏感性:脂肪生成、新生脂肪生成和新脂质的作用。j .实习生。地中海。280, 465-475(2016)。
竹原,等人。癌症相关脂肪细胞通过SAA1表达促进胰腺癌进展。癌症科学。111, 2883-2894(2020)。
波切特,L.等。脂肪细胞来源的成纤维细胞促进肿瘤进展,并有助于乳腺癌的结缔组织反应。癌症Res。73, 5657-5668(2013)。
华森,方,M. & Lowenstein, J. M.三羧酸酯和羟柠檬酸酯:ATP底物和抑制剂:柠檬酸草酰乙酸裂解酶。拱门。物化学。Biophys。135, 209-217(1969)。
Onakpoya, I., Hung, s.k, Perry, R., Wider, B. & Ernst, E.使用葡萄藤提取物(羟基柠檬酸)作为减肥补充剂:随机临床试验的系统回顾和荟萃分析。j . ob。2011, 509038(2011)。
Jena, B. S., Jayaprakasha, G. K., Singh, R. P. & Sakariah, K. K.藤黄(-)-羟基柠檬酸的化学和生物化学。j·阿格利司。食品化学。50, 10-22(2002)。
赫姆斯菲尔德,S. B.等。藤黄(羟基柠檬酸)作为一种潜在的抗肥胖药物:一项随机对照试验。《美国医学会杂志》280, 1596-1600(1998)。
Madeo, F, Carmona-Gutierrez, D, Hofer, S. J. & Kroemer, G.针对年龄相关疾病的热量限制模拟:目标、机制和治疗潜力。细胞金属底座。29, 592-610(2019)。
马里诺,G.等人。胞浆乙酰辅酶A对自噬的调控。摩尔。细胞53, 710-725(2014)。本研究表明,营养剥夺诱导的乙酰辅酶a耗竭以p300调节的方式激活自噬.
Longo, V. D. & Panda, S.健康寿命中的禁食、昼夜节律和限时喂养。细胞金属底座。23, 1048-1059(2016)。
Lien, e.c.等。低血糖饮食改变脂质代谢从而影响肿瘤生长。自然599, 302-307(2021)。
pomato - watson, l.c.d.等人。无论饮食成分如何,每日热量限制比热量循环更有效地限制肿瘤生长。Commun Nat。12, 6201(2021)。
Pietrocola, F.等人。热量限制模拟增强抗癌免疫监测。癌症细胞30., 147-160(2016)。
米肖等人。化疗药物诱导小鼠自噬依赖的抗癌免疫反应。科学334, 1573-1577(2011)。
Amaravadi, R. K, Kimmelman, a.c. & Debnath, J.癌症自噬靶向:最新进展和未来方向。癌症。9, 1167-1181(2019)。
山本等。自噬通过降解MHC-I促进胰腺癌的免疫逃避。自然581, 100-105(2020)。
郑毅,等。ATP柠檬酸裂解酶抑制剂通过p-eIF2alpha/ATF4/CHOP轴触发内质网应激诱导肝癌细胞凋亡。细胞生物学。25, 1468-1479(2021)。
Shah, S.等人。靶向ACLY通过影响ACLY- ampk -AR反馈机制使去势抵抗前列腺癌细胞对AR拮抗敏感。Oncotarget7, 43713-43730(2016)。
皮尔斯,N. J.等。ATP柠檬酸裂解酶在血脂代谢调节中的作用。SB-204990的降血脂作用,一种有效的ATP柠檬酸裂解酶抑制剂SB-201076的内酯前药。物化学。J。334, 113-119(1998)。
Burke, a.c. & Huff, m.w. atp -柠檬酸裂解酶:遗传学,分子生物学和血脂异常的治疗靶点。咕咕叫。当今。脂醇。28, 193-200(2017)。
平科斯基,S. L.等。苯培土酸抑制肝脏特异性atp -柠檬酸裂解酶降低LDL-C并减弱动脉粥样硬化。Commun Nat。7, 13457(2016)。
唐哲,等。GEPIA:用于癌症和正常基因表达分析和交互分析的web服务器。核酸测定。45, w98-w102(2017)。
顾,L.等。IKKbeta-USP30-ACLY轴控制脂肪生成和肿瘤发生。肝脏病学73, 160-174(2021)。
乔,C.等。igf1介导的HOXA13过表达通过上调ACLY和IGF1R促进结直肠癌转移。细胞死亡。12, 564(2021)。
平科斯基,S. L.等。amp激活的蛋白激酶和atp -柠檬酸裂解酶是ETC-1002的两个不同的分子靶点,这是一种新的脂质和碳水化合物代谢的小分子调节剂。脂质Res;54, 134-151(2013)。
黄,等。LKB1-AMPK通路在抑制pten缺陷小鼠肿瘤发生中的重要作用物化学。J。412, 211-221(2008)。
Houde, V. P.等。AMPK beta1减少肿瘤进展,提高p53缺失小鼠的存活率。摩尔。杂志。11, 1143-1155(2017)。
戴,等。能量状态决定了PD-L1蛋白的丰度和抗肿瘤免疫,从而实现检查点封锁。摩尔。细胞81, 2317 - 2331。e6(2021)。
魏,J.等。一种有效抑制人atp -柠檬酸裂解酶的变构机制。自然568, 566-570(2019)。
魏,X.,舒尔茨,K., Bazilevsky, G. A, Vogt, A. & Marmorstein, R. atp -柠檬酸裂解酶生产乙酰辅酶A的分子基础。Nat。结构。摩尔。杂志。27, 33-41(2020)。
Verschueren, K. H. G.等。ATP柠檬酸裂解酶的结构和克雷布斯循环中柠檬酸合酶的起源。自然568, 571-575(2019)。本文与Wei et al.(2019)和Wei et al.(2020)一起首次报道了ACLY同型四聚体的结构.
斯文森,R. U.等。在临床前模型中,抑制乙酰辅酶a羧化酶抑制非小细胞肺癌的脂肪酸合成和肿瘤生长。Nat,地中海。22, 1108-1119(2016)。这项研究表明,ACC抑制抑制基因工程肺癌小鼠模型中的肿瘤生长.
Liefwalker, d.f.等人。RAS、BCR-ABL和myc驱动的淋巴样恶性肿瘤中脂肪生成的代谢收敛。癌症金属底座。9, 31(2021)。
Alkhouri, N., Lawitz, E., Noureddin, M., DeFronzo, R. & Shulman, g.i. GS-0976 (firsocostat):一种实验性肝靶向乙酰辅酶a羧化酶(ACC)抑制剂,用于治疗非酒精性脂肪性肝炎(NASH)。专家。当今。Investig。药物29, 135-141(2020)。
李,H.等。能量-应力介导的AMPK激活抑制铁下垂。细胞生物学。22, 225-234(2020)。
林格尔,A. E.等。肥胖影响肿瘤微环境代谢,抑制抗肿瘤免疫。细胞183, 1848 - 1866。e26(2020)。
韦伦,K. E.和斯奈德,N. W.我们是否应该考虑代谢物的亚细胞区隔化,如果是,我们如何测量它们?咕咕叫。当今。中国。减轻。金属底座。护理22, 347-354(2019)。
迪特里希,i.a.等人。乙酰辅酶a通量调节蛋白质组和乙酰-蛋白质组以维持细胞内代谢串扰。Commun Nat。10, 3929(2019)。
他,A.等人。来源于肝脏过氧化物酶体β -氧化的乙酰辅酶a抑制自噬并通过mTORC1激活促进脂肪变性。摩尔。细胞79, 30-42。e4(2020)。
Huber, K.等人。n -乙酰天冬氨酸通路是营养反应性的,协调棕色脂肪细胞的脂质和能量代谢。Biochim。Biophys。分子学报。1866, 337-348(2019)。
荣格,s.m.等人。体内同位素示踪揭示了葡萄糖作为棕色脂肪组织底物的多功能性。细胞的代表。36, 109459(2021)。
列维,M. J.等。酰基辅酶A/蛋白质相互作用网络的系统化学蛋白质组学分析。细胞化学。医学杂志。27, 322 - 333。e5(2020)。
Montgomery, d.c.等。乙酰转移酶反馈调控的全球概况。j。化学。Soc。138, 6388-6391(2016)。
Goncalves, m.d.等。高果糖玉米糖浆促进小鼠肠道肿瘤生长。科学363, 1345-1349(2019)。
确认
K.E.W.和D.A.G.由NIH的NIDDK (R01DK116005)支持。K.E.W.也得到了NCI (R01CA228339, R01CA174761, R01CA248315和R01CA262055)和路德维希研究所的支持。D.A.G.也得到了NIH的NIDDK的支持(R01DK094004和R01DK127175)。
作者信息
作者及隶属关系
贡献
作者对文章的各个方面都作了同样的贡献。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然评论癌症感谢G. Steinberg, R. Perry和其他匿名审稿人对这项工作的同行评审所做的贡献。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
术语表
- 发病
-
脂肪细胞衍生因子释放到血液中,以自分泌或旁分泌方式调节新陈代谢的因子
- 辅酶Q
-
(公鸡)。也被称为泛醌,一种酶,包括氧化还原活性醌头基团和异戊二烯类尾合成的甲羟戊酸途径,作为电子载体,作为电子传递链的一部分和作为抗氧化剂。
- 从头脂肪生成
-
(黑暗)。由非脂质前体乙酰辅酶A生成脂肪酸的过程,乙酰辅酶A可以通过多种途径产生,但最常见的是来自碳水化合物。
- 甲羟戊酸途径
-
这一途径以其关键的中间体——五碳分子甲戊酸酯命名,可生成一大家族类异戊二烯的前体,包括胆固醇和辅酶Q。
- M1和M2巨噬细胞表型
-
一种分类系统,其中异质巨噬细胞被分为M1和M2, M1定义了激活的促炎巨噬细胞,与细菌和病毒的保护有关,M2是交替激活的巨噬细胞,表达不同的标记物,与伤口愈合和免疫抑制有关。
- 正电子发射断层扫描示踪器
-
含有正电子发射放射性同位素的化学物质,用于肿瘤成像,例如[18F]氟脱氧葡萄糖,一种葡萄糖的非代谢类似物,可以成像高糖摄取率的肿瘤。
- 还原羧化作用
-
谷氨酰胺代谢的还原途径,其中异柠檬酸脱氢酶1 (IDH1)和IDH2反向作用,从α-酮戊二酸和CO生成异柠檬酸和柠檬酸2.
- 稳定同位素追踪
-
一种用于跟踪传递到细胞或组织的示踪分子的代谢命运的技术,如[13C .葡萄糖或[13C -15谷氨酰胺,其中一种或多种丰富的自然存在的元素——通常是C、H或N——被含量较低的非放射性同位素所取代,这种同位素可以用质谱仪按质量区分。
- 他汀类药物
-
以3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)为靶点的降胆固醇药物。
- 硫酯键
-
一种化学键,可以概括为R-CO-S-R ',其中连接羧酸酯的是硫而不是氧。
- Ubiquitylation
-
将泛素蛋白附着在赖氨酸残基上的翻译后修饰过程,可作为调节信号或形成针对蛋白质的多泛素链进行降解。
权利和权限
根据与作者或其他权利持有人签订的出版协议,自然或其许可方(例如,社会或其他合作伙伴)对本文拥有排他性权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。
关于本文
引用本文
盖汀,d。a。韦伦,k。e。癌症中的乙酰辅酶a代谢。Nat Rev癌症23, 156-172(2023)。https://doi.org/10.1038/s41568-022-00543-5
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41568-022-00543-5
