摘要
在过去的一个世纪里,乳腺癌的治疗有了巨大的进步,从严格的手术方法到协调的方法,包括局部和全身治疗。早期疾病的系统治疗最初仅在辅助试验中与观察或安慰剂进行对比。随后的临床试验侧重于治疗“微调”,队列规模、持续时间和成本显著增加,导致在过去十年中对新辅助治疗的兴趣日益浓厚。新辅助试验设计的优点是能够直接评估治疗对肿瘤直径的影响,并通过治疗前、治疗中和治疗后肿瘤生物学的比较分析提供独特的转化研究机会。目前的技术使识别更好的预测性生物标志物正在塑造(新)辅助试验的新时代。迫切需要加强制药业和学术界之间的合作,以共享数据,从而建立大型生物标志物数据数据库,以及科学界易于访问的患者结果。在这篇综述中,我们总结了从前基因组到后基因组时代的(新)辅助试验的演变,并对目前如何设计新辅助研究提供了关键的见解,讨论了对更好的终点和更个性化的治疗策略的需求,包括在新辅助治疗后的环境中。
要点
在过去的八十年中,早期乳腺癌患者的全身治疗有了显著的改善,(新)辅助临床试验的目标和设计也不断发展。
临床试验从前基因组时代向后基因组时代的过渡是基于对疾病生物学的更深理解和对发现与治疗反应相关的分子标记的更高层次的兴趣。
目前采用的新辅助试验设计方法需要一波新的变革,实施验证终点,与生存结果具有更强的预测相关性,并采用更个性化的治疗策略(升级和/或降级)。
朝着更加个性化的治疗方法的发展,导致人们对新辅助治疗后的环境越来越感兴趣,特别是在高风险疾病患者中研究新药。
优化可以指导治疗定制的新型生物标记物的搜索效率,需要建立与临床结果相关的候选生物标记物的大型、注释良好的数据库,这些数据库也易于科学界访问。
临床试验数据的早期共享应基于制药业和学术实体之间的共同努力和加强合作。
简介
乳腺癌是全球女性中最常见的恶性肿瘤,据估计,2022年美国有29万新发病例和4.3万人死亡(参考文献)。1).这些数字可能因COVID-19大流行而出现偏差,大流行导致获得护理的机会减少,从而导致诊断延迟。这些延迟转化为短期较低的发病率,尽管有更多的患者在诊断时患有更晚期的疾病,并最终增加死亡率2.因此,乳腺癌长期以来一直是并且仍然是一个主要的公共卫生问题。
几十年的研究表明,乳腺癌是一种复杂和异质性的疾病,多年来为患者的治疗方案提供了有意义的进展,临床结果有了实质性的改善3..在这篇综述中,我们总结了早期乳腺癌患者系统治疗的发展步骤,从前基因组时代到后基因组时代,从新活性物质的鉴定到对疾病生物学的更深入理解和预测生物标志物的发现。
我们对涉及早期乳腺癌患者的研究的设计陷阱提供了关键的见解,讨论了更好的终点的必要性,并提出了新的思维方式,以解决这些问题。最后,我们强调了新技术识别新型疗效预测标记的能力,这些标记正在塑造早期乳腺癌试验的新时代。
乳腺癌治疗的发展
在过去的一个世纪里,乳腺癌患者的治疗发生了巨大的变化,从严格的手术方法发展到多学科的方法,包括放射治疗、化疗、内分泌治疗、靶向治疗和免疫治疗。这种演变是由于人们对癌症有了越来越深入的了解,并认识到使其不同于其他癌症类型的显著、独特的特征4.首先,淋巴结阳性疾病患者在缺乏特异性治疗的情况下有更高的复发风险,从全身辅助治疗中获益最大。其次,三分之二的乳腺癌患者患有激素受体(HR)阳性疾病,并受益于雌激素受体(ER)信号的抑制,使用各种内分泌疗法。第三,乳腺癌是一种极其复杂的异质性疾病,可能发生和/或推动癌症发展的基因改变可能是专门设计的治疗方法的有用靶点。在了解乳腺癌方面取得的这些成就,已被随机试验证明可降低疾病复发和死亡风险的药物的成功开发反映出来。
首批涉及早期乳腺癌患者的辅助化疗大队列研究集中在辅助化疗的作用上,这些研究要么是非随机的,要么是将化疗与观察或单独安慰剂的使用进行比较5,6,7.这些开创性的研究结果测试辅助化疗的作用,开始于1957年(参考文献。5,7,8),在国家外科辅助乳房和肠道计划(NSABP)后续研究中得到证实。8以及最终由早期乳腺癌试验合作小组(EBCTCG)领导的大型元分析6,9.这些分析表明,由几种不同药物组成的辅助化疗方案显著降低了乳腺癌的年度复发率和死亡率(分别为28%和16%)9.
迈向更个性化治疗方法的第一步是评估hr阳性乳腺癌患者的辅助内分泌治疗。20世纪80年代初,由诺伐得辅助试验组织(NATO)领导的开创性研究10,11和NSABP12首次提供了早期乳腺癌患者接受他莫西芬辅助治疗的临床获益数据。几年后,EBCTCG根据来自全球合作的3万名妇女的汇总数据证实了这些生存结果的改善,其中他莫西芬与疾病复发率和死亡率的年发病率显著降低相关(分别为25%和17%)。9.
最后,基于基础研究科学家和临床研究人员之间富有成效的合作,针对her2阳性乳腺癌患者的her2靶向治疗的出现标志着另一个里程碑,朝着更加个性化的治疗方向发展。HERA试验13证明辅助化疗后1年曲妥珠单抗对这些患者具有显著的生存益处(接受曲妥珠单抗的患者10年无病生存(DFS)获益6-8%)14;这一结果在类似的辅助试验和2021年发表的EBCTCG荟萃分析中得到证实。15).
辅助临床试验的发展
第一波开创性的临床试验将癌症疗法与单独观察或安慰剂进行了比较,随后是第二代更复杂和精细化的研究,比较不同的干预措施,包括不同的化疗方案(例如基于蒽环类的化疗方案与基于蒽环类和紫杉烷的联合化疗方案)。6,不同的内分泌疗法(如他莫昔芬与芳香化酶抑制剂)16以及不同的靶向治疗策略(如单一和双重HER2抑制)17.在次优样本量的队列中,与这些治疗方式相关的获益幅度的有限差异并不总是能被检测到。因此,EBCTCG在进行定期患者水平荟萃分析中的作用在证明小而显著的风险降低方面变得至关重要:在结节阳性乳腺癌患者的蒽环类治疗方案中添加紫杉烷分别与8年疾病复发率降低4.6%,8年乳腺癌死亡率降低2.8%和8年全因死亡率降低3.2%相关6.同样,芳香化酶抑制剂的10年乳腺癌死亡率比他莫西芬低,尽管降低了2.1% (12.1% vs 14.2%;P= 0.009)6,16.
第二波研究使人们认识到有必要显著增加试验样本量(数千名患者),尽管这种方法的改变带来了指数级的成本上升,并且仍然缺乏成功的保证。例如D-care18,比阿特丽斯19和ALTTO20.这些研究均为随机研究,但均未能证明接受试验性治疗的患者在统计学上有显著改善(补充表1).在ALTTO的审判中20.,研究人员随机分配8381例患者进行1年的曲妥珠单抗、拉帕替尼(HER2和EGFR的小分子抑制剂)辅助治疗,或这两种药物按顺序或联合使用。由于相对曲妥珠单抗的劣势,ALTTO的拉帕替尼组于2011年关闭,在协议指定的分析截止点,曲妥珠单抗+拉帕替尼对HER2的双重抑制与单曲妥珠单抗相比并没有改善DFS。相比之下,在APHINITY试验中,曲妥珠单抗+帕妥珠单抗的双重HER2抑制相对于曲妥珠单抗可显著改善侵入性DFS,尽管6年无事件生存率(EFS)仅改善2.8%(参考文献)。17).
值得注意的是,两项研究中双重与单一HER2抑制的获益程度相似(ALTTO中DFS的风险比为0.84,97.5% CI为0.70-1.02;P= 0.048;在APHINITY中,侵袭性DFS的危险比为0.81,95% CI为0.66-1.00;P= 0.045)20.,21.ALTTO的明显失败和APHINITY相同方法的成功可能反映了统计假设的差异22.
对新辅助试验越来越感兴趣
新辅助治疗方法最初是为局部晚期和/或不能手术的癌症患者开发的,使用放疗、化疗或两者结合,试图使肿瘤可手术和/或减轻肿瘤负担。然而,来自临床前模型的数据也表明,化疗可能对某些侵袭性癌症具有额外的治疗优势,因为化疗可能会降低癌细胞的复制率23.新辅助全身治疗随后被提倡作为一种方法,以增加乳房保存的可行性,妇女认为不符合这种方法的诊断。通过里程碑式的NSABP-B18试验24术前和术后给予4个周期的阿霉素加环磷酰胺,显示出相当的DFS和总生存期(OS),术前给予全身治疗的信任迅速增加。
新辅助方法的其他优点也激发了人们越来越多的兴趣,包括基于肿瘤直径的测量快速、直接评估治疗效果的可能性,以及治疗前、治疗中和治疗后肿瘤生物学的比较调查所提供的研究机会25(表1).新辅助方法的广泛采用最终是通过使用病理完全缓解(pCR)作为长期结果的快速和随时可用的替代品而获得的。
有趣的是,在随机临床试验中,pCR已被FDA支持作为加速批准新辅助药物测试的替代终点26尽管“积极的意见”也取决于在另一种情况下(如在转移性疾病患者中)测试相同概念的临床试验的结果。因此,在过去的10年里,新辅助试验的设计和实施出现了指数级增长,这些试验采用了小型队列,有足够的动力来检测pCR的差异,但无法证明EFS的任何差异。
2014年,fda赞助的一项开创性荟萃分析仅在患者水平上证明了pCR和OS之间的相关关联27进一步的证据证实,在试验水平上缺乏pCR的替代28这对pCR作为“关键”新辅助试验的主要终点的作用提出了质疑。替代终点只有在经过充分验证并因此能够准确预测药物随时间的影响时,才应被接受为支持药物批准的证据。新辅助试验的作用也随着时间的推移而发生变化,特别是随着前基因组时代向后基因组时代的过渡。
进入后基因组时代
人类基因组计划29它对整个人类基因组进行测序的努力是临床研究的一个里程碑,标志着所谓的前基因组时代的结束和后基因组时代的开始。DNA、RNA和蛋白质序列数据的分析现在是生物医学研究的重要组成部分30..
在乳腺癌方面,这些成就已经转化为一种思考新辅助临床试验的新方式。前基因组时代新辅助试验探索的关键问题主要集中在识别活性药物并预测其成功的可能性或微调其给药时间表。在这种背景下进行的开创性研究导致了当今临床实践中的里程碑,例如在以蒽环类药物为基础的方案中使用多西他赛,而不是单独使用以蒽环类药物为基础的化疗31,每周给予紫杉醇,而不是3周32以及辅助芳香化酶抑制剂相对于他莫西芬的优越性33,34.
所有这些研究都是在新辅助研究环境下进行的,具有被认为是“产生假设”的特点,随后在大型辅助研究中获得了验证性结果(表2)2).前基因组时代的新辅助试验有其优点,因为它们解决了重要的临床问题;然而,许多这些试验的特点是在寻找预测性生物标志物方面的结果令人失望,并且最终未能识别出有效的反应生物标志物,从而有可能使紫杉烷治疗成为可能35,36或者芳香化酶抑制剂33,37.
后基因组时代的新佐剂试验在确定佐剂环境中值得进一步研究的新活性药物方面发挥着重要作用。这种作用的一个例子是帕妥珠单抗和曲妥珠单抗对HER2的双重抑制,这是第一个获得FDA加速批准的治疗,仅基于pCR结果,从相对较小的(n新辅助研究(NeoSphere)38.这种方法的有效性后来在一个更大的队列中得到证实(n= 4805)的辅助治疗(APHINITY)21最终于2017年12月获得全面批准,可在两种情况下使用。我们相信KEYNOTE-522试验标志着新辅助试验历史上一个新时代的开始:这次大规模的(n= 1174),基于其两个共同主要终点pCR和EFS的显著改善,III期研究于2021年7月批准了新辅助疗法派姆单抗联合化疗用于高危早期三阴性乳腺癌(TNBC)患者39,40.一个重要的教训是:pCR改善本身并不是生存的可靠替代品,应该得到生存终点的支持,以获得监管机构的批准。除了识别新活性药物的重要作用外,后基因组时代的新辅助试验还优先考虑了另一个相关目标:疾病生物学的深层解剖和寻找临床有用的反应分子标记。
生物标志物和疾病生物学
hr阳性,her2阴性乳腺癌
自20世纪80年代末以来,一个强有力的临床前理论支持了这样一种假设,即短期的术前内分泌治疗可以改善hr阳性早期乳腺癌的预后41.然而,这种治疗后预测患者预后的最佳终点的选择一直是一个激烈的学术争论的话题。数据来自两个小型新辅助研究IMPACT42和Z1031(参考。43)的研究表明,在开始新辅助内分泌治疗后2-4周评估核蛋白Ki67水平,可能比基线Ki67水平更好地预测患者结局。在诗的审判中44研究人员对4480名hr阳性、her2阴性的绝经后早期乳腺癌患者进行了随机分组,在术前14天接受芳香化酶抑制剂或安慰剂治疗。按照当地的标准做法,允许辅助治疗。诗性试验未能显示治疗结果有任何显著差异;然而,重要的是,基线时Ki67水平低(<10%)和/或治疗2周后的患者与2周时Ki67水平高的患者相比,疾病复发的风险显著降低44这表明Ki67水平的“动态”测量可以帮助选择可能不需要进一步治疗升级的患者(那些表现出大量Ki67抑制的患者)。对于没有Ki67反应的患者,目前的升级治疗(如化疗)并没有提供强有力的获益证据;例如,Z1031试验显示,对短期新辅助内分泌治疗无Ki67应答但随后接受化疗的患者的pCR没有改善43.有趣的是,针对hr阳性、her2阴性疾病患者的WSG-ADAPT磨合试验45证实,结合静态(基因组复发评分)和动态(诱导后Ki67水平≤10%定义为内分泌增殖反应)生物标志物的评估是可行的,可以指导早期乳腺癌患者的个体化治疗决策。不幸的是,在启动几项研究在内分泌治疗中添加CDK4/6抑制剂(即PALLAS)的大型辅助试验时,这些结果还没有得到46和MonarchE47,其中只有后者有积极的结果,尽管在定义为高疾病负担而不是对内分泌治疗不够敏感的患者人群中。
在hr阳性、her2阴性的早期乳腺癌患者的新辅助治疗中,也探索了在内分泌治疗中添加CDK4/6抑制剂。这些试验揭示了低pCR率(0-5%),但也表明CDK4/6抑制剂诱导了Ki67水平从基线到2周和手术的更大幅度降低48,49,50,51,52,53.
除了Ki67水平外,术前内分泌预后指数(PEPI)评分是另一个选择患者作为治疗升级候选人的工具。PEPI评分是通过将病理肿瘤和淋巴结分期、Ki67水平和新辅助内分泌治疗后ER状态相对应的部分评分相加确定的,在IMPACT试验中已被证明可以预测无复发生存期54.在ALTERNATE研究中55,56,患有局部晚期腔内乳腺癌的妇女被随机分配接受阿那曲唑、氟维司坦或两者的联合治疗;主要终点为内分泌敏感性疾病率,定义为开始新辅助内分泌治疗的所有符合条件的患者中PEPI评分为0的患者的比例。值得注意的是,如果患者的2周Ki67水平在内分泌治疗后没有从基线水平下降,则从随机分组中移除。与阿那曲唑单用相比,氟维司坦或氟维司坦联合阿那曲唑均未显著改善内分泌敏感性疾病发病率56.无复发生存数据仍不成熟。
寻找可能使接受内分泌治疗的患者安全地避免化疗的基因表达特征是另一个研究热点。由于更广泛地使用筛查,改变了乳腺癌的流行病学,降低风险的问题变得至关重要。疾病复发的风险现在可以通过转录组特征来表征,其中两个(Oncotype-DX和MammaPrint)已被证明在选择仅辅助内分泌治疗效果良好的患者方面具有临床应用价值57,58,59.
内在肿瘤亚型也正在作为一种潜在的预测生物标志物进行研究。在对来自MONALEESA III期研究的腔腔转移性乳腺癌患者数据的回顾性探索性分析中,除基底样亚型外,所有PAM50固有亚型均与在内分泌治疗中添加核昔利后一致的OS获益相关60.目前还没有来自早期疾病患者的类似数据。
在质疑ER积极性的最佳定义时,还存在进一步的复杂性。尽管免疫组化染色ER阳性的细胞中有1%被认为是ER阳性乳腺癌的官方分界点,但10%的分界点通常用于指导临床决策,这得到了文献报告的支持,这些文献报告表明,ER表达1-9%的肿瘤(所谓的ER低肿瘤)与ER阴性肿瘤(<1%)具有相似的临床特征。61.
her2阳性乳腺癌
15-20%的乳腺癌具有与HER2过表达相关的侵袭性临床过程,这一发现标志着一个稳步进展时代的开始,在早期疾病环境中注册了四种HER2靶向治疗62.基于对HER2信号通路和HER2靶向治疗作用机制的日益了解,转化研究工作的重点是识别与HER2本身直接相关的反应的预测性生物标志物(如与HER2的比值)ERBB2通过FISH、多聚体、mRNA和蛋白质表达确定CEP17的复制数),并超越HER2,即评估其他受体和/或配体(如HER3、EGFR、EGF、IGFR), HER2下游信号通路(如PIK3CA/PTEN或RhoA),与肿瘤基质相关的特征(如肿瘤浸润淋巴细胞(TILs)或免疫相关基因标记),以及其他患者特异性变量(如HER2和/或Fcγ受体多态性的存在)。不幸的是,到目前为止,这些假定的生物标志物都没有达到临床应用62尽管有些已经产生了早期有希望的结果,例如在WSG-ADAPT试验中63,64.
基于肿瘤固有亚型的分层是另一个有吸引力的策略,可以纳入患者治疗升级或降级的选择。基于pam50的her2富集固有亚型与新辅助治疗后发生pCR的可能性较高相关65结合传统的临床、病理和分子特征来更好地预测早期her2阳性乳腺癌患者临床结果的工具目前正在开发中66.
DECRESCENDO (NCT04675827)是一种正在进行的单臂前瞻性试验,用于测试her2阳性、hr阴性和淋巴结阴性早期乳腺癌患者的化疗降级。在新辅助紫杉烷为基础的化疗和双重HER2阻断后,有pCR的患者将接受额外的14个周期的辅助帕妥珠单抗+曲妥珠单抗,但不再进一步化疗。这种方法基于这样的假设,即her2富集亚型(约占试验人群的65-70%)具有“her2成瘾”肿瘤,因此是蒽环素遗漏的良好候选者。尽管如此,为了达到本试验的主要终点,必须在这个分子定义的亚人群中证明至少94%的3年侵入性无复发生存率。
三阴性乳腺癌
TNBC传统上被认为是一种“无靶点”的乳腺癌亚型,长期以来化疗一直是唯一有效的治疗策略67.然而,过去几十年临床研究的进展已经改变了TNBC的治疗前景,无论是在化疗选择方面(如在新辅助治疗环境中引入剂量密集方案和铂基疗法),还是在目前可用于该肿瘤类型患者的其他疗法方面,包括PARP抑制剂、免疫检查点抑制剂和抗体药物偶联物。特别是免疫检查点抑制剂,已经彻底改变了几种癌症类型的治疗和临床轨迹,相关的努力正在确定反应的预测性生物标志物,包括在乳腺癌中。PD-L1 (ref。68),尖68,高肿瘤突变负担(通常≥10个突变每兆酶)69,错配修复缺陷70,免疫基因签名71和固有的分子亚型71正在研究中,但是,到目前为止,还没有生物标志物被证明在预测早期TNBC对免疫检查点抑制剂的反应中具有明确的作用。进一步的复杂性来自于几种不同的诊断分析、评分算法、样本间和样本内的异质性以及评估部位的差异(转移性与原发病变)。72.此外,除了肿瘤特征之外,还有一些其他因素可能会影响接受免疫检查点抑制剂的患者的预后73,包括患者的一般特征(包括免疫功能)74、肥胖75和/或微生物群76).因此,寻找能够预测早期TNBC患者对免疫检查点抑制剂反应的生物标志物仍然是一个巨大的挑战。
传统上被认为是tnbc的一部分肿瘤符合所谓的HER2低类别的定义(即HER2免疫组化评分为1+或2+,FISH检测不到扩增的肿瘤)。77.到目前为止,强有力的证据支持在这些患者中使用her2靶向抗体药物偶联曲妥珠单抗78,因此强调,这三种乳腺癌亚型之间的传统区分可能过于简单,在某些情况下没有帮助,因为HER2和激素受体的表达水平不是二元的,而是一个连续的表达谱,这本质上限制了大多数分类尝试。
是时候重新考虑试验设计了?
改进新辅助试验的终点
为治疗严重疾病且医疗需求未得到满足的药物建立加速审批途径可追溯到20世纪90年代初,明确提出了为了患者的最大利益而加快整个审批过程的需要79,80.这种途径通常依赖于一个或多个替代终点的改善,以提供早期的疗效指示。然而,关于代理端点如何以及何时可以真正被认为是“有效的”,存在相当多的学术争论。根据某些国际准则81,82在美国,无论是在研究水平还是在个体患者水平,替代品验证都应基于与生存终点的强大相关性。
如前所述,在研究水平上,pCR仅与OS微弱相关28,从而质疑pCR作为有效替代终点的作用。此外,当用于评估非化疗药物的疗效时,pCR似乎失去了一些预后能力。这一限制适用于免疫检查点抑制剂。例如,GeparNUEVO研究69,83是一项随机II期研究,测试了在早期TNBC患者的新辅助化疗中添加durvalumab。pCR率未见明显改善69;然而,在中位随访时间为43.7个月后,durvalumab与生存结局的显著改善相关(3年OS 95.1% vs 83.1%,危险比0.26,95% CI 0.09-0.79;P= 0.0076)83.这一观察结果可能反映了免疫检查点抑制剂与细胞毒性药物具有不同的作用机制,并且通过激活针对癌细胞的免疫反应而不是直接对癌细胞起作用,它们能够产生更持久的反应,在某些情况下,延迟反应84,85,86.此外,pCR也可能不是评估新辅助内分泌治疗反应的最佳终点。与其他乳腺癌亚型相比,hr阳性、her2阴性肿瘤的特点是pCR率低于新辅助治疗,简单区分pCR与非pCR可能没有什么用,因为很少有患者达到pCR。与其他乳腺癌亚型相比,hr阳性、her2阴性肿瘤的传统特征是pCR率低于新辅助治疗87.因此,pCR和非pCR之间的两分法可能是一个过于简单和不准确的患者预后指标,而残留疾病的程度可以提供重要的额外信息。
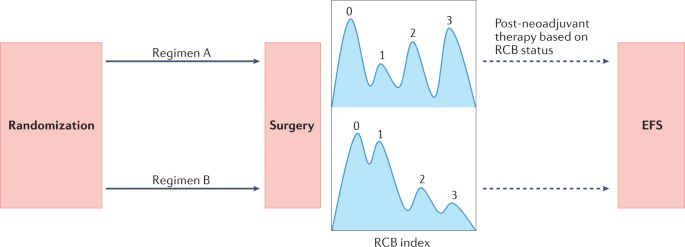
pCR的问题证明了对残留癌症负担(RCB)的重新关注。RCB是一个基于原发肿瘤(尺寸和细胞比例)和淋巴结转移(数量和大小)的病理测量评估的连续指标。根据这些参数,RCB指数可分为四类:RCB 0 (pCR), RCB 1, RCB 2和RCB 3(图。1).在所有乳腺癌亚型(hr阳性和her2阴性、her2阳性和TNBC)中,RCB与长期结果之间的关联已被证实独立于其他临床和/或病理特征88.在涉及早期乳腺癌患者的新辅助试验中,RCB指数的评估应越来越多地被采用为临床终点。
关于生存终点的作用,目前存在着相当多的争论。在FDA 2018年发布的监管审批替代终点清单中,除了pCR, DFS、EFS、客观缓解率和PFS都是允许的89.这种方法最初的理由是希望加快审批过程,因为与OS相比,基于这些终点进行评估所需的时间更短,从而使医疗需求未得到满足的患者能够更早地获得可能有效的药物。然而,这些代理端点与OS之间的关联的强度并没有很好的记录。2020年,Gyawali等人探索了这些替代终点的潜在证据90,表明存在相当大的可变性,并且在某些情况下,与OS的关联要么很弱,要么不存在。
随着过去几年癌症药物成本的指数级增长,根据此类药物的实际附加值商定一个“优先级”清单是合理的回应。随着ASCO价值框架的发展,ASCO已经进行了这项急需但困难的工作91ESMO临床效益量表(MCBS)的开发92其对OS和/或生活质量的改善的重视远远超过ORR的改善或PFS的延长。有趣的是,DFS一直是激烈辩论的主题,导致了一个合理的共识:多活几个月或几年而没有发现疾病,比多活一些时间而疾病稳定,无进展性;因此,在操作系统数据可用之前,足够量级的中位数DFS的改善被认为是ESMO-MCBS的高分,在这一点上,缺乏操作系统的好处会导致一分降级(ESMO-MCBS 2.0版即将发布)93).尽管该比额表不包括“成本”维度,但它的应用可能有助于卫生当局优先考虑更需要财政投资的药物。
新辅助治疗后的场景:一个有希望的场景越来越受欢迎
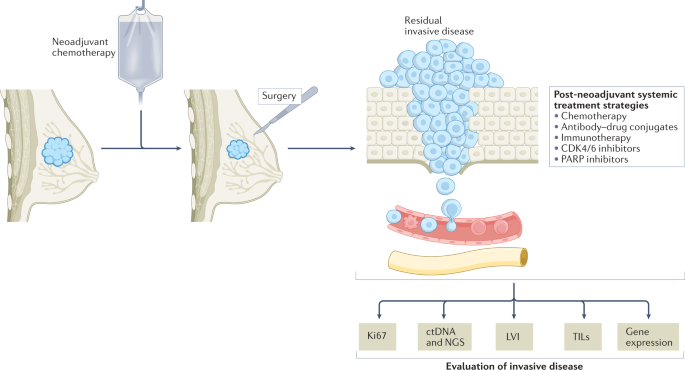
新辅助治疗方法提供的几个优点之一是可以根据患者对新辅助治疗的反应来选择他们的治疗升级或降级。尽管有不完善的替代,但在完成新辅助治疗后,没有pCR的患者通常比有pCR的患者有更差的长期生存结局27.因此,新辅助治疗后的环境是设计关键临床试验的一个有吸引力的场景,因为它涉及到在手术中选择高危残留侵袭性疾病的患者,这些患者可能是治疗升级的候选人。此外,与传统的辅助治疗相比,这种试验不太可能纳入已经通过标准治疗治愈的患者(图2)。2).基于CREATE-X试验的结果,两种用于手术中残留侵袭性疾病患者的全身新辅助治疗已经被批准用于临床实践:卡培他滨用于TNBC患者94,以及针对her2阳性疾病患者的曲妥珠单抗emtansine (T-DM1),基于KATHERINE的结果95.
在CREATE-X试验中,910例早期her2阴性(hr阳性或hr阴性)乳腺癌患者和新辅助化疗完成后残留疾病的患者被随机分配到卡培他滨6-8个周期或不治疗组。在整个人群中,新辅助治疗后卡培他滨可显著改善侵袭性DFS(风险比0.70,95% CI 0.53-0.92;P= 0.01)和OS(风险比0.59,95% CI 0.39-0.90;P= 0.01), TNBC亚组获益幅度更大(n(有创性DFS的风险比为0.58,95% CI 0.39-0.87, OS的风险比为0.52,95% CI 0.30-0.90)94.在KATHERINE试验中,1486例早期her2阳性乳腺癌患者在接受新辅助化疗和her2靶向治疗后,被随机分配接受T-DM1或曲妥珠单抗14个周期。T-DM1与侵袭性DFS的显著改善相关(危险比0.50,95% CI 0.39-0.64)95.
2021年,另一项研究奥林匹亚96,显示3年侵入性DFS显著改善(85.9% vs 77.1%,危险比0.58,99.5% CI 0.41-0.82;P< 0.001)和OS (59 vs 86事件,风险比0.68,99% CI 0.44-1.05;P= 0.02)BRCA-突变,her2阴性的早期乳腺癌,包括以前在新辅助治疗环境中治疗过的患者和在手术中出现残留疾病的患者。
新辅助治疗后的另一个吸引人的特点是可以对残留疾病进行转化分析,从而相应地调整术后全身治疗(图2)。2).换句话说,对残留疾病的评估可以揭示潜在的生物标志物(如Ki67、TILs、RCB和/或基因表达和遗传改变的变化),用于风险评估,并使后续量身定制的治疗能够进一步微调。
新辅助治疗后的设置也有几个有前景的治疗降级方案。最重要的考虑是对于没有残留疾病的患者省略乳房和/或腋窝手术。正在进行的研究正在调查完全缓解的患者在新辅助全身治疗后不进行乳房和/或腋窝手术的情况97,98,其中一些结果令人鼓舞99,One hundred.虽然这种方法目前不被认为是护理标准。
新时代:未来方向
新兴技术的应用,包括基因组学、蛋白质组学、代谢组学、药物遗传学和功能成像,用于开发疗效的预测性生物标志物,正开始塑造早期乳腺癌患者辅助临床试验的新时代。
液体活检
液体活检是一种非侵入性的方法,通过分析血液中存在的循环物质,包括循环肿瘤DNA (ctDNA)和循环肿瘤细胞,获得肿瘤特征信息,从而告知预后101.特别是,过去10年的研究结果支持将ctDNA测序作为一种可行的技术用于早期乳腺癌患者101,102越来越多的新兴数据现在表明它在这种情况下的临床应用103,104.因此,液体活检显示出在成像前预测疾病早期复发的希望103,104,它可能成为研究设计中实施的重要工具,以选择需要额外治疗的患者,并最终指导新辅助治疗后的治疗升级或降级。
正在进行的II期c-TRAK (NCT03145961)试验正在使用ctDNA突变跟踪来检测微小残留疾病,并指导高危早期TNBC患者使用派姆单抗。尽管在2021年圣安东尼奥乳腺癌研讨会上提出了不确定的初步结果,但c-TRAK无疑有潜力提供ctDNA测定初步临床应用的证据,以指导TNBC患者选择性使用全身治疗(即派姆单抗)105.
在2022年ASCO年会上,介绍了ctDNA在高风险hr阳性乳腺癌女性晚期复发(诊断后5年>)检测中的作用的数据106.在83名可评估的患者中,10%的患者通过ctDNA鉴定出微小的残留疾病。在研究随访期内,所有远处疾病复发的患者均检测到ctDNA (n= 5),提前时间(从首次ctDNA阳性样本到临床复发的时间)高达37.6个月(中位数为12.4个月)106,107.还需要进一步的研究结果来确定ctDNA检测后立即进行治疗干预是否能改善这些患者的临床结果(如ASPRIA (NCT04434040)、PERSEVERE (NCT04849364)、DARE (NCT04567420)和LEADER (NCT03285412))。
功能成像
早期的变化18f标记氟脱氧葡萄糖(18在几项涉及早期乳腺癌患者的试验中,新辅助治疗期间PET-CT观察到的FDG摄取与pCR的存在或不存在相关108,109.不幸的是,这些研究都没有探讨在新辅助治疗2-3个周期后使用次优标准化摄取值(SUVs)来调整治疗方案从而改善结果的可行性。临床应用降压治疗对患者有极好的疗效18FDG-PET似乎更有希望。
TBCRC026是一项II期试验,旨在研究两者之间的相关性18在er阴性、her2阳性的早期乳腺癌患者中,fgd - pet SUV校正了瘦体重(SULmax)和新辅助帕妥珠单抗+曲妥珠单抗(无化疗)的pCR率110.主要目的是证明在基线和新辅助治疗开始后15天评估的早期SULmax变化与pCR之间的相关性。根据预定义的统计边界,该研究的主要目标没有达到,尽管发现早期SULmax的变化可以预测pCR的可能性,因此提供了一个有希望的策略来指导基于早期功能成像结果的新辅助治疗的降级110肿瘤患者似乎对her2靶向治疗高度敏感。
PHERGain111(NCT03161353)是一项随机II期研究,旨在评估新辅助曲妥珠单抗+帕妥珠单抗的早期代谢反应18正子。在PHERGain,18FDG-PET用于识别HER2阳性乳腺癌患者,这些患者更有可能受益于新辅助双HER2抑制,无需化疗。有趣的是,在初步分析中,18FDG-PET应答者(定义为两个周期治疗后最大SUV减少至少40%)的pCR率为37.9% (95% CI 31.6-44.5;P与历史汇率相比< 0.0001)111.生存终点(DFS)的随访正在进行中,最终将提供关于选择可能能够避免化疗的患者的可能性的数据。
空间转录组学和单细胞RNA测序
人体的所有器官,包括乳房组织,都是由功能严格相互关联的不同细胞亚群组成的。通过描述每个单个细胞的转录组,单细胞RNA测序可以识别同一组织中不同的细胞亚群。然而,这些信息是通过分离细胞获得的,因此破坏了有关细胞在组织中的空间定位的信息。空间信息对于理解不同细胞之间的相互联系至关重要。因此,越来越多的努力正在合并来自单细胞RNA测序的信息与空间转录组学112.这些数据的整合可以进一步帮助识别恶性和非恶性乳腺组织之间的异同,而且还可以解剖肿瘤间和肿瘤内的异质性。
集成与协作
临床和转化早期乳腺癌研究仍然高度分散,尽管存在一些独特的倡议,如1985年开始的EBCTCG, 1999年成立的乳房国际小组和2014年启动的国家临床试验网络(前身为北美乳腺癌小组)。
生物标志物发现和验证的过程可能需要获得与临床结果相关的大量注释良好的“候选生物标志物”databases;然而,任何临床试验本身都无法实现这样的目标。基于这一原因和其他原因,国际医学期刊编辑委员会在2016年发表了一项重要声明,即分享介入临床试验的数据是一项道德义务113.现在是时候更进一步了:在一段保护时间后,使赞助商能够利用其知识产权,在充分的质量控制程序下,在试验中收集的生物标记物数据应该向更广泛的科学界免费提供。与这一过程相关的成本将不可忽略,但将远远低于与数以千计的额外和日益复杂的独立转化研究相关的成本。此外,在未来的试验设计中,寻求患者倡导者发挥越来越积极的作用,这既是学术研究的基本组成部分,也是对行业主导的研究的“平衡”114,115.
临床试验的未来前景
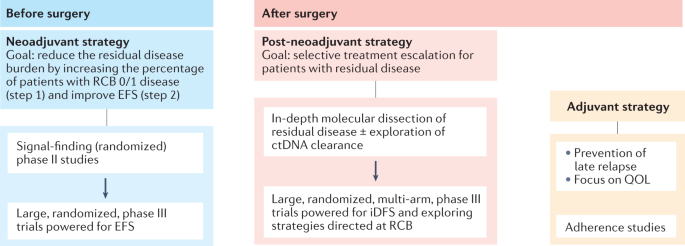
新辅助和后新辅助试验预计在评估早期乳腺癌患者的全身治疗中发挥越来越大的作用(图2)。3.).尽管如此,仍需要在试验设计和实施方面进行一些方法上的改进。那些设计新辅助策略的人应该致力于实现与生存结果更紧密相关的终点,到目前为止,考虑到RCB提供的残余疾病程度的更高粒度评估,RCB是替代pCR的最佳候选。为了优化资源,提高效率,并将患者暴露于次优或有时有毒的治疗的风险降至最低,新辅助试验应首先关注“信号寻找”,随机,涉及有限数量患者的II期设计。这些研究的结果随后可以在更大的队列、随机III期研究中得到证实,这些研究旨在证明EFS的改善。在这方面,美国倡议I-SPY (NCT01042379)多年前就采用了这一策略,在早期乳腺癌患者中测试新辅助剂和个性化适应性新药,以确定哪些新药对特定乳腺癌亚型最有效,并确定治疗成功的早期预测因素。在登记时,每个新患者都包含在十个特定分子亚型中的一个;然后,I-SPY 2随机化引擎将每个参与者分配到一个研究组,对已被证明在特定肿瘤亚型中更成功的治疗给予更多的权重。当一种实验药剂的预测概率达到预先指定的有效或无效水平时,要么宣布治疗成功,要么停止给药。毫不奇怪,RCB 0(意味着pCR)被选为主要终点,因为它可以快速周转,从而快速评估新药。 However, this design also probably explains, for reasons outlined previously, the relatively limited number of drugs declared as being ‘successful’ that have ultimately entered clinical practice in patients with early-stage disease.
新辅助试验越来越多地采用残留癌症负担(RCB)作为生存的替代终点,并应以大(n= ~ 1000 - 1500),随机,为生存终点提供足够的动力(如无事件生存;EFS),并在成功的第二阶段“信号发现”研究之后设计。目前对此类试验的兴趣正在增加,特别是那些旨在识别手术中残留疾病的患者,这些患者可能受益于基于残留侵袭性疾病的深入分子解剖和/或循环肿瘤DNA (ctDNA)检测探索的治疗升级策略。对传统辅助策略(没有新辅助治疗)的兴趣可能会下降,尽管这些研究仍然与生活质量(QOL)结果的评估、对研究治疗的坚持和探索旨在降低晚期复发风险(> 5-10年)的“延迟策略”相关,特别是在激素受体阳性疾病患者中。iDFS,侵入性无病生存。
由于新辅助治疗完成后残余疾病患者的治疗升级的可能性,新辅助治疗后的设置可能会进一步普及。对残留疾病进行深入的分子解剖,无论有无系统的ctDNA检测筛查,都将有助于设计大队列、随机、多组、III期试验,以证明侵入性DFS的潜在改善。纯辅助治疗(即,手术后不根据对先前治疗的反应进行患者选择的全身治疗)预计将发挥更边际的作用,专注于提高治疗依从性和/或生活质量的方法,尽管这种方法将继续对研究旨在解决hr阳性疾病患者肿瘤休眠和/或晚期疾病复发问题的“延迟”治疗策略非常重要。
结论
乳腺癌研究人员在两个方面为加强合作铺平了道路:对已完成试验的患者个人数据进行汇总分析,并减少设计和实施过程中的重复工作。经过20年的大量研究,小队列新辅助试验被认为是昂贵和高风险的辅助试验的理想替代品,大队列被低风险疾病患者“污染”,对pCR作为DFS替代终点的局限性的更好理解正在出现。这一观察结果促使人们愿意改进新辅助治疗试验的设计,同时人们对利用新辅助治疗后的环境作为改善高危患者预后的一种方式越来越感兴趣。尽管如此,这种新方法最薄弱的方面仍然是生物标志物研究,以改进治疗方法:更强大和更昂贵的技术正在出现,能够更详细地解剖肿瘤的生物学及其微环境;然而,在中等队列规模的试验中使用它们不太可能提供支持临床效用的数据。加速、负责任和用户友好的生物标志物和临床数据共享过程必须成为下一代试验的高度优先事项。
参考文献
Siegel, R. L., Miller, K. D., Fuchs, H. E. & Jemal, A.癌症统计,2022。CA Cancer J. Clin。72, 7-33(2022)。
Yabroff, K. R.等人。COVID-19大流行与全州癌症服务模式的关联。国立肿瘤研究所。114, 907-909(2021)。
史密斯,b.d.等人。随着时间的推移,乳腺癌预后的改善:老年女性错过了吗?j .中国。肿瘤防治杂志。29, 4647-4653(2011)。
乳腺癌:起源和进化。j .中国。投资。117, 3155-3163(2007)。
Bonadonna, G.等。联合化疗在可手术乳腺癌中的辅助治疗。心血管病。j .地中海。294, 405-410(1976)。
早期乳腺癌试验协作组(EBCTCG)等。早期乳腺癌不同多化疗方案的比较:123项随机试验中100,000名女性长期结果的荟萃分析《柳叶刀》379, 432-444(2012)。
Fisher, B.等。1-苯丙氨酸芥末(L-PAM)在原发性乳腺癌的治疗中的作用。早期调查结果报告。心血管病。j .地中海。292, 117-122(1975)。
Fisher, B., Redmond, C., Fisher, E. R. & Wolmark, N.治疗原发性可手术乳腺癌的全身辅助治疗:国家手术辅助乳腺和肠道项目经验。NCI Monogr。1, 35-43(1986)。
早期乳腺癌试验者合作小组。通过激素、细胞毒素或免疫疗法对早期乳腺癌进行全身治疗。133项随机试验,涉及75000名妇女中的31000例复发和24000例死亡。《柳叶刀》339, 71-85(1992)。
没有列出作者。他莫昔芬辅助治疗早期乳腺癌的对照试验。Nolvadex辅助试验组织四年中期分析。《柳叶刀》1, 257-261(1983)。
Nolvadex &辅助试验组织。他莫昔芬作为单一辅助剂治疗早期乳腺癌的对照试验。Br。j .癌症57, 608-611(1988)。
Fisher, B.等人。化疗和他莫西芬治疗原发性乳腺癌。心血管病。j .地中海。305, 1-6(1981)。
Piccart-Gebhart, m.j.等人。her2阳性乳腺癌辅助化疗后曲妥珠单抗治疗。心血管病。j .地中海。353, 1659-1672(2005)。
her2阳性早期乳腺癌辅助化疗后曲妥珠单抗的11年随访:赫赛汀辅助(HERA)试验的最终分析。《柳叶刀》389, 1195-1205(2017)。
布拉德利,R.等人。曲妥珠单抗治疗早期her2阳性乳腺癌:7项随机试验中13864名女性的荟萃分析。柳叶刀杂志。22, 1139-1150(2021)。
早期乳腺癌试验者合作小组(EBCTCG)。芳香化酶抑制剂与他莫昔芬在早期乳腺癌中的比较:随机试验的患者水平荟萃分析。《柳叶刀》386, 1341-1352(2015)。
Piccart, M.等。APHINITY试验中早期her2阳性乳腺癌的辅助帕妥珠单抗和曲妥珠单抗:6年随访j .中国。肿瘤防治杂志。39, 1448-1457(2021)。
科尔曼,R.等。早期乳腺癌的辅助治疗denosumab (D-CARE):一项国际、多中心、随机、对照、3期试验。柳叶刀杂志。21, 60-72(2020)。
卡梅隆等人。含贝伐单抗的辅助治疗三阴性乳腺癌(BEATRICE):一项随机3期试验的初步结果。柳叶刀杂志。14, 933-942(2013)。
Piccart-Gebhart, M.等人。辅助拉帕替尼和曲妥珠单抗治疗早期人表皮生长因子受体2阳性乳腺癌:来自随机III期辅助拉帕替尼和/或曲妥珠单抗治疗优化试验的结果j .中国。肿瘤防治杂志。34, 1034-1042(2016)。
冯·明克维茨,G.等。早期her2阳性乳腺癌的辅助帕妥珠单抗和曲妥珠单抗。心血管病。j .地中海。377, 122-131(2017)。
霍姆斯,E. M.等人。我们的统计假设是否太多了?从ALTTO试验中吸取的教训。安。肿瘤防治杂志。30., 1507-1513(2019)。
Ragaz, J.等人。乳腺癌术前辅助化疗(新辅助化疗):基本原理和安全性报告。最近。癌症研究结果。98, 99-105(1985)。
Wolmark, N., Wang, J., Mamounas, E., Bryant, J. & Fisher, B.可手术乳腺癌患者的术前化疗:国家手术辅助乳腺和肠道项目B-18的9年结果。J.自然肿瘤研究所。https://doi.org/10.1093/oxfordjournals.jncimonographs.a003469(2001)。
Fumagalli, D.等。新辅助乳腺癌临床试验的共同语言:标准定义和终点的建议。柳叶刀杂志。13, e240-e248(2012)。
食品及药物管理局。高危早期乳腺癌新辅助治疗的病理完全缓解:作为支持加速批准的终点。https://www.fda.gov/drugs/guidance-compliance-regulatory-information/guidances-drugs(2022)。
Cortazar, P.等人。乳腺癌病理完全缓解和长期临床获益:CTNeoBC汇总分析。《柳叶刀》384, 164-172(2014)。
Conforti, F.等人。早期乳腺癌新辅助随机临床试验病理完全缓解作为替代终点的评价:系统回顾和荟萃分析。BMJ375, e066381(2021)。
柯林斯,F. S.,摩根,M.和帕特里诺斯,A.人类基因组计划:大规模生物学的教训。科学300, 286-290(2003)。
梅斯特,S. M.纳鲁斯,S. P. &米切尔,J. A. In:临床研究信息学(里奇森,R. L. &安德鲁斯,J. E.)。113 - 131。(施普林格,2012)。
嗨,s.d.等人。新辅助治疗乳腺癌的多西他赛:阿伯丁试验的3年生存结果。中国。乳腺癌3., s69-s74(2002)。
格林,m.c.等。与每3周一次紫杉醇相比,每周紫杉醇可改善可手术乳腺癌的病理完全缓解。j .中国。肿瘤防治杂志。23, 5983-5992(2005)。
埃利斯,m.j.等人。对于ErbB-1阳性和/或erbb -2阳性、雌激素受体阳性的原发性乳腺癌,来曲唑是比他莫昔芬更有效的新辅助内分泌治疗:来自III期随机试验的证据j .中国。肿瘤防治杂志。19, 3808-3816(2001)。
多塞特等人。用阿那曲唑或他莫昔芬单独或联合新辅助治疗原发性乳腺癌期间Ki-67的短期变化与无复发生存相关。中国。癌症Res。11, 951 - 958s(2009)。
Pusztai, L.等人。在NSABP-B 28随机临床试验中,微管相关蛋白- tau表达作为预后和预测标志物的评价j .中国。肿瘤防治杂志。27, 4287-4292(2009)。
Bonneau, C., Gurard-Levin, Z. A., Andre, F., Pusztai, L. & Rouzier, R. tau蛋白在乳腺癌中的预测和预后价值。抗癌。Res。35, 5179-5184(2015)。
巴特利特,j.m.s.等。HER2状态预测前期人工智能获益:来自ATAC、BIG 1-98和TEAM的12129例HER2集中检测患者的TRANS-AIOG荟萃分析。欧元。j .癌症79, 129-138(2017)。
詹尼,L.等人。新辅助用药帕妥珠单抗和曲妥珠单抗治疗局部晚期、炎症性或早期her2阳性乳腺癌的有效性和安全性(NeoSphere):一项随机多中心、开放标签的2期临床试验柳叶刀杂志。13, 25-32(2012)。
Schmid, P.等人。派姆单抗用于早期三阴性乳腺癌。心血管病。j .地中海。382, 810-821(2020)。
Schmid, P.等人。派姆单抗治疗早期三阴性乳腺癌的无事件生存率。心血管病。j .地中海。386, 556-567(2022)。
Fisher, B., Saffer, E., Rudock, C., Coyle, J. & Gunduz, N.原发肿瘤切除前局部或全身治疗对小鼠血清生长刺激因子产生和反应的影响。癌症Res。49, 2002-2004(1989)。
史密斯,i.e.等人。阿那曲唑、他莫昔芬或两者联合治疗绝经后乳腺癌的新辅助治疗:立即术前阿那曲唑、他莫昔芬或联合他莫昔芬(IMPACT)多中心双盲随机试验。j .中国。肿瘤防治杂志。23, 5108-5116(2005)。
埃利斯,m.j.等人。Ki67增殖指数作为乳腺癌新辅助芳香化酶抑制剂治疗期间和之后化疗决策的工具:来自美国外科医生学会肿瘤组Z1031试验(联盟)的结果。j .中国。肿瘤防治杂志。35, 1061-1069(2017)。
史密斯等人。Ki67在绝经后妇女激素敏感性早期乳腺癌(POETIC)围手术期内分泌治疗后的长期结果和预后价值:一项开放标签、多中心、平行组、随机、3期试验柳叶刀杂志。21, 1443-1454(2020)。
尼茨,你等人。前瞻性WSG-ADAPT HR+/HER2-试验的磨合阶段证明了结合静态和动态生物标志物评估的研究设计在早期乳腺癌个体化治疗中的可行性。其他。Oncol医生。12, 1758835920973130(2020)。
Gnant, M.等。palbociclib辅助治疗早期乳腺癌:PALLAS试验结果(ABCSG-42/AFT-05/BIG-14-03)。j .中国。肿瘤防治杂志。40, 282-293(2022)。
庄士敦,s.r.d.等。Abemaciclib联合内分泌治疗辅助治疗HR+、HER2-、淋巴结阳性、高危、早期乳腺癌(君主型)。j .中国。肿瘤防治杂志。38, 3987-3998(2020)。
Cottu, P.等人。来曲唑和帕博昔利与化疗作为高风险腔内乳腺癌新辅助治疗的比较。安。肿瘤防治杂志。29, 2334-2340(2018)。
约翰斯顿等人。评估帕博西利联合来曲唑作为雌激素受体阳性早期乳腺癌新辅助治疗的随机II期研究:托盘试验j .中国。肿瘤防治杂志。37, 178-189(2019)。
马,C. X.等。NeoPalAna:新辅助疗法palbociclib,一种周期蛋白依赖性激酶4/6抑制剂,以及用于临床2期或3期雌激素受体阳性乳腺癌的阿那曲唑。中国。癌症Res。23, 4055-4065(2017)。
赫尔维茨,s.a.等人。阿贝西库和阿那曲唑在HR II期新辅助研究中对细胞周期的有效抑制和免疫应答的上调+/ HER2−乳腺癌。中国。癌症Res。26, 566-580(2020)。
盛田昭夫,周润发,l·w·C。S。,周润发,C . y . C。Ng W.-K。& Toi, M. ER的新辅助palbociclib+乳腺癌(N007):临床反应和endpredict的价值。Endocr。遗传代数。癌症25, 123-130(2018)。
普拉特,A.等。利博昔利加来曲唑与化疗治疗激素受体阳性、her2阴性、腔内B型乳腺癌绝经后妇女(CORALLEEN):一项开放标签、多中心、随机、2期试验柳叶刀杂志。21, 33-43(2020)。
埃利斯,m.j.等人。基于新辅助内分泌治疗后肿瘤特征的雌激素受体阳性乳腺癌预后预测。国立肿瘤研究所。One hundred., 1380-1388(2008)。
Suman, V. J., Ellis, M. J., Ma, C. X. ALTERNATE试验:评估生物标志物驱动的治疗绝经后妇女ER的策略+/她的2 -浸润性乳腺癌。下巴。中国。肿瘤防治杂志。4, 34(2015)。
马,C. X.等。替代方案:临床II期或III期雌激素受体阳性her2阴性乳腺癌的新辅助内分泌治疗(NET)方法+HER2-BC)在绝经后(PM)妇女中的作用:联盟A011106。j .中国。肿瘤防治杂志。38(增刊15),504(2020)。
Kalinsky, K.等21 .基因检测提示淋巴结阳性乳腺癌的化疗获益。心血管病。j .地中海。385, 2336-2347(2021)。
斯帕拉诺,J. A.等。临床和基因组风险指导乳腺癌辅助治疗的使用。心血管病。j .地中海。380, 2395-2405(2019)。
Piccart, M.等人:70基因标记作为早期乳腺癌治疗决策的辅助:更新的3期随机MINDACT试验结果,并按年龄进行探索性分析。柳叶刀杂志。22, 476-488(2021)。
普拉特,A.等。MONALEESA III期研究中内在亚型和疗效的相关生物标志物分析。j .中国。肿瘤防治杂志。https://doi.org/10.1200/JCO.20.02977(2021)。
Dieci, m.v.等。雌激素受体水平对接受新辅助/辅助化疗的非转移性三阴性乳腺癌患者结局的影响NPJ乳腺癌7, 101(2021)。
Gingras, I., Gebhart, G., de Azambuja, E. & Piccart-Gebhart, M. her2阳性乳腺癌在翻译中丢失了:以患者为中心的研究时间。Nat. Rev. clinin。肿瘤防治杂志。14, 669-681(2017)。
Nitz, U. a等。HER2阳性早期乳腺癌(EBC)的降级策略:WSG-ADAPT HER2的最终分析+/人力资源-II期试验:12周曲妥珠单抗和帕妥珠单抗新辅助双阻断±每周pac的疗效、安全性和预测标志物。安。肿瘤防治杂志。28, 2768-2772(2017)。
Graeser, M. LBA2 -在WSG-HER2+/HR- ADAPT试验中,RNA表达特征和肿瘤浸润淋巴细胞(TILs)对病理完全缓解(pCR)和12周降级新辅助帕妥珠单抗+曲妥珠单抗±紫杉醇的影响。安。肿瘤防治杂志。32(增刊2),S48(2021)。
Schettini, F.等人。her2阳性早期乳腺癌PAM50 her2富集亚型与病理完全缓解:一项荟萃分析。安。肿瘤防治杂志。30., v82(2019)。
普拉特,A.等。指导早期her2阳性乳腺癌全身治疗的多变量预后评分:一项带有外部评估的回顾性研究。柳叶刀杂志。21, 1455-1464(2020)。
Agostinetto, E, Eiger, D, Punie, K. & de Azambuja, E.三阴性乳腺癌患者的新兴治疗方法。咕咕叫。肿瘤防治杂志。代表。23, 57(2021)。
Bianchini, G.等人。肿瘤浸润淋巴细胞(TILs), PD-L1的表达及其在NeoTRIPaPDL1试验中的动态。安。肿瘤防治杂志。31(增刊4),S1145-S1146(2020)。
Loibl, S.等。GeparNuevo研究的临床结果和生物标志物分析:一项随机II期研究调查了durvalumab和基于蒽环类紫杉烷的新辅助治疗早期三阴性乳腺癌。安。肿瘤防治杂志。30., 1279-1288(2019)。
任,X.-Y。et al。错配修复缺陷和微卫星不稳定性在三阴性乳腺癌中:440例患者的回顾性研究前面。肿瘤防治杂志。11, 570623(2021)。
Emens, l.a等。转移性三阴性乳腺癌(mTNBC)的肿瘤微环境(TME)和atezolizumab + nab-紫杉醇(A+nP)活性j .中国。肿瘤防治杂志。39(增刊15),1006(2021)。
Doroshow, d.b.等人。PD-L1作为免疫检查点抑制剂反应的生物标志物。Nat. Rev. clinin。肿瘤防治杂志。18, 345-362(2021)。
阿戈斯蒂内托等人。三阴性乳腺癌患者免疫治疗的进展与缺陷。当今专家。Investig。药物31, 567-591(2022)。
萨瓦斯等人。乳腺癌宿主免疫的临床相关性:从til到临床Nat. Rev. clinin。肿瘤防治杂志。13, 228-241(2016)。
Murphy, W. J. & Longo, D. L.肥胖与癌症免疫治疗疗效之间令人惊讶的正相关。《美国医学会杂志》321, 1247-1248(2019)。
Routy, B.等人。肠道微生物影响pd -1免疫治疗上皮性肿瘤的疗效科学359, 91-97(2018)。
Eiger, D., Agostinetto, E., Saúde-Conde, R. & de Azambuja, E.令人兴奋的低her2乳腺癌治疗新领域。癌症13, 1015(2021)。
莫迪等人。曲妥珠单抗治疗her2-low晚期乳腺癌。心血管病。j .地中海。https://doi.org/10.1056/NEJMoa2203690(2022)。
Lenzer J. & Brownlee, S.监管机构是否应该根据替代终点批准药物?BMJ374, n2059(2021)。
Dawoud, D, Naci, H., Ciani, O. & Bujkiewicz, S.提高在药物监管和卫生技术评估中使用替代终点的标准。BMJ374, n2191(2021)。
谢伟,等。使用元分析对替代终点评价的系统回顾和报告建议。JNCI癌症光谱。3., pkz002(2019)。
没有列出作者。肿瘤替代终点的有效性:快速报告A10-05的执行摘要,1.1版。卫生保健质量和效率研究所:执行摘要(卫生保健质量和效率研究所,2005年)。
Loibl, S.等。Durvalumab改善TNBC的长期预后:来自II期随机GeparNUEVO研究的结果,该研究在早期三阴性乳腺癌(TNBC)中,除了蒽环类/紫杉烷为主的新辅助化疗外,还研究了新疗法Durvalumab。j .中国。肿瘤防治杂志。39(增刊15),506(2021)。
Wolchok, J. D.等。实体瘤免疫治疗活性评价指南:免疫相关反应标准中国。癌症Res。15, 7412-7420(2009)。
Hoos, A.等人。癌症免疫治疗试验终点的改进。国立肿瘤研究所。102, 1388-1397(2010)。
癌症免疫治疗试验终点的演变。安。肿瘤防治杂志。23, viii47-viii52(2012)。
Torrisi, R.等人。激素受体阳性/ her2阴性早期乳腺癌的新辅助化疗:何时,为什么,什么?暴击。启杂志。内科杂志。160, 103280(2021)。
西曼斯,W. F.等人。新辅助化疗后与残留癌负担和乳腺癌亚型相关的长期预后风险j .中国。肿瘤防治杂志。35, 1049-1060(2017)。
食品及药物管理局。作为药品批准或许可基础的替代终点表https://www.fda.gov/drugs/development-resources/table-surrogate-endpoints-were-basis-drug-approval-or-licensure(2022)。
Gyawali, B, Hey, S. P. & Kesselheim, A. S.评估FDA替代终点表中包括的替代措施背后的证据,以支持癌症药物的批准。eClinicalMedicinehttps://doi.org/10.1016/j.eclinm.2020.100332(2020)。
史尼珀,L. E.等。更新美国临床肿瘤学会的价值框架:对收到的评论的修订和反思。j .中国。肿瘤防治杂志。34, 2925-2934(2016)。
Dafni, U.等人。详细统计评估ESMO特征的临床获益量表(ESMO- mcbs)阈值规则。ESMO开放2, e000216(2017)。
沃尔夫,我,等人。esmo级临床效益量表的实施:来自2022年以色列国家报销流程的真实世界示例。ESMO开放7, 100379(2022)。
Masuda, N.等。乳腺癌术前化疗后卡培他滨的辅助治疗。心血管病。j .地中海。376, 2147-2159(2017)。
冯·明克维茨,G.等。曲妥珠单抗治疗残余侵袭性her2阳性乳腺癌。心血管病。j .地中海。380, 617-628(2019)。
塔特,A. N. J.等人。BRCA1或brca2突变乳腺癌患者的辅助奥拉帕尼。心血管病。j .地中海。384, 2394-2405(2021)。
Heil, J.等。新辅助全身治疗后乳腺癌手术模式的消除:目前的证据和未来的挑战。安。肿瘤防治杂志。31, 61-71(2020)。
Pfob, A.等。智能真空辅助活检识别新辅助全身治疗后病理完全缓解(ypT0和ypN0)的乳腺癌患者,以避免乳房和腋下手术。j .中国。肿瘤防治杂志。401903-1915(2022)。
朱利亚诺,A. E.等。腋窝清扫与不进行腋窝清扫对浸润性乳腺癌和前哨淋巴结转移患者10年总生存率的影响:ACOSOG Z0011(联盟)随机临床试验《美国医学会杂志》318, 918-926(2017)。
Donker, M.等。乳腺癌前哨淋巴结阳性后腋窝放疗或手术(EORTC 10981-22023 AMAROS):一项随机、多中心、开放标签、3期非劣等性试验。柳叶刀杂志。15, 1303-1310(2014)。
Ignatiadis, M, Sledge, G. W. & Jeffrey, S. S.液体活检进入临床-实施问题和未来挑战。Nat. Rev. clinin。肿瘤防治杂志。18, 297-312(2021)。
加西亚-穆里拉斯等人。循环肿瘤DNA突变追踪预测早期乳腺癌复发。科学。Transl地中海。7, 302ra133(2015)。
加西亚-穆里拉斯等人。早期乳腺癌分子复发检测的评价。JAMA杂志。5, 1473-1478(2019)。
帕帕康斯坦丁,A.等人。ctDNA检测在接受新辅助治疗的早期乳腺癌患者中的预后价值:一项系统回顾和荟萃分析。癌症治疗。牧师。104, 102362(2022)。
c-TRAK TN试验的主要结果:一项临床试验,利用ctDNA突变跟踪来检测中度和高危早期三阴性乳腺癌患者的微小残留疾病并触发干预。癌症Res。82(增刊4),GS3-06(2021)。
Lipsyc-Sharf, M.等人。循环肿瘤DNA (ctDNA)和高危、激素受体阳性、her2阴性乳腺癌(CHiRP)的晚期复发。j .中国。肿瘤防治杂志。40(增刊16),103(2022)。
Lipsyc-Sharf, M.等人。高危激素受体阳性、人表皮生长因子受体2阴性乳腺癌的循环肿瘤DNA和晚期复发j .中国。肿瘤防治杂志。40, 2408-2419(2022)。
18F-FDG PET/CT用于早期预测her2阳性乳腺癌对拉帕替尼、曲妥珠单抗及其联合治疗的反应:来自Neo-ALTTO的结果。j .诊断。地中海。54, 1862-1868(2013)。
康诺利,r.m.等。TBCRC 008: PET中18F-FDG摄取的早期变化预测了人表皮生长因子受体2阴性的原发性可手术乳腺癌术前全身治疗的反应。j .诊断。地中海。56, 31-37(2015)。
康诺利,r.m.等。TBCRC026的最新结果:乳腺癌患者标准化摄取值与帕妥珠单抗和曲妥珠单抗病理完全缓解的II期试验。j .中国。肿瘤防治杂志。39, 2247-2256(2021)。
Pérez-García, J. M.等。化疗降级使用18基于f - fdg - pet的her2阳性早期乳腺癌患者病理反应适应策略(PHERGain):一项多中心、随机、开放标签、非比较的2期试验。柳叶刀杂志。22, 858-871(2021)。
龙戈,郭明光,季安良,卡瓦里,陈建平。整合单细胞和空间转录组学来阐明细胞间组织动力学。Nat. Rev. Genet。22, 627-644(2021)。
Taichman, D. B.等。共享临床试验数据:来自国际医学期刊编辑委员会的建议。安。实习生。地中海。164, 505-506(2016)。
必不可少的伙伴关系:患者倡导者和合作团体。Semin。肿瘤防治杂志。35, 553-555(2008)。
Katz, m.l.等人。患者倡导者在临床试验中的作用:来自癌症和白血病B组研究者和倡导者的观点。癌症118, 4801-4805(2012)。
斯帕拉诺,J. A.等。E1199 III期临床试验的长期随访,评估紫杉烷和药物在可手术乳腺癌中的作用。j .中国。肿瘤防治杂志。33, 2353-2360(2015)。
Hamy,其子a.s.。et al。根据乳腺癌亚型的剩余癌症负担指数的预后价值:对接受新辅助化疗的BC患者队列的验证。《公共科学图书馆•综合》15, e0234191(2020)。
作者信息
作者及隶属关系
贡献
E.A.和M.P.研究了这篇手稿的数据,J.G.和M.P.讨论了手稿的内容,所有作者在提交前都撰写、审阅和/或编辑了这篇手稿。
相应的作者
道德声明
相互竞争的利益
E.A.曾因担任礼来和山德士的顾问而收取费用或酬金,并因参加礼来、gene、Istituto Gentili、诺华和罗氏的医学会议而获得支持,这些都与提交的工作无关。J.G.曾因担任Daiichi、Eisai、Exact Science、Gilead、Lilly、Merck、Novartis、Onxeo、Pfizer、Roche Genentech和Seattle Genetics的顾问而收取费用或酬金,并在一家接受Eisai、Exact Science和Roche Genentech研究资助的机构工作,这些研究都与提交的工作无关。M.P.曾担任阿斯利康、Camel-IDS/Precirix、Frame Therapeutics、吉利德、Immunomedics、Immutep、礼来、Menarini、MSD、NBE Therapeutics、诺华、Odonate、辉瑞、罗氏基因泰克、Seagen和Seattle Genetics的顾问,并在接受阿斯利康、免疫医学、礼来、Menarini、MSD、诺华、辉瑞、Radius、罗氏基因泰克、Servier和Synthon研究资助的机构工作。都与提交的作品无关。
同行评审
同行评审信息
自然评论临床肿瘤学感谢J. Heil与A. Pfob共同审阅;以及其他匿名审稿人,以表彰他们对这项工作的同行评审所作的贡献。
额外的信息
补充信息
权利和权限
根据与作者或其他权利持有人签订的出版协议,自然或其许可方(例如,社会或其他合作伙伴)对本文拥有排他性权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。
关于本文
引用本文
Agostinetto, E., Gligorov, J. & Piccart, M.早期乳腺癌的系统治疗:从过去中学习,建立未来。Nat Rev clinin Oncol(2022)。https://doi.org/10.1038/s41571-022-00687-1
接受:
发表:
DOI:https://doi.org/10.1038/s41571-022-00687-1