摘要
人类冠状病毒引起广泛的疾病,从轻微的普通感冒到急性呼吸窘迫综合征和死亡。三种高致病性人类冠状病毒——严重急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合征冠状病毒和SARS-CoV-2——已经说明了人类冠状病毒的流行和大流行潜力,为了合理设计治疗方法,迫切需要更好地了解它们的致病机制。对患者的分析显示,在人类冠状病毒感染的严重病例中,免疫系统明显失调,有充分的证据表明,对人类冠状病毒的异常免疫反应的典型表现为干扰素诱导受损、炎症反应强烈和适应性免疫反应延迟。此外,各种病毒蛋白已被证明损害干扰素的诱导和信号传递,并诱导炎症小体激活。这表明,与人类冠状病毒相关的严重疾病是由失调的宿主免疫反应和活跃的病毒干扰介导的。在这里,我们讨论我们目前对这些场景所涉及的机制的理解。
简介
冠状病毒可在人类中引起高致病性疾病,过去二十年发生的三次重大疫情证明了这一点。严重急性呼吸系统综合症(SARS)疫情首次出现在2002年,后来被消灭,但造成了大约8000例病例,死亡率约为10%1.中东呼吸综合征(MERS)疫情仍在持续,主要在中东地区,自2012年首次发现MERS冠状病毒(MERS- cov)以来,已发生2000多例病例和800例死亡(参考文献)。2).目前由SARS冠状病毒2 (SARS- cov -2)引起的COVID-19大流行已导致超过2.42亿例病例,死亡人数超过490万人(截至2021年10月25日(参考文献)。3.))。鉴于不断努力了解这些高致病性冠状病毒,科学家们描述了对这些冠状病毒免疫反应的免疫病理性质。强调这一点,宿主免疫失调已被证明有助于疾病的严重程度,并决定这些感染的疾病结局。然而,大量证据也表明,SARS-CoV、MERS-CoV和SARS-CoV-2编码的病毒蛋白的主动免疫逃避进一步加剧了宿主免疫过程的失调。从这个角度来看,我们总结了目前关于SARS-CoV-2和相关人类冠状病毒感染期间宿主免疫失调的知识。我们还描述和讨论免疫病理宿主反应和机制作用的病毒蛋白在宿主免疫系统的主动操作。
干扰素反应失调
关于干扰素在冠状病毒感染中的作用的相互矛盾的数据
干扰素是一组抗病毒细胞因子,在病毒感染期间被诱导。干扰素的抗病毒功能在很大程度上可以归因于干扰素刺激基因(干扰素刺激基因,ISGs)。ISGs在病毒感染期间被干扰素上调,以执行病毒遏制和清除的关键效应功能。ISGs的抗病毒效应功能包括但不限于抑制病毒进入、复制、翻译和输出4.除了直接抗病毒功能外,ISGs还通过招募和指导免疫细胞的分化来调节适应性免疫反应4.干扰素通路的保护作用已被研究证实,研究报告显示,在干扰素信号通路中存在遗传缺陷或具有干扰素自身抗体的COVID-19患者的疾病预后较差。10%的危及生命的COVID-19患者有I型干扰素血清自身抗体,而3.5%的严重COVID-19患者在I型干扰素依赖toll样受体3 (TLR3)和干扰素调节因子7 (IRF7)依赖表达和扩增的位点上存在遗传缺陷5,6.在这方面,干扰素与其他抗病毒分子联合治疗冠状病毒感染的益处已在临床试验中得到验证。然而,这些研究显示了不一致的结果,这可能反映在干扰素给药的时间上,因此突出了直接使用干扰素作为治疗选择的局限性7,8,9,10,11.干扰素反应在冠状病毒感染中具有保护作用的传统观点受到了一些研究的挑战,这些研究表明干扰素反应具有病理作用,特别是在病毒复制的高峰期。例如,由于在患者中观察到的不同临床结果,这种对干扰素反应作用的理解变得复杂。在对40名SARS患者的临床研究中,早期干扰素和ISG的强烈表达是严重疾病的标志12.该研究中的大多数患者将干扰素反应作为疾病解决的一部分,他们对SARS-CoV的抗体产生增加,从而导致更好的结果。然而,持续性干扰素反应的患者显示出较低的氧饱和度水平、较低的SARS-CoV抗体水平和较差的临床结果。这项研究表明,随着SARS的进展,持续的干扰素反应阻止了从先天免疫到适应性免疫的转变,导致一些患者病情严重12.在一项对COVID-19患者临床样本的纵向研究中,仅在重症患者血液中检测到干扰素表达升高,且干扰素水平升高与疾病严重程度和死亡率相关,这支持了干扰素的病理作用13.然而,在其他研究中,在轻度至中度COVID-19患者中观察到早期干扰素反应,并发现其稍后消退,而在严重疾病患者中未见干扰素上调14,15.在这些不同的研究中观察到与疾病严重程度相关的干扰素的不同时间表达模式并不令人惊讶,因为临床样本是从不同人口统计学特征的患者中收集的,与疾病进展相关的时间也不同,这使得临床环境中的分析和解释复杂化。
干扰素信号在sars - cov感染小鼠中的作用的研究也得到了相反的结果。人类SARS-CoV分离株在BALB/c小鼠中的连续传代导致整个病毒基因组出现6种突变,这对小鼠的发病机制很重要。由此产生的老鼠适应病毒在感染后引起致命疾病16.类似的策略也被用于生成针对MERS-CoV和SARS-CoV-2的小鼠适应病毒(参考文献)17,18).当干扰素-α/β (IFNα/β)受体(IFNAR)被阻断或基因缺失时,感染致命剂量的小鼠适应版SARS-CoV (SARS-MA15)的BALB/c小鼠免于致命疾病16,19.在感染sars - ma15的野生型小鼠肺部检测到的病毒水平和Ifnar1−−/在实验过程中,BALB/c小鼠在很大程度上具有可比性。与野生型小鼠相比,IFNAR基因敲除在BALB/c小鼠中的保护作用归因于炎症单核细胞和巨噬细胞浸润肺部的减少,这表明干扰素信号在这些小鼠中的有害作用本质上是免疫病理的,与病毒复制无关19.相比之下,其他使用129和C57BL/6小鼠的研究表明,信号换能器和转录激活因子1 (STAT1)的遗传耗竭,驱动IFNAR下游的信号传导,导致病毒水平升高和肺部更明显的病理变化,以及更高的死亡率20.,21.由于I型干扰素/ III型干扰素信号受损,stat1缺陷小鼠无法控制SARS-MA15的初始复制20..此外,研究发现STAT1以不依赖干扰素的方式参与伤口修复,这可能代表STAT1在宿主免疫中发挥了额外的作用21.这些在患者和动物模型中的结果揭示了在冠状病毒感染期间宿主干扰素信号在决定疾病结局方面的复杂动态,并与干扰素反应失调导致严重疾病的概念一致。
I型干扰素/ III型干扰素反应相对于疾病发作的时间
在前面讨论的基础上,宿主干扰素对冠状病毒感染反应的确切性质(保护性或有害性)仍存在争议。此外,正如本文前面所指出的,由于宿主遗传和初始病毒剂量等因素,干扰素表达的时间动力学在个体之间可能有所不同,从而导致干扰素对临床结果的影响看似不同。因此,继续努力了解宿主干扰素反应的动态,以及它如何决定疾病保护或加重是有必要的。临床研究揭示了基于干扰素反应动力学的疾病结局变异性的可能解释。对SARS和COVID-19严重病例的纵向研究显示,与轻中度病例相比,干扰素反应在较长时间内延迟和持续上调,且没有消退12,13,14.这些结果证实了在SARS和MERS小鼠模型中的发现。感染SARS-MA15的BALB/c小鼠肺部病毒滴度在干扰素表达峰值之前达到峰值,而干扰素信号在BALB/c小鼠中的有害影响是由于干扰素表达相对于病毒滴度峰值的延迟19.在病毒复制高峰之前提供干扰素治疗具有保护作用,但在病毒复制高峰之后提供干扰素治疗则不具有保护作用19.干扰素在MERS中的治疗作用也在小鼠模型中进行了测试,其中编码人类二肽基肽酶4 (hDPP4) (MERS- cov受体)的基因的11-14外显子被敲入C57BL/6小鼠(hDPP4- ki小鼠)。18,22.与SARS研究类似,对mers - cov感染小鼠进行早期干扰素治疗,将原本均匀致命的感染转变为亚致死感染,同时将干扰素治疗推迟到病毒复制高峰之后,加剧疾病,导致死亡率显著提高22.在实验性感染SARS-CoV-2的动物模型中,感染前用干扰素或干扰素受体激动剂治疗可预防严重疾病23,24,25.此外,感染SARS-CoV-2的仓鼠通过预防性干扰素治疗(感染前1天)或早期干扰素治疗(感染后1天)得到保护,而晚期干扰素治疗(感染后3天)没有提供保护26.因此,外源性干扰素治疗在不同小鼠毒株中明显矛盾的结果可能是由这些小鼠毒株之间不同的病毒复制动力学来解释的。为了支持这一点,内源性干扰素信号在感染小鼠适应版MERS-CoV (MERS-MA30)的小鼠中具有保护作用,但在感染sars - ma15的小鼠中具有致病性。SARS-MA15在BALB/c小鼠感染后16小时复制至滴度峰值,而MERS-MA30在hDPP4-KI小鼠感染后2天复制至滴度峰值。因此有人提出,干扰素产生相对于病毒滴度峰值的时间,是特定于宿主和病毒的,决定了宿主内源性干扰素信号的性质和外源性干扰素治疗的结果19,22.
一些研究试图描述干扰素信号在感染人类冠状病毒的小鼠中的病理作用。内源性或外源性I型干扰素的病理后果被证明部分是由炎症单核细胞和巨噬细胞浸润到受感染小鼠的肺部介导的。在感染亚致死或致死剂量MERS-MA30的hDPP4-KI小鼠中,感染后早期外源性接受干扰素治疗的小鼠肺部激活的单核细胞和巨噬细胞明显少于未接受干扰素治疗的感染小鼠。此外,在sars - ma15感染的BALB/c小鼠或在与病毒滴度峰值同时接受干扰素的小鼠中观察到的严重疾病与肺部激活的单核细胞和巨噬细胞数量显著增加有关19,22.炎症性单核细胞浸润增强的有害影响通过单核细胞消耗抗ccr2抗体治疗无效,证实了这些细胞在加剧疾病中的关键作用19,22.此外,人体解剖研究和外周血单个核细胞分析还发现,重症COVID-19患者的肺和血液中单核细胞和巨噬细胞数量升高(参考文献)27,28,29).转录组分析显示,COVID-19患者气道巨噬细胞中存在强大的干扰素基因标记,支持单核细胞和巨噬细胞介导干扰素的免疫病理作用的观点。例如,在这些研究中,干扰素信号传导导致巨噬细胞中促炎细胞因子的上调,可能有助于免疫病理改变13,30.,31,32,33.在小鼠中的其他研究表明,I型干扰素/ III型干扰素抑制了肺上皮细胞的再生,部分原因是通过诱导肿瘤抑制蛋白p53的表达,从而损害了肺泡II型细胞的增殖和恢复期间基底细胞的分化34,35.与这些观察结果一致,用toll样受体3 (TLR3)激动剂poly(I:C)治疗小鼠,可抑制肺上皮修复34.总之,这些结果表明,在病毒滴度达到峰值后,重症COVID-19患者急性晚期下气道中I型和III型干扰素的表达升高,通过干扰素介导的肺上皮再生抑制,导致预后不良36.这些结果表明,I型干扰素/ III型干扰素反应的暂时性失调会损害宿主对感染的所有部分反应。他们还建议,在进一步研究干扰素在COVID-19中的作用时,需要考虑干扰素信号的局部效应35.
冠状病毒编码的病毒蛋白的干扰素拮抗作用
除了导致干扰素反应失调的宿主因素外,冠状病毒对干扰素表现出不同的敏感性,而SARS-CoV、MERS-CoV和SARS-CoV-2都编码干扰素拮抗剂,积极干扰宿主干扰素诱导和/或信号传导37,38,39,40.特别是,MERS-CoV和SARS-CoV-2对干扰素的敏感性高于SARS-CoV,且这两种病毒对干扰素诱导的抑制程度高于SARS-CoV。然而,SARS-CoV和SARS-CoV-2似乎比MERS-CoV更能抑制IFNAR信号37,40.
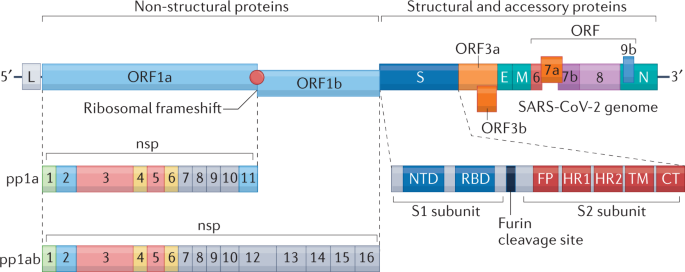
冠状病毒编码的病毒蛋白可大致分为三类:结构蛋白、非结构蛋白和辅助蛋白(图2)。1).每组蛋白质都负责病毒生命周期的特定功能。例如,非结构蛋白通过形成复制-转录复合物对病毒RNA的转录和复制至关重要。结构蛋白包括刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N),它们对病毒粒子的形成至关重要。辅助蛋白在病毒生命周期中是可有可无的,但在免疫规避活动中是重要的。为了鉴定SARS-CoV-2编码的干扰素拮抗剂,采用单转染的SARS-CoV-2病毒蛋白进行体外筛选。结果表明,非结构蛋白1 (nsp1)、nsp3、nsp12、nsp13、nsp14、nsp15、nsp16、开放阅读框3 (ORF3)蛋白、ORF6蛋白、M蛋白和N蛋白是干扰素拮抗剂,可在模拟SARS-CoV-2感染的各种刺激条件下抑制干扰素表达41,42,43(无花果。2).
严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)编码三种类型的病毒蛋白。16种非结构蛋白由开放阅读框架1a (ORF1a)和ORF1b编码,它们占基因组的三分之二以上。非结构蛋白1 (nsp1) -nsp11由聚蛋白1a (pp1a)编码。nsp12 - nsp16仅在nsp11和nsp12的交界处发生核糖体移码时才在pp1ab中表达,这种移码发生的概率约为25%136.编码结构蛋白(穗蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核蛋白(N)蛋白)和辅助蛋白(ORF3a、ORF3b、ORF6、ORF7a、ORF7b、ORF8和ORF9b蛋白)的基因位于ORF1a/1b的下游。S蛋白通过与宿主细胞表达的受体血管紧张素转换酶2 (ACE2)相互作用,负责病毒的进入。S蛋白的S1亚基结合ACE2,而S2亚基触发融合。S1和S2亚基由糠醛裂解位点分离,这在SARS-CoV中没有发现。SARS-CoV-2的辅助蛋白在复制中是可可可无的,但在介导免疫逃避中至关重要。CT,细胞质尾;FP,融合肽;HR,七,重复;L,前导序列; NTD, amino-terminal domain; RBD, receptor-binding domain; TM, transmembrane domain.
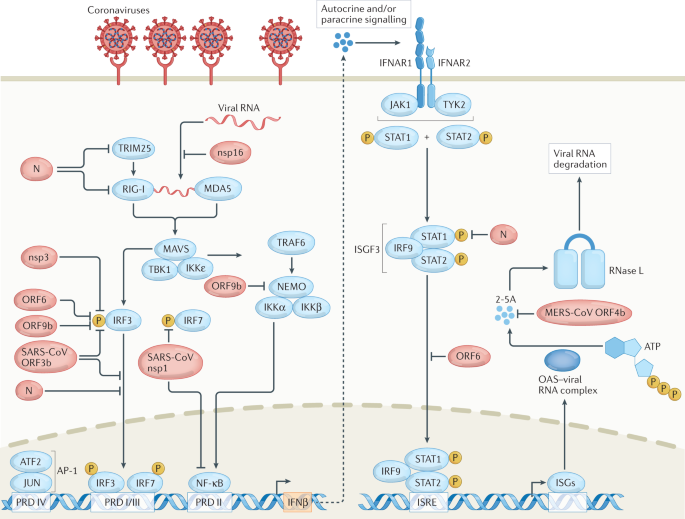
细胞质RNA传感器RIG-I和MDA5检测细胞质中的冠状病毒RNA。病毒RNA的感知触发这些传感器的构象变化,并导致下游效应蛋白的招募。MAVS通过CARD结构域与RIG-I或MDA5相互作用,招募下游激酶TBK1和IKKε用于干扰素调节因子3 (IRF3)和IRF7的磷酸化。MAVS激活还招募TNF受体相关因子6 (TRAF6),其作为IKK复合体(NEMO, IKKα和IKKβ)的适配器。IKK复合物磷酸化NF-κB典型抑制剂IκB,导致IκB降解并激活NF-κB。IRF3、IRF7和NF-κB转运至细胞核,并与相应的阳性调控域(PRD)相互作用。IRF3和IRF7结合PRD I/PRD III, NF-κB结合PRD II, AP-1 (JUN和ATF2的异源二聚体)结合PRD IV在干扰素-β (IFNβ)启动子上形成干扰素增强体,诱导IFNβ的表达。IFNβ分泌并与IFNα/β受体(IFNAR;包括IFNAR1和IFNAR2亚单位)以自分泌或旁分泌的方式。干扰素与IFNAR的结合激活了信号换能器和转录激活因子1 (STAT1)和STAT2激酶,Janus激酶1 (JAK1)和酪氨酸激酶TYK2。 Phosphorylated STAT1 and STAT2 associate with IRF9 to form ISGF3, which translocates to the nucleus and interacts with the interferon-stimulated response element (ISRE) promoter to drive the expression of downstream interferon-stimulated genes (ISGs). ISGs perform different antiviral functions. The example depicted in the figure is the 2′-5′-oligoadenylate synthetase (OAS)–RNase L pathway. OAS interacts with viral RNA and catalyses the formation of 2′-5′-oligoadenylate (2-5A) from ATP. 2-5A is a secondary messenger that activates RNase L to drive viral RNA degradation. Viral proteins of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and related coronaviruses shown in the figure interfere with interferon production and signalling at different steps. Viral proteins (depicted in red) are from SARS-CoV-2 unless otherwise specified. MERS-CoV, Middle East respiratory syndrome coronavirus; N, nucleocapsid protein; nsp, non-structural protein; ORF, open reading frame protein.
冠状病毒编码的病毒蛋白之间保守的干扰素拮抗功能突出了干扰素拮抗在冠状病毒进化中的重要作用。作为一个例子,SARS-CoV ORF6蛋白被证明通过结合核球蛋白亚基-α2来抑制干扰素信号传导(参考文献)。44),阻碍STAT1核易位。在SARS-CoV-2的情况下,ORF6蛋白劫持核孔复合物以阻止STAT1核易位38而ORF9b蛋白与线粒体输入受体亚基TOM70相互作用抑制干扰素的表达45.在另一个例子中,nsp16是一个2 ' -O在所有冠状病毒中发现的甲基转移酶,它抑制细胞内解旋酶对病毒RNA的识别46.nsp16的功能是甲基化第一个碱基的2 ' -羟基,形成cap 1结构,模拟细胞mRNA。此外,N蛋白被证明与RNA进行液相分离,通过阻止MAVS聚集来阻碍干扰素的表达47.关于干扰素拮抗剂筛选的一个注意事项是,迄今为止大多数研究使用的组织培养细胞与感兴趣的蛋白异位表达。在许多这些实验中,病毒蛋白在缺乏其他病毒蛋白的情况下单独表达,通常在超生理水平上表达。从这些实验中获得的结果应谨慎解释,这些结果需要使用相关蛋白质基因缺失的重组病毒进行验证。对于某些蛋白质,如M蛋白和N蛋白,这是不可行的,因为它们是病毒生长所必需的。在这些情况下,有可能进行突变分析,以确定特定的氨基酸重要的免疫逃避,但不是病毒活力。应该解决的另一个关键问题是,重症COVID-19患者的I型干扰素水平较低,尽管这些抗干扰素作用预计主要是抑制受感染细胞而不是旁观者细胞产生干扰素。
促炎介质增加
对冠状病毒最初的先天性炎症反应有助于免疫细胞迅速招募到主要感染部位(肺部),以及随后这些细胞的激活、分化和增殖48.尽管这种免疫反应能够清除病原体,但如果不加以抑制,可能会导致免疫病理改变。多份报告表明,在感染SARS-CoV、MERS-CoV或SARS-CoV-2的患者以及这些感染的动物模型中,病理炎症反应加剧。通过检测感染期间血液中细胞因子和趋化因子水平升高,包括IL-1β、IL-6、IL-8和肿瘤坏死因子(TNF),以及死亡患者肺部存在免疫细胞,证明了这一点13,15,49,50,51,52.这些炎症介质的高水平也与疾病的严重程度相关13,15,49,50.
失调的炎症反应改变了免疫系统
COVID-19免疫病理的确切机制仍不清楚。SARS-CoV-2感染患者中持续产生IL-6和TNF与单核细胞成熟降低相关。结果,循环单核细胞上的MHC II类抗原(HLA-DR)表达减少,导致细胞不能呈现抗原53,54.此外,这些单核细胞成熟的变化伴随着自然杀伤细胞CD4的减少+T细胞和B细胞。HLA-DR在单核细胞和总淋巴细胞计数上的表达在tocilizumab(一种IL-6受体单克隆抗体)治疗后部分恢复53这表明持续产生IL-6在改变免疫环境中发挥了作用。此外,有COVID-19病史的儿童和成人患者的多系统炎症综合征以血液中IL-1β、IL-6、IL-8和IL-10水平升高为特征(参考文献)。55),提示炎症反应在发病机制中的作用。儿童和成人的多系统炎症综合征有心脏、肾脏、呼吸系统、血液系统、胃肠系统、皮肤和神经系统的表现,实验室检测发现发热、嗜中性粒细胞增多、淋巴细胞减少和c反应蛋白、纤维蛋白原、铁蛋白、IL-6和D二聚体水平升高55.动物研究还表明,炎症细胞因子水平升高在介导冠状病毒感染的免疫病理中的作用19,22.
冠状病毒编码的病毒蛋白激活炎症小体和NF-κB信号转导
在sars - cov -2感染的人类单核细胞和COVID-19患者中,NOD-、LRR-和pyrin结构域含蛋白3 (NLRP3)炎症小体被激活(参考文献)56,57).NLRP3激活导致caspase 1激活,IL-1β和IL-18裂解为活性形式58同时也会引发焦亡,一种高度炎症性的细胞死亡。几种SARS-CoV蛋白可以激活NLRP3炎性小体。SARS-CoV E蛋白被证明具有激活NLRP3的钙离子通道活性(参考文献)。59).SARS-CoV的ORF3a蛋白被证明通过TNF受体相关因子3 (TRAF3)增强NLRP3适配器蛋白ASC的泛素化而导致NLRP3成熟。60.SARS-CoV的ORF8蛋白也通过直接相互作用激活NLRP361.基于与SARS-CoV蛋白的相似性,类似的SARS-CoV-2蛋白也可能以这些方式激活NLRP3。
SARS-CoV感染激活NF-κB信号通路62,重症COVID-19的一个标志是NF-κ b依赖性炎症分子的上调,如IL-1、IL-6、IL-8和TNF15.除了在炎症小体激活中的作用外,SARS-CoV的E蛋白还诱导NF-κB激活62.尽管有明确证据表明,SARS-CoV-2诱导的炎症小体依赖和NF-κ b依赖细胞因子和趋化因子对COVID-19的免疫发病机制至关重要,但对负责这种激活的病毒成分知之甚少。据报道,ORF3a、ORF7a、M和N蛋白在组织培养中通过激活NF-κB诱导炎症细胞因子表达63,64.然而,还需要进一步分析,以验证SARS-CoV-2是如何通过逆向遗传与真实病毒诱导这些炎症变化的。
冠状病毒感染中的补体介导免疫病理
补体系统是有效识别和消除病原体的关键。然而,与干扰素和炎症反应类似,补体系统未经控制的激活可导致严重疾病。补体被认为是COVID-19中观察到的内皮炎和血栓形成的主要成分(参考文献)。65).冠状病毒的补体激活在感染sars冠状病毒的小鼠中首次表现出来。C57BL/6J小鼠肺部最早在感染后1天就观察到补体活化产物的沉积。C57BL/6J小鼠C3补体蛋白表达基因缺陷(C3−−/小鼠)在SARS-MA15感染后临床结果显著改善。SARS-MA15-infectedC3−−/与C57BL/6J对照小鼠相比,小鼠肺部中性粒细胞和炎症单核细胞减少,肺部和血清中炎症细胞因子和趋化因子水平降低,炎症反应较轻66.在感染MERS-CoV的小鼠中也观察到免疫致病性补体激活,当C5a受体激活被药理学阻断时,临床疾病得到改善67.有证据表明,COVID-19患者的补体活化,包括膜攻击复合体C4d和C5a组分(C5b、C6、C7、C8和C9)在微血管、肺、皮肤和肾脏中的沉积68,69,70,71.特别是,膜攻击复合体与呼吸衰竭有关70.所有这些结果都表明,补体系统在冠状病毒感染导致的疾病中起着重要作用。
尽管有数据表明补体系统参与了疾病的增强,但在冠状病毒感染期间,补体系统是如何被激活的以及补体系统是如何介导发病的还需要进一步研究。一些证据表明中性粒细胞在补体介导的损伤中起作用。有人提出,sars - cov -2诱导的炎症反应导致中性粒细胞异常激活和中性粒细胞细胞外陷阱形成52,68,72.过敏性毒素C3a和C5a是补体激活产物,通过激活中性粒细胞和其他免疫细胞来促进炎症状态68,73.激活的中性粒细胞和中性粒细胞细胞外陷阱与补体系统相互作用,放大补体激活级联68.此外,据推测,中性粒细胞细胞外陷阱通过接触系统激活凝血和前凝血通路,导致动脉和静脉血栓形成和凝血病变,这在许多严重疾病患者中观察到68,74.更全面地了解补体激活在严重COVID-19中的作用可能会导致更多的治疗方式。
对冠状病毒的适应性免疫
适应性免疫对于病毒清除至关重要,在COVID-19重症患者中出现失调。Coronavirus-specific CD4+T细胞,CD8+T细胞,B细胞和抗体已经在急性疾病和恢复期的患者中被鉴定出来75,76,77,78,79,80并且在SARS、MERS和COVID-19的小鼠模型中被证明具有保护作用,并且是清除病毒所必需的(参考文献)81,82).在SARS-CoV小鼠模型中,用免疫显性SARS-CoV肽脉冲的树突状细胞(dc)免疫幼稚小鼠,可保护小鼠免受随后的致命挑战83.此外,CD4细胞衰竭+T细胞导致肺免疫细胞招募减少,中和抗体产生水平降低,这与疾病加重同时发生78.在感染MERS-CoV或SARS-CoV-2的小鼠中也发现了类似的结果81,83,84,85).在COVID-19患者中,病毒特异性T细胞对病毒基因组中的几种多肽刺激有反应,而sars - cov -2特异性抗体针对多种病毒蛋白75,77,80,表示这些细胞所识别的病毒靶标的多样性。此外,淋巴细胞减少与严重疾病相关,并可能导致病毒清除无效13,15,49,50.在以下小节中,我们将介绍实验感染SARS-CoV-2和相关冠状病毒的患者和动物的适应性免疫的当前知识,并讨论病毒使用的潜在逃避机制。
冠状病毒感染中的细胞免疫反应和失调
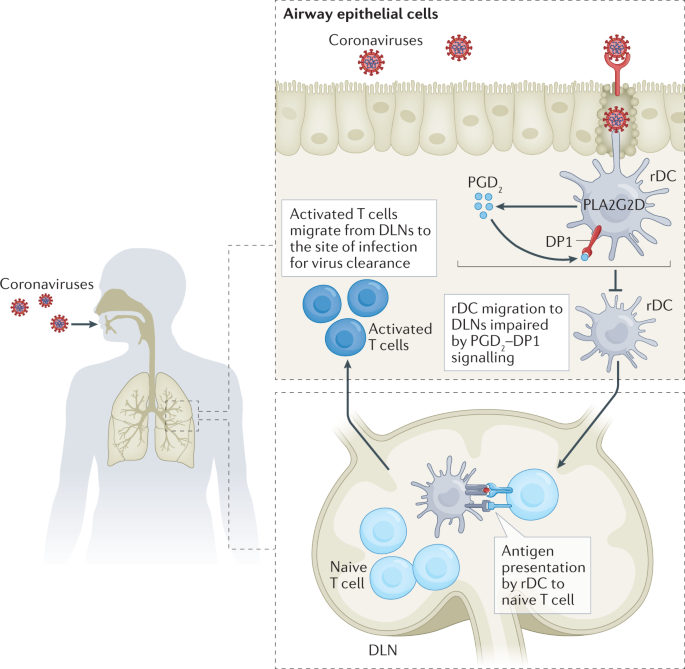
高致病性呼吸道冠状病毒,如SARS-CoV、SARS-CoV-2和MERS-CoV,感染下呼吸道,但在这三种致病性人类冠状病毒中,只有SARS-CoV-2感染上呼吸道和鼻咽腔86,87,88.在初始感染后,肺内dc从感染的上皮细胞获得外源性病毒抗原,并迁移到肺引流淋巴结,在那里抗原被提交给naive T细胞89.激活的T细胞然后迁移到肺部,在那里它们帮助清除病毒(图。3.).破坏这一过程的任何步骤都可能导致T细胞激活和反应不良。对感染SARS-CoV的小鼠的研究表明,肺部环境在这些过程中有影响。在一项研究中,抑制性肺泡巨噬细胞损害了DC从肺到引流淋巴结的迁移,导致次优T细胞激活。在将肺泡巨噬细胞转移回感染小鼠之前,当肺泡巨噬细胞在体内耗尽或在体外用TLR激动剂激活时,DCs恢复了T细胞的激活90.另一个例子是在老年小鼠中,肺DC迁移和随后的T细胞激活由于类二十烷素、前列腺素D水平升高而减弱2(PGD2),以及其上游磷脂酶PLA2G2D相对于年轻小鼠91,92.在老年小鼠中,PGD2作用于其受体PGD2受体1 (DP1)在CD11c上+DC和抑制DC向引流淋巴结的迁移,导致T细胞活化减弱,与年轻小鼠相比,疾病结局较差。特别是阻断CD11c上的DP1信号+DCs增强了DC从肺部向引流淋巴结的迁移,并改善了抗病毒T细胞反应,这在一定程度上保护了小鼠免受SARS-CoV的致命感染91.SARS-CoV-2也显示了类似的结果(参考文献)。93).这些结果与临床数据一致,表明高龄是SARS、中东呼吸综合征和COVID-19的一个危险因素(参考文献)94,95).
呼吸道上皮细胞感染严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)或相关冠状病毒。呼吸道树突状细胞(rDCs)从受感染的上皮细胞中获取病毒抗原,并将抗原加工成多肽以装载MHC。细胞表面存在mhc肽复合物的激活rdc迁移到肺引流淋巴结,并将这些mhc肽复合物呈现给幼稚T细胞。与其他必要的共刺激信号一起,T细胞在T细胞受体与rdc所呈现的mhc -肽复合物接合时被激活。活化的T细胞迅速增殖并迁移到感染部位以清除病毒。rdc从感染部位向引流淋巴结(dln)的初始迁移因前列腺素D升高而受损2(PGD2pgd)2受体1 (DP1)信号通路在rDCs中以年龄依赖的方式由磷脂酶(PLA2G2D)表达增加介导91,92.受损的rDC迁移到引流淋巴结导致次优T细胞激活和实验感染动物的不良临床结果。
除了对实验性感染动物的研究外,在描述和比较无症状、轻度症状和严重症状个体在急性感染和恢复期的T细胞反应的报告中,也描述了细胞免疫反应在COVID-19中的保护作用的证据。Le Bert等人比较了无症状患者和有症状患者的T细胞反应,发现无症状患者中T细胞效应分子IL-2和IFNγ表达更强96.纵向研究显示,早期诱导、靶向不同表位的功能性sars - cov -2特异性T细胞的出现以及T细胞反应的长时间收缩是轻症患者的特征97,98,99.COVID-19患者气道中的组织驻留T细胞表现出功能保护表型,这些细胞的频率与更年轻和更高的生存率相关One hundred..此外,sars - cov -2特异性记忆CD4的存在+T细胞和CD8+恢复期患者的T细胞与轻度疾病相关99.与COVID-19患者密切接触的个体中存在sars - cov -2特异性T细胞(参考文献)101,102).这些人无症状,没有感染证据,因为他们通过定量逆转录pcr检测SARS-CoV-2呈阴性,也没有血清转化101,102.这是一个有趣的观察结果,因为目前尚不清楚未确诊感染的个体如何产生sars - cov -2特异性T细胞反应。有可能这些人短暂感染了SARS-CoV-2,迅速清除了感染,仍然产生了T细胞反应。然而,目前的证据并不排除这些人从未感染过SARS-CoV-2的可能性,这些SARS-CoV-2特异性T细胞是预先存在的普通感冒冠状病毒特异性T细胞。有必要进一步研究这些个体中存在的sars - cov -2特异性T细胞的特征。
T细胞在冠状病毒感染中的致病作用
尽管多项证据表明T细胞反应在冠状病毒感染中具有保护作用,但T细胞介导的发病机制也已被报道。这在感染了小鼠冠状病毒,小鼠肝炎病毒(MHV)的小鼠中最为显著。易感的A/J和C3H/HeJ小鼠感染嗜肺MHV毒株(MHV-1)导致显著的肺部病理。抗体介导的CD4耗竭+T细胞和CD8+T细胞减少了肺部的病理变化,这表明CD4+T细胞和CD8+T细胞诱导了这些小鼠的肺部发病机制103.在另一个例子中,在T细胞介导的病毒清除过程中,嗜神经性MHV JHM株(MHV-JHM)的中枢神经系统感染诱发了伴有急性和慢性中枢神经系统脱髓鞘的脑炎104,105,106病毒清除和免疫病理都需要mhv - jhm特异性T细胞。此外,Zhou等人在COVID-19患者中发现了CD4的一个子集+具有T辅助细胞1样特性的T细胞,分泌高水平的粒细胞单核细胞集落刺激因子(GM-CSF), IL-6和IFNγ。这些细胞的出现频率与疾病的严重程度相关29.有人提出,这种T细胞亚群分泌的细胞因子导致CD14水平升高+CD16+IL-6表达丰富的炎性单核细胞,可能导致患者处于高度炎症状态29.然而,需要注意的是,只有一小部分患者参与了这项研究;因此,这种T细胞亚群的病理作用需要在更多的患者中得到验证。
在另一项研究中,CD8的转录组谱+T细胞表现为CD8频率较高+在重症患者中观察到表达细胞毒性效应分子(即颗粒酶B、颗粒酶H、颗粒素和FAS配体)和炎症细胞因子/趋化因子(如CCL3、CCL4、CSF2、TNF、LTA和LTB)的T细胞,但表达与T细胞衰竭相关的分子(如TIM3、LAG3和CD38)的水平低于轻症患者。还有未耗尽的CD8+在严重疾病患者中,T细胞与更强健的记忆表型相关,这可以通过涉及共刺激、促生存信号和抗凋亡途径的基因的丰富表达来证明107.这可能表明存在一种更强大的CD8+T细胞反应在介导严重疾病患者中起着重要作用。然而,另一项研究提出了相反的观点,在一些患者中,随着疾病从症状前阶段发展到症状期,T细胞衰竭标志物PD1和TIM3的表达增加108.这些结果似乎相互矛盾;然而,关于T细胞在疾病进展中的作用的不同结论可能反映了病毒特异性T细胞的异质性。在这个单细胞RNA测序的时代,在同一亚群中识别执行不同功能的不同细胞群并不奇怪29,107,108,109.一个重要的未来目标将是解剖病毒特异性T细胞的异质性,以评估T细胞是保护性的还是有害的。此外,不同T细胞群频率的显著变化可能与实际细胞数量的实质性变化无关,因为存在与严重疾病相关的淋巴细胞减少症。此外,其他研究表明,功能失调的髓系细胞可能导致次优T细胞反应One hundred..
冠状病毒感染的体液免疫和免疫病理
冠状病毒感染可诱导中和性和非中和性抗体110,111.中和抗体主要通过立体阻断S蛋白与其结合的细胞表面进入受体之间的相互作用来靶向S蛋白,从而限制病毒进入易感细胞。针对冠状病毒产生的非中和抗体的功能尚不清楚。非中和抗体的一个可能功能可能涉及抗体依赖性细胞毒性112.重症患者和轻症患者的sars - cov -2特异性抗体反应动力学不同。在严重疾病患者中检测到大量的浆母细胞,反映了高病毒载量113然而,总的来说,急性疾病患者快速诱导抗SARS-CoV-2和相关冠状病毒抗体与疾病严重程度和病毒载量降低相关110,114,115.在严重疾病存活下来的恢复期患者中,病毒特异性抗体水平高于轻症患者。在一些轻度或无症状的MERS和COVID-19病例中观察到缺乏血清转化的T细胞反应诱导,这表明T细胞和抗体反应不一致79,116.通常,血清转化发生在症状出现后7-14天,抗体水平在症状出现后15-30天达到峰值110,115,117.首先检测到病毒特异性IgM,但随后特异性IgM水平迅速下降110,115,117.症状出现3-4个月后,可检测到sars - cov -2特异性IgG,对不同病毒蛋白具有特异性。SARS-CoV-2和相关冠状病毒的抗体水平随着时间的推移而下降,特别是在轻症患者中110,115,117,118.尽管血液中的抗体水平下降,但研究发现,在感染后的6个月内,sars - cov -2特异性记忆B细胞的丰度仍在增加77.更重要的是,在对恢复期患者抗体序列的时间分析中观察到累积的体细胞高突变,这表明抗体成熟发生在恢复期77.此外,在恢复期患者的骨髓中检测到稳定的sars - cov -2特异性长寿浆细胞群119.
SARS-CoV-2变体逃避中和抗体反应
在COVID-19大流行期间,出现了几种SARS-CoV-2变种。虽然在许多病毒蛋白中检测到突变,但S蛋白是增强传播和逃避中和抗体反应的突变的热点120,121.这些变异最初通常是为了增加传播性而选择的122,123.这些变异中的一些突变介导了对自然感染或疫苗接种诱导的中和抗体的部分抗性,并使一些单克隆抗体无效。在高度免疫人群中,这些突变可能被额外选择,因为它们具有免疫逃避性120,121,124.一种SARS-CoV-2变体(β-变体,也被称为B.1.351)编码了S蛋白的几个突变,这些突变增强了传播,并使这种变体更能抵抗恢复期血浆和疫苗诱导的血清的中和120,121,124.特别是在B.1.351的S蛋白中发现的E484K突变是中和抗体耐药性的主要驱动因素。S蛋白中的L452R和N501Y突变已被证明会导致SARS-CoV-2与人类细胞上的入口受体ACE2的结合增强(参考文献)123,125).对抗体中和抗性增强的SARS-CoV-2变体的出现令人担忧。然而,保护的相关因素还没有很好地定义,一些疫苗诱导抗体反应,在暴露于变异病毒时仍然具有保护作用120.值得注意的是,对原始毒株或变异株的免疫持续时间仍然未知。因此,重要的是通过接种疫苗达到高水平的中和抗体,以最大限度地保护这些变异。此外,随着时间的推移,抗体成熟的活性体细胞超突变可以增强抗体中和,这可能为这些变异提供足够的保护77.
抗体反应在冠状病毒感染中的潜在致病作用
抗体依赖性增强是接种疫苗或自然感染后感染或再感染SARS-CoV-2最值得关注的结果之一。然而,就冠状病毒而言,抗体依赖性增强或巨噬细胞感染增强仅在感染猫传染性腹膜炎病毒的猫身上观察到。巨噬细胞可被猫传染性腹膜炎病毒有效感染,感染可通过感染猫的血清或含S蛋白结构物的疫苗接种而增强126.经典的抗体依赖性增强需要病毒-抗体免疫复合物和巨噬细胞上Fc受体的相互作用来增强感染127.在SARS-CoV-2中,巨噬细胞仅被流产感染,尽管在这些细胞中诱导了炎症反应128,129;因此,经典的抗体依赖性增强不太可能发生在SARS-CoV-2感染中130.此外,在SARS-CoV感染的情况下,抗s蛋白抗体已被证明可以改变肺浸润巨噬细胞的表型,从伤口愈合到促炎,尽管这没有影响挑战后观察到的临床疾病131.
抗体保护与致病性的另一个因素与Fc效应子功能有关。例如,抗体Fc区域的聚焦化通过增加Fc与Fcγ受体IIa和Fcγ受体III的接触来增强其活性(参考文献)。132).这可能导致保护效果增强,但也可能导致巨噬细胞激活增强和炎症细胞因子(如IL-6和TNF)的异常诱导,这些细胞因子是COVID-19发病机制的关键133,134.被集中抗体强烈激活的巨噬细胞可能破坏肺内皮壁并诱导微血管血栓形成133.在严重COVID-19患者中发现了高水平的SARS-CoV-2集中抗体(参考文献)133,134,135).这些结果说明了适当的Fc修饰对预防抗体反应介导的免疫病理的重要性。
结束语
从这个角度来看,我们已经提供了由宿主(免疫致病性)和病毒(病毒主动干扰)介导的先天性和适应性免疫失调的当前知识的概述。COVID-19是一个很好的例子,说明了宿主免疫稳态的复杂性和相互依赖性。一旦被破坏,就像COVID-19一样,后果是一系列导致疾病进展的免疫病理变化。更全面地了解这些变化可以让我们开发出更有效的治疗方法,来治疗因冠状病毒感染而患上严重疾病的患者。
改变历史
2021年12月17日
参考文献
疾病预防控制中心。非典。基础字幕新闻。https://www.cdc.gov/sars/about/fs-sars.html(2017)。
谁。世卫组织东地中海地区办公室。即爆发。MERS-CoV。健康的话题。http://www.emro.who.int/health-topics/mers-cov/mers-outbreaks.html(2021)。
谁。世卫组织冠状病毒(COVID-19)仪表盘。https://covid19.who.int.(2021)。
干扰素刺激基因:它们都做什么?为基础。启性研究。6, 567-584(2019)。
张q等。危及生命的COVID-19患者的I型IFN免疫先天错误。科学370, 6515(2020)。
混蛋,p等人。威胁生命的COVID-19患者的I型干扰素自身抗体。科学370, 6515(2020)。
黄,Y.-Q。et al。2019年轻至中度冠状病毒疾病患者中,利巴韦林+ α干扰素、洛匹那韦/利托那韦+ α干扰素和利巴韦林+洛匹那韦/利托那韦+ α干扰素的抗病毒有效性无统计学上的明显差异:一项随机、开放标记的前瞻性研究的结果。前面。杂志。11, 1071(2020)。
Omrani, A. S.等人。利巴韦林和干扰素α -2a治疗严重中东呼吸综合征冠状病毒感染:一项回顾性队列研究柳叶刀感染。说。14, 1090-1095(2014)。
Loutfy, m.r.等人。干扰素Alfacon-1联合皮质类固醇治疗严重急性呼吸综合征的初步研究。《美国医学会杂志》290, 3222(2003)。
针对COVID-19的干扰素β -1b。《柳叶刀》395, 1670-1671(2020)。
用于covid-19的新用途抗病毒药物——世卫组织团结试验中期结果。心血管病。j .地中海。384, 497-511(2020)。
卡梅隆,m.j.等人。干扰素介导的免疫病理事件与严重急性呼吸综合征患者的非典型先天和适应性免疫反应相关。j .性研究。81, 8692-8706(2007)。
Lucase, C.等。纵向分析揭示了重症COVID-19的免疫失灵。自然584, 463-469(2020)。
加拉尼,我等人。时间型I/III型干扰素模式和流感比较揭示了COVID-19中未调节的抗病毒免疫。Immunol Nat。22, 32-40(2021)。
Hadjadj, J.等人。重症COVID-19患者I型干扰素活性受损和炎症反应。科学369, 718-724(2020)。
罗伯茨等人。小鼠适应的sars冠状病毒在BALB/c小鼠中引起疾病和死亡。公共科学图书馆Pathog。3., e5(2007)。
Gu, H.等。SARS-CoV-2在BALB/c小鼠上的适应性试验科学369, 1603-1607(2020)。
Li, K.等。小鼠适应的MERS冠状病毒在人类DPP4敲入小鼠中引起致命的肺部疾病。国家科学院学报美国114, e319 - e3128(2017)。
chanappanavar, R.等人。在sars - cov感染小鼠中,I型干扰素和炎性单核-巨噬细胞反应失调导致致命肺炎。细胞宿主微生物19, 181-193(2016)。
Mahlakõiv, T.等。I型和III型干扰素的联合作用限制了严重急性呼吸综合征冠状病毒在肺部的初始复制,但不能抑制病毒的全身性传播。维罗尔将军。93, 2601-2605(2012)。
弗里德曼,m.b.等人。SARS-CoV的发病机制依赖于STAT1,但不依赖于I、II和III型干扰素受体。公共科学图书馆Pathog。6, e1000849(2010)。
chanappanavar, R.等人。相对于病毒复制的IFN-I反应时间决定了MERS冠状病毒感染的结果。j .中国。投资。129, 3625-3639(2019)。
李,M.等。STING的药理激活阻断了SARS-CoV-2感染。科学。Immunol。6, eabi9007(2021)。
毛,T.等。一种茎环RNA RIG-I激动剂可对小鼠急性和慢性SARS-CoV-2感染提供预防和治疗保护。预印在bioRxivhttps://doi.org/10.1101/2021.06.16.448754(2021)。
莱斯特,S. R.等。小鼠适应的SARS-CoV-2在标准实验室小鼠中诱导急性肺损伤和死亡。细胞183, 1070 - 1085。e12汽油(2020)。
Bessière, P.等。在SARS-CoV-2仓鼠模型中,鼻内I型干扰素治疗只有在临床症状出现之前给予才有益。公共科学图书馆Pathog。17, e1009427(2021)。
田,S.等。2例肺癌患者2019年早期新型冠状病毒肺炎的肺部病理。j . Thorac。肿瘤防治杂志。15, 700-704(2020)。
徐哲,等。COVID-19与急性呼吸窘迫综合征相关的病理结果和出版的《柳叶刀》杂志上。地中海。8, 420-422(2020)。
周,Y.等。致病性t细胞和炎性单核细胞在COVID-19重症患者中引发炎症风暴。国家的科学。牧师。7, 998-1002(2020)。
廖,M.等。COVID-19患者支气管肺泡免疫细胞的单细胞图Nat,地中海。26, 842-844(2020)。
周哲,等。COVID-19患者呼吸道固有免疫反应增强。细胞宿主微生物27, 883 - 890。e2(2020)。
israel, B.等人。SARS-CoV-2小鼠模型揭示I型干扰素信号通路的炎症作用。实验,医学。217, e20201241(2020)。
李,J. S.等。COVID-19和流感的免疫分型突出了I型干扰素在重症COVID-19发展中的作用。科学。Immunol。5, abd1554(2020)。
少校,J.等。I型和III型干扰素在病毒感染恢复期间破坏肺上皮的修复。科学369, 712-717(2020)。
斯波西托,B.等。呼吸道沿线的干扰素分布影响COVID-19的严重程度。细胞184, 4953 - 4968。e16天(2021)。
布罗吉,A.等人。III型干扰素在病毒识别时破坏肺上皮屏障。科学369, 706-712(2020)。
王尔德,a.h.等人。mers冠状病毒复制诱导严重的体外细胞病理,并被环孢素A或干扰素-α治疗强烈抑制。维罗尔将军。94, 1749-1760(2013)。
Miorin, L.等。SARS-CoV-2 Orf6劫持Nup98以阻断STAT核输入并拮抗干扰素信号。国家科学院学报美国117, 28344-28354(2020)。
Katsura, H.等。基于人肺干细胞的肺泡球为sars - cov -2介导的干扰素反应和肺细胞功能障碍提供了见解。细胞干细胞27, 890 - 904。e8(2020)。
Lokugamage, K. G.等。I型干扰素敏感性区分SARS-CoV-2和SARS-CoV。j .性研究。94, e01410-e01420(2020)。
夏,H.等。SARS-CoV-2逃避I型干扰素。细胞的代表。33, 108234(2020)。
袁,C.-K。et al。SARS-CoV-2 nsp13、nsp14、nsp15和orf6是有效的干扰素拮抗剂。紧急情况。微生物感染。9, 1418-1428(2020)。
Lei, X.等。SARS-CoV-2激活和逃避I型干扰素反应。Commun Nat。11, 3810(2020)。
弗里德曼等人。严重急性呼吸综合征冠状病毒ORF6通过隔离粗糙内质网/高尔基膜上的核输入因子拮抗STAT1功能。j .性研究。81, 9812-9824(2007)。
蒋,H.等。SARS-CoV-2 Orf9b通过靶向TOM70抑制I型干扰素反应。细胞。摩尔。Immunol。17, 998-1000(2020)。
Krafcikova, P., Silhan, J., Nencka, R. & Boura, E. SARS-CoV-2甲基转移酶复合体参与RNA帽生成与sininefungin结合的结构分析。Commun Nat。11, 3717(2020)。
王,S.等。靶向SARS-CoV-2核衣壳蛋白的液-液相分离通过提高MAVS活性促进先天性抗病毒免疫。细胞生物学。23, 718-732(2021)。
陈,L.等。器官的炎症反应和炎症相关疾病。Oncotarget9, 7204-7218(2017)。
黄,C.等。武汉地区新型冠状病毒感染患者临床特征分析《柳叶刀》395, 497-506(2020)。
马修,D.等人。对COVID-19患者的深度免疫分析揭示了具有治疗意义的不同免疫类型。科学369, eabc8511(2020)。
尼恩霍尔德,R.等。COVID-19尸检肺的两种不同的免疫病理特征。Commun Nat。11, 5086(2020)。
巴恩斯,B. J.等。针对COVID-19的潜在驱动因素:中性粒细胞细胞外陷阱。实验,医学。217, e20200652(2020)。
Giamarellos-Bourboulis, e.j.等人。COVID-19重症呼吸衰竭患者的复杂免疫失调细胞宿主微生物27, 992 - 1000。e3(2020)。
贾库齐克,C. V., Randolph, G. J. & Henson, P. M.单核细胞分化和抗原提呈功能。Nat. Rev. Immunol。17, 349-362(2017)。
卡特,m.j.等人。与SARS-CoV-2感染相关的多系统炎症综合征儿童的外周免疫表型Nat,地中海。261701-1707(2020)。
费雷拉,a.c.等。SARS-CoV-2在人原代单核细胞中参与炎性小体和焦亡。细胞死亡发现。7, 1-12(2021)。
罗德里格斯,t.s.等人。炎症小体在SARS-CoV-2感染时被激活,并与患者的COVID-19严重程度相关。实验,医学。218, e20201707(2020)。
史万森,邓敏敏,丁俊英。NLRP3炎性小体:对治疗的分子激活和调控。Nat. Rev. Immunol。19, 477-489(2019)。
Nieto-Torres, J. L.等。严重急性呼吸综合征冠状病毒E蛋白运输钙离子并激活NLRP3炎性小体。病毒学485, 330-339(2015)。
萧国强等。严重急性呼吸综合征冠状病毒ORF3a蛋白通过促进traf3依赖的ASC泛素化激活NLRP3炎性小体。美国实验生物学学会联合会J。33, 8865-8877(2019)。
史长生,纳巴宁荣,黄宁宁。sars冠状病毒开放阅读框-8b触发细胞内应激通路并激活NLRP3炎性小体。细胞死亡发现。5, 1-12(2019)。
DeDiego, M. L.等。在严重急性呼吸综合征冠状病毒感染的小鼠中,抑制NF-κ b介导的炎症可以增加生存率。j .性研究。88, 913-924(2014)。
吴,Y.等。rna诱导SARS-CoV-2核衣壳蛋白液相分离促进NF-κB超激活和炎症反应。信号。钙。目标。其他。6, 167(2021)。
苏春梅,王丽丽,刘丽娟。ORF7a蛋白介导NF-κB活化及促炎细胞因子表达的研究。科学。代表。11, 13464(2021)。
库诺,M.等人。补体激活和内皮扰动与COVID-19的严重程度和活性相似。j . Autoimmun。116, 102560(2021)。
Gralinski, L. E.等。补体活化有助于严重急性呼吸综合征冠状病毒的发病机制。mBio9, e01753-18(2018)。
蒋,Y.等。阻断C5a-C5aR轴可减轻感染MERS-CoV的hdpp4转基因小鼠的肺损伤。紧急情况。微生物感染。7, 77(2018)。
Java, A.等。COVID-19中的补体系统:朋友和敌人?江森自控的洞察力5, 15(2020)。
马格罗,C.等人。COVID-19重症感染中补体相关微血管损伤与血栓形成的发病机制:附5例报告Transl。Res。220, 1-13(2020)。
Holter, J. C.等。COVID-19住院患者全身补体激活与呼吸衰竭相关。国家科学院学报美国117, 25018-25025(2020)。
库诺,M.等人。COVID-19患者补体激活:一种新的治疗靶点。J.过敏临床。Immunol。146, 215-217(2020)。
左杨,等。COVID-19中的中性粒细胞细胞外陷阱。江森自控的洞察力5, 11(2020)。
Markiewski, m.m.和Lambris, j.d.补体在炎症疾病中的作用从幕后到聚光灯下。点。j .分册。171, 715-727(2007)。
de Bont, C. M., Boelens, W. C. & Pruijn, G. J. M. NETosis,补体和凝血:三角关系。细胞。摩尔。Immunol。16, 19-27(2019)。
勒伯特,N.等。COVID-19和SARS病例中的SARS- cov -2特异性T细胞免疫,以及未感染对照组。自然584, 457-462(2020)。
高尔,R. R.等人。在SARS-CoV-2 naïve和mRNA接种后恢复的个体中存在明显的抗体和记忆B细胞反应。科学。Immunol。6, eabi6950(2021)。
索卡尔等人。抗sars - cov -2记忆B细胞反应的成熟和持久性。细胞184, 1201 - 1213。e14灯头(2021)。
赵,J.等。气道记忆CD4+ T细胞介导对新出现的呼吸道冠状病毒的保护性免疫。免疫力44, 1379-1391(2016)。
莫,C. K. P.等。尼日利亚职业接触单峰骆驼人群对MERS冠状病毒感染的t细胞反应:一项观察性队列研究柳叶刀感染。说。21, 385-395(2021)。
Grifoni, A.等人。COVID-19患者和未暴露人群中T细胞对SARS-CoV-2冠状病毒的反应靶点细胞181, 1489-1501(2020)。
赵,J.等。中东呼吸综合征小鼠模型的快速生成。国家科学院学报美国111, 4970-4975(2014)。
israel, B.等人。SARS-CoV-2小鼠模型中病毒清除和保护的适应性免疫决定因素科学。Immunol.6, eabl4509。
Channappanavar, R., Fett, C., Zhao, J., Meyerholz, D. K. & Perlman, S.病毒特异性记忆CD8 T细胞对致命的严重急性呼吸综合征冠状病毒感染提供了实质性的保护。j .性研究。88, 11034-11044(2014)。
孙,J.等。为COVID-19的发病机制、疫苗接种和治疗建立了广泛有用的模型。细胞182, 734 - 743。e5(2020)。
陈,J.等。衰老BALB/c小鼠对严重急性呼吸综合征冠状病毒(SARS-CoV)感染的细胞免疫反应:CD4+ T细胞在控制SARS-CoV感染中很重要。j .性研究。84, 1289-1301(2010)。
顾杰,郭德伟。重症急性呼吸综合征的病理及发病机制。点。j .分册。170, 1136-1147(2007)。
德威特,E.等人。中东呼吸综合征冠状病毒(MERS-CoV)引起恒河猴短暂性下呼吸道感染。Proc。国家的。学会科学。美国110, 16598-16603(2013)。
从上呼吸道和下呼吸道标本中检测SARS CoV-2:诊断和感染控制的意义。胸部158, 1804-1805(2020)。
赵俊杰和帕尔曼。呼吸道冠状病毒对T细胞介导的免疫应答。Immunol。Res。59, 118-128(2014)。
赵娟,赵娟,罗毅仁,n.v., Perlman, S.隐形逃避:低效的免疫激活是sars - cov感染小鼠T细胞反应差和严重疾病的基础。公共科学图书馆Pathog。5, e1000636(2009)。
赵娟,赵娟,Legge, K. & Perlman, S.年龄相关性PGD2表达增加损害呼吸道DC迁移,导致呼吸道病毒感染小鼠T细胞反应减弱。j .中国。投资。121, 4921-4930(2011)。
维杰,R.等人。磷脂酶A2组IID在年龄相关性严重急性呼吸综合征-冠状病毒感染易感性中的关键作用实验,医学。212, 1851-1868(2015)。
Wong L.-Y。R.等。在患有严重COVID-19的中年小鼠中,类二十烷素信号作为治疗靶点。预印在bioRxivhttps://doi.org/10.1101/2021.04.20.440676(2021)。
戴维斯,N. G.等。COVID-19流行病传播和控制中的年龄依赖效应。Nat,地中海。26, 1205-1211(2020)。
O 'Driscoll等人。SARS-CoV-2的年龄特异性死亡率和免疫模式。自然590, 140-145(2021)。
勒伯特,N.等。无症状SARS-CoV-2感染中的高功能病毒特异性细胞免疫反应实验,医学。218, e20202617(2021)。
舒连等人。现有和诱导的sars - cov -2特异性CD8+ T细胞的特征。Nat,地中海。27, 78-85(2021)。
谭,A. T.等。在COVID-19患者中,早期诱导功能性sars - cov -2特异性T细胞与快速病毒清除和轻度疾病相关。细胞的代表。34, 108728(2021)。
Rydyznski Moderbacher, C.等。急性COVID-19患者对SARS-CoV-2的抗原特异性适应性免疫及其与年龄和疾病严重程度的关系细胞183, 996 - 1012。e19(2020)。
Szabo, p.a.等人。呼吸道和全身免疫反应的纵向分析揭示了重症COVID-19患者骨髓细胞驱动的肺部炎症。免疫力54, 797 - 814。e6(2021)。
Sekine, T.等。无症状或轻度COVID-19恢复期患者的强大T细胞免疫。细胞183, 158 - 168。e14灯头(2020)。
王哲,等。在没有检测到病毒感染的情况下,暴露于SARS-CoV-2会产生t细胞记忆。Commun Nat。12, 1724(2021)。
Khanolkar, A.等。小鼠肝炎病毒1型免疫应答的保护和病理作用:严重急性呼吸综合征的意义j .性研究。83, 9258-9272(2009)。
李志强,李志强,李志强。JHM病毒性脑脊髓炎脱髓鞘机制的研究。Acta Neuropathol。24, 76-85(1973)。
李志刚,李志刚,李志刚,李志刚。小鼠肝炎病毒4型(JHM株)。诱发致命的中枢神经系统疾病。一、遗传控制及小鼠神经元为疾病易感部位。实验,医学。153, 832-843(1981)。
Wu, G. F., Dandekar, A. A., Pewe, L. & Perlman, S. CD4和CD8 T细胞在病毒诱导的脱髓鞘中具有冗余但不相同的作用。j . Immunol。165, 2278-2286(2000)。
Kusnadi, A.等人。重症COVID-19患者sars - cov -2反应性CD8+ T细胞表现出衰竭受损特征。科学。Immunol。6, abe4782(2021)。
刁,B.等。2019冠状病毒病(COVID-19)患者T细胞减少和功能衰竭前面。Immunol。11, 827(2020)。
郑,M.等。COVID-19患者抗病毒淋巴细胞功能衰竭细胞。摩尔。Immunol。17, 533-535(2020)。
王毅,等。病毒载量和抗体反应与COVID-19严重程度的动力学j .中国。投资。130, 5235-5244(2020)。
多根,等人。SARS-CoV-2特异性抗体和中和试验显示,对病毒的体液免疫反应范围广泛。Commun。医学杂志。4, 1-13(2021)。
Loos, C.等人。早期SARS-CoV-2和交叉冠状病毒免疫的演变。mSphere5, e00622-20(2020)。
库里-塞万提斯,L.等人。与严重COVID-19相关的免疫紊乱的综合图谱。科学。Immunol。5, eabd7114(2020)。
赵,J.等。中东呼吸综合征的恢复与抗体和T细胞反应有关。科学。Immunol。2, eaan5393(2017)。
孙,B.等。COVID-19患者SARS-CoV-2特异性IgM和IgG反应动力学紧急情况。微生物感染。9, 940-948(2020)。
雷诺兹,C. J.等。无症状和轻度SARS-CoV-2感染中和抗体和T细胞反应不一致。科学。Immunol。5, abf3698(2020)。
江,X.-L。et al。COVID-19患者在感染SARS-CoV-2 3个月后持续出现抗体和T细胞反应。Commun Nat。12, 897(2021)。
Bilich, T.等人。T细胞和抗体动力学描述了SARS-CoV-2肽介导COVID-19恢复期个体的长期免疫反应。科学。Transl。地中海。13, abf7517(2021)。
特纳,J. S.等。SARS-CoV-2感染可诱导人体长寿命骨髓浆细胞。自然595, 421-425(2021)。
王,P.等。新型冠状病毒变体B.1.351和B.1.1.7的抗体耐药性。自然593, 130-135(2021)。
霍夫曼,等人。SARS-CoV-2变体B.1.351和P.1逃脱中和抗体。细胞184, 2384 - 2393。e12汽油(2021)。
侯永杰等。SARS-CoV-2 D614G变体表现出高效的体外复制和体内传播。科学370, 1464-1468(2020)。
Ramanathan, M, Ferguson, i.d, Miao, W. & Khavari, p.a. SARS-CoV-2 B.1.1.7和B.1.351刺突变体与人类ACE2的亲和力增加。柳叶刀感染。说。21, 1070(2021)。
刘,Y.等。bnt162b2诱导血清的中和活性。心血管病。j .地中海。384, 1466-1468(2021)。
斯塔尔,t.n.等。SARS-CoV-2受体结合域深度突变扫描揭示了折叠和ACE2结合的限制。细胞182, 1295 - 1310。e20(2020)。
高野,T.等人。猫冠状病毒实验和自然感染猫血清对猫肺泡巨噬细胞和人单核细胞U937感染猫传染性腹膜炎病毒的抗体依赖性增强拱门。性研究。162, 3339-3345(2017)。
Wen, J.等。冠状病毒抗体依赖性增强。Int。j .感染。说。One hundred., 483-489(2020)。
郑,J.等。严重急性呼吸综合征冠状病毒2诱导单核细胞来源的人巨噬细胞和树突状细胞的免疫激活和死亡。j .感染。说。223, 785-795(2021)。
许家培,许家培,等。冠状病毒SARS-CoV-2在人呼吸道和结膜中的趋同性、复制能力和先天免疫反应:体外和体外培养分析和出版的《柳叶刀》杂志上。地中海。8, 687-695(2020)。
李,D.等。SARS-CoV-2感染增强和中和抗体的体内外功能细胞184, 4203 - 4219。e32(2021)。
刘,L.等。抗刺突IgG在急性SARS-CoV感染期间通过扭曲巨噬细胞反应导致严重的急性肺损伤。江森自控的洞察力4, e123158(2019)。
Schäfer, A.等。抗体的效力、效应功能以及在体内对SARS-CoV-2感染的保护和治疗中的组合。实验,医学。218, e20201993(2020)。
Hoepel, W.等人。早期人抗sars - cov -2 IgG高滴度和低集中化可促进肺泡巨噬细胞炎症。科学。Transl。地中海。13, eabf8654(2021)。
Chakraborty, S.等人。重症COVID-19患者促炎IgG Fc结构Immunol Nat。22, 67-73(2021)。
拉森博士等人。集中的IgG是包膜病毒反应的特征,并与COVID-19严重程度相关。科学371, eabc8378(2021)。
Bhatt, p.r.等人。SARS-CoV-2 RNA基因组翻译过程中核糖体框架转移的结构基础。科学372, 1306-1313(2021)。
确认
作者感谢A. Sariol对手稿的严格审查。这项工作得到了美国国立卫生研究院对S.P. (P01 AI060699和R01 AI129269)和l - y.r.w. (T32 AI007511)的部分资助。
作者信息
作者及隶属关系
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
同行评审信息
《自然评论》免疫学感谢A. Bertoletti, L. Enjaunes和其他匿名审稿人对这项工作的同行评审所做的贡献。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
关于本文
引用本文
Wong LY。,Perlman, S. Immune dysregulation and immunopathology induced by SARS-CoV-2 and related coronaviruses — are we our own worst enemy?.Nat Rev Immunol22, 47-56(2022)。https://doi.org/10.1038/s41577-021-00656-2
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41577-021-00656-2
这篇文章被引用
病毒和细菌感染的宿主定向免疫治疗:过去,现在和未来
《自然评论》免疫学(2023)
SARS-CoV-2 Omicron变异病毒分离株对干扰素治疗高度敏感
细胞的发现(2022)
ORF9c和ORF10作为SARS-CoV-2免疫逃避的辅助蛋白
《自然评论》免疫学(2022)
SARS-CoV-2发病机理
自然微生物学评论(2022)
体液反应在COVID-19中的保护和致病作用
微生物学杂志(2022)