摘要
过敏原免疫治疗是一种治疗性疫苗接种的形式,用于确定ige介导的对常见过敏原来源(如花粉、室内尘螨和叮虫毒液)的超敏。1911年引入的经典方案包括不断增加过敏原提取液的重复皮下注射,然后进行为期3年的维持注射,以达到一种过敏原特异性耐受的形式,在停药后多年仍能提供临床效益。最近,通过舌下途径给药已成为一种有效、安全的替代方法。口服免疫治疗花生过敏可诱导有效的“脱敏”,但不能长期耐受。过去几十年的研究和临床试验阐明了免疫治疗诱导耐受的机制,包括减少过敏原特异性T辅助2 (TH2)细胞,诱导调节性T细胞和B细胞,并产生IgG和IgA“阻断”抗体。为了更好地利用这些机制,人们正在探索新的策略,以实现更安全、有效、更方便的方案和更持久的长期耐受性;这些包括现有免疫治疗方法的替代途径,新的佐剂,使用重组过敏原(包括低过敏原变异)和过敏原与免疫修饰剂或靶向T的单克隆抗体的组合H2细胞通路。
简介
过敏是一个日益严重的问题,影响着西方国家多达三分之一的人口1.例如,据估计,医生诊断的过敏性鼻炎在儿童中的患病率为13%2成人的比例为14%3.在美国和23%的成年人4在欧洲。过敏性鼻炎通常对睡眠质量、工作或学习表现和休闲活动有重大影响,并经常与哮喘共病有关5.据估计,在欧洲,膜翅目昆虫叮咬后的一般过敏反应发生在3.4%的儿童和7.5%的成人中6.尽管诊断标准各不相同,但美国8%的儿童有令人信服的食物过敏史,有或没有医生诊断,其中2%对花生过敏7.速发型过敏反应的相关风险和偶尔的死亡对患者及其家人的健康和生活质量有重大影响。避免过敏原,虽然代表着对过敏性疾病的最佳管理,但通常是不可行的,抗过敏药物对症治疗可能只部分有效。
过敏原免疫治疗包括在数年内反复使用过敏原提取物或产品8,9,10这可能为那些只治疗症状而不治疗根本原因的药物提供一种更持久的解决方案。免疫治疗提供给因吸入过敏原(如花粉和室内尘螨)引起的ige介导的过敏性鼻炎和/或过敏性哮喘的特应性患者,这些患者对抗过敏药物反应不充分或经历了不可接受的药物副作用。皮下免疫治疗可提供给有因昆虫叮咬而发生过敏反应风险的患者6.口服免疫疗法治疗食物过敏一直是一种实验性的方法11.然而,对于花生过敏,现在有一种批准的口服花生产品用于临床实践12,13.
从这个角度,我们回顾了从过去的经验在过敏原免疫治疗过敏性炎症的机制和免疫治疗诱导耐受的见解。我们描述了目前的实践如何发展到包括皮下和舌下途径,建立更安全、更方便的方法,并提高患者对免疫治疗的依从性。我们描述了由于分子过敏症学的进步,过敏原管理的替代途径,以及过敏原免疫治疗与免疫修饰剂或靶向过敏原相关T辅助2 (T辅助2)的单克隆抗体有效结合的潜力,目前的方法可能在未来进一步改进H2)细胞通路。
过敏原免疫治疗简史
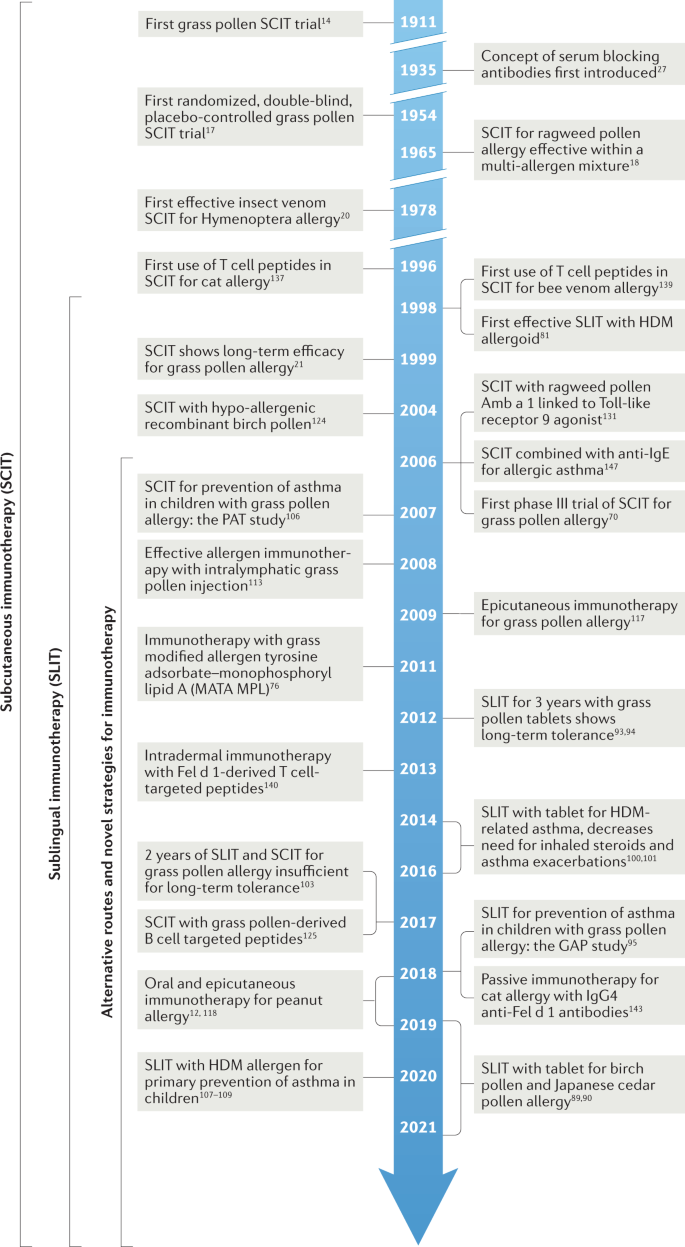
过敏原免疫治疗的关键里程碑时间表如图所示。1.1911年,伦纳德·努恩(Leonard Noon)首次证明,反复向花粉热患者注射粗草花粉提取物可以降低结膜对草花粉的即刻敏感性14.弗里曼报告说,在接下来的花粉季节,他们的鼻炎和哮喘症状减轻了15.尽管花粉被认为是花粉热的病因,但Noon的理论原理尚不清楚16而且,这一概念可能是从使用被杀死的或改良的病原生物预防传染病的预防性接种的平行发展演变而来的https://historyofvaccines.org/history/vaccine-timeline/timeline).
在第一个双盲试验中,Frankland于1954年证实了皮下草花粉注射疗法的疗效17对季节性哮喘的研究表明,导致这种效应的活性包含在过敏原提取物的高分子量蛋白质成分中,而不是洗脱的低分子量组分中。洛厄尔和富兰克林18随后证实了皮下豚草花粉提取物含有多过敏原混合物的功效。1978年,Norman和Lichtenstein首次证明过敏原免疫治疗是过敏原特异性的,豚草花粉提取物在豚草季节有效地缓解双ige致敏个体的症状,但在随后的草花粉季节无效19.同年,Hunt等人证实了皮下纯化膜翅目昆虫毒液免疫疗法的疗效,与整个昆虫身体提取物相比,当与安慰剂相比,严重的昆虫毒液过敏患者20..
值得注意的是,皮下免疫疗法在过去的100年里几乎没有改变,仍然需要每周注射,然后在几年里每月注射维持。1998年,世界卫生组织(世卫组织)的一份立场文件总结了有效性的证据,并确定了风险,特别是在哮喘无法控制的个人中8.根据主要过敏原的纯化和含量,该报告确认了在使用更标准化的过敏原提取物方面取得的进展,并提到了舌下免疫治疗是一种更安全的替代途径的新证据。这在后来世界过敏组织关于舌下免疫治疗的立场文件中得到了支持9.毒液免疫疗法已被证实是一种预防昆虫叮咬后过敏反应的高效疗法6.
1999年,有报道称,持续3年的草花粉提取物皮下免疫治疗在停药3年后产生了长期疗效21.此后多次转载22,23,这一关键观察证实了过敏原免疫治疗的特异性和长期的疾病调节作用。过敏原免疫治疗提供了一个独特的人体模型来研究潜在的长期抗原特异性耐受的免疫事件。证实停药后长期临床疗效的随机对照试验汇总在补充表中S1.
通过过敏原免疫治疗了解免疫耐受
吸入性过敏原过敏的免疫治疗机制
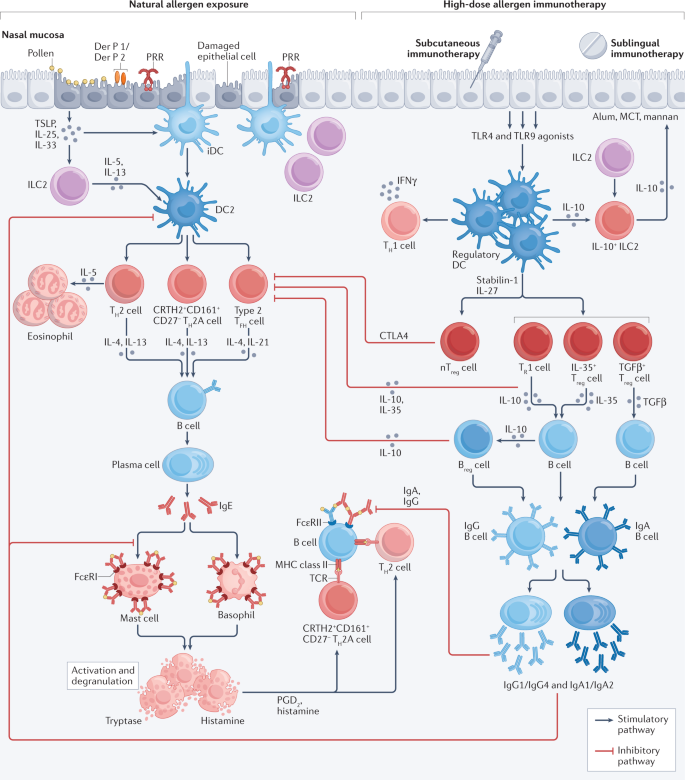
在特应性过敏的个体中,自然暴露于低浓度的环境过敏原会导致过敏性炎症,包括ige介导的肥大细胞激活和组织嗜酸性粒细胞增多,这些事件在TH2型细胞因子(无花果。2).1921年,普劳斯尼茨和库茨纳24是第一个通过血清因子(称为“reagin”,随后在1966年被描述为IgE ?25,26)的直接皮肤IgE敏感性。1935年,Cooke和他的同事发现,过敏原免疫治疗后的“保护性免疫”也可以被被动转移27.他们表明,从豚草花粉花粉热个体免疫治疗后获得的血清,当皮下注射到致敏的未治疗对照组时,可以阻断豚草花粉的直接皮肤反应。这两个观察结果首次表明,过敏(过敏)和保护性免疫(免疫治疗)依赖于被动转移的血清因子,随后分别被确定为过敏原特异性IgE和过敏原特异性IgG/ iga相关的IgE阻断活性。
过敏性炎症包括ige依赖性的肥大细胞激活和局部组织嗜酸性粒细胞增多159在T助手2 (TH2)型细胞因子(IL-4, IL-5, IL-9和IL-13)。先天免疫系统,包括树突细胞的特殊亚群28先天淋巴样细胞(ILCs)47在诱导和调节过敏原诱导的TH2型反应。这些先天细胞受到上皮细胞衍生细胞因子的影响,包括胸腺基质淋巴生成素(TSLP)。160IL-25和IL-33。在特应性过敏的个体中,2型树突状细胞28(DC2s)优先诱导TH2个细胞和一群过敏原刺激的T细胞H2个细胞定义为高表达的CRTH2和CD161和低表达的CD27 (CRTH2+CD161+CD27- - - - - -;简称为TH2细胞)。表达T细胞的另一个子集H2型细胞因子是2t型滤泡辅助因子(T跳频)细胞161,来源于淋巴结边缘区。肥大细胞上邻近的高亲和IgE受体(FcεRI)的过敏原- IgE交联释放颗粒来源的介质,如胰蛋白酶和组胺,以及膜相关的脂质介质,包括前列腺素D2 (PGD)2)和硫多肽白三烯162.过敏原- IgE复合体还与B细胞表面的IgE低亲和力受体(FcεRII)结合,导致IgE促进TH2细胞的发展41,163.在皮下免疫治疗和舌下免疫治疗期间,高剂量过敏原暴露恢复调节性树突状细胞28,29产生IL-10(参考文献。30.,31)和IL-12(参考文献。32,46),抑制TH2细胞反应104,164促进调节性T (T注册)细胞30.,34和B注册)细胞50,51反应和免疫偏差倾向于TH1细胞反应32,45.有优先的B细胞同型转向IgG和IgA104,105导致ige阻断活性41,163,165它既能抑制ige介导的肥大细胞和嗜碱性粒细胞的激活,也能抑制ige促进的抗原呈递和T细胞H2细胞反应44,163.红色箭头表示T注册细胞和B注册和IgG/ iga相关的IgE阻断活性。CTLA4,细胞毒性T淋巴细胞抗原4;iDC,未成熟树突状细胞;未经中华人民共和国交通部,微晶酪氨酸;nT注册细胞;胸腺来源的自然调节性T细胞;模式识别受体PRR;TCR, T细胞受体;TGFβ,转化生长因子β;TLR, toll样受体;TR1个细胞,1型调节性T细胞(特征为CD49b和LAG3共表达)166.
在免疫治疗期间,通过注射或舌下注射给药高剂量的过敏原会诱导具有促调节表型的树突细胞(耐药树突细胞)。28,29.在数周内,周围衍生的调节性T (T注册)表达IL-10的细胞(参考文献。30.,31,32),转化生长因子β (TGFβ)33和IL-35 (ref。34)和胸腺衍生的FOXP3+T注册细胞32.这些细胞可在血液循环和鼻粘膜中检测到35,36花粉免疫疗法。T注册细胞抑制T细胞的分化H通过调节细胞因子以及细胞与细胞之间的相互作用37.IL-10诱导B细胞进行同型类转换,有利于过敏原特异性IgG亚类,包括IgG1(参考文献)。38)和IgG4(参考。35),而TGFβ诱导B细胞优先切换以产生IgA39.这些B细胞分化为浆细胞,合成并释放过敏原特异性IgG1、IgG4、IgA1或IgA2,免疫治疗后可在外周血和鼻液中检测到40.过敏原特异性IgG和IgA与IgE争夺过敏原,直接抑制过敏原- IgE复合物的形成41尽管IgA相对于IgG的阻断活性最近受到了质疑42.这些“阻断抗体”抑制了肥大细胞和嗜碱性粒细胞的ige依赖性激活43.它们还抑制IgE介导的过敏原向低亲和IgE受体(FcεRII)表达的B细胞和高亲和IgE受体(FcεRI)表达的树突状细胞的呈递,从而导致T的减少H2细胞的发展44(无花果。2).
T注册在开始过敏原免疫治疗的几周内,细胞被过敏原启动的调节性树突状细胞诱导31,32.相比之下,高剂量的过敏原暴露,可能通过非专业抗原提呈细胞,启动更延迟的免疫偏移,有利于过敏原驱动的T细胞H1细胞反应32,45在12个月大的时候在血液和目标器官中被检测到。通过皮肤活检的原位杂交,在皮内过敏原挑战后,产生il -12的巨噬细胞和产生干扰素-γ的T细胞的局部增加,伴随着皮肤产生il -4的T细胞的减少和临床症状的改善46.
在上皮细胞因子的调节下,第2组先天淋巴样细胞(ilc2)虽然不能直接对抗原产生反应,但代表了T的另一种来源H2型细胞因子放大和增强局部过敏性炎症47.草花粉过敏原免疫治疗已被证明可以抑制ilc2的季节性增加(参考文献。48),并诱导一个表型独特的ilc2子集,表达表面KLRG1并分泌IL-1049.调节B细胞(B注册细胞)50,51和调节性T注册细胞52也增加并提供免疫治疗后IL-10的进一步来源。
花生过敏的口服免疫治疗机制
与吸入性过敏的免疫治疗相比,食物过敏的免疫治疗53的研究较少,除了花生过敏,现在有一种批准的口服产品含有300毫克的全花生胶囊(AR101),每天服用(PALISADE研究)12.对于草花粉免疫治疗,花生过敏原脱敏的成功伴随着过敏原刺激效应记忆T细胞的显著减少H2细胞表型(特征为CRTH2+CD161+CD27- - - - - -并被称为TH2细胞)54,55.外周T细胞减少的机制H2A细胞未知。而早期的花生口服免疫治疗研究显示,外周血单个核细胞IL-10分泌短暂增加,CD25增加+FOXP3+T细胞56,这可能代表记忆效应T细胞激活,随后PALISADE研究中的详细流式细胞术分析未能显示过敏原刺激的T细胞明显减少H2A细胞伴外周血T增加注册细胞55,尽管这并不排除局部T的可能性注册肠道中的细胞诱导。例如,在一个食物过敏的小鼠模型中,FOXP3的粘膜诱导+T注册细胞依赖于局部CD103+树突状细胞激活和涉及视黄酸途径和分泌TGFβ而不是IL-10(参考文献)。57).花生过敏的个体比ige致敏但不过敏的对照组有更高的过敏原刺激的嗜碱性粒细胞激活水平55,58.在花生口服免疫治疗过程中,一个惊人的发现是嗜碱性粒细胞激活的早期下降(表现为表面CD203c水平的下降),伴随花生特异性IgE的短暂升高和IgG4 / IgE比值的显著升高55功能性ige结合试验减少56.
与吸入性过敏原免疫治疗相比,口服花生免疫治疗尚未显示出令人信服的长期疗效13,53.儿童和年轻人服用药物超过2年59)和超过2.5岁的幼儿(1-4岁,IMPACT研究60),使用高维持剂量(每天4000毫克口服花生),在诱导脱敏方面非常有效,但分别只有13%和21%的参与者在3年(停药后12和6个月)观察到持续无反应。然而,那些出现持续无反应性的患者花生特异性IgE和嗜碱性粒细胞激活的基线水平较低,特异性IgG4与IgE的比值较高,且与未发生反应的患者相比年龄更小(特别是在1岁以下的儿童中)。可能的解释是花生过敏原在诱导多价和高亲和力IgE对构象表位而不是线性表位的反应61,伴随着蓬勃的TH2A细胞反应在免疫治疗停止后迅速复发,和/或缺乏持续的抗原特异性T的有效调节注册细胞反应55.
毒液过敏的免疫治疗机制
20世纪90年代,纯化的毒液过敏原的出现,使得在粗过敏原提取物无脂多糖污染的情况下,研究毒液过敏的免疫机制成为可能。纯化蜂毒过敏原皮下免疫治疗成功后,用磷脂酶A2 (PLA2;一种主要的蜂毒过敏原)表明,特异性T细胞增殖和TH2型和TH一种细胞因子的生产62诱导产生il -10的T细胞注册细胞30.,63.对于毒液免疫治疗,使用加速皮下免疫治疗方案(“急速”和“超急速”方案)快速脱敏已被证明是有效和安全的。64.一个显著的早期事件是,在免疫治疗的几个小时或几天内,通过组胺2受体(HR2)介导的fc ε ri激活的嗜碱性粒细胞的免疫沉默,嗜碱性粒细胞脱敏。65,从而抑制了包括组胺、硫化肽白三烯和细胞因子在内的嗜碱性介质的释放。T细胞上组胺受体亚型的差异调节在产生il -10的T细胞的发展中也被证明是重要的注册HR2与HR1比值的增加有利于产生il -10的T细胞的发展注册细胞66,67.随后的毒液免疫治疗研究强调了在诱导pla2特异性调节B (B注册)细胞50产生IL-10和过敏原特异性IgG4。过敏原特异性IgG4和ige阻断活性在暴露于重复自然螫刺和成功的毒液免疫治疗的养蜂人中得到证实68,69.然而,与吸入性过敏原免疫治疗相比,在停止毒液免疫治疗后,在缺乏持续的igg相关IgE阻断活性的情况下,过敏原特异性IgE反应持续受到抑制69,意味着长期耐受的不同机制。总之,这些研究强调了嗜碱性粒细胞早期快速脱敏、效应细胞和T细胞上组胺受体的差异表达以及B注册作为IL-10和IgG4的替代来源。在停止毒液免疫治疗后,有持续的IgE抑制,而不是延长的igg相关的IgE阻断活性68.
过去20年的感悟
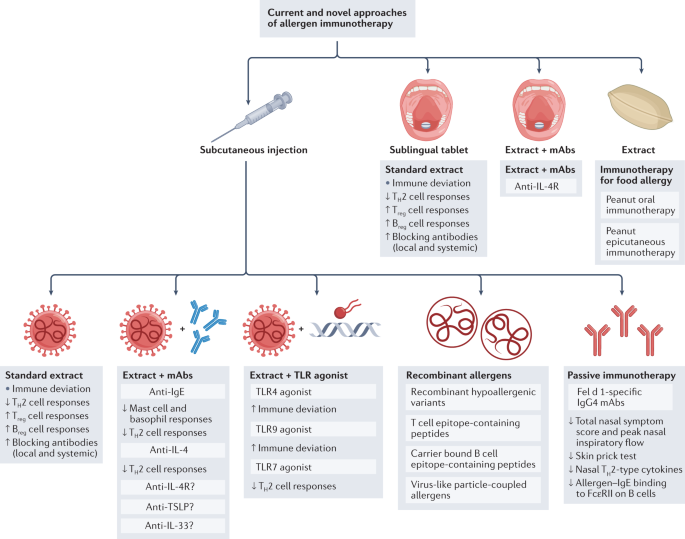
虽然被认为是黄金标准8,9,70在美国,通过皮下注射进行过敏原免疫治疗需要专家监督,因为有过敏反应等副作用的风险。在美国,过敏原提取物是用50%的甘油制备的,甘油作为防腐剂和稳定剂,而在欧洲,提取物是铝沉淀的,这减慢了注射时过敏原的释放,减少了立即的过敏副作用71.近年来,在保持过敏原免疫治疗有效性的同时,也有一些尝试提高患者的安全性和便捷性。这些包括使用改良的过敏原(称为过敏原)和替代免疫治疗途径,如下文所述。数字3.综述了目前过敏原免疫治疗的新方法。
目前,对吸入性过敏的长期耐受可能只能通过标准的全过敏原免疫治疗,通过皮下或舌下途径。为了更好地利用已知的潜在机制,人们正在探索新的策略,以实现更安全、有效、更方便的治疗方案和更持久的长期耐受性。这些包括过敏原提取物与针对T辅助蛋白2的单克隆抗体(mAbs)的结合H2)细胞通路,或与免疫修饰剂如toll样受体(TLR)激动剂。分子过敏症学使得更准确的过敏症诊断和重组全过敏原和低过敏原变异的发展成为可能,在未来,可能导致更个性化的“定制”过敏原免疫治疗。过敏原来源多肽已被开发,专门针对潜在的T或B细胞依赖通路。这些可能更安全,尽管到目前为止,它们还没有显示出比针对两种途径的整个过敏原方法更有效。基于过敏原免疫治疗诱导IgE阻断抗体的已知能力,通过注射针对主要过敏原IgE表位的IgG4单克隆抗体鸡尾酒的被动免疫治疗已被证明能成功抑制人鼻腔过敏原挑战反应。花生过敏儿童口服免疫疗法在诱导“脱敏”方面非常有效,但长期耐受仍然难以实现,而且治疗有时会伴有严重的全身副作用。婴幼儿早期干预和/或使用过敏原组合策略可以克服这些问题。使用花生过敏原贴片的皮外方法脱敏效果可能较差,但能够降低接触花生微量物质后发生过敏反应的风险,这可能是一种更可行的方法,治疗相关系统性副作用的风险较低。B注册细胞,调节B细胞;FcεRII, IgE低亲和受体;IL-4R interleukin-4受体;T注册调节性T细胞;胸腺间质淋巴生成素。
修改后的过敏原
用戊二醛或甲醛对过敏原进行化学修饰以产生过敏原72,73其三级结构改变,致敏性降低,与标准提取物相比,其疗效中等,但在减少过敏副作用方面没有明显的好处。过敏原副作用的这种未改变的风险可能是由于保留的IgE表位,暴露之前潜伏的IgE表位或在加工过程中获得新的IgE表位。类似地,从过敏原中产生“中等长度肽”,或通过受控水解74或合成75基于已知的主要过敏原序列的多肽,保留了产生保护性IgG反应的能力,并降低了体外诱导人嗜碱性粒细胞激活的能力。这些方法使用了较短的治疗方案,例如,3到6次季节前注射花粉过敏76.因此,与使用传统标准化过敏原提取物的更长疗程数年相比,它们充其量只显示出中等疗效,而且在安全性方面没有优势,这并不令人惊讶。目前还没有将这些方法与传统的过敏原提取物进行正面比较。(重组变应原混合物和低变应原变异在“新的免疫治疗策略”中讨论。)
舌下免疫治疗
在吸入过敏原口服免疫治疗失败后77可能由于胃对过敏原的消化,舌下免疫治疗被认为是直接接触上呼吸道共有的局部淋巴组织和区域引流淋巴结的一种方法。口腔黏膜是已知的免疫特权部位,反映为耐受日常暴露于高水平的食物蛋白,而不发展为过敏的绝大多数个体78.此外,与其他黏膜表面相比,口腔黏膜内树突状细胞含量较高,肥大细胞较少79.此外,在小鼠模型中,舌下途径被证明对诱导过敏原特异性耐受有效80.
人类过敏性鼻炎的研究表明舌下免疫治疗是皮下免疫治疗的一种有效和安全的替代方案9,81.治疗方法包括每天将过敏原提取液放入液体中82,83,84或平板电脑85,86形式,在舌下,可以在医生的监督下自我服用第一剂9.系统综述和荟汇分析已经证实了季节前或季节同步免疫治疗对季节性鼻炎和持续治疗因HDM过敏原引起的常年鼻炎的疗效87.最近充分动力的随机对照试验舌下片已显示出一致的疗效季节性过敏性鼻炎由草85,86,豚草88、桦木89和日本雪松90花粉过敏。该治疗对症状和/或使用抢救性药物的效果大小始终比安慰剂治疗好30-40%,与草花粉提取物皮下免疫治疗的3期试验观察到的结果相似,并与世界过敏组织提出的20%的临床疗效最小重要差异相比较91.舌下片剂与药物治疗比较的间接meta分析显示,疗效优于抗组胺片,且与鼻内皮质类固醇观察到的疗效相当92.
现在有三项针对成年人的研究90,93,94一个是5-12岁的儿童95证实每日舌下过敏片治疗3年可在停止治疗后至少2年产生长期临床效益(见补充表)1).四项独立研究表明,对hdm诱导的常年鼻炎给予超过12个月的舌下片治疗是有效的96,97,98,99.与安慰剂相比,花粉舌下免疫疗法的效应量较小,约为17-20%,可能与难以选择HDM- ige致敏个体有关,在这些个体中,HDM是导致鼻炎的原因,而不是其他常年的非过敏性原因96,97,98,99.在hdm诱导的过敏性哮喘中,舌下片免疫治疗减少了吸入性皮质类固醇的需求One hundred.降低了哮喘急性发作的几率101.在欧洲,HDM片剂免疫疗法已被批准用于这些适应症,并作为低至高剂量吸入性皮质类固醇引起的HDM过敏性哮喘患者的附加治疗选项(https://ginasthma.org/reports/).
皮下和舌下过敏原免疫治疗
欧洲过敏和临床免疫学学会最近发布了基于证据的治疗指南,确认了皮下和舌下过敏原免疫治疗季节性和常年性过敏性鼻结膜炎的有效性、安全性和长期效益102.最近的一项临床试验比较了皮下草花粉免疫治疗和舌下草花粉片免疫治疗103.两种方法在临床反应方面都是有效的,但与任何一种治疗3年相比,2年的治疗不足以在停止治疗1年后保持耐受。流式细胞术证实两种途径均能抑制过敏原特异性TH2年2个细胞的反应在3年逆转,伴随着临床疗效的丧失。同样,抑制TH鼻黏膜2型细胞因子(IL-4, IL-5, IL-9和IL-13)在3年逆转104.相比之下,血清ige阻断活性,通过抑制ige促进的过敏原ige与B细胞的结合和过敏原刺激的嗜碱性粒细胞的激活,被抑制,并持续了3年。血清和鼻液中均有阻断抗体。对于皮下免疫治疗,ige抑制活性主要由IgG4介导,而对于舌下免疫治疗,局部鼻腔和全身阻断抗体主要是IgA1和/或IgA2(参考文献)。105).虽然推测性的,但这些数据支持这样的观点:当抑制TH2型反应是诱导过敏原特异性耐受的必要条件,B细胞室的长期改变可能是耐受持续的必要条件104.
免疫治疗在哮喘中的二级预防作用由两项皮下研究提示106和舌下95免疫治疗5 - 12岁季节性鼻炎儿童,其中3年的治疗减轻了哮喘症状和5岁时对哮喘药物的需求。
在初步研究中已经对婴儿吸入剂过敏的一级预防进行了测试107,108.一项HDM舌下滴剂的安慰剂对照试验在6-18个月大、过敏风险高的婴儿中进行。多种过敏原致敏降低108在6岁时,哮喘患病率似乎有所下降109.尽管这些数据是初步的,但这些数据为开展更大规模的HDM免疫疗法用于高危婴儿哮喘一级预防的前瞻性对照试验提供了激励。全变应原或重组野生型样变应原增强IgE反应,具有诱导IgE致敏的潜力,而改性变应原衍生物或低致敏肽则不太可能诱导IgE110,111因此,它可能在未来的初级预防中有更大的前景。
免疫治疗的替代途径
淋巴内免疫治疗包括在超声引导下将过敏原提取物注射到淋巴结,通常在腹股沟112.这种方法的基本原理是,直接针对免疫系统可以更有效地增强过敏原向T细胞的呈递,同时避免直接肥大细胞激活。小型安慰剂对照试验显示,从草花粉中提取的提取物有一定的益处113和树花粉114.在一项对猫过敏的参与者进行的小型研究中115将重组猫Fel d1过敏原与易位序列和人类不变链片段融合,以增强免疫原性。与接受安慰剂治疗的参与者相比,每隔4周三次淋巴内注射Fel d1融合蛋白可防止全猫过敏原提取物的鼻腔刺激。一些研究已经表明,通过淋巴内途径的短疗程注射对草花粉过敏的疗效113,114,116,尽管这并没有在所有的研究中得到证实112.
吸入性过敏原的口服免疫治疗尚未有效77,可能是因为过敏原提取物被胃酸降解。相比之下,口服花生免疫疗法被证实对儿童有效,尽管它有很高的患病率的副作用。例如,在4-17岁儿童的3期试验中12在美国,67.2%的接受花生治疗的受试者达到了对花生的预定反应阈值,而接受安慰剂治疗的受试者为4.0%,但胃肠道副作用很常见。在接受安慰剂治疗的患者中,发生全身过敏副作用的比例为14.2%,而发生过敏反应的比例为3.2%,包括1例过敏反应。尽管口服花生免疫治疗可有效脱敏59在美国,长期耐受性,即使是伴随副作用的高剂量药物,也是难以捉摸的13.
开发表皮途径是为了利用皮肤中大量的树突状细胞,以促进极低过敏原浓度的过敏原处理117.通过皮肤贴片给有花生过敏的儿童(4-11岁)注射花生提取物,35.3%的儿童对口服花生过敏,而接受安慰剂治疗的13.6%的儿童对口服花生过敏,副作用更小,主要局限于局部局部反应118.目前,不建议花生免疫疗法用于专科中心以外的常规护理。然而,早期引入含有花生的食物来预防婴儿的花生过敏是非常有效的119.现在,有严重湿疹或鸡蛋过敏的婴儿通常建议在4-6个月大的时候食用花生,这些婴儿很容易产生花生过敏120.同样,对于1-4岁的花生致敏并有症状的儿童,口服花生免疫治疗已被证明是有效和安全的,如果在他们疾病的病程早期,当过敏原特异性IgE抗体水平非常低时,就进行口服花生免疫治疗60.
新颖的免疫治疗策略
分子变态反应学
大多数常见吸入剂和食物中的过敏原现在已经被克隆出来。这使得IgE对主要过敏原(超过50%的个体识别)和次要过敏原的敏感性的精确分子诊断成为可能,并能够识别临床相关性较小的交叉反应表位121.准确的分子诊断可能有助于为免疫治疗量身定制过敏原提取的选择,这可能转化为改善的结果。在治疗过程中也有机会更精确地监测相关IgE和IgG反应。DNA技术使重组过敏原的生产成为可能122,重组混合物123以及免疫治疗的低致敏性变种124,125精确匹配个体的敏感性,而不会有IgE对无关过敏原致敏的风险126.然而,尽管这些重组疫苗和重组低致敏变异体在二期试验中有效122,123到目前为止,它们还没有显示出与目前可用的标准化过敏原提取物相比在有效性或安全性方面的额外好处122.一种靶向B细胞选择性产生IgG反应的低致敏性重组变体将在下面讨论125.
dna疫苗
dna疫苗127已经在小鼠过敏模型上测试过了吗127,128并显示出诱导优先TH1细胞和T细胞注册细胞反应和下调TH2细胞反应129.然而,基于将质粒DNA合并到人类基因组中诱导致癌的理论风险,抗DNA抗体的发展,以及长期过敏原持久性的未知影响,可能引发广泛的IgE触发和过敏反应的风险,对它们在人类中的重复使用存在保留意见128.在对日本雪松花粉过敏的患者中测试的一种方法是将溶酶体相关膜蛋白1 (LAMP1)合并到编码日本雪松花粉主要过敏原Cry j2的质粒载体中。LAMP1将质粒靶向到溶酶体腔室,以降低细胞释放游离过敏原的风险,从而降低过敏反应的风险130.在每隔2周进行4次肌内注射后,12名参与者中有10人在4个月时对Cry j2的立即皮肤试验反应有抑制作用,但没有其他临床结果的信息。
另一种基于DNA的方法是将过敏原与含有CpG基序的细菌DNA序列结合,以选择性靶向人类B细胞和树突状细胞上表达的toll样受体9 (TLR9)。豚草花粉主要过敏原Amb a1与b型cpg -寡核苷酸(ODN)共价连接131在豚草花粉诱导的花粉热的2期试验中获得成功,尽管这在3期试验中没有得到证实,该方法被终止。另一种方法是将HDM提取液与a型CpG ODN (G10)混合,封装在病毒样颗粒中,该颗粒来自噬菌体Qb (QbG10)的表面蛋白外壳。132.该方法的目的是保护过敏原IgE的触发,促进过敏原的摄取,并共同刺激TLR9增强hdm刺激的T注册细胞形成和/或TH一种免疫偏移。在一项2期试验中,对过敏性鼻结膜炎患者每隔1-2周进行6次皮下注射含有过敏原cpg odn的病毒样颗粒,可有效抑制结膜对HDM刺激的直接反应。矛盾的是,单独QbG10和QbG10 - hdm组合一样有效,这表明CpG ODN病毒样颗粒对先天免疫反应的直接影响可能足以阻止过敏原特异性反应132.然而,随后QbG10单独治疗严重过敏性哮喘的安慰剂对照试验结果不一致133,134.
最后,基于mRNA构建的疫苗在小鼠过敏模型中成功诱导1型免疫偏离和抑制过敏性炎症135.它们在COVID-19大流行中对SARS-CoV-2的成功将不可避免地激发人们对mRNA疫苗未来是否可能在治疗过敏性疾病方面发挥作用的兴趣。
有针对性的方法
过敏原免疫治疗的一个重要问题是,新的策略是否应该主要针对T细胞反应,而过敏反应的风险最小或没有136或者,以主要B细胞反应为靶点,这种反应有利于产生具有ige阻断潜力的IgG和IgA反应104.
靶向T细胞的抗原特异性方法包括使用短链T细胞肽组合,该组合是基于对单个主要过敏原的体外人T细胞表位定位和广泛的hla -限制库开发的,使大多数靶向过敏人群能够识别肽。目的是在缺乏明显的IgG抗体反应的情况下,选择性地驱动“保护性”T细胞反应136,137,138.尽管可以将ige介导的过敏反应的风险降至最低,但仍有可能诱导T细胞依赖性的晚期哮喘反应。在一项初步研究中,有蜂毒过敏史的患者在2个月内皮下注射了增加剂量的PLA2 T细胞表位多肽混合物。尽管所有5名接受治疗的参与者都能够忍受PLA的皮内刺激,但其中2名在活蜜蜂叮咬后出现全身反应,这意味着保护不完全139.在猫过敏的患者中,在控制暴露于全猫过敏原的环境挑战室中,每隔2-4周皮下注射7个Fel d1肽(包括13-17个氨基酸)的混合物,在12周内降低了鼻结膜炎症状评分。1年时,症状明显减轻,提示诱导长期临床耐受性140.然而,一项Fel d1肽免疫疗法的三期现场试验(ClinicalTrials.govNCT01620762)141是不成功的。这可能是由于在对照人群中观察到的高安慰剂反应,或选择猫的主人(与猫的回避者相反),由于自然过敏原暴露,他们可能已经表现出一定程度的耐受性。在hdm衍生T细胞肽免疫治疗的第三期试验(NCT02150343)再次失败后142节目被叫停了。
在传统的过敏原免疫治疗中,阻断抗体的检测支持B细胞反应的选择性靶向27,40最近的研究发现产生il -10的B细胞增加注册蜂毒免疫疗法中的细胞50和HDM过敏51.这一概念在猫过敏个体被动免疫试验中得到了进一步的支持。单次皮下注射两种重组抗fel d1抗体的混合物,可对整个猫过敏原提取物的鼻刺激产生保护作用,这种保护作用持续了近3个月143.鼻液T含量减少H2型细胞因子和伴随血清和鼻腔ige阻断活性的增加144.这种方法已经在季节性桦树花粉过敏中得到了复制,针对桦树主要过敏原Bet v 1的三种单克隆抗体的鸡尾酒有效地抑制了桦树花粉鼻腔挑战的临床反应至少2个月145.
一种补充方法包括选择性诱导T细胞反应最小的过敏原特异性阻断抗体,包括用重组过敏原来源的B细胞肽进行主动免疫。重组非ige反应性线性多肽(BM32)的混合物从草花粉过敏原Phleump1、2、5和6融合到一个载体蛋白上(Pre-S蛋白,来源于丙型肝炎病毒)125.181名受试者的安慰剂对照现场研究显示,BM32治疗后,过敏原特异性IgG1和IgG4增加,IgE反应变化极小。季节性联合症状用药评分的初步分析令人鼓舞,但没有达到显著性,尽管哮喘症状评分和生活质量评分有所改善125.正在等待第三期试验的结果。
过敏原的组合策略
过敏原与TLR激动剂或与最近可用的靶向TH2细胞通路为提高疗效和长期耐受性提供了新的机会。针对通常146如TLR4与选择性激动剂结合过敏原,目的是有利于TH1个细胞的反应除以TH2个细胞的反应,已经在3期试验中进行了测试。四次TLR4激动剂单磷脂A联合草花粉过敏原的注射显示了中等的疗效,联合症状-药物治疗得分降低了13%76.
过敏原与抗ige单克隆抗体(omalizumab)联合作为辅助或前处理与吸入性过敏原免疫治疗可降低症状评分和全身ige介导的副作用,但对长期耐受性无影响147,148.
草花粉皮下免疫疗法联合抗il -4抗体下调循环中il -4表达的TH但与单独的过敏原相比,对过敏原诱导的皮肤迟发反应的抑制程度或持续时间没有影响149.草花粉过敏原与抗il -4受体(抗il - 4r)抗体的结合将针对il -4依赖和il -13依赖的途径,目前正在用两种吸入免疫疗法进行测试(NCT04502966)150,151口服花生免疫疗法(NCT03682770)152.
先天免疫反应的重要性涉及呼吸上皮细胞和树突状细胞和ilc的不同亚群,优先驱动TH细胞反应越来越被人们所认识47.抗ox40联合过敏原是转移TH2型反应153.过敏原与抗致敏上皮细胞因子抗体的组合,如胸腺基质淋巴生成素(TSLP) (NCT02237196)154和IL-33 (ref。155)目前正在评估中。
视角
目前,我们实现对吸入性过敏的长期耐受的最佳方法是用全过敏原提取物进行3年的过敏原免疫治疗102.这是基于已证实的长期临床疗效与下调过敏原特异性TH2细胞反应和“保护性”抗体反应持续增加,在治疗停止后持续很长时间21,23,93.对于皮下途径,ige抑制活性主要是IgG,而对于舌下免疫治疗,IgA是主要的同型105.事实上,舌下和皮下免疫治疗涉及不同的机制,这意味着有可能在耐药病例中结合两种治疗。哮喘的免疫治疗仍然是一个很大的未满足的需求,舌下途径可能是更可取的,基于安全性和已证实的HDM舌下片减少类固醇负担的效果One hundred.防止哮喘恶化101.
分子过敏原学的进展提供了重组过敏原,有助于更精确地诊断过敏原和选择患者进行过敏原免疫治疗126.目前,重组过敏原免疫治疗在疗效和安全性方面并没有比现有的全过敏原提取物更有价值122,123但重组的低致敏变异可能有这样的潜力。在未来,免疫治疗可能涉及包含主要过敏原或低过敏原变异的量身定制疫苗,基于个性化的IgE敏感性档案121.到目前为止,针对T细胞反应的过敏原修饰和减少ige依赖性副作用的效果有限140这表明同时靶向T细胞和B细胞臂很重要。然而,重组IgG4抗体的被动免疫治疗或靶向B细胞的重组过敏原多肽的主动免疫,有利于优先的IgG抗体反应被证明是安全和有效的125第三阶段试验目前正在进行中。考虑到IgE-阻断抗体对长期临床疗效的关键要求,未来的研究需要确定这是否需要B细胞IgG反应的持续亲和成熟(即更有效地结合单个表位)在长时间暴露或由于多克隆性增加而增加的阻断抗体的亲和力(即识别更多的表位,更有效地阻断IgE交联)156).
联合策略为提高常规免疫治疗的疗效和安全性,以更短更方便的疗程实现长期耐受提供了新的机会。基于已知的免疫治疗机制,这些“过敏原+”策略包括与TLR激动剂的联合76,131或针对IgE的单克隆抗体148或TH2细胞通路150,151.一种有吸引力的方法是将过敏原与靶向“上游”上皮细胞因子的抗体结合在一起H2细胞通路154,155.
口服免疫治疗食物过敏后的长期耐受被证明是难以捉摸的53.最近的一项突破是,对4岁以下的幼儿进行花生口服免疫治疗的早期干预,如果与特异性IgE水平低和嗜碱性粒细胞激活降低相关,可能会导致几个月对口服花生挑战持续无反应(IMPACT研究)60.在进行安全性研究之前,在这个年龄组中,包括抗tslp或抗il -33抗体的联合策略似乎可以诱导更持久的耐受性154,155.用花生表皮免疫疗法直接靶向树突细胞已被证明比口服途径更安全,尽管效果较差118.然而,持续的表皮花生免疫治疗可能会降低意外接触微量花生引起过敏反应的风险,这可能是一个更现实的目标,而不是试图通过口服花生免疫治疗实现长期耐受,伴随治疗引起过敏反应的风险13.
由于早期引入花生作为初级预防策略的显著成功和安全119,120在美国,正在对有过敏风险的婴儿进行类似的研究,以预防其他食物过敏,包括虾和腰果157和牛奶158过敏。因此,考虑初级预防策略以防止吸入剂过敏是合乎逻辑的。例如,初步数据表明,对有风险的婴儿进行舌下HDM治疗,有可能防止儿童后期发生过敏性哮喘108,109.
参考文献
过敏:未被满足的需求。中国。地中海。3., 303 - 305(2003)。
Meltzer, e.o.等人。过敏性鼻炎的负担:来自美国儿童过敏调查的结果。j .过敏中国。Immunol。124S43-S70(2009)。
Meltzer, e.o.等人。过敏性鼻炎的负担:美国、拉丁美洲和亚太地区成人的过敏调查。过敏哮喘Proc。33S113-S141(2012)。
欧洲过敏性鼻炎的患病率和诊断率。欧元。和。J。24, 758 - 764(2004)。
Bousquet, J.等。过敏性鼻炎及其对哮喘的影响(ARIA) 2008年更新(与世界卫生组织、GA(2)LEN和AllerGen合作)。过敏638 - 160(2008)。
斯图姆,G. J.等。EAACI过敏原免疫治疗指南:膜翅目蜂毒过敏。过敏73, 744 - 764(2018)。
古普塔,R. S.等。美国儿童食物过敏的患病率、严重程度和分布。儿科128e9-e17(2011)。
Bousquet, J.等。变应原免疫疗法:变态反应性疾病的治疗性疫苗。世界卫生组织。美国过敏、哮喘和免疫学会。安。过敏哮喘Immunol。81, 401 - 405(1998)。
卡尼卡,G. W.等。舌下免疫治疗:世界过敏组织立场文件2013年更新。世界变态反应器官。J。76(2014)。
考克斯,L.等。过敏原免疫治疗:实践参数第三次更新。j .过敏中国。Immunol。127S1-S55(2011)。
Pajno, G. B.等。过敏原免疫治疗EAACI指南:ige介导的食物过敏。过敏73, 799 - 815(2018)。
PALISADE临床研究小组。花生过敏AR101口服免疫疗法。心血管病。j .地中海。379, 1991 - 2001(2018)。
朱,D. K.等。口服免疫治疗花生过敏(PACE):疗效和安全性的系统综述和荟萃分析。《柳叶刀》393, 2222 - 2232(2019)。
中午,L.花粉病预防接种。《柳叶刀》1, 1572 - 1573(1911)。
预防花粉热的疫苗接种:过去三年的结果报告。《柳叶刀》183, 1178 - 1180(1914)。
不成立,C。卡他病(花粉热或花粉哮喘)性质及原因的实验研究(牛津历史书,1873)。
Frankland, a . W. & Augustin, R.夏季花粉热和哮喘的预防:比较粗草花粉提取物和分离的主要蛋白质成分的对照试验。《柳叶刀》266, 1055 - 1057(1954)。
洛厄尔,f.c.和富兰克林,W.注射治疗豚草花粉热的有效性和特异性的双盲研究。心血管病。j .地中海。273, 675 - 679(1965)。
免疫治疗的临床和免疫特异性。j .过敏中国。Immunol。61, 370 - 377(1978)。
亨特,K. J.等。免疫治疗昆虫超敏反应的对照试验。心血管病。j .地中海。299, 157 - 161(1978)。
达勒姆,S. R.等。草花粉免疫疗法的远期临床疗效。心血管病。j .地中海。341, 468 - 475(1999)。
Bozek, A., Cudak, A. & Walter Canonica, G.注射变应原免疫疗法治疗老年变应性鼻炎患者草花粉过敏的长期疗效。过敏哮喘Proc。41, 271 - 277(2020)。
Penagos, M. & Durham, S. R.过敏原免疫治疗的长期耐受性和预防。j .过敏中国。Immunol。149, 802 - 811(2022)。
普劳斯尼茨& Küstner, H. studen über die Überempfindlichkeit[德语]。Zentralbl Bakteriol。(源自。一个)86, 160 - 169(1921)。
哮喘患者一种新的免疫球蛋白(IgND)水平升高。《柳叶刀》2, 951 - 953(1967)。
石坂,K,石坂,T. & Hornbrook, M. M. reaginic抗体的理化性质。五、reaginic活性与γ- e球蛋白抗体的相关性。j . Immunol。97, 840 - 853(1966)。
Cooke, R. A, Barnard, J. H, Hebald, S. & Stull, A.在一种人类过敏(花粉热)中,免疫与致敏共存的血清学证据。j . Exp。地中海。62, 733 - 750(1935)。
Gueguen, C.等。与树突状细胞相关的标记的变化驱动T细胞的分化H2细胞或调节性T细胞与过敏原免疫治疗的临床疗效相关。j .过敏中国。Immunol。137, 545 - 558(2016)。
齐默等人。调节性树突状细胞信号与过敏原特异性舌下免疫治疗的临床疗效相关。j .过敏中国。Immunol。129, 1020 - 1030(2012)。
白介素10在特异性免疫治疗中的作用。j .中国。投资。102, 98 - 106(1998)。
弗朗西斯等。花粉免疫治疗:IL-10的诱导和后期反应的抑制先于IgG4抑制抗体活性。j .过敏中国。Immunol。121, 1120 - 1125。e2(2008)。
Bohle, B.等。舌下免疫治疗诱导产生il -10的T调节细胞、过敏原特异性T细胞耐受和免疫偏差。j .过敏中国。Immunol。120, 707 - 713(2007)。
O 'Hehir, R. E.等人。屋尘螨舌下免疫治疗:转化生长因子-β和功能调节T细胞的作用。点。j .和。暴击。保健医疗。180, 936 - 947(2009)。
Shamji, m.h.等人。IL-35在舌下过敏原免疫治疗中的作用。j .过敏中国。Immunol。143, 1131 - 1142。e4(2019)。
Nouri-Aria, K. T.等人。花粉免疫疗法诱导粘膜和外周IL-10反应和阻断IgG活性。j . Immunol。172, 3252 - 3259(2004)。
Radulovic, S, Jacobson, m.r., Durham, s.r.和Nouri-Aria, K. T.草花粉免疫疗法诱导foxp3表达CD4+CD25+鼻粘膜中的细胞。j .过敏中国。Immunol。121, 1467 - 1472。e1(2008)。
凌,E. M.等。CD4细胞的关系+CD25+调节性t细胞抑制过敏原驱动的t细胞激活对特应性状态和变态反应性疾病的表达。《柳叶刀》363, 608 - 615(2004)。
埃尔纳斯,a.m., Bodtger, U., Larsen, J. N. & Svenson, M.桦树花粉特异性免疫疗法诱导的IgG4阻断活性在定性上并不优于其他IgG亚类。摩尔。Immunol。41, 471 - 478(2004)。
皮莱特,C.等人。草花粉免疫治疗诱导与粘膜TGF-β表达相关的过敏原特异性IgA2抗体反应。j . Immunol。178, 4658 - 4666(2007)。
Shamji, m.h.等人。鼻过敏原中和IgG4抗体阻断ige介导的反应:皮下草花粉免疫治疗的新生物标志物。j .过敏中国。Immunol。143, 1067 - 1076(2019)。
van der Heijden, F. L, Joost van Neerven, R. J, van Katwijk, M., Bos, J. D. & Kapsenberg, M. L.血清ige促进特应性疾病中的过敏原呈递。j . Immunol。150, 3643 - 3650(1993)。
他,Y.等人。IgE阻断活性的诱导Dermatophagoides pteronyssinus皮下免疫治疗与特异性IgA无关,但与血清和唾液中的IgG4相关。Int。拱门。过敏Immunol。182, 1231 - 1244(2021)。
Shamji, m.h.等人。草花粉过敏个体鼻过敏原挑战后外周血效应细胞特征。过敏70, 171 - 179(2015)。
Wurtzen, P. A.等。一项双盲对照桦树过敏疫苗接种研究II: IgE结合抑制、组胺释放和促进过敏原呈现之间的相关性。中国。Exp。过敏38, 1290 - 1301(2008)。
达勒姆,S. R.等。花粉免疫疗法抑制过敏原诱导的CD4浸润+鼻粘膜中的T淋巴细胞和嗜酸性粒细胞增加了表达干扰素-γ信使RNA的细胞数量。j .过敏中国。Immunol。97, 1356 - 1365(1996)。
Hamid, Q. A, Schotman, E, Jacobson, m.r., Walker, s.m.和Durham, s.r. IL-12信使RNA增加+花粉免疫治疗成功后,细胞伴着过敏原诱导的迟发性皮肤反应的抑制。j .过敏中国。Immunol。99, 254 - 260(1997)。
Licona-Limon, P., Kim, l.k, Palm, n.w. & Flavell, R. A. TH2、过敏和2组先天淋巴样细胞。Immunol Nat。14, 536 - 542(2013)。
Lao-Araya, M., Steveling, E., Scadding, g.w, Durham, s.r.和Shamji, m.h.皮下草花粉免疫疗法抑制了周围固有2型淋巴细胞的季节性增加。j .过敏中国。Immunol。134, 1193 - 1195。e4(2014)。
Golebski, k。通过过敏原免疫治疗诱导产生il -10的2型固有淋巴样细胞与临床反应相关。免疫力54, 291 - 307。e7(2021)。
van de Veen, w等人。IgG4的产生仅限于人类产生il -10的调节B细胞,这些B细胞抑制抗原特异性免疫反应。j .过敏中国。Immunol。131, 1204 - 1212(2013)。
Boonpiyathad, t等人。在2年室内尘螨特异性免疫治疗中Der p1特异性B细胞在免疫耐受中的作用j .过敏中国。Immunol。143, 1077 - 1086。e10汽油(2019)。
谢里夫,H.等人。草花粉皮下和舌下免疫治疗后循环T滤泡辅助细胞和调节细胞染色质景观的改变。j .过敏中国。Immunol。147, 663 - 676(2021)。
食物过敏:免疫机制、诊断和免疫治疗。启Immunol Nat。16, 751 - 765(2016)。
Wambre, E.等。一种在表型和功能上截然不同的人类TH2细胞亚群与过敏性疾病相关。科学。Transl。地中海。9eaam9171(2017)。
Bajzik, V.等人。花生过敏口服脱敏治疗诱导花生特异性免疫反应的动态变化。过敏77, 2534 - 2548(2022)。
维克里,B. P.等。完成花生口服免疫治疗的受试者对花生持续无反应。j .过敏中国。Immunol。133, 468 - 475(2014)。
库姆斯等。黏膜CD103的功能特异性群体+DCs诱发Foxp3+调节T细胞通过TGF-β和维甲酸依赖机制。j . Exp。地中海。204, 1757 - 1764(2007)。
桑托斯,A. F.等。口服花生挑战过程中过敏反应严重程度和阈值的生物标志物。j .过敏中国。Immunol。146, 344 - 355(2020)。
钦特拉迦,R. S.等人。花生过敏口服免疫治疗的持续疗效(平衡研究):一项大型、随机、双盲、安慰剂对照的2期研究。《柳叶刀》394, 1437 - 1449(2019)。
琼斯,s.m.等。口服免疫疗法对1-3岁花生过敏儿童的疗效和安全性(免疫耐受网络影响试验):一项随机安慰剂对照研究《柳叶刀》399, 359 - 371(2022)。
Suarez-Farinas, M.等人。加入LEAP试验的儿童表位特异性IgE和IgG4抗体的进化。j .过敏中国。Immunol。148, 835 - 842(2021)。
Jutel, M.等。蜂毒免疫治疗可导致特定过敏原刺激的T细胞培养物中IL-4和IL-5的减少,IFN-γ的分泌增加。j . Immunol。154, 4187 - 4194(1995)。
Akdis, C. A.等。蜂毒免疫治疗中表位特异性T细胞对磷脂酶A2的耐受及IL-2和IL-15的体外恢复j .中国。投资。98, 1676 - 1683(1996)。
斯托克,R.等。毒液免疫治疗的安全性和耐受性:581种匆忙和超匆忙诱导方案的评价(匆忙和超匆忙毒液免疫治疗的安全性)。世界变态反应器官。J。14100496(2021)。
诺瓦克,N.等。组胺受体2对过敏原特异性免疫治疗过程中嗜碱性粒细胞激活的早期抑制。j .过敏中国。Immunol。130, 1153 - 1158。e2(2012)。
张丽娟,张丽娟。组胺和组胺受体表达在人过敏免疫反应中的调节作用。化学。Immunol。过敏94, 67 - 82(2008)。
Jutel, M.等。组胺通过H1和H2受体的差异表达调节t细胞和抗体反应。自然413, 420 - 425(2001)。
瓦尔加,e.m.等人。儿童蜂毒免疫治疗过程中促进过敏原- ige结合的血清抑制活性的时间过程。中国。Exp。过敏39, 1353 - 1357(2009)。
瓦尔加,e.m.等人。耐受的养蜂人在缺乏特异性IgE的情况下显示出毒性特异性的功能IgG4抗体。j .过敏中国。Immunol。131, 1419 - 1421(2013)。
Frew, a.j, Powell, R. J, Corrigan, C. J.和Durham, S. R. SQ过敏原提取物特异性免疫治疗耐药季节性变应性鼻结膜炎的疗效和安全性。j .过敏中国。Immunol。117, 319 - 325(2006)。
铝沉淀和未沉淀豚草花粉水提取物治疗花粉热的比较。j .过敏中国。Immunol。61, 384 - 389(1978)。
马什,D. G,利希滕斯坦,l.m.和坎贝尔,D. H.从自然发生的过敏原制备的“过敏原”的研究。一、甲化黑麦I组成分的致敏性和抗原性测定。免疫学18, 705 - 722(1970)。
Worm, M.等。桦树花粉过敏原皮下免疫治疗的有效性和安全性:2年双盲、安慰剂对照、随机试验加上1年开放标签扩展。中国。Exp。过敏49, 516 - 525(2019)。
Mosges, R.等人。随机,双盲,安慰剂对照,剂量发现试验多年生黑麦草肽免疫疗法。过敏73, 896 - 904(2018)。
Kettner等人。Bet v1连续重叠肽免疫治疗的疗效在第一个随访季节持续。j .过敏中国。Immunol。142, 678 - 680。e7(2018)。
DuBuske, l.m.等。超短特异性免疫疗法成功治疗草花粉引起的季节性过敏性鼻结膜炎。过敏哮喘Proc。32, 239 - 247(2011)。
陶道夫,E.和周克,B.口服草花粉。过敏38, 561 - 564(1983)。
N.诺瓦克,J.哈伯斯托克,比伯,T.和阿拉姆,J. P.口腔粘膜的免疫特权。趋势地中海摩尔。。14, 191 - 198(2008)。
阿拉姆,J. P.等。人口腔黏膜内朗格汉斯细胞和肥大细胞的分布:过敏原在舌下免疫治疗中的新应用部位?过敏63, 720 - 727(2008)。
布里姆斯,J., Kildsgaard, J., Jacobi, H. & Lund, K.舌下免疫疗法减轻鼻炎小鼠模型的过敏症状。中国。Exp。过敏37, 488 - 497(2007)。
Passalacqua, G.等。局部变应原性免疫治疗螨虫性鼻结膜炎过敏性炎症的随机对照试验。《柳叶刀》351, 629 - 632(1998)。
Creticos, P. S.等。标准豚草舌下液免疫治疗过敏性鼻结膜炎的随机、双盲、安慰剂对照试验。j .过敏中国。Immunol。133, 751 - 758(2014)。
冈本,Y.等。两季舌下免疫疗法治疗日本杉木花粉症的疗效和安全性。Int。拱门。过敏Immunol。166, 177 - 188(2015)。
Ott, H.等。花粉舌下免疫治疗连续三个季节和治疗停止后的疗效:ECRIT研究。过敏64, 1394 - 1401(2009)。
达尔,r等人。草变应原片舌下免疫治疗季节性变应性鼻结膜炎的疗效和安全性。j .过敏中国。Immunol。118, 434 - 440(2006)。
Didier, A.等。每日一次舌下免疫治疗季节性变应性鼻炎的最佳剂量、疗效和安全性j .过敏中国。Immunol。120, 1338 - 1345(2007)。
Dhami, S.等。过敏原免疫治疗过敏性鼻结膜炎:一项系统综述和荟萃分析。过敏72, 1597 - 1631(2017)。
Creticos, P. S.等。北美和欧洲成人豚草过敏免疫治疗片的随机对照试验。j .过敏中国。Immunol。131, 1342 - 1349。e6(2013)。
Biedermann, T.等。一项随机、双盲、安慰剂对照的III期试验结果显示,SQ树劈裂片非常有效,耐受性良好。j .过敏中国。Immunol。143, 1058 - 1066。e6(2019)。
Yonekura, S.等。日本雪松花粉舌下免疫治疗片的疾病调节作用。j .过敏中国。Immunol。Pract。9, 4103 - 4116(2021)。
卡尼卡,G. W.等。呼吸道过敏过敏原特异性免疫治疗临床试验标准化建议。世界过敏组织(WAO)特别工作组的声明。过敏62, 317 - 324(2007)。
达勒姆,S. R.等。舌下免疫治疗片和药物治疗季节性和常年性变应性鼻炎的疗效:综合分析。j .过敏中国。Immunol。138, 1081 - 1088。e4(2016)。
达勒姆,S. R.等。sq -标准化舌下草免疫疗法:在一项随机试验中,3年治疗后2年证实疾病改善。j .过敏中国。Immunol。129, 717 - 725。e5(2012)。
Didier, A., Malling, H. J, Worm, M, Horak, F. & Sussman, G. L.通过推荐的每日综合评分来衡量,300IR 5-草花粉片在停止治疗后可延长疗效达2年。中国。Transl。过敏512(2015)。
Valovirta, E.等。5年SQ草舌下免疫治疗片对草花粉过敏儿童哮喘预防(GAP)试验结果。j .过敏中国。Immunol。141, 529 - 538。e13(2018)。
Bergmann, K. C.等。屋尘螨过敏原提取物舌下片治疗成人变应性鼻炎的疗效和安全性。j .过敏中国。Immunol。133, 1608 - 1614。e6(2014)。
邓雷,P.等人。两剂SQ HDM slit片有效治疗室内尘螨引起的过敏性鼻炎:一项随机、双盲、安慰剂对照III期试验的结果。j .过敏中国。Immunol。137, 444 - 451。e8(2016)。
Okubo, K.等。SQ屋尘螨舌下免疫治疗片对日本成人和青少年屋尘螨过敏性鼻炎的疗效和安全性。j .过敏中国。Immunol。139, 1840 - 1848。e10汽油(2017)。
邓雷,P.等人。300 IR舌下片是一种有效、安全的治疗室内尘螨过敏性鼻炎的方法:一项国际、双盲、安慰剂对照、随机III期临床试验。j .过敏中国。Immunol。147, 1020 - 1030。e10汽油(2021)。
莫斯贝克,H.等。标准化质量(SQ)屋尘螨舌下免疫治疗片(ALK)减少吸入皮质类固醇的使用,同时保持哮喘控制:一项随机、双盲、安慰剂对照试验。j .过敏中国。Immunol。134, 568 - 575。e7(2014)。
魏尔周,J. C.等。一种屋尘螨舌下过敏原免疫治疗片对成人过敏性哮喘的疗效:一项随机临床试验。《美国医学会杂志》315, 1715 - 1725(2016)。
罗伯茨,G.等。过敏原免疫治疗EAACI指南:过敏性鼻结膜炎。过敏73, 765 - 798(2018)。
Scadding, G. W.等。舌下草花粉免疫疗法治疗2年对中重度季节性变应性鼻炎患者3年鼻腔对过敏原反应的影响:grass随机临床试验《美国医学会杂志》317, 615 - 625(2017)。
Renand, A.等。同步免疫改变反映了过敏原免疫治疗期间的临床反应。j .过敏中国。Immunol。141, 1750 - 1760。e1(2018)。
Shamji, m.h.等人。蒂莫西草皮下和舌下免疫治疗后过敏原特异性IgA反应的差异诱导。j .过敏中国。Immunol。148, 1061 - 1071。e11(2021)。
Jacobsen, L.等。特异性免疫治疗对季节性和多年性哮喘有长期预防作用:PAT研究的10年随访。过敏62, 943 - 948(2007)。
霍尔特,P. G.等。高危儿童预防性使用舌下过敏原免疫治疗:一项初步研究。j .过敏中国。Immunol。132, 991 - 993。e1(2013)。
Zolkipli, Z.等。室内尘螨过敏原口服免疫治疗儿童早期特异反应性一级预防的随机对照试验。j .过敏中国。Immunol。136, 1541 - 1547。e11(2015)。
Alviani, C.等。使用HDM SLIT对高危儿童哮喘的一级预防:6岁时评估。j .过敏中国。Immunol。145, 1711 - 1713(2020)。
昆迪格,t.m.等。病毒样颗粒上的Der p1肽在健康成人中是安全的和高免疫原性的。j .过敏中国。Immunol。117, 1470 - 1476(2006)。
坎帕纳,R.等。用重组桦花粉变应原低致敏性片段接种非过敏个体Bet v 1:安全性、效果和机制。j .过敏中国。Immunol。143, 1258 - 1261(2019)。
黄,M. P, Seresirikachorn, K., Chitsuthipakorn, W. & Snidvongs, K.淋巴内免疫治疗过敏性鼻结膜炎:一项系统综述和荟评分析。鼻科学59, 236 - 244(2021)。
Senti, G.等。淋巴内过敏原给药使特异性免疫治疗更快更安全:一项随机对照试验。美国国家科学院学报。美国105, 17908 - 17912(2008)。
康拉德森,J. R.等。花粉过敏的年轻成人鼻结膜炎和轻度哮喘的淋巴内免疫治疗:一项随机试验。j .过敏中国。Immunol。145, 1005 - 1007。e7(2020)。
Zaleska, A.等。模块化过敏原易位MAT疫苗的淋巴内免疫治疗的免疫调节过敏69, 1162 - 1170(2014)。
Skaarup, s.h., Schmid, J. M, Skjold, T, Graumann, O. & Hoffmann, H. J.淋巴内免疫治疗改善草花粉过敏性鼻结膜炎:一项3年随机安慰剂对照试验。j .过敏中国。Immunol。147, 1011 - 1019(2021)。
Senti, G.等。皮肤过敏原给药是一种新的过敏原特异性免疫治疗方法。j .过敏中国。Immunol。124, 997 - 1002(2009)。
花生过敏儿童花生蛋白摄入的表皮免疫治疗vs安慰剂。《美国医学会杂志》321956(2019)。
杜托伊特,G.等人。早期食用花生后回避对花生过敏的影响。心血管病。j .地中海。374, 1435 - 1443(2016)。
Togias等人。美国花生过敏预防指南附录:国家过敏和传染病研究所赞助的专家小组的报告。j .过敏中国。Immunol。139突然,(2017)。
Incorvaia, C.等。变态反应原免疫治疗的个体化治疗:变态反应原免疫治疗仍是一种独特的、无可比拟的模式。过敏76, 1041 - 1052(2021)。
泡利,G.等。重组桦木花粉疫苗治疗桦木变应性鼻结膜炎的疗效观察。j .过敏中国。Immunol。122, 951 - 960(2008)。
Jutel, M.等。重组草花粉过敏原特异性免疫治疗。j .过敏中国。Immunol。116, 608 - 613(2005)。
尼德伯格等人。接种转基因过敏原疫苗可预防过敏性疾病的进展。美国国家科学院学报。美国101, 14677 - 14682(2004)。
尼德伯格等人。重组b细胞表位草花粉疫苗BM32免疫治疗的安全性和有效性j .过敏中国。Immunol。142, 497 - 509。e9(2018)。
Dorofeeva, Y.等。过敏原免疫治疗疫苗的过去、现在和未来。过敏76, 131 - 149(2021)。
Scheiblhofer, S, Thalhamer, J. & Weiss, R.抗过敏的DNA和mRNA疫苗。Pediatr。过敏Immunol。29, 679 - 688(2018)。
Slater J. E, Paupore, E, Zhang yt. & Colberg-Poley, a.m.乳胶过敏原Hev b5转录本在BALB/c小鼠皮下注射其DNA疫苗后广泛分布。j .过敏中国。Immunol。102, 469 - 475(1998)。
Hartl, Hochreiter, R, Stepanoska, T, Ferreira, F.和Thalhamer, J.编码桦树花粉主要过敏原Bet v 1a的DNA疫苗的保护和治疗效率的表征。过敏59, 65 - 73(2004)。
苏,杨,等。CryJ2-LAMP质粒疫苗在日本红杉特应性受试者中的安全性和长期免疫效果:一项I期研究嗡嗡声。疫苗。Immunother。13, 2804 - 2813(2017)。
Creticos, P. S.等。豚草toll样受体9激动剂疫苗免疫治疗变应性鼻炎心血管病。j .地中海。355, 1445 - 1455(2006)。
Senti, G.等。在人类过敏原特异性免疫治疗中使用a型CpG寡脱氧核苷酸作为佐剂:I/IIa期临床试验中国。Exp。过敏39, 562 - 570(2009)。
Beeh, K. M.等。新型TLR-9激动剂QbG10对持续性过敏性哮喘有临床疗效。j .过敏中国。Immunol。131, 866 - 874(2013)。
卡萨尔,t.b.等人。TLR9激动剂CYT003在持续性过敏性哮喘中的作用——一项随机对照安慰剂2b期研究。过敏70, 1160 - 1168(2015)。
罗斯勒,E.等人。免疫和消失安全优化的信使rna疫苗与29个过敏原面板。j .过敏中国。Immunol。124, 1070 - 1077。e1-e11(2009)。
Moldaver, D. & Larche, M.多肽免疫治疗。过敏66, 784 - 791(2011)。
诺曼,p.s.等。t细胞反应肽治疗猫过敏。点。j .和。暴击。保健医疗。154, 1623 - 1628(1996)。
奥德菲尔德,W. L., Larche, M. & Kay, a.b.来自Fel d1的t细胞肽对猫敏感患者过敏反应和细胞因子产生的影响:一项随机对照试验。《柳叶刀》36047-53(2002)。
穆勒,U.等。蜂毒磷脂酶A2 t细胞表位肽免疫治疗成功诱导蜂毒过敏患者特异性t细胞无能。j .过敏中国。Immunol。101, 747 - 754(1998)。
帕特尔等人。一项随机、安慰剂对照研究显示,Fel d1源性肽抗原脱敏在开始给药1年后仍有持续的治疗效果。j .过敏中国。Immunol。131e101-e107(2013)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT01620762(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT02150343(2017)。
Orengo, J. M.等。用单克隆IgG抗体结合过敏原,防止IgE参与治疗猫过敏。Commun Nat。91421(2018)。
Shamji, m.h.等人。单剂量抗fel d1单克隆抗体REGN1908-1909被动预防猫过敏原诱导的变应性鼻炎:一项随机、双盲、安慰剂对照临床试验。点。j .和。暴击。保健医疗。20423-33(2021)。
吉瓦特,P.等人。在一项一期研究中,靶向Bet v1的新型抗体鸡尾酒可快速、可持续地治疗桦树过敏症状。j .过敏中国。Immunol。149, 189 - 199(2022)。
Kirtland, m.e., Tsitoura, d.c., Durham, s.r. & Shamji, m.h. toll样受体激动剂作为过敏原免疫治疗的佐剂。前面。Immunol。11599083(2020)。
卡萨尔,t.b.等人。Omalizumab预处理可减少豚草诱导的季节性变应性鼻炎匆忙免疫治疗后的急性反应。j .过敏中国。Immunol。117, 134 - 140(2006)。
丹泽,J. A. &伍德,R. A.奥玛珠单抗在过敏原免疫治疗中的应用。中国。Exp。过敏48, 232 - 240(2018)。
Chaker, a.m.等人。抗il -4保护伞下短期草花粉皮下免疫治疗:一项随机对照试验。j .过敏中国。Immunol。137, 452 - 461。e9(2016)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT04502966(2020)。
Corren, J.等。过敏性鼻炎的短期皮下过敏免疫治疗和dupilumab耐受性良好:一项随机试验。j .哮喘过敏14, 1045 - 1063(2021)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03682770(2021)。
Burrows, K. E.等人。OX40阻断剂抑制屋尘螨引起的小鼠过敏性肺炎症和人类体外过敏反应。欧元。j . Immunol。45, 1116 - 1128(2015)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT02237196(2019)。
钦特拉迦等人。抗il -33在花生过敏中的随机、安慰剂对照研究。江森自控的洞察力4e131347(2019)。
Holm, J., Willumsen, N., Wurtzen, P. A., Christensen, L. H.和Lund, K.通过阻断IgG抗体促进抗原呈递及其抑制取决于IgE序列的复杂性。j .过敏中国。Immunol。127, 1029 - 1037(2011)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03504774(2022)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT03462030(2021)。
吸入性过敏原的过敏原免疫治疗机制和预测性生物标志物。j .过敏中国。Immunol。140, 1485 - 1498(2017)。
科伦,J. &齐格勒,S. F. TSLP:从过敏到癌症。Immunol Nat。20., 1603 - 1609(2019)。
Varricchi, G.等。T卵泡辅助器(T跳频)正常免疫反应和过敏性疾病中的细胞。过敏71, 1086 - 1094(2016)。
Stone, K. D., Prussin, C. & Metcalfe, D. IgE,肥大细胞,嗜碱性粒细胞,嗜酸性粒细胞。j .过敏中国。Immunol。125S73-S80(2010)。
Wachholz, p.a., Soni, n.k, Till, s.j.和Durham, s.r.草花粉免疫治疗后IgG抗体抑制过敏原ige与B细胞的结合。j .过敏中国。Immunol。112, 915 - 922(2003)。
Wambre, E.等。分化阶段决定病理和保护性过敏原特异性CD4+特异性免疫治疗期间的t细胞预后。j .过敏中国。Immunol。129, 544 - 551(2012)。
Shamji, m.h.等人。IgG4的功能性而非免疫反应性水平与草花粉免疫治疗的临床反应密切相关。过敏67, 217 - 226(2012)。
Gagliani, N.等。CD49b和LAG-3的共同表达可以识别人和小鼠T调节型1细胞。Nat,地中海。19, 739 - 746(2013)。
确认
作者感谢M. Penagos提供了图1和补充表1,并对手稿进行了审阅。
作者信息
作者和联系
贡献
两位作者都为文章研究了数据,对内容的讨论做出了重大贡献,并在投稿前对稿件进行了审阅和/或编辑。那篇文章是S.R.D.写的。
相应的作者
道德声明
相互竞争的利益
S.R.D.报告了来自免疫耐受网络、美国国家过敏和传染病研究所、英国医学研究委员会和葛兰素史克的研究资助;曾收到雅培实验室、ALK、allergpharma、Pneumo Update GmbH和Stallergenes Greer的讲座费;并从ALK、ANGANY Inc.和Revolo Biotherapeutics收取咨询费。M.H.S.报告了来自Leti、Regeneron、Merck、ANGANY Inc、Allergy Therapeutics和免疫耐受网络的资助;报告来自过敏原的个人费用;报告ALK和过敏治疗公司的拨款和个人费用。
同行评审
同行审查的信息
自然评论免疫学感谢C. Akdis, R. Valenta和另一位匿名审稿人对这项工作的同行评议做出的贡献。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
相关链接
ClinicalTrials.gov:https://clinicaltrials.gov/
哮喘全球倡议指南:https://ginasthma.org/reports/
疫苗的历史:https://historyofvaccines.org/history/vaccine-timeline/timeline
补充信息
权利和权限
Nature或其许可方根据与作者或其他权利所有人签订的出版协议,对本文拥有专有权;作者对本文已接受的手稿版本的自我存档完全受此类出版协议条款和适用法律的约束。
关于这篇文章
引用这篇文章
过敏原免疫治疗:过去,现在和未来。Nat Immunol牧师(2022)。https://doi.org/10.1038/s41577-022-00786-1
接受:
发表:
DOI:https://doi.org/10.1038/s41577-022-00786-1