文摘gydF4y2Ba
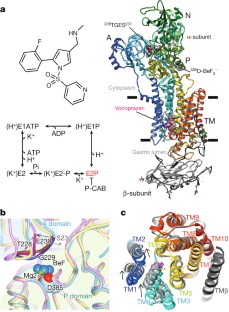
胃质子泵HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba-ATPase-is p型atp酶负责酸化的胃液pH值1。这对应于那个壁细胞的跨膜质子梯度,已知最陡的阳离子梯度任何哺乳动物的组织。HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Baatp酶是一种重要的药物治疗胃acid-related疾病的目标。这里我们提出晶体结构的HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶在复杂和两个拦截器,vonoprazan SCH28080, luminal-open状态,在2.8的决议。药物有部分重叠,但分明绑定模式在管道运行从胃腔cation-binding网站。晶体结构表明,紧cation-binding站点的配置降低了pgydF4y2BaKgydF4y2Ba一个gydF4y2BaGlu820价值甚至足以使一个质子的释放到环境pH值1的胃。gydF4y2Ba
这是一个预览的订阅内容,gydF4y2Ba通过访问你的机构gydF4y2Ba
相关的文章gydF4y2Ba
开放获取文章引用这篇文章。gydF4y2Ba
帕金森疾病ATP13A2 / PARK9函数作为溶酶体H +, K + atp酶gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2023年4月20gydF4y2Ba
H + / K +泵的结构和功能突变体揭示Na + / K +泵机制gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2022年9月09gydF4y2Ba
人类的钠钾泵的结构闸门机制的基础gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2022年9月08gydF4y2Ba
访问选项gydF4y2Ba
访问其他自然组合期刊性质和54gydF4y2Ba
得到自然+,请求书在线访问订阅gydF4y2Ba
29.99美元gydF4y2Ba/ 30天gydF4y2Ba
取消任何时候gydF4y2Ba
订阅本杂志gydF4y2Ba
收到51印刷问题和网络访问gydF4y2Ba
每年199.00美元gydF4y2Ba
只有3.90美元的问题gydF4y2Ba
本文租或购买gydF4y2Ba
价格不同的文章类型gydF4y2Ba
从gydF4y2Ba1.95美元gydF4y2Ba
来gydF4y2Ba39.95美元gydF4y2Ba
价格可能受当地税收计算在结帐gydF4y2Ba




改变历史gydF4y2Ba
2018年4月05gydF4y2Ba
扩展数据数据和表部分本文最初发表失踪了表1 - 3。这个已经被修正。gydF4y2Ba
引用gydF4y2Ba
甘塞尔,a . l . &的强项,j·g·KgydF4y2Ba+gydF4y2Ba刺激atp酶的纯化微粒体牛蛙壁细胞。gydF4y2BaBiochim。Bioshys。学报gydF4y2Ba307年gydF4y2Ba,169 - 180 (1973)。gydF4y2Ba
(goldman Sachs)、g . et al .胃H K腺苷三磷酸酶作为药物目标:过去,现在和未来。gydF4y2Baj .中国。杂志。gydF4y2Ba41gydF4y2BaS226-S242 (2007)。gydF4y2Ba
(goldman Sachs)、G。,Meyer-Rosberg, K., Scott, D. R. & Melchers, K. Acid, protons and幽门螺杆菌gydF4y2Ba。gydF4y2Ba耶鲁大学生物。地中海。gydF4y2Ba69年gydF4y2Ba,301 - 316 (1996)。gydF4y2Ba
Otake k . et al .小说的特点potassium-competitive酸阻滞剂vonoprazan延胡索酸酯(tak - 438)。gydF4y2Ba放置其他。gydF4y2Ba33gydF4y2Ba,1140 - 1157 (2016)。gydF4y2Ba
卡明斯基,J·J。,Wallmark B。,Briving, C. & Andersson, B. M. Antiulcer agents. 5. Inhibition of gastric H+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶由取代咪唑并[1,a]吡啶和相关类似物及其含义在建模的高亲和力钾离子结合位点胃质子泵酶。gydF4y2Baj .地中海,化学。gydF4y2Ba34gydF4y2Ba,533 - 541 (1991)。gydF4y2Ba
Shin j . m . & (goldman Sachs)、g .质子泵抑制剂的药理。gydF4y2Ba咕咕叫。杂志。代表。gydF4y2Ba10gydF4y2Ba,528 - 534 (2008)。gydF4y2Ba
Rabon, e·c·&鲁本,m . a .胃H的机制和结构K-ATPase。gydF4y2Ba为基础。启杂志。gydF4y2Ba52gydF4y2Ba,321 - 344 (1990)。gydF4y2Ba
Rabon, e . C。,McFall, T. L. & Sachs, G. The gastric [H,K]ATPase:H+gydF4y2Ba/ ATP化学计量学。gydF4y2Ba生物。化学。gydF4y2Ba257年gydF4y2Ba,6296 - 6299 (1982)。gydF4y2Ba
Morth, j . p . et al .钠钾泵的晶体结构。gydF4y2Ba自然gydF4y2Ba450年gydF4y2Ba,1043 - 1049 (2007)。gydF4y2Ba
Toyoshima C。,Nakasako, M., Nomura, H. & Ogawa, H. Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 Å resolution.自然gydF4y2Ba405年gydF4y2Ba,647 - 655 (2000)。gydF4y2Ba
Wolosin, j . m .离子运输研究HgydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba-ATPase-rich囊泡:对盐酸分泌和胃壁细胞生理的影响。gydF4y2Ba点。j .杂志。Gastrointest。肝脏杂志。gydF4y2Ba248年gydF4y2BaG595-G607 (1985)。gydF4y2Ba
Dukkipati,。、公园、H . H。Waghray D。,F我scher, S. & Garcia, K. C. BacMam system for high-level expression of recombinant soluble and membrane glycoproteins for structural studies.蛋白质Expr。Purif。gydF4y2Ba62年gydF4y2Ba,160 - 170 (2008)。gydF4y2Ba
戈林,a . et al .筛查和大规模的表达膜蛋白在哺乳动物细胞结构研究。gydF4y2BaNat协议。gydF4y2Ba9gydF4y2Ba,2574 - 2585 (2014)。gydF4y2Ba
Bublitz M。,Poulsen, H., Morth, J. P. & Nissen, P. In and out of the cation pumps: P-type ATPase structure revisited.咕咕叫。当今。结构体。医学杂志。gydF4y2Ba20.gydF4y2Ba,431 - 439 (2010)。gydF4y2Ba
安倍,K。,Tani, K. & Fujiyoshi, Y. Systematic comparison of molecular conformations of H+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶揭示了一个重要的贡献A-M2链接器的腔的选通。gydF4y2Ba生物。化学。gydF4y2Ba289年gydF4y2Ba,30590 - 30601 (2014)。gydF4y2Ba
奥尔森,c . et al。运输钙钙泵的结构基础。gydF4y2Ba自然gydF4y2Ba450年gydF4y2Ba,1036 - 1042 (2007)。gydF4y2Ba
劳尔森,M。,Yatime, L., Nissen, P. & Fedosova, N. U. Crystal structure of the high-affinity Na+gydF4y2BaKgydF4y2Ba+gydF4y2Ba与Mg -ATPase-ouabain复杂gydF4y2Ba2 +gydF4y2Ba绑定在阳离子结合位点。gydF4y2BaProc。《科学。美国gydF4y2Ba110年gydF4y2Ba,10958 - 10963 (2013)。gydF4y2Ba
Toyoshima C。,Norimatsu, Y., Iwasawa, S., Tsuda, T. & Ogawa, H. How processing of aspartylphosphate is coupled to lumenal gating of the ion pathway in the calcium pump.Proc。《科学。美国gydF4y2Ba104年gydF4y2Ba,19831 - 19836 (2007)。gydF4y2Ba
安倍,K。,Tani, K., Nishizawa, T. & Fujiyoshi, Y. Inter-subunit interaction of gastric H+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶防止运输周期的逆反应。gydF4y2BaEMBO J。gydF4y2Ba28gydF4y2Ba,1637 - 1643 (2009)。gydF4y2Ba
安倍,K。,Tani, K., Friedrich, T. & Fujiyoshi, Y. Cryo-EM structure of gastric H+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶与单个占领cation-binding网站。gydF4y2BaProc。《科学。美国gydF4y2Ba109年gydF4y2Ba,18401 - 18406 (2012)。gydF4y2Ba
安倍,K。,Tani, K. & Fujiyoshi, Y. Conformational rearrangement of gastric H+gydF4y2BaKgydF4y2Ba+gydF4y2Baatp酶诱导的酸抑制剂。gydF4y2BaCommun Nat。gydF4y2Ba2gydF4y2Ba155 (2011)。gydF4y2Ba
斯科特·d·R。,老李,K。B., Marcus, E. A., Lambrecht, N. W. G. & Sachs, G. The binding selectivity of vonoprazan (TAK-438) to the gastric H+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。gydF4y2Ba滋养品。杂志。其他。gydF4y2Ba42gydF4y2Ba,1315 - 1326 (2015)。gydF4y2Ba
丹科,S。,Yamasaki, K., Daiho, T. & Suzuki, H. Distinct natures of beryllium fluoride-bound, aluminum fluoride-bound, and magnesium fluoride-bound stable analogues of an ADP-insensitive phosphoenzyme intermediate of sarcoplasmic reticulum Ca2 +gydF4y2Ba腺苷三磷酸酶:变化在phosphoenzyme水解催化和交通网站。gydF4y2Ba生物。化学。gydF4y2Ba279年gydF4y2Ba,14991 - 14998 (2004)。gydF4y2Ba
丹科,S。,Yamasaki, K., Daiho, T. & Suzuki, H. Membrane perturbation of ADP-insensitive phosphoenzyme of Ca2 +gydF4y2Ba腺苷三磷酸酶修改群跨膜螺旋M2与胞质域和腔的选通。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba41172 (2017)。gydF4y2Ba
约根森,p . L。,Håkansson, K. O. & Karlish, S. J. D. Structure and mechanism of Na,K-ATPase: functional sites and their interactions.为基础。启杂志。gydF4y2Ba65年gydF4y2Ba,817 - 849 (2003)。gydF4y2Ba
Koenderink, j·B。,Swarts, H. G. P., Willems, P. H. G. M., Krieger, E. & De Pont, J. J. H. H. M. A conformation-specific interhelical salt bridge in the K+gydF4y2Ba结合位点的胃H, K-ATPase。gydF4y2Ba生物。化学。gydF4y2Ba279年gydF4y2Ba,16417 - 16424 (2004)。gydF4y2Ba
老李,K。,Garcia, R. & Sachs, G. Inhibitor and ion binding sites on the gastric H,K-ATPase.生物化学gydF4y2Ba44gydF4y2Ba,5267 - 5284 (2005)。gydF4y2Ba
Burnay, M。,Crambert, G., Kharoubi-Hess, S., Geering, K. & Horisberger, J. D. Electrogenicity of Na,K- and H,K-ATPase activity and presence of a positively charged amino acid in the fifth transmembrane segment.生物。化学。gydF4y2Ba278年gydF4y2Ba,19237 - 19244 (2003)。gydF4y2Ba
·杜尔,k . L。,Seuffert, I. & Friedrich, T. Deceleration of the E1P–E2P transition and ion transport by mutation of potentially salt bridge-forming residues Lys-791 and Glu-820 in gastric H+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。gydF4y2Ba生物。化学。gydF4y2Ba285年gydF4y2Ba,39366 - 39379 (2010)。gydF4y2Ba
Sielecki, a。R。,Fedorov, A. A., Boodhoo, A., Andreeva, N. S. & James, M. N. G. Molecular and crystal structures of monoclinic porcine pepsin refined at 1.8 Å resolution.j·摩尔,杂志。gydF4y2Ba214年gydF4y2Ba,143 - 170 (1990)。gydF4y2Ba
克莱门特·g·E。鲁尼,J。,Zakheim, D. & Eastman, J. The pH dependence of the dephosphorylated pepsin-catalyzed hydrolysis of N-acetyl-lgydF4y2Ba-phenylalanyl -gydF4y2BalgydF4y2Ba酪氨酸甲酯。gydF4y2Baj。化学。Soc。gydF4y2Ba92年gydF4y2Ba,186 - 189 (1970)。gydF4y2Ba
浅野,S。,Furumoto, R., Tega, Y., Matsuda, S. & Takeguchi, N. Mutational analysis of the putative K+gydF4y2Ba绑定网站第四跨膜段胃HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。gydF4y2Ba学生物化学j。gydF4y2Ba127年gydF4y2Ba,993 - 1000 (2000)。gydF4y2Ba
Palmgren, m·G。,Buch-Pedersen, M. J. & Møller, A. L. Mechanism of proton pumping by plant plasma membrane H+gydF4y2Ba腺苷三磷酸酶:残留在跨膜段5和6。gydF4y2Ba安。纽约私立高中科学。gydF4y2Ba986年gydF4y2Ba,188 - 197 (2003)。gydF4y2Ba
Pedersen b P。,Buch-Pedersen, M. J., Morth, J. P., Palmgren, M. G. & Nissen, P. Crystal structure of the plasma membrane proton pump.自然gydF4y2Ba450年gydF4y2Ba,1111 - 1114 (2007)。gydF4y2Ba
Focht D。,Croll, T. I., Pedersen, B. P. & Nissen, P. Improved model of proton pump crystal structure obtained by interactive molecular dynamics flexible fitting expands the mechanistic model for proton translocation in P-type ATPases.前面。杂志。gydF4y2Ba8gydF4y2Ba202 (2017)。gydF4y2Ba
约根森,p . l .司马义& f .监管和lysine-substituted Na的函数,K的盐适应泵gydF4y2Ba卤虫franciscanagydF4y2Ba。gydF4y2Baj .会员。医学杂志。gydF4y2Ba221年gydF4y2Ba39-49 (2008)。gydF4y2Ba
村庄,p . et al . HiLiDe-systematic方法在脂质膜蛋白结晶和洗涤剂。gydF4y2Ba结晶的。增长Des。gydF4y2Ba11gydF4y2Ba,2098 - 2106 (2011)。gydF4y2Ba
强,m . et al。对配合物的结构基因组学:PE / PPE蛋白复合物的晶体结构gydF4y2Ba结核分枝杆菌gydF4y2Ba。gydF4y2BaProc。《科学。美国gydF4y2Ba103年gydF4y2Ba,8060 - 8065 (2006)。gydF4y2Ba
Emsley p &卡谭,k .傻瓜:模型分子图形的工具。gydF4y2BaActa Crystallogr。DgydF4y2Ba60gydF4y2Ba,2126 - 2132 (2004)。gydF4y2Ba
亚当斯,p . d . et al .凤凰:大分子结构全面面向系统的解决方案。gydF4y2BaActa Crystallogr。DgydF4y2Ba66年gydF4y2Ba,213 - 221 (2010)。gydF4y2Ba
Kawate t & Gouaux,大肠萤光侦测precrystallization筛选整合膜蛋白凝胶排阻层析法。gydF4y2Ba结构gydF4y2Ba14gydF4y2Ba,673 - 681 (2006)。gydF4y2Ba
安倍,k . et al .胃H的低温电子显微镜结构gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba与绑定BYK99 atp酶,高亲和性K的成员gydF4y2Ba+gydF4y2Ba竞争,咪唑并吡啶抑制剂(1 a)。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba6632 (2017)。gydF4y2Ba
金井,R。,Ogawa, H., Vilsen, B., Cornelius, F. & Toyoshima, C. Crystal structure of a Na+gydF4y2Ba绑定NagydF4y2Ba+,gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶E1P前状态。gydF4y2Ba自然gydF4y2Ba502年gydF4y2Ba,201 - 206 (2013)。gydF4y2Ba
确认gydF4y2Ba
我们谢谢m .谷口的技术援助;t . Imagawa互补的猪胃HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶;p .村庄分享晶体筛选矩阵;d·麦金托什改善手稿;p·尼森和c Toyoshima关键讨论;和k谷口的初始阶段的支持这个项目。这项工作是支持的科研补助金(B),从JST波峰(JPMJCR14M4)和基础支持创新药物研究和生命科学研究(·);科学研究补助金(S),日本的新能源和工业技术发展组织(NEDO)和日本医学研究和开发署(艾湄湾)(Y.F.)。执行的同步辐射实验在BL32XU和BL41XU SPring-8批准日本同步加速器辐射研究所(JASRI提案数量:2011 b1240 2014 a1248 2014 b1165 2015 b1042 b2721 2016和2017 b2701)。我们感谢beamline人员的设施和支持。gydF4y2Ba
审核人信息gydF4y2Ba
自然gydF4y2Ba由于m . Palmgren h·保尔森,另一个匿名的评论家(s)为他们的贡献的同行评审工作。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
·和Y.F.设计的研究。·和H.S.表达的蛋白质。·H.N.提纯和结晶蛋白质。·进行生化分析。·,H.N. and K.I. corrected the X-ray diffraction data. K.A. and K.I. analysed the structures. All authors interpreted the structure and wrote the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
Y.F. CeSPIA公司的董事。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意:gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
扩展数据数据和表gydF4y2Ba
扩展数据图1胃H的结晶gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。gydF4y2Ba
一个gydF4y2Ba净化HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba在HEK293细胞atp酶表达。巷1:随着膜分数,巷2:通过国旗的树脂、巷3:洗分数,巷4:由国旗肽洗脱,巷5:TEV蛋白酶endoglycosidase-treated样本,巷6:直通Ni-NTA分数和直链淀粉树脂、巷7:集中峰值分数由凝胶排阻层析法。gydF4y2BabgydF4y2Ba的洗脱图affinity-purified HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶Superose6增加10/300。黑色,红色和绿色箭头指示洗脱体积的聚合,α-β-complex HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba分别atp酶和裂解EGFP。净化是复制,代表结果在图中所示。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba晶体的HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶的存在vonoprazan (gydF4y2BacgydF4y2Ba)或SCH28080和RbgydF4y2Ba+gydF4y2Ba(gydF4y2BadgydF4y2Ba)。酒吧,规模100μm。gydF4y2BaegydF4y2Ba,x射线衍射vonoprazan-bound晶体。2.3放大图像显示的衍射斑点的方向gydF4y2Bac *gydF4y2Ba轴,尽管晶体显示各向异性衍射。大多数晶体衍射斑点的2.8在类似的结晶条件和一些晶体衍射斑点比2.3,如图。gydF4y2BafgydF4y2Ba、水晶包装。非对称单元(分子在左下角,描绘成在无花果。gydF4y2Ba1 dgydF4y2Ba)包含一个α-β-complex HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(α-subunit,浅蓝色;β-subunit、小麦;vonoprazan,洋红色),挤满了gydF4y2BaPgydF4y2Ba3gydF4y2Ba1gydF4y2Ba21对称。单位细胞和膜的近似位置飞机提供灰色和黄色框,分别。gydF4y2Ba
扩展数据图2晶体结构的胃HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶SCH28080。gydF4y2Ba
一个gydF4y2Ba的总体结构luminal-open E2P HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶包裹着SCH28080(丝带(原理图)E2BeF)表示,如无花果。gydF4y2Ba1gydF4y2Ba。绑定SCH28080和三个RbgydF4y2Ba+gydF4y2Ba离子分别显示为绿色和紫色的球体。插图,SCH28080的化学结构。gydF4y2BabgydF4y2Ba从Rb、洋红色网显示异常的峰值gydF4y2Ba+gydF4y2Ba波状外形的在5gydF4y2BaσgydF4y2Ba水平,这表明三个RbgydF4y2Ba+gydF4y2Ba离子(蓝色、黄色和红色框)绑定到HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(原理图)E2BeF(显示为彩色丝带)。蓝色,核苷酸域和致动器域之间的接口symmetry-related邻近分子(灰色丝带)。黄色,KgydF4y2Ba+gydF4y2Ba绑定的网站在磷酸化作用域,这是同源SERCA和NagydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。红色,异常峰值在跨膜cation-binding网站找到。gydF4y2BacgydF4y2Ba(原理图)的分子表面E2BeF结构,从腔的一侧的膜。绑定SCH28080(绿棒)块的管道连接到cation-binding网站。gydF4y2BadgydF4y2Ba、结构如gydF4y2BacgydF4y2Ba,但删除绑定SCH28080,表明RbgydF4y2Ba+gydF4y2Ba绑定到cation-binding站点(紫色)暴露在腔的解决方案。gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,CgydF4y2BaαgydF4y2Ba的痕迹表明H原子模型叠加gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(冯)E2BeF(蓝色,绑定vonoprazan显示为球体)。gydF4y2Ba
扩展数据图3 TM2螺旋集群和疏水性。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba、致动器之间的接口和磷酸化作用域和胞质部分TM2的luminal-open E2P H的状态gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(冯)E2BeF (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)和luminal-closed E2P SERCA的过渡态E2-AlF (PDB代码:2 zbg)gydF4y2Ba18gydF4y2Ba(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba)所示。这两个原子模型是根据TM7-TM10叠加结构。破碎的盒子对整个分子结构(左上)表明该区域所示gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba从左(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或前(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)的分子。致动器域(绿色),TM1-TM2(蓝色),和TM3-TM4(青色)包突出显示。残留导致的疏水相互作用gydF4y2Ba19gydF4y2Ba(橙色的虚线圆)表示与类似的着色领域各自的结构组件。在H Phe170gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶是同源Tyr122 SERCA的。因为不同的磷酸盐类似物之间的协调几何(性能试验gydF4y2Ba3gydF4y2Ba−gydF4y2Ba浅蓝色;阿尔夫gydF4y2Ba4gydF4y2Ba−gydF4y2Ba,粉红色)和tg主题(显示为黑颜色在每个模型)在致动器之间的接口和磷酸化作用域(见图。gydF4y2Ba1 egydF4y2Ba关闭视图),执行机构的方位位置域两个结构之间的不同(大约30°,橙色箭头所示gydF4y2BabgydF4y2Ba)。因此,TM2的胞质部分显示了不同构象luminal-openα-helical结构之间E2P (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)和解除循环结构luminal-closed E2-P形式(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba)。CgydF4y2BaαgydF4y2Ba职位Ile119和Met334 HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(门门闩)及其同源残留SERCA (Ile71和Val300)红色(见图所示。gydF4y2Ba3gydF4y2Ba)。gydF4y2BaegydF4y2Ba鲁米那门关闭的示意图gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。在luminal-open E2P状态(左),Ile119 (TM1)和Met334 (TM4)作为一个门闩保持直立cytoplasmic-side TM1-TM2包的位置(用虚线和箭头表示)。绑定counter-transporting KgydF4y2Ba+gydF4y2Bacation-binding网站诱发腔的门关闭(右),这是伴随着TM3-TM4包(图的横向运动。gydF4y2Ba1 cgydF4y2Ba)和downward-sliding运动TM1-TM2包在左面板(红色箭头)。TM1-TM2结果的滑动运动解除TM2的胞质部分和传动装置的旋转域相对于磷酸化作用域。最后,结合磷酸反应中心的磷酸化作用域是水解由于tg的位移循环。由于缺少互动Ile199和Met334 alanine-substituted突变体(无花果。gydF4y2Ba3 cgydF4y2Ba),TM1-TM2包可能滑动;因此,鲁米那门关闭自发不管KgydF4y2Ba+gydF4y2Ba绑定到cation-binding站点。因此,引起自发的去磷酸化,产生KgydF4y2Ba+gydF4y2Ba独立的atp酶活性。gydF4y2Ba
扩展数据图4 P-CAB-binding网站。gydF4y2Ba
逆的情节1 /gydF4y2BavgydF4y2Ba和1 / (KgydF4y2Ba+gydF4y2Ba)的野生型酶在不同浓度的P-CABs (vonoprazan: 0、5、10、20 nM (gydF4y2Ba一个gydF4y2Ba);SCH28080: 0、200、500和1000 nM (gydF4y2BabgydF4y2Ba),蓝色,绿色,黄色和红色圆圈对应各自P-CAB浓度),显示出典型的KgydF4y2Ba+gydF4y2Ba竞争性抑制HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Baatp酶活性。一式三份的数据代表的意思是±s.e.m.指向每个表示KgydF4y2Ba+gydF4y2Ba浓度;代表超过三个独立的测量结果。每个插图提供了它们的化学结构。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,2gydF4y2BaFgydF4y2BaogydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2Ba电子密度图(波状外形的2gydF4y2BaσgydF4y2Ba)vonoprazan - (gydF4y2BacgydF4y2Ba)和SCH28080-binding网站(gydF4y2BadgydF4y2Ba),从大约平行膜面。在gydF4y2BadgydF4y2Ba,SCH28080被描绘成小麦色清晰。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba的横截面P-CAB-binding网站垂直于膜面。截面表面浅蓝色所示,分子表面显示为浅灰色(碳),与其他颜色对应不同的元素(红、氧气;蓝色、氮;黄色、硫)。透明球体的每个P-CABs代表他们的范德瓦耳斯半径,显示紧密绑定的绑定的口袋里。gydF4y2BaggydF4y2Ba。跨膜区域的结构比较vonoprazan-bound(红色),SCH28080-bound(绿色)HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶和ouabain-bound NagydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(小麦),从鲁米那一边。结合乌本苷和毫克gydF4y2Ba2 +gydF4y2Ba在钠离子gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶结构显示清晰。gydF4y2BahgydF4y2Ba、乌本苷和毫克gydF4y2Ba2 +gydF4y2Ba离子是叠加在vonoprazan-bound HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶结构(丝带)。7个氨基酸的HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶,突变的高亲和性乌本苷提供绑定,表示(灰色棒),相应的氨基酸NagydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶在括号中表示。gydF4y2Ba我gydF4y2Ba,绑定SCH28080叠加在结构所示gydF4y2BahgydF4y2Ba。看到gydF4y2Ba补充信息gydF4y2Ba获取详细信息。gydF4y2Ba
扩展数据图5gydF4y2BaFgydF4y2BaogydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2BaP-CABs地图。gydF4y2Ba
的gydF4y2BaFgydF4y2BaogydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2Bavonoprazan密度(gydF4y2Ba一个gydF4y2Ba)和SCH28080 (gydF4y2BabgydF4y2Ba5)波状外形的gydF4y2BaσgydF4y2Ba(蓝色网)立体视图所示。氨基酸参与绑定以棍棒表示。gydF4y2Ba
扩展数据图6 Rb Cation-binding网站gydF4y2Ba+gydF4y2Ba绑定,luminal-open E2P状态。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,特写cation-binding网站的HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(原理图)E2BeF认为大约垂直于膜从胞质(gydF4y2Ba一个gydF4y2Ba),平行于膜从TM4 (gydF4y2BabgydF4y2Ba)。3.5残留位于相邻原子之间由虚线连接。绑定RbgydF4y2Ba+gydF4y2Ba(紫色球)和水分子(红色)也表示。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba和Rb之间,比较cation-binding站点gydF4y2Ba+gydF4y2Ba丝带绑定(原理图)E2BeF(颜色)和(冯)E2BeF(小麦),显示Glu820倾向的侧链向RbgydF4y2Ba+gydF4y2Ba伴随着RbgydF4y2Ba+gydF4y2Ba绑定(箭头)。只有极地残留在清晰的观察到的区域所示。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2BaKgydF4y2Ba+gydF4y2Ba阻挡(KgydF4y2Ba+gydF4y2Ba)gydF4y2Ba2gydF4y2BaE2-MgF Na的状态gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(浅灰色,PDB代码:2 zxe)叠加在RbgydF4y2Ba+gydF4y2Ba绑定(原理图)E2BeF H的状态gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(彩色丝带)。粉色球用红色突出显示圈(网站I和II)表明绑定KgydF4y2Ba+gydF4y2Ba在NagydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Baatp酶的结构。原子模型是基于对齐TM7-TM10蛋白质的一部分。箭头表示位移的TM4腔的部分从luminal-open luminal-closed形式。TM5从结构中移除所示gydF4y2BadgydF4y2Ba和gydF4y2BafgydF4y2Ba为清晰。gydF4y2Ba
扩展数据图7氢键网络。gydF4y2Ba
一个跨膜cation-binding HgydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶(冯)E2BeF显示,从TM6方面。只显示了极地残留物,以及每个残留提供之间的距离。球体表明立场负责NagydF4y2Ba+gydF4y2Ba绑定的网站(》)NagydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶E1P-ADP状态gydF4y2Ba43gydF4y2Ba。Asp942的接近,彼此Arg946表明这些残留物形成盐桥。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
这个文件包含补充文本和补充引用gydF4y2Ba
视频1:晶体结构的H +, K + atp酶必将vonoprazan E2BeF(冯)gydF4y2Ba
原子模型的H +, K + atp酶(冯)E2BeF如图1所示gydF4y2Ba
视频2:Cation-binding网站E2BeF(冯)gydF4y2Ba
跨膜cation-binding站点的H +, K + atp酶(冯)与cytoplasmic-side E2BeF认为平行于膜正常。极性侧链可能参与了阳离子运输与它们之间的距离表示gydF4y2Ba
视频3:Cation-binding网站在Rb +绑定E2BeF(原理图)gydF4y2Ba
跨膜cation-binding站点的H +, K + atp酶(原理图)与cytoplasmic-side E2BeF认为平行于膜正常。绑定Rb +(紫色球)和极性侧链可能参与了阳离子运输与它们之间的距离表示gydF4y2Ba
权利和权限gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
安倍,K。,Irie, K., Nakanishi, H.et al。gydF4y2Ba胃质子泵的晶体结构。gydF4y2Ba自然gydF4y2Ba556年gydF4y2Ba,214 - 218 (2018)。https://doi.org/10.1038/s41586 - 018 - 0003 - 8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586 - 018 - 0003 - 8gydF4y2Ba
本文引用的gydF4y2Ba
帕金森疾病ATP13A2 / PARK9函数作为溶酶体H +, K + atp酶gydF4y2Ba
自然通讯gydF4y2Ba(2023)gydF4y2Ba
基于仿生iontronics nano-confined结构gydF4y2Ba
纳米研究gydF4y2Ba(2023)gydF4y2Ba
高通量质子泵采用不对称的仿生高分子碳氮化硅膜gydF4y2Ba
纳米研究gydF4y2Ba(2023)gydF4y2Ba
H + / K +泵的结构和功能突变体揭示Na + / K +泵机制gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
人类的钠钾泵的结构闸门机制的基础gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba
