摘要gydF4y2Ba
脂肪细胞的发育和分化在肥胖及其合并症的病因学中起着重要作用gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.尽管多项研究已经调查了产生成熟脂肪细胞的成脂干细胞和前体细胞gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba在美国,我们对它们在体内的来源和性质的了解是不完整的gydF4y2Ba2gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.这部分是由于脂肪组织仓库的高度异质性和非结构化的性质gydF4y2Ba17gydF4y2Ba这已被证明难以分子解剖使用经典的方法,如荧光激活细胞分选和基于候选标记基因的Cre-lox系gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.这里,利用单细胞转录组学的分辨能力gydF4y2Ba19gydF4y2Ba在小鼠模型中,我们揭示了皮下脂肪组织的间质血管部分中脂肪干和前体细胞的不同亚群。我们确定其中一个亚群为CD142gydF4y2Ba+gydF4y2Ba脂肪形成调节细胞,在体内和体外以旁分泌方式抑制脂肪细胞的形成。我们发现,脂肪形成调节细胞对脂肪形成是难处理的,它们在人体中是功能保守的。我们的研究结果指出了脂肪生成调节细胞在调节脂肪组织可塑性方面的潜在关键作用,这与代谢控制、差异胰岛素敏感性和2型糖尿病有关。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你所在的机构访问gydF4y2Ba
相关的文章gydF4y2Ba
引用本文的开放获取文章。gydF4y2Ba
单细胞测序揭示了免疫细胞群在癌症相关脂肪消耗中的关键贡献gydF4y2Ba
细胞的发现gydF4y2Ba开放获取gydF4y2Ba2022年11月15日gydF4y2Ba
Live-seq能够对单细胞进行转录组记录gydF4y2Ba
自然gydF4y2Ba开放获取gydF4y2Ba8月17日gydF4y2Ba
皮下脂肪组织的单细胞RNA测序确定癌症相关淋巴水肿的治疗靶点gydF4y2Ba
细胞的发现gydF4y2Ba开放获取gydF4y2Ba2022年6月21日gydF4y2Ba
访问选项gydF4y2Ba
订阅《自然》+gydF4y2Ba
立即在线访问《自然》和其他55种《自然》杂志gydF4y2Ba
29.99美元gydF4y2Ba
每月gydF4y2Ba
订阅期刊gydF4y2Ba
获得1年的完整期刊访问权限gydF4y2Ba
199.00美元gydF4y2Ba
每期仅需3.90美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba
增值税稍后将在结帐时添加。gydF4y2Ba
税务计算将在结账时完成。gydF4y2Ba
买条gydF4y2Ba
在ReadCube上获得时间限制或全文访问。gydF4y2Ba
32.00美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba


参考文献gydF4y2Ba
Müller, S., Kulenkampff, E. & Wolfrum, C. ingydF4y2Ba代谢控制gydF4y2Ba(赫齐格,S.编)251-263(施普林格国际出版,Cham, 2015)。gydF4y2Ba
罗森,e。d。斯皮格尔曼,b。m。当我们谈论脂肪的时候。gydF4y2Ba细胞gydF4y2Ba156gydF4y2Ba, 20-44(2014)。gydF4y2Ba
Crisan, M.等。多种人体器官间充质干细胞的血管周围来源。gydF4y2Ba细胞干细胞gydF4y2Ba3.gydF4y2Ba, 301-313(2008)。gydF4y2Ba
Tang, W.等。白色脂肪祖细胞存在于脂肪血管系统中。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 583-586(2008)。gydF4y2Ba
Vishvanath, L.等人。PdgfrβgydF4y2Ba+gydF4y2Ba壁前脂肪细胞参与高脂饮食和长时间冷暴露诱导的成年小鼠脂肪细胞增生。gydF4y2Ba细胞金属底座gydF4y2Ba.gydF4y2Ba23gydF4y2Ba, 350-359(2016)。gydF4y2Ba
Zannettino, a.c.w.等人。多能人脂肪来源的基质干细胞表现出血管周围表型gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Baj .细胞。杂志gydF4y2Ba.gydF4y2Ba214gydF4y2Ba, 413-421(2008)。gydF4y2Ba
蔡晓霞,林勇,李志强,李志强。脂肪干细胞起源于血管周围细胞。gydF4y2Ba医学杂志。细胞gydF4y2Ba103gydF4y2Ba, 435-447(2011)。gydF4y2Ba
古普塔,R. K.等。gydF4y2BaZfp423gydF4y2Ba表达鉴定前脂肪细胞,并定位于脂肪内皮细胞和血管周围细胞。gydF4y2Ba细胞金属底座gydF4y2Ba.gydF4y2Ba15gydF4y2Ba, 230-239(2012)。gydF4y2Ba
蒋,杨,贝瑞,唐伟,格aff, J. M.独立干细胞系调节脂肪器官发生和脂肪稳态。gydF4y2Ba细胞的报道gydF4y2Ba9gydF4y2Ba, 1007-1022(2014)。gydF4y2Ba
Tran K.-V。et al。脂肪组织的血管内皮生成白色和棕色脂肪细胞。gydF4y2Ba细胞金属底座gydF4y2Ba.gydF4y2Ba15gydF4y2Ba, 222-229(2012)。gydF4y2Ba
Majka, s.m.等。从髓系通过间充质中间体重新生成的白色脂肪细胞具有年龄、脂肪库和性别特异性。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 14781-14786(2010)。gydF4y2Ba
Billon, N.等。由神经嵴产生脂肪细胞。gydF4y2Ba发展gydF4y2Ba134gydF4y2Ba, 2283-2292(2007)。gydF4y2Ba
Sowa, Y.等人。脂肪基质细胞含有来自神经嵴的表型独特的成脂祖细胞。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba8gydF4y2Ba, e84206(2013)。gydF4y2Ba
Su, x等。脂肪细胞的筋膜来源。gydF4y2Ba干细胞gydF4y2Ba34gydF4y2Ba, 1407-1419(2016)。gydF4y2Ba
Berry, R, Jeffery, E. & Rodeheffer, m.s.对脂肪细胞前体进行称重。gydF4y2Ba细胞金属底座gydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 8-20(2014)。gydF4y2Ba
Sanchez-Gurmaches, J. & Guertin, D. A.脂肪细胞谱系:追溯脂肪的起源。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1842gydF4y2Ba, 340-351(2014)。gydF4y2Ba
克里斯坦乔,a . G. &拉扎尔,M. a .形成功能性脂肪:对脂肪细胞分化的日益理解。gydF4y2Ba细胞生物学gydF4y2Ba.gydF4y2Ba12gydF4y2Ba, 722-734(2011)。gydF4y2Ba
杰弗里,E.等人。用于脂肪组织研究的Cre重组酶模型的特性。gydF4y2Ba脂肪细胞gydF4y2Ba3.gydF4y2Ba, 206-211(2014)。gydF4y2Ba
Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C. & Teichmann, S. A.单细胞RNA测序的技术和生物学。gydF4y2Ba摩尔。细胞gydF4y2Ba58gydF4y2Ba, 610-620(2015)。gydF4y2Ba
Rodeheffer, m.s., Birsoy, K. & Friedman, J. M.白色脂肪细胞祖细胞的鉴定gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba细胞gydF4y2Ba135gydF4y2Ba, 240-249(2008)。gydF4y2Ba
胡达克,C. S.等。Pref-1标志着脂肪组织发育和扩张所需的非常早期间充质前体。gydF4y2Ba细胞的报道gydF4y2Ba8gydF4y2Ba, 678-687(2014)。gydF4y2Ba
Vignali, D. A. A., Collison, L. W. & Workman, C. J.调节性T细胞如何工作。gydF4y2BaNat. Rev. ImmunolgydF4y2Ba.gydF4y2Ba8gydF4y2Ba, 523-532(2008)。gydF4y2Ba
Rennert, R. C.等。微流体单细胞转录分析合理地识别了新的表面标记物,以增强基于细胞的治疗。gydF4y2BaNat。CommungydF4y2Ba.gydF4y2Ba7gydF4y2Ba, 11945(2016)。gydF4y2Ba
shake, B.等人。脂肪细胞在组织再生和干细胞生态位中的作用。gydF4y2Ba为基础。细胞发育生物学gydF4y2Ba.gydF4y2Ba32gydF4y2Ba, 609-631(2016)。gydF4y2Ba
Gubelmann, C.等人。转录因子ZEB1作为成脂基因调控网络的中心组成部分的鉴定。gydF4y2BaeLifegydF4y2Ba3.gydF4y2Ba, e03346(2014)。gydF4y2Ba
约翰逊,T.等人。建立一个用于遗传分析的小鼠动物园:快速生成BAC转基因小鼠的综合方案。gydF4y2Ba《创世纪》gydF4y2Ba48gydF4y2Ba, 264-280(2010)。gydF4y2Ba
Rosenwald, M., Perdikari, A., Rülicke, T. & Wolfrum, C. brite和白色脂肪细胞的双向互转化。gydF4y2Ba细胞生物学gydF4y2Ba.gydF4y2Ba15gydF4y2Ba, 659-667(2013)。gydF4y2Ba
Schmieder, R. & Edwards, R.宏基因组数据集的质量控制和预处理。gydF4y2Ba生物信息学gydF4y2Ba27gydF4y2Ba, 863-864(2011)。gydF4y2Ba
Martin, M. Cutadapt从高通量测序读取中移除适配器序列。gydF4y2BaEMBnet JgydF4y2Ba.gydF4y2Ba17gydF4y2Ba, 10-12(2011)。gydF4y2Ba
耶茨等人。运用2016年。gydF4y2Ba核酸测定gydF4y2Ba.gydF4y2Ba44gydF4y2Ba, d710-d716(2016)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Anders, S, Pyl, P. T. & Huber, W. htseq -一个用于处理高通量测序数据的Python框架。gydF4y2Ba生物信息学gydF4y2Ba31gydF4y2Ba, 166-169(2015)。gydF4y2Ba
Andrews, T. S. & Hemberg, M.建模dropout允许在scRNASeq实验中无偏倚地识别标记基因。预印在gydF4y2Bahttps://www.biorxiv.org/content/early/2016/07/21/065094gydF4y2Ba(2016)。gydF4y2Ba
Van Der Maaten, L. J. P. & Hinton, G. E.可视化数据使用gydF4y2BatgydF4y2Ba新力。gydF4y2Baj·马赫。学习。ResgydF4y2Ba.gydF4y2Ba9gydF4y2Ba, 2579-2605(2008)。gydF4y2Ba
基谢列夫,V. Y.等。SC3:单细胞RNA-seq数据一致性聚类。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 483-486(2017)。gydF4y2Ba
伦,A. T. L,麦卡锡,D. J. &马里奥尼,J. C. Bioconductor单细胞rna seq数据低级分析的逐步工作流程。gydF4y2BaF1000ResgydF4y2Ba.gydF4y2Ba5gydF4y2Ba, 2122(2016)。gydF4y2Ba
Scialdone, A.等人。从单细胞转录组数据计算细胞周期阶段。gydF4y2Ba方法gydF4y2Ba85gydF4y2Ba, 54-61(2015)。gydF4y2Ba
卡朋特,a.e.等人。CellProfiler:用于识别和量化细胞表型的图像分析软件。gydF4y2Ba基因组医学杂志gydF4y2Ba.gydF4y2Ba7gydF4y2Ba, r100(2006)。gydF4y2Ba
普拉丹,R. N.等。利用整合基因组学分析棕色脂肪形成调控网络。gydF4y2Ba科学。代表gydF4y2Ba.gydF4y2Ba7gydF4y2Ba, 42130(2017)。gydF4y2Ba
Alpern, D., Gardeux, V., Russeil, J. & deploancke, B.通过批量RNA条形码和测序实现时间和成本效益高通量转录组学。预印在gydF4y2Bahttps://www.biorxiv.org/content/early/2018/01/30/256594gydF4y2Ba(2018)。gydF4y2Ba
皮切利等人。使用Smart-seq2从单细胞获得全长RNA-seq。gydF4y2BaNat协议。gydF4y2Ba9gydF4y2Ba, 171-181(2014)。gydF4y2Ba
Ritchie, m.e.等人,limma为rna测序和微阵列研究的差异表达分析提供了动力。gydF4y2Ba核酸测定gydF4y2Ba.gydF4y2Ba43gydF4y2Ba, e47(2015)。gydF4y2Ba
Leek, J. T., Johnson, W. E., Parker, H. S., Jaffe, A. E. & Storey, J. D.在高通量实验中去除批效应和其他不需要的变化的sva包。gydF4y2Ba生物信息学gydF4y2Ba28gydF4y2Ba, 882-883(2012)。gydF4y2Ba
Drost H.-G。生物技术:基因组数据检索与R。gydF4y2Ba生物信息学gydF4y2Ba33gydF4y2Ba, 1216-1217(2017)。gydF4y2Ba
库列绍夫,m.v.等。enrichment:一个全面的基因集富集分析web服务器2016年更新。gydF4y2Ba核酸测定gydF4y2Ba.gydF4y2Ba44gydF4y2Ba, w90-w97(2016)。gydF4y2Ba
金久,M. &后藤,S. KEGG:京都基因和基因组百科全书。gydF4y2Ba核酸测定gydF4y2Ba.gydF4y2Ba28gydF4y2Ba, 27-30(2000)。gydF4y2Ba
Kelder, T.等。维基路径:建立生物途径的研究社区。gydF4y2Ba核酸测定gydF4y2Ba.gydF4y2Ba40gydF4y2Ba, d1301-d1307(2012)。gydF4y2Ba
GTEx联盟。基因型-组织表达(GTEx)先导分析:人类多组织基因调控。gydF4y2Ba科学gydF4y2Ba348gydF4y2Ba, 648-660(2015)。gydF4y2Ba
确认gydF4y2Ba
我们感谢J. Auwerx, W. Chen, E. Dorcey, N. Gheldof, O. Naveiras和K. Schoonjans的建设性讨论和仔细阅读手稿。这项研究得到了人类前沿科学计划LT001032/2013 (P.C.S.),瑞士国家科学基金会资助(#31003A_162735和31003A_162887), Kristian Gerhard Jebsen代谢研究基金会(B.D.)以及瑞士洛桑联邦理工学院(EPFL)和Zürich (ETH)的机构支持。我们感谢EPFL FCCF、BIOP(特别是R. Guiet和O. Burri)、HCF和GECF对细胞分选、成像、组织学和测序的支持,以及VITAL-IT平台(洛桑大学)对计算的支持。gydF4y2Ba
审核人信息gydF4y2Ba
自然gydF4y2Ba感谢O. Stegle和其他匿名审稿人对这项工作的同行评审所作的贡献。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
b.d., c.w., p.c.s., M.Z.和H.D.设计了这项研究并撰写了手稿。P.C.S.进行了所有与转录组学相关的分析。N.A, J.R, H.D.和m.z进行单细胞实验。H.D.和M.Z.进行了所有的FACS、qPCR、细胞培养和相关成像分析。H.D.和W.S.进行了所有与移植相关的实验。赫德完成了所有基于sirna的敲除实验。M.Z.和J.R.做了所有的组织学检查。c.c., k - u.s.和G.S.提供了人体样本并帮助处理它们。M.Z.和d.a完成了所有与人类细胞相关的实验。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意:gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 ScRNA-seq揭示了ASPCs的异质性(Fluidigm C1)。gydF4y2Ba
一个gydF4y2Ba,三个Fluidigm C1 (C1) scRNA-seq实验中每个细胞的对齐读取数。R1,gydF4y2BangydF4y2Ba= 74;R2,gydF4y2BangydF4y2Ba= 71;R3,gydF4y2BangydF4y2Ba= 63个单细胞,来自三个独立的生物复制,每个复制都来自一个小鼠池。gydF4y2BabgydF4y2Ba,所有基因或仅人工RNA spike-ins (ERCC)在单细胞中表达之间的相关性(corr, Spearman 's rho)。gydF4y2BacgydF4y2Ba,合并单细胞(每单个生物复制,R1-R3)与大群体(gydF4y2BangydF4y2Ba= 4个生物重复)样本。gydF4y2BadgydF4y2Ba,三个生物scRNA-seq重复(R1-R3)中每个重复中表达的基因数/样品,以及合并的单个重复(SC,gydF4y2BangydF4y2Ba= 3)或大群体控制样本(大,gydF4y2BangydF4y2Ba= 4)。gydF4y2BaegydF4y2Ba,无处不在的表达gydF4y2BaActbgydF4y2Ba,负(gydF4y2BaPtprcgydF4y2Ba而且gydF4y2BaPecam1gydF4y2Ba)和正(gydF4y2BaCd34gydF4y2Ba,gydF4y2BaLy6agydF4y2Ba而且gydF4y2BaItgb1gydF4y2Ba) FACS标记。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,途径gydF4y2Ba47gydF4y2Ba显著富集(gydF4y2BafgydF4y2Ba)和前10位显著富集GTExgydF4y2Ba48gydF4y2Ba组织样本(gydF4y2BaggydF4y2Ba)的前200个特定于三个种群之一的基因(P1,绿色;P2,红色;P3,蓝色)。全部富集结果列于补充表3。gydF4y2BahgydF4y2Ba,gydF4y2Bat -gydF4y2Ba所有分析细胞(C1)的SNE 2D图,突出显示干细胞标记物的表达gydF4y2BaCd34gydF4y2Ba还有脂肪生成标记gydF4y2BaFabp4gydF4y2Ba(黑色)。gydF4y2Ba我gydF4y2Ba, Bean图显示了脂肪生成评分在属于三个种群之一的细胞之间的分布(P1,gydF4y2BangydF4y2Ba= 83;P2,gydF4y2BangydF4y2Ba= 96;P3,gydF4y2BangydF4y2Ba= 29个细胞)。**gydF4y2BaPgydF4y2Ba≤0.01,Wilcoxon秩和检验。gydF4y2BajgydF4y2Ba,干细胞(下面板)和脂肪形成(上面板)在所有被分析细胞中的评分分布,突出了单个不表达或表达极低水平的异常细胞gydF4y2BaItgb1gydF4y2Ba(CD29),gydF4y2BaCd34gydF4y2Ba而且gydF4y2BaLy6agydF4y2Ba(SCA1)以及非常高水平的成熟脂肪生成标记gydF4y2BaAdipoqgydF4y2Ba,gydF4y2BaRestngydF4y2Ba而且gydF4y2BaCidecgydF4y2Ba.gydF4y2BakgydF4y2Ba12个(前)脂肪形成相关基因的表达与脂肪形成相关基因的表达之间的相关性(Spearman’s rho)gydF4y2BaFabp4gydF4y2Ba;显著性(Bonferroni多重测试调整gydF4y2BaPgydF4y2Ba≤0.01)的相关性为黑色。gydF4y2BalgydF4y2Ba,gydF4y2BatgydF4y2Ba所有分析细胞的sne 2D图,突出表达gydF4y2Ba招标书gydF4y2Ba以及以前用来标记成脂前体或前脂肪细胞的各种基因(黑色);微观RFP状态也显示出来。在gydF4y2BaegydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba,gydF4y2BalgydF4y2Ba,gydF4y2BangydF4y2Ba=来自三个独立生物实验的208个细胞,每个实验都以一组小鼠为基础。gydF4y2Ba
扩展数据图2 ScRNA-seq揭示了ASPCs的异质性(10x Genomics)。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,每个单元格的对齐读数(gydF4y2Ba一个gydF4y2Ba)和每个细胞表达的基因数目(gydF4y2BabgydF4y2Ba)用于使用10x Genomics Chromium仪器进行的scRNA-seq实验。gydF4y2BacgydF4y2Ba,无处不在的表达gydF4y2BaActbgydF4y2Ba,负(gydF4y2BaPtprcgydF4y2Ba而且gydF4y2BaPecam1gydF4y2Ba),正(gydF4y2BaCd34gydF4y2Ba,gydF4y2BaLy6agydF4y2Ba而且gydF4y2BaItgb1gydF4y2Ba) FACS标记及脂肪细胞标记(gydF4y2BaAdipoqgydF4y2Ba,gydF4y2BaRetngydF4y2Ba而且gydF4y2BaCidecgydF4y2Ba).gydF4y2BadgydF4y2Ba,四个10倍基因组学群体(G1-G4)中每个群体的细胞数量。gydF4y2BaegydF4y2Ba,在10x基因组群体(G1和G4, G2和G3)中,与C1细胞群体(P1-P3)的前100个标记基因重叠的前100个标记基因的百分比。gydF4y2BafgydF4y2Ba, Bean图显示了属于四个10x基因组群体之一(G1-G4)的细胞间的脂肪生成得分分布。只有gydF4y2BaPgydF4y2BaG2比较的值被标记。gydF4y2BaggydF4y2Ba,显示在4个10x基因组群体(G1-G4)中,脂肪形成前和ASPC标记的对数(归一化表达)值的分布的箱形图。*gydF4y2BaPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba≤0.01,Wilcoxon秩和检验。在gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaG1,gydF4y2BangydF4y2Ba= 699;G2,gydF4y2BangydF4y2Ba= 664;G3,gydF4y2BangydF4y2Ba= 122;和G4,gydF4y2BangydF4y2Ba= 319个单元格。gydF4y2BahgydF4y2Ba,gydF4y2BatgydF4y2Ba所有分析细胞的-SNE 2D图(10x Genomics),突出显示成脂前标记物的表达gydF4y2BaPdgfragydF4y2Ba而且gydF4y2BaPdgfrbgydF4y2Ba(黑色)。在gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BangydF4y2Ba= 1804个细胞,来自一个基于小鼠池的生物实验。gydF4y2Ba
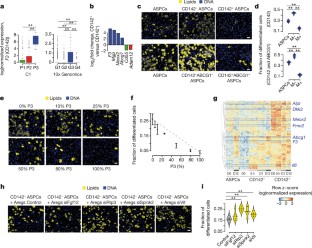
图3三个具有明显成脂分化能力的ASPC亚群。gydF4y2Ba
一个gydF4y2Ba,箱形图显示了选择用于亚群体随访的可用facs级抗体的表面标记物的对数(归一化表达)值的分布:CD55和IL13RA1 (P1, G1和G4), VAP1和ADAM12 (P2和G2)和ABCG1 (P3和G3)。*gydF4y2BaPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba≤0.01,Wilcoxon秩和检验。P1,gydF4y2BangydF4y2Ba= 83;P2,gydF4y2BangydF4y2Ba= 96;P3,gydF4y2BangydF4y2Ba= 29;G1,gydF4y2BangydF4y2Ba= 699;G2,gydF4y2BangydF4y2Ba= 664;G3,gydF4y2BangydF4y2Ba= 122;和G4,gydF4y2BangydF4y2Ba= 319个单元格。gydF4y2BabgydF4y2Ba,基于facs的分类策略,以隔离三个已识别的种群。gydF4y2BacgydF4y2Ba,基于qpcr的表达式fold-changes (log .gydF4y2Ba2gydF4y2Ba(折叠变化(FC)标记阳性与标记阴性ASPCs))为P1-, P2-和p3特异性基因面板。gydF4y2BadgydF4y2Ba,成脂分化后不同ASPC组分的显微图像;CD55gydF4y2Ba+gydF4y2Ba(P1或G1和G4), VAP1gydF4y2Ba+gydF4y2Ba(P2或G2)和ABCG1gydF4y2Ba+gydF4y2Ba(P3或G3)。细胞核用DAPI染色(蓝色),脂质用LD540染色(黄色)。比例尺,50 μm。gydF4y2BaegydF4y2Ba,显示每个ASPC亚群中分化细胞比例(Fr. diff.)分布的Bean图gydF4y2BadgydF4y2Ba,gydF4y2BangydF4y2Ba= 4口独立井。M−,标记阴性;M+,标记正。*gydF4y2BaPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba≤0.01,gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba,基于qpcr的表达式fold-changes (log .gydF4y2Ba2gydF4y2Ba(折叠变化,标记阳性与标记阴性ASPCs))对一组成脂标记基因的成脂分化。gydF4y2BaggydF4y2Ba,显示四个分化ASPC组分平均核数分布的Bean图,如图所示gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba和无花果。gydF4y2Ba2 c, dgydF4y2Ba.gydF4y2BangydF4y2Ba= 4或5口独立井。在gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,实验独立重复三次,结果相似;展示代表性图像。所有面板,种群1 (P1,绿色),种群2 (P2,红色),种群3 (P3,蓝色)。gydF4y2Ba
扩展数据图4 Aregs (CD142 .gydF4y2Ba+gydF4y2BaABCG1gydF4y2Ba+gydF4y2BaASPCs)具有成脂抑制能力。gydF4y2Ba
一个gydF4y2Ba,每次实验核数的均值和标准差;gydF4y2BaxgydF4y2Ba轴表示Lin的百分比gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2BaCD142gydF4y2Ba+gydF4y2BaABCG1gydF4y2Ba+gydF4y2Ba细胞(P3, Aregs)与Lin混合gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2BaCD142gydF4y2Ba−gydF4y2BaABCG1gydF4y2Ba−gydF4y2Ba细胞;gydF4y2BangydF4y2Ba= 4口独立井。gydF4y2BabgydF4y2Ba,旨在对CD142进行详细表征的样品采集示意图gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba分选后(D0)、电镀后(5 h)、培养后(D1)和成脂分化后(D12) ASPCs和所有ASPCs。gydF4y2BacgydF4y2Ba,在条形码RNA-seq样本中,每个样本的对齐reads数(上)和表达基因数(下)。gydF4y2BadgydF4y2Ba,排序后的条形码mRNA-seq样本与合并的scRNA-seq P3细胞之间的相关性(Spearman’s rho);gydF4y2BangydF4y2Ba= 4个生物重复(上)。在合并的scRNA-seq P3细胞和一个条形码mRNA-seq复制之间的log(归一化表达)估计之间的相关性(Spearman 's rho)示例(底部)。gydF4y2BaegydF4y2Ba,基因数量(×10gydF4y2Ba3.gydF4y2Ba),在所有aspc之间的所有比较中均有显著差异表达(FDR 0.05, fold-change 2), CD142gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba在所有ASPCs中,经过分选(D0)、电镀(5 h)、培养(D1)、成脂分化(D12)(左)以及成脂诱导(D0对D12, D0 - D12, 5 h对D12, 5 h - D12)后,CD142gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs(右)。gydF4y2BafgydF4y2Ba,维恩图显示CD142中显著差异表达基因(FDR 0.05, fold-change 2)之间有重叠gydF4y2Ba+gydF4y2BaASPCs(+)与CD142gydF4y2Ba−gydF4y2Ba分选(D0)和成脂分化(D12)后的ASPCs(−)和所有ASPCs (ASPC)。gydF4y2BaggydF4y2Ba,表达式的热图(按行gydF4y2BazgydF4y2BaCD142中显着差异表达基因(FDR 0.05, fold-change 2)的log(归一化表达)评分(从蓝色到红色)gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs和相对于所有ASPCs的成脂分化(D12)。脂肪生成标记基因是重点。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,途径gydF4y2Ba47gydF4y2Ba(gydF4y2BahgydF4y2Ba)和前10个显著富集GTEx组织样本(gydF4y2Ba我gydF4y2Ba)中显示的基因显著富集gydF4y2BafgydF4y2Ba.gydF4y2BajgydF4y2Ba,维恩图显示CD142中显著差异表达基因(FDR 0.05, fold-change 2)之间有重叠gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba在所有四个时间点评估aspc。gydF4y2BakgydF4y2Ba,表达式的热图(按行gydF4y2BazgydF4y2Ba- CD142中表达水平显著较高的基因(FDR 0.05,折叠变化2)的log(归一化表达)分数(蓝色到红色)gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba排序后的ASPCs (D0)。编码转录因子(tf)和分泌因子(Secr.)的基因被突出显示。gydF4y2BalgydF4y2Ba在CD142表达水平显著较高的基因(FDR 0.05, fold-change 2)中,前10位的GTEx组织样本显著富集gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba分别为分选、电镀和培养后(D0、5 h和D1)(左)和仅分选后(D0)(右)的aspc。gydF4y2Ba米gydF4y2Ba,途径gydF4y2Ba47gydF4y2Ba在基因中显著富集gydF4y2BakgydF4y2Ba.为gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba,完全富集结果见补充表12。gydF4y2BangydF4y2Ba,表达式的热图(按行gydF4y2BazgydF4y2Ba-一组内皮标记基因的log(归一化表达)分数,从蓝色到红色。在gydF4y2BaggydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BangydF4y2Ba,gydF4y2BangydF4y2Ba= 4 - 8,4个生物重复,每个1-3个独立孔。gydF4y2Ba
图5 Aregs的成脂抑制能力是旁分泌的。gydF4y2Ba
一个gydF4y2Ba,小鼠ASPCs与所有ASPCs在转孔中共培养的显微镜图像(成脂分化后),CD142gydF4y2Ba−gydF4y2BaASPCs或CD142gydF4y2Ba+gydF4y2BaASPCs。细胞核用Hoechst染色(蓝色),脂质用Bodipy染色(黄色)。比例尺,50 μm。实验独立重复了两次,得到了相似的结果;展示代表性图像。gydF4y2BabgydF4y2Ba,显示每个ASPC分数的分化程度(任意单位,a.u)的Bean图gydF4y2Ba一个gydF4y2Ba,以及另外一个独立的生物复制。**gydF4y2BaPgydF4y2Ba≤0.01,Wilcoxon秩和检验。实验S1: ASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs,gydF4y2BangydF4y2Ba= 8;CD142gydF4y2Ba+gydF4y2BaASPCs,gydF4y2BangydF4y2Ba= 7个视野;实验S2: ASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs,gydF4y2BangydF4y2Ba= 5;CD142gydF4y2Ba+gydF4y2BaASPCs,gydF4y2BangydF4y2Ba= 7个视野。gydF4y2BacgydF4y2Baqpcr检测基因表达(Rel. expr.)gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba,gydF4y2BaSpink2gydF4y2Ba(gydF4y2BangydF4y2Ba4)和gydF4y2Ba维特gydF4y2Ba(gydF4y2BangydF4y2Ba= 6)总SVF。两个生物重复,每个独立井2或3个。gydF4y2BadgydF4y2Ba,被镀SVF细胞敲除的显微图像gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba,gydF4y2BaSpink2gydF4y2Ba而且gydF4y2Ba维特gydF4y2Ba,以及控制(scramble siRNA)的敲除,在脂肪形成后。细胞核用DAPI染色(蓝色),脂质用LD540染色(黄色)。比例尺,50 μm。gydF4y2BaegydF4y2Ba,显示敲除后SVF细胞分化部分分布的Bean图gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba,gydF4y2BaSpink2gydF4y2Ba而且gydF4y2Ba维特gydF4y2Ba,以及控制击倒。gydF4y2BafgydF4y2Ba的豆状图,显示了中所示分化分数的平均核数的分布gydF4y2BaegydF4y2Ba.在gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,因为gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba而且gydF4y2BaSpink2gydF4y2Ba实验S1:gydF4y2BangydF4y2Ba= 7,2个生物重复,每个独立井3或4个;实验S2:gydF4y2BangydF4y2Ba= 8, 2个生物重复,每个独立井4个;为gydF4y2Ba维特gydF4y2Ba:gydF4y2BangydF4y2Ba= 6, 2个生物重复,每个独立井3个。gydF4y2BaggydF4y2Ba, qpcr检测基因表达gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba,gydF4y2BaSpink2gydF4y2Ba而且gydF4y2Ba维特gydF4y2Ba图中所示实验的Aregs。gydF4y2Ba2 hgydF4y2Ba,gydF4y2Ba我gydF4y2Ba;gydF4y2BangydF4y2Ba= 6, 2个生物重复,每个独立井3个。gydF4y2BahgydF4y2Ba,显示分化细胞比例的Bean图,在Aregs下方的CD142- ASPCs中测量,敲除gydF4y2BaFgf12gydF4y2Ba,gydF4y2BaRtp3gydF4y2Ba,gydF4y2BaSpink2gydF4y2Ba,和控制;gydF4y2BangydF4y2Ba= 6, 2个生物重复,每个独立井3个(实验的独立复制如图。gydF4y2Ba2 hgydF4y2Ba,gydF4y2Ba我)gydF4y2Ba.gydF4y2Ba我gydF4y2Ba, Bean图显示了分化分数的平均核数分布。gydF4y2Ba2 hgydF4y2Ba,gydF4y2Ba我gydF4y2Ba(实验S1)和扩展数据图。gydF4y2Ba5 hgydF4y2Ba(实验S2)。gydF4y2BangydF4y2Ba= 6, 2个生物重复,3个独立孔。gydF4y2BajgydF4y2Ba、qPCR检测CD142中脂肪发生标志物的表达gydF4y2Ba−gydF4y2Ba图中显示Aregs下方的ASPCs基因敲除。gydF4y2Ba2 hgydF4y2Ba,gydF4y2Ba我gydF4y2Ba;gydF4y2BangydF4y2Ba= 6: 2个生物重复,每个独立井3个;实验重复了两次,得到了相似的结果。在gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba, *gydF4y2BaPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba≤0.01,gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
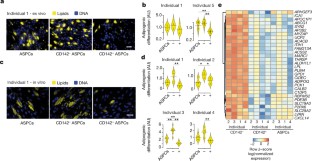
扩展数据图6 areg及其抑制能力在人体内是保守的。gydF4y2Ba
一个gydF4y2Ba,基于facs的策略分离人(如图1个个体)体外CD142gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs。gydF4y2BabgydF4y2Ba,基于qpcr的表达式fold-changes (log .gydF4y2Ba2gydF4y2Ba(折叠变化))的CD142gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs为gydF4y2BaF3gydF4y2Ba而且gydF4y2BaABCG1gydF4y2Ba排序后(左)和gydF4y2BaF3gydF4y2Ba,gydF4y2BaPPARGgydF4y2Ba而且gydF4y2BaFABP4gydF4y2Ba微分之后(右)。gydF4y2BangydF4y2Ba= 3个生物重复(不同的个体)。*gydF4y2BaPgydF4y2Ba≤0.05,单侧配对gydF4y2BatgydF4y2Ba以及。gydF4y2BacgydF4y2Ba,基于facs的策略,在体外分离人(一个个体所示)CD142gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2BaASPCs。gydF4y2BadgydF4y2Ba,显示CD142中显著差异表达基因(FDR 0.1, fold-change 2)之间重叠的维恩图gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba脂肪分化后的ASPCs和所有ASPCs (D12)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,途径gydF4y2Ba47gydF4y2Ba(gydF4y2BaegydF4y2Ba)及十大GTEx组织样本(gydF4y2BafgydF4y2Ba)在CD142中表达水平显著较高的基因(FDR 0.1, fold-change 2)中显著富集gydF4y2Ba−gydF4y2BaASPCs和CD142gydF4y2Ba+gydF4y2Ba成脂分化后的ASPCs(图;gydF4y2Ba3 e)gydF4y2Ba.gydF4y2BaggydF4y2Ba,表达式的热图(按行gydF4y2BazgydF4y2Ba- CD142中表达水平显著较高的基因(FDR 0.1,折叠变化2)的对数(归一化表达)分数(蓝色到红色)gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba成脂分化后的ASPCs (D12)。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,途径gydF4y2Ba47gydF4y2Ba(gydF4y2BahgydF4y2Ba)及十大GTEx组织样本(gydF4y2Ba我gydF4y2Ba)在CD142中表达水平显著较高的基因(FDR 0.1, fold change 2)中显著富集gydF4y2Ba+gydF4y2BaASPCs和CD142gydF4y2Ba−gydF4y2Ba脂肪分化后的aspc (D12)gydF4y2BaggydF4y2Ba.为gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,全部富集结果见补充表16。在gydF4y2BadgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba,gydF4y2BangydF4y2Ba= 4个生物重复(不同的个体)。gydF4y2BajgydF4y2Ba人离体ASPCs与小鼠Areg- (CD142)共培养的显微图像(成脂分化后gydF4y2Ba+gydF4y2Ba)或areg耗尽(CD142gydF4y2Ba−gydF4y2Ba) ASPCs。细胞核用Hoechst染色(蓝色),脂质用Bodipy染色(黄色)。比例尺,50µm。实验进行了一次。gydF4y2BakgydF4y2Ba,显示每个ASPC分数的成脂分化程度(任意单位,a.u)的Bean图,如图所示gydF4y2BajgydF4y2Ba.gydF4y2BangydF4y2Ba= 35个视野。除b: *外的所有面板gydF4y2BaPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba≤0.01,Wilcoxon秩和检验。gydF4y2Ba
扩展数据图7 areg位于血管近端,在体内抑制脂肪生成。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,小鼠皮下白色脂肪组织中CD31(橙色)、CD142(绿色)和SCA1(粉色)标记在体内定位的显微图像。细胞核赫氏染色(蓝色)。比例尺,50 μm。实验被独立地重复了至少三次,得到了相似的结果;展示代表性图像。阴性对照(gydF4y2Ba一个gydF4y2Ba)或仅用指定的二抗染色的组织冷冻切片(gydF4y2BabgydF4y2Ba).在gydF4y2BacgydF4y2Ba左为灌注组织,右为未灌注组织。在gydF4y2BadgydF4y2Ba,箭头表示CD142gydF4y2Ba+gydF4y2Ba脂肪实质内的大血管周围(左),淋巴结外(中)和单个细胞内(右);在gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,箭头表示CD142和SCA1染色的单个细胞(白色)。gydF4y2BahgydF4y2Ba、总SVF细胞和areg耗尽SVF细胞(CD142gydF4y2Ba−gydF4y2BaABCG1gydF4y2Ba−gydF4y2Ba)被植入Matrigel的皮下脂肪库。总SVF或CD142的Matrigel栓的显微图像gydF4y2Ba−gydF4y2BaABCG1gydF4y2Ba−gydF4y2BaSVF细胞。比例尺,100 μm。图3 - 5为个体,图1 - 2为个体。gydF4y2Ba4 ggydF4y2Ba.gydF4y2Ba我gydF4y2Ba、由任一Lin组成的栓子内发育成熟脂肪细胞百分比的均值和标准差gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2Ba或林gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2BaCD142gydF4y2Ba−gydF4y2BaASPCs (gydF4y2BangydF4y2Ba= 7个生物重复)使用CellProfiler分析gydF4y2Ba25gydF4y2Ba.*gydF4y2BaPgydF4y2Ba≤0.01,成对gydF4y2BatgydF4y2Ba以及。Mean和s.d.被显示出来。gydF4y2BajgydF4y2Ba,对应的Matrigel插头显微图像gydF4y2Ba我gydF4y2Ba.比例尺,100 μm。gydF4y2BakgydF4y2Ba相对应的隔离素GS-IB4(绿色)和Hoechst(蓝色)染色的Matrigel栓的显微图像gydF4y2Ba我gydF4y2Ba.比例尺,100 μm。gydF4y2BalgydF4y2Ba,栓子内血管化的定量,由任一Lin组成gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2Ba或林gydF4y2Ba−gydF4y2BaSCA1gydF4y2Ba+gydF4y2BaCD142gydF4y2Ba−gydF4y2BaASPCs (gydF4y2BangydF4y2Ba= 6个生物重复)使用CellProfiler分析gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
扩展数据图8 scRNA-seq分析的补充方法gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BatgydF4y2Ba所有分析细胞的-SNE 2D图(Fluidigm C1),突出显示在进行聚类分析时获得的四个亚群(P1-P4)gydF4y2BakgydF4y2Ba= 4 (gydF4y2Ba一个gydF4y2Ba)和属于其中一个生物复制的细胞(gydF4y2BabgydF4y2Ba)(粉色,R1;绿色,R2;蓝色,R3)。gydF4y2BacgydF4y2Ba中所示的四个集群中的每一个gydF4y2Ba一个gydF4y2Ba,每次生物复制产生的细胞数量被突出显示。gydF4y2BadgydF4y2Ba,剪影分析结果gydF4y2BakgydF4y2Ba= 3和gydF4y2BakgydF4y2Ba= 4。gydF4y2BaegydF4y2Ba,维恩图显示信件中使用M3Drop鉴定的527个显著差异表达基因与1827个高变异性(HVG)基因之间的重叠。gydF4y2BafgydF4y2Ba,对于图中所示的每个聚类。gydF4y2Ba1 bgydF4y2Ba,我们通过考虑1827个高变量基因进行SC3分析,确定了替代聚类中包含的细胞数量。无论基因选择如何,绝大多数细胞都具有相似的属性。gydF4y2BaggydF4y2Ba,信中描述的三个亚群体的前100个标记基因与基于高变基因分析得出的亚群体前100个标记基因重叠的百分比。gydF4y2BahgydF4y2Ba,gydF4y2BatgydF4y2Ba所有分析细胞(C1)的-SNE 2D图仅考虑高度可变的基因,突出了信件(M3Drop,右)中通过聚类分析识别的三个亚群(P1-P3),并使用高度可变的基因(HVG,左)。在gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BangydF4y2Ba=来自三个独立生物实验的208个细胞,每个实验都以一组小鼠为基础。gydF4y2Ba我gydF4y2Ba,标记基因在所有10x基因组细胞中的表达,包括管家基因(gydF4y2BaActbgydF4y2Ba),为阴性的FACS标记gydF4y2BaPtprcgydF4y2Ba(gydF4y2BaCd45gydF4y2Ba),gydF4y2BaPecam1gydF4y2Ba(gydF4y2BaCd31gydF4y2Ba)为阳性的FACS标记物gydF4y2BaCd34gydF4y2Ba,gydF4y2BaLy6agydF4y2Ba(gydF4y2BaSca1gydF4y2Ba),gydF4y2BaItgb1gydF4y2Ba(gydF4y2BaCd29gydF4y2Ba),以及成熟的脂肪生成标记gydF4y2BaAdipoqgydF4y2Ba,gydF4y2BaRetngydF4y2Ba而且gydF4y2BaCidecgydF4y2Ba.gydF4y2BajgydF4y2Ba,gydF4y2BatgydF4y2Ba-所有10x基因组细胞的sne 2D图,突出表达gydF4y2BaXistgydF4y2Ba还有细胞分裂标记gydF4y2BaMki67gydF4y2Ba(黑色)。gydF4y2BakgydF4y2Ba, 10倍基因组数据中不同簇数(2到15)的平方和。在gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba,gydF4y2BangydF4y2Ba= 2919个细胞来自一组小鼠的生物实验,G1之前,gydF4y2BaXistgydF4y2Ba,gydF4y2BaKrt18gydF4y2Ba或gydF4y2BaKrt19gydF4y2Ba而且gydF4y2BaEpcamgydF4y2Ba过滤。gydF4y2BalgydF4y2Ba,基因组数据中不同簇数(2至13)的剪影宽度。gydF4y2Ba米gydF4y2Ba,在10x基因组群体(G1-G4)中,与C1数据中基于高变基因推导出的群体(P1-P3)前100个标记基因重叠的前100个标记基因的百分比。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
该文件包含补充表1-19的指南gydF4y2Ba
补充数据gydF4y2Ba
此压缩文件包含补充表1-19 -见补充信息文件完整指南gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
施瓦利,p.c.,董,H.,扎卡拉,M。gydF4y2Baet al。gydF4y2Ba在哺乳动物脂肪库中抑制脂肪生成的基质细胞群。gydF4y2Ba自然gydF4y2Ba559gydF4y2Ba, 103-108(2018)。https://doi.org/10.1038/s41586-018-0226-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-018-0226-8gydF4y2Ba
这篇文章被引用gydF4y2Ba
脂肪形成的细胞和分子刹车gydF4y2Ba
自然的新陈代谢gydF4y2Ba(2022)gydF4y2Ba
通过RSPO2抑制脂肪形成的调控途径的鉴定gydF4y2Ba
自然的新陈代谢gydF4y2Ba(2022)gydF4y2Ba
皮下脂肪组织的单细胞RNA测序确定癌症相关淋巴水肿的治疗靶点gydF4y2Ba
细胞的发现gydF4y2Ba(2022)gydF4y2Ba
三碘甲状腺原氨酸(T3)通过甲状腺激素受体α介导的脂肪细胞祖细胞增殖促进棕色脂肪增生gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
单细胞测序揭示了免疫细胞群在癌症相关脂肪消耗中的关键贡献gydF4y2Ba
细胞的发现gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba
