摘要gydF4y2Ba
疫苗诱导的免疫血栓性血小板减少症(VITT)是COVID-19腺病毒载体疫苗罕见的不良反应gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.VITT类似于肝素诱导的血小板减少症(HIT),因为它与血小板活化抗体抗血小板因子4 (PF4)有关。gydF4y2Ba4gydF4y2Ba;然而,VITT患者在不接触肝素的情况下会出现血小板减少和血栓形成。在这里,我们试图确定VITT患者抗体在PF4上的结合位点。使用丙氨酸扫描诱变gydF4y2Ba5gydF4y2Ba,我们发现VITT患者抗pf4抗体的结合(gydF4y2BangydF4y2Ba= 5)仅局限于PF4表面的8个氨基酸,均位于肝素结合位点内,且结合被肝素抑制。相比之下,来自HIT患者的抗体(gydF4y2BangydF4y2Ba与PF4上两个不同位点的氨基酸结合。生物分子层干涉测量实验还显示,VITT抗PF4抗体与PF4和PF4 -肝素复合物的结合反应比HIT抗PF4抗体更强,尽管它们的解离率相似。我们的数据表明,VITT抗体可以通过与PF4的相似位点结合来模拟肝素的作用;这使得PF4四聚物聚集并形成免疫复合物,进而导致Fcγ受体IIa (Fcγ riia;也称为CD32a)依赖性血小板活化。这些结果为vitt抗体诱导的血小板活化可能导致血栓形成提供了解释。gydF4y2Ba
主要gydF4y2Ba
VITT是针对SARS-CoV-2的腺病毒载体疫苗的一种罕见但严重的不良反应。VITT的临床表现为中度至重度血小板减少伴动脉和/或静脉血栓,通常发生在不寻常的位置gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.这些发现类似于免疫药物反应HIT,在临床上表现为血小板减少和血栓形成患者谁曾接触过肝素gydF4y2Ba4gydF4y2Ba.VITT最类似于异常罕见的自发HIT,它发生在没有肝素的情况下gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
HIT是由免疫球蛋白G (IgG)抗体结合到PF4(也称为CXCL4)上的新表位引起的,PF4是一种含有70个氨基酸的阳离子蛋白,包含在血小板内gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.在肝素(一种大型阴离子多糖)与PF4上的特定位点结合后,新表位暴露出来,这导致四聚体聚集在一起。igg特异性抗体与pf4 -肝素结合形成免疫复合物,通过FcγRIIa受体激活血小板,导致血小板的强烈激活和富含促凝血剂的微粒的释放gydF4y2Ba10gydF4y2Ba.包括单核细胞在内的其他细胞也被这些免疫复合物激活,这放大了HIT患者的高凝状态gydF4y2Ba11gydF4y2Ba.据推测,VITT与HIT具有相似的病理生理学,一些研究表明,VITT患者的样本中存在高水平的抗pf4抗体gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.然而,VITT是一种独特的综合征,因为它发生在没有肝素暴露的情况下,体外血小板反应性模式不表现出典型的肝素依赖性,而在HIT中可以看到。gydF4y2Ba
在本报告中,我们描述了抗pf4抗体在VITT患者中产生的结合位点和特征,这些抗体是在用腺病毒载体接种COVID-19疫苗后产生的。我们发现VITT患者具有抗PF4抗体,这些抗体结合到PF4上一个高度受限的位点,该位点与肝素结合位点相对应。这些抗体可以在没有肝素的情况下形成血小板激活免疫复合物,可能导致VITT中观察到的血小板减少和凝血。gydF4y2Ba
病人的人口统计gydF4y2Ba
VITT患者的样本(gydF4y2BangydF4y2Ba= 5)转至麦克马斯特血小板免疫实验室诊断。所有VITT患者都接受了单剂量的ChAdOx1 nCoV-19疫苗(阿斯利康COVID-19疫苗,阿斯利康;COVISHIELD, Verity制药和印度血清研究所),随后发展成血小板减少症和血栓形成;患者的平均年龄为44岁(35-72岁),其中2 / 5(40%)为女性。从首次接种ChAdOx1型新型冠状病毒疫苗到收集样本的时间为14-40天(平均28天)。所有来自VITT患者的样本(以下简称VITT样本)均具有抗PF4抗体(平均光密度(OD), 2.71;范围内,0.763 - -3.347)。gydF4y2Ba
VITT患者的样本与HIT患者的样本进行了比较(gydF4y2BangydF4y2Ba= 10)接受肝素治疗后出现血小板减少症,临床概率评分高(4Ts评分至少为4),抗pf4 -肝素抗体可检测,体外血小板活化证据。HIT患者的平均年龄为69岁(范围52-81岁),5 / 10(50%)为女性。9 / 10(90%)的HIT患者发生血栓形成。从肝素起始到样本采集的时间为6-27天(平均14.3天)。所有来自HIT患者的样本(以下简称HIT样本)均检测出抗pf4 -肝素抗体(平均OD, 3.10;范围内,2.329 - -3.897)。gydF4y2Ba
VITT抗体的血小板活化谱gydF4y2Ba
使用功能性血小板活化试验(血清素释放试验;我们发现VITT和HIT样本在体外具有独特的血小板反应性模式。VITT样本在体外血小板激活时不表现出任何依赖于肝素(扩展数据图)。gydF4y2Ba1gydF4y2Ba).所有VITT样本在50 μg ml时均表现出强烈的、剂量依赖性的pf4介导的血小板激活gydF4y2Ba−1gydF4y2BaPF4(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).通过添加fc γ riia阻断单克隆抗体IV.3, VITT和HIT样品可以完全抑制血小板活化gydF4y2Ba4gydF4y2Ba.这些结果表明VITT抗体需要PF4来激活血小板,这是由FcγRIIa受体参与介导的,与免疫复合物的作用一致。相比之下,HIT样本激活血小板有两种不同的特征。肝素依赖型抗体的HIT患者暴露于肝素,其抗体在肝素存在时激活SRA中的血小板(扩展数据图)。gydF4y2Ba1 cgydF4y2Ba).具有肝素不依赖抗体的HIT患者是暴露于肝素的患者,其抗体在肝素存在和不存在的情况下都能激活SRA中的血小板(扩展数据图)。gydF4y2Ba1 cgydF4y2Ba).所有HIT样品也在添加PF4后激活血小板(扩展数据图。gydF4y2Ba1 dgydF4y2Ba).gydF4y2Ba
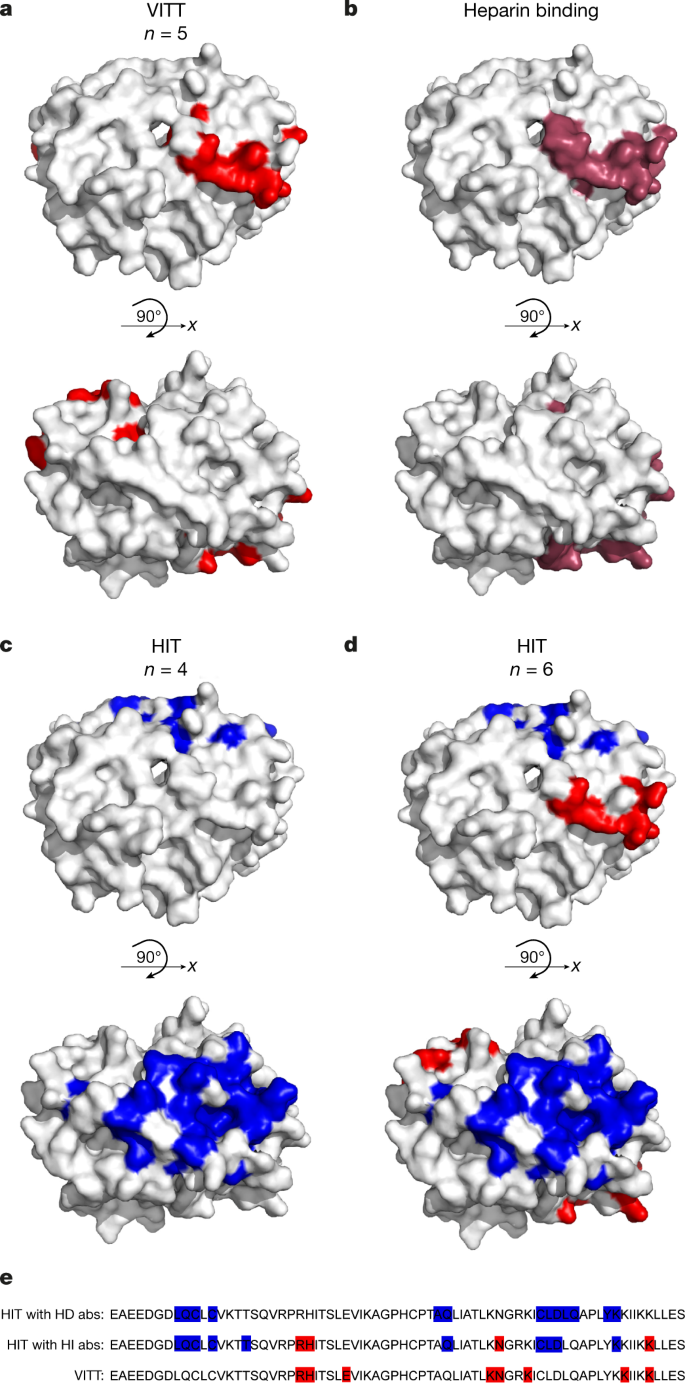
VITT抗体与PF4的结合位点gydF4y2Ba
以往的研究表明,HIT抗体的结合表位是非连续的,是构象依赖的gydF4y2Ba13gydF4y2Ba.因此,为了确定VITT抗体在PF4上的特定氨基酸靶点,我们使用丙氨酸扫描诱变法,产生了70个独特的重组PF4突变体,每个突变体只不同一个氨基酸gydF4y2Ba5gydF4y2Ba.我们将关键结合氨基酸定义为与野生型PF4相比,突变导致相应PF4突变体结合减少50%以上的氨基酸。我们鉴定了VITT样品结合所必需的8种表面氨基酸(Arg22, His23, Glu28, Lys46, Asn47, Lys50, Lys62和Lys66;表格gydF4y2Ba1gydF4y2Ba,无花果。gydF4y2Ba1gydF4y2Ba).PF4突变体R22A和E28A影响了所有5个VITT样本的结合。这一限制性表位与有限的B细胞克隆性一致,表明VITT抗体的结合位点是在PF4上的一个特定位点。我们观察到组成VITT表位的8个氨基酸中的4个(Arg22, His23, Lys46和Lys66)与肝素结合的PF4上的氨基酸相对应gydF4y2Ba14gydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba).我们假设VITT抗PF4抗体结合到PF4四聚体上的肝素结合位点,解释了为什么在体外添加肝素不会增强血小板活化,如HIT中所见;相反,它抑制血小板活化,可能是通过取代VITT抗pf4抗体。此外,在PF4酶免疫测定(EIA)中,我们发现在四个可用的VITT样本中,VITT抗体与PF4的结合被治疗性肝素浓度所抑制(扩展数据图)。gydF4y2Ba2gydF4y2Ba).我们的结果解释了为什么在以前的研究中测试了一些VITT样本gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba被治疗剂量的肝素抑制。这些发现表明,VITT抗体通过稳定PF4复合物,使VITT抗体的Fc区彼此靠近,并在血小板上交联Fcγ riia受体,从而通过肝素样机制引起血小板激活,这与单克隆抗体1E12的机制类似,后者可以独立于肝素激活血小板gydF4y2Ba15gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,有关VITT样本(gydF4y2BangydF4y2Ba= 5),结合部位(用红色标注;gydF4y2Ba一个gydF4y2Ba)在PF4上的肝素结合位点内排列(棕色;gydF4y2BabgydF4y2Ba).gydF4y2BacgydF4y2Ba, HIT样本(gydF4y2BangydF4y2Ba= 10),所有样品均鉴定出一个主要结合位点(用蓝色表示)。gydF4y2BadgydF4y2Ba在60%的HIT样本(红色)中发现了一个额外的结合位点,该结合位点位于PF4上的肝素结合位点内。gydF4y2BaegydF4y2Ba在PF4的主要序列中,被预测为VITT和肝素依赖(HD)和肝素不依赖(HI)抗体(abs)结合位点的一部分的氨基酸被突出显示。图片修改自蛋白质数据库(PDB)条目1RHP。gydF4y2Ba
然后比较VITT抗体与HIT抗体在PF4上的结合位点。将筛查出的10例HIT患者的所有关键氨基酸组合起来,总共有10种氨基酸(Leu8、Cys10、Cys12、Thr16、Arg22、Gln40、Asn47、Cys52、Leu53、Asp54、Lys61、Lys66和Leu67;表格gydF4y2Ba1gydF4y2Ba),它们是HIT表位的一部分,以不同的组合。没有单一的常见氨基酸对所有10个HIT样本的结合至关重要,这可能是由于抗体的多克隆性质gydF4y2Ba5gydF4y2Ba.PF4突变体L8A、C10A、C12A、T16A、C52A、D54A和K61A的结合缺失对应于影响HIT抗体结合的最常见氨基酸,并且在六个HIT样本中很常见。当在PF4四聚物上显示时,我们在PF4上确定了一个所有HIT样本(10个中的10个)靶向的位点(图4)。gydF4y2Ba1 c, dgydF4y2Ba).此外,10个HIT样本中有6个靶向其他位点(图2)。gydF4y2Ba1 dgydF4y2Ba)类似于肝素结合位点内的VITT位点。与VITT样本不同,HIT样本中没有一个局限于肝素结合位点。这与之前的观察结果一致,即一些HIT样本含有两种类型的血小板激活抗pf4 -肝素抗体gydF4y2Ba16gydF4y2Ba.HIT抗体与抗PF4 -肝素复合物的单克隆抗体KKO结合在一个相似的位点上,这就解释了为什么HIT抗体(而不是VITT抗体)需要肝素来交联PF4四聚体gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
除了澄清VITT抗体的结合位点外,这些结果还解释了为什么一些快速HIT免疫分析可能会产生VITT假阴性结果gydF4y2Ba17gydF4y2Ba.一种快速HIT免疫测定,乳胶免疫浊度测定(HemosIL HIT- abgydF4y2Ba(PF4-H)gydF4y2Ba),利用KKO聚合pf4 -肝素复合物。由于所有HIT样本都具有与KKO结合在同一位点的抗体,因此HIT样本在结合pf4 -肝素复合物方面与KKO竞争。相比之下,VITT抗体与KKO抗体结合在PF4上的不同位置,因此不竞争结合。gydF4y2Ba
VITT抗体的结合动力学gydF4y2Ba
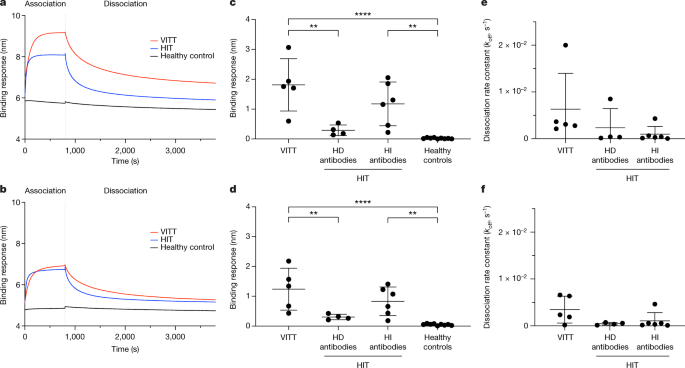
VITT样品的结合反应(gydF4y2BangydF4y2Ba= 5), HIT样本(gydF4y2BangydF4y2Ba= 10)和健康对照个体的样本(gydF4y2BangydF4y2Ba= 10)到PF4和PF4肝素的检测采用生物层干涉法(BLI;结合反应是对给定样本中抗原特异性抗体的测量。当健康对照样本(gydF4y2BangydF4y2Ba= 10)分别用固定化PF4和PF4肝素检测,平均结合响应(以平均波长位移(单位nm)±2个标准差(2 s.d)测量)分别为0.0059±0.11 nm和0.031±0.11 nm。所有VITT (gydF4y2BangydF4y2Ba= 5)及HIT (gydF4y2BangydF4y2Ba= 10)固定化PF4和固定化PF4 -肝素分别高于0.12 nm和0.14 nm的平均值+ 2 s.d.截断值,表明结合结果为阳性。VITT样品的平均结合响应(nm shift±s.d)为1.82±0.88 nm, HIT样品为0.82±0.72 nm (gydF4y2BaPgydF4y2Ba< 0.05)。同样,VITT样品的平均结合响应为1.24±0.70 nm, HIT样品的平均结合响应为0.62±0.45 nm (gydF4y2BaPgydF4y2Ba< 0.05)与pf4 -肝素复合物。因此,VITT样本中PF4和PF4 -肝素的结合反应明显高于HIT样本和健康对照样本,表明VITT患者具有更强的抗体反应。gydF4y2Ba
我们进一步比较了VITT样本与两组HIT样本的结合反应,依赖于肝素(gydF4y2BangydF4y2Ba= 4)和肝素无关(gydF4y2BangydF4y2Ba=抗体。肝素依赖抗体的HIT患者的平均结合反应为0.29±0.18 nm,而肝素不依赖抗体的HIT患者对固定化PF4的平均结合反应为1.18±0.73 nm。gydF4y2Ba2摄氏度gydF4y2Ba).当样本针对固定化pf4 -肝素复合物进行测试时,具有肝素依赖抗体的HIT患者的平均结合反应为0.30±0.09 nm,具有肝素不依赖抗体的HIT患者的平均结合反应为0.83±0.48 nm(图2)。gydF4y2Ba二维gydF4y2Ba).VITT样本的结合反应明显高于具有肝素依赖抗体的HIT患者样本和PF4和PF4 -肝素健康对照样本(VITT与具有肝素依赖抗体的HIT相比:gydF4y2BaPgydF4y2Ba< 0.01;VITT与健康对照:gydF4y2BaPgydF4y2Ba< 0.001)。相比之下,VITT样本的结合反应与具有肝素非依赖性抗体的HIT患者样本的结合反应相似。与PF4 -肝素相比,VITT样本对PF4的结合反应也显著更高(gydF4y2BaPgydF4y2Ba< 0.05),与肝素对VITT抗体与PF4结合的抑制作用一致(扩展数据图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba, VITT患者、HIT患者和健康对照参与者的抗体对生物素化PF4的代表性结合反应(gydF4y2Ba一个gydF4y2Ba)和生物素化pf4 -肝素(gydF4y2BabgydF4y2Ba)固定在链霉亲和素生物传感器上。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,与PF4的结合反应(gydF4y2BacgydF4y2Ba)和pf4 -肝素(gydF4y2BadgydF4y2Ba)和解离率(gydF4y2BakgydF4y2Ba从gydF4y2Ba)及PF4 (gydF4y2BaegydF4y2Ba)和pf4 -肝素(gydF4y2BafgydF4y2Ba),收集VITT患者的样本(gydF4y2BangydF4y2Ba= 5),肝素依赖抗体的HIT患者(gydF4y2BangydF4y2Ba= 4),肝素非依赖性抗体(gydF4y2BangydF4y2Ba= 6)和健康对照组(gydF4y2BangydF4y2Ba= 10)。伴有肝素依赖抗体的急性肝损伤患者(gydF4y2BangydF4y2Ba= 4)是典型的HIT患者和具有肝素非依赖性抗体的HIT患者(gydF4y2BangydF4y2Ba= 6)是在SRA中表现出非肝素依赖性血小板激活的HIT患者。结果表明,VITT样本对PF4和PF4 -肝素的结合反应高于具有肝素依赖抗体(PF4,gydF4y2BaPgydF4y2Ba= 0.0017;PF4-heparin,gydF4y2BaPgydF4y2Ba= 0.0090)和健康对照样本。数值显示为平均结合反应(nm)±s.d.和平均解离率gydF4y2BakgydF4y2Ba从gydF4y2Ba(年代gydF4y2Ba-1gydF4y2Ba)±s.d. HD抗体,肝素依赖抗体;HI抗体,非肝素抗体。双尾Mann-Whitney检验的统计分析;**gydF4y2BaPgydF4y2Ba< 0.01, ****gydF4y2BaPgydF4y2Ba< 0.0005。gydF4y2Ba
为了确认样本中的结合反应是由于抗PF4抗体而不是其他血清因素,从两个VITT样本中纯化总IgG抗体,然后测试其结合PF4和PF4 -肝素的能力。然而,由于样本的限制,没有进一步纯化特异性的VITT抗pf4抗体,这是本研究的潜在局限性。从VITT样本中分离出的抗PF4和PF4肝素的总IgG抗体的结合反应与在各自血清中观察到的结合反应相似,这表明结合反应是由于抗PF4抗体(扩展数据图)。gydF4y2Ba3.gydF4y2Ba).另外,2个VITT、1个HIT和2个健康对照样本在单独的实验中重新测试,并显示出可重复性(扩展数据图)。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
当多克隆抗体与抗原相互作用时,可以测量与浓度无关的解离率。平均游离速率(gydF4y2BakgydF4y2Ba从gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba±s.d)为6.32 × 10gydF4y2Ba−3gydF4y2Ba±0.0077 sgydF4y2Ba−1gydF4y2BaVITT样品为2.34 × 10gydF4y2Ba−3gydF4y2Ba±0.0041 sgydF4y2Ba−1gydF4y2Ba为含肝素依赖抗体的HIT样本,为9.65 × 10gydF4y2Ba−4gydF4y2Ba±0.0016 sgydF4y2Ba−1gydF4y2Ba对于具有肝素依赖抗体的HIT样本,用于固定化PF4(图。gydF4y2Ba2 egydF4y2Ba).同样,平均游离速率(gydF4y2BakgydF4y2Ba从gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba±s.d)为3.47 × 10gydF4y2Ba−3gydF4y2Ba±0.0029 sgydF4y2Ba−1gydF4y2BaVITT样品为4.56 × 10gydF4y2Ba−4gydF4y2Ba±0.0002 sgydF4y2Ba−1gydF4y2Ba肝素依赖抗体的HIT样本为1.07 × 10gydF4y2Ba−3gydF4y2Ba±0.0018 sgydF4y2Ba−1gydF4y2Ba对于具有肝素不依赖抗体的HIT样本,用于固定化pf4 -肝素(图。gydF4y2Ba2 fgydF4y2Ba).VITT组和两组同时使用PF4和PF4肝素的HIT组的游离率没有统计学上的显著差异(PF4: VITT与使用肝素依赖抗体的HIT组,gydF4y2BaPgydF4y2Ba= 0.482;用肝素非依赖性抗体对抗HIT,gydF4y2BaPgydF4y2Ba= 0.220;pf4 -肝素:肝素依赖抗体的VITT vs HIT,gydF4y2BaPgydF4y2Ba= 0.104;用肝素依赖抗体对抗HIT,gydF4y2BaPgydF4y2Ba= 0.160)。低解离率可能允许充分结合和形成免疫复合物,通过交联血小板上的FcγRIIa受体诱导血小板活化。由于血清中人抗体为多克隆抗体,无法测定亲和度;然而,结合反应和解离率分别表明了免疫反应的强度和多克隆样本的亲和性。gydF4y2Ba
抗PF4单克隆抗体,如KKO(参考文献;gydF4y2Ba18gydF4y2Ba)和1E12(参考。gydF4y2Ba15gydF4y2Ba)促进血小板表面PF4超大型复合物的形成。之前的研究使用了HIT患者的抗体gydF4y2Ba19gydF4y2Ba和类似HIT抗体的单克隆抗体gydF4y2Ba15gydF4y2Ba研究表明,在某些HIT患者中,非肝素抗体的高亲和力可以在没有肝素的情况下聚集PF4四聚体,并产生血小板激活免疫复合物。同样,我们发现VITT患者的抗PF4抗体与HIT患者的抗体(尤其是具有肝素不依赖抗体的HIT患者)具有相当的结合反应和亲和性,这意味着它们可以聚集PF4四聚体,并产生相同的超大型血小板激活免疫复合物(扩展数据图)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
据观察,在未添加肝素的情况下,50%的HIT样本在SRA测试中引起体外血小板激活gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.因此,HIT样本被分为两组:一组具有肝素依赖抗体,另一组具有肝素依赖抗体和肝素不依赖抗体。定义抗pf4抗体与VITT患者的显著特征是,这些患者与hit患者不同,没有暴露于肝素,并且他们的抗pf4抗体局限于肝素结合位点。gydF4y2Ba
在本报告中,我们发现VITT患者的抗PF4抗体可以在没有肝素的情况下,在PF4存在的情况下,通过FcγRIIa受体诱导血小板活化。然而,其他血清因子也可促进血小板活化。先前的研究发现,VITT患者的抗体能够在腺病毒颗粒存在的情况下以剂量依赖的方式激活血小板并引起血小板聚集gydF4y2Ba1gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.因此,VITT患者抗pf4抗体引起的血小板活化可能不是导致血栓事件发展的唯一因素。HIT还通过各种促血栓形成机制传播,这些机制在VITT中也很重要,包括fc受体多态性gydF4y2Ba25gydF4y2Ba单核细胞活化和组织因子产生gydF4y2Ba26gydF4y2Ba,以及促凝血微粒的产生gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
本研究为vitt介导的血小板活化提供了解释。在我们的研究中,VITT患者彼此之间表现出相似的抗体特征,他们的抗体与肝素结合PF4的位置相同。VITT抗体在不添加肝素或其他辅助因子的情况下形成免疫复合物,并通过FcγRIIa受体激活血小板和潜在的其他细胞,进而在多个点启动凝血,导致血小板减少和血栓形成。gydF4y2Ba
方法gydF4y2Ba
数据报告gydF4y2Ba
没有使用统计方法来预先确定样本量。实验不是随机的,研究人员在实验和结果评估期间没有对分配盲目。gydF4y2Ba
研究参与者gydF4y2Ba
参与者包括诊断为VITT的患者(gydF4y2BangydF4y2Ba= 5),确诊为HIT的患者(gydF4y2BangydF4y2Ba= 10)和健康志愿者(gydF4y2BangydF4y2Ba= 10)。VITT的诊断基于四个标准:近期接种阿斯利康疫苗;抗pf4 IgG抗体阳性;pf4增强的SRA呈阳性;之前也没有接触过肝素。HIT的诊断基于三个标准:4Ts评分,其中所有HIT患者的临床评分至少为4分;阳性的市售pf4增强的肝素依赖IgG/ a / m特异性EIA (Immucor, OD≥0.45)和阳性的SRA (SRA≥20%)gydF4y2Ba14gydF4y2BaC-serotonin版本)gydF4y2Ba27gydF4y2Ba.这项研究得到了汉密尔顿综合研究伦理委员会(HiREB)的批准,并获得了所有参与者的知情书面同意。gydF4y2Ba
血小板活化测定gydF4y2Ba
血小板活化试验在肝素存在的情况下使用SRA进行,包括增加外源性PF4剂量的修改,而不是肝素(PF4-SRA)。gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.一些实验用高浓度未分离肝素(100 IU ml)进行gydF4y2Ba−1gydF4y2Ba),或使用fc受体阻断单克隆抗体(IV.3)。gydF4y2Ba
使用丙氨酸扫描诱变技术从VITT和HIT样品中定位抗体与PF4的结合gydF4y2Ba
利用限制性内切位点NdeI和hindii (GenScript)将人PF4的全长DNA编码序列克隆到pET22b表达载体上。PF4突变体的表达和纯化如前所述gydF4y2Ba5gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.简而言之,设计PF4突变体时,野生型PF4中的非丙氨酸氨基酸突变为丙氨酸,而野生型PF4中的丙氨酸氨基酸突变为缬氨酸。将PF4突变体导入gydF4y2Ba大肠杆菌gydF4y2BaArcticExpress (DE3)细胞(安捷伦科技)。对于PF4突变体的过表达,培养物在37°C生长到指数中期,然后用0.5 mM异丙基β-诱导gydF4y2BadgydF4y2Ba-1-硫半乳糖yranoside (IPTG),在37°C下生长3小时。gydF4y2Ba大肠杆菌gydF4y2Ba每种野生型PF4或PF4突变体的细胞均在20mm磷酸钠、pH 7.2、400 mM氯化钠、1.4 mM β-巯基乙醇、5% (v/v)甘油、1% (v/v) Triton X-100 (Thermo Fisher Scientific)和0.5% (w/v)脱氧胆酸钠(MilliporeSigma)和2mm MgCl中超声裂解gydF4y2Ba2gydF4y2Ba, 10 μg mlgydF4y2Ba−1gydF4y2BaDNaseI (MilliporeSigma)和无edta蛋白酶抑制剂鸡尾酒(Roche)。然后用40000离心清除上清液gydF4y2BaggydF4y2Ba在4°C下放置40分钟,并应用于HiTrap Q HP色谱柱(Cytiva Life Sciences),该色谱柱与20 mM磷酸钠,pH 7.2, 400 mM氯化钠,1.4 mM β-巯基乙醇和5% (v/v)甘油平衡。然后将Q - HP柱的流过物储存在4°C下过夜。第二天,将血清稀释两倍,用20 mM磷酸钠、pH 7.2、1.4 mM β-巯基乙醇和5% (v/v)甘油制成浓度为200 mM的氯化钠,用0.2 μm过滤器(Acrodisc)进行注射器过滤,并装入HiTrap Heparin HP色谱柱(Cytiva Life Sciences)。污染物用0.5 M氯化钠洗脱,PF4用从0.5 M到2 M氯化钠的线性梯度洗脱。将含有纯野生型或PF4突变体的片段汇集、浓缩并缓冲交换到磷酸盐缓冲盐水(PBS)和1.5 M氯化钠中。PF4的浓度是用双辛酸(BCA)测定法测定的(赛默飞世尔科学公司)。利用4-18%变性SDS-PAGE对每个PF4突变体的蛋白表达和纯度进行评估。gydF4y2Ba
70种氨基酸对患者样本中抗pf4 -肝素抗体结合的影响,以类似于前面描述的方式进行了测量和分析gydF4y2Ba5gydF4y2Ba.使用改良的PF4 -肝素igg特异性EIA测量抗PF4 -肝素抗体与野生型PF4和PF4突变体的结合gydF4y2Ba5gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.微量孔板(384孔;用10 μg ml包被Thermo Scientific Nunc)gydF4y2Ba−1gydF4y2Ba链霉亲和素1iu mlgydF4y2Ba−1gydF4y2Ba生物素化的肝素,用添加3% (v/v)牛血清白蛋白(BSA)的PBS在室温下阻塞2小时。5 μg ml野生型PF4或PF4突变体gydF4y2Ba−1gydF4y2Ba然后加入室温孵育1小时。将稀释后的患者样品(1:50,1% BSA在PBS中制备)添加到平板上,在室温下孵育1小时。洗涤后,加入碱性磷酸酶偶联的山羊抗人IgG (γ-链特异性,Jackson免疫研究实验室),以1:3 000稀释,在室温下孵育1小时。添加1mg mlgydF4y2Ba−1gydF4y2Ba对硝基苯磷酸(MilliporeSigma)底物溶解在1 M二乙醇胺缓冲液(pH 9.6)中进行检测。使用BioTek 800TS酶标仪(BioTek)在405nm和490 nm处测量OD(作为参考),以评估抗体与野生型PF4和PF4突变体的结合。结果报告为相对于野生型PF4结合的结合损失的百分比。gydF4y2Ba
肝素抑制VITT抗pf4抗体gydF4y2Ba
微量孔板(96孔,Nunc Maxisorp)在4℃下用100 μl /孔的PF4 (60 μg ml)涂覆过夜gydF4y2Ba−1gydF4y2Ba)稀释在50mm碳酸盐-碳酸氢盐缓冲液(pH 9.6)。在室温下,用PBS制备的3% (v/v) BSA 200 μl /孔堵塞板2小时。gydF4y2BangydF4y2Ba= 4),用1% BSA在PBS中稀释1:50,并与增加浓度的未分离肝素(最终浓度为0.1、0.5、1、5和100 IU ml)预孵育gydF4y2Ba−1gydF4y2Ba;在室温下放置1小时。从微量孔板中去除阻塞液,将技术重复件中的VITT样品和肝素混合物(100 μl /孔)加入孔板,室温孵育1 h。用PBS - 0.05% Tween 20洗两次,PBS洗三次。用1% (v/v) BSA在PBS中制备的碱性磷酸酶偶联山羊抗人IgG (γ-链特异性,1:3 000,Jackson免疫研究实验室)抗体,每孔100 μl检测结合的人IgG抗体。洗板后加入100 μl底物(对硝基苯磷酸盐溶解于二乙醇胺缓冲液(MilliporeSigma))。使用BioTek 800TS微板阅读器(BioTek)在405 nm和490 nm处测量OD(作为参考)。gydF4y2Ba
总IgG抗体的纯化gydF4y2Ba
从两个VITT样品中纯化总IgG抗体,进一步分析结合动力学。将2毫升蛋白g包被的sepharose beads (Thermo Fisher Scientific)用PBS在室温300下清洗三次gydF4y2BaggydF4y2Ba患者样本在56°C下热灭活30分钟,并在PBS中稀释三次。然后将样品转移到蛋白G菌丝珠中,在室温下孵育1小时,然后用30 ml PBS大量冲洗。用0.1 M甘氨酸(pH 2.7)洗脱G蛋白琼脂糖珠中的总IgG,用Tris缓冲液(pH 8.0)中和。gydF4y2Ba
用BLI研究VITT和HIT抗体的结合动力学gydF4y2Ba
如前所述,野生型PF4用生物素标记gydF4y2Ba30.gydF4y2Ba.简而言之,野生型PF4和PF4突变体在5倍体积的肝素- sepharose 6快速流动亲和层析介质(Cytiva Life Sciences)中室温摇晃培养1小时。将EZ-Link磺基- nhs - lc -生物素(赛默飞世尔科学公司)以20摩尔过量添加到PF4和肝素sepharose混合物中,并在室温下振荡反应1小时。生物素化的野生型PF4或PF4突变体用PBS和2 M氯化钠从肝素sepharose中洗脱。使用分光光度计(Eppendorf AG)测量280 nm处的吸光度,并用于计算浓度。使用链霉亲和素包被的抗PF4 -肝素EIA检查PF4的生物素化。gydF4y2Ba
BLI实验使用Octet Red 96仪器(FortéBio)进行。样品或缓冲液分别置于96孔黑色平底微量检测板(Greiner Bio-One)中,PBS中添加1% (v/v) BSA,每孔体积为200 μl,操作温度为23℃。链霉菌素涂层生物传感器尖端(FortéBio)与1% BSA在PBS (MilliporeSigma)中水化,在抗原固定60秒前建立基线。生物素化重组PF4(终浓度7.5 μg mlgydF4y2Ba−1gydF4y2Ba),单独或与0.125 IU ml复配gydF4y2Ba−1gydF4y2Ba未分离肝素(LEO Pharma),然后在生物传感器尖端上以1000转/分钟的速度固定1200秒,然后以1000转/分钟的速度重新建立基线1800秒。然后将抗原涂层传感器与热灭活的患者样本或纯化的总IgG以1:32稀释的方式在1000转/分钟下反应780秒,然后在1000转/分钟下进行分离3000秒。使用Octet User Software v.3.1使用2:1异质配体结合模型分析数据。减去只有缓冲液的对照井的参考值,所有结果与测量基线对齐。每个样品的结合剖面响应以平均波长位移(nm)表示。gydF4y2Ba
数据采集、统计分析和再现性gydF4y2Ba
使用成对或非成对的方法检验数据间的差异是否具有统计学意义gydF4y2BatgydF4y2Ba-检验和曼-惠特尼检验。gydF4y2BaPgydF4y2Ba-values报告为双尾和gydF4y2BaPgydF4y2Ba< 0.05为差异有统计学意义。所有统计分析均使用GraphPad Prism v.9.1.0 (GraphPad软件)进行。除非另有说明,实验与技术副本独立重复两次,结果相似。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
在当前研究期间生成和/或分析的数据集没有公开提供,以实现研究成果的商业化,但可根据合理要求从通信作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Greinacher, A.等人。ChAdOx1 nCov-19疫苗接种后的血栓性血小板减少。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.gydF4y2Ba384gydF4y2Ba, 2092-2101(2021)。gydF4y2Ba
舒尔茨,n.h.等人。ChAdOx1 nCoV-19疫苗接种后血栓形成和血小板减少。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.gydF4y2Ba384gydF4y2Ba, 2124-2130(2021)。gydF4y2Ba
史高丽,等人。ChAdOx1 nCoV-19疫苗接种后出现血小板因子4病理抗体。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.gydF4y2Ba384gydF4y2Ba, 2202-2211(2021)。gydF4y2Ba
凯尔顿,J. G.等。肝素诱导的血小板减少症:实验室研究。gydF4y2Ba血gydF4y2Ba72gydF4y2Ba, 925-930(1988)。gydF4y2Ba
黄恩,A.等。在肝素诱导的血小板减少症中结合致病性抗体的血小板因子4氨基酸的特性。gydF4y2Baj . Thromb。HaemostgydF4y2Ba.gydF4y2Ba17gydF4y2Ba, 389-399(2019)。gydF4y2Ba
Warkentin, T. E., Makris, M., Jay, R. M. & Kelton, J. G.一种类似于肝素诱导血小板减少症的自发性血栓前障碍。gydF4y2Ba点。j .地中海gydF4y2Ba.gydF4y2Ba121gydF4y2Ba, 632-636(2008)。gydF4y2Ba
黄,S. R.等。全膝关节置换术后与自发肝素诱导血小板减少综合征相关的脑静脉窦血栓形成。gydF4y2Ba血小板gydF4y2Bahttps://doi.org/10.1080/09537104.2020.1828574gydF4y2Ba(2020)。gydF4y2Ba
Amiral, J.等人。大分子血小板因子4-肝素复合物在肝素诱导的血小板减少症中的抗体:44例的研究。gydF4y2BaThromb。HaemostgydF4y2Ba.gydF4y2Ba73gydF4y2Ba, 21-28(1995)。gydF4y2Ba
蔡,Z.等。肝素诱导血小板减少症免疫复合物的原子描述。gydF4y2BaNat。CommungydF4y2Ba.gydF4y2Ba6gydF4y2Ba, 8277(2015)。gydF4y2Ba
Warkentin, t.e.等。肝素诱导血小板减少症患者的血清产生具有促凝活性的血小板源性微粒:肝素诱导血小板减少症血栓并发症的解释。gydF4y2Ba血gydF4y2Ba84gydF4y2Ba, 3691-3699(1994)。gydF4y2Ba
劳瓦,L.等人。单核细胞结合PF4在肝素诱导血小板减少症发病机制中的作用。gydF4y2Ba血gydF4y2Ba116gydF4y2Ba, 5021-5031(2010)。gydF4y2Ba
Thiele, T.等。ChAdOx1 nCoV-19和BNT162b2疫苗接种后抗pf4 /聚阴离子抗体检测阳性的频率gydF4y2Ba血gydF4y2Bahttps://doi.org/10.1182/blood.2021012217gydF4y2Ba(2021)。gydF4y2Ba
霍斯伍德,P., Warkentin, T. E.,海沃德,C. P. & Kelton, J. G.肝素诱导血小板减少症的表位特异性。gydF4y2BaBr。j . HaematolgydF4y2Ba.gydF4y2Ba95gydF4y2Ba, 161-167(1996)。gydF4y2Ba
梅奥,K. H.等。肝素与血小板因子-4结合。核磁共振和定点诱变研究:精氨酸残基对结合至关重要。gydF4y2Ba物化学。JgydF4y2Ba.gydF4y2Ba312gydF4y2Ba, 357-365(1995)。gydF4y2Ba
Vayne, C.等。新型单克隆pf4特异性抗体的特性,作为典型和自身免疫性肝素诱导的血小板减少症研究的有用工具。gydF4y2BaThromb。HaemostgydF4y2Ba.gydF4y2Ba121gydF4y2Ba, 322-331(2021)。gydF4y2Ba
Nguyen T. H., Medvedev, N., Delcea, M. & Greinacher, a .抗血小板因子4/聚阴离子抗体介导自身免疫的新机制。gydF4y2BaNat。CommungydF4y2Ba.gydF4y2Ba8gydF4y2Ba, 14945(2017)。gydF4y2Ba
Vayne, C.等。PF4在疫苗诱导的血小板减少症中的免疫测定。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.(2021)。gydF4y2Ba
萨夏斯,B. S.等。HIT发病机制中的动态抗体结合特性。gydF4y2Ba血gydF4y2Ba120gydF4y2Ba, 1137-1142(2012)。gydF4y2Ba
单分子力光谱在揭示典型和自身免疫性肝素诱导的血小板减少症中的作用。gydF4y2BaInt。理学gydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 1054(2018)。gydF4y2Ba
Socher, I., Kroll, H., Jorks, S., Santoso, S. & Sachs, U. J.肝素诱导血小板减少抗体对血小板的非肝素激活:一种常见现象。gydF4y2Baj . Thromb。HaemostgydF4y2Ba.gydF4y2Ba6gydF4y2Ba, 197-200(2008)。gydF4y2Ba
Warkentin, T. E., Arnold, D. M., Nazi, I. & Kelton, J. G.血小板血清素释放试验。gydF4y2Ba点。j .内科杂志gydF4y2Ba.gydF4y2Ba90gydF4y2Ba, 564-572(2015)。gydF4y2Ba
Padmanabhan, A.等。肝素不依赖,pf4依赖的HIT抗体与血小板的结合:对HIT发病机制的影响。gydF4y2Ba血gydF4y2Ba125gydF4y2Ba, 155-161(2015)。gydF4y2Ba
蒂德,A.等人。COVID-19疫苗接种后的血栓前免疫性血小板减少症。gydF4y2Ba血gydF4y2Bahttps://doi.org/10.1182/blood.2021011958gydF4y2Ba(2021)。gydF4y2Ba
阿尔索斯,K.等。抗体介导的促凝血小板在SARS-CoV-2疫苗接种相关的免疫性血小板减少症中的应用gydF4y2BaHaematologicagydF4y2Bahttps://doi.org/10.3324/haematol.2021.279000gydF4y2Ba(2021)。gydF4y2Ba
蒋晓明,李志刚,李志刚,蒋晓明,张志刚,张志刚,张志刚gydF4y2Ba131gydF4y2Ba肝素诱导的血小板减少症和血栓形成患者的多态性、亚类特异性IgG抗肝素/血小板因子4抗体及临床病程gydF4y2Ba血gydF4y2Ba89gydF4y2Ba, 370-375(1997)。gydF4y2Ba
Kasthuri, R. S.等。PF4/肝素抗体复合物通过激活FcγRI诱导单核细胞组织因子表达和释放组织因子阳性微粒。gydF4y2Ba血gydF4y2Ba119gydF4y2Ba, 5285-5293(2012)。gydF4y2Ba
谢里丹,D.,卡特,C. &凯尔顿,J. G.肝素诱导血小板减少症的诊断试验。gydF4y2Ba血gydF4y2Ba67gydF4y2Ba, 27-30(1986)。gydF4y2Ba
纳粹,我,等等。区分抗血小板因子4/肝素抗体能和不能引起肝素诱导的血小板减少症。gydF4y2Baj . Thromb。HaemostgydF4y2Ba.gydF4y2Ba13gydF4y2Ba, 1900-1907(2015)。gydF4y2Ba
黄恩,A.等。血小板因子4高产表达及纯化体系的建立。gydF4y2Ba血小板gydF4y2Ba29gydF4y2Ba, 249-256(2018)。gydF4y2Ba
黄恩,A.等。液相免疫复合物在肝素诱导血小板减少症发病机制中的作用。gydF4y2BaThromb。ResgydF4y2Ba.gydF4y2Ba194gydF4y2Ba, 135-141(2020)。gydF4y2Ba
鲁比诺,J. G.等。血小板因子4增强血小板活化试验诊断肝素性血小板减少症的比较研究。gydF4y2Baj . Thromb。HaemostgydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 1096-1102(2021)。gydF4y2Ba
确认gydF4y2Ba
我们感谢R. Clare、N. Ivetic、A. Hucik、J. C. Moore和J. W. Smith的技术援助,以及A. Bissola和C. Groves对数字的投入。这项工作的资金支持由授予I.N的加拿大卫生研究所(CIHR 452655)拨款和授予D.M.A.的加拿大公共卫生署拨款提供gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
A.H.进行表位定位和BLI,分析数据并撰写手稿。J.G.K.和D.M.A.设计了研究,解释了数据,并撰写了手稿。M.D.对PF4突变体进行了纯化,进行了表位定位,并撰写了手稿。I.N.设计研究,分析和解释数据,并撰写手稿。所有作者审阅并批准了手稿的最终版本。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
i.n., d.m.a., J.G.K.和A.H.已申请了美国临时专利,涵盖了利用本研究的VITT诊断和VITT与HIT区分的产品和方法。作者声明没有其他竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然gydF4y2Ba感谢Zaverio Ruggeri和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1 VITT患者和HIT患者在不同sra中的血小板活化情况。gydF4y2Ba
血小板活化显示为释放的百分比gydF4y2Ba14gydF4y2BaC-serotonin。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba、VITT患者样本(gydF4y2BangydF4y2Ba= 5;红线)(gydF4y2Ba一个gydF4y2Ba)和急性呼吸道感染患者(gydF4y2BangydF4y2Ba= 10;蓝线)(gydF4y2BacgydF4y2Ba)gydF4y2Ba27gydF4y2Ba.gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,同样的VITT (gydF4y2BabgydF4y2Ba)及HIT (gydF4y2BadgydF4y2Ba)样品在pf4增强的SRAgydF4y2Ba28gydF4y2Ba,gydF4y2Ba31gydF4y2Ba添加PF4。结果表明,在标准SRA中,HIT样本通过(gydF4y2BangydF4y2Ba= 4)或不含(gydF4y2BangydF4y2Ba= 6)肝素或添加PF4,而VITT样品仅在添加PF4后激活血小板。分别用技术重复实验两次,结果相似。所有的血小板活化都被添加IV.3单克隆抗体所抑制,该单克隆抗体与血小板上的FcγRIIa受体结合。gydF4y2Ba
扩展数据图2随着肝素浓度的增加,VITT抗体与PF4的结合受到抑制。gydF4y2Ba
VITT样本(gydF4y2BangydF4y2Ba= 4)用增加浓度的肝素进行测试,以研究其对VITT抗体与PF4结合的影响。实验与技术重复独立重复两次,结果相似。在所有四个可供测试的VITT样本中,治疗浓度和高于治疗浓度的肝素破坏了VITT抗体的结合。结果显示为技术重复的平均值。OD≥0.45为抗pf4抗体阳性。gydF4y2Ba
图3比较两个VITT样本血清和纯化总IgG结合动力学的BLI曲线。gydF4y2Ba
VITT血清的结合动力学(gydF4y2BangydF4y2Ba= 2)和相应纯化的总IgG (gydF4y2BangydF4y2Ba= 2)比较显示抗pf4抗体特异性反应。实验与技术重复独立重复两次,结果相似。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,生物素化PF4的缔合和解离步骤显示(gydF4y2Ba一个gydF4y2Ba)和pf4 -肝素(gydF4y2BabgydF4y2Ba)固定在链霉亲和素生物传感器尖端。黑线代表VITT样本1的血清,红线代表纯化后的VITT样本1的总IgG,灰色线代表VITT样本2的血清,紫色线代表纯化后的VITT样本2的总IgG。gydF4y2Ba
图4 VITT患者、HIT患者和健康对照个体的重复样本结合反应。gydF4y2Ba
VITT (gydF4y2BangydF4y2Ba= 2), hit (gydF4y2BangydF4y2Ba= 1)和健康对照组(gydF4y2BangydF4y2Ba= 2)样品在不同的日子进行测试,以确定生物分子层干涉测量实验的重现性。分别用技术重复实验3次,结果相似。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,对固定化PF4的结合反应(gydF4y2Ba一个gydF4y2Ba)和pf4 -肝素(gydF4y2BabgydF4y2Ba)以平均波长位移(nm)来测量。每种抗原和样品的结合反应在单独的测定中是可重复的。红色点代表VITT样本,蓝色点代表HIT样本,黑色点代表健康对照样本。gydF4y2Ba
扩展数据图5 VITT抗体与PF4四聚体结合并聚集的机制,独立于肝素,形成血小板活化免疫复合物。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,我们假设VITT抗体结合抗原PF4 (gydF4y2Ba一个gydF4y2Ba),从而在缺乏肝素的情况下聚集PF4四聚体并产生激活血小板的免疫复合物(gydF4y2BabgydF4y2Ba).gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,免疫复合物可在血小板表面和溶液中发现,导致这些抗体的Fc部分对齐和接近,然后能够交联Fcγ riia受体(gydF4y2BacgydF4y2Ba),并导致血小板活化(gydF4y2BadgydF4y2Ba).gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
黄恩,A,凯尔顿,j.g.,阿诺德,D.M.gydF4y2Baet al。gydF4y2Ba疫苗诱导的免疫性血小板减少症中的抗体表位。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 565-569(2021)。https://doi.org/10.1038/s41586-021-03744-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-021-03744-4gydF4y2Ba
这篇文章被引用gydF4y2Ba
经颈静脉肝内门静脉分流术、局部取栓和溶栓治疗媒介疫苗诱导的血栓性血小板减少引起的暴发性门静脉肠血栓形成和非创伤性脾破裂:一例报告gydF4y2Ba
医学病例报告杂志gydF4y2Ba(2022)gydF4y2Ba
COVID-19疫苗更新:疫苗有效性、SARS-CoV-2变体、增强剂、不良反应和免疫相关保护gydF4y2Ba
生物医学科学杂志gydF4y2Ba(2022)gydF4y2Ba
疫苗诱导的免疫性血小板减少症中的NETosis和血栓形成gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
了解COVID-19疫苗接种后伴血小板减少综合征的血栓形成gydF4y2Ba
npj疫苗gydF4y2Ba(2022)gydF4y2Ba
COVID-19疫苗开发:里程碑、教训和展望gydF4y2Ba
信号转导与靶向治疗gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba