摘要gydF4y2Ba
衰老和疾病期间骨骼完整性的丧失与成骨细胞和破骨细胞相反作用的不平衡有关gydF4y2Ba1gydF4y2Ba.这里我们展示了骨骼干细胞(ssc)的内在衰老gydF4y2Ba2gydF4y2Ba在小鼠中,改变骨髓生态位中的信号,扭曲骨骼和血液谱系的分化,导致脆弱的骨骼再生不良。在功能上,衰老的ssc骨和软骨形成潜力下降,但产生更多的间质谱系,表达高水平的促炎症和促吸收细胞因子。单细胞rna测序研究将衰老小鼠中ssc的功能丧失与转录组多样性的减少联系起来,从而有助于骨髓生态位的转化。通过异慢性异种共生或年轻造血干细胞的全身重建暴露于年轻循环中,并不能逆转衰老ssc的骨软骨活性下降,也不能改善老年小鼠的骨量或骨骼愈合参数。相反,衰老的SSC谱系促进了造血干细胞和祖细胞的破骨活性和骨髓倾斜,这表明SSC的衰老是造血衰老的驱动因素。老年小鼠的骨再生不足只能通过局部骨折应用BMP2和CSF1拮抗剂的组合治疗来恢复到年轻水平,这可以重新激活衰老的ssc,同时消融炎症性的促破骨细胞环境。我们的发现为骨骼老化的复杂、多因素机制提供了机制上的见解,并为老年骨骼系统的恢复提供了前景。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你所在的机构访问gydF4y2Ba
相关的文章gydF4y2Ba
引用本文的开放获取文章。gydF4y2Ba
骨重塑在正常造血和年龄相关恶性血液病中的作用gydF4y2Ba
骨的研究gydF4y2Ba开放获取gydF4y2Ba2023年3月14日gydF4y2Ba
骨再生中周围神经功能的特征gydF4y2Ba
骨的研究gydF4y2Ba开放获取gydF4y2Ba2023年1月5日gydF4y2Ba
动态网络生物标志物识别cdkn1a介导的骨质矿化在骨质疏松症的触发阶段gydF4y2Ba
实验与分子医学gydF4y2Ba开放获取gydF4y2Ba2023年1月04日gydF4y2Ba
访问选项gydF4y2Ba
访问《自然》和其他54种《自然》杂志gydF4y2Ba
获取Nature+,我们最超值的在线订阅gydF4y2Ba
每月29.99美元gydF4y2Ba
随时取消gydF4y2Ba
订阅这本杂志gydF4y2Ba
收到51个印刷问题和在线访问gydF4y2Ba
199.00美元一年gydF4y2Ba
每期仅需3.90美元gydF4y2Ba
租或购买这篇文章gydF4y2Ba
只要这篇文章,只要你需要它gydF4y2Ba
39.95美元gydF4y2Ba
价格可能受当地税收的影响,在结账时计算gydF4y2Ba
数据可用性gydF4y2Ba
所有测序数据都已提交到资料库,并可在线获取。scRNA-seq数据可从NCBI GEO获取,登录号如下gydF4y2BaGSE161946gydF4y2Ba而且gydF4y2BaGSE172149gydF4y2Ba.大量rna测序数据已存入gydF4y2BaGSE166441gydF4y2Ba微阵列数据是公开的,就像之前发布的gydF4y2BaGSE34723gydF4y2Ba以及在gec数据库下gydF4y2Bahttps://gexc.riken.jp/models/2399gydF4y2Ba而且gydF4y2Bahttps://gexc.riken.jp/models/2400gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
博斯基,A. L. &科尔曼,R.衰老与骨骼。gydF4y2Baj .凹痕。ResgydF4y2Ba.gydF4y2Ba89gydF4y2Ba, 1333-1348(2010)。gydF4y2Ba
陈,c.k.f.等。小鼠骨骼干细胞的鉴定与鉴定。gydF4y2Ba细胞gydF4y2Ba160gydF4y2Ba, 285-298(2015)。gydF4y2Ba
衰老的遗传学。gydF4y2Ba自然gydF4y2Ba464gydF4y2Ba, 504-512(2010)。gydF4y2Ba
罗西,D. J.,贾米森,C. H. M.和韦斯曼,i.l.干细胞和衰老和癌症的途径。gydF4y2Ba细胞gydF4y2Ba132gydF4y2Ba, 681-696(2008)。gydF4y2Ba
施米奇,J.等人。两种海洋水螅类逆向发育的诱导。gydF4y2BaInt。J.戴夫。比尔gydF4y2Ba.gydF4y2Ba51gydF4y2Ba, 45-56(2007)。gydF4y2Ba
Ermolaeva, M., Neri, F., Ori, A. & Rudolph, K. L.干细胞衰老的细胞和表观遗传驱动因素。gydF4y2Ba细胞生物学gydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 594-610(2018)。gydF4y2Ba
德汉,G.和拉扎尔,s.s.老化的造血干细胞。gydF4y2Ba血gydF4y2Ba131gydF4y2Ba, 479-487(2018)。gydF4y2Ba
庞,w.w.等。随着年龄的增长,人骨髓造血干细胞的频率和髓性偏向性增加。gydF4y2Ba国家科学院学报美国gydF4y2Ba108gydF4y2Ba, 2012 - 20017(2011)。gydF4y2Ba
比尔曼,我等人。功能独特的造血干细胞通过克隆扩增机制调节衰老过程中的造血谱系潜能。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 5465-5470(2010)。gydF4y2Ba
安布罗西,T. H.,龙格,M. T. &陈,C. K. F.骨骼干细胞生物学的修正观点。gydF4y2Ba前面。细胞发育生物学gydF4y2Ba.gydF4y2Ba7gydF4y2Ba, 189(2019)。gydF4y2Ba
陈,c.k.f.等。人类骨骼干细胞的鉴定。gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 43-56(2018)。gydF4y2Ba
哈洛伦,B. P.等。雄性C57BL/6J小鼠骨骼结构和质量随年龄增长的变化gydF4y2Ba挖骨者。ResgydF4y2Ba.gydF4y2Ba17gydF4y2Ba, 1044-1050(2002)。gydF4y2Ba
Ferguson, V. L., Ayers, R. A., Bateman, T. A. & Simske, S. J.雄性C57BL/6J小鼠的骨发育和年龄相关的骨丢失。gydF4y2Ba骨gydF4y2Ba33gydF4y2Ba, 387-398(2003)。gydF4y2Ba
陈,c.k.f.等。骨、软骨和造血小生境基质细胞的克隆前体。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 12643-12648(2013)。gydF4y2Ba
Marecic, O.等人。损伤诱导的骨骼祖细胞的鉴定和特征。gydF4y2Ba国家科学院学报美国gydF4y2Ba112gydF4y2Ba, 9920-9925(2015)。gydF4y2Ba
Ashapkin, V. V., Kutueva, L. I. & Vanyushin, B. F. ingydF4y2Ba年龄相关疾病新药靶点综述gydF4y2Ba(编者,嘉宾,p.c.) 107-122(施普林格国际出版社,2020年)。gydF4y2Ba
墨菲,m.p.等人。活化骨干细胞的关节软骨再生。gydF4y2Ba地中海Nat。gydF4y2Ba.gydF4y2Ba26gydF4y2Ba, 1583-1592(2020)。gydF4y2Ba
泰铢,G. S.等。暴露在年轻的血液循环中,通过调节β-连环蛋白恢复骨骼修复。gydF4y2BaNat。CommungydF4y2Ba.gydF4y2Ba6gydF4y2Ba, 7131(2015)。gydF4y2Ba
炎症:健康和疾病中造血干细胞命运的关键调节因子。gydF4y2Ba血gydF4y2Ba130gydF4y2Ba, 1693-1698 (2017)gydF4y2Ba
赖特,D. E.,韦杰斯,A. J.,古拉提,A. P.,约翰逊,F. L. &韦斯曼,I. L.造血干细胞和祖细胞的生理迁移。gydF4y2Ba科学gydF4y2Ba294gydF4y2Ba, 1933-1936(2001)。gydF4y2Ba
Suda, T.等人。肿瘤坏死因子受体和配体家族的新成员对破骨细胞分化和功能的调节。gydF4y2BaEndocr。牧师gydF4y2Ba.gydF4y2Ba20.gydF4y2Ba, 345-357(1999)。gydF4y2Ba
Urist, m.r. Bone:自诱导形成。gydF4y2Ba科学gydF4y2Ba150gydF4y2Ba, 893-899(1965)。gydF4y2Ba
Mizuhashi, K.等人。生长板的休止区容纳了一类独特的骨骼干细胞。gydF4y2Ba自然gydF4y2Ba563gydF4y2Ba, 254-258(2018)。gydF4y2Ba
Debnath, S.等人。发现骨膜干细胞介导膜内骨形成。gydF4y2Ba自然gydF4y2Ba562gydF4y2Ba, 133-139(2018)。gydF4y2Ba
Jaiswal, S.等人。与年龄相关的克隆造血与不良结局相关。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.gydF4y2Ba371gydF4y2Ba, 2488-2498(2014)。gydF4y2Ba
比尔曼,I. &罗西,D. J.干细胞潜能在稳态、衰老和疾病中的表观遗传控制。gydF4y2Ba细胞干细胞gydF4y2Ba16gydF4y2Ba, 613-625(2015)。gydF4y2Ba
特夫林,R.等人。糖尿病骨骼干细胞生态位的药理拯救。gydF4y2Ba科学。Transl。地中海gydF4y2Ba.gydF4y2Ba9gydF4y2Ba, eaag2809(2017)。gydF4y2Ba
萨拉查,V. S.等。重新激活一个发育的gydF4y2BaBmp2gydF4y2Ba信号中心是治疗性控制小鼠骨膜生态位所必需的。gydF4y2BaeLifegydF4y2Ba8gydF4y2Ba, e42386(2019)。gydF4y2Ba
Ambrosi, t.h.等。在肥胖和衰老过程中,脂肪细胞在骨髓中的堆积会损害以干细胞为基础的造血和骨再生。gydF4y2Ba细胞干细胞gydF4y2Ba20.gydF4y2Ba, 771-784(2017)。gydF4y2Ba
沈,B.等。用于成骨和淋巴生成的机械敏感小动脉周围生态位。gydF4y2Ba自然gydF4y2Ba591gydF4y2Ba, 438-444(2021)。gydF4y2Ba
谢敏,等。雪旺细胞前体有助于小鼠和斑马鱼胚胎发育期间骨骼的形成。gydF4y2Ba国家科学院学报美国gydF4y2Ba116gydF4y2Ba, 15068-15073(2019)。gydF4y2Ba
Schurman, C. A., Verbruggen, S. W. & Alliston, T.随着衰老和TGF-β信号传导缺陷,骨细胞连通性和细胞周液流中断。gydF4y2Ba国家科学院学报美国gydF4y2Ba118gydF4y2Ba, e2023999118(2021)。gydF4y2Ba
Sinha, P.等人。G的损失gydF4y2Ba年代gydF4y2Ba成骨细胞谱系早期的α有利于间充质祖细胞和成骨细胞前体的成脂分化。gydF4y2Ba挖骨者。ResgydF4y2Ba.gydF4y2Ba29gydF4y2Ba, 2414-2426(2014)。gydF4y2Ba
山崎等人。非髓鞘化雪旺氏细胞维持造血干细胞在骨髓生态位的冬眠。gydF4y2Ba细胞gydF4y2Ba147gydF4y2Ba, 1146-1158(2011)。gydF4y2Ba
岳荣华,周宝博,岛田,赵志强,莫里森,李志强。瘦素受体通过调节骨髓间充质细胞促进脂肪生成和减少成骨。gydF4y2Ba细胞干细胞gydF4y2Ba18gydF4y2Ba, 782-796(2016)。gydF4y2Ba
沃斯利,D. L.等。Gremlin 1鉴定出具有骨、软骨和网状基质潜能的骨骼干细胞。gydF4y2Ba细胞gydF4y2Ba160gydF4y2Ba, 269-284(2015)。gydF4y2Ba
牛顿,p.t.等。克隆性的彻底转变揭示了骨骺生长板中的干细胞生态位。gydF4y2Ba自然gydF4y2Ba567gydF4y2Ba, 234-238(2019)。gydF4y2Ba
Bianco, P. & Robey, P. G.骨骼干细胞。gydF4y2Ba发展gydF4y2Ba142gydF4y2Ba, 1023-1027(2015)。gydF4y2Ba
古拉蒂,G. S.等。小鼠骨骼干细胞系的分离与功能评估。gydF4y2BaNat协议。gydF4y2Ba13gydF4y2Ba, 1294-1309(2018)。gydF4y2Ba
陈,c.k.f.等。软骨内成骨是造血干细胞生态位形成所必需的。gydF4y2Ba自然gydF4y2Ba457gydF4y2Ba, 490-494(2009)。gydF4y2Ba
罗西,D. J.等。细胞内在改变是造血干细胞老化的基础。gydF4y2Ba国家科学院学报美国gydF4y2Ba102gydF4y2Ba, 9194-9199(2005)。gydF4y2Ba
Wilkinson, a.c., Ishida, R., Nakauchi, H. & Yamazaki, S.小鼠造血干细胞的长期体外扩增。gydF4y2BaNat协议。gydF4y2Ba15gydF4y2Ba, 628-648(2020)。gydF4y2Ba
福斯特,d.s.等。阐明驱动腹腔粘连形成的基本纤维化过程。gydF4y2BaNat。CommungydF4y2Ba.gydF4y2Ba11gydF4y2Ba, 4061(2020)。gydF4y2Ba
Patro, R., Duggal, G., Love, M. I., Irizarry, R. A. & Kingsford, C. Salmon提供了快速和有偏差意识的转录表达量化。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 417-419(2017)。gydF4y2Ba
Soneson, C., Love, m.i.和Robinson, m.d. RNA-seq的差异分析:转录水平的估计提高了基因水平的推断。gydF4y2BaF1000ResgydF4y2Ba.gydF4y2Ba4gydF4y2Ba, 1521(2015)。gydF4y2Ba
姜浩,雷荣,丁世伟,丁世伟。& Zhu, S. Skewer:用于下一代测序配对末端读取的快速和准确的适配器修剪器。gydF4y2BaBMC生物信息学gydF4y2Ba15gydF4y2Ba, 182(2014)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Li, B. & Dewey, C. N. RSEM:有或没有参考基因组的RNA-seq数据的精确转录物定量。gydF4y2BaBMC生物信息学gydF4y2Ba12gydF4y2Ba, 323(2011)。gydF4y2Ba
伍尔夫,范文杰,彭志强,彭志强。扫描扫描:大规模单细胞基因表达数据分析。gydF4y2Ba基因组医学杂志gydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 15(2018)。gydF4y2Ba
Nestorowa, S.等人。小鼠造血干细胞和祖细胞分化的单细胞分辨率图。gydF4y2Ba血gydF4y2Ba128gydF4y2Ba, e20-e31(2016)。gydF4y2Ba
Bergen, V.等人。通过动力学建模将RNA速度推广到瞬时细胞状态。gydF4y2BaNat。gydF4y2Ba38gydF4y2Ba, 1408-1414(2020)。gydF4y2Ba
古拉蒂,G. S.等。单细胞转录多样性是发育潜力的标志。gydF4y2Ba科学gydF4y2Ba367gydF4y2Ba, 405-411(2020)。gydF4y2Ba
陈,e.y .等。enrichment:交互式协作HTML5基因列表丰富分析工具。gydF4y2BaBMC生物信息学gydF4y2Ba14gydF4y2Ba, 128(2013)。gydF4y2Ba
O 'Flanagan, C. H.等人。用单细胞RNA-seq冷活性蛋白酶分离实体肿瘤组织可最大限度地减少保守的胶原酶相关应激反应。gydF4y2Ba基因组医学杂志gydF4y2Ba.gydF4y2Ba20.gydF4y2Ba, 210(2019)。gydF4y2Ba
Denisenko, E.等。单细胞和单核RNA-seq工作流程中组织分离和存储偏差的系统评估。gydF4y2Ba基因组医学杂志gydF4y2Ba.gydF4y2Ba21gydF4y2Ba, 130(2020)。gydF4y2Ba
确认gydF4y2Ba
我们感谢A. McCarthy和C. Wang对鼠群的管理;L. Quinn, V. Ford, C. McQuarrie, T. Naik和L. Jerabek的实验室管理;P. Lovelace, S. Weber和C. Carswell-Crumpton的FACS支持;m.r. Eckart和斯坦福基因表达设施(PAN设施)以及斯坦福人类免疫监测中心(HIMC)对本项目提供技术支持、协助和/或建议;以及Chan Zuckerberg BioHub的L. Penland、B. Yu和M. Tan对scRNA-seq的支持。这项工作由NIH-NIA K99 R00 AG049958-01A1,传统医学基金会,美国衰老研究联合会(AFAR)关节炎国家研究基金会(ANRF)和DiGenova家族捐赠给C.K.F.C.;德国研究基金会(DFG-Fellowship) 399915929和NIH-NIA 1K99AG066963授予T.H.A.;NIH (R56 DE025597, R01 DE026730, R01 DE021683, R21 DE024230, R01 DE027323, U01 HL099776, U24 DE026914和R21 DE019274), CIRMTR1-01249,橡树基金会,哈吉实验室,Pitch Johnson基金和Gunn/Olivier研究基金;NIDDK SHINE奖R01 DK115600至I.L.W;和NIH UG3TR003355, UG3TR002968, R01AI155696, R01GM138385和R00CA151673和UCOP-RGPO (R01RG3780, R00RG2628和R00RG2642)给D.S.的额外支持来自NIH S10 RR02933801到斯坦福大学干细胞FACS核心,以及NIH S10 1S10OD02349701到斯坦福大学克拉克成像中心(首席研究员:T. Doyle)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
t.h.a.、o.m.、A.M.和C.K.F.C.构思了这项研究,进行了大部分实验,分析了结果并撰写了手稿。R.S.帮助执行和分析scRNA-seq实验。G.S.G.进行了大量RNA测序,S.M.分析了数据。X.T.和F.Y.为因子传递提供了水凝胶。y.w., h.m.s., m.y.h., l.s.k., M.P.M, e.s., r.t., m.l., s.d.c., r.e.b., L.L.和O.A.进行细胞培养,免疫组织学,组织学和双皮质骨折实验。J. Seita, D.S.和J. Sokol分析了微阵列和10X scRNA-seq数据。M.M.和n.f.n为进行scRNA-seq提供了专业知识和资源。ilw, M.T.L.和C.K.F.C.监督了这个项目。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然gydF4y2Ba感谢匿名审稿人对本工作的同行评审所作的贡献。同行评审报告是可用的。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
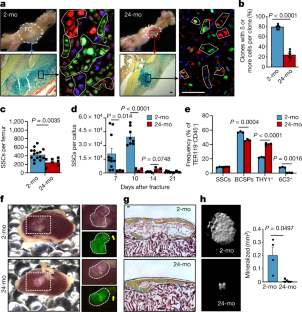
图1衰老改变小鼠的骨生理和骨折愈合。gydF4y2Ba
一个gydF4y2Ba2月龄、12月龄和24月龄小鼠股骨近端代表性苏木精和伊红(H&E)染色(代表每个年龄组3只独立小鼠的切片)。gydF4y2BabgydF4y2Ba、2月龄、12月龄和24月龄小鼠股骨骨量的三维μCT重建。gydF4y2BacgydF4y2Ba、μCT测量3个年龄组骨参数定量(gydF4y2BangydF4y2Ba=每个年龄组3名)。gydF4y2BadgydF4y2Ba, 2月龄和24月龄小鼠骨形成率(BFR)的钙黄素标记评估(gydF4y2BangydF4y2Ba=每个年龄组3名)。MS,矿化面;BS,骨面;MAR:矿物沉积速率。gydF4y2BaegydF4y2Ba损伤后第10天和第21天骨折骨痂的x线片、μCT和Movat五色染色图像。gydF4y2BafgydF4y2Ba, 2月龄、12月龄和24月龄小鼠股骨骨折后第10天和第21天的骨痂指数测定(第10天12月龄,gydF4y2BangydF4y2Ba= 5;所有其他组,gydF4y2BangydF4y2Ba= 3)。gydF4y2BaggydF4y2Ba,骨折后第21天(2-mo,gydF4y2BangydF4y2Ba= 10;24-mo,gydF4y2BangydF4y2Ba= 8)。以中心线为中值的盒须图,盒须从25 - 75百分位延伸,最小值到最大值。gydF4y2BahgydF4y2Ba、2月龄、12月龄和24月龄小鼠股骨损伤后第10天和第21天骨折痂的μCT图像。gydF4y2Ba我gydF4y2Ba、μCT测量3年龄组骨折愈伤组织参数的定量(gydF4y2BangydF4y2Ba= 3 - 6)。所有散点图数据均为均数+ s.e.m.gydF4y2BatgydF4y2Ba-检验老龄组与2个月大组的比较,适当时根据非正态性(Mann-Whitney检验)或不平等方差(Welch 's检验)进行调整。为准确的gydF4y2BaPgydF4y2Ba值,请参见源数据。比例尺,150 μmgydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
扩展数据图2老年小鼠中存在表型SSCs。gydF4y2Ba
一个gydF4y2Ba小鼠骨骼干细胞谱系。自我更新的SSC产生BCSP细胞,BCSP细胞是软骨、骨和基质谱系的前体。gydF4y2BabgydF4y2Ba,分析2月龄或24月龄小鼠高纯化SSC谱系细胞内在特征的实验策略示意图。gydF4y2BacgydF4y2Ba,用于小鼠SSC谱系细胞分离的FACS门控策略。2个月大和24个月大的小鼠在未受伤状态和第10天骨折状态下的代表性FACS图谱显示。gydF4y2BadgydF4y2Ba2月龄(蓝色)和24月龄(红色)小鼠中SSC门控细胞CD200的表达。对来自2个月大或24个月大小鼠的ssc进行同型控制显示了cd200阳性部分的门控。gydF4y2BaegydF4y2Ba,研究2个月大或24个月大的Actin-Cre骨折克隆活性的实验装置示意图gydF4y2Ba导gydF4y2Ba彩虹小鼠(dpi,损伤后几天)。gydF4y2BafgydF4y2Ba,流式细胞术定量每例未损伤股骨的BCSPs(2个月,gydF4y2BangydF4y2Ba= 15;24-mo,gydF4y2BangydF4y2Ba= 7)。gydF4y2BaggydF4y2Ba, 2月龄和24月龄小鼠骨折损伤后不同天BCSPs的患病率(2月龄,24月龄,gydF4y2BangydF4y2Ba第5 - 11 =;24-mo,gydF4y2BangydF4y2Ba= 3)。gydF4y2BahgydF4y2Ba,流式细胞术分析CD49fgydF4y2Ba+gydF4y2Ba表型ssc和BCSPs在未受伤(uninj.)和骨折(fx;第10天)2个月龄和24个月龄小鼠(gydF4y2BangydF4y2Ba=每个州4个,年龄和人口)。gydF4y2Ba我gydF4y2Ba,骨折后第10天,通过EdU掺入测量ssc和BCSPs内的增殖活性(2个月,gydF4y2BangydF4y2Ba= 7;24-mo,gydF4y2BangydF4y2Ba= 6)。gydF4y2BajgydF4y2Ba,通过Annexin V染色评估骨折后第10天ssc和BCSPs内的凋亡活性(2个月,gydF4y2BangydF4y2Ba= 4;24-mo,gydF4y2BangydF4y2Ba= 3)。gydF4y2BakgydF4y2Ba,流式细胞术定量2月龄和24月龄小鼠骨折后第10天THY1+和6C3+下游细胞群频率(gydF4y2BangydF4y2Ba=每个年龄4个)。gydF4y2BalgydF4y2Ba,流式细胞术分析2月龄和24月龄小鼠新鲜分离并培养6天的BCSPs谱系输出(gydF4y2BangydF4y2Ba=每个年龄3个)。2月龄组和24月龄组双侧学生的比较gydF4y2BatgydF4y2Ba-检验对非正态性(曼-惠特尼检验)或不平等方差(韦尔奇检验)进行了适当的调整。数据为均值+ s.e.m,表示精确gydF4y2BaPgydF4y2Ba值,请参见源数据gydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
扩展数据图3 ssc和BCSPs在体内和体外显示功能降低。gydF4y2Ba
一个gydF4y2Ba2月龄和24月龄的长骨ssc来源细胞群的成纤维细胞集落形成单位(CFU-F)能力(2月龄,gydF4y2BangydF4y2Ba= 5 - 6;24-mo,gydF4y2BangydF4y2Ba= 9)。Bonferroni事后检验的双向方差分析。gydF4y2BabgydF4y2Ba, SSC-和bcsp衍生的细胞集落大小,来源于未受伤和第10天骨折的骨骼(gydF4y2BangydF4y2Ba= 7 - 120)。按未配对学生的年龄分组进行统计学检验gydF4y2BatgydF4y2Ba-test或Mann-Whitney非正态性检验。gydF4y2BacgydF4y2Ba,水晶紫染色菌落的代表图像(代表CFU-F来自三个独立实验)。gydF4y2BadgydF4y2Ba茜素红S染色法测定2月龄和24月龄小鼠ssc和BCSPs的体外成骨能力。代表性染色(左)和成骨定量(右)(gydF4y2BangydF4y2Ba=每个年龄3个)。gydF4y2BaegydF4y2Ba通过Alican Blue染色测定2月龄和24月龄小鼠的ssc和BCSPs的体外成软骨能力。代表性染色(左)和软骨形成定量(右)(gydF4y2BangydF4y2Ba=每个年龄3个)。gydF4y2BafgydF4y2Ba油红O染色法测定2月龄和24月龄小鼠ssc和BCSPs的体外成脂能力。gydF4y2BaggydF4y2Ba来自2月龄和24月龄小鼠长骨的gfp标记BCSPs移植后4周切除移植物的肾包膜移植结果。肾脏的代表性总体图像和放大的移植物为亮场图像,显示GFP信号,细胞来自2个月大(左)和24个月大(右)的小鼠。底部显示Movat 's五色染色切片移植物。白色和黄色箭头指向自动荧光胶原蛋白海绵,它不是移植物的一部分(代表每年龄组4只独立小鼠或实验)。gydF4y2BahgydF4y2Ba、造血干细胞肾移植切片中破骨细胞表面的trap染色图像(上)和定量(下)(gydF4y2BangydF4y2Ba=每个年龄组4人)。双面学生的统计检验gydF4y2BatgydF4y2Ba-检验对非正态性(曼-惠特尼检验)或不平等方差(韦尔奇检验)进行了适当的调整。数据为均值+ s.e.m,表示精确gydF4y2BaPgydF4y2Ba值,请参见源数据。比例尺,50 μmgydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
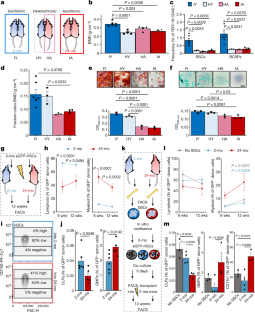
扩展数据图4暴露在年轻的血液循环中不会使SSC谱系恢复活力。gydF4y2Ba
一个gydF4y2Ba, THY1gydF4y2Ba+gydF4y2Ba流式细胞术评估异种共生4周时6C3+细胞频率(IY,gydF4y2BangydF4y2Ba= 6;HY,gydF4y2BangydF4y2Ba= 3;哈,gydF4y2BangydF4y2Ba= 3;IA,gydF4y2BangydF4y2Ba= 3)。gydF4y2BabgydF4y2Ba第10天(IY),联养小鼠的愈伤组织指数(愈伤组织的最高宽度除以骨折旁的骨轴宽度)gydF4y2BangydF4y2Ba= 9;HY,gydF4y2BangydF4y2Ba= 9;哈,gydF4y2BangydF4y2Ba= 6;IA,gydF4y2BangydF4y2Ba= 5)和第21天(IY,gydF4y2BangydF4y2Ba= 4;HY,gydF4y2BangydF4y2Ba= 5;哈,gydF4y2BangydF4y2Ba= 3;IA,gydF4y2BangydF4y2Ba= 3)骨折损伤后。统计检验采用双因素方差分析和Bonferroni事后检验。gydF4y2BacgydF4y2Ba在骨折后第10天(Fx),通过流式细胞术评估SSC谱系频率(IY,gydF4y2BangydF4y2Ba= 6;HY,gydF4y2BangydF4y2Ba= 3;哈,gydF4y2BangydF4y2Ba= 3;IA,gydF4y2BangydF4y2Ba= 3)。所有比较均采用单向方差分析和Tukey事后检验进行统计检验。gydF4y2BadgydF4y2Ba,基于微阵列技术纯化的HA和HY小鼠ssscs的炎症基因表达水平。gydF4y2BaegydF4y2Ba、四周配偶循环中RANKL的血清浓度(gydF4y2BangydF4y2Ba=每组4人)。gydF4y2BafgydF4y2Ba、四周伴侣血液循环中CTX1的血清浓度(gydF4y2BangydF4y2Ba=每组2名)。gydF4y2BaggydF4y2Ba,配对体骨折愈伤组织TRAP染色的代表图像。gydF4y2BahgydF4y2Ba,配对体骨折愈伤组织TRAP染色的定量研究(IY,gydF4y2BangydF4y2Ba= 4;HY,gydF4y2BangydF4y2Ba= 4;哈,gydF4y2BangydF4y2Ba= 3;IA,gydF4y2BangydF4y2Ba= 4)。gydF4y2Ba我gydF4y2Ba,配对体造血干细胞移植到辐照受体小鼠骨髓和淋巴细胞重建的百分比(gydF4y2BangydF4y2Ba=每组4人)。所有比较均采用单向方差分析和Tukey事后检验进行统计检验。所有数据均为均数+ s.e.mgydF4y2BaPgydF4y2Ba值,请参见源数据。比例尺,100 μmgydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
扩展数据图5骨髓微环境影响HSC谱系输出。gydF4y2Ba
一个gydF4y2Ba,从胎肝或24月龄小鼠新鲜分离的造血干细胞移植到2月龄或24月龄致命辐照小鼠的实验方法示意图。gydF4y2BabgydF4y2Ba2月龄和24月龄经致命照射移植胎肝(FL)造血干细胞或24月龄小鼠造血干细胞的小鼠,造血干细胞在造血重建后8周(E15 FL进入老年小鼠,gydF4y2BangydF4y2Ba= 6;gydF4y2BangydF4y2Ba= 5,所有其他组)。BM,骨髓。gydF4y2BacgydF4y2Ba,移植后8周时间点诱导骨折后第14天受体小鼠愈伤组织指数(E15 FL组,gydF4y2BangydF4y2Ba= 5;24个月BM组,gydF4y2BangydF4y2Ba= 4)。gydF4y2BadgydF4y2Ba,髓系典型的facs门控策略(GR1gydF4y2Ba+gydF4y2Ba)和淋巴样(B和T细胞)细胞与gfp供体造血干细胞造血重建后的外周血(从TER119门gydF4y2Ba−gydF4y2Ba,活细胞)。gydF4y2BaegydF4y2Ba,代表骨髓facs门控策略的GFPgydF4y2Ba+gydF4y2Ba供体来源细胞的造血谱系树种群。gydF4y2BafgydF4y2Ba, 2月龄和24月龄小鼠与幼龄造血干细胞进行造血重建后的外周血供体嵌合分析。gydF4y2BaggydF4y2Ba,供体衍生(GFP)的BM分析gydF4y2Ba+gydF4y2Ba流式细胞仪检测HSC谱系细胞群。双因素方差分析与Bonferroni事后检验。gydF4y2BahgydF4y2Ba2月龄小鼠和24月龄小鼠用2月龄小鼠的gfp标记造血干细胞重建第10天骨折痂的代表性trap染色和gfp荧光图像(同一切片)。gydF4y2Ba我gydF4y2Ba, TRAP总面积的量化gydF4y2Ba+gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2Ba小鼠骨折愈伤组织切片(gydF4y2BangydF4y2Ba=每个年龄组3名)。gydF4y2BajgydF4y2Ba,共培养6天的淋巴样和髓样细胞类型的流式细胞术分析(无ssc,gydF4y2BangydF4y2Ba= 4;2月,gydF4y2BangydF4y2Ba= 5;24-mo,gydF4y2BangydF4y2Ba= 5)。两组以上比较采用Tukey 's posthoc检验进行单因素方差分析。gydF4y2BakgydF4y2Ba,共培养造血细胞重建造血后的外周血供体嵌合分析。双因素方差分析与Bonferroni事后检验。gydF4y2BalgydF4y2Ba,共培养供体来源(GFP)骨髓分析gydF4y2Ba+gydF4y2Ba流式细胞术检测HSC谱系细胞群(无ssc,gydF4y2BangydF4y2Ba= 3;2月,gydF4y2BangydF4y2Ba= 4;24-mo,gydF4y2BangydF4y2Ba= 3)。两组以上比较采用Tukey事后检验进行单因素方差分析。2个月组与24个月组的双向学生比较gydF4y2BatgydF4y2Ba-检验对非正态性(曼-惠特尼检验)或不平等方差(韦尔奇检验)进行了适当的调整。Tukey事后检验的单向方差分析。所有数据均为均数+ s.e.mgydF4y2BaPgydF4y2Ba值,请参见源数据。比例尺,100 μmgydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
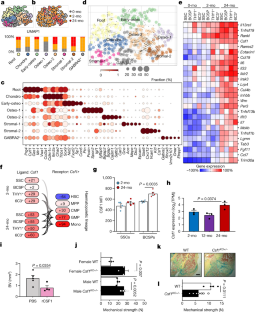
图6不同年龄造血干细胞的不同转录组特征。gydF4y2Ba
一个gydF4y2Ba,各年龄组差异表达前150个基因的莱顿聚类热图。gydF4y2BabgydF4y2Ba,每个单细胞的基因计数作为小提琴图按年龄分组(左)和在UMAP图中。Mann-Whitney检验。gydF4y2BacgydF4y2Ba,按年龄分组的单细胞数据中凋亡相关基因表达的热图。gydF4y2BadgydF4y2Ba,热图显示衰老相关基因在按年龄分组的单细胞数据中的表达。gydF4y2BaegydF4y2Ba电泳凝胶显示2月龄和24月龄小鼠新鲜纯化的ssc中端粒酶的表达。凝胶源数据请参见补充数据gydF4y2Ba1gydF4y2Ba.gydF4y2BafgydF4y2Ba,热图显示按年龄分组的单细胞数据中组织消化和应激相关反应基因的表达。gydF4y2BaggydF4y2Ba,热图显示组织消化和应激相关反应基因在单细胞数据中的表达,以莱顿聚类分组。gydF4y2BahgydF4y2Ba, UMAP图中每个单元格的总读计数。gydF4y2Ba我gydF4y2Ba, UMAP图表示单细胞的细胞周期状态。gydF4y2BajgydF4y2Ba,各年龄组细胞周期状态所占比例。gydF4y2BakgydF4y2Ba,按Leiden簇分组的单个ssc的CytoTrace评分(早期骨质,gydF4y2BangydF4y2Ba= 48;Osteo-1,gydF4y2BangydF4y2Ba= 19;Chondro,gydF4y2BangydF4y2Ba= 48;根,gydF4y2BangydF4y2Ba= 51;Stromal-1,gydF4y2BangydF4y2Ba= 19;Osteo-2,gydF4y2BangydF4y2Ba= 56;Stromal-2,gydF4y2BangydF4y2Ba= 33;GABRA2gydF4y2Ba+gydF4y2Ba,gydF4y2BangydF4y2Ba= 28个单细胞)。数据显示为盒须图,中心线为中位数,盒须从第25至75百分位延伸,最小值至最大值。gydF4y2BalgydF4y2Ba,所选年龄相关基因的单细胞数据,这些基因与增强骨丢失和支持破骨细胞形成有关,显示为按年龄分组的小提琴图。用双侧学生量表进行年龄组间的统计检验gydF4y2BatgydF4y2Ba-检验对非正态性(曼-惠特尼检验)或不平等方差(韦尔奇检验)进行了适当的调整。gydF4y2Ba米gydF4y2Ba富集GO分析24月龄、0月龄、2月龄ssscs差异表达基因及其与GO生物过程确定的细胞功能的关系gydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
图7骨骼谱系来源的CSF1促进骨吸收随年龄增长。gydF4y2Ba
一个gydF4y2Ba,文献中对破骨细胞功能描述的ssc谱系衍生CSF1作用模型。gydF4y2BabgydF4y2Ba,配体(gydF4y2BaCsf2gydF4y2Ba或gydF4y2BaCsf3gydF4y2Ba)和受体(gydF4y2BaCsf2rgydF4y2Ba或gydF4y2BaCsf3rgydF4y2Ba)在2月龄和24月龄的SSC谱系和造血谱系中批量芯片基因表达(%)。gydF4y2BacgydF4y2Ba2月龄和24月龄小鼠骨髓中体外培养破骨细胞数量的定量分析(2月龄,gydF4y2BangydF4y2Ba= 16;24-mo,gydF4y2BangydF4y2Ba= 18,每个视野数量,每个年龄组3只老鼠)。gydF4y2BadgydF4y2Ba,每个衍生破骨细胞的核数(gydF4y2BangydF4y2Ba=每个年龄组14人)。gydF4y2BaegydF4y2Ba,体外来源破骨细胞的代表性亮场图像。gydF4y2BafgydF4y2Ba, 2月龄和24月龄小鼠骨髓破骨细胞体外吸收活性的定量研究(gydF4y2BangydF4y2Ba= 5个孔,每个细胞来自不同年龄的两只小鼠)。gydF4y2BaggydF4y2Ba,同一实验中具有代表性的亮场图像。gydF4y2BahgydF4y2Ba、2月龄和24月龄小鼠SSC和BCSP培养上清中eotaxin1和TGFβ的Luminex蛋白数据(gydF4y2BangydF4y2Ba=每个年龄组4人)。双面学生的统计检验gydF4y2BatgydF4y2Ba以及。gydF4y2Ba我gydF4y2Ba、2月龄和24月龄小鼠血液中选定炎症标志物的血清浓度(gydF4y2BangydF4y2Ba=每个年龄4-5岁)。双面学生的统计检验gydF4y2BatgydF4y2Ba以及。gydF4y2BajgydF4y2Ba、2月龄和24月龄小鼠血液循环中CSF1、eotaxin1和TGFβ的血清浓度(gydF4y2BangydF4y2Ba=每个年龄5个)。双面学生的统计检验gydF4y2BatgydF4y2Ba以及。gydF4y2BakgydF4y2Ba, 2月龄、12月龄和24月龄小鼠骨折痂第10天SSCs大量rna测序数据中促造血或促破骨和促成骨基因的表达(gydF4y2BangydF4y2Ba=每个年龄3个)。片面的学生的gydF4y2BatgydF4y2Ba-老年组与2个月大组的测试。散点图中所有数据均为均值+ s.e.m.,除了gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,显示以中心线为中值的盒须图,盒须从第25至75百分位延伸,最小值至最大值。为准确的gydF4y2BaPgydF4y2Ba值,请参见源数据gydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
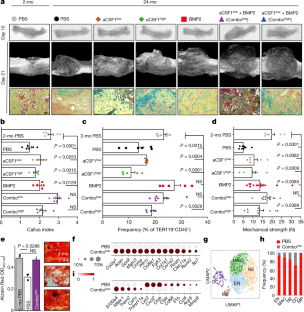
扩展数据图8 CSF1水平控制骨骼维护和修复。gydF4y2Ba
一个gydF4y2Ba,术后第10天骨折痂的代表性μCT图像,添加含有重组CSF1 (5 μg)的水凝胶或PBS作为对照。gydF4y2BabgydF4y2BarCSF1 (PBS、rCSF1、rCSF1、rCSF1、rCSF1、rCSF1、rCSF1、rCSF1、gydF4y2BangydF4y2Ba= 5;rCSF1,gydF4y2BangydF4y2Ba= 4)。gydF4y2BacgydF4y2Ba,第10天用FACS评估ssc和bcsp的总数(PBS,gydF4y2BangydF4y2Ba= 4;rCSF1,gydF4y2BangydF4y2Ba= 3)。gydF4y2BadgydF4y2Ba、未损伤野生型或单体不足型股骨的代表性μCT重建gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba(gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba+ /−gydF4y2Ba) 15个月大的雌性和雄性小鼠。gydF4y2BaegydF4y2Ba、骨小梁骨密度(上)和皮质总矿物密度(TMD;下)雌性和雄性野生型和gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba老鼠(gydF4y2BangydF4y2Ba每个基因型和性别= 4)。gydF4y2BafgydF4y2Ba、未损伤15月龄野生型和未损伤15月龄野生型小鼠μCT定量骨参数gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba雌性和雄性老鼠(gydF4y2BangydF4y2Ba每个基因型和性别= 4)。gydF4y2BaggydF4y2Ba, 15月龄野生型和大鼠21 d骨折愈伤组织μCT定量骨参数gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba雌性小鼠(WT,gydF4y2BangydF4y2Ba= 4;gydF4y2BaCsf1gydF4y2BaKOgydF4y2Ba,gydF4y2BangydF4y2Ba= 7).所有2个月组和24个月组的双侧学生比较gydF4y2BatgydF4y2Ba以及。数据为均值+ s.e.m,表示精确gydF4y2BaPgydF4y2Ba值,请参见源数据gydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
扩展数据图9具有确定因素的老年小鼠恢复骨折愈合。gydF4y2Ba
一个gydF4y2Ba, 24月龄小鼠救助实验装置示意图。gydF4y2BabgydF4y2Ba, BCSPs频率,THY1gydF4y2Ba+gydF4y2Ba和6 c3gydF4y2Ba+gydF4y2Ba24月龄小鼠骨折诱导后第10天,BMP2: 5 μg;CSF1gydF4y2Ba低gydF4y2Ba: 2 μg;CSF1gydF4y2Ba高gydF4y2Ba: 5 μg) (2-mo PBS,gydF4y2BangydF4y2Ba= 6;PBS,gydF4y2BangydF4y2Ba= 6;CSF1gydF4y2Ba低gydF4y2Ba,gydF4y2BangydF4y2Ba= 5;CSF1gydF4y2Ba高gydF4y2Ba,gydF4y2BangydF4y2Ba= 5;BMP2,gydF4y2BangydF4y2Ba= 5;组合gydF4y2Ba低gydF4y2Ba,gydF4y2BangydF4y2Ba= 9;组合gydF4y2Ba高gydF4y2Ba,gydF4y2BangydF4y2Ba= 5)。gydF4y2BacgydF4y2Ba,处理后骨折愈伤组织第21天新形成矿化骨体积的μCT分析(2-mo PBS,gydF4y2BangydF4y2Ba= 7;PBS,gydF4y2BangydF4y2Ba= 9;CSF1gydF4y2Ba低gydF4y2Ba,gydF4y2BangydF4y2Ba= 6;CSF1gydF4y2Ba高gydF4y2Ba,gydF4y2BangydF4y2Ba= 7;BMP2,gydF4y2BangydF4y2Ba= 12;组合gydF4y2Ba低gydF4y2Ba,gydF4y2BangydF4y2Ba= 12;组合gydF4y2Ba高gydF4y2Ba,gydF4y2BangydF4y2Ba= 8)gydF4y2BatgydF4y2Ba- 2个月组和每个24个月组之间的检验,适当调整了非正态性(曼-惠特尼检验)或不平等方差(韦尔奇检验)。gydF4y2BadgydF4y2Ba2-mo-PBS、PBS和' Combo从骨折痂中分离出的ssc的CFU-F能力gydF4y2Ba低gydF4y2Ba治疗组第10天(2个月PBS,gydF4y2BangydF4y2Ba= 6;PBS,gydF4y2BangydF4y2Ba= 6;组合gydF4y2Ba低gydF4y2Ba,gydF4y2BangydF4y2Ba= 5).双面学生的gydF4y2BatgydF4y2Ba-在2个月大的pbs治疗组和24个月大的组之间进行适当的非正态性(Mann-Whitney检验)调整(n.s.,不显著)。数据为均值+ s.e.m,表示精确gydF4y2BaPgydF4y2Ba值,请参见源数据gydF4y2Ba
源数据gydF4y2Ba.gydF4y2Ba
图10抢救治疗后老年小鼠骨折愈伤组织的成分和转录组变化。gydF4y2Ba
一个gydF4y2Ba10X scRNA-seq实验,共17230个骨折愈伤组织细胞,分别来自PBS处理的24月龄小鼠和aCSF1处理的24月龄小鼠gydF4y2Ba低gydF4y2Ba+ BMP2 (CombogydF4y2Ba低gydF4y2Ba).gydF4y2BabgydF4y2Ba, UMAP图显示所选Leiden聚类标记基因的表达。gydF4y2BacgydF4y2Ba, UMAP图显示各治疗组细胞分布。红色,24mo PBS;灰色,24个月CombogydF4y2Ba低gydF4y2Ba.gydF4y2BadgydF4y2Ba,每个莱顿簇的治疗组细胞百分比。gydF4y2BaegydF4y2Ba,热图显示阳性和阴性标记物用于识别ssc。gydF4y2BafgydF4y2Ba,点阵图显示在10X数据集中淋巴样基因表达的缺失。gydF4y2BaggydF4y2Ba, UMAP图,在10X数据集子集中,由治疗组标记的细胞为造血基因表达富集的细胞。gydF4y2BahgydF4y2Ba,相同的UMAP图显示所选标记基因的表达。gydF4y2Ba
图11 ssc介导的骨骼衰老的图形摘要。gydF4y2Ba
随着年龄增长,由于骨形成减少和骨吸收增加而导致的骨骼完整性丧失与SSC频率和活性降低有关。24个月大的骨骼的特征是骨质流失增加,再生受损和SSC谱系向破骨细胞支持基质的谱系倾斜。骨骼再生可以通过同时应用重组BMP2和低剂量阻断CSF1作用的抗体来恢复。gydF4y2Ba
补充信息gydF4y2Ba
补充数据1gydF4y2Ba
扩展图数据6e的原始数据。未修剪的电泳凝胶比较了“2个月”和“24个月”ssc之间的端粒酶活性。gydF4y2Ba
补充表1gydF4y2Ba
来自新生、年轻成年和老年小鼠的ssc单细胞rna测序分析结果的Excel表格。莱顿聚类间差异表达基因。gydF4y2Ba
补充表2gydF4y2Ba
来自新生、年轻成年和老年小鼠的ssc单细胞rna测序分析结果的Excel表格。不同年龄组间基因表达差异。gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
安布罗西,t.h.,马雷契奇,奥,麦卡德尔,A。gydF4y2Baet al。gydF4y2Ba老化的骨骼干细胞产生炎性退行性生态位。gydF4y2Ba自然gydF4y2Ba597gydF4y2Ba, 256-262(2021)。https://doi.org/10.1038/s41586-021-03795-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-021-03795-7gydF4y2Ba
这篇文章被引用gydF4y2Ba
骨再生中周围神经功能的特征gydF4y2Ba
骨的研究gydF4y2Ba(2023)gydF4y2Ba
动态网络生物标志物识别cdkn1a介导的骨质矿化在骨质疏松症的触发阶段gydF4y2Ba
实验与分子医学gydF4y2Ba(2023)gydF4y2Ba
骨重塑在正常造血和年龄相关恶性血液病中的作用gydF4y2Ba
骨的研究gydF4y2Ba(2023)gydF4y2Ba
组织干细胞及其利基的老化和再生gydF4y2Ba
《自然分子细胞生物学gydF4y2Ba(2023)gydF4y2Ba
IL-1信号介导的间质生态位炎症是造血衰老的可靶向驱动因素gydF4y2Ba
自然细胞生物学gydF4y2Ba(2023)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba
