摘要gydF4y2Ba
基于单细胞的研究揭示了干细胞和祖细胞区室的巨大异质性,表明在谱系承诺的不同状态下,细胞的混合和器官发生过程中显著的可塑性持续分化轨迹gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.肝-胰-胆器官系统依赖于一个小的内胚层祖细胞室,它产生各种不同的成人组织,包括肝脏、胰腺、胆囊和肝外胆管gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.小鼠胚胎中各种发育信号的实验操作强调了这一胚胎领域中重要的细胞可塑性gydF4y2Ba6gydF4y2Ba.这反映在人类遗传综合征的存在以及具有肝脏、胰腺和胆囊多器官表型的先天性畸形gydF4y2Ba6gydF4y2Ba.然而,导致内胚层祖室分离为肝脏、胆道和胰腺结构的精确谱系等级和事件序列尚未建立。在这里,我们将计算建模方法与遗传谱系追踪相结合,以准确重建肝-胰-胆道谱系树。我们发现,一个多功能祖细胞亚群持续存在于胰胆器官的雏形中,不仅为胰腺和胆囊贡献细胞,而且也为肝脏贡献细胞。此外,通过单细胞RNA测序和功能实验,我们定义了一个专门的生态位,在发育过程中支持该亚群处于多能状态。综上所述,这些发现表明了肝-胰-胆发育的持续可塑性,这也可能解释了肝脏快速扩张而胰腺-胆生长减弱的原因。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你所在的机构访问gydF4y2Ba
相关的文章gydF4y2Ba
引用本文的开放获取文章。gydF4y2Ba
腹前肠的扩张与器官特异性分化增强子景观的变化有关gydF4y2Ba
自然细胞生物学gydF4y2Ba开放获取gydF4y2Ba2023年1月23日gydF4y2Ba
Jag1-Notch的顺式相互作用决定了胰腺发育中的细胞命运分离gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2023年1月21日gydF4y2Ba
连接过去和现在:单细胞谱系追踪gydF4y2Ba
蛋白质与细胞gydF4y2Ba开放获取gydF4y2Ba2022年4月19日gydF4y2Ba
访问选项gydF4y2Ba
访问《自然》和其他54种《自然》杂志gydF4y2Ba
获取Nature+,我们最超值的在线订阅gydF4y2Ba
每月29.99美元gydF4y2Ba
随时取消gydF4y2Ba
订阅这本杂志gydF4y2Ba
收到51个印刷问题和在线访问gydF4y2Ba
199.00美元一年gydF4y2Ba
每期仅需3.90美元gydF4y2Ba
租或购买这篇文章gydF4y2Ba
只要这篇文章,只要你需要它gydF4y2Ba
39.95美元gydF4y2Ba
价格可能受当地税收的影响,在结账时计算gydF4y2Ba
数据可用性gydF4y2Ba
本研究的单细胞rna测序数据已保存在基因表达Omnibus中,并添加了登录代码gydF4y2BaGSE144103gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
单细胞rna测序数据使用公开的R包进行分析。型号D可在gydF4y2Bahttps://www.ebi.ac.uk/biomodels/MODEL2105030001gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Etzrodt, M., Endele, M. & Schroeder, T.干细胞研究的定量单细胞方法。gydF4y2Ba细胞干细胞gydF4y2Ba15gydF4y2Ba, 546-558(2014)。gydF4y2Ba
费舍尔,D. S.等人。从单细胞rna测序时间序列数据推断种群动态。gydF4y2Ba生物科技Nat。》。gydF4y2Ba37gydF4y2Ba, 461-468(2019)。gydF4y2Ba
哈斯,S,特朗普,A. &米尔索姆,m.d.造血干细胞异质性的原因和后果。gydF4y2Ba细胞干细胞gydF4y2Ba22gydF4y2Ba, 627-638(2018)。gydF4y2Ba
Laurenti, E. & Göttgens, B.从造血干细胞到复杂分化景观。gydF4y2Ba自然gydF4y2Ba553gydF4y2Ba, 418-426(2018)。gydF4y2Ba
诺沃钦,S.等人。在单细胞分辨率下小鼠肠道内胚层的紧急景观。gydF4y2Ba自然gydF4y2Ba569gydF4y2Ba, 361-367(2019)。gydF4y2Ba
Zaret, K. S. & Grompe, M.肝和胰腺细胞的生成和再生。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 1490-1494(2008)。gydF4y2Ba
佐恩,A. M. &威尔斯,J. M.脊椎动物内胚层发育和器官形成。gydF4y2Ba为基础。细胞发育生物学。gydF4y2Ba25gydF4y2Ba, 221-251(2009)。gydF4y2Ba
干细胞在器官发生中的起源。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 1498-1501(2008)。gydF4y2Ba
拉森,H. L.等。随机启动和空间线索协调了小鼠胰腺器官发生的异质克隆贡献。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 605(2017)。gydF4y2Ba
Treutlein, B.等。利用单细胞RNA-seq重建远端肺上皮的谱系层次。gydF4y2Ba自然gydF4y2Ba509gydF4y2Ba, 371-375(2014)。gydF4y2Ba
Baron, C. S.和van Oudenaarden, A.利用遗传谱系追踪在发育和再生过程中解开细胞关系。gydF4y2Ba细胞生物学。gydF4y2Ba20.gydF4y2Ba, 753-765(2019)。gydF4y2Ba
裴,W.等。多聚物条形码揭示造血干细胞在体内实现的命运。gydF4y2Ba自然gydF4y2Ba548gydF4y2Ba, 456-460(2017)。gydF4y2Ba
鲁兰兹,S. &西蒙斯,B. D.追踪组织发育、维持和疾病中的细胞动力学。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba43gydF4y2Ba, 38-45(2016)。gydF4y2Ba
先验,N.等。Lgr5就gydF4y2Ba+gydF4y2Ba干细胞和祖细胞位于异质胚肝母细胞池的顶端。gydF4y2Ba发展gydF4y2Ba146gydF4y2Ba, dev174557(2019)。gydF4y2Ba
特伦布莱,K. D. & Zaret, K. S.不同的内胚层细胞群聚集在一起产生胚胎肝芽和腹前肠组织。gydF4y2BaDev,杂志。gydF4y2Ba280gydF4y2Ba, 87-99(2005)。gydF4y2Ba
李,L.-C。et al。单细胞转录组分析显示不同的背侧/腹侧胰腺程序。gydF4y2BaEMBO代表。gydF4y2Ba19gydF4y2Ba, e46148(2018)。gydF4y2Ba
斯宾塞,J. R.等。Sox17调节腹前肠祖细胞的器官谱系分离。gydF4y2BaDev细胞。gydF4y2Ba17gydF4y2Ba, 62-74(2009)。gydF4y2Ba
周,Q.等。多能祖细胞结构域指导胰腺器官发生。gydF4y2BaDev细胞。gydF4y2Ba13gydF4y2Ba, 103-114(2007)。gydF4y2Ba
Sosa-Pineda, B, Wigle, J. T. & Oliver, G.肝脏发育过程中的肝细胞迁移需要Prox1。gydF4y2BaNat,麝猫。gydF4y2Ba25gydF4y2Ba, 254-255(2000)。gydF4y2Ba
raaue, A.等人。从系统生物学定量动力学建模中得到的教训。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba8gydF4y2Ba, e74335(2013)。gydF4y2Ba
Rodríguez-Seguel, E.等。相互排斥的信号信号特征定义了肝和胰腺祖细胞谱系的分歧。gydF4y2BaDev的基因。gydF4y2Ba27gydF4y2Ba, 1932-1946(2013)。gydF4y2Ba
Ober, E. A. & Lemaigre, F. P.肝脏的发育:对器官和组织形态发生的洞察。gydF4y2Baj .乙醇。gydF4y2Ba68gydF4y2Ba中国农业科学,1049-1062(2018)。gydF4y2Ba
刘,J.等。非平行重组限制了基于cre - loxp的报告器作为条件遗传操作的精确指标。gydF4y2Ba《创世纪》gydF4y2Ba51gydF4y2Ba, 436-442(2013)。gydF4y2Ba
丹尼尔,P. S., Muccino, D., Rowitch, D. H., Michael, S. K. & McMahon, a . P.用他莫西芬诱导的Cre重组酶修饰子宫内小鼠胚胎的基因活性。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba8gydF4y2Ba, 1323-1326(1998)。gydF4y2Ba
罗托,J.等。单细胞转录组揭示了肝实质细胞和非实质细胞谱系的早期出现。gydF4y2Ba细胞gydF4y2Ba183gydF4y2Ba, 702 - 716。e14(2020).
Hebrok, M.刺猬信号在胰腺发育。gydF4y2Ba动力机械。Dev。gydF4y2Ba120gydF4y2Ba, 45-57(2003)。gydF4y2Ba
Bangs, F. & Anderson, K. V.初级纤毛和哺乳动物刺猬信号。gydF4y2Ba冷泉港。教谕。医学杂志。gydF4y2Ba9gydF4y2Ba, a028175(2017)。gydF4y2Ba
Dessaud, E., McMahon, a . P. & Briscoe, J.脊椎动物神经管的模式形成:超音刺猬形态素调节的转录网络。gydF4y2Ba发展gydF4y2Ba135gydF4y2Ba, 2489-2503(2008)。gydF4y2Ba
Martínez-Frías, m.l.等。气管食管瘘,胃肠畸形,尿道下裂,产前生长缺陷。gydF4y2Ba点。J.医学热内。gydF4y2Ba44gydF4y2Ba, 352-355(1992)。gydF4y2Ba
米切尔,J.等人。新生儿糖尿病伴胰腺发育不全、肠闭锁和胆囊发育不全:寻找一种新的常染色体隐性综合征的病因。gydF4y2BaDiabetologiagydF4y2Ba47gydF4y2Ba, 2160-2167(2004)。gydF4y2Ba
海杰,H. A. & Niessen, G. J.与先天性胆囊缺失相关的环形胰腺。gydF4y2Baj . Pediatr。杂志。gydF4y2Ba22gydF4y2Ba, 1033(1987)。gydF4y2Ba
Park, E. J.等。他莫昔芬诱导cre-重组酶表达系统gydF4y2BaFoxa2gydF4y2Ba小鼠的基因座。gydF4y2BaDev,直流发电机。gydF4y2Ba237gydF4y2Ba, 447-453(2008)。gydF4y2Ba
辛戈拉尼,S. R.等。侵袭前和侵袭性导管胰腺癌及其在小鼠中的早期检测。gydF4y2Ba癌症细胞gydF4y2Ba4gydF4y2Ba, 437-450(2003)。gydF4y2Ba
Perl, A.-K。T., Wert, S. E., Nagy, A., Lobe, C. G. & Whitsett, J. A.肺形成过程中周围和近端细胞谱系的早期限制。gydF4y2Ba国家科学院学报美国gydF4y2Ba99gydF4y2Ba, 10482-10487(2002)。gydF4y2Ba
Snippert, H. J.等人。肠隐窝稳态是由对称分裂的Lgr5干细胞之间的中性竞争引起的。gydF4y2Ba细胞gydF4y2Ba143gydF4y2Ba, 134-144(2010)。gydF4y2Ba
Abe, T.等。在ROSA26位点建立活细胞成像条件报告小鼠系。gydF4y2Ba《创世纪》gydF4y2Ba49gydF4y2Ba, 579-590(2011)。gydF4y2Ba
龚,S.等。基于细菌人工染色体的中枢神经系统基因表达图谱。gydF4y2Ba自然gydF4y2Ba425gydF4y2Ba, 917-925(2003)。gydF4y2Ba
Means a.l ., Xu Y., Zhao A., Ray K. C., Gu G. CK19(CreERT)敲入小鼠系允许多个内胚层器官上皮细胞的条件DNA重组。gydF4y2Ba《创世纪》gydF4y2Ba46gydF4y2Ba, 318-323(2008)。gydF4y2Ba
Gu, G., Dubauskaite, J. & Melton, d.a .胰腺谱系的直接证据:NGN3+细胞是胰岛祖细胞,与导管祖细胞不同。gydF4y2Ba发展gydF4y2Ba129gydF4y2Ba, 2447-2457(2002)。gydF4y2Ba
Madisen, L.等人。一个强大的和高通量的Cre报告和表征系统的整个小鼠大脑。gydF4y2BaNat。>。gydF4y2Ba13gydF4y2Ba, 133-140(2010)。gydF4y2Ba
龚淑娟,杨晓文,李春华,Heintz, N.含R6Kgamma复制源的新型穿梭载体对细菌人工染色体的高效修饰。gydF4y2Ba基因组Res。gydF4y2Ba12gydF4y2Ba, 1992-1998(2002)。gydF4y2Ba
裴卓德,K. M. & Spagnoli, F. M.胚胎胰腺体外培养系统。gydF4y2BaJ. Vis. Exp。gydF4y2Ba(66)gydF4y2Ba, e3979(2012)。gydF4y2Bahttps://doi.org/10.3791/3979gydF4y2Ba.gydF4y2Ba
Preibisch, S., Saalfeld, S. & Tomancak, P.平铺三维显微图像采集的全局最优拼接。gydF4y2Ba生物信息学gydF4y2Ba25gydF4y2Ba, 1463-1465(2009)。gydF4y2Ba
德维茨,C.等人。脊髓的核组织依赖于由连环蛋白和afadin功能协调的运动神经元层合。gydF4y2Ba细胞的代表。gydF4y2Ba22gydF4y2Ba, 1681-1694(2018)。gydF4y2Ba
Husson, F., Josse, J. & Pagès, J.主成分方法-层次聚类-分区聚类:为什么我们需要选择可视化数据?应用数学系,1-10(2010)。gydF4y2Ba
Charrad, M., Ghazzali, N., Boiteau, V. & Niknafs, a . NbClust:用于确定数据集中相关簇数的R包。gydF4y2BaJ.统计。gydF4y2Ba61gydF4y2Ba, 1-36(2014)。gydF4y2Ba
raaue, A.等人。Data2Dynamics:为动力系统中的参数估计量身定制的建模环境。gydF4y2Ba生物信息学gydF4y2Ba31gydF4y2Ba, 3558-3560(2015)。gydF4y2Ba
皮切利等人。Smart-seq2用于单细胞敏感的全长转录组分析。gydF4y2BaNat方法。gydF4y2Ba10gydF4y2Ba, 1096-1098(2013)。gydF4y2Ba
伦,A. T. L,麦卡锡,D. J. &马里奥尼,J. C. Bioconductor单细胞rna seq数据低级分析的逐步工作流程。gydF4y2BaF1000ResgydF4y2Ba5gydF4y2Ba, 2122(2016)。gydF4y2Ba
麦卡锡,D. J.,坎贝尔,K. R.,伦,A. T. L. &威尔斯,Q. F. Scater: R.单细胞RNA-seq数据的预处理、质量控制、归一化和可视化。gydF4y2Ba生物信息学gydF4y2Ba33gydF4y2Ba, 1179-1186(2017)。gydF4y2Ba
Lun, a.t., Bach, K. & Marioni, J. C.跨细胞池化,以许多零计数的单细胞RNA测序数据规范化。gydF4y2Ba基因组医学杂志。gydF4y2Ba17gydF4y2Ba, 75(2016)。gydF4y2Ba
Amezquita, R. A.等。与Bioconductor协调单细胞分析。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 137-145(2020)。gydF4y2Ba
特拉普内尔,C.等。通过单细胞的伪时间排序揭示了细胞命运决策的动力学和调控因子。gydF4y2Ba生物科技Nat。》。gydF4y2Ba32gydF4y2Ba, 381-386(2014)。gydF4y2Ba
Escot, S., Willnow, D., Naumann, H., Di Francescantonio, S. & Spagnoli, F. M. Robo信号通过调节Tead转录因子控制胰腺祖细胞身份。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 5082(2018)。gydF4y2Ba
Palaria, A., Angelo, J. R., Guertin, T. M., Mager, J. & Tremblay, K. D. BMP对肝-胰胆管边界的描图揭示了小鼠肝芽内的异质性。gydF4y2Ba肝脏病学gydF4y2Ba68gydF4y2Ba, 274-288(2018)。gydF4y2Ba
桑德斯,E. J., Varedi, M. & French, a . S.原肠胚细胞增殖:一项使用BrdU掺入和PCNA定位的研究。gydF4y2Ba发展gydF4y2Ba118gydF4y2Ba, 389-399(1993)。gydF4y2Ba
范登伯格,G.等人。尾端增殖生长中心有助于形成心脏管的两极。gydF4y2Ba中国保监会,Res。gydF4y2Ba104gydF4y2Ba, 179-188(2009)。gydF4y2Ba
克利弗斯,H. &瓦特,F. M.根据功能而不是表型来定义成体干细胞。gydF4y2Ba为基础。学生物化学启。gydF4y2Ba87gydF4y2Ba, 1015-1027(2018)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Spagnoli实验室的所有成员对这项研究提出的有益意见和建议;H. Naumann寻求技术帮助;G. Pazour IFT57抗体;A. Christ和T. Willnow用于GLI2和SMO抗体;MDC转基因单元的技术帮助,以生成gydF4y2BaProx1gydF4y2Ba-rtTA小鼠品系;D-BSSE基因组学设施的C. Beisel用于NGS RNA测序。先进光学显微镜技术平台的工作人员通过亥姆霍兹协会的MDC提供的资金支持了双光子显微镜装置的维护。这项研究得到了亥姆霍兹协会(FMS, JW)、欧盟地平线2020研究与创新计划(Pan3DP资助协议no. 1)的资助。(fms, dw);D.W.是波黑(Tr. PhD)奖学金的获得者。U.B.是EMBO短期奖学金(7853)的获得者。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
F.M.S.和D.W.构思了这项研究,设计了实验并撰写了手稿。D.W.完成了所有的实验。I.M.P.产生了gydF4y2BaProx1gydF4y2Ba-rtTA转基因菌株。A.M.参与了五彩纸屑血统追踪实验和双光子图像采集。u.b., F.K.和J.W.开发了数学建模方法。m.l.v., A.V.和Z.K.进行了scRNA-seq数据分析。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然gydF4y2Ba感谢Dominic Grun, Meritxell Huch和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
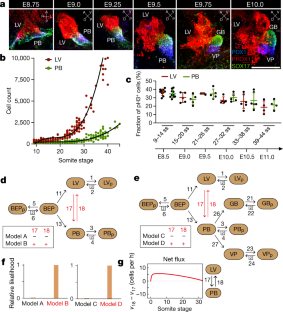
图1肝-胰-胆标志物在早期细胞命运规范中的表达。gydF4y2Ba
一个gydF4y2Ba,使用蔡司Stemi 2000立体显微镜拍摄的小鼠胚胎在指定的躯体阶段(ss)的图像。比例尺,1mm。gydF4y2BabgydF4y2Ba, Prox1染色胚胎的代表性共聚焦全贴壁免疫荧光(IF)图像。除了腹前肠区(VFG)外,Prox1从6ss起在发育中的心管(HT)中表达。比例尺,100μm。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba, E8.5-E8.75 (8-13ss)胚胎VFG的代表性共聚焦IF图像。VFG显示为正面的整个‐坐垫(gydF4y2BacgydF4y2Ba)或横向(gydF4y2BadgydF4y2Ba)视图或横切切片(gydF4y2BaegydF4y2Ba).Prox1(红色),Pdx1(蓝色)和Sox17(绿色)标记肝脏(Prox1gydF4y2Ba+gydF4y2Ba)和胰胆道(Prox1 .gydF4y2Ba+gydF4y2Ba/ Pdx1gydF4y2Ba+gydF4y2Ba/ Sox17gydF4y2Ba+gydF4y2Ba) VFG中的祖细胞(用虚线勾勒)。Insets的gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba显示Pdx1通道的灰度框区放大倍数较高。右边的面板gydF4y2BadgydF4y2Ba灰色刻度显示Pdx1通道,突出显示VFG唇处Pdx1表达的开始。用赫斯特染料作核反染色。比例尺,100μm。gydF4y2BafgydF4y2Ba,显示LV比值的散点图gydF4y2Ba与gydF4y2BaPB细胞计数(gydF4y2BangydF4y2Ba166个胚胎)。在IF染色的冷冻切片上定量LV和PB芽中的细胞数量(见图2)。gydF4y2Ba1 bgydF4y2Ba).数据代表3个或3个以上具有相似结果的生物独立实验。gydF4y2Ba
图2肝、胰胆腹侧、胰背侧器官萌芽细胞增殖和凋亡动态。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,小鼠胚胎在指定躯体阶段的冷冻切片的代表性IF图像,pH3染色(绿色)和指示标记物。在gydF4y2Ba一个gydF4y2Ba, Ecad(红色)为0ss时内胚层和外胚层上皮细胞。在gydF4y2BabgydF4y2Ba, Ecad(蓝色)/Prox1(红色)在6秒时标记腹前肠(VFG)。在gydF4y2BacgydF4y2BaProx1(左)标记肝细胞;Pdx1/Prox1(左图)或Pdx1/Sox17(右图)标记胰胆道PB细胞。在gydF4y2BacgydF4y2Ba,左右面板显示了同一胚胎的连续切片。VFG、LV和PB用白色虚线标出。用赫斯特染料作核反染色。NF,神经褶皱。比例尺,100μm。gydF4y2BadgydF4y2BapH3的定量gydF4y2Ba+gydF4y2Ba冷冻切片上PB芽中的细胞(gydF4y2BangydF4y2Ba= 26个胚胎)。点阵图显示pH3的数值gydF4y2Ba+gydF4y2Ba从E8.5到E11.0 (9-41ss), PB芽中细胞数占总细胞数的百分比。在Prox1/Pdx1/pH3或Sox17/Pdx1/pH3染色的相同胚胎的连续切片上计数增殖的PB细胞。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。Ns,不显著。gydF4y2BaegydF4y2BapH3的定量gydF4y2Ba+gydF4y2Ba背侧(DP)和腹侧(VP)胰腺细胞冷冻切片(gydF4y2BangydF4y2Ba= 28个胚胎)。点阵图显示pH3的%分数gydF4y2Ba+gydF4y2Ba从E9.0到E11.0(15-44秒),细胞相对于每个器官雏形的总细胞数(占总细胞数的%)。PB芽内VP细胞定义见扩展数据图。gydF4y2Ba5gydF4y2Ba.均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2BafgydF4y2Ba,经pH3(绿色)、Prox1(红色)和Pdx1(蓝色)染色的胚胎E9.0-E9.75 (16-26 ss)的代表性全挂载IF图像。LV和PB芽用白虚线勾勒。比例尺,100μm。gydF4y2BaggydF4y2Ba、在指定的茎段阶段测量LV和PB芽体积(gydF4y2BangydF4y2Ba= 129个胚胎)。通过测量共焦z系列全植入if的单个光学切片上的表面积来重建三维器官体积(图2)。gydF4y2Ba1gydF4y2Ba).然后将每个胚胎的平均表面积乘以组织厚度。gydF4y2BahgydF4y2BapH3的定量gydF4y2Ba+gydF4y2BaLV和PB芽全贴装IF图细胞数(gydF4y2BangydF4y2Ba= 71个胚胎)归一化到器官芽体积(毫米)gydF4y2Ba3.gydF4y2Ba).与肝芽相比,早期胰胆芽的pH3水平较高(E8.5;gydF4y2BaPgydF4y2Ba= 0.0016),后期两种器官芽无显著差异。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2Ba我gydF4y2Ba,标记物染色的18ss胚胎的代表性图像显示BrdU(绿色)标记细胞在4小时标记期后。Prox1(红色)标记LV, Prox1/Pdx1(蓝色)标记PB祖细胞。LV和PB芽由白虚线勾勒。比例尺,100μm。gydF4y2BajgydF4y2Ba在BrdU脉冲追赶期后,E8.5和E10.5胚胎的LV和PB祖细胞中BrdU合并。点状图显示brdu标记细胞相对于每个器官雏形中总细胞数的比例(占总细胞数的%)。每个点代表单个胚胎的平均值[E8.5: n(1h) = 4, n(2h) = 6, n(4h) = 8;E10.5: n(0.5h) = 3, n(4h) = 5]。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2BakgydF4y2Ba,图中以BrdU %表示细胞增殖率gydF4y2Ba+gydF4y2Ba不同标记期E8.5和E10.5左室和PB器官结构域的细胞(扩展数据图。gydF4y2Ba2 jgydF4y2Ba).细胞周期长度(tgydF4y2BacgydF4y2Ba)基于BrdU掺入采用线性回归估计gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba.LV (E8.5)斜率= 3.8%/h;估计细胞周期长度= 26.6h(95%置信区间:44.7h-19h)。PB (E8.5)斜率= 5.8%/h;估计细胞周期长度= 17.3h(95%置信区间:29.6h-12.2h)。LV (E10.5)斜率= 5.5%/h;估计细胞周期长度= 18.2h(95%置信区间21h-16.1h)。PB (E10.5)斜率= 4.8%/h;估计细胞周期长度= 21h(95%置信区间:33h-15.4h)。在E8.5时,LV和PB祖细胞的平均细胞周期长度差异无统计学意义(gydF4y2BaPgydF4y2Ba= 0.14)或E10.5 (gydF4y2BaPgydF4y2Ba= 0.36)。双尾线性回归t-gydF4y2Ba测验gydF4y2Ba.gydF4y2BalgydF4y2Ba, pH3的分数gydF4y2Ba+gydF4y2Ba/ BrdUgydF4y2Ba+gydF4y2Ba为总BrdU的%gydF4y2Ba+gydF4y2Ba示踪脉冲追逐期的细胞数量[n(0.5h) = 3, n(4h) = 3]。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2Ba米gydF4y2Ba, BrdU的分数gydF4y2Ba+gydF4y2BaLV和PB芽中早期和晚期有丝分裂细胞占指示脉冲追逐期早期或晚期有丝分裂细胞总数的百分比[n(0.5h) = 3, n(4h) = 3]。pH3 IF染色强度用于识别早期(低,点状pH3信号)和晚期(高pH3信号)有丝分裂细胞。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2BangydF4y2Ba, BrdU的分数gydF4y2Ba+gydF4y2BaE9.5胚LV、PB、DP芽在指示的脉冲追逐期[n(2h) = 2, n(4h) = 5]后,对细胞进行抑制。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2BaogydF4y2Ba, BrdU的分数gydF4y2Ba+gydF4y2BaE10.5胚胎DP、VP和GB细胞在指示的脉冲追逐期后(gydF4y2BangydF4y2Ba= 4).均数±s.d。双尾Kruskal-Wallis检验与Dunn 's多重比较检验。ns。gydF4y2BapgydF4y2Ba,gydF4y2Ba问gydF4y2Ba,在指定的体细胞阶段,对胚胎中的凋亡细胞标记物cleaved caspase 3 (cCas3)进行免疫染色。E8.0 (5ss) Tg冷冻切片的代表性IF图像(gydF4y2BaProx1gydF4y2Ba-EGFP)胚胎(gydF4y2BapgydF4y2Ba)进行cCas3(蓝色)、Prox1(红色)和GFP(绿色)染色,检测VFG细胞(Prox1gydF4y2Ba+gydF4y2Ba,绿色荧光蛋白gydF4y2Ba+gydF4y2Ba)和E9.5 (22ss)胚胎(gydF4y2Ba问gydF4y2Ba)的cCas3(蓝色)、Prox1(红色)和Pdx1(蓝色)染色。插图显示了较高的放大灰度框区域为指示的频道。在LV和PB芽(箭头)以及周围的间质(箭头)中发现罕见的凋亡细胞。Hoechst,核反染色。比例尺,100μm。gydF4y2BargydF4y2Ba细胞凋亡的定量分析(cCas3gydF4y2Ba+gydF4y2Ba冷冻切片染色后,VFG、LV和PB芽中的细胞(gydF4y2BangydF4y2Ba= 19个胚胎),如gydF4y2BapgydF4y2Ba,gydF4y2Ba问gydF4y2Ba.点阵图显示了cCas3的分数gydF4y2Ba+gydF4y2Ba所示器官区域细胞总数的百分比。在E8.5-E9.0 (12-20ss)和E9.5-E10.0 (21-31ss)时,LV芽与PB芽凋亡差异无统计学意义。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。数据代表3个或3个以上具有相似结果的生物独立实验。gydF4y2Ba
图3腹前肠发育的扩展计算模型分析。gydF4y2Ba
一个gydF4y2Ba模型A和模型B与实验数据吻合。模型A(黑色实线)和模型B(红色实线)的最佳拟合及其各自的标准差如图所示。在E7.5和E11.5 (0-45ss)之间收集的细胞计数数据(黑点)用于估计模型的参数值。gydF4y2BabgydF4y2Ba,模型C、D拟合实验细胞计数数据(黑点)。模型C(黑色实线)和模型D(红色实线)的最佳拟合及各自的标准差如图所示。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba模型C(黑色实线)和模型D(红色实线)中不同细胞群的模拟(显示在每个面板上)。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,模型D的模拟预测细胞从胰胆(PB)群体流向肝脏(LV)群体(gydF4y2BahgydF4y2Ba),以及反向延迟增加的通量(gydF4y2Ba我gydF4y2Ba).直到30ss,从PB区域到LV区域的细胞流量超过LV区域到PB区域的细胞流量。然后,正净通量的方向被反转。gydF4y2BajgydF4y2Ba,模型D(红线)模拟的BEP、BEPp、LV、LVp细胞计数之和(LV*)与拟合模拟细胞计数的指数函数(黑色虚线)叠加,估算加倍时间(11.8h)。gydF4y2BakgydF4y2Ba,模型D(红线)模拟的PB、PBp、VP、VPp、GB和GBp细胞计数(PB*)的总和,与拟合模拟细胞计数的指数函数(黑色虚线)叠加,以估计倍增时间(14.1h)。gydF4y2BalgydF4y2Ba, BEP, BEPp, LV和LVp细胞计数之和(LV*,暗红色线)和PB, PBp, VP, VPp, GB和GBp细胞计数之和(PB*,暗绿色线)使用标称参数值用模型D模拟。浅色线表示通过设置参数k降低塑性后LV*和PB*单元数的模拟gydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba1/4gydF4y2BathgydF4y2Ba它们的标称参数值。结果表明,塑性降低降低了LV*细胞计数,PB*细胞计数增加。gydF4y2Ba米gydF4y2Ba,模型D模拟的BEP、BEPp、LV、LVp单元数之和(LV*)与PB、PBp、VP、VPp、GB、GBp单元数之和(PB*)的比值(红线)与模型D模拟的LV*/PB*比值(kgydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba都化成了1/2 1/4gydF4y2BathgydF4y2Ba和1/8gydF4y2BathgydF4y2Ba他们的原始价值。叠加显示了参数k的减少gydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba(即塑性)降低LV*/PB*细胞计数比。gydF4y2Ba
图4肝胰胆细胞群及其标记基因表达概况。gydF4y2Ba
一个gydF4y2Ba,柱状图显示为每个somite阶段收集的数据点的数量,并用于参数化数学模型。gydF4y2BabgydF4y2Ba,用重叠的彩色框覆盖的数学模型C的示意图表示,表示各种肝-胰-胆亚群的标记基因表达(Prox1,红色;Sox17,绿色;Pdx1,蓝色;pH3,灰色)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, 8个新的细胞群扩展了模型D: LVs, LVsp, PBs, PBsp, GBs, GBsp, VPs和VPsp,它们对应于标记细胞(见补充说明)gydF4y2Ba1gydF4y2Ba).模拟了两种不同的实验设置:多色Prox1-rtTA、Confetti谱系跟踪和Pdx1-CreERT谱系跟踪实验。两个实验设置,Prox1-rtTA;Confetti沿袭跟踪(gydF4y2BacgydF4y2Ba)和Pdx1-CreERT谱系追踪实验(gydF4y2BadgydF4y2Ba),在受峰值事件影响的细胞群集上有所不同。缩写:s, spike-in。gydF4y2Ba
扩展数据图5肝和胰胆道器官结构域包含具有不同标记物表达谱的细胞亚群。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,在E8.5-E11.5 (9-45ss)时,胰腺-胆道(PB)芽中Pdx1和Sox17的荧光强度(FI)的单细胞测量。绘制单个细胞的Pdx1和Sox17 FI值。胚体发育阶段相似的胚按提示进行分组(n,胚数;9-14ss:gydF4y2BangydF4y2Ba= 27,6608个细胞;15-20ss:gydF4y2BangydF4y2Ba= 15 4310个细胞;21-26ss:gydF4y2BangydF4y2Ba= 16,5125个细胞;27-32ss:gydF4y2BangydF4y2Ba= 16,6644个cell;33-38ss:gydF4y2BangydF4y2Ba= 16, 13002单元;39-45ss:gydF4y2BangydF4y2Ba= 6,10588 cells)。在E8.5 - E9.5 (9ss-26ss)期间,PB器官雏形中大部分细胞共表达Sox17和Pdx1,而在E10.0-E11.5 (27ss-45ss)期间,大部分细胞同时表达Sox17和Pdx1gydF4y2Ba高gydF4y2Ba或Pdx1gydF4y2Ba高gydF4y2Ba的身份。FI使用ImageJ/Fiji进行测量。数值在每个胚胎内通过线性归一化进行校正。黑色虚线表示基于Pdx1和Sox17 FI水平的祖先群体细分。gydF4y2BaggydF4y2Ba,从E8.5 (11ss)到E11.0 (40ss)胚胎PB器官区域冷冻切片的代表性IF图像。Pdx1(绿色)和Sox17(红色)标记PB祖细胞。E9.75后(约27ss), PB芽分化为胆囊(GB;以Sox17为标志)和腹侧胰芽(VP;标记为Pdx1)。用赫斯特染料作核反染色。比例尺,100μm。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,显示不同PB基细胞数量随发育时间变化的散点图(gydF4y2BangydF4y2Ba= 96个胚胎)。利用FI数据根据Pdx1和Sox17的相对表达量对亚群体进行分类。Pdx1gydF4y2Ba高gydF4y2BaVP祖细胞(Pdx1-FI >50, Sox17-FIgydF4y2Ba\ (\ \)gydF4y2Ba50)(绿点);Sox17gydF4y2Ba高gydF4y2Ba对应GB祖细胞(Pdx1-FIgydF4y2Ba\ (\ \)gydF4y2Ba50, Sox17-FI >50)(红点);Pdx1/ sox17双阳性低(Pdx1- figydF4y2Ba\ (\ \)gydF4y2Ba50岁的Sox17-FIgydF4y2Ba\ (\ \)gydF4y2Ba50)或高水平(Pdx1-FI >50, Sox17-FI >50)对应于PB祖细胞(黄点)。这三个亚群体表现出不同的繁殖动力学,如图所示的绝对细胞计数在单个器官域(gydF4y2BahgydF4y2Ba)或每个亚群体的百分比,即PB芽中总细胞数的百分比(gydF4y2Ba我gydF4y2Ba)对somite阶段。E9.75 [26-27ss;(gydF4y2Ba我gydF4y2Ba)],它们的细胞总数在整个分析时间内保持不变(gydF4y2BahgydF4y2Ba).gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,胚胎冷冻切片上Prox1(红色)、Pdx1(蓝色)和白蛋白(绿色)的代表性IF染色。介于15至19秒之间(gydF4y2BajgydF4y2Ba),肝(LV)祖细胞的一个亚群对肝脏标志物白蛋白(箭头)呈阳性。在36秒(gydF4y2BakgydF4y2Ba),大多数LV细胞同时表达Prox1和白蛋白,但只有一小部分表达白蛋白gydF4y2Ba-gydF4y2Ba细胞位于左心室(箭头)。在未分析的时间点,白蛋白gydF4y2Ba+gydF4y2Ba/ Prox1gydF4y2Ba-gydF4y2Ba左室可见细胞。右(gydF4y2BajgydF4y2Ba)或底部(gydF4y2BakgydF4y2Ba)面板显示合并或单一通道时,框内区域的放大倍率更高。用Hoechst作核反染色。比例尺,100μm。gydF4y2BalgydF4y2Ba白蛋白定量gydF4y2Ba+gydF4y2Baif染色冷冻切片上LV芽中的细胞(gydF4y2BangydF4y2Ba= 23个胚胎),表示为Prox1的%gydF4y2Ba+gydF4y2BaLV细胞。gydF4y2Ba米gydF4y2Ba, Prox1和白蛋白冷冻切片检测左室细胞计数的比较(gydF4y2BangydF4y2Ba= 20个胚胎),从模型D中预测LV细胞计数[图;gydF4y2Ba1 egydF4y2Ba;预测的左室细胞计数结合了左室和左室血压的模型预测(扩展数据图。gydF4y2Ba3 dgydF4y2Ba)人口]。尽管基于白蛋白表达(红点)或Prox1表达(黑圈)的LV细胞计数在这些早期时间点略有不同,但在早期somite阶段(<30ss),表达测量结果与模型预测结果吻合良好。gydF4y2Ba
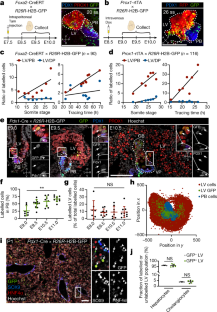
扩展数据图6肝-胰-胆祖人群扩展谱系追踪分析。gydF4y2Ba
一个gydF4y2Ba的转基因结构的示意图表示gydF4y2BaProx1gydF4y2Ba小鼠肝-胰-胆祖细胞的-rtTA谱系追踪。2A肽使rtTA和mCherry荧光报告基因共表达。loxP站点显示为紫色三角形。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,实验参数影响评估gydF4y2BaProx1 -gydF4y2BartTA标签效率。中柱状图gydF4y2BabgydF4y2Ba显示了在增加强力霉素剂量[75μg/g体重(bw),gydF4y2BangydF4y2Ba= 22;100μg / g bw,gydF4y2BangydF4y2Ba= 29;150μg / g bw,gydF4y2BangydF4y2Ba= 116]。图中gydF4y2BacgydF4y2Ba显示了个体胚胎中基因标记细胞的数量与三种多西环素剂量标记的体细胞阶段之间的正相关。在所有进一步分析中,妊娠雌性注射150μg/g bw强力霉素。gydF4y2BadgydF4y2Ba,显示遗传标记的肝(LV)或胰-胆道(PB)祖细胞的数量,作为百分比(%)在这两种胚芽中标记的细胞总数,绘制在体细胞阶段gydF4y2BaFoxa2gydF4y2Ba-CreERT实验(上面板)或追踪期在gydF4y2BaProx1gydF4y2Ba-rtTA实验(下面板)。垂直排列的成对点对应同一胚胎LV(红点)或PB(绿点)中测量的标记细胞(%)。双尾线性回归t-gydF4y2Ba测验gydF4y2Ba;gydF4y2BaPgydF4y2Ba= 0.006 (gydF4y2BaFoxa2gydF4y2Ba-CreERT;gydF4y2BangydF4y2Ba= 83个胚胎),gydF4y2BaPgydF4y2Ba= 0.061 (gydF4y2BaProx1gydF4y2Ba-rtTA;gydF4y2BangydF4y2Ba= 81个胚胎)。gydF4y2BaegydF4y2Ba的转基因结构的示意图表示gydF4y2BaFoxa2gydF4y2Ba小鼠肝-胰-胆道祖细胞的creert谱系追踪。loxP站点显示为紫色三角形。IRES,内部核糖体进入位点;mER,小鼠雌激素受体。gydF4y2BafgydF4y2Ba, Tg克隆标记实验装置示意图(gydF4y2BaFoxagydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎。怀孕女性腹腔注射单剂量他莫昔芬(TAM;12μg/g bw) E8.5龄和e9.0 ~ e9.5龄(gydF4y2BangydF4y2Ba= 15个胚胎)。gydF4y2BaggydF4y2Ba,代表Tg的全装IF (gydF4y2BaFoxa2gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba在E8.5注射TAM后,E9.0-E9.5 (16-21ss)的-H2B-GFP胚胎。箭头表示基因标记(GFPgydF4y2Ba+gydF4y2Ba)细胞在LV和PB芽。在克隆标记实验中,通常发现2-3个标记细胞彼此靠近,这表明它们是一个共同标记祖细胞的后代。在右侧面板中,框状区域以更高的放大倍率显示;白色虚线圈表示两个相邻的绿色荧光蛋白gydF4y2Ba+gydF4y2Ba一个Pdx1细胞gydF4y2Ba+gydF4y2Ba和一个Pdx1gydF4y2Ba-gydF4y2Ba,这可能源于一个共同的祖先。比例尺,100μm。gydF4y2BahgydF4y2Ba的原理表示gydF4y2BaR26RgydF4y2Ba五彩纸屑转基因。重组后,基因标记细胞表达核GFP (nGFP),细胞质RFP或YFP,或膜相关CFP (mCFP)。gydF4y2Ba我gydF4y2Ba, E11.5 Tg双光子显微镜三维扫描代表光学切片(gydF4y2BaProx1gydF4y2Ba-rtTA;gydF4y2BaR26RgydF4y2Ba五彩纸屑)胚胎。在胰芽腹侧(VP)和胰芽背侧(DP)(用白虚线圈出)均检测到表达CFP、YFP或RFP的基因标记细胞。比例尺,100μm。gydF4y2BajgydF4y2Ba, E10.5 Tg中VP和DP芽的代表图像(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP) (top)或Tg(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-五彩纸屑)(下)胚胎。顶部面板,Pdx1(蓝色)和Prox1(红色)的IF染色标记VP和DP芽;绿色荧光蛋白gydF4y2Ba+gydF4y2Ba(绿色)标记的细胞在VP和DP的Tg(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎。底部面板,双光子显微镜三维扫描Tg的光学切片(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-Confetti)胚胎在基因标记细胞中显示CFP、YFP和RFP的原生报告荧光。比例尺,100μm。gydF4y2BakgydF4y2Ba对所示荧光团对胚胎中标记细胞总数的贡献的定量分析表明,每个荧光团在不同组织之间具有可比性的特征诱导效率。均数±s.d。Brown-Forsythe和Welch方差分析与Dunnett’s T3多重比较检验。gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2BalgydF4y2Ba,在硅重建的基因标记细胞在胰芽Tg(gydF4y2BaProx1gydF4y2Ba-rtTA;gydF4y2BaR26RgydF4y2Ba五彩纸屑)胚胎。采用Imaris软件中的斑点检测分析进行识别gydF4y2BaxyzgydF4y2Ba-单个基因标记细胞的坐标,并重建标记组织。gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba,克隆大小分布建立从五彩纸屑沿袭追踪实验使用gydF4y2BaProx1gydF4y2Ba-rtTA (gydF4y2Ba米gydF4y2Ba)或gydF4y2BaPdx1gydF4y2Bacre (gydF4y2BangydF4y2BaTg线。信息gydF4y2BaxyzgydF4y2Ba使用DP和VP中标记细胞的-坐标,根据细胞之间的几何距离将单个细胞聚类为克隆簇gydF4y2Ba46gydF4y2Ba.VP和DP的克隆大小分布有显著差异,VP中大多数集群由4-5个细胞组成,DP中每集群约有8个细胞。(Prox1gydF4y2BangydF4y2Ba= 38个胚胎;Pdx1,gydF4y2BangydF4y2Ba= 16个胚胎)。垂直虚线表示平均值;双尾Mann-Whitney检验。gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2BaogydF4y2Ba, E10.5 Tg的DP和VP中细胞总数(灰点)和gfp标记细胞(绿点)的定量(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎(gydF4y2BangydF4y2Ba= 18个胚胎)。总细胞计数和绿色荧光蛋白gydF4y2Ba+gydF4y2BaDP中标记细胞明显高于VP。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2BapgydF4y2Ba,绿色荧光蛋白的量化gydF4y2Ba+gydF4y2BaTg的VP(绿点)或DP(蓝点)的细胞数量占总细胞数量的百分比(%)gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎(gydF4y2BangydF4y2Ba= 18个胚胎)。DP与VP之间差异无统计学意义。均数±标准差。双尾Mann-Whitney检验。Ns,不显著。gydF4y2Ba问gydF4y2Ba,有丝分裂H2B-GFP的定量gydF4y2Ba+gydF4y2BaE11.5 Tg冷冻切片if染色显示LV、DP和PB器官芽胞中的细胞(gydF4y2BaProx1gydF4y2Ba-rtTA;gydF4y2BaR26RgydF4y2Ba-H2B-GFP) (gydF4y2BangydF4y2Ba= 4个胚胎)和E10.5 Tg(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎(gydF4y2BangydF4y2Ba= 4个胚胎)。点状图显示有丝分裂中基因标记细胞相对于各自器官芽中标记细胞总数的比例。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。ns。gydF4y2BargydF4y2Ba, Prox1-rtTA仿真;五彩纸屑谱系追踪实验(见附注)gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba4摄氏度gydF4y2Ba).标记细胞在所有VP*群体中的比例(VP和VPsp细胞计数的总和与VP、VPsp、VP和VPp细胞计数的总和的比值)显示了标签诱导时间点和重组效率的不同组合。灰色表面为用模型D模拟的带有标称参数值的标记VP*的分数;白色-红色梯度表面为通过设置参数k降低塑性后,用模型D模拟的标记VP*的分数gydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba到面值的1/8。在可塑性降低的模型中,标记VP*的比例总是较高,这支持了PB到LV的可塑性导致VP中的无性扩散和簇大小减小的假设。gydF4y2Ba年代gydF4y2Ba, VP和VPp细胞计数的总和,从模型D模拟中获得,使用标称kgydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba参数值(红线)或模型D的模拟,其中两个参数kgydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba减为1/2(黑线),1/4gydF4y2BathgydF4y2Ba(深灰色线),或者1/8gydF4y2BathgydF4y2Ba(浅灰色线)的标称价值。叠加显示了参数k的减少gydF4y2Ba17gydF4y2Ba和kgydF4y2Ba18gydF4y2Ba(即可塑性)导致VP和VPp细胞计数增加。gydF4y2Ba
扩展数据图7 Pdx1扩展谱系追踪分析gydF4y2Ba+gydF4y2Bapancreato-biliary祖细胞。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,空间表示gydF4y2BaPdx1gydF4y2Bacre血统追踪实验。E10.5冷冻切片的中频图像(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)及E11.0 (gydF4y2BacgydF4y2Ba) Tg (gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎经Prox1、Pdx1、GFP染色后数字化得到gydF4y2BaxyzgydF4y2Ba-所有GFP的坐标gydF4y2Ba−gydF4y2Ba(红色)和GFPgydF4y2Ba+gydF4y2Ba(绿色)肝脏(LV)和胰胆管(PB;蓝色)芽gydF4y2Ba44gydF4y2Ba.E10.5个体胚胎数据(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba;gydF4y2BangydF4y2Ba= 8)和E11.0 (gydF4y2BacgydF4y2Ba;gydF4y2BangydF4y2Ba= 10),并根据它们的大小绘制细胞图gydF4y2BaxygydF4y2Ba- (gydF4y2BabgydF4y2Ba)或gydF4y2BayzgydF4y2Ba坐标(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba).gydF4y2BadgydF4y2Ba, Tg的代表性IF图像(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎在E11.0。GFP(绿色)识别来自Pdx1的标记细胞gydF4y2Ba+gydF4y2Ba祖细胞。Prox1(红色)标记LV和胆囊(GB;白色虚线所示),Prox1/Pdx1(蓝色)标记腹侧胰腺(VP;由白色虚线勾勒)。插图显示合并和单个GFP和Pdx1通道时,框区放大倍率更高。箭头表示绿色荧光蛋白gydF4y2Ba+gydF4y2Ba左室细胞与VP和GB交界。用赫斯特染料作核反染色。比例尺,100μm。gydF4y2BaegydF4y2Ba,新生儿Tg代表性IF图像(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)小鼠肝脏。谷氨酰胺合成酶(GS,红色)标记靠近中央静脉的肝细胞,而Krt19(蓝色)标记胆管细胞。GFP与GS(箭头)或Krt19(箭头)共染可识别Pdx1的后代gydF4y2Ba+gydF4y2BaPB细胞可分化为肝细胞和胆管细胞。比例尺,100μm。gydF4y2BafgydF4y2Ba, Tg的代表性IF图像(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎在E9.5。右图显示框区放大倍数较高。箭头表示基因标记(GFPgydF4y2Ba+gydF4y2BaPB芽和LV芽周围细胞Krt19阳性。比例尺,100μm。gydF4y2BaggydF4y2Ba,绿色荧光蛋白的定量gydF4y2Ba+gydF4y2Ba基因标记为Tg(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎(E9.0,gydF4y2BangydF4y2Ba= 7;E9.5,gydF4y2BangydF4y2Ba= 10;E10.5,gydF4y2BangydF4y2Ba= 7;E11.0,gydF4y2BangydF4y2Ba= 7)和新生小鼠(P1,gydF4y2BangydF4y2Ba= 5)显示了总肝细胞群0.8%的恒定标记指数。分析时间点间差异无统计学意义。均数±s.d。双尾Kruskal-Wallis检验。Ns,不显著。gydF4y2BahgydF4y2Ba,标记PB祖细胞在Tg中的定量分析(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-五彩纸屑)胚胎(E9.5,gydF4y2BangydF4y2Ba= 4;E10.5,gydF4y2BangydF4y2Ba= 10)。基因标记细胞的数量随着发育阶段的增加而增加。均数±标准差。双尾Mann-Whitney检验。gydF4y2BaPgydF4y2Ba= 0.04。gydF4y2Ba我gydF4y2Ba, Tg前腹内胚层标记LV祖细胞占总标记细胞群的百分比(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-五彩纸屑)胚胎(E9.5,gydF4y2BangydF4y2Ba= 4;E10.5,gydF4y2BangydF4y2Ba= 10)。均数±标准差。双尾Mann-Whitney检验。gydF4y2BaPgydF4y2Ba= 0.03。gydF4y2BajgydF4y2Ba, E10.5 Tg冷冻切片的代表性IF图像(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-五彩纸屑)染色为Prox1(蓝色),RFP(红色)和GFP(绿色)。抗gfp抗体还能检测膜结合的CFP和细胞质YFP。白虚线为PB祖细胞。插图显示了放大倍数较高的区域,突出显示了Pdx1基因标记的后代gydF4y2Ba+gydF4y2BaLV芽中表达YFP(箭头)或RFP(箭头)的PB细胞。比例尺,100μm。gydF4y2BakgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba,克隆的空间表示gydF4y2BaPdx1gydF4y2Ba-四个个体E10.5 Tg的cre谱系追踪实验(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba五彩纸屑)胚胎。对中频数据进行数字化处理gydF4y2BaxyzgydF4y2Ba个体标记LV (LV- cfp, LV- rfp, LV- yfp)和PB祖细胞(PB细胞)的-坐标gydF4y2Ba44gydF4y2Ba.细胞被绘制根据他们的gydF4y2BaxygydF4y2Ba- (gydF4y2BakgydF4y2Ba-gydF4y2Ba米gydF4y2Ba)或gydF4y2BayzgydF4y2Ba坐标(gydF4y2BangydF4y2Ba).相同颜色的单个克隆沿肝弦分布。黄色箭头表示从Pdx1产生的标记细胞簇的轨迹gydF4y2Ba+gydF4y2BaPB祖细胞沿肝弦扩散。gydF4y2Ba
扩展数据图8 Pdx1诱导谱系追踪实验gydF4y2Ba+gydF4y2Bapancreato-biliary祖细胞。gydF4y2Ba
一个gydF4y2Ba的原理表示gydF4y2BaPdx1gydF4y2Ba-CreERT转基因和实验装置,以获得遗传标记Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)或Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-tdTomato)胚胎。妊娠女性腹腔注射单剂量他莫昔芬[TAM;150μg / g (gydF4y2BaR26RgydF4y2Ba-H2B-GFP)或25μg/g (gydF4y2BaR26RgydF4y2BaE8.5, E9.5或E10.5。在E11.5处收集标记胚胎。基于TAM给药和Cre-ERT2诱导之间的时滞gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba, Pdx1gydF4y2Ba+gydF4y2Ba细胞可在注射后24小时内标记。gydF4y2BabgydF4y2Ba, E11.5 Tg冷冻切片的代表性IF图像(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)的胚胎被Prox1(红色)、Pdx1(蓝色)和GFP(绿色)染色。绿色荧光蛋白gydF4y2Ba+gydF4y2Ba在给予E8.5(左图)和E9.5(右图)的TAM后,在胰腺腹侧(VP)、胆囊(GB)、肝外胆管(EHBD)和肝脏(LV)中发现了标记细胞。插图显示框内区域的放大倍数更高。GB、VP和EHBD由白色虚线勾勒。EHBD结构是胰胆管(PB)芽的衍生物,在小鼠中从E11.5开始可见gydF4y2Ba17gydF4y2Ba.比例尺,100μm。gydF4y2BacgydF4y2Ba,定量显示VP中基因标记Tg的标记细胞百分比(%)(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)(灰点;扩展数据图中的数据。gydF4y2Ba6 pgydF4y2Ba;gydF4y2BangydF4y2Ba= 18个胚胎)或Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎[绿点;n(TAM E8.5) = 22个胚胎,n(TAM E9.5) = 24个胚胎,n(TAM E10.5) = 13个胚胎]。由本构诱导的标记VP细胞的比例gydF4y2BaPdx1gydF4y2Ba-Cre Tg明显高于tam诱导物gydF4y2BaPdx1gydF4y2Ba-CreERT Tg,与之前的报道一致gydF4y2Ba23gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。gydF4y2BaPgydF4y2Ba< 0.001。Ns,不显著。gydF4y2BadgydF4y2Ba,标记非vp细胞(即GB、EHBD和LV)在Tg中占总标记细胞的百分比(%)的定量(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)(灰点;gydF4y2BangydF4y2Ba= 18个胚胎)或Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎[绿点;n(TAM E8.5) = 21个胚胎,n(TAM E9.5) = 24个胚胎,n(TAM E10.5) = 13个胚胎]。标记的非vp细胞的部分诱导gydF4y2BaPdx1gydF4y2Ba-Cre Tg明显高于tam诱导物gydF4y2BaPdx1gydF4y2Ba-CreERT。与E10.5时的TAM相比,E8.5时的TAM诱导显著提高了标记非vp细胞的比例。均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验。**gydF4y2BaPgydF4y2Ba= 0.005;* * *gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2BaegydF4y2Ba,柱状图显示左室细胞标记胚胎的百分比(%)gydF4y2BaPdx1gydF4y2Ba-Cre[(18/19), 94.7%]或tam -诱导gydF4y2BaPdx1gydF4y2Ba-CreERT血统追踪策略[TAM E8.5:(3/22), 15%;Tam e9.5:(2/24), 8.3%;Tam e10.5:(0/13), 0%]。gydF4y2BafgydF4y2Ba,定量显示VP中基因标记Tg的标记细胞百分比(%)(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-tdTomato)(灰点;gydF4y2BangydF4y2Ba= 5个胚胎)或Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-tdTomato)胚胎(红点;n(TAM E8.5) = 7个胚胎)。由本构诱导的标记VP细胞的比例gydF4y2BaPdx1gydF4y2Ba-Cre Tg明显高于tam诱导物gydF4y2BaPdx1gydF4y2Ba-CreERT Tg,与之前的报道一致gydF4y2Ba23gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.均数±标准差。双尾Mann-Whitney检验。gydF4y2BaPgydF4y2Ba= 0.003。gydF4y2BaggydF4y2Ba,标记非vp细胞(即GB、EHBD和LV)在Tg中占总标记细胞的百分比(%)的定量(gydF4y2BaPdx1gydF4y2Bacre;gydF4y2BaR26RgydF4y2Ba-tdTomato)(灰点;gydF4y2BangydF4y2Ba= 5个胚胎)或Tg(gydF4y2BaPdx1gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-tdTomato)胚胎[红点;n(TAM E8.5) = 7个胚胎]。标记的非vp细胞的部分诱导gydF4y2BaPdx1gydF4y2Ba-Cre Tg明显高于tam诱导物gydF4y2BaPdx1gydF4y2Ba-CreERT。均数±标准差。双尾Mann-Whitney检验。gydF4y2BaPgydF4y2Ba= 0.003。gydF4y2BahgydF4y2Ba,柱状图显示左室细胞标记胚胎的百分比(%)gydF4y2BaPdx1gydF4y2Ba-Cre[(5/5), 100%]或tam -诱导gydF4y2BaPdx1gydF4y2Ba-CreERT谱系追踪策略[TAM E8.5:(3/7), 42.9%]。gydF4y2Ba我gydF4y2Ba,模拟gydF4y2BaPdx1gydF4y2Ba-CreERT谱系追踪实验(见补充说明gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba4 dgydF4y2Ba).LV*群体中标记细胞比例(LV总和与LVsp细胞计数之比)gydF4y2BavsgydF4y2Ba.显示了不同标签诱导时间点和重组效率组合的LVs、LVsp、LV和LVp细胞计数之和)。标记LV*的最大分数为21%。标记细胞的比例随着重组效率的提高而增加,这反映了在体内观察到的LV标记细胞的差异gydF4y2BaPdx1gydF4y2Bacre和gydF4y2BaPdx1gydF4y2Ba-CreERT谱系追踪胚胎(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba).对于任何选择的重组效率,标记LV细胞的比例在诱导后的时间点下降,证实了从结果gydF4y2BaPdx1gydF4y2Ba-CreERT谱系追踪实验(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba).具体而言,30ss后的诱导时间点产生的标记LV细胞百分比较低,与重组效率无关。gydF4y2BajgydF4y2Ba,对应于实验设置的三个诱导时间点的模拟(gydF4y2Ba一个gydF4y2Ba)。gydF4y2Ba
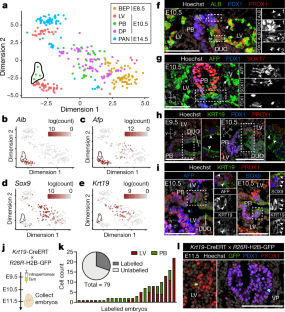
扩展数据图9不同的标记基因特征定义了肝脏和胰胆道亚群。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,所选细胞类型特异性标记基因归一化对数表达值的小提琴图(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba)和编码Fgfr2和Robo-Slit成分的基因(gydF4y2BaegydF4y2Ba)、正则和非正则Wnt (gydF4y2BafgydF4y2Ba)和刺猬信号(gydF4y2BaggydF4y2Ba从本研究中生成的sc-RNA-seq数据集中获得不同祖细胞亚群中的通路。显示了E8.5双能内胚层祖细胞(BEP)、E10.5肝祖细胞(LV)、E10.5中间祖细胞(IMP)和E10.5腹侧胰胆祖细胞(PB细胞)的数据。gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba,标记基因表达投影在t-SNE图上。细胞被投影到t-SNE空间,如gydF4y2BangydF4y2Ba,但通过指示的肝-胰-胆道标记基因的相对表达而不是聚类分配来着色。颜色的梯度从红色(高表达)到灰色(低表达)。用黑线圈出IMP细胞。gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba, E10.5胚胎Sox17(红色)、Pdx1(蓝色)、Sox9[绿色;(gydF4y2BalgydF4y2Ba)], Hnf1β[(绿色);(gydF4y2Ba米gydF4y2Ba)]。右侧面板显示合并时框内区域的更高放大倍率(gydF4y2BalgydF4y2Ba)或单一渠道(gydF4y2Ba米gydF4y2Ba).在gydF4y2BalgydF4y2Ba,箭头标记与十二指肠相邻的细胞(DUO)、LV和PB芽(框状区域),显示低水平的Sox9(绿色)和Pdx1(蓝色)。在(gydF4y2Ba米gydF4y2Ba), Hnf1β在Sox17中富集gydF4y2Ba+gydF4y2Ba但在DUO、LV和PB之间的边界(框区2)低。比例尺为100μm。gydF4y2BangydF4y2Ba不同的肝母细胞和肝间充质细胞基因特征决定了E10.5肝芽的亚群。来自BEP、E10.5 LV、PB、背侧胰腺细胞(DP)和E14.5胰腺细胞(PAN)的sc-RNA-seq的t-SNE图可视化(见图)。gydF4y2Ba3gydF4y2Ba).LV细胞分为两组,分别为LV- a(虚线)和LV- b(实线)。gydF4y2BaogydF4y2Ba, E10.5 LV-A和LV-B亚群体中所选基因平均表达水平的热图。LV-A显示肝母细胞类型的标记物,而LV-B显示肝-间充质混合祖细胞,最近由Lotto等报道。gydF4y2Ba25gydF4y2Ba.两个亚群都表达了gydF4y2BaProx1gydF4y2Ba.gydF4y2BapgydF4y2Ba- - - - - -gydF4y2Ba年代gydF4y2Ba,标记基因表达投影在t-SNE图上。细胞被投影到t-SNE空间,如gydF4y2BangydF4y2Ba,但通过指示的肝间充质杂交祖细胞标记的相对表达来着色。颜色的梯度从红色(高表达)到灰色(低表达)。gydF4y2Ba
图10肝、胰胆祖细胞整合的Sc-RNA-seq数据集。gydF4y2Ba
一个gydF4y2Ba, Li等人公开可用的sc-RNA-seq数据集的t-SNE图可视化。gydF4y2Ba16gydF4y2Ba背侧胰腺细胞[DP;E9.5(30个细胞),E10.5(84个细胞)],腹侧胰胆细胞[PB;E9.5(44个细胞),E10.5(210个细胞)]和肝祖细胞[LV;E10.5 (22 cell)]。细胞根据起源组织(上图)或胚胎阶段(下图)着色。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,标记基因表达投影在t-SNE图上。细胞被投影到t-SNE空间,如gydF4y2Ba一个gydF4y2Ba,并根据指示的肝-胰-胆标记基因的相对表达进行着色。颜色的梯度从红色(高表达)到灰色(低表达)。中间祖细胞(IMP)位于LV和PB簇之间,表现为肝-胰-胆的中间基因标记,用黑色实线圈出。gydF4y2BahgydF4y2Ba, Li等人Seurat积分的t-SNE可视化。gydF4y2Ba16gydF4y2Ba(点)数据集和本研究生成的sc-RNA-seq数据(三角形)(所有数据集合并并缩放在一起)。细胞的颜色由簇标识(左面板;基于基因表达谱相似性的聚类分配)或胚胎阶段(右图)。来自两个数据集的E10.5 PB细胞子集显示了一个中间的肝-胰-胆基因签名,位于LV和PB簇之间(见所述单细胞)。缩写:EP,内分泌祖细胞;锅,胰腺。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba,标记基因表达投影在t-SNE图上。细胞被投影到t-SNE空间,如gydF4y2BahgydF4y2Ba,但被指示的肝-胰-胆标记基因的相对表达着色。颜色的梯度从红色(高表达)到灰色(低表达)。虚线圈表示IMP细胞。gydF4y2BaogydF4y2Ba,点状图显示了在集成数据集中识别的细胞簇中肝-胰-胆道标记基因的子集的表达。点的大小表示每个簇中表达该标记的细胞的百分比,颜色表示平均表达水平。颜色的梯度从蓝色(高表达)到红色(低表达)。gydF4y2BapgydF4y2Ba,与合并数据集中的LV和PB祖细胞相比,IMP细胞中富集基因的生物过程GO术语分析。gydF4y2Ba问gydF4y2Ba- - - - - -gydF4y2Ba年代gydF4y2Ba利用两个整合数据集(不包括原始分析中的DP和E14.5胰腺(PAN)细胞)中的E8.5双能内胚层祖细胞(BEP)、E10.5 LV和PB细胞构建伪时间轨迹。单片眼镜3gydF4y2Ba53gydF4y2Ba将测序细胞排列成以BEP为起始状态,以LV或VP/EP为结束状态的分支轨迹。主要细胞轨迹用UMAP可见,但按细胞簇着色(gydF4y2Ba问gydF4y2Ba),伪时间(gydF4y2BargydF4y2Ba),或显示IMP单元格(gydF4y2Ba年代gydF4y2Ba).这些线与Monocle 3学习的主图相对应。gydF4y2Ba
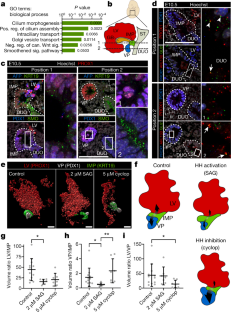
扩展数据图11肝胰胆亚群发育潜力和信号信号特征的扩展描述。gydF4y2Ba
一个gydF4y2Ba,用于中间祖细胞谱系追踪的转基因示意图。gydF4y2BabgydF4y2Ba, E10.0 (29ss)冷冻切片pH3、Pdx1、Prox1(左)和Krt19(右)染色的代表性IF。左右面板显示同一胚胎连续切片的if。二、十二指肠;LV,肝祖细胞(Prox1gydF4y2Ba+gydF4y2Ba);PB,胰胆道祖细胞(Prox1gydF4y2Ba+gydF4y2Ba/ Pdx1gydF4y2Ba+gydF4y2Ba;左面板,白色虚线);IMP (Pdx1gydF4y2Ba+gydF4y2Ba/ Krt19gydF4y2Ba+gydF4y2Ba;右边面板,白色虚线)。比例尺,100μm。gydF4y2BacgydF4y2Ba增殖量化(pH3gydF4y2Ba+gydF4y2Baif染色冷冻切片上E10.0 (29-31ss)背侧胰腺(DP)、LV、PB和IMP结构域(gydF4y2BabgydF4y2Ba).图中显示了pH3的比例gydF4y2Ba+gydF4y2Ba[n(LV, PB, DP) = 4个胚;n(IMP) = 6个胚胎。灰色线连接的样品中pH3gydF4y2Ba+gydF4y2Ba在同一胚胎的连续切片上计数细胞。增殖细胞的大小没有统计学上的显著差异。尽管IMP细胞并不比周围的隔室增殖得更多,但当它们从它们的隔室中退出时,有可能gydF4y2Ba利基市场gydF4y2Ba它们可能被招募到一个假定的过境放大细胞室,并经历增加的分裂轮,例如在皮肤干细胞室中所示gydF4y2Ba58gydF4y2Ba.均数±s.d。双尾Kruskal-Wallis检验和Dunn 's多重比较检验,ns。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,空间表示gydF4y2BaKrt19gydF4y2Ba-CreERT血统追踪实验。E11.5 Tg冷冻切片的IF图像(gydF4y2BaKrt19gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎经Prox1、Pdx1、GFP染色后数字化得到gydF4y2BaxyzgydF4y2Ba- GFP的坐标gydF4y2Ba-gydF4y2Ba(红色)和GFPgydF4y2Ba+gydF4y2Ba(橙色)肝脏(LV)以及绿色荧光蛋白gydF4y2Ba-gydF4y2Ba(蓝色)和绿色荧光蛋白gydF4y2Ba+gydF4y2Ba(绿色)PB细胞gydF4y2Ba44gydF4y2Ba.每幅图都显示了个体Tg(gydF4y2BaKrt19gydF4y2Ba-CreERT;gydF4y2BaR26RgydF4y2Ba-H2B-GFP)胚胎,LV和PB器官域有标记细胞。细胞是根据它们的gydF4y2BaxygydF4y2Ba-(上面板)或gydF4y2BaxzgydF4y2Ba-坐标(下面板)。在不同器官中标记细胞的接近性,如(d, f, g)强烈表明细胞起源于E9.5的共同多能祖细胞。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba, E9.5-E10.5胚胎的代表性冷冻切片进行标记标记染色。在E9.5时,Flrt2和Flrt3在PB芽中共定位,但在后期PB胚中标记出不同的亚群体。在E10.0-E10.5, Flrt2在Pdx1中富集gydF4y2Ba+gydF4y2Ba而Flrt3在Pdx1中富集gydF4y2Ba-gydF4y2Ba胆囊(GB)。Krt19在DUO、LV和PB芽边缘的中间亚群(IMP)中富集。比例尺,100μm。gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba, LV、PB和DUO之间E10.5肠边界的代表性IF图像为指示标记。Shh(绿色)在DUO (gydF4y2BakgydF4y2Ba).Krt19染色(绿色)定义了中交界区gydF4y2BalgydF4y2Ba,包括IMP细胞。右图显示框区Shh合并或单通道的放大倍率较高(gydF4y2BakgydF4y2Ba)及Krt19 (gydF4y2BalgydF4y2Ba)染色。虚线是IMP和DUO之间的边界。用赫斯特染料作核反染色。比例尺,100μm。gydF4y2Ba米gydF4y2Ba, E10.5胚胎神经管纤毛标记物Arl13b和Shh通路成分Smo和Gli2染色的代表性图像。腹侧神经管区(vnt)作为主动Hedgehog信号的阳性对照gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,在初级纤毛处显示高密度的Smo定位(Arl13bgydF4y2Ba+gydF4y2Ba)和Gli2一起(底部面板),而背侧神经管区域(dnt)不存在Gli2gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.插图显示框区1和2的放大倍率较高,箭头表示在vnt中初级纤毛子集尖端的Gli2和Arl13b共定位。gydF4y2BangydF4y2BaE10.5肝-胰-胆道区Arl13b(左)和Smo(右)的IF。DUO、PB和IMP由白虚线勾勒。用赫斯特染料作核反染色。Smo的密度gydF4y2Ba+gydF4y2Ba初生纤毛在DUO和IMP芽细胞中较高,而在PB芽中较低。比例尺,10μm。gydF4y2BaogydF4y2Ba, Arl13b(左红色)和Smo(右红色)的IF显示DP中缺乏Hedgehog信号(即没有纤毛Smo信号),由E-cadherin (Ecad;绿色)。右边的面板显示了更高的放大框区域为灰色尺度的指示通道。用赫斯特染料作核反染色。比例尺,100μm。gydF4y2BapgydF4y2Ba如先前发表的,IF染色显示肺、vnt和脊索(nc)中有大量的Shh(绿色)gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.用赫斯特染料作核反染色。比例尺,100μm。gydF4y2Ba问gydF4y2Ba- - - - - -gydF4y2BatgydF4y2Ba的表达,t-SNE图gydF4y2BaFlrt2gydF4y2Ba(gydF4y2Ba问gydF4y2Ba),gydF4y2BaFlrt3gydF4y2Ba(gydF4y2BargydF4y2Ba),gydF4y2BaRobo2gydF4y2Ba(gydF4y2Ba年代gydF4y2Ba),gydF4y2BaIft57gydF4y2Ba(gydF4y2BatgydF4y2Ba)在我们的sc-RNA-Seq数据集中。颜色的梯度从红色(高表达)到灰色(低表达)。gydF4y2Ba
图12建立腹前肠外植体作为体外调控Hedgehog信号通路的模型系统。gydF4y2Ba
一个gydF4y2Ba, E9.5小鼠胚胎腹前肠外植体收集和培养的实验工作流程示意图。白色虚线表示用于体外培养的后腹前肠和前中肠(包含肝和胰胆道器官萌芽)显微解剖的切口位置。gydF4y2BabgydF4y2Ba, Prox1、Pdx1和Krt19染色的全安装前肠外植体的代表性3D图像。Prox1标记肝脏(LV;红色),Prox1/Pdx1胰腺(VP;Prox1/Krt19中间祖基因(IMP;绿色)域。外植体用2μM平滑激动剂(SAG)或5μM KAAD-cyclopamine处理24h或不处理(对照)。顶部面板以3D投影模式显示原始数据。中间是Prox1gydF4y2Ba+gydF4y2Ba使用Imaris (Bitplane)中的手工表面创建工具突出显示组织,以量化不同的肝-胰-胆器官域的体积。底部面板显示了使用Imaris (Bitplane)中的手动阈值自动曲面创建工具生成和量化的不同器官域的3D效果图。比例尺,100μm。gydF4y2BacgydF4y2Ba, Prox1(红色)、Pdx1(白色)和Krt19(绿色)(左图)腹侧前肠外植体全挂置IF的代表性图像。抗体洗脱后,再次染色Pdx1(白色)、Sox17(红色)、Cdx2(绿色),标记胆囊(GB;Pdx1gydF4y2Ba-gydF4y2Ba/ Sox17gydF4y2Ba+gydF4y2Ba;白色虚线)和肠(Cdx2gydF4y2Ba+gydF4y2Ba)(右面)。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba, SAG处理后腹前肠外植体中不同器官域体积的量化(对照,gydF4y2BangydF4y2Ba= 12;2μM凹陷,gydF4y2BangydF4y2Ba= 7)。图中显示LV/GB (gydF4y2BadgydF4y2Ba), gb / imp (gydF4y2BaegydF4y2Ba),或GB/VP (gydF4y2BafgydF4y2Ba)体积比。平均±s.d。SAG导致GB/IMP体积比降低[(e);双尾Mann-Whitney检验;gydF4y2BaPgydF4y2Ba= 0.01)。gydF4y2BaggydF4y2Ba, E10.5小鼠胚胎中肝-胰-胆区示意图。PB芽包含一个与左室和十二指肠接壤的IMP结构域(绿色),并从周围的上皮组织和间充质组织接收不同的信号信号(绿色、红色、蓝色箭头)。该区域内的细胞在器官发生过程中表现出延长的细胞命运可塑性(E8.5-E11.5),并保留了对胰芽(蓝色)、GB(橙色)和LV(红色)贡献的独特能力(黑色箭头)。左侧列出了涉及肝-胰脏-胆道发育的不同祖细胞结构域和信号通路的标记。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
此文件包含补充文本、补充注释1(数学模型描述)、补充注释2 (Tg(Prox1-rtTA)转基因小鼠系的生成)和补充参考文献gydF4y2Ba
41586 _2021_3844_moesm3_esm.xlsxgydF4y2Ba
补充表1gydF4y2Ba模型中所考虑的细胞群的描述gydF4y2Ba.包括数学模型中考虑的细胞群的描述,它们的首字母缩略词,以及与图1相关的归因于表型标记的表格,扩展数据图3,补充注释1。gydF4y2Ba
41586 _2021_3844_moesm4_esm.xlsxgydF4y2Ba
补充表2gydF4y2Ba模型A和模型B的实验数据和细胞群的总和gydF4y2Ba.模型A和模型B的实验数据及其对应的细胞群总和。gydF4y2Ba
41586 _2021_3844_moesm5_esm.xlsxgydF4y2Ba
补充表3gydF4y2Ba模型C和D的实验数据和细胞群的总和gydF4y2Ba.C、D两种模型的实验数据及其对应的细胞居群总和。gydF4y2Ba
41586 _2021_3844_moesm8_esm.xlsxgydF4y2Ba
补充表6gydF4y2Ba扩展模型D的初始条件和细胞计数在标记诱导时间点的重新分配gydF4y2Ba.表描述了扩展模型D中每个群体的初始细胞数量,以及在标记诱导时间点细胞群体中细胞重新分布到峰值的速率。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
威尔诺,D.,贝纳利,U.,马吉尼亚努,A.。gydF4y2Baet al。gydF4y2Ba定量谱系分析确定了肝-胰脏-胆道祖细胞生态位。gydF4y2Ba自然gydF4y2Ba597gydF4y2Ba, 87-91(2021)。https://doi.org/10.1038/s41586-021-03844-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-021-03844-1gydF4y2Ba
这篇文章被引用gydF4y2Ba
腹前肠的扩张与器官特异性分化增强子景观的变化有关gydF4y2Ba
自然细胞生物学gydF4y2Ba(2023)gydF4y2Ba
Jag1-Notch的顺式相互作用决定了胰腺发育中的细胞命运分离gydF4y2Ba
自然通讯gydF4y2Ba(2023)gydF4y2Ba
使用小鼠发育的单细胞图谱系统识别细胞命运调节程序gydF4y2Ba
自然遗传学gydF4y2Ba(2022)gydF4y2Ba
连接过去和现在:单细胞谱系追踪gydF4y2Ba
蛋白质与细胞gydF4y2Ba(2022)gydF4y2Ba
CRISPR筛选揭示了HHEX在胰腺谱系承诺和可塑性限制中的核心要求gydF4y2Ba
自然细胞生物学gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba
