摘要gydF4y2Ba
哺乳动物胚胎发生需要快速生长和适当的代谢调节gydF4y2Ba1gydF4y2Ba.妊娠中期的特点是随着胎儿器官发育而增加氧气和营养可用性gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba.了解代谢如何支持发育需要直接观察子宫内模式生物的代谢。在这里,我们使用同位素示踪和代谢组学来确定小鼠妊娠中期胎盘和胚胎中进化的代谢程序。这些组织在整个妊娠中期的代谢上存在差异,但我们将妊娠日(GD) 10.5-11.5确定为胎盘和胚胎的过渡期。同位素示踪显示,组织间碳水化合物代谢和快速葡萄糖依赖嘌呤合成的差异,特别是在胚胎中。葡萄糖对三羧酸(TCA)循环的贡献在胚胎的整个妊娠中期上升,但在胎盘中没有。到GD12.5时,胚胎内明显出现区室化代谢程序,包括不同器官对TCA循环的不同营养贡献。为了研究与孟德尔代谢缺陷相关的发育异常,我们分析了缺乏LIPT1的小鼠,LIPT1是激活与TCA循环相关的2-酮酸脱氢酶的酶gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba.在GD10.5-GD11.5过渡期间,LIPT1缺失抑制TCA循环代谢,干扰大脑、心脏和红细胞发育,导致GD11.5导致胚胎死亡。这些数据记录了子宫内发育器官的个性化代谢程序。gydF4y2Ba
主要gydF4y2Ba
代谢通过为能量生产、合成代谢、基因表达的表观遗传调节和告知胚胎模式的代谢梯度的形成提供代谢中间体来支持组织发育gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.着床后胚胎和胎盘最初在相对缺氧状态下发育gydF4y2Ba9gydF4y2BaO (1 - 5%gydF4y2Ba2gydF4y2Ba).在此期间,胎盘和胚胎都需要缺氧诱导的基因表达程序,破坏这些途径或延长暴露于缺氧会导致细胞不适当的分化和过早的致死率gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2BaGD10左右。妊娠中期的标志是随着胎儿红细胞生成的开始和胎盘和胚胎中血管系统的成熟,从母体循环中转移的营养物质和氧气增加。这一时期的特点是胎盘和胚胎的加速生长,以及心脏、大脑和肝脏的形态发生gydF4y2Ba2gydF4y2Ba,gydF4y2Ba13gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba),两者都表明妊娠中期是一个代谢动态时期。代谢的遗传和环境改变导致人类发育缺陷gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba尽管许多此类异常的机制尚不清楚。以前对小鼠胚胎代谢的分析大多依赖于离体模型,或间接从遗传功能丧失实验的发育后果推断代谢需求gydF4y2Ba1gydF4y2Ba.我们开始在妊娠中期直接观察体内完整胎儿胎盘单位的代谢,以确定代谢转变并测试扰动它们的影响。gydF4y2Ba
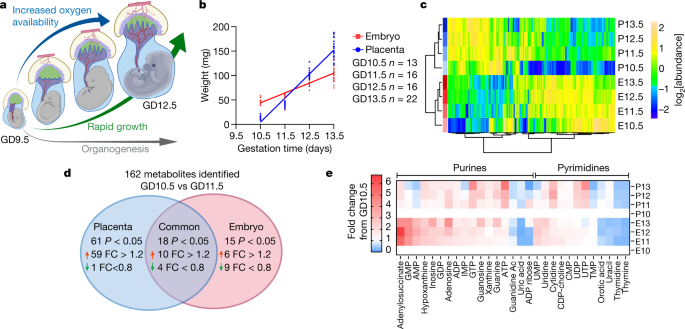
一个gydF4y2Ba怀孕中期是一个动态发展的时期。gydF4y2BabgydF4y2Ba, 13.6±3.8周龄怀孕母体的组织重量。gydF4y2BacgydF4y2Ba,代谢组学数据组平均热图。gydF4y2BadgydF4y2Ba,代谢物gydF4y2BaPgydF4y2Ba在GD10.5和GD11.5之间,褶皱变化(FC) >为1.2或< 0.8。gydF4y2BaegydF4y2Ba,嘌呤和嘧啶的热图,绘制为相对于GD10.5的折叠变化。统计检验:直线最小二乘拟合,然后是额外的平方和gydF4y2BaFgydF4y2Ba以及(gydF4y2BabgydF4y2Ba);学生的gydF4y2BatgydF4y2Ba测试(gydF4y2BadgydF4y2Ba).数据为均数±标准差。统计检验为双侧。胍Ac,乙酸胍;IMP,肌苷单磷酸(其他缩写,补充表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
在GD10.5处有明显的代谢转变gydF4y2Ba
在小鼠中,胎盘开始形成gydF4y2Ba2gydF4y2Ba在GD3.5时,从胚胎中轻易剥离胎盘是可能的。为了描述妊娠中期的代谢特征,我们从GD10.5到GD13.5的初孕C57BL/6J坝中收集胚胎和胎盘,并进行代谢组学研究。在此期间,胎盘和胚胎的组织质量迅速增加(图2)。gydF4y2Ba1 bgydF4y2Ba).胎盘和胚胎代谢组学在整个妊娠中期都是不同的,正如预期的那样,因为它们的细胞组成和功能不同。gydF4y2Ba1 cgydF4y2Ba扩展数据图gydF4y2Ba1gydF4y2Ba).在这两种组织中,GD10.5与随后几天的代谢不同,表明GD10.5与GD11.5之间的过渡(图5)。gydF4y2Ba1 cgydF4y2Ba扩展数据图gydF4y2Ba1gydF4y2Ba).这些转变在胚胎和胎盘之间很大程度上是不同的,大多数代谢物在一个组织中发生变化,而在另一个组织中没有变化(图2)。gydF4y2Ba1 dgydF4y2Ba扩展数据图gydF4y2Ba2模拟gydF4y2Ba).代谢集过度代表分析(MSOA)确定了GD10.5和GD11.5之间胎盘中发生变化的许多途径,特别是与氮和氨基酸代谢相关的途径(扩展数据图)。gydF4y2Ba二维gydF4y2Ba).在GD11.5时,胎盘中尿素循环相关代谢产物突然但短暂地增加(扩展数据图)。gydF4y2Ba2 egydF4y2Ba),可能反映了精氨酸在刺激胎盘-胎儿血液流动中的作用gydF4y2Ba17gydF4y2Ba.在胚胎中,GD10.5和GD11.5之间的MSOA将嘌呤和嘧啶代谢确定为两个得分最高的途径(扩展数据图)。gydF4y2Ba2摄氏度gydF4y2Ba).大多数嘌呤在胚胎中GD10.5后表现出持续的增加,而嘧啶在两种组织中几乎没有变化或减少(图5)。gydF4y2Ba1 egydF4y2Ba).gydF4y2Ba
子宫内快速和局部的代谢gydF4y2Ba
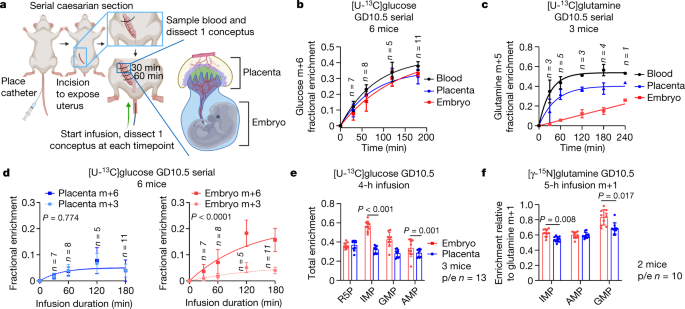
为了评估子宫内代谢物的周转,我们采用了以前的方法gydF4y2Ba18gydF4y2Ba注入均匀标记[gydF4y2Ba13gydF4y2Ba(U - C]葡萄糖(gydF4y2Ba13gydF4y2BaC .葡萄糖)注入GD10.5的孕鼠体内。胚胎和相邻胎盘每30分钟切除一次,同时保持子宫血流,以便从动力学上评估营养运输和代谢(图2)。gydF4y2Ba2gydF4y2Ba).该分析揭示了在母体血液、胎盘和胚胎中的快速标记,表明葡萄糖从母体循环到胚胎的有效转移,正如预期的那样(图2)。gydF4y2Ba2 bgydF4y2Ba).相比之下,胚胎谷氨酰胺从[U-gydF4y2Ba13gydF4y2BaC .孕妇血液循环中的谷氨酰胺。gydF4y2Ba2摄氏度gydF4y2Ba),表明不同营养物质的转运动力学不同。gydF4y2Ba
一个gydF4y2Ba,连续剖腹产手术。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,时间依赖性富集[U-gydF4y2Ba13gydF4y2BaC]葡萄糖(gydF4y2BabgydF4y2Ba)和[U-gydF4y2Ba13gydF4y2BaC]谷氨酰胺(gydF4y2BacgydF4y2Ba).gydF4y2BadgydF4y2Ba,连续剖宫产输注时主要葡萄糖-6-磷酸同位素。gydF4y2BaegydF4y2Ba,总富集(1−未标记)从[U-gydF4y2Ba13gydF4y2BaC]葡萄糖。gydF4y2BafgydF4y2Ba, M+1富集于[γ-]嘌呤中gydF4y2Ba15gydF4y2BaN]谷氨酰胺。gydF4y2Ba15gydF4y2Ban -谷氨酰胺富集被归一化为谷氨酰胺m+1,以解释不同区室之间的差异(见图。gydF4y2Ba2摄氏度gydF4y2Ba).统计检验:平稳期,单相衰减最小二乘拟合,霍尔姆-西达克多重比较调整(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba) (gydF4y2BabgydF4y2Ba:胚胎vs胎盘gydF4y2BaPgydF4y2Ba= 0.09,胚胎vs血液gydF4y2BaPgydF4y2Ba= 0.0001,胎盘vs血液gydF4y2BaPgydF4y2Ba= 0.003;gydF4y2BacgydF4y2Ba:胚胎vs胎盘gydF4y2BaPgydF4y2Ba< 0.0001,胚胎vs血液gydF4y2BaPgydF4y2Ba< 0.0001,胎盘vs血液gydF4y2BaPgydF4y2Ba< 0.0001);配对gydF4y2BatgydF4y2Ba-检验或Wilcoxon配对符号秩检验,然后是Holm-Sidak的多重比较调整(gydF4y2BaegydF4y2Ba);日志gydF4y2Ba2gydF4y2Ba配对gydF4y2BatgydF4y2Ba-测试,然后是Holm-Sidak的多重比较调整(gydF4y2BafgydF4y2Ba).数据为均数±标准差。统计检验为双侧。p / e、胎盘/胚胎。gydF4y2Ba
下游代谢物的快速标记表明概念中的稳健代谢,胚胎和胎盘中不同的标记特征表明组织之间的代谢差异。水平的gydF4y2Ba13gydF4y2BaC在葡萄糖代谢产物中的富集反映了标记物和未标记物通过交叉途径的共同贡献(扩展数据图)。gydF4y2Ba3gydF4y2Ba).葡萄糖-6-磷酸(G6P)在胚胎中以m+6的形式迅速出现,表明从母体葡萄糖转化而来(图6)。gydF4y2Ba二维gydF4y2Ba).然而,在同一只小鼠中,胎盘G6P的标记不同。总体上G6P富集低于胚胎,G6P m+6和m+3出现在相似的时间尺度上(图2)。gydF4y2Ba二维gydF4y2Ba).对碳水化合物代谢的全面了解需要对区室特异性酶进行敲除,但胎盘标记模式表明,糖原分解、糖异生和先前在哺乳动物胎盘中报道的其他途径对碳水化合物代谢有贡献gydF4y2Ba19gydF4y2Ba(扩展数据图。gydF4y2Ba3gydF4y2Ba).gydF4y2Ba
磷酸戊糖通路中间体和核苷酸前体核糖-5-磷酸(R5P)也迅速翻转。R5P与G6P相似,标记分布在几个同位素中,完全标记的R5P (m+5)是胚胎中主要的标记形式,而不是胎盘(扩展数据图)。gydF4y2Ba3 b, cgydF4y2Ba).4小时后,嘌呤在胎盘和胚胎中被广泛标记,但在胚胎中标记率更高(图2)。gydF4y2Ba2 egydF4y2Ba扩展数据图gydF4y2Ba3 d-fgydF4y2Ba).总富集(即1.0 -未标记的部分,包括所有gydF4y2Ba13gydF4y2Bac标记形式)在所有嘌呤分析中均高于0.3,这表明在4小时内,至少30%的胚胎嘌呤库含有来自母体循环的碳(图2)。gydF4y2Ba2 egydF4y2Ba).虽然大部分嘌呤标记似乎来自R5P,但胚胎中也含有嘌呤碱基gydF4y2Ba13gydF4y2BaC;碱基标记的证据包括嘌呤总标记量高于R5P(图5)。gydF4y2Ba2 egydF4y2Ba),且存在肌苷单磷酸,GMP和AMP含五种以上gydF4y2Ba13gydF4y2BaC核(扩展数据图。gydF4y2Ba3 d-fgydF4y2Ba).在嘌呤池扩大的情况下(图。gydF4y2Ba1 egydF4y2Ba)和广泛的丝氨酸和甘氨酸标记(扩展数据图。gydF4y2Ba3 ggydF4y2Ba),这些数据指向胚胎中嘌呤的从头合成。作为一种正交标记方法,我们注入怀孕小鼠[γ-gydF4y2Ba15gydF4y2BaN]谷氨酰胺。在从头合成过程中,标记的氮被并入嘌呤环。同样,在胚胎中检测到较高的单磷酸肌苷和GMP相对富集(图。gydF4y2Ba2 fgydF4y2Ba).嘧啶也被标记为[U-gydF4y2Ba13gydF4y2BaC .葡萄糖和[γ-]gydF4y2Ba15gydF4y2BaN]谷氨酰胺,但胚胎和胎盘之间的差异不太一致(扩展数据图。gydF4y2Ba3 h,我gydF4y2Ba).总的来说,这些数据表明妊娠中期代谢迅速,包括对母体葡萄糖和谷氨酰胺对胚胎嘌呤的显著利用,以及胚胎和胎盘之间代谢标记的独特模式。gydF4y2Ba
分隔的胚胎代谢gydF4y2Ba
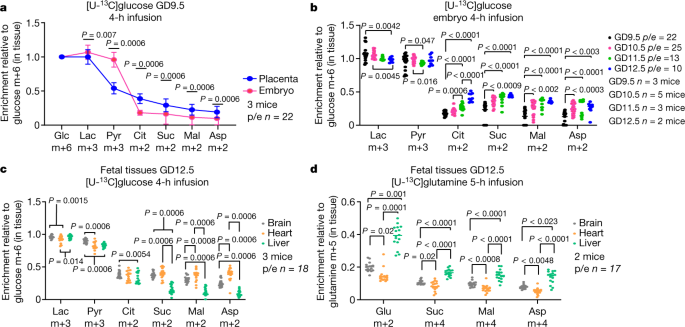
血运化、红细胞生成和心功能增加gydF4y2Ba2gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba预测妊娠中期胚胎氧化代谢增强。我们表演了[U-]gydF4y2Ba13gydF4y2BaC .葡萄糖输注在GD9.5和GD12.5之间,当氧气水平增加时gydF4y2Ba9gydF4y2Ba.在GD9.5,胎盘显示出比胚胎更高的三羧酸(TCA)循环中间产物的标记(图5)。gydF4y2Ba3gydF4y2Ba).在接下来的3天里,胎盘TCA周期中间产物的标记变化很小,但胚胎中间产物的标记增加,以至于到GD12.5时,胚胎的标记与胎盘的相似或更高(图5)。gydF4y2Ba3 bgydF4y2Ba扩展数据图gydF4y2Ba4 a、bgydF4y2Ba).柠檬酸m+2/丙酮酸m+3比值报告了标记的二碳单位通过丙酮酸脱氢酶(PDH)从葡萄糖转移到柠檬酸,而柠檬酸m+3/丙酮酸m+3比值报告了标记的三碳单位通过丙酮酸羧化酶转移。在所有的日子里,在两个组织中,柠檬酸m+2/丙酮酸m+3超过柠檬酸m+3/丙酮酸m+3,表明丙酮酸主要通过PDH进入TCA循环(扩展数据图)。gydF4y2Ba4 c, dgydF4y2Ba).在胚胎中,这两种比例在GD9.5和GD12.5之间都有所增加,但在胎盘中没有,胎盘的标记量略有下降。这些数据表明,丙酮酸在胚胎和胎盘中的氧化时间不同,在胚胎中滞后几天。gydF4y2Ba
一个gydF4y2Ba,富集归一化至葡萄糖m+6。gydF4y2BabgydF4y2Ba,从[U- .gydF4y2Ba13gydF4y2BaC . GD9.5和GD12.5之间的葡萄糖。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,器官特异性富集在GD12.5。统计检验:成对gydF4y2BatgydF4y2Ba-测试,然后是Holm-Sidak的多重比较调整(gydF4y2Ba一个gydF4y2Ba);Kruskal-Wallis检验后Dunn多重比较调整或单因素方差分析后Tukey多重比较调整(gydF4y2BabgydF4y2Ba);线性混合效应分析,然后采用Holm-Sidak多重比较调整(gydF4y2BacgydF4y2Ba,组织间比较);或Welch的单向方差分析,然后Dunnett’s T3多重比较调整或Kruskal-Wallis检验,然后Dunn’s多重比较调整(gydF4y2BadgydF4y2Ba).数据为均数±标准差。统计检验为双侧。Asp,天冬氨酸;Cit,柠檬酸;相关,葡萄糖;虫胶,乳酸;发作,苹果酸;Pyr,丙酮酸;往下,琥珀酸。gydF4y2Ba
胚胎中葡萄糖对TCA循环贡献的增加可能反映了肝脏、心脏和大脑等氧化器官的发育。为了评估与线粒体功能相关的基因表达特征,我们分析了ENCODE门户网站的polyA + RNAseq数据gydF4y2Ba21gydF4y2Ba从GD10.5-GD13.5的这些器官中这表明在此期间电子传递链(ETC)相关转录本丰度增加,特别是在心脏(扩展数据图)。gydF4y2Ba4 egydF4y2Ba).相比之下,胎盘中大多数etc相关转录物在妊娠中期下降(扩展数据图。gydF4y2Ba4 ggydF4y2Ba).然后我们表演了[U-gydF4y2Ba13gydF4y2BaC .葡萄糖注入并分析了大脑、心脏和肝脏的标记。在GD12.5上,TCA循环中间产物在大脑和心脏中显示出一致的高标记,而在肝脏中显示出较少的标记(图5)。gydF4y2Ba3 cgydF4y2Ba).在妊娠中期,心脏中柠檬酸和丙酮酸标记的比例增加,对应于ETC亚单位表达的增强(扩展数据图。gydF4y2Ba4 e, fgydF4y2Ba);这是值得注意的,因为心脏发育需要增加氧合和减少HIF1α的表达gydF4y2Ba2gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.我们还注入了[U-gydF4y2Ba13gydF4y2BaC .谷氨酰胺来评估替代燃料的新陈代谢。相对于[U- .gydF4y2Ba13gydF4y2BaC .葡萄糖,输注[U-。gydF4y2Ba13gydF4y2BaC .与大脑或心脏相比,谷氨酰胺导致GD12.5肝脏代谢产物的标记更高。gydF4y2Ba3 dgydF4y2Ba).动力学实验显示,在每个器官中谷氨酰胺标记一致,但在整个时间过程中,肝脏中的谷氨酸标记较高(扩展数据图)。gydF4y2Ba4 hgydF4y2Ba).这些数据表明了胚胎器官发育过程中燃料代谢的不同模式。gydF4y2Ba
LIPT1促进发育代谢gydF4y2Ba
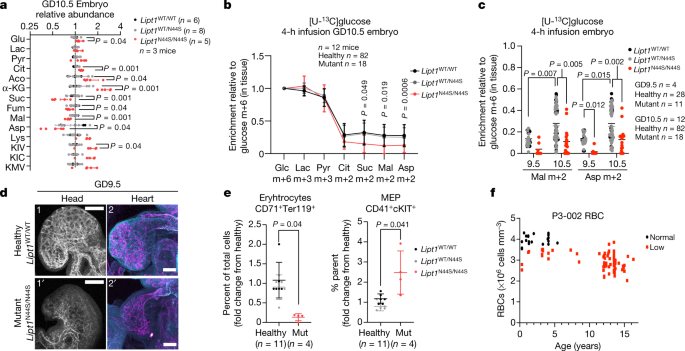
为了测试妊娠中期氧化代谢增强的重要性,我们检测了子宫内脂酰转移酶-1 (LIPT1)缺乏的影响。LIPT1将必需的硫酸辅因子转移到与TCA循环相关的线粒体2-酮酸脱氢酶上,包括PDH、α-酮戊二酸脱氢酶(AKGDH)、支链酮酸脱氢酶(BCKDH)和2-氧己二酸脱氢酶gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba.我们报道了一例具有致病性LIPT1变异(N44S和S292X)的复合杂合性患者,其表型为神经发育障碍和癫痫gydF4y2Ba5克ydF4y2Ba.N44S变异的小鼠纯合子在GD10.5处检测到接近预期孟德尔比,但在GD11.5处检测不到,这表明在这段时间内发生了胚胎致死gydF4y2Ba5克ydF4y2Ba.gydF4y2BaLipt1gydF4y2BaWT / N44SgydF4y2Ba老鼠是健康的,按预期的频率出生gydF4y2Ba5克ydF4y2Ba有相似的代谢特征gydF4y2BaLipt1gydF4y2BaWT / WTgydF4y2BaGD10.5的胚胎(图;gydF4y2Ba4gydF4y2Ba扩展数据图gydF4y2Ba5gydF4y2Ba),所以我们分组gydF4y2BaLipt1gydF4y2BaWT / WTgydF4y2Ba而且gydF4y2BaLipt1gydF4y2BaWT / N44SgydF4y2Ba在统计分析中被称为“健康”。gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba概念是可行的,但在GD10.5上很小(扩展数据图。gydF4y2Ba5 bgydF4y2Ba).GD10.5,gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba概念的代谢组学模式与缺乏脂酰化和TCA循环相一致。胎盘和胚胎中α-酮戊二酸的积累明显导致AKGDH缺陷;AKGDH下游产物的耗竭也发生在胚胎中(图。gydF4y2Ba4gydF4y2Ba扩展数据图gydF4y2Ba5度gydF4y2Ba).与2-酮酸脱氢酶功能障碍相关的其他异常包括赖氨酸和支链酮酸的积累,特别是在胚胎中(图2)。gydF4y2Ba4gydF4y2Ba扩展数据图。gydF4y2Ba5度gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,所示基因型胚胎中的相关代谢物。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,从[U- .gydF4y2Ba13gydF4y2BaC]葡萄糖。gydF4y2BadgydF4y2Ba,头部内皮细胞PECAM1和endoucin染色(1和1 ';scale bar, 200 μm),心脏内皮细胞PECAM1、endoucin(洋红色)和connecnexin 40(青色)染色(2和2′;比例尺,100 μm)。图像代表了gydF4y2BangydF4y2Ba= 3个水坝,胚胎数量如下:gydF4y2BaLipt1gydF4y2BaWT / WTgydF4y2Ba(gydF4y2BangydF4y2Ba= 5),gydF4y2BaLipt1gydF4y2BaWT / N44SgydF4y2Ba(gydF4y2BangydF4y2Ba= 4),gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba(n = 8)。gydF4y2BaegydF4y2Ba,用CD71、TER119、CD41和c-Kit抗体染色的游离GD10.5全胚细胞的定量。红细胞表达CD71和TER119,骨髓-红系祖细胞(MEP)表达CD41和c-Kit。'% parent'表示CD71的比例gydF4y2Ba- - - - - -gydF4y2BaTER119gydF4y2Ba- - - - - -gydF4y2BaCD41染色的细胞gydF4y2Ba+gydF4y2Bac - kitgydF4y2Ba+gydF4y2Ba.gydF4y2BafgydF4y2Ba, lipt1缺乏患者的红细胞纵向测量。统计检验:学生的gydF4y2BatgydF4y2Ba测试(gydF4y2Ba一个gydF4y2Ba);日志gydF4y2Ba2gydF4y2Ba-变换,然后是Holm-Sidak多重比较调整(gydF4y2BabgydF4y2Ba);Mann-Whitney检验及Holm-Sidak多重比较调整(gydF4y2BaegydF4y2Ba);Kruskal-Wallis检验,然后是Dunn的多重比较调整(gydF4y2BacgydF4y2Ba).数据为±s.d。统计检验为双侧。α公斤,α酮戊二酸;Aco,顺乌头酸酶;嬉笑,延胡索酸酯;赖氨酸、赖氨酸;KIV a-ketoisovalerate;断裂韧性,α-ketoisocaproate;KMV,α酮-β-methylvalerate。gydF4y2Ba
接下来,我们在GD9.5和GD10.5的怀孕大坝中进行了注入,首先评估的能力gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胎盘吸收营养并将其转移给胚胎。gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胎盘在吸收[U-]方面无缺陷gydF4y2Ba13gydF4y2BaC .葡萄糖或[U-]gydF4y2Ba13gydF4y2BaC .从母体循环或转移到胚胎的谷氨酰胺标签(扩展数据图。gydF4y2Ba5 d, egydF4y2Ba).胎盘分化标记在健康和Lipt1之间基本保守gydF4y2BaN44S / N44SgydF4y2Ba胎盘(扩展数据图。gydF4y2Ba5 fgydF4y2Ba).由此,我们得出结论,尽管LIPT1缺乏改变了胎盘代谢,但胎盘功能障碍并不是致死性的主要原因gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胚胎。gydF4y2Ba
我们还研究了LIPT1缺失在GD9.5和GD10.5时对TCA循环标记的影响。gydF4y2Ba4 b, cgydF4y2Ba扩展数据图gydF4y2Ba5克gydF4y2Ba),就在死亡点之前。gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胚胎代谢活跃,在丙酮酸或乳酸标记中与健康胚胎难以区分gydF4y2Ba13gydF4y2Ba比较(图gydF4y2Ba4 bgydF4y2Ba).然而,TCA循环标记被抑制gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba组织,特别是AKGDH下游,在GD9.5和GD10.5(图5)。gydF4y2Ba4 b, cgydF4y2Ba扩展数据图gydF4y2Ba5克gydF4y2Ba).因此,gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胚胎在妊娠中期死亡前不会诱导TCA周期标记。gydF4y2Ba
最后,我们评估了这些胚胎的发育情况。在GD9.5时,基因型之间的体细胞计数无法区分(扩展数据图)。gydF4y2Ba6gydF4y2Ba).血管最初的形成和形态是正常的,血管遍及全身gydF4y2BaLipt1gydF4y2BaN44S / N44SgydF4y2Ba胚胎(扩展数据图。gydF4y2Ba6 bgydF4y2Ba).通过流量响应标记物Connexin 40评估的血管成熟度也正常(扩展数据图)。gydF4y2Ba6 bgydF4y2Ba).然而,突变体的大脑和心脏都更小。gydF4y2Ba4 dgydF4y2Ba扩展数据图gydF4y2Ba6 bgydF4y2Ba).我们还通过使用细胞表面标记对分离胚胎的细胞进行流式细胞术来评估红细胞的生成。我们观察到CD71的丰度下降gydF4y2Ba+gydF4y2BaTER119gydF4y2Ba+gydF4y2Ba胎儿红细胞和CD41丰度增加gydF4y2Ba+gydF4y2Bac - kitgydF4y2Ba+gydF4y2Ba骨髓-红系祖细胞gydF4y2BaLIPT1gydF4y2BaN44S / N44SgydF4y2Ba胚胎,提示红细胞分化受损(图;gydF4y2Ba4 egydF4y2Ba,扩展数据图。gydF4y2Ba6gydF4y2Bac, d,gydF4y2Ba7gydF4y2Ba).为了检验这一观察结果的人类相关性,我们回顾了我们的lipt1缺陷患者15年的临床记录,发现她患有慢性,原因不明的贫血(图2)。gydF4y2Ba4 fgydF4y2Ba),尽管铁、叶酸和维生素B12水平正常。她的血小板和白细胞计数被保存(扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba),表明红系血统中有一种特殊的缺陷。gydF4y2Ba
结论gydF4y2Ba
代谢缺陷和暴露于代谢抑制剂gydF4y2Ba16gydF4y2Ba可导致人类先天性异常,强调在胎儿发育期间精确的代谢控制的重要性。虽然资源存在评估基因表达和表观遗传特征在整个发展gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba了解代谢缺陷的发育后果将受益于直接评估子宫内代谢的方法。在这篇文章中,我们报道了妊娠中期胎盘和胚胎的代谢特征,这两个组织都经历了广泛但很大程度上不同的变化。代谢差异与快速生长的要求一致,这些组织的细胞组成显著不同,细胞环境不断变化。G6P和其他代谢物的区室特异性标记差异表明局部的胎盘碳水化合物代谢可能对胚胎糖代谢没有直接影响,并且在每个区室如何满足其生长需求方面可能存在差异。在胚胎中,葡萄糖提供糖酵解、磷酸戊糖途径和不断扩大的嘌呤库,所有这些都在母体循环中被葡萄糖迅速标记。gydF4y2Ba
母体来源的营养物质对胚胎TCA周期的贡献随着妊娠中期超过GD9.5的进展而增加gydF4y2Ba26gydF4y2Ba.因此,我们试图检查中断这一过程的人类基因组变异的代谢效应。LIPT1激活负责向TCA循环提供呼吸底物的多种酶,人类LIPT1缺乏会导致包括大脑在内的氧化器官发育异常。在小鼠中,我们发现LIPT1对于GD10.5以后发育所必需的线粒体代谢的精确时间变化是必需的;在野生型的TCA循环标记增加后,LIPT1突变体持续约一天,然后死亡。胚胎死亡包括组织发育延迟或缺陷,如心脏,在妊娠期间丙酮酸氧化增强,红细胞的发育需要线粒体功能gydF4y2Ba27gydF4y2Ba.值得注意的是,丙酮酸的代谢命运已被建议在某些情况下告知发育,与干细胞扩张和分化相关的TCA循环中的氧化有关的持续转化为乳酸盐gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.观察个体胚胎器官水平上的代谢途径可以提供一种有效的方法来识别支持时空发育程序的途径。gydF4y2Ba
方法gydF4y2Ba
材料gydF4y2Ba
材料的获取方法如下:[U-gydF4y2Ba13gydF4y2BaC]葡萄糖(Cambridge isotope, CLM-1396), [U-gydF4y2Ba13gydF4y2BaC]谷氨酰胺(剑桥同位素,CLM-1822), C57BL/6J (UTSW小鼠育种核心或Jackson实验室)和gydF4y2BaLipt1gydF4y2BaN44SgydF4y2Ba敲入小鼠(内部开发)gydF4y2Ba5克ydF4y2Ba.gydF4y2Ba
受试者信息和临床资料gydF4y2Ba
lipt1缺失的个体,在图中提供临床数据。gydF4y2Ba4 fgydF4y2Ba扩展数据图gydF4y2Ba6 e, fgydF4y2Ba前面已经介绍过了gydF4y2Ba5克ydF4y2Ba.该患者参与了一项前瞻性、非随机、非盲性观察性研究,其首要目标是在任何年龄的患者中发现新的代谢疾病相关基因,并表征这些患者的代谢表型(NCT02650622)。该研究得到了德克萨斯大学西南医学中心(UTSW)的机构审查委员会(IRB)的批准,并获得了患者父母的书面知情同意。符合研究条件的患者及其家庭成员在UTSW、其附属医院和其他合作医院确定。入组后,研究对象为代谢组学和基因组学提供血液,基于研究的数据综合分析可以优先考虑潜在致病的基因组变异,在实验室进行功能分析。该研究是纯粹的观察性研究,没有提出任何治疗干预措施,尽管对患者进行了纵向随访,以了解每种疾病的自然史和作为常规临床护理一部分的治疗措施的效果。计划共纳入超过1500例患者,目的是代表队列中的许多罕见疾病。gydF4y2Ba
参考数据集和数据处理gydF4y2Ba
妊娠中期胎儿组织的数据可从ENCODE获得gydF4y2Ba21gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba40gydF4y2Ba项目鼠标开发矩阵(gydF4y2Bahttps://www.encodeproject.org/mouse-development-matrixgydF4y2Ba).我们从polyA plus RNAseq检测中下载了带有以下标识符的tsv文件:ENCFF262TPS (E11.5 liver-1), ENCFF414APX (E11.5 liver-2), ENCFF173NFQ (E12.5 liver-1), ENCFF144DHB (E13.5 liver-2), ENCFF971KKK (E13.5 liver-1), ENCFF042DVY (E13.5 liver-2), ENCFF770SOB (E10.5 heart-1), ENCFF351QKG (E10.5 heart-2), ENCFF159DWP (E11.5 heart-1), ENCFF168UJM (E11.5 heart-2), ENCFF484QWQ (E12.5 heart-1), ENCFF329HOZ (E12.5 heart-2), ENCFF148BEQ (E13.5 heart-1), ENCFF836QQS (E13.5 heart-2), ENCFF145PTV(E10.5 forebrain-1), ENCFF476ADM (E10.5 forebrain-2),ENCFF606UHO (E11.5 forebrain-1), ENCFF434CSI (E11.5 forebrain-2), ENCFF928MQD (E12.5 forebrain-1), ENCFF046RSQ (E12.5 forebrain-2), ENCFF960KJV (E13.5 forebrain-1), ENCFF356CTG (E13.5 forebrain-2)。胎盘RNA转录丰度由基因表达综合(GEO)登录代码获得gydF4y2BaGSE100053gydF4y2Ba.表达数据根据已知代谢基因进行筛选gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba人鼠基因定位基于HomoloGene数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/homologenegydF4y2Ba).gydF4y2Ba
胎盘基因表达数据来自GEO库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/gdsgydF4y2Ba)使用GEOquery包gydF4y2Ba36gydF4y2Ba(gydF4y2Bahttps://doi.org/10.18129/B9.bioc.GEOquerygydF4y2Ba) v2.62.1 from BioConductor release (3.14) (gydF4y2Bahttps://www.bioconductor.org/gydF4y2Ba).根据已知的代谢基因对数据进行筛选gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba并根据京都基因和基因组百科全书metaboAnalyst_KEGG R包中的路径注释进行排序(gydF4y2Bahttps://github.com/xia-lab/MetaboAnalystRgydF4y2Ba).人鼠基因定位基于HomoloGene数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/homologenegydF4y2Ba).gydF4y2Ba
动物研究gydF4y2Ba
所有程序均经德州大学西南动物护理和使用委员会(IACUC)批准gydF4y2Ba《实验动物护理和使用指南》gydF4y2Ba.所有小鼠被安置在无病原体环境(温度20-26°C,湿度30-70%),12小时:12小时明暗循环,随意喂食饲料(Teklad 2916)。健康的8-15周龄,naïve怀孕的雌性在05:00至07:00之间与合适基因型的种马交配。第二天早上,露出阴道塞的雌性被确认怀孕,并被转移到一个新的笼子里,直到指定的怀孕日。gydF4y2Ba
代谢组学分析gydF4y2Ba
所有样本采集都是在09:00至11:00之间进行的,之前没有对怀孕的水坝进行禁食。小鼠最初使用异氟醚麻醉,样品在冷氯化钠冲洗液(Baxter)中解剖,并在液氮中快速冷冻。整个胚胎和胎盘用橡胶均质器在冰冷的乙腈:水(80:20)中人工均质。样品在液氮中快速冷冻3次,然后在16000下离心gydF4y2BaggydF4y2Ba在4℃下放置10分钟。上清进行BCA分析,归一化至70 μg mlgydF4y2Ba−1gydF4y2Ba并置于LC-MS小瓶中。代谢物分析使用Vanquish UHPLC耦合Thermo Scientific QExactive HF-X混合四极轨道高分辨率质谱仪(HRMS)gydF4y2Ba31gydF4y2Ba.从所有个体样本的均等混合中生成汇总样本,并使用个体正极性和负极性谱ddHRMS/MS采集方法进行分析,以获得高可信度的代谢物ID。代谢物鉴定主要通过三种方式进行:(1)前体离子gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba与化学公式预测的理论质量相差5ppm;(2)片段离子光谱与已知代谢物片段的耐受性在5ppm范围内匹配;(3)代谢物的保留时间在相同色谱方法纯化标准品保留时间的5%以内。LC-MS/MS数据收集使用SCIEX Analyst v1.6.3和Thermo Scientific XCalibur 4.1.50,数据分析使用SCIEX Multiquant v2.1.1和Thermo Scientific Trace Finder v5.1。相对代谢物丰度通过在5ppm的公差范围内整合前体离子的色谱峰面积,然后归一化为总离子计数(TIC)来确定。使用MetaboAnalyst 5.0 (gydF4y2Bahttps://www.metaboanalyst.cagydF4y2Ba).在分析之前,对数据进行日志转换和自动缩放。附加热图(图;gydF4y2Ba1 egydF4y2Ba扩展数据图gydF4y2Ba2 egydF4y2Ba)使用GraphPad Prism 9.0.1生成。为gydF4y2Ba13gydF4y2BaC研究中,观察到的质量同位素分布使用定制的R脚本对自然同位素丰度进行了校正,该脚本可以在GitHub存储库(gydF4y2Bahttps://github.com/wencgu/nacgydF4y2Ba).该脚本是采用AccuCor算法v0.2.4编写的gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
孕鼠输液gydF4y2Ba
所有的输注都发生在09:00到11:00之间,没有事先禁食怀孕的水坝。小鼠最初使用氯胺酮和xylazine (120 mg kg)麻醉gydF4y2Ba−1gydF4y2Ba16毫克千克gydF4y2Ba−1gydF4y2Ba,分别腹腔内),并在麻醉下使用后续剂量的氯胺酮(20mg kggydF4y2Ba−1gydF4y2Ba(腹腔内)根据需要。将导管(25号)插入尾静脉,在进行后眶抽血标记时间零点后立即开始注入同位素。在葡萄糖输注中,总剂量为2.48 g kggydF4y2Ba−1gydF4y2Ba溶于750 μl生理盐水中,以62.5 μl min给药gydF4y2Ba−1gydF4y2Ba以2.5 μl min注射1 mingydF4y2Ba−1gydF4y2Ba3-4小时。在输注过程中进行眶后抽血以监测母体血液中示踪剂的富集情况。谷氨酰胺输注总剂量为1.73 g kggydF4y2Ba−1gydF4y2Ba溶解于1500 μl生理盐水中,每147 μl注射一次gydF4y2Ba−1gydF4y2Ba以3 μl min注射1 mingydF4y2Ba−1gydF4y2Ba5小时。小鼠在输注结束时安乐死,然后取出子宫,胎盘和胚胎在冷氯化钠冲洗液中解剖,并冷冻在液氮中。在输注过程中注意不要使营养浓度超过输注前水平。gydF4y2Ba
连续剖腹产手术gydF4y2Ba
对于连续剖宫产,输注参数与前文相同,但有以下改动:(1)连续剖宫产输注不含丸剂;(2)提高给药速率至5 μl mingydF4y2Ba−1gydF4y2Ba以便获得足够的标签。虽然连续剖腹产的数据模式与我们在4小时输注中观察到的数据模式相匹配,但总体标记值略低,因此我们没有将连续剖腹产的数据与较长时间输注的数据进行比较。尾静脉插管,眶后抽血零时间后,开小切口剖开孕坝下腹。从腹膜腔中取出子宫,将离卵巢最近的胚胎从子宫中剥离,在冷氯化钠冲洗液中进一步解剖成胎盘和胚胎,然后冷冻在液氮中。用氯化钠冲洗液冲洗腹膜腔,覆盖纱布,并在手术剩余时间内定期用冲洗液冲洗。开始输注,在指定的时间点以类似的方式解剖单个胚胎,直到所有胚胎都被解剖或达到3小时时间点。gydF4y2Ba
气相色谱质谱(GCMS)gydF4y2Ba
采用气相色谱-质谱法(GCMS)对葡萄糖、丙酮酸、乳酸、柠檬酸、琥珀酸、苹果酸和天冬氨酸进行了鉴别。这些代谢物也通过液相色谱-质谱(LC-MS)鉴定,富集值相似。输注过程中获得的血液样本在冰上冷藏5-10分钟,然后在液氮中快速冷冻。将10 ~ 20 μl等分加入80:20乙腈:水中提取。将冷冻组织(整个胚胎和整个胎盘)加入80:20乙腈:水中,提取分析gydF4y2Ba13gydF4y2BaC浓缩。样品使用橡胶均质器手动中断,经过三个冻融循环,然后在16000离心gydF4y2BaggydF4y2Ba沉淀大分子15分钟。GCMS为1 μl DgydF4y2Ba27gydF4y2Ba内对照加入肉豆蓟酸,蒸发上清液,再以30 μl无水吡啶10 mg ml重悬gydF4y2Ba−1gydF4y2Ba甲氧胺在室温下孵育过夜。第二天早上,样品在70°C下孵卵10-15分钟,然后在16000下离心gydF4y2BaggydF4y2Ba上清转移到预备的70 μl GC/MS自动注射器中gydF4y2BaNgydF4y2Ba-(gydF4y2Ba叔gydF4y2Ba-butyldimethylsilyl) -gydF4y2BaNgydF4y2Ba-甲基三氟乙酰胺(MTBSTFA)衍生化试剂。样品在70°C下孵育1 h后,注入1 μl的等分样品进行分析。样品分别使用Agilent 6890或7890气相色谱仪与Agilent 5973N或5975C质选检测器耦合进行分析。使用Agilent ChemStation E02.02.1431收集并分析GC-MS数据。使用定制的R脚本对观测到的质量同位素分布进行了校正,以适应自然同位素丰度,该脚本可以在GitHub存储库(gydF4y2Bahttps://github.com/wencgu/nacgydF4y2Ba).该脚本是采用AccuCor算法v0.2.4编写的gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
基因表达gydF4y2Ba
使用TRIzol试剂(Thermo Fisher Scientific cat)从胎盘组织中提取总RNA。不。15596026)。以RNA (3250 ng)为模板,用TaqMan逆转录试剂(Thermo Scientific cat。不。N8080234)根据制造商的说明。cDNA在无核酸酶水中1:1稀释,终体积为4 μl,置于384孔板中。胎盘标记物引物如所述gydF4y2Ba33gydF4y2Ba并稀释至最终浓度为2.5µM。底漆与iTaq Universal SYBR Supermix (Bio-Rad cat.)混合。不。1725121),以6 μl的体积进行电镀,总反应体积为10 μl。在Bio-Rad CFX384触摸式实时荧光定量PCR检测仪中,按照以下协议进行检测:(1)聚合酶激活:95°C保持30分钟;(2) PCR期,40个循环:95°C保存5 s, 60°C保存30 s;(3)熔体曲线,仪器默认设置。相对褶皱感应计算采用∆∆gydF4y2BaCgydF4y2BaTgydF4y2Ba方法,如所述gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
胚胎RNA测序数据从ENCODE小鼠发育矩阵下载gydF4y2Ba35gydF4y2Ba(gydF4y2Bahttps://www.encodeproject.org/gydF4y2Ba).从GD10.5-GD12.5中获得胎儿心脏、前脑和肝脏的PolyA + RNA-seq数据(并非所有日期都可用于肝脏)。从GEO接入代码中获得胎盘RNA转录丰度gydF4y2BaGSE100053gydF4y2Ba使用GEOquery包gydF4y2Ba36gydF4y2Ba(gydF4y2Bahttps://doi.org/10.18129/B9.bioc.GEOquerygydF4y2Ba) v2.62.1 from BioConductor release (3.14) (gydF4y2Bahttps://www.bioconductor.org/gydF4y2Ba).根据已知的代谢基因对数据进行筛选gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba并根据京都基因和基因组百科全书metaboAnalyst_KEGG R包中的路径注释进行排序(gydF4y2Bahttps://github.com/xia-lab/MetaboAnalystRgydF4y2Ba).人鼠基因定位基于HomoloGene数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/homologenegydF4y2Ba).gydF4y2Ba
流式细胞术gydF4y2Ba
将GD10.5孕鼠的整个胚胎收集到1× PBS中,用一次性杵(VWR)机械破坏,然后通过40- M细胞过滤器过滤以去除团块。在冰上进行抗体染色20分钟,然后用HBSS (Invitrogen)洗涤,并在200下离心gydF4y2BaggydF4y2Ba5分钟。用抗小鼠CD71 (FITC-R17.217.1.4 Biolegend, 1:100)、小鼠Ter119 (APC-TER-119 TONBO, 1:100)、小鼠CD41 (PE/Cy7-MWReg30 Biolegend, 1:100)和小鼠CD117 (ckit - apc - e面粉780-Invitrogen, 1:100)的直接偶联抗体染色细胞。基于DAPI (1 μg ml)对所有细胞进行正向和侧面散射,并对活细胞进行门控gydF4y2Ba−1gydF4y2Ba;σ,eflour - 450 a)。红细胞是CD117 (c-KIT)阴性,CD71和Ter119阳性的细胞。骨髓-红系祖细胞CD71和TER119阴性,CD41和CD117阳性(c-KIT)。在LSRFortessa细胞分析仪(Becton Dickinson)上检测细胞,并使用BD FACSDiva 8.0和FlowJo v10生成图像。gydF4y2Ba
全挂免疫荧光染色gydF4y2Ba
处于理想发育阶段的怀孕雌性被二氧化碳窒息安乐死,子宫和胚胎外组织被切除。用卵黄囊进行基因分型,并对染色体体进行计数。胚胎在4%多聚甲醛中25°C或4°C固定1小时过夜。固定胚胎用1× PBS清洗至少3次,通过一系列甲醇或乙醇(25%,50%,75%和100%,两次)脱水,用1% Triton X-100 (Fisher Bioreagents, cat)渗透。不。BP151-100)在PBS中25°C浸泡1.5-2小时,然后使用CAS Block (Life Technologies, cat。不。008120) 2小时。胚胎在CAS Block中稀释的一抗中孵育,4℃过夜:大鼠-抗pecam1 (1:100, BD, Biosciences, cat。不。 553370), Rat-anti-endomucin (1:100, Santa Cruz, sc-65495) and Rabbit-anti-connexin 40 (1:100, Alpha Diagnostics International, cat. no. CX-40A). Embryos were washed with 1× PBS then incubated with secondary antibodies diluted in CAS Block at 1:250 overnight at 4 °C: donkey-anti-rat 488 (Invitrogen, cat. no. A21208), donkey-anti-rabbit 555 (Invitrogen, cat. no. A31572). Embryos were washed in 1× PBS, then dehydrated to 100% methanol through a methanol series (25%, 50%, 75%, 100% two times, 10 min each), cleared in a 1:2 benzyl alcohol:benzyl benzoate (BABB) solution, and mounted in BABB in 5 mm Thick Microscopy slides (Chang Biosciences, Rb167104D_1) and cover slipped. Images were obtained using a LSM700 Ziess confocal microscope with the Carl Zeiss ZEN 2011 software. If images of the dissected heart were desired, whole embryos were rehydrated through a methanol series into PBS, hearts were dissected and placed in a 1.5 mm 2-well concavity slide (Electron Microscopy Sciences, cat. no. 71878-03) containing PBS. Whole-heart images were obtained using a Ziess Images M2 with an Axiocam 506 mono camera attached with the Carl Zeiss ZEN 2011 software. For sectioned samples, paraffin embedded samples were transverse sectioned at 5 μm and stained with haematoxylin and eosin.
统计分析gydF4y2Ba
在流式细胞仪、同位素示踪、代谢组学、定量PCR、组织重量、体细胞计数和组织学实验中,数据分析不考虑样本基因型。a。s。收集样本然后交给a。塔斯多根。用于流式细胞仪或I.M.-M。M.A.C.负责组织学和免疫荧光,还有a·塔朗吉洛。用于定量PCR。A.S.处理样品进行质谱分析并分析数据。在每个实验都分析了这些模式之后,D.杜梅尼尔。提供基因型信息,以便对结果进行解释。在野生型小鼠的实验中,没有对胎盘和胚胎进行盲法,因为A.S.进行了这些实验并分析了数据。对于来自公开数据集的基因表达研究,没有进行盲法。gydF4y2Ba
小鼠被随机分配到实验中,样本按任意顺序处理,但没有使用正式的随机化技术。样本量不是根据统计功率计算预先确定的,而是基于我们对这些测定的经验。在大多数实验中,小鼠的最小数量是3只,除了一些胚胎/胎盘数量的例外gydF4y2BangydF4y2Ba≥10。没有数据被排除;然而,有时小样本量低于代谢组学分析的阈值。在这些情况下,使用了可以从母亲血液或其他组织中获得的数据。这些样本不用于直接比较胚胎相对于自己的胎盘,如果其中一个样本不存在。gydF4y2Ba
在分析组间差异的统计学意义之前,我们检验了数据是否正态分布,组间方差是否相似。为了检验是否正常,当3≤时,我们进行了Shapiro-Wilk检验gydF4y2BangydF4y2Ba< 20或D 'Agostino综合测试时gydF4y2BangydF4y2Ba≥20。为了测试我们执行的组间差异性是否有显著差异gydF4y2BaFgydF4y2Ba-检验(用于两组以上的实验)或列文中位数检验(用于两组以上的实验)。当数据显著偏离正态或变异性在不同条件下显著不同时,我们记录gydF4y2Ba2gydF4y2Ba-转换数据并再次测试其正态性和可变性。如果转换后的数据不再显著偏离正态性和相等可变性,则对转换后的数据进行参数检验。如果日志gydF4y2Ba2gydF4y2Ba-转换不可能或转换后的数据仍然显著偏离正态性或相等可变性,我们对未转换的数据进行非参数测试。gydF4y2Ba
当数据或日志gydF4y2Ba2gydF4y2Ba-转换数据正常且变量相同,使用Student 's进行统计分析gydF4y2BatgydF4y2Ba-测试或配对gydF4y2BatgydF4y2Ba-检验(当有两组时),单向ANOVA或重复测量单向ANOVA(当有两个以上组时),双向重复测量ANOVA(当有两个或两个以上组具有多个代代物或时间点时),或混合效应模型(当存在缺失值,但数据满足单向或双向重复测量ANOVA的假设时)。当数据或日志gydF4y2Ba2gydF4y2Ba-转换数据正常,但变量不相等,使用Welch 's进行统计分析gydF4y2BatgydF4y2Ba-检验(当有两组时)或Welch的单向方差分析,然后是Dunnett’s T3检验,用于多次比较调整(当有两组以上时)。当数据和日志gydF4y2Ba2gydF4y2Ba-转换数据异常或变量不均等时,采用Mann-Whitney或Wilcoxon配对符号秩检验(当有两组时)或Kruskal-Wallis检验(当有两组以上时)进行统计分析。gydF4y2BaPgydF4y2Ba-在方差分析或混合效应模型后,使用Tukey方法(当有两个以上组且所有比较都感兴趣时)或Sidak方法(当有两个以上组且计划进行比较时),或在Kruskal-Wallis检验后使用Dunn方法调整多个比较的值。Holm-Sidak的方法用于调整两种条件之间涉及多种代谢物的比较。采用线性回归或非线性曲线拟合方法,采用平稳期和单相关联来拟合时间序列数据和额外平方和gydF4y2BaFgydF4y2Ba-test用于评估两条拟合的直线/曲线之间是否存在差异。多直线/曲线拟合gydF4y2BaPgydF4y2Ba-值使用Holm-Sidak方法进行调整。使用GraphPad Prism V9.0.1或R 4.0.2进行统计检验。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
质量同位素使用定制的R脚本进行了自然同位素丰度的校正,该脚本可以在GitHub存储库(gydF4y2Bahttps://github.com/wencgu/nacgydF4y2Ba).该脚本是采用AccuCor算法v0.2.4编写的gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Johnson, m.t., Mahmood, S. & Patel, m.s.小鼠早期胚胎发生的中间代谢和能量学。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 31457-31460(2003)。gydF4y2Ba
缺氧在哺乳动物胚胎发育中的作用。gydF4y2BaDev细胞。gydF4y2Ba17gydF4y2Ba, 755-773(2009)。gydF4y2Ba
汉森,J. M.琼斯,D. P. &哈里斯,C.发展的氧化还原理论。gydF4y2BaAntioxid。氧化还原信号。gydF4y2Ba32gydF4y2Ba, 715-740(2020)。gydF4y2Ba
苏孟松,李志强,李志强,等。硫辛酸代谢与线粒体氧化还原调控。gydF4y2Ba生物。化学。gydF4y2Ba293gydF4y2Ba, 7522-7530(2018)。gydF4y2Ba
Ni, M.等。细胞、小鼠和人类脂酰转移酶-1缺乏症的功能评估。gydF4y2Ba细胞的代表。gydF4y2Ba27gydF4y2Ba, 1376 - 1386。e1376(2019).
陆志勇,陈志强,陈志强。表观遗传学的代谢调控。gydF4y2Ba细胞金属底座。gydF4y2Ba16gydF4y2Ba, 9-17(2012)。gydF4y2Ba
Oginuma等人。在羊膜动物胚胎体轴伸长过程中糖酵解活性的梯度协调FGF和Wnt信号。gydF4y2BaDev细胞。gydF4y2Ba40gydF4y2Ba, 342 - 353。e310 (2017).
布鲁苏,V.等。糖酵解活性梯度与小鼠胚胎中胚层发育的时空分析。gydF4y2BaDev细胞。gydF4y2Ba40gydF4y2Ba, 331 - 341。e334(2017).
Rodesch, F., Simon, P., Donner, C. & Jauniaux, E.怀孕早期子宫内膜和滋养层组织的氧含量测量。gydF4y2Ba比较。。Gynecol。gydF4y2Ba80gydF4y2Ba, 283-285(1992)。gydF4y2Ba
Maltepe, E., Schmidt, J. V, Baunoch, D. Bradfield, C. A. & Simon, M. C.缺乏ARNT蛋白小鼠的异常血管生成和葡萄糖和氧气剥夺反应。gydF4y2Ba自然gydF4y2Ba386gydF4y2Ba, 403-407(1997)。gydF4y2Ba
Iyer, n.v.等。细胞和发育控制OgydF4y2Ba2gydF4y2Ba缺氧诱导因子1 α的内稳态。gydF4y2BaDev的基因。gydF4y2Ba12gydF4y2Ba, 149-162(1998)。gydF4y2Ba
考登·达尔,k.d.等人。缺氧诱导因子1α和2α调节滋养层分化。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba25gydF4y2Ba, 10479-10491(2005)。gydF4y2Ba
Thion, m.s., Ginhoux, F. & Garel, S.小胶质细胞与早期大脑发育:亲密之旅。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, 185-189(2018)。gydF4y2Ba
Patel, K. P., O 'Brien, T. W., Subramony, S. H., Shuster, J. & Stacpoole, P. W.丙酮酸脱氢酶复合物缺乏症谱:371例患者的临床、生化和遗传特征。gydF4y2Ba摩尔,麝猫。金属底座。gydF4y2Ba106gydF4y2Ba, 385-394(2012)。gydF4y2Ba
科曼,D.,科曼,D.,克朗克,K. R. &克里斯托杜卢,J. ingydF4y2BaGeneReviewsgydF4y2Ba(亚当,m.p.等人编)(华盛顿大学,1993年)。gydF4y2Ba
Coscia, l.a等。母体霉酚酸酯致畸性的最新进展。gydF4y2Baj . Pediatr。麝猫。gydF4y2Ba4 gydF4y2Ba, 42-55(2015)。gydF4y2Ba
徐春宁,田玉玲。妊娠期精氨酸营养和代谢对子代结局的影响。gydF4y2Ba营养物质gydF4y2Ba11gydF4y2Ba, 1452(2019)。gydF4y2Ba
福伯特等人。人肺肿瘤的乳酸代谢。gydF4y2Ba细胞gydF4y2Ba171gydF4y2Ba, 358 - 371。e359(2017).
滕斯特,S. J.,沃森,E. D.,福登,A. L. &伯顿,G. J.胎盘糖原储存和胎儿生长:来自遗传小鼠模型的见解。gydF4y2Ba繁殖gydF4y2Ba159gydF4y2Ba, r213-r235(2020)。gydF4y2Ba
Kumaravelu, P.等。确定造血干细胞/长期再生单位(HSC/RUs)的定量发育解剖:主动脉-性腺-中肾(AGM)区域和卵黄囊在小鼠胚胎肝脏定植中的作用。gydF4y2Ba发展gydF4y2Ba129gydF4y2Ba, 4891-4899(2002)。gydF4y2Ba
他,P.等人。全组织和单细胞分辨率下小鼠胚胎转录组的变化。gydF4y2Ba自然gydF4y2Ba583gydF4y2Ba, 760-767(2020)。gydF4y2Ba
Menendez-Montes, I.等。心肌VHL-HIF信号控制胚胎代谢开关对心脏成熟至关重要。gydF4y2BaDev细胞。gydF4y2Ba39gydF4y2Ba, 724-739(2016)。gydF4y2Ba
Beutner, G., Eliseev, R. A. & Porter, G. A. Jr胚胎心脏中电子传递链活性的启动与线粒体复合体1的激活和超复合体的形成一致。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba9gydF4y2Ba, e113330(2014)。gydF4y2Ba
曹,J.等。哺乳动物器官发生的单细胞转录景观。gydF4y2Ba自然gydF4y2Ba566gydF4y2Ba, 496-502(2019)。gydF4y2Ba
刘,Y.等。单细胞RNA-seq揭示了人类胎盘滋养层亚型和分化模式的多样性。gydF4y2Ba细胞Res。gydF4y2Ba28gydF4y2Ba, 819-832(2018)。gydF4y2Ba
Miyazawa, H.等。在小鼠绒毛膜尿囊分支期间,通过抑制PFK-1和醛缩酶重新连接胚胎葡萄糖代谢。gydF4y2Ba发展gydF4y2Ba144gydF4y2Ba, 63-73(2017)。gydF4y2Ba
刘,等。mtorc1介导的蛋白翻译对红细胞生成中线粒体生物发生的调控。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 626-638(2017)。gydF4y2Ba
谢尔,J. C.等。线粒体丙酮酸代谢对肠干细胞功能和增殖的控制。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 1027-1036(2017)。gydF4y2Ba
弗洛雷斯,A.等。乳酸脱氢酶活性驱动毛囊干细胞活化。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 1017-1026(2017)。gydF4y2Ba
Anso, E.等。线粒体呼吸链对造血干细胞的功能至关重要。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 614-625(2017)。gydF4y2Ba
塔斯多根,A.等。代谢异质性决定了黑色素瘤转移潜力的差异。gydF4y2Ba自然gydF4y2Ba577gydF4y2Ba, 115-120(2020)。gydF4y2Ba
苏晓霞,吕文伟,王晓明。代谢产物轨道谱精度的研究。gydF4y2Ba肛交。化学。gydF4y2Ba89gydF4y2Ba, 5940-5948(2017)。gydF4y2Ba
Rhee, C.等。ARID3A是哺乳动物胎盘发育所必需的。gydF4y2BaDev,杂志。gydF4y2Ba422gydF4y2Ba, 83-91(2017)。gydF4y2Ba
Livak, K. J. & Schmittgen, T. D.使用实时定量PCR分析相关基因表达数据gydF4y2Ba−ΔΔgydF4y2BaCgydF4y2BaTgydF4y2Ba方法。gydF4y2Ba方法gydF4y2Ba25gydF4y2Ba, 402-408(2001)。gydF4y2Ba
ENCODE项目联盟。扩充了人类和小鼠基因组中DNA元素的百科全书。gydF4y2Ba自然gydF4y2Ba583gydF4y2Ba, 699-710(2020)。gydF4y2Ba
Davis, S. & Meltzer, p.s. GEOquery:基因表达综合(GEO)和BioConductor之间的桥梁。gydF4y2Ba生物信息学gydF4y2Ba23gydF4y2Ba, 1846-1847(2007)。gydF4y2Ba
Possemato, R.等人。功能基因组学揭示丝氨酸合成途径在乳腺癌中至关重要。gydF4y2Ba自然gydF4y2Ba476gydF4y2Ba, 346-350(2011)。gydF4y2Ba
Birsoy, K.等。线粒体电子传递链在细胞增殖中的重要作用是使天冬氨酸合成。gydF4y2Ba细胞gydF4y2Ba162gydF4y2Ba, 540-551(2015)。gydF4y2Ba
朱晓刚等。体内功能基因组学研究揭示了胰腺癌细胞的代谢依赖性。gydF4y2Ba细胞金属底座。gydF4y2Ba33gydF4y2Ba, 211 - 221。e216(2021).
戴维斯,C. A.等人。DNA元素百科全书(ENCODE):数据门户更新。gydF4y2Ba核酸测定。gydF4y2Ba46gydF4y2Ba, d794-d801(2018)。gydF4y2Ba
确认gydF4y2Ba
这份手稿献给杰拉尔多·格瓦拉,他是一位优秀的实验室成员和朋友,我们深深地怀念他。K. Dickerson帮助解释了病人的贫血症,A. B. Jaffe提供了重要的反馈。A.S.是尤尼斯肯尼迪施赖弗国家儿童健康与人类发展研究所的Ruth L. Kirschstein国家研究服务奖博士后(F32HD096786-01)。B.F.获得了国家癌症研究所职业转型奖(K99CA237724-01A1)的支持。R.J.D.由H.H.M.I.调查员计划、N.C.I. Grant R35CA22044901、Baldridge家族和Robert L. Moody高级教员学者捐赠基金支持。A.R.得到了维多利亚癌症机构早期职业研究奖学金的支持。她是Ruth L. Kirschstein国家研究服务奖的博士预科研究员(F30CA254150-01A1)。T.J.R. (K00CA212230)和A. Tarangelo。(K00CA234650)是NCI的博士后研究员。妊娠中期示意图(图。gydF4y2Ba1gydF4y2Ba)和注射(图;gydF4y2Ba2gydF4y2Ba)的程序,由BioRender (gydF4y2Bahttps://biorender.com/gydF4y2Ba).我们也承认ENCODE联盟gydF4y2Ba35gydF4y2Ba,gydF4y2Ba40gydF4y2Ba以及用于生成本研究中使用的数据集的ENCODE生产实验室gydF4y2Ba21gydF4y2Ba.gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
a.s., B.F.和R.J.D.构想了这个项目,设计了实验并解释了数据。a.s., w.g., a.r., s.k., A. Tarangelo。, A.塔斯多根,g.g., i.m.m。,M.A.C. and D. Dumesnil performed experiments. T.P.M., L.G.Z., M.S.M.-S. and D. Do, performed metabolomics and LCMS experiments. A.S., T.J.R., P.P. and L.C. performed metabolic tracing and gene-expression analysis. A.S., M.N. and C.P. generated and bred mice for LIPT1 experiments. Z.Z. performed statistical analyses. A.S. and R.J.D. wrote and edited the manuscript with help from B.F., A.P., O.C., S.J.M. and H.A.S.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
R.J.D.是Agios Pharmaceuticals和Vida Ventures的顾问,也是Atavistik Bio的联合创始人。其他作者宣称没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Nicola Zamboni和其他匿名审稿人对这项工作的同行评审所做的贡献。可以获得同行评审报告。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1妊娠中期发育组织的动态代谢。gydF4y2Ba
(a)使用Metaboanalyst 5.0生成的主成分分析和(b)树状图分析(gydF4y2Bahttps://www.metaboanalyst.ca/gydF4y2Ba).gydF4y2Ba
扩展数据图2 gd10.5-gd11.5的组织特异性代谢变化。gydF4y2Ba
(a)胚胎与胎盘显著差异的前50个代谢产物热图。(b)有助于gd10.5胚胎和胎盘代谢谱分离的前25种代谢物。(c-d)利用胚胎(c)和胎盘(d)中代谢物在gd10.5-gd11.5之间的丰度差异(p < 0.05)进行代谢集过度代表分析。(e)与尿素循环相关的代谢产物在gd11.5时短暂增加,随后两天下降。使用学生t检验来确定统计学意义。所有数据均为均数±标准差。统计检验为双侧。gydF4y2Ba
图3葡萄糖促进发育组织中嘌呤的合成。gydF4y2Ba
(a)从[U-gydF4y2Ba13gydF4y2BaC]葡萄糖。(b-f) G6P (b)、R5P (c)、IMP (d)、GMP (e)和AMP (f)同位素[U- .gydF4y2Ba13gydF4y2BaC]葡萄糖。(g)相对于总葡萄糖富集的丝氨酸和甘氨酸的总富集(1-未标记部分)。(h) R5P (Ri5P/X5P等压线)、UMP和CMP中[U-gydF4y2Ba13gydF4y2BaC]葡萄糖。(i) UMP和CMP从[γ-]富集m+1gydF4y2Ba15gydF4y2BaN]谷氨酰胺。gydF4y2Ba15gydF4y2Ban -谷氨酰胺富集被归一化为谷氨酰胺m+1,以解释不同隔间之间的差异(见图。gydF4y2Ba2摄氏度gydF4y2Ba).使用配对t检验(b, c, h和i)或Wilcoxon配对符号秩检验(b-g)以及Holm-Sidak多重比较调整(b-i)来确定统计学意义。所有数据均为均数±标准差。统计检验为双侧。gydF4y2Ba
图4妊娠中期组织特异性TCA循环代谢。gydF4y2Ba
(a)从[U- .gydF4y2Ba13gydF4y2BaC .胎盘中gd9.5-gd12.5之间的葡萄糖。(b) gd12.5上的浓缩归一化至葡萄糖m+6。(c-d)每日柠檬酸m+2/丙酮酸m+3 (c)和柠檬酸m+3/丙酮酸m+3 (d)的浓缩比。(e)归一化至gd10.5(肝脏为gd11.5)的胎儿组织中的etc相关转录本计数(n = 2)。(f)胎儿心脏每日总柠檬酸/丙酮酸富集比。(g)胎盘ETC复合体基因表达。(h)谷氨酸m+5/谷氨酰胺m+5在注入[U-gydF4y2Ba13gydF4y2Ba谷氨酰胺。采用Mann-Whitney检验(a, g)、配对t检验(b)或直线最小二乘拟合(h),然后采用Holm-Sidak多重比较调整(a, b, g和h),线性混合效应分析(c,d),然后采用Sidak 's (c-d;组织间比较)或Tukey 's (c-d;时间间比较)多重比较调整,或单因素方差分析后再进行Tukey多重比较调整(f)。所有数据均为均数±s.d。统计检验为双面检验。gydF4y2Ba
LIPT1活动对于从gd10.5-gd11.5过渡至关重要。gydF4y2Ba
(a)代谢组学数据的主成分分析图和(b)出生窝仔的组织重量gydF4y2BaLipt1gydF4y2BaWT / N44SgydF4y2Ba交叉。(c)所示基因型胎盘中的相关代谢物。(d-e)胎盘摄取(左)和胚胎移植(右)[U-gydF4y2Ba13gydF4y2BaC .葡萄糖(d)和[U-gydF4y2Ba13gydF4y2BaC .谷氨酰胺(e). (f)胎盘标记物的表达。(g)从[U-gydF4y2Ba13gydF4y2BaC .各种胎盘中的葡萄糖gydF4y2BaLipt1gydF4y2Ba基因型。采用双向重复测量方差分析,然后进行Sidak多重比较调整(b),学生t检验(c)或Mann-Whitney检验(d-g),然后进行Holm-Sidak多重比较调整,以确定统计学意义。所有数据均为均数±标准差。统计检验为双侧。gydF4y2Ba
图6 LIPT1缺乏阻碍器官发生和红细胞生成。gydF4y2Ba
(a)所生窝胚中Somite计数gydF4y2BaLipt1gydF4y2BaWT / N44SgydF4y2Ba交叉点为gd9.5。(b) Brightfield整体安装图像,比例尺= 500μm (1,1 ');背主动脉用Connexin 40染色,比例尺= 100μm(2,2’);全心PE染色,比例尺= 300μm(3,3’);心的H&E染色,比例尺= 50μM(4,4 ')。所有图片均来自gd9.5胚胎。(c-d) Gd10.5全胚胎细胞,用抗红系标记CD71和TER119 (c)和髓系/红系祖细胞标记cKIT和CD41 (d)的抗体染色。对24个个体胚胎(健康n = 11,突变n = 7)进行流式细胞术检测,取自一名lipt1缺陷患者的白细胞(WBC) (e)和血小板(f)计数。采用Student的t检验,然后采用Holm-Sidak的多重比较调整来确定统计学意义。所有数据均为均数±标准差。统计检验为双侧。gydF4y2Ba
图7流式细胞术门控策略。gydF4y2Ba
(a)整个胚胎的单细胞悬液按正向和侧面散射面积(P1)、正向散射高度和宽度(P2)、侧面散射高度和宽度(P3)进行门控。细胞DAPI染色,活细胞DAPI阴性(P4), CD117 (cKIT)阴性(P5)。胎儿红细胞被鉴定为CD71gydF4y2Ba+gydF4y2Ba/ TER119gydF4y2Ba+gydF4y2Ba(红框- P5:Q2),髓系/红系祖细胞被门控为CD71gydF4y2Ba-gydF4y2Ba/ TER119gydF4y2Ba-gydF4y2Ba(蓝框- P5:Q3),也作为cKITgydF4y2Ba+gydF4y2Ba/ CD41gydF4y2Ba+gydF4y2Ba(P6)。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
索蒙森,A,福伯特,B,顾,W。gydF4y2Baet al。gydF4y2Ba区室化代谢支持哺乳动物妊娠中期发育。gydF4y2Ba自然gydF4y2Ba604gydF4y2Ba, 349-353(2022)。https://doi.org/10.1038/s41586-022-04557-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-04557-9gydF4y2Ba
这篇文章被引用gydF4y2Ba
亚硝基化改变了新陈代谢gydF4y2Ba
自然化学生物学gydF4y2Ba(2022)gydF4y2Ba
单细胞转录组分析揭示了母体高血糖小鼠模型中心脏祖细胞和心肌细胞的失调gydF4y2Ba
通信生物学gydF4y2Ba(2022)gydF4y2Ba
一种新的与铜铜中毒相关的LncRNA特征,用于预测肝细胞癌的预后gydF4y2Ba
科学报告gydF4y2Ba(2022)gydF4y2Ba
胃癌铜化相关基因在预后、肿瘤微环境浸润及免疫治疗应答中的综合分析gydF4y2Ba
癌症研究与临床肿瘤学杂志gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba