摘要
真涡虫的性张力Schmidtea mediterranea是突尼斯和几个地中海岛屿的土著,是一个雌雄同体的人1,2。在这里,我们分离出单个染色体并使用Hi-C测序3.,4以及链接映射,以组装染色体尺度的基因组参考。连锁图谱显示1号染色体的重组率极低。通过对单个精子细胞和卵母细胞进行基因分型,我们证实了1号染色体上的重组抑制。我们表明,先前确定的基因组区域保持杂合性,即使在长时间近交后,基本上构成了所有的1号染色体。对野外分离个体的基因组测序表明,这种现象在撒丁岛和科西嘉岛的种群中特别进化。我们发现大多数知名的监管大师5,6,7,8,9,10,11,12,13生殖系统的染色体都位于1号染色体上。我们使用RNA干扰14,15敲除单倍型偏向表达的基因,从而形成更明显的雌性交配器官。在这些观察的基础上,我们提出1号染色体是一个为进化成性染色体而启动的常染色体。
主要
性染色体由同源常染色体进化而来,这些常染色体获得了决定性别的基因,失去了重组的能力16,17,18,19,20.,21。因此,性染色体的进化与重组抑制密切相关16,17,18,19,20.,21。然而,由于很难获得这种同源常染色体为进化为性染色体的直接证据,因此对与重组抑制进化相关的分子特征知之甚少。
淡水涡虫Schmidtea mediterranea,是再生研究的重要模式生物22,23存在于无性繁殖株和有性繁殖株。这种性毒株主要分布在突尼斯、撒丁岛、科西嘉岛和西西里岛1。性菌株是一种同时发育男性和女性生殖系统的雌雄同体,在同一个成年个体中,并特意异交以使其他个体受精24,25。无性系的个体不发育有性生殖系统。我们认为,研究同时雌雄同体的染色体进化可能提供原始性染色体早期进化的见解。
年代。 mediterranea有四对染色体,是稳定的二倍体。据报道,该基因组由774 Mb组成,组装成481个不连续的基因组序列系列或支架26,27,28。之前的一项研究发现,即使在实验室菌株广泛近交后,大约300 Mb的基因组仍然保持杂合,这一现象也自然发生在撒丁岛的野生种群中24。这两组杂合等位基因统称为J和V单倍型。定义这些等位基因的染色体位置,并研究支撑杂合性持续存在的原因年代。 mediterranea在美国,需要对所有四条染色体进行详细的组装。
染色体尺度的基因组组装
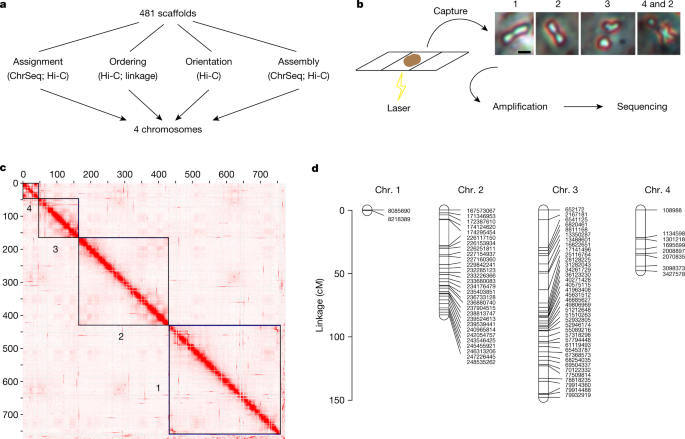
改造481个脚手架26我们进行了染色体测序(ChrSeq)29,30.以及用Hi-C进行染色质接近测序3.(无花果。1).为此,我们使用激光捕获技术从有丝分裂细胞中分离出单个染色体,并对每条染色体分别进行扩增和测序(图2)。1 b).我们分别在相同和不同染色体的多个样本中检查了每个支架的测序深度,以确保重复性和特异性(扩展数据图)。1).总的来说,我们成功地扩增了774 Mb基因组中的740 Mb,并自信地将其分配到四条染色体中的一条(补充表1).
我们使用由Hi-C生成的ChrSeq信息和染色质相互作用数据来校正和连接染色体内的单个支架到染色体尺度的基因组,以下称为Smed_chr_ref_v1。采用SALSA支架式算法对Hi-C数据进行分析3.将481个脚手架分解为57个超级脚手架和104个单脚手架。ChrSeq数据显示57个超级支架中有3个是分离的染色体间片段,与Hi-C接触热图一致(图2)。1 c).我们将分离的超级支架拆分,将支架合并为染色体,并使用Juicebox可视化软件对染色体内的所有支架进行排序和定向4(方法).单独使用ChrSeq进行染色体分配(补充表1)和单独使用Hi-C时,384个支架中只有3个(0.8%)不一致(补充表2).我们根据Hi-C数据手动将这三个支架分配到染色体上。Hi-C还检测到26个染色体间或染色体内组装错误(补充表2)26,其中5个经ChrSeq证实为染色体间分离支架(补充表2).最终的基因组组装,Smed_chr_ref_v1(图。1 c),有4条染色体,总大小为764 Mb,是先前报道的98.4%26。在Hi-C未在Smed_chr_ref_v1中包含的1.6%的先前组装中,约有一半(52.6%)的支架不能被分配到一条染色体上或被ChrSeq分配到两条染色体上,表明组装质量较低(补充表3).此外,33.0%和12.4%的支架分别与染色体1和2的结构复杂区域存在染色质相互作用信号(扩展数据图。2),表明它们可能是可替代的组合或重复序列。在我们的新组装Smed_chr_ref_v1中,4号染色体两端被> 1000个端粒重复TTAGGG所覆盖,表明组装质量较高。
为了验证Smed_chr_ref_v1中染色体的线性性,我们生成了一个连锁映射。我们杂交了两种不同的实验室菌株年代。 mediterranea, S2F10b和D5,以产生F2我们用RADseq对单个蠕虫进行基因分型31。80个标记在至少98%的F2分离子(91 / 93)用于建立4个连锁群(图。1 d而且补充表4)代表四条染色体。连锁图中80个标记的排序与Smed_chr_ref_v1一致,独立地支持了我们染色体尺度基因组组装的质量。这种高度连续和完整的基因组组装和连接图一起促进了对这种模式涡虫基因组功能的进一步遗传和表观遗传研究。
1号染色体重组抑制
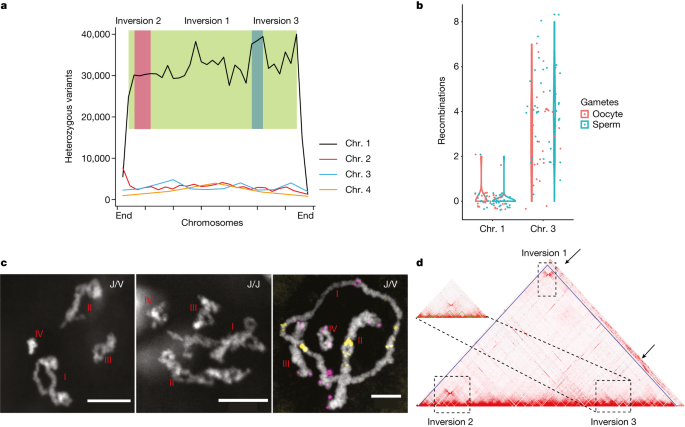
接下来,我们重新检查了在新组装的基因组中定义J和V单倍型的杂合等位基因。我们发现87.7%保持杂合的遗传标记位于染色体1上,长度为333 Mb,变异密度为30148 / 10 Mb(图2)。2).其余12.3%的杂合标记位于其他3条染色体上,密度为每10 Mb 3274个变异,可能对应于重复元素高度相似副本之间的差异,而不是真正的多态性(补充表5).所有F2蠕虫(n= 93)在本研究中,染色体1是杂合的,而染色体2-4 (补充表6),这与先前的研究结果一致24。因此,我们认为J/V单倍型位于1号染色体上。
一个S2近交谱系沿4条染色体保持杂合变异分布。的y轴显示每10 Mb的变体计数。绿色、粉色和蓝色方框分别表示倒序1、2和3。b,卵母细胞(红色)和精子细胞(青色)1号和3号染色体上减数分裂重组事件的数量。点代表单个配子,用小提琴图概括。cJ/V虫卵母细胞(左图和右图)早期晚期1号染色体的交叉位点少于J/J虫卵母细胞(中图)。该实验独立重复了10多次,结果相似。右侧面板显示FISH42端粒重复TTAGGG(洋红色)和着丝粒附近的重复(黄色)。这个实验独立地重复了三次以上,得到了相似的结果。d,染色体1的染色质接触热图。虚线矩形表示可能反转的位置。箭头表示来自未分配支架的带有反转区域的染色质接触信号。
我们的连锁图谱显示,1号染色体上的重组率极低,整个染色体只有0.5 cM(图2)。1 d).这是特别值得注意的,因为在333 Mb, 1号染色体是四条染色体中最大的,包含超过40%的基因组。
为了直接检测1号染色体是否可以重组,我们对J/V系S2的45个单精子细胞和28个单卵母细胞进行了测序(图2)。二维).配子测序是首选的,因为在孵化中的重组事件可以通过差异受精或胚胎致死来选择。我们在1号染色体上鉴定出3197个单核苷酸变异(SNVs),在3号染色体上鉴定出3312个SNVs,覆盖了每条染色体长度的99% (补充表7).snv在20 mb窗口上的分布密度相似,染色体1和染色体3的变异系数分别为0.38和0.31 (补充表7).我们观察到98%的精子细胞(45个中的44个)和93%的卵母细胞(28个中的26个)在1号染色体上没有交叉。相比之下,大多数精子细胞和卵母细胞在染色体2、3和4上有交叉。2 b扩展数据图3 a, b而且补充表7).因此,我们得出结论,1号染色体的重组受到了强烈的抑制。
与这一结论一致的是,我们发现在前期I,当其他染色体有大量交叉时,染色体1在J/V虫的卵母细胞中形成了环状结构,而在J/J虫的卵母细胞中没有形成环状结构(图2)。2摄氏度和扩展数据图。4).用端粒探针进行的荧光原位杂交(FISH)表明,染色体1的两个同源对之间的交叉只发生在靠近端粒的区域,导致观察到的环状构象,而不是在染色体2、3和4中观察到的并排配对。此外,Hi-C分析显示,1号染色体有3个假定的倒置位点,每个>大小为20 Mb(图2)。二维);这种反转会导致交叉抑制32,33,34。基因组的其余部分仅在2号染色体上有一个大约10 Mb的大反转(扩展数据图)。2 b).
1号染色体的岛屿特异性进化
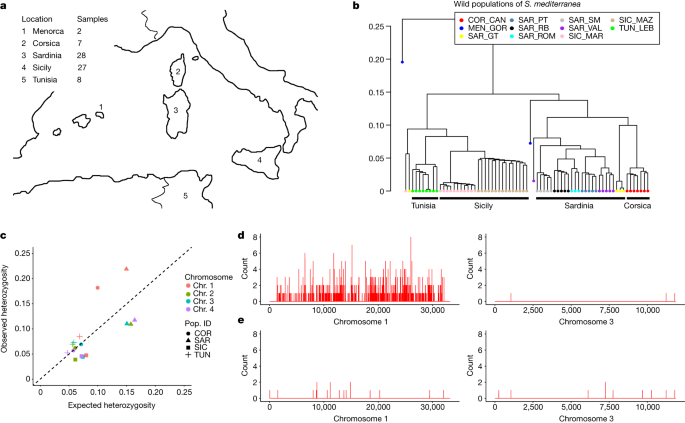
研究植物的遗传多样性年代。 mediterranea并确定染色体1 J/V杂合性是否发生在整个物种,我们使用RADseq31对来自撒丁岛、科西嘉岛、西西里岛和突尼斯的70个有性个体和来自梅诺卡岛的2个无性个体的基因组进行取样1(无花果。3).为了寻找个体之间的遗传关系,我们确定了通过身份-状态对距离测量的亲缘性聚类35并发现了两个超星系团。来自西西里的动物与来自突尼斯的动物有密切的亲缘关系,来自撒丁岛的动物与来自科西嘉岛的动物有密切的亲缘关系。3 b).系统发育聚类(扩展数据图。5),固定指数(F圣)值(扩展数据图。6),并使用Structure进行分析(扩展数据图。7)进一步支持了这一观点。
来自撒丁岛和科西嘉岛的人群的亲缘关系表明,他们可能与来自西西里岛和突尼斯的人群具有不同的基因组特征。事实上,撒丁岛和科西嘉岛的动物在染色体1上的杂合度比Hardy-Weinberg平衡下预期的要高(图2)。3 c),而这些群体中其他三条染色体的杂合度和其他群体中所有四条染色体的杂合度与预期密切相关。通过分析野生群体J/V单倍型标记,我们发现来自撒丁岛和科西嘉岛的动物为杂合子J/V,而来自西西里岛和突尼斯的动物为纯合子J/J。此外,撒丁岛的动物(n= 28)在80%以上的个体中有许多杂合位点,这些位点沿1号染色体的长度分布,但靠近末端的部分除外;相反,西西里岛的动物(n= 27)很少有这样的杂合位点(图。3 d, e而且补充表8).在两个群体中,在染色体2、3和4上都很少观察到这种杂合位点。3 d, e和扩展数据图。3 c, d).这些分析表明,1号染色体是在撒丁岛和科西嘉岛上专门进化和分化的。
性别引物染色体
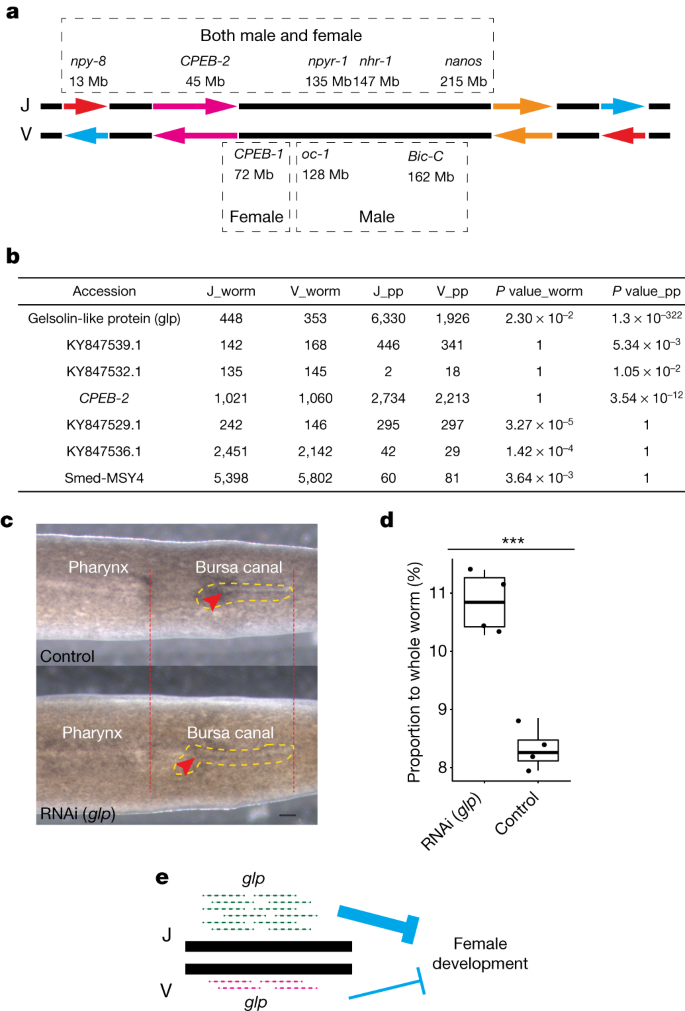
为了深入了解1号染色体上岛特异性的重组抑制,我们检查了位于该染色体上的基因,它包含了所有注释基因的39%。七个已知的生殖系统主要调控因子中的五个在染色体1上被发现,包括nano5,nhr-1(参考文献。8,9),npy-8(ref。6,npyr-1(ref。11),CPEB-2(ref。12) (ophi11而且boule-2(ref。10)是两个例外)(图。4).这些主要调控因子中的任何一个被抑制都会导致男性和女性生殖组织的衰竭5,6,8,9,10,11,12。1号染色体上这些在性发育中起关键作用的基因的存在表明1号染色体的完整性对有性生殖的维持是重要的。的确,无性血统年代。 mediterranea它没有任何生殖器官23从1号染色体转位到3号染色体,可能是由于这些基因中的一个或多个功能丧失而进化的。
一个, 1号染色体上J和V单倍型的推断结构示意图。箭头表示假定的逆序。名称,位置和性别特异性显示了染色体1上的8个基因,在生殖系统的发展中具有已知的关键作用。b,整个性成熟蠕虫和阴茎乳头(PP)转录组中关键基因J和V等位基因的read计数比较。Bonferroni-correctedP表达式相等的双面二项式检验的值显示出来。c、控制点的背侧视图(上)和Smed-glp击倒(下)性成熟的涡虫。红色虚线和箭头分别表示咽和囊管的后端和前端。比例尺,400 um。黄色虚线勾勒出囊管。d,定量法氏囊管的长度相对于整个蠕虫。的y轴以箱形图的形式显示了滑囊管跨越的整个蠕虫长度的百分比,其中单个数据点显示(n= 4控制和击倒蠕虫)。统计显著性评估采用双侧,双样本的学生t以及(* * *P= 0.00029)。RNAi (按):最小值为10.28;最大,11.4;值,10.845;第一四分位数,10.375;第三个四分位数,11.31。对照:最低,7.95;最大,8.85;值,8.26;第一四分位数,8.06;第三个四分位数,8.6。e法氏囊管发育负调控模型Smed-glp等位基因。
1号染色体还包含了已知的男性或女性生殖组织的四个主要调节因子中的三个(CPEB-1(ref。12),onecut13而且Bic-C5;dmd-1(ref。36)是例外)(图。4).的CPEB-1该基因是卵母细胞和卵黄腺发育所特别需要的12。的损失onecut而且Bic-C表达导致“无睾丸”表型而不影响卵巢5,13。在不重组的染色体上存在女性决定基因,为性染色体的进化提供了理想的基础。两条同源染色体中有一条的基因发生了功能丧失的突变,这条染色体就会变成决定男性的染色体。类似的逻辑也适用于男性决定基因。
性别特异性基因的单倍型特异性表达是性别引物常染色体的预测特征。为了验证这一预测,我们在性成熟的成虫和雄性交配器官阴茎乳头中检测了20种基因的表达7,在一个J/V线。选择这20个基因是因为它们在文献中被描述为具有性别特异性功能和/或表达,包括上述8个主调控基因5,12(补充表9).在这20个基因中,13个在编码序列中包含至少一个杂合变异,这使我们能够确定这些基因是否从J或V单倍型中偏倚表达(扩展数据图)。8).我们发现了一种凝胶蛋白12,中小企业-按在全虫和阴茎乳头中均以J单倍型表达为主,在雄性交配器官中单倍型特异性表达较多。其他4个基因在全虫(KY847529.1和KY847536.1)或阴茎乳头(KY847539.1和KY847539.1)中偏表达CPEB-2),另外两个基因在雄性交配器官(KY847532.1)或整个蠕虫(Smed-MSY4)中偏倚表达。4 b而且补充表9).所有7个基因都定位在反转位点或靠近反转断点(补充表5).
我们用FISH和杂交链式反应来证实Smed-glp在阴茎乳头和囊管高度富集7,37(扩展数据图。9),这是女性用来接收交配伴侣精子的器官。检查…的功能Smed-glp,我们使用了RNA干扰(RNAi)14,15来抑制它在幼仔体内的表达。经过8周的喂养,被击倒的和对照的幼龟都达到了性成熟。值得注意的是,在被击倒的动物中,囊管更为明显。4 c, d).雄性交配器官形态无明显差异。这些结果表明,J等位基因Smed-glp可能在防止女性法氏囊管过度发育方面发挥更大的作用(图。4 e),可能是通过控制器官特异性肌肉纤维的数量38。这与之前的观察相一致,即J/J个体表现出更高的卵子产量,表明对女性生殖的贡献更大(参考文献中的图4b)。24;补充信息).
这样,我们在雌雄同体的涡虫中鉴定出了一条染色体年代。 mediterranea不重组,丰富的生殖系统的主调控因子,显示等位基因特异性表达的性别相关基因,并包含基因同源的性染色体上的曼氏裂体吸虫(补充表9而且10,补充信息),这是已知唯一有性染色体分化的扁形蠕虫种39。这些观察结果共同引导我们提出年代。 mediterranea准备进化成性染色体。
1号染色体年代。 mediterranea标志着一个研究性染色体进化的有趣系统40。来自撒丁岛和科西嘉岛的涡虫为J和V单倍型杂合子,而西西里岛和突尼斯的涡虫为J/J纯合子。在J/V系的实验室杂交中,所有幼体均为J/V杂合子24。无论是在自然界还是在实验室杂交中,都没有发现V/V涡虫。我们对J/V个体之间的杂交单受精卵进行基因分型,确定纯合子(J/J或V/V)存在(扩展数据图)。10而且补充信息).我们认为,在自然和实验室杂交中,早期胚胎致死导致J/J和V/V成虫的损失。这种致死率可能是由于交叉抑制导致J和V单倍型上编码序列的退化。事实上,相对于基因组的其他部分,1号染色体具有更高的转座因子和引入终止密码子的突变率(补充表11)以及较高的非同义替代率(补充表13和扩展数据图。10 b).因此,J和V单倍型各自携带一组独特的功能基因,这些基因在另一单倍型上被沉默或截断(补充表11).
1号染色体上三个嵌套反转的存在表明,这条染色体上的重组抑制可能以与人类X和Y染色体相似的逐步进化方式进化17。为了支持这种可能性,我们观察到与反转区域相对应的三个进化层的证据。我们使用PacBio基因测序数据26来识别连接反转断点的长读取,并且我们验证了Hi-C (补充表12而且补充信息).我们观察到,在三种反转中,杂合位点和同义取代的比例都有所上升,其模式与进化层一致(图2)。2、补充表格5而且13、扩展数据图。10 b, c).我们使用了实验室杂交个体的深度全基因组测序数据24估计有性涡虫的从头突变率约为1.0 × 10−8每代核苷酸的突变数。根据这一估计,倒位3、1和2可能分别在大约45万代、32万代和26万代之前进化而来。
虽然不可能知道1号染色体将如何进化,但我们的发现提供了一个早期阶段的快照,支持性染色体从同源常染色体进化而来的假设,这些同源常染色体获得了性别特异性的作用,并停止重组16,17,18,19。锁定的J/V杂合系统可能通过在雌雄异株进化之前维持涡虫种群中的性别特异性等位基因来促进这一过程41。我们提出,涡虫1号染色体单倍型提供了一个独特的机会,直接检查一个性别启动常染色体的分子特征。
方法
真涡虫饲养,RNAi和表型
有性涡虫每周喂食一次有机牛肝。所有用于实验的动物都是随机选择的。对于RNAi,使用了来自菌株S2F10的大约2周大的幼崽。将1µg双链RNA与10µl肝糊混合制备RNAi食品15。为了检查RNAi表型,当动物自由游泳时,用蔡司立体显微镜(Zeiss)拍摄照片。多名研究人员在双盲实验设计中使用ImageJ软件测量蠕虫或囊管的长度。法氏囊管与整个蠕虫的比例被用来减轻蠕虫大小的潜在变化和由其柔软的身体引起的松弛程度。
染色体测序
染色体取自同一克隆系S2的多个动物,在实验室中通过截肢和再生保持。根据先前开发的方案,在无核酸酶膜载玻片(蔡司)上制备染色体扩增,但在最后一步,组织被解离成单个核并放置在载玻片上,而不使用盖玻片压扁42。在×40镜头下鉴定单个染色体,并通过PALM MicroBeam激光显微解剖(Zeiss)收集到单个PCR管的盖上。收集到的染色体用台式离心机在4µl PBS中旋转,用REPLI-g单细胞试剂盒(Qiagen)扩增微球中的DNA,在MiSeq或HiSeq 3000测序系统(Illumina)上测序。
染色体尺度的基因组组装
利用DpnII酶从S2株的多个动物中制备Hi-C测序文库。已排序的读取对齐到dd_Smes_g4.fasta26使用bwa mem(0.7.17版本)43。从SALSA准备了一个汇编文件3.最终的输出。fasta与juicebox_scripts(阶段基因组学)。.hic文件是由run-assembly- visuizer .sh从三维从头组装中准备的44。这两个文件被加载到Juicebox中4用于支架操作,使用分裂,合并,顺序和定向命令和染色体组装。使用juicebox_assembly_converter.py将修改后的组装文件(染色体规模)转换为fasta (Smed_chr_ref_v1)。
高碳图书馆建设
使用Phase Genomics Proximo Animal Kit 3.0版本生成Hi-C库。将大约4只蠕虫切碎,然后在室温下与1毫升Proximo交联溶液端到端混合交联20分钟。交联反应在室温下用淬火溶液终止15分钟,再次进行端到端混合。淬火组织用1×染色质漂洗缓冲液(CRB)漂洗一次,转移到液氮冷却砂浆中,研磨成细粉。粉末在700 μ l Proximo裂解缓冲液1中重悬,并在室温下在旋涡混合器上用玻璃珠裂解20分钟。使用低速旋转清除大的碎片,并将含有染色质的上清转移到新的管中。第二次高速旋转后,去除上清液,用1× CRB洗涤含有裂解物核部分的颗粒。去除1× CRB洗涤液后,将颗粒重悬于100 μ l Proximo裂解缓冲液2中,在65℃下孵育15 min。染色质在室温下与回收珠结合10分钟。将珠子放在磁架上,用200 μ l的1× CRB洗涤。
结合在珠上的染色质在150µl Proximo碎片缓冲液中重悬,并加入2.5µl Proximo碎片酶。反应在37℃下孵育1小时,冷却至12℃,然后用2.5µl整理酶孵育30分钟。加入6µl停止液后,用1× CRB洗涤,重悬于100µl加入5µl近距离连接酶的Proximo连接缓冲液中。在室温下端到端混合,近距离连接反应孵育4小时。在此基础上,加入5 μ l反向交联酶,在65℃下孵育1 h。
在反转交联后,用回收珠纯化游离DNA,并将Hi-C连接结合到链霉亲和素珠上,清洗以去除未结合的DNA。使用Proximo文库制备试剂,将洗净的珠粒用于制备成对端深测序文库。
卵母细胞和精子细胞测序
性成熟S2株动物的精子细胞被释放到无钙无镁缓冲液(1% BSA)中。将细胞解离液放在载玻片上,在相衬显微镜下检查以识别单个精子细胞。卵母细胞从卵囊中释放出来。将单个精子细胞或卵母细胞转入单个PCR管,用复制i -g单细胞试剂盒(Qiagen)进行扩增。RADseq文库和全基因组文库在HiSeq 3000或NovaSeq S2测序系统(Illumina)上制备并测序。RADseq测序数据如连锁图部分所述进行分析。全基因组测序数据如重组部分所述进行分析。
同线性分析
对于候选基因,感兴趣的基因的蛋白质序列是从Schmidtea标本。这些基因与年代。 曼氏基因组39使用蛋白质到核苷酸BLAST (tblastn)工具。为了系统地检测整个基因组的同步性,我们使用SonicParanoid (version 1.3.8)45鉴别之间一对一的蛋白质同源物年代。 mediterranea而且年代。 曼氏。的年代。 曼氏基因组组装(V9)及其蛋白质注释可在https://zenodo.org/record/5149023#.Ybk9jn3MK3I。
连锁图
一条J/J线D5与一条J/V线S2F8b交叉,形成一条F /V线2有93只动物。使用Easy-DNA gDNA纯化试剂盒(K180001, ThermoFisher)从每只动物的一个片段中提取基因组DNA。按照Adapterama III程序制备RADseq测序文库31做了一些修改。使用Stacks(版本2.41)识别遗传变异4647]。使用VCFtools过滤所有变量(版本0.1.14)48去除插入和删除,并选择双等位snv。位于200 bp以内的标记簇被移除,因为它们可能对应重复元素。不服从孟德尔隔离的标记也被删除。只使用双亲纯合子的标记。利用R/QTL构建连锁图谱49。
量化重组
将S2及其卵母细胞和精子细胞的测序reads用bwa mem (version 0.7.17)与Smed_chr_ref_v1进行比对。通过使用基因组分析工具包(GATK,版本4.1.4.1)与基因组数据库和基因型gvcf联合调用遗传变异50。通过去除异常标记进一步筛选S2中双等位基因杂合标记,包括配子中两个等位基因未分离的标记、近距离(< 200bp)的标记簇和精细胞中杂合性标记。J和V单倍型人工分型未重组卵母细胞,并用mpr .基因分型进行分型51所有配子。MPR。基因分型包也用于校正缺失或错误的基因型。最后的基因型箱用定制的R代码进行识别和可视化重组。重组的量化主要集中在沿着染色体的单倍型长轨迹之间的交叉。假定的基因转换事件,如单倍型开关的短轨迹包含<1%的染色体长度不包括在内。
基因表达分析
为了检测1号染色体上的基因含量,从NCBI序列阅读档案(SRA)下载了转录组数据。为了检查与性发育相关的基因,从性成年人的转录组9,12,52,性少年9和性成年人nhr-1RNAi9被使用。为了检测干细胞富集基因,使用了来自分选X1细胞和CIW4细胞的转录组53,54。
所有测序数据均以dd_Smed_v6(参考。27)使用bwa mem(版本0.7.17)。用DESeq2 (version 1.26.0)分析差异基因表达55。用kallisto在转录本水平定量表达(版本0.44.0)56并通过tximport导入并总结为基因级计数矩阵57。
Haplotype-specific表达式
为了检测生殖系统关键调控因子的单倍型特异性表达,从6只性成熟的S2 J/V系动物中提取mRNA,并将其作为3个生物重复进行分析,每个重复中汇集2只动物。从同一系的9只有性成年动物中解剖了9个阴茎乳头,并将其作为3个生物学重复进行分析,每个重复中汇集了3只动物的阴茎乳头。所有mRNA样本均在同一天提取,并同时进行文库制备和测序,以尽量减少技术差异。RNA-seq文库使用Clontech SMARTer搁浅总RNA-seq (Pico)试剂盒制备。该工作流程包括将总RNA转化为cDNA,然后通过PCR添加适配器进行Illumina测序。PCR产物被纯化,核糖体DNA被耗尽。用所有文库通用的引物进一步扩增cDNA片段。最后,对PCR产物再次进行纯化,得到最终的cDNA文库。使用不同的适配器在一个通道中进行多路采样。测序在Illumina NovaSeq 6000上进行,配对端读150bp。 Data quality checks were conducted using the Illumina Sequencing Analysis Viewer. Demultiplexing was performed using Illumina Bcl2fastq2 version 2.17.
所有测序数据均以dd_Smed_v6(参考。27)使用bwa mem(版本0.7.17)。为了确保准确性,使用整合基因组学查看器手动检查了14个感兴趣基因的单倍型特异性表达。外显子中每个双等位基因变体的J或V等位基因计数被确定。对于一个特定的基因,J和V单倍型的所有外显子上的所有变体的等位基因计数都是聚合的。然后对等位基因计数进行二项检验和Bonferroni校正58确定观察到的等位基因偏倚是否具有统计学意义。PBonferroni校正后> 1设置为1。
从头映射,参数优化和系统发育推断
所有数据集都通过从头管道运行,就像在Stacks 2.52版本中实现的那样(参考文献)。46,47).首先,使用PROCESS_RADTAGS对两端读取进行解复用和质量过滤,并将其截断为135 bp的长度。Phred分数低于30或未调用碱基的单个读取被丢弃(96.9%的读取通过了质量过滤器)。根据参考文献的指导原则确定了最佳参数。59通过运行从头管道的多次迭代,并在同一总体[Sic_mar]的13个样本子集上的每次新迭代中只改变一个参数,遵循建议60。我们将最小堆栈深度(-m)变化在1到6之间(m1-m6),允许在堆栈之间的错配数量(-m)变化在1到10之间(M1-M10),以及允许合并目录位点的错配数量(-n),同时保持所有其他参数不变(m3, M2和n0)。然后,我们使用样本表示截断80% (r80)比较样本间多态组装位点的数量,并在每次新迭代中获得或失去多态位点。一旦-m和-m被优化,我们通过评估多态位点数量的变化来评估-nn=米−1n=米而且n=米+ 1。然后使用堆栈中的denovo_map.pl包装器组装RAD位点,并设置以下参数:米= 3,米= 2和n= 3。
从群体中保留75%的个体中存在的组装位点,使用0.04(—min-maf)的小等位基因频率(MAF)过滤器过滤掉可能掩盖群体结构的单例snp,使用最大观察到的杂合度(—max-obs-het)过滤器去除潜在的副同源位点61。此外,为了构建系统发育树,我们将所有RADseq基因座经过过滤(——phlip -var-all)后拼接。采用RAxML-NG 0.9.0版本最大似然法构建系统发育树。62),从随机种子开始,应用GTR+G替代模型和1000个自举重复。来自Menorca (Sme7-5_men)的样本被用作外组来扎根树。
人口结构分析
在此分析中,我们排除了外群序列,并运行种群以保留在所有种群中存在的位点(- 10)和每个种群中存在的75%的个体(-r 0.75)。在通过筛选标准的位点的基础上,生成一个包含1000个位点的随机白名单,并再次以相同的标准遍遍population,但保留每个位点的第一个SNP(——write-single-snp)。输出以结构格式导出,结构版本2.3.4(参考。63)用于推断种群结构,其中1万条链为老化链,10万条MCMC链为20次迭代K=(1 - 11)。生成的文件通过结构收割机运行64,最优K确定了65。
DNA的鱼
对于卵母细胞染色体上的端粒FISH,如先前报道的那样解剖卵巢66,67。杂交进行的报告与染色体传播42除卵巢在洗涤缓冲液或杂交缓冲液中保持悬浮外。杂交前,用消化缓冲液(0.1% SDS和10µg ml)处理解剖卵巢−1蛋白酶K (Qiagen)在0.3% Triton X-100在PBS)室温下10分钟。图中重复位于着丝粒附近。2摄氏度有以下的序列:tcggacgggatttttttaatctttataggcttgtatctctgtcattttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttaattgcaaaaatcataacgggctcgtcaaacacaagagtcat。
杂交链式反应和RNA FISH
检查基因的组织表达按而且smedwi-1,我们使用从Molecular Instruments购买的第三代ISH链式反应探针和缓冲液。性成熟涡虫为7.5%N乙酰-l-半胱氨酸(Sigma-Aldrich) 10分钟,然后固定在4%多聚甲醛(电子显微镜科学;16%溶液在PBS中1:4稀释)20分钟。性交器被切开放入1.5 ml无rnase的试管中。其余的程序遵循分子仪器的完整小鼠胚胎的杂交链式反应RNA FISH协议。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
数据可用性
作者确认,作为研究结果基础的所有数据都是完全可获得的,不受限制。所有测序数据均可从NCBI SRA数据库(登录号PRJNA731187).染色体尺度的基因组组装为性美国mediterranea(包括相阶段基因组和具有重复元素的基因组)在plansphere (https://planosphere.stowers.org/)、计划矿(https://planmine.mpibpc.mpg.de/planmine/begin.do)、GenBank (GCA_022537955.1)及Zenodo (https://doi.org/10.5281/zenodo.5807415)数据库。我们使用公开的NCBI PacBio测序数据(登录号SRX2700681- - - - - -SRX2700684)和涡虫转录组数据(登录号SRR2658118- - - - - -SRR2658125,SRR2658134- - - - - -SRR2658141,SRR3473955- - - - - -SRR3473957,SRR3629945- - - - - -SRR3629952,SRR6351185- - - - - -SRR6351188,SRR6351201- - - - - -SRR6351204,SRR6351213- - - - - -SRR6351216,SRR6363910- - - - - -SRR6363927而且SRR6364586- - - - - -SRR6364588).
代码的可用性
数据分析的自定义代码可以在Zenodo数据库上公开访问https://doi.org/10.5281/zenodo.5807415。
参考文献
Lazaro, E. M.等人。Schmidtea mediterranea系统地理学:一个在地中海岛屿上生存的古老物种?BMC另一个星球。医学杂志。11, 274(2011)。
贝纳齐,M, Baguná, J.,巴莱斯特,R.,普契尼利,I. &帕帕,R. D.对«分类学的进一步贡献Dugesia Lugubris-Polychroa集团的描述Dugesia MediterraneaN.S.P. (tricadida, Paludicola)。博耳。黑旋风。42, 81-89(1975)。
伯顿,J. N.等。基于染色质相互作用的新生基因组组装的染色体尺度脚手架。生物科技Nat。》。31, 1119-1125(2013)。
杜兰德,n.c.等人。Juicebox为Hi-C接触地图提供了无限缩放的可视化系统。细胞系统。3., 99-101(2016)。
王永华,蔡瑞敏,郭涛,郭文杰,李文杰。nano功能对涡虫生殖细胞的发育和再生至关重要。国家科学院学报美国104, 5901-5906(2007)。
柯林斯,J. J. III等。全基因组分析揭示了肽激素在涡虫生殖系发育中的作用。公共科学图书馆杂志。8, e1000509(2010)。
庄婷婷,史建明,王玉玉,李志明。涡虫雌雄同体生殖系统的分子标记Schmidtea mediterranea。BMC发展生物学。11, 69(2011)。
Tharp, M. E. Collins, J. J. III和Newmark, P. A.涡虫生殖系统发育需要一种环光栖动物特异性核激素受体。Dev,杂志。396, 150-157(2014)。
张,S.等。核激素受体和脂质代谢轴是生殖器官维持和再生所必需的。预印在bioRxivhttps://doi.org/10.1101/279364(2018)。
艾耶,李志刚,李志刚,夏尔玛,李志刚。真涡虫中球状细胞的减数分裂功能Schmidtea mediterranea。国家科学院学报美国113, e3509-e3518(2016)。
Saberi, A., Jamal, A., Beets, I., schfs, L. & Newmark, P. A. GPCRs在涡虫中直接生殖系发育和体细胞性腺功能。公共科学图书馆杂志。14, e1002457(2016)。
Rouhana, L., Tasaki, J., Saberi, A. & Newmark, P. A.通过描述涡虫生殖系统的遗传解剖Schmidtea mediterraneaCPEB同系物。Dev,杂志。426, 43-55(2017)。
Li, P.等。单细胞分析曼氏裂体吸虫确定了一个控制生殖干细胞命运的保守遗传程序。Commun Nat。12, 485(2021)。
Newmark, p.a., Reddien, p.w., Cebrià, F. & Alvarado, a.s.摄取细菌表达的双链RNA抑制涡虫的基因表达。国家科学院学报美国One hundred., 11861-11865(2003)。
Rouhana, L.等人。体外合成双链RNA对涡虫的干扰:方法和动力学。Dev,力学。242, 718-730(2013)。
性染色体进化的动态观点。咕咕叫。当今。麝猫。Dev。16, 578-585(2006)。
人类X染色体上的四个进化层。科学286, 964-967(1999)。
动物Y性染色体的进化。生物科学46, 331-343(1996)。
查尔斯沃斯,性染色体的进化。科学251, 1030-1033(1991)。
在平衡致死因素的情况下,遗传变异,双胞胎杂交和恒定杂交。遗传学3., 422-499(1918)。
性染色体之间重组率的进化。费罗斯。反式。r . Soc。Lond。B372, 20160456(2017)。
雷迪恩,P. W. &桑切斯·阿尔瓦拉多,A.真涡虫再生基础。为基础。细胞发育生物学。20., 725-757(2004)。
纽马克,P. a .和桑切斯·阿尔瓦拉多,a .不是你父亲的理想主义者:一个经典模型进入了功能基因组学时代。Nat. Rev. Genet。3., 210-219(2002)。
郭丽丽,张珊珊,鲁宾斯坦,罗斯,E.和Alvarado, A. S.基因组杂合性的广泛维持Schmidtea mediterranea。Nat,生态。另一个星球。1, 19(2016)。
扎亚斯,R. M.等。真涡虫的Schmidtea mediterranea作为表观遗传生殖细胞规范的模型:雌雄同体菌株的ESTs分析。国家科学院学报美国102, 18491-18496(2005)。
Grohme, m.a.等人。基因组Schmidtea mediterranea以及核心细胞机制的进化。自然554, 56-61(2018)。
Brandl, H.等人。planmine -涡虫生物学和生物多样性的可开采资源。核酸测定。44, d764-d773(2016)。
罗柏,S. M.罗斯,E. &桑切斯·阿尔瓦拉多,A.史麦德:本Schmidtea mediterranea基因组数据库。核酸测定。36, d599-d606(2008)。
魏斯,A.等人。微解剖染色体区域的高通量测序。欧元。j .的嗡嗡声。麝猫。18, 457-462(2010)。
Ma, L.等人。用染色体显微解剖直接测定分子单倍型。Nat方法。7, 299-301(2010)。
Bayona-Vasquez, n.j.等人。Adapterama III:四索引,双/三酶RADseq文库(2RAD/3RAD)。PeerJ7, e7724(2019)。
杜布尚斯基,T. & Epling, C.在反转杂合子的交叉抑制果蝇pseudoobscura。国家科学院学报美国34, 137-141(1948)。
米勒,d.e.等。中国第二染色体平衡子的分子和遗传特征黑腹果蝇。G38, 1161-1171(2018)。
孙杨,Svedberg, J., Hiltunen, M., Corcoran, P. & Johannesson, H.大规模抑制重组先于基因组重排脉孢菌tetrasperma。Commun Nat。8, 1140(2017)。
郑,X.等。用于SNP数据相关性和主成分分析的高性能计算工具集。生物信息学28, 3326-3328(2012)。
钟,T, Collins, J. J. III, Brubacher, J. L, Zarkower, D. & Newmark, P. A.性别特异性转录因子控制同时雌雄同体的男性身份。Commun Nat。4, 1814(2013)。
海曼,l.h.in无脊椎动物,第二卷(Boell, E. J.) 52-458 (McGraw-Hill图书公司,1951)。
Bertin, B.等人。Gelsolin而且dCryAB作用于肌肉识别基因的下游,有助于防止肌肉分裂和分叉果蝇。科学。代表。11, 13197(2021)。
Buddenborg, S.等人。血吸虫的组装染色体曼氏裂体吸虫为其ZW性别决定系统的演化提供了见解。预印在bioRxivhttps://doi.org/10.1101/2021.08.13.456314(2021)。
查尔斯沃斯,B. &查尔斯沃斯,D.一个雌雄异株和雌雄异株进化的模型。点。Nat。112, 975-997(1978)。
Charlesworth, D. & David, S. in植物的性别决定,第1版(ed. Ainsworth, c.c.) 25-50 (Garland Science, 1999)。
郭,L.等。用于无脊椎研究生物的适应性染色体制备方法。BMC医学杂志。16, 25(2018)。
李,H. & Durbin R.快速和准确的短读对齐与Burrows-Wheeler变换。生物信息学25, 1754-1760(2009)。
杜琴科,O.等。从头组装的埃及伊蚊使用Hi-C的基因组产生染色体长度支架。科学356, 92-95(2017)。
Cosentino, S. & Iwasaki, W. SonicParanoid:快速,准确和简单的矫形推断。生物信息学35, 149-151(2019)。
Catchen, J., Hohenlohe, P. A., Bassham, S., Amores, A. & Cresko, W. A. Stacks:人群基因组学的分析工具集。摩尔。生态。22, 3124-3140(2013)。
Catchen, J. M., Amores, A., Hohenlohe, P., Cresko, W. & Postlethwait, J. H. Stacks:从短读序列构建和基因分型新生位点。G31, 171-182(2011)。
Danecek, P.等人。变量调用格式和VCF工具。生物信息学27, 2156-2158(2011)。
Broman, kw, Wu, H., Sen, S. & Churchill, G. A. R/qtl:实验杂交的qtl定位。生物信息学19, 889-890(2003)。
麦肯纳等人。基因组分析工具包:用于分析下一代DNA测序数据的MapReduce框架。基因组Res。20., 1297-1303(2010)。
谢伟,等。基于群体测序构建超高密度连锁图谱的亲本无关基因分型。国家科学院学报美国107, 10578-10583(2010)。
戴维斯,e.l.等人。组织内稳态和再生所需的成体干细胞的胚胎起源。eLife6, e21052(2017)。
曾,A.等。前瞻性分离的四span蛋白+新细胞是支撑涡虫再生的成体多能干细胞。细胞173, 1593-1608(2018)。
Duncan, E. M., Chitsazan, A. D., Seidel, C. W. & Sanchez Alvarado, A. Set1和MLL1/2靶向体内功能不同的基因组位点的不同集。细胞的代表。13, 2741-2755(2015)。
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。15, 550(2014)。
Bray, N. L, Pimentel, H., Melsted, P. & Pachter, L.近最优概率RNA-seq量化。生物科技Nat。》。34, 525-527(2016)。
Soneson, C., Love, m.i.和Robinson, m.d. RNA-seq的差异分析:转录水平的估计提高了基因水平的推断。F1000Res4, 1521(2015)。
词源:Bonferroni校正。紧急情况。感染。说。21, 289(2015)。
帕里斯,J. R.史蒂文斯,J. R. & Catchen, J. M.迷失在参数空间:堆栈的路线图。生态方法。另一个星球。8, 1360-1373(2017)。
Rochette, N. C. & Catchen, J. M.使用堆栈从RAD-seq短读数据中获得基因型。Protoc Nat。12, 2640-2659(2017)。
Stobie, C. S., Oosthuizen, C. J., Cunningham, M. J. & Bloomer, P.用RAD测序探索六倍体淡水鱼的系统地理学。生态。另一个星球。8, 2326-2342(2018)。
Kozlov, a . M., Darriba, D., Flouri, T., Morel, B. & Stamatakis, a . RAxML-NG:用于最大似然系统发育推断的快速、可扩展和用户友好的工具。生物信息学35, 4453-4455(2019)。
普里查德,J. K., Stephens, M. & Donnelly, P.利用多位点基因型数据推断种群结构。遗传学155, 945-959(2000)。
厄尔,D. a . &冯霍尔特,B. M.结构收割机:一个用于可视化结构输出和实现埃瓦诺方法的网站和程序。Conserv。麝猫。Resour。4, 359-361(2012)。
Evanno, G., Regnaut, S. & Goudet, J.使用软件结构检测个体集群的数量:模拟研究。摩尔。生态。14, 2611-2620(2005)。
郭,L.等。涡虫减数分裂的亚细胞分析暗示了核膜破裂中一个新的双膜泡化过程。预印在bioRxivhttps://doi.org/10.1101/620609(2019)。
郭,F.等。涡虫卵巢解剖进行超微结构分析和抗体染色。J. Vis. Exp。175, e62713(2021)。
Ouellette, L. A., Reid, R. W., Blanchard, S. G. & Brouwer, C. R. linkagemapview -渲染高分辨率链接和QTL地图。生物信息学34, 306-307(2018)。
确认
我们感谢L. Rouhana、G. Bruni和S. Zdraljevic的讨论;Z. Kashif, E. Belfer和B. Pakfar的真涡虫养殖;X. Li和加州大学洛杉矶分校基因组学和生物信息学技术中心,用于下一代测序。我们感谢曾轶、E. Noskova和D. Pasha就人口历史问题进行的讨论。我们感谢生命科学编辑专业的编辑服务。共聚焦激光扫描显微镜在加州大学洛杉矶分校加州纳米系统研究所的先进光学显微镜/光谱学实验室和徕卡微系统卓越中心进行,由NIH共享仪器拨款S10OD025017和NSF主要研究仪器拨款CHE-0722519资助。这项工作得到了霍华德·休斯医学研究所(L.K.)和海伦·海·惠特尼基金会(L.G.)的资助。
作者信息
作者及隶属关系
贡献
L.K.和L.G.对研究进行了概念化。L.G.协调了项目,进行了实验,并撰写了原始草案。L.G E.B.-D。和tv.l开发了单精子测序方法。l.g., k.k., k.h., e.w., C.C.和Y.W.收集数据。l.g., j.s.b., d.d.s。,米.R., J.B. and D.L. analysed the data. K.K., K.H., E.W., C.C. and Y.W. maintained planarian colonies. L.K., L.G., O.T.S. and A.S.A. edited the manuscript. A.S.A. provided the D5 and S2 strains, and sequencing data of a dozen oocytes. M.R. provided wild isolate DNA. L.K. acquired funding and supervised the project.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然感谢Bo Wang和其他匿名审稿人对这项工作的同行评审所做的贡献。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
扩展的数据图形和表格
扩展数据图1通过ChrSeq进行染色体分配。
(A-C)不同支架的染色体测序深度与连锁群分配一致。联动组:lg11 = chr1, lg1+lg4 = chr2, lg7 = chr3, lg17 = chr4。(D-F)不同支架的染色体测序深度与基因组组装smed_chr_ref_v1中的染色体分配一致。染色体测序样本:1号染色体(A, D);2号染色体(B, E);3号染色体(C, F)。
扩展数据图2通过染色质接触热图检测到涡虫基因组的假定反转。
(A)在Juicebox中显示的1号染色体染色质接触热图显示3个潜在的倒置(虚线矩形)。(B) 2号染色体上的复杂结构变异。绿色大纲:dd_Smes_g4脚手架。蓝色轮廓:染色体边界。
图3配子重组与野生染色体2、4杂合度分布。
(a -B) 2号和4号染色体上卵母细胞和精子的重组数量总结为小提琴图(a)和箱形图(B)。2号染色体上精子重组的中位数为3个,卵母细胞重组的中位数为2个,共来自49个精子和38个卵母细胞。4号染色体上重组的中位数是精子2次,卵母细胞1次,总共来自50个精子和26个卵母细胞。Chr2精子:min = 0, max = 7,中位数= 3,第一四分位数= 2,第三四分位数= 4。Chr2卵母细胞:最小值= 0,最大值= 7,中位数= 2,第一四分位数= 0,第三四分位数= 4;Chr4精子:min = 0, max = 7,中位数= 2,第一四分位数= 1,第三四分位数= 4;Chr4卵母细胞:最小值= 0,最大值= 3,中位数= 1,第一四分位= 1,第三四分位= 2。(C-D)在西西里岛(C)和撒丁岛(D),超过80%的2号和4号染色体上的野生分离物很少有一致的杂合位点。
图4 1号染色体呈环状的晚期I期卵母细胞的代表性图像。
来自> 40个卵巢和> 20个性菌株的100多个卵母细胞被检查是否存在环状染色体1。实验独立重复>10次,结果相似。在早期晚期卵母细胞的J/V株中,1号染色体总是形成一个环。图中显示的是8个不同卵母细胞在前期i的染色体。箭头指向环状染色体1。
图5野生分离株的系统发育树Schmidtea mediterranea。
这棵树的根是一只来自梅诺卡岛的无性动物(Sme7-5)。左边的树(A)包括来自SAR和SIC的两只动物,它们的基因组杂合度高于来自相同收集点的队列。系统发育关系与先前东方和西方种群的指定一致1。特别行政区:撒丁岛;心脏:科西嘉岛;SIC:西西里;桶:突尼斯。
扩展数据图6固定指数(F圣)野生分离株分析。
成对总体F圣所有来自撒丁岛(SAR)、科西嘉岛(COR)、梅诺卡岛(MEN)、西西里岛(SIC)和突尼斯(TUN)的收集地点。蓝色圆圈(右上)的大小和暗度对应F的值圣(左下角)。
图7野生分离株的结构分析。
Evanno分析支持K = 2分割,将样本在地理上分为东方和西方组。当K = 3时,其余3组均出现突尼斯信号(浅蓝色)。
扩展数据图8检测单倍型特异性表达的数据集。
测序从基因组(j -单倍型卵母细胞,v -单倍型卵母细胞,二倍体S2蠕虫)和转录组(pp, ww来自二倍体S2蠕虫)读取到Smed_chr_ref_v1。图中显示的是基因CPEB-2的读数。带有J和V等位基因的两个变体用彩色条标记。在成虫S2的基因组(即DNA)中,J和V等位基因都以相等的比例存在。在卵母细胞(J或V单倍型,即DNA)的基因组中,变体只有一个等位基因。这些观察结果证实了杂合变异。在S2成虫的阴茎乳头(pp)和全虫(ww)的转录组(即RNA)中,J和V等位基因都存在。在pp的三个转录组中,J等位基因均有较高的表达。在ww的3个转录组中,J:V等位基因比例存在差异,且没有明显偏离等表达。
扩展数据图9smed-glp在男性生殖器官(阴茎乳头)和女性生殖器官(囊管)。
表达按基因(红色)和干细胞标记smedwi-1(绿色)在解剖交配器中可见荧光原位杂化链式反应。(A)白色虚线勾勒出阴茎乳头和囊管。核用DAPI染色(蓝色)。没有按阴茎乳头或囊管周围组织的表达。少于1%按+细胞表达干细胞标记物smedwi-1。(B)表达这两种标记的细胞确实存在于法氏囊管和阴茎乳头中。这个实验用6只性成熟的蠕虫独立重复了3次,产生了类似的结果。
扩展数据图10Schmidtea mediterranea。
(A) 3号染色体上有差异SNP标记的两个J/V系杂交。收集受精卵进行基因分型。染色体3杂合标记验证受精的发生。受精卵中1号染色体的3个基因型均为J/J、J/V和V/V。(B-C) J/V菌株S2各杂合位点的非同义分化度(B)和同义分化度(C)及其在不同染色体上的分布用箱线图总结。1号染色体具有最高的平均值(红点)和中位数dN或dS值。每条染色体dN (B)的最小值、最大值、中位数、平均值、第一四分位数和第三四分位数如下:chr1 = (0,0.0052, 0,0.0017, 0,0.0021), chr2 = (0,0,0,0.000092, 0,0), chr3 = (0,0,0,0.00031, 0,0), chr4 =(0,0,0,0.000088, 0,0)。每条染色体dS (C)的最小值、最大值、中位数、平均值、第一四分位数和第三四分位数如下:chr1 = (0,0.024, 0.0022, 0.006, 0,0.0098), chr2 = (0,0,0,0.00021,0,0), chr3 = (0,0,0,0.00093,0,0), chr4 =(0,0,0,0.00026,0,0)。(D) J/V菌株S2中所有杂合位点的同义散度及其在1号染色体3个反转位点和其余基因组中的分布,用箱线图总结。dS的平均值(红点)和中位数依次下降:反转3 (inv3),反转1 (inv1),反转2 (inv2),以及基因组的其余部分(非INV)。单因素方差分析(One way ANOVA)和Turkey Honest显著性差异检验(Significant Differences)显示,三种反演的dS差异显著(inv2-inv1: p.adj = 0.005; inv3-inv1: p.adj < 1e-06; inv3-inv2: p.adj < 1e-06). The min, max, median, mean, first quartile, and third quartile of dS for each inversion are as following: inversion 1 = (0, 0.026, 0.0034, 0.0064, 0, 0.01), inversion 2 = (0, 0.021, 0.0026, 0.0053, 0, 0.0083), inversion 3 = (0, 0.036, 0.0084, 0.0091, 0, 0.015), and non-inversion = (0, 0, 0, 0.0005, 0, 0). A total of 8317 genes from chromosome 1, 6568 genes from chromosome 2, 3394 genes from chromosome 3, and 1834 genes from chromosome 4 were plotted for non-synonymous divergence (B) and synonymous divergence (C). A total of 6633 genes from inversion 1, 754 genes from inversion 2, 298 genes from inversion 3, and 12428 genes from the rest of the genome were plotted for synonymous divergence (D).
补充信息
补充信息
该文件包含补充讨论和方法。
补充表1
将481个支架分配到17个测序染色体上。给出了dd_Smes_g4中481个支架的染色体样本信息(倍性、身份和潜在污染)、测序覆盖率和每个支架的染色体分配。对于染色体分配,0表示无法被ChrSeq分配到染色体上的支架,5表示被ChrSeq分配到两条染色体上的支架,1-4为染色体。
补充表2
通过Hi-C染色质接触测序将481个dd_Smes_g4支架连接到染色体中。给出了分配给或未分配给Smed_chr_ref_v1 (chrAssembly)的dd_Smes_g4支架,它们在原始Hi-C测序数据的SALSA组装中的身份(salsa_scaffold)以及ChrSeq对它们的染色体分配。对于染色体分配,0表示无法被ChrSeq分配到染色体上的支架,5表示被ChrSeq分配到两条染色体上的支架,1-4为染色体。
补充表3
最终染色体尺度的基因组组装总结(Smed_chr_ref_v1)。Hi-C在dd_Smes_g4中检测到26个装配错误,其中5个经ChrSeq验证为染色体间误连接。共有97个dd_Smes_g4支架没有分配给Smed_chr_ref_v1。
补充表4
遗传标记和从F2映射人口(图1d的支持数据)。L.3、L.6和L.8连锁群仅包含1个遗传标记,未列入表中。染色体2和4分别分裂成两个连锁群,可能是由于F2人口的映射。
补充表5
近交谱系中保持杂合性的遗传变异分布(图2a的支持数据)。染色体被分成10 mb的窗口。从S2 ~ S2F9b的近交谱系中鉴定出杂合变异。
补充表6
1号染色体在F2人口。遗传标记在J/V亲本(parent_S2F10B_2A和parent_S2F10B_2B)为杂合,在J/J亲本(parent_D5-1)为纯合,均为无性系。291 F的RADseq基因分型数据2列举了一些例子。291f2样本对应93个不同的分离剂。0/0,纯合参考等位基因;1/1,纯合交替等位基因;0/1,杂合的;。/。,米issing data.
补充表7
配子中的重组(图2b和扩展数据图3a, b的支持数据)。在20mb窗口内,在S2 J/V系中鉴定并用于染色体1和3交叉评估的杂合变异分布如图所示。还显示了染色体1和3上每个配子识别的交叉数。
补充表8
撒丁岛和西西里岛野生分离株的1号染色体基因型(支持图3d, e的数据)。收集了撒丁岛6个不同收集点和西西里岛2个不同收集点的基因分型数据。第一行显示单个动物的名称。0/0,纯合参考等位基因;1/1,纯合交替等位基因;0/1,杂合的;。/。,米issing data.
补充表9
男性和女性基因的等位基因特异性表达(支持图4a, b的数据)。从已发表的工作中鉴定出具有良好性别相关功能的基因。它们在Smed_chr_ref_v1和美国曼测定染色体。在整个蠕虫和分离的雄性交配器官阴茎乳头的转录组中,对9个雄性或雌性基因中的每一个表达的J或V等位基因进行了量化。
补充表10
之间的正交正交的分布美国mediterranea而且美国曼染色体。同源基因间共有的同源基因的数目美国mediterranea而且美国曼染色体是给定的。Sman_W为的性染色体美国曼。
补充表11
转座子和停止密码子突变在不同染色体上的分布美国mediterranea。显示了g4wRepeat_chr_ref不同染色体上的转座子、短重复序列等重复元素的数量,以及smed_chr_ref_v1不同染色体上的终止密码子的数量。smed_chr_ref_v1基因组分期为J单倍型或V单倍型(补充信息)。
补充表12
跨越1号染色体上三个反转的远端的桥接读。使用公开的PacBio测序数据(SRX2700681-SRX2700684)来识别染色体1上三个反转的断点。相同的读取被对齐到smed_chr_ref_v1和g4wRepeat_chr_ref。带有重复unmasking (g4wRepeat_chr_ref)的程序集标识了更多的桥接读取,特别是对于反转1。
补充表13
J/V菌株S2编码区域的同义发散性(支持扩展数据图10b, c)。采用S2阶段基因组来确定编码区域的同义发散性。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
郭,L,布鲁姆,j.s.,杜斯-瑟瑞特,D。et al。性涡虫中性别启动常染色体的岛特异性进化。自然606, 329-334(2022)。https://doi.org/10.1038/s41586-022-04757-3
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41586-022-04757-3
这篇文章被引用
有性倾向的染色体
自然(2022)