摘要gydF4y2Ba
过氧化物酶体是普遍存在的细胞器,容纳各种代谢反应,对人类健康至关重要gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.腔内过氧化物酶体蛋白通过移动受体从细胞质中输入,然后通过一个尚不清楚的过程循环回细胞质gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.回收需要通过膜嵌入的泛素连接酶复合物修饰受体,该复合物包含三个环指结构域蛋白质(Pex2, Pex10和Pex12)gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba.在这里,我们报道了连接酶复合物的冷冻电子显微镜结构,结合生化和体内实验,揭示了它作为过氧化物酶体输入受体的逆转录易位通道的功能。复合物的每个亚基贡献5个跨膜片段,共同组装成一个开放通道。三个环指结构域形成一个细胞质塔,环指2 (RF2)位于通道孔上方。我们提出,循环受体的N端从过氧化物酶体腔内插入孔中,并被RF2单泛素化,以使提取到细胞质中。如果循环受损,受体在RF10和RF12的协同作用下多泛素化并降解。这种多泛素化途径也维持其他过氧化物酶体输入因子的稳态。我们的研究结果阐明了过氧化物酶体蛋白导入过程中的一个关键步骤,并揭示了为什么连接酶复合物中的突变会导致人类疾病。gydF4y2Ba
主要gydF4y2Ba
过氧化物酶体是存在于大多数真核细胞中的膜界细胞器。它们参与必要的细胞代谢,特别是脂肪酸的氧化和活性氧的破坏。大多数过氧化物酶体代谢酶存在于腔内,但在细胞质中合成并输入细胞器gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.过氧化物酶体的重要性在其生物发生的人类遗传疾病中被突出,如齐薇格综合征gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
大多数管腔过氧化物酶体蛋白含有一个c端靶向信号(PTS1),该信号由Ser-Lys-Leu序列或其变体组成gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.PTS1信号在细胞质中被受体Pex5识别(在一些真菌中它的副产物Pex9),它与过氧化物酶体上的一个对接复合物结合,随后将货物运送到腔内。Pex5是否伴随货物进入腔内gydF4y2Ba8gydF4y2Ba或者整合到膜中成为易位通道的一部分gydF4y2Ba9gydF4y2Ba是有争议的,但至少有一部分似乎穿过了膜。为了开始一个新的导入周期,Pex5必须最终返回细胞质。这种循环需要在N端附近的保守Cys上对Pex5进行单泛素化,并由六聚体双环atp酶提取,其中包括交替的Pex1和Pex6亚基gydF4y2Ba10gydF4y2Ba.受体如何重新出现在细胞质中,使单泛素化和反转录易位跨膜尚不清楚。gydF4y2Ba
其他管腔蛋白的导入依赖于PTS2信号,Pex7识别的n端序列和真菌中的其他受体包括Pex18, Pex20和Pex21(参考文献)。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba).这些受体与Pex5相似,因为它们也在保守的n端Cys上单泛素化,并通过Pex1-Pex6 atp酶返回细胞质。当Pex5或其他受体的正常循环被阻断时,例如,通过失活Pex1-Pex6 atp酶,受体转而在Lys残基上多泛化,随后被蛋白酶体降解。这种替代途径被称为“缺乏循环的受体积累和降解(RADAR)”。gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
受体的单泛素化和多泛素化都由保守的膜包埋泛素连接酶(E3)复合物催化,由Pex2, Pex10和Pex12组成(参考文献)。gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba).在酵母中,单泛素化也需要泛素偶联(E2)酶Pex4及其膜锚定激活剂Pex22;在高等生物中,这些酶可能被更混杂的E2酶所取代gydF4y2Ba13gydF4y2Ba.多泛素化需要E2酶Ubc4或其同源物gydF4y2Ba14gydF4y2Ba.Pex2, Pex10和Pex12都有无名指结构域gydF4y2Ba6gydF4y2Ba,是许多泛素连接酶的标志。然而,三个无名指蛋白的参与是独特的,关于它们在单泛素化和多泛素化中的作用存在矛盾的数据gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.目前还不清楚连接酶复合物是否只催化受体的泛素化或也促进它们的逆转录易位,类似于泛素连接酶如何介导错误折叠的蛋白质从内质网(ER)到细胞质降解(ERAD)的逆转录易位。gydF4y2Ba17gydF4y2Ba.gydF4y2Ba
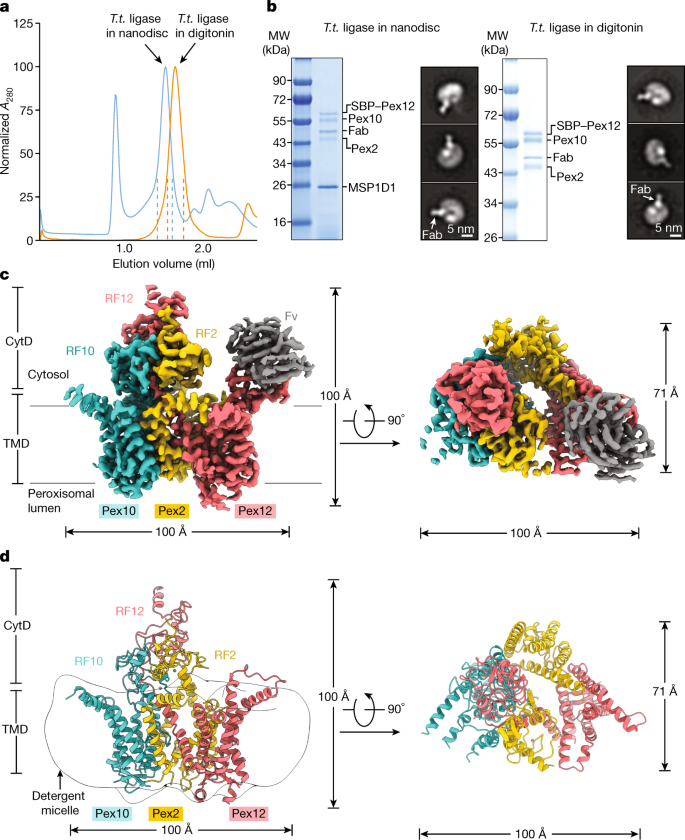
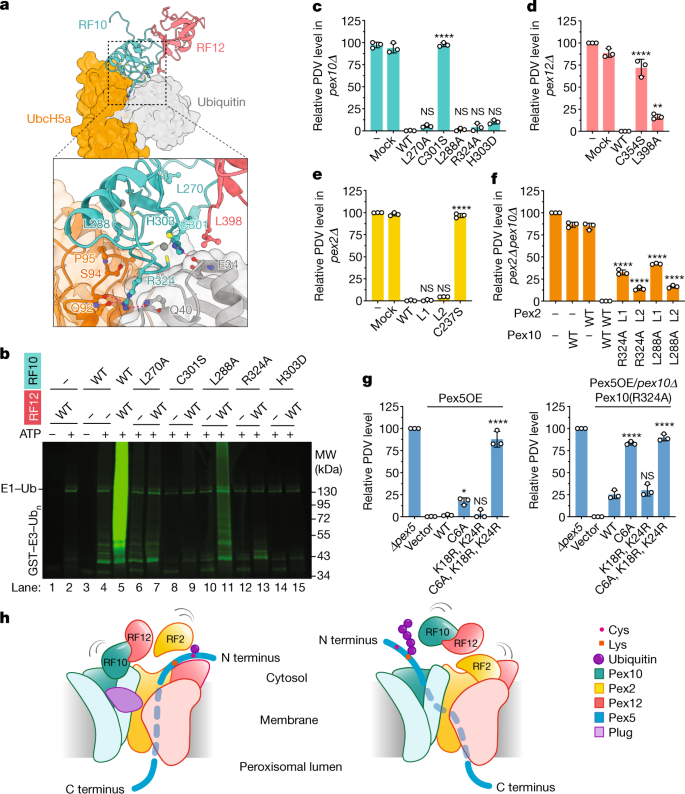
结构测定gydF4y2Ba
为了阐明过氧化物酶体连接酶复合物的功能,我们使用来自嗜热真菌的Pex2, Pex10和Pex12测定了其冷冻电子显微镜(cro - em)结构gydF4y2BaThermothelomyces酸奶gydF4y2Ba,与中相应蛋白高度同源gydF4y2Ba酿酒酵母gydF4y2Ba和高级生物(扩展数据图。gydF4y2Ba1gydF4y2Ba).这三种蛋白在gydF4y2Ba毕赤酵母属pastorisgydF4y2Ba并通过亲和层析和凝胶过滤在洗涤剂中纯化洋地黄苷。它们形成了大约150 kDa的稳定的1:1:1的络合物gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba1 a, bgydF4y2Ba).用同源物得到了相似的配合物gydF4y2Ba酿酒酵母gydF4y2Ba或gydF4y2Ba毛壳菌属thermophilumgydF4y2Ba(扩展数据图。gydF4y2Ba2gydF4y2Ba).为了增加颗粒的大小并便于定向它们进行低温电镜分析,我们使用噬菌体显示诱变来生成针对病毒的fabgydF4y2Bat .酸奶gydF4y2Ba连接酶复合物被重组成纳米圆盘。其中一种fab与纳米盘和洋地黄苷中的连接酶复合物强烈结合(图2)。gydF4y2Ba1 a, bgydF4y2Ba),可能形成一个从表面突出的环(图。gydF4y2Ba1 bgydF4y2Ba).在3.1 Å总分辨率下测定了洋地黄苷中Pex2-Pex10-Pex12-Fab配合物的冷冻电镜结构(扩展数据图)。gydF4y2Ba3 gydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).密度图(图;gydF4y2Ba1 cgydF4y2Ba)可以为蛋白质的所有部分建立模型(图;gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba3 ggydF4y2Ba),除了一些在其他物种中不可见且不保守的循环(扩展数据图。gydF4y2Ba1gydF4y2Ba).Fab结合到由Pex12细胞质环形成的腔中(图12)。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba3 hgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, fab结合的凝胶过滤剖面gydF4y2Bat .酸奶gydF4y2Ba(gydF4y2BaT.t。gydF4y2Ba)连接酶复合物(Pex2 (140-495), Pex10(1-454)和Pex12(1-439)与n端链霉亲和素结合肽(SBP)标签)在纳米盘或洋地黄苷中。gydF4y2BabgydF4y2Ba中虚线之间的峰值分数gydF4y2Ba一个gydF4y2Ba采用SDS-PAGE、考马斯蓝染色和EM阴性染色对其进行分析。MSP1D1为纳米盘的支架蛋白。白色箭头表示绑定Fab。结果具有代表性的3个生物重复序列。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.MW,分子量。gydF4y2BacgydF4y2Ba,结合Fab的连接酶复合物的Cryo-EM密度图,从侧面和细胞质看。这张地图是用锉刀削尖的gydF4y2BaBgydF4y2Ba因子为−80.0 ÅgydF4y2Ba2gydF4y2Ba曲线上显示的是0.041。CytD,胞浆结构域;Fv, Fab可变畴;TMD,膜嵌入结构域。gydF4y2BadgydF4y2Ba,连接酶复合物模型。指出了洗涤剂胶束的边界。gydF4y2Ba
连接酶复合物的结构gydF4y2Ba
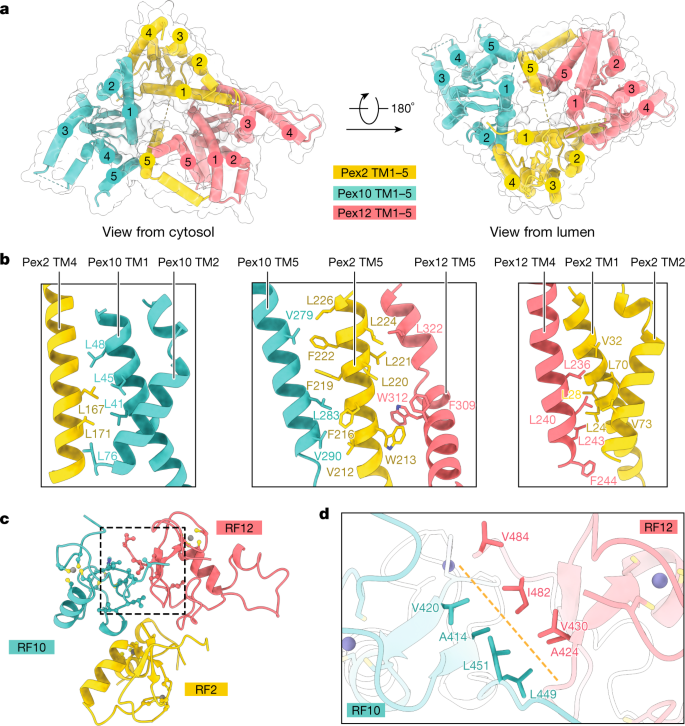
这三个Pex蛋白与它们的跨膜片段形成一个通道,与它们的环指结构域形成一个细胞质塔(图。gydF4y2Ba1 c, dgydF4y2Ba).每个蛋白质都有5个跨膜片段,由于它们的亲水性,大部分在预测中被遗漏了gydF4y2Ba18gydF4y2Ba.这三个蛋白质的序列不相关,但它们的五个跨膜片段中的四个形成了重叠的结构(扩展数据图。gydF4y2Ba4gydF4y2Ba),表明有共同的祖先。无名指塔由膜近端RF2和RF10结构域以及更远端的RF12结构域组成(图2)。gydF4y2Ba1 dgydF4y2Ba).RF12通过一个中心连接段与Pex12的膜嵌入结构域连接,该中心连接段穿过RF2和RF10之间的接口,包含几个保守的Pro残基(扩展数据图)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
膜嵌入结构呈三角形gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba2gydF4y2Ba).Pex10和Pex12的5个跨膜段形成紧密的螺旋束,而Pex2的最后一个跨膜段(跨膜段5 (TM5))从TM1分离到TM4。Pex2在膜内与Pex10和Pex12广泛结合,同时利用TM5和TM1-4(图1)。gydF4y2Ba2 bgydF4y2Ba),而它的无名指与其他无名指结构域的相互作用很弱。gydF4y2Ba2摄氏度gydF4y2Ba),并且在用隔离域进行的凝胶过滤实验中不与它们结合(扩展数据图。gydF4y2Ba5 b, cgydF4y2Ba).相反,Pex10和Pex12在膜内不相互作用(图。gydF4y2Ba2gydF4y2Ba),并仅通过无名指域进行关联。RF10和RF12有广泛的接口(大约450 ÅgydF4y2Ba2gydF4y2Ba)(图。gydF4y2Ba2摄氏度gydF4y2Ba),由几个保守的疏水残基介导(图。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba1gydF4y2Ba),并且隔离域在凝胶过滤实验中相互作用(扩展数据图。gydF4y2Ba5 d, egydF4y2Ba).该结构表明,只有这三种蛋白质的组装才能形成稳定的复合物。致病点突变映射到跨膜片段,特别是Pex10和Pex12的簇,以及三个无名指结构域(扩展数据图)。gydF4y2Ba6 a、bgydF4y2Ba).gydF4y2Ba
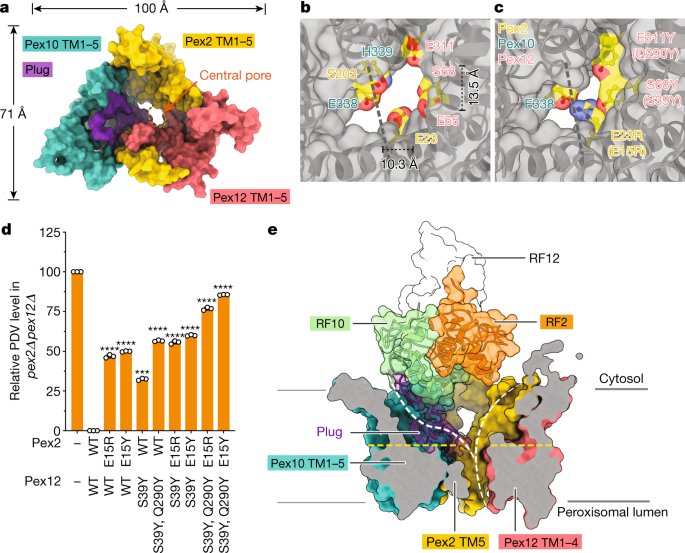
膜上开放的孔gydF4y2Ba
Pex蛋白的跨膜段形成一个具有开放孔的通道(图2)。gydF4y2Ba3 a, bgydF4y2Ba).一个短管状的Pex2环位于孔隙旁边,但在密度图中不可见(由虚线表示)。因为这一段只包含5个小氨基酸,它不太可能堵塞孔,留下直径约10 Å的开口。孔周围的一些残基是亲水且保守的(图。gydF4y2Ba3 bgydF4y2Ba和扩展数据图。gydF4y2Ba4 b, cgydF4y2Ba).在Pex2和Pex12的最后跨膜段之间的膜内可见一个意义不明的亲水腔。gydF4y2Ba4 dgydF4y2Ba).为了测试开放的孔隙是否为过氧化物酶体输入受体的再循环提供了易位路径,并因此对整个蛋白质输入到过氧化物酶体至关重要,我们在孔隙周围的位置引入了大块的残基(图2)。gydF4y2Ba3 cgydF4y2Ba)及评估进口gydF4y2Ba酿酒酵母gydF4y2Ba细胞。蛋白质导入检测测量色氨酸转化为绿色色素(原脱氧紫紫素(PDV))通过工程酶级联,其中最后一个酶(VioE)被一个附加的PTS1信号发送到过氧化物酶体,因此只能参与级联时,其导入受到损害gydF4y2Ba19gydF4y2Ba.与通过孔的受体易位一致,当孔的大小因体积较大的残基数量的增加而减小时,蛋白质的输入逐渐被抑制。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba5克gydF4y2Ba).因此,循环受体可能从过氧化物酶体管腔进入催化环指,而不是从膜的侧面进入,这与横向通道门的缺乏一致,并且有证据表明,受体Pex5在返回细胞质之前进入过氧化物酶体管腔gydF4y2Ba8gydF4y2Ba.RF2位于孔的正上方,这表明循环受体将其n端插入孔中,因此RF2可以在其保守的Cys上催化单泛素化。另外两个无名指距离更远,无法被位于孔内的多肽到达,因为通路被连接Pex10的最后一个跨膜段与其无名指结构域的环路阻塞(图2)。gydF4y2Ba3 a, egydF4y2Ba).然而,这个插头可能是灵活的,它的序列保守性很差(扩展数据图。gydF4y2Ba1gydF4y2Ba).事实上,蛋白质的导入并不是必需的(扩展数据图。gydF4y2Ba5 hgydF4y2Ba),而在高等生物中,它似乎更短或没有。gydF4y2Ba
一个gydF4y2Ba,连接酶复合物膜包埋部分的空间填充模型,从细胞质上观察。为了清晰起见,省略了射频塔。假定的插头用紫色表示。gydF4y2BabgydF4y2Ba,中央孔的放大视图,从管腔观察,突出显示孔内的残留物。孔洞的尺寸已标明。一个短段的管腔环,显示为虚线,是不可见的密度图。gydF4y2BacgydF4y2Ba,如gydF4y2BabgydF4y2Ba,但预测孔径因指示突变而减小。相应的突变gydF4y2Ba酿酒酵母gydF4y2Ba括号中所示。gydF4y2BadgydF4y2Ba野生型(WT)或突变型Pex2或Pex12表达为来自内源性启动子的flag标记蛋白gydF4y2Ba酿酒酵母gydF4y2Ba缺乏Pex2和Pex12的细胞(gydF4y2Bapex2Δpex12ΔgydF4y2Ba)(表达式级别参见扩展数据图。gydF4y2Ba5 hgydF4y2Ba).过氧化物酶体蛋白的导入是通过荧光色素(PDV)形成的减少来确定的。荧光测量细胞裂解液和数据归一化,设置荧光gydF4y2Bapex2Δpex12ΔgydF4y2Ba细胞为100%,WT细胞为0%。柱状图显示了三个生物重复的单个数据点、平均值和s.e.m.。采用单因素方差分析计算WT与突变体间的统计学差异。***gydF4y2BaPgydF4y2Ba< 0.01和****gydF4y2BaPgydF4y2Ba< 0.0001。请参见源数据文件。gydF4y2BaegydF4y2Ba,通过膜嵌入区域的空间填充模型的切面侧视图,与嵌入的卡通模型的密度显示插头。完整地显示了无名指区域。白色虚线表示多肽从管腔到细胞质的两种不同途径。左路径只能在塞子移位时使用。黄色虚线表示减孔残留所在平面(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba
连接酶通道的壁由单层跨膜片段组成,并包含被磷脂和固醇分子堵塞的小孔,磷脂的亲水头群面向通道内部(扩展数据图)。gydF4y2Ba6 c, dgydF4y2Ba).大约10 Å直径的孔可以解释为什么过氧化物酶体膜可以渗透小于约800 Da的分子gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.其他能被小分子渗透的膜只有线粒体、叶绿体和细菌的外膜。gydF4y2Ba
无名指结构域的结构与功能gydF4y2Ba
结构表明RF10是一个典型的无名指,有两个ZngydF4y2Ba2 +gydF4y2Ba由Cys和His残基配位的原子和两个保守环被预测与e2 -泛素缀合物(E2-Ub)相互作用gydF4y2Ba21gydF4y2Ba,一个回路包含残基L288和另一个R324(称为关键残基)gydF4y2Ba22gydF4y2Ba)(无花果。gydF4y2Ba2摄氏度gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).相比之下,RF2和RF12都不是典型的无名指。虽然RF2有两个环(L1和L2)有望与E2酶相互作用,但它们不包含在其他无名指中看到的保守氨基酸。RF2也缺乏关键位点残基。RF12与标准无名指的偏差更大。它只含有5个而不是7个保守的Cys残基,并且缺少第二个ZngydF4y2Ba2 +gydF4y2Ba原子,如图所示的冷冻- em结构(图;gydF4y2Ba2摄氏度gydF4y2Ba)的晶体结构gydF4y2Ba酿酒酵母gydF4y2Ba我们在1.5 Å分辨率下确定的同源物(扩展数据图。gydF4y2Ba7一个gydF4y2Ba及扩展数据表gydF4y2Ba2gydF4y2Ba).因此,RF12预计不会与E2酶相互作用。gydF4y2Ba
无名指结构域的结构特征与使用分离的无名指和E2酶Ubc4的体外多素化测定结果一致。RF10有一些低活性,而RF2和RF12都是不活跃的(图。gydF4y2Ba4 bgydF4y2Ba、4车道和扩展数据图。gydF4y2Ba8gydF4y2Ba).RF12是RF10的激活剂,它极大地刺激了RF10的多泛素化(图10)。gydF4y2Ba4 bgydF4y2Ba这与之前的研究结果一致gydF4y2Ba5克ydF4y2Ba.预测RF10中取消E2结合(L288A或R324A)或与RF12相互作用(L270A)的突变没有或低活性(11、13和7通道)。RF12刺激RF10活性的机制可以从与RF10 - RF12复合物结构最相似的同型二聚体环指连接酶的比较中推导出来;这种环指二聚体含有结合的E2-UbgydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba预测Pex12的L398与泛素单螺旋末端相互作用(图2)。gydF4y2Ba4gydF4y2Ba和扩展数据图。gydF4y2Ba7 b, cgydF4y2Ba).在体外实验中,L398的突变大大降低了RF12的刺激作用(扩展数据图)。gydF4y2Ba8 bgydF4y2Ba).因此,RF10和RF12可能作为一个单元在多泛素化作用中发挥作用。gydF4y2Ba
一个gydF4y2Ba,预测RF10与E2-Ub的相互作用。与泛素(Protein Data Bank ID: 4AP4)结合的UbcH5a被停靠在RF10-RF12复合物的Pex10上。RF10是一个gydF4y2Ba酿酒酵母gydF4y2Ba由同源模型导出gydF4y2Bat .酸奶gydF4y2Ba低温电子显微镜的结构。RF12是一种晶体结构(扩展数据图。gydF4y2Ba7一个gydF4y2Ba).放大图显示了氨基酸之间的相互作用(红色虚线)。gydF4y2BabgydF4y2Ba,在Uba1、Ubc4、dylight800标记的泛素和ATP存在下,用WT或突变体RF10或RF12进行多泛素化反应。结果具有代表性的3个生物重复序列。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2Ba, WT或突变体Pex10在gydF4y2Ba酿酒酵母gydF4y2Ba缺乏Pex10的细胞(gydF4y2Bapex10ΔgydF4y2Ba).“Mock”表示细胞只表达一种抗生素抗性基因。蛋白质的输入是由荧光色素(PDV)形成的减少决定的。细胞裂解物中的荧光被归一化,设置荧光gydF4y2Bapex10ΔgydF4y2Ba细胞为100%,WT细胞为0%。柱状图显示了三个生物重复的单个数据点、平均值和s.e.m.。采用单因素方差分析计算WT与突变体间的统计学差异。NS,不显著;*gydF4y2BaPgydF4y2Ba< 0.1, **gydF4y2BaPgydF4y2Ba< 0.05, ****gydF4y2BaPgydF4y2Ba< 0.001。请参见源数据文件。gydF4y2BadgydF4y2Ba,如gydF4y2BacgydF4y2Ba,但对于gydF4y2Bapex12ΔgydF4y2Ba.gydF4y2BaegydF4y2Ba,如gydF4y2BacgydF4y2Ba,但对于gydF4y2Bapex2ΔgydF4y2Ba.gydF4y2BafgydF4y2Ba,如gydF4y2BacgydF4y2Ba,但对于gydF4y2Bapex2Δpex10ΔgydF4y2Ba.L1和L2表示Pex2环突变。gydF4y2BaggydF4y2Ba在WT细胞或Pex10(R324A)突变细胞中,WT或突变体Pex5过表达(Pex5OE)。向量,没有Pex5的向量。gydF4y2BahgydF4y2Ba,受体循环途径涉及RF2的单泛素化(左模型),降解途径涉及RF10和RF12的多泛素化(右模型)。RF10为活动域。gydF4y2Ba
为了测试RF10和RF12在过氧化物酶体蛋白输入中的作用,我们将内源性的Pex10或Pex12替换为gydF4y2Ba酿酒酵母gydF4y2Ba多泛素化缺陷的无名指突变体。Pex10突变体L270A, L288A, R324A和H303D,以及Pex12突变体L398A,与相应的野生型蛋白一样活跃(图。gydF4y2Ba4 c, dgydF4y2Ba).即使是Pex10(L288A)和Pex12(L398A)的组合也没有导致导入缺陷(扩展数据图。gydF4y2Ba8 cgydF4y2Ba).因此,RF10-RF12的多泛素化在过氧化物酶体蛋白导入和正常受体循环中是不可缺少的。据此,人类突变(H310D/Q和R331Q),相当于gydF4y2Ba酿酒酵母gydF4y2BaH303D和R324Q导致相对轻微的疾病表型gydF4y2Ba25gydF4y2Ba.相反,预测影响ZngydF4y2Ba2 +gydF4y2Ba配合物(Pex10中的C301S和Pex12中的C354S)的结合和折叠取消了体内导入(图。gydF4y2Ba4 c, dgydF4y2Ba).因此,人类无名指蛋白质中的Cys突变会导致严重的齐薇格综合征gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
为了更好地理解rf10 - rf12依赖的多泛素化作用,我们通过定量蛋白质组学方法鉴定了该通路的底物gydF4y2Ba酿酒酵母gydF4y2Ba.在表达多泛素化缺陷Pex10突变体R324A的细胞中,过氧化物酶体导入受体Pex5、Pex9和Pex18积累(扩展数据图)。gydF4y2Ba9gydF4y2Ba).底物还包括受体对接复合物的组分gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,特别是Pex13(扩展数据图。gydF4y2Ba9gydF4y2Ba).其他过氧化物酶体蛋白保持不变。这些数据表明,多泛素化途径不仅介导受体的降解(RADAR途径),而且还维持其他重要因子的稳态,这与报道的几种过氧化物酶体膜蛋白的连接酶依赖性降解一致gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.gydF4y2Ba
接下来,我们测试了第三个无名指(即RF2)的作用。设计RF2突变预防ZngydF4y2Ba2 +gydF4y2Ba结合(C237S)取消了蛋白质导入(图;gydF4y2Ba4 egydF4y2Ba),但不影响连接酶复合物的组装(扩展数据图。gydF4y2Ba5 fgydF4y2Ba).RF2的L1和L2环(P223A/R224D和D257A)的突变预计会减少与E2酶的相互作用,但没有引起输入缺陷(图2)。gydF4y2Ba4 egydF4y2Ba).然而,当这些突变与多泛素化缺陷的Pex10突变R324A或L288A结合时(它们本身也是良性的),输入显著减少,尤其是L1突变(图2)。gydF4y2Ba4 fgydF4y2Ba).因此,RF2介导的受体单泛素化可能在环突变体中受损,但由pex10pex12介导的多泛素化补偿。gydF4y2Ba
为了进一步测试RF2在单泛素化途径中的作用,我们在中过表达了Pex5突变体gydF4y2Ba酿酒酵母gydF4y2Ba含有内源性Pex5的细胞。过度表达的Pex5(C6A),一种缺乏Cys的突变体,通常由单泛素修饰gydF4y2Ba14gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,在野生型细胞中只引起轻微的输入缺陷(图。gydF4y2Ba4 ggydF4y2Ba).因此,C6A突变体没有阻断内源性Pex5的连接酶通道,即使它不能通过单泛素化途径从孔中提取。相反,孔隙似乎通过多泛素化(即RADAR)途径清除了过表达的突变蛋白。事实上,进口大幅减少(图。gydF4y2Ba4 ggydF4y2Ba)当C6A突变与排除Pex5多泛化的Lys突变结合时(K18R和K24R)gydF4y2Ba14gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.K18R/K24R突变本身没有引起输入缺陷(图2)。gydF4y2Ba4 ggydF4y2Ba).与RF10 - rf12介导的Pex5多泛素化一致,C6A突变在RF10突变的多泛素化受损细胞(R324A)中表达时,也会引起同样强烈的输入缺陷(图3)。gydF4y2Ba4 ggydF4y2Ba).相比之下,当C6A突变体在携带RF2 L1环突变的菌株中表达时,几乎看不到影响(扩展数据图)。gydF4y2Ba8 dgydF4y2Ba).因此,这些结果表明RF2介导受体循环途径中正常的单泛素化,而RF10-RF12的多泛素化则在循环途径受损时防止连接酶通道的堵塞。与RF2催化单泛素化一致,当Pex5 K18R/K24R突变体在RF2突变株中表达时,输入量减少了约50%(与野生型Pex5相比)。gydF4y2Ba8 dgydF4y2Ba),而在rf10突变株中未观察到输入缺陷(图10。gydF4y2Ba4 ggydF4y2Ba).值得注意的是,我们无法在体外用分离的RF2或全长连接酶复合物证明Pex5的单泛素化,这可能是因为该反应可能需要受体适当插入连接酶孔或其他成分的存在。gydF4y2Ba
连接酶功能模型gydF4y2Ba
我们的结果支持了一个模型,即过氧化物酶体输入受体进入细胞器腔,然后输出回细胞质gydF4y2Ba8gydF4y2Ba.在输出过程中,非结构的n端段会从管腔侧插入通道孔,这样保守的Cys残基就可以在RF2和Pex4(或者在高等生物中,另一个E2)的联合作用下被修饰(图2)。gydF4y2Ba4 hgydF4y2Ba).单泛素化受体随后被Pex1-Pex6 atp酶提取到细胞质中。当受体循环受损时,n端段会横向移动以达到RF10,这一运动需要塞的位移(图2)。gydF4y2Ba4 hgydF4y2Ba).然后RF10将与RF12和Ubc4(或其同源物)合作,多泛化邻近Lys残基上的受体。多泛素化的受体将被另一个atp酶从连接酶通道中提取,可能是Cdc48(哺乳动物中的p97或VCP),最后由蛋白酶体降解。这种多泛素化途径也用于降解其他过氧化物酶体膜蛋白。在我们的低温电镜结构中,RF2和RF10与E2酶的相互作用将导致空间位阻冲突(扩展数据图)。gydF4y2Ba7 d, egydF4y2Ba),表明两只无名指都需要经历构象变化才能变得活跃。由于RF2和RF10与膜埋区通过柔性环连接,这些构象变化不会影响孔隙。gydF4y2Ba
过氧化物酶体受体循环和降解的整体途径类似于根除- l,其中错误折叠的腔内ER蛋白被多跨泛素连接酶反位,多泛素化,然后由Cdc48 atp酶从膜中提取gydF4y2Ba17gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.然而,在erda - l中,Hrd1泛素连接酶和相关的Der1蛋白分别与细胞质腔和腔内腔形成“半通道”;易位发生在薄膜区域,而不是通过水孔gydF4y2Ba32gydF4y2Ba.过氧化物酶体反转位子更类似于经典的Sec61/SecY转位子,因为它们都具有多肽易位的水孔gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
克隆,质粒构建和菌株gydF4y2Ba
所有结构均使用Gibson汇编克隆。用于连接酶复合物的过表达gydF4y2Bap . pastorisgydF4y2Ba的DNA序列编码gydF4y2Ba嗜热葡萄球菌,酿酒葡萄球菌gydF4y2Ba或gydF4y2Bac . thermophilumgydF4y2Ba采用GeneArt of Life技术合成组分并优化密码子。Pex12含有一个n端SBP标记和一个HRV3C蛋白酶裂解位点,Pex10含有一个c端血凝素(HA)标记,Pex2含有一个c端FLAG标记。所有基因都克隆在pPlCZA- link载体的EcoRI和NotI位点之间,该载体由pPlCZA修饰而成,允许多个基因表达gydF4y2Ba36gydF4y2Ba.无名指的表达gydF4y2Ba大肠杆菌gydF4y2Ba的DNA序列gydF4y2Ba酿酒酵母gydF4y2Ba在载体pGEX6P-1的BamHI和NotI位点之间合成并克隆含有n端谷胱甘肽的基因gydF4y2Ba年代gydF4y2Ba-转移酶(GST)标记,随后是HRV3C蛋白酶裂解位点。所有结构的变体都是使用Quikchange (Agilent)生成的。gydF4y2Ba
的gydF4y2Ba酿酒酵母gydF4y2Ba野生型菌株UTL7A (MATa, ura3-52, trp1, leu2-3/112)由R. Erdmann (Ruhr-University Bochum)提供。所有单、双敲除菌株均采用标准转化技术和pFA6A-NatMX或KanMX质粒构建。利用pFA6A-HygMX载体在Pex2、Pex10和Pex12的内源位点上进行同源重组,得到了flag标记的Pex2、Pex10和Pex12。对于Pex5过表达,在全长Pex5的C端融合HA标记和6×His标记。该基因位于ATG起始密码子上游约500 bp处,因此Pex5由其内源性启动子表达。该序列被插入到CEN质粒pRS416的多重克隆位点(参考文献)。gydF4y2Ba32gydF4y2Ba).所有的变换gydF4y2Ba酿酒酵母gydF4y2Ba细胞采用LiAc-PEG法gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
蛋白表达、纯化及纳米盘重建gydF4y2Ba
的gydF4y2Bap . pastorisgydF4y2Ba野生型菌株SMD1168从Life Technology获得。按照制造商的说明,通过电穿孔进行转换。转化酵母细胞在含zeocin的YPDS (YPD培养基+山梨醇)板上30°C生长3天。选取单个菌落接种起始培养物,在30°C下孵育过夜。然后通过将发酵剂1:100稀释到缓冲的最小甘油(BMG)培养基中接种大培养物。培养物在30°C下孵育约24小时,通过切换到相同体积的缓冲最小甲醇(BMM)培养基诱导蛋白表达。在28°C下孵育约20小时后,在4500℃下离心收集细胞gydF4y2BaggydF4y2Ba10分钟。颗粒储存在−80°C,直到进一步使用。gydF4y2Ba
将约100 g的细胞球重悬在100 - 120 ml缓冲液A (25 mM HEPES pH 7.4, 400 mM NaCl)中,补充2 mM苯基甲烷磺酰氟(PMSF)和2 μM pepstatin A。细胞在BioSpec Beadbeater中裂解40分钟,在水冰浴中开/关20秒/60秒。匀浆在10,000离心gydF4y2BaggydF4y2Ba冲洗20分钟,清除细胞碎片。将上清液在Ti45转子(Beckman)中以44,000转/分的速度在4°C下离心1小时。将球团膜用Dounce匀浆器在缓冲液a中重悬,并通过离心再次球团。将膜重新悬浮在含有1%月桂麦芽糖新戊二醇(LMNG)和蛋白酶抑制剂鸡尾酒的200-250 ml缓冲液A中,并在4°C下孵育60分钟。不溶性物质在贝克曼Ti45转子中以44,000转/分离心30分钟去除。将上清液转移到新管中,用2 ml高容量链霉亲和素树脂(Thermo Scientific)孵育1小时。用20-30 ml含有0.1%洋地黄苷的缓冲液A (EMD Millipore)清洗树脂,用10-15 ml缓冲液B (25 mM HEPES pH 7.4, 150 mM NaCl, 10%甘油和0.1%洋地黄苷)补充2 mM生物素(Sigma)洗脱结合蛋白。该复合物使用100 kda切断Amicon过滤器(Sigma-Millipore)进行浓缩,并在Superose 6 3.2/300 Increase柱(GE Healthcare)上通过尺寸排除色谱进一步纯化,用C缓冲液(25 mM HEPES pH 7.4, 150 mM NaCl和0.05%地黄皂苷)进行平衡。gydF4y2Ba
为了纳米盘的重建,首先制备了脂质原液。原液中含有1,2-二油酰-sn-甘油-3-磷酸胆碱(DOPC)、1,2-二油酰-sn-甘油-3-磷酸乙醇胺(DOPE)和1,2-二油酰-sn-甘油-3-磷酸-各10毫米gydF4y2BalgydF4y2Ba-丝氨酸(DOPS),制备方法见参考文献。gydF4y2Ba38gydF4y2Ba.将洋地黄苷纯化的蛋白质以1:240:5摩尔比的蛋白质:脂质:膜支架蛋白1D1 (MSP1D1)纳入纳米盘。该混合物在4°C下温和搅拌2小时。然后,Bio-Beads (Bio-Rad)在4°C下连续旋转添加过夜。Bio-Beads被移除,重组混合物在12000离心gydF4y2BaggydF4y2Ba20分钟,去除聚集的蛋白质。将上清液加载到凝胶过滤缓冲液(25 mM HEPES pH 7.4和150 mM NaCl)中的Superose 6 3.2/300增加粒径排除柱(GE Healthcare)上。将含有纳米盘重组连接酶复合物的组分合并浓缩至10 μM左右。这种材料被用来生成fab。gydF4y2Ba
为了组装Fab -连接酶复合物,纯化的连接酶复合物在洋地黄苷中与Fab以1:1.5摩尔比在冰上孵育1小时。将fab -连接酶复合物浓缩并负载在C缓冲液(25 mM HEPES pH 7.4, 150 mM NaCl和0.05%洋地黄苷)中的Superose 6 3.2/300增加尺寸排除柱(GE Healthcare)上。将峰值组分汇总并浓缩至约7 mg mlgydF4y2Ba1gydF4y2Ba用于低温电镜分析。gydF4y2Ba
为了纯化gst标记的无名指结构域,蛋白在gydF4y2Ba大肠杆菌gydF4y2Ba应变BL21 (DE3)。细胞裂解液首先在10000度下进行离心gydF4y2BaggydF4y2Ba在4°C下浸泡30分钟,过滤后的上清液应用于谷胱甘肽树脂(GE Healthcare)。用还原性谷胱甘肽洗脱后,将蛋白质浓缩并负载到Superdex 200 3.2/300增加尺寸排除柱(GE Healthcare)上,该柱在凝胶过滤缓冲液(25 mM HEPES pH 7.4, 150 mM NaCl, 1 mM Tris(2-羧乙基)盐酸磷化氢(TCEP)和5%甘油)中平衡。在−80°C下储存峰值组分直到使用。gydF4y2Ba
为了纯化用于结晶的Pex12环指结构域,与谷胱甘肽树脂结合的GST- 3c - Pex12 RF与pression蛋白酶在4℃下孵育过夜,以分离GST标记。通过的部分被收集并加载到Mono Q离子交换柱(GE Healthcare)。用盐梯度(0-500 mM NaCl和25 mM HEPES pH 7.4)洗脱蛋白,并将峰馏分合并。与Pex12环指结构域相对应的组分被浓缩并应用于HiLoad 16/60 Superdex 75凝胶过滤柱(GE Healthcare),预平衡在凝胶过滤缓冲液中(25 mM HEPES, pH 7.4, 150 mM NaCl, 1 mM TCEP和5%甘油)。将纯化的蛋白质浓缩至6 mg mlgydF4y2Ba1gydF4y2Ba,在液氮中速冻,并在−80°C保存。gydF4y2Ba
结晶gydF4y2Ba酿酒酵母gydF4y2BaPex12无名指结构域gydF4y2Ba
用悬滴扩散法将0.2 μl蛋白以6 mg ml的浓度混合,得到了Pex12环指结构域gydF4y2Ba1gydF4y2Ba100 μl含0.1 M双三丙烷,pH 8.5, 0.2 M氟化钠和20% PEG3350的储液0.2 μl。通过反复添加添加了30%甘油的孔液,逐渐增加滴液中甘油的浓度,可以对晶体进行低温保护。从滴液中取出晶体,用另一滴添加了30%甘油的好溶液擦拭,然后在液氮中快速冷冻。在高级光子源(APS)的24-ID-C光束线处收集100 K的数据。使用HKL2000/3000包对数据进行索引、集成和缩放,分辨率为1.5 Å。gydF4y2Ba
利用噬菌体展示鉴定连接酶复合物特异性fabgydF4y2Ba
的纯化gydF4y2Bat .酸奶gydF4y2Ba如上所述,除了使用化学生物素化的MSP1D1外,连接酶复合物被重组成纳米圆盘。通过用链霉亲和素包被顺磁珠(Promega)捕获纳米圆盘来评估生物素化的效率。对于Fab的选择,使用了先前描述的Fab噬菌体库gydF4y2Ba39gydF4y2Ba.将含有连接酶复合物和文库的纳米盘稀释到选择缓冲液(20 mM HEPES pH 7.4, 150 mM NaCl和1% BSA)中。如前所述,进行了五轮排序gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba.在第一轮中,使用400 nM的重组连接酶复合物手工进行生物筛选。为了增加筛选压力的严密性,通过逐步降低目标浓度,再半自动地进行4轮筛选:第二轮200 nM,第三轮100 nM,第四轮50 nM,第五轮25 nM。所有回合的噬菌体显示都使用先前描述的协议进行gydF4y2Ba39gydF4y2Ba.对于除第一轮外的每一轮,都使用前一轮中扩增的噬菌体种群作为输入池。在空MSP1D1纳米圆盘中,2 μM被用作竞争品。gydF4y2Ba
单点噬菌体ELISA验证Fab与重组连接酶复合物的结合gydF4y2Ba
采用单点噬菌体酶联免疫吸附试验(ELISA)验证从第4轮和第5轮噬菌体展示中获得的独特结合物。在芝加哥大学综合癌症中心DNA测序设备上对携带噬菌体的单个菌落进行测序,如前所述,在ELISA前选择独特的克隆并扩增噬菌体gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba.ELISA使用先前描述的方案进行gydF4y2Ba42gydF4y2Ba.gydF4y2Ba
Fab克隆、表达、纯化和验证gydF4y2Ba
基于噬菌体ELISA结果的特异性结合物在芝加哥大学综合癌症中心DNA测序设备进行测序,然后使用In-Fusion克隆试剂盒(Takara)将独特的克隆亚克隆到Fab表达载体RH2.2 (S. Sidhu的捐赠)。DNA测序证实克隆成功。然后像前面描述的那样表达和纯化fabgydF4y2Ba35gydF4y2Ba.纯化后,用4-20% SDS-PAGE验证Fab样品的纯度,随后在25 mM HEPES pH 7.4和150 mM NaCl中透析过夜。用多点ELISA法测定纯化后Fab的亲缘性gydF4y2Ba42gydF4y2Ba在生物素化纳米圆盘中使用连接酶复合物。gydF4y2Ba
Negative-stain EMgydF4y2Ba
连接酶复合物在0.02 mg ml浓度的纳米盘或洋地黄苷中重构gydF4y2Ba1gydF4y2Ba应用于发光放电连续碳栅格(电子显微镜科学公司)。吸附1 min后,用滤纸吸除多余样品,立即用4 μl 1.5%新鲜甲酸铀酰溶液洗涤两次,再用4 μl 1.5%甲酸铀酰溶液孵育30 s。然后用滤纸进一步吸干栅格以去除甲酸铀溶液,在室温下风干,并使用配备LaB6灯丝并在120 kV加速电压下操作的Tecnai T12电子显微镜(Thermo Fisher Scientific)进行检查,使用名义放大倍率×52,000,像素大小为2.13 Å。gydF4y2Ba
单颗粒低温电镜样品制备和数据采集gydF4y2Ba
将浓缩样品与MS(PEG)12甲基-PEG- nhs -酯(Thermo Fisher)以1:40摩尔比在冰上孵育2小时,以减少颗粒在网格上的优先取向gydF4y2Ba43gydF4y2Ba.然后,将3.0µl PEGylated的样品应用于发光放电的quantifoil网格(1.2/1.3,400目)。在大约100%的湿度下,以12的印迹力对网格进行7秒的印迹,并使用Vitrobot Mark IV仪器(赛默飞世尔科学公司)在液态乙烷中冷冻。gydF4y2Ba
Cryo-EM数据是在一台300kv的泰坦克瑞斯电子显微镜(FEI)上收集的,并在HHMI Janelia农场的Cryo-EM设施中配备了K2 Summit直接电子探测器(Gatan)。能量过滤器的狭缝宽度为20 eV,用于去除非弹性散射电子。所有低温em电影都是在使用SerialEM的超分辨率计数模式下记录的。在超分辨率模式下,×81,000的标称放大倍率对应于1.06 Å和0.53 Å的校准物理像素大小。剂量率为5.28电子ÅgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.总暴露时间为10秒,总剂量为52.8电子ÅgydF4y2Ba−2gydF4y2Ba分割成50帧(每帧200毫秒)。样品的离焦范围在−1.0和−2.5µm之间。gydF4y2Ba
数据处理gydF4y2Ba
使用MotionCor2程序(参考文献)对9019部剂量分级的超分辨率电影进行了运动校正。gydF4y2Ba44gydF4y2Ba)使用2× binning,产生像素大小为1.06 Å。每个图像堆栈的所有帧(总共50帧)的总和按照剂量加权方案计算,并用于除离焦确定外的所有图像处理步骤。程序CtfFind4(参考。gydF4y2Ba45gydF4y2Ba)用于估计所有电影帧的总和图像的离焦值。粒子在Relion 3.1中被自动转换。gydF4y2Ba46gydF4y2Ba).经过人工检查和分类,丢弃较差的图像,在Relion 3.1中进行分类。共提取了3,224,513个颗粒,并进行了一轮无参考的2D分类,以去除错误的拾取和明显的垃圾分类。为了加快数据处理过程中的3D分类速度,我们将整个数据集按照收集的顺序分为4批,每批分别进行3D分类。每批中只有一类具有蛋白质特征,并将该类中的颗粒组合进行进一步分类(共1,007,363个颗粒)。利用之前三维分类重建的颗粒集作为初始模型,并在蛋白质和洗涤剂胶束周围建立软掩膜,对该颗粒集进行自动细化。在这一轮细化之后,粒子进行贝叶斯抛光,然后使用包含连接酶复合物和Fab的掩膜进行另一轮自动细化和集中细化。这一步的细化产生了一个3.3 Å映射。使用焦点细化后获得的角度分配,1.8°局部三维分类(2西格玛和gydF4y2BaTgydF4y2Ba= 20),采用自适应掩模进一步对颗粒进行分类。从一个类别中总共选择了795,444个粒子,并进行了另一轮自动细化。三维分类(T30)不对齐,但使用蒙版,进一步提高地图的质量。在选择了121644个粒子后,最后一轮自动细化,然后使用自适应掩码进行集中细化,得到了位于3.1 Å的地图。使用Resmap v1.1.5计算局部分辨率。gydF4y2Ba47gydF4y2Ba),并在Relion 3.1中执行地图锐化。所有报告的分辨率都基于金标准的细化程序和傅里叶壳层相关= 0.143准则。利用3DFSC服务器计算方向傅里叶壳层相关曲线直方图和球度值gydF4y2Ba48gydF4y2Ba.所有软件均由SBGrid支持gydF4y2Ba49gydF4y2Ba.gydF4y2Ba
结构模型的建立、细化和分析gydF4y2Ba
所有模型都是在白骨顶建造的gydF4y2Ba50gydF4y2Ba并在PHENIX中进行了改进gydF4y2Ba51gydF4y2Ba使用3.1 Å锐化密度图。对于Pex2, Pex10和Pex12,每个蛋白的跨膜螺旋都很容易被识别,最初被构建为poly-Ala。然后,我们手动将跨膜螺旋安装到密度中,并使用二级结构预测和大块残基(如Phe, Trp和Arg)作为标记点,在白骨顶中追踪跨膜段的主干和它们之间的连接器。密度图的质量足以为关键残基分配旋转器。在不能分配旋转分子的情况下,侧链在Cβ原子处被截断。使用PHENIX real_space_refine在没有二级结构约束的真实空间中细化模型。PHENIX real_space_refine中的强非晶体对称约束用于固定未细化的域。在目视检查后,使用Phenix和Coot进行了几次手动优化和全局优化的迭代。对于无名指结构域,采用RaptorX软件建立各ring结构域的同源性模型gydF4y2Ba52gydF4y2Ba或者Alphafold 2(参考。gydF4y2Ba53gydF4y2Ba).然后,将这些模型拟合到UCSF Chimera的密度图中gydF4y2Ba54gydF4y2Ba并转移到Coot进行手动模型构建,使用XtalPred服务器的二级结构预测作为附加指南。对于Fab模型的构建,沉积的GgMFSD2A Fab复合物(PDB ID: 7MJS)的Fab部分被用作起始模板,并与Chimera手动对接到低温- em密度中。该模型是通过迭代的自动细化来细化的。由于Fab常数畴的密度较弱,其结构被去除。对于脂类模型,将麦角甾醇或POPC的PDB文件导入白骨顶,作为配体拟合成密度。gydF4y2Ba
Pex12射频晶体数据集采集波长为0.967 Å,其中ZngydF4y2Ba2 +gydF4y2Ba有很强的异常信号。该信号提供了高质量的异常数据,使SHELXD能够以直接的方式定位锌原子。利用该数据集和重原子位置,用SHARP程序计算了相位概率分布gydF4y2Ba55gydF4y2Ba.导出相位的质量允许大多数Pex12 RF模型在Coot中自动或手动完成。用REFMAC进行精制gydF4y2Ba56gydF4y2Ba.gydF4y2Ba
原子模型的可视化是使用UCSF Chimera完成的gydF4y2Ba54gydF4y2Ba, ChimeraXgydF4y2Ba57gydF4y2BaPyMOL (PyMOL分子图形系统,2.0版,Schrödinger, LLC.)。gydF4y2Ba
过氧化物酶体蛋白导入试验gydF4y2Ba
紫罗兰素通路(VioA, VioB和VioE-SKL)gydF4y2Ba19gydF4y2Ba被整合到gydF4y2Ba酿酒酵母gydF4y2Ba在Leu2位点的细胞。简言之,质粒pWCD1401或pWCD1402(参考文献。gydF4y2Ba58gydF4y2Ba)用NotI-HF酶切,凝胶提取的11.5 kb片段用于转化。克隆在SD-Leu板上选择。如前所述,使用含有紫罗兰素途径的菌株敲除Pex2、Pex10和Pex12。gydF4y2Ba
为了补充缺乏Pex2、Pex10或Pex12的菌株,从每个基因的内源性位点表达野生型蛋白或突变体的flag标记版本。如上所述,使用载体pFA6A-HygMX进行同源重组引入基因。质粒转化为含有紫罗兰素途径但缺乏PEX基因的细胞,并在SD-Leu培养基上筛选。每种转化的3个菌落在SD-Leu培养皿上,各取1个菌落在30°C、250转/分的YPD培养基中培养过夜。然后将饱和培养物稀释50倍至3 ml新鲜SD-Leu培养基中,培养约60小时。gydF4y2Ba
绿色色素PDV的提取方法如下。将细胞球置于300 μl冰醋酸中重悬,转移至薄壁Eppendorf管中。然后将试管在95°C下孵育15分钟,通过反转混合并再孵育15分钟。细胞碎片首先通过4700转/分离心5分钟去除,然后用Acroprep Advance 0.2 μm滤板(Pall Corporation)过滤上清液。滤液转移到96孔不透明板(Greiner Bio-one)。荧光检测使用microplate reader (Bio-Tek Synergy Neo2),激发波长和发射波长分别为535 nm和585 nmgydF4y2Ba19gydF4y2Ba.gydF4y2Ba
体外多泛素化试验gydF4y2Ba
体外多泛化实验在反应缓冲液(25 mM HEPES pH 7.4, 150 mM NaCl, 10 mM MgCl)中进行gydF4y2Ba2gydF4y2Ba50 μM TCEP)。蛋白组分的浓度分别为:0.1 μM Uba1、4 μM Ubc4、0.5 μM GST-RFs和100 μM泛素。混合物中还含有1 μM dylight - maleimide -800标记的cys -泛素。反应由加入5 mM ATP开始,60 min后加入4× SDS样品缓冲液结束。样品采用4-20% SDS-PAGE和800 nm荧光扫描仪(Li-Cor)进行分析。gydF4y2Ba
定量等压标记蛋白质组学gydF4y2Ba
如前所述,用液相色谱-串联质谱对样品进行制备和分析gydF4y2Ba59gydF4y2Ba.简而言之,酵母细胞在50 ml YNBG培养基(0.3%酵母浸膏、0.5%蛋白胨、0.67%酵母氮碱含氨基酸和0.5%葡萄糖,pH 6.0)中培养过夜至log期,然后切换到YNBO培养基(0.3%酵母浸膏、0.5%蛋白胨、0.67%酵母氮碱不含氨基酸、0.5%葡萄糖、0.05% Tween40和0.1%油酸,pH 6.0)中再培养18 h,诱导过氧化物酶体增殖。将细胞球重新悬浮在裂解缓冲液(8 M尿素,200 mM EPPS pH 8.5和蛋白酶抑制剂(Pierce))中,然后使用BioSpec Beadbeater裂解5个循环,每个循环30秒,然后60秒。匀浆在2000度下离心gydF4y2BaggydF4y2Ba10分钟以清除细胞碎片和上清液转移到新管。样品用5 mM TCEP还原30分钟,用10 mM碘乙酰胺烷基化30分钟,然后用10 mM DTT淬火15分钟。流线型串联质标标记和液相色谱-质谱都是按照参考文献中描述的方案进行的。gydF4y2Ba59gydF4y2Ba.基于定量等压标记的蛋白质组学数据处理使用MSconvert 3.0 (gydF4y2Bahttps://proteowizard.sourceforge.io/tools/msconvert.htmlgydF4y2Ba)和彗星2021.02 rev. 0 (gydF4y2Bahttp://comet-ms.sourceforge.net/gydF4y2Ba).gydF4y2Ba
免疫印迹gydF4y2Ba
将缺乏Pex2和Pex12并表达来自内源性启动子下的原生位点的flag标记Pex2和Pex12野生型或突变型蛋白的酵母细胞在50 ml YNBG培养基中培养过夜至log期。将细胞转移到YNBO培养基中再培养18 h,诱导过氧化物酶体增殖。如上所述,用玻璃珠裂解细胞,用离心去除细胞碎片。膜组分在45000转/分的超离心下分离60分钟。膜在含1% Triton X-100的裂解缓冲液中均质溶解1小时。用10 μl anti-FLAG M2树脂在4℃下孵育2 h。用含0.1% Triton X-100的裂解缓冲液洗涤三次,用含0.4 mg ml的缓冲液洗脱结合蛋白gydF4y2Ba1gydF4y2Ba3×FLAG肽(Sigma)。洗脱蛋白进行SDS-PAGE和免疫印迹。flag标记的Pex2和Pex12用抗flag (F7425, Sigma)抗体以1:3 000稀释检测。作为负载对照,总细胞裂解液用抗sec61 α抗体(自制兔血清)按1:3 000稀释进行免疫印迹。gydF4y2Ba
统计和再现性gydF4y2Ba
所有生化实验都独立进行了至少三次,结果相似。使用GraphPad Prism 9.3.0进行多重比较的单向方差分析,以评估与Pex2、Pex10、Pex12或Pex5突变体导入相比,野生型细胞中过氧化物酶体蛋白导入效率的统计学意义。柱状图如图所示。gydF4y2Ba3 dgydF4y2Ba而且gydF4y2Ba4 c ggydF4y2Ba和扩展数据图。gydF4y2Ba5 hgydF4y2Ba而且gydF4y2Ba8 c, dgydF4y2Ba显示三个生物重复的单个数据点,平均值和S.E.M.。NS,不显著;*gydF4y2BaPgydF4y2Ba< 0.1, **gydF4y2BaPgydF4y2Ba< 0.05, ****gydF4y2BaPgydF4y2Ba< 0.001。基于定量等压标记的蛋白质组学实验独立进行了两次,结果相似。结果统计(扩展数据图。gydF4y2Ba9gydF4y2Ba)由多个未配对的人执行gydF4y2BatgydF4y2Ba-测试,然后采用两阶段逐步提升的方法(Benjamini, Krieger和Yekutieli,期望错误发现率(gydF4y2Ba问gydF4y2Ba) = 1%),基于3个生物重复。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
低温电磁密度图和对应的坐标gydF4y2Bat .酸奶gydF4y2BaPex2, Pex10, Pex12和Fab络合物已在电子显微镜数据库(EMDB)和PDB中存入登录代码gydF4y2Baemd - 25750gydF4y2Ba而且gydF4y2Ba7 t92gydF4y2Ba,分别。的坐标和晶体结构因子gydF4y2Ba酿酒酵母gydF4y2BaRF12根据登录代码存放在PDB中gydF4y2Ba7 t9xgydF4y2Ba.质谱蛋白质组学数据已通过PRIDE合作伙伴存储库保存在ProteomeXchange Consortium中,并带有数据集标识符gydF4y2BaPXD031792gydF4y2Ba(gydF4y2Bahttps://www.ebi.ac.uk/pride/gydF4y2Ba).两个同二聚环结构域(RNF4和BIRC7)结合到它们相应的用于比对的E2-Ub共轭物的结构可在PDB中根据登录代码获得gydF4y2Ba4 ap4gydF4y2Ba而且gydF4y2Ba4 auqgydF4y2Ba,分别。用于Fab模型构建的GgMFSD2A-Fab综合体的结构可在PDB中根据登录代码获得gydF4y2Ba7乔丹gydF4y2Ba.所有凝胶和免疫印迹的未裁剪版本见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Farré, J., Mahalingam, s.s, Proietto, M. & Subramani, S.过氧化物酶体生物发生,膜接触位点和质量控制。gydF4y2BaEMBO代表。gydF4y2Ba20.gydF4y2Ba, e46864(2019)。gydF4y2Ba
Walter, T. & Erdmann, R.蛋白质导入过氧化物酶体的最新进展。gydF4y2Ba蛋白质J。gydF4y2Ba38gydF4y2Ba, 351-362(2019)。gydF4y2Ba
弗朗西斯科,T.等。蛋白质转运到过氧化物酶体:已知和未知。gydF4y2BaBioessaysgydF4y2Ba39gydF4y2Ba, 1700047(2017)。gydF4y2Ba
藤木,Y.等人。过氧化物酶体生物发生和相关疾病的最新见解。gydF4y2Ba细胞科学。gydF4y2Ba133gydF4y2Ba, jcs236943(2020)。gydF4y2Ba
Okumoto, K., Noda, H. & Fujiki, Y.过氧化物酶体靶向信号类型1 (PTS1)受体Pex5p泛素化的不同模式调节PTS1蛋白的导入。gydF4y2Ba生物。化学。gydF4y2Ba289gydF4y2Ba, 14089-14108(2014)。gydF4y2Ba
Magraoui, f.e.等。环型泛素连接酶Pex2p, Pex10p和Pex12p形成一个异聚复合物,以泛素偶联酶选择的方式表现出增强的活性。gydF4y2Ba2月J。gydF4y2Ba279gydF4y2Ba, 2060-2070(2012)。gydF4y2Ba
韦勒,S.,古尔德,S. J. &瓦勒,D.过氧化物酶体生物发生障碍。gydF4y2Ba为基础。基因组学:哼。麝猫。gydF4y2Ba4 gydF4y2Ba, 165-211(2003)。gydF4y2Ba
Dammai, V. & Subramani, S.人过氧化物酶体靶向信号受体Pex5p被转位到过氧化物酶体基质中并循环到细胞质中。gydF4y2Ba细胞gydF4y2Ba105gydF4y2Ba, 187-196(2001)。gydF4y2Ba
Meinecke, M.等人。过氧化物酶体导入体构成了一个巨大的高度动态孔隙。gydF4y2Ba细胞生物学。gydF4y2Ba12gydF4y2Ba, 273-277(2010)。gydF4y2Ba
布洛克,n.b.等人。低温电镜观察到过氧化物酶体Pex1/Pex6 atp酶复合物独特的双环结构。gydF4y2Ba国家科学院学报美国gydF4y2Ba112gydF4y2Ba, e4017-e4025(2015)。gydF4y2Ba
Léon, S.等。PpPex20p过氧化物酶体导入周期的动态研究。gydF4y2BaJ.细胞生物学。gydF4y2Ba172gydF4y2Ba, 67-78(2006)。gydF4y2Ba
Léon, S., Goodman, J. M. & Subramani, S.蛋白质导入过氧化物酶体基质机制的独特性:通过穿梭受体运输折叠、辅助因子结合和低聚蛋白。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1763gydF4y2Ba, 1552-1564(2006)。gydF4y2Ba
威廉姆斯,C.等。从Pex4p:Pex22p复合物的结构深入了解泛素偶联酶/共激活剂相互作用。gydF4y2BaEMBO J。gydF4y2Ba31gydF4y2Ba, 391-402(2012)。gydF4y2Ba
grouu, c.p.等。E2D (UbcH5)家族成员介导过氧化物酶体导入受体Pex5p保守半胱氨酸的泛素化。gydF4y2Ba生物。化学。gydF4y2Ba283gydF4y2Ba, 14190-14197(2008)。gydF4y2Ba
普拉塔,H. W.等。Pex2和Pex12作为蛋白泛素连接酶参与过氧化物酶体蛋白的导入。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba29gydF4y2Ba, 5505-5516(2009)。gydF4y2Ba
Williams, C., van den Berg, M., Geers, E. & Distel, B. Pex10p作为E3连接酶作用于ubc4p依赖的Pex5p泛素化。gydF4y2Ba物化学。Biophys。Commun >,gydF4y2Ba374gydF4y2Ba, 620-624(2008)。gydF4y2Ba
吴,x和Rapoport, t.a. er相关蛋白降解的机制见解。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba53gydF4y2Ba, 22-28(2018)。gydF4y2Ba
普拉塔,H. W.,哈根,S. &厄德曼,R.出口体:过氧化物酶体受体出口机械。gydF4y2Ba细胞。生命科学gydF4y2Ba70gydF4y2Ba, 1393-1411(2013)。gydF4y2Ba
德罗奇,W. C., Russ, Z. N. & Dueber, J. E.重新利用酵母过氧化物酶体来分隔异源代谢途径。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 11152(2016)。gydF4y2Ba
Antonenkov, V. D., Sormunen, R. T. & Hiltunen, J. K.大鼠肝脏过氧化物酶体膜对辅助因子形成了通透性屏障,但对体外小代谢物没有作用。gydF4y2Ba细胞科学。gydF4y2Ba117gydF4y2Ba, 5633-5642(2004)。gydF4y2Ba
Deshaies, R. J. & Joazeiro, C. A. P. RING结构域E3泛素连接酶。gydF4y2Ba为基础。学生物化学启。gydF4y2Ba78gydF4y2Ba, 399-434(2009)。gydF4y2Ba
普鲁内达,J. N.等。E3的结构:E2gydF4y2Ba∼gydF4y2BaUb复合物揭示了RING/U-box连接酶共享的变构机制。gydF4y2Ba摩尔。细胞gydF4y2Ba47gydF4y2Ba, 933-942(2012)。gydF4y2Ba
Plechanovová, A., Jaffray, E., Tatham, M. H., Naismith, J. H. & Hay, R. T.环E3连接酶的结构和泛素负载E2启动催化。gydF4y2Ba自然gydF4y2Ba489gydF4y2Ba, 115-120(2012)。gydF4y2Ba
Dou, H., Buetow, L., Sibbet, G. J., Cameron, K.和Huang, D. T. BIRC7-E2泛素共轭结构揭示了RING二聚体泛素转移的机制。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba19gydF4y2Ba, 876-883(2012)。gydF4y2Ba
Ebberink, m.s.等人。600多名齐薇格综合征谱系障碍患者的遗传分类和突变谱。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba32gydF4y2Ba, 59-69(2011)。gydF4y2Ba
Chen, X., Devarajan, S., Danda, N. & Williams, C.研究过氧化物酶体泛素化机制在酵母中Pex13p降解中的作用gydF4y2BaHansenula polymorphagydF4y2Ba.gydF4y2BaJ. Mol.生物学。gydF4y2Ba430gydF4y2Ba, 1545-1558(2018)。gydF4y2Ba
Léon, S. & Subramani, S.一种保守的半胱氨酸残基gydF4y2Ba毕赤酵母属pastorisgydF4y2BaPex20p对于其从过氧化物酶体循环到细胞质至关重要。gydF4y2Ba生物。化学。gydF4y2Ba282gydF4y2Ba, 7424-7430(2007)。gydF4y2Ba
Pex18p在过氧化物酶体生物发生过程中被组成性降解。gydF4y2Ba生物。化学。gydF4y2Ba276gydF4y2Ba, 47684-47689(2001)。gydF4y2Ba
普拉塔,H. W.等。过氧化物酶体导入受体Pex5p的泛素化是其循环利用所必需的。gydF4y2BaJ.细胞生物学。gydF4y2Ba177gydF4y2Ba, 197-204(2007)。gydF4y2Ba
Williams, C., van den Berg, M., Sprenger, r.r. & Distel, B.一个保守的半胱氨酸对于过氧化物酶体导入受体Pex5p依赖的泛素化是必不可少的。gydF4y2Ba生物。化学。gydF4y2Ba282gydF4y2Ba, 22534-22543(2007)。gydF4y2Ba
Schliebs, W., Girzalsky, W. & Erdmann, R.过氧化物酶体蛋白输入和ERAD:一个共同主题的变化。gydF4y2Ba细胞生物学。gydF4y2Ba11gydF4y2Ba, 885-890(2010)。gydF4y2Ba
吴,等。Hrd1泛素连接酶复合物介导er相关蛋白降解的结构基础。gydF4y2Ba科学gydF4y2Ba368gydF4y2Ba, eaaz2449(2020)。gydF4y2Ba
范登伯格,B.等人。蛋白质传导通道的x射线结构。gydF4y2Ba自然gydF4y2Ba427gydF4y2Ba, 36-44(2004)。gydF4y2Ba
Voorhees, R. M. & Hegde, R. S.由信号序列打开的Sec61通道的结构。gydF4y2Ba科学gydF4y2Ba351gydF4y2Ba, 88-91(2016)。gydF4y2Ba
李,L.等。底物参与的secret蛋白易位通道的晶体结构。gydF4y2Ba自然gydF4y2Ba531gydF4y2Ba, 395-399(2016)。gydF4y2Ba
亚历山德罗夫,A.等。一种简便的高通量蛋白对共表达方法。gydF4y2Ba摩尔。细胞。蛋白质组学gydF4y2Ba3 gydF4y2Ba, 934-938(2004)。gydF4y2Ba
Gietz, R. D. & Schiestl, R. H.利用LiAc/SS载体DNA/PEG方法进行高效酵母转化。gydF4y2BaProtoc Nat。gydF4y2Ba2gydF4y2Ba, 31-34(2007)。gydF4y2Ba
王珊珊,王瑞娥,刘铁勇,李志强,张志强。管状内质网结构的研究。gydF4y2Ba自然gydF4y2Ba543gydF4y2Ba, 257-260(2017)。gydF4y2Ba
Rizk, s.s.等人。利用工程构象特异性效应蛋白对配体结合亲和力的变构控制。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba18gydF4y2Ba, 437-442(2011)。gydF4y2Ba
多米尼克,P. K.等人。利用纳米盘抗体噬菌体展示进行膜蛋白结构研究的构象伴侣。gydF4y2Ba结构gydF4y2Ba24gydF4y2Ba, 300-309(2016)。gydF4y2Ba
Paduch, M. & Kossiakoff, A.生成构象和复合物特异性合成抗体。gydF4y2Ba方法分子生物学。gydF4y2Ba1575gydF4y2Ba, 93-119(2017)。gydF4y2Ba
金,J.等人。其结构及耐药性gydF4y2Ba恶性疟原虫gydF4y2Ba运输机PfCRT。gydF4y2Ba自然gydF4y2Ba576gydF4y2Ba, 315-320(2019)。gydF4y2Ba
吴X,卡巴诺斯,C.和拉波波特,t.a.内质网膜翻译后蛋白易位机制的结构。gydF4y2Ba自然gydF4y2Ba566gydF4y2Ba, 136-139(2019)。gydF4y2Ba
郑世强等。MotionCor2:改进冷冻电子显微镜光束诱导运动的各向异性校正。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 331-332(2017)。gydF4y2Ba
Rohou, A. & Grigorieff, N. CTFFIND4:快速准确的电子显微图像离焦估计。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba192gydF4y2Ba, 216-221(2015)。gydF4y2Ba
Zivanov, J.等人。在RELION-3中自动高分辨率冷冻- em结构测定的新工具。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e42166(2018)。gydF4y2Ba
Kucukelbir, A., Sigworth, F. J. & Tagare, H. D.对低温电磁密度图的局部分辨率进行量化。gydF4y2BaNat方法。gydF4y2Ba11gydF4y2Ba, 63-65(2014)。gydF4y2Ba
谭永哲等。通过倾斜在单颗粒低温电子显微镜中解决优选样品取向。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 793-796(2017)。gydF4y2Ba
莫林,A.等。协作可以最大限度地利用软件。gydF4y2BaeLifegydF4y2Ba2gydF4y2Ba, e01456(2013)。gydF4y2Ba
Casañal, A., Lohkamp, B. & Emsley, P.电子冷冻显微镜和晶体学数据的大分子模型构建的当前发展。gydF4y2Ba蛋白质科学。gydF4y2Ba29gydF4y2Ba, 1069-1078 (2020)gydF4y2Ba
Liebschner, D.等人。使用X射线、中子和电子测定大分子结构:Phenix的最新进展。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 861-877(2019)。gydF4y2Ba
Källberg, M.等。使用RaptorX web服务器进行基于模板的蛋白质结构建模。gydF4y2BaProtoc Nat。gydF4y2Ba7gydF4y2Ba, 1511-1522(2012)。gydF4y2Ba
Jumper, J.等。高度准确的蛋白质结构预测AlphaFold。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 583-589(2021)。gydF4y2Ba
彼得森,E. F.等人。UCSF chimera -用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605-1612(2004)。gydF4y2Ba
de La Fortelle, E. & Bricogne, G.[27]多重同构替换和多波长异常衍射方法的极大似然重原子参数细化。gydF4y2BaEnzymol方法。gydF4y2Ba276gydF4y2Ba, 472-494(1997)。gydF4y2Ba
Murshudov, G. N., Vagin, A. A., Lebedev, A., Wilson, K. S. & Dodson, E. J.利用FFT高效各向异性细化大分子结构。gydF4y2BaActa Crystallogr。DgydF4y2Ba55gydF4y2Ba, 247-255(1999)。gydF4y2Ba
彼得森,E. F.等人。UCSF ChimeraX:为研究人员、教育工作者和开发人员提供结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70-82(2020)。gydF4y2Ba
加德纳,b.m.等人。过氧化物酶体aaa - atp酶Pex1/Pex6通过加工穿线展开底物。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 135(2018)。gydF4y2Ba
李,J.等。ttpro试剂:一组等压标记质量标签,可同时在16个样品中进行蛋白质组范围的测量。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 399-404(2020)。gydF4y2Ba
MUSCLE:一种减少时间和空间复杂度的多序列比对方法。gydF4y2BaBMC生物信息学gydF4y2Ba5克ydF4y2Ba, 113(2004)。gydF4y2Ba
沃特豪斯,A. M.,普罗克特,J. B.,马丁,D. M., Clamp, M. & Barton, G. J. Jalview版本2 -一个多序列比对编辑器和分析工作台。gydF4y2Ba生物信息学。gydF4y2Ba25gydF4y2Ba, 1189-1191(2009)。gydF4y2Ba
Ashkenazy, H.等人。ConSurf 2010:计算蛋白质和核酸序列和结构的进化守恒。gydF4y2Ba核酸测定。gydF4y2Ba38gydF4y2Ba, w529-w533(2010)。gydF4y2Ba
确认gydF4y2Ba
我们感谢HHMI Janelia Cryo-EM设备的Z. Yu, S. Yang和R. Yan在显微镜操作和数据收集方面的帮助,SBGrid团队的软件和工作站支持,R. Erdmann和B. Gardner提供材料,Y. Gao在进口分析方面的帮助,Y. Gao, M. Yip, S. Shao,特别是M. Skowyra对手稿的评论。这项工作得到了NIGMS拨款(R01 GM052586)给T.A.R.的支持,NIH/NIGMS拨款(R01 GM132129)给J.A.P.的支持,以及NIGMS拨款(R01 GM067945)给S.P.G. T.A.R.是霍华德休斯医学研究所的研究员。这篇文章是受HHMI的开放获取出版物政策。HHMI实验室负责人此前已在其研究文章中向公众授予了非独家CC BY 4.0许可,并向HHMI授予了可转许可的许可。根据这些许可,作者接受的本文手稿可以在出版后立即在CC BY 4.0许可下免费提供。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
P.F.进行了蛋白质纯化、结晶、泛素化和导入分析以及诱变。P.F.和X.W.进行了低温电子显微镜数据收集、数据处理和模型构建。S.K.E, P.K.和A.A.K.生成和选择晶圆厂。J.A.P.和S.P.G.进行了定量质谱分析。T.A.R.监督这个项目。p.f., X.W.和T.A.R.写了手稿的草稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1不同物种Pex2、Pex10和Pex12的序列比对。gydF4y2Ba
所有序列都从Uniprot中检索,并与程序MUSCLE对齐gydF4y2Ba60gydF4y2Ba,使用JalView中的默认参数gydF4y2Ba61gydF4y2Ba.根据氨基酸的性质用ClustalX染色。氨基酸保存的程度由颜色的强度来表示。RFs显示为圆角矩形,TMs显示为圆柱体,边界根据冷冻- em结构。插头显示为紫色。黑线表示rf中与E2酶相互作用的环;在这些环中突变的残基用蓝点标记。红色三角形表示突变的RFs中的Cys残留。橙色点突出了RF10和RF12界面上的残留物。中删除了N端和c端Pex2序列(以黄色背景显示)gydF4y2Bat .酸奶gydF4y2Ba用于低温电子显微镜的结构。使用人PEX10长亚型(UniProtKB - O60683-2)进行序列比对。gydF4y2Ba
扩展数据图2 Pex2, Pex10,和Pex12gydF4y2Ba酿酒酵母gydF4y2Ba或gydF4y2Bac . thermophilumgydF4y2Ba形成化学计量复合体。gydF4y2Ba
全身的gydF4y2Ba酿酒酵母gydF4y2Ban端链霉亲和素结合肽(SBP)标记的Pex12与全长同时表达gydF4y2Ba酿酒酵母gydF4y2BaPex10和Pex2gydF4y2Bap . pastorisgydF4y2Ba.该复合物用链霉亲和素珠纯化,并进行凝胶过滤。上面的面板显示吸光度剖面。用SDS-PAGE和考马斯蓝染色分析虚线之间的部分(下面板)。从gydF4y2Bac . thermophilumgydF4y2Ba含有Pex2(残基107-455),在N端和c端没有非保守残基,用同样的方法纯化。结果具有代表性的3个生物重复序列。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
扩展数据图3结合Fab的泛素连接酶复合物的Cryo-EM数据处理和重建。gydF4y2Ba
一个gydF4y2Ba,代表性低温em图像。在两个独立的实验中得到了相似的结果。选中的粒子用红色圆圈标记。gydF4y2BabgydF4y2Ba,所选粒子的代表性、无参考的二维类平均。gydF4y2BacgydF4y2Ba, Cryo-EM处理流程(另见扩展数据表)gydF4y2Ba1gydF4y2Ba).为进一步分析而选择的类被框起来。说明了用于分类和细化的掩码。gydF4y2BadgydF4y2Ba,右侧为带比例尺的局部分辨率地图。gydF4y2BaegydF4y2Ba,细化粒子的欧拉角分布在两种不同的视图中显示。gydF4y2BafgydF4y2Ba、三维傅里叶壳层相关(FSC)曲线和偏好取向分析。红线表示全局FSC,绿色虚线表示方向性FSC曲线均值周围的+1和- 1个标准差。FSC计算使用了侧面显示的遮罩。gydF4y2BaggydF4y2Ba, Pex2、Pex10和Pex12的TMs和RING结构域(rf)的密度图和模型。如图所示为Pex10的插头和Pex12的连接器。gydF4y2BahgydF4y2Ba, Fab与Pex12循环的交互作用。Fab的Fv部分显示为绿色卡通。Pex12显示为嵌入在空间填充模型中的粉红色卡通。界面上的残留物被突出显示。gydF4y2Ba
图4连接酶复合物组分的结构关系及氨基酸守恒。gydF4y2Ba
一个gydF4y2Ba, Pex2、Pex10和Pex12的TMs1-4结构相似。上面的面板分别将这些tm显示为圆柱体,下面的面板显示了它们叠加的不同视图。gydF4y2BabgydF4y2Ba,显示的是不同物种连接酶之间的氨基酸保存程度,由程序ConSurf确定gydF4y2Ba62gydF4y2Ba(侧面的比例)。gydF4y2BacgydF4y2Ba,如gydF4y2BabgydF4y2Ba,但从腔内观察的空间填充模型显示了守恒。gydF4y2BadgydF4y2Ba,从前后观察膜嵌入域的空间填充模型,氨基酸根据其疏水性着色。亲水空腔用箭头表示。gydF4y2Ba
图5测试rf之间的相互作用以及封堵和孔径的作用。gydF4y2Ba
一个gydF4y2Ba,连接酶复合物的密度图,从侧面看。射频塔,Pex12的TM5,以及将TM连接到RF12的中心连接器以彩色显示。右边的面板显示了被框区域的放大视图。指出了中心连接器中保守的Pro残基。gydF4y2BabgydF4y2Ba,将纯化后的RF2和RF12混合,进行凝胶过滤。上面的面板显示吸光度剖面。用SDS-PAGE和考马斯蓝染色分析折线之间的部分(下图)。gydF4y2BacgydF4y2Ba,如gydF4y2BabgydF4y2Ba,但含有RF2和RF10的混合物。gydF4y2BadgydF4y2Ba,如gydF4y2BabgydF4y2Ba,但混合了RF10和RF12。gydF4y2BaegydF4y2Ba,如gydF4y2BabgydF4y2Ba,但含有RF2, RF10和RF12的混合物。gydF4y2BafgydF4y2Ba,野生型(WT)gydF4y2Ba酿酒酵母gydF4y2Ba连接酶复合物和含有突变Pex2的复合物(C237S),均含有n端链霉亲和素结合肽(SBP)标签的Pex12gydF4y2Bap . pastorisgydF4y2Ba.用链霉亲和素珠对该复合物进行分离,结合物用SDS-PAGE和考马斯蓝染色进行分析。gydF4y2BaggydF4y2Ba,降低孔径的flag标记Pex2或Pex12突变体的表达量(见图。gydF4y2Ba3 dgydF4y2Ba)用FLAG抗体免疫印迹法测定。Sec61α的印迹作为加载对照。结果是gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba代表三个生物重复序列。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BahgydF4y2Ba野生型(WT) Pex10或突变体(Δplug)从内源启动子中表达gydF4y2Ba酿酒酵母gydF4y2Ba缺乏Pex10的细胞(gydF4y2Bapex10ΔgydF4y2Ba).对照采用gydF4y2Bapex10ΔgydF4y2Ba细胞和只表达抗生素抗性基因的细胞(模拟)。过氧化物酶体蛋白的导入是通过荧光色素(PDV)形成的减少来确定的。荧光测量细胞裂解液和数据归一化,设置荧光gydF4y2Bapex10ΔgydF4y2Ba细胞为100%,WT细胞为0%。柱状图显示了来自三个生物重复的单个数据点、平均值和S.E.M.。野生型与突变体间采用单因素方差分析,**gydF4y2BaPgydF4y2Ba< 0.01。请参见源数据文件gydF4y2Ba
图6致病点突变和磷脂、胆固醇分子的位置。gydF4y2Ba
一个gydF4y2Ba,连接酶复合体模型的侧面视图,螺旋为圆柱体。在患者中发现的PEX2、PEX10或PEX12的点突变用不同颜色的球表示。具体的突变和相应的位置gydF4y2Bat .酸奶gydF4y2Ba(gydF4y2BaT.tgydF4y2Ba.)蛋白质列在旁边。gydF4y2BabgydF4y2Ba,来自细胞质的rf放大视图,突出显示疾病突变。用Pex10的长异构体(UniProtKB - O60683-2)进行残基编号。gydF4y2BacgydF4y2Ba,连接酶复合体的空间填充模型在两个不同的侧面视图。氨基酸根据其疏水性的程度着色(箭头下方的刻度)。以磷脂或麦角甾醇分子为模型的Cryo-EM密度显示为紫色。gydF4y2BadgydF4y2Ba,磷脂和麦角甾醇分子堵塞通道壁孔洞的例子。所示为半透明空间填充和嵌入卡通模型的切口。对于磷脂,表示了模拟的头基和酰基链。gydF4y2Ba
图7 RF12的结构特征和假定的rf与E2酶的相互作用。gydF4y2Ba
一个gydF4y2Ba,的冷冻em结构叠加gydF4y2Bat .酸奶gydF4y2Ba(gydF4y2BaT.tgydF4y2Ba)。的晶体结构gydF4y2Ba酿酒酵母gydF4y2Ba(gydF4y2Ba南卡罗来纳州gydF4y2Ba)。请参见扩展数据表gydF4y2Ba2gydF4y2Ba).Cys残基为黄色棒状,结合Zn的结构如图所示gydF4y2Ba2 +gydF4y2Ba亚当是一个灰色的球。注意,结构的核心是相似的,但有几个循环是不同的。gydF4y2BabgydF4y2Ba的假定相互作用gydF4y2Ba酿酒酵母gydF4y2BaRF10-RF12配合物和一个E2-Ub共轭物。RF10的结构是基于cryo-EM结构的同源模型,RF12的结构是晶体结构(gydF4y2Ba一个gydF4y2Ba).RF10-RF12的结构与泛素连接酶RNF4与泛素偶联E2酶UbcH5a (PDB代码4AP4)结合的同二聚体RF的结构一致。校准是基于RF10和RNF4中的一个RFs。UbcH5a和泛素在一个半透明的空间填充模型中以卡通的形式显示。RF10和RF12为彩色动画,RNF4的rf为白色动画。一个圆圈突出了RF10和RNF4的关键残基(分别为R324和R181),另一个圆圈显示了Pex12的L398或RNF4中的等效残基(Y258)与泛素螺旋之间的相互作用。gydF4y2BacgydF4y2Ba,如gydF4y2BabgydF4y2Ba而同型二聚体RF连接酶BIRC7 (PDB编码4AUQ)。gydF4y2BadgydF4y2BaE2~Ub缀合物的模型结构停靠在RF2的假定结合位点上。观察到的冲突表明RF2必须经历构象变化才能激活。gydF4y2BaegydF4y2Ba,如gydF4y2BadgydF4y2Ba,但用于E2-Ub对接到RF10。严重的碰撞再次表明了构象变化的激活。gydF4y2Ba
扩展数据图8gydF4y2Ba在体外gydF4y2BaRFs的多泛素化活性。gydF4y2Ba
一个gydF4y2Ba在E1酶、E2酶Ubc4和dylight800标记的泛素存在下,用纯化的RF2、RF12或RF10 (E3酶)的gst融合物进行多泛素化反应。凡注明的部分都省略了。采用SDS-PAGE和荧光扫描对样品进行分析。gydF4y2BabgydF4y2Ba,如gydF4y2Ba一个gydF4y2Ba但野生型(WT)或突变型RF10和RF12的组合不同。结果是gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba代表三个生物重复序列。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2BaWT Pex10或Pex12,或指示突变体,从内源启动子表达gydF4y2Ba酿酒酵母gydF4y2Ba缺乏Pex10和Pex12的细胞(gydF4y2Bapex10Δpex12ΔgydF4y2Ba).过氧化物酶体蛋白的导入是通过荧光化合物(PDV)的形成减少来确定的。荧光测量细胞裂解液和数据归一化,设置荧光gydF4y2Bapex10Δpex12ΔgydF4y2Ba表达WT Pex10和Pex12细胞的细胞表达率为0%。图中为三次实验的均值和标准误差。gydF4y2BadgydF4y2Ba, WT或突变体Pex5在包含RF2 L1环突变的Pex2突变细胞中过表达(Pex5OE) (gydF4y2Bapex2ΔgydF4y2BaPex2L1)。Vec,没有Pex5的向量。缺乏Pex5的细胞(gydF4y2Bapex5ΔgydF4y2Ba)作为对照。蛋白质输入的测量方法为gydF4y2BacgydF4y2Ba.图中的柱状图gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba显示三个生物重复的单个数据点、平均值和S.E.M.。用单因素方差分析计算野生型与突变体间的统计学差异。Ns,不显著;**gydF4y2BaPgydF4y2Ba< 0.05;****gydF4y2BaPgydF4y2Ba< 0.001。请参见源数据文件gydF4y2Ba
图9基于定量等压标记的蛋白质组学鉴定多泛素化途径底物gydF4y2Ba
一个gydF4y2Ba,野生型蛋白质(WT)gydF4y2Ba酿酒酵母gydF4y2Ba用质谱分析等压标记蛋白组学方法对表达内源性启动子下多泛素化缺陷(R324A) Pex10突变体的细胞进行分析。两个独立实验的结果具有代表性。火山图中的每个点代表一个蛋白质,给出了其在R324A突变体和野生型细胞(R324A/WT)中的丰度之比,以及统计显著性的测量(p值)。统计由多重未配对执行gydF4y2BatgydF4y2Ba-test,然后采用两阶段递增法(Benjamini, Krieger,和Yekutieli,期望FDR (Q) = 1%),基于三个生物重复。上图中红点所示的蛋白质在突变株中大量积累(gydF4y2BaPgydF4y2Ba< 0.03, R324A/WT >1.3)。gydF4y2BabgydF4y2Ba中以红点表示的蛋白质列表gydF4y2Ba一个gydF4y2Ba.过氧化物酶体蛋白以红色背景突出显示。其他列出的蛋白质可能间接受到Pex10突变或错误识别的影响(包括线粒体核糖体蛋白、细胞壁蛋白和DNA结合蛋白)。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
冯鹏,吴X, Erramilli, S.K.gydF4y2Baet al。gydF4y2Ba过氧化物酶体泛素连接酶复合物形成逆转录易位通道。gydF4y2Ba自然gydF4y2Ba607gydF4y2Ba, 374-380(2022)。https://doi.org/10.1038/s41586-022-04903-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-04903-xgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba