摘要gydF4y2Ba
自组织类神经器官代表了一个有前途的体外平台,用于模拟人类发育和疾病gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.然而,类器官缺乏体内存在的连通性,这限制了成熟,并使与其他控制行为的电路集成成为不可能。在这里,我们发现移植到新生无腺大鼠体感觉皮层的人类干细胞来源的皮质类器官发育成熟的细胞类型,整合到感觉和动机相关的电路。MRI显示移植后在多个干细胞系和动物间的类器官生长,而单核谱显示皮质发生的进展和活性依赖转录程序的出现。事实上,移植的皮层神经元比体外的神经元表现出更复杂的形态、突触和内在膜特性,这使得发现蒂莫西综合征个体的神经元缺陷成为可能。解剖和功能追踪显示,移植的类器官接受丘脑皮层和皮质皮层输入,而神经活动的体内记录表明,这些输入可以在人类细胞中产生感觉反应。最后,皮质类器官在大鼠大脑中延伸轴突,它们的光遗传激活可以驱动寻求奖励的行为。因此,移植的人类皮层神经元成熟并参与控制行为的宿主回路。我们预计,这种方法将有助于检测电路水平的表型在患者来源的细胞,否则无法发现。gydF4y2Ba
主要gydF4y2Ba
人类大脑的发育是一个了不起的自我组织过程,在这个过程中,细胞增殖、分化、迁移并形成功能正常的神经回路,这些神经回路随后被感官经验完善gydF4y2Ba1克ydF4y2Ba.理解人类大脑发育的一个关键挑战,特别是在疾病的背景下,是缺乏获取脑组织的途径。通过将指导性信号应用于在三维(3D)培养中生长的人类诱导多能干(hiPS)细胞,自组织类器官类似于神经系统的特定区域,包括人类皮质类器官(hCO;也称为人体皮质球体)可以生成gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.然而,有几个限制限制了他们在理解神经回路的发展和功能更广泛的应用。具体来说,目前尚不清楚hCO的成熟是否受到体内存在的某些微环境和感觉输入的缺乏的限制。此外,由于hCO没有集成到可以产生行为输出的电路中,它们在建模遗传复杂和从行为上定义的神经精神疾病方面的效用目前是有限的。gydF4y2Ba
将hCO移植到完整的活体大脑有可能克服这些限制。先前的研究表明,移植到啮齿动物皮层的人类神经元能够存活、投射并与啮齿动物细胞建立联系gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.然而,这些实验通常是在成年动物身上进行的,这可能限制了突触和轴突的整合。在这里,我们介绍了一个移植范例,我们将hiPS细胞衍生的3D hCO移植到早期发育阶段的免疫缺陷大鼠的初级体感觉皮层(S1)gydF4y2Ba13gydF4y2Ba.移植的hCO (t-hCO)神经元经过大量成熟,接受丘脑皮层和皮质皮层输入,能够唤起感觉反应,并将轴突投射延伸到大鼠大脑,从而驱动奖励寻求行为。t-hCO的高级成熟揭示了来自蒂莫西综合征(TS)患者的神经元缺陷,这是一种由l型电压敏感钙通道Ca突变引起的严重遗传性疾病gydF4y2BaVgydF4y2Ba1.2(由gydF4y2BaCACNA1CgydF4y2Ba)gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
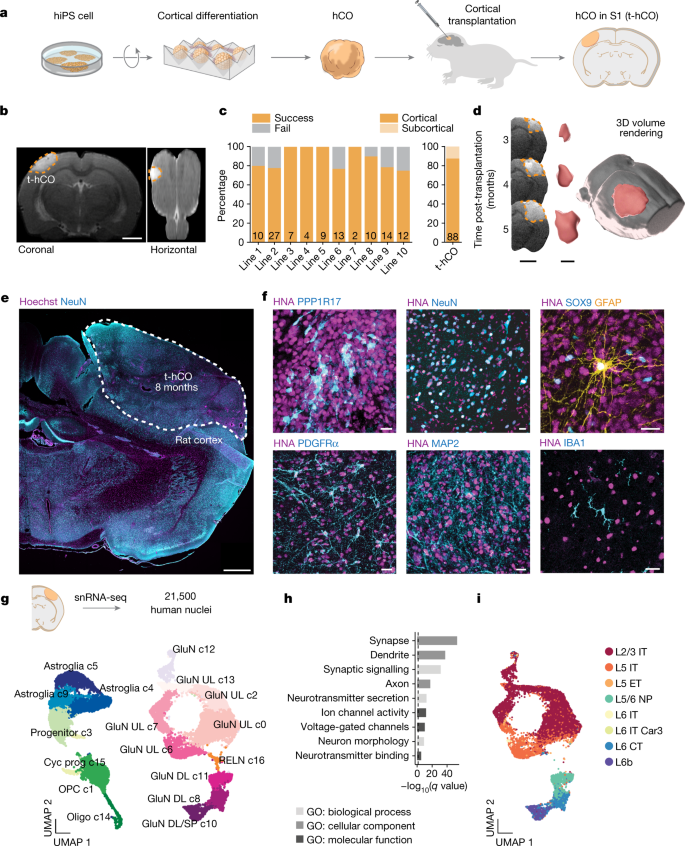
为了研究体内回路中的人源性皮质神经元,我们立体定向地将完整的3D hCO移植到出生后早期无腺大鼠的S1中(出生后3-7天)(图。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1得了gydF4y2Ba).在这个时间点,丘脑皮层和皮质皮层轴突投影还没有完成S1神经的支配(参考文献。gydF4y2Ba13gydF4y2Ba).因此,这种方法旨在最大限度地整合t-hCO,同时最小限度地损害内源性电路。为了可视化t-hCO在活体动物中的位置,我们在移植后2-3个月对大鼠脑进行了t2加权MRI重建(图。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba1 dgydF4y2Ba).t-hCO很容易观察到,t-hCO的体积测量与固定切片的计算结果相似(扩展数据图)。gydF4y2Ba1 d, egydF4y2Ba;gydF4y2BaPgydF4y2Ba> 0.05)。在移植后约2个月,我们在81%的移植动物中鉴定出t-hCO (gydF4y2BangydF4y2Ba= 72只;hCO来自10株hiPS细胞系;hiPS细胞系见补充表gydF4y2Ba1克ydF4y2Ba).其中,87%位于大脑皮层。gydF4y2Ba1 cgydF4y2Ba).通过对同一移植大鼠在多个时间点进行连续MRI扫描,我们发现t-hCO在3个月内体积增加了9倍(图2)。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba1 fgydF4y2Ba).移植动物在移植后12个月的存活率很高(74%)(扩展数据图。gydF4y2Ba1克gydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba),且未检测到明显的运动或记忆缺陷、胶质细胞增生或脑电图(EEG)异常。gydF4y2Ba1氯gydF4y2Ba而且gydF4y2Ba3 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba、实验设计示意图。由hiPS细胞产生的hCO在分化30-60天移植到新生无胸腺大鼠的S1中。gydF4y2BabgydF4y2Ba冠状位和水平位t2加权MRI图像显示移植后2个月S1中t-hCO。比例尺,2毫米。gydF4y2BacgydF4y2Ba,每个hiPS细胞系移植成功率的量化(gydF4y2BangydF4y2Ba= 108,柱状内的数字表示每个hIPS细胞系t-hCO的数量)和皮层或皮层下位置(gydF4y2BangydF4y2Ba= 88)。gydF4y2BadgydF4y2Ba,冠状MRI图像(左;比例尺,3毫米)和相应的三维体积重建(比例尺,3毫米)显示t-hCO在3个月内增长。gydF4y2BaegydF4y2Ba,大鼠皮层t-hCOs样例概述。比例尺,1毫米。gydF4y2BafgydF4y2Bat-hCO代表性免疫细胞化学图像从左上到右(分化时间):PPP1R17(4个月),NeuN(8个月),SOX9和GFAP(8个月),PDGFRα;MAP2(8个月)和IBA1(8个月)。比例尺,20 μm。HNA共表达表明细胞来源于人类。gydF4y2BaggydF4y2Ba, snRNA-seq:均匀流形近似和投影(UMAP)聚类高质量t-hCO核Seurat积分后的降维可视化(gydF4y2BangydF4y2Ba= 3个t-hCO样品,gydF4y2BangydF4y2Ba= 2个hiPS细胞株)。星形胶质细胞,星形胶质细胞谱系;Cyc prog,循环祖;GluN DL,深层谷氨酸能神经元;GluN DL/SP、深层和基底谷氨酸神经元;GluN UL,上层谷氨酸能神经元;益生元,少突细胞;OPC,少突胶质细胞祖细胞;RELN,卷轴神经元。gydF4y2BahgydF4y2Ba基因本体(GO)术语富集分析基因显著上调(调整gydF4y2BaPgydF4y2Bat-hCO谷氨酸能神经元与hCO谷氨酸能神经元相比,< 0.05,折叠变化> 2,至少10%的细胞核表达)。虚线表示agydF4y2Ba问gydF4y2Ba值为0.05。gydF4y2Ba我gydF4y2Ba, UMAP显示t-hCO的GluN细胞类型,使用来自成人运动皮层的标签转移gydF4y2Ba22gydF4y2BasnRNA-seq参考数据集。CT,皮质丘脑细胞;ET,脑外细胞;IT,脑内细胞;NP, near-projecting。gydF4y2Ba
我们接下来评估了t-hCO的细胞结构和总细胞组成。大鼠内皮细胞抗体染色显示t-hCO血管化,而IBA1染色显示大鼠小胶质细胞遍布移植物(图2)。gydF4y2Ba1 fgydF4y2Ba和扩展数据图。gydF4y2Ba3 c, dgydF4y2Ba).免疫染色鉴定出共表达PPP1R17(皮质祖细胞)、NeuN(神经元)、SOX9和GFAP(胶质谱系细胞)或PDGFRα(少突胶质细胞祖细胞)的人核抗原(HNA)阳性细胞(图)。gydF4y2Ba1 fgydF4y2Ba).为了以单细胞分辨率探索t-hCO的细胞组成,我们在分化约8个月时进行了单核RNA测序(snRNA-seq)。高质量的大鼠核过滤和去除得到了21,500个高质量的人类单核谱(图2)。gydF4y2Ba1克gydF4y2Ba和扩展数据图。gydF4y2Ba4 a、bgydF4y2Ba).典型细胞类型标记的表达模式识别了主要皮层细胞类别的集群,包括深层和浅层谷氨酸神经元、循环祖细胞、少突胶质细胞和星形胶质细胞谱系细胞(图2)。gydF4y2Ba1克gydF4y2Ba扩展数据图gydF4y2Ba4摄氏度gydF4y2Ba及补充表gydF4y2Ba3 gydF4y2Ba).SATB2和CTIP2的免疫染色显示,尽管存在皮层层亚型,t-hCO没有显示明显的解剖分层(扩展数据图。gydF4y2Ba3gydF4y2Ba).snRNA-seq阶段匹配的hCO产生了大致相似的细胞类别,但有一些例外,包括缺乏少突胶质细胞和gaba能神经元的存在,这可能反映了体外条件有利于在长期培养中产生一些腹侧祖细胞,如先前报道的那样gydF4y2Ba15gydF4y2Ba(扩展数据图。gydF4y2Ba4外:我gydF4y2Ba及补充表gydF4y2Ba4gydF4y2Ba).差异基因表达分析强调了t-hCO和hCO之间谷氨酸神经元的实质性差异(补充表gydF4y2Ba5gydF4y2Ba),包括与神经元成熟相关的基因集的上调,如突触信号,树突定位和电压门控通道活性(图。gydF4y2Ba1 hgydF4y2Ba及补充表gydF4y2Ba6gydF4y2Ba).因此,t-hCO皮层谷氨酸能神经元表现出提前的转录成熟。gydF4y2Ba
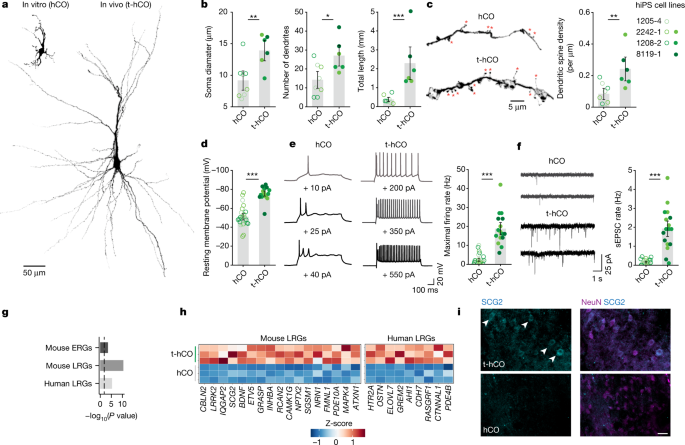
为了检验t-hCO的这些转录变化是否与体外hCO和体内t-hCO之间的形态学差异有关,我们在分化7-8个月的急性切片中重建了阶段匹配的充满生物素的hCO和t-hCO神经元。gydF4y2Ba2gydF4y2Ba).t-hCO神经元比体外培养的hCO神经元大得多,胞体直径大1.5倍,树突多两倍,总的来说,树突总长度比hCO增加了6倍(图2)。gydF4y2Ba2 bgydF4y2Ba).此外,我们观察到t-hCO神经元的树突棘密度明显高于hCO神经元(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).这表明t-hCO神经元经历了广泛的树突延伸和树突化,结合持续的细胞增殖可能有助于移植后t-hCO的广泛生长(图。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba1 fgydF4y2Ba).这促使我们研究电生理特性。膜电容提高了8倍(扩展数据图。gydF4y2Ba8 dgydF4y2Ba),静息膜电位更极化(约20 mV),电流注射在t-hCO神经元中引起的最大放电速率高于体外hCO神经元(图2)。gydF4y2Ba2 d, egydF4y2Ba),与t-hCO更大、更复杂的形态特征相一致。此外,t-hCO神经元中自发兴奋性突触后电流事件(EPSCs)的发生率明显更高。gydF4y2Ba2 fgydF4y2Ba),表明在t-hCO神经元中观察到的树突棘密度的增加与功能性兴奋性突触数量的增加有关。我们通过记录标记的谷氨酸能神经元,在体外证实了hCO神经元的不成熟特征(扩展数据图。gydF4y2Ba6 a - cgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,分化8个月时生物素填充的hCO和t-hCO神经元的三维重建。gydF4y2BabgydF4y2Ba、形态特征的量化(gydF4y2BangydF4y2Ba= 8 hCO神经元,gydF4y2BangydF4y2Ba= 6个t-hCO神经元;**gydF4y2BaPgydF4y2Ba= 0.0084, *gydF4y2BaPgydF4y2Ba= 0.0179和gydF4y2Ba* * * PgydF4y2Ba< 0.0001)。gydF4y2BacgydF4y2Ba,分化8个月时三维重建hCO和t-hCO树突分支。红色星号表示假定的树突棘。树突棘密度的量化(gydF4y2BangydF4y2Ba= 8 hCO神经元,gydF4y2BangydF4y2Ba= 6个t-hCO神经元;**gydF4y2BaPgydF4y2Ba= 0.0092)。gydF4y2BadgydF4y2Ba,静息膜电位的定量(gydF4y2BangydF4y2Ba= 25 hCO神经元,gydF4y2BangydF4y2Ba= 16个t-hCO神经元;***gydF4y2BaPgydF4y2Ba< 0.0001)。gydF4y2BaegydF4y2Ba,增加电流注入诱导hCO和t-hCO的重复动作电位放电,并量化最大放电速率(gydF4y2BangydF4y2Ba= 25 hCO神经元,gydF4y2BangydF4y2Ba= 16个t-hCO神经元;***gydF4y2BaPgydF4y2Ba< 0.0001)。gydF4y2BafgydF4y2Ba,分化8个月时hCO和t-hCO神经元中的自发EPSCs (sEPSCs),以及突触事件频率的量化(gydF4y2BangydF4y2Ba= 25 hCO神经元,gydF4y2BangydF4y2Ba= 17个t-hCO神经元;***gydF4y2BaPgydF4y2Ba< 0.0001)。为gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba, 1208-2中的hCO和t-hCO取自同一分化批,平行维持。gydF4y2BaggydF4y2Ba,基因集富集分析(单侧Fisher’s精确检验)显著上调(调整)的基因gydF4y2BaPgydF4y2Ba在t-hCO谷氨酸能神经元中< 0.05,折叠变化> 2,至少10%的细胞核表达),与在小鼠体内研究中鉴定的具有早期反应(ERG)和晚期反应(LRG)活性依赖基因集的hCO谷氨酸能神经元相比gydF4y2Ba16gydF4y2Ba以及来自体外神经元的人类特异性lrggydF4y2Ba17gydF4y2Ba.虚线表示bonferroni校正gydF4y2BaPgydF4y2Ba值为0.05。gydF4y2BahgydF4y2Ba在t-hCO谷氨酸能神经元中,通过LRG基因的snRNA-seq复制的GluN基因表达(每个基因的伪体和缩放)显著上调。gydF4y2Ba我gydF4y2Ba免疫染色显示t-hCO(上)和hCO(下)神经元中SCG2的表达。白色箭头表示SCG2gydF4y2Ba+gydF4y2Ba细胞。比例尺,25µm。数据以均数±s.e.m表示。gydF4y2Ba
根据在离体切片中观察到的t-hCO活性增加,snRNA-seq显示t-hCO中活性依赖基因转录物与体外hCO相比上调。t-hCO谷氨酸能神经元表达较高水平的晚反应活性调控基因(图。gydF4y2Ba2 g hgydF4y2Ba)在之前对小鼠和人类神经元的研究中发现gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.例如,gydF4y2Ba脑源性神经营养因子gydF4y2Ba18gydF4y2Ba,gydF4y2BaSCG2gydF4y2Ba而且gydF4y2BaOSTNgydF4y2Ba是一种灵长类动物特有的活性调节基因gydF4y2Ba17gydF4y2Ba与hCO神经元相比,t-hCO神经元表达增加(图2)。gydF4y2Ba2胃肠道gydF4y2Ba).因此,通过转录、形态和功能分析,t-hCO神经元与hCO神经元相比表现出了增强成熟的特征。gydF4y2Ba
为了进一步评估t-hCO的成熟与人类大脑发育的关系,我们与人类胎儿进行了转录组比较gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba和成人gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba皮层细胞类型,以及开发大量皮层基因表达数据gydF4y2Ba23gydF4y2Ba(扩展数据图。gydF4y2Ba5gydF4y2Ba).与之前的工作一致gydF4y2Ba24gydF4y2Ba在分化7-8个月时,hCO和t-hCO的整体转录组成熟状态与体内发育时间大致吻合,最相当于胎儿期晚期(扩展数据图)。gydF4y2Ba5gydF4y2Ba).值得注意的是,与年龄匹配的hCO相比,我们观察到t-hCO的转录组成熟度增加,以及与突触发生、星状发生和髓鞘形成相关的转录本上调(扩展数据图)。gydF4y2Ba5罪犯gydF4y2Ba).在细胞类水平上,我们发现了t-hCO中更精细的皮层层亚型的证据,谷氨酸神经元簇重叠于成人L2/3、L5和L6神经元亚类(图2)。gydF4y2Ba1我gydF4y2Ba).相比之下,t-hCO谷氨酸能神经元和妊娠中期胎儿皮层神经元之间有更有限的簇重叠gydF4y2Ba(gydF4y2Ba扩展数据图。gydF4y2Ba5 e-jgydF4y2Ba).为了确定t-hCO神经元在功能上是否类似于出生后的人类新皮层神经元,我们对出生后的人类皮层L2/3锥体神经元进行了电生理记录和解剖重建(扩展数据图)。gydF4y2Ba7一个gydF4y2Ba).L2/3锥体神经元的电生理特性与t-hCO锥体神经元相似(扩展数据图)。gydF4y2Ba7 egydF4y2Ba).从形态学上看,来自出生后人类样本的L2/3神经元与t-hCO比hCO更相似,尽管L2/3细胞更长,总体上包含更多分支,具有更高的棘密度(图2)。gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba7罪犯gydF4y2Ba).gydF4y2Ba
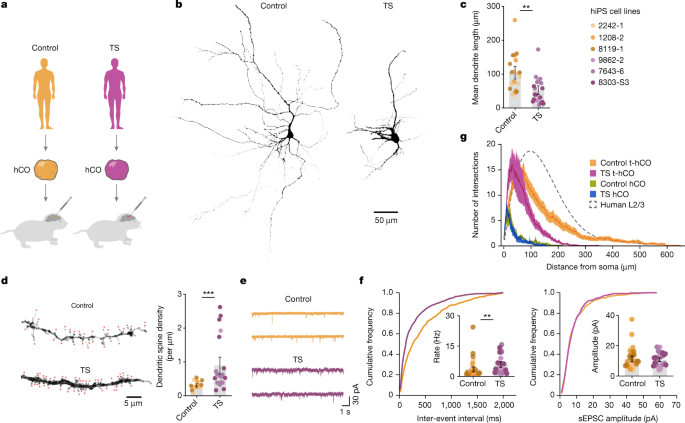
一个gydF4y2Ba对照和TS hiPS细胞系生成的hCO移植到新生大鼠。gydF4y2BabgydF4y2Ba,分化8个月时生物素填充t-hCO神经元的三维重建。gydF4y2BacgydF4y2Ba,平均枝晶长度的量化(gydF4y2BangydF4y2Ba= 19个控制神经元,gydF4y2BangydF4y2Ba= 21个TS神经元;**gydF4y2BaPgydF4y2Ba= 0.0041)。gydF4y2BadgydF4y2Ba,分化8个月时对照和TS t-hCO的3d重建树突分支,定量树突棘密度(gydF4y2BangydF4y2Ba= 16个控制神经元,gydF4y2BangydF4y2Ba= 21个TS神经元,***gydF4y2BaPgydF4y2Ba< 0.0001)。红色星号表示假定的树突棘。gydF4y2BaegydF4y2Ba对照组和TS t-hCO神经元在分化8个月时自发EPSCs。gydF4y2BafgydF4y2Ba,突触事件频率和振幅的累积频率图和量化(gydF4y2BangydF4y2Ba= 32个控制神经元,gydF4y2BangydF4y2Ba= 26个TS神经元;**gydF4y2BaPgydF4y2Ba= 0.0076和gydF4y2BaPgydF4y2Ba= 0.8102)。gydF4y2BaggydF4y2BahCO和t-hCO中TS和对照神经元的shull分析。虚线为出生后人类L2/3锥体神经元作比较(gydF4y2BangydF4y2Ba= 24个对照t-hCO神经元,gydF4y2BangydF4y2Ba= 21个TS t-hCO神经元,gydF4y2BangydF4y2Ba= 8控制hCO神经元和gydF4y2BangydF4y2Ba= 7 TS hCO神经元)。数据以均数±s.e.m表示。gydF4y2Ba
t-hCO能够概括人类皮层神经元的高级形态和功能特征,这促使我们验证t-hCO是否可以用于揭示疾病表型。我们专注于TS,一种严重的神经发育疾病,由编码Ca的基因的功能获得性突变引起gydF4y2BaVgydF4y2Ba1.2,在神经元中启动活性依赖基因转录gydF4y2Ba14gydF4y2Ba.我们从三名携带最常见替代基因(p.G406R)的TS患者和三名对照组参与者中生成了hCO。gydF4y2Ba3gydF4y2Ba).移植后,我们发现与对照组相比,TS神经元的树突形态发生了改变。gydF4y2Ba3 bgydF4y2Ba和扩展数据图。gydF4y2Ba8 a、bgydF4y2Ba),初生树突数量增加了两倍,平均树突长度和总树突长度总体上减少了(图2)。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba8 cgydF4y2Ba).与对照神经元相比,这与TS中突触棘密度的增加和自发EPSCs的更高频率有关(图2)。gydF4y2Ba3 d-fgydF4y2Ba和扩展数据图。gydF4y2Ba8 ggydF4y2Ba).进一步的分析显示,与对照组相比,TS -hCO中有异常的树突分支模式,但在试管中处于相似分化阶段的TS -hCO中没有异常的树突分支模式(图2)。gydF4y2Ba3 ggydF4y2Ba).这与我们之前报道的TS中活动依赖性树突收缩一致gydF4y2Ba25gydF4y2Ba并强调了这种移植平台在体内环境下揭示疾病表型的能力。gydF4y2Ba
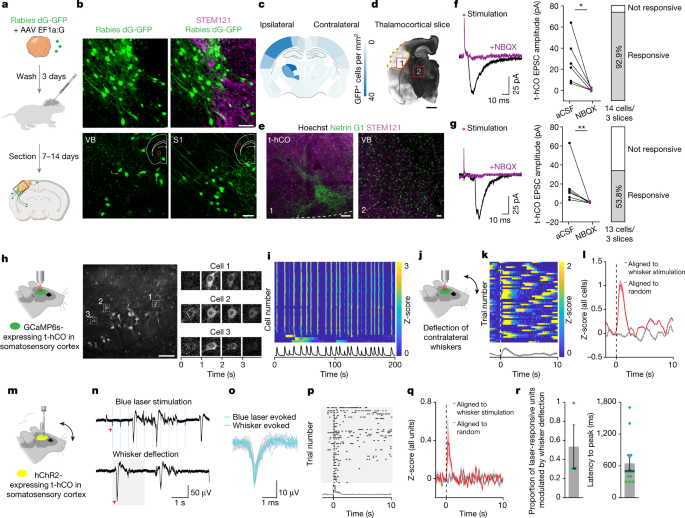
接下来,我们询问t-hCO细胞在多大程度上功能整合到大鼠S1中。啮齿动物的S1接收来自同侧腹基底核和丘脑后核,以及同侧运动和次级体感皮层和对侧S1的强大突触输入(图2)。gydF4y2Ba4gydF4y2Ba).为了重建神经支配模式,我们用raby - dg - gfp /AAV-G感染hCO, 3天后将hCO移植到大鼠S1。移植后7-14天,我们观察到同侧S1和腹基底核神经元中有密集的GFP表达。gydF4y2Ba4 b, cgydF4y2Ba).此外,丘脑标记物网蛋白G1的抗体染色显示t-hCO中存在丘脑末端(图。gydF4y2Ba4 d, egydF4y2Ba).为了评估这些传入投射是否能够在t-hCO细胞中唤起突触反应,我们在急性丘脑皮质切片上对人类细胞进行了全细胞记录gydF4y2Ba26gydF4y2Ba.电刺激大鼠S1、内囊、白质、t-hCO中附近的纤维,或光遗传激活t-hCO中表达视蛋白的丘脑末梢,在t-hCO神经元中诱发了短潜伏期EPSCs,这些EPSCs被AMPA受体拮抗剂NBQX阻断。gydF4y2Ba4 f, ggydF4y2Ba和扩展数据图。gydF4y2Ba9 ggydF4y2Ba).这些数据表明,t-hCO在解剖学上融入了大鼠大脑,并能够被宿主大鼠组织激活。gydF4y2Ba
一个gydF4y2Ba,狂犬病追踪实验示意图。gydF4y2BabgydF4y2Bat-hCO和大鼠皮层之间的GFP和人特异性STEM121表达(上)。GFP在大鼠同侧腹基底核(VB)(左下)和同侧S1(右下)的表达也显示出来。比例尺,50 μm。红色方块表示大脑中图像的拍摄区域。gydF4y2BacgydF4y2Ba,表达gfp细胞的定量(gydF4y2BangydF4y2Ba= 4只老鼠)。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba, Netrin G1gydF4y2Ba+gydF4y2Bat-hCO的丘脑末梢。在gydF4y2BadgydF4y2Ba,显示包含t-hCO和VB核的冠状切面。比例尺,2毫米。在gydF4y2BaegydF4y2Bat-hCO(左)和VB神经元(右)中Netrin G1和STEM121的表达。比例尺,50µm。橙色虚线表示t-hCO的边界。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,大鼠S1电刺激后t-hCO神经元的电流痕迹(gydF4y2BafgydF4y2Ba)或内囊(gydF4y2BaggydF4y2Ba),左边有(紫色)或没有(黑色)NBQX。EPSC振幅有或没有NBQX (gydF4y2BangydF4y2Ba= 6 S1神经元,*gydF4y2BaPgydF4y2Ba= 0.0119;而且gydF4y2BangydF4y2Ba= 6个内囊神经元,**gydF4y2BaPgydF4y2Ba= 0.0022)(中)。大鼠S1电刺激后显示EPSCs的t-hCO神经元的百分比(gydF4y2BafgydF4y2Ba)或内胶囊(gydF4y2BaggydF4y2Ba)(右)。aCSF,人工脑脊液gydF4y2BahgydF4y2Ba, 2p成像实验示意图(左)。GCaMP6s在t-hCO中的表达(中)。比例尺,100 μm。GCaMP6s荧光的时间衰减(右)。gydF4y2Ba我gydF4y2Ba,自发活动的z分荧光。gydF4y2BajgydF4y2Ba,晶须刺激原理图。gydF4y2BakgydF4y2Ba,在一个示例单元中,单次试验z评分的2P荧光轨迹在时间零点对准须偏转(虚线)。gydF4y2BalgydF4y2Ba,在时间零点(虚线)(红色)或随机生成的时间戳(灰色)对准须偏转的所有细胞的总体平均z评分响应。gydF4y2Ba米gydF4y2Ba,光标记实验原理图。gydF4y2BangydF4y2Ba,在蓝色激光刺激或晶须偏转过程中,来自示例t-hCO单元的原始电压痕迹。红色箭头表示第一个光诱发(上)或须偏转诱发(下)峰值。灰色阴影表示须偏转的周期。gydF4y2BaogydF4y2Ba,光和晶须偏转响应的Spike波形。gydF4y2BapgydF4y2Ba,在示例单元中,单次试验spike对准晶须偏转。0表示晶须偏转(虚线)。gydF4y2Ba问gydF4y2Ba,在时间零点(虚线)(红色)或随机生成的时间戳(灰色)对准须偏转的所有光响应单元的总体平均z得分发射率。gydF4y2BargydF4y2Ba,受晶须偏转显著调制的光响应单元比例(gydF4y2BangydF4y2Ba= 3只老鼠)(左)。z-score峰值潜伏期(gydF4y2BangydF4y2Ba= 3只;gydF4y2BangydF4y2Ba= 5(浅绿色),gydF4y2BangydF4y2Ba= 4(深绿色)和gydF4y2BangydF4y2Ba=每只大鼠4(青色)须偏转调制单位)(右)。数据以均数±s.e.m表示。gydF4y2Ba
接下来,我们询问t-hCO是否可以在体内被感官刺激激活。我们将表达基因编码的钙指标GCaMP6s的hCO移植到大鼠S1中。150天后,我们进行纤维光度测定或双光子钙成像(图2)。gydF4y2Ba4 hgydF4y2Ba和扩展数据图。gydF4y2Ba10gydF4y2Ba).我们发现t-hCO细胞表现出同步的,有节奏的活动(图。gydF4y2Ba4我gydF4y2Ba扩展数据图gydF4y2Ba10 bgydF4y2Ba及补充视频gydF4y2Ba1克ydF4y2Ba).为了表征t-hCO的峰值活性,我们对麻醉移植大鼠进行了细胞外电生理记录(扩展数据图。gydF4y2Ba10氟gydF4y2Ba).我们根据MRI图像生成立体定向坐标;因此,这些记录的单位代表假定的人类神经元,尽管仅电生理学不允许物种起源鉴定。我们观察到同步爆发的活动(扩展数据图。gydF4y2Ba10 dgydF4y2Ba).峰值爆发的长度约为460毫秒,并由大约2秒长的沉默期分开(扩展数据图)。gydF4y2Ba10 d, egydF4y2Ba).每个单位平均每次爆发发射大约3个尖峰,每次爆发招募了大约73%的记录单位。单个单位的活性是高度相关的,这些相关性高于在相同条件下记录的非移植动物中鉴定的单位(扩展数据图)。gydF4y2Ba10 fgydF4y2Ba).为了进一步描述确切的人类来源的神经元的刺突反应,我们在移植了表达光敏阳离子通道通道视紫红质-2 (hChR2)的hCO麻醉大鼠中进行了光标记实验,其中t-hCO神经元通过对蓝光刺激的短潜伏期(小于10 ms)反应被识别(图2)。gydF4y2Ba4 m-ogydF4y2Ba).t-hCO神经元显示自发活动爆发的频率与钙成像观察到的频率相似,以及在t-hCO中进行的电生理记录,而没有光标记(扩展数据图)。gydF4y2Ba10 c ggydF4y2Ba).在体外记录的阶段匹配的hCO中未观察到自发活动。为了评估t-hCO是否能被感官刺激激活,我们短暂地将大鼠的胡须转向对侧的t-hCO(图。gydF4y2Ba4 j, mgydF4y2Ba和扩展数据图。gydF4y2Ba10 h kgydF4y2Ba).根据之前的研究gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba10gydF4y2Ba, t-hCO细胞的一个子集显示出响应须偏转的活性增加,当数据与随机时间戳对齐时未观察到这一点(图2)。gydF4y2Ba4 k-qgydF4y2Ba和扩展数据图。gydF4y2Ba10 h-qgydF4y2Ba).事实上,大约54%的光标记单单元在胡须刺激后显示出显著的放电速率增加,并在大约650 ms后达到峰值(图2)。gydF4y2Ba4 rgydF4y2Ba).总之,这些数据表明t-hCO接受适当的功能输入,并可被环境刺激激活。gydF4y2Ba
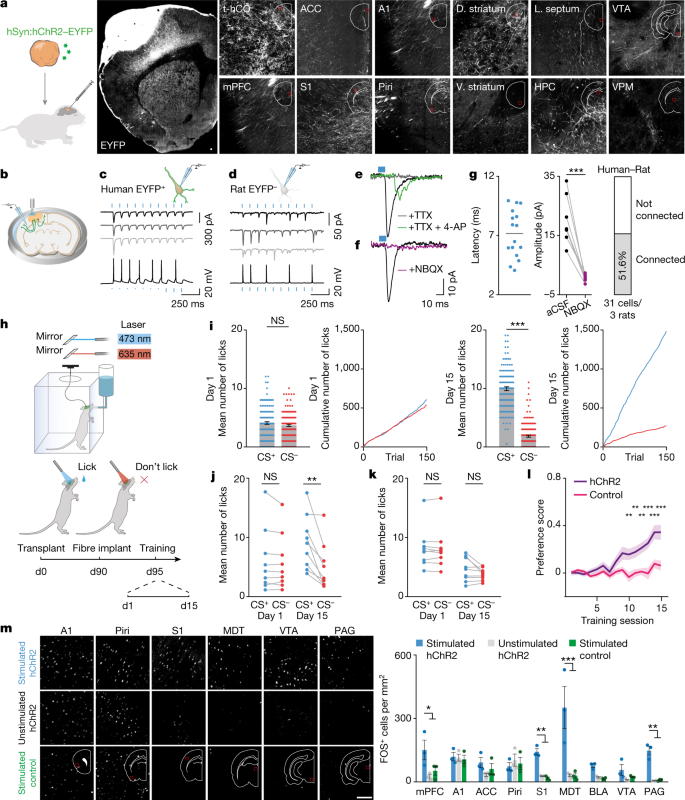
接下来,我们研究了t-hCO是否能激活大鼠的神经回路来驱动行为。我们首先研究了t-hCO神经元是否向周围的大鼠组织发送轴突投射。我们用hChR2融合EYFP的慢病毒(hChR2 - EYFP)感染hCO。110天后,我们观察到EYFP在同侧皮层区域(包括听觉、运动和躯体感觉皮层)以及皮层下区域(包括纹状体、海马体和丘脑)的表达。gydF4y2Ba5gydF4y2Ba).为了评估这些传出投射是否能够在大鼠细胞中唤起突触反应,我们通过光学激活表达hchr2 - eyfp的t-hCO细胞,同时记录急性脑切片中的皮质大鼠细胞。蓝光激活t-hCO轴突可在大鼠锥体皮层神经元中诱发短潜伏期EPSCs,而NBQX则阻断了这一过程(图2)。gydF4y2Ba5 b-ggydF4y2Ba).此外,这些反应可被河豚毒素(TTX)阻断,而被4-氨基吡啶(4-AP)恢复,表明它们是由单突触连接引起的gydF4y2Ba27gydF4y2Ba(无花果。gydF4y2Ba5 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,轴突示踪示意图(左)。t-hCO EYFP表达(右)。比例尺,100 μm。A1,听觉皮层;ACC,前扣带皮层;D.纹状体,背纹状体;HPC,海马状突起;L. septum,侧隔;mPFC,内侧前额叶皮层;梨状皮质; v. striatum, ventral striatum; VPM, ventral posteromedial nucleus of thalamus; VTA, ventral tegmental area. Red squares indicate the region of the brain from which the image is taken.bgydF4y2Ba、刺激实验示意图。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,例如人类EYFP中蓝光诱发的光电流(上)和电压响应(下)gydF4y2Ba+gydF4y2Bat-hCO (gydF4y2BacgydF4y2Ba)或大鼠EYFPgydF4y2Ba- - - - - -gydF4y2Ba细胞(gydF4y2BadgydF4y2Ba).gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,大鼠神经元在TTX和4-AP(绿色)、TTX(灰色)或aCSF(黑色)的蓝光刺激t-hCO轴突后的电流痕迹(gydF4y2BaegydF4y2Ba),或带(紫色)或不带(黑色)gydF4y2BafgydF4y2Ba).gydF4y2BaggydF4y2Ba、大鼠细胞蓝光诱发反应潜伏期(gydF4y2BangydF4y2Ba= 16单元格);横杆表示平均延迟(7.13 ms)(左)。有无NBQX记录的光诱发EPSCs振幅(gydF4y2BangydF4y2Ba= 7单元格;***gydF4y2BaPgydF4y2Ba< 0.0001)(中)。显示对蓝光有反应的EPSCs的大鼠细胞百分比(右)。gydF4y2BahgydF4y2Ba,行为任务的示意图。D0,第0天。gydF4y2Ba我gydF4y2Ba,样例动物在训练第1天(左)或第15天(右)的表现。第1天(左)或第15天(中右)的平均舔次数(gydF4y2BangydF4y2Ba= 150次蓝光试验,gydF4y2BangydF4y2Ba= 150红灯试验;***gydF4y2BaPgydF4y2Ba< 0.0001)。第1天(中间左)或第15天(右边)红光和蓝光试验的累计舔次数。NS,不显著。gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,表达hChR2-EYFP的t-hCO移植后所有动物的行为表现(gydF4y2BajgydF4y2Ba)或控制荧光团(gydF4y2BakgydF4y2Ba)在第1天或第15天(hChR2-EYFP:gydF4y2BangydF4y2Ba= 9只老鼠,**gydF4y2BaPgydF4y2Ba= 0.0049;控制:gydF4y2BangydF4y2Ba= 9,gydF4y2BaPgydF4y2Ba= 0.1497)。gydF4y2BalgydF4y2Ba,偏好评分演变(gydF4y2BangydF4y2Ba= 9 hChR2,gydF4y2BangydF4y2Ba= 9对照;**gydF4y2BaPgydF4y2Ba< 0.001, ***gydF4y2BaPgydF4y2Ba< 0.0001)。gydF4y2Ba米gydF4y2Ba在S1中,t-hCO光遗传激活对FOS表达的影响。FOS表达图(左)和定量图(gydF4y2BangydF4y2Ba=每组3人;*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001)(右)显示。比例尺,100 μm。数据以均数±s.e.m. BLA,基底外侧杏仁核;MDT,丘脑背中核;PAG,导水管周围灰质。gydF4y2Ba
最后,我们询问t-hCO是否能够调节大鼠行为。为了验证这一点,我们将表达hChR2-EYFP的hCO移植到S1中,90天后,我们将光纤植入t-hCO中进行光传输。然后,我们用改良的操作性条件反射范式训练大鼠。gydF4y2Ba5 hgydF4y2Ba).我们将动物放入一个行为测试室,并随机交错使用5秒长的蓝色(473 nm)和红色(635 nm)激光刺激。如果动物在蓝光刺激下舔,就会得到水的奖励,但如果它们在红光刺激下舔,就不会。在训练的第一天,无论是在蓝光还是红光刺激下,动物的舔舐行为都没有表现出差异。然而,在第15天,移植了表达hChR2-EYFP的hCO的动物在蓝光刺激下比红光刺激下舔舐量增加。在移植了表达对照荧光团的hCO的对照动物中,没有观察到这些舔舐行为的变化(学习成功率:hChR2 89%, EYFP 0%,图。gydF4y2Ba5我gydF4y2Ba及补充视频gydF4y2Ba2gydF4y2Ba).这些数据表明t-hCO细胞可以激活大鼠神经元来驱动寻求奖励的行为。为了探索t-hCO可能参与了哪些大鼠神经回路来驱动这些行为变化,我们在训练过的动物中光基因激活了t-hCO,并在90分钟后收集了组织。免疫组织化学显示,活动依赖蛋白FOS在一些涉及动机行为的大脑区域表达,包括内侧前额叶皮层、背侧丘脑和导水管周围灰质,而这在未受刺激的对照组动物或未表达视蛋白的受刺激对照组动物中未观察到(图2)。gydF4y2Ba5米gydF4y2Ba).总之,这些数据证明t-hCO可以调节大鼠神经元的活动来驱动行为。gydF4y2Ba
讨论gydF4y2Ba
类神经器官是一种很有前途的系统,可以在体外探索人类发育和疾病,但它们受到体内缺乏电路连接的限制。我们开发了一种新的平台,将hCO移植到出生后免疫受损大鼠的S1中,以检测体内人类细胞的发育和功能。我们已经证明t-hCO可以发展成熟的细胞类型gydF4y2Ba28gydF4y2Ba而t-hCO在解剖和功能上都融入了啮齿动物的大脑。将t-hCO整合到啮齿动物神经回路中,使我们能够在人类细胞的活动和习得的动物行为之间建立联系,表明t-hCO神经元可以调节大鼠神经元活动以驱动行为反应。gydF4y2Ba
与之前将人类细胞移植到啮齿动物大脑的研究相比,我们所描述的平台有几个优势gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.首先,我们将hCO移植到出生后早期大鼠发育中的大脑皮层,这可能有利于解剖和功能的整合。其次,MRI监测t-hCO使我们能够检查活体动物移植物的位置和生长,使我们能够在多种动物中进行长期研究,并建立多种hiPS细胞系的可靠性。最后,我们植入了完整的类器官,而不是分离的单细胞悬浮液,这对人类细胞的破坏性更小,可能有助于在大鼠脑中整合和生成一组人类皮层神经细胞。gydF4y2Ba
我们认识到,尽管该平台提供了进步,但时空和跨物种的限制阻碍了即使在移植发育的早期阶段也能形成高保真的人类神经回路。例如,目前尚不清楚在t-hCO中观察到的自发活动是否代表一种发育表型,类似于在皮层发育过程中观察到的节律性活动gydF4y2Ba29gydF4y2Ba,或与t-hCO中缺乏抑制性细胞类型有关。同样,尚不确定t-hCO中缺乏分层会在多大程度上影响电路连通性gydF4y2Ba30.gydF4y2Ba.未来的工作将旨在结合其他细胞类型,如人类小胶质细胞,人类内皮细胞和不同比例的gaba能中间神经元,如体外使用组装体所示gydF4y2Ba6gydF4y2Ba,以及理解神经整合和处理如何在转录、突触和行为水平上改变患者来源的t-hCO。gydF4y2Ba
总的来说,这个体内平台是一个强大的资源,可以补充人类大脑发育和疾病的体外研究。我们预计,这个平台将使我们能够在患者来源的细胞中发现新的电路水平的表型,并测试新的治疗策略。gydF4y2Ba
方法gydF4y2Ba
hCO代gydF4y2Ba
如前所述,我们从hiPS细胞中生成hCOgydF4y2Ba2gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.为了使在饲养器上培养的hiPS细胞产生hCO,使用disase (0.35 mg ml)从培养皿中提取完整的hiPS细胞菌落gydF4y2Ba−1gydF4y2Ba)转移到超低附着塑料培养盘(Corning)中,在hiPS细胞培养基中添加两种SMAD抑制剂dorsomorphin (5 μM;P5499, Sigma-Aldrich)和SB-431542 (10 μM;1614, Tocris)和ROCK抑制剂Y-27632 (10 μM;S1049 Selleckchem)。前5天,每天更换hiPS细胞培养基,并补充dorsomorphin和SB-431542。悬浮第6天,神经球状体转移到含有神经碱-A (10888, Life Technologies)、不含维生素A的B-27补充剂(12587,Life Technologies)、谷氨酰胺(1:100,Life Technologies)、青霉素和链霉素(1:100,Life Technologies)并补充表皮生长因子(EGF;20 ng mlgydF4y2Ba−1gydF4y2Ba;研发系统)和成纤维细胞生长因子2 (FGF2;20 ng mlgydF4y2Ba−1gydF4y2Ba;研发系统)直到第24天。从第25天到第42天,在培养基中添加脑源性神经营养因子(BDNF;20 ng mlgydF4y2Ba−1gydF4y2Ba, Peprotech)和神经营养因子3 (NT3;20 ng mlgydF4y2Ba−1gydF4y2Ba;Peprotech)每隔一天进行中等变化。从第43天开始,hCO维持在未补充的神经碱- a培养基中(NM;1088022,赛默飞世尔),每4-6天有中等变化。为了使在无饲料条件下培养的hiPS细胞产生hCO, hiPS细胞用accutase (at -104, Innovate Cell Technologies)在37℃下孵育7分钟,分离成单细胞,并以3 × 10的密度接种到AggreWell 800板(34815,STEMCELL Technologies)gydF4y2Ba6gydF4y2Ba每孔单个细胞在Essential 8培养基中添加ROCK抑制剂Y-27632 (10 μM;S1049 Selleckchem)。24小时后,通过上下移液介质从每个微孔中收集球体,并将其转移到含有补充dorsomorphin的Essential 6培养基(A1516401, Life Technologies)的超低附着塑料皿(3262,Corning)中(2.5 μM;P5499, Sigma-Aldrich)和SB-431542 (10 μM;1614年,Tocris)。从第2天到第6天,每天更换Essential 6培养基,并补充dorsomorphin和SB-431542。从悬浮第六天开始,神经球体转移到神经基底培养基中,并如上所述保持。gydF4y2Ba
移植到无胸腺新生大鼠gydF4y2Ba
所有的动物程序都遵循斯坦福大学实验动物管理委员会(aplacc)批准的动物护理指南。怀孕的RNU (RNU /+)大鼠购买(查尔斯河实验室)或在室内繁殖。动物被维持在12小时的明暗循环下,并自由地提供食物和水。3 - 7天大的无胸腺(gydF4y2BaFOXN1gydF4y2Ba- - - - - -gydF4y2Ba/gydF4y2Ba- - - - - -gydF4y2Ba)大鼠幼仔在宰杀前通过未成熟的胡须生长来识别。幼犬(雄性和雌性)用2-3%异氟醚麻醉,并放置在立体定向框架上。在S1上方进行直径约2-3毫米的开颅手术,保留硬脑膜完整。接下来,使用30g针(约0.3 mm)靠近开颅术外侧穿刺硬脑膜。然后将hCO移到3 × 3厘米的薄层膜上,去除多余的介质。使用Hamilton注射器连接到23g, 45°针头,将hCO轻轻拉入针的最末端。然后将注射器安装在与立体定向装置相连的注射泵上。然后将尖尖的针尖置于硬脑膜上0.3 mm宽的预先穿孔上方(gydF4y2BazgydF4y2Ba= 0 mm),注射器缩小1-2 mm (gydF4y2BazgydF4y2Ba=约-1.5 mm),直到针与硬脑膜之间形成紧密密封。接下来,注射器被提升到皮层表面的中心,在gydF4y2BazgydF4y2Ba= -0.5 mm, hCO以1-2 μ l / min的速度喷射。注射hCO完成后,以0.2-0.5 mm /分钟的速度收回针,闭合皮肤,立即将幼鼠放置在温暖的热垫上,直到完全恢复。部分动物双侧移植。gydF4y2Ba
移植大鼠MRIgydF4y2Ba
所有的动物程序都遵循斯坦福大学aplacc批准的动物护理指南。大鼠(移植后60天以上)在诱导时用5%异氟醚麻醉,成像时用1-3%异氟醚麻醉。对于成像,使用了带有国际电气公司(IECO)梯度驱动器的主动屏蔽Bruker 7特斯拉水平内径扫描仪(Bruker Corp.), 120毫米内径屏蔽梯度插入(600 mT/m, 1000 T/m/s), AVANCE III电子设备,八通道多线圈射频和多核能力,以及配套的Paravision 6.0.1平台。采集采用内径86mm的主动可解耦容积射频线圈,该线圈带有一个四通道低温冷却接收专用射频线圈。轴向2D Turbo-RARE(重复时间= 2500 ms,回波时间= 33 ms,平均2次)16次切片采集,切片厚度0.6 - 0.8 mm,采样256 × 256个。用内径2厘米的正交发射-接收体积射频线圈(Rapid MR International, LLC)接收信号。最后,利用Imaris (BitPlane)内置曲面估计函数进行三维体绘制和分析。成功的移植被定义为在被移植的半球产生连续的t2加权MRI信号区域的移植。失败移植被定义为在移植半球没有产生t2加权MRI信号连续区域的移植。皮质下t-hCO在随后的分析中被排除。gydF4y2Ba
慢病毒标记和g -删除狂犬病感染gydF4y2Ba
为了在hCO中稳定表达GCaMP6s用于双光子钙成像,hiPS细胞被pLV[Exp]-EF1a:: GCaMP6s - wpre - puro感染,然后进行抗生素选择。简单地说,细胞与EDTA分离,并以约300000个细胞的密度悬浮在1 ml的Essential 8介质中,存在聚brene(5µg ml)gydF4y2Ba−1gydF4y2Ba)和15 μ l病毒。然后细胞在悬浮液中孵育60分钟,并以每孔50,000个细胞的密度镀膜。汇合后,用5-10µg ml处理细胞gydF4y2Ba−1gydF4y2Ba嘌呤霉素5-10天或直到菌落稳定。如前所述,进行hCO急性感染gydF4y2Ba5gydF4y2Ba做了一些修改。简而言之,30-45 hCO转移到1.5 ml含有100µl神经介质的Eppendorf微离心管中。接下来,去除约90µl的培养基和3-6µl的高滴度慢病毒(0.5 × 10gydF4y2Ba8 gydF4y2Ba到1.2 × 10gydF4y2Ba9gydF4y2Ba)加入管中,将hCO移至培养箱30 min。接下来,向每个试管中加入90-100 μ l的培养基,并将试管放回培养箱过夜。第二天,将hCO转移到低附着板的新鲜神经介质中。7天后,hCO移至24孔玻璃底板进行成像和感染质量评估。pLV[Exp]-SYN1::EYFP-WPRE和pLV[Exp]-SYN1::hChR2-EYFP-WPRE由VectorBuilder生成。慢病毒被用于大多数实验,因为它被纳入宿主基因组,允许报告基因在被感染的细胞系中表达。为了进行狂犬病追踪,将第30-45天的hCO与狂犬病-ΔG-eGFP和AAV-DJ-EF1a-CVS-G-WPRE-pGHpA(质粒#67528,Addgene)联合感染,在3天内彻底清洗,移植到大鼠S1体内并在体内维持7-14天。gydF4y2Ba
组织制备、免疫组化和定量gydF4y2Ba
在免疫细胞化学方面,动物被麻醉,经心灌注PBS,然后加入4%多聚甲醛(PBS中的PFA;电子显微镜科学)。大脑用4% PFA在4℃下固定2小时或过夜,30%蔗糖在PBS中冷冻保存48-72小时,1:1嵌入30%蔗糖:OCT (Tissue-Tek OCT Compound 4583, Sakura Finetek),用低温恒温器(Leica)在30 μm处进行冠状切片。厚切片免疫组化方法:PBS灌注,用振动器(徕卡)在300 ~ 400 μm处切开动物大脑,4% PFA固定30 min。冷冻切片或厚切片用PBS清洗,室温封闭1 h(10%正常驴血清(NDS)和0.3% Triton X-100稀释于PBS中),4℃与一抗在封闭液中孵育。冷冻切片孵育一夜,而厚切片孵育5天。使用的一抗为:抗neun(小鼠,1:500;ab104224, abcam)抗ctip2(大鼠,1:300;ab18465, abcam), anti-GFAP(兔,1:10 00;Z0334, Dako),抗gfp(鸡肉,1:10 00; GTX13970, GeneTex), anti-HNA (mouse, 1:200; ab191181, abcam), anti-NeuN (rabbit, 1:500; ABN78, Millipore), anti-PDGFRA (rabbit, 1:200; sc-338, Santa Cruz), anti-PPP1R17 (rabbit, 1:200; HPA047819, Atlas Antibodies), anti-RECA-1 (mouse, 1:50; ab9774, abcam), anti-SCG2 (rabbit, 1:100; 20357-1-AP, Proteintech), anti-SOX9 (goat, 1:500; AF3075, R&D Systems), Netrin G1a (goat, 1:100; AF1166, R&D Systems), anti-STEM121 (mouse, 1:200; Y40410, Takara Bio), anti-SATB2 (mouse, 1:50; ab51502, abcam), anti-GAD65/67 (rabbit, 1:400; ABN904, Millipore) and anti-IBA1 (goat, 1:100; ab5076, abcam). Sections were then washed with PBS and incubated with secondary antibodies for either 1 h at room temperature (cryosections) or overnight at 4 °C (thick sections). Alexa Fluor secondary antibodies (Life Technologies) diluted in blocking solution at 1:1,000 were used. Following washes with PBS, nuclei were visualized with Hoechst 33258 (Life Technologies). Finally, slides were mounted for microscopy with cover glasses (Fisher Scientific) using Aquamount (Polysciences) and imaged on a Keyence fluorescence (BZ-X analyzer) microscope or Leica TCS SP8 (Las-X) confocal microscope. Images were processed in ImageJ (Fiji). To quantify the fraction of human neurons in t-hCO and the rat cortex, 387.5-µm-wide rectangular images were taken at the t-hCO centre, edge or from the adjacent rat cortex. The edge of the graft was determined by assessing changes in tissue transparency, the presence of HNA+gydF4y2Ba细胞核和/或组织自身荧光。在每张图像中,NeuN的总数gydF4y2Ba+gydF4y2Ba和海航集团gydF4y2Ba+gydF4y2Ba细胞数除以NeuN总数gydF4y2Ba+gydF4y2Ba同一区域内的细胞。为了确保成像平面上只有细胞核的细胞被计数,只有同样是Hoechst的细胞被计数gydF4y2Ba+gydF4y2Ba都包括在计算中。两幅图像,至少相隔1mm,平均以减少统计误差。gydF4y2Ba
单核分离与基因表达gydF4y2Ba
在样本收集前一周,移植了hCO的动物(大约分化8个月)被安置在一个黑暗的房间里,胡须被修剪以减少感官刺激。如前所述进行核分离gydF4y2Ba31gydF4y2Ba做了一些修改。简而言之,t-hCO和hCO用2毫升玻璃组织研磨机(D8938, Sigma-Aldrich/KIMBLE)用洗涤剂-机械细胞裂解法被破坏。粗核用40 μm过滤器过滤,320℃离心gydF4y2BaggydF4y2Ba在4°C下放置10分钟,然后进行蔗糖密度梯度。经过离心步骤(320gydF4y2BaggydF4y2Ba在0.04% BSA/PBS中添加0.2 U μl,在4℃下重悬20 min)gydF4y2Ba−1gydF4y2BaRNAse抑制剂(40u μlgydF4y2Ba−1gydF4y2Ba, AM2682, Ambion),并通过40 μm流量滤波器。然后将解离的细胞核重悬在含0.02% BSA的PBS中,并加载到铬单细胞3 '芯片上(每个通道估计可回收8000个细胞)。snRNA-seq文库使用Chromium Single cell 3 ' GEM, Library & Gel Bead Kit v3 (10x Genomics)制备。Admera Health在NovaSeq S4 (Illumina)上对来自不同样本的文库进行汇总和测序。gydF4y2Ba
单核表达分析gydF4y2Ba
使用10x Genomics CellRanger分析软件套件(版本6.1.2)对每个假定的核条形码的基因表达水平进行量化。具体来说,reads被映射到使用mkref命令创建的组合人类(GRCh38, Ensemble release 98)和大鼠(Rnor_6.0, Ensemble release 100)参考基因组,并使用count命令-include-introns =TRUE进行量化,以包括映射到内含子区域的reads。对于t-hCO样本,根据至少95%的总测序序列与人类基因组一致的保守要求,确定了人核。所有后续分析都是在CellRanger使用R(版本4.1.2)包Seurat(版本4.1.1)输出的过滤条形码矩阵上进行的。gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
为了确保只有高质量的核被包括在下游分析中,每个样品都实现了迭代过滤过程。首先,检测到的独特基因少于1000个、线粒体数量占总数的20%以上的低质量细胞核被识别并去除。随后,使用sctransform函数(vst.flavor= " v2 ")对原始基因计数矩阵进行正则化负二项式回归归一化,并使用默认参数识别出前3000个高变量基因。在顶部变量基因上使用主成分分析(PCA)进行降维,并通过共享最近邻图构建和FindNeighbors和FindClusters函数实现的模块化检测在PCA空间中识别核簇,使用默认参数的数据集维数为30(根据肘部图的视觉检查选择dim = 30,用于所有样本和集成分析)。随后,我们进行了迭代的聚类(分辨率= 1),根据离群值低基因计数(中位数低于第10百分位),离群值高分数线粒体基因(中位数高于第95百分位),和/或由DoubletFinder包识别的假定双基因的高比例,识别和删除推定的低质量细胞集群gydF4y2Ba33gydF4y2Ba(DoubletFinder得分中位数高于95%)。t-hCO样本(gydF4y2BangydF4y2Ba= 3)及hCO样本(gydF4y2BangydF4y2Ba= 3)分别使用IntegrateData函数与上述参数进行集成。另一轮质量过滤随后执行的综合数据集如上所述。gydF4y2Ba
在去除低质量核后,集成数据集被聚类(分辨率= 0.5)并嵌入UMAP以实现可视化目的gydF4y2Ba34gydF4y2Ba.使用FindMarkers函数和默认参数确定每个簇的标记基因,根据归一化基因表达数据计算。我们通过标记的组合来识别和分类主要的细胞类别gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba35gydF4y2Ba通过与参考人类胎儿和成人皮层数据集集成的基因表达和注释。具体来说,循环祖细胞是通过表达gydF4y2BaMKI67gydF4y2Ba而且gydF4y2BaTOP2AgydF4y2Ba.祖细胞簇定义为缺乏有丝分裂转录物,与中胎晚期皮层中描述的多能胶质祖细胞簇高度重叠gydF4y2Ba20.gydF4y2Ba,和表示gydF4y2Ba表皮生长因子受体gydF4y2Ba而且gydF4y2Ba通过简单地去除OLIG1gydF4y2Ba.我们使用术语星形胶质细胞来包括星形胶质细胞分化的多种状态,从放射状胶质细胞晚期到星形胶质细胞成熟。星形胶质细胞簇表达高水平的gydF4y2BaSLC1A3gydF4y2Ba而且gydF4y2BaAQP4gydF4y2Ba并证明映射到胎儿径向胶质细胞亚型和/或成人星形胶质细胞。信息公开化表示gydF4y2BaPDGFRAgydF4y2Ba而且gydF4y2BaSOX10gydF4y2Ba,而少突胶质细胞表达髓鞘形成的标记物(gydF4y2BaMOGgydF4y2Ba而且gydF4y2BaMYRFgydF4y2Ba).谷氨酸能神经元通过存在神经元转录本(gydF4y2BaSYT1gydF4y2Ba而且gydF4y2BaSNAP25gydF4y2Ba),缺乏gaba能标记物(gydF4y2BaGAD2gydF4y2Ba)及表达gydF4y2BaNEUROD6gydF4y2Ba,gydF4y2BaSLC17A7gydF4y2Ba,gydF4y2BaBCL11BgydF4y2Ba或gydF4y2BaSATB2gydF4y2Ba.GluN神经元进一步分为上层(表达gydF4y2BaSATB2gydF4y2Ba而缺少gydF4y2BaBCL11BgydF4y2Ba)和深层(表达gydF4y2BaBCL11BgydF4y2Ba)子类。假定基板(SP)神经元表达已知SP标记gydF4y2Ba18gydF4y2Ba如gydF4y2BaST18gydF4y2Ba而且gydF4y2BaSORCS1gydF4y2Ba,除深层GluN标记外。脉络膜丛样细胞的表达gydF4y2Ba竞技场队伍gydF4y2Ba脑膜样细胞表达成纤维细胞相关基因,并映射到参考数据集的轻脑膜/血管细胞。gydF4y2Ba
t-hCO和hCO亚类之间的差异基因表达分析使用最近开发的伪体方法进行gydF4y2Ba36gydF4y2Ba跨样本重复,使用Libra R包(版本1.0.0)实现。具体而言,对每个样本重复的给定细胞类别的细胞间基因计数进行edgeR(版本3.36.0,R包)对数似然比检验。对于热图可视化,使用edgeR (CPM()函数)计算每百万计数(CPM)归一化表达值,并缩放(以实现均值= 0,标准差= 1)。基因本体(GO)富集分析显著上调的t-hCO GluN基因(benjaminii - hochberg -adjusted)gydF4y2BaPgydF4y2Ba值小于0.05,至少10%的t-hCO GluN细胞表达,且fold change增加至少2)使用ToppGene Suite (gydF4y2Bahttps://toppgene.cchmc.org/gydF4y2Ba)gydF4y2Ba37gydF4y2Ba.我们使用带有默认参数的ToppFun应用程序,并报告Benjamini-Hochberg-adjustedgydF4y2BaPgydF4y2Ba从GO注释的超几何测试中计算出的值。gydF4y2Ba
将我们的snRNA-seq簇映射到参考原代成人单细胞RNA-seq或snRNA-seq研究的注释细胞簇gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,我们执行了成对数据集集成方法。我们在Seurat中使用SCTransform标准化(v2)工作流来集成和比较数据集之间的集群重叠(使用上面描述的相同参数)。为了提高计算效率,将单个数据集随机划分为每个原始簇最多有500个细胞或核。使用前面描述过的类似方法gydF4y2Ba22gydF4y2Ba,簇重叠被定义为每个集成簇中与参考簇标签重叠的细胞或细胞核的比例。为了进一步分类GluN,我们在GluN子集数据上使用Seurat中的TransferData工作流,将参考数据集标签分配给我们的GluN单元。gydF4y2Ba
为了评估t-hCO和hCO样本的整体转录组成熟状态,我们将伪体样本与BrainSpan/psychENCODE进行了比较gydF4y2Ba23gydF4y2Ba它由跨越人类大脑发育的大量RNA-seq组成。我们对来自怀孕后10周及以上皮质样本的组合样本归一化基因表达矩阵进行了主成分分析,子集为5,567个基因(与我们的数据共享),这些基因之前被确定在BrainSpan皮质样本中受到发育调控(使用三次模型定义为年龄解释方差大于50%)。gydF4y2Ba38gydF4y2Ba.如前所述,我们进一步通过非负矩阵分解获得了与主要神经发育转录组特征相关的基因gydF4y2Ba38gydF4y2Ba.从非负矩阵分解程序计算的样本权重绘制在扩展数据图中。gydF4y2Ba5 bgydF4y2Ba对于Zhu等人描述的五个特征中的每一个。gydF4y2Ba38gydF4y2Ba.类似地,活性依赖的转录标记是从以前发表的研究中获得的。具体而言,视觉刺激后小鼠视觉皮层的snRNA-seq收集发现谷氨酸神经元中erg和lrg显著上调,来自Hrvatin et al的补充表3。gydF4y2Ba16gydF4y2Ba.从氯化钾激活的人类胎儿脑培养物中获得富集人类的LRGs,并在刺激后6小时收集,对其进行筛选,以发现人类中显著上调的基因,而不是啮齿动物gydF4y2Ba17gydF4y2Ba(补充表4)。使用这些基因集进行基因富集分析,采用单侧Fisher精确检验。gydF4y2Ba
体外t-hCO切片电生理学gydF4y2Ba
用异氟醚麻醉大鼠,取出大脑,置于低温(约4°C)充氧(95% OgydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba)蔗糖切片溶液,含:234 mM蔗糖,11 mM葡萄糖,26 mM NaHCOgydF4y2Ba3 gydF4y2Ba, 2.5 mM KCl, 1.25 mM NaHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 10 mM MgSOgydF4y2Ba4gydF4y2Ba0.5 mM的CaClgydF4y2Ba2gydF4y2Ba(约310mosm)。如前所述,使用徕卡VT1200振动棒对含有t-hCO的冠状大鼠脑切片(300-400µm)进行切片gydF4y2Ba39gydF4y2Ba.然后将切片移动到室温下连续充氧切片室,其中含有:10 mM葡萄糖,26 mM NaHCO制成的aCSFgydF4y2Ba3 gydF4y2Ba, 2.5 mM KCl, 1.25 mM NaHPOgydF4y2Ba4gydF4y2Ba, 1 mM MgSOgydF4y2Ba4gydF4y2Ba, 2 mM CaClgydF4y2Ba2gydF4y2Ba和126 mM NaCl (298 mOsm)至少45分钟后再记录。切片记录在水下室中进行,连续灌注aCSF (95% O气泡)gydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba).所有数据均在室温下记录。t-hCO神经元用含127 mM葡萄糖酸钾、8 mM NaCl、4 mM ATP镁、0.3 mM GTP钠、10 mM HEPES和0.6 mM EGTA (pH 7.2,用KOH (290 mOsm)调节)的内液的硼硅酸盐玻璃移液管进行修补。为重建目的,记录液中加入生物ocytin(0.2%)。gydF4y2Ba
使用MultiClamp 700B放大器(分子器件)和Digidata 1550B数字化仪(分子器件)获取数据,在2 kHz下低通滤波,在20 kHz下数字化,并使用Clampfit(分子器件),Origin (OriginPro 2021b, OriginLab)和自定义MATLAB (Mathworks)函数进行分析。使用JPCalc计算液体结电位,并用估计的−14 mV对记录进行校正。的gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaVgydF4y2Ba操作由一系列电流步骤构成,从-250到750pa增量为10 - 25pa。gydF4y2Ba
如前所述,在膜片钳记录hCO神经元期间,在丘脑皮层切片中进行丘脑、白质和S1传入的电刺激gydF4y2Ba25gydF4y2Ba.简而言之,大脑被放置在一个倾斜10°的3d打印台上,前额大脑被切割成35°角。然后,大脑被粘在切面上,切片保存了丘脑皮层的投射轴突。双极钨电极(0.5 MΩ)被安装在第二个微操作器上,并被巧妙地放置以刺激每个细胞的四个区域(内部囊,白质,S1和hCO)。在0.03-0.1 Hz的300 μ a相位刺激下记录突触反应。gydF4y2Ba
通过×40物镜(0.9 NA;记录细胞旁的hchr2表达过程。照明场直径约为0.5 mm,总强度为10-20 mW。脉冲宽度设置为10毫秒,这与行为训练实验中传递的脉冲相对应。应用了从1到20 Hz的多个刺激频率,但为了量化,只使用了列车的第一个脉冲。序列间间隔通常大于30 s,对突触抑制或促进通路的影响最小。为了测试hChR2反应是否为单突触,我们在浴液中应用TTX(1µM),直到EPSC反应消除,然后应用4-氨基吡啶(4-AP;100µM)。通常情况下,反应在几分钟内恢复,在LED开始和EPSC产生之间有稍长的延迟。应用NBQX(10µM)检测反应是否由AMPA受体驱动。gydF4y2Ba
体外hCO切片制备及膜片钳记录gydF4y2Ba
急性hCO切片生成如前所述gydF4y2Ba5gydF4y2Ba.简而言之,将hCO切片嵌入4%琼脂糖中,并转移到含有126 mM NaCl, 2.5 mM KCl, 1.25 mM NaH的aCSF中gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 1 mM MgSOgydF4y2Ba4gydF4y2Ba, 2 mM CaClgydF4y2Ba2gydF4y2Ba, 26毫米NaHCOgydF4y2Ba3 gydF4y2Ba和10mmgydF4y2BadgydF4y2Ba-(+)葡萄糖。切片在室温下使用徕卡VT1200振动器在200-300 μ m下切割,并在室温下保持在aCSF中。然后在直立切片显微镜下进行hCO切片的全细胞膜片钳记录(scientiica)。切片灌注aCSF (95% OgydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba),并在室温下记录细胞信号。用硼硅酸盐玻璃移液管修补hCO神经元,该移液管内充有127 mM葡萄糖酸钾、8 mM NaCl、4 mM ATP镁、0.3 mM GTP钠、10 mM HEPES和0.6 mM EGTA, pH值7.2,用KOH (290 mOsm)调节。为了重建目的,在内液中加入0.2%的生物ocytin。gydF4y2Ba
使用Clampex (Clampex 11.1,分子器件),使用MultiClamp 700B放大器(分子器件)和Digidata 1550B数字化仪(分子器件)获取数据,在2 kHz下低通滤波,在20 kHz下数字化,并使用Clampfit(版本10.6,分子器件)和自定义MATLAB (MATLAB 2019b, Mathworks)函数进行分析。使用JPCalc计算液体结电位,并用估计的−14 mV液体结电位对记录进行校正。的gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaVgydF4y2Ba操作由一系列电流步骤构成,从-50到250 pA增量为5-10-pA。gydF4y2Ba
链霉亲和素染色及神经元示踪gydF4y2Ba
为了进行膜片钳位神经元的形态重建,在内液中加入0.2%的生物ocytin (Sigma-Aldrich)。在闯入后,细胞至少被填充15分钟。然后慢慢收回移液管,超过1-2分钟,直到记录的膜完全重新密封。切片生理学过程完成后,切片在4%的PFA中4°C固定过夜,然后用PBS X3清洗,然后用链霉素偶联的DyLight 549或DyLight 405 (Vector Labs)以1:10 000稀释在室温下孵育2小时,标记充满生物ocytin的细胞(2%;Sigma-Aldrich)在膜片钳记录期间。切片然后使用Aquamount (Thermo Scientific)将切片安装在玻片上进行显微镜检查,并于第二天在徕卡TCS SP8共聚焦显微镜上成像,使用×40 1.3 NA油浸物镜,×0.9-1.0缩放gydF4y2BaxygydF4y2Ba采样频率约为每微米7像素。连续获取间隔为1 μm的Z堆栈,并进行Z堆栈平铺和基于leica的自动拼接,覆盖每个神经元的整个树突树。神经元随后使用neuTube接口进行半手动跟踪gydF4y2Ba40gydF4y2Ba生成SWC文件。这些文件随后被加载到Fiji (ImageJ, version 2.1.0;(NIH)插件SimpleNeuriteTracergydF4y2Ba41gydF4y2Ba.gydF4y2Ba
初级人体样本采集gydF4y2Ba
根据斯坦福大学机构审查委员会批准的协议,在知情同意的情况下获得了人类大脑皮层组织。这两个出生后的人体组织样本(3岁和18岁)是作为治疗医学难治性癫痫手术的一部分,从额叶皮层(额中回)切除中获得的。切除后,将组织收集在含有92 mM NMDG, 2.5 mM KCl, 1.25 mM NaH的冰冷NMDG- acsf中gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 30毫米NaHCOgydF4y2Ba3 gydF4y2Ba, 20毫米HEPES, 25毫米葡萄糖,2毫米硫脲,5毫米钠-抗坏血酸,3毫米钠-丙酮酸,0.5毫米氯化钙gydF4y2Ba2gydF4y2Bah·4gydF4y2Ba2gydF4y2BaO和10mm MgSOgydF4y2Ba4gydF4y2Bah·7gydF4y2Ba2gydF4y2BaO.用浓盐酸滴定pH值至7.3-7.4。在30分钟内将组织转移到实验室,按上述步骤制作冠状切片。gydF4y2Ba
用于纤维光度测定的纤维注入gydF4y2Ba
所有的动物程序都遵循斯坦福大学aplacc批准的动物护理指南。大鼠(移植后140天以上)用5%异氟醚麻醉诱导,术中用1-3%异氟醚麻醉。动物被放置在立体定向框架(Kopf)和丁丙诺啡缓释(SR)皮下管理。显露颅骨,清洁颅骨,置入3-5颗骨螺钉。为了瞄准t-hCO,我们根据MRI获得的图像生成立体定向坐标。在感兴趣的位置钻一个毛刺孔,并将纤维(直径400 μm, 0.48 NA, Doric)降低到hCO表面以下100 μm,并用紫外线固化的牙科水泥(Relyx)固定在颅骨上。gydF4y2Ba
纤维光度测定记录gydF4y2Ba
纤维光度测定记录如前所述gydF4y2Ba42gydF4y2Ba.为了记录自发活动,大鼠被放置在一个干净的笼子里,一根直径400µm的光纤跳线(Doric)连接到植入的光纤上,该光纤与纤维测光采集系统耦合。在10分钟的自发活动记录期间,动物们可以自由地探索笼子。为了记录诱发活性,大鼠(移植后140天以上)用5%异氟醚麻醉诱导,1-3%异氟醚麻醉维持。动物被放置在立体定向框架(Kopf)中,t-hCO对侧的胡须被修剪至约2厘米,并穿过与压电驱动器(PI)耦合的网格。连接到采集系统的直径400微米的光纤膜片线(Doric)连接到植入的光纤上。在20分钟的记录中,使用压电驱动器随机时间对t-hCO对侧的晶须进行50次偏转(2毫米,20赫兹,每次演示2秒)。偏转计时使用定制的MATLAB代码,使用Arduino的MATLAB支持包进行控制。使用晶体管-晶体管逻辑(TTL)脉冲将事件与采集软件同步。gydF4y2Ba
颅窗手术gydF4y2Ba
大鼠(移植后140天以上)用5%异氟醚麻醉诱导,术中用1-3%异氟醚麻醉。将动物置于立体定向框架(Kopf)中,皮下注射丁丙诺啡SR和地塞米松。显露颅骨,清洁颅骨,置入3-5颗骨螺钉。为了瞄准t-hCO,我们根据MRI获得的图像生成立体定向坐标。用高速钻在移植的hCO正上方进行圆形开颅(直径约1厘米)。一旦骨变得尽可能薄,但在钻透骨头之前,使用钳子取出剩余的完整骨盘,以显示下面的t-hCO。开颅术中注入无菌生理盐水,用紫外线固化的牙水泥(Relyx)将玻璃套和定制的头棒固定在颅骨上。gydF4y2Ba
急性体内双光子钙成像gydF4y2Ba
使用布鲁克多光子显微镜,尼康LWD物镜(×16, 0.8 NA)进行双光子成像。GCaMP6成像在920 nm, ×1.4放大在一个单一gydF4y2BazgydF4y2Ba-平面,8×帧平均7.5帧每秒。大鼠用5%异氟醚麻醉诱导,用1-3%异氟醚维持。大鼠被放置在定制的头部固定装置中,并放置在物镜下方。获得自发活动的3分钟基线记录。在20分钟的记录过程中,随机使用picospritzer向t-hCO对侧的须垫输送50个气泡(每次演示持续100毫秒)。使用定制的MATLAB代码,使用Arduino的MATLAB支持包来控制气雾定时。使用TTL脉冲将事件与采集软件(prarieview 5.5)同步。为了进行分析,图像进行了校正gydF4y2BaxgydF4y2Ba- - - - - -gydF4y2BaygydF4y2Ba运动使用仿射修正在MoCo,运行在斐济。使用CNMF-E提取单个细胞的荧光迹线gydF4y2Ba43gydF4y2Ba.从每个感兴趣的区域提取荧光,转换为dF/F迹线,然后转换为z评分。gydF4y2Ba
急性体内细胞外电生理gydF4y2Ba
大鼠(移植后140天以上)用5%异氟醚麻醉诱导,术中用1-3%异氟醚麻醉。将动物置于立体定向框架(Kopf)中,皮下注射丁丙诺啡SR和地塞米松。对侧t-hCO的晶须被修剪至约2厘米,并穿过与压电驱动器耦合的网格。头骨被露出并清理干净。一个不锈钢螺丝固定在颅骨上。为了瞄准t-hCO,我们根据MRI获得的图像生成立体定向坐标。用高速钻直接在t-hCO上方进行圆形开颅(直径约1厘米)。一旦骨变得尽可能薄,但在钻透骨头之前,使用钳子取出剩余的完整骨盘,以显示下面的t-hCO。使用32通道或64通道高密度硅探针(Cambridge Neurotech)记录单个单元,并将其接地螺钉,并用RHD放大器(Intan)预放大。使用操作器将电极通过开颅术降至目标部位,并在开颅术中灌注无菌生理盐水。 Data acquisition was performed at 30 kHz with an Open Ephys acquisition system. Recordings only proceeded if we identified more than ten channels with highly correlated, rhythmic spontaneous activity, suggesting that electrodes were positioned in the graft (based on two-photon calcium imaging data). A 10-min baseline recording of spontaneous activity was obtained. Fifty deflections (2 mm at 20 Hz for 2 s per presentation) were then made to the whiskers contralateral to the t-hCO using a piezo-electric actuator at random times during a 20-min recording. Deflection timing was controlled using custom MATLAB code using the MATLAB Support Package for Arduino (MATLAB 2019b). Events were synchronized with the acquisition software using TTL pulses.
在光标记实验中,一根直径200微米的光纤补片线(Doric)与473纳米激光(Omicron)耦合,连接到一根直径200微米的光纤,该光纤位于开颅术上方。就在这之前,从跳线输出的功率被调整到20mw。使用操作器将电极通过开颅术降至目标部位,并在开颅术中灌注无菌生理盐水。在记录开始时,发送了10个473纳米光脉冲(2hz,脉冲宽度为10毫秒)。光响应单元被定义为在70%或更多的试验中在光开始10毫秒内显示峰值反应的单元。gydF4y2Ba
为了进行分析,使用Kilosort2对尖峰进行排序,并使用Phy2手动管理(参考文献)。gydF4y2Ba44gydF4y2Ba).发射速率使用200毫秒的箱子计算,滑动窗口为100毫秒,并转换为z分数。使用带有两个状态的隐马尔可夫模型来标记种群活动中的“开”和“关”状态。开状态被认为代表爆发,关状态被认为代表爆发间间隔。采用Baum-Welch算法(MATLAB hmmtrain,收敛阈值为1 × 10)对模型的发射跃迁参数进行拟合gydF4y2Ba6gydF4y2Ba和转换矩阵的初始猜测:[0.95,0.05;0.05, 0.96]和排放:[0.5,0.5;0.1, 0.99]),然后使用Viterbi算法估计每个时间点的状态分配。为了评估对须须偏转的反应,采用Wilcoxon符号秩检验比较须须偏转开始后1秒内的发射速率和须须偏转开始前1秒内的发射速率,显著性阈值为gydF4y2BaPgydF4y2Ba< 0.05。潜伏期计算为须须偏转后2 s内达到z分数峰值的时间。功率谱密度采用Welch 's方法(MATLAB中的pwelch())计算,滑动窗口为10 × fs,其中fs为信号的采样率。gydF4y2Ba
用于光遗传操作的纤维植入gydF4y2Ba
大鼠(移植后90天以上)用5%异氟醚麻醉诱导,术中用1-3%异氟醚麻醉。动物被放置在立体定向框架(Kopf)和丁丙诺啡SR皮下给药。显露颅骨,清洁颅骨,置入3-5颗骨螺钉。为了瞄准t-hCO,我们根据MRI获得的图像生成立体定向坐标。在感兴趣的地方钻了一个毛刺孔,和纤维(直径200 μm, 0.48 NA;Thorlabs)被降低到hCO表面以下100微米,并用紫外线固化的牙科水泥(Relyx)固定在颅骨上。gydF4y2Ba
光遗传行为试验gydF4y2Ba
饮水计划的大鼠(每天1小时的水)被放置在一个定制的操作室中,该操作室装有一个配有舔嘴的入口,用于水奖励的输送。通过红外光束的断裂来检测进入鼻刺的入口,通过电容式触摸传感器来检测舔舐。使用定制的MATLAB代码,使用Arduino的MATLAB支持包(MATLAB 2019b)控制和记录所有事件。手术后至少1周,动物开始进行预训练。在预训练第1天,随机延迟1小时,动物在奖励喷口处获得小水奖励。在预训练的第2天和第3天,只有在持续1小时内不断增加舔嘴次数后,动物才会获得少量的水奖励。所有的动物都乐于表现出这种行为。在预训练后,训练动物将移植hCO的光遗传刺激与奖励传递联系起来。动物被放置在操作室中,一根直径200微米的光纤补线(Doric)与操作室外的473纳米(Omicron)和635纳米(CNI)激光连接到植入的光纤上。就在这之前,从跳线输出的功率被调整到20mw。 Laser timing was controlled by a Master-8 pulse generator (AMPI). One second after entering the nosepoke portal, animals received random presentations of either 473-nm or 635-nm stimulation (10 Hz with 10-ms pulse width for 5-s total stimulation). If animals performed one or more licks during the 473-nm stimulation, a small water reward was dispensed at the reward spout after stimulation was complete. The next trial was initiated after collection of this reward. If animals performed one or more licks during the 635-nm stimulation, there was no consequence. Trials were separated by a variable interval of 5–10 s. Animals received daily training sessions that concluded after 150 473-nm and 150 635-nm trials had been completed or after 150 min, whichever came first, for a total of 15 days. Behavioural performance was quantified by calculating a preference index for each training session: (number of licks during 473-nm stimulation − number of licks during 635-nm stimulation)/(number of licks during 473-nm stimulation + number of licks during 635-nm stimulation). The learning success rate was defined as the percentage of trained animals that achieved a preference score >0.2 on at least 2 consecutive training days.
光遗传刺激和FOS染色gydF4y2Ba
将大鼠放入干净的大鼠笼中,将直径200µm的光纤补片线(Doric)与473 nm (Omicron)激光连接到植入的光纤上。就在这之前,从跳线输出的功率被调整到20mw。受刺激的动物接受10 Hz, 10 ms脉冲宽度和473 nm刺激10分钟,然后返回它们的笼子。未受刺激的动物在被送回它们的笼子前10分钟没有受到任何刺激。大鼠经心灌注150 ml PBS安乐死,光遗传刺激90 min后再灌注100 ml 4% PFA。提取大脑,在振动棒上切割100 μm的切片。用山羊抗gfp (abcam)和兔抗fos (abcam)一抗、Alexa 488驴抗山羊(Invitrogen)和Alexa 594驴抗兔(Invitrogen)二抗和DAPI标记。图像使用带有×20物镜的共聚焦显微镜(蔡司)获取,并覆盖来自Paxinos、George和Watson大鼠大脑图谱的图像,用于在特定大脑区域盲法人工计数fos阳性细胞。gydF4y2Ba
脑电图记录gydF4y2Ba
FOXN1gydF4y2Ba−−/gydF4y2Ba用异氟醚麻醉大鼠,在双侧体感皮质和双侧运动皮质上立体定向植入不锈钢丝(791400,A-M Systems)。在小脑上方放置参考线,并用牙骨水泥固定种植体(Metabond, S399, S371和S398;Jet Set4液体,朗牙科,3802X6)。相对于Bregma,使用以下立体定向坐标:初级体感觉皮层(S1BF),前后- 1.3 mm和外侧3.3 mm;和初级运动皮层(M1),前后+2.5 mm,外侧2.5 mm。植入物的导线被固定在定制的Mill-Max头戴适配器(ED90267-ND, Digi-Key Electronics)上。为了开始记录,适配器连接到头级,由数字仪和放大器板(C3334,盈田科技)组成。清醒的、自由行为的动物被拴在一个采集板(Open Ephys)上,使用轻质SPI接口电缆(C3206, Intan Technologies)。采用Open Ephys软件(0.4.4.1版本;gydF4y2Bahttps://open-ephys.orggydF4y2Ba).数据以2 kHz采样,并在1至300 Hz之间进行带通滤波。gydF4y2Ba
露天场地运动行为评估gydF4y2Ba
大鼠(3个月以上,移植后90天以上)在行为测试开始前连续5天处理3分钟。大鼠被放置在一个露天活动场地(43厘米× 43厘米× 30厘米)的角落,在一个声音衰减室中包含三个红外探测器平面(Med Associates)。允许大鼠探索竞技场10分钟,并用Med Associates软件计算移动的距离。在每一回合结束时,竞技场都用1%的维康溶液进行清洁。gydF4y2Ba
新型物体识别gydF4y2Ba
在这个测试中使用了两个不同的物体(绿色塔和白色瓶子)。这些物体有相似的高度和体积,但在形状、质地和外观上有所不同。第1天,将大鼠放置在一个黑色方形塑料区域(50 cm × 50 cm × 45 cm),并允许大鼠使用两个习惯物(15 ml离心管)探索竞技场5分钟。第2天,大鼠首先进行训练。在这一环节中,大鼠被放置在竞技场中,并被允许用两个相同的物体在竞技场中探索5分钟,这两个物体被放置在距离角落15厘米的对角线上。然后将大鼠放回鼠笼5分钟。在测试阶段,老鼠被放回竞技场5分钟,其中一个物体被一个新物体取代。大鼠使用自动跟踪系统(Noldus信息技术)进行跟踪,与每个物体互动的时间由一名试验组不知情的实验者手动评分。交互作用被定义为大鼠将鼻子指向距离它2厘米内的物体。训练和测试的对象和这些对象的位置是伪随机化的。 Objects and the arena were cleaned with a 1% Virkon solution at the end of each training and testing session. A discrimination index was calculated as (time spent interacting with novel object – time spent interacting with familiar object)/(time spent interacting with novel object + time spent interacting with familiar object) during the testing session.
恐惧条件反射gydF4y2Ba
实验包括1天的训练、1天的情境恐惧测试和1天的提示恐惧测试。训练和语境测试都使用了相同的语境。这个环境有铝墙,灰色金属网格作为地板,黄色的房子灯和薄荷提取物的气味,并用10%的简单绿色溶液清洗老鼠(Coulbourn Instruments)。提示的恐惧测试环境是圆形的,有塑料墙壁和地板,蓝色的房子灯和香草提取物的气味,并且在大鼠之间用70%的乙醇清洗。第1天(训练),将大鼠单独放入训练室200 s。音调(20秒,80分贝,2千赫),音调结束18秒后电击(0.5 mA,持续2秒)。这个过程总共重复了三次,在电击结束和随后的音调开始之间间隔60秒。在最后一次电击后60秒,老鼠被从实验室内移出并放回它们的笼子。第2天,将大鼠置于无音调或电击的训练环境中5分钟,进行情境记忆测试。第三天,大鼠被放置在提示恐惧的环境中。 After 200 s of habituation, rats were presented with tones (20 s, 80 dB, 2 kHz) three times at 80-s intervals. Stimulus presentation was controlled using FreezeFrame software. An overhead camera was used to record behaviour. Freezing behaviour was scored manually by an experimenter who was blind to the experimental groups. Freezing was defined as the absence of all movements except those caused by respiration.
统计和再现性gydF4y2Ba
除非另有说明,数据以均数±s.e.m表示。对原始数据的分布进行正态分布检验;统计分析使用学生的gydF4y2BatgydF4y2Ba-检验、Kolmogorov-Smirnov检验、Wilcoxon符号秩检验或Bonferroni校正方差分析进行多重比较。使用Prism (GraphPad)和OriginPro (OriginLab)进行统计分析。各图表面板的详细统计资料载于补充表格gydF4y2Ba7gydF4y2Ba.除非另有说明,代表性实验的数据至少在三个独立的生物重复中得到了相似的结果。样本量是根据以往的研究经验估计的。hCO被随机分配到不同的实验。行为实验由不了解实验条件的研究人员进行。gydF4y2Ba
道德声明gydF4y2Ba
所有涉及人体细胞的实验都符合所有相关的准则和规定。本研究中的人类捐赠者同意使用他们的细胞来生成hiPS细胞和衍生细胞。细胞的来源及其机构批准在补充表中列出gydF4y2Ba1克ydF4y2Ba.这项研究还受益于斯坦福法律和生物科学中心关于斯坦福大脑器官发生大想法项目(斯坦福吴仔神经科学研究所)工作伦理方面的咨询。斯坦福实验动物护理(aplacc)研究合规办公室已批准将hCO移植到大鼠体内。在移植的动物中没有发现明显的运动或记忆缺陷,它们的健康状况全程受到监测。手术神经组织样本获得斯坦福大学机构审查委员会的批准。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
单细胞基因表达数据可在基因表达综合登录号下获得gydF4y2BaGSE190815gydF4y2Ba.支持本研究结果的数据可由通讯作者索取。以下公共数据集用于snRNA-seq分析:来自Ensembl (gydF4y2Bahttp://ftp.ensembl.org/pub/release-98/fasta/homo_sapiens/dna/Homo_sapiens.GRCh38.dna.primary_assembly.fa.gzgydF4y2Ba)和来自GENCODE (gydF4y2Bahttp://ftp.ebi.ac.uk/pub/databases/gencode/Gencode_human/release_32/gencode.v32.primary_assembly.annotation.gtf.gzgydF4y2Ba);大鼠基因组序列的资料来自Ensembl (gydF4y2Baftp://ftp.ensembl.org/pub/release-100/fasta/rattus_norvegicus/dna/Rattus_norvegicus.Rnor_6.0.dna.toplevel.fa.gzgydF4y2Ba);艾伦大脑研究所从内侧颞回生成了成人snRNA-seq数据gydF4y2Ba21gydF4y2Ba以及初级运动皮层gydF4y2Ba22gydF4y2Ba(gydF4y2Bahttps://portal.brain-map.org/atlases-and-data/rnaseqgydF4y2Ba;进入2022年5月);人胎儿皮质单细胞rna序列数据gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba(Polioudakis等。gydF4y2Ba19gydF4y2Ba数据来自gydF4y2Bahttp://solo.bmap.ucla.edu/shiny/webapp/gydF4y2Ba2022年4月;Trevino等人。gydF4y2Ba20.gydF4y2Ba数据从具有登录号的基因表达集合中下载gydF4y2BaGSE162170gydF4y2Ba)和来自发育中的人类皮层的大量RNA-seq数据由psychENCODE生成gydF4y2Ba38gydF4y2Ba(gydF4y2Bahttp://development.psychencode.org/gydF4y2Ba;访问于2022年4月)。gydF4y2Ba
代码的可用性gydF4y2Ba
用于数据处理和分析的数据和代码可根据相应作者的要求提供。用于分析snRNA-seq数据的代码可从以下网站下载gydF4y2Bahttps://github.com/kkelley85/Transplant_organoid_snRNAseqgydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
凯利,K. W.和帕帕卡,s.p.人脑器官发生:朝着细胞理解的发展和疾病。gydF4y2Ba细胞gydF4y2Ba185gydF4y2Ba, 42-61(2021)。gydF4y2Ba
帕斯卡,a.m.等人。三维培养人脑多能干细胞的功能性皮层神经元和星形胶质细胞。gydF4y2BaNat方法。gydF4y2Ba12gydF4y2Ba, 671-678(2015)。gydF4y2Ba
Valesco, S.等。个体脑类器官可重复形成人类大脑皮层的细胞多样性。gydF4y2Ba自然gydF4y2Ba570gydF4y2Ba, 523-527(2019)。gydF4y2Ba
钱,X.等。使用微型生物反应器模拟ZIKV暴露的脑区域特异性类器官。gydF4y2Ba细胞gydF4y2Ba165gydF4y2Ba, 1238-1254(2016)。gydF4y2Ba
尹,S. J.等。人类皮质类器官生成的可靠性。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba, 75-78(2019)。gydF4y2Ba
Birey, F.等人。功能集成人前脑球状体组装。gydF4y2Ba自然gydF4y2Ba545gydF4y2Ba, 54-59(2017)。gydF4y2Ba
埃斯彭尼-卡马乔等人。来自人类多能干细胞的锥体神经元在体内有效地整合到小鼠脑回路中。gydF4y2Ba神经元gydF4y2Ba77gydF4y2Ba, 440-456(2013)。gydF4y2Ba
Linaro, D.等人。异种移植的人类皮层神经元揭示了物种特异性的发育和与小鼠视觉回路的功能整合。gydF4y2Ba神经元gydF4y2Ba104gydF4y2Ba, 972 - 986。e6(2019)。gydF4y2Ba
曼苏尔,a.a.等人。功能性和血管化人脑类器官的体内模型。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 432-441(2018)。gydF4y2Ba
Real, r等。人体神经元动力学和唐氏综合症的体内模型。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, eaau1810(2018)。gydF4y2Ba
Kitahara, T.等。移植人脑类器官沿皮质脊髓束的轴突延伸。gydF4y2Ba干细胞代表gydF4y2Ba15gydF4y2Ba, 467-481(2020)。gydF4y2Ba
熊,M.等。人类干细胞衍生的神经元可以修复电路并恢复神经功能。gydF4y2Ba细胞干细胞gydF4y2Ba28gydF4y2Ba, 112 - 126。e6(2021)。gydF4y2Ba
Kichula, E. A. &亨特利,G. W.小鼠和大鼠桶皮层后内侧丘脑皮层神经支配的发育和比较方面。gydF4y2BaJ. Comp. Neurol。gydF4y2Ba509gydF4y2Ba, 239-258(2008)。gydF4y2Ba
Ebert, D. H. & Greenberg, m.e.活动依赖神经元信号和自闭症谱系障碍。gydF4y2Ba自然gydF4y2Ba493gydF4y2Ba, 327-337(2013)。gydF4y2Ba
特鲁希略,C. A.等。从皮质类器官中产生的复杂振荡波模拟了早期人类大脑网络的发展。gydF4y2Ba细胞干细胞gydF4y2Ba25gydF4y2Ba, 558 - 569。e7(2019)。gydF4y2Ba
Hrvatin, S.等。小鼠视觉皮层中经验依赖转录组状态的单细胞分析。gydF4y2BaNat。>。gydF4y2Ba21gydF4y2Ba, 120-129(2018)。gydF4y2Ba
阿塔曼,B.等。灵长类动物大脑中骨分泌素作为活动调节因子的进化。gydF4y2Ba自然gydF4y2Ba539gydF4y2Ba, 120-129(2016)。gydF4y2Ba
Hong, E. J., McCord, A. E. & Greenberg, M. E. Bdnf转录的神经元活性依赖成分在皮层抑制发展中的生物学功能。gydF4y2Ba神经元gydF4y2Ba60gydF4y2Ba, 610-624(2008)。gydF4y2Ba
Polioudakis, D.等人。妊娠中期人类新皮层发育的单细胞转录组图谱。gydF4y2Ba神经元gydF4y2Ba103gydF4y2Ba, 785 - 801。e8(2019)。gydF4y2Ba
特维诺,A. E.等人。在单细胞分辨率下发育中的人类大脑皮层的染色质和基因调节动态。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 5053 - 5069。e23(2021)。gydF4y2Ba
霍奇,R. D.等人。人与小鼠皮层中具有不同特征的保守细胞类型。gydF4y2Ba自然gydF4y2Ba573gydF4y2Ba, 61-68(2019)。gydF4y2Ba
巴肯,T. E.等。人、绒猴和小鼠运动皮层的比较细胞分析。gydF4y2Ba自然gydF4y2Ba598gydF4y2Ba, 111-119(2021)。gydF4y2Ba
李,M.等。人脑发育与神经精神风险的整合功能基因组分析。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, eaat7615(2018)。gydF4y2Ba
戈登等人。人类皮质类器官的长期成熟与关键的出生后早期转变相匹配。gydF4y2BaNat。>。gydF4y2Ba24gydF4y2Ba, 331-342(2021)。gydF4y2Ba
克里,J. F.等。Timothy综合征与啮齿动物和人类神经元的活动依赖性树突收缩有关。gydF4y2BaNat。>。gydF4y2Ba16gydF4y2Ba, 201-209(2013)。gydF4y2Ba
Agmon, A. & Connors, B. W.小鼠体感(桶)皮层在体外的丘脑皮质反应。gydF4y2Ba神经科学gydF4y2Ba41gydF4y2Ba, 365-379(1991)。gydF4y2Ba
gydF4y2Ba自然gydF4y2Ba457gydF4y2Ba, 1142-1145(2009)。gydF4y2Ba
Kalmbach, B. E. et al. h通道有助于人类与小鼠大脑皮层中粒上锥体神经元的发散性内禀膜特性。gydF4y2Ba神经元gydF4y2BaOne hundred.gydF4y2Ba, 1194 - 1208。e5(2018)。gydF4y2Ba
Molnár, Z., Luhmann, H. J. & Kanold, P. O.瞬态皮层回路与发育过程中自发和感觉驱动的活动相匹配。gydF4y2Ba科学gydF4y2Ba370gydF4y2Ba, eabb2153(2020)。gydF4y2Ba
新皮层回路发展中的命运与自由。gydF4y2BaCommun Nat。gydF4y2Ba8 gydF4y2Ba, 16042(2017)。gydF4y2Ba
马特森,K. J.等。成人脊髓核的分离用于大规模并行单核RNA测序。gydF4y2BaJ. Vis. Exp。gydF4y2Ba140gydF4y2Ba, 58413(2018)。gydF4y2Ba
斯图尔特,T.等人。单细胞数据的全面集成。gydF4y2Ba细胞gydF4y2Ba177gydF4y2Ba, 1888 - 1902。e21(2019)。gydF4y2Ba
McGinnis, C. S., Murrow, L. M. & Gartner, Z. J. DoubletFinder:使用人工最近邻在单细胞RNA测序数据中的双态检测。gydF4y2Ba细胞系统。gydF4y2Ba8 gydF4y2Ba, 329 - 337。e4(2019)。gydF4y2Ba
贝克特,E.等。使用UMAP可视化单单元数据的降维。gydF4y2Ba生物科技Nat。》。gydF4y2Ba37gydF4y2Ba, 38-44(2019)。gydF4y2Ba
Nowakowski, t.j.等人。时空基因表达轨迹揭示了人类皮层的发育层次。gydF4y2Ba科学gydF4y2Ba358gydF4y2Ba, 1318-1323(2017)。gydF4y2Ba
Squair, J. W.等。面对单细胞差异表达的错误发现。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 5692(2021)。gydF4y2Ba
陈杰,Bardes, E. E., Aronow, B. J. & Jegga, A. G. ToppGene套件用于基因列表富集分析和候选基因优先级。gydF4y2Ba核酸测定。gydF4y2Ba37gydF4y2Ba, w305-w311(2009)。gydF4y2Ba
朱毅,等。人类和猕猴大脑发育的时空转录组差异。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, eaat8077(2018)。gydF4y2Ba
Huguenard, J. R. & Prince, D. A.体外丘脑内节律性研究:名义t电流调制引起稳健的抗振荡效应。gydF4y2Baj . >。gydF4y2Ba14gydF4y2Ba, 5485-5502(1994)。gydF4y2Ba
冯良,赵涛,金俊杰。Neutube 1.0:一种基于SWC格式的高效神经元重建软件。gydF4y2BaeNeurogydF4y2Ba2gydF4y2Ba中国科学院学报,2015年2月。gydF4y2Ba
Arshadi, C., Günther, U., Eddison, M., Harrington, K. I. S. & Ferreira, T. a . SNT:神经元解剖学量化的统一工具箱。gydF4y2BaNat方法。gydF4y2Ba18gydF4y2Ba, 374-377(2021)。gydF4y2Ba
斯坦伯格,E. E.等。杏仁核-中脑连接调节食欲和厌恶学习。gydF4y2Ba神经元gydF4y2Ba106gydF4y2Ba, 1026 - 1043。e9(2020)。gydF4y2Ba
Zhou, P.等。从微内窥镜视频数据中高效准确地提取体内钙信号。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e28728(2018)。gydF4y2Ba
Stringer, C., Pachitariu, M., Steinmetz, N., Carandini, M. & Harris, K. D.视觉皮层群体反应的高维几何。gydF4y2Ba自然gydF4y2Ba571gydF4y2Ba, 361-365(2019)。gydF4y2Ba
确认gydF4y2Ba
我们感谢L. D. Pisani和Pasca、Deisseroth和Huguenard实验室的成员,包括M. Thete,他们进行了富有洞察力的讨论和技术支持。这项工作得到了斯坦福大学脑器官发生大想法项目(吴仔神经科学研究所)(到S.P.P., K.D.和B.C.),国家精神卫生研究所(R01 MH115012)(到S.P.P.), Kwan基金(到S.P.P.), Senkut基金(到S.P.P.), Coates基金会(到S.P.P.),路德维希家庭基金会(到S.P.P.), Alfred E. Mann基金会(到S.P.P.),斯坦福妇幼健康研究所(MCHRI)博士后奖学金(到F.B.和O.R.),Walter V.和Idun Berry博士后奖学金(授予F.G.和J.A.), NARSAD青年研究员奖(授予F.G.)和NIH NIDA K99/R00 (K99 DA050662)(授予F.G.)。S.P.P.是纽约干细胞基金会(NYSCF)罗伯逊干细胞研究员和CZI Ben Barres研究员。我们感谢斯坦福活体成像创新中心(SCi 3) -小动物成像中心,该中心得到了NIH S10共享仪器拨款(S10RR026917-01)的支持;斯坦福大学行为和功能神经科学实验室,由NIH S10动物研究共享仪器拨款(1S10OD030452-01)支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
手术室,N.S.和S.N.设计并执行了移植实验。J.A.和X.C.准备了单核分析实验。K.W.K.进行了单细胞rna序列分析。j.a., n.d.a., S.K.和O.R.进行免疫细胞化学和成像。f.b., j.a., X.C.和O.R.维持并分化hiPS细胞。F.B.生成表达gcamp6的hiPS细胞系。手术室做了核磁共振。x.y和B.C.有助于表征移植物的形态。O.R, m.y l和J.R.H.用膜片钳对神经元电生理特性进行了分析。手术室和j。k。k。分析了脑电图记录。 G.A.G. collected primary human samples. N.S. monitored animal wellbeing. O.R. and M.-Y.L. reconstructed neuronal morphology. O.R. performed rabies tracing. F.G. performed and analysed two-photon imaging, fibre photometry, extracellular in vivo electrophysiological recordings, optogenetic manipulations and immunohistochemistry, and axonal tracing. S.W.B. assisted with optogenetic behavioural experiments. R.M. assisted with calcium imaging analysis. N.L.S. and M.S. performed and supervised the behavioural testing. O.R., F.G., S.P.P. and K.D. conceived the project and designed the experiments. O.R., F.G., K.W.K. and S.P.P. wrote the manuscript with input from all authors. S.P.P. supervised all aspects of the work.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
斯坦福大学拥有生成皮质类器官/球状器官的专利(列出S.P.P.为发明人)和移植类器官的临时专利申请(列出S.P.P., o.r., f.g., K.D.和K.W.K.为发明人)。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1移植程序示意图及对动物行为的影响。gydF4y2Ba
得了gydF4y2Ba.手术入路示意图。gydF4y2BadgydF4y2Ba.gydF4y2Ba左gydF4y2Ba, t2加权MRI显示t-hCO。gydF4y2Ba正确的gydF4y2Ba, t-hCO用DAPI可视化。gydF4y2BaegydF4y2Ba.MRI或组织学切片计算出相同t-hCO的重建体积(n = 3, P = 0.9160 t-hCO)。gydF4y2BafgydF4y2Ba.MRI体积重建随时间的定量(n = 6 t-hCO, *P = 0.0239)。gydF4y2BaggydF4y2Ba.移植动物随时间存活的量化。gydF4y2Bah-jgydF4y2Ba.移植t-hCO的动物没有表现出行为缺陷或癫痫发作。gydF4y2BahgydF4y2Ba.移植对照动物(橙色)或未移植对照动物(灰色)在10分钟测试过程中的每分钟(左)和整个10分钟测试过程中的距离(右)(n = 11只非移植对照大鼠,9只移植大鼠,P = 0.4082)。gydF4y2Ba我gydF4y2Ba.移植对照动物(橙色)和非移植对照动物(灰色)计算的新物试验辨别指数((与新物互动时间-与熟悉物互动时间)/(与新物互动时间+与熟悉物互动时间)(n = 11只非移植对照大鼠,9只移植大鼠,P = 0.8756)。gydF4y2BajgydF4y2Ba.移植对照动物(橙色)和非移植对照动物(灰色)在恐惧条件反射训练、情境恐惧记忆测试和提示恐惧记忆测试中的冻结行为(n = 11只非移植对照大鼠,9只移植对照大鼠,P = 0.9599)。gydF4y2BakgydF4y2Ba.未移植大鼠(左)和移植大鼠(右)额叶和体感觉皮质的代表性脑电图记录。gydF4y2BalgydF4y2Ba.未移植对照大鼠和移植大鼠(n = 3只移植大鼠,3只非移植大鼠)体感觉皮层记录脑电图活动的功率谱密度图。gydF4y2Ba米gydF4y2Ba.在单个大鼠(n = 3只移植大鼠)的非移植半球和移植半球同时记录体感觉皮层脑电图活动的功率谱密度图。数据以均数±标准差表示。gydF4y2Ba
图2 t-hCO的免疫组化特征。gydF4y2Ba
a - bgydF4y2Ba.NeuN在t-hCO和大鼠脑周围的表达。gydF4y2BacgydF4y2Ba.HNA和NeuN在t-hCO和大鼠皮层中表达重叠的定量(4个hiPS系共5个t-hCO,每系1-2个t-hCO)。gydF4y2BadgydF4y2Ba.GAD65/67在t- hco大鼠皮层边缘表达的代表性图像。gydF4y2BaegydF4y2Ba.一个很少被观察到的海航的示例图像gydF4y2Ba+gydF4y2BaGAD65/67gydF4y2Ba+gydF4y2Bat-hCO中的神经元。除非另有说明,所有图像均在移植后8个月获得。gydF4y2Ba
图3 t-hCO的免疫组化特征继续。gydF4y2Ba
一个gydF4y2Ba.t-hCO中SATB2和CTIP2表达的代表性图像。gydF4y2BabgydF4y2Ba.t-hCO中SOX2和NeuN表达的示例图像。gydF4y2BacgydF4y2Ba.移植后3个月t-hCO及附近大鼠皮层中大鼠eethelial -marker-1 (RECA1)和IBA1表达的代表性图像。gydF4y2BadgydF4y2Ba.t-hCO中HNA和IBA1的表达。HNA与IBA1无重叠提示小胶质细胞来源于大鼠。gydF4y2BaegydF4y2Ba.GFAP和IBA1在t-hCO和大鼠皮层中的表达。除非另有说明,所有图像均在分化7-9个月时获得。gydF4y2Ba
图4单核RNA-seq样本和hCO分析的数据质量。gydF4y2Ba
一个gydF4y2Ba.snRNA-seq读取计数的数量对准大鼠和人类基因组的每个细胞核分裂的样本。人类细胞核定义为总reads中>95%与人类基因组对齐的细胞核。gydF4y2BabgydF4y2Ba.snRNA-seq质量指标,显示每个样本中每个细胞的计数数量、基因数量和线粒体(MT)基因分数的分布。MT基因片段以箱线图表示(横线表示中位数;上下铰链分别对应第一和第三四分位数;晶须延伸1.5倍四分位间范围,在此范围外显示异常值)。线表示核质量阈值。gydF4y2BacgydF4y2Ba.t-hCO中选择标记基因的基因表达小提琴图。gydF4y2BadgydF4y2Ba.如图所示,相同的集成UMAP。gydF4y2Ba1克gydF4y2Ba, t-hCO样品上色。gydF4y2BaegydF4y2Ba.t-hCO样品中细胞类型的比例由簇着色。gydF4y2BafgydF4y2Ba.Seurat整合后所有聚集的高质量hCO核的UMAP降维可视化(n = 3个来自3个hiPS系的t-hCO样本)。gydF4y2BaggydF4y2Ba.选择标记基因的基因表达小提琴图。gydF4y2BahgydF4y2Ba.与面板f中所示的集成UMAP相同,由hCO样品着色。gydF4y2Ba我gydF4y2Ba.hCO样品中细胞类型的比例由簇着色。2242-1第227天的hCO和t-hCO取自于平行维持的同一分化批次。赛克。掠夺。,cycl我ngprogenitor; Astroglia, astrocyte lineage cell; IPC, intermediate progenitor cell; GluN_UL, upper layer glutamatergic neuron; GluN_DL, deep layer glutamatergic neuron; GluN_DL/SP, deep layer and subplate glutamatergic neurons; RELN, Reelin neurons; IN, GABAergic neurons; Choroid, choroid plexus-like cells; Mening., meningeal-like cells.
扩展数据图5移植hCO RNA-seq与胎儿和成人皮层的比较。gydF4y2Ba
一个gydF4y2Ba.左:第一主成分(PC1)计算的基因表达(对数以2为底RPKM,读取每千碱基外显子每百万读取)从人类皮层BrainSpan样本gydF4y2Ba23gydF4y2Ba伪体(方法)snRNA-seq样本使用之前定义的发育调控基因gydF4y2Ba38gydF4y2Ba.右:t-hCO和hCO样品的PC1值。gydF4y2BabgydF4y2Ba.Zhu等鉴定的五个神经发育转录组特征的样本权重(方法)。gydF4y2Ba38gydF4y2Ba人类大脑皮层样本。虚线为黄土回归拟合曲线。gydF4y2BacgydF4y2Ba.基因集富集分析(单侧Fisher精确检验),使用来自假体GluN簇(神经发生、神经元分化和突触发生特征)、星形胶质细胞簇(天体发生特征)和所有簇的假体(髓鞘相关特征)的t-hCO基因的前200个神经发育特征显著上调(校正p值< 0.05)的基因。线表示Bonferroni校正p值为0.05。gydF4y2BadgydF4y2Ba.前50个显著上调t-hCO基因(按差异表达p值显著性排序)的每个签名的基因表达(伪体和缩放)。gydF4y2Bae-fgydF4y2Ba.t-hCO热图(gydF4y2BaegydF4y2Ba)及hCO (gydF4y2BafgydF4y2Ba通过RNA-seq与原代人胎儿皮层细胞簇的整合来实现簇重叠gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.细胞簇标签来自原始研究。RG,放射状胶质细胞;赛克。prog,cycl我ng progenitors; tRG, truncated radial glia, mGPC, multipotent glial progenitor cell; OPC/Oligo, oligodendrocyte progenitor cell/oligodendrocyte; nIPC, neuronal intermediate progenitor cell; GluN, glutamatergic neuron; CGE IN, caudal ganglionic eminence interneuron; MGE IN, medial ganglionic eminence interneuron; EC, endothelial cell; MG, microglia; Peric., Pericytes; PgG2M and PgS, cycling progenitors; IP, intermediate progenitor; oRG, outer radial glia; End, endothelial cell; Per, pericyte; vRG, ventricular radial glia; ExM, maturing excitatory neuron; ExN, excitatory neuron; ExM.U, maturing upper layer excitatory neuron; ExDp, excitatory deep layer neuron; In, interneuron.g-hgydF4y2Ba.t-hCO GluN细胞类型分类的UMAP可视化(gydF4y2BaggydF4y2Ba)及hCO (gydF4y2BahgydF4y2Ba)使用标签转移(方法)从成人皮质单核RNA-seq参考数据集。内侧颞回皮层夹层转移标记gydF4y2Ba21gydF4y2Ba所示gydF4y2BaggydF4y2Ba再往左gydF4y2BahgydF4y2Ba.右(gydF4y2BahgydF4y2Ba):从运动皮层转移标记GluN亚类的标签(M1)gydF4y2Ba22gydF4y2Ba.gydF4y2Bai jgydF4y2Ba.t-hCO热图(gydF4y2Ba我gydF4y2Ba)及hCO (gydF4y2BajgydF4y2Ba通过RNA-seq与原代成人皮层细胞簇的整合来实现簇重叠gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.细胞簇标签来自原始研究。Exc,兴奋性神经元;Inh,抑制性神经元;Astro,星形胶质细胞;Endo,内皮细胞;CT,皮质丘脑细胞;ET,脑外细胞;IT,脑内细胞;微,小胶质细胞; NP, near-projecting; oligo, oligodendrocyte; OPC, oligodendrocyte precursor; PVM, perivascular macrophage; VLMC, vascular and leptomeningeal cells.
图6谷氨酸hCO神经元的电生理和形态特征。gydF4y2Ba
一个gydF4y2Ba.8个月时生物素填充Camk2α:表达eyfp的hCO神经元的3d重建。gydF4y2BabgydF4y2Ba.三维重构Camk2α的形态特征gydF4y2Ba+gydF4y2BahCO神经元(n = 8)。gydF4y2BacgydF4y2Ba.Camk2α的电生理特性gydF4y2Ba+gydF4y2BahCO神经元(n = 16个)。数据以均数±标准差表示。gydF4y2Ba
图7出生后人脑皮层神经元的电生理和形态特征。gydF4y2Ba
一个gydF4y2Ba.显示切除标本位置和记录条件的示意图。gydF4y2BabgydF4y2Ba.生物素填充人L2/3锥体神经元的三维重建。gydF4y2BacgydF4y2Ba.量化胞体直径、初级分支数量、树突总数、总长度和脊柱密度(2个标本中12个L2/3神经元)。gydF4y2BadgydF4y2Ba.l分析比较L2/3神经元的树突复杂度(样本1中L2/3神经元n = 7个,样本2中神经元n = 8个)。gydF4y2BaegydF4y2Ba.定量L2/3锥体神经元的膜电容、静息膜电位、最大放电速率、峰值振幅、峰值半宽和峰值阈值(来自2个样本的22个L2/3神经元)。虚线表示t-hCO进行比较。数据以均数±标准差表示。gydF4y2Ba
图8对照和TS t-hCO神经元的形态和电生理特性。gydF4y2Ba
得了gydF4y2Ba.对照和TS - t-hCO神经元的形态学特征。gydF4y2Baa - bgydF4y2Ba.三维重建t-hCO神经元的例子,从左到右填充细胞的Line标识,对照:1208-2;2242 - 1;8119 - 1;2242 - 1;2242 - 1;1208 - 2;TS: 8303-S3;8303 - s3;7643 - 6; 7643-6; 9862-2; 8303-S3; 8303-S3; 8303-S3; 8303-S3; 9862-2; 8303-S3; 7643-6.cgydF4y2Ba.体细胞直径、初生分支数、树突总数和总长度的量化(对照:n = 19个神经元,TS: n = 23个神经元,P = 0.592, *P = 0.025;控制:n = 19个神经元,TS: n = 21神经元P = 0.7627, P = 0.0112)。gydF4y2BadgydF4y2Ba.hCO和t-hCO的膜电容比较(hCO: n = 25个神经元,t-hCO: n = 18个神经元,***P < 0.0001)。gydF4y2BaeggydF4y2Ba.对照和TS - t-hCO神经元的电生理特性。gydF4y2BaegydF4y2Ba.在对照和TS t-hCO神经元中单个AP放电的示例痕迹,显示AP高度(黑色箭头)和阈值(灰色虚线)的差异。gydF4y2BafgydF4y2Ba.对照与TS - t-hCO神经元电生理特性比较膜电容(控制:n = 30神经元,TS: n = 36个神经元,P = 0.0848),静止膜电位(控制:n = 31个神经元,TS: n = 33个神经元,* * P < 0.0044),最大发射率(控制:n = 29神经元,TS: n = 36个神经元,* * * P < 0.0001),峰值振幅(控制:n = 31个神经元,TS: n = 35神经元,* * * P < 0.0001),峰值半角(控制:n = 31个神经元,TS: n = 34个神经元,P = 0.0984)和峰值阈值(控制:n = 31个神经元,TS: n = 34个神经元,* * * P < 0.0001)。gydF4y2BaggydF4y2Ba.自发性EPSCs衰变时间和电荷的累积频率图和定量(对照组:n = 32个神经元;TS: n = 26个神经元,P = 0.0744, P = 0.4812)。数据以均数±标准差表示。gydF4y2Ba
扩展数据图9输入t-hCO的电生理特性。gydF4y2Ba
一个gydF4y2Ba.电激活大鼠组织的实验制备示意图,同时从t-hCO神经元进行全细胞记录。gydF4y2BabgydF4y2Ba.gydF4y2Ba左gydF4y2Ba,有(紫色)或没有(黑色)NBQX的白质电刺激后,来自代表性t-hCO神经元的电流痕迹。gydF4y2Ba中间gydF4y2Ba,有无NBQX时EPSC振幅的定量(配对t检验,*P = 0.0295)。gydF4y2Ba正确的gydF4y2Ba,在白质电刺激下显示EPSCs的t-hCO神经元的百分比。gydF4y2BacgydF4y2Ba.gydF4y2Ba左gydF4y2Ba有(紫色)或没有(黑色)NBQX的t-hCO电刺激后,来自代表性t-hCO神经元的电流痕迹。gydF4y2Ba中间gydF4y2Ba,有无NBQX对EPSC振幅的定量(Wilcoxon检验,**P = 0.0022)。gydF4y2Ba正确的gydF4y2Ba, t-hCO电刺激后显示EPSCs的t-hCO神经元的百分比。gydF4y2BadgydF4y2Ba.电刺激体感觉皮层(S1, n = 13个神经元)、内囊(IC, n = 7个神经元)、白质(WM, n = 8个神经元)或t-hCO (n = 11个神经元)后,t-hCO神经元发生EPSC的潜伏期。gydF4y2BaegydF4y2Ba.光遗传学激活t-hCO大鼠丘脑末梢的实验制备示意图,同时从t-hCO神经元进行全细胞记录。gydF4y2BafgydF4y2Ba.gydF4y2Ba前gydF4y2Ba,例记录t-hCO神经元。gydF4y2Ba底gydF4y2Ba有(紫色)或没有(黑色)NBQX的大鼠t-hCO丘脑末梢光遗传激活后,来自代表性t-hCO神经元的电流痕迹。gydF4y2BaggydF4y2Ba,gydF4y2Ba左gydF4y2Ba大鼠t-hCO丘脑末梢光遗传激活后,t-hCO神经元中EPSC的潜伏期(n = 7个神经元,2只动物)。gydF4y2Ba正确的gydF4y2Ba,大鼠t-hCO丘脑末端光遗传激活后显示EPSCs的t-hCO神经元的百分比。数据以均数±标准差表示。gydF4y2Ba
图10 t-hCO活性的表征gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
ggydF4y2Ba.t-hCO自发活性的表征gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba得了gydF4y2Ba.自发t-hCO活性的纤维光度测定记录gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba.gydF4y2Ba前gydF4y2Ba,实验制备原理图。gydF4y2Ba底gydF4y2Ba, t-hCO中GcaMP6s表达的代表图像。比例尺,100 μm。gydF4y2BabgydF4y2Ba.清醒时自发活动记录的z评分荧光痕迹。gydF4y2Ba氟gydF4y2Ba.自发t-hCO活性的细胞外记录gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2BacgydF4y2Ba.gydF4y2Ba前gydF4y2Ba,实验制备原理图。gydF4y2Ba底gydF4y2Ba,假定t-hCO单位的平均波形。gydF4y2BadgydF4y2Ba.隐马尔可夫模型用于识别人口活动的“开”和“关”时期。gydF4y2Ba前gydF4y2Ba,同时记录单元自发活动的栅格图。gydF4y2Ba底gydF4y2Ba,由隐马尔可夫模型识别的“开启”状态的人口平均z得分活动,覆盖在红色区域。gydF4y2BaegydF4y2Ba.定量的自发尖峰活动。gydF4y2Ba左gydF4y2Ba(n = 4只大鼠,每只大鼠10个(深绿色),12个(浅绿色),19个(青色),14个(蓝色)单位)。gydF4y2Ba离开中心gydF4y2Ba,每次爆发的记录单位的比例(n = 4只大鼠)。gydF4y2Ba正确的中心gydF4y2Ba, ON时间(n = 4只大鼠)。gydF4y2Ba正确的gydF4y2Ba, OFF周期持续时间(n = 4只大鼠)。gydF4y2BafgydF4y2Ba.在移植大鼠(假定的人类单位,蓝色,来自4只大鼠的n = 48个单位)或非移植大鼠(大鼠单位,红色,来自3只大鼠的n = 56个单位,P < 0.0001)中,每个单位与所有其他同时记录的单位的中位数相关性的直方图。gydF4y2BaggydF4y2Ba.所使用的所有记录方式(双光子n = 1只大鼠,光纤光度法n = 3只大鼠,细胞外电生理n = 4只大鼠,光标签n = 3只大鼠)的自发活动峰值功率谱密度频率。gydF4y2Bah-qgydF4y2Ba.t-hCO诱发活性的表征gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Bah-jgydF4y2Ba.纤维光度法记录t-hCO活性对晶须偏转的响应。gydF4y2BahgydF4y2Ba.响应晶须偏转的t-hCO神经元的光纤测光记录的实验制备示意图。gydF4y2Ba我gydF4y2Ba.对动物(n = 3只大鼠)在时间零点(红色)或随机生成的时间戳(灰色)对须偏转的z评分反应的平均值。gydF4y2BajgydF4y2Ba.与基线相比,须刺激后的平均z评分定量(n = 3只大鼠,*P = 0.0430)。gydF4y2Bak - ngydF4y2Ba.细胞外电生理记录t-hCO活性对须偏转的响应。gydF4y2BakgydF4y2Ba.响应晶须偏转的t-hCO活性的细胞外电生理记录的实验制备示意图。gydF4y2BalgydF4y2Ba.单次试验对典型单体晶须刺激的响应。gydF4y2Ba前gydF4y2Ba,单次试钉活动与须偏转对齐的栅格图。gydF4y2Ba底gydF4y2Ba,试验平均z得分射击率。gydF4y2Ba米gydF4y2Ba.在时间零点(红色)或随机生成的时间戳(灰色)对准须偏转的所有细胞的总体平均z得分发射率。gydF4y2BangydF4y2Ba.诱发尖峰活性的量化。gydF4y2Ba左gydF4y2Ba,须偏转显著调节的单位比例(n = 4只大鼠)。gydF4y2Ba正确的gydF4y2Ba,潜伏期到峰值z-score (n = 4只大鼠,n = 8(深绿色),11(浅绿色),12(青色)和11(蓝色)只大鼠须偏转调制单位)。gydF4y2Bao-qgydF4y2Ba.在不同的记录方式下,所有确定的假定t-hCO细胞的试验平均反应的热图。gydF4y2BaogydF4y2Ba.gydF4y2Ba前gydF4y2Ba,所有t-hCO细胞的试验平均z评分荧光轨迹热图,用双光子钙成像记录到晶须偏转(左)或随机生成的时间戳(右)。gydF4y2Ba底gydF4y2Ba,群体平均z评分荧光痕迹(n = 14个细胞来自1只大鼠)。gydF4y2BapgydF4y2Ba.gydF4y2Ba前gydF4y2Ba,所有t-hCO单位的试验平均z评分发射速率热图,记录细胞外电生理与须偏转对齐(左)或随机生成的时间戳(右)。gydF4y2Ba底gydF4y2Ba,群体平均z得分射击率(4只大鼠n = 42个单位)。gydF4y2Ba问gydF4y2Ba.gydF4y2Ba前gydF4y2Ba,所有光标记t-hCO单元的试验平均z评分发射速率热图,记录细胞外电生理与须偏转对齐(左)或随机生成的时间戳(右)。gydF4y2Ba底gydF4y2Ba,群体平均z得分射击率(n = 31个单位,来自3只大鼠)。数据以均数±标准差表示。gydF4y2Ba
补充信息gydF4y2Ba
补充表1gydF4y2Ba
用于实验的hiPS细胞株。hiPS细胞系用于各种实验gydF4y2Ba
补充表2gydF4y2Ba
兽医人员在12个月内提交的移植和未移植动物的发病率报告。gydF4y2Ba
补充表3gydF4y2Ba
移植hCO细胞型簇标记基因。每个注释细胞簇的标记基因形成集成t-hCO snRNA-seq,使用Seurat FindMarkers函数和默认参数确定(带有Bonferroni校正的双面Wilcoxon秩和检验)。gydF4y2Ba
补充表4gydF4y2Ba
hCO细胞型簇标记基因。每个注释细胞簇的标记基因来自hCO snRNA-seq数据集,使用Seurat FindMarkers函数和默认参数确定(带有Bonferroni校正的双面Wilcoxon秩和检验)。gydF4y2Ba
补充表5gydF4y2Ba
谷氨酸神经元差异表达基因。显著增加差异表达t-hCO GluN基因(EdgeR对数似然比检验,Benjamini-Hochberg校正,校正后gydF4y2BaPgydF4y2Ba值< 0.05,在至少10%的t-hCO GluN细胞中表达),t-hCO和hCO谷氨酸能神经元之间的绝对折叠变化差异至少为2。gydF4y2Ba
补充表6gydF4y2Ba
t-hCO谷氨酸神经元上调基因的基因本体(GO)术语富集。GO项浓缩gydF4y2BaPgydF4y2Bat-hCO谷氨酸能神经元中上调基因与hCO谷氨酸能神经元的比较值(超几何检验)(补充表5)gydF4y2Ba
补充表7gydF4y2Ba
统计详细图1-5,扩展数据图1-10。gydF4y2Ba
补充视频1gydF4y2Ba
t-hCO自发活性的体内双光子钙成像。gydF4y2Ba
补充视频2gydF4y2Ba
t-hCO的光遗传激活驱动奖励寻求行为。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Revah, O., Gore, F., Kelley, K.W.gydF4y2Baet al。gydF4y2Ba移植人皮质类器官的成熟与电路集成。gydF4y2Ba自然gydF4y2Ba610gydF4y2Ba, 319-326(2022)。https://doi.org/10.1038/s41586-022-05277-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05277-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba