摘要gydF4y2Ba
多通膜蛋白在生物学中发挥着多种作用,包括受体、转运蛋白、离子通道和酶gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.多通道蛋白是如何在内质网协同翻译插入和折叠的还不清楚gydF4y2Ba2gydF4y2Ba.主流模型认为,多通道蛋白的每个跨膜结构域(TMD)通过Sec61蛋白易位通道的前侧侧门依次进入脂双分子层gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.PAT复合体是一种由Asterix和CCDC47组成的膜内伴侣,它与多传递蛋白的早期tmd结合,以一种未知的机制促进其生物生成gydF4y2Ba10gydF4y2Ba.本研究通过对多通道蛋白生物发生过程中中间体的生化和结构分析,发现新生链未与Sec61参与,Sec61被CCDC47封闭锁存。相反,Asterix与底物结合并重定向到Sec61后面的位置,在那里PAT复合体有助于形成一个围绕着半封闭的、充满脂质腔的多通道易位子gydF4y2Ba11gydF4y2Ba.从核糖体中出现后,在这个空腔中检测到多个tmd,表明多通蛋白插入并折叠到Sec61后面。因此,Sec61侧门的抑制剂不影响多个多通蛋白的生物生成。这些发现阐明了膜内伴侣蛋白的机制,并为内质网多通道膜蛋白生物发生提供了一个新的框架。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你的机构获取gydF4y2Ba
访问选项gydF4y2Ba
订阅自然+gydF4y2Ba
立即在线访问《自然》和其他55种《自然》杂志gydF4y2Ba
29.99美元gydF4y2Ba
每月gydF4y2Ba
订阅杂志gydF4y2Ba
获得1年的完整期刊访问权限gydF4y2Ba
199.00美元gydF4y2Ba
每期仅需$3.90gydF4y2Ba
所有价格均为净价格。gydF4y2Ba
增值税将在稍后的结帐中添加。gydF4y2Ba
税金计算将在结账时完成。gydF4y2Ba
买条gydF4y2Ba
在ReadCube上获得时间限制或全文访问权限。gydF4y2Ba
32.00美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba

数据可用性gydF4y2Ba
本研究产生的数据可在主要文章、补充材料或公共资料库中查阅。gydF4y2Baemd - 25994gydF4y2Ba而且gydF4y2Baemd - 26133gydF4y2BaEMDB (gydF4y2Bawww.ebi.ac.uk emdbgydF4y2Ba),gydF4y2Ba7 tm3gydF4y2Ba而且gydF4y2Ba7图gydF4y2BaPDB (gydF4y2Bawww.rcsb.orggydF4y2Ba).所有凝胶的源数据可在补充图中找到。gydF4y2Ba1gydF4y2Ba.流式细胞术实验的门控策略见补充图。gydF4y2Ba2gydF4y2Ba.图的源数据gydF4y2Ba4gydF4y2Ba在补充表gydF4y2Ba1gydF4y2Ba.扩展数据图的源数据。gydF4y2Ba7 fgydF4y2Ba在补充表gydF4y2Ba4gydF4y2Ba.此外,我们利用了先前发表的一个结构模型(加入号为。gydF4y2Ba6 t59gydF4y2Ba)和UniProt Fasta数据库(gydF4y2Bahttps://www.uniprot.org/proteomesgydF4y2Ba)gydF4y2Bac .狼疮后裔gydF4y2Ba(2021年3月30日访问)和gydF4y2Bao .地道gydF4y2Ba(2021年3月9日访问)。gydF4y2Ba
代码的可用性gydF4y2Ba
本研究没有使用自定义代码。gydF4y2Ba
参考文献gydF4y2Ba
膜蛋白宇宙:有什么?为什么要这么麻烦?gydF4y2Baj .实习生。地中海。gydF4y2Ba261gydF4y2Ba, 543 - 557(2007)。gydF4y2Ba
膜蛋白整体生物发生的机制。gydF4y2Ba分子细胞生物学。gydF4y2Ba23gydF4y2Ba, 107 - 124(2022)。gydF4y2Ba
细胞内蛋白质拓扑发生。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba77gydF4y2Ba, 1496 - 1500(1980)。gydF4y2Ba
Heinrich, S. U., Mothes, W., Brunner, J. & Rapoport, T. a . Sec61p复合体通过允许跨膜结构域的脂质分割来介导膜蛋白的整合。gydF4y2Ba细胞gydF4y2Ba102gydF4y2Ba, 233 - 244(2000)。gydF4y2Ba
Görlich, D. & Rapoport, T. A.蛋白质易位到由内质网膜纯化成分重建的蛋白脂质体。gydF4y2Ba细胞gydF4y2Ba75gydF4y2Ba, 615 - 630(1993)。gydF4y2Ba
Martoglio, B., Hofmann, m.w ., Brunner, J. & Dobberstein, B.内质网膜中的蛋白质传导通道向脂质双分子层的横向开放。gydF4y2Ba细胞gydF4y2Ba81gydF4y2Ba, 207 - 214(1995)。gydF4y2Ba
高,s等。Sec61p在I型和II型信号锚蛋白的膜插入过程中与它们相邻。gydF4y2Baj .细胞杂志。gydF4y2Ba121gydF4y2Ba, 743 - 750(1993)。gydF4y2Ba
拉波波特,李丽,帕克,对蛋白质易位的结构和机制的洞察。gydF4y2Ba为基础。细胞发育生物学。gydF4y2Ba33gydF4y2Ba, 369 - 390(2017)。gydF4y2Ba
Van den Berg, B.等。蛋白质传导通道的x射线结构。gydF4y2Ba自然gydF4y2Ba427gydF4y2Ba36-44(2004)。gydF4y2Ba
膜内伴侣复合物促进膜蛋白的生物生成。gydF4y2Ba自然gydF4y2Ba584gydF4y2Ba, 630 - 634(2020)。gydF4y2Ba
McGilvray, p.t.等人。用于多通道膜蛋白生物生成的ER易位子。gydF4y2BaeLifegydF4y2Ba9gydF4y2Bae56889(2020)。gydF4y2Ba
膜蛋白的生物发生:内质网。gydF4y2Ba细胞gydF4y2Ba91gydF4y2Ba, 575 - 582(1997)。gydF4y2Ba
邵淑华,贺德华。膜蛋白在内质网的插入。gydF4y2Ba为基础。细胞发育生物学。gydF4y2Ba27gydF4y2Ba25-56(2011)。gydF4y2Ba
Chitwood, P. J., Juszkiewicz, S., Guna, A., Shao, S. & Hegde, R. S., EMC需要启动精确的膜蛋白拓扑发生。gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 1507 - 1519(2018)。gydF4y2Ba
O 'Keefe, S.等。内质网膜蛋白生物生成的另一途径。gydF4y2BaCommun。医学杂志。gydF4y2Ba4gydF4y2Ba828(2021)。gydF4y2Ba
安格尔,s.a, McGilvray, p.t, Hegde, R. S. & Keenan, R. J.真核内质网中Oxa1同源物的鉴定。gydF4y2Ba细胞的代表。gydF4y2Ba21gydF4y2Ba, 3708 - 3716(2017)。gydF4y2Ba
Guna, A., Volkmar, N., Christianson, J. C. & Hegde, R. S. ER膜蛋白复合物是一种跨膜结构域插入酶。gydF4y2Ba科学gydF4y2Ba359gydF4y2Ba, 470 - 473(2018)。gydF4y2Ba
Do H., Falcone, D., Lin J., Andrews, D. W. & Johnson, a . E.膜蛋白在磷脂双分子层的共翻译整合是一个多步骤的过程。gydF4y2Ba细胞gydF4y2Ba85gydF4y2Ba, 369 - 378(1996)。gydF4y2Ba
Mothes, W.等。膜蛋白整合到内质网的分子机制。gydF4y2Ba细胞gydF4y2Ba89gydF4y2Ba, 523 - 533(1997)。gydF4y2Ba
Mravic, M.等。极侧链的排列使得精确设计高稳定的膜蛋白成为可能。gydF4y2Ba科学gydF4y2Ba363gydF4y2Ba, 1418 - 1423(2019)。gydF4y2Ba
齐默,冯·海杰内,G.和白s.h。整体膜蛋白插入和折叠的机制。gydF4y2Baj·摩尔,杂志。gydF4y2Ba427gydF4y2Ba, 999 - 1022(2015)。gydF4y2Ba
Talbot, b.e, Vandorpe, d.h, Stotter, b.r, Alper, s.l. & Schlondorff, j.s.跨膜插入酶和gydF4y2BaNgydF4y2Ba-糖基化在很大程度上决定了非选择性阳离子通道TRPC6的合成、转运和活性。gydF4y2Ba生物。化学。gydF4y2Ba294gydF4y2Ba, 12655 - 12669(2019)。gydF4y2Ba
Meacock, s.l., Lecomte, F. J. L, Crawshaw, s.g. & High, S.在多面体蛋白的膜整合过程中,不同的跨膜结构域与不同的内质网成分相关。gydF4y2Ba摩尔。杂志。细胞gydF4y2Ba13gydF4y2Ba, 4114 - 4129(2002)。gydF4y2Ba
Ismail, N., Crawshaw, S. G. & High, S.跨膜结构域的主动和被动移位都发生在视蛋白Sec61转座的生物生成过程中。gydF4y2Baj .细胞科学。gydF4y2Ba119gydF4y2Ba, 2826 - 2836(2006)。gydF4y2Ba
Sundaram等人。多通道膜蛋白转位子的底物驱动组装。gydF4y2Ba自然gydF4y2Bahttps://doi.org/10.1038/s41586-022-05330-8gydF4y2Ba(2022)。gydF4y2Ba
Pfeffer, S.等。解剖translocon相关蛋白复合物的分子组织。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba14516(2017)。gydF4y2Ba
德特默等。跨膜蛋白147 (TMEM147)是Nicalin-NOMO蛋白复合物的一个新成分。gydF4y2Ba生物。化学。gydF4y2Ba285gydF4y2Ba, 26174 - 26181(2010)。gydF4y2Ba
普遍存在的蛋白质转运蛋白SecY和YidC的统一进化起源。gydF4y2BaBMC医学杂志。gydF4y2Ba19gydF4y2Ba266(2021)。gydF4y2Ba
Mariappan等人。尾锚蛋白插入膜相关步骤的机制。gydF4y2Ba自然gydF4y2Ba477gydF4y2Ba, 61 - 66(2011)。gydF4y2Ba
跳楼者,j等。使用AlphaFold进行高度精确的蛋白质结构预测。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 583 - 589(2021)。gydF4y2Ba
Tunyasuvunakool, K.等。人类蛋白质组的高度精确的蛋白质结构预测。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 590 - 596(2021)。gydF4y2Ba
Voorhees, R. M., Fernández, i.s, Scheres, S. H. W. & Hegde, R. S.哺乳动物核糖体- sec61复合体的结构到3.4 Å分辨率。gydF4y2Ba细胞gydF4y2Ba157gydF4y2Ba, 1632 - 1643(2014)。gydF4y2Ba
Plath, K., Mothes, W., Wilkinson, b.m, Stirling, c.j . & Rapoport, T. A.酵母ER膜翻译后蛋白转运的信号序列识别。gydF4y2Ba细胞gydF4y2Ba94gydF4y2Ba, 795 - 807(1998)。gydF4y2Ba
Voorhees, R. M. & Hegde, R. S.由信号序列打开的Sec61通道结构。gydF4y2Ba科学gydF4y2Ba351gydF4y2Ba, 88 - 91(2016)。gydF4y2Ba
李,L.等。底物参与的SecY蛋白易位通道的晶体结构。gydF4y2Ba自然gydF4y2Ba531gydF4y2Ba, 395 - 399(2016)。gydF4y2Ba
Keenan, R. J., Freymann, D. M., Walter, P. & Stroud, R. M.信号识别粒子信号序列结合亚基的晶体结构。gydF4y2Ba细胞gydF4y2Ba94gydF4y2Ba, 181 - 191(1998)。gydF4y2Ba
Mateja等人。Get3基因识别尾锚膜蛋白的结构基础。gydF4y2Ba自然gydF4y2Ba461gydF4y2Ba, 361 - 366(2009)。gydF4y2Ba
Fry, m.y, Saladi, S. M. & Clemons, W. M. sti1结构域是一个具有疏水槽的柔性α -螺旋褶皱。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 882 - 898(2021)。gydF4y2Ba
王芳,Brown, E. C., Mak, G., Zhuang J. & Denic, V.翻译后膜插入内质网的蛋白质伴侣级联排序。gydF4y2Ba摩尔。细胞gydF4y2Ba40gydF4y2Ba, 159 - 171(2010)。gydF4y2Ba
小分泌蛋白的钙调素依赖性易位途径。gydF4y2Ba细胞gydF4y2Ba147gydF4y2Ba, 1576 - 1588(2011)。gydF4y2Ba
Itakura, E.等。泛素伴随和分选线粒体膜蛋白降解。gydF4y2Ba摩尔。细胞gydF4y2Ba63gydF4y2Ba21-33(2016)。gydF4y2Ba
设计到内部位置的前氨基末端信号序列指导两侧蛋白质结构域的易位。gydF4y2Baj .细胞杂志。gydF4y2Ba101gydF4y2Ba, 2292 - 2301(1985)。gydF4y2Ba
Kalies, K. U., Görlich, D. & Rapoport, T. A. sec61p复合体介导的核糖体与粗面内质网的结合。gydF4y2Baj .细胞杂志。gydF4y2Ba126gydF4y2Ba, 925 - 934(1994)。gydF4y2Ba
Hennon S. W., Soman, R., Zhu, L. & Dalbey, R. E. YidC/Alb3/Oxa1插入酶家族。gydF4y2Ba生物。化学。gydF4y2Ba290gydF4y2Ba, 14866 - 14874(2015)。gydF4y2Ba
UniProt:通用蛋白质知识库。gydF4y2Ba核酸Res。gydF4y2Ba46gydF4y2Ba, 2699 - 2699(2018)。gydF4y2Ba
膜蛋白拓扑学。gydF4y2Ba分子细胞生物学。gydF4y2Ba7gydF4y2Ba, 909 - 918(2006)。gydF4y2Ba
膜蛋白的结构对称性。gydF4y2Ba为基础。启Biophys。gydF4y2Ba44gydF4y2Ba, 311 - 337(2015)。gydF4y2Ba
梅菲尔德,S. V.等。分泌蛋白谱显示TNF-α被选择性和混杂的Sec61调节剂失活。gydF4y2Ba化学。医学杂志。gydF4y2Ba18gydF4y2Ba, 1082 - 1088(2011)。gydF4y2Ba
帕特罗,a.o.等人。阿霉素通过直接阻断Sec61蛋白易位通道杀死细胞。gydF4y2Ba细胞化学。医学杂志。gydF4y2Ba23gydF4y2Ba, 561 - 566(2016)。gydF4y2Ba
Zong, G.等。益豆素F结合Sec61α抑制蛋白质易位。gydF4y2Baj。化学。Soc。gydF4y2Ba141gydF4y2Ba, 8450 - 8461(2019)。gydF4y2Ba
冯强,邵松。体外重建转译阻滞通路。gydF4y2Ba方法gydF4y2Ba137gydF4y2Ba20-36(2018)。gydF4y2Ba
沙玛,A., Mariappan, M., Appathurai, S. & Hegde, R. S.蛋白质转位进入哺乳动物内质网的体外解剖。gydF4y2Ba摩尔。生物方法。gydF4y2Ba619gydF4y2Ba, 339 - 363(2010)。gydF4y2Ba
用于共翻译蛋白易位的微粒体膜的制备。gydF4y2BaEnzymol方法。gydF4y2Ba96gydF4y2Ba, 84 - 93(1983)。gydF4y2Ba
林。等。TTC5通过mRNA降解介导微管蛋白的自动调节。gydF4y2Ba科学gydF4y2Ba367gydF4y2Ba, 100 - 104(2020)。gydF4y2Ba
Fons, R. D, Bogert, B. A. & Hegde, R. S. translocon相关蛋白复合物在内质网膜易位过程中的底物特异性功能。gydF4y2Baj .细胞杂志。gydF4y2Ba160gydF4y2Ba, 529 - 539(2003)。gydF4y2Ba
Mirdita, M.等人。ColabFold:让所有人都能折叠蛋白质。gydF4y2BaNat方法。gydF4y2Ba19gydF4y2Ba, 679 - 682(2022)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.。gydF4y2BaActa Crystallogr。D杂志。Crystallogr。gydF4y2Ba66gydF4y2Ba, 486 - 501(2010)。gydF4y2Ba
阿凡宁,P. V.等。用于冷冻- em和晶体学的PHENIX实空间精炼。gydF4y2BaActa Crystallogr。教派。D结构。医学杂志。gydF4y2Ba74gydF4y2Ba, 531 - 544(2018)。gydF4y2Ba
Liebschner, D.等。利用x射线、中子和电子测定大分子结构:凤凰的最新进展。gydF4y2BaActa Crystallogr。教派。D结构。医学杂志。gydF4y2Ba75gydF4y2Ba, 861 - 877(2019)。gydF4y2Ba
Pettersen, E. F.等。UCSF ChimeraX:为研究人员、教育工作者和开发人员提供结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70 - 82(2021)。gydF4y2Ba
Ménétret,李文华等。Sec61和TRAP的单拷贝与非翻译的哺乳动物核糖体相关。gydF4y2Ba结构gydF4y2Ba16gydF4y2Ba, 1126 - 1137(2008)。gydF4y2Ba
Ménétret,李文华等。来自天然膜的核糖体-通道复合体的结构。gydF4y2Baj·摩尔,杂志。gydF4y2Ba348gydF4y2Ba, 445 - 457(2005)。gydF4y2Ba
Pfeffer, S.等。哺乳动物内质网蛋白转位子中寡糖转移酶复合体的结构。gydF4y2BaCommun Nat。gydF4y2Ba5gydF4y2Ba3072(2014)。gydF4y2Ba
亨德森,R.等。第一次电子显微镜验证工作小组会议的结果。gydF4y2Ba结构gydF4y2Ba20.gydF4y2Ba, 205 - 214(2012)。gydF4y2Ba
Ashkenazy, H.等。ConSurf 2016:估算和可视化大分子进化守恒的改进方法。gydF4y2Ba核酸Res。gydF4y2Ba44gydF4y2BaW344-W350(2016)。gydF4y2Ba
确认gydF4y2Ba
我们感谢V. O. Paavilainen和K. McPhail提供ApraA, J. Taunton提供CT8, W. Q. Shi提供ipomoeasin F, s - y。Peak-Chew负责质谱分析,J. O 'Donnell和V. Chandrasekaran就结构建模和数字提供建议,H. Wang对手稿进行评论,Hegde实验室成员进行富有成效的讨论。这项工作得到了英国医学研究委员会的支持(批准号:MC_UP_A022_1007至R.S.H.)、MRC国际博士项目(L.S.和A.J.O.L.)、韩国国家研究基金会奖学金(M.K.K.)和美国国立卫生研究院(编号R01 GM130051和R01 GM086487至R.J.K.)。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
L.S.进行了生化和细胞分析,并提供了图。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2汉英gydF4y2Ba,gydF4y2Ba3 a, b, dgydF4y2Ba,gydF4y2Ba4 a、b d-fgydF4y2Ba和扩展数据图。gydF4y2Ba1 fgydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba7gydF4y2Ba而且gydF4y2Ba9gydF4y2Ba.M.K.K.准备了冷冻- em样品,收集和处理了冷冻- em数据,帮助建立模型,并贡献了图中的数据。gydF4y2Ba2 a, bgydF4y2Ba而且gydF4y2Ba4摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba1中gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 a egydF4y2Ba而且gydF4y2Ba8 a - cgydF4y2Ba.A.J.O.L.帮助解释了结构数据,并对图中的观测和分析做出了贡献。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba3 fgydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba8 dgydF4y2Ba.R.J.K.对模型的建立、结构的验证和图中所示的结构数据的解释做出了贡献。gydF4y2Ba2 b, cgydF4y2Ba而且gydF4y2Ba4摄氏度gydF4y2Ba和相关的扩展数据图。R.S.H.和R.J.K.提供了资金和总体概念指导。R.S.H.构思了这个项目,监督了它的实施,指导了l.s.、M.K.K.和A.J.O.L.,并在征求其他所有作者意见的情况下撰写了论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然gydF4y2Ba感谢Osamu Nureki和其他匿名审稿人对这项工作的同行评议做出的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
扩展的数据图和表gydF4y2Ba
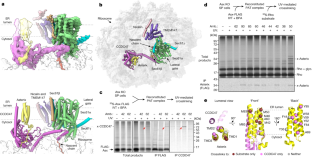
扩展数据图1 RhogydF4y2BaextgydF4y2Ba构造。gydF4y2Ba
一个gydF4y2Ba,gydF4y2Ba35gydF4y2BaS-methionine贴上ρgydF4y2BaextgydF4y2Ba在兔网织红细胞裂解液(RRL)中,在犬胰源粗粒体(RMs)存在下合成了指定长度的核糖体新生链复合体(rnc)。在说明的地方,rnc使用双马来酰亚胺己烷(BMH)进行化学交联。标明了糖基化(+糖基化)和非糖基化(-糖基化)翻译产物的位置。与Asterix的交联(用x-Asx表示)在变性条件下使用抗Asterix抗体(底部面板)进行免疫沉淀验证。Rho的PAT复合招募模式gydF4y2BaextgydF4y2Ba构造类似于前面描述的非扩展Rho构造gydF4y2Ba10gydF4y2Ba.gydF4y2BabgydF4y2Ba,gydF4y2Ba35gydF4y2BaS-methionine贴上ρgydF4y2BaextgydF4y2Ba在含有或不含有糖基化位点的RRL中合成指定长度的RNC。翻译产物用蛋白酶K (PK)消化。插入膜的多肽群体被保护免受PK。gydF4y2BacgydF4y2Ba,翻译产物如b组(车道1和4)生产,之后RMs被沉积分离(车道2和5),并与BMH交联(车道3和6)。与Asterix的交联显示。gydF4y2BadgydF4y2Ba, FLAG或双链标记(TST),包含Rho的膜插入rnagydF4y2BaextgydF4y2Ba对TMD1以外的70个截断氨基酸(aa)进行分馏和亲和纯化。IVT的总产物被离心,以获得膜部分,然后在非变性条件下溶解(可溶性部分)。可溶性部分进行抗flag亲和纯化。用抗flag免疫印迹法(上图)分析纯化等分物(洗脱部分多5倍)。底板显示了CCDC47、Asterix、RPL8、Sec61β和EMC2免疫印迹的两种纯化物的洗脱部分。对ER微粒体的连续稀释进行平行分析。共和党全国委员会的ρgydF4y2BaextgydF4y2Ba可以有效的亲和纯化,回收相关的PAT复合物。请注意,CCDC47和Asterix印迹的左右车道是来自同一种凝胶和相同的曝光,竖线表示车道拼接在一起的点。gydF4y2BaegydF4y2Ba,牛催乳前蛋白(pPL)的膜插入rna在信号序列之外截断了56个残基gydF4y2Ba34gydF4y2Ba和ρgydF4y2BaextgydF4y2Ba在TMD1以外截断的70个残基进行反flag亲和纯化,如图d所示gydF4y2BaextgydF4y2Ba作为特异性对照。在说明的地方,样品在RMs溶解之前与BMH交联。上图为亲和纯化步骤的抗flag免疫印迹图(见图d),下图为CCDC47、Asterix、RPL8和Sec61α各纯化免疫印迹图的洗脱组分。印迹结果表明pPL转译中间体与PAT复合体没有关联,而PAT复合体与Rho有关联gydF4y2BaextgydF4y2Ba在没有交联或有交联的情况下都具有相当的效率,从几乎没有非交联的Asterix来判断,这证明几乎是定量的。这表明PAT复合体与Rho有关联gydF4y2BaextgydF4y2BaRNCs在所采用的纯化条件下是耐盐和耐洗涤剂的。CCDC47末巷的弱带为IgG重链污染。gydF4y2BafgydF4y2Ba上面的图描述了编码全长n端标记TRAM2的结构,其拓扑结构与Rho的拓扑结构相反。下面的面板显示了一个类似于罗的实验gydF4y2BaextgydF4y2Ba图所示。gydF4y2Ba1 bgydF4y2Ba.纯化的样品在RMs系列稀释旁边用免疫印迹法进行分析。相同的翻译水平和rnc的恢复反映在底物印迹和类似水平的Sec61亚基和核糖体上。缺乏mRNA的反应作为与亲和树脂非特异性结合的阴性对照。注意,对于gydF4y2BaextgydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba), PAT复合体向TRAM2转译中间体的募集依赖于新生链的长度。虽然在超过TMD1的70-100 aa处可以检测到少量的募集,但在超过TMD1的110 aa处可以观察到稳定的最大募集起始点。gydF4y2BaggydF4y2Ba,图显示了Rho和TRAM2在PAT复合体初始稳定招募点的底物配置,近似于比例。这对应于Rho在TMD1之外的~70 aa和TRAM2在TMD1之外的~110 aa。长度上的差异可以由TMD1的不同拓扑结构解释。为了简单起见,这里没有显示translocon。gydF4y2Ba
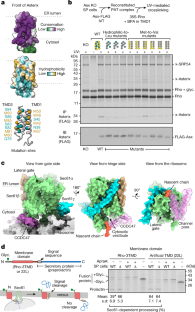
图2 Rho-2TMD图处理方案及分辨率信息。gydF4y2Ba
一个gydF4y2Ba,描述Rho-2TMD RNC样品的分类方案和冷冻- em显微图分析的流程图。被称为“TRAP复合体”的类似乎只包含由Sec61和TRAP复合体组成的核心转位子,其构象明显有些不同,正如先前在低温电子显微镜和低温电子断层扫描工作中所描述的那样gydF4y2Ba26gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba.这些问题没有进一步讨论。注意,模型构建几乎完全依赖于Rho-2TMD参考地图,少数地区使用两个子地图进行验证。复合图如图5所示。gydF4y2Ba2gydF4y2Ba只是为了说明的目的,作为一种同时显示每个地图贡献的最佳区域的方法。FCwSS是信号相减的集中分类。gydF4y2BabgydF4y2Ba, Rho-2TMD参考图的傅里叶壳层相关(FSC)曲线,通过金标准方法显示总体分辨率为3.25 ÅgydF4y2Ba64gydF4y2Ba.gydF4y2BacgydF4y2Ba,两张根据局部分辨率着色的rh - 2tmd参考地图的视图。指出了关键的结构元件。gydF4y2Ba
图3 Rho-2TMD地图和模型的特征。gydF4y2Ba
a、bgydF4y2Ba,从Rho-2TMD参考图的膜平面的两个视图,低通滤波到7 Å分辨率,与模型拟合。给出了膜的近似位置。为了清楚起见,省略了洗涤胶束和核糖体。gydF4y2BacgydF4y2Ba,从与模型拟合的低通滤波Rho-2TMD参考图的ER管腔观察。剪切面在膜内靠近内质腔。为清晰起见,省略了洗涤胶束和核糖体,核糖体隧道出口的位置已标明。gydF4y2BadgydF4y2Ba,洗涤胶束和核糖体中低通过滤参考图谱概述。这张地图在两个等高线上标出。蓝线显示低轮廓水平,管腔密度和完整胶束可见。不透明密度显示在更高的等高线水平,以可视化translocon,颜色如面板a-c。核糖体和胶束呈透明灰色。gydF4y2BaegydF4y2Ba, PAT子分类图(扩展数据图子图2)。gydF4y2Ba2gydF4y2Ba)经核糖体局部分辨率过滤,以说明最接近核糖体(并由核糖体稳定)的区域分辨率特别高。表明了新生链密度的位置和核糖体出口通道的入口。gydF4y2BafgydF4y2BaRho-2TMD模型的空间填充描述说明了CCDC47的c端区域如何进入核糖体出口隧道口,毗邻新生链,并缩小出口隧道尺寸。顶部显示了剪辑前后的概况,虚线框表示下面放大倍数更高的区域。gydF4y2Ba
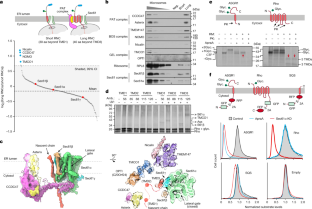
图4 PAT, Sec61, GEL和BOS复合体的AlphaFold2预测。gydF4y2Ba
所有的AlphaFold2预测都是使用ColabFold获得的。对于所有的配合物,预测对齐误差(PAE)矩阵,由预测局部距离差异检验(pLDDT)着色的结构模型和拟合到各自密度的最终模型都显示出来。请注意,PAE矩阵的范围是从0-5 Å,而不是默认的0-30 Å输出,以强调非常高的置信度交互。gydF4y2Ba一个gydF4y2Ba,人类PAT复合物,由CCDC47和Asterix组成。最终模型拟合到来自PAT子分类图(扩展数据图中的子图2)的各自密度中。gydF4y2Ba2gydF4y2Ba)由本地分辨率过滤。gydF4y2BabgydF4y2Ba犬Sec61复合物。最后的模型拟合到各自的密度从Rho-2TMD参考地图通过局部分辨率过滤。gydF4y2BacgydF4y2Ba人BOS复合物,由TMEM147、Nicalin和NOMO组成。最终模型(省略了NOMO,因为它没有在地图中显示出来)拟合到从TMEM147子分类地图(扩展数据图中的子地图1)中获取的各自密度。gydF4y2Ba2gydF4y2Ba)由本地分辨率过滤。尼卡林的密度也显示在一个非常低的阈值透明白色,以可视化管腔域密度。gydF4y2BadgydF4y2Ba,人凝胶复合物,由TMCO1和OPTI (C20orf24)组成。最后的模型拟合到各自的密度从Rho-4TMD地图通过局部分辨率过滤。gydF4y2Ba
图5 SP细胞中PAT复合体重构的特征。gydF4y2Ba
一个gydF4y2Ba,图解了用Asterix变体进行PAT复合体重构的策略,然后分析衬底相互作用。Asterix KO细胞含有内源性CCDC47的残留水平。当阿斯泰里克斯gydF4y2Ba在体外gydF4y2Ba在RRL中翻译,辅以Asterix KO半渗透(SP)细胞,插入并与CCDC47相互作用重建PAT复合体。当底物rna随后被引入时,可以测试它们与PAT复合物的相互作用。gydF4y2BabgydF4y2Ba,gydF4y2Ba35gydF4y2Bas标记的Asterix在Asterix KO SP细胞存在下被翻译。然后用离心分离法分离细胞,用蛋白酶保护法分析Asterix拓扑结构(左),并通过共免疫沉淀(IP;右)。Asterix的胞质n端可被蛋白酶(胰蛋白酶)接触,剩下的受保护片段可通过c端FLAG-tag免疫沉淀回收。右边的面板显示了总数gydF4y2Ba在体外gydF4y2Ba翻译产物(巷1),沉积的SP细胞(巷2),带有CCDC47抗体的原生IP(巷3)或使用对照抗体的原生IP(巷4)。gydF4y2BacgydF4y2Ba在含有Asterix KO SP细胞的RRL(非放射性蛋氨酸)和琥珀抑制试剂中翻译了野生型和琥珀密码子的Asterix变体(在指定的位置),用于光交联氨基酸BPA的位点特异性结合。细胞被分离并孵育gydF4y2Ba35gydF4y2Bas标记Rho rna在TMD1以外的70个残基处截断。然后,在指定的地方使用双马来酰亚胺己烷(BMH)交联样品。底物中唯一的半胱氨酸位于第一个TMD。注意,所有的Asterix变体与底物形成bmh介导的交联,表明底物-Asterix相互作用成功重建。为了进行比较,对含有BPA的样品进行了紫外线照射,说明Asterix和衬底之间的光交联也可以看到(参见图。gydF4y2Ba二维gydF4y2Ba和e).正如预期的那样,光交联的效率低于化学交联。gydF4y2BadgydF4y2Ba, Asterix和CCDC47之间光交联实验的放射自显像。gydF4y2Ba35gydF4y2Bas标记的带有BPA的Asterix变体被重组为Asterix KO SP细胞,如c图所示。细胞被分离,紫外线照射,并直接分析或使用抗ccdc47抗体变性IP后进行分析。gydF4y2BaegydF4y2Ba如图c所示,在指示位置上含有BPA的非放射性asterix变体被重组为asterix KO SP细胞。然后将重组的SP细胞在32°c下孵育10分钟,分离出来gydF4y2Ba35gydF4y2Bas标记Rho rna截断了TMD1以外的70个残基。样品经紫外光照射,SDS-PAGE和放射自显影分析。指出了非糖基化和糖基化Rho的位置,以及与Asterix (x-Asterix)的交联。在这个实验中,只有42号位置显示出强烈的交联。gydF4y2BafgydF4y2Ba图中分析了Asterix突变体的原生CCDC47 IPs。gydF4y2Ba3 bgydF4y2Ba.gydF4y2Ba35gydF4y2Bas标记的Asterix变体在RRL中翻译,并添加Asterix KO SP细胞。SP细胞经离心分离,在原生条件下溶解,用抗ccdc47抗体进行免疫沉淀。分离的SP细胞的等分图(上图)和CCDC47 IP的产物(下图)。值得注意的是,一小部分Asterix明显地以反向插入(“inv. Asterix”)并变成糖基化。该种群不与CCDC47共ip,提供内部特异性控制。突变位置的描述方案如图所示。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
图6 CCDC47闩锁螺旋不利于Sec61开启。gydF4y2Ba
一个gydF4y2BaRho-2TMD模型中的Sec61复合体(左)呈封闭构象,CCDC47的锁存螺旋紧挨着Sec61α的TMD2和TMD3之间的胞质环。开放的Sec61复合体(中间,PDB 3JC2)会与CCDC47发生冲突,因为Sec61的n -半部分需要从核糖体结合的c -半部分旋转,以适应侧门的底物(如该结构中的信号肽)。右图显示了两个结构通过核糖体结合域的排列,说明了Sec61的n -半部分在侧门打开时需要如何旋转。gydF4y2BabgydF4y2Ba, Rho-2TMD数据集中含有(左)或缺乏(右)PAT复合物的粒子重建的实验低温- em密度。在相似的等高线水平上,Sec61的核糖体和c -半区在两个图谱中基本相同,含ccdc47的图谱中n -半区密度明显更好。在低等高线水平,在ccdc47缺失的地图中可以看到n -一半,尽管由于假定位置的异质性,分辨率较低。没有和有PAT配合物的粒子中Sec61密度的差异不能归因于细化的差异。精化过程中的粒子排列主要由核糖体提供的强信号所主导,这在两类之间没有区别。聚焦分类后未进行重排。两个图谱中核糖体和Sec61许多部分的密度非常相似,这一事实提供了事后验证,即精化过程是一致的。转孔胶束复合体相对于核糖体的整体灵活性差异可以被排除,因为只有在门控过程中已知的Sec61移动的部分可以看到实质性的密度差异。相比之下,Sec61位于RBD远端但不受门控影响的部分保持不变。基于这些原因,我们将含有pat和不含pat的映射之间的Sec61密度差异归因于前者被稳定在封闭状态。gydF4y2Ba
扩展数据图7衬底参与的多通易位子分析。gydF4y2Ba
一个gydF4y2Ba在添加HEK293 SP细胞的RRL中合成了在指定长度截断的FLAG-TRAM2 rna(见图)。rna在原生条件下通过n端flag标记进行亲和纯化(如扩展数据图。gydF4y2Ba1 fgydF4y2Ba),并用免疫印迹法对指示蛋白进行分析。阴性对照(neg)是一种没有mRNA的翻译反应。gydF4y2BabgydF4y2BaRNCs of Twin-Strep Tag (TST)-RhogydF4y2BaextgydF4y2Ba(见图)对TMD2、TMD3、TMD5或TMD7下游截断的40个残基进行了PAT复合体关联分析,如图所示。gydF4y2Ba1 bgydF4y2Ba.长度为7+的RNC表示一个比TMD7截断了70个残基的新生链。gydF4y2BacgydF4y2Ba如扩展数据图所示,对TMD下游截断40个残基的FLAG-TRAM2 rnc(见图)进行PAT复合体关联分析。gydF4y2Ba1 fgydF4y2Ba.gydF4y2BadgydF4y2Ba光交联分析gydF4y2Ba35gydF4y2Bas -蛋氨酸标记的Rho-4TMD易位中间体(如图所示)。gydF4y2Ba4 dgydF4y2Ba)通过安装在TMD1 (Amb1)、TMD3 (Amb3)或两者琥珀密码子上的BPA。上面的面板显示了超离心分离后总rna的自动放射照相。其中三个关键样本也使用指定的抗体进行免疫沉淀,并在底部面板进行放射自显影分析。非糖基化和糖基化底物(Rho和Rho+glyc。,respectively) and the adducts to Asterix (x-Asterix), Sec61β (x-S61β) and Sec61α (x-S61α) are indicated.egydF4y2Ba光交联分析gydF4y2Ba35gydF4y2Bas -蛋氨酸标记的Rho-4TMD易位中间体通过BPA安装在TMD2(位置85)。比较三种半透化细胞:野生型(WT)、TMCO1 KO(∆TMCO1)和瞬时转染标记TMCO1的∆TMCO1细胞。与WT SP细胞的主要交联在∆TMCO1 SP细胞中丢失,在∆TMCO1 SP细胞中可以看到与大小相似的未知蛋白的其他弱交联。当∆TMCO1细胞的一个子集现在表达FLAG-TMCO1时,可以看到一个新的交联,其迁移速度略慢于WT细胞中的主要产物。这些结果验证了WT细胞中主要的交联是TMCO1,而在重构后的∆TMCO1细胞中稍大的交联是FLAG-TMCO1。与TMD2中不同位置的BPA交联表明其亲水面与TMCO1相互作用(如图所示)。gydF4y2BafgydF4y2BaWT或∆TMCO1 SP细胞中Rho-4TMD RNC的蛋白酶保护试验。放射自显像显示相同的糖基化表明TMD1插入效率相同,但不同数量的完全保护产物表明3-TMD插入成功。在∆TMCO1细胞中,大量的蛋白质无法插入TMDs 2和3,导致蛋白酶可及性(见图)。在洗涤剂(下标d)存在的情况下,PK消化导致完全消化。图表显示了三个独立实验的量化结果,显示了平均值和标准差。通过双尾Student 's t检验,观察到差异有统计学意义(p = 0.01)。该图的源数据见补充表gydF4y2Ba4gydF4y2Ba.gydF4y2BaggydF4y2BaRNCs of RhogydF4y2BaextgydF4y2Ba将超过TMD1的70个残基组装在WT、∆Asterix、∆CCDC47、∆TMCO1和∆TMEM147 SP细胞中,并在原生条件下通过FLAG-tag进行亲近纯化,如图所示。gydF4y2Ba1 bgydF4y2Ba.用免疫印迹法对指示蛋白的细胞裂解物和纯化rna进行分析。gydF4y2BahgydF4y2Ba双马来酰亚胺正己烷(BMH)介导的交联通过半胱氨酸取代了红紫红质TMD1中的F56,使TMD1下游的70个残基中断(上面板),或者相当于RNC,其中TMD1被22个亮氨酸残基和一个类似位置的半胱氨酸残基取代(下面板)。gydF4y2Ba35gydF4y2Ba将s -甲硫氨酸标记的rnc与WT、∆Asterix、∆TMCO1和∆TMEM147 SP细胞组装,进行BMH交联,并通过SDS-PAGE和放射自成像直接分析,或在变性抗Asterix IP后进行分析。在没有BMH交联的所有样品中,相同的糖基化效率表明TMD1插入不受MPT组分丢失的影响。在∆TMCO1和∆TMEM147 SP细胞中,Asterix交联(标记为x-Asx)未受损伤。在∆Asterix细胞中,Rho的TMD1交联到一个未知的产品,其迁移速度略快于Asterix(向上箭头)。22L TMD没有与Asterix或未知产品交联,这表明这些相互作用需要部分TMD亲水性。gydF4y2Ba
图8 Rho-4TMD地图和模型的特征。gydF4y2Ba
一个gydF4y2Ba,描述Rho-4TMD RNC样品的分类方案和冷冻- em显微图分析的流程图。被称为“TRAP复合体”的类似乎只包含由Sec61和TRAP复合体组成的核心转位子,其构象明显有些不同,正如先前在低温电子显微镜和低温电子断层扫描工作中所描述的那样gydF4y2Ba26gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba.这些问题没有进一步讨论。gydF4y2BabgydF4y2Ba, Rho-4TMD图的傅里叶壳层相关(FSC)曲线,通过金标准方法显示总体分辨率为3.88 ÅgydF4y2Ba64gydF4y2Ba.gydF4y2BacgydF4y2Ba,两张根据局部分辨率着色的rh - 4tmd参考地图的视图。指出了关键的结构元素,包括分配给基板TMD3的密度。gydF4y2BadgydF4y2Ba,空间填充模型显示了多通道转位子高度保守的内表面,面对充满脂质的腔(gydF4y2Ba左gydF4y2Ba)和面对周围膜的保守性差的外表面(gydF4y2Ba正确的gydF4y2Ba).模型按蛋白质、疏水性、电荷和守恒(由ConSurf计算)依次上色(从上到下)gydF4y2Ba65gydF4y2Ba).PAT复合物的保守的两亲性底物结合结构域、GEL复合物的保守的带正电亲水性前庭以及BOS复合物上的保守sec61 -对接位点都被指出。gydF4y2Ba
图9 Sec61抑制剂对各种基质的影响gydF4y2Ba在体外gydF4y2Ba和细胞。gydF4y2Ba
一个gydF4y2Ba,检测其对Sec61抑制剂敏感性的底物示意图。可切割信号序列(棕色),糖基化位点(绿色),和实验确定的蛋白酶可达性位点(淡紫色)。抗蛋白酶消化的β1AR∆CL3的核心也被指出。PrP是朊病毒蛋白;LeP是先导肽酶;ASGR1是唾液糖蛋白受体1;肿瘤坏死因子α是肿瘤坏死因子α。gydF4y2Ba罪犯gydF4y2Ba,gydF4y2Ba35gydF4y2Ba用蛋白酶保护法分析含有RMs和Sec61抑制剂2 μ M的s -蛋氨酸的RRL翻译反应。b组使用Apratoxin A (ApraA,见图。gydF4y2Ba4 egydF4y2Ba), c组使用Ipomeassin F (Ipom-F), d组使用cotransin-8 (CT8)。等量DMSO作为阴性对照。翻译产物要么不处理,要么用蛋白酶K (PK)消化,不使用洗涤剂(下标d)。通过SDS-PAGE和放射自显影或c端FLAG标记的免疫印迹法(在TNFα的情况下,它在蛋白酶保护的片段中缺乏蛋氨酸)对样本进行直接分析。红色箭头表示未被PK消化的片段,表明易位成功。β1AR∆CL3的抗蛋白酶折叠核以蓝色箭头标记。NTF和CTF分别代表n端片段和c端片段。TNFα印迹中的星号标志着FLAG抗体有时能检测到的背景带。gydF4y2BaegydF4y2Ba通过删除61个残基(从T166到D326),对C3AR1(一种GPCR)或一个约180个氨基酸长的第二细胞外环(EL2)的变体进行蛋白酶保护分析。为简单起见,构造中省略了大部分c端胞质结构域。C3AR1(左)和C3AR1∆EL2(右)在2µM ApraA存在或不存在的情况下进行翻译反应,并用蛋白酶保护法进行分析。在使用的蛋白酶浓度下,如果蛋白质正确插入,所有的胞质短环都对消化有抵抗作用,但如果任何插入步骤失败,就可以进入胞质短环(见图表)。成功插入和抗pk产品用向下的红色箭头表示。在ApraA存在的情况下,TMD4插入失败有两个后果:下游环没有糖基化,蛋白质在TMD3下游是蛋白酶可达的。因此,没有观察到双糖基化产物,在PK消化过程中产生了一个受保护的n端片段(NTF,用深蓝色向上箭头标记),代表前三个tmd。注意,根据这些标准,即使没有ApraA,也会出现一些插入失败的情况。C3AR1∆EL2不受ApraA影响,且大部分均正确插入。星号标记的是由PK消化非插入(因此是非糖基化)种群产生的C3AR1∆EL2片段的位置。gydF4y2BafgydF4y2Ba,荧光蛋白(FP)标记的底物对细胞中Sec61抑制剂的敏感性测试图。2A是病毒序列,在该序列上肽键形成失败而不中断延伸。因此,每个翻译周期产生两个产品:一个FP标记的基质和一个不同颜色的FP作为翻译级别的内部控制。对于RFP标记的ASGR1和SQS,在病毒2A序列之前的GFP作为转译控制,而RFP的荧光水平报告在底物上。其他底物是gfp标记的,RFP作为翻译控制。gydF4y2BaggydF4y2Ba,指示的报告者的散点图,每个报告者在稳定细胞系中从一个诱导启动子表达。在报告因子诱导过程中,用200 nM Apratoxin A (ApraA)处理的细胞显示为蓝色,而用载体处理的细胞显示为红色。与这些结构相对应的直方图如图所示。gydF4y2Ba4 fgydF4y2Ba.gydF4y2BahgydF4y2Ba, N端点扩展(NgydF4y2BaextgydF4y2Baβ1AR和AGTR2(见图a)的实验结果与图b相似gydF4y2BaextgydF4y2Ba-AGTR2表达稳定,NgydF4y2BaextgydF4y2Ba-β1-AR通过瞬时转染表达24 h,最后12 h包含ApraA。gydF4y2Ba我gydF4y2Ba,在载物(灰色)、200 nM ipomoeasin F (Ipom-F,浅蓝色)或1 μ M CT8(深蓝色)存在下表达6 h后归一化底物水平的直方图。gydF4y2Ba
补充信息gydF4y2Ba
补充讨论gydF4y2Ba
与论文相关的附加注释。gydF4y2Ba
补充图1gydF4y2Ba
这张纸上未裁剪的凝胶。gydF4y2Ba
补充图2gydF4y2Ba
流式细胞术的门控策略。gydF4y2Ba
补充表1gydF4y2Ba
数据如图4a所示。gydF4y2Ba
补充表2gydF4y2Ba
本研究中使用的结构列表。gydF4y2Ba
补充表3gydF4y2Ba
本研究中使用的抗体列表。gydF4y2Ba
补充表4gydF4y2Ba
数据绘制在扩展数据图7f。gydF4y2Ba
权利和权限gydF4y2Ba
自然或其许可方(例如,社会或其他合作伙伴)根据与作者或其他权利所有人签订的出版协议,对本文享有专有权;作者对本文已接受的手稿版本的自我存档完全受此类出版协议条款和适用法律的约束。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
smalinskait, L., Kim, M.K, Lewis, A.J.O.gydF4y2Baet al。gydF4y2Ba多通膜蛋白膜内伴侣的作用机制。gydF4y2Ba自然gydF4y2Ba(2022)。https://doi.org/10.1038/s41586-022-05336-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05336-2gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba
