摘要gydF4y2Ba
干扰素基因刺激因子(STING)在DNA传感中作为环GMP-AMP合酶的下游功能,或作为细菌环二核苷酸和小分子的直接受体,在感染、癌症和免疫治疗期间激活免疫gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.STING的精确调控对于确保平衡的免疫反应和预防有害的自身炎症至关重要gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.活化后,STING,一种跨膜蛋白,从内质网运输到高尔基体,在那里它被蛋白激酶TBK1磷酸化,从而实现信号转导gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.在高尔基体上终止STING信号的机制仍然未知。在这里,我们发现适配器蛋白复合物1 (AP-1)控制sting依赖的免疫激活的终止。我们发现AP-1将磷酸化的STING分类到网格蛋白包裹的转运囊泡中,并将其递送到内溶酶体系统,在那里STING被降解gydF4y2Ba21gydF4y2Ba.我们在STING的细胞质c端尾(CTT)中发现了一个高度保守的二白氨酸基体,它与tbk1依赖的CTT磷酸化一起决定了STING的AP-1接合。AP-1与磷酸化STING复合物的冷冻电子显微镜结构解释了tbk1激活的STING的增强识别。我们发现AP-1的抑制加剧了sting诱导的免疫反应。我们的研究结果揭示了STING负调控的结构机制,并建立了信号的启动与信号的终止密不可分,以实现短暂的免疫激活。gydF4y2Ba
主要gydF4y2Ba
在内质网(ER)激活和退出后,STING参与两条分叉的细胞效应通路。第一个途径沿着STING向高尔基体的过渡发散,并使自噬成为可能,这是STING的一种原始抗病毒功能;相反,从高尔基体开始的第二种途径促进先天免疫基因的转录激活——一种进化上较新的功能适应gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.这两种途径最终会聚在溶酶体,在那里STING被降解gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.STING下游转录级联的启动由一个多步骤过程控制:它始于TBK1的募集,接着是TBK1对STING的磷酸化,并导致磷酸化的STING参与干扰素调节因子3 (IRF3)gydF4y2Ba17gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.而sting结合的IRF3则被TBK1磷酸化,并与NF-κB等转录因子一起转位到细胞核调控基因表达。通过这种级联分子事件,STING触发了广泛的效应功能,最显著的是I型干扰素(IFNs)、促炎细胞因子和共刺激分子的表达。由于这些有利的免疫刺激特性,STING激动剂正在开发用作免疫治疗剂gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.然而,为了在预防免疫病理的同时优化强大的免疫激活,STING反应需要严格的调控。在这里,我们寻找一种机制来解释sting依赖性免疫信号是如何结束的。gydF4y2Ba
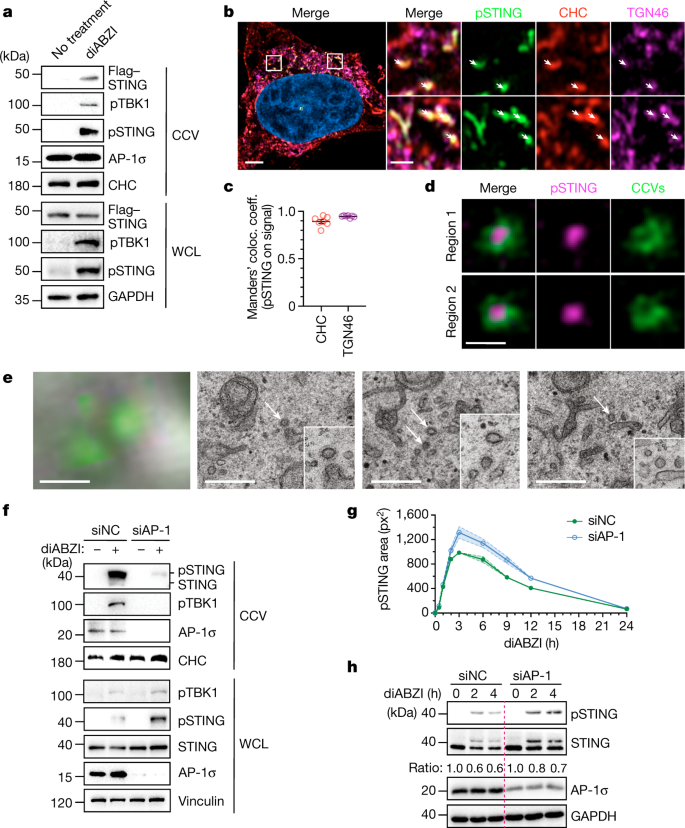
我们追踪激活的STING(在S366位点磷酸化;(参考。gydF4y2Ba17gydF4y2Ba)通过高分辨率共聚焦和airscan显微镜在HeLa细胞中沿细胞内运输路线进行检测。扩展之前的发现gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba在小分子激动剂diABZI- c3(以下简称diABZI)刺激后(参考文献。gydF4y2Ba3 gydF4y2Ba), pSTING迅速(约0.5 h)出现在gydF4y2Ba反式gydF4y2Ba-高尔基网络(TGN),然后转移到LAMP1gydF4y2Ba+gydF4y2Ba消失前的内溶酶体隔室(扩展数据图。gydF4y2Ba1模拟gydF4y2Ba).pSTING转RAB7gydF4y2Ba+gydF4y2Ba晚期核内体,但未与EEA1共定位gydF4y2Ba+gydF4y2Ba,早期核内体的标记物(扩展数据图。gydF4y2Ba1 c, dgydF4y2Ba).TGN和内吞细胞器之间的膜运输可能涉及网格蛋白包裹的运输囊泡(CCVs)。gydF4y2Ba29gydF4y2Ba.值得注意的是,STING和pSTING在从diabzi刺激细胞中获得的CCVs中富集,但在从未刺激细胞中获得的CCVs中没有富集(图2)。gydF4y2Ba1gydF4y2Ba).此外,pSTING在TGN46位点与网格蛋白重链共定位,网格蛋白重链是CCVs的决定性成分gydF4y2Ba+gydF4y2Ba活化细胞中的区室(图;gydF4y2Ba1 b, cgydF4y2Ba和扩展数据图。gydF4y2Ba1 egydF4y2Ba).受激发射耗竭(STED)超分辨率显微镜证实pSTING被并入小的(直径约100nm) CCVs(图。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba2gydF4y2Ba).在相关的光学和电子显微镜(CLEM)实验中,我们观察到,激活后,特征性STING核周病灶定位于包含多个CCVs的区域(图2)。gydF4y2Ba1 egydF4y2Ba和扩展数据图。gydF4y2Ba2 b, cgydF4y2Ba).总之,这些结果表明CCVs可以作为活化STING的运输载体。gydF4y2Ba
一个gydF4y2Ba,表达标记STING的HeLa细胞的全细胞裂解液(WCL)和CCV部分(HeLa .gydF4y2Ba刺痛gydF4y2Ba)进行western blot分析。以网格蛋白重链(CHC)和GAPDH作为装载和加工对照。gydF4y2BabgydF4y2Ba,海拉的airscan成像gydF4y2Ba刺痛gydF4y2Ba被diABZI刺激的细胞。一个有代表性的细胞gydF4y2BangydF4y2Ba= 7单元格。白色箭头表示发生pSTING。比例尺,4µm(左)或1µm(放大面板)。gydF4y2BacgydF4y2Ba中描述的pSTING与CHC共定位的定量gydF4y2BabgydF4y2Ba,使用Manders共域系数。均数±s.e.m。的gydF4y2BangydF4y2Ba= 7单元格。gydF4y2BadgydF4y2Ba,经mCherry-clathrin和Flag-STING转染并经diABZI刺激的细胞的STED图像显示pSTING包裹在CCVs中。区域1和2从大视场STED图像放大(见扩展数据图)。gydF4y2Ba2gydF4y2Ba).比例尺,200nm。gydF4y2BaegydF4y2Ba,海拉的CLEMgydF4y2BaGFP-STINGgydF4y2Ba被diABZI刺激的细胞。图像描述了扩展数据图框3。gydF4y2Ba2 bgydF4y2Ba在空气扫描显微镜(左)或电子显微镜在不同gydF4y2BaZgydF4y2Ba-heights(右边三个面板)。白色箭头表示CCVs。比例尺,0.5微米。gydF4y2BafgydF4y2Ba用非靶向对照(NC)小干扰RNA (small interference RNA, siRNA)或AP-1 siRNA处理HeLa细胞,用diABZI刺激,western blot分析其WCL和CCV片段。CHC作为加载对照。gydF4y2BaggydF4y2Ba, HeLa亮场荧光显微镜图像中pSTING区域的定量gydF4y2Ba刺痛gydF4y2Ba用sirna处理并用diABZI刺激的细胞。均数±s.e.m。的gydF4y2BangydF4y2Ba= 3个独立实验,每个条件99个视野。gydF4y2BahgydF4y2Bawestern blot检测转染siRNAs和diABZI刺激的HeLa细胞。STING与负载控制(GAPDH)的比值归一化到每个条件的0-h时间点。三个例子中的一个代表性例子(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba)或两个(gydF4y2BafgydF4y2Ba)独立实验。gydF4y2Ba
AP-1将STING分类为ccvgydF4y2Ba
CCVs的形成依赖于异四聚体适配蛋白复合物,它将网格蛋白与跨膜负载蛋白物理连接gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.参与TGN到内溶酶体的货物穿梭的最突出的适配器蛋白复合物是AP-1,它由四个亚单位β1, γ,µ1和σ1组成(参考文献)。gydF4y2Ba32gydF4y2Ba).值得注意的是,敲除三个AP-1亚基(gydF4y2BaAP1G1gydF4y2Ba,gydF4y2BaAP1S1gydF4y2Ba而且gydF4y2BaAP1B1gydF4y2Ba)导致CCVs内STING、pSTING和pTBK1水平显著降低,而STING和pSTING的整体细胞水平升高(图。gydF4y2Ba1 f-hgydF4y2Ba和扩展数据图。gydF4y2Ba3gydF4y2Ba).关键是,在ap -1缺失的细胞中,从ER到TGN的STING运输不受影响(扩展数据图)。gydF4y2Ba3 bgydF4y2Ba).我们证实,在小鼠胚胎成纤维细胞(mef)中单独敲除σ1亚基或基因敲除μ 1亚基会影响STING的降解,并且重新引入缺失的亚基可以恢复激活的STING的衰变(参考文献)。gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba扩展数据图gydF4y2Ba3 c, dgydF4y2Ba).这些发现表明AP-1通过控制其加载到CCVs中来控制激活的STING。gydF4y2Ba
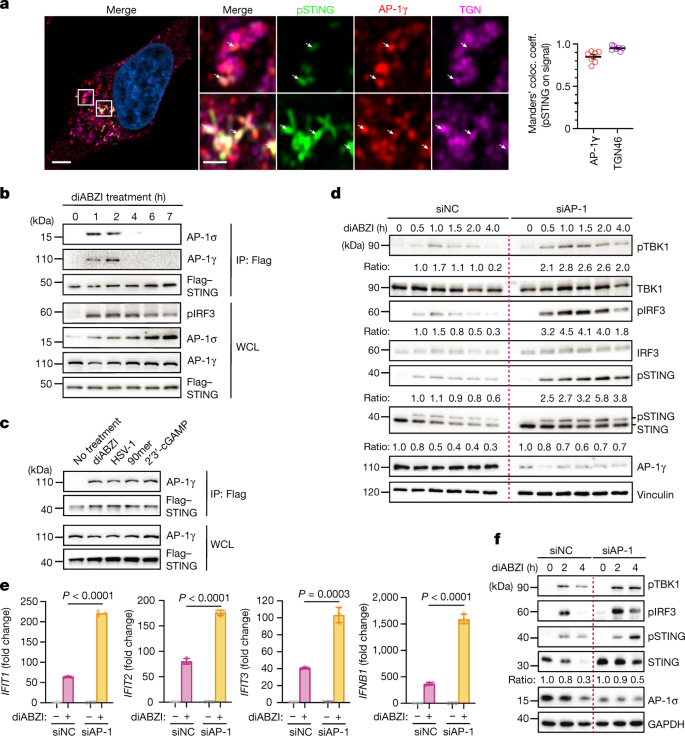
适配蛋白依赖的分选需要多聚体复合物与其目标膜上的货物直接接合gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.因此,pSTING与AP-1在TGN共定位,STING激活后与AP-1的γ和σ1亚基结合(图2)。gydF4y2Ba2 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba).STING与AP-1相关,响应不同的STING细胞激活因子,包括双链DNA (dsDNA),环状GMP-AMP (cGAMP)和生理激活因子单纯疱疹病毒1 (HSV-1),这提供了AP-1识别是STING细胞生物学调控的一个不可或缺的元素(图1)。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,海拉的airscan成像gydF4y2Ba刺痛gydF4y2Ba用diABZI刺激2.5小时的细胞。pSTING与AP-1γ的共定位通过Manders的共定位系数进行量化。一个代表性的细胞所示,定量是平均值±s.e.m。的gydF4y2BangydF4y2Ba= 4个独立实验中的1个的7个细胞。白色箭头表示发生pSTING。比例尺,4µm(左)或1µm(放大面板)。gydF4y2BabgydF4y2Ba,海拉gydF4y2Ba刺痛gydF4y2Ba用diABZI刺激细胞。用抗flag抗体免疫沉淀(IP)后,用western blot分析细胞。gydF4y2BacgydF4y2Ba,海拉gydF4y2Ba刺痛gydF4y2Ba用diABZI刺激细胞2小时,用HSV-1(感染多重数(MOI) = 10)感染细胞6小时,或用90mer dsDNA(1µg)转染细胞3小时,或用1µM 2 ' 3 ' -cGAMP转染细胞6小时。经抗flag抗体免疫沉淀后,采用western blot方法进行分析。gydF4y2BadgydF4y2Ba,转染siRNAs的HeLa细胞用diABZI刺激,western blot分析。以Vinculin作为加载对照。gydF4y2BaegydF4y2Ba,归纳gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba而且gydF4y2BaIFIT3gydF4y2Ba通过反转录定量PCR (RT-qPCR)检测转染siRNAs的HeLa细胞和diABZI处理3 h后的表达。的比率gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba而且gydF4y2BaIFIT3gydF4y2Ba信使rna和gydF4y2BaGAPDHgydF4y2Ba各组mRNA归一化至未处理组。数据为均数±标准差。三个技术复制。gydF4y2BaPgydF4y2Ba值由双尾学生得到gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba,转染siRNAs 3天的WI-38人成纤维细胞用diABZI刺激,western blot分析。采用GAPDH作为加载对照。三个例子中的一个代表性例子(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba)或两个(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)独立实验。目标蛋白与负载对照的比值归一化至每个条件的0-h时间点(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba).gydF4y2Ba
AP-1限制STING信令gydF4y2Ba
接下来,我们确定了AP-1的破坏如何影响sting依赖的免疫信号。AP-1的下调除了pSTING外,还增加了pTBK1和pIRF3的水平,与受刺激的对照细胞相比,延长了信号传递(图2)。gydF4y2Ba二维gydF4y2Ba).阻断溶酶体酸化进一步促进了AP-1缺失细胞中TBK1的激活,这与AP-1作为溶酶体上游信号关闭启动器的模型一致(扩展数据图)。gydF4y2Ba4 bgydF4y2Ba).AP-1缺失的细胞表现出增加的I型IFN反应,这与更有效地抑制HSV-1复制相关(图。gydF4y2Ba2 egydF4y2Ba和扩展数据图。gydF4y2Ba4摄氏度gydF4y2Ba).相比之下,抑制AP-1轻度降低的I型IFN反应由三磷酸RNA引起,rig -I样解旋酶的触发,表明AP-1介导的先天免疫激活的负调控是STING信号的一个特定特征(延伸数据图)。gydF4y2Ba4 egydF4y2Ba).对各种细胞、刺激和读出以及单个亚基敲除的分析表明,ap -1依赖的I型IFN信号的限制是控制STING活性的普遍机制(图2)。gydF4y2Ba2 fgydF4y2Ba和扩展数据图。gydF4y2Ba4外:我gydF4y2Ba而且gydF4y2Ba5模拟gydF4y2Ba).与µ1a重组的mef相比,μ 1a缺陷mef中sting依赖性更强的I型IFN反应也很明显(扩展数据图)。gydF4y2Ba4 j, kgydF4y2Ba).在婴儿期发病的sting相关血管病变(SAVI)中,的功能获得等位基因gydF4y2BaSTING1gydF4y2Ba导致本构I型IFN反应gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.AP-1在SAVI患者成纤维细胞中的耗竭与明显亢进的STING变异gydF4y2Ba12gydF4y2Ba,gydF4y2Ba35gydF4y2Ba导致夸张的I型IFN信号和STING的积累(扩展数据图。gydF4y2Ba5 e-jgydF4y2Ba).总的来说,这些结果确立了AP-1作为在各种生物学相关环境中平衡STING反应的关键和保守的中介,并表明AP-1招募到STING是免疫信号终止的起始事件。gydF4y2Ba
AP-1直接参与STINGgydF4y2Ba
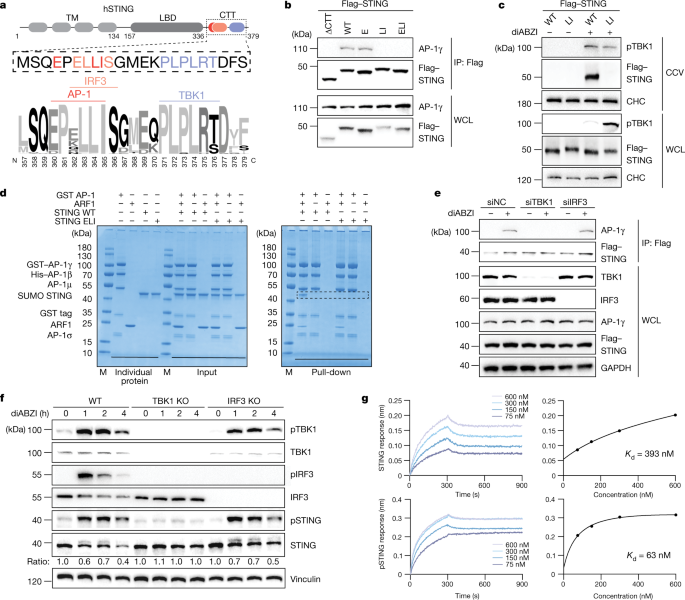
适配蛋白相互作用依赖于跨膜负载蛋白胞浆尾部的线性分选信号的识别gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.对STING细胞质部分的检查显示,位于CTT(氨基酸336-379)的高度保守的酸性二亮氨酸一致基序[D/E]XXXL[L/I](其中X表示任何残基),并与TBK1募集所必需的PLPLRT/SD结合基序并列,并与IRF3的ɸLXIS募集基序部分重叠(其中ɸ表示亲水残基)(参考文献)。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba27gydF4y2Ba)(图。gydF4y2Ba3gydF4y2Ba).值得注意的是,在活化的细胞中,两个疏水残基的突变破坏了STING与AP-1的结合,而单独的酸性残基突变的影响可以忽略。gydF4y2Ba3 bgydF4y2Ba).缺乏整个CTT的STING突变体也没有结合AP-1(图。gydF4y2Ba3 bgydF4y2Ba).正如AP-1对货物装载的要求所预期的那样,LI基序的破坏取消了STING与CCVs的结合,并影响了随后的降解(图2)。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).此外,中和364位的疏水亮氨酸残基(EXXXLI)到丙氨酸,可以放大I型IFN信号,这可以通过更强的IRF3磷酸化和对HSV-1复制更有效的抑制来证明(扩展数据图)。gydF4y2Ba4 dgydF4y2Ba而且gydF4y2Ba6 bgydF4y2Ba).考虑到第365位(EXXXLI)的异亮氨酸基体也是IRF3招募到STING(ɸLXIS)所必需的。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,该位置的突变消除了IRF3的激活(扩展数据图。gydF4y2Ba6摄氏度gydF4y2Ba).通过分析STING的自然变异,我们发现了一个错义突变p.l ll363lf,它位于EXXXLI基序中,已被报道用于人类癌症gydF4y2Ba39gydF4y2Ba.重组实验表明,L364F取代增加了STING与AP-1的结合,加速了STING降解动力学,并强烈削弱了STING信号活性(扩展数据图)。gydF4y2Ba6 d-fgydF4y2Ba).因此,EXXXLI基序内的独特取代影响人类STING的I型IFN激活阈值。gydF4y2Ba
一个gydF4y2Ba,人类STING (hSTING)的CTT示意图及50个物种的CTT序列标识。gydF4y2BabgydF4y2BaHeLa STING-敲除(KO)细胞转染Flag-tagged STINGgydF4y2BaΔCΤΤgydF4y2Ba(Δ1-341),野生型(WT) STING, STINGgydF4y2BaEgydF4y2Ba(E360A),刺痛gydF4y2Ba李gydF4y2Ba(L364A/I365A)或STINGgydF4y2Ba伊莱gydF4y2Ba(E360A/L364A/I365A)用diABZI处理2 h。经抗flag抗体免疫沉淀后,采用western blot方法进行分析。gydF4y2BacgydF4y2Ba从用Flag-tagged野生型STING或STING重组的HeLa STING KO细胞中提取CCV片段gydF4y2Ba李gydF4y2Ba(L364A/I365A)和未用diABZI处理的基因进行western blot分析。CHC作为加载对照。gydF4y2BadgydF4y2Ba,野生型LBD-STING或LBD-STING的谷胱甘肽sepharose下拉分析gydF4y2Ba伊莱gydF4y2Ba通过谷胱甘肽gydF4y2Ba年代gydF4y2Ba-转移酶(GST)标记的AP-1核与或不与ARF1。gydF4y2BaegydF4y2Ba,海拉gydF4y2Ba刺痛gydF4y2Ba用NC siRNA或siRNA转染的细胞gydF4y2BaTBK1gydF4y2Ba或gydF4y2BaIRF3gydF4y2Ba接受或不接受diABZI治疗。经抗flag抗体免疫沉淀后,采用western blot方法进行分析。采用GAPDH作为加载对照。gydF4y2BafgydF4y2Bawestern blot分析diABZI刺激0、1、2、4 h后HeLa野生型细胞、HeLa TBK1 KO细胞和HeLa IRF3 KO细胞。目标蛋白与负载对照的比值归一化到每个条件的0-h时间点。以Vinculin作为加载对照。gydF4y2BaggydF4y2Ba,生物层干涉测量结合研究的LBD-STING(上)或tbk1磷酸化的LBD-STING(下)与AP-1 ΔμCTD。右边的图表显示了STING(上)和pSTING(下)的绑定亲和力。至少三个例子中的一个代表性例子(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)或两个(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)独立实验。gydF4y2Ba
为了直接分析AP-1对STING二亮氨酸基序的识别,我们利用AP-1核心复合物在体外重组了AP-1靶结合gydF4y2Ba40gydF4y2Ba.重组STING包含配体结合域(LBD),包括CTT (LBD-STING),在下拉实验中与arf1 - gtp激活的AP-1相互作用gydF4y2Ba40gydF4y2Ba而STING二亮氨酸基序(LBD-STING)突变gydF4y2Ba伊莱gydF4y2Ba)无法与AP-1结合(图;gydF4y2Ba3 dgydF4y2Ba).野生型LBD-STING,但不是LBD-STINGgydF4y2Ba伊莱gydF4y2Ba,也结合了AP-1核的一个版本,其中µc端结构域被截断;该变体模仿AP-1的开放构象,在没有ARF1变构激活的情况下,易于与二亮氨酸基序相互作用(参考文献)。gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba扩展数据图gydF4y2Ba6克gydF4y2Ba).总之,这些结果揭示了STING和“解锁”激活的AP-1复合物之间的直接相互作用,这是由STING二亮氨酸基序的识别介导的。gydF4y2Ba
STING与AP-1结合的磷酸化调控gydF4y2Ba
由于EXXXLI motif相对于TBK1和IRF3的信号元件的定位(见上文;参考文献。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba),分别在STING、TBK1、IRF3和AP-1之间同时发生相互作用在物理上是不可能的。因此,我们考虑IRF3和TBK1是否会各自干扰AP-1对STING的识别。然而IRF3的缺失对STING与AP-1的结合没有影响,TBK1的缺失却强烈地减少了结合,这表明TBK1不是减弱而是加强了STING与AP-1之间的相互作用(图1)。gydF4y2Ba3 egydF4y2Ba).与这一发现一致的是,STING的截断版本是TBK1招募缺陷(STINGgydF4y2BaLRgydF4y2Ba)gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba无法绑定AP-1(扩展数据图。gydF4y2Ba7一个gydF4y2Ba).此外,TBK1敲除细胞表现出活化STING的降解受损,重建研究和BX795对TBK1的化学抑制揭示TBK1对STING降解的影响取决于完整的激酶活性(图2)。gydF4y2Ba3 fgydF4y2Ba和扩展数据图。gydF4y2Ba7 b, cgydF4y2Ba).因此,我们假设tbk1介导的磷酸化可能决定了STING和AP-1之间的相互作用。定量STING与AP-1的体外结合表明,尽管未修饰的LBD-STING结合在开放的AP-1核心上,TBK1 (pLBD-STING)体外磷酸化STING显著增加了表观亲和力(图1)。gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba7 dgydF4y2Ba).不出所料,LBD-STINGgydF4y2Ba伊莱gydF4y2Ba显示无结合,而模拟磷酸化STING突变gydF4y2Ba18gydF4y2Ba将结合亲和力提高到与体外磷酸化STING相似的水平(扩展数据图)。gydF4y2Ba7 e, fgydF4y2Ba).因此,tbk1依赖性磷酸化对于调节STING和AP-1之间的结合增强至关重要,在细胞环境中,这对于有效的货物识别至关重要。gydF4y2Ba
pSTING-AP-1复合物的结构gydF4y2Ba
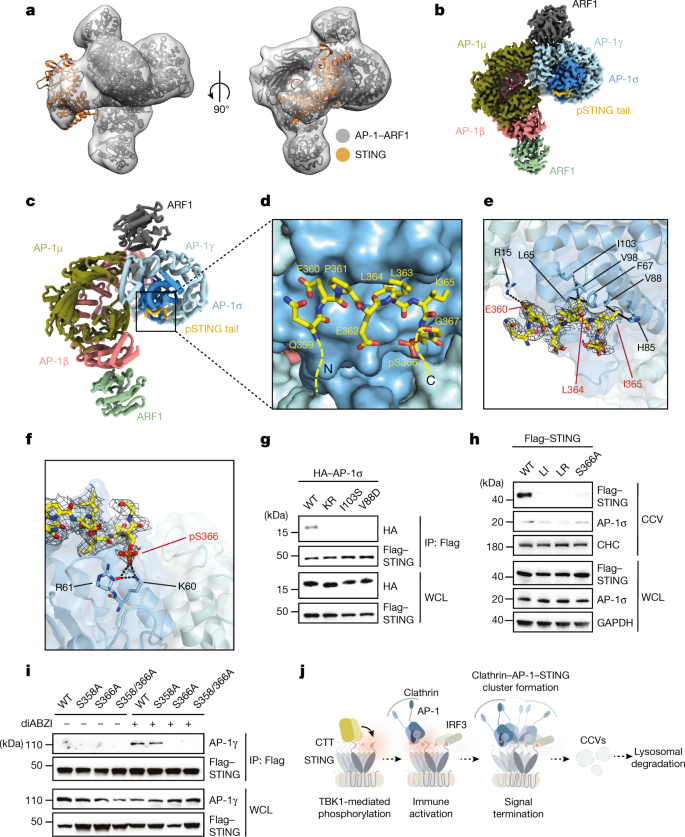
为了确定AP-1增强pSTING识别的机制,我们接下来确定了arf1激活的AP-1核心和tbk1磷酸化的LBD-STING之间复合物的结构(图1)。gydF4y2Ba4gydF4y2Ba,扩展数据图。gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba9gydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).2.3-Å-resolution冷冻电子显微镜(cryo-EM)重建显示STING通过其c端展开环与AP-1进行多次接触(残基359-367)(图。gydF4y2Ba4 b-fgydF4y2Ba).在环的c端部分,EXXXLI排序基序的STING L364和I365通过疏水相互作用与σ亚基的L65、F67、H85、V88和V98相互作用(图2)。gydF4y2Ba4 egydF4y2Ba).在环的n端,E360的羧基通过静电相互作用与γ亚基的R15接触(图3)。gydF4y2Ba4 egydF4y2Ba).这些触点一起将STING锚定在AP-1上,其方式类似于前面描述的适配器蛋白-负载肽复合物gydF4y2Ba41gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.值得注意的是,S366上的磷酸化部分与σ亚基的K60和R61形成的保守碱性斑块形成氢键,该碱性斑块可与二亮氨酸基序界面协同作用,加强pSTING与AP-1的结合(图)。gydF4y2Ba4 fgydF4y2Ba和扩展数据图。gydF4y2Ba10gydF4y2Ba).结合研究证实,K60和R61的替代选择性地降低了AP-1与pSTING的结合,但没有降低原生STING的结合,这与这两种酸性残基在指定pSTING识别中的重要性一致(图6)。gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba10 bgydF4y2Ba).在细胞中,K60/R61突变体的表达或σ亚基残基的取代(这对二白氨酸识别至关重要)消除了STING和AP-1之间的相互作用(参考文献)。gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba)无花果。gydF4y2Ba4 ggydF4y2Ba和扩展数据图。gydF4y2Ba10 cgydF4y2Ba).相反,STING上S366(而不是S358)的突变破坏了STING与AP-1的结合,并减少了STING进入CCVs的排序(图5)。gydF4y2Ba4 h,我gydF4y2Ba).总之,这些结果表明了STING C端独特的磷酸化事件如何赋予AP-1差异识别,并建立了一种可推广的机制,通过磷酸化调节来细化基于AP-1的货物选择。gydF4y2Ba
一个gydF4y2Ba三维(3D)重建的复杂在两个不同的方向。二聚体人LBD-STING (Protein Data Bank (PDB) code: 4KSY)和AP-1复合物(PDB 6DFF)的原子模型通过刚体对接方式拟合到图(灰色)中。gydF4y2BabgydF4y2Ba, AP-1核心和pSTING尾部在2.34-Å分辨率下的高分辨率三维重建,轮廓为3gydF4y2BaσgydF4y2Ba.gydF4y2BacgydF4y2Ba,带状表示AP-1 pSTING复杂结构。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,绑定接口详细视图。gydF4y2BaegydF4y2Ba,虚线表示EXXXLI基序周围潜在的疏水相互作用。pSTING尾部密度图(灰色网格)等高线为3gydF4y2BaσgydF4y2Ba.gydF4y2BafgydF4y2Ba,虚线表示pS366周围可能的氢键。pSTING尾部的密度图(灰色网格)轮廓为3gydF4y2BaσgydF4y2Ba.gydF4y2BaggydF4y2BaHEK293T细胞分别转染tag - STING和ha -tag野生型AP-1σ或AP-1σ突变体σgydF4y2Ba基米-雷克南gydF4y2Ba(K60A/R61A)、σ(I103S)和σ(V88D)用diABZI刺激2 h。提取细胞裂解物,用抗flag抗体免疫沉淀,western blot分析。gydF4y2BahgydF4y2Ba从未处理和diabzi处理的HeLa STING KO细胞的WCL和CCV部分,用flag标记的野生型STING和指示的STING突变体STING重建gydF4y2Ba李gydF4y2Ba、刺gydF4y2BaLRgydF4y2Ba蛋白印迹法分析(L374A/R375A)或STING(S358A)。以CHC和GAPDH为加载对照。gydF4y2Ba我gydF4y2Ba,用Flag-tagged STING重组的HeLa STING KO细胞和STING突变体STING(S358A)、STING(S366A)或STING(S358/366A)用diABZI刺激2小时或不处理。经抗flag抗体免疫沉淀后,采用western blot方法进行分析。gydF4y2BajgydF4y2Ba, AP-1在STING信令终止中的作用示意图。至少三个例子中的一个代表性例子(gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba)独立实验。gydF4y2Ba
讨论gydF4y2Ba
我们的结果与之前的工作一起,为STING的负反馈控制提供了详细的机制gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,支持tgn区室化调节sting依赖性免疫反应的模型(图2)。gydF4y2Ba4 jgydF4y2Ba).首先,STING低聚物结合TBK1,这导致STING cts的强磷酸化,从而创建一个与下游因子相互作用的平台。尽管信号激活是由IRF3募集、磷酸化和核易位的重复循环决定的,但信号失活是由AP-1识别控制的,AP-1识别调节活化的STING进入新生网格蛋白涂层的排序。因此,信号转导在高尔基体上的启动和关闭是生化耦合的,从而提供了一种自我限制STING诱导的免疫激活的分子策略。gydF4y2Ba
我们的结构分析揭示了磷酸化对初级二亮氨酸结合基序的重塑如何使AP-1优先识别STING的激活状态。外套的形成是一个高度合作的过程,它依赖于大量离散的“适应”货物的聚类,以有效地跨桥网格蛋白三叉体并促进囊泡出芽。因此,即使是在分拣界面上相对温和的亲和力增加,如磷酸化所提供的,也能显著影响细胞水平上的货物选择。值得注意的是,先前在HIV-1 M-Nef背景下的工作表明,单个磷酸化事件可以通过AP-1抑制双亮氨酸基序和系瑟蛋白下调(参考文献)。gydF4y2Ba41gydF4y2Ba).这与我们的发现结合在一起,突出了相当程度的适应性,其中磷酸化可以在相反的方向上利用,以细化双亮氨酸结合,并使AP-1能够区分不同的货物状态。gydF4y2Ba
尽管在动物中高度保守,但CTT仅在脊椎动物STING中出现,以实现基于ifn的免疫,这补充了原始的抗病毒效应功能,包括自噬和NF-κB信号通路gydF4y2Ba22gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.以类似的方式,我们在这里描述的ap -1介导的转运过程导致了ifn诱导的STING的消除,补充了自噬介导的STING降解(参考文献)。gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba).在STING CTT中AP-1募集motif的显著保守性(图2)。gydF4y2Ba3gydF4y2Ba)表明,在脊椎动物中,I型IFN信号模块的获得可能与其自身的综合调控系统一起进化。gydF4y2Ba
总之,通过揭示TGN的负反馈机制,我们的工作填补了知识空白,提供了对STING依赖性免疫的更完整的理解,并可能提供了一种概念性策略,以调整STING的免疫原性效应以进行治疗干预。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
HeLa (CCL-2)细胞取自Sigma-Aldrich。HEK293T细胞是D. Trono的礼物,最初从ATCC (SD-3515)购买。从ATCC中获得THP-1细胞和WI-38细胞。HaCaT细胞来源于CLS。原代人肺泡上皮细胞(上皮细胞)从商业供应商(Cell Biologics)获得。μ1 KO细胞和μ1A重组的μ1 KO细胞是P. Schu赠与的。由R. Goldbach-Mansky提供三名SAVI患者的原代成纤维细胞。HeLa, HEK293T, WI-38, HaCaT和原代成纤维细胞培养于Dulbecco的改良Eagle培养基(DMEM, Thermo Fisher Scientific, 41965039)中,添加10% (v/v)热灭活胎牛血清(FBS) (Thermo Fisher Scientific, Gibco SKU, 10270106), 100 IU mlgydF4y2Ba−1gydF4y2Ba青霉素-链霉素(BioConcept, 4-01F00-H), 2 mMgydF4y2BalgydF4y2Ba-谷氨酰胺(Thermo Fisher Scientific, 25030024)和1mm丙酮酸钠(BioConcept, 5-60F00-H)在37°C和大气OgydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba.THP-1细胞培养于RPMI 1640培养基(Thermo Fisher Scientific, 21875091),添加10%胎牛血清,1×青霉素-链霉素-gydF4y2BalgydF4y2Ba-谷氨酰胺(Corning, 30-009-Cl)和1× 2-巯基乙醇(Gibco)在37°C和大气OgydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba.mef在DMEM (Thermo Fisher Scientific, 41965039)中培养,DMEM中添加15% (v/v)热灭活胎牛血清(FBS) (Thermo Fisher Scientific, Gibco SKU, 10270106), 100 IU mlgydF4y2Ba−1gydF4y2Ba青霉素-链霉素(BioConcept, 4-01F00-H)和1mm丙酮酸钠(BioConcept, 5-60F00-H)在37°C和大气OgydF4y2Ba2gydF4y2Ba5% COgydF4y2Ba2gydF4y2Ba.根据供应商的说明,原代人肺泡上皮细胞(上皮细胞)在完全人上皮细胞培养基(cell Biologics, H6621)中培养。用PCR反复检测细胞株支原体。没有使用细胞系验证方法。gydF4y2Ba
质粒gydF4y2Ba
对于CRISPR-Cas9质粒,利用网络工具CRISPOR设计了靶向TBK1、IRF3、环状GMP-AMP合成酶(cGAS)、AP-1σ1和STING的单导RNA (sgRNA)gydF4y2Ba47gydF4y2Ba.以TBK1、IRF3、cGAS和AP-1σ1为靶点的sgRNAs克隆于pSpCas9(BB)-2A-Puro (PX459) V2.0质粒(Addgene, 62988),以STING为靶点的sgRNAs克隆于pSpCas9(BB)-2A-GFP (PX458)质粒(Addgene, 48138)。这两个质粒都是F. Zhang的礼物gydF4y2Ba48gydF4y2Ba.基于pef - bos的STING截断(1-341和1-317)和突变(E360A, LI364/365AA, ELI360/364/365AAA, LR374/375ΑΑ, L364A, L364F和I365A)通过定点突变获得。pef - bos -人类TBK1-Flag-His是S. Cerboni的礼物。TBK1(S172A)由单氨基酸突变产生。pCDNA3-HA γ-adaptin 1(AP1G1) (Addgene, 10712)购自Addgene。将5 ' BamHI和3 ' XhoI位点旁的AP1S1编码序列插入到pCDNA3载体中,生成pCDNA3- ha -AP1S1。通过单氨基酸诱变得到AP1G1(R15E)、AP1S1(I103S)和AP1S1(V88D)。用于质粒构建和sgRNA序列的引物见补充表gydF4y2Ba1gydF4y2Ba.NF-κB-Luc质粒(Promega, E8491)购自Promega公司,pifn - β - gluc质粒之前已报道gydF4y2Ba8gydF4y2Ba.所有结构均经DNA测序证实。gydF4y2Ba
稳定细胞系gydF4y2Ba
HeLa STING KO细胞取自F. MartinongydF4y2Ba49gydF4y2Ba.海拉gydF4y2Ba刺痛gydF4y2Ba细胞和海拉gydF4y2BaGFP-STINGgydF4y2Ba细胞由HeLa STING KO细胞通过感染分别携带Flag-STING或GFP-STING的pTJ慢病毒载体和嘌呤霉素耐药基因生成。用嘌呤霉素(2µg mlgydF4y2Ba−1gydF4y2Ba).采用CRISPR-Cas9技术生成HeLa TBK1 KO细胞、HeLa RIF3 KO细胞和HaCaT σ1 ΚΟ细胞。简单地说,将HeLa细胞以80%的融合度镀于六孔培养板中并转染。每孔3.5µl Lipofectamine 2000 (Life Technologies, 11668019)和1µg质粒dna分别稀释在125µl OptiMEM (Life Technologies, 31985047)中,混合,孵育5分钟,并添加到孔的顶部。第二天,更换培养基,将细胞置于嘌呤霉素(5µg mlgydF4y2Ba−1gydF4y2Ba)选择三天。存活的细胞在无抗生素的培养基中培养,三天后通过荧光激活细胞分选(FACS)分选成单克隆。通过western blotting鉴定生长中的克隆,并选择TBK1缺失的克隆。使用CRISPR-Cas9技术生成HeLa cGAS/STING KO细胞。用pX459-sgcGAS质粒转染HeLa细胞24 h,然后用嘌呤霉素筛选3天。将存活的细胞在无抗生素的培养基中扩增,然后以同样的方式转染pX458-sgSTING质粒3天,并通过FACS进行分类。表达GFP的细胞维持为HeLa cGAS/STING双KO细胞。用western blotting鉴定生长中的克隆,并选择不含cGAS和STING的克隆。gydF4y2Ba
转染gydF4y2Ba
对于质粒转染,按照制造商各自的协议,用质粒和Lipofectamine 2000试剂(Invitrogen, 11668019)(用于所有成像实验)或GeneJuice转染试剂(Millipore, 70967)(用于所有其他实验)转染细胞。对于siRNA敲除,3 × 10gydF4y2Ba4 gydF4y2Ba按照制造商的方案,用Lipofectamine RNAiMAX转染试剂(Invitrogen, 13778075)和40 pmol siRNA转染细胞,然后孵育3天。转染后6 h,将含有转染试剂的培养基更换为新鲜培养基。消声器选择预先设计的siRNAs (4390847), siAP1G1 (s1143), siAP1B1 (s1141), siAP1S1 (s3115)和siAP1S3 (s43490)从赛默飞世尔科技购买;siIRF3和siTBK1由Mircosynth合成。siRNAs的序列在补充表中提供gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
细胞刺激gydF4y2Ba
用2.5 μM diABZI (Selleckchem, S8796)处理细胞,并在指定时间点收集细胞。对于cGAMP, 90mer和IVT4刺激,根据制造商的协议,使用Lipofectamine 2000 (Invitrogen, 11668019)转染0.1 μM cGAMP (Invivogen), 0.2 μg 90mer或0.5 μg IVT4,并培养细胞3小时。90mer的DNA序列见补充表gydF4y2Ba1gydF4y2Ba.在细胞培养基中加入Poly(I:C) (Invivogen),终浓度为10 μg mlgydF4y2Ba−1gydF4y2Ba24小时。感染HSV-1 KOS株(MOI为10)后,感染细胞孵育6 h。BX795 (MedChemExpress)预处理在2µM下进行24 h, baafilomycin A1 (Baf A1;Sigma)在20 nM下进行1 h。5 μg ml处理的MEFsgydF4y2Ba−1gydF4y2Ba或40 μg mlgydF4y2Ba−1gydF4y2Ba刺激后2 h或3 h收集DMXAA (Invivogen)。对于h -151对STING的抑制作用,每24小时向细胞中加入h -151(2µM),持续3天,然后用RT-qPCR检测细胞。gydF4y2Ba
抗体gydF4y2Ba
使用的一抗:小鼠单克隆抗vinculin (hVIN-1) (Sigma-Aldrich, V9264,免疫印迹1:5 000),兔单克隆抗gapdh (14C10)(细胞信号技术,2118,免疫印迹1:3 000),小鼠单克隆抗flag (M2) (Sigma-Aldrich, F1804,免疫印迹1:3 000),兔单克隆抗人磷酸化sting (Ser366) (D7C3S)(细胞信号技术,19781,免疫印迹1:3 000),兔单克隆抗磷酸化tbk1 /NAK (Ser172) (D52C2)(细胞信号技术,5483,免疫印迹1:1 000),兔单克隆抗磷酸化irf3 (Ser386) (EPR2346) (Abcam, ab76493,免疫印迹1:10 00)、兔单克隆抗tbk1 /NAK (D1B4)(细胞信号技术,3504,免疫印迹1:10 00)、兔多克隆抗tmem173 /STING (Proteintech, 19851-1-AP,免疫印迹1:10 00)、兔单克隆抗irf3 (D6I4C)(细胞信号技术,11904,免疫印迹1:10 00)、兔抗格网蛋白重链单克隆(P1663)(细胞信号技术,2410,免疫印迹1:10 00)、小鼠抗格网蛋白重链单克隆抗体(X22)(赛默飞世尔科技,MA1-065,免疫荧光(IF) 1:100)、兔多克隆抗ap1s1(赛默飞世尔科技,PA5-63913,免疫印迹1:10 00)、兔多克隆抗ap1g1(赛默飞世尔科技,PA5-65290,免疫印迹1:10 00)、兔多克隆抗ap1b1 (Sigma-Aldrich, HPA065226,免疫印迹1:10 00)、兔多克隆抗ap1m1 (Proteintech, 12111 -1- ap,免疫印迹1:10 00)、小鼠单克隆抗hsv -1 ICP0 (11060) (Santa Cruz, sc-53090, immunoblot 1:500),小鼠单克隆抗ha。11表位标签(16B12)(生物传说,MMS-101R,免疫印迹1:20 00)。小鼠单克隆γ-适应蛋白(AP1G1) (100/3) (Sigma-Aldrich, A4200, IF 1:100)、小鼠单克隆EEA1 (E9Q6G) (Cell Signaling, 48453, IF 1:100)、小鼠单克隆LAMP1 (H4A3) (Abcam, ab25630, IF 1:100)、兔单克隆抗人磷酸化sting (Ser366) (D8K6H) (Cell Signaling Technology, 40818, IF 1:100, STED 1:50)、小鼠单克隆RAB7 (E9O7E) (Cell Signaling Technology, 95746, IF 1:100)和绵羊多克隆人TGN46 (Bio-Rad, AHP500G, IF 1:200)。hrp偶联二抗:驴抗兔IgG (H+L)-HRP (Jackson ImmunoResearch, 711-036-152,免疫印迹:1:5 000)和驴抗小鼠IgG (H+L)-HRP (Jackson ImmunoResearch, 715-036-151,免疫印迹:1:5 000)。荧光偶联二抗:山羊抗小鼠IgG2a交叉吸附二抗,Alexa Fluor 647偶联(Invitrogen, A-21241, IF 1:80),驴抗绵羊IgG (H+L)交叉吸附二抗,Alexa Fluor 488偶联(Invitrogen, A-11015, IF 1:800),山羊抗兔IgG (H+L)交叉吸附二抗,Alexa Fluor 568偶联(Invitrogen, A-11011, IF 1:800)和山羊抗兔IgG F(ab) ATTO647N (H+L) (Hypermol,2318, IF 1:500)。抗体详情见补充表gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
RT-qPCRgydF4y2Ba
细胞在RLT缓冲液(Qiagen)中裂解。RNA提取遵循制造商的方案(Qiagen RNeasy Plant Mini Kit)。RNA使用RevertAid第一链cDNA合成试剂盒(赛默飞世尔科学公司)进行反转录,并使用ChamQ Universal SYBR qPCR Master Mix (Vazyme)进行RT-qPCR分析,重复3次或4次。qPCR反应在QuantStudio 7 Real-Time PCR系统(赛默飞世尔科学公司)上进行。gydF4y2BaGAPDHgydF4y2Ba被用作正常化的管家基因。引物序列见补充表gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
免疫印迹和免疫沉淀gydF4y2Ba
收集细胞,用1×磷酸盐缓冲盐水(PBS)快速冲洗,并在裂解缓冲液(20 mM Tris pH 7.4, 0.5% Triton X-100, 150 mM NaCl, 1.5 mM MgCl)中裂解gydF4y2Ba2gydF4y2Ba, 2 mM EGTA, 2 mM DTT和1× cOmplete蛋白酶抑制剂鸡尾酒(罗氏)),放在冰上30分钟,在12000 rpm下离心,4°C 10分钟。上清液用4×加载缓冲液(200 mM Tris pH 6.8, 8% SDS, 40%甘油,0.4 M DTT, 0.4%溴酚蓝)煮沸10分钟。使用SurePAGE预处理凝胶(GenScript)通过SDS - page分析蛋白质,并按照制造商的说明使用Trans-Blot Turbo RTA Midi硝化纤维转移试剂盒(Bio-Rad)转移到硝化纤维膜上。用2%牛血清白蛋白(BSA) + 1%牛奶在PBST (PBS + 0.05% Tween-20)中在室温下阻断膜1小时,然后在4℃下与一抗(在PBST中稀释)孵育过夜。在PBST中洗涤后,膜与二抗在室温下孵育1小时。膜用PBST清洗,用western blotting检测试剂(Advansta)显像,并使用ChemiDoc XRS Bio-Rad成像仪和Image Lab软件成像。使用斐济软件(NIH)定量条带强度。为了进行免疫沉淀,将细胞接种到六孔板中,并用指示的质粒进行转染。转染16小时后,细胞在冰上裂解缓冲液中裂解30分钟,在4℃下以12000 rpm离心10分钟。将上清液转移到新管中,与anti-Flag M2磁珠(Sigma-Aldrich, M8823)在旋转器上4°C混合过夜。用裂解缓冲液洗涤3 ~ 6次,用冷的1× PBS洗涤1 ~ 2次后,用1×负载缓冲液煮沸10分钟。 Samples of 20 μl were loaded into gel after a short centrifugation, and this was followed by SDS–PAGE and immunoblotting analysis.
荧光素酶检测gydF4y2Ba
HEK293T细胞被镀到96孔板上,以非靶向对照或sirna靶向组合转染gydF4y2BaAP1G1gydF4y2Ba,gydF4y2BaAP1S1gydF4y2Ba而且gydF4y2BaAP1B1gydF4y2Ba三天。使用GeneJuice转染试剂(Millipore)将IFNβ启动子-报告质粒(pIFNβ-GLuc)与sting表达质粒(pEF-Bos-Flag-STING)结合转染细胞。转染16 h后,用含2.5 μM diABZI的新鲜培养基刺激细胞6 h。以腔肠嗪(PJK GmbH)为底物,测定上清液中的高斯荧光素酶活性。为了测定NF-κB启动子荧光素酶活性,如前所述,先用siRNAs转染细胞,然后用GeneJuice转染NF-κB启动子-报告质粒(NF-κB- luc)。16 h后,用含2.5 μM diABZI的新鲜培养基刺激细胞18 h。使用Bright-Glo荧光素酶测定系统(Promega)测定启动子活性。免疫印迹法检测蛋白表达。为了确定培养中存活细胞的数量,细胞被播种到96孔板中,并按照生产商的说明每24小时用CellTiter- Glo发光细胞活力测定系统(Promega)测量一次。gydF4y2Ba
闭路提取gydF4y2Ba
CCV提取是根据先前描述的协议进行的gydF4y2Ba50gydF4y2Ba.简而言之,细胞从一个融合500厘米gydF4y2Ba2gydF4y2Ba用2.5 μM diABZI处理2 h后,用PBS冲洗2次。将细胞刮入5 ml缓冲液A (0.1 M MES, pH 6.5, 0.2 mM EGTA, 0.5 mM MgCl)中gydF4y2Ba2gydF4y2Ba),用5ml的注射器,带22g针头,上下移液25次以上均质。细胞裂解液在4100℃离心gydF4y2BaggydF4y2Ba, 4°C 32分钟。将上清液移至新管中,用50 μg ml处理gydF4y2Ba−1gydF4y2Ba在冰上放置核糖核酸酶A 30分钟,然后在50,000 rpm下离心,4°C,使用70型钛转子(Beckman Coulter) 30分钟。将微球重悬于300 μl缓冲液A中,与等量缓冲液B (12.5% (w/v) Ficoll,缓冲液A中12.5% (w/v)蔗糖)混合后,在20000 rpm下,4℃离心25 min。上清转入新管,用4体积缓冲液A稀释,4°C, 40000 rpm离心30 min,得到ccv富集部分。gydF4y2Ba
共聚焦显微镜样品制备gydF4y2Ba
海拉gydF4y2Ba刺痛gydF4y2Ba细胞在CellCarrier-96 Ultra microplate (PerkinElmer, 6055302)中以每孔10,000个细胞的密度被镀,并放置至少5小时以粘附。然后通过添加1µM的diABZI (MedChemExpress, HY-103665)刺激细胞,持续指定的时间。在时间过程实验中,细胞以连续的方式被刺激,并同时固定。在刺激结束时,用PBS冲洗井一次,然后在CBS缓冲液中加入4%的多聚甲醛(10 mM MES pH 6.9, 138 mM KCl, 2 mM MgCl)固定细胞gydF4y2Ba2gydF4y2Ba和2 mM EGTA)在室温下5-10分钟。然后在PBS中清洗细胞三次至少5分钟,然后在室温下用添加0.1% (v/v)皂素和5% (v/v)热灭活FBS的PBS封闭1-2小时,然后在4℃下用染色液稀释一抗过夜(添加0.1% (v/v)皂素的PBS和1% (w/v)牛血清白蛋白(Sigma-Aldrich, A7906))。抗体及浓度见补充表gydF4y2Ba2gydF4y2Ba.PBS清洗细胞3次5 min,在染色液稀释的二抗中室温孵育1.5 h。从那时起,盘子就被遮光了。细胞在PBS中洗涤两次以上(每次5分钟),并在Hoechst 33342 (Sigma-Aldrich, B2261) 0.2µg ml中孵育30-60分钟gydF4y2Ba−1gydF4y2Ba在PBS。然后将细胞放回每孔100 μ l PBS中,直接成像或保存在4°C直到成像。AP-1的KD实验,HeLagydF4y2Ba刺痛gydF4y2Ba细胞被镀(6孔板中每孔60000个细胞),并放置6-16小时。然后根据制造商的说明,使用Lipofectamine RNAiMax试剂(赛默飞世尔科学公司)对它们进行sirna转染。消声器选择预先设计的sirna从赛默飞世尔科技公司购买:阴性对照(4390847),或siAP1G1 (s1143), siAP1B1 (s1141)和siAP1S1 (s3115);详见补充表gydF4y2Ba1gydF4y2Ba.每孔使用2µl 10µM的siRNAs (siAP-1井的三个siRNAs平均分配),再加上7µl脂质体RNAiMax试剂,共400µl OptiMEM。6 ~ 16 h后更换培养基。siRNA处理3天后,将细胞复制到显微镜板中(每孔10,000个细胞),对未siRNA处理的细胞继续上述实验。gydF4y2Ba
共聚焦显微镜成像和分析gydF4y2Ba
固定并染色96孔板,然后在两台显微镜上成像:一台共聚焦Leica SP8倒置显微镜,配有HC PL APO 63×/1.40/油(放大/N.A./浸没)物镜和HyD探测器,用Leica LAS X软件操作;还有一台PerkinElmer Operetta CLS,使用PerkinElmer Harmony软件,配备Andor Zyla 5.5相机和LD C Apochromat放大率/N.A.物镜/浸水63×/1.4/水。结合PerkinElmer Harmony (v.4.9)和Fiji (v.2.3.0)进行图像分析和定量,并用KNIME (v.4.3.2)和GraphPad PRISM 9 (v.9.3.1)对数据进行进一步处理。图像面板使用OMERO进行组装(v.5.11.0)gydF4y2Ba51gydF4y2Ba.更详细地说,所有描绘的细胞图像都是用Leica SP8共聚焦显微镜(63×)获得的,除了证实pSTING在用siRNA对抗AP-1处理后(与siNC相比)仍在TGN积聚的图像,这些图像是在Operetta上捕获的(63×)。根据Operetta (63×)图像,在Harmony软件中计算pSTING总面积或AP1G1强度的定量。gydF4y2Ba
Airyscan显微镜gydF4y2Ba
海拉gydF4y2Ba刺痛gydF4y2Ba细胞在µ-Slide八孔载玻片(ibidi, 80826-IBI)中以每孔10,000个细胞的密度被镀,并放置过夜。然后通过添加1µM的diABZI (MedChemExpress, HY-103665)刺激细胞0、150或360分钟(图2)。gydF4y2Ba1 bgydF4y2Ba为150分钟时间点和扩展数据图。gydF4y2Ba1 egydF4y2Ba0和360分钟)或仅0和150分钟(图。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba1 c, dgydF4y2Ba).在时间过程实验中,细胞以连续的方式被刺激,并同时固定。在刺激结束时,用PBS冲洗井一次,然后在CBS缓冲液中加入4%的多聚甲醛(10 mM MES pH 6.9, 138 mM KCl, 2 mM MgCl)固定细胞gydF4y2Ba2gydF4y2Ba, 2 mM EGTA)室温5-10分钟。然后在PBS中清洗细胞三次至少5分钟,然后在室温下用添加0.1% (v/v)皂素和5% (v/v)热灭活FBS的PBS封闭1-2小时,然后在4℃下用染色液稀释一抗过夜(添加0.1% (v/v)皂素的PBS和1% (w/v)牛血清白蛋白(Sigma-Aldrich, A7906))。抗体及浓度见补充表gydF4y2Ba2gydF4y2Ba.PBS清洗细胞3次5 min,在染色液稀释的二抗中室温孵育1.5 h。从那时起,盘子就被遮光了。细胞在PBS中洗涤两次以上(每次5分钟),并在Hoechst 33342 (Sigma-Aldrich, B2261,图示为蓝色)0.2µg ml中孵育30-60分钟gydF4y2Ba−1gydF4y2Ba在PBS。然后将细胞放回每孔200µl PBS中,直接成像或保存在4°C直到成像。使用蔡iss LSM 980倒置显微镜(多用共聚焦32通道AiryScan, tPMT,宽视场和亮度视场能力),使用计划- apochromat 63×/1.40/油(放大/N.A./浸没)物镜和AiryScan模式进行成像,图像在ZEN软件中使用嵌入式AiryScan处理(3d模式和“正常”分辨率)进行处理。使用Fiji (v.2.3.0)进行图像分析和定量。使用BIOP JACoP插件对斐济进行了共定位分析,并对所有通道使用Otsu阈值。使用KNIME (v.4.3.2)对数据进行进一步处理,将它们组合起来,并去除pSTING阈值低于500的单元格(考虑为背景),然后使用GraphPad PRISM 9 (v.9.3.1)绘制结果。图像面板使用OMERO (v.5.11.0)进行组装。gydF4y2Ba51gydF4y2Ba).gydF4y2Ba
CLEMgydF4y2Ba
海拉gydF4y2BaGFP-STINGgydF4y2Ba细胞被镀在玻璃底培养皿(MatTek, P35G-1.5-14-CGRD)中,每个培养皿的细胞密度为100,000个,并放置过夜。通过添加1µM的diABZI (MedChemExpress, HY-103665)刺激2.5小时。然后用1%戊二醛和2%多聚甲醛的缓冲溶液在0.1 M磷酸盐缓冲液中进行化学固定,pH值为7.4。然后用光学显微镜对培养皿进行筛选,以识别感兴趣的细胞,用透射和荧光显微镜(如上所述的AiryScan模式)对其成像,以记录它们在网格上的位置。然后用碳酸钙缓冲液(0.1 M, pH 7.4)彻底清洗细胞,并在1.0%四氧化锇和1.5%亚铁氰化钾中固定40分钟,然后单独在1.0%四氧化锇中固定40分钟。最后在1%的乙酸铀酰水中染色40分钟,然后通过增加酒精浓度脱水,然后嵌入Durcupan ACM树脂(Fluka)。然后用1毫米的树脂填充盘子,在65°C的烤箱中硬化18小时。然后根据感兴趣的细胞在字母-数字网格上的位置进行识别,从剩余的材料中切割出来并粘在空白树脂块上。用金刚石刀(Diatome)和超微切片仪(Leica Microsystems, UC7)将超薄(50nm厚)连续切片贯穿整个细胞,并用pioloform支撑膜收集到单个槽网格上。这些切片进一步与柠檬酸铅和醋酸铀酰进行对比,并使用透射电子显微镜(FEI公司,Tecnai Spirit)和数码相机(FEI公司,Eagle)拍摄的图像。 To correlate the light microscopy images with the electron microscopy images and identify the exact position of the Centrin-1:GFP foci, fluorescent images were overlaid onto the electron micrographs of the same cell using Photoshop (Adobe).
发生的gydF4y2Ba
HeLa cGAS/STING双KO细胞被镀在3.5厘米玻璃底培养皿(FluoroDish, WFD35-100)中,密度为每皿100,000个细胞,并放置过夜。通过添加1µM的diABZI (MedChemExpress, HY-103665)刺激2.5小时。然后根据制造商的说明,使用Lipofectamine 2000试剂(Invitrogen, 11668019)转染含有flaghsting和mCherry-clathrin的质粒(均为pEF-Bos哺乳动物表达质粒)。每个质粒1微克,250µl OptiMEM (Life Technologies, 31985047)中的脂质体4.5µl用于一个培养皿。转染6小时后用新鲜培养基替换培养基。第二天,通过添加1µM的diABZI (MedChemExpress, HY-103665)刺激细胞2.5小时。然后将其固定,并按照airscan显微镜样品的描述进行pSTING染色。STED图像采集使用徕卡SP8 STED 3X(徕卡微系统),配备脉冲白光激光器(WLL)作为激发源,775纳米脉冲激光器作为耗尽光源,用于mCherry和ATTO647N。样品用100×物镜(徕卡,HC APO CS2 100×/1.40/oil),使用LAS X软件(徕卡Microsystems)成像。对于各自通道的激发,mCherry设置为587 nm, ATTO647N设置为647 nm。 Hybrid spectral detectors were used to acquire the images with a final pixel size of 9.2 × 9.2 nm. The detector time gates were set to 1.5–7.5 ns for mCherry and 0.5–6 ns for ATTO647N. Images were acquired as single planes of 1,392 × 1,392 pixels, 600 lines per second, 32× line averaging for mCherry and 16× line averaging for ATTO647N. Deconvolution of STED images was done with Huygens Remote Manager v.3.7, using Good’s roughness maximum likelihood estimation with 60 iterations and a signal-to-noise ratio equal to 2 until it reached a quality threshold of 0.03.
蛋白表达及纯化gydF4y2Ba
pHis2载体his - tevsite - hs ARF1 (17-181)-Q71L在BL21 (DE3)细菌中表达(Sigma-Aldrich, CMC0014)。单个菌落接种于100ml LB和氨苄西林(100µg ml)培养瓶中gydF4y2Ba−1gydF4y2Ba),并在37°C下摇晃(200 rpm, informs - ht Multitron)过夜作为预培养。第二天,将100 ml预培养物倒入含有2 l LB和氨苄西林(100µg ml)的5 l Erlenmeyer烧瓶中,开始大规模表达蛋白gydF4y2Ba−1gydF4y2Ba).细胞生长至600 nm处的光密度为0.7。加入β-异丙基诱导表达gydF4y2BadgydF4y2Ba-1-硫半乳糖吡喃苷(IPTG),最终浓度为0.5 mM,同时将培养物转移到18°C的摇床中过夜。然后通过离心收集细菌,在HisTrap缓冲液A (20 mM HEPES, 500 mM NaCl, 20 M咪唑,1 mM DTT和5%甘油,pH 7.5)中溶解,补充4-(2-氨基乙基)-苯并磺酰氟盐酸盐(AEBSF)和cOmplete蛋白酶抑制剂(Roche),超声裂解,20000离心清除gydF4y2BaggydF4y2Ba然后在快速蛋白液相色谱(FPLC)系统上通过5ml镍固定化金属亲和层析柱(Cytiva, HisTrap HP, 17524802)。用B缓冲液(20 mM HEPES, 500 mM NaCl, 500 mM咪唑,1 mM DTT和5%甘油,pH 7.5)洗脱目标蛋白。然后通过Superdex 75 Hiload 16/600色谱柱(Cytiva 28-9893-33)进行尺寸排除层析纯化ARF1。将人LBD-STING cDNA(139-379)克隆到n端带有His6-SUMO标记的pET-28载体中。LBD-STING表达于gydF4y2Ba大肠杆菌gydF4y2BaBL21 (DE3)与0.4 mM IPTG诱导过夜在16°C。在ph8.0、350 mM NaCl、20 mM咪唑和0.5 mM苯基甲烷磺酰氟(PMSF)条件下,用超声波裂解细胞颗粒,并在50 mM Tris中Ni-NTA柱上纯化。蛋白用含50 mM Tris的缓冲液在pH 8.0、350 mM NaCl和300 mM咪唑下洗脱,然后在PBS中加载到Superdex 75 HiLoad 16/600色谱柱(Cytiva 28-9893-33)上。将样品组分混合,通过摩尔吸收测量来定量蛋白质。所有突变体均采用基于pcr的技术和适当的引物生成,并通过DNA测序确认。突变STING蛋白的表达和纯化方法与野生型STING相同。将his标记的AP-1β 1-584、gst标记的AP-1γ 1-595、AP-1μ 1-423和AP-1σ 1-154克隆到pST44载体中,称为AP-1核。将his标记的AP-1β 1-584、gst标记的AP-1γ 1-595、AP-1μ 1-142和AP-1σ 1-154克隆到pST44载体上,命名为AP-1 ΔμCTD。pST44载体中的AP-1核心复合物在BL21 (DE3)中表达(Sigma-Aldrich, CMC0014)。单个菌落接种于含有氨苄西林(100µg ml)的400 ml LB培养瓶中gydF4y2Ba−1gydF4y2Ba),并在37°C下摇晃(200 rpm, informs - ht Multitron)过夜作为预培养。将100 ml预培养物倒入2 l Auto Induction Media Terrific Broth (Formedium, AIMTB0210)中,加入氨苄西林(100µg ml),于次日开始大规模表达复合物(共8 l: 2 l在4个5升Erlenmeyer烧瓶中)gydF4y2Ba−1gydF4y2Ba).将烧瓶在37°C下摇晃培养6小时,然后在18°C下培养过夜。然后通过离心收集细胞(4000gydF4y2BaggydF4y2Ba, 15分钟)。将2 l表达培养的细胞球转移到Falcon 50ml试管中。将2-l表达细胞在pH为7.5的PBS中加入1mm DTT、1mm EDTA和2%甘油,加入AEBSF和cOmplete蛋白酶抑制剂,然后超声裂解。细胞裂解液经离心澄清,然后经0.45-µm过滤。上清首先在FPLC系统(Cytiva Aktä Pure)上用谷胱甘肽sepharose 4B 5ml色谱柱(Cytiva 28401748)纯化。TEV在分子量为3500的切断透析管中,在pH为7.5、含5%甘油的PBS中,在4°C下裂解过夜后,样品通过Superose 6 HiLoad 16/600尺寸排除层析柱(Cytiva 29323952),在pH为7.5、含2%甘油的PBS中平衡,去除TEV蛋白酶和游离GST。当用于GST下拉时,跳过TEV解理,直接将GST- ap -1洗脱液池加载到排除尺寸色谱柱上。AP-1 ΔμCTD的表达纯化方法与AP-1核心相同。gydF4y2Ba
TBK1体外磷酸化SUMO-STING 139-379gydF4y2Ba
重组SUMO-STING原液蛋白在含有20 mM Tris, 25 mM MgCl的测定缓冲液中稀释gydF4y2Ba2gydF4y2Ba, 2mm EDTA, 4mm EGTA和1mm DTT在pH值7.5,补充磷酸酶抑制剂鸡尾酒和蛋白酶抑制剂。在样品中加入10 mM ATP前后控制pH值。TBK1 (MRC PPU试剂,DU12469)以1:20 (w/w)的比例加入。反应在4℃下进行过夜。样品装载在Superdex 200 Increase 10/300 GL排除尺寸色谱柱(Cytiva, 28990944)上,从其他试剂中纯化磷酸化的SUMO-STING。采用液相色谱-电喷雾电离质谱(LC/ESI-MS)检测磷酸化水平。gydF4y2Ba
GST下拉试验gydF4y2Ba
AP-1 - ARF1下拉时,将30 μg gst标记AP-1复合物、10 μg ARF1和10 μg LBD-STING混合或单独加入40 μl下拉缓冲液(PBS中添加2 mM MgCl)中gydF4y2Ba2gydF4y2Ba, 1毫米GTP和2毫米TCEP)。混合物在冰上冷藏一夜。将30微升谷胱甘肽sepharose珠(Cytiva)与混合物在4°C下孵育30分钟。每次用200 μl的下拉缓冲液清洗多余的蛋白质,共4次。在树脂中加入20微升的5× SDS加载缓冲液,将混合物煮沸5分钟。然后对样品进行简单离心。用SDS-PAGE分析5微升上清液。考马斯蓝染色可见蛋白条带。将30 μg GST-tagged AP-1 ΔμCTD复合物和10 μg LBD-STING混合或单独加入添加2 mM TCEP的40 μl PBS中,得到AP-1 ΔμCTD下拉。混合物在冰上冷藏一夜。 Thirty microlitres of glutathione sepharose beads (Cytiva) was incubated with the mixture for 30 min at 4 °C. Excess proteins were washed off the beads using 200 μl PBS each time for four times. Twenty microlitres of 5× SDS loading buffer was added to the resin and the mixture was boiled for 5 min. The samples were then centrifuged briefly. Five microlitres of supernatant was analysed by SDS–PAGE. The protein bands were visualized by Coomassie blue staining.
Bio-layer干涉法gydF4y2Ba
生物层干涉测量法分析在25°C下使用带有链霉亲和素探针的GatorPrime生物传感器系统(GatorBio)进行。将STING、STING突变体或pSTING与生物素(es - link - nhs - lc - lc - biotin, Thermo Fisher Scientific)以3个生物素分子对1个STING的摩尔比混合,在室温下孵育30分钟,然后使用脱盐柱(PD 10, Cytiva)去除多余的生物素。生物素化STING (10 μg mlgydF4y2Ba−1gydF4y2Ba)固定在链霉亲和素生物传感器(GatorBio, 18-5019)上1分钟。尖端用PBS缓冲液清洗2分钟以获得基线读数,然后将生物传感器浸入含有不同浓度AP-1 ΔμCTD或其突变体的孔中5分钟,随后进行10分钟缓冲清洗,使分子从传感器上解离。使用GraphPad PRISM 9进行数据分析,采用标准1:1绑定模型。每个样品分别进行两次独立实验。gydF4y2Ba
低温电子显微镜数据采集gydF4y2Ba
将2毫克gst标记裂解的AP-1核心复合物与2毫克ARF1在添加2毫米MgCl的PBS中室温孵育30分钟gydF4y2Ba2gydF4y2Ba, 1毫米GTP和2毫米TCEP。然后加入两毫克的pSTING,将混合物在冰上孵育一夜。在PBS中用Superose 6增加10/300 GL柱(Cytiva)去除多余的ARF1和pSTING。收集AP-1-ARF1-pSTING复合物部分,浓缩至0.8 mg mlgydF4y2Ba−1gydF4y2Ba.等分3 μl AP-1-ARF1-pSTING配合物加载到发光放电孔碳网格上(Electron Microscopy Sciences, Q250AR1.3, Quantifoil, Au, R 1.2/1.3, 300目)。网格被吸干4秒,用Vitrobot在4°C和100%湿度的液态乙烷中冷冻。在TFS Glacios显微镜(200 kV)上对网格进行颗粒存在和冰质量筛选,并将最佳网格转移到TFS Titan Krios G4上。使用TFS Titan Krios G4透射电子显微镜(TEM)收集Cryo-EM数据,并在Falcon IV探测器上以电子计数模式配备Cold-FEG。猎鹰4号增益参考是在数据收集之前收集的。使用TFS EPU v.2.12.1采用无像差图像移位协议(AFIS)收集数据,每个冰洞记录8张显微照片。在270,000×的放大倍率下记录电影,对应于样本水平的0.45 Å像素大小,离焦值为−0.8 ~−1.8 μm。曝光被自动调整到60 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba总剂量,导致每部电影大约3秒的曝光时间。总共收集了30004张EER格式的显微照片。gydF4y2Ba
低温电子显微镜数据处理gydF4y2Ba
在未装箱的情况下,使用cryoSPARC实现运动校正,对原始堆栈进行运动校正。总共有1,701,051个基于模板的粒子被自动挑选出来,粒子以4的倍数被分类。进行了两轮二维(2D)分类,得到539,684个粒子集。二维粒子分类结果表明,STING和AP-1的相对取向变化较大。从二维分类中选择的粒子用于从头计算重建。经过两轮从头算重建,根据STING密度筛选出326,772个粒子。粒子被重新集中,并以2的分箱因子重新提取。在cryoSPARC中对颗粒进行迭代CTF细化和非均匀细化至2.34 Å。所报道的分辨率是基于金标准傅里叶壳相关0.143准则。使用cryoSPARC估计局部分辨率的变化。gydF4y2Ba
模型构建和细化gydF4y2Ba
AP-1-ARF1-pSTING模型使用已发表的AP-1-ARF1-tetherin Nef结构(PDB 6DFF)生成。去除tetherin Nef配体后的AP-1-ARF1模型被停靠到Chimera的cryo-EM图中,并通过Coot手动调整进行微调。pSTING的尾巴被停靠在Coot的冷冻- em地图上,整个模型在PHENIX中被细化。AP-1、ARF1和pSTING的几个循环区域被手动调整以适应使用Coot的地图。该模型在PHENIX中再次在真实空间中进行了细化。所有结构图均使用UCSF Chimera, UCSF ChimeraX和PyMOL制作。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
补充图中提供了所有western blot和凝胶荧光图像的全扫描。gydF4y2Ba1gydF4y2Ba.三维低温em密度图存入电子显微镜数据库,登录号为EMD-14312。坐标保存在PDB中,编号为7R4H。本文提供了原始数据。gydF4y2Ba
参考文献gydF4y2Ba
Ishikawa, H. & Barber, g.n. STING是一种内质网适配器,促进先天免疫信号。gydF4y2Ba自然gydF4y2Ba455gydF4y2Ba, 674-678(2008)。gydF4y2Ba
伯黛特,D. L.等。STING是一种直接的环二磷酸腺苷(cyclic di-GMP)天然免疫传感器。gydF4y2Ba自然gydF4y2Ba478gydF4y2Ba, 515-518(2011)。gydF4y2Ba
Ramanjulu, J. M.等人。具有全身活性的氨基苯并咪唑STING受体激动剂的设计。gydF4y2Ba自然gydF4y2Ba564gydF4y2Ba, 439-443(2018)。gydF4y2Ba
Corrales, L.等人。STING在肿瘤微环境中的直接激活可导致强有力的全身肿瘤消退和免疫。gydF4y2Ba细胞的代表。gydF4y2Ba11gydF4y2Ba, 1018-1030(2015)。gydF4y2Ba
潘,b.s.等。一种具有抗肿瘤活性的口服非核苷酸STING激动剂。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, eaba6098(2020)。gydF4y2Ba
Chin, E. N.等。系统性sting激活非核苷酸cGAMP模拟物的抗肿瘤活性。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, 993-999(2020)。gydF4y2Ba
吴,J.等。环GMP-AMP是胞质DNA介导的先天性免疫信号通路中的内源性第二信使。gydF4y2Ba科学gydF4y2Ba339gydF4y2Ba, 826-830(2013)。gydF4y2Ba
Ablasser, a . et al. cGAS产生一个2'-5'-链接的环二核苷酸第二信使,激活STING。gydF4y2Ba自然gydF4y2Ba498gydF4y2Ba, 380-384(2013)。gydF4y2Ba
高,P.等。Cyclic [G(2',5')pA(3',5')p]是由dna激活的环状GMP-AMP合成酶产生的后生动物第二信使。gydF4y2Ba细胞gydF4y2Ba153gydF4y2Ba, 1094-1107(2013)。gydF4y2Ba
Diner, E. J.等。先天免疫DNA传感器cGAS产生一种激活人STING的非典型环二核苷酸。gydF4y2Ba细胞的代表。gydF4y2Ba3 gydF4y2Ba, 1355-1361(2013)。gydF4y2Ba
Decout, A, Katz, J. D, Venkatraman, S. & Ablasser, A. cGAS-STING通路作为炎症性疾病的治疗靶点。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba21gydF4y2Ba, 548-569(2021)。gydF4y2Ba
刘,Y.等。血管和肺综合征的激活STING。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba371gydF4y2Ba, 507-518(2014)。gydF4y2Ba
Jeremiah, N.等人。遗传sting激活突变是狼疮样表现的家族性炎症综合征的基础。gydF4y2Baj .中国。投资。gydF4y2Ba124gydF4y2Ba, 5516-5520(2014)。gydF4y2Ba
斯坦纳,A.等。coatomer complex I缺乏导致STING信号异常激活。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba, 2321(2022)。gydF4y2Ba
麦考利,m.e.等。髓系细胞中的C9orf72抑制sting诱导的炎症。gydF4y2Ba自然gydF4y2Ba585gydF4y2Ba, 96-101(2020)。gydF4y2Ba
楚,T.-T。et al。STING信号的滋补启动-增强介导尼曼-匹克病C型。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 570-575(2021)。gydF4y2Ba
刘,S.等。先天性免疫适配器蛋白MAVS, STING和TRIF的磷酸化诱导IRF3激活。gydF4y2Ba科学gydF4y2Ba347gydF4y2Ba, aaa2630(2015)。gydF4y2Ba
赵,B.等。STING保守的PLPLRT/SD基序介导TBK1的招募和激活。gydF4y2Ba自然gydF4y2Ba569gydF4y2Ba, 718-722(2019)。gydF4y2Ba
张,C.等。STING与TBK1结合并被TBK1磷酸化的结构基础gydF4y2Ba自然gydF4y2Ba567gydF4y2Ba, 394-398(2019)。gydF4y2Ba
Mukai, K.等人。STING的激活需要高尔基体的棕榈酰化。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 11932(2016)。gydF4y2Ba
Gonugunta, V. K.等。运输介导的STING降解需要对酸化的内溶酶体进行分选,可以靶向增强抗肿瘤反应。gydF4y2Ba细胞的代表。gydF4y2Ba21gydF4y2Ba, 3234-3242(2017)。gydF4y2Ba
马戈利斯,s.r.,威尔逊,s.c.和万斯,r.e. cGAS-STING信号的进化起源。gydF4y2BaImmunol趋势。gydF4y2Ba38gydF4y2Ba, 733-743(2017)。gydF4y2Ba
Gui, X.等。通过STING转运的自噬诱导是cGAS通路的原始功能。gydF4y2Ba自然gydF4y2Ba567gydF4y2Ba, 262-266(2019)。gydF4y2Ba
Konno, H., Konno, K. & Barber, g.n.环状二核苷酸触发STING的ULK1 (ATG1)磷酸化以防止持续的先天免疫信号。gydF4y2Ba细胞gydF4y2Ba155gydF4y2Ba, 688-698(2013)。gydF4y2Ba
Prabakaran, T.等。cGAS-STING信号的减弱是由TBK1激活的p62/ sqstm1‐依赖自噬途径介导的。gydF4y2BaEMBO J。gydF4y2Ba37gydF4y2Ba, e97858(2018)。gydF4y2Ba
Balka, K. R.等。TBK1和IKKε在髓系细胞中冗余介导sting诱导的NF-κB反应。gydF4y2Ba细胞的代表。gydF4y2Ba31gydF4y2Ba, 107492(2020)。gydF4y2Ba
赵,B.等。IRF-3由先天免疫适配器蛋白协调招募和激活的结构基础。gydF4y2Ba国家科学院学报美国gydF4y2Ba113gydF4y2Ba, e3403-e3412(2016)。gydF4y2Ba
Corrales, L., McWhirter, S. M., Dubensky, T. W. Jr & Gajewski, T. F.肿瘤和免疫界面的宿主STING通路。gydF4y2Baj .中国。投资。gydF4y2Ba126gydF4y2Ba, 2404-2411(2016)。gydF4y2Ba
Kirchhausen, T., Owen, D. & Harrison, S. C.网格蛋白介导的膜运输的分子结构、功能和动力学。gydF4y2Ba冷泉港。教谕。医学杂志。gydF4y2Ba6克ydF4y2Ba, a016725(2014)。gydF4y2Ba
欧文,D. J.柯林斯,B. M. &埃文斯,p.r.网格蛋白涂层的适配器:结构和功能。gydF4y2Ba为基础。细胞发育生物学。gydF4y2Ba20.gydF4y2Ba, 153-191(2004)。gydF4y2Ba
崔波,李志强,李志强。网格蛋白介导的胞吞作用中的货物识别。gydF4y2Ba冷泉港。教谕。医学杂志。gydF4y2Ba5gydF4y2Ba, a016790(2013)。gydF4y2Ba
Heldwein, E. E.等。网格蛋白接合蛋白1核心的晶体结构。gydF4y2Ba国家科学院学报美国gydF4y2Ba101gydF4y2Ba, 14108-14113(2004)。gydF4y2Ba
齐齐奥利,D.等人。γ-适应蛋白缺乏小鼠胚胎早期死亡。gydF4y2Ba生物。化学。gydF4y2Ba274gydF4y2Ba, 5385-5390(1999)。gydF4y2Ba
Meyer, C.等μ 1a适应蛋白缺失小鼠:致命性,AP-1结合缺失和甘露糖6-磷酸受体重定向。gydF4y2BaEMBO J。gydF4y2Ba19gydF4y2Ba, 2193-2203(2000)。gydF4y2Ba
林,B.等。病例报告:STING1中新型sav引起的变异扩大了临床疾病谱,并提出了STING激活的改进模型。gydF4y2Ba前面。Immunol。gydF4y2Ba12gydF4y2Ba, 636225(2021)。gydF4y2Ba
Ohno, H.等人。基于酪氨酸的分选信号与网格蛋白相关蛋白的相互作用。gydF4y2Ba科学gydF4y2Ba269gydF4y2Ba, 1872-1875(1995)。gydF4y2Ba
Doray, B., Lee, I., knisisl, J., Bu, G. & Kornfeld, S.网格蛋白适配器AP-1和AP-2的γ/σ1和α/σ2半复合体含有二亮氨酸识别位点。gydF4y2Ba摩尔。杂志。细胞gydF4y2Ba18gydF4y2Ba, 1887-1896(2007)。gydF4y2Ba
Chaudhuri, R., Lindwasser, O. W., Smith, W. J., Hurley, J. H. & Bonifacino, J. S.人类免疫缺陷病毒1型Nef对CD4的下调依赖于网格蛋白,涉及Nef与AP2网格蛋白接头的直接相互作用。gydF4y2Baj .性研究。gydF4y2Ba81gydF4y2Ba, 3877-3890(2007)。gydF4y2Ba
Konno, H.等。通过表观遗传沉默和错义突变抑制STING信号通路阻碍DNA损伤介导的细胞因子产生。gydF4y2Ba致癌基因gydF4y2Ba37gydF4y2Ba, 2037-2051(2018)。gydF4y2Ba
任X, Farías, G. G., Canagarajah, B. J., Bonifacino, J. S. & Hurley, J. H. Arf1招募和激活AP-1网格蛋白适配器复合物的结构基础。gydF4y2Ba细胞gydF4y2Ba152gydF4y2Ba, 755-767(2013)。gydF4y2Ba
莫里斯,K. L.等。HIV-1 Nefs是货物敏感AP-1三聚体开关在栓氨酸下调。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 659-671(2018)。gydF4y2Ba
贾,x,等。通过劫持网格蛋白接合蛋白复合物,HIV-1 vpu介导的BST2拮抗的结构基础gydF4y2BaeLifegydF4y2Ba3 gydF4y2Ba, e02362(2014)。gydF4y2Ba
凯利,B. T.等。AP2复合物结合内吞双亮氨酸基序的结构解释。gydF4y2Ba自然gydF4y2Ba456gydF4y2Ba, 976-979(2008)。gydF4y2Ba
马特雷,R. Boehm, M. Chaudhuri, R. Prabhu, Y. & Bonifacino, J.通过适配器蛋白(AP)复合物变体保护和多样化的二亮氨酸信号识别。gydF4y2Ba生物。化学。gydF4y2Ba286gydF4y2Ba, 2022-2030(2011)。gydF4y2Ba
Kranzusch, P. J., Lee, a . S, Berger, J. M. & Doudna, J. a .人类cGAS的结构揭示了先天免疫中第二信使酶的保守家族。gydF4y2Ba细胞的代表。gydF4y2Ba3 gydF4y2Ba, 1362-1368(2013)。gydF4y2Ba
马戈利斯,s.r.等。环状二核苷酸2'3'-cGAMP在海葵中诱导广泛的抗菌和抗病毒反应gydF4y2BaNematostella vectensisgydF4y2Ba.gydF4y2Ba国家科学院学报美国gydF4y2Ba118gydF4y2Ba, e2109022118(2021)。gydF4y2Ba
Concordet, j。& Haeussler, M. CRISPOR: CRISPR/Cas9基因组编辑实验和筛选的直观指南选择。gydF4y2Ba核酸测定。gydF4y2Ba46gydF4y2Ba, w242-w245(2018)。gydF4y2Ba
Ran, F. A.等。利用CRISPR-Cas9系统进行基因组工程。gydF4y2BaProtoc Nat。gydF4y2Ba8gydF4y2Ba, 2281-2308(2013)。gydF4y2Ba
Di Micco, A.等人。AIM2炎性小体被核膜完整性的药理学破坏所激活。gydF4y2Ba国家科学院学报美国gydF4y2Ba113gydF4y2Ba, e4671-4680(2016)。gydF4y2Ba
赫斯特等人。“knocksideways”系统显示AP-1和GGAs的不同和重叠作用。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba22gydF4y2Ba, 1711-1716(2012)。gydF4y2Ba
艾伦,C.等。OMERO:实验生物学的灵活、模型驱动的数据管理。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 245-253(2012)。gydF4y2Ba
确认gydF4y2Ba
我们感谢约旦提供的技术援助;aa实验室的成员进行讨论;P. Schu,大学医学中心Göttingen (GER),分享µ1a缺陷mef及其补充对应物;R. Goldbach-Mansky,美国国立卫生研究院(NIH)国家过敏和传染病研究所(NIAID),提供SAVI患者的成纤维细胞;EPFL生物成像和光学核心设施,特别是N. Chiaruttini, R. Guiet, T. Laroche和C. Stoffel,为成像和数据处理提供支持;EPFL生物电子显微镜核心设备,特别是G. Knott, S. Rosset和J. Blanc,用于执行电子显微镜和CLEM实验的校准。Cryo-EM数据采集是在洛桑Dubochet成像中心进行的,我们非常感谢A. Myasnikov, B. Beckert, S. Nazarov和E. Uchikawa。这项工作由瑞士国家科学基金会(310030_188759)、约瑟夫·施泰纳博士癌症研究基金会、欧盟地平线2020研究与创新计划资助协议(批准号为no。804933, ImAgine), Leenaards基金会,Acteria基金会和美国国立卫生研究院授予jh.h.p.x.和C.L. R01 AI 120691,由EMBO博士后奖学金(ALTF 184-2021和ALTF 88-2022)支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
实验由Y.L.、P.X.、S.R.、C.L.和J.R.设计、进行和分析,细胞实验由Y.L.和S.R.进行,共聚焦和airscan显微镜研究由Y.L.和S.R.进行,Cryo-EM结构实验和分析由P.X.进行,STED图像采集和分析由C.L.进行,生化实验由P.X.和J.R. X.R.和J.H.H.进行,共享材料,用于接头蛋白复合物的体外重建,并为生化研究提供建议。A.A.构思、监督这部作品并撰写手稿。所有作者都对手稿的编辑做出了贡献,并支持其结论。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
A.A.是IFM Due的科学联合创始人。J.H.H.是Casma Therapeutics的联合创始人和股东,并接受Casma Therapeutics、Genentech和Hoffman-La Roche的研究资助。其余作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢s øren Paludan、Sandra Schmid和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1细胞内pSTING转运。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,共焦成像(gydF4y2Ba一个gydF4y2Ba)或在亮场荧光显微镜图像中定量pSTING区域(gydF4y2BabgydF4y2Ba)海拉gydF4y2Ba刺痛gydF4y2Ba1 μ M diABZI刺激细胞0、0.5、1、2、3、6、9、12或24 h。细胞固定,TGN46染色(gydF4y2Ba反式gydF4y2Ba-高尔基体),pSTING和LAMP1(内溶酶体隔室)以及Hoechst染料(细胞核,深蓝色)。均数±s.e.m.gydF4y2BangydF4y2Ba= 3个独立实验,每个条件至少84个视野。比例尺,4微米。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba、airscan成像(gydF4y2BacgydF4y2Ba)海拉gydF4y2Ba刺痛gydF4y2Ba1µM diABZI刺激细胞2.5 h。细胞固定,TGN46染色(gydF4y2Ba反式gydF4y2Ba-高尔基体,此处未显示),pSTING和指示标记以及赫斯特染料(细胞核,深蓝色)。pSTING与指示标记的共定位通过Manders的共定位系数(gydF4y2BadgydF4y2Ba).一个代表性的细胞所示,和量化的平均数±s.e.m.gydF4y2BangydF4y2Ba= 4个独立实验中的1个检查了8个细胞。比例尺,4µm在较大的左侧面板,1µm在放大面板。gydF4y2BaegydF4y2Ba,海拉的airscan成像gydF4y2Ba刺痛gydF4y2Ba细胞被刺激20,150(见图。gydF4y2Ba1 bgydF4y2Ba)或360分钟,1µM diABZI。细胞固定,TGN46染色(gydF4y2Ba反式gydF4y2Ba-高尔基体),pSTING和CHC(网格蛋白)以及Hoechst染料(细胞核,深蓝色)。至少显示一个代表性的单元格gydF4y2BangydF4y2Ba=来自3个独立实验的6个细胞。白色箭头表示发生pSTING。比例尺,4µm在较大的左侧面板,1µm在放大面板。gydF4y2Ba
图2 CCVs中STING的超分辨率成像。gydF4y2Ba
一个gydF4y2Ba,显示pSTING和CCVs共定位的大视场STED图像。用mCherry-clathrin和Flag-STING转染HeLa cGAS/STING双KO细胞。1天后,用1 μ M diABZI刺激2.5 h,然后固定并染色进行pSTING。在方框中突出显示的两个代表性事件被放大(见图。gydF4y2Ba1 dgydF4y2Ba).比例尺,2 μm。图像描述了gydF4y2BangydF4y2Ba=在2个独立实验过程中,62个细胞中有1个成像,其中25个细胞显示明显的共定位,3个细胞显示网格蛋白环结构。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba1µM diABZI刺激2.5 h后,GFP-hSTING稳定重建HeLa STING KO细胞的CLEM (gydF4y2BabgydF4y2Ba)或未经处理(gydF4y2BacgydF4y2Ba).对于受刺激细胞(gydF4y2BabgydF4y2Ba),部分GFP-STING强度高的区域(黄框)在相应的z高度用电子显微镜(EM)以更高分辨率重新成像。放大和高分辨率的电子显微镜切片从盒子3显示在图中。gydF4y2Ba1 egydF4y2Ba.LM -光学显微镜(Airyscan)。白色箭头表示CCVs。比例尺(gydF4y2BabgydF4y2Ba), 2µm(未放大的顶部图像)和0.5µm(放大框图像)。比例尺(gydF4y2BacgydF4y2Ba), 1µm。gydF4y2BangydF4y2Ba= 3个受刺激细胞中的1个(gydF4y2BabgydF4y2Ba),gydF4y2BangydF4y2Ba=每2个非刺激细胞中有1个从一个样本中成像,每个条件为CLEM准备。gydF4y2Ba
扩展数据图3 AP-1激活后与STING相关。gydF4y2Ba
一个gydF4y2BaWestern blot显示转染NC siRNA或AP-1 siRNA后HeLa细胞AP-1亚基水平。采用GAPDH作为加载对照。gydF4y2BabgydF4y2Ba,亮场荧光显微镜图像及相应的HeLa AP-1γ信号强度定量gydF4y2Ba刺痛gydF4y2Ba用NC siRNA或AP-1 siRNA处理细胞3天,然后用1µM diABZI刺激0、0.5、1、2、3、6、9、12或24小时。细胞固定,TGN46染色(gydF4y2Ba反式gydF4y2Ba-高尔基体),pSTING和AP-1γ以及Hoechst染料(细胞核,深蓝色)。这里显示的图像来自2小时的时间点。均数±s.e.m.gydF4y2BangydF4y2Ba= 3个独立实验,每个条件有99个视野。比例尺,4微米。gydF4y2BacgydF4y2Ba用NC siRNA或靶向AP-1σ1和AP-1 σ3的siRNA孵育HeLa cGAS KO细胞3天,用空载体或ha标记的AP-1σ1重组细胞,用2.5µM diABZI处理0、2、4 h后进行western blot分析。以Vinculin作为加载对照。gydF4y2BadgydF4y2Ba0.5 μg/mL DMXAA处理AP-1 μ1 KO MEFs和μ1 KO + μ1A MEFs 2 h, western blot分析。以Vinculin作为加载对照。三家公司代表一名(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)或至少两个(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)独立实验。目标蛋白与加载对照的比值归一化到每个条件下未处理的样品(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba
图4 AP-1耗竭促进sting依赖性免疫激活。gydF4y2Ba
一个gydF4y2BaHEK293T细胞转染FLAG-tagged STINGgydF4y2BaWTgydF4y2Ba用2.5µM diABZI处理或不处理2 h,用抗flag抗体免疫沉淀(IP), western blot分析。gydF4y2BabgydF4y2Ba,转染NC siRNA或AP-1 siRNA 3天的HeLa细胞用20nM Baf A1和2.5µM diABZI处理2小时,western blot分析。采用GAPDH作为加载对照。gydF4y2BacgydF4y2Ba用NC siRNA或AP-1 siRNA孵育3 d的HeLa细胞感染HSV-1 (MOI = 5) 14 h, western blot分析。采用GAPDH作为加载对照。gydF4y2BadgydF4y2Ba, HeLa cGAS/STING双KO细胞转染标记STINGgydF4y2BaWTgydF4y2Ba、刺gydF4y2BaL364AgydF4y2Ba用2.5µM diABZI处理2 h,感染HSV-1 (MOI=5) 14 h, western blot分析。采用GAPDH作为加载对照。gydF4y2BaegydF4y2Ba的mRNA水平gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba而且gydF4y2BaIFIT3gydF4y2BaRT-qPCR检测NC siRNA和AP-1 siRNA转染HeLa细胞3 d后,0.5 μg/mL IVT4处理HeLa细胞。gydF4y2BafgydF4y2Ba用NC siRNA或AP-1 siRNA孵育HEK293T细胞3天,随后进行STING瞬时表达和diABZI(2.5µM)刺激。gydF4y2BaggydF4y2Ba,归纳gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba,gydF4y2BaIFIT3gydF4y2Ba用RT-qPCR检测NC siRNA和AP-1 siRNA转染HeLa细胞3 d后,再用1 μg 90mer转染HeLa细胞。gydF4y2BahgydF4y2Ba,归纳gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba,gydF4y2BaIFIT3gydF4y2Ba采用RT-qPCR检测转染NC siRNA或AP-1 siRNA 3 d的HeLa细胞的表达情况,再转染1 μM 2 ' 3 ' -cGAMP。gydF4y2Ba我gydF4y2Ba,采用RT-qPCR检测转染非靶向对照(NC) siRNA或AP-1σ、AP-1β和AP-1γ siRNA 3天的HeLa细胞IFIT1表达的诱导,然后用1µM diABZI处理3 h。gydF4y2BajgydF4y2Ba,通过RT-qPCR检测DMSO或2µM H-151处理3天的MEFs细胞中小鼠ifi44 mRNA水平。gydF4y2BakgydF4y2Ba,小鼠的mRNA水平gydF4y2BaCxcl10gydF4y2Ba,gydF4y2BaIsg15gydF4y2Ba,gydF4y2Baifi44gydF4y2Ba,gydF4y2Baifnb1gydF4y2Ba用RT-qPCR法检测40µg/mL DMXAA处理3 h后MEFs细胞的活性。三家公司代表一名(gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba)或至少两个(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)独立实验。在RT-qPCR实验中gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba,gydF4y2BaIFIT3gydF4y2Ba信使rna和gydF4y2BaGAPDHgydF4y2Ba各组mRNA归一化至未处理组。三的平均值±标准差(gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba)技术复制。gydF4y2BaPgydF4y2Ba基于双尾学生的值gydF4y2Bat -gydF4y2Ba测试(gydF4y2BaegydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba,gydF4y2BakgydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001 (gydF4y2BakgydF4y2Ba).目标蛋白与负载对照的比值归一化至每个条件的0时间点(gydF4y2BabgydF4y2Ba).gydF4y2Ba
图5 AP-1耗竭促进不同细胞类型的sting依赖性免疫激活。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba、HaCaT细胞(gydF4y2Ba一个gydF4y2Ba)或THP-1细胞(gydF4y2BabgydF4y2Ba)转染NC siRNA或AP-1 siRNA 3天,用2.5µM diABZI处理指定时间,western blot分析。采用GAPDH作为加载对照。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, NC siRNA或AP-1 siRNA孵育3天的人原代上皮细胞用2.5µM diABZI处理,RT-qPCR分析(gydF4y2BacgydF4y2Ba)及western blot (gydF4y2BadgydF4y2Ba).以Vinculin作为加载对照。gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba,成纤维细胞来源于SAVI患者gydF4y2BaSTING1gydF4y2BaN154S突变(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba), h72n (gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba)或V147M (gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba)与NC siRNA或AP-1 siRNA孵育3 d, western blot分析。以Vinculin作为加载对照gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba.gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2Ba我gydF4y2Ba,归纳gydF4y2BaIFNB1gydF4y2Ba,gydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaIFIT2gydF4y2Ba,gydF4y2BaIFIT3gydF4y2Ba通过RT-qPCR检测转染NC siRNA或AP-1 siRNA 3天的HeLa细胞的表达,然后用1µM diABZI刺激。三的平均值±标准差(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2Ba我gydF4y2Ba)技术复制。gydF4y2BaPgydF4y2Ba基于双尾学生的值gydF4y2Bat -gydF4y2Ba测试(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2Ba我gydF4y2Ba).gydF4y2Ba
AP-1通过二亮氨酸基序与STING结合。gydF4y2Ba
一个gydF4y2Ba, HeLa cGAS/STING双KO细胞转染标记STINGgydF4y2BaWTgydF4y2Ba、刺gydF4y2Ba1 - 317gydF4y2Ba或刺痛gydF4y2Ba李(L364A / I365A)gydF4y2Ba用2.5µM diABZI处理或不处理14 h, western blot分析。以Vinculin作为加载对照。gydF4y2BabgydF4y2Ba, HeLa cGAS/STING双KO细胞转染标记STINGgydF4y2BaWTgydF4y2Ba或刺痛gydF4y2BaL364AgydF4y2Ba用2.5µM diABZI处理或不处理14 h, western blot分析。以Vinculin作为加载对照。gydF4y2BacgydF4y2Ba, HeLa cGAS/STING双KO细胞转染标记STINGgydF4y2BaL363AgydF4y2Ba、刺gydF4y2BaL364AgydF4y2Ba或刺痛gydF4y2BaI365AgydF4y2Ba用2.5µM diABZI处理或不处理14 h, western blot分析。采用GAPDH作为加载对照。gydF4y2BadgydF4y2BaHEK293T细胞转染FLAG-tagged STINGgydF4y2BaWTgydF4y2Ba、刺gydF4y2BaL374AgydF4y2Ba或刺痛gydF4y2BaL374FgydF4y2Ba用2.5µM diABZI处理2 h,抗flag抗体免疫沉淀,western blot分析。gydF4y2BaegydF4y2Ba, HeLa cGAS/STING双KO细胞转染标记STINGgydF4y2BaWTgydF4y2Ba或刺痛gydF4y2BaL364FgydF4y2Ba用2.5µM diABZI处理或不处理14 h, western blot分析。采用GAPDH作为加载对照。gydF4y2BafgydF4y2Ba在转染表达STING的质粒的HEK293T细胞中进行IFN-β荧光素酶检测,并用diABZI(2.5µM)刺激。gydF4y2BaggydF4y2Ba, LBD-STING的谷胱甘肽- Sepharose下拉分析gydF4y2BaWTgydF4y2Ba或LBD-STINGgydF4y2Ba艾利(E360A / L364A / I365A)gydF4y2Ba由gst标记AP-1 ΔμCTD核心。三家公司代表一名(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba)或两个(gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba)独立实验。目标蛋白与加载对照的比值归一化到每个条件下未处理的样品(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba).三的平均值±标准差(gydF4y2BafgydF4y2Ba)技术复制。gydF4y2BaPgydF4y2Ba基于双尾学生的值gydF4y2Bat -gydF4y2Ba测试(gydF4y2BafgydF4y2Ba).gydF4y2Ba
图7 STING-AP-1相互作用依赖于tbk1介导的磷酸化。gydF4y2Ba
一个gydF4y2Ba, HeLa STING KO细胞转染FLAG-tagged STINGgydF4y2BaWTgydF4y2Ba或刺痛gydF4y2BaLR (L374A / I375A)gydF4y2Ba用2.5µM diABZI处理0、1、2 h,抗flag抗体免疫沉淀,western blot分析。gydF4y2BabgydF4y2Ba,用空质粒或表达TBK1的质粒重组HeLa TBK1 KO细胞gydF4y2BaWTgydF4y2Ba或者酶死亡的TBK1gydF4y2BaS172AgydF4y2Ba用2.5µM diABZI处理2 h, western blot分析。GAPDH作为处理对照。gydF4y2BacgydF4y2Ba,用DMSO或2µM BX795预处理24 h的HeLa细胞用2.5µM diABZI刺激或不刺激(2 h), western blot分析。以Vinculin作为加载对照。至少两名的代表之一(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba)独立实验。目标蛋白与加载对照的比值归一化到每个条件下未处理的样品(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba).gydF4y2BadgydF4y2Ba,质谱检测了SUMO LBD-STING和tbk1磷酸化的LBD-STING (pSTING)的分子量。gydF4y2BaegydF4y2Ba生物层干涉法结合LBD-STING的研究gydF4y2Ba艾利(E360A / L364A / I365A)gydF4y2BaAP-1 ΔμCTD。gydF4y2BafgydF4y2Ba生物层干涉法结合LBD-STING的研究gydF4y2Ba3 s (S355D / S358D / S366D)gydF4y2BaAP-1 ΔμCTD。至少两名的代表之一(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)独立实验。gydF4y2Ba
图8 pSTING与AP-1配合物的低温电镜分析。gydF4y2Ba
一个gydF4y2BapSTING和ARF1配合物AP-1核的纯化及SDS-PAGE分析。gydF4y2BabgydF4y2BaSTING配合物中AP-1核的纯化及SDS-PAGE分析gydF4y2Ba3 s (S355D / S358D / S366D)gydF4y2Ba.gydF4y2BacgydF4y2Ba,玻璃化冰中AP-1 pSTING复合物的代表性显微照片,来自3004张原始图像。比例尺,30纳米。gydF4y2BadgydF4y2Ba, AP-1 pSTING复合粒子的2D类平均。盒子尺寸,27nm。gydF4y2BaegydF4y2Ba、数据处理流程图;看到gydF4y2Ba方法gydF4y2Ba获取详细信息。gydF4y2BafgydF4y2BaAP-1 pSTING复合物的最终三维重建,根据局部分辨率着色。gydF4y2BaggydF4y2Ba, AP-1 pSTING配合物最终三维重建的三维傅里叶壳层相关。gydF4y2BahgydF4y2Ba,修正了AP-1 pSTING配合物的金标准傅里叶壳层相关曲线,用于三维电子显微镜重建。gydF4y2Ba我gydF4y2Ba, AP-1 pSTING粒子的角分布纳入最终重建。至少两名的代表之一(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)独立实验。gydF4y2Ba
图9 AP-1-pSTING配合物的密度图和结构模型。gydF4y2Ba
AP-1和pSTING的密度图(灰网格)等高线为3σ。贴合到密度图中的蛋白质结构由棒状模型显示。gydF4y2Ba
图10 pSTING的pS366与AP-1σ的一个基本补丁结合。gydF4y2Ba
一个gydF4y2BaAP-1σ在不同物种和人σ亚单位异构体中的序列比对。gydF4y2BabgydF4y2Ba, LBD-STING或pLBD-STING与AP-1 ΔμCTD σ的生物层干涉结合研究gydF4y2Ba基米-雷克南gydF4y2Ba.gydF4y2BacgydF4y2BaHEK293T细胞转染FLAG-tagged STINGgydF4y2BaWTgydF4y2Ba和ha标记的AP-1γgydF4y2BaWTgydF4y2Ba,γgydF4y2BaR15EgydF4y2Ba,σgydF4y2BaWTgydF4y2Ba,σgydF4y2BaI103SgydF4y2Ba或σgydF4y2BaV88DgydF4y2Ba分别用2.5µM diABZI处理2 h,抗flag抗体免疫沉淀(IP), western blot分析。一个代表两个(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)独立实验。gydF4y2Ba
补充信息gydF4y2Ba
补充图1gydF4y2Ba
Uncropped凝胶。gydF4y2Ba
补充表1gydF4y2Ba
寡核苷酸序列。gydF4y2Ba
补充表2gydF4y2Ba
研究中使用的抗体列表。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘玉玉,徐鹏,李世峰,李世峰。gydF4y2Baet al。gydF4y2Ba网格蛋白相关AP-1控制STING信号的终止。gydF4y2Ba自然gydF4y2Ba610gydF4y2Ba, 761-767(2022)。https://doi.org/10.1038/s41586-022-05354-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05354-0gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba