摘要gydF4y2Ba
在不可切除的晚期黑色素瘤患者中,relatlimumab和nivolumab联合免疫治疗比nivolumab单一治疗提高了无进展生存期gydF4y2Ba1gydF4y2Ba.我们在可切除的临床III期或寡转移性IV期黑色素瘤(NCT02519322)患者中研究了该方案。患者接受两剂新辅助治疗(nivolumab 480 mg, relatlimumab 160 mg,每4周静脉注射一次),随后手术,然后10剂辅助联合治疗。主要终点为病理完全缓解(pCR)率gydF4y2Ba2gydF4y2Ba.在接受治疗的30例患者中,联合治疗的pCR率为57%,总体病理应答率为70%。采用实体瘤疗效评价标准1.1的放射学有效率为57%。在新辅助治疗中未观察到3-4级免疫相关不良事件。有任何病理反应的患者1年和2年无复发生存率分别为100%和92%,而没有病理反应的患者为88%和55% (gydF4y2BaPgydF4y2Ba= 0.005)。基线免疫细胞浸润增加,治疗期间M2巨噬细胞减少,与病理反应相关。我们的结果表明,新佐剂relatlimumab和nivolumab诱导了高pCR率。新辅助治疗的安全性优于其他联合免疫治疗方案。这些数据与RELATIVITY-047试验的结果相结合gydF4y2Ba1gydF4y2Ba,进一步证实了这种新的免疫治疗方案的有效性和安全性。gydF4y2Ba
主要gydF4y2Ba
局部晚期、可切除的黑色素瘤患者复发和死亡的风险很高gydF4y2Ba3.gydF4y2Ba.具体来说,患有临床检测到的淋巴结疾病的患者有高达75%的黑色素瘤特异性死亡风险gydF4y2Ba3.gydF4y2Ba.虽然目前的辅助治疗降低了约50%的复发风险(braf靶向治疗风险比(HR) 0.49,单药PD-1风险比约0.54)gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba在美国,对总体生存的影响尚未得到证实gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.为了强化单药抗pd -1之外的治疗,Checkmate-915试验旨在研究在辅助治疗中加入伊匹单抗与尼伏单抗相比是否能提高无复发生存期(RFS)。伊匹单抗和尼鲁单抗联合使用没有改善RFS (HR 0.92),但显著增加了毒性(3-4级不良事件(AEs) 43%,而单药抗pd -1为23%)。gydF4y2Ba7gydF4y2Ba,提示在辅助治疗中加强伊匹单抗和尼伏单抗辅助治疗并不是改善复发结果的最佳方法。gydF4y2Ba
与前期手术和辅助治疗相比,新辅助治疗具有几个优势,包括改善临床结果的潜力,以及了解治疗反应和耐药性的分子和免疫机制gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.此外,在临床前模型和人类样本中,新辅助免疫治疗已证明有能力增加抗原特异性T细胞的扩张,这是由于治疗时肿瘤的存在,而与在辅助环境中施用相同的免疫治疗时所看到的扩张相比gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.新辅助治疗还提供了在短的术前疗程中加强联合治疗的机会,可以直接评估治疗效果,并为辅助治疗决策提供信息。gydF4y2Ba
如果治疗期间发生3/4级免疫相关不良事件(IRAEs),新辅助免疫治疗的一个潜在限制是延迟治疗性手术。例如,新辅助给药2-3次伊匹单抗3 mg kggydF4y2Ba−1gydF4y2Ba+ nivolumab 1 mg kggydF4y2Ba−1gydF4y2Ba与73-90%的3/4级毒性相关,导致约27%的患者手术延迟gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.OpACIN-NEO试验比较了ipilimumab和nivolumab两种不同剂量的新辅助治疗策略。本研究证明伊匹单抗1 mg kggydF4y2Ba−1gydF4y2Banivolumab 3mg kggydF4y2Ba−1gydF4y2Ba显示出至少与伊匹单抗3 mg kg相当的pCR率(57%)gydF4y2Ba−1gydF4y2Ba+ nivolumab 1 mg kggydF4y2Ba−1gydF4y2Ba方案(47%),但3/4级毒性发生率较低(20%对40%)gydF4y2Ba17gydF4y2Ba.这些数据强调了识别新方案的目标,增强病理反应,降低复发风险,改善毒性特征。gydF4y2Ba
淋巴细胞激活基因3 (LAG-3)调节抑制性免疫检查点限制T细胞活性,是T细胞衰竭的标志gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.Relatlimab是一种人IgG4 lag -3阻断单克隆抗体,可恢复衰竭T细胞的效应功能,已在两个检查点进行了研究inhibitor-naïve (NCT03470922)gydF4y2Ba1gydF4y2Ba难治性转移性黑色素瘤(NCT01968109)gydF4y2Ba20.gydF4y2Ba.在随机2/3期relative -047研究中,在treatment-naïve不可切除的III期或IV期转移性黑色素瘤患者中,relatlimumab联合nivolumab与单药nivolumab相比,在无进展生存方面有显著改善(HR 0.78(95%可信区间(CI), 0.64-0.94)。此外,该组合具有良好的耐受性,21.1%的患者经历了3/4级治疗相关AEsgydF4y2Ba1gydF4y2Ba.鉴于其疗效和良好的毒性,该联合疗法于2022年3月18日获得美国食品和药物管理局批准用于转移性黑色素瘤患者。gydF4y2Ba
我们小组之前发表了一项由研究者发起的单药nivolumab(每2周静脉注射240 mg,最多4次)或1 mg kg nivolumab的随机临床试验经验gydF4y2Ba−1gydF4y2Ba用伊匹单抗3mg ggydF4y2Ba−1gydF4y2Ba(每3周静脉注射一次,最多3次)gydF4y2Ba16gydF4y2Ba.在本试验中,我们得出结论,尽管新辅助单药nivolumab是安全的(8%的3/4级毒性),但其疗效适中(25%的pCR率)。虽然nivolumab联合ipilimumab有效,pCR率为45%,但毒性高得令人难以接受,有73%的3/4级毒性gydF4y2Ba16gydF4y2Ba.考虑到这些数据以及由于两个治疗组的不佳表现而导致的研究过早结束,我们的团队试图评估新的免疫治疗组合,目的是保留病理反应,同时最小化毒性。我们在现有的前瞻性临床试验中开辟了一个新的分支,以确定relatlimumab和nivolumab联合治疗可切除的临床III期或寡转移性IV期黑色素瘤患者的pCR率、安全性和有效性(Clinicaltrial.gov编号NCT02519322)。gydF4y2Ba1gydF4y2Ba).在这里,我们报告了这种新辅助治疗组合的临床结果和免疫谱。gydF4y2Ba
病人的特点gydF4y2Ba
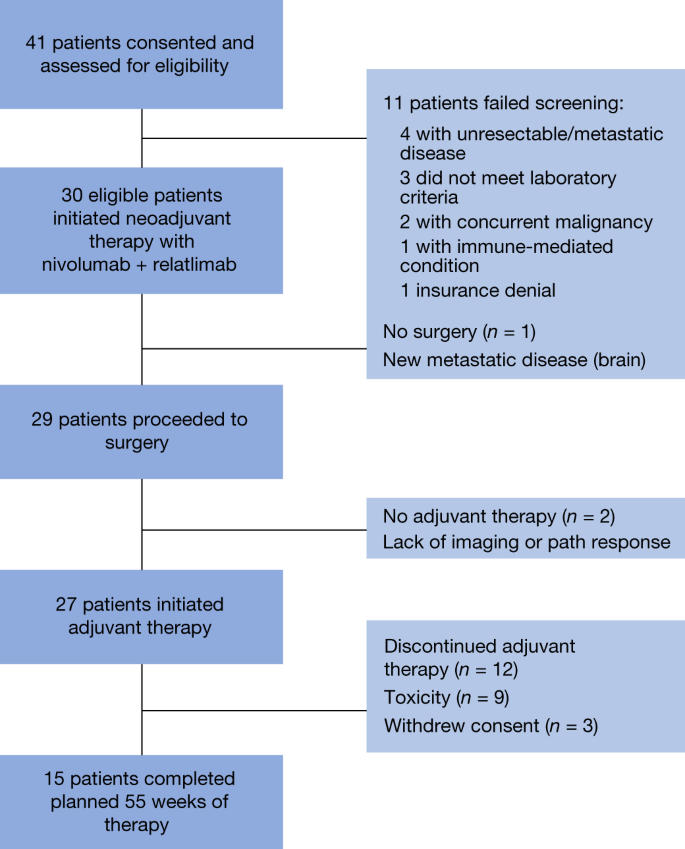
2018年9月19日至2020年9月23日,41名患者获得同意,30名患者通过筛查评估,并在MD安德森癌症中心和纪念斯隆凯特琳癌症中心接受治疗。筛查失败的最常见原因包括多学科研究确定的缺乏可切除疾病(gydF4y2BangydF4y2Ba= 4例)及化验值超出指定标准(gydF4y2BangydF4y2Ba= 3例)(图;gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
接受治疗的患者中位年龄为60岁(范围35-79岁),63%的患者为男性(扩展数据表)gydF4y2Ba1gydF4y2Ba).根据美国癌症联合委员会第8版标准,黑色素瘤临床分期为60% IIIB期,26% IIIC期,7% IIID期和7% M1A期gydF4y2Ba3.gydF4y2Ba.33%的患者有新的临床III期或寡转移性IV期黑色素瘤,67%的患者既往有黑色素瘤手术。只有17%的患者有gydF4y2BaBRAF -gydF4y2Ba突变的黑色素瘤,可能是由于参加了一项竞争的新辅助试验,专门针对患有gydF4y2BaBRAF -gydF4y2Ba突变的疾病。只有1例患者既往接受过全身治疗(BRAF和MEK抑制)。中位靶病变直径总和为26 mm(扩展数据表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
耐心的性格gydF4y2Ba
在30例接受治疗的患者中,29例能够接受计划的两剂新辅助药relatlimumab和nivolumab。一名患者因无症状肌钙蛋白升高而只接受了一次剂量,并担心心肌炎,在患者进行心肌活检并能够安全进行手术后,最终确定这不是由于新辅助免疫治疗。1例患者因在新辅助治疗期间发生远处转移性疾病而未进行手术。在29例接受手术的患者中,27例患者在第9周按计划进行手术;一名患者因上述心肌炎毒性问题被推迟,另一名患者因SARS-CoV2大流行相关的医院手术限制而被推迟。27例患者继续进行辅助治疗,2例患者因病理和影像学反应不佳而选择不进行辅助治疗。56%的患者完成了整个方案治疗期间,33%的患者因毒性而停止辅助治疗,11%的患者在辅助治疗期间撤回同意(图。gydF4y2Ba2gydF4y2Ba).目前,所有患者都脱离了常规治疗。gydF4y2Ba
临床活动gydF4y2Ba
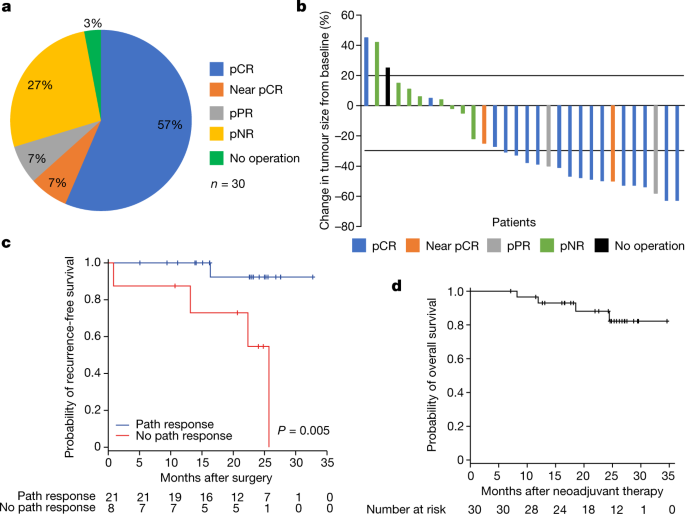
入组的30例患者中,29例患者接受了手术(97%),17例(57%;95% CI, 37-75%)达到pCR, 2例(7%)接近pCR(定义为大于0%但小于或等于10%的活瘤),2例(7%)部分病理反应(pPR;定义为大于10%至小于或等于50%的存活肿瘤)和8例(27%)无病理反应(pNR;定义为大于50%的存活肿瘤)(图;gydF4y2Ba3gydF4y2Ba).63%的患者达到主要病理反应(pCR +近pCR), 70%的患者达到任何病理反应(pCR +近pCR + pPR)gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba根据INMC指南解释的29例手术患者的病理反应分解。结果细节(图四舍五入值):30例患者中有1例(3.33%)没有手术;30例患者中有17例(56.67%)有pCR;pPR为2 / 30 (6.67%),pNR为8 / 30(26.67%)。gydF4y2BabgydF4y2Ba,根据RECIST 1.1标准的新辅助反应瀑布图,彩色编码表示病理反应。pCR表明缺乏活的肿瘤。近pCR表示大于0%但小于或等于10%的肿瘤活菌,pPR大于10%到小于或等于50%的肿瘤活菌,pNR大于50%的肿瘤活菌。gydF4y2BacgydF4y2Ba,基于任何病理反应与无病理反应的无复发概率。gydF4y2BadgydF4y2Ba,整个队列的总体生存曲线。gydF4y2Ba
放射学总缓解率为57%(所有部分缓解(PRs);33%的患者病情稳定(SD), 10%的患者病情进展(PD)。gydF4y2Ba3 bgydF4y2Ba))在有意治疗人群中。8周时病理反应常与x线反应不一致。例如,在19例达到主要病理反应(pCR和近pCR)的患者中,1例患者x线片上有PD, 3例有SD, 15例有PR。在8例pNR患者中,只有1例x线片上有PD, 7例有SD。在16例肿瘤直径总和在中位数或更高(至少26毫米)的患者中,实体瘤的反应评价标准(RECIST;6% PD, 38% SD, 56% PR)和病理反应(38% pNR, 6% pPR, 6%近pCR, 50% pCR),表明基线肿瘤负荷与病理或影像学反应没有直接相关。gydF4y2Ba
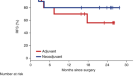
30例患者的中位随访时间为24.4个月(范围7.1-34.6个月),1年和2年无事件生存率(所有患者从开始治疗到复发的时间)分别为90%和81%(扩展数据图)。gydF4y2Ba1gydF4y2Ba).1年和2年的RFS率(手术患者从手术到复发的时间)分别为97%和82%(扩展数据图。gydF4y2Ba2gydF4y2Ba).pCR患者的1年和2年RFS率分别为100%和91%,而无pCR患者的RFS率分别为92%和69% (gydF4y2BaPgydF4y2Ba= 0.10)(扩展数据图。gydF4y2Ba2 bgydF4y2Ba).有任何病理反应的患者的1年和2年RFS率分别为100%和92%,而没有病理反应的患者的RFS率分别为88%和55% (gydF4y2BaPgydF4y2Ba= 0.005)(图gydF4y2Ba3 cgydF4y2Ba).所有患者的1年和2年总生存率分别为93%和88%。gydF4y2Ba3 dgydF4y2Ba).gydF4y2Ba
在三名接受新辅助治疗的RECIST PD患者中,一名患者发生远处转移(脑),未接受手术。另外两例RECIST PD患者似乎仅在受累性淋巴结盆局部进展,两例患者均实现了完全手术切除。其中1例患者由于pNR和患者/医生的决定而没有继续辅助治疗;另一组达到pCR,继续辅助治疗并完成方案治疗,无疾病复发(图。gydF4y2Ba2gydF4y2Ba).2例患者(均为pNR)在完成全部10个剂量的辅助治疗后3个月和14个月发生了先前手术切除部位附近软组织局部复发。据报道,一名患有pCR的患者在大脑中经历了未经证实的疾病进展,并在手术后14个月去世。gydF4y2Ba
安全gydF4y2Ba
在8周的新辅助治疗期间,没有3/4级的IRAEs(扩展数据表)gydF4y2Ba2gydF4y2Ba).26%的患者在辅助治疗中出现3/4级IRAEs(从第9周及之后)(扩展数据表)gydF4y2Ba2gydF4y2Ba).总体而言,33%的患者因任何毒性(最常见的是转氨炎)而选择停止辅助治疗。尽管存在无症状肌钙蛋白升高,但根据心脏病学会诊评估,没有患者出现由研究药物引起的有症状的肌钙蛋白升高、心肌炎或其他心脏毒性。最常见的IRAE是继发性肾上腺功能不全(23%),迄今为止没有一例患者出现肾上腺功能恢复。gydF4y2Ba
相关研究gydF4y2Ba
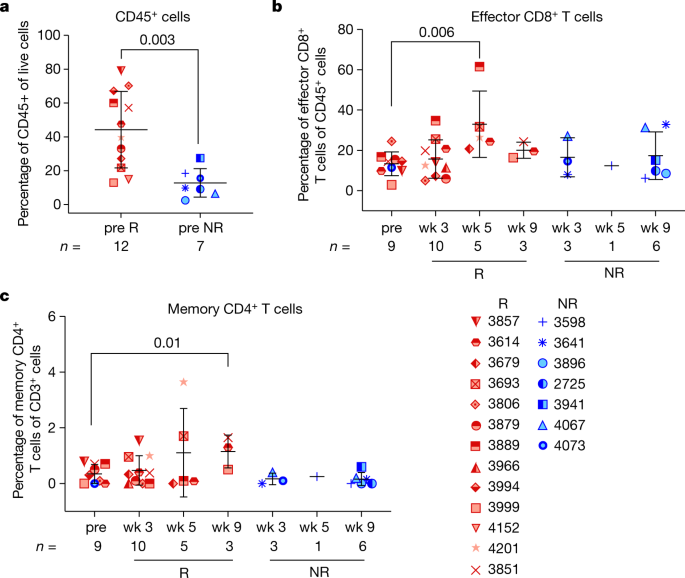
生物标志物分析侧重于描述肿瘤微环境和外周血中的免疫细胞亚群,采用细胞质量测定(CyTOF)和流式细胞仪进行。基线肿瘤样本中的LAG-3和PD-1水平与病理反应无关(扩展数据图。gydF4y2Ba3.gydF4y2Ba).在肿瘤中,CD45的频率gydF4y2Ba+gydF4y2Ba与无反应的预处理样本相比,有反应者(定义为手术时肿瘤生存能力低于50%的患者)的预处理样本中细胞含量更高(NRs;大于或等于50%的肿瘤存活率)(图。gydF4y2Ba4gydF4y2Ba)。无监督聚类鉴定出一个效应子CD8gydF4y2Ba+gydF4y2BaT细胞亚群(CD8gydF4y2Ba+gydF4y2BaCD45ROgydF4y2Ba低gydF4y2Ba)和记忆CD4细胞gydF4y2Ba+gydF4y2BaT细胞亚群(CD4gydF4y2Ba+gydF4y2BaCD45ROgydF4y2Ba+gydF4y2BaTCF7gydF4y2Ba+gydF4y2BaCD28gydF4y2Ba+gydF4y2BaBTLAgydF4y2Ba+gydF4y2BaTIGITgydF4y2Ba+gydF4y2Ba),在治疗后的肿瘤标本中,与治疗前相比,反应良好的患者的肿瘤标本增加(图。gydF4y2Ba4 b, cgydF4y2Ba).这些细胞群的增加在NR患者组中没有体现出来,尽管应该注意的是,该组中可评估的标本数量较低(图2)。gydF4y2Ba4 b, cgydF4y2Ba).相比之下,在疗效良好的患者治疗后,肿瘤中m2样巨噬细胞亚群的频率下降(扩展数据图)。gydF4y2Ba4gydF4y2Ba).在血液中,eome有增加的趋势gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2Ba治疗后患者的T细胞阳性反应和阴性反应,在治疗后第5周差异最大(扩展数据图)。gydF4y2Ba4 bgydF4y2Ba).gydF4y2Ba
从基线、relatlimumab和nivolumab治疗后的患者身上采集的肿瘤组织样本通过CyTOF (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba).gydF4y2Ba一个gydF4y2BaCD45的频率gydF4y2Ba+gydF4y2Ba细胞通过手动门控进行评估。gydF4y2BabgydF4y2Ba,效应子CD8的频率gydF4y2Ba+gydF4y2BaT细胞亚群(CD3gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2BaCD45ROgydF4y2Ba低gydF4y2Ba)在无监督聚类中。gydF4y2BacgydF4y2Ba,记忆CD4的频率gydF4y2Ba+gydF4y2Ba子集(CD45ROgydF4y2Ba+gydF4y2Ba国际安全和发展理事会gydF4y2Ba+gydF4y2BaTCF7gydF4y2Ba+gydF4y2BaBTLAgydF4y2Ba+gydF4y2BaCD28gydF4y2Ba+gydF4y2BaTIGITgydF4y2Ba+gydF4y2Ba)由无监督聚类确定。数据载于gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba均值±标准差,和gydF4y2BangydF4y2Ba数值如图所示。gydF4y2BaPgydF4y2Ba每个图中显示的值是用双尾不配对计算的gydF4y2BatgydF4y2Ba-test,没有多重比较。红色表示病理反应;蓝色,无。CyTOF,大规模细胞术;NR的人;R,应答器;周,一周。gydF4y2Ba
讨论gydF4y2Ba
在可切除的临床III期或寡转移IV期黑色素瘤患者中,新辅助relatlimumab联合尼鲁单抗可导致高pCR率(57%;95% CI, 37-75%),与没有病理反应的患者相比,有任何病理反应的患者的2年RFS率有所改善(gydF4y2BaPgydF4y2Ba= 0.005)。CI下限(37%)超过了研究设计中30%的最低目标。该方案在新辅助治疗中耐受性良好,在辅助治疗中继续给药有26%的3级毒性。在有病理反应的患者中,在基线时发现免疫细胞浸润增加,在新辅助治疗过程中显示M2巨噬细胞减少。gydF4y2Ba
该试验的前两个随机组分别评估了单药nivolumab和联合使用ipilimumab 3mg kggydF4y2Ba−1gydF4y2Ba尼伏单抗1mg kggydF4y2Ba−1gydF4y2Ba.27%的患者接受3 mg kg伊匹单抗治疗gydF4y2Ba−1gydF4y2Ba尼伏单抗1mg kggydF4y2Ba−1gydF4y2Ba由于需要类固醇和延长类固醇减量,手术需要延迟1-10周gydF4y2Ba16gydF4y2Ba.在新辅助治疗中没有观察到3/4级的IRAEs,也没有确认毒性相关的手术延迟,现在nivolumab和relatlimumab联合使用提供了补充信息,并证明了一种在新辅助治疗中毒性可控的高效方案。gydF4y2Ba
虽然在新辅助治疗中没有3/4级的IRAEs,但在辅助治疗中有26%的3/4级毒性。最常见的IRAE为继发性肾上腺功能不全。由于毒性,33%的患者在计划的全年治疗前停止治疗,这就提出了一个问题,即在新辅助治疗的病理反应后,是否有必要继续在辅助治疗中给药。此外,由于毒性而早期停止治疗的患者均未出现复发事件。对于新辅助试验是否需要辅助治疗尚无明确共识,已完成或正在进行的试验包括完全省略任何辅助治疗、仅在反应差的患者中使用辅助治疗或辅助治疗完成1年治疗gydF4y2Ba8gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba此外,辅助治疗的使用肯定会影响RFS,并可能使新辅助治疗数据的解释变得模糊。了解辅助免疫治疗在新辅助治疗后对临床获益的贡献仍然是一个活跃的研究兴趣领域。gydF4y2Ba
新辅助化疗的历史教条强调pCR是与最持久的临床结果相关的关键终点gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.国际新辅助黑色素瘤联盟(INMC)对临床III期黑色素瘤患者使用新辅助BRAF/MEK抑制剂的综合分析也同样赞赏这一点,表明获得pCR而不是pPR与RFS的改善相关gydF4y2Ba9gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.虽然pCR终点可能仍然适用于新辅助化疗或分子靶向治疗,但我们的数据提供了进一步的证据,在黑素瘤新辅助免疫治疗的背景下,任何病理反应(小于50%的存活肿瘤)都与有利的长期临床结果相关(图。gydF4y2Ba3 cgydF4y2Ba)gydF4y2Ba9gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.在实体肿瘤的新辅助免疫治疗试验中,与任何病理反应相似的改善临床反应的模式正在得到赞赏gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.gydF4y2Ba
虽然肿瘤样本中基线LAG-3和PD-1水平与应答无关,但我们观察到记忆CD4频率的增加gydF4y2Ba+gydF4y2Ba效应子CD8gydF4y2Ba+gydF4y2BaT细胞在治疗后肿瘤患者标本中具有良好的治疗反应。这些发现与之前的研究一致,即抗pd -1反应与CD8升高有关gydF4y2Ba+gydF4y2BaT细胞gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.此外,我们观察到仅在病理反应患者中,m2样巨噬细胞在治疗后减少,这可能是进一步提高对该方案的反应性的靶点,和/或在其他nivolumab + relatlimumab的研究中进一步评估gydF4y2Ba29gydF4y2Ba.纵向外周血标本的流式细胞仪分析显示eome的频率较高gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2Ba治疗后患者样本中的T细胞,提示CD8gydF4y2Ba+gydF4y2Ba表达eome的T细胞可能有助于肿瘤消退。这支持了emes在CD8抗肿瘤活性中的潜在关键作用gydF4y2Ba+gydF4y2BaT细胞,如前所述gydF4y2Ba30.gydF4y2Ba.这些数据表明,总免疫细胞浸润的频率更高,以及特异性效应CD4的增加gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞亚群,伴随着肿瘤微环境中抑制性髓细胞的减少,与新辅助治疗中对该方案的临床反应相关。值得注意的是,NR患者的可用样本数量较少,这限制了本研究的比较相关性分析。gydF4y2Ba
我们承认,这项研究因样本量小而有局限性,这些结果是基于两个学术研究机构的发现而得出的初步结果。然而,本研究评估的队列(gydF4y2BangydF4y2Ba= 30)在很大程度上类似于OpACIN-NEO研究中的单个组和其他单臂新辅助免疫治疗试验gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.中位随访24个月,我们也承认需要进一步随访以充分评估临床影响和反应的持久性。然而,这些初始数据是令人鼓舞的,对黑色素瘤新辅助试验的汇总分析支持病理缓解率作为持久获益的早期预测因子的重要性gydF4y2Ba9gydF4y2Ba.同样,超出本文范围的其他转化研究正在计划中,包括RNA测序,以广泛评估涉及免疫治疗耐药性的其他免疫标记和人群gydF4y2Ba28gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.gydF4y2Ba
总之,新辅助治疗relatlimumab和nivolumab是一种高活性方案,在高危、可切除的临床III期或寡转移IV期黑色素瘤患者中达到70%的病理缓解率,具有良好的安全性。这些数据是对RELATIVITY-047在不可切除的转移性黑色素瘤患者中的研究的补充,并进一步支持了这种新的联合免疫治疗方案在这种疾病中的前景。gydF4y2Ba
方法gydF4y2Ba
病人gydF4y2Ba
符合条件的患者年龄为18岁或以上,临床III期或少转移性(少于3个器官转移)IV期黑色素瘤,病变由RECIST 1.1测量(参考文献)。gydF4y2Ba32gydF4y2Ba).可切除的临床III期黑色素瘤被定义为临床可检测、recist可测量的淋巴结疾病,伴有或不伴有区域转移或卫星转移,且无远处转移。通过多学科会议验证了III期和IV期疾病的可切除性。复发性黑色素瘤患者或新生美国癌症联合委员会第8版gydF4y2Ba3.gydF4y2Ba临床III期或IV期疾病被认为是符合条件的,所有黑色素瘤亚型,包括葡萄膜、粘膜或肢端瘤,都符合入选条件。所有患者的东方肿瘤合作组表现状态均为0或1,器官功能正常,无手术禁忌指征。需要积极免疫抑制治疗的患者,或患有活动性自身免疫性疾病或感染性疾病的患者,或患有无法控制的心血管疾病或持续并发恶性肿瘤的患者被排除在外。gydF4y2Ba
研究设计gydF4y2Ba
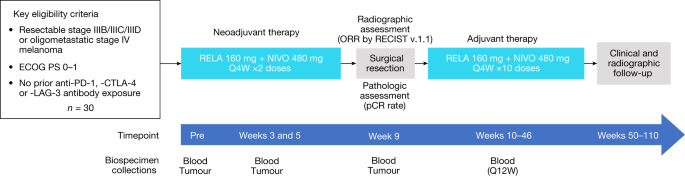
这项由研究者发起的前瞻性研究在美国的两个学术医疗中心进行。患者接受两次静脉固定剂量的relatlimumab 160 mg和nivolumab 480 mg,间隔4周。手术计划在治疗开始后9周进行。患者在手术后4-6周开始服用多达10剂的联合药物,共完成12剂。术后随访患者2年,寻找疾病复发的证据(研究设计细节见图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
主要终点是pCR(定义为手术病理评估无存活肿瘤)率的测定gydF4y2Ba2gydF4y2Ba.在这项探索性生物标志物研究中,建议采用这种联合治疗的患者的病理缓解率为30%。假设这个真实的pCR率,30个患者中至少有5个经历pCR的概率为0.97。次要终点包括RECIST 1.1总有效率、安全性、RFS、无事件生存期、总生存期和免疫分析与应答的相关性。gydF4y2Ba
根据美国国家癌症研究所不良事件通用术语标准v.4.03(参考文献),监测所有患者的不良事件。gydF4y2Ba33gydF4y2Ba).基于先前的相关单抗研究考虑到心肌炎gydF4y2Ba1gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba在每次输注前,除了评估血细胞计数、电解质、肝肾功能外,还要求患者进行心肌肌钙蛋白检测。所有患者在治疗开始后28天内进行了基线肿瘤分期(计算机断层扫描或正电子发射断层扫描-身体计算机断层扫描和大脑磁共振成像),并在第8周再次进行了RECIST反应测定。在术后2年内,每3个月进行一次扫描。在治疗开始的28天内,在第3周和第5周进行核心针活检以进行相关研究。在治疗开始时、第3、5、9周和术后每12周采集一次血液,持续2年(图2)。gydF4y2Ba1gydF4y2Ba).根据机构标准和INMC指南,在第9周完成手术切除gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.手术切除标本的病理复查由一小组皮肤病理学家进行,他们根据INMC概述的实践评估标本gydF4y2Ba2gydF4y2Ba.pCR被定义为无活的肿瘤,近pCR被定义为大于0%但小于或等于10%活的肿瘤,pPR被定义为大于10%到小于或等于50%活的肿瘤,pNR被定义为大于50%活的肿瘤。gydF4y2Ba
研究监督gydF4y2Ba
该研究是根据国际协调会议和赫尔辛基宣言定义的临床试验方案和良好临床实践指南进行的。这项研究得到了MD安德森癌症中心和纪念斯隆凯特琳癌症中心的机构审查委员会的批准。所有患者均知情同意参与临床试验。这项研究是由MD安德森癌症中心的研究人员设计的,手稿由作者完整撰写。试验监测由MD安德森癌症中心的新药研究办公室负责。研究药物由百时美施贵宝提供。gydF4y2Ba
统计分析gydF4y2Ba
RFS时间计算从手术日期到进展/复发或死亡日期(如果死亡无进展/复发)。无事件生存时间计算从治疗开始到进展/复发或死亡日期(如果死亡无进展/复发)。在最后一次随访日期存活且未发生进展/复发的患者被审查。未经历进展/复发而死亡的患者被切除。总生存时间计算从新辅助治疗开始到最后已知生命状态。在最后一个随访日期存活的患者被检查。采用Kaplan-Meier法估计结局指标,采用log-rank检验评估组间差异。所有统计分析均使用SAS v.9.4 for Windows进行。gydF4y2Ba
相关研究gydF4y2Ba
在如图所示的时间点采集血液和肿瘤。gydF4y2Ba1gydF4y2Ba.从外周血和肿瘤组织中分离和制备细胞,按照以下规范进行流式细胞术和CyTOF分析。gydF4y2Ba
从外周血和组织中分离和制备细胞gydF4y2Ba
全血收集在含肝素钠(BD Vacutainer)的试管中,在磷酸盐缓冲盐水(PBS)中重悬,在Ficoll (StemCell Technologies)上分层,在800℃离心gydF4y2BaggydF4y2Ba25分钟。收集界面外周血单个核细胞(pmcs),用PBS洗涤两次,并在500下离心gydF4y2BaggydF4y2Ba10分钟。新鲜肿瘤组织用GentleMACS系统(Miltenyi Biotec)分离。用5 μmol l对PBMC和用于CyTOF分析的肿瘤标本进行细胞活力染色gydF4y2Ba−1gydF4y2Ba将顺铂(Fluidigm,现为Standard Biotools)注入含1%牛血清白蛋白(BSA)的PBS中,然后清洗三次。所有标本在10% (vol/vol)二甲亚砜的AB血清中重悬,保存于液氮中,直到进行下游检测。gydF4y2Ba
流式细胞仪染色分析gydF4y2Ba
流式细胞仪分析pbmc(见扩展数据表)gydF4y2Ba3.gydF4y2Ba用于流式细胞术的抗体)。单细胞悬液用16种荧光一抗和活/死染料染色。使用BD LSRFortessa ×20细胞仪和BD FACSDiva采集软件v.8.0.1 (BD Biosciences)分析标本,使用FlowJo软件v.10.5.3 (BD)手动进行下游分析。参见扩展数据图。gydF4y2Ba5gydF4y2Ba用于流式细胞仪顺序门控/分选策略。gydF4y2Ba
流式细胞仪染色和分析gydF4y2Ba
在肿瘤标本和pbmc上进行CyTOF分析(见扩展数据表)gydF4y2Ba4gydF4y2Ba用于CyTOF分析的抗体)。单细胞悬液用41个抗体、Ir dna插片器和顺铂进行检测。抗体或从Fluidigm购买预偶联抗体,或使用MaxPar X8聚合物试剂盒(Fluidigm,现为Standard Biotools)购买纯化并在内部偶联。简单地说,样品在含5%山羊血清和1% BSA的PBS中解冻并用细胞表面抗体在4℃下染色30分钟。然后将样品在含1% BSA的PBS中洗涤,使用FoxP3染色缓冲液组(eBioscience)按照制造商的说明进行固定和渗透,然后在渗透缓冲液中与细胞内抗体在4℃下孵育30分钟。样品在Ir插入器(Fluidigm,现为Standard Biotools)中清洗和孵育,并在4°C下存储,直到采集,通常在12小时内。在采集之前,将样品清洗并重新悬浮在含有EQ 4元素珠的水中(Fluidigm,现为Standard Biotools)。样品在Helios细胞仪(Fluidigm,现为Standard Biotools)上采集。gydF4y2Ba
在R (R Foundation for Statistical Computing)中对FCS文件进行预处理gydF4y2Bahttps://www.R-project.org/gydF4y2Ba))使用CyTOF包(Premessa, Parker癌症免疫治疗研究所(gydF4y2Bahttps://github.com/ParkerICIgydF4y2Ba),并在FlowJo (BD)中手动门控。然后将数据导出为FCS文件进行下游分析,并使用系数为5 [x_transformed = arcsinh(x/5)]进行arcsinh转换。为了使高维数据在二维中可视化,应用了t分布随机邻居嵌入降维算法,使用除了用于手动gate感兴趣的总体(例如CD45或CD3)之外的所有通道。聚类分析在R中使用FlowSOM和ConsensusClusterPlus包进行gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
图形及统计gydF4y2Ba
使用GraphPad Prizm v.9.2 (GraphPad Software, LLC)创建图表并进行统计分析。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据已提供给gydF4y2Ba自然gydF4y2Ba通过直接沉积。gydF4y2Ba
参考文献gydF4y2Ba
Tawbi, H. A.等。relatlimumab和nivolumab治疗晚期黑色素瘤。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba386gydF4y2Ba, 24-34(2022)。gydF4y2Ba
Tetzlaff, m.t.等人。转移性黑色素瘤新辅助治疗后切除标本的病理评估。gydF4y2Ba安。肿瘤防治杂志。gydF4y2Ba29gydF4y2Ba, 1861-1868(2018)。gydF4y2Ba
Gershenwald, J. E.等。黑色素瘤分期:美国癌症联合委员会的循证变化:第八版癌症分期手册。gydF4y2BaCA Cancer J. Clin。gydF4y2Ba67gydF4y2Ba, 472-492(2017)。gydF4y2Ba
Long, G. V.等。佐剂dabrafenib联合曲美替尼治疗III期braf突变黑色素瘤。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba377gydF4y2Ba, 1813-1823(2017)。gydF4y2Ba
埃格蒙特,a.m. m.m.等。在切除的III期黑色素瘤中,辅助派姆单抗与安慰剂的比较。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba378gydF4y2Ba, 1789-1801(2018)。gydF4y2Ba
韦伯等人。nivolumab与ipilimumab辅助治疗切除的IIIB-C或IV期黑色素瘤的五年结果(CheckMate 238)。gydF4y2Ba猪。细胞梅尔。Res。gydF4y2Ba35gydF4y2Ba, 97-184(2022)。gydF4y2Ba
Long, G. V.等。nivolumab联合伊匹单抗与nivolumab单独用于切除的iib - d /IV期黑色素瘤患者的辅助治疗(CheckMate 915)。gydF4y2Ba癌症Res。gydF4y2Bahttps://doi.org/10.1158/1538-7445.AM2021-CT004gydF4y2Ba(2021)。gydF4y2Ba
Amaria, R. N.等人。黑色素瘤的新辅助全身治疗:国际新辅助黑色素瘤协会的建议。gydF4y2Ba柳叶刀杂志。gydF4y2Ba20.gydF4y2Ba, e378-e389(2019)。gydF4y2Ba
孟席斯,a.m.等人。黑色素瘤新辅助治疗的病理反应和生存期:来自国际新辅助黑色素瘤联盟(INMC)的汇总分析。gydF4y2BaNat,地中海。gydF4y2Ba27gydF4y2Ba, 301-309(2021)。gydF4y2Ba
范·阿克库伊,a.c.j等人。黑素瘤患者的新辅助全身治疗(NAST):国际新辅助黑素瘤联盟的手术考虑。gydF4y2Ba安。Surg.杂志。gydF4y2Ba29gydF4y2Ba, 3694-3708(2022)。gydF4y2Ba
Cortazar, P.等人。乳腺癌病理完全缓解和长期临床获益:CTNeoBC汇总分析。gydF4y2Ba《柳叶刀》gydF4y2Ba384gydF4y2Ba, 164-172(2014)。gydF4y2Ba
佩里,F.等人。膀胱癌膀胱切除术患者新辅助化疗后病理完全缓解与生存的相关性:一项荟萃分析。gydF4y2Ba欧元。Urol。gydF4y2Ba65gydF4y2Ba, 350-357(2014)。gydF4y2Ba
卡西,A.等。局部晚期直肠癌的全新辅助化疗与标准治疗:系统回顾和荟萃分析。gydF4y2BaJAMA Netw。开放。gydF4y2Ba3.gydF4y2Ba, e2030097(2020)。gydF4y2Ba
刘,J.等。与辅助免疫治疗相比,新辅助治疗在根除转移性疾病方面的疗效有所提高。gydF4y2Ba癌症盘。gydF4y2Ba6gydF4y2Ba, 1382-1399(2016)。gydF4y2Ba
布兰克,c.u.等人。ⅲ期黑色素瘤的新辅助治疗与伊匹单抗加尼伏单抗的对照。gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba, 1655-1661(2018)。gydF4y2Ba
Amaria, R. N.等人。新辅助免疫检查点阻断在高危可切除黑色素瘤中的应用gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba, 1649-1654(2018)。gydF4y2Ba
Rozeman, E. A.等。在宏观III期黑色素瘤(OpACIN-neo)中确定新辅助药物ipilimumab + nivolumab的最佳联合给药方案:一项多中心、2期随机对照试验。gydF4y2Ba柳叶刀杂志。gydF4y2Ba20.gydF4y2Ba948-960(2019)。gydF4y2Ba
哇,S.-R。et al。免疫抑制分子LAG-3和PD01协同调节T细胞功能,促进肿瘤免疫逃逸。gydF4y2Ba癌症Res。gydF4y2Ba72gydF4y2Ba, 917-927(2012)。gydF4y2Ba
Anderson, a.c, Joller, N. & Kuchroo, V. K. Lag-, Tim-3和TIGIT共抑制受体在免疫调节中的特殊功能。gydF4y2Ba免疫力。gydF4y2Ba44gydF4y2Ba, 989-1004(2016)。gydF4y2Ba
Ascierto, p.a.等。BMS-986016(一种靶向淋巴细胞激活基因-3 (LAG-3)的单克隆抗体)联合nivolumab治疗既往抗pd -1/PD-L1治疗(mel prior IO)期间进展的黑色素瘤患者在所有病例和生物标志物富集人群中的疗效。gydF4y2Ba安。肿瘤防治杂志。gydF4y2Ba28gydF4y2BaV611-V612(2017)。gydF4y2Ba
黄,a.c.等。单剂量新辅助PD-1阻断剂预测可切除黑色素瘤的临床结果。gydF4y2BaNat,地中海。gydF4y2Ba25gydF4y2Ba, 454-461(2019)。gydF4y2Ba
Amaria, R. N.等人。新辅助治疗加辅助治疗的达拉法非尼和曲美替尼与手术可切除高风险黑素瘤患者的标准治疗:一项单中心、开放标签、随机2期试验gydF4y2Ba柳叶刀杂志。gydF4y2Ba19gydF4y2Ba, 181-193(2018)。gydF4y2Ba
Long, G. V.等。新辅助药物达拉法非尼联合曲美替尼治疗可切除的IIIB-C期BRAF(V600)突变阳性黑色素瘤(NeoCombi):一项单臂、开放标签、单中心、2期试验。gydF4y2Ba柳叶刀杂志。gydF4y2Ba20.gydF4y2Ba, 961-971(2019)。gydF4y2Ba
福德,P. M.等。新辅助PD-1阻断在可切除肺癌中的应用。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba378gydF4y2Ba, 1976-1986(2018)。gydF4y2Ba
托帕利安,s.l.等。在CheckMate 358试验中,nivolumab用于可切除的默克尔细胞癌患者。gydF4y2Baj .中国。肿瘤防治杂志。gydF4y2Ba38gydF4y2Ba, 2476-2487(2020)。gydF4y2Ba
沃斯,J. L.等。nivolumab和ipilimumab的新辅助免疫治疗在头颈部鳞状细胞癌患者中诱导了主要的病理反应。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 7348(2021)。gydF4y2Ba
Riaz, N.等人。尼伏单抗免疫治疗期间肿瘤和微环境的演变。gydF4y2Ba细胞gydF4y2Ba171gydF4y2Ba, 934-949(2017)。gydF4y2Ba
Rozeman, E. A.等。OpACIN-neo和OpACIN-neo新辅助免疫治疗III期黑色素瘤试验的生存和生物标志物分析。gydF4y2BaNat,地中海。gydF4y2Ba27gydF4y2Ba, 256-263(2021)。gydF4y2Ba
乔丹,K. R.等。骨髓源性抑制细胞与晚期黑色素瘤患者的疾病进展和总生存率降低有关。gydF4y2Ba癌症Immunol。Immunother。gydF4y2Ba62gydF4y2Ba, 1711-1722(2013)。gydF4y2Ba
Llao-Cid, L.等。eome对CD8的抗肿瘤活性至关重要gydF4y2Ba+gydF4y2Ba慢性淋巴细胞白血病中的T细胞。gydF4y2Ba白血病gydF4y2Ba35gydF4y2Ba, 3152-3162(2021)。gydF4y2Ba
Helmink, B. A.等。B细胞和三级淋巴结构促进免疫治疗反应。gydF4y2Ba自然gydF4y2Ba277gydF4y2Ba, 549-555(2020)。gydF4y2Ba
艾森豪尔,e.a.等。实体肿瘤的新反应评价标准:修订的RECIST指南(1.1版)。gydF4y2Ba欧元。j .癌症。gydF4y2Ba45gydF4y2Ba, 228-247(2009)。gydF4y2Ba
美国卫生与公众服务部,国家卫生研究院和国家癌症研究所。不良事件通用术语标准(CTCAE v.4.03)。gydF4y2Bahttps://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/CTCAE_4.03_2010-06-14_QuickReference_8.5x11.pdfgydF4y2Ba(2010)。gydF4y2Ba
诺维卡,等人。CyTOF工作流程:高通量高维细胞术数据集的差异发现。gydF4y2BaF1000Res。gydF4y2Ba6gydF4y2Ba, 748(2017)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢德克萨斯大学MD安德森癌症中心的黑色素瘤信息学、组织资源和转化病理学核心。该项目由德克萨斯大学MD安德森癌症登月计划的慷慨慈善捐款支持。M. Postow得到了美国国立卫生研究院/国家癌症研究所癌症中心支持基金P30 CA08748的支持。ca由MSKCC帕克癌症免疫疗法研究所的试点拨款支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
r.n.a., e.m.b., m.a.d., J.A.W.和H.A.T.与百时美施贵宝合作,对研究的概念和设计做出了贡献。R.N.A。m . Postow M.I.R, I.C.G。l ., J.L.M, M.K.W, J.E.G, J.E.L, R.P.G, E.Z.K, S.B.F A.B.-W。,一个.N.S., M.C., D.C., E.K.B., D.B., P.M., S.P.P., A.D., A.L., M.A.D., J.A.W., C.A. and H.A.T. recruited and/or treated patients and gathered clinical data on efficacy and safety. D.R.M. analysed the clinical data and performed statistical analyses. F.D., C.N., A.G., X.Z., J.P.A. and P.S. performed biomarker analyses. M.T.T., C.T.-C., K.B. and V.G.P. performed pathologic analyses. B.R.K. and M. Patnana performed radiologic analyses. All authors interpreted the data. All authors had access to all the data in the study, participated in developing or reviewing the manuscript and provided final approval to submit the manuscript for publication.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
rn.a:百时美施贵宝(Bristol-Myers Squibb)、Iovance、默克(Merck)和诺华(Novartis)提供研究资金;百时美施贵宝(Bristol-Myers Squibb)、Iovance和诺华(Novartis)的顾问角色。M. Postow: Aduro、Array BioPharma、Bristol-Myers Squibb、Eisai、Incyte、Merck、NewLink Genetics、Novartis和Pfizer的咨询费;百时美施贵宝(Bristol-Myers Squibb)和默克(Merck)的荣誉奖金;来自Array BioPharma、阿斯利康(AstraZeneca)、百时美施贵宝(Bristol-Myers Squibb)、Infinity、Merck、Novartis和RGenix的机构支持。M.I.R: Amgen提供临床研究资助;安进、Castle BioSciences、默克和诺华担任咨询/顾问委员会成员。国际医疗集团:百时美施贵宝、默克和辉瑞提供研究资金;百时美施贵宝和诺华的顾问角色。J.L.M:百时美施贵宝(Bristol-Myers Squibb)和罗氏(Roche)的荣誉; consultant for Merck. M.K.W.: advisory boards for Adagene, Bristol-Myers Squibb, Castle Biosciences, EMD-Serono, ExiCure, Merck, Pfizer and Regeneron. J.E.G.: consultant and/or advisory role; Merck and Regeneron. A.N.S.: research funding from Bristol-Myers Squibb, Checkmate Pharmaceuticals, Foghorn Therapeutics, Immunocore, Novartis, Pfizer, Polaris, Targovax and Xcovery; advisory board for Bristol-Myers Squibb, Immunocore and Novartis. A.D.: research funding from Apexigen, Idera and Nektar; consulting for Apexigen, Idera, Memgen, Nektar and Pfizer. S.P.P.: research funding from Bristol-Myers Squibb, Ideaya and Provectus; consulting honoraria from Cardinal Health, Castle Biosciences and Merck. M.A.D.: consultant to ABM Therapeutics, Apexigen, Array, Bristol-Myers Squibb, Eisai, GlaxoSmithKline, Pfizer, Roche/Genentech, Novartis, Sanofi-Aventis and Vaccinex; PI of research grants to GlaxoSmithKline, MD Anderson by Roche/Genentech, Merck, Myriad, Oncothyreon and Sanofi-Aventis. J.P.A.: consulting or stock ownership or advisory board for Achelois, Adaptive Biotechnologies, Apricity, BioAtla, BioNTech, Candel Therapeutics, Codiak, Dragonfly, Earli, Enable Medicine, Hummingbird, ImaginAb, Jounce, Lava Therapeutics, Lytix, Marker, PBM Capital, Phenomic AI, Polaris Pharma, Time Bioventures, Trained Therapeutix and Venn Biosciences. P.S.: consulting or stock ownership or advisory board for Achelois, Adaptive Biotechnologies, Affini-T, Apricity, BioAtla, BioNTech, Candel Therapeutics, Catalio, Codiak, Constellation, Dragonfly, Earli, Enable Medicine, Glympse, Hummingbird, ImaginAb, Infinity Pharma, Jounce, JSL Health, Lava Therapeutics, Lytix, Marker, MedImmune, Oncolytics, PBM Capital, Phenomic AI, Polaris Pharma, Sporos, Time Bioventures, Trained Therapeutix and Venn Biosciences. J.A.W.: compensation for speaker’s bureau and honoraria from Bristol-Myers Squibb, Dava Oncology, Gilead, Illumina, Imedex, MedImmune, Omniprex, PeerView and Physician Education Resource; consultant/advisory board member for AstraZeneca, Biothera Pharmaceuticals, Bristol-Myers Squibb, GlaxoSmithKline, Merck, Micronoma, Novartis and Roche/Genentech. C.A.: consulting fees from Iovance. H.A.T.: research funding from GlaxoSmithKline; research funding and consulting honoraria from Bristol-Myers Squibb, Genentech, Merck and Novartis; consulting for Boxer, Eisai, Iovance, Karyopharm and Pfizer. All other authors report no conflicts of interest.
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Mark Faries, Antoni Ribas和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1gydF4y2Ba
所有接受研究治疗的患者无事件发生的概率。gydF4y2Ba
图2无递归概率。gydF4y2Ba
一个gydF4y2Ba)所有手术患者无复发的概率。gydF4y2BaBgydF4y2Ba)基于病理完全缓解与非病理完全缓解的无复发概率(gydF4y2BaPgydF4y2Ba= 0.10)。gydF4y2Ba
扩展数据图3基线肿瘤中PD-1和LAG-3水平。gydF4y2Ba
通过CyTOF检测肿瘤浸润免疫细胞,并通过手动门控频率分析gydF4y2Ba一个gydF4y2Ba) PD-1和gydF4y2BaBgydF4y2Ba)治疗前T细胞的LAG-3水平。红色,病理反应;蓝色,病理无反应。数据均值为+/−SD;gydF4y2BaPgydF4y2Ba所示值由双尾未配对确定gydF4y2BatgydF4y2Ba-test,没有多重比较。gydF4y2BangydF4y2Ba每个组/时间点的值在每个图中都有显示。gydF4y2Ba
图4肿瘤中m2样巨噬细胞和血液中eoms + CD8+ T细胞。gydF4y2Ba
一个gydF4y2Ba) m2样巨噬细胞亚群(CD68+ HLA-DR+ CD14+ VISTA+ CD163+ CD45RO+ PD-L1+)的频率由单个实验的CyTOF数据的无监督聚类确定。gydF4y2BaBgydF4y2BaEOMES+ CD8+ T细胞的频率。从血液样本中分离出的pmcs通过流式细胞仪进行单次实验分析。数据均值为+/−SD;gydF4y2BaPgydF4y2Ba价值由双尾未配对确定gydF4y2BatgydF4y2Ba-test,没有多重比较。gydF4y2BangydF4y2Ba每个组/时间点的值在每个图中都有显示。红色表示病理反应;蓝色,无。gydF4y2Ba
扩展数据图5手动分析来自肿瘤和血液标本的CyTOF数据的门控模式。gydF4y2Ba
一个gydF4y2Ba)将肿瘤机械分离,用免疫细胞特异性抗体对细胞进行染色。通过CyTOF软件在Helios细胞仪上对标本进行分析。然后通过FlowJo软件准备细胞仪数据进行手动和无监督分析。主要细胞群被人工鉴定并报告。上面显示了一个病人标本的例子,以供参考。gydF4y2BaBgydF4y2Ba)用于流式细胞术分析血液标本的门控模式。来自患者标本的外周血单个核细胞与FMO(荧光减1)对照一起染色,并通过BD LSRFortessa细胞仪和BD FACSDiva采集软件进行分析。如上所述,通过FlowJo软件分析数据。简单地说,通过FMO(荧光减1)标本鉴定活CD3+单链,并将其门控到T细胞谱系中,并对这些谱系中的8个表型标记(BCL6、BLIMP1、CD27、CD28、cMYC、emes、ICOS、Ki67)的频率进行分析。一个例子的一个表型标记(eoms)在一个病人标本显示上面的参考。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
阿玛利亚,r.n.,波斯托,M,伯顿,E.M.gydF4y2Baet al。gydF4y2Ba新佐剂relatlimumab和nivolumab治疗可切除黑色素瘤。gydF4y2Ba自然gydF4y2Ba611gydF4y2Ba, 155-160(2022)。https://doi.org/10.1038/s41586-022-05368-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05368-8gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba