摘要gydF4y2Ba
传统的神经精神疾病缺乏脑病理的定义,但最近的工作已经证明了分子水平上的调节异常,其特征是转录组和表观遗传改变gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.在自闭症谱系障碍(ASD)中,这种分子病理学包括小胶质细胞、星形胶质细胞和神经免疫基因的上调,突触基因的下调,以及皮层基因表达梯度的衰减gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.然而,这些变化是否局限于皮质相关区域,还是更广泛的尚不清楚。为了解决这个问题,我们对725个大脑样本进行了rna测序分析,这些样本来自112个ASD患者和典型对照组的死后样本,涵盖11个皮层区域。我们发现ASD的皮层中广泛的转录组变化,呈现出从前到后的梯度,在初级视觉皮层中差异最大,与皮层区域之间典型的转录组差异的衰减相一致。单核rna测序和甲基化分析表明,这种强大的分子特征反映了细胞类型特异性基因表达的变化,特别是影响兴奋性神经元和胶质细胞。罕见和常见的asd相关遗传变异都集中在一个涉及突触信号的下调共表达模块中,而普通变异单独富集在一个上调蛋白伴侣基因模块中。这些结果强调了ASD患者大脑皮层广泛的分子变化,超出了联想皮层,广泛涉及初级感觉区域。gydF4y2Ba
主要gydF4y2Ba
与其他神经精神疾病类似,ASD的风险因素涉及大量的遗传成分,这是非常复杂和多因素的,涉及数百个风险基因gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.然而,尽管存在病因异质性,ASD的分子分析研究在大多数病例中发现了涉及额叶和颞叶皮层的转录组和表观遗传失调的一致模式gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.这是否代表了局部性,区域性或更广泛的分子病理尚不清楚。了解这些分子变化的性质和分布对于破译ASD的神经生物学基础是至关重要的。gydF4y2Ba
ASD中皮层范围的转录组变化gydF4y2Ba
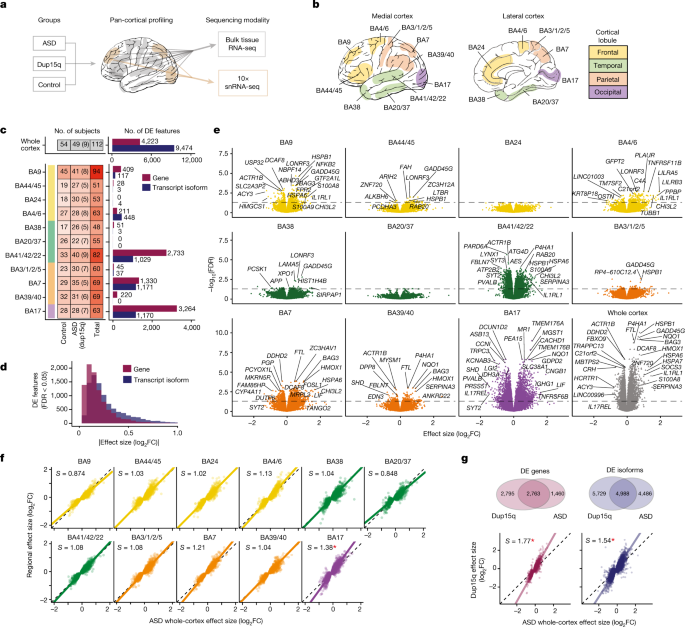
在这里,我们进行了rna测序分析(RNA-seq),以确定基因和转录本(或剪接基因亚型)在725个样本中的变化,这些样本横跨11个不同的大脑区域和所有四个皮质小叶(额叶、顶叶、颞叶和枕叶),包括多个关联和主要感觉区,来自49个特发性ASD个体和54个匹配的神经典型对照(图2)。gydF4y2Ba1得了gydF4y2Ba,扩展数据图。gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba、补充数据gydF4y2Ba1克ydF4y2Ba和方法)。与以前的工作相比gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,这意味着所分析的样本和区域数量增加了三倍多。与增加的统计力一致,我们发现了4,223个基因和9,474个转录本(错误发现率(FDR) < 0.05)在皮层范围内差异表达,与之前的分析相比显著增加gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba5gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba,扩展数据图。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba及补充资料gydF4y2Ba3.gydF4y2Ba).与基因水平相比,我们在转录本中发现了明显的差异表达信号,转录本变化在ASD中表现出比其匹配基因更大的影响(图。gydF4y2Ba1 dgydF4y2Ba扩展数据图gydF4y2Ba4gydF4y2Ba和,补充数据gydF4y2Ba2gydF4y2Ba),支持选择性剪接和异构体表达在ASD中的重要作用,与常见变异遗传力的划分一致gydF4y2Ba10gydF4y2Ba和之前的转录组分析gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,研究实验设计。11个区域通过bulk RNA-seq进行了测序,3个区域也通过单核RNA测序(snRNA-seq)进行了测序(图。gydF4y2Ba4gydF4y2Ba).gydF4y2BabgydF4y2Ba人脑皮层Brodmann区(BA)测序,图中皮层小叶颜色一致。gydF4y2BacgydF4y2Ba,按地区和诊断划分的独特个体数量(左),括号中包括额外的dup15q综合征个体数量。右,差异表达(DE)(线性混合模型FDR < 0.05)特征(基因和转录异构体)在整个皮层(上)或个别区域(下)的数量。gydF4y2BadgydF4y2Ba,在全皮层分析中,差异表达基因和异构体的效应量变化绝对值显示出来。在转录异构体水平观察到更大的效应量变化。gydF4y2BaegydF4y2Ba,火山图显示了区域内和整个皮层的最高差异表达基因。gydF4y2BafgydF4y2Ba,差分表达式效应大小(loggydF4y2Ba2gydF4y2BaFC)对4,223个皮质范围差异表达基因的个体区域与全皮质变化进行比较。斜率(gydF4y2Ba年代gydF4y2Ba)用主成分回归计算,*gydF4y2BaPgydF4y2Ba< 0.05为gydF4y2Ba年代gydF4y2Ba与通过bootstrap(方法)进行统一有显著不同。gydF4y2BaggydF4y2Ba, Top, Venn图描述了dup15q样本与特发性ASD相比在整个皮层差异表达的基因和异型的数量。底部,特发性ASD全皮质日志gydF4y2Ba2gydF4y2BaFC与dup15q全皮质测井的比较gydF4y2Ba2gydF4y2BaASD全皮质差异表达基因(左)和亚型(右)的FC。用主成分回归计算斜率。gydF4y2Ba
接下来,我们试图确定这些模式的区域一致性,方法是分别计算每个皮层区域内的差异表达,并比较区域效应量变化(loggydF4y2Ba2gydF4y2Ba折叠变化(FC))和相应的全皮层特征(图。gydF4y2Ba1 e, fgydF4y2Ba扩展数据图gydF4y2Ba3.gydF4y2Ba、补充数据gydF4y2Ba2gydF4y2Ba和方法)。尽管差异表达基因的数量差异很大,这可能反映了样本量的差异gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba1 cgydF4y2Ba),我们观察到ASD在所有11个皮层区域的转录组特征一致,与整个皮层特征相比,每个区域的效应量变化高度一致(图2)。gydF4y2Ba1 fgydF4y2Ba).我们在初级视觉皮层(BA17)观察到最大的信号,有3264个差异表达基因,其中59%与全球观察到的基因重叠(图17)。gydF4y2Ba1 c, egydF4y2Ba扩展数据图gydF4y2Ba4gydF4y2Ba及补充资料gydF4y2Ba2gydF4y2Ba).此外,与整个皮层信号相比,BA17的效应量变化显著更大,这在任何其他评估区域中都没有观察到(图2)。gydF4y2Ba1 fgydF4y2Ba和方法)。总之,这些结果证明了ASD的一致的皮层范围转录组特征,在BA17中最明显。gydF4y2Ba
接下来,我们评估了另外83个泛皮质样本中的差异基因和转录本表达,这些样本来自9名患有产妇dup15q综合征的受试者,这是一种罕见的遗传疾病,其特征是染色体15q11-q13区域的重复。Dup15q综合征是综合征性ASD最常见的形式之一,这些受试者的基因表达变化先前被证明与特发性ASD在额叶和颞叶皮层的基因变化有很强的平行性,但影响程度更大gydF4y2Ba5gydF4y2Ba.我们在检查的皮层区域广泛复制了这些先前的结果,发现dup15q和特发性ASD之间的转录组变化存在大量重叠,而且dup15q总体上表现出更大程度的基因表达失调(图2)。gydF4y2Ba1克gydF4y2Ba扩展数据图gydF4y2Ba4gydF4y2Ba及补充资料gydF4y2Ba2gydF4y2Ba).BA17在dup15q中也表现出最多的差异表达基因(扩展数据图。gydF4y2Ba4gydF4y2Ba).这些结果表明,这种罕见的遗传形式的ASD和特发性ASD共享的分子病理学广泛存在于皮层的不同区域,并且存在一些区域效应差异的共性,这两种情况除了影响高阶关联区域外,还影响感觉区域。gydF4y2Ba
弱化区域同一性gydF4y2Ba
在典型的大脑中,皮层区域可以根据基因表达的差异来区分,这些基因表达主要反映了每个区域的细胞结构、连通性和功能的可变性,其中V1是最明显的gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.我们之前观察到ASD中两个区域(额叶和颞叶)之间的这些典型基因表达差异显著减弱gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,我们在这里称之为转录组区域同一性(ARI)的衰减。这两个皮层关联区域之间基因表达差异的显著减少表明它们在ASD中发育模式、连通性和/或持续功能的改变。在这里,我们试图了解这些分子改变的程度,以确定它们是否确实是局部性的或更广泛的,涉及额外的关联或感觉区域。gydF4y2Ba
我们首先系统地对比了11个皮层区域的所有独特对(总共55个比较),使用保守的基于排列的统计方法来解释各区域样本量的差异(图2)。gydF4y2Ba2gydF4y2Ba和方法)。通过与Allen Brain Atlas中的转录组区域识别模式进行比较,我们验证了在对照组中观察到的转录组区域识别模式是稳健的gydF4y2Ba13gydF4y2Ba(扩展数据图。gydF4y2Ba5gydF4y2Ba、补充数据gydF4y2Ba4gydF4y2Ba和方法)。在排列的基础上,与对照组相比,有10对区域在ASD中表现出明显更大的ARI,使用另一种互补的、基于自举的方法,55对区域中有另外41对区域在ASD中表现出明显的衰减(图。gydF4y2Ba2 bgydF4y2Ba扩展数据图gydF4y2Ba5gydF4y2Ba、补充数据gydF4y2Ba4gydF4y2Ba和方法)。这些结果表明,在ASD中,区分皮层区域的基因表达差异显著减少,从而产生分子更均匀的皮层区域(扩展数据图)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, ASD转录组区域识别的统计学显著性差异的识别方法综述。这里以BA17与BA41/42/22的区域比较为例。左,在对照和ASD样本中计算区域间差异表达基因的数量。对,然后用一个排列的零分布来确定对照和ASD样本之间差异表达基因差异的显著性。gydF4y2BabgydF4y2BaASD中ARI的区域比较,这些比较达到一个排列gydF4y2BaPgydF4y2Ba< 0.05用一条线连接(红色刻度)。通过自举方法(方法)识别的皮质范围衰减由区域颜色(蓝色尺度;0,没有ASD衰减对;10,所有配对在ASD中都表现出衰减)。对于区域颜色,如果一个区域对在ASD中含有较少的差异表达,则该区域对被认为是衰减的。ARI基因从区域比较和排列中提取gydF4y2BaPgydF4y2Ba< 0.05(方法)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,下调(gydF4y2BacgydF4y2Ba)及上调(gydF4y2BadgydF4y2Ba) ARI基因。左上,BA17和BA4/6中的衰减转录因子(tf)。直线连接来自同一个体的配对样本,以及配对Wilcoxon符号秩检验gydF4y2BaP -gydF4y2Ba值在箱形图上方。右上,各区域ARI基因主成分1 (pc1);区域由控制中位数排序。左下和中下分别为基因本体和细胞类型富集(*FDR < 0.05)。右下,前10个减弱的转录因子;FDR代表了这些转录因子如何将BA17和BA39/40与其余9个皮层区域区分开来(方法)。转录因子结合位点的富集也被描述(bonferroni校正gydF4y2BaP -gydF4y2Ba值< 0.05为富集所需)。ExNeuron,兴奋性神经元;InNeuron,抑制性神经元;益生元,少突细胞;OPC,少突胶质细胞前体细胞;内皮细胞。gydF4y2Ba
我们观察到,在ASD表现出明显衰减的10个区域对中,有9个区域包括BA17或BA39/40后部区域之一。gydF4y2Ba2 c, dgydF4y2Ba).值得注意的是,BA17也是病例-对照基因表达差异最大的区域之一。为了确定基因表达变化是如何在这些对中分散在各个区域的,我们使用保守过滤过程来识别个体表现出ARI的代表性基因(方法和补充数据gydF4y2Ba4gydF4y2Ba).尽管这些基因普遍失调,但BA17和BA39/40这两个较靠后的区域表现出最大的变化。gydF4y2Ba2 c, dgydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).ARI基因在dup15q样本中也同样被破坏(扩展数据图。gydF4y2Ba6gydF4y2Ba),表明大脑皮层的转录组区域识别减弱在异质性ASD中是共享的。总之,这些结果表明,在ASD中,区分皮层区域的典型转录模式显著减少,某些后部区域(BA17和BA39/40)表现出特别强烈的衰减模式。gydF4y2Ba
为了研究在ASD中导致这种广泛的后显性ARI基因失调的生物学过程,我们将所有在对照组中典型地沿前后轴表达增加,但在ASD中没有的ARI基因组合在一起(ARI下调:1881个基因;无花果。gydF4y2Ba2摄氏度gydF4y2Ba),或者在对照组中沿着这条轴表达减少,但在ASD中没有(ARI上调:1695个基因;无花果。gydF4y2Ba二维gydF4y2Ba).上调和下调的两种模式在ASD中都是后方最显著的,BA17的影响最大,其次是顶叶皮层(BA39/40)。事实上,ARI基因与在这些区域检测到的差异表达基因表现出显著的重叠,远远超过在额叶区域(BA17:gydF4y2BaPgydF4y2Ba< 1.8 × 10gydF4y2Ba−67gydF4y2Ba;BA39/40:gydF4y2BaPgydF4y2Ba< 1.7 × 10gydF4y2Ba−16gydF4y2Ba;BA4/6:gydF4y2BaPgydF4y2Ba= 0.19;费雪精确测试)。ARI基因的上调组包含了一些参与皮层模式形成的转录因子,包括gydF4y2BaSOX4gydF4y2Ba,以及gydF4y2BaSOX11gydF4y2Ba,通过对投射神经元成熟的时间效应控制小鼠出生后皮层间投射神经元连接gydF4y2Ba15gydF4y2Ba.下调的ARI基因显示广泛富集神经元细胞类型特异性标记和rna处理途径,以及已知的基因gydF4y2BaETV4gydF4y2Ba结合位点(图;gydF4y2Ba2摄氏度gydF4y2Ba).值得注意的是,gydF4y2BaETV4gydF4y2Ba已知其在树突发育、连通性和可塑性中起重要作用,其表达通常在后方(BA17)高于后方(BA4/6),在ASD中显著减弱,减少了这种梯度gydF4y2Ba16gydF4y2Ba.我们通过后续的共表达网络分析进一步描述了ARI基因的失调,这进一步细化了相关的拓扑结构和通路。gydF4y2Ba
皮质范围的模块包含ASD风险基因gydF4y2Ba
接下来我们使用加权基因相关网络分析gydF4y2Ba17gydF4y2Ba(WGCNA)在所有样本中将基因划分为高水平共表达的簇,称为模块。模块将个体的转录变化组织成具有共享生物学功能或共同转录调节的簇gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba(方法)。我们共鉴定出35个基因共表达模块,可以用它们的特征基因来概括,特征基因代表了模块中基因表达的第一个主成分。ASD中9个模块下调,15个模块上调(扩展数据图。gydF4y2Ba7gydF4y2Ba及补充资料gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).我们还使用基因转录水平(异构体)量化生成了网络,这反映了可选剪接和可选启动子的使用,确定了61个转录模块(方法)。其中,39个转录模块与基因模块不重叠,其中5个在ASD中相对于对照组下调,9个在ASD中上调(扩展数据图)。gydF4y2Ba8gydF4y2Ba及补充资料gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).总共有38个模块在ASD的至少一个区域上调或下调。其中大部分可分为两大类:(1)皮层范围失调,各区域的程度相当(18个模块);或(2)跨区域呈现可变变化(13个模块)。为了支持额叶和颞叶的早期发现,dup15q变化与ASD中观察到的变化相似,但在量级上更大(扩展数据图)。gydF4y2Ba7gydF4y2Ba而且gydF4y2Ba8gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
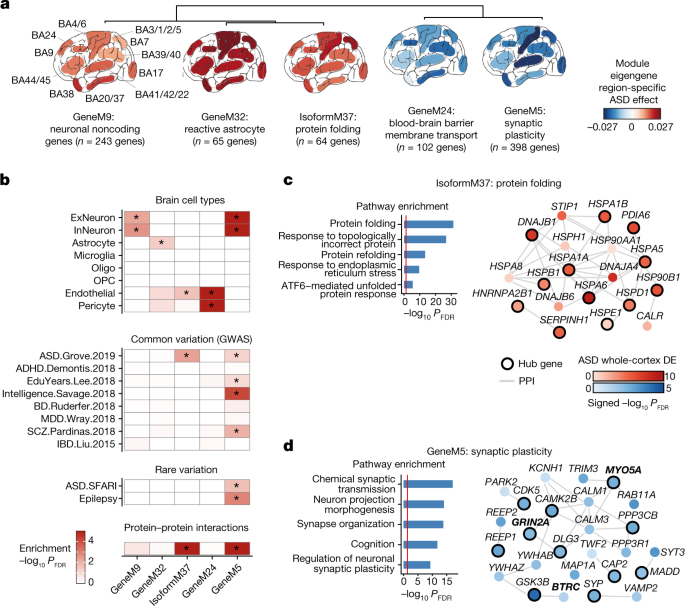
18个基因或转录模块在ASD的所有区域表现出一致的表达异常(线性混合模型,FDR < 0.05;无花果。gydF4y2Ba3gydF4y2Ba,扩展数据图。gydF4y2Ba7gydF4y2Ba而且gydF4y2Ba8gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba)包括:GeneM9,一个上调的神经元模块,显著富集非蛋白质编码基因;GeneM32,一个表达活性星形胶质细胞的强烈上调模块;GeneM24是一个下调的模块,富含参与血脑屏障功能的内皮细胞和周细胞标记基因(图2)。gydF4y2Ba3 bgydF4y2Ba扩展数据图gydF4y2Ba7gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).这些模块复制了先前在ASD中神经元变化、星形胶质细胞反应性和血脑屏障破坏的发现gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba但通过证明这些过程广泛存在于大脑皮层,而不仅仅局限于额颞叶相关区域,来扩展这些发现。gydF4y2Ba
一个gydF4y2Ba,对具有区域一致性ASD失调模式的前5个最失调基因和异构体共表达模块特征基因(模块的第一主成分)进行分层聚类。模块特征基因ASD效应被指示为每个检查的皮层区域(方法)。gydF4y2BangydF4y2Ba表示每个模块中基因或异构体的数量。gydF4y2BabgydF4y2Ba−日志gydF4y2Ba10gydF4y2Ba(FDR)用于细胞型,全基因组关联研究(GWAS),罕见变异和蛋白质-蛋白质相互作用富集的模块描述gydF4y2Ba一个gydF4y2Ba.GWAS引用(左侧空白):ASD.Grove。2019年,裁判。gydF4y2Ba21gydF4y2BaADHD.Demontis。2018年,裁判。gydF4y2Ba39gydF4y2Ba;EduYears.Lee。2018年,裁判。gydF4y2Ba40gydF4y2Ba;Intelligence.Savage。2018年,裁判。gydF4y2Ba41gydF4y2Ba;BD.Ruderfer。2018年,裁判。gydF4y2Ba42gydF4y2Ba;MDD.Wray。20.18,ref.43gydF4y2Ba;SCZ.Pardinas。2018年,裁判。gydF4y2Ba44gydF4y2Ba;IBD.Liu。20.15,ref.45gydF4y2Ba.*显著富集(细胞型、稀有变异和蛋白-蛋白相互作用富集FDR < 0.05, GWAS富集FDR < 0.1)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,对于ASD gwas富集模块,IsoformM37 (gydF4y2BacgydF4y2Ba)和GeneM5 (gydF4y2BadgydF4y2Ba)、顶级基因本体术语(左)和与其他模块基因的基因产物参与蛋白-蛋白相互作用的中心基因(与模块特征基因相关性最高的前20个基因中的模块基因)及其PPI伙伴(右)被描述。节点颜色是有符号的-loggydF4y2Ba10gydF4y2Ba(FDR)为全皮质ASD效应,边缘为直接PPIs,中心基因以黑色轮廓表示。SFARI数据库gydF4y2Ba22gydF4y2Ba基因符号加粗。gydF4y2Ba
显示皮质范围失调的两个模块- genem5和isoformm37 -显示了asd相关的常见遗传变异的显著富集gydF4y2Ba21gydF4y2Ba(无花果。gydF4y2Ba3罪犯gydF4y2Ba).GeneM5在ASD中表达下调,包含许多参与突触囊泡功能、细胞骨架和突触可塑性的神经元基因,并与下调的突触模块CTX有明显重叠。M16,之前由Parikshak等人确定。gydF4y2Ba5gydF4y2Ba在额叶和颞叶皮层(图;gydF4y2Ba3 dgydF4y2Ba及补充资料gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).除了常见的遗传变异外,GeneM5还显著富集含有与ASD相关的罕见从头蛋白干扰突变的基因,包括高置信风险基因gydF4y2BaGRIN2AgydF4y2Ba,gydF4y2BaMYO5AgydF4y2Ba而且gydF4y2BaBTRCgydF4y2Ba22gydF4y2Ba(补充数据gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba和方法)。GeneM5在皮层兴奋性和抑制性神经元细胞类型标记中富集gydF4y2Ba23gydF4y2Ba(扩展数据图。gydF4y2Ba7gydF4y2Ba),将它们确定为ASD中罕见和常见遗传风险的汇合点。相比之下,IsoformM37在ASD常见遗传风险变异(但不是罕见突变)中富集,在ASD中上调,并包含参与热休克反应和蛋白质折叠的基因(图2)。gydF4y2Ba3 a, cgydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).据我们所知,这是第一个与已知ASD风险变异相关的ASD转录组特征上调的报道,它暗示了ASD中蛋白质稳态失调。gydF4y2Ba
地区差别gydF4y2Ba
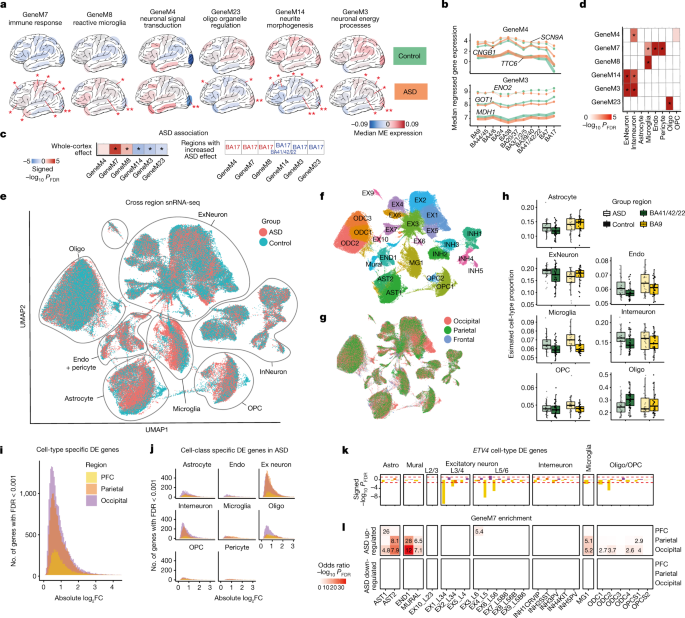
我们发现13个模块在ASD中表现出区域性的调节异常模式(图2)。gydF4y2Ba4得了gydF4y2Ba扩展数据图gydF4y2Ba7gydF4y2Ba、补充数据gydF4y2Ba6gydF4y2Ba和方法),所有这些在典型神经样本中也表现出前后梯度的表达。然而,对于已知的ASD遗传风险变异,这些模块都没有显著丰富。在BA17中观察到最明显的变化,有四个模块表现出与ASD的显著关联,仅在该区域可检测到。这些包括GeneM30,一个OPC模块的中心基因包括gydF4y2BaSOX4gydF4y2Ba而且gydF4y2BaSOX11gydF4y2Ba.另一个是GeneM4,是一个抑制性神经元模块,包含许多对各种细胞内信号传递和成熟过程重要的基因,例如gydF4y2BaSCN9AgydF4y2Ba(无花果。gydF4y2Ba4模拟gydF4y2Ba及补充资料gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).GeneM4显著富集长基因间非编码rna (lincRNAs)和先前报道的与发育相关的上调通路相关的基因模块gydF4y2Ba5gydF4y2Ba和信号gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba在ASD中,尽管我们在BA17中首次观察到这种效应(扩展数据图。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,调节失调最严重的6个模块,其调节失调模式具有区域差异。由诊断分层的模块特征基因(ME)的中位数被描述为每个检查的皮层区域。* ASD存在显著的区域特异性调控异常;与全皮质效应相比,**个区域的效应显著增加(方法)。gydF4y2BabgydF4y2Ba, GeneM4(上)和GeneM3(下)前3个枢纽基因的中位数回归基因表达。gydF4y2BacgydF4y2Ba中描述的模块的全皮层ASD效应gydF4y2Ba一个gydF4y2Ba(* fdr < 0.05)。底部,与全皮层效应相比,区域的效应显著增加gydF4y2Ba一个gydF4y2Ba列出。gydF4y2BadgydF4y2Ba,区域可变模块的单元格类型富集。gydF4y2BaegydF4y2Ba,来自约250,000个细胞的snRNA-seq数据的统一流形近似和降维(UMAP)图,这些细胞包含匹配的ASD和神经典型对照样本,分布在额叶、顶叶和枕叶皮质,根据诊断着色。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,以特定细胞类型着色的UMAP图(gydF4y2BafgydF4y2Ba)和皮层起源区(gydF4y2BaggydF4y2Ba).gydF4y2BahgydF4y2Ba,广泛的神经细胞类型比例从匹配的大量甲基化阵列数据去卷积。在ASD中未观察到fdr显著性细胞比例变化。gydF4y2Ba我gydF4y2Ba细胞类型特异性差异表达基因的区域特异性效应量变化(FDR < 0.001),其中BA17再次显示出最大的转录组变化。gydF4y2BajgydF4y2Ba差异表达基因显示为广泛的细胞类别。gydF4y2BakgydF4y2Ba,gydF4y2BaETV4gydF4y2Ba显示ASD中多种细胞类型的后显性下调。gydF4y2BalgydF4y2Ba在ASD中,免疫模块GeneM7在细胞类型特异性差异表达基因中显示后显性富集。gydF4y2Ba
12个区域变量模块显示包含ARI信号的基因显著富集,表明这些模块有助于在典型神经对照中观察到的转录组区域特征,但在ASD中减弱(扩展数据图)。gydF4y2Ba7gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).在典型的受试者中,这些模块中的6个在后部区域相对于前部区域表达更高,并且在整个ASD皮层中被观察到下调(图2)。gydF4y2Ba4模拟gydF4y2Ba扩展数据图gydF4y2Ba7gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).其中包括GeneM3,这是一种丰富的神经元模块,用于能量产生和高度依赖能量的神经元过程,如囊泡运输和释放。在典型的受试者中,四个模块在前区相对于后区表达更高,在ASD中表现出皮质范围的上调,减弱了这种模式gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba4模拟gydF4y2Ba扩展数据图gydF4y2Ba7gydF4y2Ba及补充资料gydF4y2Ba6gydF4y2Ba).其中包括GeneM8,这是一种微胶质细胞模块,包含参与免疫信号传递和吞噬作用的基因;GeneM7是一种包含NF-κB和干扰素反应通路等基因的免疫应答模块。尽管先前报道过ASD中神经元和少突胶质细胞的下调以及免疫和小胶质细胞的上调gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba这些发现表明,这种调节异常在大脑皮层广泛存在,在后部区域的程度增加,这种模式在BA17中最为明显。gydF4y2Ba
接下来,我们试图确定所观察到的跨区域ASD影响幅度变化的驱动因素。众所周知,BA17是人脑中神经元密度最大的区域,与其他皮质区域相比,BA17的3/4层(L3/4)厚度显著扩大gydF4y2Ba18gydF4y2Ba.类似地,在小鼠和灵长类动物中观察到神经元密度增加的前后梯度gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.我们认为神经元密度或层流厚度的区域差异可能导致ASD效应的区域差异。在人脑中,跨多个大脑区域的区域神经元密度还没有被定量表征,但在非人类灵长类动物的一些区域中已经建立了这种梯度gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.因此,我们将基因模块中区域特异性ASD效应量变化与灵长类动物中测量的区域神经元核密度进行了比较gydF4y2Ba25gydF4y2Ba在物种间的六个匹配区域。我们观察到L3/4厚度、神经元密度与ASD中几个模块失调的效应大小之间存在显著相关性(补充数据)gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
细胞类型特异性表达梯度gydF4y2Ba
这些观察促使我们对一组受试者进行snRNA-seq,以帮助评估基因表达的变化在多大程度上反映了ASD中细胞比例的变化,以及不同的神经细胞类型是如何导致通过体块RNA-seq识别的ASD转录组失调的区域差异的。gydF4y2Ba4比gydF4y2Ba扩展数据图gydF4y2Ba9gydF4y2Ba、补充数据gydF4y2Ba8gydF4y2Ba和方法)。我们从6个表现出强烈差异表达签名的ASD个体和6个匹配的对照组中测序了超过250,000个核,这些核横跨额叶、顶叶和枕叶皮质,具有匹配的bulk RNA-seq。从这些数据中,我们确定了26个不同的细胞簇,它们代表了枕叶皮层中所有预期的皮层细胞类型和区域特异性兴奋性细胞类型。gydF4y2Ba4 fgydF4y2Ba、补充数据gydF4y2Ba8gydF4y2Ba和方法)。正如我们从非人灵长类动物的数据中所预期的那样,我们观察到,与额叶(前额叶皮层(PFC))和/或顶叶区域相比,对照组和ASD受试者枕叶区域的浅表兴奋性神经元(EX1 L3/4)比例增加了5%以上。gydF4y2Ba4 f, ggydF4y2Ba及补充资料gydF4y2Ba8gydF4y2Ba).这些结果与已知BA17 L3/4皮质区较其他皮质区厚度增加一致gydF4y2Ba28gydF4y2Ba.gydF4y2Ba
接下来,我们使用snRNA-seq数据进行了细胞组成分析,以确定ASD中细胞类型比例是否发生了变化,并可以解释所观察到的潜在大量RNA-seq特征。尽管有名义上asd相关的星形胶质细胞(AST1)的增加和下层兴奋性神经元(EX7和EX8)比例的减少,这些变化是小幅度的,反映了名义上显著的趋势(fdr校正)gydF4y2BaP -gydF4y2Ba> 0.18;扩展数据图。gydF4y2Ba9gydF4y2Ba及补充资料gydF4y2Ba8gydF4y2Ba).为了在更大的队列中证实这些结果(gydF4y2BangydF4y2Ba=每组36个),我们进一步使用大量额叶和颞叶皮层甲基化分析数据进行细胞类型反褶积(CTD),这些数据具有来自人脑单细胞甲基化组分析的细胞类型特异性特征gydF4y2Ba29gydF4y2Ba.甲基化CTD分析检测到在ASD中PFC小胶质细胞名义上增加,颞叶少突胶质细胞减少,但在FDR校正中没有细胞比例的改变(图2)。gydF4y2Ba4 hgydF4y2Ba及补充资料gydF4y2Ba7gydF4y2Ba).最后,为了直接评估细胞类型比例如何影响我们在大量RNA-seq数据中观察到的ASD效应,我们比较了ASD日志gydF4y2Ba2gydF4y2Ba从我们原始的线性模型中计算的fc,其中甲基化CTD细胞类型比例为协变量(扩展数据图。gydF4y2Ba9gydF4y2Ba、补充数据gydF4y2Ba7gydF4y2Ba和方法)。ASD日志之间的Spearman相关性gydF4y2Ba2gydF4y2BaCTD有或没有甲基化的fc较高(gydF4y2BaρgydF4y2Ba> 0.7;扩展数据图。gydF4y2Ba9gydF4y2Ba及补充资料gydF4y2Ba7gydF4y2Ba),表明细胞类型比例对我们通过大量RNA-seq数据观察到的asd相关变化没有显著影响。虽然这些结果可能指出ASD中皮层细胞类型比例的一些微妙变化,但细胞比例的变化不能解释在体RNA-seq中观察到的广泛的转录组特征。gydF4y2Ba
另一种解释是,与ASD相关的大量转录组特征和模块主要反映细胞内类型的基因表达变化,这些变化在后部区域最容易检测到。为了利用snRNA-seq数据评估这一点,我们计算了额叶、顶叶和枕叶区域ASD中细胞类型特异性的差异基因表达签名(方法)。在这里,我们再次观察到一个显著的区域梯度,在枕部和顶骨细胞类型中观察到的差异表达基因是PFC的三到四倍(gydF4y2BangydF4y2Ba=在FDR<0.001时,26个细胞簇中分别有23,144,17,042和5,235个基因差异表达;无花果。gydF4y2Ba4我gydF4y2Ba、补充数据gydF4y2Ba8gydF4y2Ba和方法)。这种模式在向下采样之后是一致的,以确保在比较中相同的细胞数量。大多数差异表达变化来自不同区域的兴奋性神经元,枕叶的兴奋性神经元类别总体上表现出最大的差异表达信号,无论是就差异表达基因的数量还是效应大小而言(图2)。gydF4y2Ba4 i, jgydF4y2Ba及补充资料gydF4y2Ba8gydF4y2Ba).作为一个例子,我们观察到转录因子gydF4y2BaETV4gydF4y2Ba-体rna -seq中的ARI基因之一在多种不同的枕骨细胞类型中显示出显著的下调,包括兴奋性神经元和少突胶质细胞(图2)。gydF4y2Ba4 kgydF4y2Ba及补充资料gydF4y2Ba8gydF4y2Ba).最后,我们发现了与大量RNA-seq共表达发现的显著重叠,96个基因和异型模块中的90个在细胞类型特异性差异表达基因(fdr校正)中表现出显著富集gydF4y2BaPgydF4y2Ba< 0.05, Fisher精确检验;补充数据gydF4y2Ba8gydF4y2Ba和方法)。例如,ASD风险基因庇护模块GeneM5在21个细胞类别的细胞类型特异性差异基因表达信号中被强烈富集,特别是包括在多个少突胶质细胞和兴奋性神经元亚型中发现的下调基因。同样,ASD gwas富集热休克亚型模块(IsoformM37)显示出几乎所有细胞类型的上调基因显著重叠。这些富集模式也观察到区域特定模块。例如,后显性免疫模块GeneM7在所有主要的神经胶质细胞类型中富集ASD差异表达信号,具有后显性富集模式(图2)。gydF4y2Ba4 kgydF4y2Ba).gydF4y2Ba
因此,通过执行多区域snRNA-seq和CTD,我们表明预测的细胞类型比例以及细胞类型特异性基因表达谱在ASD大脑皮层中受到影响。值得注意的是,我们发现细胞类型特异性的转录组失调对体RNA-seq观察到的变化有很大的影响,而细胞类型比例的影响是微妙的(扩展数据图)。gydF4y2Ba9gydF4y2Ba及补充资料gydF4y2Ba7gydF4y2Ba而且gydF4y2Ba8gydF4y2Ba).虽然细胞类型特异性的转录组变化和细胞类型比例变化都有助于通过体块RNA-seq观察到的ASD基因表达模式,但我们的分析表明,细胞类型特异性的基因表达改变解释了大部分观察到的体块组织基因表达变化。gydF4y2Ba
讨论gydF4y2Ba
这里提出的发现极大地完善了我们对ASD分子病理学的理解,超越了先前在额叶和颞叶观察到的“下调神经元”和“上调胶质细胞/免疫”功能类别gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.我们发现ASD的基因和转录本表达变化发生在大脑皮层,影响许多神经细胞类型和特定的生物学过程(扩展数据图)。gydF4y2Ba10gydF4y2Ba),从高阶联想区域延伸到初级感觉区域,最显著的是BA17gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.我们发现,最近观察到的基因表达信号上调,反应性星形胶质细胞和下调血脑屏障膜运输gydF4y2Ba1克ydF4y2Ba存在于ASD的皮质范围内。令人惊讶的是,ASD中最深刻的基因表达变化是在初级视觉皮层(BA17)中观察到的。有趣的是,在主要感觉区域观察到的重大变化可能与ASD中广泛存在的感觉处理差异有关,这种差异如此普遍,以至于已被列入DSM-5诊断标准gydF4y2Ba31gydF4y2Ba.gydF4y2Ba
我们发现,上调的免疫反应和反应性小胶质细胞基因,以及下调的神经突形态发生和神经元能量通路基因,不仅在ASD中受到皮层范围的影响,而且还表现出反映皮层细胞结构基本要素的区域梯度。值得注意的是,ASD中区域差异表达变化的幅度与ARI中观察到的模式相似,与它们代表的共同潜在生物学过程的表现一致。考虑到这些结果,以及我们对ASD皮层普遍存在的神经元失调的观察,未来的工作应该确定ASD风险基因的变化如何影响皮层模式和连通性。这一点尤其突出,因为ASD中的ARI可能是皮层实现的早期发育改变的表现,这既涉及细胞内在因素(例如,遗传或表观遗传调节程序),也涉及对外部信号的反应,如形态发生梯度和丘脑输入gydF4y2Ba27gydF4y2Ba.考虑到区域细胞结构,局部电路和大脑远程连接之间的联系gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,简约主义表明,除了发展模式的贡献gydF4y2Ba5gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,转录组区域同一性的减弱反映了局部神经元回路功能的变化,以及广泛传播的突触稳态的变化gydF4y2Ba32gydF4y2Ba.这得到了观察结果的支持,即代表突触可塑性基因的GeneM5共表达模块在ASD中皮层范围内下调。此外,GeneM5富集了常见和罕见的ASD相关风险变异基因,这与该模块的下调在ASD中具有因果作用一致。虽然单一的死后快照无法区分上述机制,但我们的结果为他们进一步的实验研究提供了强有力的基础,例如在早期发育期间对人脑的泛皮层细胞类型特异性基因组分析gydF4y2Ba34gydF4y2Ba以及开发能够概括区域特征的类器官系统。gydF4y2Ba
对这些结果的解释应考虑若干技术和生物学因素。所使用的样本来自不同种类的死后皮层组织,代表了年龄在2至68岁之间的广泛性别受试者。使用严格的方法来解释生物学和技术上的可变性,确保这里报告的结果是保守的和可推广的。为了解决细胞分辨率和皮层区域分离变异性的问题,我们进行了snRNA-seq,进一步加深了我们对ASD转录组失调区域变异的理解。然而,snRNA-seq实验通常比批量RNA-seq实验具有更少的唯一样本,并且snRNA-seq细胞类型比例与真实细胞类型比例的可比性目前尚不清楚gydF4y2Ba35gydF4y2Ba.使用单细胞RNA-seq方法定量估计转录本也具有挑战性,而这仍然是大块组织RNA-seq的优势,特别是与网络分析相结合时gydF4y2Ba36gydF4y2Ba.利用这一点,我们随后确定了一个上调的转录特异性共表达模块,富含ASD GWAS变体,首次暗示蛋白质折叠功能障碍可能是导致ASD因果机制的途径。值得注意的是,蛋白稳态上调也与唐氏综合症有关gydF4y2Ba37gydF4y2Ba类似的热休克机制已被确定为结节性硬化症复合体的潜在药物靶点gydF4y2Ba38gydF4y2Ba这表明这可能是多种神经发育障碍中受影响的生物过程。采用具有更大的细胞分辨率的方法将是必要的,以进一步细化这里提出的特定皮层细胞类型的结果。随着我们寻求对ASD神经病理学的全面了解,未来整合不同生物数据来源的方法——包括这一覆盖皮层的转录组资源——来确定ASD风险基因如何影响大脑将是至关重要的。gydF4y2Ba
方法gydF4y2Ba
RNA-seq的样本采集和制备gydF4y2Ba
死后大脑皮层样本来自哈佛脑库,作为自闭症脑网项目的一部分,前身是自闭症组织项目(ATP),以及马里兰大学脑库(UMDB)。每个脑库都遵循样本采集协议,在采集前对样本进行去识别,从而免除IRB审查。共有842个样本来自ASD或dup15q综合征患者和非精神病学对照组(112个独特的受试者),横跨11个皮质区域,包括所有主要的皮质叶-额叶:BA4/6, BA9, BA44/45, BA24;颞部:BA38、BA41/42/22、BA20/37;顶叶:ba3 / 1/2/3 /5、BA7、BA39/40;枕骨ba17获得。这些样本包括Parikshak等人(2016年)先前发表的253个样本。gydF4y2Ba5gydF4y2Ba来自BA9和BA41/42/22和/或Gandal等人(2018)gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba5gydF4y2BaBA9, BA4/6和BA41/42/22。自闭症诊断访谈修订版(ADIR)在30名受试者中确认了ASD诊断。其余19例患者的诊断以临床病史为依据。获得了其他具有“NCTL”诊断的样本(天使综合征、某些CNVs或癫痫-但不包括ASD的样本)并进行了测序,但这些样本最终没有用于本文的分析(但它们包含在本工作的原始数据文件中)。冷冻的大脑样本储存在−80°C。为了从这些样品中提取RNA,在脱水解剖室的干冰上从感兴趣的皮层区域解剖大约50-100毫克的组织,以减少样品解冻和/或湿度的降解影响。然后使用miRNeasy试剂盒(Qiagen)进行无修饰的RNA分离。对于每个RNA样本,使用安捷伦生物分析仪上的RNA完整性编号(RIN)对RNA质量进行量化。gydF4y2Ba
RNA-seq和RNA数据处理gydF4y2Ba
BA9和BA41/42/22样品的初始测序按所述分三批进行gydF4y2Ba5gydF4y2Ba.对于这些批次,从总RNA开始,核糖体RNA (rRNA)被耗尽(RiboZero Gold, Illumina),并使用TruSeq v2试剂盒制备文库(Illumina)来构建非链文库。其余样本(BA9和BA41/42/22的额外脑区和技术重复)在三个新批次中进行测序,使用TruSeq搁浅总RNA样本制备试剂盒(RiboZero Gold, Illumina)制备链特异性文库。所有的样本库都使用Illumina TruSeq条形码随机组合成24个样本。每个通道在Illumina HiSeq 2500或4000仪器上进行5次测序,使用高输出模式,标准化学和协议,对50、69或100 bp的末端读取(读取长度随批次而异),以达到7000万次读取的目标深度(见扩展数据图)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
测序后,从所有批次(包括Parikshak et al。gydF4y2Ba5gydF4y2Ba样品)经过相同的处理管道。首先,FastQC对FASTQ文件进行评估gydF4y2Ba46gydF4y2Ba(v0.11.2),以验证质量足以进行进一步处理。FASTQ文件随后与人类参考基因组(GRCh37gydF4y2Ba47gydF4y2Ba合奏v75)与STARgydF4y2Ba48gydF4y2Ba(v2.5.2b)。Picard工具(v2.5.0)与生成的BAM文件一起使用,除了STAR收集的质量度量外,还收集了各种读取质量度量。verifyBAMIDgydF4y2Ba49gydF4y2Ba也与这些BAM文件以及Parikshak等人的已知样本基因型一起使用。gydF4y2Ba5gydF4y2Ba以验证所有BAM文件的样例标识是否正确。此外,的表达gydF4y2BaXISTgydF4y2Ba(一种女性特异性基因)被评估为有助于样本身份验证。最后,RSEMgydF4y2Ba50gydF4y2Ba(v1.3.0)用于定量(Gencode .gydF4y2Ba51gydF4y2Ba释放25lift37)以获得基因和转录本水平的预期阅读计数。gydF4y2Ba
预期的基因和转录本阅读计数经过几个处理步骤,为下游分析做准备,主要使用RgydF4y2Ba52gydF4y2Ba.首先,从计数中获得每百万计数(CPM),用于基因和转录本过滤。筛选基因和转录本,使至少30%的样本中CPM > 0.1的基因和转录本被保留。去除有效长度(RSEM测量)小于15 bp的基因和转录本。转录本被另外过滤,使所有转录本在基因水平分析中与基因相对应。通过这些过滤器的剩余基因(24,836)和转录本(99,819)的计数在limma中使用limma-trend方法进行归一化gydF4y2Ba53gydF4y2BaR包。简而言之,limma-trend方法通过获取日志来获得规范化表达式数据gydF4y2Ba2gydF4y2Ba(CPM)的读计数,并对样本读深度方差进行调整。用CQN计算的偏移值gydF4y2Ba54gydF4y2Ba在标准化过程中,还考虑了读定量中的GC含量偏差和基因/转录本有效长度偏差。有了这些归一化表达数据,样本异常值在每个测序批中由皮质叶(额叶、顶叶、颞叶和枕叶)组识别(1)具有绝对值gydF4y2BazgydF4y2Ba-对于前10个表达式主成分中的任何一个,得分都大于3;(2)样本连通性得分小于- 2。使用WGCNA中的fundamentalNetworkConcepts函数计算样本连通性gydF4y2Ba17gydF4y2BaR包,以样本双权中相关的带符号邻接矩阵(软实力为2)作为输入。该过程识别出34个异常值,最终得到808个样本(341个对照,384个ASD和83个dup15q),这些样本被继续分析。gydF4y2Ba
在皮质范围内评估ASD差异表达基因和转录本gydF4y2Ba
所有后续分析的线性模型描述在gydF4y2Ba补充的方法gydF4y2Ba.的limmagydF4y2Ba53gydF4y2BaR包用于识别ASD中特定区域和皮层范围内的差异表达基因和转录本,控制已知的生物学和测序相关技术协变量。生物协变量包括:诊断、地区、测序批次、性别、血统、年龄和年龄平方。技术协变量列在gydF4y2Ba补充的方法gydF4y2Ba.limma::duplicateCorrelation函数用于解释来自同一主题的多个大脑区域的样本的非独立性。对于区域特异性和全皮质效应,fdr校正的基因或转录本gydF4y2BaPgydF4y2Ba-值<0.05为明显失调。通过这种方法也建立了Dup15q区域特异性和全皮质调节异常。性别、年龄和年龄平方的固定效应也通过全基因和转录本模型获得(补充数据gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
为了比较不同区域ASD转录组特征的大小,我们试图计算ASD效应量线性回归的斜率(loggydF4y2Ba2gydF4y2BaFC)在全皮质和区域比较中的变化gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba1 egydF4y2Ba).然而,线性回归斜率依赖于响应的(任意)排序(gydF4y2BaYgydF4y2Ba)和预测器(gydF4y2BaXgydF4y2Ba)变量,这两个变量的估计都有误差,我们发现在实践中,斜率可以根据这个顺序发生很大的变化。为了避免这个问题,我们使用了总最小二乘回归(也称为正交回归),它提供了一个对预测器和响应变量的选择不变的斜率估计,正如我们之前发表的那样gydF4y2Ba6gydF4y2Ba(见gydF4y2Ba补充的方法gydF4y2Ba).gydF4y2Ba
转录组区域特征分析gydF4y2Ba
为了用我们基于排列的方法识别所有55对皮层区域之间的差异表达基因和转录本,使用了只包含受试者随机效应和诊断和区域固定效应(以及模型残差)的回归基因表达数据集。这个回归数据集是用“lmerTest”创建的gydF4y2Ba55gydF4y2Ba通过从每个基因中减去技术协变量和除受试者、诊断和区域外的所有生物协变量的影响,在R中包装,只留下随机截距、这三个剩余的生物协变量效应和残差。通过以下过程建立了ASD中每对区域之间差异表达基因的显著衰减(转录组区域身份差异的减少)。(1)提取区域对中包含每个区域的ASD和对照主题用于分析。(2) ASD组和对照组分别采用配对Wilcoxon符号秩检验计算各区域间差异表达基因的数量。具有fdr校正的基因gydF4y2BaPgydF4y2Ba-value < 0.05为差异表达。(3)计算ASD与对照组之间区域差异表达基因数量的差异(“真实”差异)。(4)生成ASD与对照组不同区域差异表达基因差异的排列分布,以测试“真实”差异。每个排列(总共10,000个)随机分配“ASD”和“对照”状态给受试者,但保持ASD和对照受试者的数量与ASD和对照受试者的真实数量一致。(5)双尾gydF4y2BaPgydF4y2Ba-value是通过对排列分布测试“真”差值得到的。如果进行区域比较gydF4y2BaPgydF4y2Ba-value < 0.05, ASD区域间差异表达基因数量少于对照组,则认为ASD区域间比较显著减弱。否则,ASD的区域比较被认为是过度模式。用转录水平的回归基因表达数据重复此过程(同样,仅包含受试者的随机效应和诊断和区域的固定效应,以及模型残差),以确定在转录水平上ASD中转录组特征的改变。gydF4y2Ba
先前描述的排列方法旨在识别ASD中转录组区域特征的差异。重要的是,这种方法不适用于评估跨区域对和诊断的区域间差异表达基因的预期数量的方差,因为ASD和对照受试者的数量在不同区域对中是不同的。为了检验这一点,我们还实现了一个基于引导的方法。对于每个区域比较,我们将子集划分为10对ASD和对照受试者(选择10对,因为每个区域比较都至少有这么多受试者)。在细分时,受试者被删除,以便其余受试者的年龄最接近该区域比较可用样本的中位数年龄。然后采用自举方法分别计算对照组和ASD受试者区域间差异表达基因的数量(所有基因的Wilcoxon检验,FDR < 0.05)。在10,000个自举后,对照和ASD分布与Wilcoxon检验进行比较,以确定是否存在显著的区域特性衰减(55个区域对Wilcoxon检验比较自举中的差异表达基因分布的FDR < 0.05)。用于排列方法的相同的回归表达式数据集被用于这个自举分析。任何区域比较中,ASD区域间差异表达基因的数量少于对照组,fdr校正gydF4y2BaPgydF4y2Ba-value < 0.05,认为ASD减弱。gydF4y2Ba
为了验证我们对对照区域对之间差异表达基因数量的自主估计,我们将这些估计与艾伦大脑图谱的估计进行了比较gydF4y2Ba13gydF4y2Ba,这是可供公开比较的最佳作品。Allen Brain Atlas区域与Brodmann区域相匹配(补充数据gydF4y2Ba4gydF4y2Ba),并提取匹配的区域对与本工作进行比较。当艾伦大脑图谱中有两个或两个以上的区域对与一个区域对匹配时,在整个艾伦大脑图谱区域对中取平均值。一个gydF4y2BaPgydF4y2Ba与Allen Brain Atlas相比,本工作中获得的对照组区域间差异表达基因数量的关联值是通过线性模型(皮质范围自举平均值~ Allen Brain Atlas平均值)计算得出的。gydF4y2Ba
我们应用了严格的筛选过程,从上述排列程序鉴定的每个显著减弱的区域比较中鉴定出高可信度的ARI基因。首先,对于每个减弱的区域比较,我们提取了在10,000个排列中每个标记为对照的受试者中被确定为区域差异表达的基因。然后,我们计算了对照受试者中成对区域之间真正差异表达的每个基因在各自的排列组中存在的次数(可能从0到10,000次出现)。在每个减弱的区域比较中,那些“真正的”差异表达基因在各自排列中小于95%的基因被保留为ARI基因。对于每组ARI基因(共10个),每个基因都匹配到其在对照组中表达较高的区域。成对的Wilcoxon符号秩gydF4y2BaPgydF4y2Ba在对照组(用于排列分析的对象)中为这些基因识别的-值也被提取出来,并在补充数据中共享gydF4y2Ba4gydF4y2Ba.gydF4y2Ba
ARI基因组(ARI下调基因,其中BA17和BA39/40相对对照组高表达;ARI上调基因,即BA17和BA39/40中相对于对照中其他区域低水平表达的基因)是通过在所有10个已识别的asd减弱区域比较中取并(无重复),并根据跨区域的基因表达谱将基因分为两组来创建的。该过程的详细信息请参见gydF4y2Ba补充的方法gydF4y2Ba,以及函数注释过程。gydF4y2Ba
基于网络的功能表征gydF4y2Ba
使用WGCNA的标准工作流gydF4y2Ba17gydF4y2Ba如Parikshak等人先前所述。gydF4y2Ba5gydF4y2Ba甘达尔等人。gydF4y2Ba1克ydF4y2Ba(稍作修改)鉴定基因和转录本共表达模块。关于网络形成、模块识别和模块功能描述的详细信息在gydF4y2Ba补充的方法gydF4y2Ba.gydF4y2Ba
snRNA-seqgydF4y2Ba
冷冻的大脑样本被放置在脱水解剖室的干冰上,以减少样本解冻和/或湿度的降解影响。切片约50 mg皮层,确保特定的灰质-白质边界。组织切片在无rnase的条件下,用轻洗剂在冰上使用匀浆机进行均质,通过40 μ m过滤器过滤,并在1000℃下离心gydF4y2BaggydF4y2Ba在4℃下加热8分钟。然后在4°C下,通过两部分微梯度(30%/50%)过滤球团核20分钟。干净的核从碎片中被压成颗粒。再用PBS/1%BSA/RNase洗涤细胞核两次,以500度旋转gydF4y2BaggydF4y2Ba5分钟。细胞质量检查(形状,颜色和膜完整性)和伯爵夫人II仪器计数。然后将它们装载到10X基因组学平台上,分离单核并生成文库,用于在NovaS4或NovaS2 Illumina机器上进行RNA测序。gydF4y2Ba
测序完成后,使用Cell Ranger软件(10X Genomics)制备fastq文件,将reads对准人类GRCh38 pre-mRNA基因组,按细胞基质生成每个文库的基因。Pegasus (v.1.4.0)被用于严格过滤单元格,删除双联,将所有库集成在一起并批量更正。如果细胞表达的基因超过6000个或少于750个,或者线粒体测序读数超过10%,就会被移除。使用65台pc, Harmony(作为Pegasus套件的一部分)用于集成和批处理库,执行Louvain聚类以聚类单元并使用UMAP可视化生成的集群gydF4y2Ba56gydF4y2Ba.基于UMAP可视化的已知标记基因的表达和无偏基因标记分析来注释细胞类型(补充数据)gydF4y2Ba8gydF4y2Ba).典型基因是根据小鼠和人类研究以及已发表的参考图集富集基因选择的gydF4y2Ba23gydF4y2Ba,gydF4y2Ba57gydF4y2Ba.gydF4y2Ba
对于snRNA-seq数据的细胞组成分析,计算每个样本的细胞分数,然后进行中心对数比(clr)转换,这说明了组成数据,并且值相对于几何平均值进行解释gydF4y2Ba58gydF4y2Ba.采用重复测量方差分析(repeated-measures ANOVA)来评估群体水平的显著性,控制区域、性别、年龄、文库大小、nGene和百分率(percent_mito)等固定效应,对受试者随机影响。使用NEBULA R包(v1.2.0)中实现的负二项式混合模型评估差异表达gydF4y2Ba59gydF4y2Ba.我们使用了一个模型矩阵~诊断+年龄+性别+ nGene +百分比,其中定量数据是按比例缩放的。过滤后的原始计数作为输入,并使用NEBULA-LN方法(其他选项使用默认值)。最后通过Benjamini-Hochberg校正确定差异调控基因gydF4y2BaPgydF4y2Ba值。gydF4y2Ba
甲基化CTD分析gydF4y2Ba
CTD的计算使用匹配样本的大块甲基化阵列数据gydF4y2Ba60gydF4y2BaBA9和BA41/42/22(补充数据gydF4y2Ba7gydF4y2Ba),我们使用单细胞甲基化组参考数据对七种脑细胞类型(兴奋性神经元、抑制性神经元、星形胶质细胞、小胶质细胞、内皮细胞、少突胶质细胞和少突胶质细胞前体细胞)进行了基于参考的反褶积gydF4y2Ba29gydF4y2Ba.我们在这篇手稿中选择强调这些结果,因为与转录组数据相比,每个细胞中0到1的比例和恒定数量的潜在甲基化位点使其更易于反褶积。我们使用甲基化CTD细胞类型比例来测试细胞类型比例是否可以解释我们在bulk RNA-seq数据中观察到的ASD差异表达效应。我们通过将细胞类型比例作为协变量添加到差异表达基因分析的线性模型中来解决这一问题。我们尝试了两种不同的模型:一种包括广义的细胞类型比例,另一种包括细胞类型比例的前两种主要成分(成分pc;补充数据gydF4y2Ba7gydF4y2Ba).这些模型对ASD日志都没有任何实质性的影响gydF4y2Ba2gydF4y2BaFC来源于差异表达基因分析(扩展数据图。gydF4y2Ba9gydF4y2Ba及补充资料gydF4y2Ba7gydF4y2Ba).请参阅gydF4y2Ba补充说明gydF4y2Ba对这些分析进行了详细的说明。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本文中生成的源数据(bulk和snRNA-seq)可通过PsychENCODE知识门户(gydF4y2Bahttps://psychencode.synapse.org/gydF4y2Ba)gydF4y2Bahttps://doi.org/10.7303/syn34637740.2gydF4y2Ba.PsychENCODE知识门户是一个访问数据、分析和工具的平台,这些数据是由美国国家精神卫生研究所(NIMH) PsychENCODE项目资助的。根据以下数据访问和数据归属的要求,数据可用于一般研究用途:gydF4y2Bahttps://psychencode.synapse.org/DataAccessgydF4y2Ba.从艾伦大脑图谱下载单细胞和批量RNA-seq数据gydF4y2Bahttp://portal.brain-map.org/gydF4y2Ba.Luo等人的单细胞甲基化数据可从GSE140493下的基因表达Omnibus获得。gydF4y2Ba
代码的可用性gydF4y2Ba
支持本研究结果的RNA-seq分析代码可在GitHub公开访问的存储库中获得gydF4y2Bahttps://github.com/dhglab/Broad-transcriptomic-dysregulation-across-the-cerebral-cortex-in-ASDgydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
甘达尔,m.j.等人。自闭症谱系障碍、精神分裂症和双相情感障碍中转录组范围的亚型水平失调。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, eaat8127(2018)。gydF4y2Ba
Wu, y.e., Parikshak, n.n., Belgard, t.g.和Geschwind, d.h.全基因组综合分析提示自闭症谱系障碍中的microRNA失调。gydF4y2BaNat。>。gydF4y2Ba19gydF4y2Ba, 1463-1476(2016)。gydF4y2Ba
孙,W.等。组蛋白乙酰基与自闭症谱系障碍的关联研究。gydF4y2Ba细胞gydF4y2Ba167gydF4y2Ba, 1385 - 1397。e11(2016)。gydF4y2Ba
Voineagu, I.等人。自闭症大脑的转录组分析揭示了趋同的分子病理学。gydF4y2Ba自然gydF4y2Ba474gydF4y2Ba, 380-384(2011)。gydF4y2Ba
Parikshak, n.n.等。自闭症中lncRNA、剪接和区域基因表达模式的全基因组变化gydF4y2Ba自然gydF4y2Ba540gydF4y2Ba, 423-427(2016)。gydF4y2Ba
甘达尔,m.j.等人。在主要精神疾病中共享的分子神经病理学与多基因重叠相似。gydF4y2Ba科学gydF4y2Ba359gydF4y2Ba, 693-697(2018)。gydF4y2Ba
Sullivan, P. F. & Geschwind, D. H.定义精神疾病的遗传、基因组、细胞和诊断架构。gydF4y2Ba细胞gydF4y2Ba177gydF4y2Ba, 162-183(2019)。gydF4y2Ba
de la Torre-Ubieta, L., Won, H., Stein, J. L. & Geschwind, D. H.通过遗传学促进对自闭症疾病机制的理解。gydF4y2BaNat,地中海。gydF4y2Ba22gydF4y2Ba, 345-361(2016)。gydF4y2Ba
Ramaswami, G.等人。整合基因组学鉴定了一种趋同的分子亚型,将自闭症的表观基因组与转录组差异联系起来。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 4873(2020)。gydF4y2Ba
沃克,R. L.等。发育中的人脑表达和剪接的遗传控制为疾病机制提供信息。gydF4y2Ba细胞gydF4y2Ba179gydF4y2Ba, 750 - 771。e22(2019).
Oldham, m.c.等人。人脑转录组的功能组织。gydF4y2BaNat。>。gydF4y2Ba11gydF4y2Ba, 1271-1282(2008)。gydF4y2Ba
伯纳德等人。灵长类动物新皮层的转录结构。gydF4y2Ba神经元gydF4y2Ba73gydF4y2Ba, 1083-1099(2012)。gydF4y2Ba
Hawrylycz, m.j.等人。成人大脑转录组的解剖学综合图谱。gydF4y2Ba自然gydF4y2Ba489gydF4y2Ba, 391-399(2012)。gydF4y2Ba
Amunts, K. & Zilles, K.人脑的结构映射超出Brodmann。gydF4y2Ba神经元gydF4y2Ba88gydF4y2Ba, 1086-1107(2015)。gydF4y2Ba
克林格勒,E.等人。区域间皮层投射神经元命运多样性的时间控制。gydF4y2Ba自然gydF4y2Ba599gydF4y2Ba, 453-457(2021)。gydF4y2Ba
Fontanet, P. A., Ríos, A. S., Alsina, F. C., Paratcha, G. & Ledda, F. Pea3转录因子,Etv4和Etv5,是正常海马树突发育和可塑性所必需的。gydF4y2BaCereb。皮质gydF4y2Ba28gydF4y2Ba, 236-249(2018)。gydF4y2Ba
朗菲尔德,P.和霍瓦特,S. WGCNA:加权相关网络分析的R包。gydF4y2BaBMC Bioinf。gydF4y2Ba9gydF4y2Ba, 559(2008)。gydF4y2Ba
张,B. & Horvath, S.加权基因共表达网络分析的一般框架。gydF4y2BaStat .。麝猫。摩尔。杂志。gydF4y2Ba4gydF4y2Ba, 17(2005)。gydF4y2Ba
朗菲尔德,P.,罗,R., Oldham, M. C.和Horvath, S.我的网络模块是保存和可复制的吗?gydF4y2Ba公共科学图书馆第一版。医学杂志。gydF4y2Ba7gydF4y2Ba, e1001057(2011)。gydF4y2Ba
Parikshak, n.n.等。整合功能基因组分析涉及自闭症的特定分子通路和回路。gydF4y2Ba细胞gydF4y2Ba155gydF4y2Ba, 1008-1021(2013)。gydF4y2Ba
格罗夫,J.等。自闭症谱系障碍常见遗传风险变异的鉴定。gydF4y2BaNat,麝猫。gydF4y2Ba51gydF4y2Ba, 431-444(2019)。gydF4y2Ba
亚伯拉罕,B. S.等。SFARI基因2.0:一个社区驱动的自闭症谱系障碍(ASDs)知识库。gydF4y2Ba自闭症摩尔。gydF4y2Ba4gydF4y2Ba, 36(2013)。gydF4y2Ba
霍奇,R. D.等人。人与小鼠皮层中具有不同特征的保守细胞类型。gydF4y2Ba自然gydF4y2Ba573gydF4y2Ba, 61-68(2019)。gydF4y2Ba
Keller, D, Erö, C. & Markram, H.小鼠大脑中的细胞密度:系统回顾。gydF4y2Ba前面。Neuroanat。gydF4y2Ba12gydF4y2Ba, 83(2018)。gydF4y2Ba
Collins, C. E., Airey, D. C., Young, N. A., Leitch, D. B. & Kaas, J. H.灵长类动物皮层区域内神经元密度不同。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 15927-15932(2010)。gydF4y2Ba
柯林斯,c.e.等人。黑猩猩大脑半球皮层细胞和神经元密度的估计。gydF4y2Ba国家科学院学报美国gydF4y2Ba113gydF4y2Ba, 740-745(2016)。gydF4y2Ba
Cadwell, C. R., Bhaduri, A., Mostajo-Radji, M. A., Keefe, M. G. & Nowakowski, T. J.大脑皮层的发育和实现。gydF4y2Ba神经元gydF4y2Ba103gydF4y2Ba, 980-1004(2019)。gydF4y2Ba
Wagstyl, K.等人。BigBrain三维皮层层图谱:感觉皮层和运动皮层的皮层层厚度梯度不同。gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba18gydF4y2Ba, e3000678(2020)。gydF4y2Ba
Luo, C.等。单核多组学鉴定人类皮层细胞调控基因组多样性。gydF4y2Ba细胞基因组学gydF4y2Ba2gydF4y2Ba, 100106(2022)。gydF4y2Ba
古普塔等人。转录组分析揭示先天免疫反应基因和神经元活动依赖基因在自闭症中的异常调节。gydF4y2BaCommun Nat。gydF4y2Ba5gydF4y2Ba, 5748(2014)。gydF4y2Ba
精神疾病诊断与统计手册:DSM-5gydF4y2Ba(美国精神病学协会,2013)。gydF4y2Ba
Ecker, C.等人。自闭症谱系障碍成人大脑的内在灰质连通性。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 13222-13227(2013)。gydF4y2Ba
Hilgetag, C. C., Beul, S. F., van Albada, S. J. & Goulas, A.一种结构型原理将宏观皮质-皮质连接与灵长类大脑的内在皮质回路整合在一起。gydF4y2BaNetw。>。gydF4y2Ba3.gydF4y2Ba, 905-923(2019)。gydF4y2Ba
Bhaduri, A.等。皮层实现图谱识别动态分子特征。gydF4y2Ba自然gydF4y2Ba598gydF4y2Ba, 200-204(2021)。gydF4y2Ba
帕特里克,E.等。反卷积细胞类型异质性对皮层基因表达的贡献。gydF4y2Ba公共科学图书馆第一版。医学杂志。gydF4y2Ba16gydF4y2Ba, e1008120(2020)。gydF4y2Ba
Arzalluz-Luque,。单细胞RNAseq用于研究异构体——这怎么可能?gydF4y2Ba基因组医学杂志。gydF4y2Ba19gydF4y2Ba, 110(2018)。gydF4y2Ba
朱培杰等。ISR的激活介导唐氏综合征的行为和神经生理异常。gydF4y2Ba科学gydF4y2Ba366gydF4y2Ba, 843-849(2019)。gydF4y2Ba
Di Nardo, A.等。对tsc缺陷神经元的表型筛选显示热休克机制是mTORC1和减少纤毛的可药物通路。gydF4y2Ba细胞的代表。gydF4y2Ba31gydF4y2Ba, 107780(2020)。gydF4y2Ba
狄蒙提斯等人。发现第一个注意力缺陷/多动障碍全基因组显著风险位点。gydF4y2BaNat,麝猫。gydF4y2Ba51gydF4y2Ba, 63-75 (2019)gydF4y2Ba
李,J. J.等。基因发现和多基因预测来自110万人受教育程度的全基因组关联研究。gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 1112-1121 (2018)gydF4y2Ba
萨维奇,J. E.等人。对269,867人进行的全基因组关联元分析发现了与智力有关的新的遗传和功能联系。gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 912-919(2018)。gydF4y2Ba
精神病学基因组学联盟双相情感障碍和精神分裂症工作组。双相情感障碍和精神分裂症的基因组解剖,包括28个亚表型。gydF4y2Ba细胞gydF4y2Ba173gydF4y2Ba, 1705 - 1715。e16天(2018)。gydF4y2Ba
Wray, N. R.等人。全基因组关联分析确定了44种风险变异,并完善了重度抑郁症的遗传结构。gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 668-681(2018)。gydF4y2Ba
Pardiñas, a.f.等。常见的精神分裂症等位基因富集在突变不耐受基因和强背景选择区域。gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 381-389(2018)。gydF4y2Ba
刘建忠等。关联分析确定了炎症性肠病的38个易感位点,并强调了人群中共享的遗传风险。gydF4y2BaNat,麝猫。gydF4y2Ba47gydF4y2Ba, 979-986(2015)。gydF4y2Ba
安德鲁斯等人。FastQC。gydF4y2Bahttp://www.bioinformatics.babraham.ac.uk/projects/fastqc/gydF4y2Ba(2010)。gydF4y2Ba
耶茨,a.d.等人。运用2020年。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, d682-d688(2020)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Jun, G.等。在测序和基于阵列的基因型数据中检测和估计人类DNA样本的污染。gydF4y2Ba点。j .的嗡嗡声。麝猫。gydF4y2Ba91gydF4y2Ba, 839-848(2012)。gydF4y2Ba
Li, B. & Dewey, C. N. RSEM:有或没有参考基因组的RNA-Seq数据的精确转录物定量。gydF4y2BaBMC生物信息学gydF4y2Ba12gydF4y2Ba, 323(2011)。gydF4y2Ba
弗兰克什,A.等人。人类和小鼠基因组的GENCODE参考注释。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, d766-d773(2019)。gydF4y2Ba
R核心团队。gydF4y2BaR:统计计算的语言和环境gydF4y2Ba(R统计计算基础,2020)。gydF4y2Ba
Ritchie, m.e.等人,limma为rna测序和微阵列研究的差异表达分析提供了动力。gydF4y2Ba核酸测定。gydF4y2Ba43gydF4y2Ba, e47(2015)。gydF4y2Ba
Hansen, K. D., Irizarry, R. A. & Wu, Z.使用条件分位数归一化去除RNA-seq数据中的技术变异性。gydF4y2Ba生物统计学gydF4y2Ba13gydF4y2Ba, 204-216(2012)。gydF4y2Ba
库兹涅佐娃,A.布罗克霍夫,P. B. &克里斯滕森,R. H. B. lmerTest包:线性混合效应模型的测试。gydF4y2BaJ.统计。gydF4y2Bahttps://doi.org/10.18637/jss.v082.i13gydF4y2Ba(2017)。gydF4y2Ba
李,B.等。Cumulus为大规模单细胞和单核RNA-seq提供基于云的数据分析。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 793-798(2020)。gydF4y2Ba
Velmeshev, D.等人。单细胞基因组学鉴定自闭症细胞类型特异性分子变化。gydF4y2Ba科学gydF4y2Ba364gydF4y2Ba, 685-689(2019)。gydF4y2Ba
奎因,t.p.等人。任何组学数据组成分析的现场指南。gydF4y2BaGigasciencegydF4y2Ba8gydF4y2Ba, giz107(2019)。gydF4y2Ba
他,L.等人。NEBULA是一个快速负二项式混合模型,用于大规模多主体单细胞数据的差分或共表达分析。gydF4y2BaCommun。医学杂志。gydF4y2Ba4gydF4y2Ba, 629(2021)。gydF4y2Ba
黄志强等。全基因组DNA甲基化分析鉴定了死后人脑组织中与特发性和综合征性自闭症相关的趋同分子特征。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba28gydF4y2Ba, 2201-2211(2019)。gydF4y2Ba
确认gydF4y2Ba
本研究中使用的组织标本和/或数据来自自闭症脑网(以前的自闭症组织计划),该计划由西蒙斯基金会和马里兰大学脑组织银行赞助,后者是NIH神经生物库的组成部分。我们非常感谢参与组织捐献计划的患者和家属。一些数据是作为PsychENCODE联盟的一部分生成的-一个完整的资助和主要研究人员的列表提供在gydF4y2Bahttps://doi.org/10.7303/syn24240356gydF4y2Ba.这项工作的资金由授予D.H.G. (NIMH R01MH110927, U01MH115746, P50-MH106438和R01MH109912, R01MH094714和Simons基金会),M.J.G. (SFARI独立桥奖,NIMH R01-MH121521, NIMH R01-MH123922和NICHD-P50-HD103557), J.R.H.(大学科学家基金会洛杉矶创始人分会成就奖励,加州大学洛杉矶分校神经科学跨部门项目),G.T.C. (SFARI赠款675474,NIMH F32MH124337),G.D.H.(加州大学洛杉矶分校Semel研究所研究学者之友奖和Burroughs Wellcome基金医学家职业奖),C.L. (NIMH R01-MH125252),和C.X.Y.(富布赖特未来奖学金,昆士兰大学RTP津贴和学费抵消,Sam和Marion Frazer HDR神经疾病充值奖学金,自闭症CRC)。我们感谢J. Sinsheimer对转录组区域特征分析方法的讨论。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
M.J.G.提供了项目领导、专家建议和对整个手稿的实质性贡献,包括对初始手稿的实质性重写、重新分析和修订,并为这项工作提供了一些资金。M.J.G.还为散装RNA-seq RNA提取的样品解剖做出了贡献。J.R.H.对整个手稿都有贡献,包括对大量RNA-seq数据的所有分析,对snRNA-seq数据的支持分析,撰写主要文本,创建所有图形和编译所有补充信息。B.W.对手稿的编辑、修订和补充数据和信息的汇编做出了贡献,包括图。gydF4y2Ba4gydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba和创建补充数据gydF4y2Ba8gydF4y2Ba并用匹配的样本完成了snRNA-seq实验。C.X.Y, A.B.和C.L.进行了基于甲基化的CTD分析。p.s.e., n.c., T.J.和D.W.进行了CTD分析。G.D.H.为手稿提供了专家的功能电路和区域神经解剖学输入,并协助了图形设计。D.d.A.对基因和转录模块进行蛋白-蛋白相互作用富集分析。s.p., G.T.C, C.L.H.和G.R.对RNA-seq数据处理,分析,解释和可视化做出了贡献。C.L.H.创建了RNA-seq计算管道,用于处理原始的大量RNA-seq数据,并获得基因和转录水平的基因表达量化。D.Q.分离样品核,制备snRNA-seq的RNA文库。R.K.使用Pegasus集成snRNA-seq原始数据,使用b.w.j.o.进行初始细胞成分分析和每个主要细胞类别的差异表达,提取RNA并为散装RNA-seq制备RNA文库。y.e.w.、N.N.P、V.S.和T.G.B.参与了本实验的初始计划,并协助进行了样品解剖。 T.G.B. contributed to the initial planning of this experiment and sample dissection. M.G. served in an advisory and project-planning role for the CTD analysis. B.P. provided expert statistical advice for the bulk RNA-seq analysis, particularly for the permutation tests assessing region-specific increases in magnitude of ASD gene-expression effects. D.H.G. conceived of the project, provided project leadership, expert advice and direction at all stages of the project, substantial contributions to the entire manuscript at each stage, and obtained the primary major funding for this work. D.H.G. also obtained all of the samples for RNA-seq.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢匿名审稿人对本工作的同行评审所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1实验流程及样品概述。gydF4y2Ba
a.实验流程概述。b.样本组成总结(生物数据、脑库来源、PMI)。gydF4y2Ba
扩展数据图2质量控制措施。gydF4y2Ba
a.测序批次。b.批次的脑区和病例对照样本量。c.与元数据(上)和测序统计数据(下)相关的前15个表达pc(基因和转录本,注明方差解释百分比)。d.箱线图显示中位数和四分位范围(25gydF4y2BathgydF4y2Ba/ 75gydF4y2BathgydF4y2Ba百分位;+/−1.5倍的四分位数范围(胡须)的RIN值和跨诊断x区域的测序统计,每个区域和诊断的生物学独立样本数量如图所示。gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
扩展数据图3模型协变量,ADI-R相关性,以及11个皮层区域的先前研究。gydF4y2Ba
a.对于为基因(左)和转录本(右)线性混合模型选择的协变量,在所有基因/转录本中解释的表达方差的%。箱形图显示中位数和四分位范围(25gydF4y2BathgydF4y2Ba/ 75gydF4y2BathgydF4y2Ba百分位;盒界)+/−1.5倍的四分位数范围(胡须),分别为24,836和99,819个不同的基因和异型,测量了来自112个独特受试者的725个大脑样本。b.可用的ADI-R评分与ASD差异表达基因的第一和第二主成分的Spearman相关性,在所有区域(整个皮层)、BA9和BA17中计算。c. Voineagu等人和Parikshak等人的研究gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba, ASD日志gydF4y2Ba2gydF4y2Ba在这些研究中确定的差异表达基因的FC,与此数据集相比(斯皮尔曼相关rho, R与线性最小二乘回归最佳拟合线一起绘制)。gydF4y2Ba
扩展数据图4 11个皮层区域的转录组变化。gydF4y2Ba
a.全皮层差异表达的ASD基因和转录本(蓝色)与其他皮层区域差异表达的基因(无颜色)重叠。右侧没有第三个数字标记的区域与全皮质差异表达基因完全重叠。b. Whole-Cortex差异表达,基因和转录本重叠。未显示的区域没有唯一的微分表达式。c .日志gydF4y2Ba2gydF4y2Ba全皮质ASD差异表达重叠和不同基因和转录本的FC(上)和标准误差(下)。d. ASD和dup15q基因及转录本差异表达重叠。e.对于ASD基因差异表达区域(左)和转录本差异表达区域(右),ASD日志gydF4y2Ba2gydF4y2BaFC v. dup15q日志gydF4y2Ba2gydF4y2Ba特定区域的FC(带主成分回归斜率,S)。gydF4y2Ba
图5 ASD的转录组区域同一性衰减。gydF4y2Ba
a.所有区域比较的样本量。b.所有区域比较的名义置换衍生p值(双面)(见方法)。c. bootstrap(10,000个bootstrap)表示区域间差异表达基因数量的差异,ASD - CTL(对照)。Wilcoxon秩和检验结果显示FDR < 0.05。阴性/蓝色值=与对照组相比,ASD区域间差异表达基因较少,阳性/红色值=与对照组相比,ASD区域间差异表达基因较多。d.与Allen Brain Atlas(参考文献)相比,本研究中区域对之间差异表达基因数量之间的Spearman相关性(对照组自举带平均值,y轴)。gydF4y2Ba13gydF4y2Ba,匹配区域均值,x轴;参见匹配区域的方法)。采用as89算法计算Spearman相关P值(两面)。gydF4y2Ba
图6附加的ARI基因失调。gydF4y2Ba
a. ASD中ARI基因的第一主成分(PC1)表现为后下调(n = 1881个基因,左)或上调(n = 1695个基因,右)的表达模式。箱形图显示中位数和四分位范围(25gydF4y2BathgydF4y2Ba/ 75gydF4y2BathgydF4y2Ba百分位;+/−1.5倍于这些基因的PC1的四分位范围(胡须),在对照和dup15q样本中总结(黄土回归线绘制)。每个区域被试的唯一数量如图所示。gydF4y2Ba1克ydF4y2Ba.b.对于每个显著减毒的区域比较,识别的减毒区域特征(ARI)基因。在中心,ARI基因在每对区域具有更高的神经典型表达的数量。在barplot的任何一侧,具有更大的神经典型前(左)或后(右)表达的基因的PC1在对照组和ASD的对区域中被绘制出来。Wilcoxon符号秩检验(未配对;双尾)p值。箱形图显示中位数和四分位范围(25gydF4y2BathgydF4y2Ba/ 75gydF4y2BathgydF4y2Ba百分位;+/−1.5倍于每个区域比较的基因PC1的四分位范围(胡须),在对照和ASD样本中总结,每组x区域比较的唯一受试者数量如图所示。gydF4y2Ba1 bgydF4y2Ba.gydF4y2Ba
图7基因水平共表达网络分析模块关联。gydF4y2Ba
上:模块特征基因双权重中间相关的平均链接层次聚类。显著的FDR校正p值(双侧)(FDR < 0.05;对于GWAS, FDR < 0.1)。对于ASD, dup15q和年龄协变量,描述了来自线性混合模型的fdr校正p值(双面),测试这些协变量与模块特征基因的关联。对于ASD和dup15q区域特异性比较,皮质小叶的颜色是指示的(图。gydF4y2Ba1克ydF4y2Ba),斜体加粗的fdr校正p值表明,这些区域受到的影响明显大于ASD全皮质(方法)。对于基因生物型,正富集和负富集都显示出来(Fisher精确测试;方法)。阳性富集显示为细胞型,神经元亚型(参考。gydF4y2Ba23gydF4y2Ba)、ARI基因、GWAS、稀有变异富集(方法)。gydF4y2Ba
图8转录水平共表达网络分析模块关联。gydF4y2Ba
上:模块特征基因双权重中间相关的平均链接层次聚类。显著的FDR校正p值(双侧)(FDR < 0.05;对于GWAS, FDR < 0.1)。对于ASD, dup15q和年龄协变量,描述了来自线性混合模型的fdr校正p值,测试这些协变量与模块特征基因的相关性。对于ASD和dup15q区域特异性比较,皮质小叶的颜色是指示的(图。gydF4y2Ba1gydF4y2Ba).对于基因生物型,正富集和负富集都显示出来(Fisher精确测试;方法)。阳性富集显示细胞型,GWAS和罕见变异富集(方法)。gydF4y2Ba
图9细胞型组合关联、snRNA-seq和细胞型反褶积。gydF4y2Ba
一个gydF4y2Ba.ASD bulk RNA-seq日志gydF4y2Ba2gydF4y2Ba与用于计算DE基因的原始模型相比,FC(从BA9(左)和BA41-42-22(右)计算时没有(x轴)和有(y轴)甲基化数据导出的细胞类型比例作为协变量(方法)(图)。gydF4y2Ba1克ydF4y2Ba).示出斯皮尔曼相关。gydF4y2BabgydF4y2Ba.从ASD皮层(左)和CTL皮层(右)分离snRNA-seq UMAP图,细胞亚型染色。gydF4y2BacgydF4y2Ba.直接来自snRNA-seq数据的每个区域的细胞簇的细胞类型比例(平均值+标准误差)(n = 12个生物独立个体,每组6个,在3个大脑区域采样)。区域是彩色的,细胞类型表示在每个图中。来自方差分析的名义和fdr校正P值(两面)显示了趋势级关联。gydF4y2BadgydF4y2Ba.火山图在区域比较中显示细胞类型差异表达。x轴为ASD效应大小(loggydF4y2Ba2gydF4y2BaFC), y轴是-loggydF4y2Ba10gydF4y2Ba(FDR)来自星云。带|日志的基因gydF4y2Ba2gydF4y2Ba标记FC| > 0.2和FDR < 0.001。gydF4y2Ba
图10结果汇总。gydF4y2Ba
ASD转录组的泛皮层特征结果概述。左上,ASD的差异基因表达签名,虽然在皮质范围内观察到,但在后部区域,尤其是BA17,显示出最大的效应大小变化。右上,在ASD中观察到广泛的转录组区域识别的后显性衰减。底部,共同表达网络提供了一个组织框架,解释皮质范围和区域可变的影响。一种皮质范围的上调共表达模块(isoM37)由参与蛋白质平衡的基因组成,用于丰富常见的asd相关遗传变异。一个皮质范围内,下调模块特征基因涉及突触信号和可塑性显示富集常见和罕见的遗传风险变异。其他模块显示皮质范围或区域显着的差异表达模式在ASD突出。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
此文件包含补充方法和引用。gydF4y2Ba
补充数据1gydF4y2Ba
来自处理数据集的所有样本的可用元数据和测序质量指标(已删除的异常值不包括在内)。gydF4y2Ba
补充数据2gydF4y2Ba
全脑与区域差异基因/异构体表达结果重叠;与Perturb-Seq结果的比较(参考文献72);基因表达PCs与ADI-R评分的Spearman相关性。gydF4y2Ba
补充数据3gydF4y2Ba
ASD与对照组和dup15q与对照组比较的整个皮层和区域特异性差异基因表达(DGE)和差异异型表达(DIE)结果的汇总统计。gydF4y2Ba
补充数据4gydF4y2Ba
概括统计ASD与对照样本ARI结果的特征。基于排列和自举分析的结果,与Allen Brain Atlas的比较,以及ARI基因富集分析。gydF4y2Ba
补充数据5gydF4y2Ba
基因水平和亚型水平WGCNA结果。WGCNA模块分配和模块成员(kME值),以及基因注释,用于所有评估的基因。gydF4y2Ba
补充数据6gydF4y2Ba
基于神经细胞类型、基因本体论、基因生物型、ARI基因、GWAS遗传力和罕见变异信号的所有基因和亚型模块的功能特征。gydF4y2Ba
补充数据7gydF4y2Ba
区域ASD差异表达特征与神经元密度和L4厚度的比较。ASD病例和对照中基于细胞型CTD的大量脑甲基化数据的总结结果。gydF4y2Ba
补充数据8gydF4y2Ba
ASD和对照受试者在3个大脑区域(PFC,顶叶,枕叶皮层)的snRNA-seq分析的元数据和总结结果。聚类定义、umap和来自特定细胞类型的差异表达分析的汇总统计信息。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
甘达尔,M.J,哈尼,J.R,沃姆斯利,B。gydF4y2Baet al。gydF4y2Ba广泛的转录组失调发生在ASD的大脑皮层。gydF4y2Ba自然gydF4y2Ba611gydF4y2Ba, 532-539(2022)。https://doi.org/10.1038/s41586-022-05377-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05377-7gydF4y2Ba
这篇文章被引用gydF4y2Ba
制定主要精神疾病的治疗方法:算法针对主要受影响的脑细胞类型gydF4y2Ba
发现心理健康gydF4y2Ba(2023)gydF4y2Ba
静息状态脑功能连接与基因表达之间的关系在自闭症谱系障碍中改变gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba