摘要gydF4y2Ba
巨噬细胞是维持组织内稳态的重要角色gydF4y2Ba1gydF4y2Ba.血管周围和软脑膜巨噬细胞位于中枢神经系统(CNS)薄壁附近gydF4y2Ba2gydF4y2Ba它们在中枢神经系统生理中的作用还没有得到充分的研究。考虑到它们与脑脊液(CSF)的持续相互作用和战略定位,我们将这些细胞统称为实质边界巨噬细胞(PBMs)。在这里,我们证明PBMs调节CSF血流动力学。我们确定了表达高水平CD163和LYVE1(清道夫受体蛋白)的PBMs的一个亚群,它们与脑动脉树密切相关,并表明LYVE1gydF4y2Ba+gydF4y2BaPBMs调节驱动脑脊液流动的动脉运动。PBMs的药理或遗传耗竭导致细胞外基质蛋白的积累,阻碍脑脊液进入血管周围间隙,损害中枢神经系统的灌注和清除。在脑内注射巨噬细胞集落刺激因子后,衰老相关的PBMs改变和脑脊液动力学损伤得以恢复。从阿尔茨海默病(AD)患者和非AD个体中获得的单核RNA测序数据表明,PBMs上的吞噬、内吞和干扰素-γ信号通路发生了变化,这些通路在AD小鼠模型中得到了证实。总的来说,我们的研究结果将PBMs确定为CSF血流动力学的新细胞调节剂,在药理学上可靶向缓解与衰老和AD相关的大脑清除缺陷。gydF4y2Ba
这是订阅内容的预览,gydF4y2Ba通过你的机构获取gydF4y2Ba
访问选项gydF4y2Ba
订阅Nature+gydF4y2Ba
立即在线访问《自然》和其他55种《自然》杂志gydF4y2Ba
29.99美元gydF4y2Ba
每月gydF4y2Ba
订阅期刊gydF4y2Ba
获得1年的完整期刊访问权限gydF4y2Ba
199.00美元gydF4y2Ba
每期仅需$3.90gydF4y2Ba
所有价格均为净价格。gydF4y2Ba
增值税将在稍后的结帐中添加。gydF4y2Ba
税金计算将在结账时完成。gydF4y2Ba
买条gydF4y2Ba
在ReadCube上获得时间限制或全文访问权限。gydF4y2Ba
32.00美元gydF4y2Ba
所有价格均为净价格。gydF4y2Ba
数据可用性gydF4y2Ba
小鼠单细胞mRNA测序数据可在登录号下的基因表达集合中获得gydF4y2BaGSE188285gydF4y2Ba.Knight ADRC的人类单核数据可通过国家老年痴呆症衰老遗传学研究所数据存储站点的请求公开获取,该站点有登录号gydF4y2BaNG00108.v1gydF4y2Ba(gydF4y2Bahttps://www.niagads.org/datasets/ng00108gydF4y2Ba).要访问DIAN脑库的数据,必须使用以下URL提出特殊请求:gydF4y2Bahttps://dian.wustl.edu/our-research/for-investigators/gydF4y2Ba.gydF4y2Ba
代码的可用性gydF4y2Ba
用于分析mRNA测序数据的定制代码可在以下网站免费获得gydF4y2Bahttps://doi.org/10.5281/zenodo.7047054gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
组织内巨噬细胞的个体发生和内稳态。gydF4y2Ba免疫力gydF4y2Ba44gydF4y2Ba, 439-449(2016)。gydF4y2Ba
增田,T.等。CNS巨噬细胞亚群在出生后的特定生态位中发生。gydF4y2Ba自然gydF4y2Ba604gydF4y2Ba, 740-748(2022)。gydF4y2Ba
Alves de Lima, K.等人。脑膜γδ T细胞通过神经元中的IL-17a信号调节焦虑样行为。gydF4y2BaImmunol Nat。gydF4y2Ba21gydF4y2Ba, 1421-1429(2020)。gydF4y2Ba
菲利亚诺,A. J.等。干扰素-γ在调节神经元连接和社会行为中的意想不到的作用。gydF4y2Ba自然gydF4y2Ba535gydF4y2Ba, 425-429(2016)。gydF4y2Ba
康斯曼,j.p,帕内特,P. &丹泽尔,R.细胞因子诱导的疾病行为:机制和意义。gydF4y2Ba趋势>。gydF4y2Ba25gydF4y2Ba, 154-159(2002)。gydF4y2Ba
梅斯特,h。脑脊液的流动是由动脉搏动驱动的,在高血压时减少。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 4878(2018)。gydF4y2Ba
伊利夫,J. J.等。脑动脉搏动驱动鼠脑血管旁脑脊液-间质液交换。gydF4y2Baj . >。gydF4y2Ba33gydF4y2Ba, 18190-18199(2013)。gydF4y2Ba
van Veluw, S. J.等。在清醒的小鼠大脑中,血管运动作为副血管清除的驱动力。gydF4y2Ba神经元gydF4y2Ba105gydF4y2Ba, 549 - 561。e5(2020)。gydF4y2Ba
伊利夫,J. J.等。旁血管通路促进脑脊液通过脑实质和清除间质溶质,包括淀粉样β。gydF4y2Ba科学。Transl地中海。gydF4y2Ba4gydF4y2Ba, 147ra111(2012)。gydF4y2Ba
Louveau, A.等。中枢神经系统淋巴管的结构和功能特征。gydF4y2Ba自然gydF4y2Ba523gydF4y2Ba, 337-341(2015)。gydF4y2Ba
李,x等。脑膜淋巴管介导中枢神经系统的嗜神经性病毒引流。gydF4y2BaNat。>。gydF4y2Ba25gydF4y2Ba, 577-587(2022)。gydF4y2Ba
Rustenhoven, J.等。硬脑膜窦作为神经免疫界面的功能特征。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 1000 - 1016。e27(2021)。gydF4y2Ba
Kierdorf, K, Masuda, T, Jordão, M. J. C. & Prinz, M.巨噬细胞在中枢神经系统界面:个体发生和在健康和疾病中的功能。gydF4y2Ba神经科学。gydF4y2Ba20.gydF4y2Ba, 547-562(2019)。gydF4y2Ba
G. Faraco, Park, L. Anrather, J. & Iadecola, C.脑血管周围巨噬细胞:特征及其在健康和疾病中的功能作用。gydF4y2BaJ.摩尔医学。gydF4y2Ba95gydF4y2Ba, 1143-1152(2017)。gydF4y2Ba
Van Hove, H.等。小鼠脑巨噬细胞的单细胞图谱揭示了由个体发育和组织环境形成的独特转录特性。gydF4y2BaNat。>。gydF4y2Ba22gydF4y2Ba, 1021-1035(2019)。gydF4y2Ba
戈德曼,T.等人。中枢神经系统界面巨噬细胞的起源、命运和动态。gydF4y2BaImmunol Nat。gydF4y2Ba17gydF4y2Ba, 797-805(2016)。gydF4y2Ba
法拉科,G.等。血管周围巨噬细胞介导与高血压相关的神经血管和认知功能障碍。gydF4y2Baj .中国。投资。gydF4y2Ba126gydF4y2Ba, 4674-4689(2016)。gydF4y2Ba
Thanopoulou, K., Fragkouli, A., Stylianopoulou, F. & georgopoullos, S.清除受体B类I型(SR-BI)调节血管周围巨噬细胞并修饰阿尔茨海默小鼠模型中的淀粉样病变。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba107gydF4y2Ba, 20816-20821(2010)。gydF4y2Ba
Park, L.等。脑血管周围巨噬细胞启动阿尔茨海默Aβ肽的神经血管功能障碍。gydF4y2Ba中国保监会,Res。gydF4y2Ba121gydF4y2Ba, 258-269(2017)。gydF4y2Ba
Jordão, M. J. C.等。单细胞分析在神经炎症过程中确定了具有不同命运的髓系细胞亚群。gydF4y2Ba科学gydF4y2Ba363gydF4y2Baeaat7554(2019)。gydF4y2Ba
詹先生,D.等人。高维单细胞定位中枢神经系统免疫细胞揭示了健康、衰老和疾病中不同的髓系亚群。gydF4y2Ba免疫力gydF4y2Ba48gydF4y2Ba, 380 - 395。e6(2018)。gydF4y2Ba
沃德劳,j.m.等。脑血管周围空间:解剖学、生理学和病理学。gydF4y2BaNat. Rev. Neurol。gydF4y2Ba16gydF4y2Ba, 137-153(2020)。gydF4y2Ba
梅斯特,h。鼠脑水通道蛋白-4依赖的glymphatic溶质运输。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e40070(2018)。gydF4y2Ba
杨,L.等。利用临床相关的鞘内输注脑脊液示踪剂评价胶状淋巴通路的功能。gydF4y2BaJ.翻译医学。gydF4y2Ba11gydF4y2Ba, 107(2013)。gydF4y2Ba
Da Mesquita, S.等。老年和阿尔茨海默病中脑膜淋巴管的功能方面。gydF4y2Ba自然gydF4y2Ba560gydF4y2Ba, 185-191(2018)。gydF4y2Ba
安,J. H.等。颅底的脑膜淋巴管引流脑脊液。gydF4y2Ba自然gydF4y2Ba572gydF4y2Ba, 62-66(2019)。gydF4y2Ba
梅斯特,h。脑脊液流入导致急性缺血性组织肿胀。gydF4y2Ba科学gydF4y2Ba367gydF4y2Ba, eaax7171(2020)。gydF4y2Ba
Polfliet, m.m.等人。一种选择性消耗中枢神经系统血管周围和脑膜巨噬细胞的方法。gydF4y2Baj . Neuroimmunol。gydF4y2Ba116gydF4y2Ba, 188-195(2001)。gydF4y2Ba
哈布利茨,l.m.等。麻醉下小鼠脑电δ功率高、心率低,与glymphtic流入增加有关。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Ba, eaav5447(2019)。gydF4y2Ba
Gakuba, C.等。全身麻醉抑制“glymphatic系统”的活动。gydF4y2Ba开展gydF4y2Ba8gydF4y2Ba, 710-722(2018)。gydF4y2Ba
林海燕等。表达透明质酸受体lyve -1的巨噬细胞通过透明质酸介导的平滑肌细胞胶原蛋白调节维持动脉张力。gydF4y2Ba免疫力gydF4y2Ba49gydF4y2Ba, 326 - 341。e7(2018)。gydF4y2Ba
周伯威等。中枢神经小动脉中的小泡介导神经-血管耦合。gydF4y2Ba自然gydF4y2Ba579gydF4y2Ba, 106-110(2020)。gydF4y2Ba
Baccin等人。结合单细胞和空间转录组学揭示了骨髓的分子、细胞和空间生态位组织。gydF4y2BaNat细胞生物学。gydF4y2Ba22gydF4y2Ba, 38-48(2020)。gydF4y2Ba
张,N.等。LYVE1gydF4y2Ba+gydF4y2Ba小鼠腹膜间皮巨噬细胞促进网膜依赖性卵巢肿瘤生长。gydF4y2BaJ.经验医学。gydF4y2Ba218gydF4y2Ba, e20210924(2021)。gydF4y2Ba
Boissonneault等人。巨噬细胞集落刺激因子对阿尔茨海默病β-淀粉样蛋白沉积和认知障碍的强大有益作用。gydF4y2Ba大脑gydF4y2Ba132gydF4y2Ba, 1078-1092(2009)。gydF4y2Ba
脑淀粉样血管病中血管周围巨噬细胞的选择性靶向清除β-淀粉样蛋白。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba106gydF4y2Ba, 1261-1266(2009)。gydF4y2Ba
Keren-Shaul, H.等。一种与限制阿尔茨海默病发展有关的独特小胶质细胞类型。gydF4y2Ba细胞gydF4y2Ba169gydF4y2Ba, 1276 - 1290。e17(2017)。gydF4y2Ba
Da Mesquita, S.等。脑膜淋巴管影响小胶质细胞反应和抗a β免疫治疗。gydF4y2Ba自然gydF4y2Ba593gydF4y2Ba, 255-260(2021)。gydF4y2Ba
优滋,s.g.等。早期命运决定了小胶质细胞和非实质脑巨噬细胞的发育。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 557 - 573。e18(2020).
皮雷,P. W.等。卒中倾向自发性高血压大鼠巨噬细胞耗竭后大脑中动脉结构和内皮功能的改善。gydF4y2Ba微循环gydF4y2Ba20.gydF4y2Ba, 650-661(2013)。gydF4y2Ba
Császár, E.等。小胶质细胞通过嘌呤能作用调节血流、神经血管耦合和低灌注。gydF4y2BaJ.经验医学。gydF4y2Ba219gydF4y2Ba, e20211071(2022)。gydF4y2Ba
Erde, J., Loo, R. R. O. & Loo, J. A.用增强的FASP (eFASP)提高蛋白质组定量实验的蛋白质组覆盖率和样品回收率。gydF4y2Ba方法分子生物学;gydF4y2Ba1550gydF4y2Ba, 11-18(2017)。gydF4y2Ba
Rappsilber, J., Mann, M. & Ishihama, Y.使用StageTips进行蛋白质组学肽的微纯化、富集、预分割和存储的协议。gydF4y2BaProtoc Nat。gydF4y2Ba2gydF4y2Ba, 1896-1906(2007)。gydF4y2Ba
蔡,R.等。透明小鼠的泛视成像显示全身神经元投射和脑膜连接。gydF4y2BaNat。>。gydF4y2Ba22gydF4y2Ba, 317-327(2019)。gydF4y2Ba
Lun, A. T. L, McCarthy, D. J. & Marioni, J. C.使用Bioconductor对单细胞rna序列数据进行低级分析的逐步工作流程。gydF4y2BaF1000ResearchgydF4y2Ba5gydF4y2Ba, 2122(2016)。gydF4y2Ba
麦卡锡,D. J.,坎贝尔,K. R.,伦,a.t.l.和威尔斯,Q. F.斯卡特:单细胞rna序列数据的预处理、质量控制、归一化和可视化。gydF4y2Ba生物信息学gydF4y2Ba33gydF4y2Ba, 1179-1186(2017)。gydF4y2Ba
Butler, A., Hoffman, P., Smibert, P., Papalexi, E. & Satija, R.跨不同条件、技术和物种整合单细胞转录组数据。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 411-420(2018)。gydF4y2Ba
Van den Berge, K.等。观察权重解锁批量RNA-seq工具,用于零膨胀和单细胞应用。gydF4y2Ba基因组医学杂志。gydF4y2Ba19gydF4y2Ba, 24(2018)。gydF4y2Ba
Robinson m.d, McCarthy, d.j. & Smyth, G. K. edgeR:用于数字基因表达数据的差异表达分析的Bioconductor包。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 139-140(2010)。gydF4y2Ba
洪国光,张伟,李红华,沈晓霞,郭铮。上调和下调基因通路的分离富集分析。gydF4y2BaJ. R.社会接口gydF4y2Ba11gydF4y2Ba, 20130950(2014)。gydF4y2Ba
确认gydF4y2Ba
我们感谢S. Smith对手稿的编辑;负责动物护理的S. Blackburn、N. Al-Hamadani、X. Wang和E. Griffin;S. Brophy负责实验室管理;感谢基普尼斯实验室的所有成员在对这项工作的多次讨论中提出的宝贵意见;华盛顿大学细胞成像核心中心(WUCCI)的所有成员,感谢他们对电子显微镜成像的宝贵贡献;弗吉尼亚大学流式细胞术核心和测序核心的工作人员,感谢他们在细胞排序和测序方面的帮助;感谢华盛顿大学小动物MR成像设施和弗吉尼亚大学分子成像核心设施的所有成员在MRI方面的帮助。我们感谢Y. Mi、P. Erdmann-Gilmore、A. Davis和R. Connors为华盛顿大学蛋白质组共享资源(WU-PSR)脑脊液蛋白质组学实验提供的专家技术支持,以及R. Reid Townsend(主任)、R. Sprung和T. Zhang(联合主任);查尔斯·f·和乔安妮·奈特阿尔茨海默病研究中心(ADRC)神经病理学核心的工作人员和其他人员;以及参与者及其家人的无私奉献,以及每个参与地点的Knight ADRC和DIAN研究和支持人员对本次研究的贡献。 This work was supported by grants from the National Institutes of Health/National Institute on Aging (AG034113, AG057496, AG078106), the Cure Alzheimer’s Fund and the Ludwig Foundation to J.K.; AG057777 and AG067764 to O.H.; and AG062734 to C.M.K. O.H. is an Archer Foundation Research Scientist. The WU-PSR is supported in part by the WU Institute of Clinical and Translational Sciences (NCATS UL1 TR000448), the Mass Spectrometry Research Resource (NIGMS P41 GM103422; R24GM136766) and a Siteman Comprehensive Cancer Center Support grant (NCI P30 CA091842). The Neuropathology Cores and the Charles F. and Joanne Knight ADRC are supported by P30 AG066444, P01AG026276 and P01AG03991. Data collection and sharing for this project was supported by the DIAN (UF1AG032438) funded by the National Institute on Aging (NIA), the German Center for Neurodegenerative Diseases (DZNE), Raul Carrea Institute for Neurological Research (FLENI), partial support by the Research and Development Grants for Dementia from Japan Agency for Medical Research and Development, AMED, and the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI). This manuscript has been reviewed by DIAN Study investigators for scientific content and consistency of data interpretation with previous DIAN Study publications. The illustrations of the mice and MRI are freely available from Servier Medical Art (https://smart.servier.comgydF4y2Ba).大脑漫画和概要插图是由作者创作的。gydF4y2Ba
作者信息gydF4y2Ba
作者和隶属关系gydF4y2Ba
财团gydF4y2Ba
贡献gydF4y2Ba
公元公元设计并进行实验,分析和解释数据,创建数据并撰写手稿。S.D.和S.E.S.进行了实验,分析和解释了数据。fz .和S.H.进行了光声成像实验。z . p对dcln进行了实时成像。S.B.协助进行实验和数据分析。J.R.和T.M.为实验提供了智力贡献和协助。td进行小鼠scRNA-seq数据分析,人单核RNA-seq数据分析,并参与方法撰写。K.K.进行了行为实验和分析。oh监督并解释了scRNA-seq数据分析。C.M.K、R.J.B、R.P、M.F、J.C.和P.S.为DIAN网络生成数据集。 G.J.R. providedLyve1gydF4y2BacregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba老鼠和智力贡献。is协助进行动物手术和盲法数据分析和量化。J.K.设计了实验,提供了资源和智力贡献,监督数据分析和解释,并撰写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
J.K.是PureTech的科学顾问和合作者。J.K.和A.D.持有与本文所述发现相关的临时专利申请。R.J.B是C2N诊断公司的联合创始人和科学顾问委员会成员。C2N诊断公司已将某些抗tau抗体授权给艾伯维进行治疗开发。他得到了来自百健、卫材和DIAN-TU制药联盟的研究支持。他也是Amgen和Hoffman La-Roche的顾问。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Kiavash Movahedi和其他匿名审稿人对这项工作的同行评议做出的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
扩展的数据图和表gydF4y2Ba
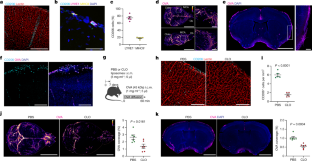
图1 PBMs不同于小胶质细胞和样本CSF和ISF。gydF4y2Ba
一个gydF4y2BaCD206+ PBMs(青色)很容易与IBA1+小胶质细胞(黄色)区分,位于静脉凝集素+大血管附近(红色)。比例尺,100 μm。gydF4y2BabgydF4y2Ba在美国,PBMs位于脑血管外,在血管周围空间。gydF4y2BacgydF4y2Ba全脑切片定量显示PBMs通过血管周围空间(PVS)和轻脑膜(LM)的空间分布。比例尺,20 μm。N = 5只小鼠。gydF4y2BadgydF4y2Ba, PBM检测的门控策略。pbm被定义为DAPIgydF4y2Ba−gydF4y2BaCD45gydF4y2Ba+gydF4y2BaTCRbgydF4y2Ba−gydF4y2BaCD19gydF4y2Ba−gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaCD64gydF4y2Ba嗨gydF4y2BaF4/80gydF4y2Ba嗨gydF4y2BaCD206gydF4y2Ba+gydF4y2Ba细胞。pbm可以用MHCII和CD38分为亚型。gydF4y2BaegydF4y2Ba小鼠腹腔注射Alexa-647结合卵白蛋白(OVA;45 kDa;1毫克/毫升;5μl)。卵巢注射1 h后,小鼠静脉注射Alexa-594结合凝集素(30 μl), 5 min后灌流。清除小鼠大脑光板显微镜获得的最大投影图像显示在静脉注射凝集素+血管(青色)附近的大脑OVA(洋红色)分布。比例尺,1mm。gydF4y2BafgydF4y2Ba小鼠腹腔注射Alexa-647结合卵白蛋白(OVA;45 kDa;1毫克/毫升;5μl)。小鼠在注射OVA 1小时后进行灌流。具有代表性的体视显微镜图像显示大脑中动脉(MCA)远端全脑OVA分布,并定量显示血管周围和细胞OVA分布。比例尺,1mm和200 μm(插入)。N = 6只小鼠。gydF4y2BaggydF4y2Ba实验原理:WT小鼠i.c.m.注射FITC葡聚糖(FITCDex;4 kDa;10毫克/毫升;5 μl), 1 h后取脑。冠状面进行抗cd206(青色)和DAPI染色。比例尺,2mm和50 μm(插图)。gydF4y2BahgydF4y2Ba实验示意图:WT小鼠房腔内注射含FITC-Dex 0.5 μl (10mg/ml;绿)和0.5 μl OVA (1 mg/ml;洋红色)和大脑在一小时后被收获。然后对大脑进行抗cd206染色(青色)。比例尺,2mm和50 μm(插图)。gydF4y2Ba我gydF4y2Ba1小时后,小鼠分别在i.s.注射A488-OVA(绿色)和i.c.m.注射A647-OVA(洋红色)。小鼠在1小时后(i.s.注射2小时后)进行灌流。一些细胞同时取样了i.i.c.m.和i.c.m.的OVAs。比例尺,2毫米和100 μm(插入)。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2BaggydF4y2Ba而且gydF4y2BahgydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图2 PBM损耗的影响。gydF4y2Ba
一个gydF4y2Ba, WT小鼠接受氯膦酸酯负载脂质体(CLO)或PBS负载脂质体(PBS)的i.c.m.注射。使用抗iba1染色(黄色)鉴定小胶质细胞。不在轻脑膜和CD206-中的细胞被用于细胞数量的量化和shull分析。比例尺,100 μm和20 μm。n = 5只/组,双尾未配对Welch 'sgydF4y2BatgydF4y2Ba以及;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BabgydF4y2Ba, WT小鼠i.c.m.注射dii脂质体(5 mg/ml;5 μl), 24 h后灌流。dii脂质体覆盖整个大脑的代表性图像。标尺:2mm。gydF4y2BacgydF4y2Ba代表性图像显示,在DAPI共染色的轻脑膜(LM)中,CD206+ PBMs(品红)吸收了dii脂质体(青色)。比例尺:50 μm和10 μm(插入)。gydF4y2BadgydF4y2Ba实验示意图:在i.c.m.注射dii脂质体24小时后,收集轻脑膜,对dii阳性细胞进行排序并进行单细胞RNA测序。gydF4y2BaegydF4y2BatSNE图显示dii阳性细胞:单核细胞、PBMs、粒细胞、迁移树突状细胞(migDCs)、成纤维细胞和NK/T细胞。gydF4y2BafgydF4y2Ba,单细胞RNA测序显示4个PBM簇。gydF4y2BaggydF4y2Ba,点图显示gydF4y2BaMrc1gydF4y2Ba,gydF4y2BaH2-Ab1gydF4y2Ba,gydF4y2BaCd74gydF4y2Ba,gydF4y2BaCd163gydF4y2Ba而且gydF4y2BaLyve1gydF4y2Ba基因在4个PBM亚型中的表达。gydF4y2BahgydF4y2Ba,与MHCII相比,下调和上调基因对应的火山图gydF4y2Ba嗨gydF4y2Ba与Lyve1gydF4y2Ba嗨gydF4y2Bapbm。gydF4y2BaFgydF4y2Ba-test,根据每个基因用零膨胀模型计算的权重和Benjamini-Hochberg调整的P值调整自由度。gydF4y2Ba我gydF4y2Ba通路分析显示MHCII的上调和下调通路比较gydF4y2Ba嗨gydF4y2Ba与Lyve1gydF4y2Ba嗨gydF4y2Bapbm。代表测试。gydF4y2BajgydF4y2Ba.实验示意图:WT小鼠腹腔注射CLO或PBS脂质体。三天后腹腔注射OVA,一小时后灌流。gydF4y2BakgydF4y2Ba.DAPI共染脑冠状面CD206+ PBMs(青色)代表性图像,并进行相应定量。比例尺,200 μm。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BalgydF4y2Ba,注射OVA 1小时后全脑内OVA分布的代表性图像及定量。比例尺,5mm。gydF4y2Ba米gydF4y2Ba,冠状面OVA覆盖代表性图像及定量。比例尺,2毫米。为gydF4y2BalgydF4y2Ba而且gydF4y2Ba米gydF4y2Ban = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BangydF4y2BaCLO治疗后3天硬脑膜非上矢状窦区代表性图像进行抗cd206(青色)和抗cd31(黄色)联合染色并进行相应量化。gydF4y2BaogydF4y2BaCLO治疗3天后硬脑膜上矢状窦区代表性图像进行抗cd206(青色)和抗cd31(黄色)联合染色,并进行相应的量化。为gydF4y2BangydF4y2Ba而且gydF4y2BaogydF4y2Ba:比例尺,200 μm;N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BapgydF4y2Ba- - - - - -gydF4y2BaugydF4y2Ba, WT小鼠i.c.m.注射CLO或PBS脂质体。一周后收集组织。gydF4y2BapgydF4y2Ba,硬脑膜Lyve1(洋红色)覆盖范围的代表图像共染色用于DAPI和相应的量化。比例尺,3毫米。gydF4y2Ba问gydF4y2Ba,高倍镜显示横窦水平LYVE1染色,DAPI和相应的量化共染色。比例尺,500 μm。gydF4y2BargydF4y2Ba高倍镜图像显示上矢状窦水平LYVE1染色,DAPI和相应的量化共染色。比例尺,200 μm。gydF4y2Ba年代gydF4y2Ba,高倍镜图像显示CD206染色(青色)共染抗cd31(黄色)和相应的定量。比例尺,500 μm。为gydF4y2BapgydF4y2Ba- - - - - -gydF4y2Ba年代gydF4y2Ban = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BatgydF4y2Ba,来自侧脉络膜丛整体标本的代表图像进行抗cd206(青色)、抗cd31(红色)和DAPI联合染色,用相应的高倍倍数和定量。比例尺,2mm和200 μm(插图)。n = PBS组5只,CLO组6只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaugydF4y2Ba,代表颈深淋巴结抗iba1(青色)和DAPI联合染色的图像及相应的量化。比例尺,200 μm。N = 10只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2BadgydF4y2Ba而且gydF4y2BajgydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
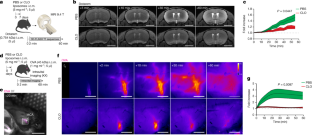
图3 PBM耗竭后脑脊液流量。gydF4y2Ba
一个gydF4y2BaPBM消耗一周后,小鼠接受fitc -葡聚糖(FITCDex;4 kDa;5 μl), 1小时后取脑,冠状面共染DAPI测定FITCdex(绿色)覆盖度。展示了代表性的图像和相应的量化。比例尺,2 mm, n = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BabgydF4y2BaPBM消耗一周后,小鼠接受i.c.m.注射德州红(3 kDa;5 μl), 1小时后取脑,冠状面共染测定德州红(Texas Red, Red)覆盖率。展示了代表性的图像和相应的量化。刻度条,2 mm. n = PBS组4只,CLO组5只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BacgydF4y2BaPBM耗竭一周后,小鼠房腔内注射OVA (45 kDa;1 μl), 1 h后取脑。展示了代表性的图像和相应的量化。刻度条,2 mm. n = PBS组4只,CLO组5只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BadgydF4y2Ba在PBM消耗一周后,小鼠接受fitc -右旋糖酐(FITCdex;4 kda;1 μl), 1 h后取脑。展示了代表性的图像和相应的量化。刻度条,2 mm, n = 4只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaegydF4y2Ba注射CLO或PBS脂质体一周后麻醉小鼠,i.c.m.插入玻璃毛细血管收集脑脊液进行蛋白质组学分析。gydF4y2BafgydF4y2Ba与pbm耗尽小鼠和对照小鼠相比,CSF中下调和上调蛋白对应的火山图。gydF4y2BaFgydF4y2Ba-test,根据每个基因用零膨胀模型计算的权重和Benjamini-Hochberg调整的P值调整自由度。gydF4y2BaggydF4y2Ba,相应的氧化石墨烯通路分析显示在pbm耗尽小鼠和对照小鼠中下调和上调通路。代表测试。gydF4y2BahgydF4y2Ba, Sunburst图表示PBM耗尽后上调的csf衍生的神经元/突触相关蛋白的位置。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba,相对光谱计数的量化gydF4y2Ba我gydF4y2Ba, Clusterin (CLU);gydF4y2BajgydF4y2Ba,载脂蛋白E (APOE)和gydF4y2BakgydF4y2Ba淀粉样前体肽(APP)。为gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BakgydF4y2BaPBS组4只,CLO组5只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BalgydF4y2Ba在PBM衰竭前和PBM衰竭后一周进行基于t2加权解剖序列的MRI检查。gydF4y2Ba米gydF4y2Ba代表性T2图像显示侧脑室(高信号)在PBM耗竭前后。比例尺,2毫米。gydF4y2BangydF4y2Ba,计量心室容积,单位为mmgydF4y2Ba3.gydF4y2Ba.N = 5只/组;单因素方差分析与Tukey多重比较检验。gydF4y2BaogydF4y2Ba在PBM耗尽后1 - (7d)和3 (21d)周测量颅内压。n = PBS组5只,CLO组7只;PBS组6只,CLO组7只;双向方差分析与Sidak多重比较检验。gydF4y2BapgydF4y2Ba, T1-FLASH 3D图像矢状视图,显示Dotarem (0.754 kDa;5 μl)在嗅球(OB)、侧脑室(Lat vtl)和大脑中动脉(MCA)等不同脑区室中积累。比例尺,3毫米。gydF4y2Ba问gydF4y2Ba,代表性T1-FLASH 3D图像显示Dotarem在MCA水平随时间的分布。比例尺,3毫米。gydF4y2BargydF4y2Ba,量化的Dotarem信号折叠增加超过一小时。n = PBS组5只,CLO组7只;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2Ba年代gydF4y2BaCLO或PBS脂质体注射1周后,小鼠腹腔注射OVA, 1小时后收获颈深淋巴结(dCLNs)。gydF4y2BatgydF4y2Ba, dCLN切片上OVA覆盖的代表性图像。比例尺,200 μm。gydF4y2BaugydF4y2Ba, dCLN面积的量化。gydF4y2BavgydF4y2Ba, OVA覆盖率的量化。为gydF4y2BaugydF4y2Ba而且gydF4y2BavgydF4y2Ban = 10只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BawgydF4y2BaCLO或PBS脂质体注射一周后,小鼠腹腔注射OVA,平卧位置于体视显微镜下动态成像暴露淋巴结内OVA扩散情况。gydF4y2BaxgydF4y2Ba,代表性图像显示随着时间的推移dcln中OVA的覆盖。比例尺,500 μm。gydF4y2BaygydF4y2Ba, OVA流入(左)和流出(右)随时间的量化。n = PBS组3只,CLO组7只;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BazgydF4y2Ba, dcln中出现OVA流出的小鼠比例。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2BaegydF4y2Ba,gydF4y2Ba年代gydF4y2Ba而且gydF4y2BawgydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图4 .扩展数据gydF4y2Ba在活的有机体内gydF4y2Ba大脑中动脉水平示踪剂扩散的记录和血管周围间隙的评价。gydF4y2Ba
一个gydF4y2Ba实验示意图:CLO或PBS脂质体注射一周后,将小鼠置于立体定向架中,剃去头部顶部和右侧,切开皮肤,轻轻去除右侧颞肌。gydF4y2BabgydF4y2Ba用棉签清洁患处后,小鼠在i.c.m.注射OVA,并立即侧卧于体视显微镜下。gydF4y2BacgydF4y2Ba,注射前和注射后20min OVA在大脑中动脉水平(MCA)的分布实例。比例尺,5毫米。gydF4y2BadgydF4y2Ba,插页gydF4y2BacgydF4y2Ba.注射后一小时OVA分布的放大图像。示踪剂位于血管周围,在血管周水平。比例尺,1毫米。gydF4y2BaegydF4y2Ba,高倍率gydF4y2BadgydF4y2Ba表明OVA可以通过血管周围细胞进行采样。比例尺,100 μm。gydF4y2BafgydF4y2Ba实验示意图:小鼠分别用KX或异氟醚麻醉(4%诱导,动态成像时1-2%),并在i.c.m.注射OVA。小鼠在动态成像过程中保持相同的麻醉状态。gydF4y2BaggydF4y2Ba, OVA随时间分布的代表性图像。比例尺,1毫米。gydF4y2BahgydF4y2Ba, OVA覆盖率随时间变化的量化。N = 5只/组;双向方差分析混合效应分析(仅最后30分钟)。gydF4y2Ba我gydF4y2Ba而且gydF4y2BajgydF4y2Ba小鼠灌流后用体视显微镜进行全脑成像,切片后进行冠状面分析。gydF4y2Ba我gydF4y2Ba代表性图像显示全脑OVA分布和定量,大脑中动脉放大。比例尺,2毫米(左面板)和1毫米(右面板)。gydF4y2BajgydF4y2Ba,冠状面OVA覆盖的代表性图像。比例尺,2毫米。为gydF4y2Ba我gydF4y2Ba而且gydF4y2BajgydF4y2Ba, n = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BakgydF4y2BaPBM耗竭1周,i.c.m.注射OVA 1小时后灌流小鼠,取出脑组织,在DAPI染色的冠状切片上分析OVA分布,并从脑表面定量分析OVA深度分布。比例尺,100 μm和50 μm(插图)。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BalgydF4y2Ba,代表图像显示抗水通道蛋白4 (AQP4)染色。比例尺,50 μm。gydF4y2Ba米gydF4y2Ba, AQP4覆盖率的量化。gydF4y2BangydF4y2Ba, AQP4+血管定量。为gydF4y2Ba米gydF4y2Ba而且gydF4y2BangydF4y2Ba, n = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaogydF4y2Ba,对脑切片进行抗aqp4(黄色)和抗cd31(青色)共染,用垂直于血管的线测量血管周围间隙。比例尺,50 μm和10 μm(插图)。gydF4y2BapgydF4y2Ba, PBS(左)和CLO(右)处理小鼠血管周围空间(PVS)的表现。gydF4y2Ba问gydF4y2Ba,血管周围间隙量化。n = PBS组4只,CLO组5只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BargydF4y2Ba在PBM耗尽一周后,小鼠接受0.1 μm厚荧光微珠的i.c.m.注射;5 μl)后立即侧卧于体视显微镜下,在MCA水平上动态成像。gydF4y2Ba年代gydF4y2Ba,代表性图像显示珠子分布在近端MCA超过一小时。比例尺,1mm。gydF4y2BatgydF4y2Ba,随着时间的推移,珠子覆盖在MCA水平的量化。n = PBS组4只,CLO组7只;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BaugydF4y2Ba,代表性图像显示位于MCA血管周围间隙的小珠gydF4y2Ba在活的有机体内gydF4y2Ba(左)和体外灌注PBS和固定4% PFA后的小鼠(右)。比例尺,1mm。gydF4y2BavgydF4y2Ba,从提取的整个大脑的代表图像显示珠子在低(左图)和高放大(右图)和相应的图轮廓。小珠(绿线)位于MCA(红线)外,在血管周水平。比例尺,2毫米。gydF4y2BawgydF4y2Ba,测量血管周围间隙(PVS)gydF4y2Ba在活的有机体内gydF4y2Ba而且gydF4y2Ba体外gydF4y2Ba来自同样的老鼠。N = 4只;双尾配对gydF4y2BatgydF4y2Ba以及。gydF4y2BaxgydF4y2Ba,代表图像显示gydF4y2Ba体外gydF4y2Bapbm消耗小鼠和pbm处理的对照组小鼠在MCA水平上的珠粒再分配,以及相应的珠粒覆盖定量。比例尺,500 μm;n = PBS组4只,CLO组5只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaygydF4y2Ba,总血管周间隙(MCA两侧之间的间隙,发现有珠粒积累)和MCA直径(通过静脉注射凝集素确定)的量化。gydF4y2BazgydF4y2Ba,对发现珠子堆积的功能空间进行量化。为gydF4y2BaygydF4y2Ba而且gydF4y2BazgydF4y2BaPBS组10只,CLO组9只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2Ba一个gydF4y2Ba,gydF4y2BafgydF4y2Ba而且gydF4y2BargydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图5 PBM耗竭对小鼠行为有轻微影响,对生命体征无影响。gydF4y2Ba
PBM消耗一周后,小鼠进行了一系列不同的行为测试。gydF4y2Ba一个gydF4y2Ba,提示恐惧条件反射:量化第一天三次电击期间冻结的时间百分比,并在恐惧条件反射后1天和7天暴露于条件反射线索。gydF4y2BabgydF4y2Ba高架加迷宫:在打开的手臂上花费的时间百分比(左),在打开的手臂上花费的总时间(中)和总移动距离(右)的量化。gydF4y2BacgydF4y2Ba、开场试验:量化1小时内移动的距离、总移动距离、1小时内在盒子中心停留的时间和在盒子中心停留的总时间。gydF4y2BadgydF4y2Ba,强制游泳测试:量化总漂浮时间(左)和漂浮延迟(右)。为gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ban = 10只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaegydF4y2Ba三室试验:小鼠首先暴露于老鼠(S1)或物体(O),然后暴露于先前暴露的老鼠(S1)或新老鼠(S2)。定量的总嗅时间和总时间花在室内的两个试验。n = PBS组17只,CLO组13只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2BaPBM衰竭1周后监测呼吸频率、心率、动脉搏动和动脉内径。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。所有数据均以平均值+/−SEM表示。gydF4y2Ba
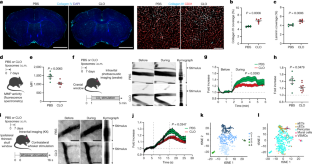
图6 PBMs和细胞外基质重塑。gydF4y2Ba
一个gydF4y2Ba注射CLO或PBS脂质体一周后灌流小鼠,取脑,切除侧脉络膜丛,对CD45-CD13+和CD45-CD31+细胞进行排序,用于单细胞RNA测序。根据典型标记确定了9种不同的细胞类型。gydF4y2BabgydF4y2Ba,火山图对应上调和下调的基因,比较pbm消耗小鼠和pbm治疗对照组小鼠的成纤维细胞,以及相应的氧化石墨烯通路分析显示-(左)和下调(右)通路。gydF4y2BacgydF4y2Ba,火山图对应的上调和下调基因,比较pbm耗尽小鼠和pbs处理的对照组小鼠的周细胞,以及相应的GO Pathway分析显示-(左)和下调(右)通路。gydF4y2BadgydF4y2Ba,火山图对应的上调和下调基因比较ppbm耗尽小鼠和pbs处理对照组小鼠的毛细血管内皮细胞(cECs),以及相应的GO通路分析显示-(左)和下调(右)通路。为gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,火山情节:gydF4y2BaFgydF4y2Ba-test根据每个基因的权重计算,采用零膨胀模型和Benjamini-Hochberg调整的P值,调整自由度;go路径分析:过表征检验。gydF4y2BaegydF4y2Ba具有代表性的图像显示,抗cd13(壁细胞,黄色)染色的大脑皮层部分,抗cd206(品红色),抗层粘连蛋白(青色)和DAPI的共染色,并进行相应的量化。比例尺,100 μm;N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba具有代表性的图像显示大脑皮层部分的抗cd31(内皮细胞)染色和相应的量化。比例尺,200 μm;N = 6只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaggydF4y2Ba具有代表性的图像显示在i.c.m.注射OVA(洋红色)的小鼠皮质大脑切片,染色为抗-αSMA(血管平滑肌细胞,青色),共染色为抗cd31(黄色),并进行相应的量化。比例尺,200 μm;N = 6只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BahgydF4y2Ba注射CLO或PBS脂质体1周后,冠状切片进行抗层粘连蛋白(青色)和DAPI(蓝色)染色。比例尺,2毫米。gydF4y2BakgydF4y2Ba高倍镜图像显示层粘连蛋白(青色)与CD31+血管(红色)相结合。比例尺,200 μm。gydF4y2Ba我gydF4y2Ba, PBM消耗一周后分离的脑血管中胶原蛋白iv (160 kDa)和Ponceau S的代表性Western blot图像,并进行相应的量化。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BajgydF4y2Ba,代表图像显示胶原- iv(青色)沉积在两个αSMAgydF4y2Ba+gydF4y2Ba(动脉/小动脉;黄色)和αSMA-血管。比例尺,200 μm。gydF4y2BakgydF4y2Ba而且gydF4y2BalgydF4y2Ba,小鼠皮层的代表性图像显示gydF4y2BakgydF4y2Ba: Collagen-IV;而且gydF4y2BalgydF4y2Ba:层粘连蛋白(青色),抗cd31共染色(红色),以及各自的量化。比例尺,200 μm;N = 6只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2Ba米gydF4y2Ba,高倍镜图像显示与αSMA相关的层粘连蛋白(青色)gydF4y2Ba+gydF4y2Ba表面和穿透的大血管(洋红色),以及相应的量化。gydF4y2BangydF4y2Ba高倍镜图像显示胶原- iv(青色)与αSMA相关gydF4y2Ba+gydF4y2Ba表面和穿透的大血管(洋红色),以及相应的量化。为gydF4y2Ba米gydF4y2Ba而且gydF4y2BangydF4y2Ba:比例尺,200 μm;N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaogydF4y2Ba实验示意图:小鼠在腹腔注射OVA (1mg/ml) 30min前先腹腔注射多巴酚丁胺(40μg/kg)或生理盐水;5μl)。小鼠在1小时后进行灌流。gydF4y2BapgydF4y2Ba全脑OVA分布及定量的代表性图像。gydF4y2Ba问gydF4y2Ba,脑组织冠状面OVA覆盖及定量的代表性图像。为gydF4y2BapgydF4y2Ba而且gydF4y2Ba问gydF4y2Ba,比例尺,2毫米;n = PBS组6只,CLO组4只;多巴酚丁胺组PBS组3只,CLO组5只;具有多次比较的双向方差分析。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2Ba一个gydF4y2Ba而且gydF4y2BaogydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图7 LYVE1+ PBMs驱动脑脊液流动动力学。gydF4y2Ba
一个gydF4y2Ba,全脑单细胞RNA测序。根据典型标记确定了18种细胞类型。gydF4y2BabgydF4y2Ba扫描电子显微镜图像从小鼠皮层显示的PBM和血管平滑肌细胞(VSMC)之间的相互作用。比例尺,2 μm。gydF4y2BacgydF4y2Ba的点图。gydF4y2BaMrc1gydF4y2Ba(CD206),gydF4y2BaH2-Ab1gydF4y2Ba(MHCII),gydF4y2BaCd74gydF4y2Ba,gydF4y2BaCd163gydF4y2Ba而且gydF4y2BaLyve1gydF4y2Ba表达式在每个PBM集群中。gydF4y2BadgydF4y2Ba而且gydF4y2BaegydF4y2Ba火山图和GO通路分析显示PBM簇2与其他PBM簇相比,有上调和下调的通路。火山地块:gydF4y2BaFgydF4y2Ba-test根据每个基因的权重计算,采用零膨胀模型和Benjamini-Hochberg调整的P值,调整自由度;go路径分析:过表征检验。gydF4y2BafgydF4y2BaLYVE1+ PBMs(品红色)和αSMA+ VSMC(黄色)之间相互作用的代表性图像。比例尺,200 μm和50 μm(插入)。gydF4y2BaggydF4y2Ba, LYVE1+细胞与αSMA+血管相关或不相关的定量。N = 5只小鼠。gydF4y2BahgydF4y2Ba小鼠静脉注射凝集素,几分钟后再灌流。提取整个大脑,用4%的PFA固定后,染色抗-αSMA(绿色)和抗lyve1(顶部)或抗mhcii(底部)(青色)。比例尺:1mm和200 μm(插图)。gydF4y2Ba我gydF4y2BaLyve1中PBM损耗的表征gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba使用CD206染色(DAPI共染色)的小鼠(Cre+)与未表达Cre (Csf1rgydF4y2Bafl / flgydF4y2Ba;Cre)。比例尺,500 μm;n = 7只Cre-小鼠,3只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BajgydF4y2Ba流式细胞仪显示Csf1r中CD206+细胞gydF4y2Bafl / flgydF4y2Ba老鼠(左;Cre-)和Lyve1gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba老鼠(右;Cre+),以及CD206+ PBM细胞数量的量化(左)和CD45+细胞总数中CD206+ PBM的频率(右)。gydF4y2BakgydF4y2Ba, CD11b+CD45的定量分析gydF4y2BaintgydF4y2Ba小胶质细胞数量(左)和CD11b+CD45的频率gydF4y2BaintgydF4y2Ba来自CD45+细胞的小胶质细胞(右)。gydF4y2BalgydF4y2Ba流式细胞仪显示Csf1r中的CD38+和/或MHCII+ CD206+ PBMsgydF4y2BaflgydF4y2Ba老鼠(左;Cre-)和Lyve1gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2BaflgydF4y2Ba老鼠(右;Cre +)。gydF4y2Ba米gydF4y2Ba, MHCII+CD38- PBMs的定量(左),以及总体CD206+细胞中MHCII+CD38- PBMs的频率(右)。gydF4y2BangydF4y2Ba, MHCII-CD38+ PBMs的定量(左),以及总体CD206+细胞中MHCII-CD38+ PBMs的频率(右)。为gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BangydF4y2Ban = 8只Cre-小鼠,4只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaogydF4y2Ba(上)Lyve1的冠状脑切片代表性图像gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre-)小鼠抗层粘连蛋白(青色)和DAPI联合染色。(下)高倍镜图像显示层粘连蛋白位于CD31+血管附近(红色),并进行了相应的量化。比例尺,上2mm,下200 μm。gydF4y2BapgydF4y2Ba,(左)Lyve1冠状脑切片的代表性图像gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre-)小鼠的抗胶原蛋白iv(青色,右侧)和DAPI联合染色。(右)高倍镜图像显示胶原蛋白iv位于CD31+血管附近(红色),并进行了相应的量化。比例尺,左为2mm,右为200 μm。gydF4y2Ba问gydF4y2Ba3月龄Cre+和Cre-小鼠腹腔注射Dotarem (0.74 kda;5 μl),立即俯卧位放入MRI装置进行动态成像。gydF4y2BargydF4y2Ba,代表性脑冠状图像显示Dotarem分布超过一小时。比例尺,3mm。gydF4y2Ba年代gydF4y2Ban = 8只Cre-小鼠,5只Cre+小鼠;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BatgydF4y2Ba,gydF4y2Ba在活的有机体内gydF4y2BaLyve1中MCA水平OVA覆盖的成像gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre-)小鼠,具有相应的代表性图像和定量。比例尺,1mm;n = 7只Cre-小鼠,5只Cre+小鼠;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BaugydF4y2BaLyve1中全脑OVA分布的代表性图像gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre)老鼠。比例尺,5毫米。gydF4y2BavgydF4y2Ba, Lyve1冠状面OVA覆盖率gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre)老鼠。比例尺,2mm。为gydF4y2BaugydF4y2Ba而且gydF4y2BavgydF4y2Ban = 7只Cre-小鼠,3只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaxgydF4y2Ba, Lyve1中CD31的定量覆盖gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre-)小鼠脑切片。n = 7只Cre-小鼠,3只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaygydF4y2Ba, Lyve1中MMP活性的定量分析gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre-)小鼠孵育15 min后荧光光谱测定。n = 8只Cre-小鼠,4只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BazgydF4y2Ba,通过Lyve1量化颅内压gydF4y2BaCregydF4y2Ba:: Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre+)和Csf1rgydF4y2Bafl / flgydF4y2Ba(Cre)老鼠。n = 6只Cre-小鼠,4只Cre+小鼠;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。所有数据均以平均值+/−SEM表示。老鼠的插图(gydF4y2BahgydF4y2Ba,gydF4y2Ba问gydF4y2Ba)及核磁共振扫描仪(gydF4y2Ba问gydF4y2Ba)来自Servier Medical ArtgydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
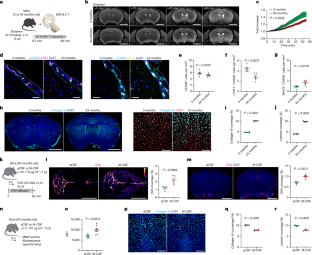
图8正常老化的PBMs。gydF4y2Ba
一个gydF4y2Ba,实验示意图:幼龄(3月龄)和幼龄(24月龄)小鼠腹腔注射OVA (45kda;1毫克/毫升;5μl)。注射后立即将小鼠侧躺在体视显微镜下进行动态成像。gydF4y2BabgydF4y2Ba, OVA随时间分布的代表性图像。比例尺,1毫米。gydF4y2BacgydF4y2Ba3 m和24 m龄小鼠OVA信号随时间的增加而增加。N = 5只/组;重复测量2-way方差分析与Geisser-Greenhouse校正。gydF4y2BadgydF4y2Ba而且gydF4y2BaegydF4y2Ba3、24 m龄小鼠i.c.m.注射OVA。小鼠在1小时后进行灌流。gydF4y2BadgydF4y2Ba3 m和24 m龄小鼠全脑OVA分布的代表性图像,并进行了定量分析。比例尺,5毫米。gydF4y2BaegydF4y2Ba3 m和24 m龄小鼠冠状切片OVA覆盖情况,并进行相应定量分析。比例尺,2毫米。为gydF4y2BadgydF4y2Ba而且gydF4y2BaegydF4y2Ba: 3 m小鼠5只,24 m小鼠4只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba3m和24m龄小鼠i.c.m.注射Texas Red (3 kDa;1毫克/毫升;5 μl), 1 h后取脑。德克萨斯州红色覆盖的代表性图像(红色)和相应的量化。比例尺,2 mm, n = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaggydF4y2Ba,免疫染色定量LYVE1+MHCII-与LYVE1-MHCII+ PBMs的饼图表示。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BahgydF4y2Ba3 m和24 m龄小鼠的代表性流式细胞仪图显示PBM亚型,其特征是CD38和MHCII的表达。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba,量化gydF4y2Ba我gydF4y2Ba: CD206+ PBMs;gydF4y2BajgydF4y2Ba: MHCII+CD38- PBMs和gydF4y2BakgydF4y2Ba: MHCII-CD38+ PBMs。为gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba, n = 6只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BalgydF4y2Ba3、24m龄小鼠腹腔注射pHrodo颗粒(1 μm;5 μl),被吞噬后荧光才显现。比例尺,2毫米。gydF4y2Ba米gydF4y2Ba,代表性共聚焦图像显示pHrodo颗粒被CD206+ PBMs吞噬。比例尺,50 μm。gydF4y2BangydF4y2Ba, phrodo阳性PBMs也可以通过流式细胞术检测。gydF4y2BaogydF4y2Ba3米龄小鼠中pHrodo+MHCII-CD38+与pHrodo+MHCII+CD38- PBMs的定量分析。N = 6只小鼠;配对gydF4y2BatgydF4y2Ba以及。gydF4y2BapgydF4y2Ba3 m和24 m龄小鼠的代表性图像显示在MCA水平上pHrodo颗粒再分区,并进行了相应的量化。比例尺,2毫米。gydF4y2Ba问gydF4y2Ba3 m和24 m龄小鼠体内pHrodo+CD206+ PBMs的定量研究。为gydF4y2BapgydF4y2Ba而且gydF4y2Ba问gydF4y2Ban = 6只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BargydF4y2Ba24 m龄小鼠中pHrodo+MHCII-CD38+与pHrodo+MHCII+CD38- PBMs的定量分析。N = 6只小鼠;配对gydF4y2BatgydF4y2Ba以及。gydF4y2Ba年代gydF4y2Ba3 m和24 m大鼠分别接受0.1 μm厚荧光微珠的I.C.M.注射;5μl)。小鼠在1小时后进行灌流。从提取的整个大脑的代表图像显示珠子在低(左图)和高倍放大(插图,右图)的重新划分。比例尺,2毫米和1毫米(插图)。gydF4y2BatgydF4y2Ba,脑珠覆盖率的量化。gydF4y2BaugydF4y2Ba,总血管周间隙的量化(MCA两侧之间的间隙,发现有珠粒堆积)gydF4y2BavgydF4y2Ba, MCA直径的定量(通过静脉注射凝集素鉴定)。gydF4y2BawgydF4y2Ba,对发现珠子堆积的功能空间进行量化。为gydF4y2BatgydF4y2Ba-gydF4y2BawgydF4y2Ban = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BaxgydF4y2Ba3 m和24 m龄小鼠的冠状面共染抗aqp4(黄色)和抗cd31(青色),测量血管周围空间大小。50 μm和10 μm刻度条(插图)和3 m(中间)和24 m(右)老年小鼠血管周围空间(PVS)直径的表示。gydF4y2BaygydF4y2Ba,血管周围间隙直径的量化。N = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BazgydF4y2Ba,(左)脑冠状切片染色抗层粘连蛋白(青色)和DAPI(蓝色)。(右)高倍镜图像显示层粘连蛋白(青色)与CD31+血管(红色)相结合。比例尺,200 μm。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2Ba一个gydF4y2Ba而且gydF4y2BadgydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图9老年小鼠M-CSF治疗。gydF4y2Ba
一个gydF4y2Ba,小提琴情节表现的表达gydF4y2BaCsf1rgydF4y2Ba主要由PBMs,单核细胞和小胶质细胞,以及表达gydF4y2BaCsf1gydF4y2Ba,主要由内皮细胞、壁细胞和小胶质细胞表达,来自小鼠5xFAD单细胞RNA测序数据集。gydF4y2BabgydF4y2Ba而且gydF4y2BacgydF4y2Ba在i.c.m.注射人工脑脊液(aCSF)或M-CSF (10 μg/ml) 6小时后的老年小鼠脑冠状面;5 μl)染色gydF4y2BabgydF4y2Ba:抗胶原蛋白iv(左图)或gydF4y2BacgydF4y2Ba:抗层粘连蛋白(右侧面板),DAPI,比较尺,2mm和200 μm共染色。gydF4y2BadgydF4y2Ba实验方法:24 m龄小鼠i.c.m.注射m -CSF(或aCSF作为对照),24 h后小鼠i.c.m.注射OVA,评估CSF流量。gydF4y2BaegydF4y2Ba, MCA水平OVA覆盖的代表性图像,以及相应的量化。比例尺,500 μm。n = aCSF组7只,M-CSF组8只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba实验示意图:24 m龄小鼠i.c.m.注射m - csf(或aCSF作为对照),24 h后用荧光光谱法测定MMP活性。gydF4y2BaggydF4y2Ba, MMP活性的量化。N = 8只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。所有数据均以平均值+/−SEM表示。老鼠的插图gydF4y2BadgydF4y2Ba而且gydF4y2BafgydF4y2Ba来自瑟维尔医学艺术gydF4y2BaCc / 3.0gydF4y2Ba.gydF4y2Ba
图10阿尔茨海默病小鼠模型和AD患者中的PBMs。gydF4y2Ba
一个gydF4y2Ba而且gydF4y2BabgydF4y2BaCLO或PBS脂质体注射1个月后,5xFAD小鼠腹腔注射OVA, 1小时后分析大脑。gydF4y2Ba一个gydF4y2Ba全脑OVA分布的代表性图像和定量。比例尺,2毫米。gydF4y2BabgydF4y2Ba,冠状面OVA覆盖代表性图像及定量。比例尺,2毫米。为gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2BaPBS组小鼠7只,CLO组小鼠8只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BacgydF4y2Ba,杏仁核、皮质和海马Aβ覆盖的定量分析。n = PBS组小鼠7只,CLO组小鼠8只;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BadgydF4y2Ba根据CD13、CD31和CD45的表达,tSNE图显示5xFAD小鼠单细胞RNA测序数据集上的35个不同簇。gydF4y2BaegydF4y2Ba,gydF4y2BaMrc1gydF4y2Ba在巨噬细胞簇中表达可以识别PBM。gydF4y2BafgydF4y2Ba,热图显示经校正p值后,每簇前10个正差异表达基因。gydF4y2BaggydF4y2Ba通路分析显示,与WT窝鼠相比,5xFAD小鼠的通路上调和下调。代表测试。gydF4y2BahgydF4y2BaRNA磁铁算法确定PBMs优先与血管平滑肌细胞(VSMCs)、周细胞和成纤维细胞样细胞(FLCs)相互作用。gydF4y2Ba我gydF4y2Ba对家族、症状前、散发和非ad患者进行单核RNA测序。gydF4y2BajgydF4y2Ba通路分析显示,与对照组相比,家族性AD患者的通路上调和下调。代表测试。gydF4y2BakgydF4y2Ba的基因表达水平gydF4y2BaIfngr1gydF4y2Ba而且gydF4y2BaIfngr2gydF4y2Ba来自小鼠5xFAD单细胞RNA测序数据集的免疫细胞和基质细胞。gydF4y2BalgydF4y2Ba而且gydF4y2Ba米gydF4y2Ba野生型小鼠在i.c.m.注射人工脑脊液(aCSF)或干扰素γ (IFNγ, 20 ng/ml;1μl)。同样的小鼠接受腹腔注射OVA (1mg/ml;3 h后取脑,1 h后取脑。gydF4y2BalgydF4y2Ba全脑OVA分布的代表性图像和定量。gydF4y2Ba米gydF4y2Ba,冠状面OVA覆盖及定量的代表性图像。为gydF4y2BalgydF4y2Ba而且gydF4y2Ba米gydF4y2Ba, n = 5只/组;双尾未配对韦尔奇氏gydF4y2BatgydF4y2Ba以及。gydF4y2BangydF4y2Ba,提出的模型,概括了研究结果。所有数据均以平均值+/−SEM表示。gydF4y2Ba
补充信息gydF4y2Ba
补充数据gydF4y2Ba
此文件包含补充图1,即脑血管片段的原始western blot,以及补充图2,即脑血管片段的原始Ponceau S。gydF4y2Ba
补充数据1gydF4y2Ba
包含所有原始数据和分析的PRISM文件。gydF4y2Ba
补充视频1gydF4y2Ba
CD206gydF4y2Ba+gydF4y2Bapbm位于大血管的周边。gydF4y2Ba
补充视频2gydF4y2Ba
光片显微镜观察脑组织OVA分布。gydF4y2Ba
补充视频3gydF4y2Ba
通过MRI观察pbs处理小鼠的Dotarem动态分布。gydF4y2Ba
补充视频4gydF4y2Ba
磁共振成像显示clo治疗小鼠的Dotarem动态分布。gydF4y2Ba
补充视频5gydF4y2Ba
体视显微镜观察pbs处理小鼠体内OVA的动态分布。gydF4y2Ba
补充视频6gydF4y2Ba
立体显微镜观察小鼠体内OVA的动态分布。gydF4y2Ba
补充视频7gydF4y2Ba
CO后血管舒张gydF4y2Ba2gydF4y2Ba光声显微镜对pbs处理小鼠的挑战。gydF4y2Ba
补充视频8gydF4y2Ba
CO后血管舒张gydF4y2Ba2gydF4y2Ba通过光声显微镜观察氯代酚处理小鼠的变化。gydF4y2Ba
补充视频9gydF4y2Ba
体视显微镜下pbs处理小鼠须刺激后血管舒张。gydF4y2Ba
补充视频10gydF4y2Ba
体视显微镜下pbs处理小鼠须刺激后血管舒张。gydF4y2Ba
权利与权限gydF4y2Ba
自然或其许可方(例如,社会或其他合作伙伴)根据与作者或其他权利所有人签订的出版协议,对本文享有专有权;作者对本文已接受的手稿版本的自我存档完全受此类出版协议条款和适用法律的约束。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
德里乌,A,杜,S,斯托克,SgydF4y2Baet al。gydF4y2Ba实质边界巨噬细胞调节脑脊液的流动动力学。gydF4y2Ba自然gydF4y2Ba(2022)。https://doi.org/10.1038/s41586-022-05397-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05397-3gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba
