摘要gydF4y2Ba
父亲接触电离辐射如何影响后代的遗传和疾病风险一直是辐射生物学中一个长期存在的问题。在人类中,近80%的遗传突变发生在父系生殖系gydF4y2Ba1gydF4y2Ba但电离辐射暴露的跨代效应仍有争议,其机制尚不清楚。这里我们用性别区分来说明gydF4y2Ba秀丽隐杆线虫gydF4y2Ba菌株,父亲,但不是母亲,暴露于电离辐射会导致跨代胚胎致死。受辐射雄性的后代表现出多种基因组不稳定表型,包括DNA片段化、染色体重排和非整倍体。父本DNA双链断裂由母本提供的易出错聚合酶介导的末端连接修复。从机制上讲,我们发现人类组蛋白H1.0的同源物HIS-24或异染色质蛋白HPL-1的缺失可以显著逆转跨代胚胎致死率。去除HIS-24或HPL-1可以减少组蛋白3赖氨酸9二甲基化,并使F -1的种系无错误同源重组修复成为可能gydF4y2Ba1gydF4y2Ba电离辐射处理P产生gydF4y2Ba0gydF4y2Ba雄性,从而提高了FgydF4y2Ba2 gydF4y2Ba的一代。这项工作建立了父亲辐射暴露对后代健康的遗传后果的机制基础,这可能导致人类的先天性疾病和癌症。gydF4y2Ba
主要gydF4y2Ba
电离辐射诱导DNA双链断裂(DSBs),可引起新生突变(dnm)和染色体畸变gydF4y2Ba2 gydF4y2Ba。体细胞dnm与癌症和衰老高度相关gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。生殖系dna可以传递给后代,是基因组进化的驱动力gydF4y2Ba5gydF4y2Ba但也可能导致先天性疾病gydF4y2Ba6克ydF4y2Ba。在人类中,近80%的dnmgydF4y2Ba1gydF4y2Ba-包括70%的从头结构变体gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba-起源于父系生殖系。越来越多的证据表明,父系生殖系dnm与各种先天性疾病、精神分裂症、自闭症和生殖缺陷有关gydF4y2Ba1gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba。尽管如此,父母接触电离辐射与后代遗传效应之间的关系仍不确定gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba。从出生在核电站附近的儿童那里得到了相互矛盾的观察结果gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba。对切尔诺贝利事故清理工人的后代以及广岛和长崎原子弹爆炸幸存者的研究表明,没有证据表明父母的辐射照射会产生跨代影响gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba。然而,人类流行病学研究通常受到样本量、混合人群和辐射剂量记录的限制。相比之下,父亲在受孕前接受化疗最近与种系高突变有关gydF4y2Ba21gydF4y2Ba这与后代的罕见遗传疾病有关gydF4y2Ba22gydF4y2Ba。这就提出了一个问题,即父亲接触诱变剂是否会导致跨代效应。gydF4y2Ba
这里,我们使用了性别分离的突变体gydF4y2Ba秀丽隐杆线虫gydF4y2Ba探讨父亲辐射暴露的跨代效应。我们表明,父亲暴露于电离辐射导致基因组不稳定的FgydF4y2Ba1gydF4y2Ba代和跨代胚胎致死率。我们确定父本DNA损伤主要通过母体提供的易出错聚合酶介导的末端连接(TMEJ)在受精卵中修复,从而导致染色体畸变。具有这种TMEJ特征微同源性的结构变异也存在于自然界中gydF4y2Ba秀丽隐杆线虫gydF4y2Ba变异和人类父系生殖系突变,表明一个保守的机制。去除组蛋白H1 HIS-24或异染色质蛋白HPL-1可以通过激活无错误同源重组修复(HRR)途径逆转父亲暴露于电离辐射的跨代胚胎致死。我们的工作为父亲暴露于电离辐射的跨代遗传和表观遗传效应提供了机制基础。gydF4y2Ba
电离辐射引起跨代效应gydF4y2Ba
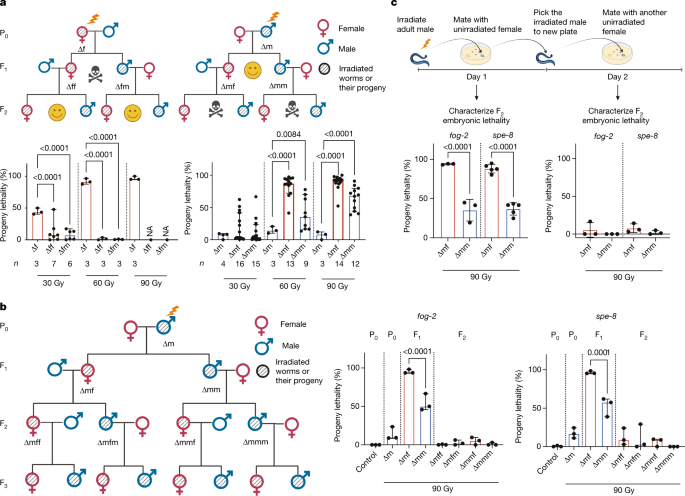
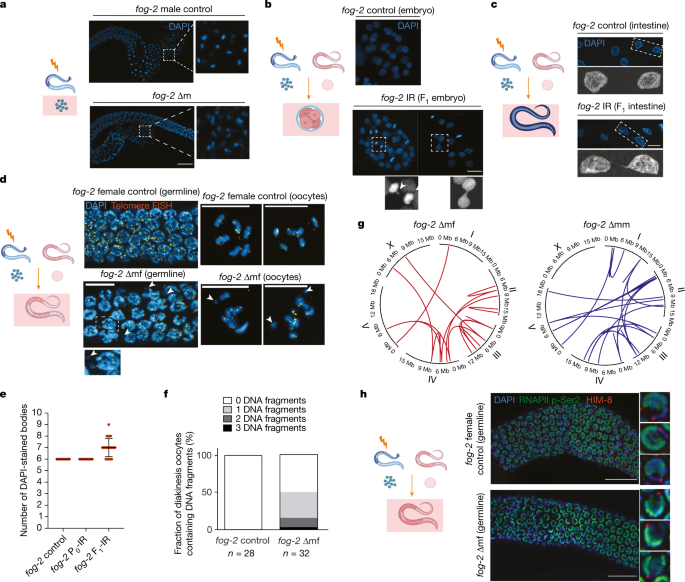
为了研究遗传毒性应激的跨代后果,我们暴露了gydF4y2Ba秀丽隐杆线虫gydF4y2Ba电离辐射,并评估其对后代的影响。野生型gydF4y2Ba秀丽隐杆线虫gydF4y2Ba有两种性别形式:自我受精的雌雄同体和雄性。为了区分DNA损伤对雄性和雌性配子的影响,我们使用了雌性化突变体gydF4y2Bafog-2gydF4y2Ba它有一个雌雄异株生殖系统:体细胞雌雄同体,只产生一个雌性生殖系和一个正常的雄性生殖系。电离辐射处理后,雌性(∆f)立即与未辐照的雄性交配,24 h后观察后代的生存能力。正如预期的那样,电离辐射治疗导致了剂量依赖性的胚胎致死率(图2)。gydF4y2Ba1gydF4y2Ba;所有结果的完整统计分析见补充表gydF4y2Ba1gydF4y2Ba),这是由于卵母细胞中存在过多未修复的DNA dsb。当我们将幸存的雌性(∆ff)和雄性(∆fm)杂交时gydF4y2Ba1gydF4y2Ba蠕虫和健康的异性蠕虫,FgydF4y2Ba2 gydF4y2Ba代显示几乎没有胚胎致死性(图2)。gydF4y2Ba1gydF4y2Ba).这一观察结果表明,卵母细胞中携带的DNA dsb可以得到适当的修复或消除,从而防止母体DNA损伤的任何跨代效应。gydF4y2Ba
一个gydF4y2Ba母亲和父亲接触不同剂量电离辐射的谱系和跨代特征。左图,母体暴露于电离辐射(PgydF4y2Ba0gydF4y2Ba∆f)导致f的代间胚胎致死率gydF4y2Ba1gydF4y2Ba的一代。除90 Gy组没有存活的后代发育到成年外,其余均存活gydF4y2Bafog-2gydF4y2BaFgydF4y2Ba1gydF4y2Ba(∆ff和∆fm)与未辐照异性杂交后,胚胎致死性恢复到基础水平。gydF4y2BangydF4y2Ba表示生物复制的数量;每个复制包括三个gydF4y2Bafog-2gydF4y2Ba女性和三名gydF4y2Bafog-2gydF4y2Ba男性。对,父亲电离辐射暴露(PgydF4y2Ba0gydF4y2Ba∆m)导致胚胎致死率轻微增加gydF4y2Ba1gydF4y2Ba一代,以及幸存的FgydF4y2Ba1gydF4y2Ba(∆mf和∆mm)显示了FgydF4y2Ba2 gydF4y2Ba的一代。gydF4y2BangydF4y2Ba生物复制的数量。数据中位数为±95%置信区间;gydF4y2BaPgydF4y2Ba显示值。在整个图中,红色条表示女性,蓝色条表示男性。NA,不适用。gydF4y2BabgydF4y2Ba父亲电离辐射暴露(90 Gy)的家系和三代后代的跨代致死率特征。gydF4y2BangydF4y2Ba= 3个生物重复,每个重复3雌3雄。数据中位数为±95%置信区间;gydF4y2BaPgydF4y2Ba显示值。gydF4y2BacgydF4y2Ba,新鲜辐照PgydF4y2Ba0gydF4y2Ba成年雄性和雄性在电离辐射照射2天后表现出不同的跨代效应。gydF4y2Bafog-2gydF4y2Ba:gydF4y2BangydF4y2Ba= 3个生物重复;gydF4y2Baspe-8gydF4y2Ba:gydF4y2BangydF4y2Ba= 5个生物重复;每个重复包括3只雌性和3只雄性。数据中位数为±95%置信区间;gydF4y2BaPgydF4y2Ba显示值。比例数据采用logit链接函数广义线性模型(GLM)和Tukey多重比较,单向(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或双向(gydF4y2BacgydF4y2Ba)采用反正弦变换方差分析(ANOVA)对统计结果进行验证(补充表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
接下来,我们测试了雄性电离辐射治疗(∆m)是否会影响后代。电离辐射暴露后,雄鼠立即与未经处理的雌鼠交配。∆m的后代致死率相对较低(图2)。gydF4y2Ba1gydF4y2Ba),这表明父系DNA损伤要么被修复,要么在FgydF4y2Ba1gydF4y2Ba的一代。没想到,过了FgydF4y2Ba1gydF4y2Ba与健康的异性虫杂交,FgydF4y2Ba2 gydF4y2Ba生成量明显增加(图2)。gydF4y2Ba1gydF4y2Ba).值得注意的是,这种胚胎致死率的增加在雌性FgydF4y2Ba1gydF4y2Ba(∆mf)和雄性FgydF4y2Ba1gydF4y2Ba(∆mm)蠕虫(图。gydF4y2Ba1gydF4y2Ba).这些观察结果证实,男性暴露于电离辐射可导致F的跨代致死率gydF4y2Ba2 gydF4y2Ba的一代。gydF4y2Ba
随后交配的幸存后代从FgydF4y2Ba2 gydF4y2Ba有健康异性的一代恢复了后代的生存能力(图2)。gydF4y2Ba1 bgydF4y2Ba),这表明精子遗传的有害影响可以在与健康蠕虫杂交两代内基本消除。我们还用一个独立的雌性化突变体验证了这一观察结果,gydF4y2Baspe-8gydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
可能是由于高度浓缩的染色体结构中有限的DNA修复能力,成熟精子比精母细胞更容易受到DNA损伤gydF4y2Ba23gydF4y2Ba。和人类一样,精子发生在男性身上gydF4y2Ba秀丽隐杆线虫gydF4y2Ba在成年线虫中是持续进行的,在一个线虫的交配中,大约三分之二的成熟精子被射精。为了测试成熟精子是否可能是跨代致死率的原因,我们首先收集了来自新鲜辐照的后代gydF4y2Bafog-2gydF4y2Ba或gydF4y2Baspe-8gydF4y2Ba评估辐照对雄性成熟精子的影响。第二天,我们将辐照后的雄虫与未处理的雌虫交配,以测试辐照对成熟前精子发生的影响。只有刚受辐射的雄性的后代导致了跨代致死率(图2)。gydF4y2Ba1 cgydF4y2Ba),表明只有成熟精子对电离辐射引起的跨代致死率负责。gydF4y2Ba
接下来,我们测试了跨代致死率是否也发生在野生型中gydF4y2Ba秀丽隐杆线虫gydF4y2Ba雌雄同体。精子发生开始于L3幼虫期晚期,到L4幼虫期晚期停止,此时种系转向卵发生,而成熟精子储存在精囊中。只有在L4晚期照射野生型雌雄同体,而在L4晚期或L4幼龄时不照射,可导致F的跨代致死率gydF4y2Ba2 gydF4y2Ba和FgydF4y2Ba3.gydF4y2Ba世代(扩展数据图)gydF4y2Ba1gydF4y2Ba),验证了暴露在雌雄同体野生型蠕虫的成熟精子中的电离辐射可能导致跨代致死。gydF4y2Ba
与…相反gydF4y2Bafog-2gydF4y2Ba突变体,野生型雌雄同体自我受精,因此可能进一步延续不稳定的基因组。事实上,我们观察到,跨代致死率至少维持了六代(扩展数据图)。gydF4y2Ba1 bgydF4y2Ba).这些结果表明,FgydF4y2Ba3.gydF4y2Ba一代的gydF4y2Bafog-2gydF4y2Ba突变主要是由于通过与未受辐射的异性进行三次异交来稀释跨代效应。gydF4y2Ba
父亲诱导的基因组不稳定gydF4y2Ba
为了解决父系DNA损伤是否会导致遗传变化,我们跟踪了从辐照精子到生殖细胞的染色质状态gydF4y2Ba1gydF4y2Ba的一代。电离辐射治疗导致精子形态改变gydF4y2Bafog-2gydF4y2Ba∆m具有“彗星状”构象(图2)。gydF4y2Ba2gydF4y2Ba及扩展数据图gydF4y2Ba2gydF4y2Ba).受精后,胚胎表现出各种染色体不稳定表型,包括染色体桥的形成和染色体滞后(图2)。gydF4y2Ba2 bgydF4y2Ba及扩展数据图gydF4y2Ba2 bgydF4y2Ba).染色体桥的形成表明分裂的胚胎细胞进入了“断裂-融合-桥”周期gydF4y2Ba24gydF4y2Ba。尽管存在这些染色体畸变,但大多数胚胎发育为表型健康的成人,这表明精子中的dsb在胚胎发生早期绕过了有丝分裂检查点的监视。与父本辐照的胚胎不同,母本辐照引起的DNA损伤主要是DNA片段化gydF4y2Ba1gydF4y2Ba胚胎(扩展数据图)gydF4y2Ba2 b, cgydF4y2Ba).这样的DNA片段可能进一步引发有丝分裂灾难,解释了FgydF4y2Ba1gydF4y2Ba的一代。gydF4y2Ba
一个gydF4y2Ba左,雄性种系DAPI染色。对,放大的成熟精子。标尺,20 μm。gydF4y2BabgydF4y2Ba胚胎DAPI染色。底部,染色体滞后和桥接。标尺,10 μm。gydF4y2BacgydF4y2Ba肠DAPI染色。下图为两个代表性细胞的放大图。标尺,10 μm。gydF4y2BadgydF4y2Ba、端粒荧光原位杂交(FISH)和DAPI染色。下图是DNA片段的放大图。对,晚期卵母细胞。箭头表示DNA断裂。标尺,10 μm。实验gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba重复三次,观察结果相似;实验gydF4y2BadgydF4y2Ba重复了两次,得到了相似的结果。gydF4y2BaegydF4y2Badapi染色体在晚期卵母细胞中的定量。数据为平均值±标准差,gydF4y2BangydF4y2Ba= 25个卵母细胞gydF4y2BafgydF4y2BaDNA片段的定量分析(不含端粒FISH信号)。gydF4y2BangydF4y2Ba表示卵母细胞数。gydF4y2BaggydF4y2Ba在∆mf和∆mm中显示染色体易位(染色体间或染色体内融合)的代表性圆形图。所有易位列于补充表gydF4y2Ba3.gydF4y2Ba。gydF4y2BahgydF4y2BaRNAPll p-Ser2、hm -8和DAPI染色。对,三个有代表性的原子核。标尺,20 μm。这个实验重复了三次,结果相似。红外表明暴露于电离辐射。绘图说明(gydF4y2Ba一个gydF4y2Ba)精子,(gydF4y2BabgydF4y2Ba) FgydF4y2Ba1gydF4y2Ba胚胎(gydF4y2BacgydF4y2Ba) FgydF4y2Ba1gydF4y2Ba体细胞组织和(gydF4y2BadgydF4y2Ba,gydF4y2BahgydF4y2Ba) FgydF4y2Ba1gydF4y2Ba在各自的小组中调查辐照雄性的生殖系。gydF4y2Ba
接下来,我们描述了成人的染色体状态gydF4y2Bafog-2gydF4y2BaFgydF4y2Ba1gydF4y2Ba有遗传DNA损伤的后代肠核在幼虫发育过程中经历了一组程序性内重复,在肠核中显示出染色体桥gydF4y2Bafog-2gydF4y2BaFgydF4y2Ba1gydF4y2Ba的后代gydF4y2Bafog-2gydF4y2Ba∆m(图。gydF4y2Ba2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba二维gydF4y2Ba),这表明DNA的持久性从胚胎发育一直持续到成年。我们观察到类似的染色体桥在雌雄同体FgydF4y2Ba1gydF4y2Ba辐照后L4幼虫的后代(扩展数据图)gydF4y2Ba2 egydF4y2Ba).肠染色体桥在大肠杆菌中缺失gydF4y2Ba1gydF4y2Ba母体辐射暴露的代,表明存活的FgydF4y2Ba1gydF4y2Ba受辐射母亲的后代得到恢复(扩展数据图)。gydF4y2Ba二维gydF4y2Ba).这一观察结果也在gydF4y2Baspe-8gydF4y2Ba突变(扩展数据图)gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
我们还观察到两者的∆mf和∆mm的发育生长延迟gydF4y2Bafog-2gydF4y2Ba和gydF4y2Baspe-8gydF4y2Ba突变(扩展数据图)gydF4y2Ba2 fgydF4y2Ba),这表明父亲暴露于电离辐射可导致后代的表型后果。gydF4y2Ba
在种系的粗线区gydF4y2Bafog-2gydF4y2Ba∆mf虫,我们观察到DNA片段(图2)。gydF4y2Ba二维gydF4y2Ba端粒序列缺失(图2)。gydF4y2Ba二维gydF4y2Ba(左)。而不是正常的六个高度浓缩和离散的卵母细胞二价体,减数分裂分裂细胞gydF4y2Bafog-2gydF4y2Ba∆mf种系含有大量dapi染色的小体,这些小体大小不规则,其中一些携带随机分配的端粒序列(图2)。gydF4y2Ba二维gydF4y2Ba,对,e,f)。染色体重排、断裂和非整倍体gydF4y2Ba1gydF4y2Ba一代人也可以解释为什么跨代效应仅限于美国的三代人gydF4y2Bafog-2gydF4y2Ba在雌雄同体的野生型蠕虫中,突变体可以持续6代以上,因为与正常单倍体配子的异交可以极大地挽救非整倍体的遗传。gydF4y2Ba
染色体畸变提示我们检测凋亡DNA损伤检查点是否被激活gydF4y2Ba1gydF4y2Ba生殖系。由于雄性生殖系缺乏这种凋亡反应gydF4y2Ba25gydF4y2Ba,定量对照、∆f、∆mf虫种系的凋亡尸体。电离辐射诱导∆f虫种系细胞凋亡显著增加;然而,在∆mf的种系中仅检测到轻微的细胞凋亡增加(扩展数据图)。gydF4y2Ba2 ggydF4y2Ba),表明父系遗传的基因组不稳定性不会触发F基因中的DNA损伤检查点gydF4y2Ba1gydF4y2Ba生殖系。gydF4y2Ba
目的:检测新发基因组畸变gydF4y2Bafog-2gydF4y2BaFgydF4y2Ba1gydF4y2Ba第一代,我们对单株PgydF4y2Ba0gydF4y2Ba和它们的直接FgydF4y2Ba1gydF4y2Ba后代。我们在每个女性(∆mf)中检测到3到21个新生易位(染色体间或染色体内融合),在每个男性(∆mm) F中检测到2到28个新生易位gydF4y2Ba1gydF4y2Ba个人。总共,我们绘制了154个易位gydF4y2Bafog-2gydF4y2Ba∆mf和gydF4y2Bafog-2gydF4y2Ba∆mm虫与亲代相比(扩展数据图)。gydF4y2Ba2 hgydF4y2Ba及补充表gydF4y2Ba2 gydF4y2Ba),而串联复制(gydF4y2BangydF4y2Ba= 1)和插入数(gydF4y2BangydF4y2Ba= 1)罕见(补充表gydF4y2Ba3.gydF4y2Ba).F .的所有新生易位gydF4y2Ba1gydF4y2Ba蠕虫是杂合的,只与父系遗传的基因组畸变一致。女性和男性后代的基因组显示出总体上相似的常染色体易位数量。父系X染色体遗传于gydF4y2Bafog-2gydF4y2Ba∆mf而不是ingydF4y2Bafog-2gydF4y2Ba∆mm虫,只携带母体X染色体。一直以来,只有gydF4y2Bafog-2gydF4y2Ba∆mf蠕虫携带X染色体易位(图。gydF4y2Ba2 ggydF4y2Ba扩展数据图gydF4y2Ba2 i, jgydF4y2Ba及补充表gydF4y2Ba3.gydF4y2Ba),表明易位只发生在父系染色体上。gydF4y2Ba
X染色体易位可能是造成白头翁后代致死率特别高的原因gydF4y2Bafog-2gydF4y2Ba∆mf,因为X染色体的完整性对于减数分裂性染色体失活(MSCI)至关重要。当X染色体失去连续性时,X染色体不能进入MSCI转录失活状态,导致后代致死率高gydF4y2Ba26gydF4y2Ba。为了评估MSCI是否被破坏,我们染色了转录活性标记,RNA聚合酶II (RNAPII)的Ser2磷酸化(p-Ser2)。在种系粗线区,未经处理的X染色体(用HIM-8抗体标记,标记X染色体配对中心)gydF4y2Ba雾,gydF4y2Ba2只雌性缺乏RNAPII p-Ser2,而在2只雌性中缺乏RNAPII p-Ser2gydF4y2Bafog-2gydF4y2Ba∆mf, RNAPII p-Ser2均匀分布在常染色体和X染色体上(图2)。gydF4y2Ba2 hgydF4y2Ba).与此一致的是,染色体基因分布的基因集富集分析(GSEA)表明,F染色体中X染色体蛋白的强烈上调gydF4y2Ba1gydF4y2Ba辐照野生型蠕虫的生成(扩展数据图)。gydF4y2Ba3.gydF4y2Ba及补充表gydF4y2Ba4gydF4y2Ba),而其他染色体没有显著富集(扩展数据图。gydF4y2Ba3.gydF4y2Ba及补充表gydF4y2Ba4gydF4y2Ba).这些观察结果表明,X染色体重排在生殖系gydF4y2Bafog-2gydF4y2Ba∆mf破坏MSCI过程,再加上染色体易位和常染色体断裂,导致后代致死率明显高于gydF4y2Bafog-2gydF4y2Ba∆毫米。gydF4y2Ba
除了…之外gydF4y2Bafog-2gydF4y2Ba我们还对单雌雄同体野生型F进行了WGSgydF4y2Ba1gydF4y2Ba蠕虫和它们的PgydF4y2Ba0gydF4y2Ba的父母。不像雌雄异株gydF4y2Bafog-2gydF4y2Ba在这个系统中,自受精的雌雄同体携带了大约两倍的杂合易位gydF4y2Ba1gydF4y2Ba生成(扩展数据图gydF4y2Ba4gydF4y2Ba和gydF4y2Ba5gydF4y2Ba).这可以用两种可能性来解释:(1)雌雄同体的精子比雄性蠕虫产生的精子更脆弱;(2)与自交受精的野生型雌雄同体相比,交配的gydF4y2Bafog-2gydF4y2Ba雄性和健康的雌性提供一组未受损的母体染色体可以大大增加基因组的稳定性。与上述结果类似,我们还观察到F的非整倍性表型和X染色体的去沉默gydF4y2Ba1gydF4y2Ba辐照的雌雄同体野生型蠕虫(扩展数据图)。gydF4y2Ba4 b, cgydF4y2Ba).gydF4y2Ba
母体TMEJ修复了父亲的DNAgydF4y2Ba
dsb主要由无错误的HRR或易出错的非同源末端连接(NHEJ)修复。在缺乏NHEJ或HRR的细胞中,易出错的TMEJ对存活至关重要gydF4y2Ba27gydF4y2Ba。TMEJ涉及断裂两侧DNA的微同源性,并使用靠近断点的DNA作为从头合成的模板gydF4y2Ba28gydF4y2Ba。我们分析了在F基因中发现的154个新生易位的序列背景gydF4y2Ba1gydF4y2Ba一代的gydF4y2Bafog-2gydF4y2Ba蠕虫虽然大多数易位在断点之间没有插入,但约23%的易位包含至少1个插入碱基对,6%的易位至少有3 bp的插入,其模板可以在断点周围±25 bp内找到,从而与中定义的TMEJ模式相匹配gydF4y2Ba秀丽隐杆线虫gydF4y2Ba28gydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba及扩展数据图gydF4y2Ba6gydF4y2Ba).野生型样本显示了类似的模式,11%的模板插入(扩展数据图。gydF4y2Ba6 b, cgydF4y2Ba).这表明易位诱导易出错的DSB修复可以使用靠近断点的DNA作为末端连接之前从头合成的模板。gydF4y2Ba
一个gydF4y2Ba,易位足迹分布gydF4y2Bafog-2gydF4y2BaFgydF4y2Ba1gydF4y2Ba父亲受到90戈瑞电离辐射的成年人模板插入是指融合位点之间长度≥3bp的插入,在两个断裂点之一的±25bp内具有匹配序列。杂插入是指< 3bp的插入或在断点周围±25bp内没有匹配序列的插入。gydF4y2BangydF4y2Ba,易位数。gydF4y2BabgydF4y2Ba左图为1型易位示意图。义链是蓝色的,反义链是红色的。数字表示核苷酸到断点的距离;黄色框表示显示微同源的位置。右,热图表示所有类型1易位图的总和由∆mf和∆mm (gydF4y2BangydF4y2Ba= 23个易位),不包括模板插入的易位。深色表示相应碱基之间的序列相似性较高。沿着gydF4y2BaxgydF4y2Ba- - -gydF4y2BaygydF4y2Ba-轴对应于左边的轴。gydF4y2BaPgydF4y2Ba值在补充表中提供gydF4y2Ba1gydF4y2Ba。gydF4y2BacgydF4y2Ba,指示菌株的子代致死率。gydF4y2BangydF4y2Ba表示生物复制的数量。数据为中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值。gydF4y2BadgydF4y2Ba不同亲本组合的子代致死率gydF4y2Bapolq-1gydF4y2Ba接受和不接受90戈瑞电离辐射的蠕虫gydF4y2BangydF4y2Ba= 3个生物重复。数据为中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值。比例数据采用logit链接函数GLM和Tukey多重比较,单向(gydF4y2BacgydF4y2Ba)或双向(gydF4y2BadgydF4y2Ba)方差分析与反正弦变换证实统计结果。完整的统计分析载于补充表gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
考虑到TMEJ特征,我们接下来测试了在重新易位的断点附近是否存在微同源性。我们根据其序列取向将易位分为四种类型,并在每种类型中鉴定了微同源性。类型1和类型3如图所示。gydF4y2Ba3 bgydF4y2Ba类型2和类型4如扩展数据图所示。gydF4y2Ba6 d-fgydF4y2Ba。类型1和类型3注释相同的易位-一种是从5 '方向注释,另一种是从3 '方向注释。为清楚起见,我们将两者都称为类型1。我们在断点周围的8-bp窗口中评估序列相似性程度。易位内的最后一个碱基对,即断点,记为零,后面三个碱基对记为正数,最后四个未包含在易位中的碱基对记为负数(图2)。gydF4y2Ba3 bgydF4y2Ba右,扩展数据图。gydF4y2Ba6 egydF4y2Ba).我们在野生型F的基因组中发现了相同的模式gydF4y2Ba1gydF4y2Ba蠕虫扩展数据图gydF4y2Ba6 fgydF4y2Ba).最后,我们研究了断点周围的基本组成(扩展数据图)。gydF4y2Ba6克gydF4y2Ba).因此,DNA断点的序列上下文使人想起容易出错的TMEJ的结果。gydF4y2Ba
为了证实修复途径的使用,我们将主要DSB修复途径的突变体与gydF4y2Bafog-2gydF4y2Ba: HRR在gydF4y2Babrc-1gydF4y2Ba突变体中,NHEJ失活gydF4y2Backu - 70gydF4y2Ba突变体,TMEJ在gydF4y2Bapolq-1gydF4y2Ba突变体。嗯有缺陷gydF4y2Babrc-1;fog-2gydF4y2Ba突变体没有进一步提高PgydF4y2Ba0gydF4y2Ba和FgydF4y2Ba1gydF4y2Ba代(无花果。gydF4y2Ba3 cgydF4y2Ba),表明父系遗传的DNA损伤不参与无错误的HRR修复途径。与之形成鲜明对比的是,TMEJ突变体gydF4y2Bapolq-1;fog-2gydF4y2Ba线虫对父本DNA损伤异常敏感(图2)。gydF4y2Ba3 cgydF4y2Ba),以及罕见的FgydF4y2Ba1gydF4y2Ba幸存者由于种系发育缺陷而不育。NHEJ修复蛋白CKU-70的缺失加重了小鼠后代的致死率gydF4y2Backu - 70;fog-2gydF4y2Ba∆m和gydF4y2Backu - 70;fog-2gydF4y2Ba∆mm与gydF4y2Bafog-2gydF4y2Ba单突变体。我们通过rna介导的干扰(RNAi)敲除这些修复蛋白进一步证实了这些观察结果gydF4y2Bafog-2gydF4y2Ba扩展数据图gydF4y2Ba6小时gydF4y2Ba).这些结果表明,TMEJ主要修复父本DNA损伤,NHEJ部分修复父本DNA损伤。鉴于TMEJ和NHEJ都是容易出错的修复途径gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,这些发现为观察到的染色体异常提供了解释gydF4y2Ba1gydF4y2Ba的一代。gydF4y2Ba
接下来,我们测试了TMEJ在成熟精子或受损精子受精后是否活跃。我们把男女分开。gydF4y2Bapolq-1gydF4y2Ba突变体和雄性和雌性的杂交组合gydF4y2Bafog-2gydF4y2Ba突变体精通或缺乏(gydF4y2Bapolq-1gydF4y2Ba)为TMEJ。后代的致死率增加到接近100%只有当gydF4y2Bapolq-1gydF4y2Ba雌性与接受电离辐射处理的雄性交配,与父系无关gydF4y2Bapolq-1gydF4y2Ba状态(图。gydF4y2Ba3 dgydF4y2Ba),表明母体提供的TMEJ是成熟精子DNA修复的主要途径。gydF4y2Ba
为了测试TMEJ修复结果的这种跨代效应是否也可能在生理条件下发生,我们在自然条件下鉴定了新生种系突变中的TMEJ特征gydF4y2Ba秀丽隐杆线虫gydF4y2Ba种群和人类种系突变数据集。TMEJ特征先前已在五种不同的天然分离株中发现gydF4y2Ba秀丽隐杆线虫gydF4y2Ba28gydF4y2Ba。在540个自然分离的CeNDR数据库中,我们发现在缺失位点的断点附近有高度显著的1 bp微同源过富集gydF4y2Ba30.gydF4y2Ba(扩展数据图gydF4y2Ba7 a、fgydF4y2Ba).最近一项涉及几种诱变剂的野生型和不同dna修复突变体的突变积累实验显示了一种具有大量微同源足迹的模式gydF4y2Ba31gydF4y2Ba。重新分析没有任何诱变剂处理的样品的缺失仍然显示1 bp微同源TMEJ足迹的显着过度代表(扩展数据图)。gydF4y2Ba7 b, fgydF4y2Ba).这些结果与TMEJ修复生殖细胞中的dsb的要求一致,因此可能是在未受干扰的条件下进化的驱动因素gydF4y2Ba32gydF4y2Ba。gydF4y2Ba
在人类中,TMEJ具有2- 6 bp的微同源足迹gydF4y2Ba27gydF4y2Ba,gydF4y2Ba33gydF4y2Ba。在千人基因组计划中gydF4y2Ba34gydF4y2Ba,我们在28%的缺失中发现了2- 6bp的微同源性(扩展数据图)。gydF4y2Ba7 c、fgydF4y2Ba).这些数据表明,TMEJ足迹在自然人类变异位点被过度代表。类似地,Polaris数据集的trios子代中的从头结构变异(gydF4y2Bahttps://github.com/Illumina/PolarisgydF4y2Ba)显示了微同源性的显著过度表征(扩展数据图。gydF4y2Ba7 d, fgydF4y2Ba).最近对2396个家庭新生结构变异的配子起源分析表明,大多数新生结构变异是在精子中产生的,患有散发性自闭症谱系障碍的儿童结构变异数量增加gydF4y2Ba8gydF4y2Ba。此外,微同源结构变异显示父亲作为原生亲本的比例增加。同样,在冰岛1548对已知配子来源的三胞胎中,精子中产生的新生缺失比卵母细胞中产生的更多gydF4y2Ba35gydF4y2Ba。在我们对已发表的突变呼叫的重新分析中,精子中产生的缺失特别表现出显著的微同源性过度表征(扩展数据图)。gydF4y2Ba7 e, fgydF4y2Ba).因此,TMEJ也可能在无挑战条件下的精子诱变中发挥作用gydF4y2Ba秀丽隐杆线虫gydF4y2Ba人类也是如此。gydF4y2Ba
组蛋白H1和HPL-1触发致死性gydF4y2Ba
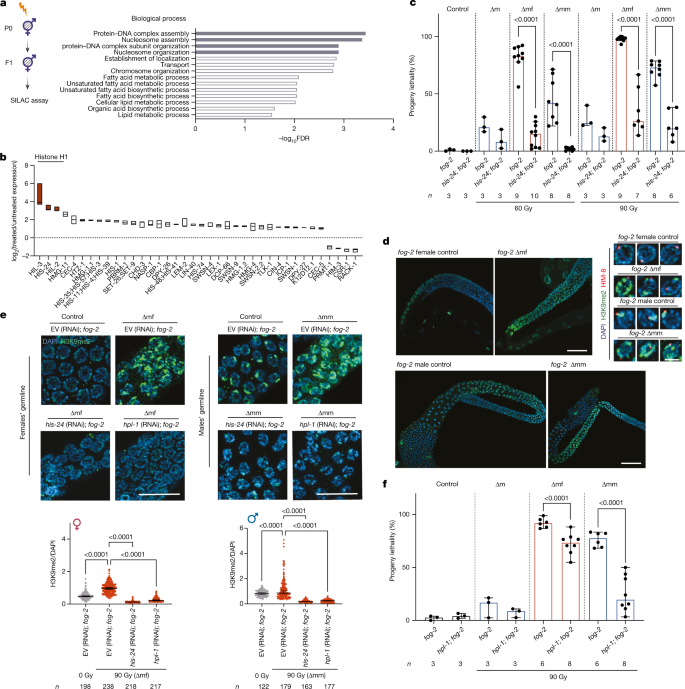
为了确定F .蛋白质组的全局变化gydF4y2Ba1gydF4y2Ba本研究利用基于氨基酸(SILAC)的蛋白质组学方法进行了稳定同位素标记。gydF4y2Ba4gydF4y2Ba)利用野生型雌雄同体进行可行性研究。蛋白质组的变化在蛋白质- dna组装、核小体组装和核小体组织中高度富集(图2)。gydF4y2Ba4gydF4y2Ba),大部分蛋白在FgydF4y2Ba1gydF4y2Ba用电离辐射处理的蠕虫,特别是组蛋白(图2)。gydF4y2Ba4 bgydF4y2Ba).三种高度上调的蛋白是连接组蛋白(H1)变体,HIL-3, HIS-24和HIL-2。击倒的gydF4y2Bahil-2gydF4y2Ba不论辐照与否,RNAi均能捕获幼虫gydF4y2Bahil-3gydF4y2BaRNAi只显示出轻微的,但不显著的降低FgydF4y2Ba1gydF4y2Ba后代。值得注意的是,RNAi敲低gydF4y2Ba24gydF4y2Ba显著地恢复了野生型F的胚胎活力gydF4y2Ba2 gydF4y2Ba(扩展数据图)gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba基因本体论术语分析,对有或没有亲代暴露于电离辐射的野生型蠕虫的SILAC试验中显著调节蛋白的生物过程进行分析。前4个富集过程用灰色突出显示。罗斯福,错误发现率。日志值gydF4y2Ba10gydF4y2BaFDR大于1.3对应FDR < 0.05。gydF4y2BabgydF4y2Ba,亲本暴露于电离辐射后参与染色体或dna结合过程的蛋白质的相对表达。浮动条表示值的范围,中线表示中位数。gydF4y2BangydF4y2Ba= 4个生物重复。gydF4y2BacgydF4y2Ba,子代致死率表征gydF4y2Ba24;fog-2gydF4y2Ba有或没有父本电离辐射照射的突变体。gydF4y2BangydF4y2Ba生物复制的数量。数据为中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值。gydF4y2BadgydF4y2Ba左图为指示菌株种系H3K9me2(绿色)和DAPI(蓝色)染色。标尺,20 μm。右边,三个有代表性的细胞核与X染色体标记hm -8(红色)共同染色。比例尺:3 μm。gydF4y2BaegydF4y2Ba, H3K9me2(绿色)和DAPI(蓝色)染色在指示的RNAi菌株的种系有或没有父亲电离辐射暴露。标尺,10 μm。下图为H3K9me2信号强度量化。gydF4y2BangydF4y2Ba显示单元格号码。数据为中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值;采用Bonferroni多重比较检验的单因素方差分析。实验gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba重复了三次,得到了相似的结果。EV,空向量。gydF4y2BafgydF4y2Ba后代的致命性gydF4y2Bafog-2gydF4y2Ba和gydF4y2Bahpl-1;fog-2gydF4y2Ba有或没有父亲电离辐射照射。gydF4y2BangydF4y2Ba生物复制的数量。数据为中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值;比例数据采用logit链接函数的GLM (gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba)和双尾gydF4y2BatgydF4y2Ba采用反正弦变换-检验对统计结果进行验证。完整的统计分析见补充表gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
一致地,gydF4y2Ba24;fog-2gydF4y2Ba双突变体显著抑制由父本电离辐射暴露引起的跨代胚胎致死率(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).然而,在维持该菌株多代后,HIS-24耗竭的拯救作用迅速降低,这意味着HIS-24的功能可以被其他调节因子逐渐补偿。为了规避这种适应,我们推倒了gydF4y2Ba24gydF4y2Ba在gydF4y2Bafog-2gydF4y2Ba使用RNAi的突变体∆mm的子代细胞活力显著恢复,而gydF4y2Ba24gydF4y2BaRNAi不足以降低∆mf后代的高致死率,这可能是因为即使有一个异常的X染色体结构也足以阻止MSCI,从而导致致死率。gydF4y2Ba8 bgydF4y2Ba).这些数据表明,遗传的父系DNA损伤导致组蛋白H1水平的增加,组蛋白H1是导致胚胎死亡的原因gydF4y2Ba2 gydF4y2Ba的一代。gydF4y2Ba
组蛋白H1主要参与DNA包装和染色体凝聚,并与异染色质蛋白一起调节染色质的流动性、高阶染色质结构和转录gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba。因此,组蛋白H1在FgydF4y2Ba1gydF4y2Ba代可能与异染色质区域的增加有关。在non-irradiatedgydF4y2Bafog-2gydF4y2Ba突变体中,H3K9me2异染色质标记弱而均匀地分布在雌性粗线细胞晚期的染色质上,而在雄性粗线细胞的X染色体上强烈富集,这是雄性种系减数分裂期间X染色体沉默所必需的(图2)。gydF4y2Ba4 dgydF4y2Ba).在FgydF4y2Ba1gydF4y2Ba在线虫中,我们发现H3K9me2水平的显著增加与X染色体没有特异性关联,而是随机分布的(图2)。gydF4y2Ba4 dgydF4y2Ba).HIS-24的缺失显著消除了两者种系中H3K9me2的增加gydF4y2Bafog-2gydF4y2Ba∆mf和gydF4y2Bafog-2gydF4y2Ba∆mm虫(图;gydF4y2Ba4 egydF4y2Ba).gydF4y2Ba
HPL-1对于异染色质结构的建立和维持至关重要。类似于gydF4y2Ba24gydF4y2Ba(RNAi);gydF4y2Bafog-2gydF4y2BaHPL-1被敲低gydF4y2Bafog-2gydF4y2BaH3K9me2在FgydF4y2Ba1gydF4y2Ba蠕虫(无花果。gydF4y2Ba4 egydF4y2Ba).一致地,我们发现了显著抑制的后代致死率的父亲辐照gydF4y2Bahpl-1;fog-2gydF4y2Ba突变蠕虫(图2)gydF4y2Ba4 fgydF4y2Ba).我们通过gydF4y2Bahpl-1gydF4y2BaRNAi在gydF4y2Bafog-2gydF4y2Ba突变(扩展数据图)gydF4y2Ba8 cgydF4y2Ba).我们的观察结果表明,父本DNA损伤导致组蛋白H1表达增加,导致异染色质形成增加,从而导致胚胎死亡gydF4y2Ba2 gydF4y2Ba的一代。gydF4y2Ba
HRR防止了跨代致死率gydF4y2Ba
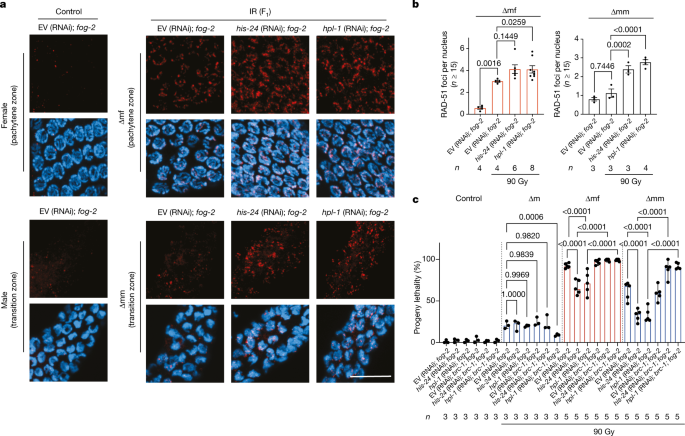
异色化可以阻止忠实的DSB修复,如HRRgydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba。RAD-51疫源地略有增加,这表明HRRgydF4y2Ba40gydF4y2Ba,在FgydF4y2Ba1gydF4y2Ba与未辐照虫的后代比较。击倒的gydF4y2Ba24gydF4y2Ba和gydF4y2Bahpl-1gydF4y2Ba在gydF4y2Bafog-2gydF4y2Ba突变体显著增加了∆mm虫种系的RAD-51病灶,而∆mf虫种系的RAD-51病灶在gydF4y2Bahpl-1gydF4y2Ba(RNAi);gydF4y2Bafog-2gydF4y2Ba突变体(无花果。gydF4y2Ba5 a、bgydF4y2Ba).在∆mf种系的粗期区和∆mm种系的过渡区,RAD-51病灶的增加最为明显。gydF4y2Ba
一个gydF4y2Ba、EV (RNAi)种系的RAD-51免疫荧光(红色)和DAPI染色(蓝色);gydF4y2Bafog-2gydF4y2Ba,gydF4y2Ba24gydF4y2Ba(RNAi);gydF4y2Bafog-2gydF4y2Ba和gydF4y2Bahpl-1gydF4y2Ba(RNAi);gydF4y2Bafog-2gydF4y2Ba不论父系是否受到90戈瑞电离辐射。上图,雌性生殖系的粗线带。下图为雄性生殖系的过渡区。标尺,10 μm。实验gydF4y2Ba一个gydF4y2Ba重复了三次,得到了类似的结果。gydF4y2BabgydF4y2Ba,父亲是否暴露于90 Gy电离辐射下,雌性和雄性生殖系中每个细胞核的RAD-51病灶的定量。每个生殖系都有15个以上的细胞核;gydF4y2BangydF4y2Ba表示生殖系的数量。每个点表示一个种系中每个细胞核中RAD-51病灶数量的平均值。柱状图表示中位数±95%置信区间。gydF4y2BaPgydF4y2Ba显示值;嵌套单因素方差分析采用Bonferroni多重比较检验,反映了不同种系之间的差异。gydF4y2BacgydF4y2Ba,空载体子代致死率表征;gydF4y2Ba24gydF4y2Ba和gydF4y2Bahpl-1gydF4y2BaRNAi上gydF4y2Bafog-2gydF4y2Ba和gydF4y2Babrc-1;fog-2gydF4y2Ba有或没有父本电离辐射照射(90 Gy)的突变体。控制、∆m:gydF4y2BangydF4y2Ba= 3;∆mf,∆mm:gydF4y2BangydF4y2Ba= 5个生物重复。数据中位数为±95%置信区间。gydF4y2BaPgydF4y2Ba显示值;具有logit链接函数和Tukey多重比较的GLM;比例数据采用反正弦变换的单因素方差分析来确认统计结果,并纳入完整统计结果(补充表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
为了评估缺乏HIS-24和HPL-1的蠕虫的拯救作用是否由于HRR的激活,我们敲除gydF4y2Ba24gydF4y2Ba和gydF4y2Bahpl-1gydF4y2Ba在gydF4y2Babrc-1;fog-2gydF4y2Ba双突变体。拯救后代的杀伤力gydF4y2Ba24gydF4y2Ba和gydF4y2Bahpl-1gydF4y2BaRNAi的损耗完全被消除gydF4y2Bafog-2;brc-1gydF4y2Ba突变体,表明HRR介导了FgydF4y2Ba1gydF4y2BaH1缺失后的子代(图2)gydF4y2Ba5度gydF4y2Ba).我们证实了HRR对HIS-24和HPL-1缺失恢复雌雄同体野生型和HPL-1活力的能力的要求gydF4y2Babrc-1gydF4y2Ba突变(扩展数据图)gydF4y2Ba8 dgydF4y2Ba).尽管BRC-1的缺失完全消除了h1缺失的F的后代生存能力gydF4y2Ba1gydF4y2Ba结果表明,其对子代生存能力无显著影响gydF4y2Ba0gydF4y2Ba表明h1介导的DNA修复限制主要影响FgydF4y2Ba1gydF4y2Ba生殖系。gydF4y2Ba
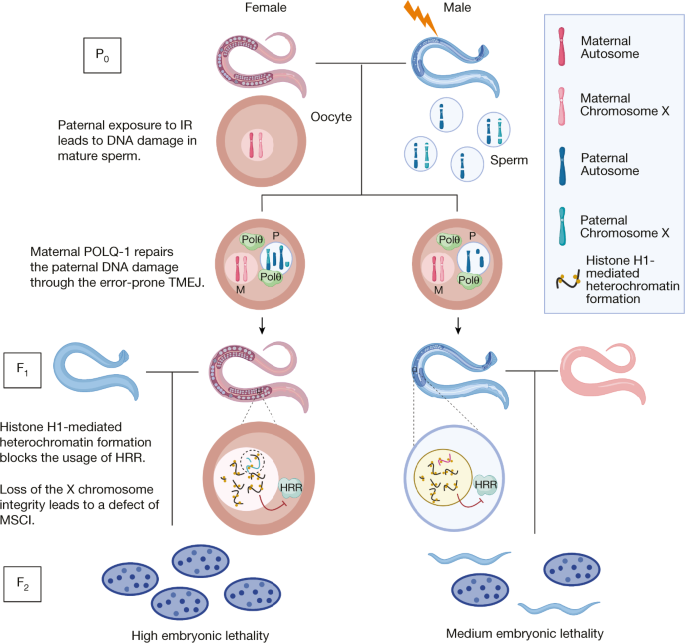
我们得出结论,父系遗传的DNA损伤导致组蛋白H1和异染色质形成增加,这反过来又阻止了FgydF4y2Ba1gydF4y2Ba从使用忠实的DSB修理机械产生。去除异染色质屏障有助于无差错HRR的参与,并显著地挽救了由父本电离辐射照射引起的跨代胚胎致死率(图2)。gydF4y2Ba6克ydF4y2Ba).gydF4y2Ba
男性电离辐射(IR)暴露gydF4y2Ba秀丽隐杆线虫gydF4y2Ba导致成熟精子中的DNA dsb,它将片段DNA携带到受精(未辐照)的卵母细胞中。母体卵母细胞提供TMEJ机制来修复父亲的DNA损伤,导致各种染色体畸变。在FgydF4y2Ba1gydF4y2Ba在后代中,连接蛋白h1介导的异染色质结构在生殖细胞的染色质中积累,这阻止了DNA dsb被无错误的HRR检测和修复。尤其是女性的FgydF4y2Ba1gydF4y2Ba(∆mf), X染色体易位和断裂阻止了MSCI,从而进一步加重了后代的胚胎致死率。总之,父亲暴露于电离辐射会通过异色化限制DNA修复途径导致跨代胚胎致死。gydF4y2Ba
讨论gydF4y2Ba
对父母接触电离辐射的跨代后果的确定是有限的,主要是因为这一过程的机制仍然未知。动物研究提供的证据表明,父亲接触电离辐射可能导致后代的生存能力、生育能力和基因组稳定性受损gydF4y2Ba41gydF4y2Ba。用电离辐射处理的成熟精子受精的牛卵母细胞在胚胎发生早期表现出染色体断裂和父系染色体易位,导致非整倍体和不相等的染色体分离gydF4y2Ba42gydF4y2Ba。这种基因嵌合现象是体外受精中流产率高、着床率低的主要原因gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。可行的FgydF4y2Ba1gydF4y2Ba受辐射雄性小鼠的后代表现出增加的基因组不稳定性和增加的癌症发病率gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba。成熟精子的特殊脆弱性与儿童恶性疾病风险增加与父亲在怀孕前后(即成熟精子暴露于辐射时)的辐射暴露之间的相关性是一致的gydF4y2Ba14gydF4y2Ba,gydF4y2Ba16gydF4y2Ba。一致地,人类种系高突变最近与父亲在受孕前暴露于化疗药物有关gydF4y2Ba21gydF4y2Ba这可能会增加后代患遗传疾病的风险gydF4y2Ba22gydF4y2Ba。gydF4y2Ba
成熟精子的特殊脆弱性可以解释为其高度致密的染色质结构阻碍了DSB修复,需要在受精后通过母体因子进行修复。小鼠HRR和NHEJ因子的缺失可显著增加携带父本dsb的早期胚胎的染色体结构畸变gydF4y2Ba23gydF4y2Ba。我们在gydF4y2Ba秀丽隐杆线虫gydF4y2Ba,母体TMEJ是受精后作用于父本基因组的主要DSB修复机制。生理条件下产生的新生种系结构变异也显示出TMEJ特征,在人类中,父系产生的dnm尤其丰富gydF4y2Ba5gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba。从进化的角度来看,与稳定的母系基因组不同,不稳定的父系基因组对物种的遗传多样性贡献很大。TMEJ似乎在塑造基因组进化中起着重要作用,因为它的特征存在于gydF4y2Ba秀丽隐杆线虫gydF4y2Ba变体gydF4y2Ba32gydF4y2Ba在父亲的人类结构变异中。因此,人们很容易推测,控制母体TMEJ在父系基因组中的参与的机制,从而有助于遗传多样化。gydF4y2Ba
我们在受辐射雄性后代中观察到的基因组不稳定性是由表观基因组的变化驱动的,这为开发潜在的治疗方法提供了理论基础,以防止亲代辐射暴露的有害遗传后果。异染色质抑制剂或H3K9甲基转移酶抑制剂gydF4y2Ba49gydF4y2Ba可能被认为在携带父亲基因组不稳定的后代中促进了HRR。此外,我们的工作进一步强调,成熟精子中的父亲基因组特别脆弱,可能导致后代基因组不稳定,增加了对诱变暴露的保护需求,特别是在孕前的两个月期间。总之,我们的工作阐明了父亲暴露于辐射的跨代效应的一个先前未知的机制,并要求进一步评估人类父亲DNA损伤的跨代效应。gydF4y2Ba
方法gydF4y2Ba
秀丽隐杆线虫gydF4y2Ba菌株gydF4y2Ba
所有菌株在20°C的标准条件下保持。所用菌株为N2 (Bristol;野生型),CB4108gydF4y2Bafog-2 (q71)gydF4y2Ba, BC784gydF4y2Baspe-8(溶血素)gydF4y2Ba, RB1067gydF4y2Ba24 (ok1024)gydF4y2Ba, MT13971gydF4y2Bahpl-1 (n4317)gydF4y2Ba, DW102gydF4y2Babrc-1 (tm1145)gydF4y2Ba, FX1524gydF4y2Backu - 70 (tm1524)gydF4y2Ba, FX2026gydF4y2Bapolq-1 (tm2026)gydF4y2Ba, BJS1017gydF4y2Ba24 (ok1024);fog-2 (q71)gydF4y2Ba, BJS1018gydF4y2Bahpl-1 (n4317);fog-2 (q71)gydF4y2Ba, BJS1019gydF4y2Babrc-1 (tm1145);fog-2 (q71)gydF4y2Ba, BJS1020gydF4y2Backu - 70 (tm1524);fog-2 (q71)gydF4y2Ba, BJS1021gydF4y2Bapolq-1 (tm2026);fog-2 (q71)gydF4y2Ba。gydF4y2Ba
电离辐射致子代致死率的测定gydF4y2Ba
对于雌性化突变体,同步L4雌性和雄性被分离并维持过夜。第二天,成年女性或男性要么不接受治疗,要么接受铯137照射源(Biobeam GM 8000, Eckert & Ziegler, Gamma-Service Medical)规定剂量的电离辐射照射。然后,立即将≥3只辐照过的成虫和≥3只未辐照过的异性成虫转移到3个新板上,作为3个生物重复,孵卵2 h。然后雄性被移走,留下雌性继续产卵4小时。然后取出雌性,计算卵子的数量。24 h后测定存活子代数,检验小蠊子代致死率gydF4y2Ba0gydF4y2Ba的一代。然后,我们转移≥3个幸存的雄性后代(FgydF4y2Ba1gydF4y2Ba)或存活的雌性后代≥3只(FgydF4y2Ba1gydF4y2Ba)转移到新的培养皿中,作为一个生物复制,并将它们与三只未经处理的异性成虫放在一起,让它们产卵一天。每个试验至少设置3个生物重复。然后把成虫移走,计算产卵的数量。24小时后,对存活的子代进行计数,以表征FgydF4y2Ba1gydF4y2Ba的一代。gydF4y2Ba
对于雌雄同体的虫,通过采摘将同步的L4晚期雌雄同体与其余的虫分离,并对≥3只L4晚期雌雄同体进行处理或用指定剂量的电离辐射照射。将3个受辐照的雌雄同体转移到3个单独的板上作为3个生物复制,并允许产卵6小时。取成虫,24 h后计数卵数,将孵化出的子代以子代致死率量化gydF4y2Ba0gydF4y2Ba的一代。幸存的蠕虫被转移到三个盘子里,让它们产卵一天。取成虫,24 h后测定后代致死率。gydF4y2Ba
发展分析gydF4y2Ba
对照和父系处理的同步L1虫gydF4y2Ba1gydF4y2Ba通过标准次氯酸盐处理生成。将捕获的L1蠕虫置于含有OP50的NGM琼脂板上,用细菌喂养,在20℃下孵育48 h。然后,在蔡司的发现下,蠕虫的幼虫阶段被表征。V8显微镜。在每个试验中,每个重复选取bbb30只L1幼虫;gydF4y2BangydF4y2Ba= 3个生物重复。gydF4y2Ba
生殖细胞凋亡尸体定量gydF4y2Ba
用5mm左旋咪唑(AppliChem A431005)固定第1天的成年雌虫,并将其固定在显微镜载玻片上的2%琼脂糖垫上。在蔡司Axio成像仪M1/2上使用Nomarski DIC显微镜根据生殖腺环内凋亡生殖细胞的折光形态学变化对凋亡尸体数量进行评分gydF4y2Ba50gydF4y2Ba。gydF4y2Ba
RNAi疗法gydF4y2Ba
RNAi喂养克隆从J. Ahringer文库获得。的gydF4y2Ba大肠杆菌gydF4y2Ba用含氨苄西林(100 μg ml)的LB培养基培养具有RNAi克隆的饲养菌株HT115 (DE3)gydF4y2Ba−1gydF4y2Ba一夜之间)。在RNAi琼脂板(含有氨苄西林和IPTG的NGM琼脂)上播种前,加入IPTG (1 mM)诱导RNAi产物。在RNAi摄食实验中,bbb30同步L1幼虫作为PgydF4y2Ba0gydF4y2Ba代放置在RNAi琼脂板上gydF4y2Ba大肠杆菌gydF4y2Ba饲养菌株HT115 (DE3)含有特异性RNAi或空载体控制。三天后,分离成年雄性和雌性,将其转移到新鲜的RNAi板上,以保持RNAi效率,直到进行进一步的实验。随后的实验按照“电离辐射诱导子代致死率的测量”进行。gydF4y2Ba
免疫荧光染色gydF4y2Ba
从培养皿中取出成虫,将其转移到一滴M9缓冲液中,并将其转移到0.3%聚赖氨酸处理过的三孔载玻片上(Fisher Scientific公司的3 × 14 mm印刷孔载玻片)。用2根注射针进行种系解剖,3.7%甲醛固定1 h。然后,将24 × 24 mm的盖片放置在滴液上,将载玻片置于- 80°C的冰箱中冷冻10分钟以进行冷冻裂解程序。然后将载玻片快速转移到- 20°C的甲醇中,持续不到1分钟。为了显示细胞核,载玻片分别用PBS和PBST (0.2% Tween在PBS中)洗涤一次,用DAPI Fluoromount-G装片介质(Southern Biotech)装片,并用指甲油密封。另一次染色,固定后,载玻片用1倍PBS洗涤1次,用1倍PBT (0.5% Triton X-100在PBS中)洗涤2次。为了改善信号质量,首先用Image-iT FX信号增强剂(Thermo Fisher)阻断载玻片20分钟,然后用含10%驴血清的1× PBT再阻断20分钟。随后,用含5%驴血清的1× PBT稀释一抗,涂于载玻片上,4℃孵育过夜。用1倍PBT洗涤3次后,用1倍PBT稀释的二抗在37℃下孵育30 min。然后用1× PBT清洗3次载玻片,用DAPI Fluoromount-G装片培养基(Southern Biotech)装片,用指甲油密封。 Slides were stored at 4 °C in the dark before imaging.
用于免疫荧光染色的一抗为兔多克隆抗磷酸化rnapii (Ser2)抗体(Thermo Fisher, A300-654A;稀释1:500 (PBT);小鼠单克隆抗h3k9me2抗体(Abcam, ab1220;稀释1:100 (PBT);兔多克隆抗him -8 (Novus Biologicals, 41980002;稀释1:100 (PBT);兔抗rad -51抗体(a . Gartner实验室赠送;稀释1:20 00 (PBT)。二抗:AlexaFluor 488驴抗小鼠IgG (Thermo Fisher, A21202;PBT稀释1:500)和AlexaFluor 594驴抗兔IgG (Thermo Fisher A21207; dilution 1:500 in PBT).
定量荧光图像采用蔡司Meta 710共聚焦激光扫描显微镜拍摄。为了定量,对不同处理和菌株设置固定的曝光时间。H3K9me2、RNAPII p-Ser2和RAD-51染色gydF4y2BazgydF4y2Ba采用Zeiss Meta 710共聚焦显微镜获取-stack图像,用Imaris x64 9.1.2软件定量测定H3K9me2和RNAPII p-Ser2信号强度和每个细胞核RAD-51焦数。荧光强度归一化为DAPI信号。gydF4y2Ba
SILAC化验gydF4y2Ba
稳定同位素标记程序已在先前的研究中描述gydF4y2Ba51gydF4y2Ba。简而言之,ET505gydF4y2Ba大肠杆菌gydF4y2Ba(赖氨酸营养不良,来自大肠杆菌遗传储备中心)在M9最小培养基(NagydF4y2Ba2 gydF4y2BaHPOgydF4y2Ba4gydF4y2Ba5.8 g lgydF4y2Ba−1gydF4y2Ba, KHgydF4y2Ba2 gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba3 g lgydF4y2Ba−1gydF4y2Ba, NaCl 0.5 g lgydF4y2Ba−1gydF4y2Ba,在北半球gydF4y2Ba4gydF4y2BaClgydF4y2Ba2 gydF4y2Ba1 g lgydF4y2Ba−1gydF4y2Ba葡萄糖0.2% (w/v), MgSOgydF4y2Ba4gydF4y2Ba1 mM,硫胺素0.01% (w/v), 40µg mlgydF4y2Ba−1gydF4y2Ba13gydF4y2BaCgydF4y2Ba6克ydF4y2Ba-标记赖氨酸(剑桥同位素实验室)或40µg mlgydF4y2Ba−1gydF4y2Ba正常的gydF4y2BalgydF4y2Ba-赖氨酸,并在37°C孵育过夜至gydF4y2Ba一个gydF4y2Ba600gydF4y2Ba= 1。细菌被浓缩到gydF4y2Ba一个gydF4y2Ba600gydF4y2Ba= 50,接种到NGM-N板上(3 g NaCl和12 g琼脂糖溶解在970 ml去离子水中)。gydF4y2Ba
次氯酸盐处理产生的同步胚胎孵化并在M9缓冲液中捕获,然后将L1蠕虫转移到NGM-N板上,接种重同位素标记的赖氨酸(重赖氨酸)或正常赖氨酸(轻赖氨酸)标记的ET505gydF4y2Ba大肠杆菌gydF4y2Ba。将标记菌投喂两代,使其掺入率达到97%,然后选取L4期后期的线虫进行电离辐射或模拟处理。试验共设4个重复,其中2个为电离辐射处理重赖氨酸组和模拟处理轻赖氨酸组,另外2个重复为模拟处理重赖氨酸组和电离辐射处理轻赖氨酸组。gydF4y2Ba
等量的FgydF4y2Ba1gydF4y2Ba用M9缓冲液将成虫从重赖氨酸板和轻赖氨酸板上洗净并合并。去除M9缓冲液后,将裂解缓冲液(6 M氯化胍(GuCl), 10 mM TCEP, 40 mM CAA, 100 mM Tris-HCl)添加到蠕虫颗粒中。在95°C下加热样品10分钟,用Bioruptor对样品进行超声(30秒超声,30秒中断,10个循环,高性能)。再次加热和超声。然后将样品在20000℃下离心gydF4y2BaggydF4y2Ba静置20 min,收集上清。用20 mM Tris稀释5微升蛋白溶液,使氯化胍浓度降至0.6 M以下。加入50 mM TEAB将样品稀释至100µl,然后加入1µg Lys-C, 37℃孵育4 h。样品进一步用180µl TEAB稀释,并用2µg Lys-C在37℃下处理过夜。加入1%的甲酸停止酶切,根据CECAD/CMMC蛋白质组学核心设施的标准方案(gydF4y2Bahttps://www.proteomics-cologne.com/protocolsgydF4y2Ba).质谱蛋白质组学数据已通过PRIDE合作伙伴存储库存储到ProteomeXchange Consortium,数据集标识符为PXD031873。gydF4y2Ba
只蠕虫WGSgydF4y2Ba
单L4男性和女性gydF4y2Bafog-2gydF4y2Ba将经指示处理的雌雄同体野生型转移到有紫外线杀灭的OP50细菌的板上,以减少细菌DNA的污染。第2天,取一只成虫,加入10µl M9缓冲液,- 80°C冷冻。按照标准Illumina DNA制备方案提取DNA。使用标准Illumina协议准备文库进行测序。简而言之,使用头链转座体将120 ng基因组DNA与接头序列进行了标记。标记的DNA经PCR扩增5个循环。按照制造商的协议,在Illumina HiSeq 2500上对文库进行测序。数据已通过BioProject数据库的链接录入,登录号为PRJNA826255。gydF4y2Ba
端粒鱼gydF4y2Ba
端粒FISH通过修改后的方案进行gydF4y2Ba52gydF4y2Ba。将20只成年雌性或雄性转移到一滴M9缓冲液中,滴在0.3%聚赖氨酸处理的3孔载玻片上(3 × 14 mm印刷的孔载玻片;费舍尔科学)。用2根注射针进行种系解剖,3.7%甲醛固定1 h。然后将24 × 24 mm的盖片放置在滴液上,将载玻片置于- 80°C的冷冻柜中10分钟以进行冷冻裂解程序。然后将载玻片快速转移到- 20°C的甲醇中,持续不到1分钟。载玻片用1倍PBS洗涤1次,室温下在渗透缓冲液(0.5% Triton X-100在1倍PBS中)中孵育1小时,然后用1倍PBS洗涤。然后用0.01 N HCL快速洗涤载玻片,再用0.1 N HCL洗涤2分钟。为了防止FISH探针的非特异性结合,50µg mlgydF4y2Ba−1gydF4y2BaRNase A溶液(10µg ml)gydF4y2Ba−1gydF4y2Ba将RNase A(1倍PBS)加到载玻片上,37℃孵育45分钟。然后用2倍SSC洗涤2次。预杂交时,在载玻片上加入50µl预杂交溶液(2× SSC, 50%甲酰胺),室温下在潮湿的室内孵育2小时。然后FISH探针(PNA-FISH TTAGGC端粒探针,Panagene,重悬至100µM,荧光团:Cy3)在杂交缓冲液(2× SSC, 50%甲酰胺,10% (w/v)硫酸葡聚糖,50µg ml)中以1:500稀释gydF4y2Ba−1gydF4y2Ba肝素,100µg mlgydF4y2Ba−1gydF4y2Ba剪鲑鱼精子DNA)。预杂交完成后,尽可能将溶液从载玻片上清除,然后将50µl FISH探针加入样品中,用Frame-Seal原位PCR和杂交载玻片室(Bio-Rad SLF0601)覆盖,载玻片在37℃下孵育过夜。第2天,80℃下变性5 min, 37℃下继续孵育2 d。取出杂交室,室温下用2× SSC洗涤载玻片5分钟。为了固定染色,载玻片在37℃的预热2× SSC中洗涤3次,在55℃的预热0.2× SSC中洗涤2次。最后一步,载玻片在室温下用1× PBT洗涤10分钟,用含有DAPI (Vector Laboratories H-1200-10)的7µl Vectashield贴载培养基贴载。gydF4y2Ba
染色图像采用蔡司Meta 710共聚焦激光扫描显微镜拍摄。为了可视化端粒信号,gydF4y2BazgydF4y2Ba使用蔡司Meta 710共聚焦显微镜获取-叠片图像gydF4y2BazgydF4y2Ba-叠图处理,用Image J/Fiji v2.3.0/1.53f对DNA片段数进行计数。gydF4y2Ba
公共数据集gydF4y2Ba
对以下公共数据集进行了重新分析:删除了20220216 CeNDR 29版本的硬过滤变体gydF4y2Ba30.gydF4y2Ba都是从gydF4y2Bahttps://www.elegansvariation.org/data/release/20220216gydF4y2Ba。的数据gydF4y2Ba秀丽隐杆线虫gydF4y2Ba突变积累实验下载自Volkova等人的补充资料。gydF4y2Ba31gydF4y2Ba。过滤后的hg38 SNV_INDEL_SV_phased_panel。1000基因组计划的20220422版本中所有染色体的vcf文件gydF4y2Ba34gydF4y2Ba都是从gydF4y2Bahttp://ftp.1000genomes.ebi.ac.uk/vol1/ftp/data_collections/1000G_2504_high_coverage/working/20220422_3202_phased_SNV_INDEL_SV/gydF4y2Ba。hg38 illumina-polaris-v2.1-sv-truthset结构变体(gydF4y2Bahttps://github.com/Illumina/PolarisgydF4y2Ba)已从gydF4y2Bahttps://s3-us-west-1.amazonaws.com/illumina-polaris-v2.1-sv-truthset/all_merge.vcf.gzgydF4y2Ba。从Jónsson等人的补充数据中下载了冰岛1548个三人组的hg38变体,包括配子起源分析。gydF4y2Ba35gydF4y2Ba。gydF4y2Ba
生物信息学分析gydF4y2Ba
基因集富集分析gydF4y2Ba
染色体基因分布富集分析在R v3.6.3中使用clusterProfiler v3.14.3的GSEA功能进行gydF4y2Ba53gydF4y2BamaxGSSize = 20000, nPerm = 20000。gydF4y2Ba
WGS预处理gydF4y2Ba
fastq文件使用Fastp v0.20.0进行预处理gydF4y2Ba54gydF4y2Ba,并与BWA-0.7.17进行映射gydF4y2Ba55gydF4y2Ba参数bwa mem -M -K 100000000,参考基因组ce11。将映射的文件转换为BAM并使用samtools v1.6进行排序gydF4y2Ba56gydF4y2Ba使用GATK v4.1.0.0 markduplicate删除了重复读取gydF4y2Ba57gydF4y2Ba。gydF4y2Ba
结构变量调用gydF4y2Ba
结构变量在Manta v1.6.0中被调用gydF4y2Ba58gydF4y2Ba并且只使用通过所有蝠鲼质量过滤器的结构变体。为了找到F中新诱导的结构变异gydF4y2Ba1gydF4y2Ba代,结构变异与任何P的结构变异重叠gydF4y2Ba0gydF4y2Ba在补充表中过滤或未过滤的样本全部结构变异位点gydF4y2Ba3.gydF4y2Ba).重复区域很难定位和识别,因此我们删除了重复区域内的任何插入-删除突变,或者两个断点与相同重复类重叠的任何易位。蝠鲼把两个方向的易位称为两个断点,包括一个位置置信区间。为了避免重复,我们在任何组合的各自置信区间内过滤了具有相同起始和结束断点的易位。gydF4y2Ba
易位的类型gydF4y2Ba
一个易位被称为两个断点,可以在VCF文件中以四种不同的方式出现。将参考序列s替换为融合到p位置后的序列t,分别在p位置融合之前的序列t。这可以通过四种方式实现:gydF4y2Ba
类型1:t[p]从p位置向右延伸的基因组位置在t之后融合。换句话说,这些是3 '义链和5 '义链之间的融合。gydF4y2Ba
类型2:t]p]基因组位置p左侧的反向成分在t之后融合。换句话说,这些是3 '义链和5 '反义链之间的融合。gydF4y2Ba
3型:[p]t从位置p向左延伸的基因组位置在t之前融合。这与1型相同。gydF4y2Ba
类型4:[p] t从位置p向右延伸的基因组位置的反向成分在t之前融合。换句话说,这些是3 '反义链和5 '义链之间的融合。gydF4y2Ba
看到gydF4y2Bahttps://github.com/samtools/hts-specs/blob/master/VCFv4.1.pdfgydF4y2Ba欲知详情。gydF4y2Ba
圆环图gydF4y2Ba
库循环v0.4.12gydF4y2Ba59gydF4y2Ba在R v3.6.3中生成circos图。gydF4y2Ba
带有分布的模板化插入gydF4y2Ba
在断点周围±25 bp范围内搜索插入的序列,在两个方向上,在正方向上,在反向、补体和反向补体方向上。≥3bp且在±25bp范围内可找到模板的插入称为模板插入,而其他插入则归类为杂项插入。gydF4y2Ba
微同源与排列gydF4y2Ba
对于每个易位,在一个8 × 8的网格中比较两个断裂位点周围的8 bp(即两个断裂位点上游和下游的4 bp)(即每个周围的碱基与其他碱基进行比较)。匹配的碱基为1,不匹配的碱基为0。因此,对于具有相同基数的64种组合,每张地图都包含1,否则为0。图中所示的热图包含了所有这些各自热图的总和除以易位的总数。对于四种易位类别中的每一种,计算了一个单独的微同源性。对于1型易位,左右侧翼都在传感链上的5 '到3 '。2型易位的左侧为5′~ 3′义链,右侧为反向补体序列。对于4型易位,左侧为反向补体序列,右侧为5′~ 3′义链序列。gydF4y2Ba
为了计算单个箱子的显著性,进行了排列检验。对于每个排列,与原始热图中相同数量的易位(相同类型)随机分布在基因组上,以计算64个箱中每个箱的微同源比率。计算agydF4y2BaPgydF4y2Ba排列测试的值是用100,000个排列来计算的。计算调整后的gydF4y2BaPgydF4y2Ba值为64个bin的statmodels v0.11.1gydF4y2Ba60gydF4y2Ba在Python 3.6中使用参数method= ' fdr_bh '进行multipletests方法gydF4y2Ba61gydF4y2Ba是使用。gydF4y2Ba
碱基组成gydF4y2Ba
对于所有长度为1的微同源易位(gydF4y2BangydF4y2Ba= 35gydF4y2Bafog-2gydF4y2Ba,gydF4y2BangydF4y2Ba= 58(野生型),计算断点周围8bp的碱基组成。对于8个位置中的每个位置,计算A, C, T和G的百分比。为了能够将其与随机背景分布进行比较,我们对相同数量的位置进行了采样,即35个gydF4y2Bafog-2gydF4y2Ba野生型为58%,并计算了25000种这样的排列中每种A、C、T和G的平均百分比。gydF4y2Ba
公众分析gydF4y2Ba秀丽隐杆线虫gydF4y2Ba数据集gydF4y2Ba
CeNDRgydF4y2Ba
20220216 CeNDR的硬过滤变体的删除gydF4y2Ba30.gydF4y2Ba下载释放并进一步过滤8至200 bp之间的缺失。在同一重复类中注释两个中断位点的删除被删除。每次缺失被分为非同源性(即断裂位点上没有匹配碱基)、微同源性(即断裂位点上只有一个匹配碱基)和宏同源性(即多个匹配碱基)。偶然地,我们预计75%的断裂位点是非同源的,16.66%是微同源的,8.33%是大同源的。微同源缺失位点的过度表示是使用Python的Scipy-v1.5.1包中的二项式测试函数binom_test计算的。过度代表的微同源变异在热图中使用,如上所述,用于16 × 16网格。gydF4y2Ba
突变积累gydF4y2Ba
突变积累实验数据下载自Volkova等人的补充数据。gydF4y2Ba31gydF4y2Ba。两个断裂位点在同一重复类中被注释的缺失被删除,只有长度在8到200 bp之间的缺失被考虑用于后续分析。统计数据和热图的计算方法如上所述。gydF4y2Ba
公共人类数据集的分析gydF4y2Ba
千人基因组计划gydF4y2Ba
过滤后的hg38 SNV_INDEL_SV_phased_panel。1000基因组计划的20220422版本中所有染色体的vcf文件gydF4y2Ba34gydF4y2Ba下载并进一步过滤8 - 200bp之间的缺失。由于人类的微同源足迹为2-6 bp,我们定义了3个不同的类别gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。0-1 bp的同源性在75% + 16.66% = 91.66%的断裂位点上有机会得到。8.325%的断裂位点具有微同源性,即2-6 bp的同源性,1/12288≈0.00008%的断裂位点具有大同源性。统计数据和热图按上述方法计算。gydF4y2Ba
北极星gydF4y2Ba
hg38 illumina-polaris-v2.1-sv-truthset结构变体(gydF4y2Bahttps://github.com/Illumina/PolarisgydF4y2Ba)被下载并过滤掉在质量列中有PASS的删除。为了关注新生缺失,任何与亲本中任何一方重叠的缺失都被过滤掉,只有8到200 bp之间的缺失被考虑用于后续分析。统计数据和热图的计算方法如上所述。gydF4y2Ba
冰岛三人小组gydF4y2Ba
从Jónsson等人的补充数据中下载了冰岛1548个三人组的hg38变体,包括配子起源分析。gydF4y2Ba35gydF4y2Ba。我们只考虑了8 ~ 200 bp之间的缺失,而这些缺失的来源是配子。统计和热图分别计算来自母亲和父亲的缺失,如上所述。gydF4y2Ba
数据展示和统计分析gydF4y2Ba
使用GraphPad Prism 7软件包(GraphPad)和R studio对所有数据和统计学意义进行分析。对于本文所示的比例数据,使用logit链接函数(R v4.0.2, emmeans v1.5.2)的GLM (gydF4y2Bahttps://cran.r-project.org/web/packages/emmeans/index.htmlgydF4y2Ba))和反正弦变换值的普通方差分析(反正弦变换方程:gydF4y2BaYgydF4y2Ba= arcsin(√(gydF4y2BaYgydF4y2Ba/gydF4y2BangydF4y2Ba) × 180/π)来证实观测值的显著性,完整统计结果见补充表gydF4y2Ba1gydF4y2Ba。此外,还附有QQ图进行方差分析,以评估转换值的正态分布。只有gydF4y2BaPgydF4y2Ba用GLM方法计算的值如图所示。统计方法,gydF4y2BaPgydF4y2Ba数值、样本量信息和误差条描述在图例中报告。没有采用随机化,因为分组分配是根据各自突变蠕虫的基因型进行的。然而,在每次实验中,从大型菌株群体中随机选择给定基因型的蠕虫,而不进行任何预处理。由于实验是在高度标准化和预先确定的条件下进行的,因此可以排除研究者引起的偏倚,因此没有使用盲法。对于子代致死性表征和染色定量,使用95%置信区间的中位数,因为这些数据类型包含异常值。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然投资组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
单虫WGS数据已存入BioProject数据库,登录号为gydF4y2BaPRJNA826255gydF4y2Ba。质谱蛋白质组学数据已通过带有数据集标识符的PRIDE合作伙伴存储库存入ProteomeXchange ConsortiumgydF4y2BaPXD031873gydF4y2Ba。gydF4y2Ba
代码的可用性gydF4y2Ba
本研究中使用的自定义代码可从gydF4y2Bahttps://github.com/Meyer-DH/swWGS_Custom_CodegydF4y2Ba。gydF4y2Ba
参考文献gydF4y2Ba
Kong, A.等。新生突变率和父亲年龄对疾病风险的重要性。gydF4y2Ba自然gydF4y2Ba488gydF4y2Ba, 471-475(2012)。gydF4y2Ba
联合国核辐射效应科学委员会。gydF4y2Ba《辐射的遗传效应》,2001年提交大会的报告,附科学附件gydF4y2Ba(联合国,2001年)。gydF4y2Ba
Schumacher, B., Pothof, J., Vijg, J. & Hoeijmakers, J. H. J. DNA损伤在衰老过程中的核心作用。gydF4y2Ba自然gydF4y2Ba592gydF4y2Ba, 695-703(2021)。gydF4y2Ba
杨建军,董欣。衰老过程中体细胞突变和基因组嵌合的致病机制。gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 12-23(2020)。gydF4y2Ba
突变、近亲繁殖、杂交和选择在进化中的作用。:gydF4y2Ba第十一届国际遗传学大会教授gydF4y2Ba8gydF4y2Ba, 209-222(1932)。gydF4y2Ba
胡,C.等。癌症易感基因的遗传种系突变与胰腺癌风险之间的关系。gydF4y2Ba《美国医学会杂志》gydF4y2Ba319gydF4y2Ba, 2401(2018)。gydF4y2Ba
Kloosterman, w.p.等。人类基因组从头结构变化的特征。gydF4y2Ba基因组Res。gydF4y2Ba25gydF4y2Ba, 792-801(2015)。gydF4y2Ba
Belyeu, j.r.等。通过对2,396个家庭的基因组测序揭示了从头结构突变率和配子起源偏差。gydF4y2Ba点。j .的嗡嗡声。麝猫。gydF4y2Ba108gydF4y2Ba, 597-607(2021)。gydF4y2Ba
父亲因素和精神分裂症风险:新生突变和印记。gydF4y2BaSchizophr。公牛。gydF4y2Ba27gydF4y2Ba, 379-393(2001)。gydF4y2Ba
卡松,r.m.等人。年轻人的生殖系突变率预示着寿命和生殖寿命。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba浙江农业大学学报,2000(2020)。gydF4y2Ba
Holtgrewe等人。父亲暴露于电离辐射后人类后代的多位点从头突变。gydF4y2Ba科学。代表。gydF4y2Ba8gydF4y2Ba, 14611(2018)。gydF4y2Ba
Dubrova,余。E.小鼠和人类种系的突变诱导。gydF4y2Ba拉斯。j .麝猫。gydF4y2Ba52gydF4y2Ba, 17-28(2016)。gydF4y2Ba
Little, M. P, Goodhead, D. T, Bridges, B. A.和Bouffler, S. D.辐照父母的后代的非靶向和跨代效应的相关证据。gydF4y2BaMutat。Res。gydF4y2Ba753gydF4y2Ba, 50-67(2013)。gydF4y2Ba
加德纳,m.j.等人。西坎布里亚郡塞拉菲尔德核电站附近年轻人白血病和淋巴瘤病例对照研究结果。gydF4y2Ba英国人。地中海。J。gydF4y2Ba300gydF4y2Ba, 423-429(1990)。gydF4y2Ba
儿童白血病和父亲的辐射暴露——也许是这条路的尽头?gydF4y2Baj . Radiol。普罗特。gydF4y2Ba23gydF4y2Ba; 359-362(2003)。gydF4y2Ba
Gardner, M. J, Hall, A. J, Downes, S. & Terrell, J. D.对在其他地方出生但在西坎布里亚郡西斯卡尔上学的儿童的跟踪研究(学校队列)。gydF4y2Ba英国人。地中海。J。gydF4y2Ba295gydF4y2Ba, 819-822 (1987)gydF4y2Ba
耶格尔,M.等。缺乏切尔诺贝利事故电离辐射暴露的跨代影响。gydF4y2Ba科学gydF4y2Ba372gydF4y2Ba, 725-729(2021)。gydF4y2Ba
莫顿,l.m.等。切尔诺贝利事故后甲状腺乳头状癌的辐射相关基因组图谱。gydF4y2Ba科学gydF4y2Ba372gydF4y2Ba, eabg2538(2021)。gydF4y2Ba
koaira, M., Satoh, C., Hiyama, K. & Toyama, K.原子弹辐射对人类生殖细胞串联重复元件遗传不稳定性影响的缺乏。gydF4y2Ba点。j .的嗡嗡声。麝猫。gydF4y2Ba57gydF4y2Ba, 1275(1995)。gydF4y2Ba
Kodaira, M.等。没有证据表明原子弹幸存者后代的微卫星位点突变率增加。gydF4y2BaRadiat。Res。gydF4y2Ba173gydF4y2Ba, 205-213(2010)。gydF4y2Ba
卡普兰尼斯,J.等。遗传和化疗对种系超突变的影响。gydF4y2Ba自然gydF4y2Ba605gydF4y2Ba, 503-508(2022)。gydF4y2Ba
卡普兰尼斯,J.等。结合医疗保健和研究数据发现了28种遗传疾病的证据。gydF4y2Ba自然gydF4y2Ba586gydF4y2Ba, 757-762(2020)。gydF4y2Ba
Marchetti, F, Essers, J, Kanaar, R.和Wyrobek, A. J.母亲DNA修复的破坏增加了精子来源的染色体畸变。gydF4y2Ba自然科学进展。美国gydF4y2Ba104gydF4y2Ba, 17725-17729(2007)。gydF4y2Ba
[2]染色体断端稳定性的研究gydF4y2Ba玉米gydF4y2Ba。gydF4y2Ba遗传学gydF4y2Ba26gydF4y2Ba, 234-282(1941)。gydF4y2Ba
Gartner, A., Milstein, S., Ahmed, S., Hodgkin, J.和Hengartner, M. O.一个保守的检查点通路介导DNA损伤诱导的细胞凋亡和细胞周期阻滞gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。gydF4y2Ba摩尔。细胞gydF4y2Ba5gydF4y2Ba, 435-443(2000)。gydF4y2Ba
Rappaport, Y.等。在染色体减数分裂过程中,X染色体的一分为二破坏了染色体沉默的起始gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 4802(2021)。gydF4y2Ba
怀亚特,d.w.等。聚合酶θ-介导的末端连接在染色体断裂修复中的重要作用。gydF4y2Ba摩尔。细胞gydF4y2Ba63gydF4y2Ba, 662-673(2016)。gydF4y2Ba
Roerink, s.f, van Schendel, R. & Tijsterman, M.聚合酶介导的复制相关DNA末端连接断裂gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。gydF4y2Ba基因组Res。gydF4y2Ba24gydF4y2Ba, 954-962(2014)。gydF4y2Ba
缅甸,S,陈b.p.c.,陈d.j .非同源末端连接(NHEJ)在维持基因组完整性中的作用。gydF4y2BaDNA修复gydF4y2Ba5gydF4y2Ba, 1042-1048(2006)。gydF4y2Ba
Cook, D. E., Zdraljevic, S., Roberts, J. P. & Andersen, E. C. CeNDRgydF4y2Ba秀丽隐杆线虫gydF4y2Ba自然多样性资源。gydF4y2Ba核酸类。gydF4y2Ba45gydF4y2Ba, d650-d657(2017)。gydF4y2Ba
Volkova, n.v.等。突变特征是由DNA损伤和修复共同形成的。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 2169(2020)。gydF4y2Ba
Van Schendel, R., Roerink, S. F., Portegijs, V., Van Den Heuvel, S.和Tijsterman, M.聚合酶Θ是基因组进化和CRISPR/ cas9介导的突变的关键驱动因素。gydF4y2BaCommun Nat。gydF4y2Ba6克ydF4y2Ba, 7394(2015)。gydF4y2Ba
卡瓦哈尔-加西亚,J.等。聚合酶微同源性鉴定和基因组瘢痕形成的机制基础。gydF4y2Ba自然科学进展。美国gydF4y2Ba117gydF4y2Ba中文信息学报,8476-8485(2020)。gydF4y2Ba
Byrska-Bishop, M.等。扩展千人基因组计划队列的高覆盖率全基因组测序,包括602个三人组。gydF4y2BaSSRN电子。J。gydF4y2Ba185gydF4y2Ba, 3426 - 3440。e19(2021)。gydF4y2Ba
Jónsson, H.等。亲本对冰岛1548个三胞胎人类种系新生突变的影响gydF4y2Ba自然gydF4y2Ba549gydF4y2Ba, 519-522(2017)。gydF4y2Ba
组蛋白H1和异染色质蛋白1 (HP1)调节特定基因的表达,而不是全局转录。gydF4y2Ba蠕虫gydF4y2Ba2 gydF4y2Ba, e1002940(2013)。gydF4y2Ba
Studencka, M.等。Hox基因的转录抑制gydF4y2Ba秀丽隐杆线虫gydF4y2BaHP1/HPL和H1/HIS-24。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba8gydF4y2Ba, e1002940(2012)。gydF4y2Ba
异染色质和DNA损伤修复:使用不同的组蛋白变体和放松。gydF4y2Ba核gydF4y2Ba8gydF4y2Ba, 583-588(2017)。gydF4y2Ba
异染色质和DNA损伤反应:需要放松。gydF4y2Ba物化学。细胞生物。gydF4y2Ba89gydF4y2Ba, 45-60(2011)。gydF4y2Ba
Alpi, A, Pasierbek, P., Gartner, A.和Loidl, J.重组蛋白RAD-51的遗传和细胞学特征gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。gydF4y2BaChromosomagydF4y2Ba112gydF4y2Ba, 6-16(2003)。gydF4y2Ba
Dubrova, Y. E.和Sarapultseva, E. I.辐射诱导的动物跨代效应。gydF4y2BaInt。j . Radiat。医学杂志。gydF4y2Ba98gydF4y2Ba中文信息学报,1047-1053(2020)。gydF4y2Ba
米德尔坎普,s。精子DNA损伤导致胚胎早期发育的基因组不稳定。gydF4y2Ba科学。睡觉。gydF4y2Ba6克ydF4y2Ba, eaaz7602(2020)。gydF4y2Ba
泰勒,t.h.等人。人类染色体嵌合体的起源、机制、发病率和临床后果。gydF4y2Ba嗡嗡声。天线转换开关。更新gydF4y2Ba20.gydF4y2Ba, 571-581(2014)。gydF4y2Ba
等。染色体嵌合程度影响体外受精治疗的临床结果。gydF4y2BaFertil。杂志。gydF4y2Ba109gydF4y2Ba, 77-83(2018)。gydF4y2Ba
主啊,B.等。甲基亚硝基尿素在孕前父亲污染钚-239后诱导肿瘤。gydF4y2BaBr。j .癌症gydF4y2Ba78gydF4y2Ba, 301-311(1998)。gydF4y2Ba
Vorobtsova, I. E, Aliyakparova, L. M. & Anisimov, V. N.促进皮肤肿瘤gydF4y2BaOgydF4y2Ba-十四烷酰磷-13-醋酸酯在两代雄性小鼠后代暴露于x射线照射。gydF4y2BaMutat。摩尔,械甲怪。诱变剂。gydF4y2Ba287gydF4y2Ba, 207-216(1993)。gydF4y2Ba
马科娃,k.d.和李,w.h。人类和类人猿DNA序列的强烈雄性驱动进化。gydF4y2Ba自然gydF4y2Ba416gydF4y2Ba, 624-626(2002)。gydF4y2Ba
戈德曼,j.m.等人。新生突变的亲本特异性特征。gydF4y2BaNat,麝猫。gydF4y2Ba48gydF4y2Ba中文信息学报,935-939(2016)。gydF4y2Ba
Roberti, A., Valdes, A. F., Torrecillas, R., Fraga, m.f.和Fernandez, A. F.,癌症治疗和纳米医学的表观遗传学。gydF4y2Ba中国。表观遗传学gydF4y2Ba11gydF4y2Ba, 81(2019)。gydF4y2Ba
Gartner, A., MacQueen, A. J. & Villeneuve, A. M. ingydF4y2Ba检查点控制与癌症gydF4y2Ba卷280(编Schönthal, a.h.) 257-274 (Humana, 2004年)。gydF4y2Ba
Larance, M.等。线虫氨基酸的稳定同位素标记。gydF4y2BaNat方法。gydF4y2Ba8gydF4y2Ba, 849-851(2011)。gydF4y2Ba
徐博,李,等。利用荧光原位杂交(FISH)和PNA探针对秀丽隐杆线虫端粒和重复序列的观察和定量。gydF4y2BaJ. vi .解释;gydF4y2Ba114gydF4y2Ba, e54224(2016)。gydF4y2Ba
于国强,王立国。,Han, Y. & He, Q.-Y. clusterProfiler: an R package for comparing biological themes among gene clusters.组学gydF4y2Ba16gydF4y2Ba, 284-287(2012)。gydF4y2Ba
陈思,周勇,陈勇,顾杰。fastp:一种超快速一体化FASTQ预处理器。gydF4y2Ba生物信息学gydF4y2Ba34gydF4y2Ba, i884-i890(2018)。gydF4y2Ba
利用BWA-MEM对序列读取、克隆序列和组装序列进行比对。预印在gydF4y2Bahttps://doi.org/10.48550/arXiv.1303.3997gydF4y2Ba(2013)。gydF4y2Ba
李,H.等。序列比对/映射格式和SAMtools。gydF4y2Ba生物信息学gydF4y2Ba25gydF4y2Ba, 2078-2079(2009)。gydF4y2Ba
范德奥维拉,g.a.和奥康纳,b.d.。gydF4y2Ba云中的基因组学:在Terra中使用Docker、GATK和WDLgydF4y2Ba(O 'Reilly Media, 2020)。gydF4y2Ba
陈旭,等。Manta:用于生殖系和癌症测序应用的结构变异和索引的快速检测。gydF4y2Ba生物信息学gydF4y2Ba32gydF4y2Ba, 1220-1222(2016)。gydF4y2Ba
Gu, Z., Gu, L., Eils, R., Schlesner, M. & Brors, B. circlize在R中实现并增强了圆形可视化。gydF4y2Ba生物信息学gydF4y2Ba30.gydF4y2Ba, 2811-2812(2014)。gydF4y2Ba
seold, S. & Perktold, J. statmodels:用Python进行计量经济和统计建模。在gydF4y2Ba第九届科学Python大会主持人gydF4y2Ba第57卷(SciPy, 2010)。gydF4y2Ba
vanRossum G。gydF4y2BaPython参考手册gydF4y2Ba(证照,1995)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢CECAD蛋白质组学和成像设施,以及科隆大学区域计算中心(RRZK)为dfg资助的高性能计算(HPC)系统CHEOPS提供计算时间和支持。蠕虫菌株由国家生物资源项目(由日本教育、文化、体育、科学和技术省支持)提供gydF4y2Ba秀丽gydF4y2Ba遗传学中心(由美国国立卫生研究院国家研究资源中心资助)和gydF4y2Ba秀丽隐杆线虫gydF4y2Ba俄克拉何马医学研究基金会的基因敲除项目(国际gydF4y2Ba秀丽隐杆线虫gydF4y2Ba基因敲除联盟)。NGS在科隆西德基因组中心进行,由NGS能力网络(项目423957469)的DFG研究基础设施(407493903)支持。作为DFG测序电话的一部分,B.S.获得了DFG拨款SCHU 2494/7-1。D.H.M.得到了科隆老龄研究研究生院的支持。理学士获得了德意志研究基金会(SCHU 2494/3-1、SCHU 2494/7-1、SCHU 2494/10-1、SCHU 2494/11-1、SCHU 2494/15-1、CECAD EXC 2030 - 390661388、SFB 829、KFO 286、KFO 329和GRK 2407)、德意志德意志银行(70114555)、h2020 - mca - itn -2018 (Healthage和ADDRESS ITNs)和约翰邓普顿基金会(61734)的资助。图中的原理图是用BioRender.com创建的。gydF4y2Ba
资金gydF4y2Ba
开放获取资金由Universität zu Köln提供。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
D.H.M.进行了所有的生物信息学分析。S.W.执行和分析实验,并与B.S.一起构思和设计研究,所有作者都写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
B.S.是Agevio Therapeutics的联合创始人。gydF4y2Ba
同行评审gydF4y2Ba
同行评议信息gydF4y2Ba
自然gydF4y2Ba感谢Lenhard Rudolph和其他匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
扩展数据图和表gydF4y2Ba
图1在L4晚期,雌雄同体WT暴露于IR会导致延长的跨代胚胎致死率。gydF4y2Ba
一个gydF4y2Ba。IR处理的WT雌雄同体在L3(精子发生开始)、年轻L4(正在进行的精子发生)和L4晚期(成熟精子储存在精囊中)的跨代致死率特征。每个生物重复10只,n = 3个生物重复。误差条表示95% CI的中位数。gydF4y2BabgydF4y2Ba。雌雄同体P0 L4晚期经IR处理的多代后代致死率特征。每个剂量组10只,每个生物重复,n = 3个生物重复。误差条表示95% CI的中位数。gydF4y2Ba
扩展数据图2父本暴露于IR导致F1代基因组不稳定。gydF4y2Ba
一个gydF4y2Ba。“彗星”状精子的定量(显示p值和表示精子的n数,进行卡方检验)。gydF4y2BabgydF4y2Ba。父亲和母亲暴露于IR的F1染色体畸变的量化(显示了p值和指示胚胎的n个数,进行了Fisher的精确检验)。gydF4y2BacgydF4y2Ba。具有代表性的DAPI荧光显微图像(蓝色)gydF4y2Bafog-2gydF4y2Ba来自对照或辐照雌性的胚胎。染色体片段的放大图像如下所示,片段DNA用箭头表示。比例尺= 10 μm。gydF4y2BadgydF4y2Ba。辐照雄性和雌性F1后代肠道染色体桥的定量分析(ngydF4y2Bafog-2gydF4y2Ba= 9, ngydF4y2Baspe-8gydF4y2Ba= 10个肠,显示95% CI的中位数,显示p值,使用logit关联函数的双因素GLM和Tukey多重比较)。对比例数据也采用反正弦变换的双向方差分析来确认统计结果,并纳入补充表所示的全统计结果gydF4y2Ba1gydF4y2Ba。gydF4y2BaegydF4y2Ba。表达H2B::GFP的雌雄同体WTs肠道细胞在亲本红外照射(90 Gy)或不照射(90 Gy)下的代表性荧光显微镜图像。在F1的肠细胞中观察到染色体桥接。比例尺= 10 μm。gydF4y2BacgydF4y2Ba和gydF4y2BaegydF4y2Ba重复三次,结果相似。gydF4y2BafgydF4y2Ba。对照组小鼠L1期后48h测定发育分期gydF4y2Bafog-2gydF4y2Ba和gydF4y2Baspe-8gydF4y2Ba和F1一代gydF4y2Bafog-2gydF4y2Ba和gydF4y2Baspe-8gydF4y2Ba,每个实验分析n = 30个个体(每个品系n = 3个独立实验,p值为表,采用双尾t检验)。完整统计结果见补充表gydF4y2Ba1gydF4y2Ba。gydF4y2BaggydF4y2Ba。定量未辐照对照、90Gy处理WT的∆f、∆mf、gydF4y2Bafog-2gydF4y2Ba和gydF4y2Baspe-8gydF4y2Ba突变体(n = 9种系,显示95% CI的中位数,显示p值,使用Bonferroni多重比较检验的双向方差分析)。完整统计结果见补充表gydF4y2Ba1gydF4y2Ba。gydF4y2BahgydF4y2Ba。∆mf (n = 6只虫)和∆mm (n = 8只虫)新染色体易位数。方框描绘了顶部和底部四分位数的中位数,须延伸到1.5 IQR。每个样本的新易位和映射读数显示在补充表中gydF4y2Ba2 gydF4y2Ba。gydF4y2Ba我gydF4y2Ba。和gydF4y2BajgydF4y2Ba。Circos图显示了六种新型染色体易位gydF4y2Bafog-2gydF4y2Ba∆mf (gydF4y2Ba我gydF4y2Ba)和八gydF4y2Bafog-2gydF4y2Ba∆毫米(gydF4y2BajgydF4y2Ba).所有易位的清单见补充表gydF4y2Ba3.gydF4y2Ba。gydF4y2Ba
图3亲本IR暴露下雌雄同体WT (F1) SILAC蛋白组学数据的I - V染色体基因集富集分析。gydF4y2Ba
基因集富集分析(GSEA)来自雌雄同体WT (F1),亲本IR暴露(90 Gy),染色体I至v。每个面板的顶部按顺序显示蛋白质组学数据的log2倍变化。底部的面板显示运行富集分数为绿色线。虚线表示距离0最远的位置。除了X染色体外,没有一条染色体与随机分布有显著不同。每条染色体的完整统计资料见补充表gydF4y2Ba4gydF4y2Ba。gydF4y2Ba
图4雌雄同体WT L4晚期的IR暴露导致染色体重排。gydF4y2Ba
一个gydF4y2Ba。全基因组测序分析显示,与未经治疗的对照组相比,亲本IR暴露(90 Gy)的雌雄同体WT成年(F1)的新染色体易位数量归一化。n = 11只蠕虫,方框描绘了顶部和底部四分位数的中位数,而胡须延伸到1.5 IQR。每个样本的新易位和映射读取的数量显示在补充表中gydF4y2Ba2 gydF4y2Ba。gydF4y2BabgydF4y2Ba。雌雄同体WT成年(F1)在有或没有亲代IR暴露(90 Gy)的情况下,晚期卵母细胞中dapi染色体的特征。gydF4y2BacgydF4y2Ba。免疫荧光共染色RNA Pol ll p-Ser2(绿色)、hm -8(红色)和DAPI(蓝色)的合并图像,来自雌雄同体WT成年(F1)的解剖种系,有或没有亲本IR暴露(90 Gy)。右侧显示三个有代表性的核。标尺= 20 μm。这个实验重复了三次,结果相似。gydF4y2Ba
扩展数据图5 Circos图显示了双亲IR (90 Gy)照射下10个雌雄同体WT (F1)的染色体易位。gydF4y2Ba
所有易位的清单见补充表gydF4y2Ba3.gydF4y2Ba。gydF4y2Ba
图6雌雄同体WT动物使用TMEJ修复遗传DNA损伤。gydF4y2Ba
一个gydF4y2Ba。的易位位点之间插入模板位置的密度图gydF4y2Bafog-2gydF4y2Ba成人(F1)与父亲暴露于IR (90 Gy)。只包括至少3bp的插入,并且其模板在其中一个断点附近±25bp内被发现(对应于图3中模板化的插入)。gydF4y2Ba3gydF4y2Ba).x轴上的橙色刻度表示找到模板的位置。蓝色曲线将核密度估计描述为估计发现位置的概率密度函数的非参数方法。黑线表示距离断点±25bp的距离截止。gydF4y2BabgydF4y2Ba。当父亲暴露于IR (90 Gy)时,WT成年(F1)易位足迹的分布。模板插入是指融合位点之间长度≥3bp的插入,在两个断点附近±25bp内具有匹配序列。杂插入是指< 3bp的插入或在断点周围±25bp内没有匹配序列的插入。gydF4y2BacgydF4y2Ba。与(A)中相同的密度图,但对于父亲暴露于IR (90 Gy)的WT成年(F1)(对应于扩展数据图中的模板插入)。gydF4y2Ba3 bgydF4y2Ba).gydF4y2BadgydF4y2Ba。2型(上)和4型(下)易位示意图。义链是蓝色的,反义链是红色的。数字表示到断点的核苷酸距离。2型易位是3 '义链与5 '反义链之间的融合。4型易位是3 '反义链与5 '义链之间的融合。黄框表示显示微同源的位置。2型显示左侧断点与右侧负链第二碱基的微同源性。4型与右侧被排除部分的倒数第二个碱基和左侧被排除部分的最后一个碱基具有微同源性。因此,4型的微同源性不在融合的区域。gydF4y2BaegydF4y2Ba。热图表示所有类型2(顶部,n = 51个易位),各自类型4(底部,n = 45个易位)的总和,易位图来源于gydF4y2Bafog-2gydF4y2Ba父亲暴露于IR (90 Gy)的成人(F1),不包括模板插入的易位。用颜色表示相似度。颜色越深表示相应碱基之间的序列相似性越高。x轴和y轴上的数字与扩展数据图中的解释相同。gydF4y2Ba3 dgydF4y2Ba。gydF4y2BafgydF4y2Ba。与(e)相似,但适用于父母暴露于IF (90 Gy)的WT成人(F1)。1型(n = 65位易位)、2型(n = 57位易位)和4型(n = 58位易位)易位图来自父母暴露于IR (90 Gy)的WT成人(F1),不包括模板插入易位。gydF4y2BaggydF4y2Ba。长度为1的微同源易位断点附近的碱基组成gydF4y2Bafog-2gydF4y2Ba(左,n = 35)或WT(右,n = 58)。位置0表示断点。负数是聚变后不包含的碱基,而正数表示距离聚变点的距离,聚变后包含。4个碱基用不同的颜色编码,背景中的阴影显示了AT的分布,分别是CG,对于25000个排列。y轴表示在给定位置对应基的百分比。gydF4y2BahgydF4y2Ba。击倒的gydF4y2BaEV, brc-1, cku-80gydF4y2Ba和gydF4y2Bapolq-1gydF4y2Ba通过RNAigydF4y2Bafog-2gydF4y2Ba有或没有父本IR暴露的突变体。N表示生物复制。显示了95% CI的中位数(p值)。采用logit链接函数GLM和Tukey多重比较)。比例数据也采用反正弦变换的单因素方差分析(One-way ANOVA)来确认统计结果,并纳入补充表中的完整统计结果gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
图7公众分析gydF4y2Ba秀丽隐杆线虫gydF4y2Ba以及人类数据集。gydF4y2Ba
热图表示微同源缺失断裂位点的所有碱基相似度的总和。用颜色表示相似度。颜色越深表示相应碱基之间的序列相似性越高。x轴为右侧,y轴为左侧缺失断裂位点。正值表示侧翼序列,负值表示删除的序列,即-1为第一个删除的碱基gydF4y2Ba一个gydF4y2Ba。该热图代表了540个CeNDR数据集中长度≤200 bp且微同源性为1 bp的天然分离株的缺失位点之和gydF4y2Ba30.gydF4y2Ba(22.6%显示1 bp-微同源性,预期为16.66%,二项p值= 5e-324,总缺失n = 68062)。gydF4y2BabgydF4y2Ba。热图显示了公共突变积累数据集中未经诱变剂处理的样品中长度≤200 bp和微同源性为1 bp的缺失位点的总和gydF4y2Ba31gydF4y2Ba(24.5%显示1 bp-微同源性,16.66%预期,二项p值= 0.00035,总缺失n = 314)。gydF4y2BacgydF4y2Ba。该热图表示人类1000基因组计划中长度≤200 bp且微同源性为2-6 bp的缺失位点的总和gydF4y2Ba34gydF4y2Ba(28%显示2-6 bp的微同源性,预期为8.3%,二项p值= 1e-323,总缺失n = 501024)。gydF4y2BadgydF4y2Ba。热图显示的是gydF4y2Ba新创gydF4y2Ba长度≤200bp的缺失位点和2- 6bp的微同源性gydF4y2Ba新创gydF4y2BaPolaris数据集的trios子代中的结构变异(gydF4y2Bahttps://github.com/Illumina/PolarisgydF4y2Ba)(19.5%显示2-6 bp的微同源性,预期为8.3%,二项p值= 1.36e-292,总缺失n = 10883)。gydF4y2BaegydF4y2Ba。热图显示的是gydF4y2Ba新创gydF4y2Ba来自冰岛的1548个三联染色体存在长度≤200 bp和2-6 bp微同源性的父本诱导缺失gydF4y2Ba35gydF4y2Ba已知配子起源(44.2%显示2-6 bp微同源性,预期8.3%,二项p值= 3.42e-10,总缺失n = 43)。更多细节见图。gydF4y2Ba3 egydF4y2Ba。gydF4y2BafgydF4y2Ba。表为公众重新分析的微同源性结果gydF4y2Ba秀丽隐杆线虫gydF4y2Ba以及人类基因组测序数据集。热图图显示在扩展数据图中。gydF4y2Ba7gydF4y2Baa e。采用二项检验,显示p值。gydF4y2Ba
图8 HIS-24调控父系遗传的胚胎致死性。gydF4y2Ba
一个gydF4y2Ba。雌雄同体WT动物中10个dna相关候选蛋白的RNAi筛选,以研究父系遗传的跨代胚胎致死率。击倒的gydF4y2Ba24gydF4y2Ba显著降低了F1代的后代致死率。n = 3个生物重复,显示95% CI的中位数(p值)。采用logit链接函数GLM和Tukey多重比较)。gydF4y2BabgydF4y2Ba。子代致死率表征gydF4y2Ba电动汽车(RNAi);fog-2gydF4y2Ba和gydF4y2Ba24 (RNAi);fog-2gydF4y2Ba接受或不接受父亲IR照射(60 Gy和90 Gy)。N表示生物复制。显示了95% CI的中位数(p值)。使用logit链接函数的GLM)。gydF4y2BacgydF4y2Ba。子代致死率表征gydF4y2Ba电动汽车(RNAi);fog-2gydF4y2Ba,gydF4y2Ba24 (RNAi);fog-2gydF4y2Ba,gydF4y2Bahpl-1 (RNAi);fog-2gydF4y2Ba接受或不接受父亲红外线照射(90 Gy)。N表示生物复制。显示95% CI的中位数(显示p值,使用logit链接函数的GLM和Tukey多重比较)。gydF4y2BadgydF4y2Ba。击倒的gydF4y2BaEV, his-24, hp -1gydF4y2Ba和gydF4y2Bahpl-2gydF4y2Ba在雌雄同体WT和gydF4y2Babrc-1gydF4y2BaL4期后期亲本暴露(90 Gy)的突变体,以及F1代后代致死率的表征。显示95% CI的中位数(n表示生物重复,p值显示)。采用logit链接函数GLM和Tukey多重比较)。单因素方差分析(gydF4y2Ba一个gydF4y2Ba和gydF4y2BacgydF4y2Ba)双向方差分析(gydF4y2BadgydF4y2Ba)和双尾t检验(gydF4y2BabgydF4y2Ba)对比例数据进行反正弦变换,以确认统计结果,并纳入补充表所示的完整统计结果gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
补充信息gydF4y2Ba
补充表1gydF4y2Ba
完整的统计分析。gydF4y2Ba
补充表2gydF4y2Ba
在FgydF4y2Ba1gydF4y2Ba每个样本的子代数。gydF4y2Ba
补充表3gydF4y2Ba
用P过滤前后染色体结构变异位点的完整列表gydF4y2Ba0gydF4y2Ba。gydF4y2Ba
补充表4gydF4y2Ba
染色体富集的蛋白质组学GSEA结果。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王淑娟,梅耶,D.H.和舒马赫,B.组蛋白介导的DNA损伤的遗传。gydF4y2Ba自然gydF4y2Ba613gydF4y2Ba, 365-374(2023)。https://doi.org/10.1038/s41586-022-05544-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05544-wgydF4y2Ba
这篇文章是由gydF4y2Ba
遗传辐射诱导的DNA损伤的机制gydF4y2Ba
自然gydF4y2Ba(2023)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba