摘要gydF4y2Ba
开花植物已经进化出许多种内和种间的合子前生殖障碍,以防止产生不利的后代gydF4y2Ba1gydF4y2Ba.在一个物种中,自交不亲和(SI)是一种广泛使用的排斥自交花粉的机制gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba避免近亲繁殖萧条。种间障碍抑制种间繁殖,通常遵循SI × self- compatibility (SC)规则,即种间花粉在SI雌蕊上单方不亲和(UI),而在SC雌蕊上单方亲和(UC)gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.在芸苔科中,SI、UI、SC和UC的分子机制及其相互关系尚不清楚。在这里,我们证明了SI花粉的决定因素gydF4y2Ba年代gydF4y2Ba-基因座富半胱氨酸蛋白/gydF4y2Ba年代gydF4y2Ba-位点蛋白11 (SCR/SP11)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba或者来自UI花粉的信号与SI雌性行列式结合gydF4y2Ba年代gydF4y2Ba-位点受体激酶(SRK)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,招募FERONIA (FER)gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba并在SI柱头中激活fer介导的活性氧的产生gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba排斥不相容的花粉。相容反应为花粉包衣蛋白b类gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2BaSC和UC花粉不同程度地触发一氧化氮,亚硝酸盐FER抑制SC柱头中的活性氧,促进花粉以种内优先的方式生长,保持种内完整性。我们的研究结果表明,SRK和FER整合了种内和种间屏障的机制,为实现芸苔科作物的远程育种提供了途径。gydF4y2Ba
主要gydF4y2Ba
在开花植物中,受精前的一个或多个检查点可能会出现合子前生殖障碍,以防止产生不利的后代gydF4y2Ba1gydF4y2Ba.在自然界中,开放的花的柱头接触到来自本物种的花粉,因此必须做出相应的反应。在物种内部,SI被广泛应用于避免近交萧条和通过排斥自我来提高杂种活力的机制gydF4y2Ba-gydF4y2Ba花粉和接受种内交叉亲和(CP)花粉gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.种间不亲和保持了种的完整性,通常遵循SI × SC规则,即种间花粉在SI雌蕊上为UI,在SC雌蕊上为UCgydF4y2Ba1gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.到目前为止,对芸苔科植物中调节这些相容性系统及其相互联系的分子机制知之甚少。gydF4y2Ba
在十字花科SI中,自花花粉是通过花粉表达的SCR/SP11与其受体柱头表达的质膜定位SRK之间的配体-受体相互作用来识别的gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.这激活了SI的两个下游正调控因子gydF4y2Ba米gydF4y2Ba-位点蛋白激酶(MLPK)gydF4y2Ba15gydF4y2Ba含有1 (ARC1) E3泛素连接酶的ARM-repeatgydF4y2Ba16gydF4y2Ba.MLPK如何发挥作用尚不清楚gydF4y2Ba2gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.ARC1针对相容因子如外囊成分EXO70A1进行降解,阻断花粉水化gydF4y2Ba2gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.我们发现女性生育调节剂FER受体激酶gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba保持柱头门在gydF4y2Ba拟南芥gydF4y2Ba14gydF4y2Ba具有排斥SI花粉和促进SC花粉萌发的双重作用gydF4y2Ba芸苔属植物拉伯gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba通过信号迅速升高柱头活性氧(ROS)或其下降。gydF4y2Ba
SRK控制UI花粉的排斥反应gydF4y2Ba
我们首次描述了在SI, SC, UI或UC授粉过程中花粉诱导的反应gydF4y2Bab·拉伯gydF4y2Ba而且gydF4y2Ba答:芥gydF4y2Ba通过沉积花粉的柱头gydF4y2Bab·拉伯gydF4y2Ba种间密切相关gydF4y2Ba芸苔属植物oleraceagydF4y2Ba,更遥远的属间gydF4y2BaBarbarea寻常的gydF4y2Ba而且gydF4y2Ba答:芥gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba).特别有趣的是交叉涉及gydF4y2Bab .寻常的gydF4y2Ba由于它对真菌和昆虫病原体有很高的抵抗力gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,但属间屏障阻止其可取的性状渗入gydF4y2Ba芸苔属植物gydF4y2Ba作物。gydF4y2Ba
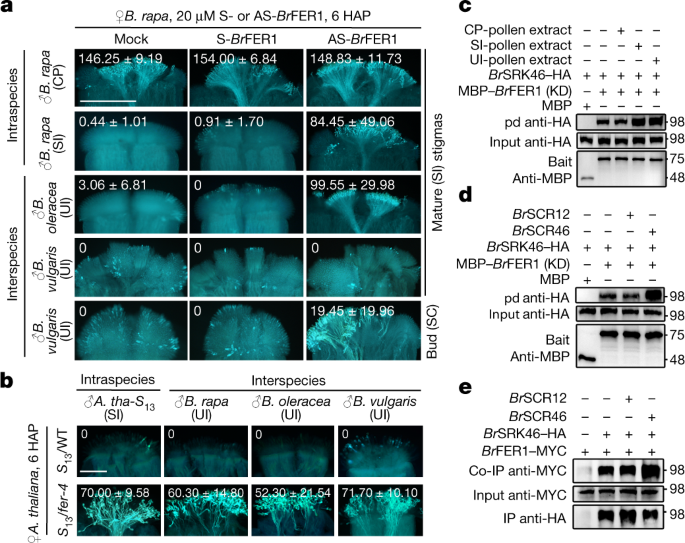
一个gydF4y2Ba,利用内部转录间隔序列最大似然分析的芸苔科物种开放花和系统发育树。远亲gydF4y2BaCochlearia丹妮卡gydF4y2Ba作为一个外部团体。标尺,每个位点核苷酸取代的平均数。gydF4y2BabgydF4y2Ba,苯胺蓝染色显示花粉在成熟期和花蕾期种内和种间生长gydF4y2Bab·拉伯gydF4y2Ba的污名。gydF4y2BacgydF4y2BaHgydF4y2Ba2gydF4y2Ba未授粉或授粉的ROS的DCFDA染色gydF4y2Bab·拉伯gydF4y2Ba的污名。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba, AS-中放松SI和UIgydF4y2BaBrgydF4y2BaSRK46-treatedgydF4y2BaB. rapa;gydF4y2Ba46gydF4y2Ba污名(gydF4y2BadgydF4y2Ba)和srk缺陷的柱头gydF4y2Bab·拉伯gydF4y2Ba、溴gydF4y2BaSRKgydF4y2Ba∆TMgydF4y2Ba(gydF4y2BaegydF4y2Ba).gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba种内花粉和种间花粉(gydF4y2BafgydF4y2Ba)和活性氧反应(gydF4y2BaggydF4y2Ba)的柱头从SCgydF4y2Ba答:芥gydF4y2Ba即野生型(WT),柱头来自SIgydF4y2Ba答:芥gydF4y2Ba表达gydF4y2BaA. halleri SgydF4y2Ba13gydF4y2Ba基因(gydF4y2Ba答:那gydF4y2Ba-gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba).中的值gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba图像以平均±s.d表示柱头花粉管的平均数目(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)和平均ROS强度(gydF4y2BacgydF4y2Ba,gydF4y2BaggydF4y2Ba).同样的数据也以所有数据点的箱形图(扩展数据图)表示。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba).比例尺,0.5厘米(gydF4y2Ba一个gydF4y2Ba), 500 μm (gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)和200 μm (gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba).每个实验至少重复三次,结果一致。gydF4y2Ba
我们使用gydF4y2Bab·拉伯gydF4y2Bavar。gydF4y2Ba学报gydF4y2Ba大白菜是一种重要的经济蔬菜作物,也是柱头上花粉诱导反应的代表性SI物种。十字花科SI的一个特征是其强度是发育调节的,这是由于从萌芽阶段到成熟阶段SRK积累量的逐渐增加gydF4y2Ba23gydF4y2Ba(扩展数据图。gydF4y2Ba1gydF4y2Ba).与粗CP相比花粉管穿透成熟gydF4y2Bab·拉伯gydF4y2Ba柱头、SI和种间花粉受到严重抑制(图。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba).Bud-stagegydF4y2Bab·拉伯gydF4y2BaSI和SI均能较好地穿透柱头gydF4y2Bab . oleraceagydF4y2Ba花粉,反映了srk介导的机制参与UI,模仿SI。然而,他们仍然无法穿透gydF4y2Bab .寻常的gydF4y2Ba而且gydF4y2Ba答:芥gydF4y2Ba花粉(无花果。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba),甚至可能在芽期低水平的SRKgydF4y2Bab·拉伯gydF4y2Ba柱头足以排斥种间花粉。gydF4y2Ba
鉴于SRK的表达与ROS的积累是一致的gydF4y2Ba10gydF4y2Ba,我们研究了耻感氧化还原状态是否在UI反应中起关键作用。如si诱导的柱头ROS增加gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba但与cp引起的ROS下降相反,UI花粉促进成熟植株ROS显著升高gydF4y2Bab·拉伯gydF4y2Ba的污名。芽期柱头ROS降低gydF4y2Bab . oleraceagydF4y2Ba花粉却增加了gydF4y2Bab .寻常的gydF4y2Ba而且gydF4y2Ba答:芥gydF4y2Ba授粉后10分钟,花粉减少(图;gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba1 c, dgydF4y2Ba).此外,用水杨酸钠(Na-SA)隔离ROS。gydF4y2Ba8gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba不仅打破了障碍gydF4y2Bab . oleraceagydF4y2Ba花粉成熟gydF4y2Bab·拉伯gydF4y2Ba耻辱也是障碍gydF4y2Bab .寻常的gydF4y2Ba花蕾期柱头上的花粉(扩展数据图。gydF4y2Ba1比gydF4y2Ba).总之,这些结果支持UI花粉诱导的ROS对SI柱头的排斥至关重要。gydF4y2Ba
接下来,我们测试了SRK除了拒绝SI花粉外,是否也构成了UI反应的基础。治疗gydF4y2Ba年代gydF4y2Ba46gydF4y2Bab·拉伯gydF4y2Ba作为-gydF4y2BaBrgydF4y2BaSRK46(反义寡脱氧核糖核苷酸(AS-ODN),特异性抑制gydF4y2BaBrgydF4y2BaSRK46)gydF4y2Ba10gydF4y2Ba,允许渗透的gydF4y2Bab . oleraceagydF4y2Ba花粉管成成熟柱头和gydF4y2Bab .寻常的gydF4y2Ba花粉管进入花蕾期柱头,与ROS减少一致(图。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba2模拟gydF4y2Ba).此外,“gydF4y2Bab·拉伯gydF4y2Bafast plant self- compatibility (FPsc)表达了一种跨膜结构域缺失的SRK,简称BrgydF4y2BaSRKgydF4y2BaΔTMgydF4y2Ba,未能响应SI和UI花粉引发的ROS增加,并表现出SI和UI花粉的抑制反应(图2)。gydF4y2Ba1 egydF4y2Ba和扩展数据图。gydF4y2Ba2 e-jgydF4y2Ba).总之,这些结果清楚地表明SRK不仅控制SI,而且还控制种间和属间花粉的排斥。gydF4y2Ba
此外,gydF4y2Ba答:芥gydF4y2Ba,是一种典型的SC芸苔科的功能丧失突变或完全缺失gydF4y2BaSRKgydF4y2Ba和/或gydF4y2Ba可控硅gydF4y2Ba基因gydF4y2Ba23gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,使花粉穿透gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bab·拉伯gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba而且gydF4y2Bab .寻常的gydF4y2Ba,授粉后出现柱头ROS减少。然而,转基因gydF4y2Ba答:芥gydF4y2Ba表达SP11/SCR、SRK和ARC1gydF4y2Ba答:hallerigydF4y2Ba的gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba(简称gydF4y2Ba答:那gydF4y2Ba-gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba下文),它概括了SIgydF4y2Ba28gydF4y2Ba,强烈抑制种间花粉,迅速增加柱头ROS(图;gydF4y2Ba1 f, ggydF4y2Ba和扩展数据图。gydF4y2Ba2 kmgydF4y2Ba).此外,gydF4y2BaB.甘蓝gydF4y2Ba36gydF4y2Ba花粉同样被排斥gydF4y2Bab·拉伯gydF4y2Ba几个不同的柱头gydF4y2Ba年代gydF4y2Ba-haplotypes(扩展数据图。gydF4y2Ba2 ngydF4y2Ba),表明SRK变体在UI中的功能没有差异。总之,这些结果清楚地表明SRK和依赖SRK的高柱头ROS水平与UI花粉的排斥正相关,类似于SI反应。gydF4y2Ba
UI和SI激活srk - fer调控的ROSgydF4y2Ba
考虑到FER在调节ROS中的作用gydF4y2Ba8gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,我们抑制了BrgydF4y2BaFER1gydF4y2Ba在gydF4y2Bab·拉伯gydF4y2Ba柱头被AS-ODN或交叉gydF4y2Bafer-4gydF4y2BaSI突变体gydF4y2Ba拟南芥gydF4y2Ba,并观察到有效抑制SI和UI花粉引发的柱头ROS增加,并标记SI和UI分解(图2)。gydF4y2Ba2 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba3 ggydF4y2Ba).抑制gydF4y2BaBrgydF4y2BaANJEA1 (gydF4y2BaBrgydF4y2BaANJ1),与FER复配gydF4y2Ba14gydF4y2Ba,或gydF4y2BaBrgydF4y2BaRBOHF,产生ROSgydF4y2Ba10gydF4y2Ba,也严重抑制了ROS的增加,并损害了SI和UI花粉排斥反应(扩展数据图。gydF4y2Ba3 h lgydF4y2Ba而且gydF4y2Ba4 gydF4y2Ba).此外,酵母双杂交,双分子荧光互补(扩展数据图。gydF4y2Ba5 a、bgydF4y2Ba)和蛋白质下拉实验证明了这一点gydF4y2BaBrgydF4y2BaSRK46与gydF4y2BaBrgydF4y2BaFER1(无花果。gydF4y2Ba2 c, dgydF4y2Ba).此外,还研究了SI和UI花粉的蛋白质提取物和SI决定因子gydF4y2BaBrgydF4y2BaSCR46,明显增强gydF4y2BaBrgydF4y2BaSRK46-HA被MBP -拉下gydF4y2BaBrgydF4y2BaFER1(激酶结构域(KD)),而CP花粉提取物和gydF4y2BaBrgydF4y2BaSCR12无影响(图;gydF4y2Ba2 c, dgydF4y2Ba和扩展数据图。gydF4y2Ba5氟gydF4y2Ba).此外,当在烟叶中共表达时,gydF4y2BaBrgydF4y2BaSCR46增强gydF4y2BaBrgydF4y2BaFER1-MYC共免疫沉淀gydF4y2BaBrgydF4y2Ba烟草叶片中SRK46-HA和ROS的产生(图;gydF4y2Ba2 egydF4y2Ba和扩展数据图。gydF4y2Ba5胃肠道gydF4y2Ba).综上所述,这些结果表明来自SI花粉的SCRgydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba来自UI花粉的未知信号通过促进SRK-FER相互作用来拒绝不相容的花粉,从而触发srk依赖的fer调控ROS产生的激活。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba、治疗gydF4y2Bab·拉伯gydF4y2Ba柱头具AS-gydF4y2BaBrgydF4y2BaFER1或交叉gydF4y2Bafer-4gydF4y2Ba到如果gydF4y2Ba答:芥gydF4y2Ba不良现象,gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba/gydF4y2Bafer-4gydF4y2Ba,放松SI和UI。中的值gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba图像以平均±s.d表示柱头上花粉管的平均数量。同样的数据也显示在所有数据点的箱形图中(扩展数据图。gydF4y2Ba3.gydF4y2Ba).gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,下拉(pd) (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)和免疫共沉淀(co-IP) (gydF4y2BaegydF4y2Ba)显示SI和UI花粉的蛋白质提取物。gydF4y2BaBrgydF4y2BaSCR46增强了gydF4y2BaBrgydF4y2BaSRK46 -gydF4y2BaBrgydF4y2BaFER1交互。蛋白质样本来自同一实验,印迹并行处理(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba).凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.比例尺,500 μm (gydF4y2Ba一个gydF4y2Ba)和200 μm (gydF4y2BabgydF4y2Ba).每个实验至少重复三次,结果一致。gydF4y2Ba
然后,我们探索了ferr - ros信号通路如何与已知的SRK信号通路连接gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.抑制gydF4y2BaBrgydF4y2BaMLPK和gydF4y2BaBrgydF4y2Baas - odn的ARC1也允许SI的渗透gydF4y2Bab . oleraceagydF4y2Ba成熟花粉管gydF4y2Bab·拉伯gydF4y2Ba柱头(扩展数据图。gydF4y2Ba6模拟gydF4y2Ba).然而,虽然AS-gydF4y2BaBrgydF4y2BaMLPK抑制SI和ui触发的ROS增加,AS-gydF4y2BaBrgydF4y2BaARC1没有(扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba).综上所述,这些结果表明SRK在感知到SI和UI花粉后,激活了两条平行的胞内信号通路:介导花粉排斥反应的FER转ROS通路,可能涉及MLPK,以及降解花粉生长所需兼容因子的arc1介导通路。gydF4y2Ba
相对于UC花粉,FER和pcp - b更青睐SC花粉gydF4y2Ba
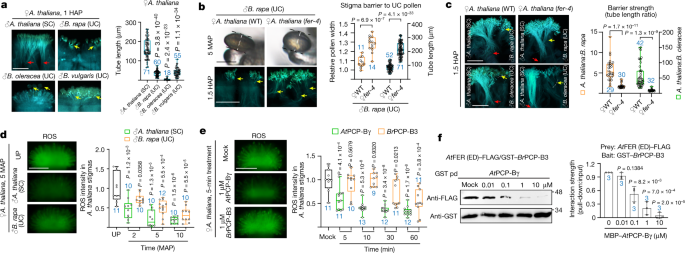
我们使用gydF4y2Ba答:芥gydF4y2Ba花粉对SC柱头的反应。尽管花粉管来自gydF4y2Bab·拉伯gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba或gydF4y2Bab .寻常的gydF4y2Ba所有的渗透gydF4y2Ba答:芥gydF4y2Ba传粉后6小时柱头(HAP)(图;gydF4y2Ba1 fgydF4y2Ba), UC花粉管比SC花粉管短得多(1 HAP)(图。gydF4y2Ba3gydF4y2Ba),这表明UC花粉存在更严格的屏障。我们确定FER在抑制UC花粉中有重要作用gydF4y2Ba答:芥gydF4y2Ba耻辱,gydF4y2Bab·拉伯gydF4y2Ba花粉水化得快得多,花管也长得多gydF4y2Bafer-4gydF4y2Ba柱头比野生型增加1.5 HAP。gydF4y2Ba3 bgydF4y2Ba).此外,同时沉积gydF4y2Ba答:芥gydF4y2Ba与gydF4y2Bab·拉伯gydF4y2Ba花粉,或gydF4y2Ba答:芥gydF4y2Ba与gydF4y2Bab . oleraceagydF4y2Ba花粉也一样gydF4y2Ba答:芥gydF4y2Ba年柱头屏障强度显著降低gydF4y2Ba拿来gydF4y2Ba而且gydF4y2BarbohdgydF4y2Ba污名(无花果。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba7得了gydF4y2Ba).UC花粉诱导ROS下降的速度也比SC花粉慢(图2)。gydF4y2Ba3 dgydF4y2Ba),与ferr介导的ROS在SC柱头中作为屏障区分种间花粉以保持物种完整性一致。gydF4y2Ba
一个gydF4y2Ba,在gydF4y2Ba答:芥gydF4y2Ba不良现象,gydF4y2Ba答:芥gydF4y2Ba花粉管较花粉管长gydF4y2Bab·拉伯gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba而且gydF4y2Bab .寻常的gydF4y2Ba在1点。gydF4y2BabgydF4y2Ba,水化和生长更快gydF4y2Bab·拉伯gydF4y2Ba花粉在gydF4y2BaA. thaliana fer-4gydF4y2Ba的污名。橙色图表示相对花粉宽度,蓝色图表示花粉管长度。用白色虚线表示花粉粒的赤道直径,在ImageJ中测量花粉宽度。gydF4y2BacgydF4y2Ba,放松物种间的屏障gydF4y2Bafer-4gydF4y2Ba的污名。种内杂交和种间杂交花粉管长度的比值被用来作为屏障强度的衡量标准。在gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,箭头为花粉管前部。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,物种优先的ROS减少gydF4y2Ba答:芥gydF4y2Ba花粉的柱头(gydF4y2BadgydF4y2Ba)及pcp - b (gydF4y2BaegydF4y2Ba)来自种内和种间。gydF4y2BafgydF4y2Ba,下拉试验显示gydF4y2Ba在gydF4y2BaPCP-Bγ与GST -呈剂量依赖性竞争gydF4y2BaBrgydF4y2BaPCP-B3用于交互gydF4y2Ba在gydF4y2Ba带(ED)的旗帜。蛋白质样本来自同一实验,印迹并行处理(gydF4y2BafgydF4y2Ba).凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.比例尺,200 μm (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)和20 μm(花粉在gydF4y2BabgydF4y2Ba).箱形图(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba),中线表示中位数,方框范围表示上四分位数和下四分位数,圆点表示个别数据点,而须则表示最高和最低数据点。gydF4y2BaPgydF4y2Ba值由双尾学生确定gydF4y2BatgydF4y2Ba测试。gydF4y2BangydF4y2Ba(蓝色)表示柱头或花粉粒的数量。在gydF4y2BafgydF4y2Ba,数据条为平均值±s.d.;该印迹的三个生物重复的平均强度表示在左侧(双尾gydF4y2BatgydF4y2Ba以及,gydF4y2BangydF4y2Ba= 3)。每个实验至少重复三次,结果一致。gydF4y2Ba
花粉包衣蛋白b类(pcp - b)是一种高度多态性的富含半胱氨酸的多肽,广泛存在于芸苔科植物中。gydF4y2Ba7 d, egydF4y2Ba),对花粉水合作用很重要gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.在gydF4y2Ba答:芥gydF4y2Ba, PCP-Bγ与FER结合,减少柱头ROS,使花粉生长gydF4y2Ba14gydF4y2Ba.因此,我们研究了来自不同物种的pcp - b抑制ROS的功效。在gydF4y2Ba答:芥gydF4y2Ba不良现象,gydF4y2Ba在gydF4y2BaPCP-Bγ早在处理后5分钟就诱导ROS显著降低,但gydF4y2BaBrgydF4y2BaPCP-B3 (ref。gydF4y2Ba12gydF4y2Ba)仅在治疗后60分钟将ROS降低到类似水平。相反地,gydF4y2Bab·拉伯gydF4y2Ba柱头ROS对gydF4y2BaBrgydF4y2Ba早于PCP-B3gydF4y2Ba答:芥gydF4y2Ba污名(无花果。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba7 f, ggydF4y2Ba).此外,物种特异性pcp - b诱导的ROS抑制在gydF4y2Ba拟南芥gydF4y2Ba根,也表示FERgydF4y2Ba29gydF4y2Ba(扩展数据图。gydF4y2Ba7小时,我gydF4y2Ba),从而提供进一步的支援。下拉实验证明了这一点gydF4y2Ba在gydF4y2BaPCP-Bγ与gydF4y2BaBrgydF4y2BaPCP-B3,反之亦然,用于与gydF4y2Ba在gydF4y2BaFER细胞外结构域(ED)gydF4y2Ba3 fgydF4y2Ba和扩展数据图。gydF4y2Ba7 jgydF4y2Ba).综上所述,这些结果表明,PCP-Bs和FER之间的种间匹配对于快速的配伍反应非常重要,并作为种间屏障,有利于种内花粉受精。gydF4y2Ba
相容花粉诱导的no减少ROSgydF4y2Ba
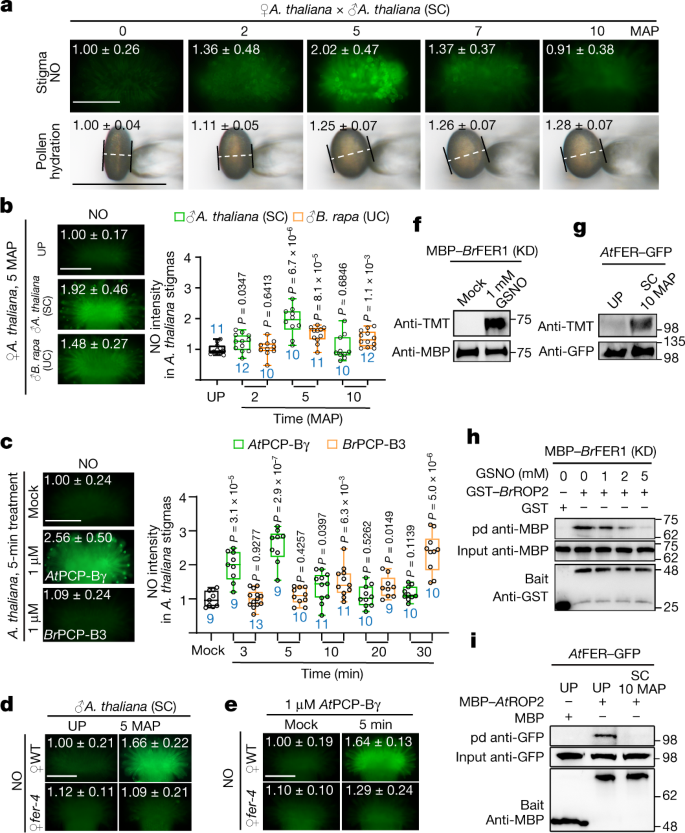
由于ROS信号与一氧化氮(NO)密切相关gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,我们研究了NO是否在SC和UC反应过程中调控耻辱性ROS。在gydF4y2Ba答:芥gydF4y2Ba在柱头上,NO含量在传粉后2 min迅速上升,在传粉后5 min达到最大值,随后迅速下降至传粉前水平,与花粉水化过程相似(图2)。gydF4y2Ba4gydF4y2Ba、上面板和扩展数据图。gydF4y2Ba8 a、bgydF4y2Ba).然而,gydF4y2Bab·拉伯gydF4y2Ba花粉和gydF4y2BaBrgydF4y2BaPCP-B3明显慢于gydF4y2Ba答:芥gydF4y2Ba花粉和gydF4y2Ba在gydF4y2BaPCP-Bγ对NO的刺激作用gydF4y2Ba答:芥gydF4y2Ba污名(无花果。gydF4y2Ba4 b, cgydF4y2Ba).此外,与野生型不同,gydF4y2Bafer-4gydF4y2Ba柱头NO对SC授粉无反应gydF4y2Ba在gydF4y2BaPCP-Bγ处理(图;gydF4y2Ba4 d, egydF4y2Ba和扩展数据图。gydF4y2Ba8 c, dgydF4y2Ba).物种优先的pcp - b诱导的NO增加也在根中得到了再现(扩展数据图)。gydF4y2Ba8 eggydF4y2Ba).种内和种间花粉及各自pcp - b诱导的NO差异增加(图2)。gydF4y2Ba4 b, cgydF4y2Ba)与诱导的ROS变化相反(图;gydF4y2Ba3 d, egydF4y2Ba),揭示了NO和ROS在鉴别种间相容花粉方面的反向功能关系。gydF4y2Ba
一个gydF4y2BaDAF-FM DA染色对授粉诱导NO反应和花粉水合作用的影响gydF4y2Ba答:芥gydF4y2Ba的污名。用白色虚线表示花粉粒的赤道直径,在ImageJ中测量花粉宽度。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,中NO的物种优先升高gydF4y2Ba答:芥gydF4y2Ba的污名。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,依赖于fer的NO升高gydF4y2Ba答:芥gydF4y2Ba花粉引起的柱头(gydF4y2BadgydF4y2Ba),gydF4y2Ba在gydF4y2BaPCP-Bγ(gydF4y2BaegydF4y2Ba).中的值gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba图像以平均±s.d表示平均NO强度(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)和花粉粒赤道直径(gydF4y2Ba一个gydF4y2Ba).同样的数据也显示在所有数据点的箱形图中(扩展数据图。gydF4y2Ba8gydF4y2Ba).gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba, FER亚硝化。gydF4y2BaBrgydF4y2BaFER1在体外被NO供体GSNO亚硝化(gydF4y2BafgydF4y2Ba),gydF4y2Ba在gydF4y2BaFER-GFP转化gydF4y2Ba答:芥gydF4y2Ba柱头在体内被SC授粉亚硝化(gydF4y2BaggydF4y2Ba).gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,下拉实验显示FER在体外亚硝化(gydF4y2BahgydF4y2Ba)和通过授粉(gydF4y2Ba我gydF4y2Ba)减少了与下游ROP2信号模块的相互作用。蛋白质样本来自同一实验,印迹并行处理(gydF4y2BafgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba).凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.比例尺,200 μm (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)和50 μm(花粉在gydF4y2Ba一个gydF4y2Ba).箱形图(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba),中线表示中位数,方框范围表示上四分位数和下四分位数,圆点表示个别数据点,而须则表示最高和最低数据点。gydF4y2BangydF4y2Ba(蓝色)表示柱头或花粉粒的数量。gydF4y2BaPgydF4y2Ba值由双尾学生确定gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
另外的观察结果进一步支持NO在调控柱头ROS和花粉生长中的作用。扫气gydF4y2Ba答:芥gydF4y2Ba污名NO由cPTIOgydF4y2Ba31gydF4y2Ba抑制SC诱导的NO增加和ROS减少,抑制SC花粉生长(扩展数据图)。gydF4y2Ba8 h,我gydF4y2Ba).在缺no条件下进行授粉实验gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba和NO-overaccumulatinggydF4y2Ba35gydF4y2Ba突变体同样支持NO参与的重要性(扩展数据图。gydF4y2Ba8 j]gydF4y2Ba).此外,在gydF4y2Bab·拉伯gydF4y2Ba,柱头NO反应相似,受SC刺激,但不受SI或UI花粉刺激(扩展数据图。gydF4y2Ba9 a、bgydF4y2Ba).通过cPTIO或gydF4y2Ba年代gydF4y2Ba-亚硝基谷胱甘肽(GSNO)也分别诱导ROS和花粉生长发生相反的变化gydF4y2Bab·拉伯gydF4y2Ba柱头(扩展数据图。gydF4y2Ba9碳氢键gydF4y2Ba).这些结果证实了NO在柱头中被亲和性花粉特异性诱导以减少ROS和促进花粉生长。gydF4y2Ba
在相容反应中没有亚硝酸盐gydF4y2Ba
NO的主要生物活性是gydF4y2Ba年代gydF4y2Ba-许多蛋白质中特定半胱氨酸的亚硝化作用gydF4y2Ba9gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.鉴于此处检查的FER和rboh的作用(扩展数据图。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4 gydF4y2Ba),它们可能是亚硝化作用的目标。串列质量标签开关分析gydF4y2Ba9gydF4y2Ba,gydF4y2Ba38gydF4y2Bagsno处理的MBP -gydF4y2BaBrgydF4y2Ba在KD中,FER1显示了Cys730和Cys752的亚硝化作用,这在许多芸苔科物种的fer中是保守的(图2)。gydF4y2Ba4 fgydF4y2Ba和扩展数据图。gydF4y2Ba9我gydF4y2Ba).gydF4y2Ba在gydF4y2BaFER-GFP被转化了gydF4y2Ba答:芥gydF4y2Ba的污名gydF4y2Ba8gydF4y2Ba,gydF4y2Ba29gydF4y2BaSC授粉后也发生亚硝化(图;gydF4y2Ba4 ggydF4y2Ba),表明FER的亚硝化作用在相容反应中起重要作用。gydF4y2Ba
蛋白质的亚硝化作用可能影响其稳定性、生化性质以及与其他蛋白质的相互作用gydF4y2Ba9gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.GSNO-treatedgydF4y2BaBrgydF4y2BaFER1 (KD)和Cys730Trp (gydF4y2BaBrgydF4y2BaFERC730W)转化,模拟亚硝化作用gydF4y2Ba40gydF4y2Ba,两者都表现出与下游相互作用的妥协gydF4y2BaBrgydF4y2BaROP2信号复合物(图;gydF4y2Ba4 hgydF4y2Ba和扩展数据图。gydF4y2Ba9 m, ngydF4y2Ba).我们还观察到gydF4y2Ba在gydF4y2BaFER-GFP被拉下来gydF4y2Ba在gydF4y2BaROP2在gydF4y2Ba答:芥gydF4y2Ba柱头具SC花粉(图;gydF4y2Ba4我gydF4y2Ba).此外,柱头表达的rboh在体外和授粉中也被亚硝化(扩展数据图。gydF4y2Ba9到水果gydF4y2Ba),类似于免疫信号诱导的亚硝化作用gydF4y2Ba36gydF4y2Ba.综上所述,这些结果表明,柱头ROS的下降是兼容授粉刺激的NO的结果,FER的亚硝化使下游RAC/ rop调节的rboh依赖的ROS产生失活,并且已经产生的rboh迅速抑制了柱头中ROS产生的活性。gydF4y2Ba
打破了远距离繁殖的障碍gydF4y2Ba
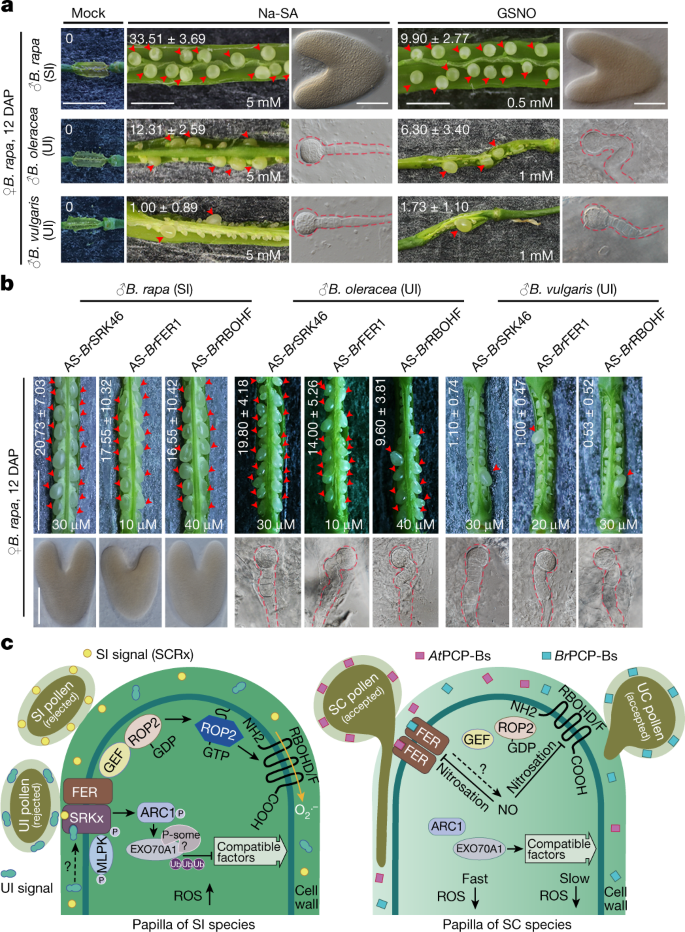
在建立了柱头处种间屏障的机制之后,我们接下来探讨了在多大程度上打破这种屏障可能促进远距离繁殖。我们对待gydF4y2Bab·拉伯gydF4y2Ba用Na-SA降低雌蕊ROS水平,用GSNO增加NO水平,用AS-ODNs破坏雌蕊gydF4y2BaBrgydF4y2BaSRK -gydF4y2BaBrgydF4y2BaFER相互作用gydF4y2BaBrgydF4y2BaFER-to -gydF4y2BaBrgydF4y2BaRBOH信号,然后用SI和UI花粉授粉。授粉后12天,SIgydF4y2Bab·拉伯gydF4y2Ba花粉、gydF4y2Bab . oleraceagydF4y2Ba花粉和gydF4y2Bab .寻常的gydF4y2Ba在这些处理过的雌蕊中,花粉都导致胚珠增大和胚胎发育(图2)。gydF4y2Ba5 a、bgydF4y2Ba和扩展数据图。gydF4y2Ba10gydF4y2Ba).柱头以外的其他障碍一定妨碍了健壮的异受精和阻碍杂交胚胎的发育(图。gydF4y2Ba5 a、bgydF4y2Ba和扩展数据图。gydF4y2Ba10gydF4y2Ba).结合这里所使用的策略和胚胎抢救,一种广泛应用于远程育种的离体培养技术gydF4y2Ba41gydF4y2Ba,应该允许种间杂交胚胎成功发育成可存活的植物。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,通过ROS清道夫减少污名ROS,通过NO发生器增加NO (gydF4y2Ba一个gydF4y2Ba),并扰乱gydF4y2BaBrgydF4y2BaSRK -gydF4y2BaBrgydF4y2BaFER相互作用gydF4y2BaBrgydF4y2BaFER1-to -gydF4y2BaBrgydF4y2Ba由AS-ODNs发出的RBOH信号(gydF4y2BabgydF4y2Ba)缓解种间和属间繁殖障碍。箭头表示胚珠增大。虚线表示杂交胚胎的轮廓。中的值gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba图像显示为平均±s.d,显示荚果中增大胚珠的平均数量。同样的数据也显示在所有数据点的箱形图中(扩展数据图。gydF4y2Ba10gydF4y2Ba).比例尺,0.5厘米(角锥)和100 μm (emb ryos)。每个实验至少重复三次,结果一致。gydF4y2BacgydF4y2Baferr调控ROS作为SI、UI、SC和UC响应中的共享信号节点的模型。在SI种的柱头中,SI花粉和UI花粉通过srk - fe - rop2 - rbohs途径激活ROS,并与arc1介导的过程一起发挥作用。SC种的柱头与种间花粉亲和,但cpp - b与FER之间的种优先相互作用通过no介导的FER和RBOHs的亚硝化作用,启动了更快的亲和反应,以抑制ROS的产生,促进种内优先性,保护物种完整性。虚线和' ?表示“待确定”。磷、磷酸;p,蛋白酶体;乌兰巴托,泛素。gydF4y2Ba
讨论gydF4y2Ba
在授粉时,花粉和柱头进行一系列的交流,以促进理想花粉的生长,并阻止入侵者和不理想的花粉gydF4y2Ba1gydF4y2Ba.在一项研究中,我们将SI、UI、SC和UC一起探索,证明了SRK和FER这两种受体激酶之间的相互作用如何提供感知不同花粉信号的能力,以微调柱头氧化还原条件,并确定来自开花时间相似的种内或同域种间的花粉的接受或排斥。从我们的工作模型(图。gydF4y2Ba5度gydF4y2Ba),我们展示了来自SI和UI花粉的不相容信号如何激活fer介导的ROS产生,从而在SI柱头中产生花粉排斥反应,并与arc1介导的过程并行gydF4y2Ba2gydF4y2Ba.我们还证明了pcp - b和FER的种间优先相互作用如何导致SC柱头的种间屏障。gydF4y2Ba
芸苔科包括许多重要的蔬菜和油料作物。由于遗传多样性相对狭窄,在一个物种内进行育种远不能最大限度地提高杂交活力。种间育种丰富了种质资源,但种间障碍限制了远缘育种的成功机会。在这里通过打破柱头屏障实现种间和种间受精gydF4y2Bab·拉伯gydF4y2Ba特别是具有抗真菌和抗昆虫的杂交胚胎的生产gydF4y2Bab .寻常的gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba(无花果。gydF4y2Ba5 a、bgydF4y2Ba),这是一项了不起的成就和重大突破,使远缘物种的优良性状得以渗入作物。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
耻辱的gydF4y2Bab·拉伯gydF4y2Bavar。gydF4y2Ba学报gydF4y2Ba大白菜,也被称为大白菜gydF4y2Ba答:芥gydF4y2Ba主要用于授粉反应。对于SI柱头上的相互作用,gydF4y2Bab·拉伯gydF4y2Ba的双单倍体系的柱头gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba用花粉授粉gydF4y2BaB. rapa;gydF4y2Ba46gydF4y2Ba或gydF4y2Ba年代gydF4y2Ba12gydF4y2Ba如SI或CP授粉,或花粉来自gydF4y2Bab . oleraceagydF4y2Ba(gydF4y2Ba年代gydF4y2Ba36gydF4y2Ba),gydF4y2Bab .寻常的gydF4y2Ba(SC)和gydF4y2Ba答:芥gydF4y2Ba(SC)作为UI授粉。对于SC柱头上的相互作用,具有SRK等位基因缺陷的FPsc缺乏跨膜结构域和SC的编码序列gydF4y2Ba答:芥gydF4y2Ba被使用。gydF4y2Bab·拉伯gydF4y2Ba耻辱的gydF4y2Ba年代gydF4y2Ba46岁,gydF4y2Ba年代gydF4y2Ba12日,gydF4y2Ba年代gydF4y2Ba9,gydF4y2Ba年代gydF4y2Ba40gydF4y2Ba而且gydF4y2Ba年代gydF4y2Ba38gydF4y2Ba用花粉授粉gydF4y2Bab . oleraceagydF4y2Ba(gydF4y2Ba年代gydF4y2Ba36gydF4y2Ba)进行单倍型依赖分析。转基因SIgydF4y2Ba答:芥gydF4y2Ba28gydF4y2Ba,gydF4y2BapgydF4y2Ba在gydF4y2Ba带:gydF4y2Ba在gydF4y2BaFER-GFPgydF4y2Ba29gydF4y2Ba植物,纯合子gydF4y2Bafer-4gydF4y2Ba(gk - 106 a06 GABI-Kat)gydF4y2Ba29gydF4y2Ba,gydF4y2BasrngydF4y2Ba(γ射线突变体)gydF4y2Ba42gydF4y2Ba,gydF4y2Bahot5-4gydF4y2Ba(FLAG_298F11,凡尔赛基因组资源中心)gydF4y2Ba35gydF4y2Ba,gydF4y2Banoa1gydF4y2Ba(CS6511)gydF4y2Ba9gydF4y2Ba,gydF4y2Barbohd-3gydF4y2Ba(Salk_070610C)gydF4y2Ba10gydF4y2Ba而且gydF4y2Barbohd-4gydF4y2Ba(CS9555)gydF4y2Ba10gydF4y2Ba突变体及其相应的野生型植物Col-0, C24或WS先前已被描述。转基因植物gydF4y2BapgydF4y2Ba在gydF4y2Ba带:GFP -gydF4y2Ba在gydF4y2BaRBOHDgydF4y2Ba由gydF4y2Ba根癌土壤杆菌gydF4y2Ba-介导的花浸法gydF4y2Ba43gydF4y2Ba.gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba/gydF4y2Bafer-4gydF4y2Ba由交叉产生gydF4y2Bafer-4gydF4y2Ba突变成SI拟南芥(gydF4y2Ba年代gydF4y2Ba13gydF4y2Ba的gydF4y2Ba答:hallerigydF4y2Ba);表明这两种基因改造是相同的gydF4y2Ba拟南芥gydF4y2Ba工厂。gydF4y2Ba
的种子gydF4y2Bab·拉伯gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba而且gydF4y2Bab .寻常的gydF4y2Ba在盆栽土壤(Pindstrup基质,丹麦)中发芽。春化在10°C - 5°C,光照强度为100 mmol m,光照周期为14 h - 10 h的生长室中进行gydF4y2Ba−gydF4y2Ba2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.1个月后冷敷1周gydF4y2Bab·拉伯gydF4y2Ba7-8叶期3个月gydF4y2Bab . oleraceagydF4y2Ba而且gydF4y2Bab .寻常的gydF4y2Ba在25°C - 15°C的温室条件下,光照强度为300 mmol m,光照周期为16 h - 8 hgydF4y2Ba−gydF4y2Ba2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.的种子gydF4y2Ba答:芥gydF4y2Ba而且gydF4y2Ba烟草gydF4y2BabenthamianagydF4y2Ba在相对湿度为60%、温度22℃、光暗循环16-8 h的温室盆栽土壤中发芽生长。gydF4y2Ba
统计分析gydF4y2Ba
ROS、NO、花粉水合作用和花粉管长度数据用GraphPad Prism v8.0.1生成的箱线图表示。除非另有说明,箱形图的中线表示中位数,框限表示下四分位数和上四分位数,胡须表示最低和最高数据点。蛋白图和qRT-PCR相关数据以数据条(平均±s.d.,gydF4y2BangydF4y2Ba= 3)。传粉后柱头NO随时间变化的数据以折线图(平均±s.d;gydF4y2BangydF4y2Ba表示柱头的数量)。所有统计数据都标上了确切的数字gydF4y2BaPgydF4y2Ba值,数据条和箱形图中的点表示单个数据点。每个实验至少重复三次,结果一致。gydF4y2Ba
柱头处理及花粉生长观察gydF4y2Ba
花粉管穿透柱头乳头细胞的数量表明了亲和性。柱头喂养试验紧随裁判的试验。gydF4y2Ba10gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.gydF4y2Bab·拉伯gydF4y2Ba刚开但花药开裂前的花或花蕾期花在距柱头表面3毫米处被阉割。切除的柱头插入基本PGM (5 mM CaCl)中gydF4y2Ba2gydF4y2Ba, 5 mM KCl, 0.01% HgydF4y2Ba3.gydF4y2Ba薄gydF4y2Ba3.gydF4y2Ba, 1 mM MgSOgydF4y2Ba4 gydF4y2Ba•7 hgydF4y2Ba2gydF4y2BaO, 10%蔗糖和0.8%琼脂糖,pH 7.5)或处理介质,并在恒温(22.5°C)和湿度(45%)的室中保存指定的时间(S-ODNs或AS-ODNs 1小时;Na-SA, GSNO和cPTIO 6 h)。将处理过的柱头转移到基本PGM培养基上,用等量的SI、CP或各种UI花粉进行人工授粉,并在相同条件下保持6小时或根据指示进行授粉。然后将柱头固定在Canoy的固定液(乙醇与乙酸3:1)中,在10m NaOH中软化,并在0.1%苯胺蓝中染色。在尼康Eclipse Ni上用epifluorescence (Ex375-328, DM415和BA351p)观察花粉管。图像由DS-Ri2数码相机拍摄。gydF4y2Ba
对于植物处理,只开放花,或花蕾期花,对花序gydF4y2Bab·拉伯gydF4y2Ba以S-ODN和AS-ODN、Na-SA、GSNO或相应的模拟溶液处理植株,间隔30 min,再用等量的SI、CP、gydF4y2Bab . oleraceagydF4y2Ba或gydF4y2Bab .寻常的gydF4y2Ba花粉。授粉后12天,计数增大的胚珠数。随后进行胚胎清理和观察。gydF4y2Ba45gydF4y2Ba与修改。在霍耶氏培养基(7.5 g阿拉伯胶,100 g水合氯醛,5 ml甘油和60 ml H)中清除增大的胚珠gydF4y2Ba2gydF4y2BaO) 5天,然后在配备DS-Ri2数码相机的尼康Eclipse Ni显微镜上进行差分干涉造影剂观察。gydF4y2Ba
化学药剂或柱头表达基因突变对SC种内或种间花粉生长的影响gydF4y2Ba答:芥gydF4y2Ba花粉水化率和花粉管长度是柱头的主要表现。SCgydF4y2Ba答:芥gydF4y2Ba花在第12阶段被阉割(参考。gydF4y2Ba46gydF4y2Ba),在PGM中培养14 h后,用gydF4y2Ba答:芥gydF4y2Ba花粉或gydF4y2Bab·拉伯gydF4y2Ba花粉。花粉水合作用采用尼康Eclipse Ni显微镜和DS-Ri2数码相机对授粉后各时间点进行差分干涉对比成像。在ImageJ v1.53c中测量不同时间点花粉粒的赤道直径。花粉管长度gydF4y2Ba答:芥gydF4y2Ba的污名与gydF4y2Ba答:芥gydF4y2Ba花粉、gydF4y2Bab·拉伯gydF4y2Ba花粉或gydF4y2Bab . oleraceagydF4y2Ba在1或1.5 HAP下对花粉进行苯胺蓝染色。在双授粉实验中,gydF4y2Ba答:芥gydF4y2BaWT和gydF4y2Ba拿来gydF4y2Ba-突变雌蕊(或其他突变雌蕊)同时与gydF4y2Ba答:芥gydF4y2Ba花粉在一半和任何一个gydF4y2Bab·拉伯gydF4y2Ba或gydF4y2Bab . oleraceagydF4y2Ba花粉在同一柱头的另一半上,中间有明显的边界。柱头的花粉生长明显局限于雌蕊的相应一半,易于区分。gydF4y2Ba
ODN的设计和处理gydF4y2Ba
柱头的ODN设计和处理参照文献。gydF4y2Ba10gydF4y2Ba.S-ODNs和AS-ODNs用于靶向以下基因(登录号见补充表)gydF4y2Ba1gydF4y2Ba):gydF4y2BaBrgydF4y2BaSRK46,gydF4y2BaBrgydF4y2BaFER1和gydF4y2BaBrgydF4y2BaRBOHF。S-ODNs或AS-ODNs是基于Sfold (gydF4y2Bahttps://sfold.wadsworth.org/cgi-bin/soligo.plgydF4y2Ba).BLAST程序(gydF4y2Bahttps://blast.ncbi.nlm.nih.gov/Blast.cgigydF4y2Ba)来评估潜在的脱靶效应。odn在北京基因研究所(BGI)合成。S-ODN和AS-ODN的5 '端和3 '端均有3个碱基被磷酸化修饰以保持稳定性。S-ODNs和AS-ODNs序列见补充表gydF4y2Ba2gydF4y2Ba.在花柱顶端1mm处切除柱头,插入含有S-ODN或AS-ODN的PGM中,处理1 h。柱头在6 HAP下进行苯胺蓝试验,观察花粉生长。gydF4y2Ba
ROS和NO染色gydF4y2Ba
对于污名ROS染色,gydF4y2Bab·拉伯gydF4y2Ba耻辱和gydF4y2Ba答:芥gydF4y2Ba将未授粉或SI、CP或UI花粉授粉后10 min的柱头用MES缓冲液(10 mM MES、5 μM KCl和50 μM CaCl)预处理gydF4y2Ba2gydF4y2Ba, pH 6.15),用50 μM H染色30 mingydF4y2Ba2gydF4y2BaDCF-DA(2 ',7 ' -二氯荧光素二乙酸酯;Sigma-Aldrich)分别孵育30分钟,然后在观察前在缓冲液中至少洗涤三次。对于污名NO染色,gydF4y2Bab·拉伯gydF4y2Ba耻辱和gydF4y2Ba答:芥gydF4y2Ba将授粉前后的柱头浸泡在Tris缓冲液(10mm Tris- hcl和10mm KCl, pH 7.5)中30 min,用20 μM DAF-FM DA(3-氨基,4-氨基甲基-2 ',7 ' -二荧光素二乙酸盐)染色;Thermo Scientific) 1小时,然后在观察前在缓冲液中至少清洗三次。gydF4y2Ba
首先将柱头在MES缓冲液中浸泡30分钟,然后在添加0.0125% Tween 20的MES缓冲液中按指定浓度和持续时间用S-ODNs或AS-ODNs、化学物质、多肽或花粉提取物处理。在MES缓冲液中洗涤三次后,如上所述对处理过的柱头进行ROS或NO染色。gydF4y2Ba
根ROS或NO染色,3天gydF4y2Ba答:芥gydF4y2Ba幼苗或2天龄gydF4y2Bab·拉伯gydF4y2Ba幼苗在相应的缓冲液中浸泡30 min, 0.1 μM of处理gydF4y2Ba在gydF4y2BaPCP-Bγ或gydF4y2BaBrgydF4y2BaPCP-B3在规定的时间内,然后用50 μM H染色gydF4y2Ba2gydF4y2BaDCF-DA或20 μM DAF-FM DA 1 h。gydF4y2Ba
在eGFP epifluorescence (Ex470-440, DM4951p和BA525/550)下进行成像,使用尼康Eclipse Ni并配备DS-Ri2数码相机。在一次实验中,所有比较样品的暴露时间完全相同。在Image J v1.53c中测量点状区域所示的平均ROS或NO信号;对照组柱头的ROS或NO设为1进行对比分析。gydF4y2Ba
作为比较,柱头直接用相同浓度的H染色gydF4y2Ba2gydF4y2BaDCF-DA或DAF-FM DA 10分钟,无缓冲预处理,并在共聚焦显微镜(蔡司LSM880)下成像。ROS和NO的变化与宽视场荧光显微镜成像一致。由于对整个柱头标本的取样需要大量的观测,因此本研究使用了广域观测来收集大量的数据。gydF4y2Ba
用于渗透烟叶的ROS染色,农杆菌细胞含有gydF4y2BaBrgydF4y2BaFER1-MYC GFP -gydF4y2BaBrgydF4y2BaRBOHD2和gydF4y2BaBrgydF4y2Ba将SRK46-HA混合后渗入烟叶。渗透2天后,10 μM GST -gydF4y2BaBrgydF4y2BaSCR12或GST -gydF4y2BaBrgydF4y2Ba将SCR46注入同一叶片,处理10 min。硝基蓝四唑(NBT)染色gydF4y2Ba47gydF4y2Ba用于检测渗透叶片的ROS。用5 mg ml真空浸润叶片gydF4y2Ba−1gydF4y2BaNBT (10mm柠檬酸钠,pH 7.0)室温40分钟。然后将叶片在脱色溶液(95%乙醇与甘油3:1)中煮沸10分钟,脱色3次。图像由数码相机捕获,并在Image J v1.53c中测量ROS强度。对原生质体进行ROS染色,从上述共表达的浸润烟叶中分离出原生质体gydF4y2BaBrgydF4y2BaFER1-MYC GFP -gydF4y2BaBrgydF4y2BaRBOHD2和gydF4y2BaBrgydF4y2BaSRK46-HA,在ref的后面。gydF4y2Ba48gydF4y2Ba.然后用缓冲液处理原生质体,gydF4y2BaBrgydF4y2BaSCR12和gydF4y2BaBrgydF4y2Ba在用10 μM H染色前,分别用SCR46染色15 mingydF4y2Ba2gydF4y2BaDCF-DA 10分钟。以缓冲液浸渍的烟叶原生质体为对照,进行ROS染色。gydF4y2Ba
RBOHs的酶活性gydF4y2Ba
将授粉前后的柱头用MES缓冲液冲洗3次,然后在N液中冷冻gydF4y2Ba2gydF4y2Ba.RBOHs的酶活性按照制造商的说明进行测量(南京JC生物)。简而言之,约0.05 g柱头组织(约100个柱头)在液体N中研磨gydF4y2Ba2gydF4y2Ba,提取于buffer (0.2 M NaH .gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba和0.2 M NagydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4 gydF4y2Ba(pH值7.2),并在4000下离心gydF4y2BaggydF4y2Ba在4°C下放置20分钟。所得上清液以FAD和NADPH为底物,在340 nm处分光光度法测定RBOH活性。结果显示为一个样品的三次技术重复的平均值。gydF4y2Ba
RNA分离和qRT-PCRgydF4y2Ba
用SteadyPure Universal RNA Extraction Kit (AG21017, Accurate Biotechnology)提取总RNA,用HiScript III第一链cDNA Synthesis Kit (Vazyme)逆转录。qRT-PCR在QuantStudio 3系统(Applied Biosystems)上使用ChamQ SYBR qPCR Master Mix (Vazyme)进行,使用BrgydF4y2BaACTIN2gydF4y2Ba作为内部控制。用于qRT-PCR的基因特异性引物列表见补充表gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
分子克隆gydF4y2Ba
为gydF4y2BaBrgydF4y2BaSRK46-HA或gydF4y2BaBrgydF4y2BaRBOHD2-GFP构造,序列编码全长gydF4y2BaBrgydF4y2BaSRK46或gydF4y2BaBrgydF4y2BaRBOHD2扩增gydF4y2Bab·拉伯gydF4y2Ba柱头cDNA采用2× Phanta Max Master Mix (Vazyme)。使用asy - basic无缝克隆和组装试剂盒(TransGen Biotech)将该片段克隆到修饰过的pCAMBIA1300载体上,并带有HA或GFP标签。对于GST融合蛋白构建,序列编码gydF4y2BaBrgydF4y2BaPCP-B3(残基1-76),gydF4y2BaBrgydF4y2BaSCR46(残基1-78),gydF4y2BaBrgydF4y2BaSCR12(残基1-76),全长gydF4y2BaBrgydF4y2BaROP2, c端细胞质区gydF4y2BaBrgydF4y2BaRBOHD1 (CT;残留758 - 923),gydF4y2BaBrgydF4y2BaRBOHD2 (CT;残基614-904)和gydF4y2BaBrgydF4y2BaRBOHF (CT;残基767-949)扩增后克隆到pGEX-4T-1载体中。对于MBP融合蛋白构建,编码ED的序列gydF4y2BaBrgydF4y2BaFER1(残基14-420),KDgydF4y2BaBrgydF4y2BaFER1(残基486-783),成熟gydF4y2Ba在gydF4y2BaPCP-Bγ(残基23-76)和gydF4y2Ba在gydF4y2Ba将ROP2基因扩增,克隆到pMAL-p2X载体上。对于FLAG融合蛋白结构,ED的gydF4y2Ba在gydF4y2BaFER(残基29-446)和KDgydF4y2BaBrgydF4y2Ba扩增SRK46(残基448-860),克隆到pFLAG-CTS载体中。对于MYC融合蛋白结构,gydF4y2BaBrgydF4y2BaFER1(残基1-788)扩增并克隆到pCXSNF中。对于双分子荧光互补结构,KDgydF4y2BaBrgydF4y2BaSRK46(残基448-860)和gydF4y2BaBrgydF4y2BaFER1(残基486-783)通过Gateway BP Clonase酶Mix (Invitrogen Life Technologies)扩增并克隆到pDONR207,并通过LR反应通过Gateway LR Clonase酶Mix (Invitrogen Life Technologies)克隆到pEARLY GATE 201或pEARLY GATE 202载体。对于酵母双杂交结构,KDgydF4y2BaBrgydF4y2BaSRK46(残基448-860)和的KDgydF4y2BaBrgydF4y2Ba将FER1(残基486-783)扩增并克隆到pGADT7或pGBKT7载体中。MBP -gydF4y2BaBrgydF4y2BaFER1gydF4y2BaC730WgydF4y2Ba(KD),从MBP -中扩增出突变片段gydF4y2BaBrgydF4y2BaFER1 (KD)载体与适当的PCR引物使用快速突变系统(TransGen生物技术)根据制造商的说明。用于上述结构的基因特异性引物列表包括在补充表中gydF4y2Ba4 gydF4y2Ba.gydF4y2Ba
蛋白表达及纯化gydF4y2Ba
将构建的GST、MBP和FLAG融合蛋白转化为gydF4y2Ba大肠杆菌gydF4y2BaBL21 (DE3)蛋白表达。在37℃下用0.5 mM IPTG诱导4-6小时后,将细胞旋转并在5 ml PBS (140 mM NaCl, 2 mM KCl, 2 mM KH)中重悬gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba和10mm NagydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4 gydF4y2Ba.7HgydF4y2Ba2gydF4y2Ba分别用磁性GSH珠(BEAVER)、直链淀粉磁珠(PuriMag Pro)或抗flag磁珠(BeyoMag)纯化超声(SCIENTZ)蛋白。用SDS-PAGE分离纯化蛋白,western blot检测相应抗体。gydF4y2Ba
用于肽的制备,MBP -gydF4y2Ba在gydF4y2BaPCP-Bγ和GST -gydF4y2BaBrgydF4y2BaPCP-B3表达于gydF4y2Ba大肠杆菌gydF4y2Ba并用相应的磁珠纯化BL21细胞。的gydF4y2Ba在gydF4y2BaScilight Biotechnology也合成了PCP-Bγ(残基23-76)多肽,纯度超过95%。将多肽在无菌ddH中稀释至1mmgydF4y2Ba2gydF4y2BaO为原液。gydF4y2Ba
对于烟叶中表达的蛋白质,gydF4y2Ba根癌土壤杆菌gydF4y2Ba将含有相应构造的GV3101 (Weidi)细胞浸润gydF4y2Ban benthamianagydF4y2Ba按照标准程序离开gydF4y2Ba48gydF4y2Ba.简而言之,gydF4y2Ba农杆菌属gydF4y2Ba细胞的转速是5000gydF4y2BaggydF4y2Ba在4°C下浸泡10分钟,在渗透缓冲液(10 mM MES, 10 mM MgCl)中重悬至600 nm的光密度0.6gydF4y2Ba2gydF4y2Ba0.5%葡萄糖,pH 6.5),浸泡前加入100 μM乙酰丁香酮。5 - 6周龄烟草植株叶片用1 ml注射器浸润。浸渍2 d后,叶片在N液中均质gydF4y2Ba2gydF4y2Ba,与1 ml植物蛋白提取缓冲液(75 mM KAc, 300 mM NaCl, 100 mM arginine, 10 mM EDTA, 0.25% Triton X-100, pH 7.4, 1 mM PMSF和1 mM鸡尾酒蛋白酶抑制剂)混合在1.5 ml离心管中,冰保存20分钟。在13800离心后gydF4y2BaggydF4y2Ba4℃下10分钟,上清液转入新管进行下拉或co-IP测定。gydF4y2Ba
蛋白质相互作用测定gydF4y2Ba
酵母双杂交试验gydF4y2BaBrgydF4y2BaFER1 (KD)gydF4y2BaBrgydF4y2Ba按照标准程序进行SRK46 (KD)、载体构建、酵母转化、脱落培养基上生长和X-Gal染色gydF4y2Ba29gydF4y2Ba.gydF4y2Ba
对于双分子荧光互补分析,pEARLY GATE 201含有gydF4y2BaBrgydF4y2BaFER1 (KD) -nYFP和珍珠之门202包含gydF4y2BaBrgydF4y2Ba将SRK46 (KD) -cYFP转化为gydF4y2Ba根癌土壤杆菌gydF4y2Ba应变GV3101。两种同等体积的文化混合渗透进去gydF4y2Ban benthamianagydF4y2Ba如上所述的叶子。浸润后2天,在eGFP epifluorescence (Ex470-440, DM4951p和BA525/550)下进行成像,使用尼康Eclipse Ni相机,配备DS-Ri2数码相机。gydF4y2Ba
的下拉试验gydF4y2BaBrgydF4y2BaSRK46-HA by MBP -gydF4y2BaBrgydF4y2BaFER1 (KD),gydF4y2BaBrgydF4y2Ba从渗透的烟叶中提取SRK46-HA蛋白,与直链磁珠(PuriMag Pro)结合的MBP -混合gydF4y2BaBrgydF4y2BaFER1 (KD)诱饵蛋白6小时,在4°C。在下拉缓冲液(50 mM Tris-HCl, pH 7.0, 100 mM NaCl和0.1% Triton X-100 (v/v))中洗涤三次,并在SDS-PAGE加载缓冲液中煮沸5分钟。蛋白进行SDS-PAGE、western blot和抗mbp抗体(1:15 000;Abmart)或抗ha抗体(1:5 000;抗小鼠辣根过氧化物酶(HRP)偶联二抗(1:15 000;Abmart),然后用化学发光成像系统(TIAN NENG)进行HRP检测试剂盒(Vazyme)分析。对于多肽的作用,GST -gydF4y2BaBrgydF4y2BaSCR46或GST -gydF4y2BaBrgydF4y2BaSCR12,或从SI提取的蛋白质(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba), cp (gydF4y2Ba年代gydF4y2Ba12gydF4y2Ba)花粉或种间(gydF4y2Bab . oleraceagydF4y2Ba)花粉的相互作用gydF4y2BaBrgydF4y2BaSRK46 -gydF4y2BaBrgydF4y2BaFER1 (KD) 0.5 μM多肽或0.65 mg mlgydF4y2Ba−1gydF4y2Ba蛋白提取物与gydF4y2BaBrgydF4y2BaSRK46-HA蛋白在下拉实验前1小时。gydF4y2Ba
的co-IP测定gydF4y2BaBrgydF4y2BaFER1-MYC由gydF4y2BaBrgydF4y2BaSRK46-HA, GV3101gydF4y2Ba农杆菌属gydF4y2Ba细胞包含gydF4y2Ba35 s::gydF4y2BaBrgydF4y2BaSRK46-HAgydF4y2Ba或gydF4y2Ba35 s::gydF4y2BaBrgydF4y2BaFER1-MYCgydF4y2Ba都混在一起渗透成吗gydF4y2Ban benthamianagydF4y2Ba叶子。渗透2天后,10 μM GST -gydF4y2BaBrgydF4y2BaSCR12或GST -gydF4y2BaBrgydF4y2Ba将SCR46浸取到同一片叶片中,处理10 min。然后用叶子提取蛋白质。取1 ml上清液,用100 μl抗ha磁珠(PuriMag Pro)在4℃旋转孵育过夜。水洗3次后,煮沸蛋白进行SDS-PAGE、western bolt和抗myc抗体免疫检测(1:5 000;Abmart)和抗ha抗体(1:5 000;Abmart)和抗小鼠酶标二抗(1:10 000;Abmart)。gydF4y2Ba
用于MBP -的下拉试验gydF4y2BaBrgydF4y2Ba通过GST -测定FER1 (KD)gydF4y2BaBrgydF4y2BaROP2 MBP -gydF4y2BaBrgydF4y2Ba用1、2、5 mM GSNO在室温下处理FER1 (KD)蛋白3小时,然后与GSH珠(BEAVER)结合,GST -混合gydF4y2BaBrgydF4y2BaROP2诱饵蛋白6小时,4°C。煮沸后进行SDS-PAGE、western bolt、抗mbp抗体免疫检测(1:15 000;Abmart)或抗gst抗体(1:5 000;抗小鼠酶标二抗(1:15 000;Abmart)。MBP -gydF4y2BaBrgydF4y2BaFER1gydF4y2BaC730WgydF4y2Ba(KD),不加GSNO处理,用GST -进行类似的下拉试验gydF4y2BaBrgydF4y2BaROP2。gydF4y2Ba
的下拉gydF4y2Ba在gydF4y2BaFER-GFP by MBP -gydF4y2Ba在gydF4y2BaROP2, MBP或MBP -gydF4y2Ba在gydF4y2Ba将ROP2诱饵蛋白与直链淀粉磁珠(PuriMag Pro)结合6 h,用下拉缓冲液洗涤3次。gydF4y2Ba答:芥gydF4y2Ba耻辱的gydF4y2BapgydF4y2Ba在gydF4y2Ba带:gydF4y2Ba在gydF4y2BaFER-GFPgydF4y2Ba转基因植物,未授粉或授粉后10分钟,用于总蛋白提取。gydF4y2Ba在gydF4y2Ba将FER-GFP蛋白与相应的饵料蛋白在4℃孵育8 h。水洗3次后,煮沸后进行SDS-PAGE、western bolt、抗gfp抗体免疫检测(1:10 0;Abmart)或抗mbp抗体(1:15 000;抗小鼠酶标二抗(1:10 000;Abmart)。gydF4y2Ba
为检测肽竞争的下拉试验,抗flag磁珠(BeyoMag)结合gydF4y2Ba在gydF4y2BaFER (ED) - flag饵蛋白与GST -孵育gydF4y2BaBrgydF4y2BaPCP-B3在4°C旋转2 h,然后增加浓度gydF4y2Ba在gydF4y2Ba加入pcp - b - γ多肽在4°C下竞争3 h。竞争由GST -gydF4y2BaBrgydF4y2BaPCP-B3多肽与MBP -gydF4y2Ba在gydF4y2BaPCP-Bγ相互作用gydF4y2Ba在gydF4y2BaFER (ED) -FLAG诱饵蛋白的处理类似。煮沸后进行SDS-PAGE、western bolt、抗flag抗体免疫检测(1:5 000;Abmart),抗gst抗体(1:5 000;Abmart)或抗mbp抗体(1:15 000;Abmart)和抗小鼠酶标二抗(1:5 000;Abmart)。gydF4y2Ba
蛋白质亚硝化试验gydF4y2Ba
在体外gydF4y2Ba年代gydF4y2Ba-亚硝化试验紧随ref。gydF4y2Ba35gydF4y2Ba经过修改,使用皮尔斯gydF4y2Ba年代gydF4y2Ba-Nitrosylation Western Blot Kit (90105, Thermo Scientific)。纯化的GST -蛋白gydF4y2BaBrgydF4y2BaRbohd1 (ct), gst -gydF4y2BaBrgydF4y2BaRbohd2 (ct), gst -gydF4y2BaBrgydF4y2BaRBOHF (CT)和MBP -gydF4y2BaBrgydF4y2BaFER1 (KD)经丙酮沉淀脱盐,重悬于HENS缓冲液(100 mM HEPES, pH 7.0, 1 mM EDTA, 0.1 mM neocuproine, 2.5% SDS)中。在100 μl HENS缓冲液中加入1mm GSNO,在室温黑暗条件下孵育约150 μg蛋白2 h。样品用冷丙酮沉淀,100 μl HENS缓冲液重悬。在50°C, 200 mM孵育1小时后gydF4y2BaNgydF4y2Ba-乙基马来酰亚胺(Solarbio),室温30分钟,用冷丙酮沉淀,在HENS缓冲液中重悬。用60 mM抗坏血酸钠和0.4 mM碘ttzero标记试剂处理样品2 h。上述所有步骤都是在黑暗中进行的。最后用冷丙酮沉淀蛋白,在2 M尿素缓冲液中重悬。采用SDS-PAGE分离各蛋白等分,抗tmt抗体免疫印迹(1:5 000;Thermo Scientific)和山羊抗小鼠IgG (H+L) -HRP (1:10 000;Thermo Scientific)用于亚硝化蛋白的检测。同时,检测这些蛋白是否加载抗gst抗体(1:5 000;Abmart)或抗mbp抗体(1:15 000;Abmart)和山羊抗小鼠IgG-HRP (1:10 000; Abmart).
用于分析gydF4y2Ba年代gydF4y2Ba-授粉前后柱头的亚硝化作用,200柱头(约0.1克)gydF4y2Ba答:芥gydF4y2Ba植物表达gydF4y2BapgydF4y2Ba在gydF4y2Ba带:gydF4y2Ba在gydF4y2BaFER-GFPgydF4y2Ba或gydF4y2BapgydF4y2Ba在gydF4y2Ba带:GFP -gydF4y2Ba在gydF4y2BaRBOHDgydF4y2Ba种内相容花粉授粉后10分钟(WTgydF4y2Ba拟南芥gydF4y2Ba花粉),在N液中均质gydF4y2Ba2gydF4y2Ba再悬浮于0.7 ml植物蛋白萃取缓冲液中。蛋白提取物1.5 mg / 150 μl,冷丙酮沉淀,重悬于HENS缓冲液中,与体外亚硝化检测相似。gydF4y2Ba
亚硝化残留物的质谱分析gydF4y2Ba
质谱鉴定gydF4y2Ba年代gydF4y2Ba-亚硝化半胱氨酸残基由上海Bioprofile生物技术公司(中国)进行。用HENS缓冲液溶解蛋白颗粒gydF4y2BaNgydF4y2Ba-乙基马来酰亚胺(Sigma)用于阻断游离半胱氨酸。的gydF4y2Ba年代gydF4y2Ba用抗坏血酸钠(Sigma)特异性地还原蛋白质的亚硝化位点,然后用iodoTMT零试剂(Thermo Scientific)标记。用胰蛋白酶在50 mM NH中消化处理过的蛋白质gydF4y2Ba4 gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba在37°C过夜。然后用C18药筒(Thermo Scientific)对肽进行脱盐。根据制造商(Thermo Scientific)的指示,用抗tmt树脂富集碘化tmt标记的多肽。然后,将富集肽加载到液相色谱-质谱分析中进行分析。Q Exactive HF-X质谱仪与Easy nLC1200 (Thermo Scientific)耦合,在2小时的时间梯度上进行肽质谱检测。质谱原始数据导入MaxQuant软件v1.6.0.16进行数据解释和蛋白鉴定gydF4y2Bab·拉伯gydF4y2Ba基因组数据库gydF4y2Ba49gydF4y2Ba(gydF4y2Bahttp://brassicadb.cngydF4y2Ba).在位点水平、肽谱匹配水平和蛋白质水平上,对搜索结果进行筛选和导出,误发现率小于1%。MaxQuant分析仅筛选那些确信定位(I类,定位概率大于0.75)且修饰肽得分大于40的亚硝化位点(iodoTMT标记)。gydF4y2Ba
生物信息学分析gydF4y2Ba
所有分析的序列都是从gydF4y2Bab·拉伯gydF4y2Ba基因组数据库gydF4y2Ba49gydF4y2Ba(gydF4y2Bahttp://brassicadb.cngydF4y2Ba), NCBI GenBankgydF4y2Ba50gydF4y2Ba(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/genbankgydF4y2Ba)或ensemble plantsgydF4y2Ba51gydF4y2Ba(gydF4y2Bahttp://plants.ensembl.org/index.htmlgydF4y2Ba)或PhytozomegydF4y2Ba52gydF4y2Ba(gydF4y2Bahttps://phytozome-next.jgi.doe.govgydF4y2Ba).gydF4y2Bac .丹妮卡gydF4y2Ba被选为外群来推断物种间的关系gydF4y2Bab·拉伯gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba,gydF4y2Bab .寻常的gydF4y2Ba,gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Ba萝卜gydF4y2Ba,gydF4y2Ba拟南芥lyratagydF4y2Ba而且gydF4y2Ba答:hallerigydF4y2Ba.基于上述物种核糖体内部转录间隔序列排列的最大似然树是在具有1000个自举带的Tamura-Nei核苷酸取代模型下推断出来的。对于RBOHs、pcp和SRKs的系统发育树,采用MEGA X中实现的MUSCLE算法进行序列比对gydF4y2Ba53gydF4y2Ba,并使用MEGA X中1,000个自举带的邻域连接方法构造。pcp - b的氨基酸序列和FER比对采用在线软件Clustal Omega进行gydF4y2Ba54gydF4y2Ba(gydF4y2Bahttps://www.ebi.ac.uk/Tools/msa/clustalogydF4y2Ba),然后导入到ESPript 3.0(参考。gydF4y2Ba55gydF4y2Ba) (gydF4y2Bahttps://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgigydF4y2Ba)来生成图片。gydF4y2Ba
图的准备gydF4y2Ba
采用Image J v1.53c (gydF4y2Bahttps://imagej.netgydF4y2Ba).直方图使用GraphPad Prism v8.0.1 (gydF4y2Bahttps://www.graphpad-prism.cngydF4y2Ba).主要人物是在Adobe Illustrator中组装的;所有其他图形都是在Adobe Photoshop中组装的。一些卡通部件来自gydF4y2Bawww.figdraw.comgydF4y2Ba用于模型绘制。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
源数据为图。gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba和扩展数据图。gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba提供纸张。本论文中使用的未裁剪的原始凝胶和基因登录号显示在gydF4y2Ba补充信息gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
改变历史gydF4y2Ba
2023年3月2日gydF4y2Ba
对本文的更正已发表:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05816-zgydF4y2Ba
参考文献gydF4y2Ba
布罗兹,A. K. &贝丁格,P. A.花粉-雌蕊相互作用作为生殖障碍。gydF4y2Ba为基础。植物生物学。gydF4y2Ba72gydF4y2Ba, 615-639(2021)。gydF4y2Ba
贾尼,E.奈尔斯,H. &戈林,D. R.芸苔科自交不亲和和自花粉排斥的分子和细胞调控。gydF4y2BaInt。Rev.细胞摩尔生物学。gydF4y2Ba343gydF4y2Ba, 1-35(2019)。gydF4y2Ba
芸苔科植物的自交不亲和:自认的调控与机制。gydF4y2Ba咕咕叫。上面。Dev,杂志。gydF4y2Ba131gydF4y2Ba, 435-452(2019)。gydF4y2Ba
开花植物的单侧不亲和。gydF4y2Ba遗传gydF4y2Ba12gydF4y2Ba, 233-256(1958)。gydF4y2Ba
李志刚,李志刚,李志刚。芸苔科作物的自交不亲和:种间不亲和的经验教训。gydF4y2BaSci繁殖。gydF4y2Ba64gydF4y2Ba, 23-37(2014)。gydF4y2Ba
贝丁格,P. A., Broz, A. K., Tovar-Mendez, A. & McClure, B.花粉-雌蕊相互作用及其在配偶选择中的作用。gydF4y2Ba植物杂志。gydF4y2Ba173gydF4y2Ba, 79-90(2017)。gydF4y2Ba
Escobar-Restrepo, J. M.等人。FERONIA受体样激酶在花粉管接受过程中介导雌雄相互作用。gydF4y2Ba科学gydF4y2Ba317gydF4y2Ba, 656-660(2007)。gydF4y2Ba
段,Q.等。活性氧介导花粉管破裂释放精子进行受精gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaCommun Nat。gydF4y2Ba5gydF4y2Ba, 3129(2014)。gydF4y2Ba
段,Q.等。FERONIA控制果胶和一氧化氮介导的雌雄相互作用。gydF4y2Ba自然gydF4y2Ba579gydF4y2Ba, 561-566(2020)。gydF4y2Ba
张,L.等。FERONIA受体激酶调节活性氧介导的自交不亲和gydF4y2Ba芸苔属植物拉伯gydF4y2Ba.gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba31gydF4y2Ba, 3004-3016(2021)。gydF4y2Ba
Franklin-Tong, N. & Bosch, M.植物生物学:柱头ROS决定花粉是否被接受或拒绝。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba31gydF4y2Ba, r904-r906(2021)。gydF4y2Ba
王,L.等。PCP-B类花粉包衣蛋白是水合检查点的关键调节因子gydF4y2Ba拟南芥gydF4y2Bapollen-stigma交互。gydF4y2Ba新植醇。gydF4y2Ba213gydF4y2Ba, 764-777(2017)。gydF4y2Ba
Doughty, J., Wong, H. Y. & Dickinson, H. G.富含半胱氨酸的花粉包膜蛋白(pcp)及其与柱头S(不亲和)和S相关蛋白的相互作用gydF4y2Ba芸苔属植物gydF4y2Ba:在SI和授粉中的假定作用。gydF4y2Ba安。机器人。gydF4y2Ba85gydF4y2Ba, 161-169(2000)。gydF4y2Ba
刘,C.等。花粉PCP-B多肽开启柱头肽受体激酶门控机制进行授粉。gydF4y2Ba科学gydF4y2Ba372gydF4y2Ba, 171-175(2021)。gydF4y2Ba
Murase, K.等。一种膜锚定蛋白激酶gydF4y2Ba芸苔属植物gydF4y2Baself-incompatibility信号。gydF4y2Ba科学gydF4y2Ba303gydF4y2Ba, 1516-1519(2004)。gydF4y2Ba
顾涛,马祖科,M., Sulaman, W., Matias, D. D. & Goring, D. R.臂重复蛋白与激酶结构域的结合gydF4y2Ba年代gydF4y2Ba-位点受体激酶。gydF4y2Ba国家科学院学报美国gydF4y2Ba95gydF4y2Ba, 382-387(1998)。gydF4y2Ba
刘平,北史波,刘平,西尾涛,Nasrallah, J. B. & Nasrallah, m.egydF4y2Ba芸苔属植物gydF4y2Ba自不相容修饰符gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba国家科学院学报美国gydF4y2Ba108gydF4y2Ba, 18173-18178(2011)。gydF4y2Ba
Stone, S. L., Anderson, E. M., Mullen, R. T. & Goring, D. R. ARC1是一种E3泛素连接酶,在排斥自我不相容过程中促进蛋白质的泛素化gydF4y2Ba芸苔属植物gydF4y2Ba花粉。gydF4y2Ba植物细胞gydF4y2Ba15gydF4y2Ba, 885-898(2003)。gydF4y2Ba
贝利,c.d.等人。试论芸苔科的全球系统发育。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba23gydF4y2Ba, 2142-2160(2006)。gydF4y2Ba
蔡,X.等。异源多倍体化和结构变异对种内多样化的影响gydF4y2Ba芸苔属植物拉伯gydF4y2Ba.gydF4y2Ba基因组医学杂志。gydF4y2Ba22gydF4y2Ba, 166(2021)。gydF4y2Ba
尼尔森,J. K., Nagao, T., Okabe, H. & Shinoda, T.植物中的抗性,gydF4y2BaBarbarea寻常的gydF4y2Ba,以及由皂素介导的跳蚤甲虫的反适应。gydF4y2Baj .化学。生态。gydF4y2Ba36gydF4y2Ba, 277-285(2010)。gydF4y2Ba
Badenes-Perez, F. R., Reichelt, M., Gershenzon, J. & Heckel, D. G.利用植物化学和昆虫偏好研究了Barbarea(十字花科)作为小菜蛾(鳞翅目:小菜蛾科)的死角诱捕作物的潜力。gydF4y2Ba植物化学gydF4y2Ba98gydF4y2Ba, 137-144(2014)。gydF4y2Ba
刘国强,刘国强。自我不相容的世代gydF4y2Ba拟南芥gydF4y2Ba通过2的转移gydF4y2Ba年代gydF4y2Ba基因座gydF4y2Ba答:lyratagydF4y2Ba.gydF4y2Ba科学gydF4y2Ba297gydF4y2Ba, 247-249(2002)。gydF4y2Ba
罗,X. & Lehotay, D. C.用水杨酸盐作为捕集剂气相色谱-质谱法测定羟基自由基。gydF4y2Ba中国。物化学。gydF4y2Ba30.gydF4y2Ba, 41-46(1997)。gydF4y2Ba
Liszkay, A., van der Zalm, E. & Schopfer, P.玉米根系产生活性氧中间产物(超氧化物、H2O2和羟基自由基)及其在壁松动和伸长生长中的作用。gydF4y2Ba植物杂志。gydF4y2Ba136gydF4y2Ba, 3114-3123(2004)。gydF4y2Ba
贝克斯高,J. S.,卡斯特里克,V.,查尔斯沃斯,D.,维克曼斯,X. & Schierup, M. H.自相容性的转变gydF4y2Ba拟南芥gydF4y2Ba以及s单倍型超过10 Myr的进化。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba23gydF4y2Ba1741-1750(2006)。gydF4y2Ba
Tsuchimatsu, T.等。自我相容性的进化gydF4y2Ba拟南芥gydF4y2Ba因为男性特异性基因的突变。gydF4y2Ba自然gydF4y2Ba464gydF4y2Ba, 1342-1346(2010)。gydF4y2Ba
张,T.等。产生自亲和的转基因gydF4y2Ba拟南芥gydF4y2Ba显示出对自交不亲和基因的属特异性偏好。gydF4y2Ba植物(巴塞尔)gydF4y2Ba8gydF4y2Ba570(2019)。gydF4y2Ba
段琪,李春华,吴海明,吴海明,李春华,吴海明。FERONIA受体样激酶对根毛发育RHO GTPase信号通路的调控。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 17821-17826(2010)。gydF4y2Ba
Besson-Bard, A., Pugin, A. & Wendehenne, D.植物一氧化氮信号的新见解。gydF4y2Ba为基础。植物生物学。gydF4y2Ba59gydF4y2Ba, 21-39(2008)。gydF4y2Ba
多明戈斯,P.,普拉多,A. M.,黄,A.,葛林,C. &菲乔,J. A.一氧化氮:植物中的多任务信号气体。gydF4y2Ba摩尔。植物gydF4y2Ba8gydF4y2Ba, 506-520(2015)。gydF4y2Ba
郭芳,冈本,M. & Crawford, n.m.植物一氧化氮合酶基因参与激素信号的鉴定。gydF4y2Ba科学gydF4y2Ba302gydF4y2Ba, 100-103(2003)。gydF4y2Ba
莫罗,M.,李,G. I.,王,Y., Crane, B. R. & Klessig, D. F. AtNOS/AtNOA1是一个函数gydF4y2Ba拟南芥gydF4y2BacGTPase而不是一氧化氮合酶。gydF4y2Ba生物。化学。gydF4y2Ba283gydF4y2Ba, 32957-32967(2008)。gydF4y2Ba
Tewari, R. K., Prommer, J. & Watanabe, M.原生质体叶绿体内源性一氧化氮生成。gydF4y2Ba植物细胞代表gydF4y2Ba32gydF4y2Ba, 31-44(2013)。gydF4y2Ba
李,U.,魏,C.,费尔南德斯,B. O., Feelisch, M. & Vierling, E.亚硝化胁迫的调制gydF4y2Ba年代gydF4y2Ba-亚硝基谷胱甘肽还原酶是植物耐热性和生长的关键gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba植物细胞gydF4y2Ba20.gydF4y2Ba, 786-802(2008)。gydF4y2Ba
云,B. W.等。gydF4y2Ba年代gydF4y2BaNADPH氧化酶-亚硝基化在植物免疫中调控细胞死亡。gydF4y2Ba自然gydF4y2Ba13gydF4y2Ba, 264-268(2011)。gydF4y2Ba
赫斯,D. T. &斯塔姆勒,J. sgydF4y2Ba年代gydF4y2Ba蛋白质翻译后修饰的亚硝基化。gydF4y2Ba生物。化学。gydF4y2Ba10gydF4y2Ba, 4411-4418(2012)。gydF4y2Ba
Qu, Z.等。蛋白质组学定量和位点定位gydF4y2Ba年代gydF4y2Ba-亚硝基化蛋白使用等压iodoTMT试剂。gydF4y2BaJ.蛋白质组。gydF4y2Ba13gydF4y2Ba, 3200-3211(2014)。gydF4y2Ba
冯俊,陈琳,左娟。蛋白质gydF4y2Ba年代gydF4y2Ba植物-亚硝基化的研究进展与挑战。gydF4y2Baj .中国。植物医学杂志。gydF4y2Ba61gydF4y2Ba, 1206-1223(2019)。gydF4y2Ba
詹,等。gydF4y2Ba年代gydF4y2Ba-亚硝基化作用在植物缺氧反应中针对GSNO还原酶进行选择性自噬。gydF4y2Ba摩尔。细胞gydF4y2Ba71gydF4y2Ba, 142-154(2018)。gydF4y2Ba
西秀生,田田明,丰田等。蔬菜作物胚培养的研究。3白菜与大白菜种间杂交胚培养的影响条件。gydF4y2Ba公牛。长的矮。Sta >,gydF4y2Ba9gydF4y2Ba, 75-100(1970)。gydF4y2Ba
罗特曼等人。在受精过程中雌性控制雄性配子的输送gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba4 gydF4y2Ba, 432-436(2003)。gydF4y2Ba
克拉夫,S. J. &本特,a . F.花浸渍:一种简化的方法gydF4y2Ba农杆菌属gydF4y2Ba-介导转化gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba植物J。gydF4y2Ba16gydF4y2Ba, 735-743(1998)。gydF4y2Ba
黄,J.等。大白菜和萝卜柱头乳头细胞程序性死亡与衰老诱导的自交不亲和破裂有关。gydF4y2Ba前面。植物科学。gydF4y2Ba11gydF4y2Ba, 586901(2020)。gydF4y2Ba
刘,C.和Meinke, D. W.泰坦突变体gydF4y2Ba拟南芥gydF4y2Ba在种子发育过程中有丝分裂和细胞周期控制被破坏。gydF4y2Ba植物J。gydF4y2Ba16gydF4y2Ba, 21-31(1998)。gydF4y2Ba
史密思,鲍曼,J. L. &迈耶罗维茨,E. M.花的早期发育gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba植物细胞gydF4y2Ba2gydF4y2Ba, 755-767(1990)。gydF4y2Ba
植物中活性氧(ROS)、脂质过氧化和电解质泄漏的测定和检测。gydF4y2Ba方法分子生物学。gydF4y2Ba639gydF4y2Ba, 292-298(2010)。gydF4y2Ba
李,C.等。糖基磷脂酰肌醇锚定蛋白作为FERONIA受体激酶信号通路的伴侣和共受体gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaeLifegydF4y2Ba4 gydF4y2Ba, e06587(2015)。gydF4y2Ba
陈海霞等。BRAD V3.0:升级的芸苔科数据库。gydF4y2Ba核酸测定。gydF4y2Ba50gydF4y2Ba, 1432-1441(2022)。gydF4y2Ba
Benson, d.a.等人。基因库。gydF4y2Ba核酸测定。gydF4y2Ba41gydF4y2Ba, 36-42(2013)。gydF4y2Ba
豪,K. L.等。Ensembl Genomes 2020-实现非脊椎动物基因组研究。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, 689-695(2020)。gydF4y2Ba
古德斯坦等人。Phytozome:绿色植物基因组学的比较平台。gydF4y2Ba核酸测定。gydF4y2Ba40gydF4y2Ba, 1178-1186(2012)。gydF4y2Ba
Kumar, S., Stecher, G., Li, M., Knyaz, C. & Tamura, K. MEGA X:跨计算平台的分子进化遗传学分析。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba35gydF4y2Ba, 1547-1549(2018)。gydF4y2Ba
马德拉,F.等。2019年的EMBL-EBI搜索和序列分析工具api。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, 636-641(2019)。gydF4y2Ba
Robert, X. & Gouet, P.用新的ENDscript服务器破译蛋白质结构的关键特征。gydF4y2Ba核酸测定。gydF4y2Ba42gydF4y2Ba, w320-w324(2014)。gydF4y2Ba
确认gydF4y2Ba
感谢山东农业大学的许多人对我们的全方位帮助:郝颖、包中、张曦分享设备,任中、周成讨论稿件;和北京大学先进农业科学研究所的L. Guo帮助从FPsc中检索SRK基因组序列。本工作得到国家自然科学基金(32170365 - Q.D.)、山东省自然科学基金(ZR2021ZD07和ZR2020KC017 - Q.D.)、山东亿益农业科技有限公司(Q.D.)、国家重大科研计划(2013CB945100 -张先生)、美国国家科学基金(MCB-1715764和ios2101467 - A.Y.C.和h.m.w .)、美国马萨诸塞州大学NIFA/USDA (MAS00525 - A.Y.C.)的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Q.D.提出了研究的概念,设计了研究计划和实验,并解释了结果,黄俊,杨林,A.Y.C, h.m.w和张先生都有贡献。q.d和a.y.c主导了写作过程,j.h., l.y.,张先生,h.m.w, R.P.和W.Z.参与了讨论和手稿修改。黄建军、杨林进行了主要实验和数据分析,刘洋、小文、惠建军、小春、海燕、圣林、Q.X、M.P、曹玉玉、陈永哲、j.l l和金永哲进行了柱头饲养实验,沈立林、J.Y.和m.p.y.z进行了载体构建工作,曹玉玉、陈永勇、小荣和j.l J. Hui进行了花粉水化测定,q.x.x w、Y.Y.和张晓伟协助。对大白菜种质资源进行了研究gydF4y2Ba年代gydF4y2Ba-单倍型相关的UI实验。在j.d., N.W.和q.l.c m的帮助下,X.W.进行了生物信息学分析,C.D.和P.W.进行了SIgydF4y2Ba答:芥gydF4y2Ba有关的实验。在F.C.和y.w.g.x.的帮助下,进行SI和UI的植物分解,参与生化实验和数据分析,在刘洋小光的帮助下绘制工作模型。所有作者都参与了数据收集、展示和最终定稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Marcus Samuel和其他匿名审稿人对本工作的同行评审所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1在UI过程中,ROS是种间花粉排斥的基础。gydF4y2Ba
一个gydF4y2BaSI发育受调控,SRK从芽发期到成熟期逐渐增加。gydF4y2BabgydF4y2Ba, intra的个数gydF4y2Ba- - - - - -gydF4y2Ba成熟或花蕾期种间花粉管多种多样gydF4y2Bab·拉伯gydF4y2Ba的污名。成熟的gydF4y2Bab·拉伯gydF4y2Ba柱头排斥SI,种间花粉均检出,但花蕾期gydF4y2Bab·拉伯gydF4y2Ba柱头有利于SI花粉和种间的生长gydF4y2Bab . oleraceagydF4y2Ba花粉,仍然排斥属间gydF4y2Bab .寻常的gydF4y2Ba而且gydF4y2Ba答:芥gydF4y2Ba花粉。见图。gydF4y2Ba1 bgydF4y2Ba.gydF4y2BacgydF4y2Ba, H成像gydF4y2Ba2gydF4y2Badcfda染色的ROS在共聚焦显微镜下和宽视场荧光显微镜下显示相似的变化gydF4y2Bab·拉伯gydF4y2Ba虚线勾勒出ROS定量区域。本研究需要大量的数据收集,采用了广域观测,对整个柱头标本进行了相当高的采样。gydF4y2BadgydF4y2Ba,未授粉(UP)或授粉的ROS强度gydF4y2Bab·拉伯gydF4y2Ba耻辱。见图。gydF4y2Ba1 cgydF4y2Ba.gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaNa-SA清除ROS抑制柱头ROS的诱导,促进SI花粉的生长gydF4y2Bab . oleraceagydF4y2Ba花粉成熟期和成熟期gydF4y2Bab .寻常的gydF4y2Ba花蕾期的花粉gydF4y2Bab·拉伯gydF4y2Ba的污名。比例尺,500 μm。数据栏(gydF4y2Ba一个gydF4y2Ba):平均值±SD。柱头三个生物学重复的平均相对表达水平(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图2 SRK是UI过程中种间花粉排斥反应的基础。gydF4y2Ba
一个gydF4y2Ba定量RT-PCR显示AS-BrSRK46处理后减少gydF4y2BaBrSRK46gydF4y2Ba成熟表达gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba),并进一步降低其在萌芽期柱头中本已较低的水平(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba).gydF4y2BabgydF4y2Ba, AS-BrSRK46处理成熟gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba)打破了对gydF4y2Bab . oleraceagydF4y2Ba花粉不gydF4y2Bab .寻常的gydF4y2Ba花粉。AS-BrSRK46治疗萌芽期柱头(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba)打破抑制gydF4y2Bab .寻常的gydF4y2Ba花粉。见图。gydF4y2Ba1 dgydF4y2Ba.gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaAS-BrSRK46处理降低了成熟期ROSgydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba),并进一步降低其花蕾期柱头中本已较低的ROS (gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba).gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,序列比对(gydF4y2BaegydF4y2Ba)、系统发育分析(gydF4y2BafgydF4y2Ba)和SRK在FPsc中的表达(Brara.G02663) (gydF4y2BaggydF4y2Ba).来自FPsc的SRK缺乏跨膜结构域的编码序列,我们将其命名gydF4y2BaBrSRKgydF4y2Ba∆TMgydF4y2Ba从今以后。gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba在SI和UI花粉引发的ROS增加中,FPsc成熟和芽期柱头存在缺陷gydF4y2Ba(hgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)以及对SI和UI花粉的排斥反应(gydF4y2BajgydF4y2Ba).见图。gydF4y2Ba1 egydF4y2Ba.gydF4y2BakgydF4y2Ba,gydF4y2BaSRK13gydF4y2BaSI表达式gydF4y2Ba答:芥gydF4y2Ba柱头与gydF4y2Ba拟南芥hallerigydF4y2BaAhSP11 / SCR13-AhSRK13-AhARC1。这三个转基因是在一个结构中。gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba, intra的个数gydF4y2Ba- - - - - -gydF4y2Ba或种间花粉管(gydF4y2BalgydF4y2Ba)和ROS变化(gydF4y2Ba米gydF4y2Ba)在SCgydF4y2Ba答:芥gydF4y2Ba柱头和在SIgydF4y2Ba答:芥gydF4y2Ba的污名。见图。gydF4y2Ba1 f, ggydF4y2Ba.gydF4y2BangydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba花粉的gydF4y2Ba年代gydF4y2Ba36gydF4y2Ba-haplotype被拒绝gydF4y2Bab·拉伯gydF4y2Ba耻辱的gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba,gydF4y2Ba年代gydF4y2Ba12gydF4y2Ba,gydF4y2Ba年代gydF4y2Ba9gydF4y2Ba,gydF4y2Ba年代gydF4y2Ba40gydF4y2Ba,或gydF4y2Ba年代gydF4y2Ba38gydF4y2Ba,表示对gydF4y2Ba年代gydF4y2BaRK在种间花粉排斥反应中与SCR-SRK相互作用无关。比例尺,500 μm (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BangydF4y2Ba).数据栏(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BakgydF4y2Ba):平均值±SD。柱头三个生物学重复的平均相对表达水平(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba,gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图3 FER/ANJ信号通路调节UI过程中的耻辱性ROS。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba定量RT-PCR显示AS-BrFER1处理抑制了gydF4y2BaBrFER1gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),促进SI花粉的生长gydF4y2Bab . oleraceagydF4y2Ba花粉成熟gydF4y2Bab·拉伯gydF4y2Ba集体荣辱感和gydF4y2Bab .寻常的gydF4y2Ba花蕾期花粉(gydF4y2BabgydF4y2Ba)gydF4y2Bab·拉伯gydF4y2Ba的污名。见图。gydF4y2Ba2gydF4y2Ba.gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, AS-BrFER1处理抑制了SI和ui诱导的成熟期和芽期ROS的增加gydF4y2Bab·拉伯gydF4y2Ba柱头在10map。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,表达gydF4y2Ba拿来gydF4y2Ba而且gydF4y2BaSRKgydF4y2Ba在耻辱中gydF4y2Ba答:那gydF4y2Ba(SI)gydF4y2Ba/ fer-4gydF4y2Ba(gydF4y2BaegydF4y2Ba)和SI中FER的损失gydF4y2Ba答:芥gydF4y2Ba促进SI花粉的生长,gydF4y2Bab . oleraceagydF4y2Ba花粉和gydF4y2Bab .寻常的gydF4y2BaSI花粉gydF4y2Ba答:芥gydF4y2Ba污名(gydF4y2BafgydF4y2Ba).见图。gydF4y2Ba2 bgydF4y2Ba.gydF4y2BaggydF4y2Ba, SI中FER的损失gydF4y2Ba答:芥gydF4y2Ba抑制SI和ui诱导的ROS增加gydF4y2Ba答:那gydF4y2Ba(SI)gydF4y2Ba/ fer-4gydF4y2Ba柱头在10map。gydF4y2BahgydF4y2BaBrANJs蛋白的结构域显示只有BrANJ1具有完整的胞外和胞内结构域。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba, AS-BrANJ1处理抑制了gydF4y2BaBrANJ1gydF4y2Ba(gydF4y2Ba我gydF4y2Ba),促进SI花粉的生长gydF4y2Bab . oleraceagydF4y2Ba花粉成熟gydF4y2Bab·拉伯gydF4y2Ba集体荣辱感和gydF4y2Bab .寻常的gydF4y2Ba花蕾期花粉gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2BajgydF4y2Ba).gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba, AS-BrANJ1处理抑制SI和ui诱导的成熟(gydF4y2BakgydF4y2Ba)和萌芽期(gydF4y2BalgydF4y2Ba)gydF4y2Bab·拉伯gydF4y2Ba柱头在10map。比例尺、比例尺、500 μm (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba), 200 μm (gydF4y2BaggydF4y2Ba).数据栏(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2Ba我gydF4y2Ba):平均值±SD。柱头三个生物学重复的平均相对表达水平(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图4 UI过程中rboh产生ROS。gydF4y2Ba
一个gydF4y2Ba定量RT-PCR显示AS-BrRBOHF处理抑制了gydF4y2BaBrRBOHFgydF4y2Ba.gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba, AS-BrRBOHF处理抑制了SI和ui诱导的成熟(gydF4y2BabgydF4y2Ba)和萌芽期(gydF4y2BacgydF4y2Ba)gydF4y2Bab·拉伯gydF4y2Ba柱头在10map。gydF4y2BadgydF4y2Ba, RBOH酶活性成熟gydF4y2Bab·拉伯gydF4y2BaSI和UI花粉授粉后柱头增加,CP花粉授粉后柱头减少。gydF4y2BaegydF4y2Ba, AS-BrRBOHF处理促进了SI花粉的生长gydF4y2Bab . oleraceagydF4y2Ba花粉成熟期和成熟期gydF4y2Bab .寻常的gydF4y2Ba花蕾期的花粉gydF4y2Bab·拉伯gydF4y2Ba的污名。比例尺,500 μm。数据栏(gydF4y2Ba一个gydF4y2Ba):平均值±SD。柱头三个生物学重复的平均相对表达水平(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。数据栏(gydF4y2BadgydF4y2Ba):一个含有100个柱头(双尾)的柱头样品的3个技术重复中产生ROS酶的平均活性gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。除非另有规定,每个实验至少重复三次,结果一致。gydF4y2Ba
图5 UI过程中SRK与污名性ROS相关。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba在酵母双杂交实验中,BrSRK46激酶结构域(KD)与BrFER1 (KD)相互作用(gydF4y2Ba一个gydF4y2Ba)及BiFC (gydF4y2BabgydF4y2Ba).gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, SI花粉蛋白提取物gydF4y2Bab . oleraceagydF4y2Ba花粉(gydF4y2Ba年代gydF4y2Ba36gydF4y2Ba),而非来自CP花粉(gydF4y2Ba年代gydF4y2Ba12gydF4y2Ba),增加ROSgydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba) (gydF4y2BacgydF4y2Ba),以及BrSRK46和BrFER1相互作用的增强(gydF4y2BadgydF4y2Ba)在下拉试验中。见图。gydF4y2Ba2摄氏度gydF4y2Ba.gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba.ROS在gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba)增加(gydF4y2BaegydF4y2Ba), BrSRK46-BrFER1相互作用在下拉过程中增强(gydF4y2BafgydF4y2Ba)及Co-IP化验(gydF4y2BaggydF4y2Ba)通过GST-BrSCR46,而不是GST-BrSCR12,后者对gydF4y2Ba年代gydF4y2Ba12gydF4y2Ba耻辱。蛋白质样本来自同一实验,印迹并行处理(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba).凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.见图。gydF4y2Ba2 d, egydF4y2Ba.gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba硝基蓝四氮唑染色或烟叶与HgydF4y2Ba2gydF4y2Ba对共表达BrFER1、BrRBOHD2和BrSRK46的烟叶原生质体进行DCFDA染色,显示BrSCR46对ROS的增强作用,而不是BrSCR12。比例尺,500 μm (gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba);50 μm (gydF4y2Ba我gydF4y2Ba).数据栏(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba):平均值±SD。图中所示的印迹的三个生物重复的平均相对强度。gydF4y2Ba2汉英gydF4y2Ba(正反gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数,烟叶,原生质体样本。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图6 SI和UI过程中fe - ros信号通路与MLPK、ARC1的关系gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba定量RT-PCR结果显示AS-BrMLPK和AS-BrARC1处理抑制了其表达gydF4y2BaBrMLPKgydF4y2Ba而且gydF4y2BaBrARC1gydF4y2Ba分别在成熟gydF4y2Bab·拉伯gydF4y2Ba的污名。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, AS-BrMLPK (gydF4y2BacgydF4y2Ba)和AS-BrARC1 (gydF4y2BadgydF4y2Ba)处理促进成熟SI和UI花粉管的生长gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba).gydF4y2BaegydF4y2Ba, AS-BrMLPK处理成熟gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba)抑制SI和UI花粉诱导的ROS增加。gydF4y2BafgydF4y2Ba, AS-BrARC1处理成熟gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2Ba年代gydF4y2Ba46gydF4y2Ba)不影响SI和UI花粉诱导ROS的增加。比例尺,500 μm。数据栏(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba):平均值±SD。柱头三个生物学重复的平均相对表达水平(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。数据条:平均值±标准差。箱形图(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图7 pcp - b与FER的种间匹配。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,当观察到1.5 HAP时,生殖障碍降低到gydF4y2Bab·拉伯gydF4y2Ba而且gydF4y2Bab . oleraceagydF4y2Ba花粉gydF4y2BaA. thaliana fergydF4y2Ba突变体(gydF4y2Ba一个gydF4y2Ba,gydF4y2BasrngydF4y2Ba),gydF4y2BarbohdgydF4y2Ba突变体(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)柱头明显。参见图。gydF4y2Ba3 cgydF4y2Ba.gydF4y2BadgydF4y2Ba, PCP-B基因的系统发育分析gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba,gydF4y2Bab·拉伯gydF4y2Ba.我们命名为BrapaB3gydF4y2Ba12gydF4y2Ba,是AtPCP-Bγ的同源物,以后称为BrPCP-B3。gydF4y2BaegydF4y2Ba, pcp - b的氨基酸序列比对gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba,gydF4y2Bab·拉伯gydF4y2BaPCP-B序列比较。它们在成熟多肽中都有7或8个半胱氨酸的共同模式。红色矩形表示保守的半胱氨酸(AtPCP-B的C30, C32, C33),突变导致柱头ROS减少能力和花粉水化能力的丧失gydF4y2Ba14gydF4y2Ba.gydF4y2BafgydF4y2Ba合成AtPCP-Bγ和重组mmp -AtPCP-Bγ在降低UP ROS方面具有相似的作用gydF4y2Ba答:芥gydF4y2Ba但GST-BrPCP-B3在5或10 MAT时没有减少ROS的作用。gydF4y2BaggydF4y2Ba,gydF4y2Bab·拉伯gydF4y2Ba集体荣辱感和gydF4y2Ba答:芥gydF4y2Ba柱头表达不同的FER,在减少ROS方面优先响应BrPCP-B3。gydF4y2BahgydF4y2Ba, AtPCP-Bγ降低ROS的速度远快于GST-BrPCP-B3gydF4y2Ba答:芥gydF4y2Ba根,也表示FERgydF4y2Ba28gydF4y2Ba.gydF4y2Ba我gydF4y2Ba, GST-BrPCP-B3对降低ROS更有效gydF4y2Bab·拉伯gydF4y2Ba根比gydF4y2Ba答:芥gydF4y2Ba的根源。gydF4y2BajgydF4y2Ba定量的下拉实验数据显示GST-BrPCP-B3在与AtFER (ED)-FLAG相互作用时与AtPCP-Bγ竞争效率低。蛋白质样本来自同一实验,印迹并行处理。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.参见图。gydF4y2Ba3 fgydF4y2Ba.比例尺,200 μm (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba)和根(gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).数据栏(gydF4y2BajgydF4y2Ba):平均值±SD。来自3个生物学重复的印迹的平均相对强度表示在左侧(两个尾部)gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头或根的数量。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
扩展数据图8中ROS减少需要污名NOgydF4y2Ba答:芥gydF4y2BaSC和UC期间的柱头。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,共聚焦和宽视野成像显示,SC花粉在5map处柱头NO含量增加(gydF4y2Ba一个gydF4y2Ba)和sc诱导NO和花粉水合作用的定量数据gydF4y2Ba答:芥gydF4y2Ba柱头在~ 5map处均无峰值(gydF4y2BabgydF4y2Ba).见图。gydF4y2Ba4gydF4y2Ba.gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, fe依赖的NO升高gydF4y2Ba答:芥gydF4y2Ba花粉和At-PCP-Bγ诱导的柱头见图。gydF4y2Ba4 d, egydF4y2Ba.gydF4y2BaegydF4y2Ba, AtPCP-Bγ增加NO的速度明显快于GST-BrPCP-B3gydF4y2Ba答:芥gydF4y2Ba的根源。gydF4y2BafgydF4y2Ba, GST-BrPCP-B3对提高NO的效果更好gydF4y2Bab·拉伯gydF4y2Ba根比gydF4y2Ba答:芥gydF4y2Ba的根源。gydF4y2BaggydF4y2Ba的根源gydF4y2Bafer-4gydF4y2Ba对AtPCP-Bγ诱导NO无反应。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba(从左至右)cPTIO清除SC诱导的NO,抑制SC诱导的ROS还原,抑制SC花粉水化和花管管生长gydF4y2Ba答:芥gydF4y2Ba的污名。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba,相对于WT,gydF4y2Banoa1gydF4y2Ba柱头中NO含量较低,ROS含量较高,SC (WT)水化速度较慢gydF4y2Ba答:芥gydF4y2Ba)花粉及花粉管生长(gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba).相对于WT,gydF4y2Bahot5-4gydF4y2Ba柱头的NO和ROS水平较低,SC (WT)水化速度较快gydF4y2Ba答:芥gydF4y2Ba)花粉及花粉管生长(gydF4y2BajgydF4y2Ba,gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba).gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba, NOA1突变,gydF4y2Banoa1gydF4y2Ba(gydF4y2BaogydF4y2Ba)及GSNOR,gydF4y2Bahot5-4gydF4y2Ba(gydF4y2BapgydF4y2Ba),分别增强和降低了生殖障碍gydF4y2Bab·拉伯gydF4y2Ba或gydF4y2Bab . oleraceagydF4y2Ba花粉gydF4y2Ba答:芥gydF4y2Ba柱头在1.5 HAP。比例尺,200 μm (gydF4y2Ba一个gydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba,gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba)和根(gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba);花粉为50 μm (gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba).箱形图(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BapgydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头、花粉粒或根的数量。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
图9 NO、ROS与BrFER1、RBOHs亚硝化的反比关系gydF4y2Bab·拉伯gydF4y2Ba的污名。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba种内CP花粉(2gydF4y2BandgydF4y2Barow),而不是SI和gydF4y2Bab . oleraceagydF4y2Ba(UI)花粉,诱导NO在gydF4y2Bab·拉伯gydF4y2Ba的污名。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,清除NO增加ROS (gydF4y2BacgydF4y2Ba)和RBOH酶活性gydF4y2BaB.rapagydF4y2Ba污名(gydF4y2BadgydF4y2Ba),抑制CP花粉管的生长gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2BaegydF4y2Ba).gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba, GSNO处理增加NO (gydF4y2BafgydF4y2Ba),减少ROS (gydF4y2BafgydF4y2Ba)和RBOH酶活性gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2BaggydF4y2Ba),促进了SI或的增长gydF4y2Bab . oleraceagydF4y2Ba花粉成熟或成熟gydF4y2Bab .寻常的gydF4y2Ba花蕾期花粉gydF4y2Bab·拉伯gydF4y2Ba污名(gydF4y2BahgydF4y2Ba).gydF4y2Ba我gydF4y2Ba, BrFER1(KD),而不是BrFER1(ED)被GSNO亚硝化。参见图。gydF4y2Ba4 fgydF4y2Ba.gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba, LC-MS谱显示BrFER1蛋白中亚硝基化半胱氨酸残基。gydF4y2BalgydF4y2Ba, FER氨基酸序列测序显示亚硝化半胱氨酸,Cys730和Cys752(*)是进化保守的。gydF4y2Ba米gydF4y2Ba下拉实验显示GSNO处理诱导了gst - brop2复合物对MBP-BrFER1(KD)的定量抑制。参见图。gydF4y2Ba4 hgydF4y2Ba.gydF4y2BangydF4y2Ba拟亚硝化突变Cys730W减少了被gfp - brop2拉低的BrFER1的数量。gydF4y2BaogydF4y2BaBrRBOHs和AtRBOHD的系统发育分析。BrRBOHD1和BrRBOHD2比其他BrRBOHs更接近AtRBOHD。gydF4y2BapgydF4y2Ba- - - - - -gydF4y2BargydF4y2Ba, RBOHD被NO亚硝化。gydF4y2Ba在体外gydF4y2BaGSNO对BrRBOHD1亚硝化作用(gydF4y2BapgydF4y2Ba);cp诱导的GFP-AtRBOHD蛋白亚硝化gydF4y2Ba答:芥gydF4y2Ba污名(gydF4y2Ba问gydF4y2Ba), LC-MS谱显示GST-BrRBOHD1的Cys891亚硝化(CT, c端)(gydF4y2BargydF4y2Ba).亚硝基化氨基酸残基用TMT标记。蛋白质可以代表三种以上的独立制剂。gydF4y2Ba年代gydF4y2Ba,gydF4y2BatgydF4y2Ba, GST-BrRBOHD2 (CT) (gydF4y2Ba年代gydF4y2Ba)及GST-BrRBOHF (CT) (gydF4y2BatgydF4y2Ba)蛋白质被亚硝化gydF4y2Ba在体外gydF4y2Ba.蛋白质样本来自同一实验,印迹并行处理(gydF4y2Ba我gydF4y2Ba,gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba,gydF4y2BapgydF4y2Ba,gydF4y2Ba问gydF4y2Ba,gydF4y2Ba年代gydF4y2Ba,gydF4y2BatgydF4y2Ba).凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.比例尺,500 μm。折线图(gydF4y2BabgydF4y2Ba):平均值±SD。柱头的三个生物重复的平均相对NO强度显示在a(双尾gydF4y2BatgydF4y2Ba-test, n = 3)。数据栏(gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba):一个含有100个柱头(双尾)的柱头样品的3个技术重复中产生ROS酶的平均活性gydF4y2BatgydF4y2Ba-test, n = 3)。数据栏(gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba):平均值±SD。柱头的三个生物学重复的平均相对强度(gydF4y2Ba一个gydF4y2Ba)和图中的印迹gydF4y2Ba4 hgydF4y2Ba在(gydF4y2BangydF4y2Ba)(双尾)gydF4y2BatgydF4y2Ba-test, n = 3)。箱形图(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),柱头数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。除非另有规定,每个实验至少重复三次,结果一致。gydF4y2Ba
扩展数据图10打破种间屏障gydF4y2Ba芸苔属植物gydF4y2Ba作物。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2BaNa-SA降低ROS或GSNO增加NO均可增加♀荚果中增大胚珠的数量gydF4y2Bab·拉伯gydF4y2Ba×♂gydF4y2Bab . oleraceagydF4y2Ba或♀gydF4y2Bab·拉伯gydF4y2Ba×♂gydF4y2Bab .寻常的gydF4y2Ba.见图。gydF4y2Ba5gydF4y2Ba.gydF4y2BacgydF4y2Ba,抑制的表达gydF4y2BaBrSRK46gydF4y2Ba,gydF4y2BaBrBrFER1gydF4y2Ba,或gydF4y2BaBrRBOHFgydF4y2Ba通过AS-ODNs增加♀荚果中增大胚珠的数量gydF4y2Bab·拉伯gydF4y2Ba×♂gydF4y2Bab . oleraceagydF4y2Ba或♀gydF4y2Bab·拉伯gydF4y2Ba×♂gydF4y2Bab .寻常的gydF4y2Ba.参见图。gydF4y2Ba5 bgydF4y2Ba.gydF4y2BadgydF4y2Ba,gydF4y2Bab . oleraceagydF4y2Ba花粉管或gydF4y2Bab .寻常的gydF4y2Ba花粉管gydF4y2Bab·拉伯gydF4y2Ba雌蕊。扩大♀数量的减少gydF4y2Bab·拉伯gydF4y2Ba×♂gydF4y2Bab .寻常的gydF4y2Ba胚珠可能是由于较少gydF4y2Bab .寻常的gydF4y2Ba花粉管从传粉组织中分离出来,并以花粉管为目标gydF4y2Bab·拉伯gydF4y2Ba胚珠由于额外的障碍基于他们的进化距离(图。gydF4y2Ba1gydF4y2Ba).箭头指向传播组织中的花粉管束,星星指向被花粉管穿透的胚珠。比例尺,100 μm (gydF4y2BadgydF4y2Ba).箱形图(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba):中线,中间;方框限制,下四分位数和上四分位数;点,单个数据点;胡须,最高和最低的数据点。N(蓝色),雌蕊数。gydF4y2BaPgydF4y2Ba值,双尾gydF4y2BatgydF4y2Ba测试。每个实验至少重复三次,结果一致。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
该文件包含补充图1和补充表1 - 4。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
黄俊,杨,林,杨,林。gydF4y2Baet al。gydF4y2Ba柱头受体控制芸苔科种内和种间屏障。gydF4y2Ba自然gydF4y2Ba614gydF4y2Ba, 303-308(2023)。https://doi.org/10.1038/s41586-022-05640-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05640-xgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba