摘要gydF4y2Ba
单细胞技术已经能够以前所未有的深度描述肿瘤微环境,并揭示了肿瘤细胞及其生态位之间的巨大细胞多样性。抗肿瘤免疫依赖于肿瘤微环境中的细胞-细胞关系gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba然而,许多单细胞研究缺乏空间背景,依赖于分离组织gydF4y2Ba3 gydF4y2Ba.在这里,我们应用成像细胞术来描述139个高级别胶质瘤和46个脑转移瘤患者的免疫景观。通过对389张高维组织病理学图像中超过110万个细胞的单细胞分析,实现了免疫谱系和激活状态的空间分辨率,揭示了原发肿瘤和不同实体癌脑转移之间免疫景观的差异。这些分析揭示了与胶质母细胞瘤患者生存相关的细胞邻近区,我们利用这些细胞邻近区确定了与长期生存相关的独特的髓过氧化物酶(MPO)阳性巨噬细胞群。我们的发现为原发性和转移性脑肿瘤的生物学提供了见解,加强了将空间分辨率集成到单细胞数据集以分析癌症的微环境背景的价值。gydF4y2Ba
主要gydF4y2Ba
脑肿瘤由多种恶性肿瘤组成,这些恶性肿瘤要么来自大脑内部,要么来自从其他原发部位扩散的癌细胞。代表这两类癌症的最常见类型包括胶质母细胞瘤(约占成人所有原发性脑恶性肿瘤的50%)gydF4y2Ba4 gydF4y2Ba)和脑转移(约占所有脑部恶性肿瘤的90%),其中脑转移最常由黑色素瘤、肺肿瘤或乳腺肿瘤引起gydF4y2Ba5gydF4y2Ba.除了手术,靶向肿瘤细胞的细胞毒性疗法——比如立体定向放射疗法——通常是治疗的第一线,但疗效甚微,存活超过2年的患者很少gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba.肿瘤微环境(TME)是癌症进展的主要调节因子,其治疗价值随着免疫检查点封锁的出现而增长gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.与其他组织相比,脑TME具有独特的组成,主要由功能多样化的星形胶质细胞和个体发育独特的致瘤巨噬细胞主导,不包括浸润淋巴细胞gydF4y2Ba8gydF4y2Ba.单细胞分析技术已经揭示了其他癌症TME中许多有前途的治疗靶点;例如,多重成像已经发现了几种新的生物标志物,可以预测乳房的结果和治疗效果gydF4y2Ba9克ydF4y2Ba,gydF4y2Ba10克ydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba、肠癌gydF4y2Ba13gydF4y2Ba还有胰腺癌gydF4y2Ba14gydF4y2Ba.然而,对大脑TME的全面分析却很少(尽管很重要)gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba)与其他恶性肿瘤相比的进展,到目前为止,还没有一项研究包括使用高度多样化的组织学对其生态位内的单个细胞进行空间表征。在这里,我们使用成像大规模细胞术(IMC)对患者样本描述胶质母细胞瘤和BrM的大脑TME,并探索空间分辨率特征与临床结果的关系。gydF4y2Ba
用IMC绘制大脑TMEgydF4y2Ba
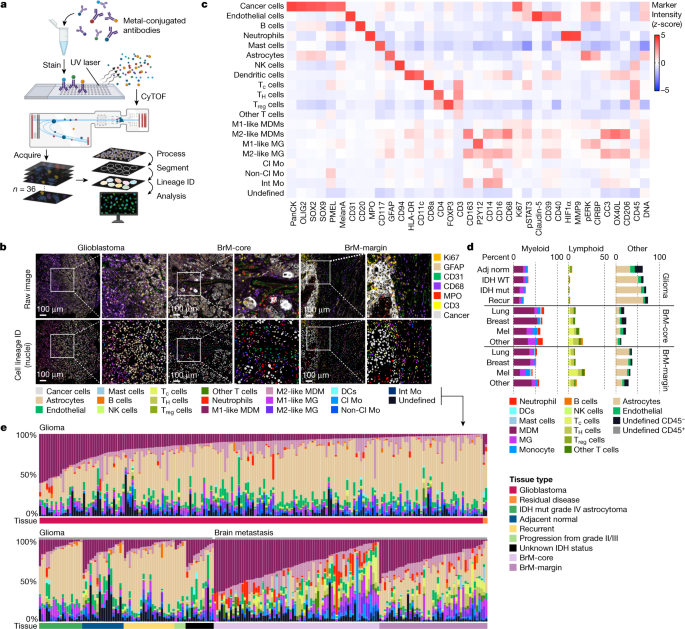
为了全面分析大脑TME的细胞组成和空间组织,我们优化了高度复用的抗体面板和IMC管道(扩展数据图。gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3 gydF4y2Ba,补充图。gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3 gydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba).抗体在正常和恶性组织中根据预期的染色模式进行验证(扩展数据图)。gydF4y2Ba3gydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).我们获得了389张高维组织病理学图像,代表139个高级别胶质瘤和46个BrM患者肿瘤。gydF4y2Ba1 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba1gydF4y2Ba).胶质瘤包括手术中获得的切除组织(共270张图像,192张来自原发性胶质瘤),包括来自长期幸存者的子集(78张图像)。BrM图像来自多种原发恶性肿瘤,包括肺(51张图像),乳腺(29张图像),黑色素瘤(19张图像)和其他原发来源(20张图像),患者匹配的样本来自转移病灶的中心(BrM核心)和组织界面(BrM边缘)。图像被分割成1,163,362个总细胞,并使用监督谱系分配方法对肿瘤细胞、星形胶质细胞、血管和超过16个免疫细胞群进行分类,使用规范的身份标记(图2)。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).正如预期的那样,在所有组织的间质室中,主要的细胞群包括GFAPgydF4y2Ba+gydF4y2Ba星形胶质细胞和CD68gydF4y2Ba+gydF4y2Ba巨噬细胞,而淋巴细胞相对较少(图;gydF4y2Ba1 d, egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,应用于胶质瘤和BrM组织微阵列的IMC管道示意图。对样品进行多重染色,并使用飞行时间(CyTOF)细胞仪获取数据。在空间分析之前进行细胞分割和谱系分配。由BioRender.com创建。gydF4y2BabgydF4y2Ba,来自胶质母细胞瘤、brm核心和brm边缘样本的IMC图像(上)和相应的谱系分配(下),每张图像的右侧都有放大区域。提供了IMC标记(右上)和谱系分配(下)的颜色代码(代表gydF4y2BangydF4y2Ba= 389张图片)。比例尺,100 μm。gydF4y2BacgydF4y2Ba,热图显示了用IMC鉴定的细胞群中所有标记物的相对平均表达(gydF4y2BangydF4y2Ba= 389张图片)。胶质瘤IMC抗体组特异性标记物子集(SOX2, SOX9, OLIG2, CD40, CD206;gydF4y2BangydF4y2Ba= 270张图像)和BrM IMC抗体组的第二个子集(泛细胞角蛋白,PMEL, MelanA, pERK, CIRBP;gydF4y2BangydF4y2Ba= 119张图片)。gydF4y2BadgydF4y2Ba,根据临床亚组,所示细胞类型占TME内所有细胞的百分比的堆叠柱状图。胶质瘤:相邻正常(adj正常),gydF4y2BangydF4y2Ba= 18;原生异柠檬酸脱氢酶(IDH)野生型(WT)gydF4y2BangydF4y2Ba= 192;IDH突变体(mut)gydF4y2BangydF4y2Ba= 19;复发性(复发),gydF4y2BangydF4y2Ba= 22。BrM-core:肺癌、gydF4y2BangydF4y2Ba= 29;乳腺癌、gydF4y2BangydF4y2Ba= 17;黑色素瘤(mel),gydF4y2BangydF4y2Ba= 13;其他的,gydF4y2BangydF4y2Ba= 13。BrM-margin:肺癌、gydF4y2BangydF4y2Ba= 22;乳腺癌、gydF4y2BangydF4y2Ba= 12;黑色素瘤,gydF4y2BangydF4y2Ba= 6;其他的,gydF4y2BangydF4y2Ba= 7。数据为平均值;gydF4y2BangydF4y2Ba指图像数量。gydF4y2BaegydF4y2Ba细胞群在TME中所有细胞的百分比分布,按组织类型分类。每个图像的单元格频率(gydF4y2BangydF4y2Ba= 389张图像)显示为竖条(颜色对应于中细胞谱系gydF4y2BabgydF4y2Ba)和相关的组织类型在下面的水平面板中显示(右侧图例中显示的颜色)。Cl Mo,经典单核细胞;DC,树突细胞;Int Mo,中间单核细胞;毫克,小胶质细胞;非cl Mo,非经典单核细胞;NK细胞,自然杀伤细胞;panCK pan-cytokeratin;TgydF4y2BacgydF4y2Ba,细胞毒性T细胞;TgydF4y2BaHgydF4y2Ba, T助手;TgydF4y2Ba注册gydF4y2Ba, T调节细胞;其他T细胞,CD8gydF4y2Ba−gydF4y2BaCD4gydF4y2Ba−gydF4y2Ba双阴性T细胞。gydF4y2Ba
体外刺激的巨噬细胞可以被定义为连续的激活状态;尽管通常被认为是M2样,但肿瘤相关巨噬细胞的原位激活要复杂得多,并不一定符合M1/M2模式gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.考虑到这一局限性,我们根据个体发育和激活状态细分巨噬细胞;嘌呤能受体P2Y12的表达区分了组织驻留的小胶质细胞和单核细胞来源的巨噬细胞gydF4y2Ba19gydF4y2Ba(MDMs)和CD163表达区分假定的“m2样”和“m1样”细胞gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba和补充图。gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba).CD163中也富集了CD206和CD39等其他促肿瘤标志物gydF4y2Ba+gydF4y2Bam2样巨噬细胞片段(补充图。gydF4y2Ba5 b, cgydF4y2Ba).与以前的报告一致gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba在所有样本中,MDMs和小胶质细胞是主要的免疫种群,分别约占TME的30.5%和9.2%。gydF4y2Ba1 dgydF4y2Ba).gydF4y2Ba
单细胞相互作用网络gydF4y2Ba
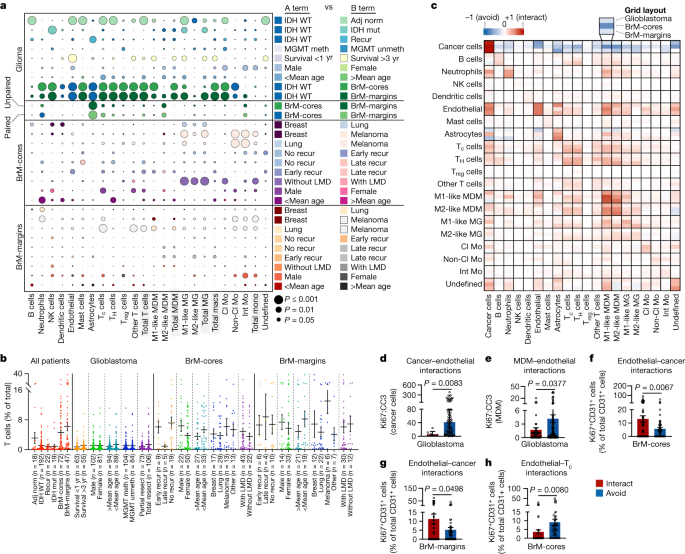
我们将每种细胞类型的频率作为每张图像中细胞总数的百分比进行量化,并比较临床相关的患者亚组(图2)。gydF4y2Ba2 a, bgydF4y2Ba和补充图。gydF4y2Ba6克ydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).相似地评估每个图像区域内的细胞密度(扩展数据图。gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba8gydF4y2Ba).正如预期的那样,与胶质母细胞瘤相比,相邻正常组织中大多数细胞类型的频率都有所增加。gydF4y2Ba2gydF4y2Ba),而当检查细胞密度时,这一趋势相反(扩展数据图。gydF4y2Ba4gydF4y2Ba),反映了正常大脑生态位的稀疏细胞景观。IDH野生型(胶质母细胞瘤)与IDH突变型(IV级星形细胞瘤)肿瘤的比较gydF4y2Ba23gydF4y2Ba时,NK细胞频率降低(图;gydF4y2Ba2gydF4y2Ba).CD16的比例较低gydF4y2Ba+gydF4y2Ba(细胞毒性)比CD16gydF4y2Ba−gydF4y2Ba(未成熟)NK细胞亚群在胶质母细胞瘤肿瘤(补充图。gydF4y2Ba7 b, cgydF4y2Ba),与先前的研究结果一致gydF4y2Ba15gydF4y2Ba.我们还发现,IDH野生型肿瘤与突变型肿瘤相比,募集的MDMs(但不包括小胶质细胞)的频率和密度更高。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba),提示巨噬细胞的外周招募与更严重的疾病gydF4y2Ba24gydF4y2Ba.通过MGMT甲基化状态(预后指标)分析胶质母细胞瘤样本,发现最小的免疫差异;然而,根据生存时间的细分显示,长期幸存者(LTSs)(总生存期超过3年)的肿瘤内皮频率高于短期幸存者(STSs)(总生存期小于1年)(图2)。gydF4y2Ba2gydF4y2Ba).这是出乎意料的,可能与化疗输送的效率有关。另外,血管壁龛的特征可能在某些患者中赋予生存益处。与STS肿瘤相比,LTS肿瘤也有更高的CD8频率gydF4y2Ba−gydF4y2BaCD4gydF4y2Ba−gydF4y2BaT细胞(可能包括γδ T细胞,与增加生存率有关gydF4y2Ba25gydF4y2Ba)和m1样巨噬细胞积累,而m2样巨噬细胞无差异(图。gydF4y2Ba2gydF4y2Ba).在胶质母细胞瘤临床亚组中,根据频率观察到的淋巴细胞非常少(图2)。gydF4y2Ba2 bgydF4y2Ba)及密度(补充图;gydF4y2Ba8gydF4y2Ba),支持胶质母细胞瘤是T细胞沙漠,对免疫检查点封锁反应不佳gydF4y2Ba26gydF4y2Ba.然而,一部分胶质母细胞瘤图像显示出异常高的T细胞频率(TME中超过5%的细胞)。这些样品富集CD8gydF4y2Ba+gydF4y2Ba, CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba−gydF4y2BaCD4gydF4y2Ba−gydF4y2BaT细胞亚群,但不是免疫抑制TgydF4y2Ba注册gydF4y2Ba与T细胞数量较少(TME中细胞数量小于5%)的样本相比,平均生存时间增加62%(扩展数据图)。gydF4y2Ba4 b, cgydF4y2Ba).最后,我们观察到男性患者肿瘤中外周来源单核细胞的频率高于女性患者,同时内皮细胞的频率也高于女性患者(图2)。gydF4y2Ba2gydF4y2Ba),强调了对癌症的免疫反应中假定的性别二态性。gydF4y2Ba
一个gydF4y2Ba,细胞频率在临床亚组患者之间的比较,对应的数据在gydF4y2BabgydF4y2Ba和补充图。gydF4y2Ba6克ydF4y2Ba.在每一行中,气泡颜色表示具有较高细胞类型表示的临床亚组(A项与B项,右),气泡大小表示gydF4y2BaP -gydF4y2Ba价值。双面的学生的gydF4y2BatgydF4y2Ba-test,除非另有说明,否则未配对;配对分析来自患者匹配的样本。轻脑膜病;冰毒,甲基化;unmeth unmethylated;复发,复发。gydF4y2BabgydF4y2Ba, T细胞频率占临床亚群总细胞的百分比。数据为均数±s.e.m.;所有数据点叠加;gydF4y2BangydF4y2Ba指图像的数量。切除,切除。gydF4y2BacgydF4y2Ba,恶性胶质瘤成对互动回避评分热图(上行,gydF4y2BangydF4y2Ba= 192张图像),BrM-cores(中间行,gydF4y2BangydF4y2Ba= 59张图片)和brm边距(底部行,gydF4y2BangydF4y2Ba= 40张图片)。关联应该从行到列读取。gydF4y2BadgydF4y2Ba, Ki67:与癌细胞相互作用的CC3比率(红色;gydF4y2BangydF4y2Ba= 6幅图像中的107个单元格)或避免(蓝色;gydF4y2BangydF4y2Ba= 67张图像中的11,163个细胞)胶质母细胞瘤中的内皮细胞。数据为中位数±四分位数范围;双面曼-惠特尼检验。gydF4y2BaegydF4y2Ba, Ki67:与MDMs相互作用的CC3比例(红色;gydF4y2BangydF4y2Ba= 51张图像中270个单元格)或避免(蓝色;gydF4y2BangydF4y2Ba= 2808个细胞,共94张图像)胶质母细胞瘤中的内皮细胞。数据为均数±s.e.m.;双面的学生的gydF4y2BatgydF4y2Ba以及。gydF4y2BafgydF4y2Ba, Ki67在brm核中与(红色)癌细胞相互作用或避免(蓝色)癌细胞的内皮细胞中的表达。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba=每组61张图像中有347个细胞;双面的学生的gydF4y2BatgydF4y2Ba以及。gydF4y2BaggydF4y2Ba, Ki67在与brm边缘的癌细胞相互作用(红色)或避免(蓝色)的内皮细胞中的表达。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba=每组45张图像中156个细胞;双面的学生的gydF4y2BatgydF4y2Ba以及。gydF4y2BahgydF4y2Ba, Ki67在内皮细胞与T相互作用(红色)或回避(蓝色)时的表达gydF4y2BacgydF4y2Babrm核中的细胞。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba=每组41张图像中有235个细胞;双面的学生的gydF4y2BatgydF4y2Ba以及。在gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,没有感兴趣的细胞或缺乏感兴趣的成对相互作用的图像被排除在分析之外。gydF4y2Ba
接下来,我们研究了BrM样本中的免疫细胞动力学。我们发现NK细胞的频率和密度增加(特别是CD16细胞)gydF4y2Ba+gydF4y2Ba15gydF4y2Ba)、中性粒细胞、巨噬细胞、经典单核细胞和T细胞(包括TgydF4y2Ba注册gydF4y2Ba细胞gydF4y2Ba15gydF4y2Ba与胶质母细胞瘤相比,树突状细胞和非经典单核细胞减少(图2)。gydF4y2Ba2gydF4y2Ba扩展数据图gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba7 b, cgydF4y2Ba).当检查BrM核心中与BrM进展相关的免疫变化时,我们发现在没有轻脑膜疾病的患者中,单核细胞和小胶质细胞增加(图2)。gydF4y2Ba2gydF4y2Ba)或局部复发(超过724天后)(补充图gydF4y2Ba9gydF4y2Ba),这表明这些细胞在这种情况下具有假定的保护作用。在比较来自不同原发肿瘤部位的brm时,brm相关炎症的程度(即分析的免疫细胞类型的频率)通常在来自乳腺肿瘤的肿瘤中最低,在来自黑色素瘤的肿瘤中最高,而在来自肺部的肿瘤中处于中等水平。与肺和乳腺BrM相比,黑色素瘤BrM单核细胞和小胶质细胞富集,并表现出明显的CD8积累gydF4y2Ba+gydF4y2Ba肿瘤边缘的T细胞占总细胞的百分比(图2)。gydF4y2Ba2gydF4y2Ba和补充图。gydF4y2Ba9 bgydF4y2Ba).这与观察结果一致,与胶质母细胞瘤不同,BrM对免疫检查点封锁表现出一定的脆弱性,尤其是黑素瘤BrMgydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.与胶质母细胞瘤相似,我们观察到brm核的性别二态性,有更多的CD8gydF4y2Ba+gydF4y2Ba男性患者的T细胞与女性患者的T细胞比较。我们还发现了更多的中性粒细胞、树突状细胞和CD4细胞gydF4y2Ba+gydF4y2Ba年轻患者的brm核心中的T细胞与老年患者的相比(图2)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
为了描述单个细胞之间的通信模式,我们使用置换测试来量化细胞-细胞共定位并识别细胞对之间的相互作用或回避行为,研究了脑肿瘤的位置结构gydF4y2Ba11gydF4y2Ba(无花果。gydF4y2Ba2摄氏度gydF4y2Ba).该方法显示,与胶质母细胞瘤相比,BrM中的癌细胞更有可能避免TME中的大多数非癌症谱系(图2)。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba),表明BrM中癌细胞的地形相对于胶质母细胞瘤的分散性质更为紧凑,与观察到的同型细胞相互作用模式一致(图。gydF4y2Ba2摄氏度gydF4y2Ba).与胶质母细胞瘤相比,BrM的整体异型细胞相互作用增加(图。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba5 bgydF4y2Ba),这表明胶质母细胞瘤和BrM与周围脑实质的界面方式是根本不同的,尽管它们共享一个共同的组织生态位。gydF4y2Ba
在胶质母细胞瘤和BrM中,血管系统都是脑TME的关键组成部分;例如,血管周围生态位维持胶质瘤起始细胞池gydF4y2Ba29gydF4y2Ba,血脑屏障(BBB)调节BrM的传播。鉴于我们对LTS肿瘤中内皮细胞富集的观察(图。gydF4y2Ba2gydF4y2Ba),我们检查了胶质母细胞瘤血管生态位内的细胞动力学。正如预期的那样,内皮细胞在胶质母细胞瘤中表现出与星形胶质细胞相互作用的强烈可能性,这对血脑屏障功能至关重要(图。gydF4y2Ba2摄氏度gydF4y2Ba).内皮细胞也表现出与癌细胞的强相互作用(图。gydF4y2Ba2摄氏度gydF4y2Ba);特别是,血管周围癌细胞与没有血管的癌细胞相比,Ki67:CC3比值降低。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba),表明直接接触血管可能会阻碍癌细胞的扩张gydF4y2Ba30.gydF4y2Ba-一项可能为LTS肿瘤生物学提供见解的发现。与之前的报道一致,我们观察到MDMs,而不是单核细胞或小胶质细胞,在胶质母细胞瘤中也表现出与内皮细胞相互作用的强烈趋势gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba(无花果。gydF4y2Ba2摄氏度gydF4y2Ba),尽管MDMs的频率与内皮细胞之间存在弱相关性(扩展数据图。gydF4y2Ba6 bgydF4y2Ba).这强调了这些相互作用是空间协调的,而不是简单地由丰富的关联引起的。与避免直接与内皮细胞相互作用的MDMs相比,与内皮细胞相互作用时MDMs表现出较低的Ki67:CC3比率(图2)。gydF4y2Ba2 egydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba),概括了脑巨噬细胞增殖与胶质瘤进展之间的关系gydF4y2Ba31gydF4y2Ba.最后,尽管T细胞的发病率很低,但它们与内皮细胞或MDMs相互作用的趋势不大(图2)。gydF4y2Ba2摄氏度gydF4y2Ba),促使我们进一步剖析这些关系。具体来说,我们发现了更多的CD40gydF4y2Ba+gydF4y2BaMDMs与T相互作用gydF4y2BaHgydF4y2Ba细胞比CD40多gydF4y2Ba−gydF4y2BaMDMs(扩展数据图。gydF4y2Ba6摄氏度gydF4y2Ba), CD40是一种参与胶质瘤T细胞募集的共刺激蛋白gydF4y2Ba32gydF4y2Ba.当检查血管邻近时,血管周围m1样MDMs比远离血管的MDMs表现出更高的CD40表达(扩展数据图)。gydF4y2Ba6 dgydF4y2Ba),类似地,血管周围的m2样MDMs表达高水平的OX40L(另一种共刺激分子)(扩展数据图。gydF4y2Ba6 egydF4y2Ba).总之,这些数据暗示了血管微池的存在——巨噬细胞可能为T细胞提供有益的信号信号,癌细胞的扩张受到控制——并支持血管在形成大脑TME结构中的作用。gydF4y2Ba
我们接下来探讨了BrM中的血管相互作用。与胶质母细胞瘤相似,在BrM中内皮细胞具有与癌细胞相互作用的高度倾向(图2)。gydF4y2Ba2摄氏度gydF4y2Ba),这对于外渗后的转移定殖至关重要gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.在brm核心和brm边缘,与癌细胞相关的内皮细胞显示Ki67表达增加,使人联想到微血管增生(图2)。gydF4y2Ba2 f, ggydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).考虑到微血管增生和高级别胶质瘤之间的关系,这是有趣的gydF4y2Ba35gydF4y2Ba,这可能表明转移中更具有侵袭性的肿瘤特征的局部细胞壁龛。内皮细胞增殖通过与CD8的相互作用被抑制gydF4y2Ba+gydF4y2BaT细胞——一种特定于brm核心的效应(图。gydF4y2Ba2 hgydF4y2Ba和扩展数据图。gydF4y2Ba6 fgydF4y2Ba).值得注意的是,血脑屏障中紧密连接蛋白claudin-5的表达与BrM的血管通透性有关gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba-是空间调节的。在brm核心(而不是brm边缘),癌邻近内皮细胞与避免癌的内皮细胞相比表现出更低的claudin-5表达。gydF4y2Ba6克gydF4y2Ba).此外,claudin-5的频率gydF4y2Ba+gydF4y2Ba与brm边缘相比,brm核心的癌邻近内皮细胞较低。gydF4y2Ba6克gydF4y2Ba),支持了BrM定植过程中血管征用的模型,即在内皮连接减弱的区域开始定植gydF4y2Ba34gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.claudin-5下调与瘤周性脑水肿有关gydF4y2Ba40gydF4y2Ba,我们根据术前MRI评估的水肿程度对brm核进行细分。与癌细胞相关的内皮细胞在肿瘤周围中度-高度水肿的BrMs中显示claudin-5减少(水肿评分2-3分);在无瘤周水肿或低水肿(水肿评分0-1.5)的BrMs中,这种关系不存在。gydF4y2Ba6小时gydF4y2Ba).这些数据强调了血脑屏障完整性和转移之间的空间解析联系,以及它与血管增生和水肿的关系。gydF4y2Ba
空间细胞小区gydF4y2Ba
接下来,我们探讨了肿瘤内的多细胞结构,而不是成对的相互作用,是否会为大脑TME动力学的组织和预后价值提供有意义的见解。两个变量影响细胞邻域评估:一个邻域内相互作用的细胞数量(gydF4y2BaNgydF4y2Ba)和总细胞邻域(CNs)数目。为了深入了解邻里的大小和复杂性与生存的关系,我们首先使用我们的胶质母细胞瘤数据集作为模型,并改变每个细胞的最近空间邻居的数量(gydF4y2BaNgydF4y2Ba= 3,5,10,20,30),同时保持恒定数量的邻域(CN = 9,与之前的工作一样gydF4y2Ba13gydF4y2Ba).在大多数情况下,富集m1样MDMs的中枢神经与生存率增加有关,而与最近的空间邻居数量无关(扩展数据图)。gydF4y2Ba7gydF4y2Ba).值得注意的是,m1样MDMs的频率与总生存率无关(补充图。gydF4y2Ba7一个gydF4y2Ba),强调空间关系的价值,而不仅仅是丰富。为了解决构成这种生存优势的特定细胞相互作用,我们在维持的同时将中枢神经的数量强制增加到30个(而不是9个)gydF4y2BaNgydF4y2Ba= 10个最近的邻居。使用这种方法,我们解析了6个富集了m1样MDMs的CNs(扩展数据图。gydF4y2Ba8gydF4y2Ba).其中,只有两个维持了长期生存的关系;这些中枢神经主要由m1样MDMs、中性粒细胞和m1样小胶质细胞组成。在剩下的m1样mdm富集的中枢神经系统中,如果中性粒细胞或m1样小胶质细胞减少,生存关系就会丧失(扩展数据图)。gydF4y2Ba8gydF4y2Ba).重要的是,我们发现m1样MDMs、中性粒细胞和m1样小胶质细胞的患病率没有相关性(扩展数据图)。gydF4y2Ba8 bgydF4y2Ba),表明这些细胞之间的空间相互作用是有目的的,而不是它们协调丰度的产物。gydF4y2Ba
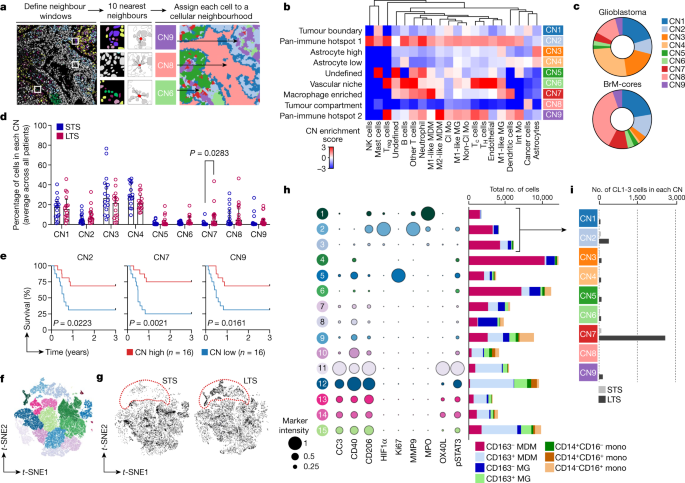
接下来我们比较了胶质母细胞瘤和BrM之间的多细胞相互作用。使用gydF4y2BaNgydF4y2Ba= 10个最近的邻居(我们模型的中点,与其他研究相似gydF4y2Ba13gydF4y2Ba),我们在胶质母细胞瘤和BrM图像中识别出9个中枢神经(图。gydF4y2Ba3 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba9 a、bgydF4y2Ba).CNs的细胞组成概括了已知的组织特征,包括肿瘤边界(CN1)或肿瘤隔室(CN8),两个泛免疫热点,所有免疫群体(CN2)水平高,或某些亚群(CN9)缺陷,高(CN3)或低(CN4)星形胶质细胞,血管niche (CN6),巨噬细胞富集(CN7),以及主要由我们的小组未定义的细胞(CN5)所代表的邻域(图5)(图5)。gydF4y2Ba3 bgydF4y2Ba).正如预期的那样,胶质瘤以CN3和CN4(星形胶质细胞富集)为主,而brm核富集CN8(肿瘤室),反映了胶质瘤与转移性肿瘤相比的浸润性(图)。gydF4y2Ba3 cgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,细胞邻域(CN)分配示意图。中枢神经系统被投影为Voronoi图(右)。gydF4y2BabgydF4y2Ba,在胶质母细胞瘤和brm核中发现的9个中枢的细胞类型热图(gydF4y2BangydF4y2Ba= 251张图片;gydF4y2BaNgydF4y2Ba= 10个最近的邻居,CN = 9个邻居)。gydF4y2BacgydF4y2Ba,中枢神经在胶质母细胞瘤中的分布(gydF4y2BangydF4y2Ba= 192张图像)和brm -core (gydF4y2BangydF4y2Ba= 59张图片)。对于每张图像,确定来自每个CN的细胞百分比,然后为每种疾病类型取平均值。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba, LTS(总生存>3年)和STS(总生存<1年)的受控胶质母细胞瘤队列分析(见扩展数据图)。gydF4y2Ba9 fgydF4y2Ba).gydF4y2BadgydF4y2Ba, LTS和STS胶质母细胞瘤队列中中枢神经的分布。当来自同一患者的多个样本时,CN频率平均。数据为中位数±四分位数范围;gydF4y2BangydF4y2Ba=每组16例;双面曼-惠特尼检验。gydF4y2BaegydF4y2Ba,基于中位CN频率的LTS和STS胶质母细胞瘤队列Kaplan-Meier分析。当来自同一患者的多个样本时,CN频率平均。Log-rank (Mantel-Cox)检验;gydF4y2BangydF4y2Ba每组= 16例。gydF4y2BafgydF4y2Ba,gydF4y2Bat -gydF4y2Ba所有胶质母细胞瘤图像中巨噬细胞和单核细胞的SNE无监督聚类(gydF4y2BangydF4y2Ba= 192张图像中的93,513个细胞)。gydF4y2BaggydF4y2Ba,gydF4y2Bat -gydF4y2Ba胶质母细胞瘤患者单核细胞和巨噬细胞的SNE投影,红色标出CL1-3簇细胞。LTS,gydF4y2BangydF4y2Ba= 32张图像中的17,752个单元格;STS,gydF4y2BangydF4y2Ba= 28张图像中的10,456个单元格。gydF4y2BahgydF4y2Ba,功能标记物的相对表达(左)和15个单核细胞和巨噬细胞簇(CL1-15)的细胞类型分布(右)。gydF4y2Ba我gydF4y2BaLTS和STS胶质母细胞瘤队列中每个细胞邻域中CL1-3细胞的数量。gydF4y2Ba
许多BrM患者出现脑外转移,影响生存分析;因此,我们将CN富集与局部复发联系起来。最强的趋势是高CN5(未定义)与局部复发时间缩短之间的关联(扩展数据图。gydF4y2Ba9 cgydF4y2Ba).我们证实,在我们的数据集中,未定义的细胞中有96%是CD45gydF4y2Ba−gydF4y2Ba(非免疫)(扩展数据图gydF4y2Ba9 dgydF4y2Ba).接下来,我们研究了不同原发部位的brm边缘和brm核心之间的中枢神经的分布。brm之间的邻近相似性是由区域决定的,而不是由原发肿瘤类型决定的,brm边缘比brm核心更类似于胶质母细胞瘤(图。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba9 egydF4y2Ba).例如,肺brm核与黑素瘤或乳房brm核相比,与肺brm边缘更相似(扩展数据图。gydF4y2Ba9 egydF4y2Ba).尽管来自不同原发肿瘤的BrM之间的细胞频率存在高度差异(补充图)。gydF4y2Ba6克ydF4y2Ba), CN分布相对恒定,突出了识别脑肿瘤统一特征的能力,这些特征可能具有治疗信息。gydF4y2Ba
我们接下来检查了STS和LTS的平衡胶质母细胞瘤队列,排除了最大的混杂临床变量(部分切除),并控制了影响生存的其他变量,如MGMT甲基化状态(扩展数据图)。gydF4y2Ba9 fgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba).我们比较了在给定的肿瘤样本中代表每个CN的细胞比例,发现LTS肿瘤中富含巨噬细胞的CN7的比例明显高于STS肿瘤(图2)。gydF4y2Ba3 dgydF4y2Ba).此外,使用这个改进的队列,我们证实了CN7和改善生存率之间的关联(图7)。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba9克gydF4y2Ba).这与我们使用可变数量相互作用细胞的邻域分析一致,其中m1样MDMs富集的CNs与延长生存有关(扩展数据图)。gydF4y2Ba7gydF4y2Ba).值得注意的是,CN2和CN9(泛免疫热点)也与生存率的提高有关(图2)。gydF4y2Ba3 egydF4y2Ba);细胞动力学分析显示CD4细胞数量升高gydF4y2Ba+gydF4y2Ba与STS肿瘤相比,LTS肿瘤中的T细胞(补充图。gydF4y2Ba10克ydF4y2Ba),并在CN2和CN9中富集(图。gydF4y2Ba3 bgydF4y2Ba).这些数据表明,T细胞邻近区在胶质母细胞瘤中具有潜在的有益作用,尽管它们的频率较低。gydF4y2Ba
我们关注CN7在胶质母细胞瘤中的预后相关性,因为与其他cnn相比,CN7与生存最一致。此外,鉴于有前景的临床前研究,在临床环境中靶向脑肿瘤中的巨噬细胞正受到越来越多的关注gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.为了确定周围的巨噬细胞身份,我们从胶质母细胞瘤样本中提取了所有巨噬细胞和单核细胞亚群,并进行了实验gydF4y2BatgydF4y2Ba-随机邻域嵌入(gydF4y2BatgydF4y2Ba-SNE)的降维和基于表型标记的谱聚类(图。gydF4y2Ba3 fgydF4y2Ba).与STS肿瘤相比,LTS肿瘤中细胞簇(CL) 1-3显著富集(图2)。gydF4y2Ba3 ggydF4y2Ba和补充图。gydF4y2Ba11gydF4y2Ba),其中大部分是CD163gydF4y2Ba−gydF4y2BaP2Y12gydF4y2Ba−gydF4y2Ba,提示m1样MDM表型(图。gydF4y2Ba3 hgydF4y2Ba).然而,它们共表达CD206,这表明这些细胞不遵循M1/M2范式,不像其他CD206高的细胞群富集CD163gydF4y2Ba+gydF4y2Ba细胞(例如CL11-15;无花果。gydF4y2Ba3 hgydF4y2Ba).在比较CL1-3在每个CN中的相对表示(图。gydF4y2Ba3 bgydF4y2Ba),我们观察到CN7在LTS肿瘤患者中特别富集(图。gydF4y2Ba3我gydF4y2Ba).总之,这些数据表明巨噬细胞的空间关系可能包含关键的预后信息,因为我们已经确定了一个与长期生存相关的独特的巨噬细胞富集区域,这在这种疾病中是罕见的。gydF4y2Ba
MPOgydF4y2Ba+gydF4y2Ba巨噬细胞与生存有关gydF4y2Ba
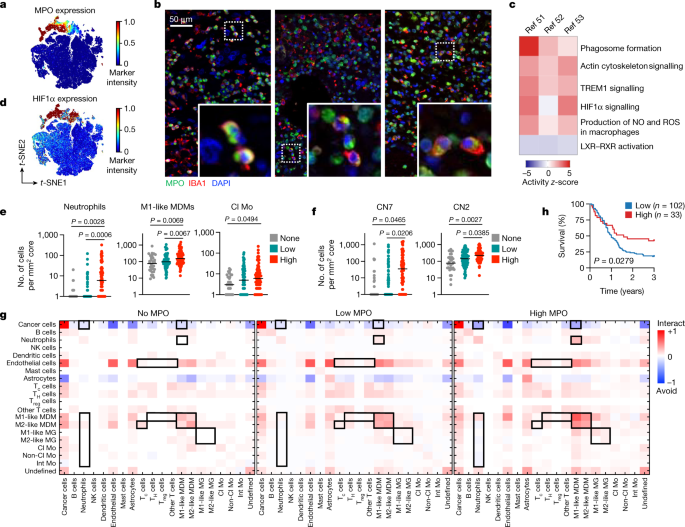
鉴于CL1-3巨噬细胞与LTS肿瘤之间的关系,我们探讨了它们的假定功能。CL1-3巨噬细胞表达高水平的MPO(图;gydF4y2Ba4gydF4y2Ba),以及超过80%的MPOgydF4y2Ba+gydF4y2Ba巨噬细胞为CD163gydF4y2Ba−gydF4y2BaP2Y12gydF4y2Ba−gydF4y2Ba(扩展数据图。gydF4y2Ba10 a, bgydF4y2Ba),提示促炎表型主要由外周衍生的MDMs主导。MPO常被用作中性粒细胞的标记物,它介导活性氧和氧化爆发的产生。尽管巨噬细胞内的MPO染色可能部分反映了嗜中性粒细胞吞噬作用的增强,gydF4y2BaMPOgydF4y2Ba在脑肿瘤MDMs中也可检测到转录本(扩展数据图。gydF4y2Ba10 cgydF4y2Ba)和外周单核细胞(扩展数据图。gydF4y2Ba10 dgydF4y2Ba)达到与中性粒细胞相当的水平。事实上,中性粒细胞样单核细胞和巨噬细胞已经在一些免疫病理背景下被确认,包括动脉粥样硬化gydF4y2Ba44gydF4y2Ba,存在gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba还有肺癌gydF4y2Ba47gydF4y2Ba.它们可能来自单核细胞发育轨迹的转变,有利于粒细胞-单核细胞祖细胞(GMP)衍生的谱系gydF4y2Ba48gydF4y2Ba或通过组织小生境内的MPO诱导。我们确认了MPO的存在gydF4y2Ba+gydF4y2BaIBA1gydF4y2Ba+gydF4y2Ba胶质母细胞瘤肿瘤中的巨噬细胞使用免疫荧光(图。gydF4y2Ba4 bgydF4y2Ba;为了验证目的,IBA1被用作CD68的替代巨噬细胞标记)。利用来自胶质母细胞瘤患者的单细胞rna测序数据集,我们确定了MPO富集的基因gydF4y2Ba+gydF4y2Ba巨噬细胞对MPOgydF4y2Ba−gydF4y2Ba巨噬细胞(扩展数据图。gydF4y2Ba10 egydF4y2Ba).差异表达最多的基因是gydF4y2BaS100A8gydF4y2Ba而且gydF4y2BaS100A9gydF4y2Ba, gmp衍生谱系的标记gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.我们观察到活性氧生物合成和吞噬体形成(表明细胞毒性)以及HIF1α信号(表明与血管的距离)相关的特征(图。gydF4y2Ba4摄氏度gydF4y2Ba).一致,MPOgydF4y2Ba+gydF4y2Ba与MPO相比,巨噬细胞与内皮细胞相互作用的可能性较小gydF4y2Ba−gydF4y2Ba巨噬细胞(扩展数据图。gydF4y2Ba10 fgydF4y2Ba),与CL1-3中富集的HIF1α相一致(图1 - 3)。gydF4y2Ba4 dgydF4y2Ba).我们还看到了降低的LXR-RXR信号。gydF4y2Ba4摄氏度gydF4y2Ba),表明这些细胞内脂肪酸代谢的改变与它们在动脉粥样硬化中避免脂肪条纹是一致的gydF4y2Ba44gydF4y2Ba.这些数据表明,尽管在TME中很少见,MPOgydF4y2Ba+gydF4y2Ba巨噬细胞可能具有抗肿瘤特性。gydF4y2Ba
一个gydF4y2Ba,投影到a上的MPO表达热图gydF4y2BatgydF4y2Ba-SNE映射(图;gydF4y2Ba3 fgydF4y2Ba)胶质母细胞瘤患者单核细胞和巨噬细胞(gydF4y2BangydF4y2Ba= 192张图像中的93,513个细胞)。gydF4y2BabgydF4y2Ba代表性免疫组织荧光(IHF)图像显示MPO和IBA1(巨噬细胞标记物)在胶质母细胞瘤肿瘤中共定位。展开的区域显示MPO的示例gydF4y2Ba+gydF4y2Ba巨噬细胞(gydF4y2BangydF4y2Ba= 5张图片)。gydF4y2BacgydF4y2BaMPO富集通路的匠心通路分析gydF4y2Ba+gydF4y2Ba与MPOgydF4y2Ba−gydF4y2Ba来自三个公开数据集的巨噬细胞gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.gydF4y2BadgydF4y2Ba, HIF1α表达投射到a上gydF4y2BatgydF4y2Ba胶质母细胞瘤患者单核细胞和巨噬细胞的-SNE图(gydF4y2BangydF4y2Ba= 192张图像中的93,513个细胞)。gydF4y2BaegydF4y2Ba,每1mm的细胞数gydF4y2Ba2gydF4y2Ba胶质母细胞瘤样本中零(gydF4y2BangydF4y2Ba= 32张图片),低(gydF4y2BangydF4y2Ba= 79张图片)或高(gydF4y2BangydF4y2Ba= 81张图片)MPOgydF4y2Ba+gydF4y2BaM1-like mdm。该图显示了平均值(黑色水平线)和所有数据点;单向方差分析;数据以对数尺度表示,因此具有0单元格的图像被赋值为1。gydF4y2BafgydF4y2Ba,每1mm中每个细胞邻近的原始细胞数gydF4y2Ba2gydF4y2Ba胶质母细胞瘤患者核(gydF4y2BangydF4y2Ba= 32张图片gydF4y2Ba)gydF4y2Ba,低(gydF4y2BangydF4y2Ba= 79张图片)或高(gydF4y2BangydF4y2Ba= 81个图像)MPO的数量gydF4y2Ba+gydF4y2BaM1-like mdm。该图显示了平均值(黑色水平线)和所有数据点;单向方差分析;单元格为0的图像被赋值为1。gydF4y2BaggydF4y2Ba,对于MPO为零、低或高的患者,对单个图像进行双向排列测试(每个图像1000个排列)的成对相互作用gydF4y2Ba+gydF4y2BaM1-like mdm。红色,交互(交互);蓝色,回避(避免)。gydF4y2BahgydF4y2Ba,基于MPO的Kaplan-Meier分析gydF4y2Ba+gydF4y2BaIBA1gydF4y2Ba+gydF4y2Ba通过IHF染色测定135例胶质母细胞瘤患者肿瘤的细胞频率(gydF4y2BazgydF4y2Ba分数)。当多个样本对应于同一个体时,细胞频率被平均。Log-rank (Mantel-Cox)检验。gydF4y2Ba
接下来,我们根据MPO的中位密度对组织进行分类gydF4y2Ba+gydF4y2Bam1样MDM:无,低(每mm 1-5个细胞)gydF4y2Ba2gydF4y2Ba)和高(每毫米6个或更多细胞gydF4y2Ba2gydF4y2Ba).更高的MPO数字gydF4y2Ba+gydF4y2Ba巨噬细胞与总中性粒细胞、m1样MDMs和经典单核细胞的增加相对应(图。gydF4y2Ba4 egydF4y2Ba),支持了这样一种观点,即这些肿瘤可能会引发强烈的先天效应反应。我们还比较了CN的患病率,发现CN7(巨噬细胞富集,正如预期的那样)和CN2(泛免疫热点)相关的细胞富集(图2)。gydF4y2Ba4 fgydF4y2Ba),两者都为患者提供了显著的生存益处(图。gydF4y2Ba3 egydF4y2Ba).为了深入了解肿瘤结构,我们比较了MPO类别中主要免疫谱系之间的空间相互作用。随着MPO的密度增加,癌细胞对中性粒细胞和m1样MDMs有更大的回避倾向gydF4y2Ba+gydF4y2Ba巨噬细胞增加(图;gydF4y2Ba4 ggydF4y2Ba).事实上,大多数髓系细胞群避免中性粒细胞作为MPOgydF4y2Ba+gydF4y2Ba巨噬细胞密度增加,但m1样MDMs除外(图。gydF4y2Ba4 ggydF4y2Ba).中性粒细胞与MPO的关系gydF4y2Ba+gydF4y2Ba免疫组织荧光证实巨噬细胞为高MPO样本gydF4y2Ba+gydF4y2BaIBA1gydF4y2Ba−gydF4y2Ba中性粒细胞也有较高的MPOgydF4y2Ba+gydF4y2BaIBA1gydF4y2Ba+gydF4y2Ba巨噬细胞(扩展数据图。gydF4y2Ba10克gydF4y2Ba).同理,MPO的相互作用分析gydF4y2Ba+gydF4y2Bam1样MDMs显示了与中性粒细胞和m1样小胶质细胞的相互作用(扩展数据图。gydF4y2Ba10 hgydF4y2Ba),与我们的CN发现相呼应(扩展数据图。gydF4y2Ba8gydF4y2Ba).MPO的密度更高gydF4y2Ba+gydF4y2Ba巨噬细胞还与内皮细胞和m1样MDMs与T细胞之间相互作用的增加有关,同时与m2样MDMs与CD8之间相互作用的减少有关gydF4y2Ba+gydF4y2BaT细胞(图;gydF4y2Ba4 ggydF4y2Ba),可在癌症中发挥免疫调节作用。在巨噬细胞室中,MDMs之间的关联增加,而在小胶质细胞中相对不明显。gydF4y2Ba4 ggydF4y2Ba)——这表明,组织常驻细胞与单核细胞来源的巨噬细胞的动态变化可能对肿瘤生物学有不同的影响,正如临床前模型所表明的那样gydF4y2Ba41gydF4y2Ba.这些数据说明了随着MPO密度的变化,TME成分的逐渐变化gydF4y2Ba+gydF4y2Ba巨噬细胞。gydF4y2Ba
最后,为了进一步探讨临床相关性,我们证实了MPO水平的升高gydF4y2Ba+gydF4y2BaCD163gydF4y2Ba−gydF4y2BaP2Y12gydF4y2Ba−gydF4y2BaCD68gydF4y2Ba+gydF4y2Ba在我们平衡的胶质母细胞瘤队列中,巨噬细胞与延长生存期相关(扩展数据图。gydF4y2Ba10我gydF4y2Ba).复发性胶质母细胞瘤中MPO含量较少gydF4y2Ba+gydF4y2BaCD163gydF4y2Ba−gydF4y2BaP2Y12gydF4y2Ba−gydF4y2BaCD68gydF4y2Ba+gydF4y2Ba与STS或LTS肿瘤相比的巨噬细胞(扩展数据图。gydF4y2Ba10 jgydF4y2Ba).为了使用低plex技术检验我们发现的实用性,我们对MPO和IBA1进行了免疫组织荧光共染色,以评估135例胶质母细胞瘤患者的生存结果。作为MPO的绝大多数(83.96%)gydF4y2Ba+gydF4y2Ba巨噬细胞是CD163gydF4y2Ba−gydF4y2Ba和P2Y12gydF4y2Ba−gydF4y2Ba(扩展数据图。gydF4y2Ba10gydF4y2Ba), MPO联合IBA1足以证实高频率双阳性细胞患者的生存期显著延长(图。gydF4y2Ba4 hgydF4y2Ba).先前的研究表明,脑肿瘤中的巨噬细胞积累与晚期疾病有关gydF4y2Ba24gydF4y2Ba,我们的发现突出了MPOgydF4y2Ba+gydF4y2Ba与意外生存效益相关的亚群体。这表明,广泛针对胶质母细胞瘤巨噬细胞的治疗可能会耗尽有益的巨噬细胞亚群,这为使用CSF-1R抑制剂的临床试验增加了见解,这些试验在很大程度上是不成功的gydF4y2Ba50gydF4y2Ba,并加深了我们对这种疾病中巨噬细胞复杂性的理解。gydF4y2Ba
讨论gydF4y2Ba
我们使用IMC提供了大脑TME的高维空间图。我们对胶质母细胞瘤和BrM的细胞动力学、相互作用和邻近区进行了全面分析,并将胶质母细胞瘤的空间特征与患者生存期相关联。我们定义了在疾病状态和地区普遍存在的多细胞结构,与单独的细胞频率相比,它在预测患者生存方面更胜一筹。我们发现了一个独特的中性粒细胞样巨噬细胞亚群,其MPO染色呈阳性,这似乎有利于胶质母细胞瘤患者的生存。我们推测,宿主免疫倾向于gmp衍生的中性粒细胞样状态可能有利于患者的预后gydF4y2Ba48gydF4y2Ba.或者,编程巨噬细胞采用中性粒细胞样特征或增强吞噬作用可能发生在特定的肿瘤生态位内。我们的数据集增加了越来越多的证据,即肿瘤在细胞水平上的空间组织对于理解控制癌症的免疫机制至关重要。鉴于脑肿瘤患者的治疗选择有限,预后不佳,在理解大脑TME的空间结构如何与肿瘤生物学相关,以及是否可以利用特定的免疫细胞亚群来改善结果方面,仍有未开发的转化价值。gydF4y2Ba
方法gydF4y2Ba
IMC临床样本gydF4y2Ba
在2006年至2019年期间,185名患者接受了原发性脑肿瘤(BrM)手术切除。在本研究中使用的肿瘤样本的患者分解可以在扩展数据图中找到。gydF4y2Ba1gydF4y2Ba.所有患者的临床资料均来自手术和病理报告。所有来自胶质母细胞瘤患者的肿瘤样本都是未经治疗的,并在初次手术去体积后由认证的神经病理学家(M.C.G.)进行分类。在第二次随访手术(残余肿瘤)或肿瘤复发(复发肿瘤)期间切除一部分肿瘤。根据世界卫生组织2021年指南gydF4y2Ba23gydF4y2Ba,以前归类为IDH突变型胶质母细胞瘤的肿瘤现在被认为是IV级IDH突变型星形细胞瘤;因此,在本研究中,只有IV级IDH野生型肿瘤被指定为胶质母细胞瘤。我们进一步区分了由II/III级肿瘤进展导致的胶质母细胞瘤(扩展数据图。gydF4y2Ba1gydF4y2Ba).LTSs定义为总生存期大于3年(远长于预期生存期)的患者,STSs定义为总生存期小于1年(短于预期生存期)的患者。脑转移样本gydF4y2Ba54gydF4y2Ba从病人的肺(gydF4y2BangydF4y2Ba= 51张图片),乳房(gydF4y2BangydF4y2Ba= 29张)和黑色素瘤(gydF4y2BangydF4y2Ba= 19张图片)原发肿瘤以及少量膀胱、结肠直肠、胃、胃肠和卵巢肿瘤,统称为“其他”(gydF4y2BangydF4y2Ba= 20张图像)。术前MRI图像由神经放射学家(S.L.)用于确定瘤周水肿的程度(评分0-3)。Leptomeningeal疾病gydF4y2Ba55gydF4y2Ba由神经放射学家(S.L.)通过MRI检查蛛网膜下腔或脑室的对比增强病变确定。所有患者手术后均接受标准护理(SOC),除非另有规定。从福尔马林固定、石蜡包埋(FFPE)的组织块中取出核(直径1-1.5 mm),并组装成组织微阵列(TMAs)。在胶质瘤队列中,我们包括肿瘤邻近的“正常”组织以及从肿瘤体中提取的原发性脑肿瘤样本,这些样本由神经病理学家(M.C.G.)使用相应的苏木精和伊红(H&E)染色确认。BrM样本从肿瘤体和/或肿瘤-脑界面(分别称为BrM-核心和BrM-边缘)提取。185例患者共采集了242个组织区域,包括139个高级别胶质瘤,18个胶质瘤邻近正常,41个brm核心和44个brm边缘。在这242个区域中,142个是重复采样,2个是三重复采样,共389个核。此外,39例BrM患者的核缘对匹配。所有手术标本和临床资料均经患者书面知情同意后获得。临床信息按照麦吉尔大学和蒙特利尔神经学研究所-医院(REB: nue -10-066, 2018-4150)的机构审查委员会去识别和使用。gydF4y2Ba
抗体的优化gydF4y2Ba
对照组织包括脾脏、扁桃体、淋巴结、肝脏、肾脏、正常肺、正常脑、肺癌、胶质母细胞瘤和/或BrM。在扩展数据图。gydF4y2Ba3gydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba,我们展示了我们小组中所有标记物的免疫组织荧光(IHF)和IMC染色的代表性优化图像,但有一些例外:IHF不用于市售的共轭金属同位素抗体(CD20和CD45除外;IHF使用非偶联型),Ki67不进行IHF,因为常规使用B56克隆。所有抗体的列表可在补充表中找到gydF4y2Ba1gydF4y2Ba.对于IHF染色,根据制造商说明,使用Ventana Discovery Ultra自动染色平台(Roche Diagnostics)对FFPE切片进行脱亲和和热介导抗原提取。FFPE载玻片在70°C的预配制EZ Prep溶液中孵育(Roche Diagnostics),然后在95°C的预配制Cell Conditioning 1溶液中孵育(Roche Diagnostics),总运行时间约2.5 h。用1× PBS冲洗载玻片,在Dako无血清蛋白块溶液(安捷伦)中室温孵育1小时。在Dako antibody dilent中制备抗体鸡尾酒,载玻片与一抗在4°C下孵育一夜。用1× PBS冲洗载玻片,用Dako antibody dilent配制的二抗鸡尾酒室温孵育1 h。载玻片在室温下用DAPI复染5分钟,并使用Dako安装介质安装。使用AxioScan Z1扫描仪捕获组织图像。gydF4y2Ba
免疫染色和IMCgydF4y2Ba
根据制造商说明书,使用Ventana Discovery Ultra自动染色平台(Roche Diagnostics)对FFPE TMA玻片进行脱亲和和热介导抗原提取。FFPE载玻片在70°C的预配制EZ Prep溶液中孵育(Roche Diagnostics),然后在95°C的预配制Cell Conditioning 1溶液中孵育(Roche Diagnostics),总运行时间约2.5 h。用1× PBS冲洗载玻片,在Dako无血清蛋白块溶液(安捷伦)中室温孵育45分钟。在Dako抗体稀释液中以最佳稀释度制备了含有金属偶联抗体的抗体鸡尾酒。载玻片4℃一抗染色过夜,用0.2% Triton X-100和1× PBS清洗。在Dako antibody dilent中按优化的稀释度制备了含有金属偶联抗生物素的二抗鸡尾酒。抗生物素室温孵育1 h后,用0.2% Triton X-100和1× PBS冲洗。将载玻片用Cell-ID Intercalator-Ir (Fluidigm)在1× PBS中以1:400稀释,在室温下反染30分钟,用蒸馏水冲洗5分钟,风干后进行IMC采集。IMC采集使用Hyperion成像系统(Fluidigm)进行。gydF4y2Ba
数据转换和规范化gydF4y2Ba
所有IMC数据均未进行转换,分析均基于原始测量。单细胞标记表达式由每个通道的平均像素值总结。对于热图可视化,表达数据归一化到第95百分位和gydF4y2BazgydF4y2Ba绘制-得分的聚类均值。gydF4y2Ba
细胞分割和谱系分配gydF4y2Ba
所有谱系和功能标记在细胞分割前进行染色质量检查。一部分功能标记物通过了初始质量控制,但与IMC染色不一致,随后从分析中移除(GM-CSF-R, M-CSF-R, PD-1, PD-L1和CTLA-4;见补充图。gydF4y2Ba1gydF4y2Ba).细胞分割是使用经典和现代基于机器学习的计算机视觉算法的组合完成的。该管道能够实现高通量分割,并准确地解决不同组织和结构中的单个细胞。重要的是,该算法完全自动化了细胞检测,从而消除了主观偏见。对DNA通道进行预处理,用于核分割,以使用广义高斯分布(MoGG)的混合物获得感兴趣的前景区域。通道也被平铺以进行分割,因此我们可以将它们作为推断的输入传递给MaskRCNN模型。我们的分割和图像分析管道的详细描述是可用的gydF4y2Ba56gydF4y2Ba.为了分配细胞表型,我们建立了一种基于典型谱系标记、预期种群丰度、染色质量和细胞谱系成熟度的监督方法(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).我们首先使用gydF4y2BakgydF4y2Ba聚类则gydF4y2Ba57gydF4y2Ba以及广义高斯模型的混合gydF4y2Ba58gydF4y2Ba根据每个标记的染色强度创建多级图像堆栈。使用以下步骤,根据6个级别的考虑,为面板中的每个谱系标记策划掩码。(1)灰度图像通道用3 × 3窗口大小的中值滤波器进行卷积。(2)将每个像素聚为6组强度级别gydF4y2BakgydF4y2Ba则算法。(3)对于每个通道,我们选择所有达到特定级别的组作为前景(1),其余指定为背景(0)。(4)我们应用形态学斑点去除来获得更平滑的二进制掩码,其中特定区域的二进制斑点从掩码中去除以避免噪声区域。(5)为了进一步提高选择标记的准确性,通过计算使用自适应二值化方法获得的额外二进制掩码,对额外的信道特定形态操作进行计算,灵敏度为0.4。然后将此掩码与步骤4中获得的掩码合并。(6)为了增强选定通道的图像强度,我们应用了一个简单的对比度增强滤波器,通过饱和特定通道像素的底部和顶部强度级别。这一过程使我们能够在对核心细胞进行表型分析时从通道中捕获更准确的掩码。gydF4y2Ba
谱系分配的方法用下面的公式表示:对于每个单元格gydF4y2BacgydF4y2Ba我gydF4y2Ba我们考虑每个谱系标记的策展掩码gydF4y2Ba米gydF4y2BakgydF4y2Ba,在那里gydF4y2BakgydF4y2Ba= 1,…,gydF4y2BangydF4y2Ba而且gydF4y2BangydF4y2Ba是谱系标记的数量。让我们假设gydF4y2Ba\ (p {} _ {{c} _{我}}^ {j} \)gydF4y2Ba是gydF4y2BajgydF4y2BathgydF4y2Ba的周围的像素gydF4y2BacgydF4y2Ba我gydF4y2Ba并且每个像素具有以下基于谱系标记的存在向量:gydF4y2Ba
在哪里gydF4y2Ba\ (p {} _ {{M} _{我}}= \{{或}\ 0 \ \文本,1 \}\)gydF4y2Ba,决定像素是否gydF4y2Ba\ (p {} _ {{c} _{我}}^ {j} \)gydF4y2Ba是阳性的特定标记。接下来,为了确定单元格中的每个像素对于给定的标记是正的还是负的,我们通过对所有向量的存在求和来确定多数向量:gydF4y2Ba
在哪里gydF4y2Ba\ ({N} _ {{c} _{我}}\)gydF4y2Ba单元格中的像素数是多少gydF4y2BacgydF4y2Ba我gydF4y2Ba.向量中的最大值gydF4y2Ba\ ({} _ {{c} _{我}}\)gydF4y2Ba确定单元格类型分配。细胞谱系按等级优先顺序分配(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
所有用于执行这些分析的代码都可以在gydF4y2Bahttps://github.com/walsh-quail-labs/IMC-BraingydF4y2Ba.gydF4y2Ba
细胞-细胞对相互作用分析gydF4y2Ba
为了确定细胞类型之间重要的成对相互作用和避免行为,我们进行了先前描述的单细胞相互作用的排列测试gydF4y2Ba11gydF4y2Ba,gydF4y2Ba59gydF4y2Ba.6像素半径(6µm)内的细胞被认为是相互作用的。重要的互动或回避行为被定义为有gydF4y2BaPgydF4y2Ba-value小于0.01。gydF4y2Ba
细胞邻居识别gydF4y2Ba
为了识别空间单元邻居,我们首先计算邻居窗口,我们将其定义为(gydF4y2BaNgydF4y2Ba)中最接近每个单元格的单元格(如所示),如前所述gydF4y2Ba60gydF4y2Ba.每个窗口都是一个频率矢量,由的类型组成gydF4y2BaNgydF4y2Ba最接近给定单元格的单元格。邻居的窗户都挤在一起。在胶质母细胞瘤和brm核上的细胞邻域发现(于2021年进行)是使用Scikit-learn进行的,这是一种Python软件机器学习库。聚类使用MiniBatchKMeans聚类算法0.24.2,默认批大小为100,random_state = 0。brm边缘被排除在细胞邻域发现之外,因为它们的肿瘤与基质含量的混合是可变的。仅在胶质母细胞瘤核心上的细胞邻域分析(于2022年执行)使用MiniBatchKMeans聚类算法1.1.2版本,默认批大小为1024,random_state = 0。然后,每个细胞被分配到一个特定的细胞邻居基于他们的邻居窗口。每个核心的细胞邻域流行率被归一化,因此该核心的细胞邻域流行率之和为100%。当时的价值观gydF4y2BazgydF4y2Ba-得分和核心与gydF4y2BazgydF4y2Ba-得分高于或等于0和低于0的患者进行生存结果比较。gydF4y2Ba
IMC生存分析gydF4y2Ba
胶质母细胞瘤生存分析使用临床对照队列进行,这些患者在治疗前接受了肿瘤全切除,经术后MRI证实,并接受了SOC治疗(扩展数据图)。gydF4y2Ba9 fgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba).总生存期从手术日期到死亡日期计算。对于死亡日期未明确的胶质母细胞瘤患者,使用其最后一次已知随访的日期来估计总生存期。对于BrM生存分析,在术前未经治疗的病灶中评估局部无复发生存,并经术后MRI证实为完全宏观全切除术。对于所有Kaplan-Meier分析,当从同一患者的肿瘤中收集多个核时,图像被平均(即,每个患者在分析中只有一个生存值)。gydF4y2Ba
tgydF4y2Ba新力gydF4y2Ba
使用默认参数,gydF4y2BatgydF4y2Ba-SNE降维图在MATLAB中生成(版本2019b)。聚类使用定制的高维基于光谱的聚类算法,由于我们的细胞的诅咒维数(百万数量级的细胞)。在我们定制的算法中,我们首先使用DBSCAN来隔离具有相似密度的集群(每个集群的最大距离为3个像素的最小数量为30个点的固定参数)。这种方法产生了一些小的和一些大的星团,它们的密度彼此相似。然后使用谱聚类算法对大聚类组进行重新聚类。为了能够在我们的海量维度数据上实现光谱聚类结果,我们对数据进行了子抽样(子抽样率为10),这为我们提供了数据的整体形状。然后,我们用光谱聚类得到的聚类标签为每个聚类分配。最后,我们拟合一个gydF4y2BakgydF4y2Ba-最近邻分类器(与gydF4y2BakgydF4y2Ba= 5)到我们标记的次采样数据,以识别所有样本的聚类标签。用于gydF4y2BatgydF4y2Ba-SNE分析包括CD14, CD16, CD68, CD163, P2Y12, CC3, Ki67, CD40, CD206, HIF1α, MMP9, MPO, OX40L和pSTAT3。为了可视化,表达式数据归一化到第95百分位。gydF4y2Ba
Immunohistofluorescence co-staininggydF4y2Ba
FFPE组织切片脱蜡,在pH为6.0的柠檬酸缓冲液或pH为9.0的EDTA缓冲液中进行热介导抗原回收。用Power Block在室温下阻断载玻片5分钟,再用一抗在室温下孵育30分钟。用TBS-T冲洗载玻片,随后在室温下用第二抗体-辣根过氧化物酶(HRP)孵育30分钟。用TBS-T冲洗载玻片,用Opal荧光团工作溶液染色10分钟(AKOYA Biosciences;蛋白石520:FP1487001KT,批次202212718;蛋白石570:FP1488001KT,批次20212821)。随后进行热介导抗体剥离去除一抗和二抗。对每个一抗重复这些步骤,共进行两轮标记:MPO, Abcam, EPR20257, ab208670, lot gr3390666 - 13,1:50 0;IBA1, fujifilwako Pure Chemicals,多克隆,019-19741,lot 41375175,1:400;马抗兔IgG HRP聚合物试剂盒,Vector Laboratories, MP-7801, lot ZH0611, 1:1。gydF4y2Ba
在进行多路复用之前,分别优化抗体特异性和稀释度。使用AxioScan Z1扫描仪捕获组织图像,并使用HALO软件(3.5版)进行处理。gydF4y2Ba
IHF临床样本gydF4y2Ba
包含胶质母细胞瘤原发肿瘤样本的组织微阵列来自麦吉尔大学(魁北克,加拿大)、卡尔加里大学(阿尔伯塔,加拿大)和荷兰癌症研究所(NKI,阿姆斯特丹,荷兰)。所有患者之前均未接受治疗,经认证的神经病理学家在初次手术去体积后将其归类为IDH野生型胶质母细胞瘤,随后进行SOC治疗。所有患者信息和组织均经书面知情同意后获得,并按照以下伦理监督使用。gydF4y2Ba
麦吉尔大学gydF4y2Ba
ngydF4y2Ba= 2006-2019年间70例患者接受手术切除;麦吉尔大学卫生中心和蒙特利尔神经学研究所和医院机构审查委员会(nue -10-066, 2018-4150);神经病理学家检查所有病例并提供TMA (M.C.G.)。这些样本代表了我们基于TMA上组织可用性的原始IMC队列的一个子集(使用了一个独立的切片)。生存<1年,gydF4y2BangydF4y2Ba= 25例;存活1-3年,gydF4y2BangydF4y2Ba= 18例;存活>3年gydF4y2BangydF4y2Ba= 27例。gydF4y2Ba
卡尔加里大学gydF4y2Ba
ngydF4y2Ba= 2002年至2020年,58例患者接受手术切除;艾伯塔省卫生研究伦理委员会、癌症委员会(HREBA.CC-16-0762)、克拉克·史密斯肿瘤生物库;神经病理学家审查所有病例并提供TMA (J.A.C.)。生存<1年,gydF4y2BangydF4y2Ba= 31例;存活1-3年,gydF4y2BangydF4y2Ba= 23例;存活>3年gydF4y2BangydF4y2Ba= 4例。gydF4y2Ba
NKI队列gydF4y2Ba
ngydF4y2Ba= 7例;NKI-AvL和nki生物库机构审查委员会(CFMPB541);TMA由D.B.提供生存<1年gydF4y2BangydF4y2Ba= 5例;存活1-3年,gydF4y2BangydF4y2Ba= 1例;> 3年,gydF4y2BangydF4y2Ba= 1例。gydF4y2Ba
公开的rna测序数据gydF4y2Ba
单细胞rna测序数据集从以下下载。gydF4y2Ba
- (1)gydF4y2Ba
GSE154795 (ref。gydF4y2Ba51gydF4y2Ba) (GSE154795_GBM.AllCell.Integrated.Scaled.ClusterRes.0.1.rds.gz)。使用Seurat对象文件gse154795_gbm . allcell . integrated . scaling . clusters .0.1。rds,创建了一个新的Seurat对象(Seurat 4.1.1),使用来自14例新患胶质母细胞瘤患者子集的RNA检测计数,并使用Seurat函数NormalizeData的默认参数进行归一化。gydF4y2Ba
- (2)gydF4y2Ba
GSE162631 (ref。gydF4y2Ba53gydF4y2Ba) (GSE162631_raw_counts_matrix.zip.gz)。使用Seurat 4.1.1从表达式矩阵计数文件中创建一个Seurat对象,参数min.cells = 0, min.features = 200。使用Seurat函数NormalizeData的默认参数对计数进行标准化。gydF4y2Ba
- (3)gydF4y2Ba
https://doi.org/10.17605/OSF.IO/4Q32EgydF4y2Ba52gydF4y2Ba.使用Seurat对象文件Seurat . obj_mnn_ref。RDS,一个新的Seurat对象是使用Seurat 4.1.1与源Seurat对象的RNA检测计数创建的,并使用Seurat函数NormalizeData的默认参数进行归一化。gydF4y2Ba
每个数据集的mdm被描述为gydF4y2BaCD68gydF4y2Ba高gydF4y2Ba(归一化表达式>0)和gydF4y2BaP2RY12gydF4y2Ba低gydF4y2Ba(归一化表达<0.1),并被分离出来用于进一步的下游分析。mdm被细分为gydF4y2BaMPOgydF4y2Ba高gydF4y2Ba(归一化表达>0.05)或gydF4y2BaMPOgydF4y2Ba低gydF4y2Ba(归一化表达<0.05)。对于每个病人,一个平均表达矩阵是由gydF4y2BaMPOgydF4y2Ba高gydF4y2Ba而且gydF4y2BaMPOgydF4y2Ba低gydF4y2Bamdm。在Seurat的FindMarkers函数被用来生成一个差异表达基因之间的列表gydF4y2BaMPOgydF4y2Ba高gydF4y2Ba而且gydF4y2BaMPOgydF4y2Ba低gydF4y2Bamdm。使用匠心通路分析软件v.01-13 (Qiagen)评估通路富集程度。差异表达基因(调整gydF4y2BaPgydF4y2Ba< 0.05)为每个数据集选择,“核心分析”与所有默认参数一起使用。gydF4y2Ba
还使用了以下数据。血液中人类免疫细胞的转录组数据gydF4y2Ba61gydF4y2Ba,透过人类蛋白质图谱(gydF4y2Bahttps://www.proteinatlas.org/ENSG00000005381-MPO/immune+cellgydF4y2Ba);恶性胶质瘤rna测序数据来自The Cancer Genome Atlas (TCGA Firehose Legacy),通过cBioPortal for Cancer genomics (gydF4y2Bahttps://www.cbioportal.orggydF4y2Ba);以及来自脑肿瘤免疫细胞的大量rna测序数据gydF4y2Ba16gydF4y2Ba,通过gydF4y2Bahttps://joycelab.shinyapps.io/braintime/gydF4y2Ba.gydF4y2Ba
统计和再现性gydF4y2Ba
所有图像分析步骤均在MATLAB(版本2019b)和Python(版本3.7.12)中完成。使用GraphPad Prism 9统计软件进行统计分析。gydF4y2BaP -gydF4y2Ba<0.05为显著,数据以均数±s.e.m表示。除非图形图例中另有说明。采用Shapiro-Wilk检验检验正态分布。参数数据用Student 's进行分析gydF4y2BatgydF4y2Ba-test,单向或双向方差分析。非参数资料采用Mann-Whitney检验;对于大样本量比较,使用Student 'sgydF4y2BatgydF4y2Ba使用-testgydF4y2Ba62gydF4y2Ba.生存数据通过log-rank (Mantel-Cox)检验进行分析,如相关图例所示。用Fisher精确检验分析列联表。Tukey 's检验用于多重比较。对于所有与生存相关的分析,包括Kaplan-Meier分析和LTS和STS队列,当从同一患者的肿瘤中收集多个核心时,图像平均,以防止结果偏向于具有更多图像的个体。所有其他与生存无关的分析(例如,种群动态)都是使用单个图像进行的,以适当地捕获TME内的异质性。使用ImageJ (version 1.53k)对IMC图像进行区域分析。所有抗体优化都至少用IHF重复两次,用IMC重复两次,使用各种各样的组织,如图扩展数据图所示。gydF4y2Ba3 gydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba.其他有代表性的IMC图像(包括图。gydF4y2Ba1 bgydF4y2Ba,扩展数据图。gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba10 bgydF4y2Ba和补充图。gydF4y2Ba3 gydF4y2Ba)从总共389张图像中选择,并描述所描述的统计变化和/或染色质量;所有纳入分析的样品均获得了相似的染色质量结果。所有其他代表性免疫染色(图。gydF4y2Ba4 bgydF4y2Ba扩展数据图gydF4y2Ba10克gydF4y2Ba和补充图。gydF4y2Ba2gydF4y2Ba)在至少五个完整的组织样本上进行了类似的结果。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的来源数据,包括高维TIFF图像和IMC对应的临床信息,已存入gydF4y2Bahttps://doi.org/10.5281/zenodo.7383719gydF4y2Ba.原始原始影像资料可根据合理要求直接从作者处获得。gydF4y2Ba
代码的可用性gydF4y2Ba
所有原始代码都保存在GitHub,可以通过以下方式访问:gydF4y2Bahttps://github.com/walsh-quail-labs/IMC-BraingydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Quail, d.f. & Joyce, j.a .肿瘤进展和转移的微环境调控。gydF4y2BaNat,地中海。gydF4y2Ba19gydF4y2Ba, 1423-1437(2013)。gydF4y2Ba
Binnewies等人。了解肿瘤免疫微环境(TIME)有助于有效治疗。gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba541-550(2018)。gydF4y2Ba
巴斯兰,T. &希克斯,J.用单细胞测序解开生物学和改变癌症的范式。gydF4y2BaNat. Rev. CancergydF4y2Ba17gydF4y2Ba, 557-569(2017)。gydF4y2Ba
Ostrom, Q. T.等人。CBTRUS统计报告:2010-2014年在美国诊断的原发性脑和其他中枢神经系统肿瘤。gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba19gydF4y2Ba, v1-v88(2017)。gydF4y2Ba
巴恩霍尔茨-斯隆,j.s.等人。在大都会底特律癌症监测系统中诊断的患者(1973年至2001年)脑转移的发病率比例。gydF4y2Baj .中国。肿瘤防治杂志。gydF4y2Ba22gydF4y2Ba, 2865-2872(2004)。gydF4y2Ba
Stupp, R.等人。恶性胶质瘤放疗加伴发和辅助替莫唑胺治疗。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba352gydF4y2Ba, 987-996(2005)。gydF4y2Ba
卡格尼,d.n.等人。脑转移患者在诊断为系统性恶性肿瘤时的发生率和预后:一项基于人群的研究。gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba19gydF4y2Ba, 1511-1521(2017)。gydF4y2Ba
奎尔,D. F. &乔伊斯,J. A.脑肿瘤的微环境景观。gydF4y2Ba癌症细胞gydF4y2Ba31gydF4y2Ba, 326-341(2017)。gydF4y2Ba
卡瓦哈尔-豪斯多夫,D. E.等。利用成像细胞术对曲妥珠单抗治疗患者的信号靶点和细胞毒性T细胞进行多重(18-Plex)测量。gydF4y2Ba中国。癌症Res。gydF4y2Ba25gydF4y2Ba, 3054-3062(2019)。gydF4y2Ba
阿里,H. R.等人。成像大规模细胞术和多平台基因组学定义了乳腺癌的表型基因组学格局。gydF4y2BaNat。癌症gydF4y2Ba1gydF4y2Ba, 163-175(2020)。gydF4y2Ba
杰克逊,h.w.等人。乳腺癌的单细胞病理图景。gydF4y2Ba自然gydF4y2Ba578gydF4y2Ba, 615-620(2020)。gydF4y2Ba
凯伦,L.等人。多重离子束成像显示三阴性乳腺癌中结构肿瘤免疫微环境。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 1373 - 1387。e1319(2018).
Schürch, C. M.等。协调的细胞社区在结直肠癌侵袭前沿协调抗肿瘤免疫。gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 1341-1359(2020)。gydF4y2Ba
刘达尔,s.m.等。胰腺导管腺癌中的白细胞异质性:与临床结果相关的表型和空间特征。gydF4y2Ba癌症。gydF4y2Ba11gydF4y2Ba, 2014-2031(2021)。gydF4y2Ba
弗里贝尔等人。人类脑癌的单细胞图谱揭示了组织入侵白细胞的肿瘤特异性指令。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 1626 - 1642。e1620.(2020).
克莱姆,F.等人。对脑肿瘤微环境景观的探究揭示了免疫细胞的疾病特异性改变。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 1643 - 1660。e1617(2020).
Schaettler, m.o.等人。通过多部门分析鉴定恶性脑肿瘤的基因组和免疫多样性。gydF4y2Ba癌症。gydF4y2Ba12gydF4y2Ba, 154-171(2022)。gydF4y2Ba
普查尔斯基,R. B.等。人类胶质母细胞瘤的解剖转录图谱。gydF4y2Ba科学gydF4y2Ba360gydF4y2Ba, 660-663(2018)。gydF4y2Ba
穆勒,S.等。人类胶质瘤的单细胞分析揭示了巨噬细胞个体发育作为肿瘤微环境中巨噬细胞激活区域差异的基础。gydF4y2Ba基因组医学杂志。gydF4y2Ba18gydF4y2Ba, 234(2017)。gydF4y2Ba
Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J. & Biswas, S. K.巨噬细胞个体发育、激活和功能多维概念的新见解。gydF4y2BaImmunol Nat。gydF4y2Ba17gydF4y2Ba, 34-40(2016)。gydF4y2Ba
Komohara, Y., Ohnishi, K., Kuratsu, J.和Takeya, M. M2抗炎巨噬细胞表型可能参与人类胶质瘤的生长。gydF4y2Baj .分册。gydF4y2Ba216gydF4y2Ba, 15-24(2008)。gydF4y2Ba
卢-爱默生,C.等人。抗血管生成治疗后肿瘤相关巨噬细胞增加与复发性胶质母细胞瘤患者生存率差相关。gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba15gydF4y2Ba, 1079-1087(2013)。gydF4y2Ba
路易斯,D. N.等。2021年世卫组织中枢神经系统肿瘤分类综述gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba23gydF4y2Ba, 1231-1251(2021)。gydF4y2Ba
普罗斯尼亚克等人。胶质瘤分级与承载M2单核细胞标志物的细胞的积累和活性有关。gydF4y2Ba中国。癌症Res。gydF4y2Ba19gydF4y2Ba, 3776-3786(2013)。gydF4y2Ba
Park, J. H.等。肿瘤缺氧抑制γδ T细胞介导的脑肿瘤抗肿瘤免疫gydF4y2BaImmunol Nat。gydF4y2Ba22gydF4y2Ba, 336-346(2021)。gydF4y2Ba
里尔登,d.a.等。尼武单抗与贝伐单抗在复发性胶质母细胞瘤患者中的疗效:CheckMate 143 iii期随机临床试验gydF4y2BaJAMA杂志。gydF4y2Ba6克ydF4y2Ba, 1003-1010(2020)。gydF4y2Ba
Tawbi, H. A.等。联合尼伏单抗和伊匹单抗治疗脑转移性黑素瘤。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba379gydF4y2Ba, 722-730(2018)。gydF4y2Ba
Long, G. V.等。尼鲁单抗联合伊匹单抗或单独尼鲁单抗治疗黑素瘤脑转移:一项多中心随机2期研究gydF4y2Ba柳叶刀杂志。gydF4y2Ba19gydF4y2Ba, 672-681(2018)。gydF4y2Ba
Calabrese, C.等人。脑肿瘤干细胞的血管周围生态位。gydF4y2Ba癌症细胞gydF4y2Ba11gydF4y2Ba, 69-82(2007)。gydF4y2Ba
加贾尔,C. M.等。血管周围生态位调节乳腺肿瘤休眠。gydF4y2Ba细胞生物学。gydF4y2Ba15gydF4y2Ba, 807-817(2013)。gydF4y2Ba
刘,H.等。促炎和增生性小胶质细胞推动胶质母细胞瘤的进展。gydF4y2Ba细胞的代表。gydF4y2Ba36gydF4y2Ba, 109718(2021)。gydF4y2Ba
van Hooren, L.等人。激烈的CD40治疗诱导三级淋巴结构,但损害胶质瘤对检查点封锁的反应。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 4127(2021)。gydF4y2Ba
Kienast, Y.等人。实时成像显示脑转移形成的单个步骤。gydF4y2BaNat,地中海。gydF4y2Ba16gydF4y2Ba, 116-122(2010)。gydF4y2Ba
Valiente, M.等人。蛇形蛋白酶在脑转移中促进癌细胞存活和血管吸收。gydF4y2Ba细胞gydF4y2Ba156gydF4y2Ba, 1002-1016(2014)。gydF4y2Ba
Gi, t等。在南瓜细胞学上,脑转移瘤的微血管增生模拟胶质母细胞瘤。gydF4y2Ba细胞病理学gydF4y2Ba28gydF4y2Ba, 228-234(2017)。gydF4y2Ba
Vanlandewijck, M.等人。大脑血管系统中细胞类型和分区的分子图谱。gydF4y2Ba自然gydF4y2Ba554gydF4y2Ba, 475-480(2018)。gydF4y2Ba
Arvanitis, c.d, Ferraro, G. B. & Jain, R. K.脑肿瘤和转移的血脑屏障和血肿瘤屏障。gydF4y2BaNat. Rev. CancergydF4y2Ba20.gydF4y2Ba, 26-41(2020)。gydF4y2Ba
亚伯拉罕,H. K.等。血管生成素-2介导血脑屏障损伤和三阴性乳腺癌细胞在大脑中的定植。gydF4y2Baj .分册。gydF4y2Ba232gydF4y2Ba, 369-381(2014)。gydF4y2Ba
Carbonell, W. S, Ansorge, O., Sibson, N. & Muschel, R.血管基底膜在脑转移中的“土壤”作用。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba4 gydF4y2Ba, e5857(2009)。gydF4y2Ba
Liebner, S.等人。Claudin-1和claudin-5在人多形性胶质母细胞瘤血管中的表达和紧密连接形态改变。gydF4y2BaActa Neuropathol。gydF4y2BaOne hundred.gydF4y2Ba, 323-331(2000)。gydF4y2Ba
Akkari, L.等人。放疗后胶质瘤巨噬细胞种群的动态变化揭示了CSF-1R抑制是克服耐药的一种策略。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba12gydF4y2Ba, eaaw7843(2020)。gydF4y2Ba
Pyonteck, s.m.等人。CSF-1R抑制改变巨噬细胞极化并阻止胶质瘤进展。gydF4y2BaNat,地中海。gydF4y2Ba19gydF4y2Ba, 1264-1272(2013)。gydF4y2Ba
鹌鹑,d.f.等。肿瘤微环境是神经胶质瘤获得性抵抗CSF-1R抑制的基础。gydF4y2Ba科学gydF4y2Ba352gydF4y2Ba, aad3018(2016)。gydF4y2Ba
Sugiyama, S.等。粒细胞巨噬细胞集落刺激因子对人动脉粥样硬化巨噬细胞髓过氧化物酶的调节及其在急性冠脉综合征中的意义。gydF4y2Ba点。j .分册。gydF4y2Ba158gydF4y2Ba, 879-891(2001)。gydF4y2Ba
阿莫林等人。IFNγ和GM-CSF在神经炎症过程中控制单核细胞到吞噬细胞转变的互补分化程序。gydF4y2BaImmunol Nat。gydF4y2Ba23gydF4y2Ba, 217-228(2022)。gydF4y2Ba
雷诺兹,W. F.等。髓过氧化物酶多态性与阿尔茨海默病性别特异性风险相关。gydF4y2Ba经验,神经。gydF4y2Ba155gydF4y2Ba, 31-41(1999)。gydF4y2Ba
Zilionis, R.等人。人类和小鼠肺癌的单细胞转录组学揭示了个体和物种间保守的髓系种群。gydF4y2Ba免疫力gydF4y2Ba50gydF4y2Ba, 1317 - 1334。e1310 (2019).
亚涅斯,A.等。粒细胞-单核细胞祖细胞和单核细胞-树突状细胞祖细胞独立产生功能不同的单核细胞。gydF4y2Ba免疫力gydF4y2Ba47gydF4y2Ba, 890 - 902。e894(2017).
Lagasse, E. & Weissman, I. L.小鼠MRP8和MRP14,两种与髓系发育相关的细胞内钙结合蛋白。gydF4y2Ba血gydF4y2Ba79gydF4y2Ba1907-1915(1992)。gydF4y2Ba
Butowski, N.等人。口服集落刺激因子1受体抑制剂PLX3397治疗复发性胶质母细胞瘤:常春藤基金会早期临床试验联盟II期研究gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba18gydF4y2Ba, 557-564(2016)。gydF4y2Ba
李,A. H.等。新辅助PD-1阻断剂诱导T细胞和cDC1激活,但不能克服复发性胶质母细胞瘤的免疫抑制肿瘤相关巨噬细胞。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 6938(2021)。gydF4y2Ba
拉维,V. M.等。胶质母细胞瘤微环境中的t细胞功能障碍是由骨髓细胞释放白介素-10介导的。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba, 925(2022)。gydF4y2Ba
谢杨,等。通过单细胞RNA测序发现人类胶质母细胞瘤中内皮细胞的关键分子改变。gydF4y2Ba江森自控的洞察力gydF4y2Ba6克ydF4y2Ba, e150861(2021)。gydF4y2Ba
丹克纳等人。与冷诱导rna结合蛋白表达相关的侵袭性生长促使手术切除的脑转移瘤复发。gydF4y2Ba神经肿瘤防治杂志。gydF4y2Ba23gydF4y2Ba, 1470-1480(2021)。gydF4y2Ba
丹克纳等人。成人实体癌轻脑膜转移的潜在生物学和治疗弱点。gydF4y2Ba癌症gydF4y2Ba13gydF4y2Ba, 732(2021)。gydF4y2Ba
Karimi, E.等。机器学习满足经典计算机视觉的精确细胞识别。预印在gydF4y2BaBioRxivgydF4y2Ba,gydF4y2Bahttps://doi.org/10.1101/2022.02.27.482183gydF4y2Ba(2022)。gydF4y2Ba
Arthur, D. & Vassilvitskii, S.;gydF4y2BakgydF4y2Ba-means++:小心播种的优点。在gydF4y2Ba第18届ACM-SIAM离散算法研讨会gydF4y2Ba1027-1035(工业与应用数学学会,2006)。gydF4y2Ba
皮尔,d.m.g.。gydF4y2Ba有限混合模型gydF4y2Ba(John & Sons, 2000)。gydF4y2Ba
Schapiro, D. et al. histoCAT:多重图像细胞术数据中细胞表型和相互作用的分析。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 873-876(2017)。gydF4y2Ba
Schurch, c.m.等人。协调的细胞社区在结直肠癌侵袭前沿协调抗肿瘤免疫。gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 1341 - 1359。e1319(2020).
乌伦,M.等人。人类血细胞中蛋白质编码基因的全基因组转录组分析。gydF4y2Ba科学gydF4y2Ba366gydF4y2Ba, eaax9198(2019)。gydF4y2Ba
法格兰,m.w。gydF4y2BatgydF4y2Ba-检验、非参数检验和大型研究——统计实践的悖论?gydF4y2BaBMC medical . Res. Methodol。gydF4y2Ba12gydF4y2Ba, 78(2012)。gydF4y2Ba
确认gydF4y2Ba
作者非常感谢Rosalind and Morris Goodman癌症研究所(GCI)和麦吉尔大学生命科学中心的核心设施的技术支持,包括单细胞和成像质量细胞仪平台(SCIMAP)和组织学核心设施(N. Robinson and P. Cruz)。作者感谢麦吉尔感染与免疫跨学科计划、魁北克癌症联盟和Ministère de l ' Économie et de l ' innovation du Québec通过Fonds d 'accélération des协作en santé提供的财政支持。L.A.W, D.F.Q, l.a., K.P.和m.c.g感谢脑肿瘤资助人合作组织的资助。L.A.W感谢加拿大卫生研究所(CIHR;PJT-162137)和加拿大创新基金会,并担任肺癌研究罗莎琳德和莫里斯·古德曼主席。d.f.q感谢CIHR (PJT-159742, PJT-178306)、加拿大创新基金会和加拿大研究主席计划的资助。P.M.S.承认来自CIHR (PJT-175066)的资助,并且是麦吉尔大学威廉·道森学者。irw感谢来自特里·福克斯研究所(1084)、CIHR (PJT-152975)和加拿大研究主席计划的资助。M.P.感谢Québec-Santé基金会的Réseau de Recherche en Cancer和Québec乳腺癌基金会的资助,并担任癌症遗传学Diane and Sal Guererra主席。奖学金支持由麦吉尔大学医学博士/博士计划(S.M.M.), GCI夏洛特和利奥·卡拉西克基金会肿瘤学博士奖学金(M.W.Y.和L.J.M.P.), Fonds de Recherche du Québec (M.W.Y.和L.J.M.P.)和GCI Canderel研究生奖学金计划提供。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
pms, D.F.Q.和L.A.W.设计了这项研究。D.F.Q, L.A.W, p.m.s., m.w.y和S.M.M.撰写了手稿并协调实验。e.k., m.r., M.W.Y, s.m.m., p.m.s., D.F.Q.和L.A.W.进行了所有IMC分析和解释数据。e.k., M.R.和B.F.编写了研究中使用的所有原始代码。l.j.m.p., y.w., I.R.W.和D.F.Q.设计,优化和/或执行IMC。m.s., S.D.和B.F.对公开数据集进行了分析。L.R, I.R.W, D.J.K.和L.A.提供了对数据解释至关重要的分析。M.P.和D.Z.为IMC的验证提供了材料,并进行了IHF优化和执行。K.P.和mc - g。提供了用于IMC的人体组织样本。 M.D., P.F., S.L., R.A. and M.C.G. assisted with collection and/or curation of clinical data for the IMC TMAs. For glioblastoma IHF, the following authors provided TMAs, pathology expertise and/or clinical data for patient samples from McGill University (K.P., M.C.G. and R.A.), the University of Calgary (J.A.C., D.L.S. and G.R.U.) and the Netherlands Cancer Institute (D.B. and L.A.). All authors reviewed and approved the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Robert Prins和其他匿名审稿人对本工作的同行评审所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1研究队列和细胞谱系分配。gydF4y2Ba
一个gydF4y2Ba,患者样本总结。患者接受手术切除,肿瘤由神经病理学家(M.C.G.)分类。胶质瘤分为:原发(第一次手术切除),残留(第二次手术切除任何剩余肿瘤),复发(肿瘤复发后手术切除),或II/III级进展(从低级别胶质瘤进展的IV级肿瘤切除)。胶质瘤样本从肿瘤体或肿瘤邻近正常部位提取。脑转移样本从肿瘤体积(核心)或肿瘤/脑界面(边缘)中提取。所有临床资料均来自手术和病理报告。获取的细胞数量对应于所有图像分割的细胞总数。gydF4y2BabgydF4y2Ba,细胞谱系分配策略示意图。由BioRender.com创建。gydF4y2Ba
扩展数据图2原发性和转移性脑肿瘤的细胞动力学。gydF4y2Ba
一个gydF4y2Ba,胶质母细胞瘤中细胞频率占所有TME细胞的百分比(gydF4y2BangydF4y2Ba= 192张图像),BrM-cores (gydF4y2BangydF4y2Ba= 72张图片)和brm边距(gydF4y2BangydF4y2Ba= 47张图片)。数据为均数±s.e.m.;双向方差分析;重大的调整gydF4y2BaPgydF4y2Ba-values突出显示。gydF4y2BabgydF4y2Ba,左:胶质母细胞瘤每种细胞类型的细胞数/幅(gydF4y2BangydF4y2Ba= 192张图像),BrM-cores (gydF4y2BangydF4y2Ba= 72张图片)和brm边距(gydF4y2BangydF4y2Ba= 47张图片);右图:胶质母细胞瘤的绝对细胞数(所有图像的总数)(gydF4y2BangydF4y2Ba= 192张图像),BrM-core (gydF4y2BangydF4y2Ba= 72张图片)和BrM-margin (gydF4y2BangydF4y2Ba= 47张图片)。gydF4y2Ba
扩展数据图3对照组织和脑肿瘤的代表性染色。gydF4y2Ba
一个gydF4y2Ba,扁桃体、脾脏或肿瘤边缘预期共染色模式的代表性IMC图像。蓝色,DNA (191Ir和193Ir)。gydF4y2BabgydF4y2Ba,主要谱系标记的代表性IMC图像(左、中)和相应的细胞分割和谱系分配(右)。提供了细胞分割图像的颜色代码(右)。gydF4y2Ba
扩展数据图4脑肿瘤患者的单细胞频率与临床亚群相关。gydF4y2Ba
一个gydF4y2Ba,临床亚组患者细胞密度比较,对应补充图。gydF4y2Ba8gydF4y2Ba.在每一行中,气泡颜色表示具有较高细胞类型的临床亚组(A项与B项,右);气泡大小表示gydF4y2BaP -gydF4y2Ba价值。双侧学生t检验,非配对,除非另有说明;配对分析来自患者匹配的样本。gydF4y2BabgydF4y2Ba,低T细胞的胶质母细胞瘤(TME <5%)每张图像中细胞频率占总细胞的百分比,gydF4y2BangydF4y2Ba= 144张图像)与高T细胞(>5%的TME,gydF4y2BangydF4y2Ba= 13张图片)。数据为均数±s.e.m.;双面学生t检验。gydF4y2BacgydF4y2Ba,低T细胞(TME <5%)的胶质母细胞瘤患者(有此信息的患者)的平均总生存时间,gydF4y2BangydF4y2Ba= 142张图像)与高T细胞(>5%的TME,gydF4y2BangydF4y2Ba= 13张图片)。数据为均数±s.e.m.;双面学生t检验。gydF4y2Ba
扩展数据图5原发性脑肿瘤与转移性脑肿瘤的细胞相互作用。gydF4y2Ba
一个gydF4y2Ba,对应图的回避得分。gydF4y2Ba2摄氏度gydF4y2Ba胶质母细胞瘤中癌细胞与非癌系的相互作用(gydF4y2BangydF4y2Ba= 192张图像)和brm -core (gydF4y2BangydF4y2Ba= 59张图片)。数据为均数±s.e.m.;双面学生t检验。gydF4y2BabgydF4y2Ba,胶质母细胞瘤细胞相互作用/回避评分的统计学意义(gydF4y2BangydF4y2Ba= 192张图像)和brm -core (gydF4y2BangydF4y2Ba= 59张图像)对应于图。gydF4y2Ba2摄氏度gydF4y2Ba.gydF4y2BaPgydF4y2Ba-由双侧学生t检验计算的值。颜色表示BrM与胶质母细胞瘤(上表)或胶质母细胞瘤与BrM(下表)有明显的相互作用(红色)或回避(蓝色)。gydF4y2Ba
图6脑肿瘤患者的单细胞空间相互作用。gydF4y2Ba
一个gydF4y2Ba、胶质母细胞瘤血管周围小生境相互作用细胞与BrM标本的IMC图像,代表图中的分析。gydF4y2Ba2 dgydF4y2Ba.第一排,胶质母细胞瘤血管周围癌细胞增殖;第二排,胶质母细胞瘤血管周围巨噬细胞增殖;第三行,肿瘤周围内皮细胞增殖;第四行,brm边缘瘤周内皮细胞增殖。每个图像的右侧都提供了高放大倍数的插图。gydF4y2BabgydF4y2Ba,胶质母细胞瘤细胞类型之间Spearman相关性热图(上行,gydF4y2BangydF4y2Ba= 192张图像),BrM-cores(中间行,gydF4y2BangydF4y2Ba= 59张图片)和brm边距(底部行,gydF4y2BangydF4y2Ba= 40张图片)。红色,正相关;蓝色代表负相关。gydF4y2BacgydF4y2BaCD40+ MDMs和CD40- MDMs与Th相互作用的频率。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba= 74张图像中的1,048个单元;双面学生t检验。gydF4y2BadgydF4y2Ba在胶质母细胞瘤中,m1样MDMs中的CD40与内皮细胞相互作用(红色)或避免内皮细胞(蓝色)。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba= 188张图像/组中的415个细胞;双面学生t检验。gydF4y2BaegydF4y2Ba在胶质母细胞瘤中,m2样MDMs中的Ox40L与内皮细胞相互作用(红色)或避免内皮细胞(蓝色)。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba= 183幅图像/组中的4,248个细胞;双面学生t检验。gydF4y2BafgydF4y2Ba, Ki67在内皮细胞与(红色)Tc细胞相互作用或避免(蓝色)Tc细胞在brm边缘。数据为均数±s.e.m.;gydF4y2BangydF4y2Ba= 28张图像中的98个单元格;双面学生t检验。gydF4y2BaggydF4y2Ba,内皮细胞中的Claudin-5与brm核心和-边缘的癌细胞相互作用(红色)或避免(蓝色)。数据为均数±s.e.m.;BrM-cores,gydF4y2BangydF4y2Ba= 61张图像中的1503个单元;BrM-margins,gydF4y2BangydF4y2Ba= 45张图像中的1507个单元;双面学生t检验。gydF4y2BahgydF4y2Ba在肿瘤周围水肿程度细分的brm核中,内皮细胞与癌细胞相互作用(红色)或避免癌细胞(蓝色)时,Claudin-5的表达。数据为均数±s.e.m.;无/低水肿,gydF4y2BangydF4y2Ba= 13张图像中的369个单元;中度/高水肿,gydF4y2BangydF4y2Ba= 42张图像中的1,046个单元;双面学生t检验。所有缺乏兴趣的成对相互作用的图像都被排除在分析之外。gydF4y2Ba
图7胶质母细胞瘤中空间细胞邻近的生存相关性。gydF4y2Ba
描述胶质母细胞瘤细胞邻近区(CN)细胞组成的热图gydF4y2BaNgydF4y2Ba= 3、5、10、20或30个最近的邻居,CN = 9个邻居。表显示gydF4y2BaPgydF4y2Ba基于中位数CN频率的样本生存分析(Log-rank (mantle - cox)检验)的值。m1样MDM中富集的与生存显著相关的中枢神经系统以灰色突出显示。当多个样本对应于同一患者时,CN频率平均。gydF4y2Ba
图8 m1样MDM富集的细胞邻近区与胶质母细胞瘤的生存相关。gydF4y2Ba
一个gydF4y2Ba,描述胶质母细胞瘤细胞邻近区(CN)细胞组成的热图,用gydF4y2BaNgydF4y2Ba= 10个最近邻居及CN = 30个邻居(gydF4y2BangydF4y2Ba= 192张图片)。6个中枢神经细胞富集>3000 m1样MDM(灰色高亮;表示每个CN中m1类MDM的个数)。其中,2种(红色字体)与延长生存有关。表显示gydF4y2BaPgydF4y2Ba基于中位数CN频率的样本生存分析(Log-rank (mantle - cox)检验)的值。当多个样本对应于同一患者时,CN频率平均。gydF4y2BabgydF4y2Ba,中性粒细胞、m1样MDM和m1样MG的细胞频率相关图。线性回归的置信区间为95%。gydF4y2Ba
图9胶质母细胞瘤和脑转移瘤的空间细胞邻近。gydF4y2Ba
一个gydF4y2Ba,胶质母细胞瘤IMC图像上中枢神经的代表性Voronoi图。gydF4y2BabgydF4y2Ba, CNs映射到BrM-core IMC图像上的代表性Voronoi图。gydF4y2BacgydF4y2Ba,基于BrM核心中位CN5频率的BrM患者(肺、黑色素瘤和乳腺原发)Kaplan-Meier分析。当多个样本对应于同一患者时,CN频率平均。Log-rank (Mantel-Cox)检验,gydF4y2BangydF4y2Ba= 13例/组。gydF4y2BadgydF4y2Ba, CD45在胶质母细胞瘤和BrM样本中未定义细胞的表达(gydF4y2BangydF4y2Ba= 389张图片)。gydF4y2BaegydF4y2Ba, CNs在BrM样品中的分布。BrM-margins:黑色素瘤gydF4y2BangydF4y2Ba= 6张,肺gydF4y2BangydF4y2Ba= 22张图片,乳房gydF4y2BangydF4y2Ba= 12张图片;BrM-cores:黑色素瘤gydF4y2BangydF4y2Ba= 13张,肺gydF4y2BangydF4y2Ba= 29张图片,乳房gydF4y2BangydF4y2Ba= 17张图片。对于每张图像,确定来自每个CN的细胞百分比,然后为每组取平均值。gydF4y2BafgydF4y2Ba,胶质母细胞瘤LTS/STS队列示意图和纳入/排除标准,与补充表有关gydF4y2Ba2gydF4y2Ba.由BioRender.com创建。gydF4y2BaggydF4y2Ba,基于中位CN频率的胶质母细胞瘤LTS/STS队列Kaplan-Meier分析。当多个样本对应于同一患者时,CN频率平均。Log-rank (Mantel-Cox)检验,gydF4y2BangydF4y2Ba= 16例/组。gydF4y2Ba
图10 MPO+巨噬细胞与增强的细胞毒功能相关。gydF4y2Ba
一个gydF4y2Ba,胶质母细胞瘤中MPO+ CD68+巨噬细胞池中巨噬细胞亚群分布的饼图(gydF4y2BangydF4y2Ba= 192张图片)。百分比反映了总MPO+ CD68+细胞的比例。gydF4y2BabgydF4y2Ba, 2例胶质母细胞瘤标本中MPO+ MDMs的代表性IMC图像。gydF4y2BacgydF4y2Ba的归一化表达式gydF4y2BaMPOgydF4y2Ba通过RNA-seq在胶质母细胞瘤和BrM免疫细胞亚群中的作用(数据来自参考文献。gydF4y2Ba16gydF4y2Ba).数据为均数±s.e.m.;gydF4y2Ban -gydF4y2Ba所示值表示患者数量。gydF4y2BadgydF4y2Ba的归一化表达式gydF4y2BaMPOgydF4y2Ba在人类血液免疫细胞亚群中通过RNA-seq(数据来自参考文献。gydF4y2Ba61gydF4y2Ba).gydF4y2BaegydF4y2Ba,热图显示了三个独立的公开的胶质母细胞瘤scRNA-seq数据集中常见的MPO+和MPO-巨噬细胞中前50个差异表达基因(数据来自参考文献。gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba).gydF4y2BafgydF4y2Ba,在内皮细胞和MPO+与MPO- m1样MDMs之间使用双面排列测试对单个图像(每个图像1000个排列)进行成对相互作用/回避评分(gydF4y2BangydF4y2Ba= 192张图片)。颜色表示互动(红色)或回避(蓝色),圆圈大小反映互动得分的大小。gydF4y2BaggydF4y2Ba, MPO(绿色)和IBA1(红色)的代表性免疫组织荧光图像;巨噬细胞标记物)在胶质母细胞瘤肿瘤中的共定位。插图中显示了MPO+ IBA1+巨噬细胞的例子,以及MPO+ IBA1-中性粒细胞或MPO- IBA1+巨噬细胞(gydF4y2BangydF4y2Ba= 5张图片)。gydF4y2BahgydF4y2Ba,针对MPO+ m1样MDM与其他细胞类型(gydF4y2BangydF4y2Ba= 192张图片);互动(红色)回避(蓝色)。gydF4y2Ba我gydF4y2Ba基于中位MPO+CD163-P2Y12-CD68+巨噬细胞富集的胶质母细胞瘤LTS/STS队列Kaplan-Meier分析。当多个样本对应于同一患者时,细胞频率平均。Log-rank (Mantel-Cox)检验,gydF4y2BangydF4y2Ba= 16例/组。gydF4y2BajgydF4y2Ba,胶质母细胞瘤LTS/STS队列中MPO+ m1样MDM的频率占总细胞的百分比(gydF4y2BangydF4y2Ba= 16例/组)和复发性胶质母细胞瘤(n = 10例)。当多个样本对应于同一患者时,平均频率。数据为中位数±四分位数范围;双面曼-惠特尼检验。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
该文件包含代表性图像和其他面板验证数据(补充图1 - 5),跨临床组的细胞频率和密度分析(补充图6-11),以及抗体和患者队列信息(补充表1和2)。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Karimi, E., Yu M.W., Maritan, S.M.gydF4y2Baet al。gydF4y2Ba原发性和转移性脑肿瘤的单细胞空间免疫图景。gydF4y2Ba自然gydF4y2Ba614gydF4y2Ba, 555-563(2023)。https://doi.org/10.1038/s41586-022-05680-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05680-3gydF4y2Ba
这篇文章被引用gydF4y2Ba
肿瘤微环境的空间蛋白质组学揭示了位置的重要性gydF4y2Ba
自然免疫学gydF4y2Ba(2023)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba