摘要gydF4y2Ba
胰腺导管腺癌(PDAC)由于转移性疾病的高发病率和对治疗的反应有限,预计到2040年将成为第二大最致命的癌症gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.只有不到一半的患者对PDAC的主要治疗方法化疗有反应gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而基因改变本身并不能解释这一现象gydF4y2Ba5gydF4y2Ba.饮食是影响治疗反应的环境因素,但其在PDAC中的作用尚不清楚。在本研究中,使用散弹宏基因组测序和代谢组学筛选,我们发现在对治疗有反应的患者中,微生物源性色氨酸代谢物吲哚-3-乙酸(3-IAA)富集。粪便菌群移植、短期膳食控制色氨酸和口服3-IAA可增加人源化无生物PDAC小鼠模型的化疗疗效。通过结合功能丧失和功能获得实验,我们表明3-IAA和化疗的疗效是由中性粒细胞来源的髓过氧化物酶许可的。髓过氧化物酶氧化3- iaa,结合化疗诱导活性氧(ROS)降解酶谷胱甘肽过氧化物酶3和谷胱甘肽过氧化物酶7的下调。所有这些都导致了癌细胞中ROS的积累和自噬的下调,从而损害了它们的代谢适应性,并最终影响了它们的增殖。在人类中,我们在两个独立的PDAC队列中观察到3-IAA水平与治疗疗效之间的显著相关性。总之,我们发现了一种在PDAC治疗中具有临床意义的微生物源代谢物,并为在癌症患者治疗期间考虑营养干预提供了动力。gydF4y2Ba
主要gydF4y2Ba
多化疗,无论是5-氟尿嘧啶(5-FU),伊立替康和奥沙利铂联合亚叶酸(FOLFIRINOX),或吉西他滨和钠-紫杉醇(GnP),都被认为是转移性PDAC (mPDAC)患者的标准护理。gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.然而,只有不到一半的患者对这种疗法有反应,而那些没有反应的患者(NR患者)会遭受疼痛,最终在几周内死亡gydF4y2Ba3 gydF4y2Ba.PDAC的基因改变不能很好地解释对治疗有反应的患者(应答者(R)患者)和NR患者之间的差异gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba这使得环境因素——包括肠道微生物群——成为化疗疗效的潜在介质。因此,迫切需要确定可能解释R患者和NR患者之间差异的环境因素,以便为未来的治疗开发新的概念。gydF4y2Ba
肠道菌群已被证明可诱导黑色素瘤患者对免疫治疗产生反应,并可由饮食习惯调节gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.在罕见的长期存活的局部PDAC患者中,细菌可以从肠道转移到肿瘤中并控制抗肿瘤免疫激活gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.然而,大多数患有侵袭性免疫治疗耐药mPDAC的患者采用多化疗治疗,目前尚不清楚微生物群或饮食习惯是否以及如何影响其疗效gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
3-IAA诱导化疗反应gydF4y2Ba
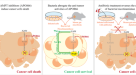
我们招募了30例mPDAC患者,其中23例未接受抗生素治疗,并提供了足够的样本材料,以便在化疗开始前分析肠道菌群(图2)。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1gydF4y2Ba).该队列的患者主要根据放射反应分为R和NR患者,在疾病稳定或CT扫描缺失的情况下,根据无进展生存期(PFS)和血清肿瘤标志物的降低(见gydF4y2Ba方法gydF4y2Ba有关详细标准)。R病人(gydF4y2BangydF4y2Ba= 11)的平均PFS为40.9周,显著高于NR患者12.8周的PFS (gydF4y2BangydF4y2Ba= 12), R患者的总生存期为51.9周,NR患者的总生存期为26.4周。gydF4y2Ba1 b, cgydF4y2Ba).R患者的微生物区系与NR患者的微生物区系截然不同。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba1 d-fgydF4y2Ba).为了研究微生物群与化疗反应之间的潜在因果关系,我们将前10例招募的R和NR患者的微生物群转移到gnotobio小鼠中,然后原位注射gydF4y2BaPdx1gydF4y2Bacre LSL -gydF4y2Ba喀斯特gydF4y2BaG12DgydF4y2BaLSL -gydF4y2BaTrp53gydF4y2BaR172H / +gydF4y2Ba(KPC)胰腺癌细胞(扩展数据图。gydF4y2Ba2模拟gydF4y2Ba).值得注意的是,两组(R和NR)均有4例患者接受FOLFIRINOX治疗,1例患者接受GnP治疗。无论最初的供体治疗方法如何,在化疗(5-FU、伊立替康和奥沙利铂;FIRINOX)(无花果。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba2 egydF4y2Ba).考虑到肠道细菌可能会转移到PDAC肿瘤中gydF4y2Ba11gydF4y2Ba,我们接下来通过16S rRNA测序分析了瘤内细菌。我们只能在12个肿瘤中检测到2个肿瘤内细菌(扩展数据图)。gydF4y2Ba2 fgydF4y2Ba),因此假设对化疗的反应是通过循环微生物群衍生的代谢物间接控制的。gydF4y2Ba
一个gydF4y2Ba在化疗(化疗)开始前,对23例mPDAC患者的肠道菌群进行了测序。女朋友,无菌。gydF4y2BabgydF4y2Ba,主坐标分析(PCoA),采用Bray-Curtis不相似矩阵,预处理NR (gydF4y2BangydF4y2Ba= 12)和R (gydF4y2BangydF4y2Ba= 10;1例患者在质量控制后被排除)菌群。gydF4y2BacgydF4y2Ba,用5种不同的R或NR微生物群定植gnotobio小鼠,原位注射KPC癌细胞,小鼠用FIRINOX治疗或不治疗。在注射肿瘤细胞后第20天,肿瘤重量相对于每个实验未治疗组的平均肿瘤重量(gydF4y2BangydF4y2Ba= 9 nr1-3;gydF4y2BangydF4y2Ba= 8 r2;gydF4y2BangydF4y2Ba= 7 R1和R3;gydF4y2BangydF4y2Ba= 5 NR5, R4, R5;gydF4y2BangydF4y2Ba= 4 nr4;来自9个独立的实验)。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,火山图显示3例R和NR患者血清中代谢产物丰度差异(gydF4y2BadgydF4y2Ba),以及定殖R或NR菌群的gnotobio小鼠血清(gydF4y2BangydF4y2Ba= 3个,生物重复)(gydF4y2BaegydF4y2Ba).NS,不显著。gydF4y2BafgydF4y2Ba, r -microbiota定植的gnotobiomice被喂食指示浓度的色氨酸,饮食干预第四天的3-IAA血清浓度显示(gydF4y2BangydF4y2Ba每人5个)。gydF4y2BaggydF4y2Ba,左为原位KPC肿瘤的肿瘤权重(gydF4y2BangydF4y2Ba= 8, 5或9)。右,3-IAA血清浓度与肿瘤重量之间的相关性gydF4y2BafgydF4y2Ba(gydF4y2BangydF4y2Ba= 15)。gydF4y2BahgydF4y2Ba, SPF小鼠原位注射KPC细胞,加或不加(+/−)3-IAA和/或加或不加FIRINOX治疗,并在实验第20天评估肿瘤重量(gydF4y2BangydF4y2Ba= 5或6)。每个符号代表一只鼠标。二选一(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba)或三个(gydF4y2BahgydF4y2Ba)独立实验。错误条表示s.e.m.显著gydF4y2BaPgydF4y2Ba值由MANOVA (gydF4y2BabgydF4y2Ba)、双尾嵌套gydF4y2BatgydF4y2Ba以及(gydF4y2BacgydF4y2Ba)、折叠变化分析和双尾分析gydF4y2BatgydF4y2Ba以及(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)、简单线性回归和皮尔逊回归gydF4y2BargydF4y2Ba(gydF4y2BaggydF4y2Ba)和Tukey事后检验的单因素方差分析(gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba).gydF4y2Ba
为了解决这一问题,我们分析了R和NR患者的血清以及匹配的定殖gnotobio小鼠,并使用液相色谱-质谱联用技术进行了靶向代谢组学筛选。我们发现,与NR患者相比,R中色氨酸代谢物3-IAA是最显著富集的代谢物(图2)。gydF4y2Ba1 dgydF4y2Ba).与此一致,与NR菌群相比,用R定殖的gnotobiomice血清中也富集了3-IAA(图2)。gydF4y2Ba1 egydF4y2Ba和扩展数据图。gydF4y2Ba2 ggydF4y2Ba).gydF4y2Ba
为了确定R患者中哪些肠道细菌可以促进3-IAA的产生,我们分析了常见的产生3-IAA的细菌菌株的丰度gydF4y2Ba14gydF4y2Ba与NR患者相比,R患者的微生物区系中存在显著差异。在分析的15个3-IAA生产者中,我们发现gydF4y2Ba脆弱拟杆菌gydF4y2Ba而且gydF4y2Ba叫多形拟杆菌gydF4y2Ba在R患者中增加,并证实其体外产生3-IAA的能力(扩展数据图)。gydF4y2Ba2 h,我gydF4y2Ba).gydF4y2Ba
接下来,我们想知道是否可以通过调节饮食中色氨酸(3-IAA的前体)的浓度来改变小鼠血清中3-IAA的水平,从而影响化疗的疗效。gydF4y2Ba15gydF4y2Ba).因为色氨酸会损害抗肿瘤免疫反应的发展,从而促进肿瘤的生长gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba在美国,我们首先测试了不同长度的饮食干预。14天的色氨酸暴露促进肿瘤生长,而仅4天的治疗期是不够的(扩展数据图。gydF4y2Ba2 j, kgydF4y2Ba).因此,我们决定在接下来的实验中选择4 - 5天的干预,以避免促肿瘤作用gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.gydF4y2Ba
其次,我们观察到4天的高色氨酸饮食已经足以增加R菌群定植的gnotobio小鼠血清中3-IAA的浓度(图2)。gydF4y2Ba1 fgydF4y2Ba).此外,当这种饮食干预与FIRINOX相结合时,我们观察到肿瘤重量下降(图2)。gydF4y2Ba1克gydF4y2Ba).此外,3-IAA血清水平与肿瘤重量呈负相关(图。gydF4y2Ba1克gydF4y2Ba).值得注意的是,这些色氨酸介导的效应——即3-IAA浓度的增加和肿瘤重量的降低——在nr微生物定植的小鼠中消失了(扩展数据图)。gydF4y2Ba2 l, mgydF4y2Ba).这些数据表明,高色氨酸饮食的影响是由3-IAA介导的,但我们不能排除在这组实验中观察到的反应增加的其他机制。因此,我们直接在特异性病原体无(SPF)小鼠中补充3-IAA,并发现我们的干预足以达到在R菌群定植的小鼠中测量到的浓度,并且不仅在SPF小鼠中,而且在nr定植的gnotobiomice中提高化疗的疗效(图。gydF4y2Ba1 hgydF4y2Ba和扩展数据图。gydF4y2Ba3得了gydF4y2Ba).我们还测试了其他微生物调节的代谢物,这些代谢物与不同的胃肠道癌症有关,如次生胆汁酸脱氧胆酸(DCA)和原发性胆汁酸糖胆酸(GCA)。gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.此外,我们选择测试在R患者或R-微生物定植的gnotobio小鼠中增加的另外两种代代物,即吲哚衍生物吲哚-3-丙酸(IPA)和马尿酸与FIRINOX联合使用。这些代谢物都没有导致与3-IAA相似的功效(扩展数据图。gydF4y2Ba3 d, egydF4y2Ba).总之,这些数据表明,在对化疗有反应的人和小鼠血清中,微生物源性色氨酸代谢物3-IAA增加,并且3-IAA的水平可以通过膳食干预色氨酸来调节。此外,3-IAA使即使是化疗耐药的PDAC也容易受到治疗。gydF4y2Ba
3-IAA的作用是由髓过氧化物酶许可的gydF4y2Ba
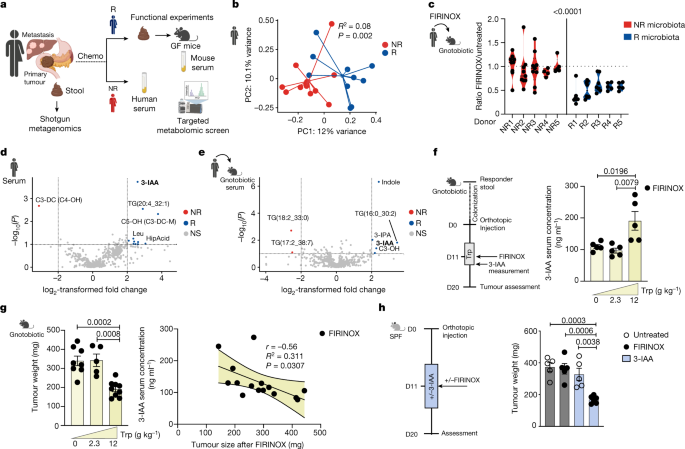
微生物群衍生的代谢物,特别是色氨酸代谢物,在形成先天免疫和适应性免疫中起着至关重要的作用gydF4y2Ba17gydF4y2Ba这反过来又在决定PDAC的化疗疗效和预后方面起着重要作用gydF4y2Ba11gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.因此,我们决定在未接受化疗或经过治疗的R或nr微生物定殖的gnotobio小鼠中分析肿瘤浸润的免疫细胞。我们持续观察到CD8频率的增加gydF4y2Ba+gydF4y2Ba化疗后,与nr -微生物定植的小鼠相比,R-的T细胞和中性粒细胞减少。当比较未处理的小鼠时,我们没有观察到肿瘤浸润免疫细胞的任何变化(扩展数据图。gydF4y2Ba4 a、bgydF4y2Ba).CD8gydF4y2Ba+gydF4y2Ba当T细胞被肠道菌群激活时,可以诱导PDAC的退化gydF4y2Ba11gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.然而,消耗CD8gydF4y2Ba+gydF4y2Ba或者两者都是CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2Ba在接受标准或高色氨酸饮食的r -微生物定植小鼠中,通过抗体治疗的T细胞并没有降低化疗的疗效(扩展数据图)。gydF4y2Ba5模拟gydF4y2Ba).类似地,CD4细胞衰竭gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞并没有降低SPF小鼠中3-IAA和FIRINOX的疗效(扩展数据图。gydF4y2Ba5 egydF4y2Ba).因此,3-IAA的作用似乎不依赖于T细胞的存在。gydF4y2Ba
中性粒细胞在PDAC中高度丰富,低中性粒细胞计数(中性粒细胞减少)与mPDAC的良好预后相关gydF4y2Ba22gydF4y2Ba.3-IAA对具有高浓度髓过氧化物酶(MPO)的细胞具有特异性毒性,这是中性粒细胞的标志gydF4y2Ba23gydF4y2Ba.在机理上,MPO可以氧化3-IAA,诱导3-亚甲基-2-恶吲哚(MOI)等有毒产物。gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.与此相一致,我们发现用3-IAA和FIRINOX培养骨髓来源的中性粒细胞,而不是T细胞(中性粒细胞的MPO水平高于T细胞)导致细胞存活率降低(扩展数据图)。gydF4y2Ba6gydF4y2Ba).此外,将MPO添加到骨髓来源的中性粒细胞培养物中或使用具有较高内源性MPO水平的未成熟中性粒细胞(前中性粒细胞)(参考文献)。gydF4y2Ba26gydF4y2Ba和扩展数据图。gydF4y2Ba6 bgydF4y2Ba)增加了3-IAA和FIRINOX的毒性(扩展数据图。gydF4y2Ba6 c, dgydF4y2Ba).相比之下,IPA在体外诱导中性粒细胞死亡方面并没有增加FIRINOX的疗效(扩展数据图)。gydF4y2Ba6 egydF4y2Ba).中性粒细胞对3-IAA和FIRINOX反应的进一步表征表明,治疗诱导了中性粒细胞脱颗粒,这被测量为MPO的释放和坏死,但不会导致中性粒细胞细胞外陷阱(NETs)或细胞凋亡的形成(扩展数据图)。gydF4y2Ba6 f-hgydF4y2Ba).接下来,我们想知道这些结果是否也在体内重现。3-IAA和FIRINOX的联合使用降低了SPF小鼠肿瘤和脾脏中中性粒细胞的频率和数量。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba6我gydF4y2Ba).值得注意的是,仅3-IAA处理并不是这样(扩展数据图。gydF4y2Ba6 jgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, SPF小鼠原位注射KPC细胞,并与FIRINOX联合或不联合3-IAA治疗,并在FIRINOX治疗后第3天分析肿瘤(gydF4y2BangydF4y2Ba每人8个)。采用流式细胞术检测原位肿瘤或各自脾脏的免疫亚群。CD8gydF4y2Ba+gydF4y2BaT细胞(CD3gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2Ba);CD4gydF4y2Ba+gydF4y2BaT细胞(CD3gydF4y2Ba+gydF4y2BaCD4);巨噬细胞(CD11bgydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba);中性粒细胞(CD11bgydF4y2Ba+gydF4y2BaLy6GgydF4y2Ba+gydF4y2Ba)显示为相对于总活免疫细胞(CD45gydF4y2Ba+gydF4y2Ba).gydF4y2BabgydF4y2Ba,辐照型和野生型原位KPC肿瘤或各自脾脏的肿瘤重量和免疫亚群计数(WT;gydF4y2BangydF4y2Ba= 4)或gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba(gydF4y2BangydF4y2Ba= 5或6)骨髓(BM)重组小鼠处理和分析gydF4y2Ba一个gydF4y2Ba.gydF4y2BacgydF4y2Ba,辐照型和野生型,gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba或gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba骨髓重建小鼠原位接受KPC细胞,并用FIRINOX或FIRINOX + 3-IAA治疗5天(gydF4y2BangydF4y2Ba每人5个)。所有小鼠都接受了为期四天的高色氨酸饮食干预。在FIRINOX治疗后第7天评估肿瘤重量。每个符号代表一只鼠标。两个独立的实验合并在一起(gydF4y2Ba一个gydF4y2Ba)或两项独立实验中的一项(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)。错误条表示s.e.m.显著gydF4y2BaPgydF4y2Ba值由双尾Mann-Whitney检验(gydF4y2Ba一个gydF4y2Ba)或双尾t检验(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba).gydF4y2Ba
鉴于中性粒细胞来源的MPO在毒性3-IAA产物的释放中起着至关重要的作用,我们想知道这是否可以解释3-IAA和FIRINOX对肿瘤生长的疗效增强。为了解决这个问题,我们建立了野生型或野生型骨髓嵌合体gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba老鼠。正如预期的那样,用FIRINOX和3-IAA治疗可导致中性粒细胞减少,并在野生型重组小鼠中显示出协同作用(图2)。gydF4y2Ba2 bgydF4y2Ba).然而,在小鼠中,用gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba在骨髓中,添加3-IAA并没有导致更小的肿瘤(图。gydF4y2Ba2 bgydF4y2Ba),提示MPO对3-IAA和FIRINOX的疗效至关重要。进一步支持MPO的作用,与单独使用FIRINOX相比,3-IAA和FIRINOX治疗野生型SPF小鼠的肿瘤中3-IAA氧化产物MOI增加(扩展数据图)。gydF4y2Ba7一个gydF4y2Ba).此外,MOI水平在肿瘤中显著降低gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba骨髓重建小鼠(扩展数据图。gydF4y2Ba7 bgydF4y2Ba).gydF4y2Ba
最后,考虑到芳基烃受体(AhR)的关键作用gydF4y2Ba)gydF4y2Ba作为3-IAA和其他吲哚的细胞内受体gydF4y2Ba27gydF4y2Ba,我们想知道gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba骨髓重建小鼠对3-IAA和FIRINOX具有抗性。肿瘤的大小gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba3-IAA和FIRINOX治疗后,骨髓重建小鼠的肿瘤减少程度与野生型重建小鼠相同(图2)。gydF4y2Ba2摄氏度gydF4y2Ba),反对AhR在调节3-IAA和FIRINOX治疗效果中的作用。此外,AhR在癌细胞中也是可有可无的gydF4y2BaAhrgydF4y2Ba-敲低的KPC细胞在体内对3-IAA和FIRINOX处理有反应(扩展数据图。gydF4y2Ba7 cgydF4y2Ba).gydF4y2Ba
这些数据表明,3-IAA和FIRINOX的疗效是由免疫细胞来源的MPO授权的,而不是通过AhR信号。gydF4y2Ba
3-IAA的作用取决于ROS和自噬gydF4y2Ba
MPO氧化3-IAA可诱导培养中性粒细胞产生ROSgydF4y2Ba23gydF4y2Ba和ROS是化疗诱导细胞死亡的主要介质gydF4y2Ba28gydF4y2Ba.因此,我们假设3-IAA和FIRINOX在MPO存在下的疗效是由ROS介导的。为了解决这一问题,我们用增加3-IAA、3-IAA和中性粒细胞剂量或3-IAA和MPO剂量的方法培养小鼠和人PDAC细胞,同时或不加化疗。3-IAA直接以剂量依赖的方式增加ROS。中性粒细胞或MPO的添加进一步增强了癌细胞中ROS的积累,MPO的添加降低了小鼠和人PDAC细胞系的活力(扩展数据图)。gydF4y2Ba7 d-kgydF4y2Ba).值得注意的是,直接添加3-IAA氧化产物MOI也增加了FIRINOX在小鼠和人PDAC细胞中的功效(扩展数据图)。gydF4y2Ba7 l, mgydF4y2Ba).gydF4y2Ba
此外,为了测试3-IAA和FIRINOX处理对体内ROS诱导的影响,我们分别用3-IAA和FIRINOX或单独用FIRINOX处理SPF小鼠。根据我们的体外数据,3-IAA和FIRINOX治疗诱导了高氧化应激,通过流式细胞术测量为癌细胞中的ROS,或在整个肿瘤组织学染色中测量为硝基酪氨酸。gydF4y2Ba7 n, ogydF4y2Ba).进一步加强ROS生成和3-IAA氧化之间的联系,我们观察到3-IAA和FIRINOX处理癌细胞后的ROS水平大大降低gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba与野生型骨髓重建小鼠相比,流式细胞术(扩展数据图;gydF4y2Ba7 pgydF4y2Ba).gydF4y2Ba
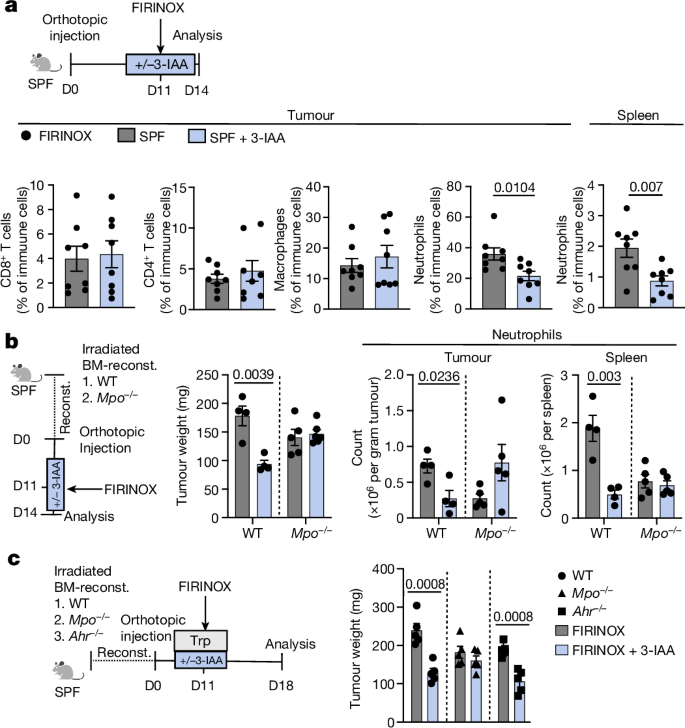
然后,我们想知道在3-IAA-和firinox治疗的肿瘤中,哪些氧化应激相关途径参与了ROS的积累。为此,我们分析了mRNA测序数据中已知的ros产生酶或ros降解酶的表达,将3-IAA和FIRINOX治疗小鼠的肿瘤与单独FIRINOX治疗小鼠的肿瘤进行比较(延长数据图)。gydF4y2Ba8gydF4y2Ba).我们发现ros降解酶谷胱甘肽过氧化物酶3 (GPX3)和谷胱甘肽过氧化物酶7 (GPX7)在体内被下调,3- iaa、FIRINOX和MPO在体外KPC细胞中导致GPX3和GPX7类似下调(延伸数据图)。gydF4y2Ba8 bgydF4y2Ba).击倒的gydF4y2BaGpx3gydF4y2Ba而且gydF4y2BaGpx7gydF4y2Ba在用FIRINOX治疗后,足以增加癌细胞中ROS的积累,并增加癌细胞对FIRINOX的易感性,其程度与3-IAA和FIRINOX相似(扩展数据图。gydF4y2Ba8 c, dgydF4y2Ba).值得注意的是,击倒gydF4y2BaGpx3gydF4y2Ba足以在体内建立对FIRINOX的敏感性(扩展数据图。gydF4y2Ba8 egydF4y2Ba).最后,我们可以证明,ROS积累对于3-IAA和FIRINOX的疗效至关重要,因为使用ROS清除剂治疗gydF4y2BaNgydF4y2Ba-乙酰半胱氨酸(NAC)在r -微生物定殖(即高3- iaa)小鼠中取消了FIRINOX的功效(图。gydF4y2Ba3gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,用R菌群定植gnotobio小鼠,原位注射KPC细胞。未处理或给予FIRINOX、NAC(第9-13天)或FIRINOX + NAC (gydF4y2BangydF4y2Ba每人5个)。显示了实验第20天的肿瘤重量。gydF4y2BabgydF4y2Ba,将携带原位KPC肿瘤的SPF小鼠替换为+/−3-IAA,用FIRINOX治疗,并根据指示进行分析。包含IHC,免疫组织化学。gydF4y2BacgydF4y2Ba,用苏木精和伊红(H&E)、LC3B或Ki67(左)染色的原位肿瘤的代表性图像及每个野区阳性细胞的各自统计数字(gydF4y2BangydF4y2Ba=每人5个)(右)。比例尺,50 μm。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,将GFP-LC3B-RFP报告细胞株Hy19636_GLRM注射到SPF小鼠体内,按指示处理小鼠(gydF4y2BangydF4y2Ba每人5个)。图表显示了第一天的GFP/RFP比值(gydF4y2BadgydF4y2Ba)和第三天的肿瘤重量(gydF4y2BaegydF4y2Ba)在FIRINOX治疗后。显示3倍放大的代表性合并免疫荧光图像或指示区域;比例尺,10 μm。gydF4y2BafgydF4y2Ba,将KPC癌细胞原位注射到r -microbiota定植的小鼠中,并按方案所示的方法进行治疗(gydF4y2BangydF4y2Ba= 4或5)。肿瘤重量显示在实验的第18天。gydF4y2BaggydF4y2Ba,用NR菌群定植的gnotobio小鼠的原位KPC肿瘤的肿瘤重量显示在指示治疗后9天(gydF4y2BangydF4y2Ba= 4或5). CQ,羟氯喹。一个实验(gydF4y2BacgydF4y2Ba)或两项独立实验中的一项(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba)。每个符号代表一只鼠标。错误条表示s.e.m.显著gydF4y2BaPgydF4y2Ba数值由单因素方差分析和Dunnett’s (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba)或杜凯(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)后验或Kruskal-Wallis后验及Dunn后验(gydF4y2BaggydF4y2Ba).gydF4y2Ba
接下来,我们想知道对高水平ROS的分子反应是什么。为了解决这一问题,我们对分离自SPF小鼠的肿瘤进行了靶向蛋白筛选和mRNA测序,这些小鼠分别接受3-IAA和FIRINOX或单独的FIRINOX治疗。gydF4y2Ba3 bgydF4y2Ba).自噬是从3-IAA和FIRINOX治疗的小鼠分离的肿瘤中下调的主要途径之一(扩展数据图。gydF4y2Ba8 f, ggydF4y2Ba及补充表格gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba3 gydF4y2Ba).值得注意的是,自噬是PDAC增殖和茁壮成长的必要代谢程序gydF4y2Ba29gydF4y2Ba.接下来,我们发现3-IAA和FIRINOX治疗SPF小鼠分离出的肿瘤中,自噬底物LC3B减少,p62/SQSTM增加(图2)。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba8 hgydF4y2Ba).与此一致,来自r -微生物定殖小鼠(高3-IAA)的肿瘤与来自nr定殖小鼠(低3-IAA)的肿瘤相比,LC3B丰度降低,p62/SQSTM1丰度增加(扩展数据图)。gydF4y2Ba8 i, jgydF4y2Ba).在3-IAA和FIRINOX治疗的小鼠中,LC3B和p62/SQSTM的变化伴随着肿瘤细胞增殖的下降,以Ki67的表达来衡量(图2)。gydF4y2Ba3 cgydF4y2Ba).然而,我们没有观察到凋亡细胞数量的变化,通过cleaved caspase-3测量。gydF4y2Ba8 kgydF4y2Ba),迟至治疗后三天。为了测试自噬下调是否是解释3-IAA和FIRINOX协同作用的重要下游机制,还是仅仅与观察到的癌细胞增殖减少有关,我们在体内建立了功能增加和功能丧失实验。首先,我们观察到用海藻糖二糖处理gydF4y2Ba30.gydF4y2Ba通过自噬报告细胞中GFP/RFP比值的降低来测量,使自噬活性正常化gydF4y2Ba31gydF4y2Ba(无花果。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba8 lgydF4y2Ba).其次,海藻糖足以完全逆转3-IAA和FIRINOX的治疗效果,类似于ROS清除剂NAC(图2)。gydF4y2Ba3 e, fgydF4y2Ba).第三,用自噬阻断剂羟氯喹治疗NR-微生物定植小鼠(低3-IAA)致敏的肿瘤到FIRINOX治疗(图。gydF4y2Ba3 ggydF4y2Ba).最后,通过强力霉素诱导的显性阴性ATG4B蛋白(mSt-ATG4B)抑制癌细胞的自噬gydF4y2Ba29gydF4y2Ba与未经强力霉素处理的对照细胞(mSt)或mSt- atg4b细胞相比,增加了SPF小鼠对FIRINOX治疗的敏感性(扩展数据图)。gydF4y2Ba8米gydF4y2Ba).gydF4y2Ba
总的来说,这些数据表明,在FIRINOX治疗过程中,当3-IAA和MPO存在时,ROS的积累增加,癌细胞的应激适应能力受损(即自噬下调),最终导致肿瘤细胞增殖能力下降。gydF4y2Ba
3-IAA具有治疗潜力gydF4y2Ba
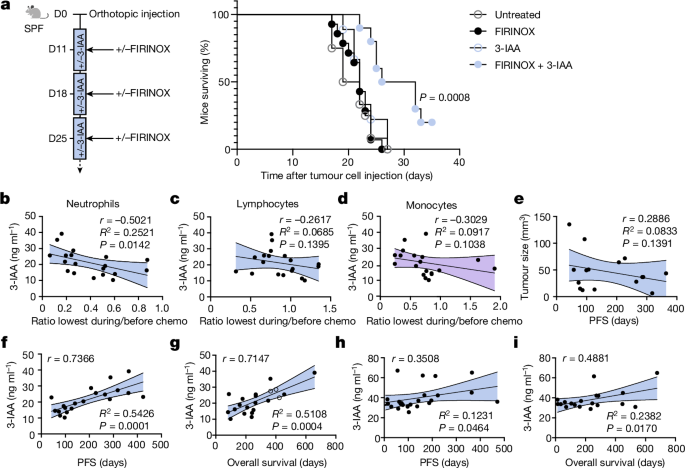
为了进一步研究3-IAA的潜在治疗意义,我们测试了重复应用3-IAA和FIRINOX对小鼠生存的影响,对其他癌症实体的治疗以及3-IAA与不同化疗组合(即GnP)的疗效。3-IAA和FIRINOX联合使用最多3个周期(但都不是单独使用),显著增加了原位PDAC的生存时间(图。gydF4y2Ba4gydF4y2Ba).值得注意的是,3-IAA在治疗皮下结直肠(MC38)或肺(LLC)肿瘤时也与FIRINOX协同作用(扩展数据图)。gydF4y2Ba9 a、bgydF4y2Ba),也与正位PDAC中的GnP协同作用(扩展数据图。gydF4y2Ba9 cgydF4y2Ba).这些发现强调了3-IAA在癌症治疗中的潜在作用。gydF4y2Ba
一个gydF4y2Ba, SPF小鼠原位注射Hy19636细胞,按指示进行治疗,其总生存率用Kaplan-Meier估计器描述(未经处理)gydF4y2BangydF4y2Ba= 12;FIRINOXgydF4y2BangydF4y2Ba= 14;3-IAAgydF4y2BangydF4y2Ba= 9;3-iaa + firinoxgydF4y2BangydF4y2Ba= 10)。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,通过化学发光免疫试验(CLIA)测量汉堡队列患者的3-IAA血清浓度,并与血液中性粒细胞(gydF4y2BabgydF4y2Ba)、淋巴细胞(gydF4y2BacgydF4y2Ba)或单核细胞(gydF4y2BadgydF4y2Ba)在总白细胞计数最低的时间点(化疗的前三个月内)计数,并在化疗开始前计数。gydF4y2BaegydF4y2Ba在汉堡队列患者中,CT扫描测量的肿瘤大小与PFS相关。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,汉堡队列患者2 ~ 3个化疗周期后3-IAA血清浓度与PFS相关(gydF4y2BafgydF4y2Ba)或总生存率(gydF4y2BaggydF4y2Ba).一名患者被排除在外gydF4y2BafgydF4y2Ba,因为患者的癌症在死亡前没有进展。以开圈为代表的患者仍然活着,因此排除在相关分析中gydF4y2BaggydF4y2Ba.gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba慕尼黑队列患者治疗开始前3-IAA血清浓度与PFS相关(gydF4y2BahgydF4y2Ba)或总生存率(gydF4y2Ba我gydF4y2Ba).每个符号代表一个病人。两个独立的实验合并在一起(gydF4y2Ba一个gydF4y2Ba).均值和95%置信区间。gydF4y2BaPgydF4y2Ba值由log-rank Mantel-Cox检验(gydF4y2Ba一个gydF4y2Ba)或简单线性回归和皮尔逊回归gydF4y2BargydF4y2Ba(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba).gydF4y2Ba
最后,我们想评估我们的发现在人类中的相关性。我们观察到对化疗有反应的患者中性粒细胞减少率较高,这与我们的小鼠数据和已知的中性粒细胞减少与PDAC预后之间的关联一致gydF4y2Ba22gydF4y2Ba(扩展数据图。gydF4y2Ba9 dgydF4y2Ba).值得注意的是,化疗后中性粒细胞水平下降,但淋巴细胞或单核细胞没有下降,与3-IAA血清浓度相关,这与他们不同水平的MPO所预期的一致(图。gydF4y2Ba4罪犯gydF4y2Ba).此外,我们观察到3-IAA血清浓度与PFS或总生存率显著相关(汉堡队列;扩展数据表gydF4y2Ba1克ydF4y2Ba),而继发性胆汁酸DCA则不存在。gydF4y2Ba4 f, ggydF4y2Ba和扩展数据图。gydF4y2Ba9 egydF4y2Ba).我们在路德维希-马克西米利安大学(LMU)医院的第二组mPDAC患者队列中验证了这些发现(慕尼黑队列;扩展数据表gydF4y2Ba1克ydF4y2Ba)(图。gydF4y2Ba4 h,我gydF4y2Ba).患者特异性(年龄、性别和体重)和肿瘤特异性(肿瘤大小和肿瘤标记物)变量均与PFS显著相关,这反映了其他临床可评估标志物在先验预测化疗反应方面的缺失价值。gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba9 fgydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
总之,我们的研究结果确定了微生物源性代谢物3-IAA是PDAC对化疗反应的关键放大器。当3-IAA和MPO在FIRINOX治疗过程中高浓度存在时,ROS的积累增加,癌细胞的应激适应能力受损,最终导致PDAC细胞增殖能力下降。尽管分析的患者数量有限(汉堡队列)gydF4y2BangydF4y2Ba= 23人,其中21人有可用血清样本;慕尼黑队列gydF4y2BangydF4y2Ba= 24),我们观察到化疗期间(汉堡队列)甚至化疗开始前(慕尼黑队列)测量的3-IAA血清浓度与PFS或总生存期之间存在很强的相关性。gydF4y2Ba
这些数据为开展旨在通过直接治疗或饮食干预提高化疗期间3-IAA血清浓度的临床试验奠定了早期前提,最终甚至提高PDAC NR患者的生存期。通过特定饲粮提高3-IAA底物色氨酸是很容易实现的;然而,这种方法受到菌群组成的影响,正如研究结果所表明的,饮食干预后,3-IAA血清浓度仅在r -菌群定植的小鼠中增加。因此,当有可能在良好的生产规范标准条件下生产3-IAA时,直接用3-IAA处理将是理想的,特别是考虑到它能够绕过不希望的微生物群的存在,正如我们在小鼠中用NR微生物群定殖的实验所显示的那样。gydF4y2Ba
在计划未来的临床试验之前,重要的是要考虑到,在没有化疗的情况下,吲哚或其他色氨酸代谢物可以通过PDAC中的AhR损害抗肿瘤免疫反应的发展gydF4y2Ba16gydF4y2Ba.然而,我们的数据显示,4 - 5天不进行化疗的3-IAA治疗不足以影响肿瘤的生长,仅在联合化疗时通过ahr独立机制降低肿瘤的生长。然而,在进行任何介入性研究之前,还需要更多的观察性研究。gydF4y2Ba
另一种方法是粪便微生物移植,目前正在试验用于治疗癌症患者gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,可能足以增加3-IAA的血清浓度,并相应地增加对化疗的反应,正如我们使用10个不同人类捐赠者的粪便进行的gnotobiomice实验所示。我们的研究表明gydF4y2Bab . fragilisgydF4y2Ba而且gydF4y2Ba亚种gydF4y2Ba在R患者的菌群中富集,并能够产生3-IAA。然而,考虑到大量在分类上不同的细菌种类能够产生3-IAA,需要更大规模的研究来揭示这些细菌是否确实负责R患者中3-IAA的产生(参考文献)。gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba).这些研究有助于缩小未来粪便微生物移植研究的供体选择范围。gydF4y2Ba
在通过3-IAA和FIRINOX治疗对肿瘤大小产生影响的同时,我们还观察到PDAC小鼠模型中中性粒细胞的减少。在患有PDAC的患者中,我们在Hamburg队列中观察到化疗期间中性粒细胞的减少与3-IAA的血清浓度呈正相关。这些数据表明,与小鼠一样,3-IAA也可促进人类中性粒细胞减少症的发展。然而,考虑到其他因素也可导致中性粒细胞减少,如化疗代谢改变、化疗药物排泄受阻或化疗剂量不同gydF4y2Ba32gydF4y2Ba在美国,需要针对这一特定方面的研究来确定3-IAA与人类中性粒细胞减少症之间是否存在因果关系。此外,由于中性粒细胞水平在许多癌症类型中是生存的关键预测因素,对其他癌症中所述机制的研究可能是有必要的gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
我们的发现有可能对PDAC和其他癌症类型(如结直肠癌)的治疗产生变革性的影响,特别是对接受基于firinox的治疗方案的患者。此外,我们的发现将引发研究的发展,以解决微生物源代谢产物对ros自噬轴的影响,以响应化疗治疗。gydF4y2Ba
方法gydF4y2Ba
患者与人体材料gydF4y2Ba
被诊断为mPDAC并计划使用GnP或FOLFIRINOX治疗的患者被纳入研究(gydF4y2BangydF4y2Ba= 30)。经汉堡伦理委员会(Ethikkommission der Ärztekammer Hamburg, Germany)批准,从所有患者获得知情同意。在治疗的前三个月接受抗生素治疗、治疗前未排便、未开始化疗或患有COVID-19的患者被排除在分析之外(gydF4y2BangydF4y2Ba= 7)。在化疗开始前使用家庭取样试剂盒(OMNIgene, Gut OMR-200)收集粪便进行散弹式宏基因组测序。测序后排除了一个样本,原因是样管过载导致固定不成功,微生物区系表现有限。因此,微生物群分析的最终队列包含22例患者。R和NR患者的分类主要基于肿瘤缩小至少25%,这是通过将治疗开始前的时间点与当地放射科医生评估的一线治疗期间显示最佳反应的时间点进行比较,CT扫描中原发肿瘤和最大转移的减少来计算的(通常认为20 - 30%的变化在CT反应评估中是显著的)gydF4y2Ba35gydF4y2Ba).在疾病稳定或缺失CT扫描的情况下,PFS超过140天的标准(真实世界FOLFIRINOX和GnP队列的中位数PFS)gydF4y2Ba36gydF4y2Ba)或血清肿瘤标志物下降至少40%(姑息性PDAC治疗的预后截止gydF4y2Ba37gydF4y2Ba)。用于功能实验的粪便收集在不含任何添加剂的试管中,直接运输到实验室,随后用20%甘油(Teknova, G1723)稀释,并在−80°C下冷冻。为了保存大部分供体微生物群用于功能实验,从厕所到冰柜的最大允许周转时间为4小时。化疗第3或第4周期抽血,与磷酸盐缓冲盐水(PBS) 1比1混合,梯度离心分离血浆。慕尼黑队列的血清材料在化疗开始前采集,并按照当地标准进行处理。经慕尼黑伦理委员会批准,所有患者均知情同意(项目编号:284-10)。gydF4y2Ba
动物模型gydF4y2Ba
本研究中使用的所有小鼠均具有C57BL/6基因背景。所有小鼠均按照机构审查委员会“Behörde für Soziales, Familie, Gesundheit und Verbraucherschutz”(德国汉堡)使用。将小鼠置于SPF级或无菌条件下,环境温度为20±2℃,湿度为55±10%,暗光循环12 h。年龄和性别相匹配的4到16周大的幼崽大部分被使用。gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba用于建立骨髓嵌合体的骨髓由S. Baldus和M. Mollenhauer提供。gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba用于建立骨髓嵌合体的骨髓由C. Esser提供。gydF4y2Ba
为了定植人类微生物群,将粪便解冻,用脑心灌注肉汤(BHI)清洗,并在BHI中稀释。将200微升的悬浮液口服给关在隔离笼中的无菌小鼠一次。2 - 4周后,肿瘤实验开始。gydF4y2Ba
在小型先导实验的基础上计算样本量,并在治疗开始前对小鼠进行随机化。由于复杂的治疗计划,治疗小鼠的人没有失明。原位PDAC模型为5 × 10gydF4y2Ba4gydF4y2Ba-10 × 10gydF4y2Ba4gydF4y2BaKpc, 2 × 10gydF4y2Ba5gydF4y2BaHy19636, 1 × 10gydF4y2Ba5gydF4y2BamSt- atg4b /mSt或1 × 10gydF4y2Ba5gydF4y2Ba以1:1的PBS和Matrigel (Corning, 356231)混合物原位注射敲除的KPC (AhR, GPX,打乱对照)细胞。除非另有指示,否则在注射肿瘤细胞后第20天评估肿瘤重量。皮下肿瘤生长2.5 × 10gydF4y2Ba5gydF4y2Balc - gfp或1 × 10gydF4y2Ba6gydF4y2BaMC38细胞被皮下注射到侧翼。皮下肿瘤生长每隔一天用卡尺测量一次。注射肿瘤细胞后第17天评估肿瘤重量。活动实验小鼠皮下肿瘤的最大允许直径为1.5厘米,并且没有超过限制。gydF4y2Ba
对于骨髓嵌合体,受体小鼠在骨髓移植前24小时接受9.6 Gy (BioBEAM 2000)照射。一天后,1 × 10gydF4y2Ba6gydF4y2Ba-4 × 10gydF4y2Ba6gydF4y2Ba从野生型中分离的骨髓细胞,gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba或gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba小鼠经静脉注射转移。转移后3 - 4周,原位注射癌细胞并按如下所述进行治疗。通过对肿瘤浸润免疫细胞的定量PCR (qPCR)验证成功植入。gydF4y2Ba
在指定的时间点(通常是癌细胞注射后第11天)开始腹腔内化疗。奥沙利铂(雅阁)5 mg kggydF4y2Ba−1gydF4y2Ba,伊立替康(雅阁)20 mg kggydF4y2Ba−1gydF4y2Ba5-FU(美达克)50 mg kggydF4y2Ba−1gydF4y2Ba是否像其他研究中描述的那样用于FIRINOX治疗gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.未使用叶酸和吉西他滨(Hexal) 120 mg kggydF4y2Ba−1gydF4y2Banab-紫杉醇(Celgene) 30 mg kggydF4y2Ba−1gydF4y2Ba用于GnP处理。从化疗前一天开始,每3天单独使用200 μg抗cd8抗体克隆53-6.7 (BioXcell, BE0004)或联合200 μg抗cd4抗体克隆GK1.5 (BioXcell, BE0003)治疗可实现T细胞的清除。对照组小鼠以相似的浓度和间隔用相应的同型对照克隆2A3 (BioXcell, BE0089)处理。自噬诱导是用两次海藻糖(Sigma, T9449)在3 g kg浓度的ip注射实现的gydF4y2Ba−1gydF4y2Ba化疗的前一天和当天。同样,60毫克千克gydF4y2Ba−1gydF4y2Ba在化疗前一天和化疗当天分别注射PBS溶解的氯喹(Sigma, C6628)。gydF4y2Ba
3-IAA (500 mg kggydF4y2Ba−1gydF4y2Ba),除另有指示外,每天用PBS溶解的吲哚乙酸钠盐(Sigma, I5148)口服灌胃,连续5天(化疗前2天至化疗后2天)。吲哚-3-丙酸;Sigma, 57400), GCA (Sigma, G2878),马尿酸(Sigma, 112003)和DCA (Sigma, 30960)溶解于PBS中的1 M NaOH中,并使用1 M HCl将ph调整为7.4。以500mg kg的浓度连续灌胃5天gydF4y2Ba−1gydF4y2Ba(3-IPA,马尿酸)或250毫克千克gydF4y2Ba−1gydF4y2Ba每个(GCA和DCA)。NAC (Sigma, a7250)在任意浓度为1 g l的饮用水中施用5天gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
在化疗前3天开始调整饮食色氨酸,直到治疗后1天。在一项实验中,色氨酸调制总共应用了14天。标准日粮(2.3 g kggydF4y2Ba−1gydF4y2Ba色氨酸;Altromin, 1320)改为无色氨酸的合成结晶AA (0 g kggydF4y2Ba−1gydF4y2Ba;S9336-E701)高色氨酸饲料或结晶AA色氨酸(12 g kg)gydF4y2Ba−1gydF4y2Ba;ssnif, S5714-E711)饮食。随后,饮食改回标准饮食。gydF4y2Ba
饲粮中多西环素(Sigma, D9891)剂量为625 mg kggydF4y2Ba−1gydF4y2Ba从癌细胞注射后第5天或第8天开始,总共持续7天。随后,饮食改回标准饮食。gydF4y2Ba
为了测量血清代谢物,在实验结束或指定时间点抽血。血液凝固30分钟后离心(1000gydF4y2BaggydF4y2Ba),其后10分钟。稀释血清,并按具体章节所述使用。gydF4y2Ba
DNA提取和鸟枪宏基因组学gydF4y2Ba
DNA提取时,样品用ZymoBIOMICS 96 MagBead DNA试剂盒(zyymo Research, D4302)分离,用zyymo DNA Clean和concentrizer -5 (zyymo Research, D4004)纯化。文库用NEBnext Ultra II DNA文库准备试剂盒for Illumina (New England Biolabs, E7645)制备,总DNA 150 ng,大小选择400-500 bp, 4× PCR循环。gydF4y2Ba
对于散弹宏基因组学,Illumina文库制备使用NEBNext Ultra II FS DNA文库准备试剂盒(New England Biolabs, E7805)。库的制备是根据制造商的说明进行的。使用AMPure XP珠(Beckman Coulter, A63882)进行大小选择,使用Illumina公司的NEBNext Multiplex寡核苷酸(New England Biolabs, E7335)进行7次PCR富集,然后进行Illumina NovaSeq (2 × 150 bp)测序。gydF4y2Ba
对于生物信息学分析,原始reads被修剪为低质量,并用bbduk对phix174和人类hg19基因组进行过滤(参考文献)。gydF4y2Ba40gydF4y2Ba).为了进行物种分类分析,所有文库都与统一人类胃肠道基因组集(gydF4y2BangydF4y2Ba= 4,644)使用BBMap(参考。gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba).定位率归一化为每百万转录本(TPM),基因组覆盖率(基因组宽度)小于10%的基因组被认为在样本中不普遍。数据以宏基因组操作分类单位(OTUs)总结为biom格式,并用phyloseq和LEfSe进行分析(参考文献)。gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba).使用HUMAnN3进行了物种水平的功能分析,也使用了人类微生物组的990万个基因综合参考目录gydF4y2Ba41gydF4y2Ba.gydF4y2Ba
菌株和分离gydF4y2Ba
叫多形拟杆菌gydF4y2Ba2079年(DSM),gydF4y2Bab . fragilisgydF4y2Ba(DSM 2151)及gydF4y2Ba普氏菌coprigydF4y2Ba(DSM 18205)来自德国微生物和细胞培养集(DSMZ)。为了分离细菌,将冷冻在甘油中的粪便样本解冻,并在BHI血液琼脂板(5%去纤维羊血和维生素K)上进行厌氧稀释gydF4y2Ba3 gydF4y2Ba)补充万古霉素。琼脂板在37℃培养箱中培养2天后,将单个菌落采摘到96孔板中的BHI-S培养基中,进一步培养24 h。用特异性引物PCR筛选得到的细菌培养物gydF4y2Ba亚种gydF4y2Ba(gydF4y2Bab .θgydF4y2BaF 5 ' -GAGGGTGTCGTATTTCCGAAGG-3 ' R 5 ' - gttccctgatccagtgtgttg -3 ')或gydF4y2Bab . fragilisgydF4y2Ba(gydF4y2Bab .碎片弹gydF4y2Baf5 ' -aatgattccgcatggtttca-3 ' r 5 ' -attttgggattagcatacgg-3 ')。在琼脂板上传代pcr阳性孔以获得纯培养物并通过Sanger测序进一步确认其身份后,将得到的菌株保存在BHI-S中,直到进一步使用。所有菌株在添加10%胎牛血清(FBS)和维生素K的BHI肉汤中进行厌氧培养和维持gydF4y2Ba3 gydF4y2Ba(BHI-S)。gydF4y2Ba
细菌上清液的提取gydF4y2Ba
添加1%色氨酸的BHI-S培养基从完全生长的隔夜细菌培养物(1:50比例)中接种,厌氧培养至指数期早期。培养物从厌氧室中取出,以4,700转/分(4,816gydF4y2BaggydF4y2Ba)室温5分钟。去除上清液,并立即在−20°C冷冻。gydF4y2Ba
16S rRNA测序gydF4y2Ba
使用DNeasy血液和组织试剂盒(Qiagen, 69504)从肿瘤中提取DNA。用蛋白酶K在ATL缓冲液中在56°C下消化约10 mg组织1小时。之后,样品按照制造商的规程进行处理。在样品提取过程中加入空白提取对照。gydF4y2Ba
根据先前的报道,使用引物对27F-338R双条形码方法扩增16S rRNA基因的可变区域V1和V2gydF4y2Ba45gydF4y2Ba.对于肿瘤,使用3.5µl DNA进行扩增,PCR产物使用琼脂糖凝胶电泳进行验证。最终PCR产物使用SequalPrep归一化板试剂盒(Thermo Fisher Scientific, A1051001)进行归一化,在Illumina MiSeq v3 2×300bp (Illumina)上进行等量混合和测序。测序后的解复用基于条形码序列中0错配。数据处理使用DADA2进行gydF4y2Ba46gydF4y2Ba大数据集工作流程(gydF4y2Bahttps://benjjneb.github.io/dada2/bigdata.htmlgydF4y2Ba;V1-V2区域调整的工作流程可以在这里找到:gydF4y2Bahttps://github.com/mruehlemann/ikmb_amplicon_processing/blob/master/dada2_16S_workflow.RgydF4y2Ba),形成扩增子序列变异(ASVs)丰富表。使用DADA2中提供的贝叶斯分类器和核糖体数据库项目(RDP)版本16版本对asv进行了分类注释。不能划分为属级的序列被归类为尽可能精细的分类学分类。gydF4y2Ba
代谢组学的屏幕gydF4y2Ba
我们使用超高压液相色谱-串联质谱(UPLC-MS /MS)在正电离和负电离模式下获取数据,从而对630种代谢物进行识别和定量。血浆样品使用MxP Quant 500试剂盒(Biocrates)根据制造商的说明进行处理。简单地说,将10µl血浆样品、校准标准品和对照品转移到含有内标的过滤器上进行内标校准。过滤器使用压力管汇(Waters)在氮气流下干燥。样品用衍生化试剂异氰酸苯酯孵育60 min。在氮气下干燥后,用5 mmol l提取分析物gydF4y2Ba−1gydF4y2Ba进一步稀释洗脱液进行UPLC-MS /MS分析。有针对性的分析涵盖630种代谢物(gydF4y2Bahttps://biocrates.com/mxp-quant-500-kit/gydF4y2Ba)经UPLC分离和流动注射分析(FIA)后,用MS/MS检测。每次测量需要进行两次UPLC测试和三次FIA测试,以覆盖所有代谢物。所有分析均在ACQUITY UPLC i级系统(Waters)上进行,该系统与Xevo TQ-S质谱仪(Waters)耦合。采用C18 lc色谱柱(Biocrates),以0.2%甲酸水溶液和0.2%甲酸乙腈为洗脱体系进行反相色谱分离。FIA的溶剂是甲醇,由套件制造商提供一种改进剂。UPLC-MS /MS结果的数据分析基于7点曲线或一点校准和内部标准归一化。低于较低阈值的值被设置为零。浓度数据使用MetaboAnalyst v.5进行分析。浓度在分析和原始前进行对数转换gydF4y2BaPgydF4y2Ba值和日志gydF4y2Ba2 gydF4y2Ba-变换后的折叠变化值如图所示。gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
3-IAA和DCA CLIAgydF4y2Ba
为了量化3-IAA或DCA血清浓度,用PBS和化学发光免疫试验(CLIA)将小鼠或人血清稀释1至10 (Abbexa, 3-IAA abx190011;DCA 258844)根据制造商的协议进行。为了检测培养物中的3-IAA,上清液按上述方法处理后直接用于检测。使用flustar Omega (BMG Labtech)检测化学发光,每个孔采样1秒,每次试验分别调整增益3,400至4,000。浓度用提供的标准进行测定,用Prism 8.4.0进行插值。gydF4y2Ba
肿瘤组织中3-IAA和MOI的测定gydF4y2Ba
将冷冻的肿瘤组织与1:1-3的冰冷甲醇混合,并使用均质器(Precyllys 24 touch)以5,500 rpm的速度使用0.4 mm的珠子均质2 × 30秒。萃取物离心(10,000gydF4y2BaggydF4y2Ba上清液用于LC-MS /MS分析。反相色谱采用联苯固定相(Raptor biphenyl (Restek),尺寸:50 mm × 2.1 mm ID;粒径:2.7 μ m)洗脱液A:水+ 0.1%甲酸+ 5mm醋酸铵,洗脱液B:甲醇+ 0.1%甲酸+ 5mm醋酸铵。流速设置为0.5 ml / min。从95%洗脱液A开始洗脱,在0.5 min内线性下降至75%。在回到初始条件之前,该组合物保持4分钟。注入体积为2µl,柱温为55℃。采用MRM (multiple reaction monitoring)模式检测3-IAA和MOI。电喷雾正电离后监测到以下转变:3-IAA:gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba176.2 > 103.0;gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba176.2 > 130.2;我:gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba148.1 > 120.2;gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba148.1 > 130.2;gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba148.1 > 133.1。定量是根据标准曲线进行的。gydF4y2Ba
免疫细胞分离及流式细胞术gydF4y2Ba
肿瘤被切成相似大小的小块。用冷PBS冲洗肿瘤,用RPMI (Sigma, 61870044)补充10% FBS (Gibco, 10500064), 2.5 mg ml消化gydF4y2Ba−1gydF4y2Ba胶原酶D (Roche, 11088866001)和0.2 mg mlgydF4y2Ba−1gydF4y2BaDNase l (Roche, 11284932001)在37°C连续摇动35分钟。之后,悬浮液通过40 μ m细胞过滤器过滤,并用冷PBS淬灭。随后,免疫细胞或肿瘤细胞用Fc阻断染色和活/死染色(赛默飞世尔科学公司L34957和L10119)在黑暗中染色30分钟。然后清洗细胞,用指示的流式细胞仪抗体染色,再次在黑暗中孵育30分钟。流式细胞仪在Fortessa流式细胞仪(BD)上进行。为了评估免疫细胞的细胞因子谱,用50 ng ml重新刺激T细胞gydF4y2Ba−1gydF4y2BaPMA, 500 ng mlgydF4y2Ba−1gydF4y2Ba离子霉素1µg mlgydF4y2Ba−1gydF4y2Babrefeldin A在37°C下进行3小时。表面染色后,使用eBioscience Foxp3细胞内染色试剂盒(00-5523-00)对细胞进行固定和渗透。使用以下细胞内抗体:IFNγ(1:200稀释)和TNF(1:40稀释)。使用以下表面抗体对淋巴细胞(CD3(1:300稀释)、CD4(1:500稀释)、CD8(1:400稀释)、CD19(1:100稀释)、CD44(1:500稀释)、PD-1(1:40稀释)、NK1.1(1:40稀释)或髓系细胞(CD11b(1:80稀释)、CD11c(1:300稀释)、CD45(1:80稀释)、Ly6G(1:80稀释)、Ly6C(1:600稀释)、Ly6B(1:200稀释)、CD115(1:300稀释)、F4/80(1:60稀释)、MHCll(1:60稀释)进行分类。上皮癌细胞用EPCAM抗体(1:200稀释)染色。Ly6B染色采用山羊抗大鼠IgG抗体(1:400稀释)。流式细胞仪使用2500 ~ 5000个珠(Spherotec, ACBP 100-10)计数细胞。根据制造商的方案,使用PI/Annexin V染色评估体外中性粒细胞的生存能力。经上述组织消化后,测定体内免疫细胞中ROS的表达。然后,ROS染料CellROX (Thermo Fisher Scientific, C10422)以1:10 00稀释与流式细胞仪抗体平行染色。 Software analysis and histogram generation was carried out using FlowJo v.10.
细胞培养gydF4y2Ba
KPC细胞来源于Ximbio,目录号153474;Hy19636_GLRM报告细胞和mSt- atg4b /mSt细胞由A. Kimmelman提供gydF4y2Ba31gydF4y2Ba;MC38和LLC-GFP (ATCC)细胞由A. Giannou提供;MIA PaCa-2、BxPC-3、T3M-4细胞(均为ATCC)由C. Güngör提供。所有细胞支原体污染检测均为阴性。细胞在37°C和5% CO的标准条件下保存gydF4y2Ba2 gydF4y2Ba并定期进行目视检查。细胞在DMEM GlutaMAX (Thermo Fisher Scientific, 10566016)中培养,补充青霉素和链霉素(Gibco, 15140122)和10% FBS (Gibco, 10500064)。在体外实验中,癌细胞在96孔板中以每孔5000 - 10,000个细胞被镀。除了中性粒细胞共培养、gpx敲低细胞处理或与MPO共同处理的实验外,允许细胞过夜播种。随后,开始使用指定化合物和治疗时间进行治疗。3-IAA或3-IPA (3-IPA, Sigma, 57400;3-IAA, Sigma, I3750)溶解于PBS中的1 M NaOH中,ph调整为7.4,根据需要使用1 M HCl或DMSO。NAC在PBS中稀释,并以1 mM的浓度使用。HgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba(Sigma, H1009)在400 μ M浓度下使用。gydF4y2Ba
根据制造商的方案,使用MTT或MTS试验(Abcam, ab201191和ab197010)评估肿瘤细胞的活力和增殖。使用flustar Omega (BMG Labtech)评估吸光度。在其他实验中,使用SYTOX (Thermo Fisher Scientific, S34857), PI (Biolegend, 421301)和2500 - 5000计数珠(Spherotec, ACBP 100-10)作为参考,流式细胞术评估了活性。同时,根据制造商的方案,使用CellROX (Thermo Fisher Scientific, C10422)测量细胞内ROS,并通过流式细胞仪进行评估。gydF4y2Ba
中性粒细胞或T细胞从健康小鼠的骨髓或脾脏中分离,并使用荧光激活细胞分选(FACS)进行分类,如LY6GgydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2Ba细胞受体)和βgydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba或CD8gydF4y2Ba+gydF4y2Ba,分别。在96孔板中以每孔20,000-50,000的浓度播种细胞。中性粒细胞或T细胞的活力在实验指定时间采用SYTOX(赛默飞世尔科学公司,S34857)或PI/Annexin V染色(Biolegend公司,640914)的流式细胞术进行评估。在一些实验中,200 mU mlgydF4y2Ba−1gydF4y2BaMPO或400 mU mlgydF4y2Ba−1gydF4y2Ba添加MPO (Merck, 475911)或指示浓度的MOI (Sigma, 493397)。通过MPO的释放来评估中性粒细胞的脱粒情况。共1 × 10gydF4y2Ba6gydF4y2Ba中性粒细胞按上述方法采用流式细胞仪进行分类。中性粒细胞在HBSS中孵育(Gibco, 14065-56)和指定的治疗,或gydF4y2BaNgydF4y2Ba-formylmethionyl-leucyl-phenylalanine (fMLP;加入Merck, F3506)作为阳性对照。孵育30分钟后,使用MPO活性测定试剂盒(Abcam, ab105136)根据制造商的方案测定MPO活性。中性粒细胞的NET形成与指示化合物或100 nM phorbol-12-肉豆蔻酸-13-乙酸酯(PMA;Merck, 524400)作为阳性对照。流式细胞术检测NETs为sytox阳性细胞。gydF4y2Ba
中性粒细胞前经流式细胞仪(流式细胞仪)分类(谱系阴性(CD3,NK1.1,CD19,B220)gydF4y2Ba−gydF4y2Ba, CD115gydF4y2Ba−gydF4y2Ba, Ly6BgydF4y2Ba+gydF4y2Ba, Ly6GgydF4y2Baint-lowgydF4y2Ba),如上文所述gydF4y2Ba26gydF4y2Ba在96孔板中以每孔2万到5万的密度培养。应用指示处理,流式细胞仪PI染色评估生存能力。gydF4y2Ba
MPO活性gydF4y2Ba
肿瘤内或骨髓来源的中性粒细胞(LY6GgydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2Ba)或前中性粒细胞(世系阴性(CD3,NK1.1,CD19,B220)gydF4y2Ba−gydF4y2Ba, CD115gydF4y2Ba−gydF4y2Ba, Ly6BgydF4y2Ba+gydF4y2Ba, Ly6GgydF4y2Baint-lowgydF4y2Ba)以FACS分类。根据制造商的方案(Abcam, ab219925),共处理了50,000个细胞,使用MPO活性测定试剂盒进行MPO活性测定。荧光分析使用flustar Omega (BMG Labtech)。MPO活度根据制造商协议建议的标准曲线计算。gydF4y2Ba
蛋白质的屏幕gydF4y2Ba
每组3只小鼠的肿瘤组织汇总,使用scioExtract buffer (Sciomics)提取蛋白质。用scioDye 2 (Sciomics)在调整后的蛋白质浓度下标记样品2小时。参考样品用scioDye 1标记(Sciomics)。2 h后停止反应,用PBS交换缓冲液。所有标记的蛋白质样品保存在−20°C直到使用。样本采用基于scioDiscover抗体微阵列(Sciomics)的参考设计的双色方法进行分析。这些阵列在Hybstation 4800 (Tecan)上用scioBlock (Sciomics)进行阻塞,然后使用双色方法与参考样品进行竞争性孵育。孵育3 h后,用1× PBSTT彻底清洗载玻片,0.1× PBS清水冲洗,氮气干燥。使用Powerscanner (Tecan)进行滑片扫描,仪器激光功率恒定,PMT设置不变。用GenePix Pro 6.0 (Molecular Devices)进行斑点分割。 Acquired raw data were analysed using the (LIMMA) package of R-Bioconductor after uploading the median signal intensities. For normalization, a specialized invariant Lowess method was applied. Downregulated proteins (M-value of < −0.35) or upregulated proteins (>0.35) in the 3-IAA and FIRINOX sample were uploaded to the STING database (https://string-db.org/cgi/input.plgydF4y2Ba).采用标准管道进行KEGG富集分析。只有错误发现率(FDR) < 0.05的通路被认为具有统计学意义。gydF4y2Ba
RNA提取和mRNA测序gydF4y2Ba
新鲜冷冻肿瘤组织用TRIzol试剂(赛默飞世尔科学公司,15596018)裂解,RNA用氯仿-异丙醇法提取。用聚t寡聚附着磁珠从总RNA中纯化mRNA。裂解后,使用随机六聚体引物合成第一链cDNA,然后合成第二链cDNA。经端修、a尾、转接器结扎、尺寸选择、扩增纯化后,文库制备完成。用Qubit和qPCR对文库进行定量,并用Bioanalyzer进行大小分布检测。定量文库在Illumina平台上测序,每个样本至少有6000万次读取。gydF4y2Ba
用fastp (v0.20.1)处理序列读取,从序列读取的3 '端删除测序适配器序列和低质量(Phred质量评分低于15)序列。然后,使用STAR将读取数据对齐到鼠标参考程序集(GRCm39.104)gydF4y2Ba47gydF4y2Ba.用DESeq2评估差异表达(参考文献)。gydF4y2Ba48gydF4y2Ba).如果对应的绝对对数,则认为该基因表达差异显著gydF4y2Ba2 gydF4y2Ba-转换折叠变化(log2FC)不小于0.6,此外,FDR不超过0.1的值。使用fgsea对自噬反应组通路(R-HSA-9612973)进行基因集富集分析(GSEA) (v.4.1)gydF4y2Ba49gydF4y2Ba.gydF4y2Ba
qPCRgydF4y2Ba
根据制造商的方案,使用Trizol试剂(Invitrogen,15596018)和总RNA提取试剂盒(Qiagen, 74004/74104)从细胞系中提取总RNA。高容量cDNA合成试剂盒(Thermo Fisher Scientific, 4368813)用于cDNA合成。引物和探针均购自应用生物系统公司。小鼠引物和探针是:gydF4y2BaGpx3gydF4y2Ba(Mm00492427_m1),gydF4y2BaGpx7gydF4y2Ba(Mm00481133),gydF4y2BaAhrgydF4y2Ba(Mm00478932_m1)。qPCR使用TaqMan Master Mix (Thermo Fisher Scientific, 4369016)在StepOne Plus系统(Applied Biosystems)上进行。每次试验使用40到44个周期,技术上使用双重复或三重复。如果技术重复的三个值中至少有两个是不可检测的,则认为该表达不可检测。相对表达式归一化为gydF4y2BaGapdhgydF4y2Ba(Mm99999915_g1)。gydF4y2Ba
shRNAs的慢病毒转移gydF4y2Ba
在人U6启动子(MISSION pLKO.1-puro)的控制下,表达短发夹rna (shRNAs)的慢病毒载体直接针对小鼠gydF4y2BaGpx3gydF4y2Ba(TRCN000076539),鼠标gydF4y2BaGpx7gydF4y2Ba(TRCN0000076563)和鼠标gydF4y2BaAhrgydF4y2Ba(TRCN0000218025)和非靶向对照shRNA (SHC002,打乱)从Sigma-Aldrich中获得。慢病毒粒子的产生已在其他地方详细描述过gydF4y2Ba50gydF4y2Ba,并可在网上(gydF4y2Bahttp://www.LentiGO-Vectors.degydF4y2Ba).对于KPC细胞与hiv -1衍生的慢病毒载体的转导,2.5 × 10gydF4y2Ba4gydF4y2Ba细胞镀于0.5 ml含8 μg ml的培养基中gydF4y2Ba−1gydF4y2Ba24孔板每孔聚苯乙烯。接种后,添加10 μl VSV-G伪分型、非浓缩慢病毒颗粒可使shrna和嘌呤霉素耐药基因稳定整合到细胞基因组中。为了提高自旋接种的转导率,将平板在1000下离心gydF4y2BaggydF4y2Ba25℃保温1小时。1 μg ml成功转导细胞的选择gydF4y2Ba−1gydF4y2Ba在转导后4天开始在培养基中加入嘌呤霉素。gydF4y2Ba
免疫组化和定量gydF4y2Ba
使用ASP300S脱水机(徕卡)和EG1160组织包埋系统(徕卡)将组织固定在4%福尔马林PBS中,并在石蜡中包埋。石蜡切片(2µm)切割后H&E染色或进行免疫组化处理:脱蜡后,内源过氧化物酶(PBS中3%过氧化氢)失活后,使用Ventana Benchmark XT机(Ventana)进行抗体特异性热介导抗原提取。切片被阻塞(10% FCS在PBS中),然后用抗lc3b抗体(1:400稀释,赛默飞世尔科学,PA1-46286)孵育;抗硝基酪氨酸抗体(1:100稀释,赛默飞世尔科学,A-21285);抗cc3抗体(1:100稀释,细胞信号,9661);p62/SQSTM1(1:500稀释,赛默飞世尔科学公司,PA5-20839);抗ki67抗体(1:100稀释,Abcam, 15580)。特异性结合检测采用Ultra View Universal DAB detection Kit (Ventana, Roche),包含二抗、DAB染色和苏木精反染试剂。使用NanoZoomer 2.0-HT (Hamamatsu Photonics)扫描幻灯片,并使用Fiji拍摄代表性图像。gydF4y2Ba
LC3B、Ki67、硝基酪氨酸和CC3采用盲法定量。使用ImageJ v.2.1.0/1.53c检测阳性细胞,并根据各自抗体的染色强度调整阈值,并对所有使用相同染色分析的肿瘤保持阈值。每个样品3 ~ 5个场,每250 ~ 500 × 500 μm场(10× ~ 40×倍率)计数阳性细胞数。gydF4y2Ba
宽视野显微镜gydF4y2Ba
为了可视化Hy19636_GLRM PDAC细胞的GFP-LC3-RFP报告信号表达,将组织固定在2% PFA溶液中,4°C过夜,在含有30%蔗糖的PBS中孵育,并在干冰上嵌入Tissue-Tek OCT化合物(Sakura Finetek)。为了进一步分析,采用了7 μm切片。使用THUNDER Imager 3D活细胞和3D细胞培养(徕卡微系统)进行宽视野成像,并配备40× 1.10 NA水浸泡物镜。首先使用阳性对照组织优化LED功率和曝光时间以及其他系统特定设置,并在不同组的图像采集之间保持不变,以提供最佳的可比性。对于每个组织切片,平均随机选择5个感兴趣的区域并成像用于后续定量分析。使用ImageJ成像软件进行文件导航、色彩平衡调整和图像分析。GFP和RFP采用ImageJ v.2.1.0/1.53c进行定量。每个肿瘤至少5个区域的每个各自信号的平均荧光强度在每张幻灯片上确定。gydF4y2Ba
图形抽象gydF4y2Ba
数字gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba2 a, dgydF4y2Ba和图中的小图标。gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba是由BioRender.com创建的。gydF4y2Ba
统计分析gydF4y2Ba
除另有说明外,所有统计分析均使用GraphPad Prism 9.3.1进行。采用Shapiro-Wilk或Kolmogorov-Smirnov检验正态性和对数正态性。如果没有给出正态性,则进行非参数检验。如无特殊说明,测试为双面进行,结果显著(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2BaPgydF4y2Ba数值会显示出来。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
RNA-seq数据已提交给欧洲核苷酸档案(ENA)。它们在注册编号下可公开获取gydF4y2BaPRJEB58222gydF4y2Ba.Shotgun宏基因组测序数据经过筛选,用于人类阅读,可在登录号下获得gydF4y2BaPRJEB58222gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Nevala-Plagemann, C., Hidalgo, M. & Garrido-Laguna, I.从最先进的治疗方法到晚期胰腺癌的新疗法。gydF4y2BaNat. Rev. clinin。肿瘤防治杂志。gydF4y2Ba17gydF4y2Ba, 108-123(2020)。gydF4y2Ba
Rahib, L., Wehner, M. R., Matrisian, L. M.和Nead, K. T.对2040年美国癌症发病率和死亡率的估计预测。gydF4y2BaJAMA Netw。开放gydF4y2Ba4gydF4y2Ba, e214708(2021)。gydF4y2Ba
冯·霍夫等人。nab-紫杉醇联合吉西他滨可提高胰腺癌患者的生存率。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba369gydF4y2Ba, 1691-1703(2013)。gydF4y2Ba
康罗伊,T.等。FOLFIRINOX或吉西他滨作为胰腺癌的辅助治疗。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba379gydF4y2Ba, 2395-2406(2018)。gydF4y2Ba
Raghavan, S.等。微环境驱动胰腺癌细胞状态、可塑性和药物反应。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 6119-6137(2021)。gydF4y2Ba
昂,K. L.等。基因组学驱动的晚期胰腺癌精准医学:COMPASS试验的早期结果。gydF4y2Ba中国。癌症Res。gydF4y2Ba24gydF4y2Ba, 1344-1354(2018)。gydF4y2Ba
麦奎德,J. L.,丹尼尔,C. R., Helmink, B. A. & Wargo, J. A.调节微生物组以改善癌症治疗反应。gydF4y2Ba柳叶刀杂志。gydF4y2Ba20.gydF4y2Ba, e77-e91(2019)。gydF4y2Ba
Davar, D.等人。粪便微生物移植克服抗pd -1治疗黑色素瘤患者的耐药性。gydF4y2Ba科学gydF4y2Ba371gydF4y2Ba, 595-602(2021)。gydF4y2Ba
巴鲁克,e.n.等人。粪便微生物移植促进免疫治疗难治性黑色素瘤患者的反应。gydF4y2Ba科学gydF4y2Ba371gydF4y2Ba, 602-609(2021)。gydF4y2Ba
斯宾塞,c.n.等人。膳食纤维和益生菌影响肠道微生物群和黑素瘤免疫治疗反应。gydF4y2Ba科学gydF4y2Ba374gydF4y2Ba, 1632-1640(2021)。gydF4y2Ba
里克尔梅等人。肿瘤微生物组的多样性和组成影响胰腺癌的预后。gydF4y2Ba细胞gydF4y2Ba178gydF4y2Ba, 795-806(2019)。gydF4y2Ba
Balachandran, V. P.等。胰腺癌长期幸存者中独特新抗原性质的鉴定。gydF4y2Ba自然gydF4y2Ba551gydF4y2Ba, 512-516(2017)。gydF4y2Ba
托马斯,R. M.和乔宾,C.胰腺健康和疾病中的微生物群:微生物组研究的下一个前沿。gydF4y2Ba胃肠醇。乙醇。gydF4y2Ba17gydF4y2Ba, 53-64(2020)。gydF4y2Ba
罗素,W. R.等人。人体肠道中主要的苯丙类代谢物可由蛋白质的微生物发酵产生。gydF4y2Ba摩尔。减轻。食物Res。gydF4y2Ba57gydF4y2Ba, 523-535(2013)。gydF4y2Ba
Kaur, H., Bose, C. & Mande, S. S.肠道微生物组和肠脑轴的色氨酸代谢:硅内分析。gydF4y2Ba前面。>。gydF4y2Ba13gydF4y2Ba, 1365(2019)。gydF4y2Ba
Hezaveh, K.等。色氨酸衍生的微生物代谢产物激活肿瘤相关巨噬细胞中的芳香烃受体以抑制抗肿瘤免疫。gydF4y2Ba免疫力gydF4y2Ba55gydF4y2Ba, 324-340(2022)。gydF4y2Ba
Opitz, C. A.等。针对色氨酸分解代谢在癌症中的治疗潜力。gydF4y2BaBr。j .癌症gydF4y2Ba122gydF4y2Ba, 30-44(2020)。gydF4y2Ba
Gál, E.等。胆汁通过MUC4的过表达加速胰腺导管腺癌细胞的致癌过程。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba, 22088(2020)。gydF4y2Ba
Yoshimoto, S.等人。肥胖诱导的肠道微生物代谢产物通过衰老分泌体促进肝癌的发生。gydF4y2Ba自然gydF4y2Ba499gydF4y2Ba, 97-101(2013)。gydF4y2Ba
雷耶斯,c.m.等人。新辅助治疗通过消耗原生免疫细胞重塑胰腺癌微环境。gydF4y2Ba中国。癌症Res。gydF4y2Ba26gydF4y2Ba, 220-231(2020)。gydF4y2Ba
Pushalkar, S.等人。胰腺癌微生物组通过诱导先天和适应性免疫抑制促进肿瘤发生。gydF4y2Ba癌症。gydF4y2Ba8gydF4y2Ba, 403-416(2018)。gydF4y2Ba
Roviello, G.等人。转移性胰腺癌患者中性粒细胞减少与nab-紫杉醇和吉西他滨生存率的关系。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba, 19281(2020)。gydF4y2Ba
德梅罗,陈志强,陈志强,宫坂,陈志强。吲哚乙酸对培养大鼠中性粒细胞氧代谢的影响。gydF4y2Ba杂志。gydF4y2Ba31gydF4y2Ba, 573-578(1998)。gydF4y2Ba
Folkes, L. K., Dennis, M. F., Stratford, M. R. L., Candeias, L. P. & Wardman, P.过氧化物酶催化吲哚-3-乙酸及其类似物对脂膜、DNA和体外哺乳动物细胞的影响。gydF4y2Ba物化学。杂志。gydF4y2Ba57gydF4y2Ba, 375-382(1999)。gydF4y2Ba
Folkes, L. K., Rossiter, S. & Wardman, P.对硫醇的反应性和3-亚甲基-2-恶吲哚的细胞毒性,来自吲哚-3-乙酸的细胞毒素,对过氧化物酶的激活。gydF4y2Ba化学。Toxicol >,gydF4y2Ba15gydF4y2Ba, 877-882(2002)。gydF4y2Ba
金,M. H.等。晚期系小鼠中性粒细胞前体种群在适应需求的颗粒生成过程中表现出动态变化。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 39084(2017)。gydF4y2Ba
Stockinger, B. Di Meglio, P. Gialitakis, M. & Duarte, J. H.芳基烃受体:免疫系统中的多任务处理。gydF4y2Ba为基础。启Immunol。gydF4y2Ba32gydF4y2Ba, 403-432(2014)。gydF4y2Ba
Perillo, B.等人。ROS在癌症治疗中的应用:光明的一面。gydF4y2BaExp、Mol、Med。gydF4y2Ba52gydF4y2Ba, 192-203(2020)。gydF4y2Ba
杨,A.等。自噬通过细胞自主和非自主机制维持胰腺癌的生长。gydF4y2Ba癌症。gydF4y2Ba8gydF4y2Ba, 276-287(2018)。gydF4y2Ba
德博斯,B. J.等。海藻糖抑制溶质载体2A (SLC2A)蛋白诱导自噬,预防肝脏脂肪变性。gydF4y2Ba科学。信号。gydF4y2Ba9gydF4y2Ba, ra21(2016)。gydF4y2Ba
山本等。自噬通过降解MHC-I促进胰腺癌的免疫逃避。gydF4y2Ba自然gydF4y2Ba581gydF4y2Ba, 100-105(2020)。gydF4y2Ba
Svedberg, A.等人。使用全外显子组测序研究非小细胞肺癌患者吉西他滨/卡铂诱导的白细胞减少和中性粒细胞减少的遗传关联。gydF4y2Ba肺癌gydF4y2Ba147gydF4y2Ba, 106-114(2020)。gydF4y2Ba
罗西尼等人。FOLFOXIRI/贝伐珠单抗治疗转移性结直肠癌患者中性粒细胞减少症和发热性中性粒细胞减少症的临床影响:GONO对TRIBE和TRIBE2研究的汇总分析gydF4y2BaESMO开放gydF4y2Ba6gydF4y2Ba, 100293(2021)。gydF4y2Ba
加久罗等人。晚期非小细胞肺癌化疗诱导的中性粒细胞减少症和治疗疗效:6项随机试验的汇总分析gydF4y2BaBMC癌症gydF4y2Ba21gydF4y2Ba, 549(2021)。gydF4y2Ba
海耶斯,s.a.等。肺癌患者CT容积测量与RECIST反应的比较。gydF4y2Ba欧元。j . Radiol。gydF4y2Ba85gydF4y2Ba, 524-533(2016)。gydF4y2Ba
Riedl, J. M.等。吉西他滨/nab-紫杉醇与FOLFIRINOX用于晚期胰腺癌的姑息性一线治疗:倾向评分分析。gydF4y2Ba欧元。j .癌症gydF4y2Ba151gydF4y2Ba, 3-13(2021)。gydF4y2Ba
Koom, W. S., Seong, J., Kim, Y. B., Pyun, H. O. & Song, S. Y. CA 19-9作为晚期胰腺癌患者接受放化疗的反应和生存的预测因子。gydF4y2BaInt。j . Radiat。肿瘤防治杂志。医学杂志。理论物理。gydF4y2Ba73gydF4y2Ba, 1148-1154(2009)。gydF4y2Ba
格里尔森,pm等。MK2/Hsp27轴是胰腺导管腺癌在基因毒性应激下的主要生存机制。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba13gydF4y2Ba, 5445(2021)。gydF4y2Ba
多赛特,M.等。PD-1/PD-L1通路:结直肠癌免疫原性化疗的适应性免疫抵抗机制gydF4y2BaOncoimmunologygydF4y2Ba7gydF4y2Ba, e1433981(2018)。gydF4y2Ba
布什内尔,B。gydF4y2BaBBMap:一个快速,准确,拼接感知校准器。gydF4y2Ba报告没有。LBNL-7065E(劳伦斯伯克利国家实验室,2014)。gydF4y2Ba
Beghini, F.等人。将不同微生物群落的分类、功能和菌株水平分析与bioBakery 3集成。gydF4y2BaeLifegydF4y2Ba10gydF4y2Ba, e65088(2021)。gydF4y2Ba
阿尔梅达,A.等。来自人类肠道微生物组的204,938个参考基因组的统一目录。gydF4y2Ba生物科技Nat。》。gydF4y2Ba39gydF4y2Ba中国农业科学,2015,34(2)。gydF4y2Ba
McMurdie, P. J. & Holmes, S. Phyloseq:一个R包,用于微生物组普查数据的可重复交互分析和图形化。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba8gydF4y2Ba, e61217(2013)。gydF4y2Ba
Segata, N.等人。segata - lefse gb - 2011。gydF4y2Ba基因组医学杂志。gydF4y2Ba12gydF4y2Ba, r60(2011)。gydF4y2Ba
卡波拉索,J. G.等。Illumina HiSeq和MiSeq平台的超高通量微生物群落分析。gydF4y2BaISME J。gydF4y2Ba6gydF4y2Ba, 1621-1624(2012)。gydF4y2Ba
卡拉汉,B. J.等。DADA2: Illumina扩增子数据的高分辨率样本推断。gydF4y2BaNat方法。gydF4y2Ba13gydF4y2Ba, 581-583(2016)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
贾萨尔,B.等。反应组途径知识库。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, d498-d503(2020)。gydF4y2Ba
Kempski, J.等人。IL22BP介导淋巴毒素对小鼠和人结直肠癌的抗肿瘤作用。gydF4y2Ba胃肠病学gydF4y2Ba159gydF4y2Ba, 1417-1430(2020)。gydF4y2Ba
确认gydF4y2Ba
我们感谢小鼠病理学核心设施、生物信息学核心设施、细胞计数和细胞分选核心设施以及汉堡-埃彭多夫大学医学中心gnotobiomice设施成员的技术援助;患者及其家属,以及所有研究地点的调查人员和研究人员;C. Saygi用于RNA-seq数据的差异表达分析;C.技术援助Bang;C.埃塞尔gydF4y2BaAhrgydF4y2Ba- / -gydF4y2Ba敲除骨髓;S. Baldus, M. Mollenhauer, K. Tinaz和C. VosengydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba敲除骨髓;M.哈姆利负责编辑;以及医学生物计量学和流行病学研究所的H.平施密特提供统计建议。本研究由Brigitte und Dr. Konstanze wegen - stiftung基金资助给J.T.;德国癌症援助奖学金授予J.T., M. Schönlein和L.K.,并授予J.T.和N.G. 70114815;ERC StG 715271授予N.G.;ERC COG 865466授予S.H.;由德国研究基金会(DFG)项目467261817和SFB841(通过B. Fehse)向K.R. V.G.P.提供的资金由德国联邦部长für Bildung und Forschung (eMed财团“纤维图”)和诺和诺德基金会(青年研究者奖;NNF21OC0066381)。此外,T.R.L、L.A.和T.S.由大众基金会的倡议“Niedersächsisches Vorab”(76251-99)和德国卓越战略下的德国研究基金会(EXC 2155,项目号390874280)资助。 F.C. is supported by an iCARE-2 fellowship issued by AIRC and the European Union’s Horizon 2020 research and innovation program under the Marie Skłodowska-Curie grant agreement no. 800924. The work of J.T.S. is supported by the German Cancer Consortium (DKTK), by the Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) through 405344257 (SI 1549/3–2) and SI1549/4–1, and by the German Federal Ministry of Education and Research (BMBF; 01KD2206A/SATURN3). M.T.-A. and J.T.S. are members of the German Cancer Consortium (DKTK). Figure1gydF4y2Ba扩展数据图gydF4y2Ba2 a, dgydF4y2Ba整个图形中的小图标都是用BioRender.com创建的。gydF4y2Ba
资金gydF4y2Ba
由Universitätsklinikum Hamburg-Eppendorf (UKE)提供的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
J.T.执行或监督了所有的实验,进行了大部分的数据分析,撰写了手稿并设计了项目。Y.X.帮助进行实验工作,并进行了盲法肿瘤评估。进行生物信息学微生物区系分析。M. Schönlein帮助招募病人和编辑手稿。l.k., A.D.G.和P.P.帮助建立了实验小鼠模型和gnotobiotic小鼠实验。D.K.和V.G.P.获得了宽视场显微图像。a。a。b。提取和处理DNA用于鸟枪宏基因组学。M.P.和T.R.建立并获得了代谢组学数据。F.C.协助流式细胞仪分析。K.R.和M.J.进行了慢病毒shRNA敲除。 L.A. extracted and cultured bacterial strains from the stool of R patients. T.S.B. helped with experimental work. M.T.-A. and J.T.S. provided intellectual feedback and support. D.Z., S.B., F.G.U. and A.S. helped with patient recruitment. T.S. provided the shotgun metagenomic pipeline and intellectual feedback. C.G. provided cancer cell lines and advice. J.R.I. and C.B. provided intellectual feedback and support and edited the manuscript. M. Sinn provided clinical supervision and feedback, edited the manuscript and helped recruit patients. A.C.K. provided autophagy reporter cells and intellectual feedback and edited the manuscript. S.H. supervised the research and edited the paper. N.G. designed and supervised the project and wrote the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
D.Z.获得了阿斯利康和安进的差旅支持,阿斯利康和罗氏的酬金。S.B.报告了来自阿斯利康、BMS、Celgene、Incyte、Janssen Cilag、MSD和Servier的科学报告和有偿咨询的酬金,以及Celgene的研究支持。J.T.S.接受阿斯利康、拜耳、勃林格殷格翰、百时美施贵宝、Immunocore、MSD Sharp Dohme、诺华、罗氏/基因泰克和施维雅作为顾问或继续医学教育演讲的酬金。他的研究机构获得了来自Abalos Therapeutics, Boehringer Ingelheim, Bristol-Myers Squibb, Celgene, Eisbach Bio和Roche/Genentech的研究资金;他持有Pharma15的所有权并任职于董事会。C.B.报告了来自赛诺菲安万特、Merck KgA、Bristol-Myers Squibb、Merck Sharp & Dohme、Lilly Imclone、拜耳医疗保健、GSO合同研究、AOK莱茵-汉堡和诺华的个人费用。M. Sinn获得了阿斯利康、安进、BMS、MSD、Incyte、皮埃尔法布尔、辉瑞施维耶和赛诺菲的酬金,并获得了安进、阿斯利康、拜耳、BMS、Incyte、MSD、皮埃尔法布尔、罗氏和施维耶的临床研究(机构)支持。N.G.报告了来自罗氏的财务支持。所有这些都在提交的工作之外。A.C.K.拥有Vescor Therapeutics, OncoRev的财务利益,并且是胰腺癌kras调节代谢途径和氧化还原控制途径的专利发明人,以GOT1为治疗方法,以丙氨酸运输为目标,以及铁代谢的自噬控制。 A.C.K. is on the scientific advisory board of Rafael/Cornerstone Pharmaceuticals and has been a consultant for Deciphera and Abbvie. The remaining authors declare no competing interests.
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Filipe Cabreiro, Marco Cassatella和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1汉堡队列中患有mPDAC的R和NR患者的生存和菌群分析。gydF4y2Ba
一个gydF4y2Ba该研究招募了30名患者。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,排除非符合条件的患者后,可分析23例患者的PFS (gydF4y2BabgydF4y2Ba)和总生存期(gydF4y2BacgydF4y2Ba).响应器的PFS和OS分别表示(R,gydF4y2BangydF4y2Ba= 11,蓝色)和非应答者(NR,gydF4y2BangydF4y2Ba= 12,红色)病人。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,由于样本收集错误导致测序失败,排除了一个样本后,分析了22例患者的微生物区系。gydF4y2BadgydF4y2Ba,微生物区系LEfSe分析分别显示R或NR患者中细菌类群富集的线性判别分析(LDA)评分。gydF4y2BaegydF4y2Ba,属热图与沃德患者聚类。gydF4y2BafgydF4y2Ba,微生物区系多样性用Shannon指数进行比较。方框表示数值的25至75% (gydF4y2BafgydF4y2Ba),误差条表示中位数,表示显著p值,采用Gehan-Breslow-Wilcoxon检验(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)或双尾Wilcoxon检验(gydF4y2BafgydF4y2Ba).gydF4y2Ba
扩展数据图2 R菌群诱导对FIRINOX处理的反应。gydF4y2Ba
一个gydF4y2Ba,收集5例患有mPDAC的R和NR患者的菌群,并转移到gnotobio小鼠。9例采用FIRINOX, 1例采用GnP。PFS (gydF4y2BabgydF4y2Ba)及操作系统(gydF4y2BacgydF4y2Ba),用Kaplan-Meier估计量描述用于菌群转移实验的患者。在4个不同供体的单独实验中,一组小鼠定植R菌群,一组小鼠定植NR菌群。粪便转移后,无菌小鼠(gydF4y2BadgydF4y2Ba)接受KPC肿瘤细胞原位注射,并在实验的第11天不治疗(n = 22 (NR)或20 (R))或用FIRINOX治疗一次(n = 23 (NR)或20 (R))。gydF4y2BaegydF4y2Ba,在实验的第20天,描述了各实验组原位肿瘤的肿瘤重量。gydF4y2BafgydF4y2Ba,从e的不同实验中随机选择肿瘤,使用16S rRNA测序分析瘤内细菌(n = 12)。表中显示了不同肿瘤(T1-12)、HgydF4y2Ba2 gydF4y2BaO或阳性对照。gydF4y2BaggydF4y2Ba,每次实验随机选择n = 3- 5只不同供体的小鼠,分析血清中3- iaa。gydF4y2BahgydF4y2Ba,宏基因组测序数据分析了一组产生3- iaa的细菌的丰度。增加的丰度gydF4y2Bab . fragilisgydF4y2Ba而且gydF4y2Ba亚种gydF4y2Ba在NR或R患者化疗期间和化疗前的粪便样本中检测到,用于gnotobio小鼠实验(每组5个供体,每个患者1-3个样本,每组n = 12)。gydF4y2Ba我gydF4y2Ba, 3-IAA在缺乏(gydF4y2Ba普氏菌coprigydF4y2Ba)和有能力(gydF4y2Ba亚种gydF4y2Ba而且gydF4y2Bab . fragilisgydF4y2Ba)根据基因组预测生产3-IAA。特征菌株包括gydF4y2Bap . coprigydF4y2Ba(DSM18205),gydF4y2Bab . fragilisgydF4y2Ba(BF DSM2151, Bf0901, Bf0902)和gydF4y2Ba亚种gydF4y2Ba(DSM, Bt0901, Bt0902)。菌株均在含1%色氨酸的BHI中培养,菌株BFi2也单独在BHI中培养(n = 3个生物重复)。gydF4y2BajgydF4y2Ba, SPF小鼠原位注射KPC细胞。小鼠在肿瘤细胞注射后7天开始补充无色氨酸的标准饮食(2.3 g/kg色氨酸)或高色氨酸饮食(12 g/kg色氨酸),共14天(n = 3)。gydF4y2BakgydF4y2Ba,如gydF4y2BajgydF4y2Ba,除饮食干预共4天后再恢复标准饮食外。在饮食干预后9天评估肿瘤重量(n = 3或4)。gydF4y2BalgydF4y2Ba, NR微生物定植小鼠(红色)分别饲喂标准饲粮(SD)或高色氨酸饲粮(TRP高)4天。在干预第四天抽血,用3-IAA CLIA检测血清中3-IAA (n = 4)。gydF4y2Ba米gydF4y2Ba,小鼠肿瘤大小gydF4y2BalgydF4y2Ba(n = 3或4)。每个符号代表一只老鼠,人或gydF4y2Ba在体外gydF4y2Ba复制。进行了一项实验(gydF4y2BafgydF4y2Ba,gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba)或四个(gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)独立的实验汇集在一起。误差条表示SEM,晶须表示10%和90% (gydF4y2BahgydF4y2Ba),表示p值显著,采用Gehan-Breslow-Wilcoxon检验(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba),单因素方差分析,然后是Tukey 's (gydF4y2BaegydF4y2Ba,gydF4y2Ba米gydF4y2Ba)或邓尼特(gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba)事后检验,双向方差分析(gydF4y2BaggydF4y2Ba)、双尾Wilcoxon配对秩检验(gydF4y2BahgydF4y2Ba)或双尾t检验(gydF4y2BalgydF4y2Ba).gydF4y2Ba
扩展数据图3 3- iaa诱导PDAC小鼠模型对FIRINOX的反应。gydF4y2Ba
一个gydF4y2Ba分别于3- iaa灌胃后2、6、24 h用CLIA法测定SPF级小鼠(n = 3只)3- iaa血清中3- iaa的浓度。以r -微生物定植的无菌小鼠的血清浓度为对照。gydF4y2BabgydF4y2Ba, SPF小鼠原位注射KPC细胞,并给予FIRINOX或FIRINOX + 3-IAA两种处理(n = 5)。实验第20天的肿瘤重量在统计数据中描述。gydF4y2BacgydF4y2Ba, nr定植的gnotobio小鼠原位注射KPC肿瘤细胞。9天后,小鼠用+/−3- iaa替代5天(d9-13),并按照实验方案(n = 3或4)进行+/−FIRINOX治疗。在实验的第20天显示肿瘤重量。gydF4y2BadgydF4y2Ba, SPF小鼠原位注射KPC肿瘤细胞。在肿瘤细胞注射后第9天,小鼠分别给予500 mg/kg 3-IAA、3-IPA或250 mg/kg GCA和250 mg/kg DCA治疗,连续5天(n = 4)。第11天采用FIRINOX治疗。在实验第20天显示肿瘤重量。gydF4y2BaegydF4y2Ba,如gydF4y2BadgydF4y2Ba,除用FIRINOX、FIRINOX + 3-IAA (500 mg/kg)或FIRINOX +海尿酸(500 mg/kg) (n = 4或5)处理的小鼠外,每个符号代表一只小鼠。一个实验(gydF4y2BaegydF4y2Ba)或两个独立实验中的一个(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba).误差条表示SEM,显著p值表示,并由Kruskal-Wallis检验和Dunn 's事后检验确定(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba),或单因素方差分析,再加上Tukey 's (gydF4y2BabgydF4y2Ba)或邓尼特(gydF4y2BadgydF4y2Ba)事后测试。gydF4y2Ba
图4来自gnotobiomice的KPC肿瘤浸润免疫细胞。gydF4y2Ba
一个gydF4y2Ba,流式细胞术门控策略分类免疫亚群(左图)或细胞内细胞因子和共抑制受体(右图)。在活CD45上使用以下标记组合确定免疫亚群gydF4y2Ba+gydF4y2Ba免疫细胞:CD8gydF4y2Ba+gydF4y2BaT细胞(CD11bgydF4y2Ba−gydF4y2BaCD3gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2Ba);CD4gydF4y2Ba+gydF4y2BaT细胞(CD11bgydF4y2Ba−gydF4y2BaCD3gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba);中性粒细胞(CD11bgydF4y2Ba+gydF4y2BaLy6GgydF4y2Ba+gydF4y2Ba);和巨噬细胞(CD11bgydF4y2Ba+gydF4y2BaLy6GgydF4y2Ba−gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba).gydF4y2BabgydF4y2Ba,在实验第20天,分析由R或NR菌群定植的gnotobio小鼠原位肿瘤免疫细胞的免疫亚群或细胞因子谱和PD-1表达。每个符号代表一只鼠标。3到5个独立的实验被合并(n = 11到23)。误差条表示扫描电镜,显著的p值表示,并通过双尾t检验确定。gydF4y2Ba
扩展数据图5 CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞对于3-IAA和FIRINOX的疗效是可有可无的。gydF4y2Ba
r -microbiota定植的gnotobio小鼠原位注射KPC肿瘤细胞。在使用FIRINOX治疗前,小鼠每3天注射同型对照抗体或cd8消耗抗体。肿瘤重量(gydF4y2Ba一个gydF4y2Ba)和肿瘤内CD8的耗尽作用gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BabgydF4y2Ba)相对于总免疫细胞(CD45gydF4y2Ba+gydF4y2Ba),流式细胞仪检测,在实验第20天显示(n = 3)。gydF4y2BacgydF4y2Ba,如gydF4y2Ba一个gydF4y2Ba除了CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞同时耗尽(n = 3或4)。gydF4y2BadgydF4y2Ba, r -微生物定植的原位KPC肿瘤gnotobio小鼠分别用FIRINOX、FIRINOX +高色氨酸饮食(d8-12) +同型对照抗体或FIRINOX +高色氨酸饮食(d8-12) + CD4/ cd8消耗抗体(n = 4或5)治疗。描述实验第20天的肿瘤重量。gydF4y2BaegydF4y2Ba,如gydF4y2BacgydF4y2Ba,除SPF小鼠用3-IAA +/−FIRINOX和CD4/ cd8消耗或同型对照抗体处理外(n = 4)。在实验第20天描述肿瘤重量。每个符号代表一只鼠标。各进行一次实验。误差条表示SEM,显著p值表示,并通过双尾t检验(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)、单因素方差分析(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)后验或Kruskal-Wallis后验及Dunn后验(gydF4y2BaegydF4y2Ba).gydF4y2Ba
图6 3-IAA和化疗诱导中性粒细胞细胞死亡。gydF4y2Ba
一个gydF4y2Ba+/−1000 μM 3-IAA和+/−FIRINOX (3.2 μM奥沙利铂、5.6 μM伊立替康和19.2 μM 5-FU)培养24 h。通过流式细胞术评估生存能力(n = 3,生物重复)。gydF4y2BabgydF4y2Ba在5万个经facs分类的骨髓来源中性粒细胞、中性粒细胞前体(系阴性,CD115)中测定了MPO活性gydF4y2Ba−gydF4y2Ba, Ly6BgydF4y2Ba+gydF4y2Ba, Ly6GgydF4y2Baint-lowgydF4y2Ba)来自骨髓或pdac浸润中性粒细胞,使用荧光MPO活性测定试剂盒(n = 4,生物重复)。gydF4y2BacgydF4y2Ba,在增加剂量的3-IAA +/−MPO +/−FIRINOX (3.2 μM奥沙利铂,5.6 μM伊立替康和19.2 μM 5-FU;N = 3,生物重复)。培养48 h后,流式细胞仪检测细胞数量。gydF4y2BadgydF4y2Ba,在增加剂量的3-IAA +/−FIRINOX (3.2 μM奥沙利铂,5.6 μM伊立替康和19.2 μM 5-FU;N = 3,生物重复)。培养48 h后,流式细胞仪检测细胞数量。gydF4y2BaegydF4y2Ba,如gydF4y2Ba一个gydF4y2Ba除中性粒细胞外,在+/−奥沙利铂(8 μM奥沙利铂)和1000 μM 3- iaa、1000 μM 3- ipa或DMSO浓度相似的条件下(n = 3 ~ 6,生物重复)培养。gydF4y2BafgydF4y2Ba,如gydF4y2BacgydF4y2Ba除了中性粒细胞的细胞死亡用流式细胞术Annexin V和PI染色。频率显示相对于总中性粒细胞(n = 3,生物重复)。gydF4y2BaggydF4y2Ba,如gydF4y2BacgydF4y2Ba除处理3小时后通过SYTOX DNA染色确定NET形成外(n = 3,生物重复)。gydF4y2BahgydF4y2Ba,脱粒量为1 × 10gydF4y2Ba6gydF4y2Ba采用MPO活性测定试剂盒(gydF4y2BangydF4y2Ba= 3,生物重复)。gydF4y2Ba我gydF4y2Ba,将KPC肿瘤细胞原位注射到SPF小鼠体内,连续5天给予+/−500 mg/kg 3-IAA治疗,第11天给予FIRINOX治疗(各n = 5)。在FIRINOX治疗后第3天,流式细胞术分析脾脏和肿瘤的免疫细胞。图示脾脏或肿瘤中中性粒细胞计数。gydF4y2BajgydF4y2Ba,如gydF4y2Ba我gydF4y2Ba,除3-IAA外,未应用FIRINOX (n = 5)。每个符号代表一只小鼠或一个体外复制。一个实验(gydF4y2BabgydF4y2Ba)或三分之一(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)或两个(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba)独立实验。误差条表示SEM,显著p值表示,并由单向方差分析和Dunnett 's (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba)事后检验或双尾t检验(gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba).gydF4y2Ba
图7 3-IAA和MPO增加ROS,降低细胞活力。gydF4y2Ba
一个gydF4y2Ba,在治疗5小时后,使用LC-MS /MS(左)或MOI(右)测量从使用FIRINOX +/−3- iaa处理的SPF小鼠分离出的肿瘤中3- iaa的浓度(n = 3个生物重复)。gydF4y2BabgydF4y2Ba,在分离自WT的肿瘤中测量3-IAA(左)或MOI(右)的浓度gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba治疗5小时后,通过LC-MS /MS对经FIRINOX + 3- iaa处理的骨髓重建小鼠(n = 3或4个生物重复)。gydF4y2BacgydF4y2BaSPF小鼠给予KPC对照或gydF4y2BaAhrgydF4y2BaKD细胞原位移植,分别用FIRINOX (d11)或FIRINOX + 3-IAA (d9-13)处理(n = 4或5)。在实验第20天评估肿瘤重量。gydF4y2BadgydF4y2Ba, KPC肿瘤细胞在增加剂量的3-IAA +/−奥沙利铂(8 μM奥沙利铂;N = 2-3个生物重复)。采用CellROX染色,流式细胞仪检测ROS的表达。增加3-IAA +/−5 × 10剂量培养Hy19636细胞gydF4y2Ba4gydF4y2Ba中性粒细胞(gydF4y2BaegydF4y2Ba)或MPO 200mU/ml (gydF4y2BafgydF4y2Ba+/−FIRINOX (1.6 μM奥沙利铂,2.8 μM伊立替康和9.6 μM 5-FU;N = 2-3个生物重复)。通过流式细胞仪检测ROS的表达。为了清晰起见,只显示了相关组的p值。MIA PaCa-2 (gydF4y2BaggydF4y2Ba), t3m-4 (gydF4y2BahgydF4y2Ba)或Hy19636 (gydF4y2Ba我gydF4y2Ba)细胞与3- iaa +/−FIRINOX (3.2 μM奥沙利铂、5.6 μM伊立替康和19.2 μM 5-FU)增加剂量培养6 h (n = 3个生物重复)。通过MTS/MTT法评估细胞活力,并在48小时后显示相对于未处理细胞的活力。KPC (gydF4y2BajgydF4y2Ba)或MIA PaCa-2 (gydF4y2BakgydF4y2Ba3-IAA +/−MPO 400 mU/ml +/−FIRINOX (3.2 μM奥沙利铂,5.6 μM伊立替康,19.2 μM 5-FU;N = 3个生物重复)。培养48 h后,流式细胞仪检测细胞数量。Hy19636 (gydF4y2BalgydF4y2Ba)或MIA PaCa-2 (gydF4y2Ba米gydF4y2Ba)细胞在MOI(100、200或400 μM) +/−FIRINOX (1.6 μM奥沙利铂、2.8 μM伊立替康和9.6 μM 5-FU;N = 5 ~ 12个生物重复)。使用MTS试验评估细胞活力,并在24小时后显示相对于未处理细胞的活力。gydF4y2BangydF4y2Ba,将KPC肿瘤细胞原位注射到SPF小鼠体内,不治疗或分别用FIRINOX (d11)、3-IAA (d9-13)或3-IAA和FIRINOX治疗(各n = 5)。统计数据和代表性图片显示,用硝基酪氨酸(ROS)染色治疗3天后,原位肿瘤发生。gydF4y2BaogydF4y2Ba, SPF小鼠注射原位肿瘤,并用FIRINOX或FIRINOX + 3-IAA治疗(各n = 5)。处理5h后,流式细胞仪检测ROS积累情况。癌细胞的ROS水平(EpcamgydF4y2Ba+gydF4y2Ba), T细胞(CD45gydF4y2Ba+gydF4y2BaCD3gydF4y2Ba+gydF4y2Ba)或髓系细胞(CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2Ba)。gydF4y2BapgydF4y2Ba,辐照和WT (n = 5)或gydF4y2BaMpogydF4y2Ba- / -gydF4y2Ba(n = 3)骨髓重建小鼠原位接受KPC细胞,用FIRINOX或FIRINOX + 3- iaa处理gydF4y2BaogydF4y2Ba.用流式细胞仪测定ROS水平gydF4y2BaogydF4y2Ba.一个(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BangydF4y2Ba)或三分之一(gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba)或两个(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BajgydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba,gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba)独立实验。误差条表示SEM或中值(gydF4y2BangydF4y2Ba),表示p值显著,用双尾t检验(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba)、单因素方差分析(gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba)或杜凯(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)事后测试。gydF4y2Ba
扩展数据图8 3-IAA和FIRINOX治疗减少体内自噬。gydF4y2Ba
一个gydF4y2Ba,与FIRINOX + 3- iaa处理的肿瘤相比,在FIRINOX处理小鼠的肿瘤mRNA测序数据中发现ros产生或降解酶的正常化表达(n = 3个生物重复;p值:GPX3 (0.00012), GPX7 (1.2*10gydF4y2Ba−8gydF4y2Ba, nox4(0.023))。gydF4y2BabgydF4y2Ba, KPC肿瘤细胞在FIRINOX (3.2 μM奥沙利铂,5.6 μM伊立替康,19.2 μM 5-FU) +/−10 μM 3-IAA和400 mU/ml MPO (n = 4个生物重复)的作用下培养。处理24 h后,采用qPCR方法检测GPX 3和7的RNA表达。表达被描述为相对于管家基因。gydF4y2BacgydF4y2Ba,打乱对照转染细胞,gydF4y2BaGpx3gydF4y2Ba或gydF4y2BaGpx7gydF4y2Ba用+/−FIRINOX (3.2 μM奥沙利铂,5.6 μM伊立替康和19.2 μM 5-FU) +/−10 μM 3- iaa和MPO处理,流式细胞术检测ROS (n = 3或4个生物重复)。gydF4y2BadgydF4y2Ba如gydF4y2BacgydF4y2Ba除使用流式细胞术计算细胞数量外(n = 4个生物重复)。gydF4y2BaegydF4y2Ba, SPF小鼠使用scramble control或GPX3 KD细胞注射原位肿瘤,并在实验的第11天(n = 5或6)用+/−FIRINOX治疗。在FIRINOX治疗后的第8天测量肿瘤大小。gydF4y2BafgydF4y2Ba, GSEA富集图显示,与经FIRINOX和3- iaa处理的肿瘤相比,经FIRINOX治疗的小鼠获得的总肿瘤中反应组途径自噬的阳性富集(n = 3个生物重复)。gydF4y2BaggydF4y2Ba,将KPC肿瘤细胞原位注射到SPF小鼠体内,分别用3- iaa和FIRINOX或单独用FIRINOX治疗(各n = 3)。在FIRINOX治疗后1天,对瘤内蛋白进行分析和比较。对3-IAA和firinox治疗小鼠肿瘤中下调的蛋白进行了富集KEGG通路的分析。在SI表中描述了前10个通路,并提供了蛋白质和上调或下调通路的完整列表gydF4y2Ba1克ydF4y2Ba来gydF4y2Ba3 gydF4y2Ba.gydF4y2BahgydF4y2Ba, KPC肿瘤细胞原位注射SPF小鼠。治疗后第3天对小鼠进行+/−FIRINOX (d11)、+/−3-IAA (d9-13)和p62/SQSTM1染色分析。统计显示p62/SQSTM1的数量gydF4y2Ba高gydF4y2Ba每个字段的单元格(每个n = 5)。展示有代表性的图片。标尺为100 μm。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba,将KPC肿瘤细胞原位注射到定殖R或NR菌群(n = 3或4)的gnotobio小鼠中。对小鼠进行+/−FIRINOX和LC3-l/ll (gydF4y2Ba我gydF4y2Ba)或p62/SQSTM1 (gydF4y2BajgydF4y2Ba)染色,于实验第20天进行分析。统计显示LC3-l/ll的数量gydF4y2Ba高gydF4y2Ba或p62 / SQSTM1gydF4y2Ba高gydF4y2Ba每个字段的单元格(n = 4)。肿瘤来自三个独立的实验,每个实验都有不同的捐赠者。展示有代表性的图片。标尺为100 μm。gydF4y2BakgydF4y2Ba时,将KPC肿瘤细胞原位注射到SPF小鼠体内,并进行处理和分析gydF4y2BahgydF4y2Ba,除对cleaved caspase-3 (CC3,凋亡)染色外。标尺为50 μm。gydF4y2BalgydF4y2Ba, SPF小鼠原位注射GFP-LC3B-RFP报告细胞,分别用FIRINOX + 3-IAA、海藻糖或FIRINOX + 3-IAA +海藻糖处理(各5只)。通过亮场成像分析肿瘤的GFP/RFP比值。每组的GFP/RFP比值显示出来。gydF4y2Ba米gydF4y2Ba, SPF小鼠注射(mSt - atg4b)或mSt对照细胞。小鼠分别通过饮食给予强力霉素治疗7天(d5至d12)或标准食物,并给予+/−FIRINOX治疗(n = 4或5只)。描述了实验第18天的肿瘤大小。有代表性的图片显示了实验结束时的肿瘤。比例尺显示一厘米。一个(gydF4y2Ba一个gydF4y2Ba,gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba)或两项独立实验中的一项(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2BalgydF4y2Ba)或三个不同长度强力霉素治疗的独立实验(gydF4y2Ba米gydF4y2Ba)。每个符号代表一只或一只鼠标gydF4y2Ba在体外gydF4y2Ba复制。柱状表示SEM (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2Ba米gydF4y2Ba)或中位数(gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba),表示显著p值,并按方法部分(gydF4y2Ba一个gydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba),采用双尾Mann-Whitney检验(gydF4y2BabgydF4y2Ba)单因素方差分析,然后是Tukey 's (gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba,gydF4y2Ba米gydF4y2Ba)或邓尼特(gydF4y2BalgydF4y2Ba)后验或Kruskal-Wallis测验及Dunn 's测验(gydF4y2BahgydF4y2Ba,gydF4y2BakgydF4y2Ba)事后测试。gydF4y2Ba
图9 3-IAA和化疗联合治疗结直肠癌和肺癌细胞系有效。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba, MC38结直肠癌细胞系(n = 5或6;gydF4y2Ba一个gydF4y2Ba)或LLC肺癌细胞系(n = 4或5;gydF4y2BabgydF4y2Ba)皮下注射,口服+/−FIRINOX和+/−3-IAA (500 mg/kg)。每隔一天测量一次肿瘤,并将肿瘤重量按比例缩放至实验第17天。gydF4y2BacgydF4y2Ba,建立原位KPC肿瘤,SPF小鼠给予一次GNP +/−3-IAA (500 mg/kg;N = 4个)。化疗后7天评估肿瘤重量(d18)。gydF4y2BadgydF4y2Ba统计显示中性粒细胞减少症(<1,5*10gydF4y2Ba9gydF4y2Ba/l)在前6个化疗周期中,汉堡组对化疗有反应或无反应的患者(n = 11 R和12 NR)。gydF4y2BaegydF4y2Ba在汉堡队列患者的血清中,在2 - 3个化疗周期后测量DCA浓度,并与PFS (n = 20)或总生存期(n = 18)相关。每个符号代表一个病人。gydF4y2BafgydF4y2Ba在汉堡队列中,使用单变量Cox比例风险模型来确定指示变量对PFS的影响。一个实验(gydF4y2BabgydF4y2Ba)或两项单独实验中的一项(gydF4y2Ba一个gydF4y2Ba)。误差条表示SEM,显著p值表示,并由单向方差分析和Dunnett事后检验(gydF4y2Ba一个gydF4y2Ba,左统计),Kruskal-Wallis检验,然后是Dunn 's (gydF4y2BabgydF4y2Ba,左统计量)事后检验,混合效应分析,Dunnett事后检验(gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba,右统计量),双尾t检验(gydF4y2BacgydF4y2Ba)、双面卡方检验(gydF4y2BadgydF4y2Ba)、简单线性回归和皮尔逊回归gydF4y2BargydF4y2Ba(gydF4y2BaegydF4y2Ba)或考克斯回归(gydF4y2BafgydF4y2Ba).gydF4y2Ba
补充信息gydF4y2Ba
补充表1gydF4y2Ba
蛋白质筛选比较从3-IAA和firinox治疗小鼠分离的肿瘤与仅从firinox治疗小鼠分离的肿瘤(对照)。按方法进行蛋白质筛选和分析。gydF4y2Ba
补充表2gydF4y2Ba
从3-IAA和firinox处理的小鼠分离的肿瘤中蛋白KEGG通路下调。选择与仅使用firinox治疗的肿瘤相比差异< - 0.35的蛋白质(表1),并按照方法中所述进行分析。gydF4y2Ba
补充表3gydF4y2Ba
从3-IAA和firinox处理的小鼠分离的肿瘤中蛋白KEGG通路上调。与只用firinox治疗的肿瘤相比,选择了> +0.35的蛋白质(表1),并按照方法中所述进行分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
丁特尔诺特,徐勇,李志刚,李志刚gydF4y2Baet al。gydF4y2Ba微生物源性3-IAA对胰腺癌化疗疗效的影响gydF4y2Ba自然gydF4y2Ba615gydF4y2Ba, 168-174(2023)。https://doi.org/10.1038/s41586-023-05728-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05728-ygydF4y2Ba
这篇文章被引用gydF4y2Ba
在化疗期间,肠道反应可以调节肿瘤的命运gydF4y2Ba
自然gydF4y2Ba(2023)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba