摘要gydF4y2Ba
革兰氏阴性菌的细胞质膜周围有一层肽聚糖(PG)细胞壁和一层外膜(OM),外层膜由脂多糖(LPS)组成。gydF4y2Ba1gydF4y2Ba.这种复杂的包膜为药物进入提供了一个强大的障碍,是这些生物固有抗生素耐药性的主要决定因素gydF4y2Ba2gydF4y2Ba.构建表面的生物发生途径也是我们许多最有效的抗菌疗法的目标gydF4y2Ba3.gydF4y2Ba.因此,了解构成革兰氏阴性包膜的分子机制有望帮助开发新的有效治疗方法,以应对日益严重的耐药感染问题。虽然PG和OM的合成和组装的单个途径已经很好地描述了,但对于这些基本表层的生物发生是如何协调的,几乎一无所知。在这里,我们报告了在革兰氏阴性病原体中PG和LPS合成途径的承诺酶之间的调节相互作用gydF4y2Ba铜绿假单胞菌gydF4y2Ba.我们发现PG合成酶MurA直接和特异性地与LPS合成酶LpxC相互作用。此外,MurA被证明可以刺激细胞和纯化体系中的LpxC活性。我们的研究结果支持了一个模型,即在许多变形杆菌物种中PG层和OM层的组装是通过连接它们各自合成途径中的承诺酶的活性来协调的。gydF4y2Ba
主要gydF4y2Ba
革兰氏阴性菌中磷脂、PG和LPS的生物合成途径依赖于共享的前体池(图2)。gydF4y2Ba1gydF4y2Ba).因此,必须平衡每个途径的通量,以防止单一途径过度消耗基本前体gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.LPS生物合成需要UDP-gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖(UDP-GlcNAc)和酰基- acp分子,也分别用于PG和磷脂的生物合成gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.此外,过量的LPS会导致内膜中LPS中间体的毒性积累gydF4y2Ba8gydF4y2Ba.因此,必须严格调节通过LPS途径的通量。gydF4y2Ba
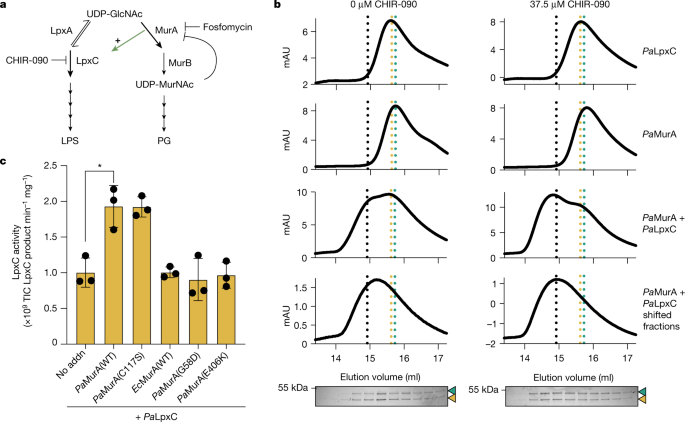
一个gydF4y2Ba,负责PG和LPS生物合成的生物合成途径示意图,显示了承诺酶MurA和LpxC,以及其他相关酶(LpxA和MurB)。t条显示抗生素磷霉素和ir -090的抑制作用。绿色箭头表示MurA激活LpxC。gydF4y2BabgydF4y2Ba尺寸排除层析,7.5 μ M纯化的F-LpxC和H-MurA单独或作为混合物在37.5 μ M ir -090存在或不存在的情况下被分解。随后收集移位的F-LpxC + H-MurA组分,重新进行尺寸排除色谱,所得组分采用SDS-PAGE分离,然后进行考马斯氏染色。虚线表示在ir -090存在时F-LpxC(金色),H-MurA(青色)或移位的F-LpxC + H-MurA分数(黑色)的迁移率峰值。在SDS-PAGE分析中,H-MurA和F-LpxC的迁移率分别用青色或金色箭头表示。数据代表两个重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2Ba,纯化产物的催化活性(总离子计数(TIC))gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC (100 nM)单独(无添加(no addn))或存在MurA变体(100 nM)。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。*gydF4y2BaPgydF4y2Ba= 0.0109(未配对,双尾gydF4y2BatgydF4y2Ba以及)。gydF4y2Ba
肠杆菌等gydF4y2Ba大肠杆菌gydF4y2Ba通过调节所参与酶的蛋白水解来控制LPS的合成,gydF4y2Ba电子商务gydF4y2BaLpxC,作者:FtsHgydF4y2Ba4gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.先前对LpxC的研究gydF4y2Ba铜绿假单胞菌gydF4y2Ba(gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba而LpxC)则不被蛋白水解gydF4y2Ba10gydF4y2Ba.因此,n端he标记gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC (H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC)在一个gydF4y2BaftsHgydF4y2Ba-deletion mutant(扩展数据图。gydF4y2Ba1gydF4y2Ba).因此,LPS在gydF4y2Ba铜绿假单胞菌gydF4y2Ba似乎是通过一种不同于肠杆菌的机制来调节的。gydF4y2Ba
巴勒斯坦权力机构gydF4y2BaLpxC被激活gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀gydF4y2Ba
H -的过量生产gydF4y2Ba电子商务gydF4y2BaLpxC而不是H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC抑制生长gydF4y2Ba铜绿假单胞菌gydF4y2Ba和增加细胞水平的LPS(扩展数据图。gydF4y2Ba1 bgydF4y2Ba而且gydF4y2Ba2gydF4y2Ba),暗示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC在gydF4y2Ba铜绿假单胞菌gydF4y2Ba细胞通过一种机制对抗无效gydF4y2Ba电子商务gydF4y2BaLpxC。为了确定可能的调节因素,H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC或H -gydF4y2Ba电子商务gydF4y2BaLpxC是在gydF4y2Ba铜绿假单胞菌gydF4y2Ba亲和纯化后确定相互作用伙伴。gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA和PA4701是唯一富集H -的蛋白gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC而不是H -gydF4y2Ba电子商务gydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba).PA4701是一种非必需蛋白(扩展数据图。gydF4y2Ba3gydF4y2Ba)功能未知,而gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA是PG合成过程中必不可少的酶gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba3 b, cgydF4y2Ba).我们关注的是gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀,gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC相互作用,并用体内拉下实验与H -进行验证gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和n - terminalflags -taggedgydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(F -gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀;扩展数据图。gydF4y2Ba4gydF4y2Ba).值得注意的是,当LpxC抑制剂ir -090处理细胞时,共纯化增强,这表明药物结合的LpxC酶可能对MurA具有更大的亲和力(扩展数据图)。gydF4y2Ba4gydF4y2Ba).纯化His-taggedgydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(H -gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀;扩展数据图。gydF4y2Ba5gydF4y2Ba)也被Flag-tagged特意拉下了gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC (F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC)使用anti-Flag树脂,表明相互作用是直接的(扩展数据图。gydF4y2Ba4 bgydF4y2Ba).纯化F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA分别或以掺入或不掺入ir -090的1:1混合物进行尺寸排除色谱(SEC)。在混合样品中,以F -异二聚体对应的体积洗脱了大量蛋白质gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(图gydF4y2Ba1 bgydF4y2Ba).与下拉实验一致,将异源二聚体组分重新应用于SEC色谱柱表明,在ir -090存在的情况下,复合物保持最稳定。gydF4y2Ba1 bgydF4y2Ba).值得注意的是,H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA刺激F -的酶活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC(无花果。gydF4y2Ba1 cgydF4y2Ba).这种刺激是特定于gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA为H -的加成gydF4y2Ba电子商务gydF4y2BaMurA没有效果(图。gydF4y2Ba1 cgydF4y2Ba).我们的结论是gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA是一种直接的特异性激活剂gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba体外LpxC。gydF4y2Ba
我们认为如果gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA是一种必需的激活剂gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC在gydF4y2Ba铜绿假单胞菌gydF4y2Ba细胞,然后gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA缺失应导致类似于两种必需酶同时失活的表型。用MurA抑制剂磷霉素处理的细胞具有PG合成抑制表型,包括膜泡的形成和溶解gydF4y2Ba11gydF4y2Ba(扩展数据图。gydF4y2Ba3 d-fgydF4y2Ba).然而,细胞耗尽gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba相反,MurA采用了放大的卵形(扩展数据图。gydF4y2Ba3 e, fgydF4y2Ba).这种表型类似于用ir -090和磷霉素处理的细胞(扩展数据图)。gydF4y2Ba3 d-fgydF4y2Ba),暗示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA耗竭损害PG和LPS的合成。因此,gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA的损耗降低了LPS水平,而通路中下一个酶的损耗,gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurB,没有(扩展数据图。gydF4y2Ba2 bgydF4y2Ba而且gydF4y2Ba3 b, cgydF4y2Ba),反而导致了类似于磷霉素治疗后的终末表型(扩展数据图。gydF4y2Ba3 d-fgydF4y2Ba).我们的结论是gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA是正常细胞水平的LPS生物合成所必需的。gydF4y2Ba
巴勒斯坦权力机构gydF4y2BaMurA有两个基本功能gydF4y2Ba
野生型(WT)生产过剩gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA并没有像预期的那样增加LPS水平gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba扩展数据图gydF4y2Ba2摄氏度gydF4y2Ba).我们怀疑这一结果可能是由于酶活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA与LPS途径竞争UDP-GlcNAc(图。gydF4y2Ba1gydF4y2Ba)从而防止失控的LPS合成。或者,一个特定的MurA构象gydF4y2Ba13gydF4y2Ba可能是激活剂,它可能不会产生足够的水平来刺激LPS的合成gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差超表达。这些情景预测了催化不活跃或构象圈闭的生产过剩gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变异应该会导致致命水平的LPS产生。因此我们搜索了toxic这个词gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀变异。gydF4y2Ba铜绿假单胞菌gydF4y2Ba用编码诱变PagydF4y2Ba不均匀gydF4y2Ba在异丙基的控制下-β-gydF4y2BadgydF4y2Ba-硫半乳糖苷(IPTG)调控启动子。所得到的文库与诱导剂一起在液体培养基中培养。从培养上清中纯化引起裂解的质粒gydF4y2Ba不均匀gydF4y2Ba对导致iptg依赖生长缺陷的基因进行测序。gydF4y2Ba
23有毒gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变体(指定gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA*)被识别(图;gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).它们的生长抑制活性被通常致命浓度的ir -090缓解,这表明它们过度激活gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba扩展数据图gydF4y2Ba6gydF4y2Ba).氨基酸在gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA*变体映射在酶的活性位点周围gydF4y2Ba14gydF4y2Ba(扩展数据图。gydF4y2Ba6 bgydF4y2Ba),并包括与磷酸烯醇丙酮酸底物形成共价中间体的催化半胱氨酸残基(C117)gydF4y2Ba15gydF4y2Ba.一个子集gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA*变体被纯化(扩展数据图。gydF4y2Ba5gydF4y2Ba),并发现它们的酶活性显著降低,同时保留了激活纯化的能力gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba扩展数据图gydF4y2Ba6 c, dgydF4y2Ba).gydF4y2Ba
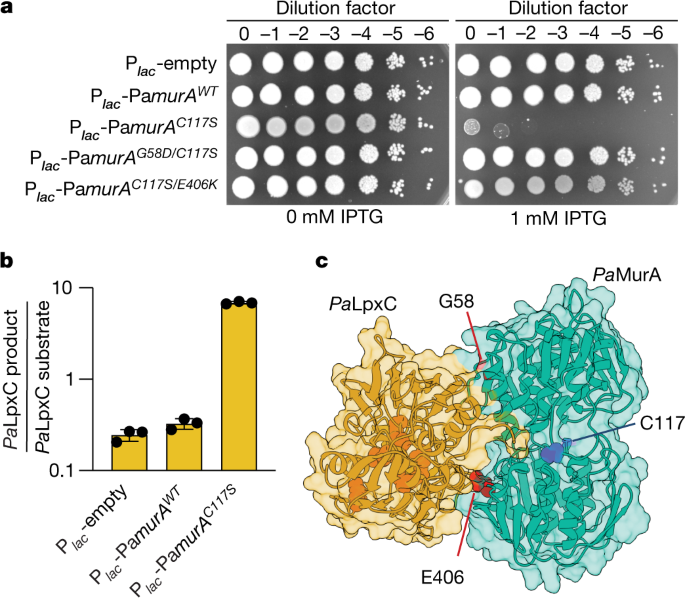
一个gydF4y2Ba,活力测定,其中连续稀释含有空质粒或所示Pa的PAO1gydF4y2Ba不均匀gydF4y2Ba将IPTG诱导对照下的变种分别在添加或不添加IPTG的LB琼脂上进行镀金。数据代表了三个生物重复。gydF4y2BabgydF4y2Ba,液相色谱-质谱法测定甲醇-氯仿萃取水溶液中LpxC产物与底物的比例gydF4y2Ba铜绿假单胞菌gydF4y2Ba全细胞溶解产物。圆点表示三次生物重复获得的值,柱状表示平均值,误差柱状表示其标准偏差。gydF4y2BacgydF4y2Ba的模型结构gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaAlphaFold预测的MurA复合体gydF4y2Ba19gydF4y2Ba.gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC用金色和表示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA用青色表示。gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA残基G58和E406用红色突出显示,残基C117用深蓝色突出显示。gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC活性位点残基gydF4y2Ba34gydF4y2Ba用橙色表示。gydF4y2Ba
等价于C117S的替换gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA已在其他正交物中被很好地表征,其中它已被证明能将酶困在与其产物结合的封闭构象中gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.因此,我们选择研究在体内激活的潜力gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC由gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)。LpxC底物(UDP-3-gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba3-hydroxydecanoyl) -gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖胺)和产物(UDP-3-gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba-3-羟基癸基)-葡萄糖胺)从过度生产的细胞中提取并定量gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(WT)或gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)。的gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba在细胞过度生产时,LpxC产物/底物比没有变化gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba相对于空矢量控制的MurA(WT)(图。gydF4y2Ba2 bgydF4y2Ba和扩展数据图。gydF4y2Ba7gydF4y2Ba).然而,生产过剩gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(C117S)导致了100倍的增加gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产物/底物比和增加的LPS水平,表明该变体是一种有效的激活剂gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC在体内(图;gydF4y2Ba2 bgydF4y2Ba和扩展数据图。gydF4y2Ba2摄氏度gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).因此,我们得出结论:gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差激活gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC在细胞中,但只有催化活性gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba由于MurA变体无法与LPS合成途径竞争UDP-GlcNAc,当它们过量产生时,会促进LPS合成的毒性水平。gydF4y2Ba
为了进一步描述之间的相互作用gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA,我们在寻找无毒的衍生物gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(C117S),理由是有些无法结合gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC。F -流感幸存者gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba从诱变质粒中选择MurA(C117S)产物,然后采用免疫印迹法筛选产生稳定的全长F -的分离株gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)。这个过程确定了gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S / G58D)gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S / E406K)。我们证实,当过量生产到类似的水平时,这两个变种都没有毒性gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)(图。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba8gydF4y2Ba).接下来我们提纯H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(G58D)和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(E406K)变体具有完整的活性位点(扩展数据图。gydF4y2Ba5gydF4y2Ba).两者都保留了MurA活动(扩展数据图。gydF4y2Ba8 bgydF4y2Ba),且与遗传结果一致,均未激活F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC体外培养(图;gydF4y2Ba1 cgydF4y2Ba).然而,值得注意的是H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(G58D)不能与F -结合gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC, H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(E406K)表现出与H -相似的结合活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)(扩展数据图。gydF4y2Ba8 cgydF4y2Ba).因此,G58D的改变削弱了的能力gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA绑定gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC,而E406K取代似乎破坏了复杂形成后的激活机制。残基G58和E406均位于该结构的同一表面上gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA结构,表明这面包括gydF4y2Ba巴勒斯坦权力机构gydF4y2Balpxc结合接口(图。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
迄今为止的结果表明gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA可能具有两种基本功能:PG合成和激活gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC。这个模型预测了催化活性的变体gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA无法激活gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC不能与Pa互补gydF4y2Ba不均匀gydF4y2Ba缺失,但仍然能够补充催化死亡gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变体,保留其gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC激活函数。为了验证这一预测,PagydF4y2Ba不均匀gydF4y2BaWTgydF4y2Ba被归入PgydF4y2Ba虫胶gydF4y2Ba对照和原生等位基因被删除或转换为PagydF4y2Ba不均匀gydF4y2BaC117SgydF4y2Ba.然后我们引入一个含或不含Pa的质粒gydF4y2Ba不均匀gydF4y2BaG58DgydF4y2Ba由阿拉伯糖诱导启动子(PgydF4y2BaaragydF4y2Ba).正如所料,gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)耗竭导致任何Δ的严重生长缺陷gydF4y2Ba不均匀gydF4y2Ba或者爸爸gydF4y2Ba不均匀gydF4y2BaC117SgydF4y2Ba背景(扩展数据图。gydF4y2Ba8 dgydF4y2Ba).然而,值得注意的是gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(G58D)得以恢复增长gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)在PagydF4y2Ba不均匀gydF4y2BaC117SgydF4y2Ba等位基因,而不是gydF4y2Ba不均匀gydF4y2Ba删除(扩展数据图。gydF4y2Ba8 dgydF4y2Ba).因此,我们得出结论gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba的LpxC激活函数gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA是必不可少的,与它的催化活性可分离。gydF4y2Ba
LpxC-MurA相互作用是守恒的gydF4y2Ba
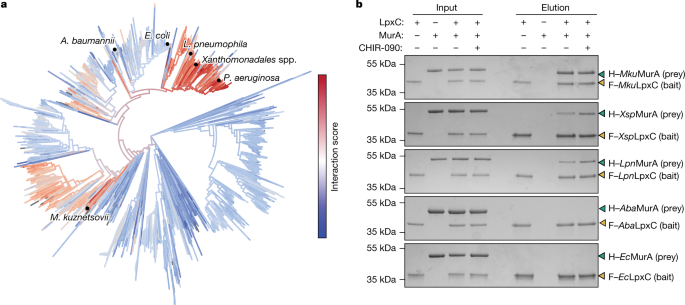
为了研究LpxC-MurA调控相互作用的守恒性,我们使用了进化共变分析gydF4y2Ba18gydF4y2Ba.然而,由于这两种酶在整个革兰氏阴性细菌中都是保守的,但只有一个子集可能相互作用,我们无法可靠地检测LpxC和MurA之间共变的残基,除非首先知道这两种蛋白质的哪个区域相互作用;被分析的基因组之间的非相互作用对产生了太多的“噪音”,无法检测到明确的相互作用特征。因此,我们用AlphaFold对LpxC-MurA复合体的结构进行了建模gydF4y2Ba19gydF4y2Ba的高置信结构gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC -gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba村拉之间却没有对应gydF4y2Ba大肠杆菌gydF4y2Ba蛋白(无花果。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba9 a、bgydF4y2Ba).的G58和E406残基gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA涉嫌gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC结合和/或激活位于建模的相互作用界面(图。gydF4y2Ba2摄氏度gydF4y2Ba),支持了结构预测的准确性。以该模型为指导,对来自8302个变形菌基因组的LpxC-MurA对进行了预测相互作用界面残基的进化共变分析。然后,每个LpxC-MurA对被分配一个“相互作用得分”,作为两个蛋白质预测相互作用的强度的指示(图。gydF4y2Ba3gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,基于直接耦合分析方法计算的MurA-LpxC相互作用评分(gydF4y2Ba方法gydF4y2Ba)绘制在最大似然系统发育树上,该树基于用FastTree生成的串联MurA和LpxC序列。重点介绍了实验测试的相互作用。gydF4y2BabgydF4y2Ba将纯化的F-LpxC(2.5µM)与纯化的H-MurA按1:1的比例混合,并在ir -090(5.7µM)存在或不存在的情况下进行混合。用抗flag树脂将混合物拉下,将输入液和洗脱液进行SDS-PAGE和考马斯亮染色。H-MurA和F-LpxC的活动性分别用青色或金色箭头表示。数据至少代表两个重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
的gydF4y2Ba铜绿假单胞菌gydF4y2BaLpxC-MurA对如预期的那样具有较高的相互作用得分,来自其他伪单胞菌纲和其他γ变形菌纲(包括Legionalles, Xanthomonadales和Oceanospirillales目)的相互作用得分也较高。gydF4y2Ba3gydF4y2Ba).此外,在红螺杆菌(Rhodospirillales)的一个亚群中也观察到较高的相互作用分数,这是阿尔法变形菌门的一个目,与红螺杆菌高度不同gydF4y2Ba铜绿假单胞菌gydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba).根据相互作用得分的分布,我们估计48%的γ -变形菌门和35%的α -变形菌门编码能够相互作用的LpxC-MurA对(扩展数据图)。gydF4y2Ba9 egydF4y2Ba).为了研究共变分析的准确性,另外三对相互作用得分较高的LpxC-MurA对(gydF4y2BaMagnetospirillum kuznetsoviigydF4y2Ba,gydF4y2BaXanthomonadalesgydF4y2Ba种虫害和gydF4y2Ba嗜肺性军团菌gydF4y2Ba)和两对相互作用得分低的LpxC-MurA对(gydF4y2Ba大肠杆菌gydF4y2Ba而且gydF4y2Ba鲍曼不动杆菌gydF4y2Ba)进行纯化(扩展数据图。gydF4y2Ba5gydF4y2Ba),并在体外测试了它们相互作用的能力。只有那些相互作用得分高的配对被观察到相互作用(图。gydF4y2Ba3 bgydF4y2Ba).此外,gydF4y2Ba退伍军人gydF4y2BaLpxC (gydF4y2BaLpngydF4y2BaLpxC),但并非如此gydF4y2Ba电子商务gydF4y2BaLpxC在其同源MurA存在的情况下,在体外表现出增加的活性(扩展数据图)。gydF4y2Ba9 f, ggydF4y2Ba).因此,我们得出结论,来自多种变形菌门的LpxC和MurA相互作用,这表明PG和LPS生物发生途径之间的调控联系在多种革兰氏阴性细菌中是保守的。gydF4y2Ba
平衡的LPS和PG合成模型gydF4y2Ba
LPS生物合成途径与磷脂和PG生物合成途径共享关键前体(图。gydF4y2Ba1gydF4y2Ba).在gydF4y2Ba大肠杆菌gydF4y2Ba和其他肠杆菌,需要通过脂多糖和磷脂生物合成途径平衡消耗酰基- acp分子已被充分证明gydF4y2Ba4gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.相比之下,很少有人知道UDP-GlcNAc的利用是如何通过LPS和PG生物合成途径协调以允许均匀的细胞包膜扩张。我们建议gydF4y2Ba巴勒斯坦权力机构gydF4y2Balpxc激活功能gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA的作用是限制LPS的生物合成,使其不能超过PG的生物合成。的过表达支持了该模型gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)能够与LPS合成途径竞争UDP-GlcNAc,对细胞活力没有影响(图2)。gydF4y2Ba2gydF4y2Ba).催化无活性变体的过表达gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba然而,MurA(C117S)导致的不平衡激活gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC在体内,导致细胞死亡(图。gydF4y2Ba2gydF4y2Ba).通过限制催化活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC来gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA水平,失控的LPS生物合成是不可能的。另一方面,MurA被下游PG前体UDP-MurNAc反馈抑制gydF4y2Ba24gydF4y2Ba.在PG前体合成通量过高的条件下,UDP-MurNAc会积累,从而与MurA结合并将其锁定为类似于MurA的封闭构象gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)gydF4y2Ba13gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.因此,当PG生物合成速度超过LPS生物合成时,MurA将受到反馈抑制,在不影响其激活能力的情况下降低其催化活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC刺激LPS生物合成并重新平衡通路。gydF4y2Ba
在肠杆菌中,LpxC被FtsH蛋白水解,FtsH又被至少两个附属蛋白:LapB和YejM调节gydF4y2Ba5gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.虽然FtsH是广泛保守的,但LapB和YejM只在变形菌基因组的一个子集中被观察到。相比之下,LpxC和MurA在变形杆菌中几乎普遍保守。我们的计算分析表明,大量的γ -变形菌门和α -变形菌门通过MurA的激活控制LpxC。gydF4y2Ba3gydF4y2Ba).为什么细菌通过LPS生物合成途径使用不同的策略来调节通量尚不清楚。然而,我们认为这可能反映了它们环境生态位的差异。例如,gydF4y2Ba铜绿假单胞菌gydF4y2Ba优先利用三羧酸而不是碳水化合物作为碳源gydF4y2Ba27gydF4y2Ba.因此,活性糖如UDP-GlcNAc可能更限制gydF4y2Ba铜绿假单胞菌gydF4y2Ba比起爱吃糖的人gydF4y2Ba大肠杆菌gydF4y2Ba使LpxC的调控集中在UDP-GlcNAc的适当分区上。如果未来的研究发现其他生物中LpxC调控的其他未知策略,也不足为奇。gydF4y2Ba
结论gydF4y2Ba
总之,我们的工作已经确定了一种以前未知的和意想不到的调节相互作用,涉及到两层不同的革兰氏阴性细胞包膜的产生。除了揭示一种协调细胞壁和OM生物发生的潜在机制外,这些发现也对抗生素的开发具有意义。MurA是抗生素磷霉素的靶点,LpxC是几项药物发现活动的主题,这些活动已经产生了具有强大抗菌活性的抑制剂gydF4y2Ba11gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba.这里发现的这些酶之间的联系表明,有可能开发双靶向药物,改变MurA和LpxC活性,同时破坏PG和OM的组装来杀死gydF4y2Ba铜绿假单胞菌gydF4y2Ba并/或使其对其他抗生素敏感,这些抗生素由于其包膜的屏障功能而失效。这些发现也提高了一种可能性,即参与不同细胞包膜组分生物发生的酶之间有更多的调节相互作用有待发现。gydF4y2Ba
方法gydF4y2Ba
培养基,菌株和质粒gydF4y2Ba
结果表明,细胞在LB(1%色氨酸,0.5%酵母提取物,0.5% NaCl)或微量M9培养基中生长gydF4y2Ba35gydF4y2Ba补充0.2%氨基酸和0.2%葡萄糖。使用以下浓度的抗生素:氯霉素,25 μg mlgydF4y2Ba−1gydF4y2Ba;卡那霉素25 μg mlgydF4y2Ba−1gydF4y2Ba;庆大霉素,30 μg mlgydF4y2Ba−1gydF4y2Ba(gydF4y2Ba铜绿假单胞菌gydF4y2Ba)或15 μg mlgydF4y2Ba−1gydF4y2Ba(gydF4y2Ba大肠杆菌gydF4y2Ba);卡本西林,200 μg mlgydF4y2Ba−1gydF4y2Ba(gydF4y2Ba铜绿假单胞菌gydF4y2Ba)或50 μg mlgydF4y2Ba−1gydF4y2Ba(gydF4y2Ba大肠杆菌gydF4y2Ba).本研究中使用的质粒列在补充表中gydF4y2Ba2gydF4y2Ba.本研究使用的菌株列在补充表中gydF4y2Ba3.gydF4y2Ba.所有gydF4y2Ba铜绿假单胞菌gydF4y2Ba报道实验中使用的菌株是PAO1的衍生物。本研究使用的引物列在补充表中gydF4y2Ba4gydF4y2Ba.除非另有说明,聚合酶链式反应(PCR)使用Q5聚合酶(NEB M0492L)进行克隆,GoTaq绿色DNA聚合酶(Promega M7123)进行诊断,均按照制造商的说明进行。质粒DNA和PCR片段分别使用PurePlasmid miniprep试剂盒(CW Biosciences CW0500M)或DNA cleanup试剂盒(CW Biosciences CW2301M)进行纯化。关于菌株和质粒结构的详细信息可以在gydF4y2Ba补充信息gydF4y2Ba.实验所用样本量未采用统计学方法,但样本量符合现场标准。gydF4y2Ba
毒性分离gydF4y2Ba不均匀gydF4y2Ba等位基因gydF4y2Ba
等位基因的gydF4y2Ba不均匀gydF4y2Ba如前所述,当过度表达时是有毒的gydF4y2Ba36gydF4y2Ba稍作改动。首先,gydF4y2Ba不均匀gydF4y2Ba用Taq聚合酶(NEB M0267L)从纯化的pKH37质粒中分离15/76引物,进行PCR诱变。由此产生的五种物质每一种都含有500纳克gydF4y2Ba色差*gydF4y2Ba然后分别使用Q5聚合酶(NEB M0492L)作为大型引物,在50 μ l反应中扩增50 ng pKH37,并设置如下热循环器:1)95°C 3 min;2) 95°C 50 s;3) 60°C 50 s;4) 72℃保温10分钟;5)重复步骤2-4,共25个循环。随后在每个反应中加入20单位的DpnI (NEB R0176L),并允许在37°C下消化未扩增的DNA 1.5小时。使用0.025- m混合纤维素酯膜(Millipore VSWP02500)在milliq水上漂浮20分钟,对每个反应进行滴析。然后将每个12µl的透析产物分别转化为100µl的neb -5 α electrocompetentgydF4y2Ba大肠杆菌gydF4y2Ba(NEB C2989K),在SOC菌体培养基(NEB B9020S)中回收,将菌体镀在添加庆大霉素的LB琼脂上,筛选出转化菌。从五个文库中分别提取了大约100万个菌群,并使用PurePlasmid miniprep试剂盒(CW Biosciences CW0500M)对pKH37衍生物进行纯化。gydF4y2Ba
PAO1在25 ml LB中生长,37°C过夜,12000离心gydF4y2BaggydF4y2Ba5分钟,再悬于等体积的300mm蔗糖中。离心和重悬步骤总共重复了四次洗涤。最后在12000度离心后gydF4y2BaggydF4y2Ba5分钟后,细胞颗粒以原来体积的1/20重悬。1.2µg的pkh37衍生文库分别转化为150µl的电活性PAO1。转化反应在37°C的LB中恢复1 h,通过将生长产物镀在添加30µg ml的LB琼脂上选择转化产物gydF4y2Ba−1gydF4y2Ba庆大霉素。每个库中大约有1-2百万个菌落被分别汇集起来。gydF4y2Ba
鉴定含有毒性等位基因的pKH37变异gydF4y2Ba不均匀gydF4y2Ba,每个PAO1 × pKH37*库被稀释到光密度为600 nm (ODgydF4y2Ba600海里gydF4y2Ba) 0.01的3毫升LB补充30 μ g mlgydF4y2Ba−1gydF4y2Ba庆大霉素,37°C生长2 h 45 min。将IPTG添加到每个培养物中,最终浓度为1 mM,并在37°C下继续孵育2小时。然后对每种培养物进行21,130离心gydF4y2BaggydF4y2Ba使用DNA清理试剂盒(CW Biosciences CW2301M)分别从2.5 ml上清液中纯化每个文库中释放的DNA。随后将纯化的DNA重新转化为上述制备的PAO1电活性细胞,并将产物镀于添加庆大霉素的LB琼脂上选择转化子。然后将得到的菌落贴在添加庆大霉素和不添加1mm IPTG的LB琼脂板上,在37℃下生长一夜。的gydF4y2Ba不均匀gydF4y2Baiptg敏感菌株编码的等位基因采用引物对15/76进行Sanger测序。gydF4y2Ba
MurA(C117S)失毒变异的分离gydF4y2Ba
pKH100通过传代进行诱变gydF4y2Ba大肠杆菌gydF4y2Ba应变XL1-red。将pKH100转化为XL1-red,并接种5个不同的培养物,每个培养物使用4个独特的转化子。传播过夜后,质粒使用PurePlasmid miniprep试剂盒(CW Biosciences CW0500M)纯化,创建5个pKH100*文库。PAO1在25 ml LB中生长,37°C过夜,12000离心gydF4y2BaggydF4y2Ba5分钟,再悬于等体积的300mm蔗糖中。离心和重悬步骤总共重复了四次洗涤。最后在12000度离心后gydF4y2BaggydF4y2Ba5分钟后,细胞颗粒以原来体积的1/20重悬。每个pKH100*的1.2µg量分别转化为150µl电控PAO1。转化反应在37°C的LB中恢复1 h,通过将生长产物镀在添加庆大霉素的LB琼脂上选择转化产物。每个文库中大约有100 - 1000万个菌落分别汇集,并在−80°C的LB + 10%二甲亚砜(DMSO)中存储。gydF4y2Ba
PAO1 × pKH100*文库镀于添加30µg ml的LB琼脂上gydF4y2Ba−1gydF4y2Ba庆大霉素和1mm IPTG,只允许生长大约0.3% - 1%的菌落形成单位。从每个池中分别对17或18个iptg抗性菌种进行条带纯化,在LB中生长并在log中期诱导1 h后,用western blot方法检测F-MurA (C117S)*的表达水平和分子量。仅对表达水平和分子量与F-MurA (C117S)一致的分离株进行Sanger测序,引物为15和76。在五个被分析的图书馆中,有三个,gydF4y2BaF-murAgydF4y2BaWTgydF4y2Ba被恢复。gydF4y2BaF-murAgydF4y2BaC117S / G58DgydF4y2Ba而且gydF4y2BaF-murAgydF4y2BaC117S / E406KgydF4y2Ba都是在五个图书馆中的一个找到的。gydF4y2Ba
蛋白质纯化gydF4y2Ba
蛋白质纯化的详细信息可以在gydF4y2Ba补充信息gydF4y2Ba.gydF4y2Ba
可行性分析gydF4y2Ba
在30°C或37°C下培养过夜,在12,000离心gydF4y2BaggydF4y2Ba2分钟,重悬至过量gydF4y2Ba600海里gydF4y2Ba重悬液在LB中连续稀释至10gydF4y2Ba−6gydF4y2Ba每种稀释液取5 μ l涂抹在添加了适当诱导剂和抗生素的LB琼脂上。在37°C下孵育过夜,使用尼康D3400相机和尼康AF-S micro NIKKOR 40mm镜头成像。gydF4y2Ba
Western blot分析gydF4y2Ba
过夜培养稀释到过量gydF4y2Ba600海里gydF4y2Ba在3 ml LB中加入0.01,在37℃下生长4小时,2 ml在12000℃下离心gydF4y2BaggydF4y2Ba3分钟。必要时,在收集培养物1 h前,将IPTG加入1mm或阿拉伯糖加入0.1%。细胞颗粒重悬至外径gydF4y2Ba600海里gydF4y2Ba在1× SDS样品缓冲液(50 mM Tris pH 6.8, 10%甘油,2% SDS, 0.2%溴酚蓝,1% β-巯基乙醇)中加入20,在100℃下煮沸10分钟。随后用Qsonica Q800R3超声波仪对裂解物进行声波检测,频率为25%,1 s开启,1 s关闭,循环30次。使用非干扰蛋白测定试剂盒(G-biosciences 786-005)定量蛋白质浓度。将10µg量的蛋白质加载到10%的聚丙烯酰胺- sds凝胶上,并在150 V下进行电泳70分钟。在Bio-Rad Trans-Blot Turbo转移系统上使用混合分子量协议将蛋白质转移到PVDF膜上,并将膜在TBST (20 mM Tris pH 8.0, 200 mM NaCl, 0.05% Tween-20)中与5%牛奶在室温下封闭1小时。然后分别用1:3 000、1:3 000或1:10万稀释的anti-His (GenScript A00186-100)、anti-Flag (Sigma F7425)或anti-RpoA (BioLegend 663104)在TBST + 5%牛奶中室温孵育1小时。膜在TBST中洗涤三次,每次5分钟,然后用过氧化物酶标记的山羊抗小鼠(Rockland 810 -1302)或兔trublot:抗兔IgG HRP (Rockland 18-8816-33)在TBST + 5%牛奶中1:3 000稀释,在室温下检测1小时。用SuperSignal West Pico PLUS化学发光衬底(Thermo 34580)在TBST中清洗膜3次,每次5分钟,并使用Azure Biosystems C600成像仪成像。gydF4y2Ba
体内共亲和纯化gydF4y2Ba
在体内识别相互作用的伙伴gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba以无偏倚的方式,在重复样品中使用两种共亲和纯化方案。具体来说,在条件1中,150 mM NaCl用于裂解和洗涤缓冲液,而在条件2中,300 mM NaCl用于裂解和洗涤缓冲液。在一夜之间gydF4y2Ba铜绿假单胞菌gydF4y2Ba培养液稀释至ODgydF4y2Ba600海里gydF4y2Ba在500 ml LB中= 0.01,在37°C生长到对数期早期。以PA1009为例,在收集前1小时用0.5%阿拉伯糖诱导培养。整个培养物在13000℃下进行离心gydF4y2BaggydF4y2Ba10分钟后,将微球重悬在4 ml裂解缓冲液(50 mM Tris pH 7.5, 2%甘油,5 mM咪唑,1% Triton X-100, 150 mM或300 mM NaCl)中,用Q125 Qsonica超声仪超声裂解细胞。在21,130离心时将细胞碎片制成颗粒gydF4y2BaggydF4y2Ba将澄清的上清液与Ni-NTA树脂(Qiagen 30230)在4℃下从头到尾旋转1.5 h。树脂用6毫升洗涤缓冲液(50 mM Tris pH 7.5, 2%甘油,25 mM咪唑,1% Triton X-100, 150 mM或300 mM NaCl)洗涤四次。蛋白质在洗脱缓冲液(50 mM Tris pH 7.5, 2%甘油,250 mM咪唑,0.1% Triton X-100和150 mM NaCl)中从树脂中洗脱。洗脱液与2× SDS样品缓冲液(100 mM Tris pH 6.8, 20%甘油,4% SDS, 0.4%溴酚蓝)1:1混合,40 μ l加载到4-20%聚丙烯酰胺Mini-PROTEAN TGX凝胶(Bio-Rad 4568094)上,在80 V下电泳25分钟。随后用考马斯氏R-250染色凝胶,并切除整个通道进行质谱分析。gydF4y2Ba
切除的车道被切割成大约1毫米gydF4y2Ba3.gydF4y2Ba碎片。然后对凝胶片进行改良的凝胶内胰蛋白酶消化程序gydF4y2Ba37gydF4y2Ba.凝胶片用乙腈清洗脱水10分钟,然后去除乙腈。然后在快速真空中完全干燥。凝胶片用含有12.5 ngµl的50mm碳酸氢铵溶液再水化gydF4y2Ba−1gydF4y2Ba修饰的测序级胰蛋白酶(Promega)在4°C。45分钟后,除去多余的胰蛋白酶溶液,用50mm碳酸氢铵溶液替换,刚好覆盖凝胶片。然后将样品放在37°C的房间中过夜。随后,通过去除碳酸氢铵溶液来提取肽,然后用含有50%乙腈和1%甲酸的溶液洗涤一次。然后将提取物在快速真空中干燥(约1小时)。然后将样品保存在4°C,直到分析。gydF4y2Ba
分析当天,样品在5-10 μ l高效液相色谱(HPLC)溶剂A(2.5%乙腈,0.1%甲酸)中重新构成。将2.6- m C18球形二氧化硅珠填充到熔融二氧化硅毛细管(内径100 μ m ×长约30 cm)中,采用火焰拉伸尖端,建立了纳米级反相高效液相色谱毛细管柱gydF4y2Ba38gydF4y2Ba.平衡色谱柱后,使用Famos自动进样器(LC填料)将每个样品加载到色谱柱上。形成梯度,用增加浓度的溶剂B(97.5%乙腈,0.1%甲酸)洗脱多肽。gydF4y2Ba
当肽洗脱后,进行电喷雾电离,然后进入LTQ Orbitrap Velos Pro离子阱质谱仪(赛默飞世尔科学公司)。多肽被检测,分离和碎片化,以产生每个肽的特定片段离子的串联质谱。通过软件程序Sequest v28 (rev. 13;赛默飞世尔科学公司)gydF4y2Ba39gydF4y2Ba.所有数据库都包含所有序列的反向版本,数据被过滤到肽假发现率为1-2%。只有符合以下标准的蛋白质被报道:在两个PA1018样品中检测到至少5个独特的肽;与相应的PAO1和PA1009样品相比,PA1018样品中至少富集了3倍。gydF4y2Ba
体内有针对性的下拉gydF4y2Ba
通宵培养gydF4y2Ba铜绿假单胞菌gydF4y2Ba编码H -组合的菌株gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC, F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)和F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(C117S)稀释至ODgydF4y2Ba600海里gydF4y2Ba= 0.01,在50 ml LB中,在37°C中生长2.5 h。将IPTG添加到每个培养物中至最终浓度为1 mM,培养物在37°C下再生长30分钟,然后将DMSO添加到0.1%,cir -090添加到0.5µg mlgydF4y2Ba−1gydF4y2Ba显示的地方。培养物在37°C下额外孵育一小时,并在12,000离心收集gydF4y2BaggydF4y2Ba10分钟。细胞在1ml LB中洗涤,12000离心成粒gydF4y2BaggydF4y2Ba2分钟。细胞重悬于1 ml裂解缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 2%甘油,0.1% Triton X-100, 5 mM咪唑,0.1% DMSO,加入或不加入0.5µg mlgydF4y2Ba−1gydF4y2Bacir -090(如所示),在冰上以40%振幅超声裂解,共4个周期,开15秒,关15秒。萃取物在21,130温度下通过两个连续离心步骤进行澄清gydF4y2BaggydF4y2Ba用非干扰蛋白测定试剂盒(G-biosciences 786-005)测定蛋白质浓度。上清液稀释至3.5 mg mlgydF4y2Ba−1gydF4y2Ba蛋白在500µl裂解缓冲液中,与25µl填充Ni-NTA树脂(Qiagen 30230)混合。混合物在4°C下旋转3小时。用500µl洗涤缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 2%甘油,0.1% Triton X-100, 25 mM咪唑,0.1% DMSO加或不加0.5µg ml)洗涤三次gydF4y2Ba−1gydF4y2Ba如所示,ir -090)。蛋白在40µl洗脱缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 2%甘油,0.1% Triton X-100, 500 mM咪唑)中洗脱。gydF4y2Ba
每个输入样品10µg蛋白质和10µl洗脱样品在10%聚丙烯酰胺凝胶中通过SDS-PAGE进行解析。在Bio-Rad Trans-Blot Turbo转移系统上使用混合分子量协议将蛋白质转移到PVDF膜上,并将膜在TBST + 5%的牛奶中在室温下阻塞1小时。然后用抗his (GenScript A00186-100)或抗flag (Sigma-Aldrich F7425)在TBST + 5%牛奶中1:3 000稀释,在室温下检测1小时。膜在TBST中洗涤三次,每次5分钟,然后用过氧化物酶标记的山羊抗小鼠(Rockland 810 -1302)或兔trublot:抗兔IgG HRP (Rockland 18-8816-33)在TBST + 5%牛奶中1:3 000稀释,在室温下检测1小时。用SuperSignal West Pico PLUS化学发光衬底(Thermo 34580)在TBST中清洗膜3次,每次5分钟,并使用Azure Biosystems C600成像仪成像。gydF4y2Ba
体外共亲和纯化gydF4y2Ba
纯化F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和H-MurA变体分别在共纯化缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 10%甘油,1 mM二硫苏糖醇(DTT), 0.5% DMSO)中稀释至2.5 μ M,最终体积为100 μ l。当指示时,将ir -090添加到5.7µM中。混合物在冰上孵育30分钟后,将每种混合物85 μ l加入等体积的Anti-Flag M2磁珠(Sigma-Aldrich M8823)中,在4°C下从头到尾旋转孵育1小时。用磁架收集珠子,用300µl共纯化缓冲液洗涤两次,用200µl共纯化缓冲液洗涤一次。当指示时,在洗涤缓冲液中保持5.7 μ M ir -090。蛋白用85µl洗脱缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 10%甘油,1 mM DTT, 100µgµl)洗脱gydF4y2Ba−1gydF4y2Ba标记肽(Millipore Sigma F3290))在室温下孵育30分钟。输入样品(5µl)和洗脱样品(15µl)在4-20%聚丙烯酰胺Mini-PROTEAN TGX凝胶(Bio-Rad 4561095)中通过SDS-PAGE分离,考马斯色染色检测蛋白质。gydF4y2Ba
证券交易委员会gydF4y2Ba
F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)单独或组合在500 μ l SEC缓冲液1(10%甘油,0.33% DMSO, 1 mM DTT, 25 mM Tris pH 8.0和150 mM NaCl)中稀释至7.5 μ M。当指示时,将ir -090添加到37.5µM中。随后,使用配有Superdex 200 10/300 GL色谱柱的ActaPure系统对混合物进行SEC处理,该色谱柱与SEC缓冲液2平衡(10%甘油,1 mM DTT, 25 mM Tris pH 8.0和150 mM NaCl),每0.35 ml收集一次洗脱馏分。对F -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)混合物,对应移位峰的三个组分(14.1-15.2 ml,不含ir -090, 13.8-14.8 ml,含ir -090)通过4°C离心浓缩,使用分子量截止值为10-kDa的离心过滤器(Amicon UFC801024)。如上所述,浓缩蛋白在Superdex 200 10/300 GL色谱柱上进行SEC反应。将15µl体积的相关组分溶解在4-20%的聚丙烯酰胺Mini-PROTEAN TGX凝胶(Bio-Rad 4568094)上,并用考马斯色染色检测蛋白质。gydF4y2Ba
增长曲线gydF4y2Ba
在30°C下培养过夜的培养物在12000℃下制成颗粒gydF4y2BaggydF4y2Ba在新鲜LB中重悬2分钟。培养物在96孔微量滴定板中稀释至ODgydF4y2Ba600海里gydF4y2Ba在Tecan Infinite M-Plex平板阅读器中培养,37°C和ODgydF4y2Ba600海里gydF4y2Ba在每个时间点后每4 min监测一次,在1毫米轨道震动200 s。gydF4y2Ba
LPS银染gydF4y2Ba
过夜培养稀释到过量gydF4y2Ba600海里gydF4y2Ba在25 ml LB培养物中增加0.01,在37°C下培养4小时。对于在诱导剂存在下生长的MurA-和murb -消耗菌株,整个生长过程中都存在1 mM的IPTG。对于MurA和LpxC过表达菌株,在生长3小时后加入1mm IPTG或0.1%阿拉伯糖,并继续培养1小时。每个培养物的体积为20毫升,在12000离心gydF4y2BaggydF4y2Ba5分钟,颗粒在1ml LB中洗涤,然后在12000离心gydF4y2BaggydF4y2Ba2分钟。颗粒重悬至ODgydF4y2Ba600海里gydF4y2Ba加入LDS样品缓冲液(Invitrogen NP0008) + 4% β-巯基乙醇,100°C煮沸10分钟。用Q125 Qsonica超声仪以25%振幅对样品进行超声,1 s开启,1 s关闭,30个周期,使用非干扰蛋白质检测试剂盒(G-biosciences 786-005)测定蛋白质浓度。将5µg的蛋白质加载到15%的聚丙烯酰胺- sds凝胶上,在150 V下电泳70分钟,然后进行如上所述的RpoA western blot分析。对于LPS凝胶,每个样品50µl与1.25µl蛋白酶K (NEB P8107S)混合,在55°C下孵育1小时,然后在95°C下孵育10分钟。相当于10µg蛋白质的当量体积在4-12%的Criterion XT Bis-Tris凝胶(Bio-Rad 3450124)上在100 V下溶解1小时45分钟,如前所述,用银染色法检测LPSgydF4y2Ba40gydF4y2Ba.简单地说,凝胶在200毫升40%乙醇和5%醋酸中培养过夜。加入0.7%的周期性酸,孵育5分钟。随后用200毫升超纯水在2小时内三次清洗凝胶。凝胶用150ml现制染色液(0.018 N NaOH, 0.4% NH)浸渍gydF4y2Ba4gydF4y2BaOH和0.667%硝酸银)浸泡10分钟,然后在2小时内用200毫升超纯水三次洗涤。凝胶用200毫升新鲜制备的显影剂溶液(0.26 mM柠檬酸pH值3.0,0.014%甲醛)显影,在100毫升1%的乙酸中停止显影。凝胶在Bio-Rad ChemiDoc MP成像系统中成像。gydF4y2Ba
显微镜gydF4y2Ba
过夜培养稀释到过量gydF4y2Ba600海里gydF4y2Ba在3 ml LB中加入1 mM IPTG作为适当的剂量。培养物在37°C下生长2.5 h,适当时,抗生素添加到以下浓度:0.5µg mlgydF4y2Ba−1gydF4y2Bair -090, 64µg mlgydF4y2Ba−1gydF4y2Ba磷霉素或0.5µg mlgydF4y2Ba−1gydF4y2Bair -090 + 16µg mlgydF4y2Ba−1gydF4y2Ba磷霉素。培养物在37°C下生长1.5小时,在12,000的温度下将1 ml制成颗粒gydF4y2BaggydF4y2Ba细胞球重悬至ODgydF4y2Ba600海里gydF4y2Ba10in LB,在LB + 1.5%琼脂板上标记,在尼康Eclipse 50i显微镜上成像,配备100倍物镜和Photometrics CoolSNAP HQgydF4y2Ba2gydF4y2Ba相机。图像使用斐济图像分析平台版本2.3.0/1.53q进行统一编辑gydF4y2Ba41gydF4y2Ba.使用ImageJ的MicrobeJ插件(版本5.13I)量化细胞宽度,使用以下设置:面积:250-max,长度:3-100,宽度:5-25,宽度变化:0-0.25,宽度对称性:0-1,圆度,0.01-1。通过Prism (GraphPad Software, LLC)进行的D 'Agostino和Pearson检验和Anderson-Darling检验对每个群体进行正性检验,并确定其缺乏正性。采用Prism (GraphPad Software, LLC)进行Kruskal-Wallis检验,以确定统计学意义。显微图像来源可在gydF4y2Bahttps://doi.org/10.5281/zenodo.7455522gydF4y2Ba(ref。gydF4y2Ba42gydF4y2Ba).gydF4y2Ba
体内LpxC产物和底物水平的测定gydF4y2Ba
过夜培养稀释到过量gydF4y2Ba600海里gydF4y2Ba在200 ml LB中添加0.01,在37°C下生长3小时,并将IPTG添加到最终浓度为1 mM。在37°C下孵育一小时后,在12000℃下离心收集细胞gydF4y2BaggydF4y2Ba在LB中重悬后,细胞在12000离心时重新成粒gydF4y2BaggydF4y2Ba2分钟。然后在400µl HPLC-grade H中重悬颗粒gydF4y2Ba2gydF4y2BaO.随后,在混合物中加入250µl氯仿和500µl甲醇。样品被大力涡旋,放置在冰上10分钟,然后在4°C, 21000度下旋转gydF4y2BaggydF4y2Ba.收集500 μ l体积的水层,并在旋转蒸发器中在30°C下过夜干燥。干燥后的材料在100µl超纯H中重悬gydF4y2Ba2gydF4y2Ba哦,还有gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba采用液相色谱-串联质谱(LC-MS /MS)对LpxC产物和底物进行检测,检测结果如下所示。gydF4y2Ba
体外LpxC活性测定gydF4y2Ba
纯化F -gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba将LpxC和H-MurA变体在结合缓冲液(25 mM Tris pH 8.0, 150 mM NaCl, 6%甘油)中稀释至200 nM,最终体积为15 μ l,并让混合物平衡至30°C 10分钟。反应由15µl底物混合物(25 mM Tris pH 8.0, 150 mM NaCl, 4% DMSO, 200µM UDP-3-)开始gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba-3-羟基癸基)-GlcNAc (Carbosynth MU75071)),并允许在30°C下进行5或10分钟,此时通过添加45 μ l 2%乙酸停止反应。将停止的反应冷冻在干冰上,冻干,并将冻干后的材料重悬于60µl H中gydF4y2Ba2gydF4y2BaO。gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba液相色谱-质谱法检测LpxC产物和底物,如下所示。用纯化的F -测定了上述反应的线性范围gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC单独作用,1、2、5、10、15或20 min后反应停止。gydF4y2Ba5 bgydF4y2Ba).H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)和H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(C117S)单独表现出LpxC活性的背景水平,证实所观察到的LpxC活性的刺激不是由于蛋白质制剂中的污染或替代的酶活性gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba扩展数据图。gydF4y2Ba6 egydF4y2Ba).gydF4y2Ba
活动测定与gydF4y2Ba退伍军人gydF4y2Ba而且gydF4y2Ba大肠杆菌gydF4y2Ba除了H-MurA变体在最终反应混合物中的浓度为200 nM外,LpxC-MurA对进行如上所述。gydF4y2Ba退伍军人gydF4y2Ba10 min后停止反应gydF4y2Ba大肠杆菌gydF4y2Ba1 min后停止反应。gydF4y2Ba
质gydF4y2Ba
为定量测定LpxC的体外活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品和底物在Agilent Technologies的1200系列HPLC系统上用LC-MS检测,该系统与Agilent 6520 Q-TOF质谱联用,电喷雾电离质谱在负模式下工作。样品在Waters Symmetry C18色谱柱上分离(5µm;3.9毫米× 150毫米)与匹配的柱保护使用以下方法:流速= 0.5 ml mingydF4y2Ba−1gydF4y2Ba, 95%溶剂A (HgydF4y2Ba2gydF4y2BaO, 10mm甲酸铵)和5%溶剂B(乙腈)浸泡5分钟,然后溶剂B从5 - 80%线性梯度浸泡20分钟。MS数据分析采用安捷伦MassHunter工作站定性分析软件B.06.00版本。的gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC底物(UDP-3-gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba3-hydroxydecanoyl) -gydF4y2BaNgydF4y2Ba-乙酰葡萄糖胺)通过监测丰度776.21进行定量gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba并分解为一个单峰,将其积分来推断底物浓度。的gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品(UDP-3-gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba-3-羟基癸基)-葡萄糖胺)通过监测734.1944的丰度进行定量gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba如前所述,通常会分解为多个峰值gydF4y2Ba43gydF4y2Ba,所有这些都被整合来推断产物浓度。gydF4y2Ba
巴勒斯坦权力机构gydF4y2Ba采用与上述LC-MS分析相同的设置,对甲醇-氯仿提取的全细胞裂解物的水馏分中的LpxC底物和产物进行了LC-MS /MS分析,并进行了以下调整。父离子gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba的776.1986(对应于gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底)和gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba的734.1872(对应于gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品)的目标为MS/MS,碰撞能量为40。碎片离子在50到850之间gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba进行分析。的相对丰度gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba通过对776.1986中观察到的峰进行积分,对LpxC底物和产物进行了定量gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba和734.1872gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba,分别。LC-MS /MS原始数据可在gydF4y2Bahttps://doi.org/10.5281/zenodo.7455522gydF4y2Ba(ref。gydF4y2Ba42gydF4y2Ba).gydF4y2Ba
体外MurA活性测定gydF4y2Ba
纯化的MurA变体被稀释到200 nM(用于gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(WT),gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(G58D)和gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(E406K))或2µM(用于gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA*变体)在MurA反应缓冲液(25 mM Tris pH 7.75, 6%甘油)中,最终体积为25 μ l,并允许平衡至室温30分钟。通过添加25 μ l MurA底物混合物(25 mM Tris pH 7.75, 2 mM UDP-)开始反应gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖(Sigma-Aldrich U4375)和1 mM磷酸烯醇丙酮酸(Sigma-Aldrich 10108294001)),在37°C下反应30分钟。加入800µl Lanzetta试剂(0.033%孔雀石绿、1%钼酸铵、1 N HCl、0.2% Triton X-100)停止反应。gydF4y2Ba44gydF4y2Ba室温孵育1.25 min后加入34%柠檬酸钠100µl。在室温下再孵育30分钟后,在600 nm (AgydF4y2Ba660海里gydF4y2Ba)。由NaH构成的标准曲线gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba用超纯水稀释,定量游离磷含量gydF4y2Ba我gydF4y2Ba由反应释放。gydF4y2Ba
MurA-LpxC复杂结构预测gydF4y2Ba
使用AlphaFold的默认参数预测LpxC-MurA复合物的结构gydF4y2Ba19gydF4y2Ba.的gydF4y2Ba铜绿假单胞菌gydF4y2BaPAO1 LpxC和MurA序列或gydF4y2Ba大肠杆菌gydF4y2BaMG1655 LpxC和MurA序列由包含15个Gly-Gly-Gly-Ser重复序列的连接子分离,为了清晰,没有显示该连接子。该结构使用ChimeraX版本1.1.1进行可视化。gydF4y2Ba45gydF4y2Ba).gydF4y2Ba
预测复杂的相互作用gydF4y2Ba
我们试图使用进化共变来预测LpxC-MurA相互作用存在或不存在的生物体。我们使用EVComplex运行evcoupling v0.0.5(参考。gydF4y2Ba18gydF4y2Ba),由AlphaFold模型通知,以根据推断出的成对交互项定义交互得分gydF4y2Ba\ ({J} _ {{ij}} \)gydF4y2Ba并验证我们提出的复杂结构。gydF4y2Ba
我们首先生成LpxC和MurA的多个序列对齐使用手提钻v3.1b2(参考。gydF4y2Ba46gydF4y2Ba),在Uniref100数据集上进行5次迭代gydF4y2Ba47gydF4y2Ba将于2021年2月上映。这两个gydF4y2Ba铜绿假单胞菌gydF4y2Ba而且gydF4y2Ba大肠杆菌gydF4y2Ba色差(Uniprot:gydF4y2BaQ9HVW7gydF4y2Ba而且gydF4y2BaP0A749gydF4y2Ba)和LpxC (Uniprot:gydF4y2BaP47205gydF4y2Ba而且gydF4y2BaP0A725gydF4y2Ba)作为初始序列。在每种情况下,序列评分阈值范围为0.1 - 0.8比特/残基,这并不会显著改变物种或蛋白质的序列。从两个物种开始收集到相同的序列。对于所有的分析,我们从54,940个MurA和23,634个LpxC序列的比对开始,然后将每个物种的MurA和LpxC序列连接起来,通过选择每个物种中最接近原始序列的序列来解决配对中的模糊性gydF4y2Ba铜绿假单胞菌gydF4y2Ba同系物。最终的串联比对包含11834个序列。从这个串联的多序列比对,进化耦合确定使用伪似然最大化gydF4y2Ba48gydF4y2Ba.gydF4y2Ba
我们更仔细地分析了排名前五的分子间偶联(gydF4y2BaJgydF4y2BaijgydF4y2Ba)的直接耦合分析模型,对应于AlphaFold2模型中结构接触中的氨基酸位置对,定义为Cα原子在9 Å以内。每对序列都可以对MurA位置之间的耦合进行打分gydF4y2Ba我gydF4y2Ba和LpxC位置gydF4y2BajgydF4y2Ba在适当的基础上gydF4y2Ba\ ({J} _ {{ij}} \)gydF4y2Ba来自模型的项。将每个物种的这五个分数相加,我们观察到一个双峰分布(扩展数据图)。gydF4y2Ba9 cgydF4y2Ba).我们只选取了5个分数之和超过0.1的序列对,共计1689对序列对(Extended Data Fig。gydF4y2Ba9 cgydF4y2Ba),并在级联比对的这些序列上训练一个新的EVcomplex模型。在这个模型中,前六个分子间偶联中的五个对应于AlphaFold2结构中的预测接触(扩展数据图。gydF4y2Ba9 dgydF4y2Ba).我们根据这个改进模型中的前20个耦合项定义了一个最终的“交互得分”,并使用它再次对所有11,834对序列进行级联比对。序列分析文件可在gydF4y2Bahttps://doi.org/10.5281/zenodo.7455522gydF4y2Ba(ref。gydF4y2Ba42gydF4y2Ba).前20个术语是任意选择的,但这个确切的选择对下游分析没有意义,并且对于5到500个顶级耦合的选择,所有关于相对相互作用得分的结论仍然成立。gydF4y2Ba
为了估计每个分支中相互作用序列的百分比,我们使用sklearn v1.0.2拟合了一个双组分高斯混合模型。gydF4y2Ba49gydF4y2Ba)到所有序列对的相互作用得分,并计算每个序列从上分布中抽取的后验概率。我们使用ETE3 v1.3.2(参考文献)将每个序列对的分类标识符映射到国家生物技术信息分类数据库中的类。gydF4y2Ba50gydF4y2Ba),共鉴定出2459个阿尔法变形菌门(alphaproteobacteria)和2781个γ变形菌门(gammaproteobacteria)。然后,我们估计每个分支中相互作用序列的期望分数,作为该分支中每个序列相互作用概率的平均值。gydF4y2Ba
为了可视化这些序列的系统发育结构,我们利用FastTree 2.1.11版本的串联多序列比对构建了MurA和LpxC的最大似然系统发育(参考文献)。gydF4y2Ba51gydF4y2Ba).在Python v3.8.8中,交互得分被映射到树上,并使用交互式生命树(ITOL) v5进行可视化(参考。gydF4y2Ba52gydF4y2Ba).本研究中使用的自定义代码可以在gydF4y2Bahttps://github.com/samberry19/evcomplex-interaction-scoringgydF4y2Ba或gydF4y2Bahttps://doi.org/10.5281/zenodo.7471436gydF4y2Ba(ref。gydF4y2Ba53gydF4y2Ba).gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
用于推导LpxC-MurA相互作用分数的LC-MS /MS源数据、显微图像和序列分析文件可在gydF4y2Bahttps://doi.org/10.5281/zenodo.7455522gydF4y2Ba.用于生成LpxC-MurA相互作用评分的基因的Uniprot登录代码包括在gydF4y2Ba方法gydF4y2Ba和源数据。本研究中开发的所有菌株和质粒均可根据要求提供。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
在本研究中生成的所有代码都可以在gydF4y2Bahttps://github.com/samberry19/evcomplex-interaction-scoringgydF4y2Ba或gydF4y2Bahttps://doi.org/10.5281/zenodo.7471436gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
西尔哈维,t.j.,凯恩,D. &沃克,S.细菌细胞包膜。gydF4y2Ba冷泉港。教谕。医学杂志。gydF4y2Ba2gydF4y2Ba, a000414(2010)。gydF4y2Ba
Zgurskaya, H. I., Lopez, C. A. & Gnanakaran, S.革兰氏阴性细胞包膜的渗透性屏障和绕过它的方法。gydF4y2BaACS感染。说。gydF4y2Ba1gydF4y2Ba, 512-522(2015)。gydF4y2Ba
针对细菌细胞壁和细胞膜的抗菌剂。gydF4y2Ba启科学。技术。gydF4y2Ba31gydF4y2Ba, 43056(2012)。gydF4y2Ba
小仓,T.等。通过AAA蛋白酶FtsH (HflB)调节降解脂质A生物合成的承诺酶,平衡主要膜成分的生物合成gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2BaMolec。Microbiol。gydF4y2Ba31gydF4y2Ba, 833-844(1999)。gydF4y2Ba
Klein, G., Kobylak, N., Lindner, B., Stupak, A. & Raina, S.脂多糖的组装gydF4y2Ba大肠杆菌gydF4y2Ba需要必需的LapB热休克蛋白gydF4y2Ba生物。化学。gydF4y2Ba289gydF4y2Ba, 14829-14853(2014)。gydF4y2Ba
内毒素生物化学。gydF4y2Ba为基础。学生物化学启。gydF4y2Ba59gydF4y2Ba, 129-170(1990)。gydF4y2Ba
Anderson, m.s., Bulawa, c.e. & Raetz, c.r.革兰氏阴性内毒素的生物合成。从UDP-GlcNAc提取脂质A前体的形成gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Ba生物。化学。gydF4y2Ba260gydF4y2Ba, 15536-15541(1985)。gydF4y2Ba
Guest, R. L., Same Guerra, D., Wissler, M., Grimm, J. & Silhavy, T. J. YejM调节YciM/FtsH蛋白酶复合物的活性以防止脂多糖的致命积累。gydF4y2BamBiogydF4y2Ba11gydF4y2Ba, e00598-20(2020)。gydF4y2Ba
安德森,m.s.等。UDP -gydF4y2BaNgydF4y2Ba乙酰氨基葡萄糖乙酰转移酶gydF4y2Ba大肠杆菌gydF4y2Ba:内毒素生物合成的第一步在热力学上是不利的。gydF4y2Ba生物。化学。gydF4y2Ba268gydF4y2Ba, 19858 - 1985(1993)。gydF4y2Ba
Langklotz, S., Schakermann, M. & Narberhaus, F.通过ftsh介导的LpxC蛋白水解控制脂多糖生物合成在肠杆菌中是保守的,但在所有革兰氏阴性菌中并非如此。gydF4y2Baj . Bacteriol。gydF4y2Ba193gydF4y2Ba, 1090-1097(2011)。gydF4y2Ba
卡汉,冯敏,卡汉,卡西迪,P. J. &克鲁普,H.磷霉素的作用机制。gydF4y2Ba安。纽约大学科学学院gydF4y2Ba235gydF4y2Ba, 364-386(1974)。gydF4y2Ba
丙酮酸转化为尿苷二磷酸乙酰葡萄糖胺的酶转移。gydF4y2Ba物化学。Biophys。学报gydF4y2Ba30.gydF4y2Ba, 645-646(1958)。gydF4y2Ba
朱俊英,等。磷酸烯醇丙酮酸与udp - n -乙酰葡萄糖胺1-羧乙烯基转移酶(MurA)共价反应的功能后果。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 12657-12667(2012)。gydF4y2Ba
Eschenberg, S. & Schonbrunn, E.非配位磷霉素靶MurA的比较x线分析。gydF4y2Ba蛋白质gydF4y2Ba40gydF4y2Ba, 290-298(2000)。gydF4y2Ba
Wanke, C. & Amrhein, N.证据表明,udp - n -乙酰氨基葡萄糖- 1-羧基乙烯基转移酶的反应通过丙酮酸的o -磷酸硫酮结合到酶的Cys115进行。gydF4y2Ba欧元。学生物化学j。gydF4y2Ba218gydF4y2Ba, 861-870(1993)。gydF4y2Ba
Eschenburg, S, Priestman, M. & Schönbrunn, E.证据表明磷霉素在udp - n -乙酰氨基葡萄糖烯醇丙酮转移酶(MurA)中的靶标Cys115对产品释放至关重要。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 3757-3763(2005)。gydF4y2Ba
Schönbrunn, E., Eschenberg, S., Krekel, F., Luger, K. & Amrhein, N.含有115残基的环在细菌细胞壁酶MurA诱导拟合机制中的作用。gydF4y2Ba生物化学gydF4y2Ba39gydF4y2Ba, 2164-2173(2000)。gydF4y2Ba
霍普夫,t.a.等。序列协同进化提供了蛋白质复合物的三维接触和结构。gydF4y2BaElifegydF4y2Ba3.gydF4y2Ba, e03430(2014)。gydF4y2Ba
Jumper, J.等。高度准确的蛋白质结构预测AlphaFold。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 583-589(2021)。gydF4y2Ba
莫汉,S.,凯利,t.m.,埃夫兰,S. S.,雷茨,C. R. &安德森,M. S. AngydF4y2Ba大肠杆菌gydF4y2Ba基因(FabZ)编码(3R)-羟基肉豆蔻酰载体蛋白脱氢酶。蚕豆与抑制脂质A生物合成突变的关系。gydF4y2Ba生物。化学。gydF4y2Ba269gydF4y2Ba, 32896-32903(1994)。gydF4y2Ba
Thomanek, N.等人。脂多糖、磷脂和脂肪酸代谢之间的复杂串扰gydF4y2Ba大肠杆菌gydF4y2Ba调节LpxC的蛋白水解。gydF4y2Ba前面。Microbiol。gydF4y2Ba9gydF4y2Ba, 3285(2018)。gydF4y2Ba
莫斯塔法维,等人。相互作用的gydF4y2Ba肺炎克雷伯菌gydF4y2BafabZ和lpxC突变导致lpxC抑制剂依赖的生长,导致细胞膜稳态的丧失。gydF4y2BamSpheregydF4y2Ba3.gydF4y2Ba, e00508-18(2018)。gydF4y2Ba
曾,D.等。通过重新平衡细胞稳态对LpxC抑制剂产生抗性的突变体。gydF4y2Ba生物。化学。gydF4y2Ba288gydF4y2Ba, 5475-5486(2013)。gydF4y2Ba
米赛德,S.等人。UDP -gydF4y2BaNgydF4y2Ba-乙酰muramic acid (UDP-MurNAc)是MurA (enolpyruvyl-UDP-GlcNAc合成酶)的有效抑制剂。gydF4y2Ba生物化学gydF4y2Ba44gydF4y2Ba, 4011-4017(2005)。gydF4y2Ba
一种必需的膜蛋白通过调节LpxC的蛋白水解来控制脂多糖的合成gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2BamBiogydF4y2Ba11gydF4y2Ba, e00939-20(2020)。gydF4y2Ba
Clairfeuille, T.等。必需内膜脂多糖- pbga复合物的结构。gydF4y2Ba自然gydF4y2Ba584gydF4y2Ba, 479-483(2020)。gydF4y2Ba
科利尔,D. N.,哈格尔,P. W. & Phibbs, P. V. Jr分解代谢抑制控制gydF4y2Ba假单胞菌gydF4y2Ba.gydF4y2BaMicrobiol >,gydF4y2Ba147gydF4y2Ba, 551-561(1996)。gydF4y2Ba
强有力的,新颖的体外抑制剂gydF4y2Ba铜绿假单胞菌gydF4y2Ba脱乙酰酶LpxC。gydF4y2Ba医学。化学。gydF4y2Ba45gydF4y2Ba, 3112-3129(2002)。gydF4y2Ba
McClerren, a.l.等人。脂质A生物合成中锌依赖脱乙酰酶LpxC的一种缓慢的、紧密结合的抑制剂,具有与环丙沙星相当的抗生素活性gydF4y2Ba生物化学gydF4y2Ba44gydF4y2Ba, 16574-16583(2005)。gydF4y2Ba
朗斯多夫,e.f.等。筛选UDP-3-的抗菌抑制剂gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba3-hydroxymyristoyl) -gydF4y2BaNgydF4y2Ba-乙酰葡萄糖胺去乙酰酶(LpxC)使用高通量质谱分析。gydF4y2Baj . Biomol。屏幕上。gydF4y2Ba15gydF4y2Ba, 52-61(2010)。gydF4y2Ba
以脂多糖生物合成酶LpxC为靶点的抗菌药物发现。gydF4y2Ba冷泉港。教谕。地中海。gydF4y2Ba6gydF4y2Ba, a025304(2016)。gydF4y2Ba
克劳斯,K. M.等。有效的LpxC抑制剂gydF4y2Ba在体外gydF4y2Ba开展抗多药耐药活动gydF4y2Ba铜绿假单胞菌gydF4y2Ba.gydF4y2BaAntimicrob。代理Chemother。gydF4y2Ba63gydF4y2Ba, e00977-19(2019)。gydF4y2Ba
Ushiyama, F.等人。2-羟甲基咪唑作为非羟氨基甲酸酯LpxC抑制剂的先导优化:TP0586532的发现。gydF4y2BaBioorg。地中海,化学。gydF4y2Ba30.gydF4y2Ba, 115964(2021)。gydF4y2Ba
杨晓明,杨晓明,杨晓明,等。催化机理与分子识别gydF4y2Ba大肠杆菌gydF4y2BaUDP-3 -gydF4y2BaOgydF4y2Ba-(gydF4y2BaRgydF4y2Ba3-hydroxymyristoyl) -gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖脱乙酰酶诱变检测。gydF4y2Ba生物化学gydF4y2Ba45gydF4y2Ba, 15240-15248(2006)。gydF4y2Ba
米勒,J。gydF4y2Ba分子遗传学实验gydF4y2Ba(冷泉港实验室,1972)。gydF4y2Ba
杨,D. C., Tan, K., Joachimiak, A. & Bernhardt, T. G.一种构象开关控制细菌细胞分裂所需的细胞壁重塑酶。gydF4y2Ba摩尔。Microbiol。gydF4y2Ba85gydF4y2Ba, 768-781(2012)。gydF4y2Ba
舍甫琴科,A., Wilm, M., Vorm, O. & Mann, M.银染聚丙烯酰胺凝胶蛋白的质谱测序。gydF4y2Ba分析的化学。gydF4y2Ba68gydF4y2Ba, 850-858(1996)。gydF4y2Ba
彭,J. & Gygi, s.p.蛋白质组学:转向混合物。gydF4y2BaJ.质谱。gydF4y2Ba36gydF4y2Ba, 1083-1091(2001)。gydF4y2Ba
吴俊杰,李志强,李志强,李志强。一种将多肽串联质谱数据与蛋白质数据库中氨基酸序列相关联的方法。gydF4y2Baj。Soc。质量范围。gydF4y2Ba5gydF4y2Ba, 976-989(1994)。gydF4y2Ba
蔡,C.-M。一种用于检测聚丙烯酰胺凝胶中脂多糖的敏感银染色剂。gydF4y2Ba分析的物化学。gydF4y2Ba119gydF4y2Ba, 115-119(1982)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
胡梅尔斯,K. R.等。“细菌细胞壁和外膜生物合成的协调”数据。ZenodogydF4y2Bahttps://doi.org/10.5281/zenodo.7455522gydF4y2Ba(2022)。gydF4y2Ba
科恩,F.等人。LpxC抑制剂抗菌活性和心血管安全性的优化。gydF4y2BaChemMedChemgydF4y2Ba14gydF4y2Ba, 1560-1572(2019)。gydF4y2Ba
兰泽塔,P. A.,阿尔瓦雷斯,L. J., Reinach, P. S. & Candia, O. A.一种改进的测定无机磷酸盐纳米摩尔量的方法。gydF4y2Ba分析的物化学。gydF4y2BaOne hundred.gydF4y2Ba, 95-97(1979)。gydF4y2Ba
彼得森,E. F.等人。UCSF ChimeraX:为研究人员、教育工作者和开发人员提供结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70-82(2021)。gydF4y2Ba
Johnson, L. S., Eddy, S. R. & portugal, E. Hidden Markov模型速度启发式和迭代HMM搜索程序。gydF4y2BaBMC Bioinform。gydF4y2Ba11gydF4y2Ba, 431(2010)。gydF4y2Ba
Suzek, B. E.等。UniRef集群:改进序列相似性搜索的综合和可扩展的替代方案。gydF4y2Ba生物信息学gydF4y2Ba31gydF4y2Ba, 926-932(2015)。gydF4y2Ba
Ekeberg, M., Lövkvist, C., Lan, Y., weight, M. & Aurell, E.改进的蛋白质接触预测:使用伪似然反演Potts模型。gydF4y2Ba理论物理。启EgydF4y2Ba87gydF4y2Ba, 012707(2013)。gydF4y2Ba
Pedregosa, F.等人。Scikit-learn: Python中的机器学习。gydF4y2Baj·马赫。学习。Res。gydF4y2Ba12gydF4y2Ba, 2825-2830(2011)。gydF4y2Ba
Huerta-Cepas, J., Serra, F. & Bork, P. ETE 3:系统基因组数据的重建、分析和可视化。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba33gydF4y2Ba, 1635-1638(2016)。gydF4y2Ba
Price, M. N. Dehal, P. S. & Arkin, a . P. FastTree:用剖面代替距离矩阵计算大型最小进化树。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba26gydF4y2Ba, 1641-1650(2009)。gydF4y2Ba
Letunic, I. & Bork, P.交互式生命树(iTOL) v5:系统发育树显示和注释的在线工具。gydF4y2Ba核酸测定。gydF4y2Ba49gydF4y2Ba, w293-w296(2021)。gydF4y2Ba
Berry, s.p. samberry19/evcomplex-interaction-scoring: v1.0 (v1.0)。ZenodogydF4y2Bahttps://doi.org/10.5281/zenodo.7471436gydF4y2Ba(2022)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Bernhardt, Rudner和Mekalanos实验室的所有成员在整个项目中进行的深入讨论和建议,特别是L. Marmont在蛋白质纯化方面的技术见解。我们也感谢S. Lory提供的菌株和试剂以及对基因操作的建议gydF4y2Ba铜绿假单胞菌gydF4y2BaB. Silva和M. Welsh协助LC-MS /MS分析,以及哈佛医学院的Taplin质谱核心设施鉴定共亲和纯化蛋白。LC-MS数据是在塔普林发现项目基金支持的安捷伦6520 Q-TOF光谱仪上获得的。蛋白质结构由加州大学旧金山分校生物计算、可视化和信息学资源开发的UCSF ChimeraX可视化,得到了美国国立卫生研究院R01-GM129325和美国国家过敏和传染病研究所网络基础设施和计算生物学办公室的支持。这项工作得到了美国国立卫生研究院(F32AI164630给k.r.h., AI148752给S.W., AI083365给t.g.b., U19 AI158028给t.g.b.和S.W.),陈·扎克伯格倡议(CZI2018-191853给D.S.M.)和霍华德·休斯医学研究所(T.G.B)的研究基金的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
K.R.H.和T.G.B.设计了这项研究,并撰写了手稿。s.p.b.、J.K.M.和D.S.M.设计并进行了共变分析。Z.L.建立了甲醇-氯仿代谢物的提取规程。a。t。和s。w。开发了LC-MS协议。K.R.H.进行了所有其他实验和数据分析。所有作者都阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢罗素·毕晓普和其他匿名审稿人对这项工作的同行评审所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 LpxC在gydF4y2Ba铜绿假单胞菌gydF4y2Ba不同于在gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Ba
(a)抗- his免疫印迹检测H-gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC表达于野生型细胞的原生染色体位点gydF4y2BaftsHgydF4y2Ba删除突变。相应的RpoA印迹作为负载对照。数据代表3个生物重复。(b)对含有空质粒或一种编码的PAO1进行连续稀释的斑点滴度测定gydF4y2Ba他- - - - - -gydF4y2Ba巴勒斯坦权力机构gydF4y2BalpxCgydF4y2Ba或gydF4y2Ba他- - - - - -gydF4y2Ba电子商务gydF4y2BalpxCgydF4y2Ba在阿拉伯糖诱导对照下,将其镀在添加阿拉伯糖和/或LpxC抑制剂ir -090的LB琼脂上。在37°C下孵育20小时后成像。数据代表3个生物重复。(c) His-的抗His免疫印迹分析gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC或His-gydF4y2Ba电子商务gydF4y2BaLpxC蛋白水平在PAO1指数增长。免疫印迹检测RpoA作为负载对照。数据代表3个生物重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
扩展数据图2 LPS水平因LpxC调控不当而改变。gydF4y2Ba
从指数生长的培养物中提取LPS的银染色和从相同样品中提取RpoA的蛋白印迹作为加载对照。(a) PAO1含有空质粒或一个编码gydF4y2Ba巴勒斯坦权力机构gydF4y2BalpxCgydF4y2Ba或gydF4y2Ba电子商务gydF4y2BalpxCgydF4y2Ba在阿拉伯糖诱导对照下,在采集样品前1小时用0.1%阿拉伯糖诱导。(b) PAO1, PA1118 [gydF4y2Ba∆P不均匀gydF4y2Ba虫胶gydF4y2Ba不均匀gydF4y2Ba],或PA1135 [gydF4y2Ba∆P murBgydF4y2Ba虫胶gydF4y2Ba-murBgydF4y2Ba]按照样品处理前的指示,在存在或不存在1 mM IPTG的情况下进行生长。(C) PAO1含有空质粒或一个编码gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(WT)gydF4y2Ba或gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)gydF4y2Ba在IPTG诱导对照下,在采集样品前1小时用1 mM IPTG诱导。数据代表3个生物重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
扩展数据图3 MurA是必不可少的,其耗竭表型同时抑制PG和LPS生物合成。gydF4y2Ba
(a-c)的生长曲线gydF4y2Ba铜绿假单胞菌gydF4y2Ba有IPTG或无IPTG时LB中的菌株。点表示3个生物重复的平均值,虚线表示标准偏差。采用以下菌株:(a) PAO1 [WT]和PA1080[∆gydF4y2BaPA4701gydF4y2Ba], (b,c) PAO1 [WT], PA1118 [gydF4y2Ba∆P不均匀gydF4y2Ba虫胶gydF4y2Ba不均匀gydF4y2Ba],及PA1135 [gydF4y2Ba∆P murBgydF4y2Ba虫胶gydF4y2Ba-murBgydF4y2Ba].(d)的相位对比图像gydF4y2Ba铜绿假单胞菌gydF4y2Ba用指定的抗生素治疗1小时后的细胞。比例尺为2µm。数据代表至少2个生物重复(e)所示的相位对比图像gydF4y2Ba铜绿假单胞菌gydF4y2Ba或gydF4y2BamurBgydF4y2Ba衰竭菌株生长4小时,有或没有诱导指示。MurB缺失作为对照进行分析,以比较PG合成中另一个早期步骤失活与MurA失活的表型。比例尺为2µm。数据代表至少3个生物重复(f)在使用指定抗生素处理1小时后或MurA或MurB耗尽后的细胞宽度量化。每个点代表一个单独的细胞,群体的中位数由一条黑线表示。N表示分析的单元格数。对于每种情况,量化的细胞来自单一群体,数据是具有代表性的生物副本。gydF4y2Ba
扩展数据图4gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA与gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC。gydF4y2Ba
(一)H -gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxCgydF4y2Ba在活的有机体内gydF4y2Ba下拉。H-的表达状态gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和F-gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba用Ni-NTA树脂共亲和纯化前(输入)和(洗脱)后的MurA在免疫印迹上显示。F-的变型gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba生成的MurA用F-的WT表示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)或*为F-gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)。当有指示时,在收获前1小时将0.5µg/mL cir -090添加到培养物中,并按照方法部分的详细说明在所有裂解和洗涤缓冲液中保持。使用以下菌株产生裂解物:PA239(通道1)、PA1013(通道2)、PA1068(通道3)、PA1071(通道4和6)和PA1121(通道5和7)。数据具有代表性,为3个生物重复。(b)纯化F-gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba将LpxC(2.5µM)与纯化的H-MurA变体按1:1的比例混合,并在ir -090(5.7µM)存在或不存在的情况下进行混合。用抗flag树脂将混合物拉下,并对输入和洗脱进行SDS-PAGE和考马斯亮染色。H-MurA和F-LpxC的流动性分别用青色或金色胡萝卜表示。数据代表3个重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
扩展数据图5本研究中使用的纯化蛋白和LpxC活性测定的线性关系。gydF4y2Ba
(a)本研究中使用的纯化蛋白通过SDS-PAGE进行分解,并用考马斯色染色对蛋白进行观察。数据至少代表两个2重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.(b) UDP-3-O-(r -3-羟基癸基)- n -乙酰氨基葡萄糖(gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC底物)转化为UDP-3-O-(r -3-羟基癸基)-葡萄糖胺(gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品)由FLAG-gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLC-MS监测20 min内LpxC。RgydF4y2Ba2gydF4y2Ba给出了线性回归的值。gydF4y2Ba
扩展数据图6gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA活性位点是有毒的,但可以通过抑制gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC。gydF4y2Ba
(a)斑点滴度试验,其中PAO1的连续稀释含有空载体,一个编码gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA(WT)或指示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变体在LB琼脂上添加IPTG和/或ir -090。显像前在37℃孵育20 h。gydF4y2Ba__gydF4y2Ba指示构造中存在无声突变。见表gydF4y2BaS2gydF4y2Ba获取详细信息。数据代表3个生物重复。的晶体结构gydF4y2Ba大肠下水道gydF4y2Ba色差(gydF4y2BaPDBgydF4y2Ba1 ejcgydF4y2Ba)gydF4y2Ba14gydF4y2Ba其中残数对应于所识别的残数gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA显性负等位基因用金色球体表示,Cys117则用红色球体表示。注意,所有的替换都集中在活性位点周围。(c)纯化后的MurA活性测定gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变体(100 nM)与UDP-GlcNAc (1 mM)和PEP (0.5 mM)混合,释放PgydF4y2Ba我gydF4y2Ba采用Lanzetta法测定。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。(d)纯化产物的催化活性gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC (100 nM)单独或存在MurA变体(100 nM),通过UDP-3-O-(r -3-羟基癸基)- n -乙酰氨基葡萄糖(gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC底物)转化为UDP-3-O-(r -3-羟基癸基)-葡萄糖胺(gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品)。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。(e)单独从MurA变体制备(100 nM)中检测LpxC酶活性,如图d所示。圆点表示三个单独重复获得的值,柱状表示平均值,误差柱状表示其标准偏差。gydF4y2Ba
图7 LC-MS/MS分析gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底和产品。gydF4y2Ba
(a)的化学结构gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底。被LpxC去除的乙酰基部分以金色突出显示。方框区域表示在c、d和h-j面板中突出显示的假定片段离子。(b) UDP-3-O-(r -3-羟基癸基)- n -乙酰氨基葡萄糖的萃取离子色谱(EIC) (gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底,776.1986gydF4y2Bam / zgydF4y2Ba,黑线)和UDP-3-O-(r -3-羟基癸基)-葡萄糖胺(gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品,734.1872gydF4y2Bam / zgydF4y2Ba,金线)从gydF4y2Ba在体外gydF4y2Ba含有gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba与LpxC底物一起纯化gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA使用LC-MS在负模式下进行解析。虚线表示分配给gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底(S)和gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC积(P). (c-d)与面板b相关的MS/MS谱分别为S峰和P峰。母离子用星号表示,片段离子对应于面板a中突出显示的片段离子被标记。(eg)启德集团gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC产品和gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba用液相色谱-质谱法检测甲醇-氯仿提取的全细胞裂解液中LpxC底物。虚线表示分配给gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC衬底(S)和gydF4y2Ba巴勒斯坦权力机构gydF4y2Balpxl产品峰值(PgydF4y2Ba1gydF4y2Ba和PgydF4y2Ba2gydF4y2Ba).注意gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba此前有报道称LpxC产物分解为两个峰gydF4y2Ba43gydF4y2Ba,两者进行整合,以推断相对产品丰度。数据具有生物三副本的代表性。(h-j)与面板g峰S、P相关的MS/MS谱gydF4y2Ba1gydF4y2Ba,和PgydF4y2Ba2gydF4y2Ba,分别。母离子用星号表示,片段离子对应于面板a中突出显示的片段离子被标记。gydF4y2Ba
扩展数据图8 MurA(G58D)和MurA(E406K)的冲击绑定和激活gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC。gydF4y2Ba
(a) Anti-FLAG免疫印迹检测F-gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba用1 mM IPTG诱导1 h后的MurA变异。相应的RpoA印迹作为负载对照。数据代表3个生物重复。(b)纯化后的MurA活性测定gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA变体(100 nM)与UDP-GlcNAc (1 mM)和PEP (0.5 mM)混合,释放PgydF4y2Ba我gydF4y2Ba采用Lanzetta法测定。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。虚线表示的平均催化活性gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba图S7C观察到MurA(C117S)。(c)gydF4y2Ba在体外gydF4y2Ba其中净化F-gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba在ir -090存在或不存在的情况下,LpxC和H-MurA变体以1:1的比例混合,并按照扩展数据图进行处理。gydF4y2Ba4 bgydF4y2Ba.数据至少代表两个重复。(d)对含有a的PAO1菌株进行连续稀释的斑点滴度测定gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba不均匀gydF4y2Ba删除或gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(C117S)gydF4y2Ba等位基因在原生位点由染色体整合,iptg诱导拷贝补充gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(WT)gydF4y2Ba与指定的补品一起镀在LB琼脂上。结果表明,菌株也含有一个空质粒或一个编码gydF4y2Ba巴勒斯坦权力机构gydF4y2Ba色差(G58D)gydF4y2Ba在阿拉伯糖诱导控制下。培养皿在37℃孵育gydF4y2BaogydF4y2Ba在C中放置20小时后拍照。数据代表3个生物重复。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
扩展数据图9gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC和gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA被预测会相互作用。gydF4y2Ba
(a,b) AlphaFold2预测的对齐误差矩阵gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC /gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA复合体gydF4y2Ba电子商务gydF4y2BaLpxC /gydF4y2Ba电子商务gydF4y2BaMurA结构复杂,分别为。(c)所分析的LpxC和MurA对之间初始相互作用得分的分布。红色条表示用于训练最终EVcomplex模型的序列和与之对应的分数gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC /gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA对由虚线表示。(d)模型结构gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC /gydF4y2Ba巴勒斯坦权力机构gydF4y2BaAlphaFold2预测的MurA复合体gydF4y2Ba19gydF4y2Ba.gydF4y2Ba巴勒斯坦权力机构gydF4y2BaLpxC用金色和表示gydF4y2Ba巴勒斯坦权力机构gydF4y2BaMurA用青色表示。从最终的EVcomplex模型中,LpxC/MurA残基之间的前六个分子间偶联以红色突出显示,并用红线连接偶联对。(e)所分析的LpxC和MurA对之间最终相互作用得分的分布。数据符合双组分高斯混合模型(黑线),表明存在低交互得分(蓝线)和高交互得分(橙线)的种群。(f)纯化产物的催化活性gydF4y2BaLpngydF4y2BaLpxC (100 nM)单独或存在gydF4y2BaLpngydF4y2Ba通过将UDP-3-O-(r -3-羟基癸基)- n -乙酰葡萄糖胺转化为UDP-3-O-(r -3-羟基癸基)-葡萄糖胺测定MurA (200 nM)。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。(g)纯化产物的催化活性gydF4y2Ba电子商务gydF4y2BaLpxC (100 nM)单独或存在gydF4y2Ba电子商务gydF4y2Ba通过将UDP-3-O-(r -3-羟基癸基)- n -乙酰葡萄糖胺转化为UDP-3-O-(r -3-羟基癸基)-葡萄糖胺测定MurA (200 nM)。圆点表示三个单独重复得到的值,柱状表示平均值,误差柱状表示它们的标准偏差。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
本文档包含“补充方法”、表1-5和“补充参考”。gydF4y2Ba
补充图1gydF4y2Ba
本研究中报道的所有电泳凝胶的原始来源图像。gydF4y2Ba
补充数据gydF4y2Ba
补充表1来源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
胡梅尔斯,k.r.,贝瑞,s.p.,李,Z。gydF4y2Baet al。gydF4y2Ba细菌细胞壁和外膜生物合成的协调。gydF4y2Ba自然gydF4y2Ba615gydF4y2Ba, 300-304(2023)。https://doi.org/10.1038/s41586-023-05750-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05750-0gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba