文摘gydF4y2Ba
热量限制,促进减肥是一个有效的策略治疗非酒精脂肪肝疾病和改善2型糖尿病患者的胰岛素敏感性gydF4y2Ba1gydF4y2Ba。尽管其有效性,在大多数人减肥通常不是保持一定程度上是由于生理适应性抑制能量消耗,这一过程称为适应性生热作用,机械基础尚不清楚gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba。治疗的啮齿动物喂食高脂肪饮食与重组生长分化因子15 (GDF15)减少肥胖和改善血糖控制通过glial-cell-derived神经营养因子家族受体α-like (GFRAL)端依赖抑制食物摄取gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba。在这里,我们发现,除了抑制食欲,GDF15抵消补偿减少能量消耗,引起更大的减肥和减少非酒精脂肪肝(NAFLD)相比,热量限制。这种效应GDF15维持能量消耗的卡路里限制需要GFRAL-β-adrenergic-dependent信号轴增加脂肪酸氧化和钙徒劳的自行车在小鼠骨骼肌。这些数据表明,GDF15-GFRAL通路可能是有用的治疗目标保持在骨骼肌能量消耗热量限制。gydF4y2Ba
主要gydF4y2Ba
GDF15是肝脏和肾脏中高度表达,诱导在所有类型的细胞线粒体毒素和内质网应激反应(前面了gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba,gydF4y2Ba11 gydF4y2Ba,gydF4y2Ba12gydF4y2Ba)。GDF15第一次被认定为可溶性因子从巨噬细胞分泌gydF4y2Ba13gydF4y2Ba和癌症细胞gydF4y2Ba14gydF4y2Ba,后来证明诱导恶病质gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba和保护小鼠免受肥胖和胰岛素抵抗gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。在啮齿动物喂高脂肪的食物,重组GDF15抒发减肥治疗,减少肝脏脂肪变性和改善血糖控制gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba,gydF4y2Ba11 gydF4y2Ba,gydF4y2Ba12gydF4y2Ba。这些减肥的效果已被证明需要后脑gydF4y2Ba19gydF4y2Ba更具体地说,GDF15受体GFRALgydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba。在短期实验生成7 - 10天,一对喂养(热量匹配)GDF15 vehicle-treated老鼠显示,减肥引起的是由于减少食物摄入量gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba。重要的是,生殖系gydF4y2BaGdf15gydF4y2Ba空的老鼠gydF4y2Ba20.gydF4y2Ba,liver-targetedgydF4y2BaGdf15 -gydF4y2Ba空的老鼠gydF4y2Ba21gydF4y2Ba和生殖系gydF4y2BaGfral -gydF4y2Ba空的老鼠gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba都有适度的食物摄入量和肥胖症的增加高脂肪饮食支持这个通路在调节能量平衡的生理作用。这些研究导致概念GDF15信号通过GFRAL减少体重和改善血糖控制主要通过抑制食欲,最少对能量消耗的影响gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba。gydF4y2Ba
肥胖的结果从一个卡路里的能量摄入和支出之间的不平衡。虽然它是成熟的,GDF15在啮齿类动物和非人灵长类的抑制能量摄入gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba结束之前,需要考虑三个重要的区别,这是唯一的机制有助于减肥。第一和最重要的是,能量摄入能量消耗和体重是彼此相互依赖的变量,这些变量都是动态链接的,在这一点上,减少能量摄入和减肥都可以导致减少了能量消耗gydF4y2Ba22gydF4y2Ba。第二,研究重组GDF15在gydF4y2BaGfralgydF4y2Ba空的老鼠进行了相对较短的一段(7 - 10天)gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba,这可能是不足以检测计数器相关监管反应减少能量消耗(即适应性产热),通常发生在啮齿动物经过更长时间的热量限制gydF4y2Ba23gydF4y2Ba。最后,现在认识到,进行能量平衡实验老鼠住在室温下(21°C),下面是啮齿动物的热中性的区,刺激交感开车gydF4y2Ba24gydF4y2Ba。这可能抑制减肥引起的代理诱导徒劳的自行车或者刺激能量消耗通过β-adrenergic信号通路gydF4y2Ba25gydF4y2Ba。总的来说,这些研究表明,重要的是要考虑的卡路里摄入量之间的相互关系,干预时间和住房时温度研究小鼠的体重和药理干预。gydF4y2Ba
GDF15减少肥胖超过食品限制gydF4y2Ba
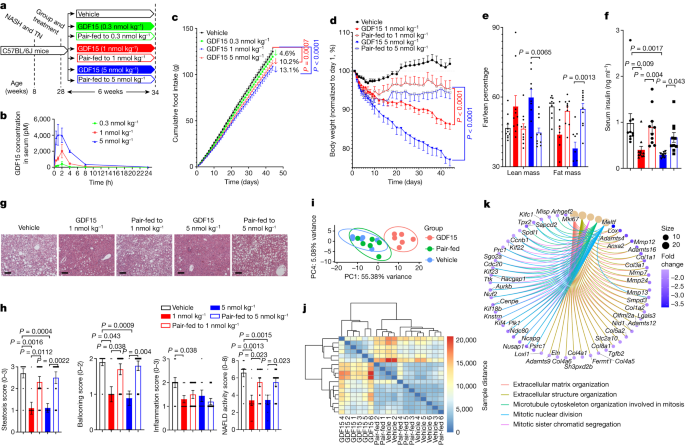
为了更好地理解GDF15的机制可以促进减肥,我们研究老鼠住在热力中性(29°C),西方饮食习惯进行喂养高脂肪和果糖促进肥胖、胰岛素抵抗与非酒精性脂肪肝(NASH)类似的病理组织学和转录的人类疾病的发展gydF4y2Ba26gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba)。在小鼠肝脏脂肪变性的卡路里摄入量的变化特别敏感,我们假设,考虑到短半衰期在老鼠(2 h)的本地人力GDF15治疗开始的时候光周期(时间当老鼠吃更少的热量)将对食品消费产生较小的影响与先前的研究相比当小白鼠注射在黑暗周期的开始gydF4y2Ba4 gydF4y2Ba。符合这一假说,与vehicle-treated控制相比,注射的老鼠在光周期的开始GDF15(每公斤5 nmol)导致每日食物摄入量减少30%相比,减少了43%的暗周期(约40%的差异;扩展的数据图。gydF4y2Ba1gydF4y2Ba)。我们随后注入老鼠每天一次的光周期与车辆或重组GDF15在三种不同剂量(0.3,每公斤1和5 nmol) 6周。个人食物摄入量每天测量,匹配pair-fed控制。注入GDF15迅速,剂量依赖性的血清水平升高GDF15在下降之前回到基线开始的黑暗周期(图。gydF4y2Ba1 bgydF4y2Ba)。正如预期的那样,慢性每日治疗GDF15导致剂量依赖性减少食物摄入量(无花果。gydF4y2Ba1 cgydF4y2Ba),与以前的观测一致使用相同的重组蛋白的准备gydF4y2Ba4 gydF4y2Ba。gydF4y2Ba
一个gydF4y2Ba、实验示意图。TN,热力中性。gydF4y2BabgydF4y2Ba、等离子体GDF15注射后0.3,每公斤1和5 nmol GDF15。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 3老鼠每组。gydF4y2BacgydF4y2Ba随着时间的推移,食物摄入量。数据均值±s.e.m。gydF4y2BangydF4y2Ba=每组10老鼠,除了GDF15(每公斤5 nmol)的gydF4y2BangydF4y2Ba= 9老鼠。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析(方差分析)与图基的多重比较检验。gydF4y2BadgydF4y2Ba随着时间的推移,体重的百分比变化。数据均值±s.e.m。gydF4y2BangydF4y2Ba=每组10老鼠,除了GDF15(每公斤5 nmol)的gydF4y2BangydF4y2Ba= 9老鼠。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BaegydF4y2Ba,脂肪的百分比/精益质量相对于体重。数据均值±s.e.m。gydF4y2BangydF4y2Ba=每组10老鼠,除了GDF15(每公斤5 nmol)的gydF4y2BangydF4y2Ba= 9老鼠。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BafgydF4y2Ba、血清胰岛素。数据均值±s.e.m。gydF4y2BangydF4y2Ba=每组10老鼠,除了GDF15(每公斤5 nmol)的gydF4y2BangydF4y2Ba= 9老鼠。gydF4y2BaPgydF4y2Ba值计算使用单向方差分析与图基的多重比较测试。gydF4y2BaggydF4y2Ba石蜡包埋的,代表图像肝部分与苏木精和伊红染色())。gydF4y2BahgydF4y2Ba从左到右,脂肪变性分数,分数和非酒精性脂肪肝活动分数膨胀的分数,炎症。数据均值±s.e.m。gydF4y2BangydF4y2Ba=每组10老鼠,除了GDF15(每公斤5 nmol)的gydF4y2BangydF4y2Ba= 9老鼠。gydF4y2BaPgydF4y2Ba使用双面未配对Mann-Whitney值计算gydF4y2BaUgydF4y2Ba测试。gydF4y2Ba我gydF4y2Ba,肝脏vehicle-treated样本和GDF15-treated PCA(每公斤5 nmol)小鼠和pair-fed控制使用从DESeq2威仕特数据。gydF4y2BangydF4y2Ba= 6小鼠每组。gydF4y2BajgydF4y2Ba热图的样本距离的基础上从DESeq2威仕特数据。gydF4y2BangydF4y2Ba= 6小鼠每组。gydF4y2BakgydF4y2Ba,Gene-concept网络图,注明相应的丰富条件(度)之间的差异表达基因根据车辆和GDF15组。gydF4y2Ba
GDF15在每公斤0.3 nmol并未显著降低体重,脂肪质量,血清胰岛素、葡萄糖耐量、胰岛素抵抗、肝组织学、肝脏甘油三酯或其他等离子体变量与vehicle-treated pair-fed控制(扩展数据图。gydF4y2Ba1 blgydF4y2Ba)。当GDF15在1和5 nmol /公斤,在治疗的前十天,减肥是相似的轨迹GDF15治疗和pair-fed控制,反映在这个时期之前的实验gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba(无花果。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba2gydF4y2Ba)。然而,10天后,pair-fed控制的体重没有进一步减少,而GDF15-treated老鼠继续减肥(无花果。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba2gydF4y2Ba)。通过实验的最后,老鼠接受GDF15在每公斤1和5 nmol失去了体重的13.6%和23.0%,分别只有5%左右pair-fed控制老鼠(图。gydF4y2Ba1 dgydF4y2Ba)。重要的是,这个减肥是归因于减少脂肪量但不是精益质量(图。gydF4y2Ba1 egydF4y2Ba),这被认为是重要的维持能量消耗gydF4y2Ba27gydF4y2Ba。符合减少体重和肥胖,GDF15在每公斤1和5 nmol降低血清胰岛素(图。gydF4y2Ba1 fgydF4y2Ba每公斤5点),而GDF15 nmol改善葡萄糖耐量和胰岛素敏感性与vehicle-treated控制(扩展数据图。gydF4y2Ba2 b, cgydF4y2Ba)。这些数据表明GDF15在慢性环境促进减少体重,降低胰岛素抵抗程度大于热量限制。gydF4y2Ba
GDF15减少热量摄取纳什独立gydF4y2Ba
非酒精性脂肪肝胰岛素抵抗是一个重要的因素gydF4y2Ba1gydF4y2Ba。GDF15(每公斤1和5 nmol),但不是pair-feeding,降低肝脂肪变性、膨胀和非酒精性脂肪肝活动分数(图。gydF4y2Ba1 g hgydF4y2Ba)。与这些组织学变化一致,GDF15但不是pair-feeding,减少肝脏甘油三酯,肝脏non-esterified free-fatty酸和血清丙氨酸转氨酶(ALT)(扩展数据图。gydF4y2Ba2 d-fgydF4y2Ba)。主成分分析(PCA)使用方差稳定的转换(VST)数据和热地图same-to-sample区别肝RNA-sequencing (RNA-seq)数据显示不同的分离GDF15-treated(1每公斤nmol)和vehicle-treated pair-fed控制(图。gydF4y2Ba1 i, jgydF4y2Ba)。与vehicle-treated和pair-fed控制相比,GDF15引起许多(扩展数据图的差异表达基因。gydF4y2Ba3 a, bgydF4y2Ba)与组织细胞外基质,细胞外结构组织(图。gydF4y2Ba1 kgydF4y2Ba和扩展数据图。gydF4y2Ba3 dgydF4y2Ba),白细胞/巨噬细胞迁移和磷脂酰肌醇3-kinase-AKT信号(扩展数据图。gydF4y2Ba3 d, egydF4y2Ba),而没有差异vehicle-treated pair-fed集团(扩展数据图。gydF4y2Ba3 cgydF4y2Ba)。层次聚类显示GDF15改变liver-fibrosis-related转录组签名与vehicle-treated或pair-fed集团(扩展数据图。gydF4y2Ba3 fgydF4y2Ba)。此外,一个既定25-gene签名用来预测纳什在人类发展gydF4y2Ba28gydF4y2Ba发现GDF15下调20的25基因(gydF4y2BaAkr1b10gydF4y2Ba,gydF4y2BaAnkrd29gydF4y2Ba,gydF4y2BaCcl20gydF4y2Ba,gydF4y2BaClic6gydF4y2Ba,gydF4y2BaCol1a1gydF4y2Ba,gydF4y2BaCol1a2gydF4y2Ba,gydF4y2BaDtnagydF4y2Ba,gydF4y2BaDusp8gydF4y2Ba,gydF4y2BaEpb41l4agydF4y2Ba,gydF4y2BaFermt1gydF4y2Ba,gydF4y2BaGdf15gydF4y2Ba,gydF4y2BaHecw1gydF4y2Ba,gydF4y2BaItgbl1gydF4y2Ba,gydF4y2BaLtbp2gydF4y2Ba,gydF4y2BaPdgfagydF4y2Ba,gydF4y2BaRgs4gydF4y2Ba,gydF4y2BaSctrgydF4y2Ba,gydF4y2BaThy1gydF4y2Ba,gydF4y2BaTnfrsf12agydF4y2Ba和gydF4y2BaTymsgydF4y2Ba),而只上调1基因(gydF4y2BaHsd17b14)gydF4y2Ba(扩展数据图。gydF4y2Ba3 ggydF4y2Ba)。因此,GDF15独立于减少热量摄取减少了纳什。gydF4y2Ba
GDF15块适应性生热作用和减肥gydF4y2Ba
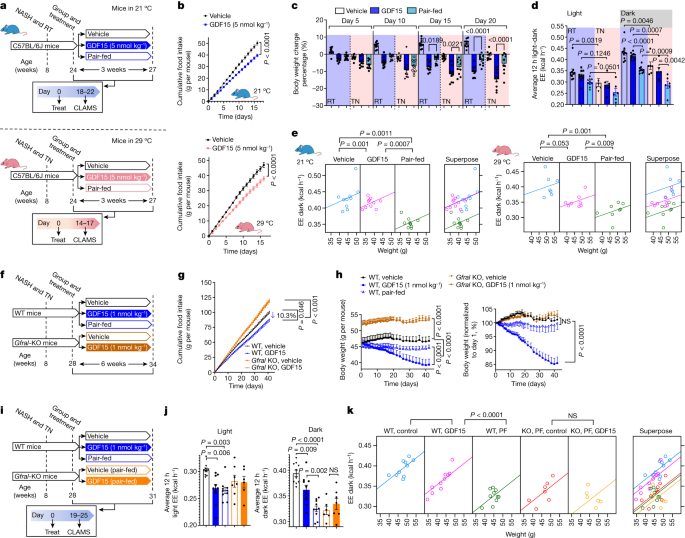
检查是否GDF15治疗的效果与pair-fed控制依赖于住房温度相比,我们随后完成匹配实验老鼠住在21°C和29°C,分别(无花果。gydF4y2Ba2gydF4y2Ba)。在16天,GDF15治疗导致了类似的累积食物摄入量减少21岁和29°C(21.3%和19.2%)(无花果。gydF4y2Ba2 bgydF4y2Ba)。GDF15-induced减肥并不不同于pair-fed控制在21或5或10天后29°C(无花果。gydF4y2Ba2摄氏度gydF4y2Ba)。10天后,无论房屋温度,GDF15-treated老鼠继续减肥,而pair-fed控制老鼠没有(图。gydF4y2Ba2摄氏度gydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba、实验示意图。老鼠被安置在室温下(RT;21°C)或热力中性(TN, 29°C)。蛤蜊、综合实验动物监测系统。gydF4y2BabgydF4y2Ba,累积的食物摄入量。数据均值±s.e.m。gydF4y2BangydF4y2Ba在室温下= 10老鼠每组。gydF4y2BangydF4y2Ba= 7每组小鼠热中和性。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BacgydF4y2Ba,体重百分比变化。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 10老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用单向方差分析与图基的多重比较测试。gydF4y2BadgydF4y2Ba平均能量消耗。数据均值±s.e.m。gydF4y2BangydF4y2Ba在室温下= 10老鼠每组。gydF4y2BangydF4y2Ba= 6小鼠每组热力中性。gydF4y2BaPgydF4y2Ba值计算用单向方差分析Šidak多重比较检验。gydF4y2BaegydF4y2Ba,ANCOVA使用体重作为协变量(两面没有调整)。gydF4y2BangydF4y2Ba= 10每组在室温和老鼠gydF4y2BangydF4y2Ba= 6小鼠每组热力中性。gydF4y2BafgydF4y2Ba,实验示意图GDF15在WT的效果gydF4y2BaGfralgydF4y2Bako小鼠。EE,能量消耗。gydF4y2BaggydF4y2Ba,累积的食物摄入量。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 10老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BahgydF4y2Ba、体重和随时间变化的百分比。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 10老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2Ba我gydF4y2Ba,实验示意图GDF15和匹配的影响热量限制在WT和能量消耗gydF4y2BaGfralgydF4y2Bako小鼠。gydF4y2BajgydF4y2Ba平均能量消耗在12 h h-12光暗周期。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 10 (WT、车辆;WT GDF15;和WT pair-fed),gydF4y2BangydF4y2Ba= 7 (KO, pair-fed)和gydF4y2BangydF4y2Ba= 6 (KO GDF15)老鼠。gydF4y2BaPgydF4y2Ba值计算用单向方差分析Šidak多重比较检验。NS,不重要。gydF4y2BakgydF4y2Ba,ANCOVA使用体重作为协变量和治疗固定因素(两面没有调整)。gydF4y2BangydF4y2Ba= 10 (WT、车辆;WT GDF15;和WT pair-fed (PF)),gydF4y2BangydF4y2Ba= 7 (KO, pair-fed)和gydF4y2BangydF4y2Ba= 6 (KO GDF15)老鼠。老鼠的图像生成的使用gydF4y2BaBioRender.comgydF4y2Ba。gydF4y2Ba
研究GDF15促进减肥,老鼠置于代谢笼。没有变化之间的体育活动组(补充图。gydF4y2Ba1gydF4y2Ba)。然而,增加减肥GDF15治疗与能量消耗在黑暗周期的维护与pair-fed控制老鼠相比,其能量消耗甚至在修正了体重减少了协方差分析(ANCOVA;无花果。gydF4y2Ba2 d, egydF4y2Ba)。这个GDF15维持能量消耗的影响是明显的,不管住房温度。正如预期的那样,能量消耗明显高于21°C相比,在所有条件(图29°C。gydF4y2Ba二维gydF4y2Ba)。这些数据表明,在老鼠身上有21°C或29°C,治疗GDF15 10多天,促进减肥与热量限制通过维持能量消耗。gydF4y2Ba
昼夜节律和喂养时间影响能量消耗;因此我们检查GDF15在两种不同的影响pair-fed组(pair-fed早上组,美联储在光周期的开始(06:00-07:00);pair-fed晚上组,美联储在黑暗周期(18:00-19:00))开始执行在不同的网站(丹麦诺和诺德公司)。使用这个修改后的协议在不同位置的高剂量GDF15(每公斤8和1 nmol)导致能量消耗的增加,刺激身体质量损失与pair-fed和对照组(扩展数据图。gydF4y2Ba4 gydF4y2Ba)。gydF4y2Ba
另一个重要的机制有助于减少能量消耗与热量限制包括甲状腺激素三碘甲状腺氨酸gydF4y2Ba29日gydF4y2Ba。GDF15激活垂体轴gydF4y2Ba30.gydF4y2Ba,暗示这可能是重要的维持能量消耗。然而,促甲状腺激素(TSH)水平并没有改变GDF15治疗小鼠(扩展数据图。gydF4y2Ba5 a、bgydF4y2Ba)和慢性治疗的小鼠三碘甲状腺氨酸阻断剂丙硫氧嘧啶并没有阻止GDF15-induced体重减轻或增加能量消耗(扩展数据图。gydF4y2Ba5 dgydF4y2Ba与pair-feeding相比)。同样,也没有相关性TSH和GDF15在肥胖的女性曾经参加食源性减肥计划gydF4y2Ba31日gydF4y2Ba(扩展数据图。gydF4y2Ba5度gydF4y2Ba)。因此,GDF15维持能量消耗热量限制独立住房温度相比,时间喂养或甲状腺激素。gydF4y2Ba
通过GFRAL GDF15维持能量消耗gydF4y2Ba
老鼠在21°C和喂高脂肪的食物,gydF4y2BaGfralgydF4y2Ba淘汰赛(KO)比野生型更肥胖小鼠(WT)控制和抵抗的抑制食欲影响GDF15在7 - 10天gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba也很重要,但这是否受体GDF15减少体重的影响和纳什在热力中性更延长治疗期是不清楚。使用如上所述(图类似的待遇条件。gydF4y2Ba2 fgydF4y2Ba),我们发现gydF4y2BaGfralgydF4y2Bako小鼠gydF4y2Ba32gydF4y2Ba有更大的食物摄入量和抵抗的抑制食欲影响GDF15(1每公斤nmol)与WT同窝出生(无花果。gydF4y2Ba2 ggydF4y2Ba)。gydF4y2BaGfralgydF4y2Bako小鼠体重与WT相比更大的同胞(无花果。gydF4y2Ba2 hgydF4y2Ba)。WT老鼠,GDF15减少体重与WT vehicle-treated和pair-fed controls-effects减毒的gydF4y2BaGfralgydF4y2Bako小鼠(无花果。gydF4y2Ba2 hgydF4y2Ba)。gydF4y2BaGfralgydF4y2Bako小鼠也耐GDF15降低脂肪变性的影响,不断膨胀、炎症和非酒精性脂肪肝活动分数(扩展数据图。gydF4y2Ba5 h,我gydF4y2Ba),肝脏甘油三酯(扩展数据图。gydF4y2Ba5 jgydF4y2Ba)和血清ALT(扩展数据图。gydF4y2Ba5 kgydF4y2Ba)。GDF15可能出现在肝脏的抗炎效应作用于独立于GFRAL髓细胞gydF4y2Ba33gydF4y2Ba;然而,我们发现,与肝脏炎症评分一致,GDF15减少肝髓系细胞群通过GFRAL和独立于减少食物的摄入量(扩展数据图。gydF4y2Ba5 l, mgydF4y2Ba和补充图。gydF4y2Ba2 gydF4y2Ba)。数据表明,与体重的变化一致,通过GFRAL-dependent GDF15减少非酒精性脂肪肝和肝脏炎症机制,减少食物摄入量无关。gydF4y2Ba
检查是否通过GFRAL GDF15维持能量消耗,我们在WT,进行了研究gydF4y2BaGfralgydF4y2Bako小鼠后19天GDF15治疗(图。gydF4y2Ba2我gydF4y2Ba)——计算之前体重组之间有显著差异(图gydF4y2Ba2 hgydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba)。没有身体活动之间的差异治疗组(扩展数据图。gydF4y2Ba6 bgydF4y2Ba)。与WT vehicle-treated老鼠相比,在黑暗中循环,GDF15维持能量消耗与pair-fed控制相比,消除的影响gydF4y2BaGfralgydF4y2Bako小鼠(无花果。gydF4y2Ba2 jgydF4y2Ba)。的维护与GDF15而pair-fed或能量消耗gydF4y2BaGfralgydF4y2Ba由ANCOVA ko小鼠持续在修正了身体质量(无花果。gydF4y2Ba2 kgydF4y2Ba)。GDF15也减少了呼吸交换率(r),表明高脂肪酸和低碳水化合物的氧化与pair-fed管制效应,也消除了gydF4y2BaGfralgydF4y2Bako小鼠(扩展数据图。gydF4y2Ba6汉英gydF4y2Ba)。因此,符合更大的长期减肥,GDF15增加脂肪酸氧化,防止减少能量消耗引起通过热量限制要求GFRAL机制。gydF4y2Ba
GDF15增加β-adrenergic信号gydF4y2Ba
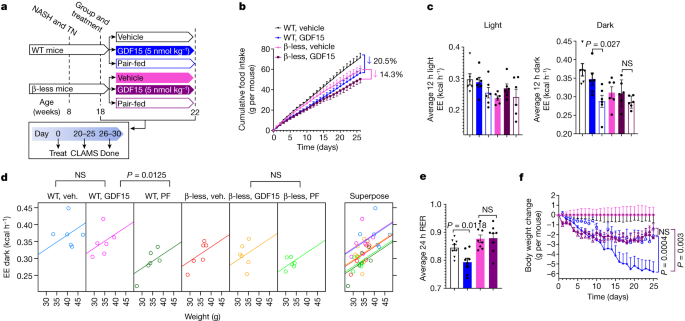
在后脑GFRAL完全表达gydF4y2Ba34gydF4y2Ba,这表明GDF15可能通过brain-somatic组织电路增加了能量消耗。除了三碘甲状腺氨酸的变化,抑制交感神经系统(SNS)活动的减少能量消耗是一个重要的因素与热量限制和减肥gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba。测试是否GDF15治疗可以促进减肥而pair-fed控制通过增加社交活动,我们管理GDF15 WT老鼠和老鼠缺乏βgydF4y2Ba1gydF4y2Ba,βgydF4y2Ba2 gydF4y2Ba和βgydF4y2Ba3 gydF4y2Ba肾上腺素能受体(以后,β-less老鼠)(无花果。gydF4y2Ba3gydF4y2Ba)。β-less老鼠反应通常GDF15抑制食物摄取的影响(图gydF4y2Ba3 bgydF4y2Ba);然而,当置于代谢笼前体重发生(扩展数据图的差异。gydF4y2Ba6克gydF4y2Ba),β-less小鼠耐GDF15维持能量消耗的影响相比,在暗循环WT控制(图。gydF4y2Ba3 c, dgydF4y2Ba和扩展数据图。gydF4y2Ba6 fgydF4y2Ba)。β-less老鼠也耐GDF15减少r的影响,增加脂肪酸氧化(无花果。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba6 h lgydF4y2Ba)。此外,类似于观察gydF4y2BaGfralgydF4y2Bako小鼠,小鼠慢性治疗β-less GDF15没有减少体重超过pair-feeding独自(无花果。gydF4y2Ba3 fgydF4y2Ba)。综上所述,这些数据表明GDF15促进体重增加能量消耗通过GFRAL-β-adrenergic信号轴。gydF4y2Ba
一个gydF4y2Ba,实验原理的影响GDF15在WT与热量限制和β-less老鼠。gydF4y2BabgydF4y2Ba,累积的食物摄入量。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 6小鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BacgydF4y2Ba平均能量消耗在12 h h-12光暗周期。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 6小鼠每组。gydF4y2BaPgydF4y2Ba值计算用单向方差分析Šidak多重比较检验。gydF4y2BadgydF4y2Ba,ANCOVA对体重的能量消耗的老鼠使用体重作为协变量和治疗固定因素(两面没有调整)。gydF4y2BangydF4y2Ba= 6小鼠每组。阿明费。,vehicle.egydF4y2Ba,平均r / 24小时。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 8老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用单向方差分析与图基的多重比较测试。gydF4y2BafgydF4y2Ba、体重改变随着时间的推移(克)。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 6小鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2Ba
检查组织是什么导致这种效果,我们测量血清和组织去甲肾上腺素注射后2 h GDF15(每公斤1 nmol)在小鼠治疗30天。GDF15没有增加去甲肾上腺素血清,intrascapular褐色脂肪组织(iBAT)或肝脏(扩展数据图。gydF4y2Ba6 m-ogydF4y2Ba)。符合这一发现,肝脏,白色脂肪组织和蝙蝠没有β-adrenergic变化或无用的信号通路(扩展数据图。gydF4y2Ba7模拟gydF4y2Ba),没有脂肪组织褐变(扩展数据图的迹象。gydF4y2Ba7 e, fgydF4y2Ba)。我们还发现,AMPK脂肪tissue-null老鼠,它们对β-adrenergic诱导脂肪组织产热增加gydF4y2Ba37gydF4y2Ba失去了身体质量与GDF15 WT小鼠(扩展数据图。gydF4y2Ba7胃肠道gydF4y2Ba)。GDF15并未改变直肠或iBAT温度(扩展数据图。gydF4y2Ba8 a - cgydF4y2Ba)。同样,GDF15不会大幅改变氧化代谢评估使用正电子发射tomography-computed断层在iBAT pet - ct机(),心脏、肝脏或肾脏与车辆控制(扩展数据图。gydF4y2Ba8 d - igydF4y2Ba)。氧化代谢低于pet - ct机检测的局限性在白色脂肪组织和骨骼肌。最后,我们去神经的蝙蝠与当地注入6-hydroxydopaminehydrobromide (6 ohda) iBAT仓库,发现,虽然这削弱了β的影响gydF4y2Ba3 gydF4y2Ba受体激动剂cl - 316243增加能量消耗和iBAT温度与生理盐水注入(补充图。gydF4y2Ba3 gydF4y2Ba),它没有抑制GDF15促进减肥的能力,增加能量消耗或脂肪酸氧化而pair-fed控件(扩展数据图。gydF4y2Ba9gydF4y2Ba)。总的来说,这些数据表明GDF15不太可能刺激通过β-adrenergic信号能量消耗脂肪组织。gydF4y2Ba
GDF15增加钙在肌肉中骑自行车gydF4y2Ba
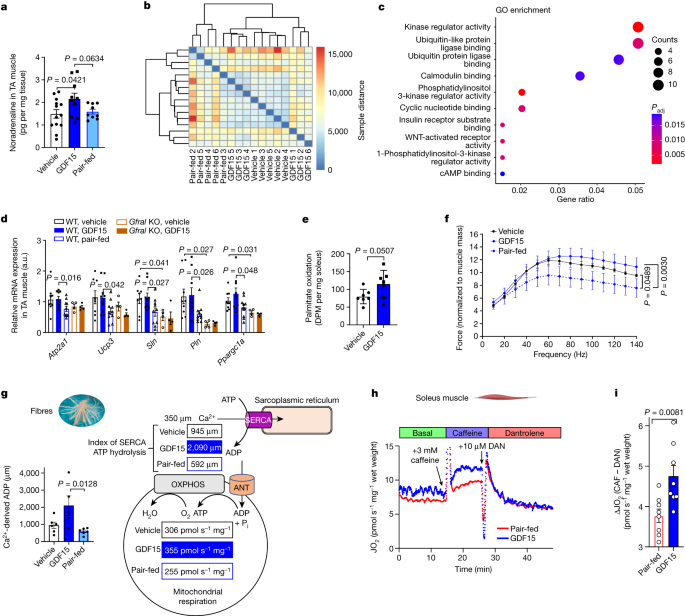
β-Adrenergic信号也会增加徒劳的在骨骼肌中骑自行车通过增加线粒体解偶联蛋白的表达和sarcolipin (SLN)gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba。SLN结合石棺/内质网钙腺苷三磷酸酶(SERCA的),从Ca解偶联atp酶活性gydF4y2Ba2 +gydF4y2Ba运输,促进ATP水解,因此徒劳的自行车的存在增加了CagydF4y2Ba2 +gydF4y2Ba(参考文献。gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba)。蝙蝠或肝相比,我们发现,去甲肾上腺素水平升高GDF15-treated小鼠胫骨前肌(无花果。gydF4y2Ba4gydF4y2Ba)。热图RNA-seq same-to-sample差异的数据发现,车辆和胫骨前肌GDF15-treated动物聚在一起明显pair-fed控件(无花果。gydF4y2Ba4 bgydF4y2Ba),发现不同于肝脏,转录组概要文件之间pair-fed和车辆控制没有不同(图。gydF4y2Ba1 i, jgydF4y2Ba和扩展数据图。gydF4y2Ba7一个gydF4y2Ba)。与去甲肾上腺素的增加相一致,基因本体论(去)注释之间的差异表达基因在骨骼肌GDF15和pair-fed组织表明,GDF15增加营地/ PKA pair-fed控制信号相比gydF4y2Ba43gydF4y2Ba(无花果。gydF4y2Ba4摄氏度gydF4y2Ba)。有针对性的分析显示更高水平的PKA-regulated基因,包括gydF4y2BaPpargc1agydF4y2Ba,gydF4y2BaUcp3gydF4y2Ba,gydF4y2BaAtp2a1gydF4y2Ba(编码SERCA1),gydF4y2BaSlngydF4y2Ba和gydF4y2BaPlngydF4y2Ba相比之下,pair-fed控制或gydF4y2BaGfralgydF4y2Bako小鼠,这表明内生GDF15水平也可能是重要的维持这个途径(图。gydF4y2Ba4 dgydF4y2Ba)。GDF15治疗也增加了gydF4y2BaSlngydF4y2Ba表达在氧化比目鱼肌和糖酵解伸肌手提键盘长肌肉与pair-fed控制(扩展数据图。gydF4y2Ba10gydF4y2Ba)。符合GFRAL不是表达介导的肌肉和响应通过SNS,治疗β-less小鼠GDF15没有改变肌肉基因表达谱(扩展数据图。gydF4y2Ba10 bgydF4y2Ba)。同样,去甲肾上腺素但不是GDF15,增加了表达gydF4y2BaAtp2a1gydF4y2Ba,gydF4y2BaSlngydF4y2Ba和gydF4y2BaPlngydF4y2Ba在培养C2C12肌管(扩展数据图。gydF4y2Ba10 cgydF4y2Ba)。最后,最近发表的分析gydF4y2Ba44gydF4y2BaRNA-seq数据从肥胖小鼠股四头肌肌肉治疗βgydF4y2Ba2 gydF4y2Ba受体激动剂瘦肉精也发现增加gydF4y2BaSlngydF4y2Ba表达式(扩展数据图。gydF4y2Ba10 dgydF4y2Ba)。综上所述,这表明GDF15增强基因重要徒劳的自行车在β-adrenergic信号通过增加骨骼肌。gydF4y2Ba
一个gydF4y2Ba因此,GDF15增加去甲肾上腺素在前侧(TA)肌肉。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 13(车辆),gydF4y2BangydF4y2Ba= 10 (GDF15),gydF4y2BangydF4y2Ba= 9 (pair-fed)老鼠。gydF4y2BaPgydF4y2Ba值计算使用单向方差分析与图基的多重比较测试。gydF4y2BabgydF4y2Ba热图的样本距离对TA肌肉。gydF4y2BangydF4y2Ba= 5老鼠每组,除了GDF15集团的gydF4y2BangydF4y2Ba= 6老鼠。gydF4y2BacgydF4y2Ba,去注释GDF15和pair-fed团体之间。的调整gydF4y2BaPgydF4y2Ba值(gydF4y2BaPgydF4y2Ba邻接的gydF4y2Ba)使用Benjamini-Hochberg方法计算。gydF4y2BadgydF4y2Ba,在肌肉相对基因表达。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 9 (WT、车辆;和WT GDF15),gydF4y2BangydF4y2Bapair-fed = 10 (WT)和gydF4y2BangydF4y2Ba= 4 (KO pair-fed;老鼠和KO, GDF15)。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。a.u。,一个rbitrary units.egydF4y2Ba比目鱼肌、脂肪酸氧化。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 7小鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双面未配对gydF4y2BatgydF4y2Ba测试。DPM,衰变/分钟。gydF4y2BafgydF4y2Ba,Force-frequency EDL肌肉的曲线。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 4老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双向方差分析与图基的多重比较测试。gydF4y2BaggydF4y2Ba计算钙(CagydF4y2Ba2 +gydF4y2Ba)派生ADP permeabilized从红骨骼肌纤维。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 6小鼠每组,除了GDF15集团的gydF4y2BangydF4y2Ba= 5老鼠。gydF4y2BaPgydF4y2Ba值计算使用单向方差分析测试(补充图与图基的多重比较。gydF4y2Ba5gydF4y2Ba)。SERCA的效率的示意图。PgydF4y2Ba我gydF4y2Ba无机磷酸盐。gydF4y2BahgydF4y2Ba从单个比目鱼肌呼吸,实时跟踪实验(gydF4y2BangydF4y2Ba每组)= 1鼠标显示实验协议测量基底,咖啡因能够刺激(CAF;3毫米)和CagydF4y2Ba2 +gydF4y2Ba独立(10μM丹曲洛林(丹))呼吸(乔gydF4y2Ba2 gydF4y2Ba)。gydF4y2Ba我gydF4y2Ba、钙gydF4y2Ba2 +gydF4y2Ba端依赖乔gydF4y2Ba2 gydF4y2Ba从扩展数据图(CAF-DAN)计算。gydF4y2Ba10 ogydF4y2Ba。数据均值±s.e.m。gydF4y2BangydF4y2Ba= 8老鼠每组。gydF4y2BaPgydF4y2Ba值计算使用双面未配对gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
检查是否这些改变基因表达的诱导功能肌肉代谢的变化,我们评估了脂肪酸氧化和发现,与体内的观察减少r一致,有强烈刺激脂肪酸氧化的倾向在孤立的比目鱼肌(+ 44%,gydF4y2BaPgydF4y2Ba= 0.0507;无花果。gydF4y2Ba4 egydF4y2Ba)。符合氧化表型越多,GDF15治疗改善原位电刺激收缩的趾长伸肌肌腱牵向前(EDL)肌肉与pair-fed控制(图。gydF4y2Ba4 fgydF4y2Ba)。这些影响是一个独立的纤维类型转换(扩展数据图。gydF4y2Ba10 e, fgydF4y2Ba)或其他明显的肌肉结构(扩展数据图的变化。gydF4y2Ba10克gydF4y2Ba),这表明GDF15可能促进氧化代谢。氧化骨骼肌线粒体呼吸的评估,通过测量ADP / O比率或泄漏呼吸在孤立的线粒体(扩展数据图。gydF4y2Ba10 h-kgydF4y2Ba)、呼吸控制比(RCR) permeabilized肌肉纤维(扩展数据图。gydF4y2Ba10 lgydF4y2Ba),发现GDF15并不直接影响线粒体耦合效率。然而,GDF15增加CagydF4y2Ba2 +gydF4y2Ba支持在permeabilized呼吸肌肉纤维相比,车辆控制(扩展数据图。gydF4y2Ba10 m, ngydF4y2Ba)。轻快但是,基于高频ADP反应在ADP滴定(补充图。gydF4y2Ba5gydF4y2Ba),ADP浓度在350µM Ca的存在gydF4y2Ba2 +gydF4y2Ba估计显示,GDF15治疗引起更大的Ca吗gydF4y2Ba2 +gydF4y2Ba派生的ADP相比,车辆和pair-fed控制(图。gydF4y2Ba4 ggydF4y2Ba和扩展数据图。gydF4y2Ba10 m, ngydF4y2Ba)。进一步检查的重要性钙徒劳的自行车驾驶肌肉耗氧量,我们评估呼吸比目鱼肌的肥胖老鼠的纳什饮食的热量限制和注射车辆(pair-fed)或GDF15 21天。肌肉呼吸评估基础,由于咖啡因(增加SERCA的活动和细胞内钙)和治疗后丹曲洛林(抑制阿诺定受体和释放从肌浆网的钙)。符合我们观察permeabilized纤维、慢性治疗GDF15没有显著增加基底呼吸(无花果。gydF4y2Ba4 h,我gydF4y2Ba)。正如所料,添加咖啡因刺激呼吸pair-fed控制;然而,在GDF15-treated老鼠,这种反应是提高了30%(图。gydF4y2Ba4 hgydF4y2Ba和扩展数据图。gydF4y2Ba10 ogydF4y2Ba)。重要的是,这呼吸增加被淘汰的丹曲洛林(无花果。gydF4y2Ba4 h,我gydF4y2Ba和扩展数据图。gydF4y2Ba10 ogydF4y2Ba),这表明GDF15增强骨骼肌能量消耗通过钙徒劳的自行车。gydF4y2Ba
在人类GDF15,肌肉生热作用和非酒精性脂肪肝gydF4y2Ba
上述研究表明GDF15维持能量消耗的一个重要作用引起通过热量限制。然而,我们的研究结果gydF4y2BaGfralgydF4y2Bako小鼠(无花果。gydF4y2Ba2 gydF4y2Ba)表明减少能量消耗和抑制β-adrenergic信号通路在骨骼肌(无花果。gydF4y2Ba3 gydF4y2Ba内生GDF15)也支持的生理作用。因此,我们检查了这些途径在三个不同的临床人群。首先,我们评估循环GDF15水平人口健康成人(gydF4y2BangydF4y2Ba= 154)的静息代谢率(RMR)使用通风罩系统评估gydF4y2Ba45gydF4y2Ba,我们发现有一个倾向之间的弱正相关GDF15和RMR(扩展数据图。gydF4y2Ba11个gydF4y2Ba),保持脂肪量校正后,无脂质量和年龄(扩展数据图。gydF4y2Ba11 bgydF4y2Ba正如我们前面描述的gydF4y2Ba46gydF4y2Ba。然而,鉴于RMR测量与稳定的体重和个人,通过设计,在缺乏运动,这一发现可能不是使我们的观察小鼠的差异与GDF15在黑暗中最大的周期和热量限制。因此我们分析了RNA-seq从人类骨骼肌样本数据(gydF4y2BangydF4y2Ba= 806)Genotype-Tissue表达式(GTEx)门户,符合我们的观察在老鼠中,参与者的肌肉更GDF15表达(25%)明显高于gydF4y2BaSLNgydF4y2Ba和其他PKA-regulated基因重要脂肪酸氧化与较低的表达GDF15(25%)(扩展数据图。gydF4y2Ba11 c, dgydF4y2Ba)。最后,尽管以前的观察性流行病学研究表明增加GDF15在人类与肝脏脂肪变性gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,这些研究没有混杂因素与非酒精性脂肪肝占已知增加GDF15,如肥胖和线粒体的压力。孟德尔随机化研究避免干扰,通常影响观察性流行病学研究的基础上通过随机分配组的等位基因从父母继承和关联这一遗传变异(即gydF4y2BaGDF15gydF4y2Ba单核苷酸多态性(SNPs))接触(血清蛋白质含量GDF15)。因此,检查潜在的转化我们的发现与非酒精性脂肪肝的相关性,我们进行了两个示例孟德尔随机化鼻中隔黏膜下切除术后(2)应用全基因组关联研究(GWAS)汇总的数据对肝脏脂肪含量和体积使用磁共振成像(MRI)扫描的英国生物库参与者(gydF4y2BangydF4y2Ba= 32859)。相比以前的流行病学研究gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,我们发现GDF15与肝脏脂肪含量负相关(扩展数据图。gydF4y2Ba11个e, fgydF4y2Ba),而不改变肝脏体积(扩展数据图。gydF4y2Ba11 ggydF4y2Ba)。这些数据表明,GDF15与增加SLN和减少非酒精性脂肪肝临床人群。gydF4y2Ba
讨论gydF4y2Ba
这里,进行仔细控制和扩展pair-feeding实验老鼠,我们已经确定了一个生物电路连接GDF15和GFRALβ-adrenergic受体和骨骼肌钙循环(扩展数据图。gydF4y2Ba12gydF4y2Ba)。这在GDF15-treated老鼠维持能量消耗,与热量限制pair-fed控制相比,与骨骼肌中去甲肾上腺素增加,脂肪酸氧化、耗氧量和钙徒劳的自行车。值得注意的是,这个拟表型小鼠overexpressing SLN也失去了更多的体重和肥胖,增加了能量消耗和肌肉脂肪酸氧化和减少肌肉疲劳而pair-fed控制gydF4y2Ba39gydF4y2Ba,gydF4y2Ba49gydF4y2Ba。增加SLN的表达式也观察到患者的骨骼肌GDF15水平高,但是没有在人类血清GDF15和RMR之间的显著联系。缺乏RMR和GDF15之间的联系可能会因为我们的观察的最小差异的耗氧量基底没有增加钙的自行车也被所示gydF4y2BaSlngydF4y2Ba转基因gydF4y2Ba39gydF4y2Ba和KO小鼠gydF4y2Ba49gydF4y2Ba。gydF4y2Ba
很难精确量化的具体贡献这个途径基础代谢率。据估计,骨骼肌贡献大约30%每日总能量消耗gydF4y2Ba49gydF4y2Ba和钙循环大约是50%的支出gydF4y2Ba32gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,也就是说,钙在肌肉中骑自行车大约15%有助于全身能量消耗。鉴于我们观察到GDF15 calcium-stimulated呼吸pair-fed控制老鼠相比,增加了30%左右,这将是一个能源expenditure-an总额增加约5%,相当于大约100千卡能量消耗减少观察与适度的热量限制和减肥gydF4y2Ba50gydF4y2Ba。虽然我们不能发现任何差异在脂肪组织产热,这也可能导致增加能量消耗。我们的研究结果表明,考虑到不同的行动GDF15在针对骨骼肌生热作用,这些发现可能解释观察增强减肥当incretin-based疗法相结合,从而抑制食欲gydF4y2Ba32gydF4y2Ba。未来的研究调查GDF15-GFRAL信号之间的联系,肌钙循环和能量消耗在人类之前和之后的减肥很重要,进一步建立这个途径的治疗潜力适应性生热作用。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
GfralgydF4y2Ba零老鼠产生如前所述gydF4y2Ba32gydF4y2Ba和繁殖对r·斯利提供的。生成的β-less小鼠b·洛厄尔如前所述gydF4y2Ba51gydF4y2Ba和繁殖提供了双j .吴。研究在老鼠身上进行了三个网站(路易斯塔里夫大学,麦克马斯特大学和诺和诺德公司)。所有的动物研究中使用被安置和关心依照当地的动物使用指南,和研究动物伦理研究董事会批准的麦克马斯特大学(AUP: 210104),路易斯塔里夫(2021 - 3001)和丹麦大学动物实验检查员(2020-15-0201-00756:C01)。所有的老鼠都是群居饲养与随意12 h-12 h光暗周期获得食物和水。所有的老鼠都雄性C57BL / 6 j背景。所有的老鼠被安置在安慰区加热印度河流域文明32-Cage(替代设计制造和供应)HEPA过滤通风和调温笼子里保持在21或29°C或在特定病原体自由microisolators在一个房间里保持在21或29°C。GDF15治疗之前,老鼠喂食高脂肪、高果糖饮食(纳什饮食:40千卡%脂肪(主要是棕榈油),20千卡%果糖和0.02%胆固醇)(研究饮食,D19101102;麦克马斯特和路易斯塔里夫大学实验执行)或西方饮食(研究饮食,D12079B;实验在诺和诺德公司)。慢性实验中使用的老鼠在麦克马斯特大学被放置在纳什的饮食和居住在热中性的条件下(12 ~ 29°C, h-12 h光暗周期)或环境温度(~ 21°C,相对湿度40 - 60%)在8周的年龄。 Mice at Novo Nordisk were placed on a housing condition (~29–30 °C, 12 h–12 h light–dark cycle) when treatment with GDF15. Before treatment, mice were randomized and separated into different treatment groups matched on body weight and composition, and single-housed. Recombinant GDF15 (Novo Nordisk, 0247-0000-0001; dissolved in synthetic buffer with 5 mM acetate, 240 mM propylene glycol and 0.007% polysorbate 20) was delivered by subcutaneous injection at the start of the light cycle in the morning (07:00–09:00) at 0.3, 1 and/or 5 nmol per kg once daily. The individual dosage was calculated by the body weight 1 day before. Pair-fed animals received the same amount of food as ingested by the corresponding GDF15-treated groups the day before. Body weight and food weight were recorded daily during the treatment period. Food intake was calculated by subtraction of the amount of food content in food hoppers from the amount added the previous day. Spillage and grind of food in cages was carefully monitored every day. Mice were euthanized in a fed state. Terminal blood was collected by cardiac puncture and blood from live animals was collected from a tail snip. Blood samples were centrifuged at 10,000 rpm for 10 min at 4 °C after clotting at room temperature for 30 min, and the supernatant was collected. Serum was saved and stored at −80 °C until use. Mice were anaesthetized using ketamine–xylazine (McMaster) or isoflurane (Novo Nordisk).
药代动力学分析gydF4y2Ba
老鼠放在纳什饮食和住房条件(29°C) 20周从8周的年龄。后一个皮下注射重组人类GDF15(0.3,每公斤1和/或5 nmol)在小鼠(gydF4y2BangydF4y2Ba每组)= 3,尾巴的血液是在0,0.5,1、2、4、8和24小时来衡量重组人类GDF15在使用人类的血清浓度GDF-15 DuoSet酶联免疫试剂盒(研发系统,DY957)gydF4y2Ba52gydF4y2Ba。gydF4y2Ba
身体成分测量gydF4y2Ba
身体成分(瘦肉和脂肪)分析了使用力量的Minispec整个身体成分分析仪(Minispec低频90 ii)基于TD-NMR或磁共振扫描器从EchoMRITM表示时间。gydF4y2Ba
测量温度的老鼠gydF4y2Ba
小鼠的体温测量通过使用一个数字温度计的直肠温度测试。老鼠的表面温度是衡量一个标准化的红外成像技术使用一个红外摄像机(T650sc,发射率0.98,FLiR系统)如前所述gydF4y2Ba53gydF4y2Ba。gydF4y2Ba
代谢活动gydF4y2Ba
代谢监测进行了使用综合实验动物监测系统(蛤,哥伦布在麦克马斯特仪器)或Promethion系统(貂系统国际,诺和诺德)。实验进行了驯化后系统12或24小时。食物摄入量、身体活动(梁断裂),耗氧量(签证官gydF4y2Ba2 gydF4y2Ba生产(VCO),二氧化碳gydF4y2Ba2 gydF4y2Ba),r和能量消耗数据收集每20分钟(蛤)或5分钟(Promethion)表示。脂肪酸氧化(mg / kg / h)是计算使用以下方程(1.70×签证官gydF4y2Ba2 gydF4y2Ba−1.69×VCOgydF4y2Ba2 gydF4y2Ba)。碳水化合物氧化(mg / kg / h)是计算使用以下方程(4.58×VCOgydF4y2Ba2 gydF4y2Ba−3.23×签证官gydF4y2Ba2 gydF4y2Ba)。gydF4y2Ba
GTT和ITT公司gydF4y2Ba
葡萄糖耐量测试(GTT)和胰岛素耐受性测试(ITT)进行安乐死,前3和2周。快速测试都执行后6 h。GTT,小鼠腹腔注射1.25克/公斤gydF4y2BadgydF4y2Ba葡萄糖。ITT公司,小鼠腹腔注射胰岛素的每公斤1.2 U (Novorapid)。对于所有的测试,血糖测量从血液一滴尾使用ACCU-CHEK英杰华手持glucometer(罗氏)0,20、40、60、90和120分钟后注入。曲线下的面积进行了分析使用GraphPad棱镜(v.9.3.0)。gydF4y2Ba
在血清和肝脏生化分析gydF4y2Ba
甘油三酸酯(开曼化学,10010303),non-esterified脂肪酸(NEFA)(和光诊断,富士胶片kouichi 999 - 34691, 995 - 34791, 991 - 34891, 993 - 35191)、胰岛素(晶体化学,90080),葡萄糖(和光诊断,富士胶片kouichi 997 - 03001)、去甲肾上腺素(Abbexa abx055012)和ALT(凝聚力生物科学,CAK1002)测量根据设备协议。gydF4y2Ba
组织学分析gydF4y2Ba
肝脏和iWAT收集和固定neutral-buffered 10%福尔马林36-48 h。固定后,样本沉浸在70%的酒精溶液。肝脏组织被处理,石蜡包埋,连续切片和染色组织学与麦克马斯特)的免疫学研究中心核心设施。图像被使用尼康90我Eclipse正直的显微镜。瞎了肝脏半定量的组织学分数分配给肝脏部分由一个病理学家。肝细胞气球样变性(0 - 2),脂肪变性评分(0 - 3)和炎症评分(0 - 3)评估根据圆)染色肝部分如前所述gydF4y2Ba54gydF4y2Ba。非酒精性脂肪肝活动评分(主)被定义为这三个分数的总和。定量评估iWAT脂肪细胞的大小和数目进行了使用图像J如前所述gydF4y2Ba55gydF4y2Ba。gydF4y2Ba
单细胞的准备和流式细胞术分析gydF4y2Ba
制备的肝细胞,叶肝脏的肝灌注后收集与PBS和消化的酶解含有0.5毫克毫升的缓冲区gydF4y2Ba−1gydF4y2Ba链霉蛋白酶E, 0.088 U mlgydF4y2Ba−1gydF4y2Ba胶原酶D和1% (v / v) DNase我30分钟37°C。肝non-parenchymal单细胞悬浮细胞制备如前所述gydF4y2Ba56gydF4y2Ba,一个小修改。总之,消化后,细胞被过滤100μM细胞过滤器。后两个离心步骤的1分钟50gydF4y2BaggydF4y2Ba去除肝细胞,其余细胞悬浮进一步透过一个40μM细胞过滤器。non-parenchymal单一细胞在1500转离心5分钟前在4°C程序阻塞/抗体染色流式细胞术。流式细胞术分析细胞被封锁,抗体对Fc受体(Fc块(1∶BD生物科学,553142))和彩色30分钟与抗体冰鸡尾酒:CD45.2 BV510 (1:25, BioLegend, 109838), CD11b APC-Cy7(1:10 0,表达载体,A15390) F4/80-APC(1:10 0,英杰公司,17-4801-82),CD3 BV605 (1:50, BD生物科学,563004),CD4 PerCP-Cy5.5 (1:10 0, BD生物科学,550954)。7法(1:10 0,热费希尔科学A1310)被用作细胞生存能力标志。染色后,细胞分析与CytoFlex流式细胞分析仪(贝克曼库尔特生命科学)。数据分析使用FlowJo (v.10.5)。gydF4y2Ba
RNA隔离,互补脱氧核糖核酸合成和qPCRgydF4y2Ba
组织在试剂盒均质和细胞溶解试剂。使离心后,上清液(水相)是应用于RNeasy工具包(试剂盒,74106)随后的总RNA提取和纯化根据其协议。互补脱氧核糖核酸的合成进行了使用上标IV逆转录酶工具包(表达载体,18090010)根据制造商的指示。cDNA表达特定基因的检测是由定量PCR (qPCR)使用AmpliTaq黄金DNA聚合酶工具包(应用生物系统公司,N8080241)。从热费希尔科学Taqman引物被购买。使用Δ相对mRNA水平量化gydF4y2BaCgydF4y2BatgydF4y2Ba方法,使用鼠标gydF4y2BaActbgydF4y2Ba(Mm02619580_g1)作为内生控制。Gene-specific引物如下:gydF4y2BaUcp1gydF4y2Ba(Mm01244861_m1),gydF4y2BaPparagydF4y2Ba(Mm00440939_m1),gydF4y2BaUcp3gydF4y2Ba(Mm01163394_m1),gydF4y2BaPpargc1agydF4y2Ba(Mm01208835_m1),gydF4y2BaAtp2a1gydF4y2Ba(Mm01275320_m1),gydF4y2BaAtp2a2gydF4y2Ba(Mm01201431_m1),gydF4y2BaSlngydF4y2Ba(Mm00481536_m1),gydF4y2BaPlngydF4y2Ba(Mm04206541_m1),gydF4y2BaCkbgydF4y2Ba(Mm00834780_g1),gydF4y2BaRyr2gydF4y2Ba(Mm00465877_m1),gydF4y2BaGpd2gydF4y2Ba(Mm00439082_m1),gydF4y2BaPpardgydF4y2Ba(Mm00803184_m1),gydF4y2BaCox8bgydF4y2Ba(Mm00432648_m1)和gydF4y2BaCideagydF4y2Ba(Mm00432554_m1)。gydF4y2Ba
RNA-seq和转录组分析gydF4y2Ba
肝脏和收集和胫骨前肌snap-frozen在液氮存储在−80°C。冰冻的肝组织或(30 - 50毫克样品)胫骨前肌在试剂盒试剂均质和细胞溶解。使离心后,上清液(水相)是应用于RNeasy工具包(试剂盒,74106)随后的总RNA提取和纯化根据制造商的协议。所有的RNA样品通过了生物分析仪的质量控制测试。RNA-seq执行使用Illumina公司NextSeq 2000 (P2流细胞,2×50个基点配置)系统。MultiQC用于质量控制从RNA-seq原始数据gydF4y2Ba57gydF4y2Ba。削减大量的用于自动化质量和适配器修剪以及质量控制。我们使用RNA-seq数据量化的表达记录通过鲑鱼gydF4y2Ba58gydF4y2Ba。鲑鱼的转录水平量化DESeq2被用来探测度gydF4y2Ba59gydF4y2Ba使用以下阈值:肝脏样本,|日志gydF4y2Ba2 gydF4y2Ba(褶皱变化)| > 1,调整gydF4y2BaPgydF4y2Ba< 0.05;对样品:胫骨前肌|日志gydF4y2Ba2 gydF4y2Ba(褶皱变化)| > 0.6,调整gydF4y2BaPgydF4y2Ba< 0.1。主成分分析是通过DESeq2使用威仕特执行数据。功能富集分析是由浓缩去分析gydF4y2Ba60gydF4y2Ba和京都基因和基因组的百科全书(KEGG)映射gydF4y2Ba61年gydF4y2Ba使用GOstats (gydF4y2Bahttps://bioconductor.orggydF4y2Ba)和KEGG。db (gydF4y2Bahttps://bioconductor.orggydF4y2Ba分别)包。结果示gene-concept网络图使用cnetplot包(gydF4y2Bahttps://bioconductor.orggydF4y2Ba)。转录组分析使用Linux系统,R和RStudio软件。RNA-seq老鼠接受β股四头肌样本的数据gydF4y2Ba2 gydF4y2Ba受体激动剂氨哮素从NCBI下载顺序读取存档参考号码gydF4y2BaPRJNA756816gydF4y2Ba(ref。gydF4y2Ba44gydF4y2Ba)。我们使用RNA-seq数据量化的表达记录通过鲑鱼gydF4y2Ba58gydF4y2Ba。gydF4y2BaSlngydF4y2Ba表达式的股四头肌决心使用威仕特数据。gydF4y2Ba
磁共振成像gydF4y2Ba
雄性C57Bl / 6 j小鼠被放置在纳什的饮食和热中性的住房条件(29°C) 4周从7周的年龄。使用随机交叉设计(gydF4y2BangydF4y2Ba= 13),小鼠禁食7 h,然后收到一个车辆或皮下注射GDF15(每公斤5 nmol), 4 h之前连续动态宠物收购(gydF4y2Ba11 gydF4y2Ba醋酸C]和[gydF4y2Ba11 gydF4y2Ba棕榈酸酯。实验课程然后重复7天后。宠物进行与雪崩photodiode-based小动物LabPET8扫描仪路易斯塔里夫分子成像中心(中心de矫揉造作的du楚,大学路易斯塔里夫)。首先在老鼠的麻醉(2%异氟烷在1.5 L分钟gydF4y2Ba−1gydF4y2Ba的氧气)然后用10兆贝可静脉注射丸的gydF4y2Ba11 gydF4y2BaC)醋酸(100µl最终体积的生理盐水)通过尾静脉,后跟一个15分钟列表模式宠物收购。然后,10丸兆贝可(gydF4y2Ba11 gydF4y2BaC]棕榈酸酯(100µl最终体积的生理盐水)注射,和一个15分钟列表模式宠物收购了。剩余(gydF4y2Ba11 gydF4y2BaC)醋酸活动(gydF4y2Ba11 gydF4y2BaC)收购棕榈酸酯是通过收购一个60年代框架纠正之前的注入gydF4y2Ba11 gydF4y2BaC]棕榈酸酯,占的蜕变速度gydF4y2Ba11 gydF4y2BaC)。最后,低剂量CT图像从综合x o小动物获得的CT扫描仪平台上的胜利。gydF4y2Ba
对于[gydF4y2Ba11 gydF4y2Ba醋酸C)扫描,图像重建成26动态帧(12×10、8×30和6×90年代),而(gydF4y2Ba11 gydF4y2BaC]棕榈酸酯扫描重建到29日动态帧(1×60,12×5、6×10 6×30和4×150年代)使用一个三维的最大似然估计方法和20个迭代,跨越63年,视野80毫米与最后一个矩阵的分辨率为160×160×128和体素的大小为0.5×0.5×0.597毫米。为(gydF4y2Ba11 gydF4y2BaC)醋酸、输入曲线提取如前所述gydF4y2Ba62年gydF4y2Ba。总之,使用酰胺(v.1.0.4) image-derived输入函数(IDIF)是通过手动定位感兴趣的区域(ROI)腔静脉,上面下面的肾脏和心肌血池。(gydF4y2Ba11 gydF4y2Ba为[C]醋酸IDIF当时纠正gydF4y2Ba11 gydF4y2BaC]标签代谢物gydF4y2Ba63年gydF4y2Ba。组织roi被吸引对肝脏、肾脏、心肌,白色脂肪组织,iBAT,股四头肌和腓肠肌肌肉。从合成时间获得定量数据曲线,并用来评估组织血流指数(的吸收速率的基础上gydF4y2Ba11 gydF4y2BaC)醋酸,gydF4y2BakgydF4y2Ba1gydF4y2Ba在g毫升gydF4y2Ba−1gydF4y2Ba最小值gydF4y2Ba−1gydF4y2Ba),氧化代谢指数(快速分级组织间隙,gydF4y2BakgydF4y2Ba2 gydF4y2Ba在最小值gydF4y2Ba−1gydF4y2Ba,(gydF4y2Ba11 gydF4y2BaC]乙酸)和non-oxidative处理(捕获gydF4y2Ba11 gydF4y2BaC在组织免费gydF4y2Ba11 gydF4y2BaC)醋酸或其他代谢物,如脂质,gydF4y2BakgydF4y2Ba3 gydF4y2Ba在最小值gydF4y2Ba−1gydF4y2Ba)使用一个标准的两舱制、two-tissue动力学模型gydF4y2Ba63年gydF4y2Ba。对于蝙蝠,一个四室、two-tissue动力学模型应用,如前所述gydF4y2Ba64年gydF4y2Ba,gydF4y2Ba65年gydF4y2Ba。为(gydF4y2Ba11 gydF4y2BaC]棕榈酸酯,IDIFs得到描述为gydF4y2Ba11 gydF4y2BaC)醋酸和roi是画在肝脏、心肌、肾脏和iBAT。脂肪酸氧化、酯化和吸收,使用three-compartment甘油三酯释放率计算,two-tissue动力学模型gydF4y2Ba66年gydF4y2Ba,gydF4y2Ba67年gydF4y2Ba。gydF4y2Ba
细胞培养的肌管gydF4y2Ba
C2C12细胞线从写明ATCC购买并验证通过在写明ATCC短串联重复序列分析和测试为阴性支原体污染。C2C12细胞保持在杜尔贝科修改鹰介质(DMEM)含10%胎牛血清在37°C公司5%gydF4y2Ba2 gydF4y2Ba。达到融合后,分化细胞在DMEM补充肌管2%马血清5 - 7天。肌管治疗与车辆,GDF15 (10 nM)和去甲肾上腺素(10μM) 15 h。肌管收集和RNA隔离,互补脱氧核糖核酸合成和qPCR进行如上所述。gydF4y2Ba
体外测定脂肪酸氧化的比目鱼肌gydF4y2Ba
比目鱼肌的肌肉被仔细解剖肌腱腱对肌肉的孵化项目如前所述gydF4y2Ba68年gydF4y2Ba,gydF4y2Ba69年gydF4y2Ba。脂肪酸代谢实验使用先前描述的过程gydF4y2Ba68年gydF4y2Ba,gydF4y2Ba69年gydF4y2Ba。总之,孤立的比目鱼肌的肌肉被放置在加热(30°C) Krebs-Henseleit缓冲pH值7.4包含2毫米丙酮酸,fatty-acid-free 4%牛血清白蛋白和0.5毫米棕榈酸。在最初孵化15 - 30分钟的玻璃小瓶,孵化缓冲区被Krebs-Henseleit取代缓冲区补充0.5μCi毫升gydF4y2Ba−1gydF4y2Ba(gydF4y2Ba14gydF4y2BaC]棕榈酸酯(PerkinElmer NEC534250UC) 60分钟450瓶包含μl苄索氢氧化铵。肌肉被移除的追逐和冲洗和冷冻在液态氮,供以后使用。总共1毫升的醋酸当时仔细添加到玻璃小瓶,立即密封。解放的醋酸有限公司gydF4y2Ba2 gydF4y2Ba通过三羧酸循环产生的脂肪酸氧化。玻璃小瓶被放置在75 rpm瓶1 h允许苄索氢氧化铵陷阱释放有限公司gydF4y2Ba2 gydF4y2Ba。内部埃普多夫管含苄索氢氧化铵小心地放入一个塑料闪烁瓶含有5毫升的液体闪烁和允许淬火在黑暗中过夜。一半的比目鱼肌均质在1.5毫升氯仿:甲醇(2:1)的解决方案。然后,2.0毫升的蒸馏HgydF4y2Ba2 gydF4y2BaO是添加到上层的分数在新管,轻轻地漩涡。然后将水相转移到塑料闪烁瓶包含5毫升的液体闪烁。dpm测量由闪烁计数器(贝克曼库尔特,LS 6500多功能闪烁计数器)。数据被表示为空闲的和有限公司gydF4y2Ba2 gydF4y2Ba和酸溶性中间体和标准化组织的重量。gydF4y2Ba
化学去神经iBATgydF4y2Ba
去神经的iBAT通过局部注射6 ohda(10毫克毫升gydF4y2Ba−1gydF4y2Ba)在盐水含1%抗坏血酸为五个不同的地方在iBAT垫(5μl每点)gydF4y2Ba70年gydF4y2Ba。老鼠被允许恢复48 h。蝙蝠去神经的确认,我们治疗小鼠βgydF4y2Ba3 gydF4y2Ba受体激动剂cl - 316243和蝙蝠温度测量使用一个标准化的红外成像技术使用一个红外摄像机(T650sc,发射率0.98,FLiR系统)gydF4y2Ba53gydF4y2Ba在蛤和能量消耗gydF4y2Ba37gydF4y2Ba,gydF4y2Ba71年gydF4y2Ba,gydF4y2Ba72年gydF4y2Ba。gydF4y2Ba
肌肉功能测试gydF4y2Ba
肌肉功能测试进行体外使用的水平浴whole-mouse测试系统(1300年,极光科学)。林格氏溶液(4.7毫米120毫米氯化钠,氯化钾,2.5毫米CaClgydF4y2Ba2 gydF4y2Ba,1.2毫米KHgydF4y2Ba2 gydF4y2Ba警察丁,1.2毫米MgSOgydF4y2Ba4 gydF4y2Ba,消息灵通的25毫米,5.5毫米葡萄糖)在水平浴都洋溢着氧气在实验开始前30分钟。简而言之,对肌肉功能测试、反伊斯兰教英国防御联盟肌肉是孤立的,使用编织丝近端和远端肌肉肌腱连接,固定在固定杠杆臂钩和测力传感器(型号809 c,极光科学)在水平浴。在这个位置,反伊斯兰教英国防御联盟肌肉是两个刺激之间对齐的平行电极。反伊斯兰教英国防御联盟肌肉刺激之前被允许休息10分钟。确定最优肌肉长度、反伊斯兰教英国防御联盟肌肉在不同刺激紧张的休息,直到最大抽搐紧张的决心gydF4y2Ba73年gydF4y2Ba。反伊斯兰教英国防御联盟这种优化后肌肉休息2分钟。force-frequency曲线是用来确定峰值强直的力量。这个力测定由1刺激每30年代初10赫兹和增加刺激频率10赫兹的增量。所有的数据收集和分析使用动态肌肉控制和分析软件(v。615年,极光科学)。gydF4y2Ba
免疫组织化学染色的老鼠的肌肉gydF4y2Ba
)染色法对冷冻腓肠肌肌肉部分使用标准协议。在每个腓肠肌,整个肌肉横截面是可视化和成像评估整个横截面。肌纤维类型如前所述gydF4y2Ba74年gydF4y2Ba。免疫荧光可视化使用尼康Eclipse 90我显微镜(尼康)和分析使用NIS-Elements AR软件(尼康,v.5.41.02)。确定fibre-type百分比,总共有4000纤维(IIb类型我、活动花絮和IIx)每腓肠肌截面被数(gydF4y2BangydF4y2Ba每组)= 4gydF4y2Ba75年gydF4y2Ba。gydF4y2Ba
从红骨骼肌线粒体呼吸在孤立gydF4y2Ba
骨骼肌线粒体分离使用温度控制(4°C)差速离心如前所述gydF4y2Ba76年gydF4y2Ba。总之,后肢骨骼肌(红色红腓肠肌、跖肌、胫骨前,比目鱼肌和股四头肌的红色部分)被切除,减少可见脂肪和结缔组织,称重和切碎的孤立的缓冲区(蔗糖100毫米,100毫米氯化钾,50 mM Tris-HCl, KH 1毫米gydF4y2Ba2 gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba、0.1毫米EGTA 0.2% BSA和1毫米ATP, pH值7.4)。剁碎组织是均质和离心机在800年gydF4y2BaggydF4y2Ba10分钟分离subsarcolemmal和intermyofibrillar线粒体分数。线粒体颗粒包含intermyofibrillar resuspended,对待一个蛋白酶枯草杆菌蛋白酶(0.025克每毫克湿组织)5分钟和冰冷的隔离缓冲随后添加蛋白酶。样本立即离心机在5000gydF4y2BaggydF4y2Ba5分钟和颗粒在800年resuspended和离心机gydF4y2BaggydF4y2Ba10分钟解放intermyofibrillar线粒体的上层清液。Subsarcolemmal intermyofibrillar线粒体和进一步离心10分钟10000克、resuspended,结合离心之前在10000年的两倍gydF4y2BaggydF4y2Ba10分钟恢复最后的线粒体颗粒。这些颗粒是resuspended毫克gydF4y2Ba2 +gydF4y2Ba缺席MiR05(0.5毫米EGTA 60 mM lactobionate钾,KH 10毫米gydF4y2Ba2 gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba,消息灵通的20毫米,110毫米蔗糖,1 g lgydF4y2Ba−1gydF4y2Ba脂肪酸自由BSA, pH值7.2)和保存在冰,直到呼吸实验。gydF4y2Ba
呼吸试验中执行Oroboros Oxygraph-2k与恒定搅拌系统在37°C。总共20µg线粒体蛋白质是加载/ 2毫升室(由布拉德福德蛋白质分析量化)。ADP / O比率计算使用氧含量的变化(nmol)后的ADP(分别在50µM (100 nmol)丸,耗尽时,100年µM (200 nmol)丸)在5毫米丙酮酸和苹果酸2毫米。最大呼吸评估后续增加5毫米ADP, 10毫米谷氨酸(最大复杂我支持呼吸)和琥珀酸10毫米(最大呼吸支持的复杂II)。软被量化为状态3的比值(饱和ADP)状态4(丙酮酸和苹果酸,缺乏ADP)呼吸。在另一项实验中,0.5µM寡霉素最初添加到室和呼吸确定饱和混合基质的存在(丙酮酸、苹果酸、ADP、谷氨酸和琥珀酸)。gydF4y2Ba
线粒体纯度被西方墨点法检查如前所述gydF4y2Ba77年gydF4y2Ba。总之,线粒体样本添加1毫升60%之上Percoll(1.336毫升5×SMEA, 4毫升Percoll, 1.334毫升蒸馏HgydF4y2Ba2 gydF4y2BaO;密度1.08 - -1.12 g毫升gydF4y2Ba−1gydF4y2Ba)。样本离心机,享年20000岁gydF4y2BaggydF4y2Ba5 h在4°C。纯化的线粒体层被悬浮在1毫升隔离缓冲和离心机,享年12000岁gydF4y2BaggydF4y2Ba在4°C为10分钟去除剩余Percoll。最后的颗粒是resuspended在隔离缓冲储存在−80°C到样本准备西方墨点法。主要包括抗体COXI (1:50 0, OXPHOS鸡尾酒,Abcam Ab110413), COXIV(1:30,000,表达载体,A21347), GLUT4 (1:2,500, Abcam Ab654) calnexin(下,Sigma-Aldrich C4731)和SERCA2 (1:1,000, Abcam ab2861)。gydF4y2Ba
呼吸在permeabilized从红骨骼肌肌肉纤维gydF4y2Ba
Permeabilized肌肉纤维是准备从红色腓肠肌肌肉如前所述gydF4y2Ba78年gydF4y2Ba,gydF4y2Ba79年gydF4y2Ba。总之,肌肉被放在冰冷的BIOPS (MES 50毫米,7.23毫米KgydF4y2Ba2 gydF4y2BaCaK EGTA, 2.77毫米gydF4y2Ba2 gydF4y2Ba咪唑EGTA 20毫米,0.5毫米二硫苏糖醇,20毫米牛磺酸、5.77毫米ATP, MgCl PCr 15毫米和6.56毫米gydF4y2Ba2 gydF4y2Ba·HgydF4y2Ba2 gydF4y2BaO, pH值7.1)和纤维束分离fine-tipped钳在显微镜下面(MX6立体镜,蔡司微系统)。纤维在40µg毫升孵化gydF4y2Ba−1gydF4y2Ba皂素30分钟和洗MiR05呼吸缓冲区(呼吸实验)15分钟。线粒体呼吸实验在MiR05呼吸缓冲Oxygraph高分辨率呼吸器在37°C (Oroboros仪器)常数旋转750 rpm。实验在室温空气饱和与复氧后的每个基质(~ 180 - 195µM OgydF4y2Ba2 gydF4y2Ba)。所有实验进行的5µM blebbistatin, 5毫米丙酮酸和苹果酸1毫米。轻快的高频ADP实验,ADP是滴定在不同浓度(25,100,250,500,1000,2000,4000,6000,8000,10000µM ADP)其次是10毫米的谷氨酸,10毫米琥珀酸和10µM细胞色素gydF4y2BacgydF4y2Ba。软计算除以最大状态3呼吸(ADP)的存在状态4呼吸(丙酮酸+苹果酸,缺乏ADP)。CagydF4y2Ba2 +gydF4y2Ba实验进行的5毫米ATP CaCl滴定前gydF4y2Ba2 gydF4y2Ba(25、50、100、200、250、300、350年µM CaClgydF4y2Ba2 gydF4y2Ba)最近报道gydF4y2Ba80年gydF4y2Ba。达到平台期后,40µM会计师加入抑制SERCA的活动。在CagydF4y2Ba2 +gydF4y2Ba滴定,SERCA的ATP水解,生成ADP刺激呼吸。因此我们使用单阶段协会从ADP滴定曲线估计ADP生成在CagydF4y2Ba2 +gydF4y2Ba滴定SERCA的索引效率。ADP滴定的回归方程如下:汽车:乔gydF4y2Ba2 gydF4y2Ba= 127 + (598−127)×(1−exp (−0.0005292×(ADP))), GDF15:乔gydF4y2Ba2 gydF4y2Ba= 128 + (463−128)×(1−exp (−0.0006502×(ADP))), pair-fed:乔gydF4y2Ba2 gydF4y2Ba= 119 + (590−119)×(1−exp (−0.0005858×(ADP)))。纤维束中恢复了所有的实验中,干体重和体重正常呼吸组织(pmol年代gydF4y2Ba−1gydF4y2Ba毫克gydF4y2Ba−1gydF4y2Ba干重)。gydF4y2Ba
呼吸在孤立的比目鱼肌的肌肉gydF4y2Ba
从老鼠呼吸实验孤立的比目鱼肌肌肉表现如前所述gydF4y2Ba81年gydF4y2Ba与一些细微的修改。比目鱼肌的肌肉与肥胖老鼠的纳什饮食超过13周的热量限制和注射车辆(pair-fed)或GDF15 21天。总之,比目鱼肌肌肉切除和放置在一个密封的小瓶包含2毫升pre-gassed(95%啊gydF4y2Ba2 gydF4y2Ba,5%的公司gydF4y2Ba2 gydF4y2Ba)修改克雷布斯的铃声(MKR)缓冲区在30°C(2.6毫米115毫米氯化钠,氯化钾,1.2毫米KHgydF4y2Ba2 gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba10毫米NaHCOgydF4y2Ba3 gydF4y2Ba10毫米玫瑰)补充4% BSA、0.5毫米棕榈酸酯和10毫米gydF4y2BadgydF4y2Ba葡萄糖1 h。1 h预培养后,比目鱼肌的肌肉都被转移到呼吸运动计量法系统(Oroboros O2k)包含hyper-oxygenated(开始[OgydF4y2Ba2 gydF4y2Ba)~ 500μM)补充MKR缓冲与恒定搅拌30°C。耗氧速率(乔gydF4y2Ba2 gydF4y2Ba基线的奇遇记》)立志20分钟之前的3毫米咖啡因(Sigma-Aldrich C0750)刺激钙泄漏,提高ATP水解。caffeine-mediated呼吸10分钟后,丹曲洛林(Sigma-Aldrich D9175 10μM在DMSO)添加到室评估抑制钙的影响gydF4y2Ba2 +gydF4y2Ba释放。比目鱼肌的肌肉恢复,减少剩余肌腱/结缔组织,涂抹干燥,重归一化的呼吸肌肉重量弄湿。所有实验测定一式两份(成对的比目鱼肌的肌肉)和技术复制平均每个乔gydF4y2Ba2 gydF4y2Ba的决心。gydF4y2Ba
生物信息学GTEx数据集的分析gydF4y2Ba
我们已经进入GTEx分析V8。本文中描述的数据用于分析得到从dbGaP加入号码gydF4y2Baphs000424.v8.p2gydF4y2Ba2022年5月11日。研究生理水平的GDF15对骨骼肌的影响在人类中,我们评估了原始RNA-seq基因计数数据来自803人的肌肉。我们比较了通过建立两组肌肉基因表达的基础上GDF15骨骼肌中的表达水平使用R和RStudio软件。gydF4y2Ba
相关分析GDF15和TSH的人类gydF4y2Ba
收集血液样本后一夜快速肥胖女性(gydF4y2BangydF4y2Ba= 22)gydF4y2Ba31日gydF4y2Ba。TSH测量由渥太华医院实验室服务。GDF15水平进行分析使用人类GDF-15 Quantikine按照制造商的指示酶联免疫试剂盒(研发系统,DGD150)。gydF4y2Ba
相关研究GDF15和RMR人类gydF4y2Ba
154名参与者的RMR测量使用通风罩gydF4y2Ba45gydF4y2Ba(JAEGER Oxycon Pro, Viasys医保)。测量了一夜后快速喂饲到10点之间。罩是放在伏卧的科目。测量持续了40分钟,当参与者被要求保持期间仍然保持清醒。平均每10分钟的值被计算和最小值作为参与者的RMR。RMR对身体成分的基础上调整TANITA数据使用我们发表的自然对数方程(Ln)gydF4y2Ba蜜蜂(基底支出)gydF4y2Ba=−0.954 + 0.707 LngydF4y2BaFFM(不含脂肪的质量)gydF4y2Ba+ 0.019 LngydF4y2Ba调频(脂肪)gydF4y2Ba(ref。gydF4y2Ba46gydF4y2Ba)。GDF15在人血浆水平测试通过使用人类GDF-15 DuoSet酶联免疫试剂盒(研发系统,DY957)gydF4y2Ba52gydF4y2Ba。GDF15水平校正年龄和体重的多元线性回归使用R。gydF4y2Ba
鼻中隔黏膜下切除术后2使用GWAS汇总数据gydF4y2Ba
鼻中隔黏膜下切除术后2使用曝光和执行结果从两个重叠和独立的数据集进行汇总的接触分析和instrument-outcome协会分析工具。鼻中隔黏膜下切除术后2都使用了TwoSampleMR R包(v0.5.6)gydF4y2Ba82年gydF4y2Ba。验证的因果效应GDF15在人类肝脏脂肪,鼻中隔黏膜下切除术后我们执行2使用曝光数据集(GDF15, GWAS ID: ebi-a-GCST90011998,样本大小:21758)gydF4y2Ba83年gydF4y2Ba,gydF4y2Ba84年gydF4y2Ba和结果的数据集(肝脂肪比例,GWAS ID: ebi-a-GCST90016673,样本大小:32858)gydF4y2Ba85年gydF4y2Ba,gydF4y2Ba86年gydF4y2Ba。检查GDF15在人类肝脏体积的影响,我们进行了鼻中隔黏膜下切除术后2使用曝光数据集(GDF15, GWAS ID: ebi-a-GCST90011998,样本大小:21758)和结果数据集(肝脏体积,GWAS ID: ebi-a-GCST90016666,样本大小:32858)gydF4y2Ba85年gydF4y2Ba,gydF4y2Ba86年gydF4y2Ba。我们确定了基因变异(snp)蛋白质含量与血液GDF15在GWAS目录数据集的基础上gydF4y2Ba独联体gydF4y2Ba-pQTL(在500 kbgydF4y2BaGdf15gydF4y2Ba基因),进一步选择代理单核苷酸多态性连锁不平衡(LD)凝结(p1 = 5 e-08,丛= TRUE, p2 = 1 e-07, r2 = 0.001 kb = 10000)。删除重复的exposure-outcome总结集后,我们进一步做了敏感性分析,包括异质性统计,水平基因多效性和分析分析。后确认没有异质性或水平基因多效性,我们接下来先生进行分析和可视化结果使用散点图和森林情节功能TwoSampleMR R包中。我们使用斯泰格尔方向测试gydF4y2Ba87年gydF4y2Ba评估之间的因果方向GDF15在人类和肝脏脂肪。方差倒数加权的方法被用来评估的意义的因果影响接触的结果。使用R和RStudio鼻中隔黏膜下切除术后2执行。gydF4y2Ba
统计数据gydF4y2Ba
统计分析使用GraphPad棱镜(v.8.4.1 v.9.3.0)或R (v.4.2.3) RStudio软件(v.1.3.1056)。所有值都报道说±s.e.m。除非另有规定。数据分析使用单向或双向方差分析与图基,Dunnett或Šidak因果测试在适当的地方。差异被认为是重要的时候gydF4y2BaPgydF4y2Ba< 0.05。统计学意义的组织学评分评估使用未配对Mann-Whitney非参数测试。ANCOVA被用来纠正协变量的变异性的影响(例如,体重)主要变量(例如,治疗)。ANCOVA执行和可视化使用HH包(v.3.1-47)gydF4y2Ba88年gydF4y2Ba在R和RStudio软件检查后回归斜坡上的同质性。相关分析是使用皮尔逊积差相关。gydF4y2Ba
报告总结gydF4y2Ba
进一步研究信息设计是可用的gydF4y2Ba自然投资组合报告总结gydF4y2Ba与这篇文章有关。gydF4y2Ba
数据可用性gydF4y2Ba
所有数据支持本研究的发现及其中可用的文章gydF4y2Ba补充信息gydF4y2Ba。肝脏组织的RNA-seq数据和已经沉积在NCBI胫骨前肌基因表达综合(GEO)和可加入数字gydF4y2BaGSE229708gydF4y2Ba(肝组织)和gydF4y2BaGSE229794gydF4y2Ba()胫骨前肌或SuperSeriesgydF4y2BaGSE230208gydF4y2Ba。RNA-seq小鼠股四头肌样本数据处理β-2受体激动剂氨哮素从NCBI下载顺序读取存档参考号码gydF4y2BaPRJNA756816gydF4y2Ba。GTEx分析V8的数据用于分析本文中描述了从dbGaP加入号码gydF4y2Baphs000424.v8.p2gydF4y2Ba2022年5月11日(gydF4y2Bahttps://www.gtexportal.org/home/gydF4y2Ba)。凝胶提供了源数据补充图。gydF4y2Ba4 gydF4y2Ba。gydF4y2Ba源数据gydF4y2Ba本文提供的。gydF4y2Ba
代码的可用性gydF4y2Ba
为RNA-seq开发的代码分析、生物信息学分析GTEx数据集和鼻中隔黏膜下切除术后2免费Zenodo (gydF4y2Bahttps://doi.org/10.5281/zenodo.7838970gydF4y2Ba)。gydF4y2Ba
引用gydF4y2Ba
彼得森,k . f . et al .逆转非酒精性肝脂肪变性,肝胰岛素抵抗,适度减肥和高血糖的2型糖尿病患者。gydF4y2Ba糖尿病gydF4y2Ba54gydF4y2Ba,603 - 608 (2005)。gydF4y2Ba
加拿大,一个。,Royer, M. M., Chaput, J. P. & Doucet, E. Adaptive thermogenesis can make a difference in the ability of obese individuals to lose body weight.Int。j . ob。gydF4y2Ba37gydF4y2Ba,759 - 764 (2013)。gydF4y2Ba
Johannsen d l . et al .代谢减慢,大量无脂减肥尽管保存质量。gydF4y2Baj .中国。性。金属底座。gydF4y2Ba97年gydF4y2Ba,2489 - 2496 (2012)。gydF4y2Ba
杨,l . et al . GFRAL GDF15受体和配体的抗肥胖效果需要。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba,1158 - 1166 (2017)。gydF4y2Ba
埃莫森,p . j . et al . GDF15在介导的代谢影响的孤儿受体GFRAL。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba,1215 - 1219 (2017)。gydF4y2Ba
Mullican, s e . et al . GFRAL GDF15的受体和配体在小鼠和非人灵长类动物促进减肥。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba,1150 - 1157 (2017)。gydF4y2Ba
许,j . y . et al . Non-homeostatic体重调节通过GDF15 brainstem-restricted受体。gydF4y2Ba自然gydF4y2Ba550年gydF4y2Ba,255 - 259 (2017)。gydF4y2Ba
王,d . et al . GDF15:新兴生物学和治疗肥胖和代谢疾病疾病的应用。gydF4y2BaNat,启性。gydF4y2Ba17gydF4y2Ba,592 - 607 (2021)。gydF4y2Ba
布莱特,s . N。,Brown, D. A. & Tsai, V. W. The GDF15-GFRAL pathway in health and metabolic disease: friend or foe?为基础。启杂志。gydF4y2Ba83年gydF4y2Ba,127 - 151 (2021)。gydF4y2Ba
Keipert, s & Ost, m .应激FGF21 GDF15在肥胖和肥胖抵抗。gydF4y2Ba性趋势。金属底座。gydF4y2Ba32gydF4y2Ba,904 - 915 (2021)。gydF4y2Ba
约翰·K。,Kleinert, M. & Klaus, S. The role of GDF15 as a myomitokine.细胞gydF4y2Ba10克ydF4y2Ba2990 (2021)。gydF4y2Ba
洛克哈特,s M。,Saudek, V. & O’Rahilly, S. GDF15: a hormone conveying somatic distress to the brain.Endocr。牧师。gydF4y2Ba41gydF4y2Babnaa007 (2020)。gydF4y2Ba
Bootcov, m . r . et al . MIC-1小说巨噬细胞抑制性细胞因子,是一种发散TGF-β家族的成员。gydF4y2BaProc。《科学。美国gydF4y2Ba94年gydF4y2Ba,11514 - 11519 (1997)。gydF4y2Ba
Kannan, K。,一个mariglio, N., Rechavi, G. & Givol, D. Profile of gene expression regulated by induced p53: connection to the TGF-beta family.2月。gydF4y2Ba470年gydF4y2Ba,77 - 82 (2000)。gydF4y2Ba
Suriben, r . et al .抗体介入抑制GDF15-GFRAL逆转癌症恶病质小鼠的活动。gydF4y2BaNat,地中海。gydF4y2Ba26gydF4y2Ba,1264 - 1270 (2020)。gydF4y2Ba
Johnen, h . et al .肿瘤导致厌食症和减肥及介导的细胞因子MIC-1总科。gydF4y2BaNat,地中海。gydF4y2Ba13gydF4y2Ba,1333 - 1340 (2007)。gydF4y2Ba
Macia l . et al。巨噬细胞抑制性细胞因子1 (MIC-1 / GDF15)减少食物摄入量,小鼠的体重和改善葡萄糖耐量正常&致肥食物。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Bae34868 (2012)。gydF4y2Ba
Chrysovergis, k . et al . NAG-1 / GDF-15防止肥胖增加产热、脂类分解和氧化代谢。gydF4y2BaInt。j . ob。gydF4y2Ba38gydF4y2Ba,1555 - 1564 (2014)。gydF4y2Ba
蔡,v . w . et al . TGFbeta细胞因子的厌食的行动MIC-1 / GDF15需要一个完整的脑干区postrema和孤束核。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba9gydF4y2Bae100370 (2014)。gydF4y2Ba
Tran, T。,Yang, J., Gardner, J. & Xiong, Y. GDF15 deficiency promotes high fat diet-induced obesity in mice.《公共科学图书馆•综合》gydF4y2Ba13gydF4y2Bae0201584 (2018)。gydF4y2Ba
Patel, et al。结合基因删除GDF15和FGF21适度对体重的影响,肝脂肪变性和高脂肪喂养小鼠胰岛素抵抗。gydF4y2Ba摩尔。金属底座。gydF4y2Ba65年gydF4y2Ba101589 (2022)。gydF4y2Ba
大厅,k·d·&郭,j .肥胖能量:体重管理和饮食成分的影响。gydF4y2Ba胃肠病学gydF4y2Ba152年gydF4y2Ba,1718 - 1727 (2017)。gydF4y2Ba
艾瑞克,Y。,leDuc, C. A., Watanabe, K. & Leibel, R. L. Effects of ambient temperature on adaptive thermogenesis during maintenance of reduced body weight in mice.点。j .杂志。Regul。中国。广告样稿,杂志。gydF4y2Ba303年gydF4y2BaR438-R448 (2012)。gydF4y2Ba
斯利,r . j . & MacDougald o . a .老鼠作为人体生理学的实验模型:当几个学位房温度。gydF4y2BaNat,金属底座。gydF4y2Ba3 gydF4y2Ba,443 - 445 (2021)。gydF4y2Ba
肖,C。,Goldgof, M., Gavrilova, O. & Reitman, M. L. Anti-obesity and metabolic efficacy of the β3-adrenergic agonist, CL316243, in mice at thermoneutrality compared to 22°C.肥胖gydF4y2Ba23gydF4y2Ba,1450 - 1459 (2015)。gydF4y2Ba
明天,m . r . et al .抑制atp柠檬酸裂解酶提高了纳什,肝纤维化,血脂异常。gydF4y2Ba细胞金属底座。gydF4y2Ba34gydF4y2Ba,919 - 936 (2022)。gydF4y2Ba
Christoffersen, b . o . et al .之外食欲规定:针对能量消耗,脂肪氧化,精益质量保护可持续减肥。gydF4y2Ba肥胖gydF4y2Ba30.gydF4y2Ba,841 - 857 (2022)。gydF4y2Ba
Govaere, o . et al .转录组分析在非酒精性脂肪肝病谱揭示基因签名肝病和纤维化。gydF4y2Ba科学。Transl地中海。gydF4y2Ba12gydF4y2Baeaba4448 (2020)。gydF4y2Ba
丰塔纳,L。克莱恩,S。,Holloszy, J. O. & Premachandra, B. N. Effect of long-term calorie restriction with adequate protein and micronutrients on thyroid hormones.j .中国。性。金属底座。gydF4y2Ba91年gydF4y2Ba,3232 - 3235 (2006)。gydF4y2Ba
西米诺et al。肾上腺轴的激活外源性和内源性GDF15。gydF4y2BaProc。《科学。美国gydF4y2Ba118年gydF4y2Bae2106868118 (2021)。gydF4y2Ba
gerrit, m . f . et al。不同的骨骼肌纤维特征和基因表达diet-sensitive与diet-resistant肥胖。gydF4y2Baj .脂质物。gydF4y2Ba51gydF4y2Ba,2394 - 2404 (2010)。gydF4y2Ba
Frikke-Schmidt, h . et al . GDF15 liraglutide协同行为,但没有必要减肥减肥手术引起的老鼠。gydF4y2Ba摩尔。金属底座。gydF4y2Ba21gydF4y2Ba13-21 (2019)。gydF4y2Ba
翁,黄永发。et al .秋水仙碱徒有选择地在肝脏诱导hepatokines抑制骨髓细胞激活。gydF4y2BaNat,金属底座。gydF4y2Ba3 gydF4y2Ba,513 - 522 (2021)。gydF4y2Ba
Rochette, L。西,M。,Cottin, Y. & Vergely, C. Insights into mechanisms of GDF15 and receptor GFRAL: therapeutic targets.性趋势。金属底座。gydF4y2Ba31日gydF4y2Ba,939 - 951 (2020)。gydF4y2Ba
年轻,j·b·&兰茨贝格l .刺激交感神经系统在蔗糖喂食。gydF4y2Ba自然gydF4y2Ba269年gydF4y2Ba,615 - 617 (1977)。gydF4y2Ba
Guarino D。,N一个nn我pieri, M., Iervasi, G., Taddei, S. & Bruno, R. M. The role of the autonomic nervous system in the pathophysiology of obesity.前面。杂志。gydF4y2Ba8gydF4y2Ba665 (2017)。gydF4y2Ba
Mottillo, e p . et al。缺乏脂肪细胞AMPK加剧胰岛素抵抗,肝脂肪变性棕色和浅褐色脂肪组织功能。gydF4y2Ba细胞金属底座。gydF4y2Ba24gydF4y2Ba,118 - 129 (2016)。gydF4y2Ba
打乱阵脚,等。在骨骼肌解偶联蛋白的表达和白色脂肪产热的β3-adrenergic受体激动剂治疗肥胖的老鼠。gydF4y2Baj .中国。投资。gydF4y2Ba97年gydF4y2Ba,2898 - 2904 (1996)。gydF4y2Ba
孔雀王朝,s . k . et al . Sarcolipin基础代谢率的关键因素,及其超表达增强能量消耗和抵抗食源性肥胖。gydF4y2Ba生物。化学。gydF4y2Ba290年gydF4y2Ba,10840 - 10849 (2015)。gydF4y2Ba
吉田,t等人βgydF4y2Ba3 gydF4y2Ba肾上腺素能受体激动剂诱导功能活跃解偶联蛋白在脂肪和慢肌纤维。gydF4y2Ba点。j .杂志。gydF4y2Ba274年gydF4y2BaE469-E475 (1998)。gydF4y2Ba
购物中心,s . et al . sarcolipin的存在导致热量生产增加了CagydF4y2Ba2 +gydF4y2Ba腺苷三磷酸酶。gydF4y2Ba生物。化学。gydF4y2Ba281年gydF4y2Ba,36597 - 36602 (2006)。gydF4y2Ba
Sahoo美国K。,Shaikh, S. A., Sopariwala, D. H., Bal, N. C. & Periasamy, M. Sarcolipin protein interaction with sarco(endo)plasmic reticulum Ca2 +gydF4y2Ba腺苷三磷酸酶(SERCA的)是不同于受磷蛋白,只有sarcolipin能促进SERCA的解偶联泵。gydF4y2Ba生物。化学。gydF4y2Ba288年gydF4y2Ba,6881 - 6889 (2013)。gydF4y2Ba
林奇,g . s .赖亚尔& j·g·β-adrenoceptor信号在骨骼肌的作用:对肌肉萎缩和疾病的影响。gydF4y2Ba杂志。牧师。gydF4y2Ba88年gydF4y2Ba,729 - 767 (2008)。gydF4y2Ba
迈斯特,j . et al .瘦肉精施加抗糖尿病的活动通过骨骼肌细胞的代谢重编程。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba22岁(2022年)。gydF4y2Ba
胡,et al。高于预测静息能量消耗和降低健康的减持中国成年人的身体活动。gydF4y2Ba细胞金属底座。gydF4y2Ba34gydF4y2Ba,1413 - 1415 (2022)。gydF4y2Ba
Pontzer, h . et al .日常能量消耗通过人类的生命历程。gydF4y2Ba科学gydF4y2Ba373年gydF4y2Ba,808 - 812 (2021)。gydF4y2Ba
Galuppo, b . et al .生长分化因子15 (GDF15)与非酒精脂肪肝(NAFLD)在青年超重或肥胖。gydF4y2Ba减轻。糖尿病gydF4y2Ba12gydF4y2Ba9 (2022)。gydF4y2Ba
古,b . k . et al .生长分化因子15预测先进纤维化biopsy-proven非酒精脂肪肝。gydF4y2Ba肝脏Int。gydF4y2Ba38gydF4y2Ba,695 - 705 (2018)。gydF4y2Ba
落下帷幕,n . C。,Sahoo美国K。,米一个urya, S. K. & Periasamy, M. The role of sarcolipin in muscle non-shivering thermogenesis.前面。杂志。gydF4y2Ba9gydF4y2Ba1217 (2018)。gydF4y2Ba
最多,j . &瑞德曼l . m .卡路里限制对能量代谢的影响。gydF4y2BaExp Gerontol。gydF4y2Ba133年gydF4y2Ba110875 (2020)。gydF4y2Ba
巴赫曼,e . s .等人βAR食源性生热作用和肥胖耐受所需信号。gydF4y2Ba科学gydF4y2Ba297年gydF4y2Ba,843 - 845 (2002)。gydF4y2Ba
Martinussen, c . et al .等离子GDF15水平是相似的主题之间减肥手术后和匹配控制,不受食物影响。gydF4y2Ba点。j .杂志。性。金属底座。gydF4y2Ba321年gydF4y2BaE443-E452 (2021)。gydF4y2Ba
起重机,j . D。,米ottillo, E. P., Farncombe, T. H., Morrison, K. M. & Steinberg, G. R. A standardized infrared imaging technique that specifically detects UCP1-mediated thermogenesis in vivo.摩尔。金属底座。gydF4y2Ba3 gydF4y2Ba,490 - 494 (2014)。gydF4y2Ba
Kleiner, d . e . et al .组织学评分系统的设计和验证非酒精性脂肪肝病。gydF4y2Ba肝脏病学gydF4y2Ba41gydF4y2Ba,1313 - 1321 (2005)。gydF4y2Ba
Parlee, s D。,lentz, S. I., Mori, H. & MacDougald, O. A. Quantifying size and number of adipocytes in adipose tissue.Enzymol方法。gydF4y2Ba537年gydF4y2Ba,93 - 122 (2014)。gydF4y2Ba
Remmerie, a . et al .骨桥蛋白表达确定的一个子集招募巨噬细胞不同于枯氏细胞脂肪肝。gydF4y2Ba免疫力gydF4y2Ba53gydF4y2Ba,641 - 657 (2020)。gydF4y2Ba
Ewels, P。,米一个gnusson, M., Lundin, S. & Kaller, M. MultiQC: summarize analysis results for multiple tools and samples in a single report.生物信息学gydF4y2Ba32gydF4y2Ba,3047 - 3048 (2016)。gydF4y2Ba
Patro, R。,Duggal, G., Love, M. I., Irizarry, R. A. & Kingsford, C. Salmon provides fast and bias-aware quantification of transcript expression.Nat方法。gydF4y2Ba14gydF4y2Ba,417 - 419 (2017)。gydF4y2Ba
爱,我。,Huber, W. & Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.基因组医学杂志。gydF4y2Ba15gydF4y2Ba550 (2014)。gydF4y2Ba
Mi, h . et al .协议更新大规模基因组和基因功能分析与豹分类系统(v.14.0)。gydF4y2BaProtoc Nat。gydF4y2Ba14gydF4y2Ba,703 - 721 (2019)。gydF4y2Ba
Kanehisa, M。gydF4y2Ba后基因组信息学gydF4y2Ba(牛津大学出版社,2000)。gydF4y2Ba
刺,s . l . et al。可重复的无创测量老鼠心肌葡萄糖吸收18 f-fdg:示踪动力学评估一个1型糖尿病模型。gydF4y2Baj .诊断。地中海。gydF4y2Ba54gydF4y2Ba,1637 - 1644 (2013)。gydF4y2Ba
巴克,a . et al . carbon-11-acetate再循环对估计的影响心肌耗氧量的宠物。gydF4y2Baj .诊断。地中海。gydF4y2Ba32gydF4y2Ba,1950 - 1957 (1991)。gydF4y2Ba
理查德·m·a . et al .(药代动力学模型的确定gydF4y2Ba11 gydF4y2BaC)醋酸褐色脂肪组织。gydF4y2BaEJNMMI Res。gydF4y2Ba9gydF4y2Ba31 (2019)。gydF4y2Ba
理查德,g . et al .灌注的贡献gydF4y2Ba11 gydF4y2BaC-acetate信号褐色脂肪组织由DCE-MRI和评估gydF4y2Ba68年gydF4y2BaGa-DOTA宠物鼠模型。gydF4y2Ba粉剂。的原因。地中海。gydF4y2Ba85年gydF4y2Ba,1625 - 1642 (2021)。gydF4y2Ba
Iozzo, p . et al .脂肪酸在肝脏代谢,以正电子发射断层扫描来衡量,是肥胖者增加。gydF4y2Ba胃肠病学gydF4y2Ba139年gydF4y2Ba,846 - 856 (2010)。gydF4y2Ba
德容,h·w·et al。动力学模型分析心肌gydF4y2Ba11 gydF4y2Ba棕榈酸C)数据。gydF4y2Ba欧元。j .诊断。地中海。摩尔。成像gydF4y2Ba36gydF4y2Ba,966 - 978 (2009)。gydF4y2Ba
Dzamko: et al . AMPK-independent通路调节骨骼肌脂肪酸氧化。gydF4y2Baj .杂志。gydF4y2Ba586年gydF4y2Ba,5819 - 5831 (2008)。gydF4y2Ba
斯坦伯格,g R。,Bonen, A. & Dyck, D. J. Fatty acid oxidation and triacylglycerol hydrolysis are enhanced after chronic leptin treatment in rats.点。j .杂志。性。金属底座。gydF4y2Ba282年gydF4y2BaE593-E600 (2002)。gydF4y2Ba
沃恩,c . H。,Zarebidaki, E., Ehlen, J. C. & Bartness, T. J. Analysis and measurement of the sympathetic and sensory innervation of white and brown adipose tissue.Enzymol方法。gydF4y2Ba537年gydF4y2Ba,199 - 225 (2014)。gydF4y2Ba
Yabut j . m . et al .基因删除的肥大细胞5 -羟色胺合成防止肥胖和胰岛素抵抗的发展。gydF4y2BaCommun Nat。gydF4y2Ba11 gydF4y2Ba463 (2020)。gydF4y2Ba
起重机,j . d . et al .抑制周边5 -羟色胺合成减少肥胖和代谢障碍,促进褐色脂肪组织产热。gydF4y2BaNat,地中海。gydF4y2Ba21gydF4y2Ba,166 - 172 (2015)。gydF4y2Ba
哈基姆c . H。,Wasala, N. B. & Duan, D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice.j .粘度实验。gydF4y2Bahttps://doi.org/10.3791/50183gydF4y2Ba(2013)。gydF4y2Ba
Bloemberg d & Quadrilatero, j .快速测定肌凝蛋白重链表达老鼠,老鼠和人类骨骼肌使用多色免疫荧光分析。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Bae35273 (2012)。gydF4y2Ba
Vechetti, i . j . et al .终身减少myomiR表达并不影响骨骼肌形态学。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba5483 (2019)。gydF4y2Ba
Holloway, g . p . et al。脂肪/ CD36-null小鼠显示,线粒体/ CD36需要上调线粒体脂肪酸氧化的收缩肌肉。gydF4y2Ba点。j .杂志。Regul。中国。广告样稿,杂志。gydF4y2Ba297年gydF4y2BaR960-R967 (2009)。gydF4y2Ba
本顿,c R。、钙mpbell, S. E., Tonouchi, M., Hatta, H. & Bonen, A. Monocarboxylate transporters in subsarcolemmal and intermyofibrillar mitochondria.物化学。Biophys。Commun >,gydF4y2Ba323年gydF4y2Ba,249 - 253 (2004)。gydF4y2Ba
Miotto, p . m . & Holloway, g . p .磷酸没有穿梭运动揭示了体内creatine-independent线粒体ADP交通的重要性。gydF4y2Ba物化学。J。gydF4y2Ba473年gydF4y2Ba,2831 - 2843 (2016)。gydF4y2Ba
“库兹涅佐夫”,a . v . et al .分析线粒体功能的原位permeabilized肌肉纤维组织和细胞。gydF4y2BaProtoc Nat。gydF4y2Ba3 gydF4y2Ba,965 - 976 (2008)。gydF4y2Ba
Petrick, h·l . et al .膳食轻快硝酸盐增加高频SERCA的活动和ADP-transfer线粒体的雌性老鼠的肌肉。gydF4y2Ba点。j .杂志。性。金属底座。gydF4y2Ba323年gydF4y2BaE171-E184 (2022)。gydF4y2Ba
拉里·j·s . v . et al .咖啡因能够刺激脂肪酸氧化钝化在CD36零老鼠。gydF4y2Ba学报杂志。gydF4y2Ba205年gydF4y2Ba,71 - 81 (2012)。gydF4y2Ba
Hemani, g . et al . MR-Base平台支持系统的因果推论整个人类的现象学。gydF4y2BaeLifegydF4y2Ba7gydF4y2Bae34408 (2018)。gydF4y2Ba
Gagliano Taliun s a &埃文斯,d . m .十个简单的规则进行孟德尔随机化研究。gydF4y2Ba公共科学图书馆第一版。医学杂志。gydF4y2Ba17gydF4y2Bae1009238 (2021)。gydF4y2Ba
桑德森、大肠等。孟德尔随机化。gydF4y2BaNat。启引物的方法gydF4y2Ba2 gydF4y2Ba6 (2022)。gydF4y2Ba
刘,y . et al .基因结构11器官特征来自腹部MRI使用深度学习。gydF4y2BaeLifegydF4y2Ba10克ydF4y2Bae65554 (2021)。gydF4y2Ba
马丁,s . et al。估计肝脏和胰腺体积和脂肪含量的影响在患糖尿病的危险:孟德尔随机化研究。gydF4y2Ba糖尿病护理gydF4y2Ba45gydF4y2Ba,460 - 468 (2022)。gydF4y2Ba
Hemani G。,Tilling, K. & Davey Smith, G. Orienting the causal relationship between imprecisely measured traits using GWAS summary data.公共科学图书馆麝猫。gydF4y2Ba13gydF4y2Bae1007081 (2017)。gydF4y2Ba
海伯格,r &罗宾斯:设计不同堆叠柱形图表李克特量表和其他应用程序。gydF4y2BaSoftw j . Stat。gydF4y2Ba57gydF4y2Ba学会年会(2014)。gydF4y2Ba
确认gydF4y2Ba
我们感谢r·斯利分享gydF4y2BaGFRALgydF4y2Ba零老鼠;b·洛厄尔分享β-less老鼠;航运和j·吴β-less老鼠。G.R.S.支持加拿大糖尿病研究员奖(di - 5 - 17 - 5302 g),加拿大卫生研究院研究基金会(201709 fdn - ceba - 116200)一级代谢疾病和加拿大研究主席j·布鲁斯·邓肯赋予椅子在代谢疾病;D.W.由麦克马斯特奖学金资助老龄研究所(米拉)麦克马斯特大学;狭义相对论的博士后奖学金支持神达和诺和诺德公司;L.K.T.由CIHR博士后奖学金奖和迈克尔DeGroote奖学金奖在基础生物医学科学;由凡尼尔E.M.D.加拿大研究生奖学金;G.P.H.由加拿大自然科学和工程研究理事会(NSERC: 400362);G.J.D.和S.M.F. NSERC-CGSM奖学金; L.D. by the Fonds de Recherche du Québec-Santé doctoral training award; D.P.B. by the GSK Chair in Diabetes of Université de Sherbrooke and a FRQS J1 salary award. The Genotype-Tissue Expression (GTEx) Project was supported by the Common Fund of the Office of the Director of the National Institutes of Health, and by the NCI, NHGRI, NHLBI, NIDA, NIMH and NINDS.
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
研究的整体概念包含在这项工作是由G.R.S.,S.B.J. and D.W. D.W. designed, managed and performed experiments and analysed data, and performed RNA-seq analysis. D.W. and G.P. designed and performed the 2SMR study. L.K.T. and B.B. helped with all of the animal experiments. G.P.H., G.J.D. and S.M.F. performed and analysed data in soleus muscle and mitochondrial respiration experiments. L.D. and D.P.B. designed, performed and analysed data in PET/CT imaging experiments. R.E.K. designed and performed animal experiments and data analysis at Novo Nordisk. L.K.T. and M.J.T.J. performed qPCR testing and histological analysis for iWAT. E.A. performed histological analysis of liver. I.A.R. and T.J.H. designed and performed the study on mouse muscle function and structure. S.H. and J.R.S. designed and performed the study on the correlation between GDF15 levels and RMR in humans. C.A.P. and M.-E.H. designed and performed the study of correlation between GDF15 levels and TSH in humans. J.S.V.L., G.P., H.C.G., T.T., E.S.J. and A.R.T. were involved in the experiment discussions and design. B.B. and J.G. performed flow cytometry analysis. S.R., E.M.D. and E.E.T. were involved in tissue collection from mice and technical assistance. D.W. and G.R.S. wrote the paper, which was reviewed and edited by all of the authors.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
S.B.J. R.E.K.诺和诺德公司的雇员,制药公司生产和销售药治疗糖尿病和肥胖症。G.R.S. Espervita疗法的联合创始人和股东。麦克马斯特大学获得了资助Espervita疗法,Esperion疗法,Poxel制药和雀巢公司的研究实验室G.R.S. S.R.支持神达博士后奖学金由诺和诺德公司赞助。H.C.G. McMaster-Sanofi人口卫生研究所的椅子在糖尿病研究和照顾。G.R.S.,G。P。和H.C.G. are inventors listed on a patent for identifying GDF15 as a biomarker for metformin. G.R.S. has received consulting/speaking fees from Astra Zeneca, Eli Lilly, Esperion Therapeutics, Merck, Poxel Pharmaceuticals and Cambrian Biosciences. The other authors declare no competing interests.
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然gydF4y2Ba谢谢斯蒂芬赫齐格,Muthu Periasamy,另,匿名的,审稿人(s)为他们的贡献的同行评审工作。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
扩展数据数据和表gydF4y2Ba
扩展数据图1 GDF15在0.3 nmol /公斤没有对体重的影响,身体成分、葡萄糖稳态和非酒精性脂肪肝。gydF4y2Ba
一个gydF4y2Ba,注射的老鼠在食物摄入量的影响开始的时候光/暗循环GDF15 (5 nmol /公斤)。数据意味着±SEM, n = 10 /组小鼠。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaBgydF4y2Ba、体重。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaCgydF4y2Ba,脂肪质量/体质量(%)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaDgydF4y2Ba精益质量/体质量(%)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaEgydF4y2Ba、血清胰岛素水平。数据意味着±SEM, n = 10组。gydF4y2BaFgydF4y2Ba葡萄糖耐量试验(GTT)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaGgydF4y2Ba,胰岛素耐量试验(ITT)。数据意味着±SEM, n = 8老鼠/组。gydF4y2BaHgydF4y2Ba石蜡包埋的,代表图像肝部分沾染了)。gydF4y2Ba我gydF4y2Ba脂肪变性的分数,分数气球样变性的肝细胞,炎症评分,和非酒精性脂肪肝活动得分。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaJgydF4y2Ba、肝脏甘油三酯(TG)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaKgydF4y2Ba、肝脏non-esterified free-fatty酸(NEFA)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BalgydF4y2Ba、血清丙氨酸转氨酶(ALT)。数据意味着±SEM, n = 10 /组小鼠。gydF4y2Ba
扩展数据图2的影响GDF15在1和5 nmol /公斤葡萄糖稳态,肝脏TG, NEFA和ALT。gydF4y2Ba
一个gydF4y2Ba、体重。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤),n = 9老鼠。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaBgydF4y2Ba葡萄糖耐量试验(GTT)。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤),n = 9老鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaCgydF4y2Ba,胰岛素耐量试验(ITT)。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤),n = 9老鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaDgydF4y2Ba、肝脏甘油三酯(TG)。数据意味着±SEM, n = 8老鼠/组。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaEgydF4y2Ba、肝脏non-esterified free-fatty酸(NEFA)。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤),n = 9老鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaFgydF4y2Ba、血清丙氨酸转氨酶(ALT)。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤),n = 9老鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2Ba
扩展数据图3基于RNA-seq肝脏转录组分析数据。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaCgydF4y2Ba火山的情节显示差异表达基因(度)之间的识别GDF15和车辆组(A), GDF15 pair-fed组(B), pair-fed和车辆组(C)。n = 6 /组小鼠。基因的差异表达分析DEGseq2基于瓦尔德测试(两面,没有调整)。gydF4y2BaDgydF4y2Ba在去注释,前30名参与车辆和GDF15之间的度,n = 6 /组小鼠。Adjust-p价值Benjamini-Hochberg计算方法。gydF4y2BaEgydF4y2Ba,排名前30位的途径通过KEGG通路富集分析。Adjust-p价值Benjamini-Hochberg计算方法。gydF4y2BaFgydF4y2Ba层次聚类,通过使用鼠标从NanoString纤维化面板。gydF4y2BaGgydF4y2Ba层次聚类的肝脏RNA-seq数据通过使用25-gene签名了gydF4y2Ba31日gydF4y2Ba在人类身上。gydF4y2Ba
扩展数据图4 GDF15独立增加能量消耗的时间进食。gydF4y2Ba
一个gydF4y2Ba、实验方案的影响GDF15热量限制和匹配(“早上pair-fed”组:美联储在开始的光周期(0600 - 0700 h);“晚上pair-fed”组:美联储开始暗周期(1800 - 1900 h))在体重和能量消耗(EE)的老鼠。gydF4y2BaBgydF4y2Ba平均能量消耗曲线。gydF4y2BaCgydF4y2Ba,AUC的平均能量消耗。数据意味着±SEM, n = 8老鼠/组除了GDF15组,n = 7小鼠。P值与图基单向方差分析的多重比较测试。gydF4y2BaDgydF4y2Ba,总能量消耗的ANCOVA对体重的老鼠使用体重作为协变量和治疗作为一个固定的因素。n = 8老鼠/组除了GDF15组,n = 7小鼠。gydF4y2BaEgydF4y2Ba,累积的食物摄入量。数据意味着±SEM, n = 8老鼠/组。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaFgydF4y2Ba、体重。数据意味着±SEM, n = 8老鼠/组除了GDF15组,n = 7小鼠。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaGgydF4y2Ba、体重百分比(归一化到0)。数据意味着±SEM, n = 8老鼠/组除了GDF15组,n = 7小鼠。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaHgydF4y2Ba,脂肪量。数据意味着±SEM, n = 8老鼠/组。P值与图基单向方差分析的多重比较测试。gydF4y2Ba我gydF4y2Ba,精益质量。数据意味着±SEM, n = 8老鼠/组除了GDF15组,n = 7小鼠。P值与图基单向方差分析的多重比较测试。gydF4y2Ba
扩展数据图5 (g)三碘甲状腺氨酸(T3)不太可能主要机制导致身体减肥,增加能量消耗(EE) GDF15引起的。gydF4y2Ba
一个gydF4y2Ba,单一剂量的GDF15并未改变血清T3。数据意味着±SEM, n = 10 /组小鼠。gydF4y2BaBgydF4y2Ba,GDF15治疗6周并没有改变血清T3。数据意味着±SEM, n = 10 /组小鼠除了GDF15 (5 nmol /公斤)和pair-fed组,n = 9老鼠。统计分析是由单向方差分析与图基的多重比较测试。gydF4y2BaCgydF4y2Ba、GDF15之间的相关性和促甲状腺激素(TSH)在人类血浆(n = 22参与者)。相关分析是使用皮尔逊积差相关的执行(两面没有调整)。gydF4y2BaDgydF4y2Ba、实验方案研究的影响T3阻滞剂丙基硫氧嘧啶(PTU)和GDF15在体重和EE在与西方饮食的老鼠和安置在热力中性。gydF4y2BaEgydF4y2Ba、体重。数据意味着±SEM, n = 6 /组小鼠。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaFgydF4y2Ba,平均12 h-ligh /黑暗的情感表达。数据意味着±SEM, n = 6 /组小鼠。P值与图基单向方差分析的多重比较测试。gydF4y2BaGgydF4y2Ba、动物活动期间12 h-light /黑圈。数据意味着±SEM, n = 6 /组小鼠。gydF4y2Ba(氯)通过GFRAL GDF15减少非酒精性脂肪肝和肝脏炎症gydF4y2Ba。gydF4y2BaHgydF4y2Ba石蜡包埋的,代表图像肝部分沾染了)。gydF4y2Ba我gydF4y2Ba脂肪变性的分数,分数气球样变性的肝细胞,炎症评分,和非酒精性脂肪肝活动得分。数据意味着±SEM, n = 10 /组小鼠。P值通过未配对Mann-Whitney测试(两面)。gydF4y2BaJgydF4y2Ba、肝脏甘油三酯(TG)。数据意味着±SEM, n = 10 /组小鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaKgydF4y2Ba、血清丙氨酸转氨酶(ALT)。数据意味着±SEM, n = 10 /组小鼠。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BalgydF4y2Ba在肝脏、骨髓细胞百分比。数据意味着±SEM, n = 8老鼠(WT-vehicle), n = 6小鼠(WT-GDF15), n = 7小鼠(WT-pair-fed), n = 4老鼠(KO-GDF15和KO-pair-fed)。P值与图基单向方差分析的多重比较测试。gydF4y2Ba米gydF4y2BaFlowcytometry分析免疫细胞数量,包括:CD45 +细胞百分比,肝巨噬细胞百分比,CD4 + T细胞比例在肝脏。数据意味着±SEM。数据意味着±SEM, n = 8老鼠(WT-vehicle), n = 6小鼠(WT-GDF15), n = 7小鼠(WT-pair-fed), n = 4老鼠(KO-GDF15和KO-pair-fed)。gydF4y2Ba
扩展数据图6 GDF15通过GFRAL增加能量消耗和脂肪酸氧化,该项信号。gydF4y2Ba
一个gydF4y2Ba、体重在综合实验室动物监控系统(蛤)。数据意味着±SEM, n = 10老鼠(WT-vehicle, WT-GDF15和WT-pair-fed), n = 7小鼠(KO-Pair-fed)和n = 6小鼠(KO-GDF15)。P值与Dunnett单向方差分析的多个对比测试。gydF4y2BaBgydF4y2Ba、动物活动期间12 h-light /黑圈。数据意味着±SEM, n = 10老鼠(WT-vehicle, WT-GDF15和WT-pair-fed), n = 7小鼠(KO-Pair-fed)和n = 6小鼠(KO-GDF15)。gydF4y2BaCgydF4y2Ba,平均呼吸交换比率(r)曲线在WT GFRAL KO小鼠和量化的平均24 h r。数据意味着±SEM, n = 10 /组小鼠。P值与Šidak单向方差分析的多个对比测试。gydF4y2BaDgydF4y2Ba,平均脂质氧化曲线在WT GFRAL KO小鼠和量化的平均24小时脂质氧化。数据意味着±SEM, n = 10 /组小鼠。P值与Šidak单向方差分析的多个对比测试。gydF4y2BaEgydF4y2Ba,平均碳水化合物氧化(CHO)曲线在WT GFRAL KO小鼠和量化的平均24 h曹。数据意味着±SEM, n = 10 /组小鼠。P值与Šidak单向方差分析的多个对比测试。gydF4y2BaFgydF4y2Ba、动物活动期间12 h-light /黑圈。数据意味着±SEM, n = 6 /组小鼠。gydF4y2BaGgydF4y2Ba在蛤、体重的老鼠。n = 6 /组小鼠。gydF4y2BaHgydF4y2Ba、实验方案的影响一个注入GDF15在呼吸道交换比率(r)、脂质氧化和碳水化合物氧化(CHO)在WT beta-less老鼠。gydF4y2Ba我gydF4y2Ba在蛤、体重。数据意味着±SEM, n = 8老鼠/组。gydF4y2BaJgydF4y2Ba随着时间的推移,呼吸交换比(r)在WT和beta-less老鼠。数据意味着±SEM, n = 8老鼠/组。gydF4y2BaKgydF4y2Ba,24小时平均脂肪酸氧化。数据意味着±SEM, n = 8老鼠/组。P值与图基单向方差分析的多重比较测试。gydF4y2BalgydF4y2Ba,平均碳水化合物氧化24 h。数据意味着±SEM, n = 8老鼠/组。P值与图基单向方差分析的多重比较测试。gydF4y2Ba米gydF4y2Ba,GDF15没有改变血浆去甲肾上腺素。数据意味着±SEM, n = 7 /组小鼠除了汽车组,n = 6小鼠。gydF4y2BaNgydF4y2Ba,GDF15并未改变去甲肾上腺素的褐色脂肪组织(蝙蝠)。数据意味着±SEM, n = 6 /组小鼠。gydF4y2BaOgydF4y2Ba,GDF15没有改变去甲肾上腺素在肝脏。数据意味着±SEM, n = 5 /组小鼠。P值与图基单向方差分析的多重比较测试。gydF4y2Ba
扩展数据图7 GDF15不会改变SNS信号在肝脏、脂肪组织产热的基因的表达,不需要脂肪组织AMPK诱导减肥。gydF4y2Ba
一个gydF4y2Ba,主成分分析(PCA)对肝脏RNAseq数据基于蛋白激酶信号通路(去:0010737),n = 6 /组小鼠。gydF4y2BaBgydF4y2Ba,gydF4y2BaUcp1gydF4y2Ba基因表达在iWAT和iBAT。数据意味着±SEM, n = 9老鼠/组除了pair-fed组,n = 10 /组小鼠。统计分析是由单向方差分析与图基的多重比较测试。gydF4y2BaCgydF4y2Ba在iBAT基因表达。数据意味着±SEM, n = 10 /组除了GDF15组小鼠,小鼠n = 9。gydF4y2BaDgydF4y2Ba在iWAT基因表达。数据意味着±SEM, n = 8老鼠/组除了汽车组,n = 7小鼠。gydF4y2BaEgydF4y2Ba石蜡包埋的,代表图像iWAT部分沾染了)。gydF4y2BaFgydF4y2Ba,意味着细胞iWAT的大小。数据意味着±SEM, n = 8老鼠/组除了汽车组,n = 7小鼠。gydF4y2BaGgydF4y2Ba、实验方案的效果GDF15在WT体重和能量消耗和诱导模型删除AMPKβ1和β2子单元在脂肪细胞(iβ1β2AKO)与西方饮食的老鼠和安置在热力中性。gydF4y2BaHgydF4y2Ba、体重变化。数据意味着±SEM, n = 5 /组小鼠(WT老鼠),n = 6 /组小鼠(iβ1β2AKO老鼠)。P值通过双向方差分析与图基的多个对比测试。gydF4y2Ba我gydF4y2Ba,平均12 h-dark EE。数据意味着±SEM, n = 5 /组小鼠(WT老鼠),n = 6 /组小鼠(iβ1β2AKO老鼠)。P值与图基单向方差分析的多重比较测试。gydF4y2Ba
扩展数据图8 GDF15不会改变体温或在肝脏或褐色脂肪组织氧化代谢。gydF4y2Ba
一个gydF4y2Ba体温(直肠温度)。数据意味着±SEM, n = 6 /组小鼠(车辆),n = 7 /组小鼠(GDF15和Pair-fed组)。gydF4y2BaBgydF4y2Ba,表面温度的老鼠。数据意味着±SEM, n = 6 /组小鼠(车辆),n = 7小鼠(GDF15和Pair-fed组)。gydF4y2BaCgydF4y2Ba的老鼠,代表红外图像。图像显示使用彩虹高对比度颜色FLiR研究红外项目。数据意味着±SEM, n = 6 /组小鼠(车辆和GDF15组),n = 7小鼠(Pair-fed)。gydF4y2BaDgydF4y2BakgydF4y2Ba1gydF4y2Ba在mL·ggydF4y2Ba−1gydF4y2Ba·敏gydF4y2Ba−1gydF4y2Ba(组织血流指数的基础上,吸收的速度(gydF4y2Ba11 gydF4y2BaC]醋酸)在肝、肩胛间的褐色脂肪组织(iBAT),心脏和肾脏。数据意味着±SEM, n = 12 /组小鼠(车辆),n = 13老鼠/组(GDF15)。gydF4y2BaEgydF4y2BakgydF4y2Ba2 gydF4y2Ba在最小值gydF4y2Ba−1gydF4y2Ba(氧化代谢指数:快速分级组织间隙的gydF4y2Ba11 gydF4y2BaC]醋酸)在肝脏,iBAT,心脏和肾脏。数据意味着±SEM, n = 12 /组小鼠(车辆除了iBAT, n = 11老鼠),n = 11老鼠,老鼠n = 13 /组小鼠(GDF15除了iBAT, n = 11)。gydF4y2BaFgydF4y2BakgydF4y2Ba3 gydF4y2Ba在最小值gydF4y2Ba−1gydF4y2Ba(non-oxidative处理:捕获的gydF4y2Ba11 gydF4y2BaC在组织免费gydF4y2Ba11 gydF4y2BaC)醋酸或其他代谢物,如脂质)在肝脏、心脏和肾脏。数据意味着±SEM, n = 12 /组小鼠(车辆),n = 13老鼠/组(GDF15)。gydF4y2BaGgydF4y2Ba、脂肪酸(FA)肝脏摄取率,使用[iBAT、心肌、肾脏gydF4y2Ba11 gydF4y2Ba棕榈酸酯的宠物。数据意味着±SEM, n = 12老鼠(车辆),n = 13老鼠(GDF15)。通过配对t检验P值gydF4y2BaHgydF4y2Ba、FA肝脏氧化率、iBAT心肌和肾脏。数据意味着±SEM, n = 12老鼠(车辆),n = 13老鼠(GDF15)。gydF4y2Ba我gydF4y2Ba、FA酯化率肝、iBAT、心肌、肾脏。数据意味着±SEM, n = 12老鼠(车辆),n = 13老鼠(GDF15)。gydF4y2Ba
扩展数据图9去神经的蝙蝠并不妨碍GDF15-induced体重损失,能量消耗和脂肪酸氧化。gydF4y2Ba
一个gydF4y2Ba、实验方案测试GDF15和匹配的影响热量限制在iBAT去神经的C57BL / 6 j小鼠美联储西方饮食和居住在热力中性(TN, 29°C)。老鼠去神经的的蝙蝠6-hydroxydopamine氢溴酸盐(6 ohda)。gydF4y2BaBgydF4y2Ba比例、体重变化和体重变化。数据意味着±SEM, n = 5 /组小鼠。按未配对t检验P值(两面)。gydF4y2BaCgydF4y2Ba、氧化消耗曲线。数据意味着±SEM, n = 5 /组小鼠。按未配对t检验P值(两面)。gydF4y2BaDgydF4y2Ba,ANCOVA对体重的能量消耗的老鼠使用体重作为协变量和治疗作为一个固定的因素。gydF4y2BaEgydF4y2Ba,平均呼吸交换比率(r)曲线。数据意味着±SEM, n = 5 /组小鼠。按未配对t检验P值(两面)。gydF4y2BaFgydF4y2Ba,平均脂质氧化曲线。数据意味着±SEM, n = 5 /组小鼠。按未配对t检验P值(两面)。gydF4y2BaGgydF4y2Ba,平均碳水化合物氧化(CHO)曲线。数据意味着±SEM, n = 5 /组小鼠。P值t测试(两面)。gydF4y2BaHgydF4y2Ba、体重。数据意味着±SEM, n = 5 /组小鼠。gydF4y2Ba我gydF4y2Ba、动物活动期间12 h-light /黑圈。数据意味着±SEM, n = 5 /组小鼠。gydF4y2Ba
扩展数据图10 GDF15增加该项信号和骨骼肌线粒体呼吸没有改变纤维类型百分比和肌肉结构。gydF4y2Ba
一个gydF4y2Ba,相对gydF4y2BaSlngydF4y2Ba基因表达水平在比目鱼肌和趾长伸肌肌腱牵向前(EDL)肌肉。数据意味着±SEM, n = 7 /组小鼠。P值的治疗因素是分析Mixed-effects模型(REML,两面没有调整)。gydF4y2BaBgydF4y2Ba的相对表达水平gydF4y2BaAtp2a1gydF4y2Ba,gydF4y2BaAtp2a2gydF4y2Ba,gydF4y2BaSln, Ucp3 Pln、Ppard Gpd2 Cox8bgydF4y2Ba和gydF4y2BaPppargc1agydF4y2Ba在TA肌肉beta-less老鼠。n = 6 /组小鼠。gydF4y2BaCgydF4y2Ba的相对表达水平gydF4y2BaAtp2a1gydF4y2Ba,gydF4y2BaAtp2a2gydF4y2Ba,gydF4y2BaSln, Pln Gpd2gydF4y2Ba,gydF4y2BaCpt1agydF4y2Ba在肌管处理车辆,GDF15和去甲肾上腺素(NE)。n = 7生物/组独立样本。P值通过双向方差分析与图基的多个对比测试。gydF4y2BaDgydF4y2Ba,gydF4y2BaSlngydF4y2Ba表达小鼠股四头肌分离处理车辆或beta 2受体激动剂(瘦肉精)。数据意味着±SEM, n = 10 /组小鼠。按未配对t检验P值(两面)。gydF4y2BaEgydF4y2Ba免疫组织化学染色,代表在腓肠肌纤维类型。gydF4y2BaFgydF4y2Ba、肌肉纤维类型百分比。数据意味着±SEM, n = 4组。gydF4y2BaGgydF4y2Ba,代表图像冻结的腓肠肌肌肉部分沾)(4老鼠/组)。在每个腓肠肌,整个肌肉横截面是可视化和成像评估整个横截面。gydF4y2BaHgydF4y2Ba,绝对的线粒体呼吸(乔gydF4y2Ba2 gydF4y2Ba);S4: 4(丙酮酸+苹果酸),S2:状态2(丙酮酸+苹果酸,耗尽ADP), S3:状态3 (PMD (+ max ADP)), CI:最大CI呼吸(PMDG马克斯谷氨酸(+)),人民共和国:最大CII呼吸(琥珀酸+ max),软:S3 / S4。数据意味着±SEM, n = 6 /组小鼠。gydF4y2Ba我gydF4y2Ba、代表微量的氧气耗尽100年的存在在线粒体μM (200 nmol)测定ADP ADP / O比率。数据意味着±SEM, n = 6 /组小鼠。gydF4y2BaJgydF4y2Ba乔,绝对的线粒体gydF4y2Ba2 gydF4y2Ba寡霉素和最大CII支持呼吸。战略性:乔gydF4y2Ba2 gydF4y2Ba线粒体+寡霉素(没有基质),与PMDGS CII:最大的呼吸。数据意味着±SEM, n = 6 /组小鼠。gydF4y2BaKgydF4y2Ba乔,线粒体的变化gydF4y2Ba2 gydF4y2Ba与PMDGS战略性。数据意味着±SEM, n = 6 /组小鼠。P值与图基单向方差分析的多重比较测试。gydF4y2BalgydF4y2Ba,乔gydF4y2Ba2 gydF4y2Ba在permeabilized纤维和无ADP和各种基质。数据意味着±SEM, n = 5老鼠/组除了GDF15组,n = 6小鼠。gydF4y2Ba米gydF4y2Ba,耗氧量(JO2) permeabilized肌肉纤维处理(点,丙酮酸+苹果酸,ATP, CagydF4y2Ba2 +gydF4y2Ba或注册会计师,cyclopiazonic酸)。数据意味着±SEM, n = 6 /组除了GDF15组小鼠,小鼠n = 5。P值与Šidak双向方差分析的多个对比测试。gydF4y2BaNgydF4y2Ba,乔的变化gydF4y2Ba2 gydF4y2Ba在滴定钙permeabilized纤维。数据意味着±SEM, n = 6 /组除了GDF15组小鼠,小鼠n = 5。P值通过双向方差分析与图基的多个对比测试。P -丙酮酸;M -苹果酸;D - ADP;G -谷氨酸;S -琥珀酸;软,呼吸控制比例。gydF4y2BaOgydF4y2Ba,绝对JO2。数据意味着±SEM, n = 8老鼠/组。按未配对t检验P值(两面)。gydF4y2Ba
扩展数据图11 GDF15之间的关系和静止代谢率(RMR)和非酒精性脂肪肝在人类身上。gydF4y2Ba
一个gydF4y2BaGDF15水平之间的相关性和RMR人口健康成人参与者(n = 137)。相关分析是使用皮尔逊积差相关的执行(两面)。gydF4y2BaBgydF4y2Ba纠正GDF15水平之间的相关性,重量和质量和r脂肪量校正后,无脂肪质量和年龄从TANITA,通过使用我们的出版方程Ln蜜蜂=−0.954 + 0.707 Ln FFM + 0.019 Ln调频。相关分析是使用皮尔逊积差相关的执行(两面)。gydF4y2BaCgydF4y2BaGDF15表达水平、分布(log10 (TPM))从806年在GTEx对人体肌肉组织。黄色和蓝色框代表了前25% (n = 200)和底部25% (n = 200)组,分别。铰链对应于第一和第三个四分位数,胡须扩展到最大/最小值,和中心的线代表中间值。gydF4y2BaDgydF4y2Ba(TPM)的相对表达水平gydF4y2BaSLN, PPARD CPT1A、CPT1B GPD2gydF4y2Ba。n = 200人类受试者每组。按未配对t检验P值(两面)。铰链对应于第一和第三个四分位数,胡须扩展到最大/最小值,和中心的线代表中间值。gydF4y2BaEgydF4y2Ba的散点图SNP-effect GDF15和SNP-effect肝脏脂肪百分比在人类通过使用两个示例孟德尔随机化鼻中隔黏膜下切除术后(2)。误差线表明95%可信区间,n = 32859参与者在英国生物库。先生的分析是由使用简单的方法,中值加权模式先生估计,加权平均法,收集鸡蛋者先生回归、方差倒数加权方法。gydF4y2BaFgydF4y2Ba,单个SNP分析GDF15在人类肝脏脂肪比例,误差表明95%可信区间,n = 32859参与者在英国生物库。gydF4y2BaGgydF4y2Ba的散点图SNP-effect GDF15和SNP-effect在人类肝脏体积。误差线表明95%可信区间,n = 32859参与者在英国生物库。先生的分析是由使用简单的方法,中值加权模式先生估计,加权平均法,收集鸡蛋者先生回归、方差倒数加权方法。gydF4y2Ba
扩展数据图形化模型图12描述生物电路连接GDF15 GFRAL和该项受体在肌肉维持能量消耗热量限制。gydF4y2Ba
老鼠、肝脏、肌肉和大脑插图得到gydF4y2BaBioRender.comgydF4y2Ba(出版许可号TZ259QRW6B)。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
补充无花果。1 - 5。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
王,D。,Townsend, L.K., DesOrmeaux, G.J.et al。gydF4y2BaGDF15促进减肥通过增强肌肉的能量消耗。gydF4y2Ba自然gydF4y2Ba(2023)。https://doi.org/10.1038/s41586 - 023 - 06249 - 4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586 - 023 - 06249 - 4gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba