在COVID-19全基因组关联研究中定义最合适的表型具有挑战性,两篇新出版物展示了病例对照定义如何在关键程度上决定结果和研究结果的下游临床应用。
探索来自一家直接面向消费者的祖先遗传学公司的70多万名参与者的自我报告数据自然遗传学Roberts等人报告了COVID-19遗传学研究中几种常用的表型定义如何融合在一起,以代表对SARS-CoV-2病毒感染的易感性或严重COVID-19疾病的风险1.出于务实的原因,COVID-19的早期全基因组关联研究(GWAS)将重点放在住院病例上,与未筛选的、通常是先前基因分型的对照组进行比较2,3..虽然可以在大流行的第一波非常具有挑战性的浪潮中进行快速评估,但这种研究设计偏向于COVID-19并发症的生物学。对轻症或无症状患者的重视,包括将家庭COVID-19暴露确定为高危措施,使作者能够通过比较COVID-19检测呈阳性的暴露者与检测呈阴性的暴露者,对SARS-CoV-2感染的易感性进行深入调查。这些评估不仅证实了有争议的观点土著居民的基因座被认为是真正的SARS-CoV-2感染易感基因2,4他们还提出了一个迄今尚未被探索的保护性变异库的存在。
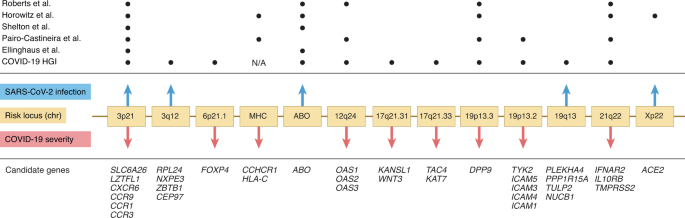
在一个专门查询罕见变异(次要等位基因频率(MAF) < 0.005),也在本期报道自然遗传学, Horowitz等人发现了血管紧张素转换酶2上游的非编码X染色体变体(rs190509934)之间的关联信号(ACE2)和预防SARS-CoV-2感染5.作者继续使用RNA测序证实了他们的发现——来自肝脏组织的数据显示,保护性等位基因导致携带者ACE2表达水平降低了近40%。这种关联本质上具有相当大的合理性,因为膜结合的ACE2是SARS-CoV-2刺突糖蛋白的结合位点,启动病毒细胞进入6.此外,Horowitz等人。5罗伯茨等人。1利用丰富的表型数据,将3p21.31染色体关联解析为一个易感信号和一个严重信号,定位于SLC6A20而且LZTFL1,这也是其他人所观察到的7.SLC6A20编码钠-亚胺酸(脯氨酸)转运蛋白1 (SIT1),其功能与ACE2相互作用(参考文献。8),而风险等位基因已被证明与基因表达增加有关SLC6A20(ref。2).此外,数据表明SARS-CoV-2刺突蛋白的受体结合域优先与A型血相互作用9的风险变异进行编码土著居民的基因座,对SARS-CoV-2感染易感性的遗传似乎集中在病毒的细胞进入装置上。
在感染SARS-CoV-2的个体中,只有不到10%的人会患上COVID-19的重症(参考文献)。10).考虑到从COVID-19的最初症状到出现伴有呼吸衰竭的严重疾病(通常约为一周)的窗口期10在美国,预测SARS-CoV-2感染后的严重病程具有相当大的临床意义,从治疗角度来看也是如此。可靠的风险分层可以指导这一引入期的治疗干预,其特征是病毒复制增强。这些干预措施可能包括抗病毒治疗、恢复期血浆、中和单克隆抗体或(可能对住院患者更重要的)免疫调节药物。
Horowitz等人发现,在有或没有年龄和糖尿病等临床危险因素的个体中,基于六种已知严重变异的高遗传风险评分(前10%)与严重疾病风险分别高1.65倍和1.75倍相关5.其他研究发现,在整个COVID-19患者群体中,3p21.31位点的rs10490770风险等位基因对死亡或严重呼吸衰竭的联合终点的影响的优势比为2.01160岁或以下的个体的效应量几乎是其两倍(优势比为3.5)。这些程度与那些与临床危险因素相关的程度相当。染色体3p21.31风险变异纯合个体年龄较低的发现支持了在年轻患者群体中遗传风险分层的增强效用2.
在COVID-19期间,GWAS的执行非常灵活,部分原因是在过去的GWAS期间建立了强大的协作网络12以及先前基因分型研究人群的利用,如UK Biobank, AncestryDNA和23andme1,3.,4,5.在COVID-19大流行期间,几家生物库和直接面向消费者的遗传学公司进行了前所未有的快速表型分型,由此发表的出版物值得承认,它是一种针对新兴疾病基因线索的“人群水平测试”形式。COVID-19宿主遗传学行动的项目编排也是活动的重要催化剂13.数字1总结了已发表和同行评审的GWAS关于COVID-19的文章。然而,即使在撰写本文时,COVID-19宿主遗传学计划第六次数据冻结的荟萃分析也已在线发布,共报告了23个涉及COVID-19易感性(7个位点)和严重程度(15个位点)的位点;仅在3个月前,就在该联盟自己的出版物中添加了10个新的基因座7.自发表第一份COVID-19全球卫生状况报告以来已过去22个月2与7年的克罗恩病遗传学相比,这似乎更令人印象深刻——从2001年核苷酸结合寡聚结构域2 (NOD2)易感基因发现的2008年元分析14,15——要达到同样的洞察力。克罗恩病遗传学的20年历史进一步证明,GWAS结果的转化研究需要时间,但可能揭示新的和意想不到的病理生理学方面。正是在这种背景下,快速解开COVID-19基因变得重要起来。一些基因座具有直接的生物学合理性(例如,ACE2和一些趋化因子),而其他趋化因子的潜在机制仍不清楚。在最近的COVID-19 GWAS冲刺之后,Horowitz等人。5罗伯茨等人。1有了重大贡献,随后的生物学研究转化超级马拉松就可以开始了,并由此对SARS-CoV-2感染的病理生理学及其并发症有了更深入的了解。疫苗接种已被证明是对抗SARS-CoV-2感染的终极保护。希望COVID-19 GWAS提供的生物学见解将有助于识别和开发新的治疗方案,不仅针对住院和危重患者,而且还可以防止住院的治疗方式。
这些位点代表了SARS-CoV-2感染(蓝色向上箭头)和伴有并发症的严重COVID-19(红色向下箭头)的混合风险变体。随着样本量的增加,可能会出现更多的基因座。在Horowitz等人中,3q12和6p21.1名义上显著相关。5由于与COVID-19 HGI报告有大量样本重叠,未指出分析。N/A表示6号染色体上的主要组织相容性复合体(MHC)在本文的报道中被省略,因为在荟萃分析中,来自个体研究的假定关联具有高度异质性。COVID-19宿主遗传学计划(https://www.covid19hg.org/).
参考文献
罗伯茨,g.h.l.等人。Nat,麝猫。https://doi.org/10.1038/s41588-022-01042-x(2022)。
Ellinghaus, D.等人。心血管病。j .地中海。383, 1522-1534 (2020)
piro - castineira, E.等人。自然591, 92-98(2021)。
谢尔顿,J. F.等。Nat,麝猫。53, 801-808(2021)。
霍洛维茨,J. E.等。Nat麝猫。.(在媒体上)。
Yan, R.等。科学367, 1444-1448(2020)。
COVID-19宿主遗传学倡议。自然https://doi.org/10.1038/s41586-021-03767-x(2021)。
Kuba, K.等。杂志。其他。128, 119-128(2010)。
吴,s.c .等。血供订购。5, 1305-1309(2021)。
柏林,D. A.,古力克,R. M. &马丁内斯,F. J.。心血管病。j .地中海。383, 2451-2460(2020)。
Nakanishi, T.等。j .中国。投资.https://doi.org/10.1172/jci152386(2021)。
布里克-沙利文,b.k. & Sullivan, p.f.。Nat麝猫44, 113(2012)。
COVID-19宿主遗传学倡议欧元。j .的嗡嗡声。麝猫.28, 715-718(2020)。
Hugot, J. P.等。自然411, 599-603(2001)。
巴雷特,J. C.等。Nat,麝猫。40, 955-962(2008)。
作者信息
作者及隶属关系
相应的作者
道德声明
相互竞争的利益
作者申报了来自AlfaSigma和Gilead的演讲费以及诺华和Intercept的顾问费。作者获得了Canica A/S的研究资助。
权利和权限
关于本文
引用本文
通过全基因组关联研究了解COVID-19。Nat麝猫54, 368-369(2022)。https://doi.org/10.1038/s41588-021-00985-x
发表:
发行日期:
DOI:https://doi.org/10.1038/s41588-021-00985-x