摘要
重金属是当今最重要的环境污染物之一。自然生长的丰裕Tetraena qataranse在卡塔尔国的拉斯拉凡石油和天然气设施周围,反映了它的耐毒素特性。研究了不同土壤浓度下荒漠植物对Ba、Cd、Cr、Cu、Ni和Pb的耐受性。电感耦合等离子体发射光谱(ICP-OES)分析表明,植物生物量积累的Cd、Cr、Cu和Ni浓度高于土壤,特别是在根部。根和芽中所有金属的生物浓缩因子(BCF)表明植物积累这些金属的能力。Cd的易位因子(TF)大于1;而对其他所有金属元素的富集值均小于1,表明植物通过植物萃取的方式对Cd进行了修复,Cd在茎部积累,Cr、Cu和Ni通过植物稳定作用富集在根部。金属植物稳定化限制运输,保护动物免受有毒物种的摄入,从而防止通过食物链传播。傅里叶红外光谱(FTIR)分析进一步证实了ICP-OES的定量数据。我们的研究结果表明t . qataranse耐Cd, Cr, Cu和Ni。潜在地,这些金属可以积聚在比这里显示的更高的浓度;因此,t . qataranse是一种适用于有毒金属植物稳定化的候选材料。
介绍
重金属是最重要的环境污染物之一;这在很大程度上是由于工业化引起的人为活动1.虽然有去除金属污染物的物理和化学处理策略,但这些方法都是劳动密集型的。此外,化学处理方法很昂贵,还会产生其他污染物2.因此,对替代技术的需求变得迫切,探索不同的生物基技术,即生物修复,随之而来。生物制剂的使用便宜、安全,对环境的不良影响有限或没有不良影响。生物修复方法包括生物强化、生物修复、生物通气、堆肥和植物修复。其中,植物修复被证明是最可行和最便宜的替代方案,并得到了越来越多的关注3..
植物的使用,如t . caerulescens而且诉calaminaria这种去除重金属的方法可以追溯到几百年前4.许多研究表明,重金属在植物组织中的积累可能会导致植物显著的酶活性受到抑制,从而对萌发性、幼苗发育和光合作用过程产生广泛的不利影响5.在重金属胁迫下,植物似乎表现出活性氧(ROS)的增加。作为结果;一些植物已经发展出对抗这种胁迫条件影响的机制。其中一个机制是特定抗氧化酶的活性增加,如过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)6.根对植物发育至关重要,在它们如何应对包括重金属暴露引起的胁迫方面起着至关重要的作用。根细胞壁有一种交换机制,可以固定重金属离子,并限制毒性作用向其他组织的传递7,8.
生物浓缩因子(BCF)和易位因子(TF)可以用来评价植物的修复潜力。BCF值大于1表示该植物为超蓄积物,而小于1则表示为排除物。TF值决定了植物从根向梢部转运重金属的效率。当TF大于1时,植物的金属从根到茎的转运被认为是有效的;这是由于一个高效的金属运输系统。然而,TF值小于1表明金属转移无效,这表明这些类型的植物在根和根状茎中积累的金属比在枝条或叶片中更多9.
植物中存在大分子,包括碳水化合物、脂类和核酸,它们具有与过渡金属相互作用的不同官能团。这些官能团对应于特定的红外光频率10以及它们与这些金属的相互作用可以通过傅里叶变换红外光谱(FTIR)来分析。因此,FTIR数据可以通过植物样品中的金属阳离子结合来定量确定植物组织中重金属的存在11.
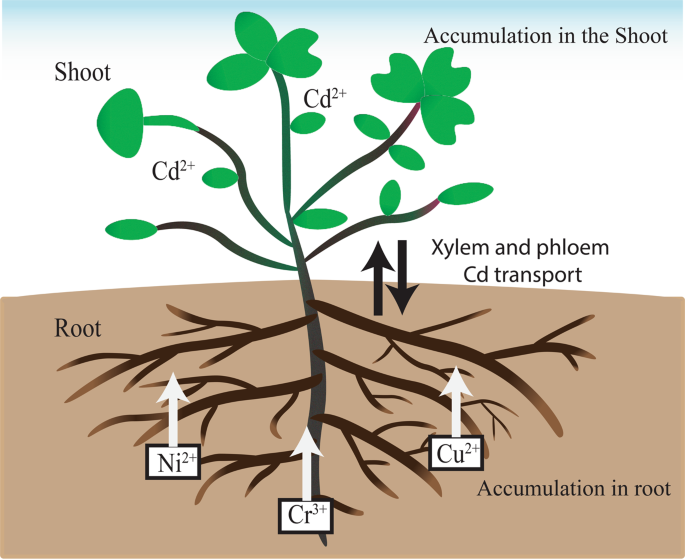
Ba、Cd、Cr、Cu、Ni和Pb等金属构成了重大的公共健康风险,在卡塔尔环境中经常出现的证据在文献中有充分的记载1,12.植物稳定化是植物修复的一种形式,允许植物稳定金属,并减少它们在通过土壤基质渗透的水中的存在。这限制了有毒和危险渗滤液的形成13.几种植物的种类,如f . rubra据报道,在植物稳定土壤中重金属的过程中是有用的14.t . qataranse是天然生长在拉斯拉凡地区的最常见的沙漠植物之一。一种沙漠灌木,很好地适应岩石和沙质盐碱地,其特征是末端多肉的分枝和多肉的叶子(图。1)15.
在这项研究中,我们评估了重金属(Ba, Cd, Cr, Cu, Ni和Pb)在四种植物(qataranse, S.蛭,l .轴板,美国aegyptiaca))生长在卡塔尔国一个人类活动频繁的工业区(拉斯拉凡)。根据金属定量,最有希望的物种(t . qataranse)评价了有毒金属植物稳定化的潜力。电感耦合等离子体-光学发射光谱(ICP-OES)和红外光谱(FTIR)数据检测了重金属的存在t . qataranse暴露后的组织。在这里,我们通过t . qataranse使其成为有毒金属植物稳定化的合适候选者。
结果
土壤特性
除了有毒金属外,Ras Laffan的土壤性质与卡塔尔大学的土壤性质大致相似,因此选择Ras Laffan作为对照区,比较FTIR数据。Ras Laffan土壤的pH值为8.05±0.12,电导率为4.25±0.44 mS/m, TOC水平为1.1±0.03%,揭示了其碱性和盐碱性质。对照区pH值为pH 8.31±0.36,电导率为4.63±0.61 mS/m, TOC为0.57±0.01%。对照地点土壤的pH值和EC没有差异(卡塔尔大学)。卡塔尔的土壤确实大部分是碱性的,含有高钙镁碳酸盐。其有机质含量相对较低,铁和粘土成分显著12.
重金属生物富集
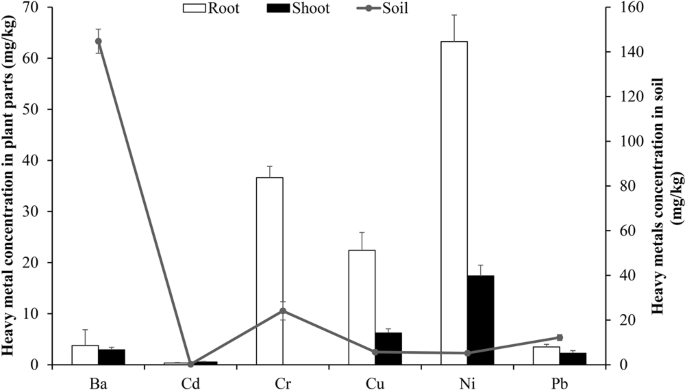
几种沙漠植物能耐受重金属胁迫。其中一些植物通常生长在卡塔尔的土壤上;例子包括南方P. australis, T. domingensis,p . juliflora,甘蒙柽柳spp.,m . polymorpha和其他人1,16.在初步研究中,我们发现t . qataranse当用含有不同浓度的不同重金属的石油和天然气产出水灌溉时生长17.然而,据我们所知,这是第一个研究检验t . qataranse与土壤中背景金属浓度相关的特定金属耐受性和组织积累能力。此外,亦测定了其他植物的金属浓度(埃及葡萄球菌,蛭形葡萄球菌而且l .轴板)生长在同一地区。然而,这些植物的组织积累要低得多(见补充图)。S1a-c),因此,本工作讨论t . qataranse结果,只有。土壤和植物组织部分(根和梢)的金属浓度如图所示。2.土壤浓度(mg/kg)干重依次为Ba (144.8) > Cr (24.1) > Pb(12.2) > Cu (5.7) > Ni (5.19) > Cd (0.2) mg/kg。尽管工业活动增加了有毒金属污染,但土壤淋滤或磨损降低了受影响地区的金属浓度18.植物组织的部分(根和拍摄),镍金属积累遵循趋势(63.3)> Cr(36.6) >铜(22.4)> Ba (3.8) > Pb(3.5) >倪Cd(0.4)和(17.4)>铜(6.2)> Ba (2.9) > Pb (2.3) > Cd (0.5) > Cr(0)分别毫克/公斤。值得注意的是,土壤中Ba、Cr和Pb的浓度远高于Cd、Cu和Ni(图2)。2).然而,这些金属的积累t . qataranse除Ni和Cr在根中的含量分别高达63.3和36.6 mg/kg外,其余组织均不显著。相比之下,Cr在笋部低于检出限,而Ni在笋部累积高达17.4 mg/kg。土壤性质决定了植物吸收金属的生物有效性,也部分原因是Cr的不易位。其他重要因素包括金属行为和对有关植物物种的毒性19.
相关分析
土壤中重金属的植物有效性可以通过建立土壤中金属浓度与植物组织中积累量之间的相关性来确定20.,受植物类型和土壤性质,特别是元素组成的影响21.本研究采用单回归分析方法对所分析金属的植物有效性进行评价。相关系数(r)采用Pearson回归方程在两个水平(i)土壤中金属浓度与不同植物部位(根和梢)之间,以及(ii)根和梢中金属浓度之间进行计算。通过相关系数来确定植物对金属积累的适宜性和不适宜性。表格1显示了土壤中金属含量与土壤中根/梢金属浓度的关系t . qataranse在土壤中自然生长的。金属之间的相关系数t . qataranse组织部分(根和芽)如表所示2.
生物浓缩因子(BCF)和易位因子(TF)
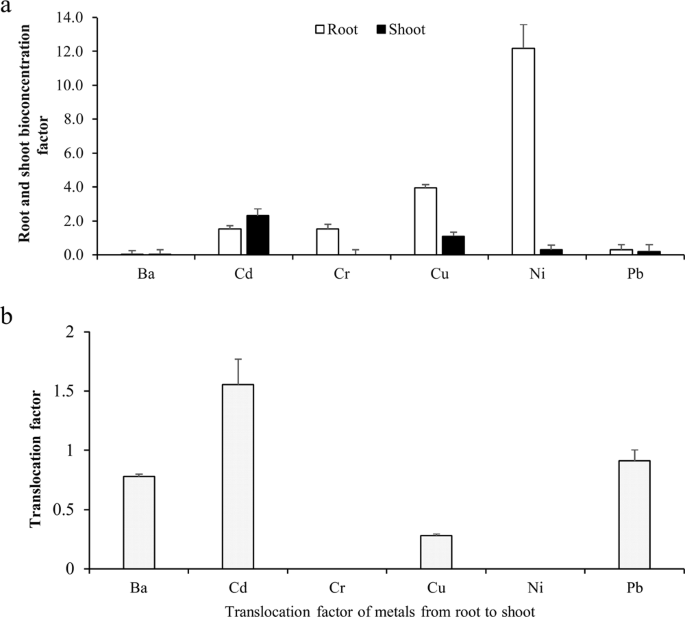
生物富集因子(BCF)和转运因子(TF)是研究重金属植物修复潜力、植物修复可行性的重要参数13.评价t . qataranseBa、Cd、Cr、Cu、Ni和Pb在近似BCF和TF下的积累如图所示。3 a, b分别。Cd、Cr、Cu和Ni的BCF值大于1,Ba和Pb的BCF值小于1。根BCF依次为;倪(12.2)>铜Cd (1.5) (3.9) > > Cr (1.5) > Pb英航(0.02),(0.2)>拍摄供应量是倪Cd(2.3)(3.3) > >铜(1.1)>铅(0.2)> Ba (0.02) > Cr(0.0毫克/公斤)。综上所述,BCF值表明Cd、Cr、Cu和Ni的植物稳定性t . qataranse.另一方面,只有Cd在1.6处的TF大于1(图2)。3 b),而其他金属(Ba、Cr、Cu、Ni和Pb)的TF均小于1,说明t . qataranseCd phytoextraction。
红外光谱分析
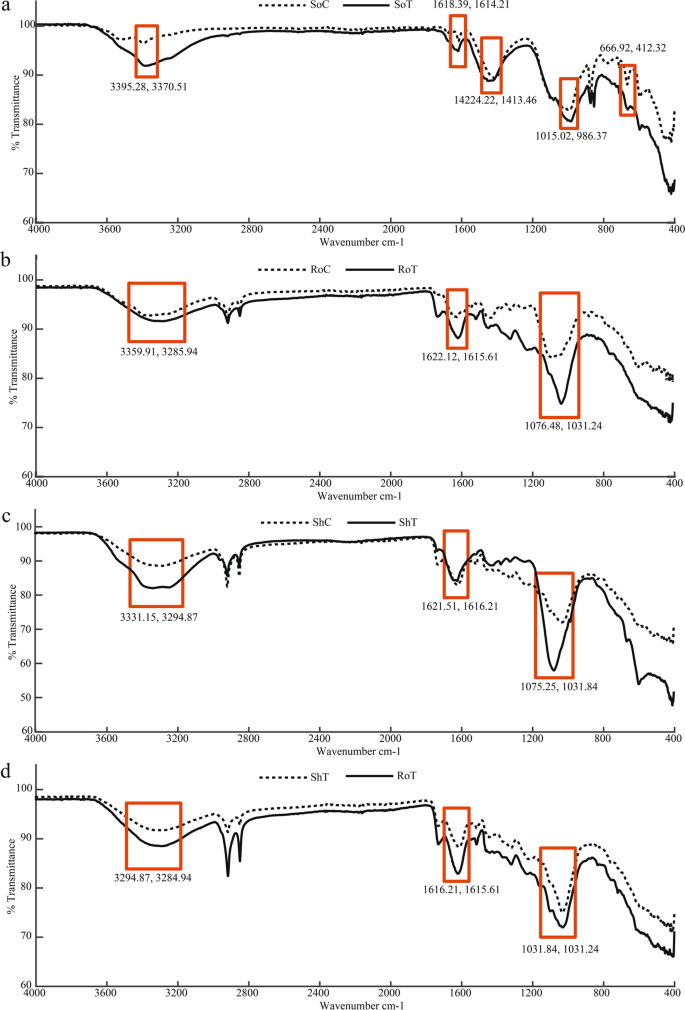
在生物样品中发现的过渡金属与生物分子的官能团相互作用,可以通过分析其红外光吸附来确定其组成11.因此,FTIR数据可用于研究生物样品中金属阳离子的结合22.用于FTIR分析,土壤和t . qataranse来自卡塔尔大学非金属污染区域的样本作为对照。用ICP-OES分析,对照点的所有金属均低于检出限。总的来说,治疗和对照组之间的带移不一致,特别是在t . qataranse生物质。我们认识到,由于分析的所有样品都来自现场,其他参数可能会对我们的FTIR结果产生影响23.因此需要注意的是,只有在明显的情况下(在文献中报道),FTIR结果才用于推断金属的存在t . qataranse并验证ICP-OES定量数据。尽管,多达5个主要波段被发现对应于土壤中的金属相互作用(图。4),其中只有三个峰值,而它们对应的位移与t . qataranse组织,因此严格检查(图。4罪犯).FTIR结果表明,干生物质具有不同的官能团,如羧基、磷酸盐、酰胺和氢氧根。宽而稳健的红外光谱区域跨越3600-3200厘米−1表征O-H和N-H拉伸24.所有带子都在1618.39和1614.21厘米−1(无花果。4)、1622.12及1615.61厘米−1(无花果。4 b)、1621.51及1615.21厘米−1(无花果。4摄氏度)以及1616.184和1615.61厘米−1(无花果。4 d)由于C=O拉伸,对应于特定的酰胺基团25.区域从1200到900厘米−1表示C-C, C-O和C-O- p拉伸重叠26主要存在于细胞多糖中
讨论
虽然关于该州土壤重金属污染的研究很少,等.12Cr、Cu、Ni、Pb在卡塔尔土壤中的空间分布。有毒金属在土壤中积累的影响不仅限于内陆环境和生物区系。根据它们的性质,金属在土壤环境中移动,随后沉积到水体中。在卡塔尔,海水淡化是家庭供水的主要来源。Nriagu最近对多哈一些居民的家庭水质进行了调查,等.27发现一些有毒金属(Cd、Cr、Ni和Pb)的浓度明显低于该州设定的水质限值。有毒金属在海洋中的运输、积累和生物聚集对人类和水生生物的健康构成潜在风险。土壤pH值、有机物、金属类型、土壤中浓度、植物类型和年龄等因素影响植物对金属的吸收28,29,30.,31,32.尽管在Ras Laffan的土壤中Ba是浓度最高的金属(144.8 mg/kg)。2).然而,在植物组织部位积累较少,特别是在茎部,只有2.9 mg/kg的转运量。这在一定程度上可能是由于金属无法用于t . qataranse吸收。与这些发现一致,科瓦尔斯卡,等.33结果表明,当Ba浓度为300 mg/kg时,植物对Ba的生物可利用性不足1%。虽然有些植物,包括t . domingensis而且c .纸莎草耐受低至中浓度Ba。高浓度时对植物有毒。一些已知的植物包括即等而且诉densiflora34可耐受较高浓度。Ba对人类毒性的信息仍有待充分确定。然而,Kowalska等.33注意到在Ba浓度升高的社区,由于心血管和心脏疾病发病率高,65岁人群死亡率高34,35.Cr在土壤中的浓度高于Ba,为24.1 mg/kg。2).虽然在茎部未被检测到,但它优先在根中积累,总浓度为36.6 mg/kg(图2)。2).Cr很少在自然界中产生,即使是人为活动产生的Cr也只存在微量36.尽管在根部积累,但无论其可用形式如何,预计将有有限的转移到芽部。Ras Laffan的土壤碱性为8.05,因此可能含有更多的生物可利用铬6 +.Cr6 +剧毒,氧化势强,比铬3 +并且主要与氧结合,形成铬酸盐或重铬酸盐离子。在植物中,它比铬更容易迁移到地上部分3 +由于其水溶性、穿透复杂生理屏障的能力和转化能力。自然存在的铬最常见的形式是铬3 +,与土壤环境中的有机物混合,基本上无害。它以铬氧化物(Cr2O3.)、氢氧化物(Cr (OH3.)或硫酸盐(Cr2(所以4)3.点(H2O)。Cr3 +对细胞壁的阳离子交换位点具有较高的亲和力,因此不太可能在植物组织中大量移动37.
与土壤中12.2 mg/kg的Pb相比,根和茎的Pb积累浓度分别为2.5和2.3 mg/kg(图2)。2).虽然铅确实会转移到植物的地上部分,但一些研究发现它优先在根中积累38,39.由于上面提到的许多因素,金属在植物中向空中部分的转运在一些物种中受到限制,包括铅。铅的另一个限制因素是所涉及的复杂的运输机制。当金属通过水流利用外质体进入根并进入内皮层区域时,调节就开始了。在迁移过程中,细胞壁中带负电荷的分子如果胶可以固定Pb离子;其他是质膜堆积或铅不溶盐沉淀。更令人信服的事实是,由于Pb可能被Casparian带困在内胚层中,它可以诉诸于共生转运,通过这种转运,大部分分离的Pb被排出体外38.另一方面,Cu和Ni表现出相似的富集模式。相对于土壤,它们分别积累了更高的组织浓度(图2)。2).此外,这两种物质向茎部转移的浓度甚至高于土壤,这表明t . qataransephytoextraction潜力。在本研究中报道的所有金属中,Ni表现出较高的富集t . qataranse在根和茎部的浓度分别为63.3和17.4 mg/kg(图2)。2).虽然Ni以多种形式存在,但在自然环境条件下,Ni通常以氧化态N的形式存在2 +.例如,与Cd和Pb不同,它具有高度的流动性,因此很容易从土壤转移到根部或穿过其他组织部位。Ni在植物中的积累和运输,Amari,等.40注意到在一些研究中,许多植物都表现出了吸收镍的能力2 +特别是在碱性pH值为8及以上的情况下。植物吸收金属的另一个重要因素是土壤有机质。有趣的是,植物根系影响土壤有机质,进而决定了它如何影响周围金属的流动性。在最近的一项研究中,等.41植物根际Ni、Cu有效性与植物根际有机质含量呈正相关。铜是植物生长发育所必需的元素。然而,当浓度超过20毫克/公斤时,它可能是有毒的41.同样的研究发现p .季,t被而且p . virgatum铜的积累浓度分别为55.8、41.8和29.4 mg/kg。Cd在土壤中的浓度最低,为0.2 mg/kg(图2)。2).然而,t . qataranse根系和地上部Cd积累量高于土壤,分别为0.4和0.5 mg/kg。虽然这里没有提到,但铁和锌是已知的两种对Cd吸收有不利影响的元素42.Zn通过与根部质膜上的一种普通转运蛋白分子具有较高的亲和力来抑制Cd的吸收43.在这两个t . qataranseCd的浓度高于土壤(图2)。2).对此的一种解释可能是铁或锌不足以抑制Cd的吸收,或者它们的抑制作用被其他存在的金属抑制了。同样重要的是土壤pH值,它是影响土壤中金属生物有效性的最关键因素之一。许多研究表明,随着pH值的增加,土壤中Cd的生物有效性降低44,45.Ras Laffan的土壤呈碱性,pH值为8.05±0.12,这可能是土壤中低生物有效性Cd的原因。事实上,柯克汉姆回顾了几项研究46表明pH值高于7.0会显著降低Cd的生物利用度。
土壤中金属浓度的相关性分析t . qataranse根部和地上部均与土壤Ni含量呈显著正相关(r= 0.96,p< 0.05)1),表明根容易累积Ni。土壤和茎叶对Ba (r=−0.98,p< 0.05), Pb浓度(r=−1.00,p< 0.05)。中金属浓度的相关性同样显著t . qataranse根和芽也存在(表2).根中Pb浓度与梢部Ni浓度呈显著正相关(r= 0.98,p< 0.05)。反之,相似但负相关系数(r=−0.98,p根中Ba浓度与Ni梢浓度之间存在< 0.05)。众所周知,某些元素,如Cu2 +对植物代谢过程必不可少,但过量时有毒;然而,与Cd和Pb等非必需元素相比,它的毒性更小47.土壤中铜含量与土壤中铜含量无相关性t . qataranse.根系Cu浓度与地上部Ba浓度呈极显著负相关(r=−1.00,p< 0.05)。根中的Cr浓度和Cu (r=−0.99,p< 0.05), Cd (r=−1.00,p< 0.05)。BCF值表明,根部积累的金属(Cr、Cu和Ni)比茎部(Cd)多(图2)。3).这些金属的易位因子(图。3 b)表明,只有Cd被转移到芽中。事实上,许多植物都以减少对地上部分的金属吸收而闻名,这些金属优先积聚在根部39.BCF和TF表明了这一点t . qataranse耐Cd、Cr、Cu、Ni。
检查我们的FTIR结果,土壤控制(SoC)在3395.28 cm处显示了一个带−1,在3370.51 cm处高于土壤处理(SoT)−1(无花果。4).根系控制(RoC)在3359.91 cm处也有相似的趋势−1移到3285.94厘米−1根治(RoT)(图。4 b),高3331.15厘米−1生枝控制(ShC)至3294.87 cm−1进行笋处理(ShT)(图;4摄氏度),最后,RoC为3294.87 cm−1RoT cm减少到3285.94−1(无花果。4 d).这些带移是由Cd引起的2 +、铬2 +、铜2 +,或Ni2 +金属氧与羟基的阳离子相互作用。D’索萨,等.48注意到类似的趋势p . tetrastromatica在熊猫实验中观察到类似的模式,等.24吸附Cd和Nil .巨大成功并得出这种结合作用是在酰胺基和Ni之间2 +通过氮原子。与Al-Ghouti事件一致,等.49, RoT的带移相对较大,从1622.12 cm到1615.61 cm−1RoC(图;4 b)是由于Cu2 +与木质纤维素物质结合t . qataranse根生物量。SoC的波段强度在1015.02处急剧下降至986.47 cm−1对于SoT(图;4), RoC值为1076.48 ~ 1030.23 cm−1对于RoT(图。4 b)和ShC(1075.25至1030.23 cm)−1对于ShT(图;4摄氏度).然而,强度从1031.84厘米下降到1031.24厘米−1对于RoT和ShT(图。4 d)被观察到。两者都表明这种转变可以归因于包括Cu在内的强金属结合2 +、Cd2 +或镍2 +50.最后,与ShT相比,RoT的带强一致降低(图。4 d), FTIR进一步证实了我们的ICP-OES结果(图。2),t . qataranse在根部吸收更多的金属(Cr、Cu和Ni), Cd进一步转移到嫩枝。
FTIR结果表明,与酰胺、羟基、磷酸盐和羧基存在结合作用。去除重金属的机制主要是通过植物表面的羧基进行离子交换。对于过渡金属,如Cd, Cr, Cu和Ni,主要通过氨基糖与植物生物量相互作用24.这些站点主要是针对H的+, Na+K+、钙2 +、镁2 +和菲+阳离子。但是,在Cd等金属的存在下2 +、铬3 +、铜2 +和倪2 +金属之间有替代的趋势51.组织特异性金属积聚的示意图t . qataranse如图所示。5.不同植物组织对特定金属离子的亲和力取决于可用的结合位点52.许多植物都以减少金属吸收到空气部件而闻名39.根在植物生长发育中起着至关重要的作用,因此决定着其他组织的反应53.在土壤中的重金属胁迫下,根系组织首先遭受暴露。植物细胞壁有一种交换机制,可以固定重金属离子,从而限制向其他组织的传输8.根据皮尔逊分类,Cr、Cu和Ni处于可极化和非极化金属的边缘,而Cd属于可极化或软类54.Cd的转运可能是由于其柔软的阳离子性质。它更有可能与类似的供体形成稳定的配合物,软配体,如氨基和巯基。而Cr、Cu和Ni对根的亲和性是由于它们与硬配体形成了更为稳定的络合物;羟基,羧酸,碳酸盐和磷酸基。考虑到Cd元素的性质和在植物体内的吸收机制,Cd具有良好的生物利用性,并能有效地从根部转运到其他部位。大量证据表明,它通过必需元素(Ca、Fe和Zn)吸收系统进入植物,甚至保护细胞Ca2 +通道对Cd是可渗透的2 +55.道尔顿,等.56参考Cd2 +作为“投机取巧的搭便车者。”
因此,金属与t . qataranse生物量由羧基和氨基组成。木质素、纤维素和蛋白质结构部分的改变导致植物的生长模式、光合活性和抗氧化系统发生变化24,57.事实上,一些研究报告了这些金属(Cd、Cr、Cu、Ni和Pb)的单一和联合效应。58,59,60,61光合活性,脯氨酸含量和可溶性糖。其他增加的活动,总谷胱甘肽,抗坏血酸,过氧化物酶,超氧化物歧化酶和过氧化氢酶在植物物种,包括芥菜,倒卵花,芥菜,芝麻菜.因此,t . qataranse对Ba、Cd、Cr、Cu、Ni和Pb的反应和生物积累模式,部分原因是由于金属的拮抗作用和抗氧化酶活性。
表中列出的其他金属性能3.有助于它们的结合行为和强度,这反过来影响植物生物量的吸附机制。水化离子半径决定水化效应,重要的是要注意,对于所有金属离子,水化半径大于晶体半径(表3.).通常,水化半径的增大表明阳离子水化能强。弱结合时,水化作用最主要,弱水化较大的离子优先聚集在界面上69.表格3.表明Ni2 +水化半径最小,Cd水化半径最大。虽然特定的机制可以控制吸附,但金属离子的结构和大小肯定会影响离子的迁移率,从而影响吸附机制。因此,考虑Cd的离子半径2 +、铬3 +、铜2 +和倪2 +和其他属性(表3.)时,它们的吸附方式可能已经进化。事实上,哈瓦里也有类似的观察等.53因此,假设Ni2 +易于迁移和吸附t . qataranse生物质。高电负性增加了金属离子的吸附能力。铜2 +具有相对较高的电负性(表3.).此外,考虑共价结合的参数,共价结合是晶体半径和电负性Cu的乘积2 +具有最高的值71.这些表明像Ni2 +与其他金属相比,铜含量较高2 +还易于吸附,具有较强的结合力t . qataranse生物质。
结论
在这项研究中,我们提供了一些重金属污染拉斯拉凡的证据,并进一步表明t . qataranse灌丛植物积累的Cd、Cr、Cu、Ni含量高于土壤。结果表明t . qataranse用植物萃取法修复Cd,用植物稳定法修复Ba、Cr、Cu、Ni和Pb。t . qataranse在干旱环境下动物可食用;它能够稳定根中的有毒金属,并限制向其他植物部位的转运,限制土壤运输,防止动物摄入,从而在食物链中传播。金属可以以比这里显示的更高的浓度积聚;因此,t . qataranse是一种适用于有毒金属植物稳定化的候选材料。然而,进一步研究这些(Cd、Cr、Cu和Ni)的单独和联合作用将进一步深入了解植物的植物萃取潜力,这是一种更有效的植物修复形式。
材料与方法
研究地点
研究地点(25°50′30.43″N 51°34′34.31″E)位于著名的Ras Laffan工业区,位于卡塔尔多哈市中心以北约80公里处。以低海拔和沙质土壤为特点,是最大的液化天然气和气转液生产基地。除了现有的石油和天然气炼油厂,拉斯拉凡还有三个发电厂和海水淡化厂。它拥有最大的人工港口,封闭水域面积约4500公顷。卡塔尔大学生物与环境科学系(25°22′21.60″N 51°29′45.28″E)是FTIR结果比较的对照点。为保护区,土壤致密。它支持更多的水分和有机物。植被类型包括灌木乔木、草和草本植物,其中包括金合欢spp.,茱萸属植物,藤条草、藤条草和沙柳.该站点仅作为比较FTIR数据的对照。土壤中的六种金属t . qataranseICP-OES分析结果显示对照区样品均低于检出限。
土壤pH值、电导率(EC)和总有机碳(TOC)
土壤理化参数确定如下:土壤pH值使用便携式数字pH计(梅特勒托莱多FE20 ATC)。为了确定土壤中可溶性盐的总浓度,还测量了电导率(EC),单位为dS m−1使用感应电磁设备(梅特勒-托莱多S230 SevenCompact)62.总有机碳(TOC)是由Walkley估算的63.所有样品的分析都是一式两份,并报告平均值。
总有机碳用TOC分析仪测量,TOC分析仪配备固体样品模块,工作温度为900°C (Shimadzu 5050 a与SSM-5000A;岛津,京都,日本)。分析是根据iso10694 (ISO, 1995)进行的。样品数量在0.5 - 1g之间,可测量范围为0.1 - 30mg OC。每个样本分析两份,并报告平均值。
样品采集和实验室处理
使用铲子和/或螺旋钻,每隔4米以网格状模式进行采样;由整株植物和根际土壤组成,距地表约20厘米深。之后,样品在塑料袋中进行酸处理,运到实验室进行重金属预分析处理。风干的土壤粉碎成更小的颗粒,以及可见的植物材料,如根和用镊子去除的残留物。在消化之前,每个样品都用玛瑙臼和杵研磨成细粉。用自来水冲洗植物样品,去除多余的土壤,特别是根部的土壤。用0.01% HCl酸洗,用去离子水彻底冲洗64.在灭菌后,将植物样品分成两部分;芽(地上生物量)和根(地下生物量)。组织样品在室温下风干48小时,然后在80°C烤箱温度下风干48 - 72小时。然后分别用机械不锈钢研磨机和木制研钵和研杵将干燥的根和芽部分研磨成粉末。对于土壤和植物组织样品,通过使用0.25 mm直径的筛网器进行筛分,获得了优良的粉状样品起始材料。
硝酸消化
样品用硝酸(HNO3.)和过氧化氢(H2O2)或氟化氢(HF)分别用于植物组织和土壤。容量大环境表达SC154 HotBlock®根据美国环境保护署(EPA)的方法3050,将消化系统作为交替温度65.在消化之前,所有的容器和玻璃器皿都经过酸洗和水冲洗。使用分析称量秤将样品称量到植物组织(根和茎)约0.5 g,土壤样品约0.25 g,步骤如下。土壤:将约9 mL 65%硝酸添加到每个含有消化容器的样品中,轻轻旋转并置于95°C的Hotblock系统中30分钟。30分钟后,当样品仍在Hotblock消化器上时,加入3 mL HF,并在95°C下进一步消化30分钟。之后,温度上升到135°C,持续1小时,然后上升到155°C,使样品蒸发到几乎干燥。随后,大约3ml HNO3.然后加入40毫升去离子水,煮沸至清澈。明确的溶液定量转移到一个150毫升的容量瓶。冷却后,所有样品用去离子水制成最终体积。植物组织:根、梢样品消化如下;10ml 65% HNO3.2 mL 30% H2O2加入,轻轻旋转,然后放入HotBlock消化系统。在95°C - 135°C的交替温度下加热样品直到澄清。冷却后,将清溶液定量转移到100ml容量瓶中,用去离子水使其达到最终体积。
重金属分析
硝酸消解后,直接注入电感耦合等离子体发射光谱法(ICP-OES)分析样品。六种重金属(Ba、Pb、Ni、Cu、Cd和Cr)的浓度与美国国家标准与技术研究所(NIST)多元素标准参考物质(SRM’s)进行了定量;土壤2709a,苹果叶1515。选择这些金属是因为它们的公共健康风险,而且文献中记录了在卡塔尔环境中存在的证据。对在Ras Laffan收集的样品进行了金属分析,并进行了FTIR分析,土壤和t . qataranse从卡塔尔大学收集的作为对照的样品也用ICP-OES进行了分析。
傅里叶变换红外光谱(FTIR)
FTIR分析根据Naumann进行,等.66.土壤和t . qataranse从Ras Laffan采集的组织是处理,而土壤和t . qataranse从卡塔尔大学收集的组织(研究金属低于检测限的区域)是对照组。采用FTS-135 (Bio-Rad)光谱仪对分散在干KBr球团中的样品进行分析;在400-4000 Cm范围内记录光谱数据−1的范围内。对处理和对照组分别分配如下代码;土壤处理(SoT);根治(RoT);笋处理(ShT);土壤治理;根控(RoC)和梢控(ShC)。
统计分析
采用Sigma Plot 13软件进行单因素方差分析(ANOVA)和最小显著性差异检验(least-significant-difference test),评价统计学意义。考虑统计学意义P< 0.05。相关系数(r)采用Pearson回归方程在两个水平(i)土壤中金属浓度与不同植物部位(根和梢)之间,以及(ii)根和梢中金属浓度之间进行计算。
生物浓缩因子(BCF)计算方法为重金属在各植物组织中积累与土壤介质中溶解的比值,如下图所示。
用上述公式计算检测重金属的转运因子(TF)67.
参考文献
亚西,B. T.和Al-Thani, R. F.野生植物的生态生理学和保护前景在卡塔尔国农业化学(eds Stoytcheva, M. & Zlatev, R. 978-953-51-1026-2 (InTech Open, 2013)。
长谷川,H.,拉赫曼,i.m.m. &拉赫曼,m.a.。金属污染土壤的环境修复技术.(施普林格,2016)。
杨晓霞,杨晓华,杨晓华,杨晓华,杨晓华,杨晓华。植物生长促进菌辅助植物修复重金属的研究进展。环绕。Exp。机器人。117, 28-40(2015)。
彭斯,n.s.。等.Zn/Cd超蓄能器中重金属转运的分子生理学研究菥caerulescens.美国国家科学院院刊97, 4956-4960(2000)。
夏尔玛,s.s. &迪茨,k - j。氨基酸及其衍生分子在植物对重金属胁迫的响应和适应中的意义。J. Exp. Bot。57, 711-726(2006)。
胡,R。等.两种嗜旱植物对铅的生理反应及耐受机制:猪毛菜passerinaBunge和藜lj .风险。板牙。205, 131-138(2012)。
布兰奎尼奥,C.布朗,D. H. & Catarino, F.地衣中Cu的细胞定位及其对膜完整性和叶绿素荧光的影响。环绕。Exp。机器人。38, 165-179(1997)。
艾伦,D. L. & Jarrell, W. M.质子和铜吸附玉米和大豆根细胞壁。植物杂志。89, 823-832(1989)。
尹俊,曹晓霞,周青,马立强。佛罗里达污染地区原生植物铅、铜、锌的积累。科学。总环境。368, 456-464(2006)。
格里菲思,P. R. &德。哈思,J. A。傅里叶变换红外光谱法.第171卷(约翰·威利父子,2007年)。
杰克逊,M. & Mantsch,红外光谱学,体外组织分析用。分析化学百科全书(2000)。
彭,Y。等.利用遥感和辅助数据绘制卡塔尔土壤中有毒金属的数字地图。远程Sens8, 1003(2016)。
应用波兰天然矿物吸附剂(白云石、高岭土、玉髓土)辅助植物稳定重金属污染土壤的研究。系列163, 123-129(2018)。
Touceda-Gonzalez, M。等.辅助植物稳定处理降低了富铜尾矿中的金属毒性,改善了土壤肥力,提高了微生物活性。j .包围。管理。186, 301-313(2017)。
阿勒萨尼,R。卡塔尔国的盐生植物.环境研究中心。卡塔尔大学,多哈,卡塔尔2007)。
Baker, A. J., Ernst, W. H., van der Ent, A., Malaisse, F. & Ginocchio, R.金属植物:独特的生物资源及其在欧洲、中非和拉丁美洲的生态和保护地位。工业污染生态学, 7-40(2010)。
乌斯曼,K, Al-Ghouti, M. A. & Abu-Dieyeh, M.利用卡塔尔植物群对重金属进行植物修复。QScience诉讼2016, 37(2016)。
潘迪,V. C. &辛格,N.粉煤灰掺入土壤系统的影响。阿格利司。,Ecosyst. Environ.136, 16-27(2010)。
乌斯曼,K. Al-Ghouti, M. A. & Abu-Dieyeh . M. H.植物修复:盐生植物作为有前途的重金属超富集物重金属(ed. Saleh, h.m.), 10.5772 (InTech Open, 2018)。
陈,Z。等.铁路沿线石坡人工土壤中重金属化学组分的分布及植物有效性j .风险。板牙。273, 165-173(2014)。
Maiti, S. K. & Nandhini, S.飞灰中金属的生物利用度及其在自然植被中的生物积累:中试规模研究。环绕。Monit。评估。116, 263-273(2006)。
Morikawa, H., Tanizawa, K. & Senda, M. Nitella细胞壁的红外光谱及细胞壁中羧酸离子的取向。阿格利司。医学杂志。化学。38, 343-348(1974)。
戴,Q。等.干污泥热解过程中粒径对多环芳烃形成的影响研究:热重红外光谱分析和批量规模研究。j .肛门。达成。热解112, 388-393(2015)。
潘达,李志强,李志强,李志强。镍在植物壳上的吸附研究Lathyrus巨大成功:行为和绑定机制。胶体冲浪。b . Biointerfaces57, 135-142(2007)。
杜马斯,P. &米勒,L.同步辐射红外微光谱技术在生物学和生物医学研究中的应用。振动器Spectrosc32, 3-21(2003)。
沃克斯,W. F.,奥利弗,A. E.,塔布林,F. & Crowe, J. H.糖玻璃的傅里叶变换红外光谱研究。Carbohydr。Res。339, 1077-1085(2004)。
科学。代表.8(2018)。
沙尔玛,潘迪。植物修复在世界情景中的现状。Int。j .包围。Bioremed。Biodegrad。2, 178-191(2014)。
da Conceição Gomes, m.a., haser - davis, r.a., de Souza, a.n. & Vitória, a.p.金属植物修复:一般策略,转基因植物及其在金属纳米颗粒污染中的应用。Ecotoxicol。环绕。Saf。134, 133-147(2016)。
曾,F。等.水稻土pH值和有机质含量对重金属有效性及水稻植株吸收的影响环绕。Pollut。159, 84-91(2011)。
Maiti, S. K. & Jaiswal, S.在粉煤灰泻湖上生长的自然植被中金属的生物积累和转运:来自印度西孟加拉邦Santaldih热电厂的实地研究。环绕。Monit。评估。136, 355-370(2008)。
阿布-戴耶,M. H.,乌斯曼,K.,阿尔杜鲁比,H. & Al-Ghouti, M. In .环境中的重金属(CRC出版社,2018)。
Kowalska, J。等.重金属污染废弃地再生利用植物的研究——一种新型的钡富集剂?波尔。j .包围。螺柱.21(2012)。
Kamachi, H., Kitamura, N., Sakatoku, A., Tanaka, D. & Nakamura, S.。钡金属蕨类植物的积累Athyrium yokoscense.定理。植物物理学。27, 99-107(2015)。
德卡斯特罗里贝罗,中华人民共和国。等.钡污染水淹土壤修复植物的选择。光化层206, 522-530(2018)。
扎耶德,李特尔,钱志明,钱俊华。铬在蔬菜作物中的积累、转运和化学形态。足底206, 293-299(1998)。
辛哈,V. Pakshirajan, K. & Chaturvedi, R.植物对铬的耐受性、生物积累和定位:综述。j .包围。管理。206, 715-730(2018)。
Kushwaha, A., Hans, N., Kumar, S. & Rani, R.土壤-微生物植物系统中铅的形态形成、动员和毒性及生物修复策略的重要综述。Ecotoxicol。环绕。Saf。147, 1035-1045(2018)。
Pourrut, B, Shahid, M, Dumat, C, Winterton, P. & Pinelli, E. In《环境污染与毒理学评论》第213卷113-136(施普林格,2011)。
Amari, T, Ghnaya, T. & Abdelly, C.镍,镉和铅的植物毒性和盐生植物在重金属提取中的潜力。美国的误判率。j .机器人。111, 99-110(2017)。
阮晓涛,李志强,李志强。植物根系对污染土壤中镍、铜、银生物利用度的差异影响。光化层168, 131-138(2017)。
李志刚,李志刚,李志刚,李志刚。锌对不同镉浓度硬粒小麦近等基因系镉积累和分配的影响。新植醇。167, 391-401(2005)。
杨,X。等.一种新型超富集锌植物的耐镉性和超富集特性(景天属植物alfredii拱腰)。植物的土壤259, 181-189(2004)。
Adams, M.,赵,F., McGrath, S., Nicholson, F. & Chambers, B.利用土壤特性预测小麦和大麦籽粒中的镉浓度。j .包围。战。33, 532-541(2004)。
杜杜雷努,L. &菲利普斯,C. J.镉积累在玉米,黑麦草和大豆植物的经验模型。j .科学。阿格利司食物。84, 845-852(2004)。
污染土壤上植物中的镉:土壤因子、超积累和修正的影响。Geoderma137, 19-32(2006)。
kuera, T. Horáková, H. & Šonská, A.光自养生物中的有毒金属离子。Photosynthetica46, 481-489(2008)。
D’souza, L., Devi, P., Divya Shridhar, M. & Naik, C. G.使用傅里叶变换红外(FTIR)光谱研究镉诱导的变化扇藻tetrastromatica(豪克)。分析的化学。的见解3., 117739010800300001(2008)。
Al-Ghouti, m.a。等.枣坑固体吸附剂去除水中重金属和染料的吸附机理。j .风险。板牙。176, 510-520(2010)。
盛,P. X.,廷,y . P.。,Chen, J. P. & Hong, L. Sorption of lead, copper, cadmium, zinc, and nickel by marine algal biomass: characterization of biosorptive capacity and investigation of mechanisms.胶体界面科学。275, 131-141(2004)。
施耐德,i.a.,卢比奥,J. &史密斯,R. W.金属在植物生物量上的生物吸附:交换吸附还是表面沉淀?Int。j .矿工。的过程。62, 111-120(2001)。
哈瓦里,A. H. &穆里根,C. N.铅的存在对厌氧生物质对铜,镉和镍的生物吸附的影响。学生物化学过程。42, 1546-1552(2007)。
Biernacki, M. & Lovett‐Doust, J.由南瓜虫引起的西瓜生长和繁殖的发育转变。新植醇。155, 265-273(2002)。
森古普塔说。重金属的环境分离:工程过程.(CRC出版社,2001)。
Perfus‐Barbeoch, L., Leonhardt, N., Vavasseur, A. & Forestier, C.重金属毒性:镉通过钙通道渗透并扰乱植物水分状态。植物J。32, 539-548(2002)。
道尔顿,t.p.。等.小鼠SLC39A8作为镉诱导睾丸毒性的转运体的鉴定。Proc。国家的。学会科学。美国102, 3401-3406(2005)。
Kumar, R., Sharma, R. K. & Singh, A. P.基于纤维素的接枝生物吸附剂-从木质纤维素生物质到有毒金属离子吸附应用的旅程-综述。J. Mol. Liq。232, 62-93(2017)。
Israr, M., Jewell, A., Kumar, D. & Sahi, S. V.铅、铜、镍和锌对生长、金属吸收和抗氧化代谢的相互作用田菁属drummondii.j .风险。板牙。186, 1520-1526(2011)。
沈,X。等.单一、二元和三元微量金属(铅、锌和铜)对动物生理反应的相互作用Kandelia obovata幼苗。环绕。Geochem。健康, 1-14(2018)。
Kutrowska,。等.二元金属组合对锌、铜、镉、铅吸收和分布的影响芸苔属植物juncea.J. Trace Elem。地中海,杂志。44, 32-39(2017)。
Rizwan, M。等.镍胁迫对水稻镍亚细胞分布、抗氧化生产和渗透物积累的响应。环绕。科学。Pollut。R24, 20587-20598(2017)。
Rhoades, J. & Corwin, D.使用感应式电磁土壤电导率仪确定土壤电导率-深度关系土壤科学。Soc。点。J。45, 255-260(1981)。
对土壤中有机碳快速测定方法的严格检验——消化条件和无机土壤成分变化的影响。土壤科学。63, 251-264(1947)。
刘志刚,张志刚,张志刚。干旱胁迫对高聚镍灌丛的影响Hybanthus floribundus(采用)。f . Muell。无性系种群。floribundus。Int。植物科学。172, 315-322(2011)。
Edgell, K。USEPA方法研究37 SW-846方法3050酸消化沉积物,污泥和土壤.(美国环境保护署,环境监测系统实验室,1989)。
Naumann, D., Helm, D., Labischinski, H. & Giesbrecht, P.微生物的傅立叶变换红外光谱(FT-IR)表征。快速微生物分析的现代技术, 43-96(1991)。
Bose, S. & Bhattacharyya, A.在工业污泥改良的土壤中生长的小麦植物重金属积累。光化层70, 1264-1272(2008)。
罗素,j.b.g.c。普通化学.McGraw-Hilt New York, pp. 314 - 316,340 - 341(1980)。
迪恩,j.a.。兰格化学手册.McGraw-Hilt New York, pp.3.11-13.12, 17.476-477.477(1985)。
马库斯,Y. &克尔特斯,a.s.。金属配合物的离子交换和溶剂萃取.Wiley-Interscience,纽约,1969年;49 - 57.128(1969)。
配位化学中的自由能关系。3复杂稳定性的综合指标。可以。j .化学。51, 2512-2524(1973)。
确认
卡塔尔大学的学生补助金QUST-CAS-SPR-2017-33支持这项研究。作者还希望感谢卡塔尔大学环境研究中心(ESC)和中央实验室单位分别为ICP-OES和FTIR分析提供的支持。我们感谢Chaevien S. Clandinen博士对修改后的手稿进行批判性阅读和语言编辑。本文的出版由卡塔尔国家图书馆资助。
作者信息
作者及隶属关系
贡献
k.u., A.M.和M.A.设计了这个实验。K.U.和A.M.收集了现场样本。ku进行了分析并收到了数据集。k.u., A.M.和M.A.分析了数据。ku写了手稿。A.M.和M.A.修改了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意:施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
乌斯曼,K., Al-Ghouti, M.A., Abu-Dieyeh, M.H.灌木植物对镉、铬、铜和镍的耐受性和生物积累的评估Tetraena qataranse.Sci代表9, 5658(2019)。https://doi.org/10.1038/s41598-019-42029-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-019-42029-9
这篇文章被引用
工业大麻(Cannabis sativa L.)田间种植的植物衰减策略和纺织品生产纤维的增值潜力
环境科学与污染研究“,(2023)
使用三种水生生物吸附剂从水溶液中去除铅,重点讨论了影响因素
科学报告(2022)
克隆咖喱草缓解了番茄植株Cr(III)和Cr(VI)的毒性
科学报告(2022)
EDTA存在下basilicum对CdS/Te量子点的植物修复
环境健康科学与工程杂志(2022)
不同浓度镍(Ni)对黑草营养和生殖生长参数的影响。
Gesunde Pflanzen(2022)