摘要gydF4y2Ba
5-甲基胞嘧啶(5mC)双加氧酶TET家族通过修饰DNA甲基化在发育过程中起关键作用。利用CRISPR技术,我们灭活了H9人胚胎干细胞(hESCs)中的TET1基因。突变型H9 hESCs保持多能性,尽管羟甲基胞嘧啶(5hmC)水平下降到野生型细胞的30%。双SMAD抑制剂诱导的神经分化不受TET1活性丧失的显著影响。然而,在无形态因子的条件下,TET1缺乏显著减少了NESTIN的产生gydF4y2Ba+gydF4y2BaSOX1gydF4y2Ba+gydF4y2Ba神经外胚层细胞从野生型细胞的70%减少到突变型细胞的20%。与此同时,PAX6的表达水平降低了20倍,PAX6启动子上5hmC的数量也显著减少。在TET1缺陷hESCs中,TET1催化结构域的过表达显著增加了分化过程中5hmC水平和PAX6的表达。与这些一致gydF4y2Ba在体外gydF4y2Ba数据显示,在tet1缺失hESCs形成的畸胎瘤中,PAX6的表达显著降低。然而,TET1缺乏并不能阻止畸胎瘤中神经管样结构的形成。我们的研究结果表明,TET1缺乏会损害hESCs向神经外胚层分化的内在能力,可能是通过降低PAX6的表达来实现的,PAX6是人类神经外胚层发育的关键调节因子。gydF4y2Ba
介绍gydF4y2Ba
人类多能干细胞(hPSCs)包括人类胚胎干细胞(hESCs)的效用在于其无限自我更新的能力和分化为所有类型体细胞的潜力gydF4y2Ba1gydF4y2Ba包括细胞替代疗法在内的许多应用gydF4y2Ba2gydF4y2Ba。定向分化的人造血干细胞到一个特定的细胞类型的兴趣是一个表观遗传转化过程gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba。因此,了解人造血干细胞分化的表观遗传机制对于破译人类发育和改善不可获取的人类细胞类型的产生至关重要gydF4y2Ba在体外gydF4y2Ba。DNA甲基化是表观遗传学调控的主要机制之一gydF4y2Ba6克ydF4y2Ba,通过促进局部染色质状态的规范gydF4y2Ba7 gydF4y2Ba,调节基因表达gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba并配合组蛋白修饰gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba。5-甲基胞嘧啶(5mC)是哺乳动物DNA甲基化的主要成分gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba。5mC的活性去甲基化需要一系列的氧化反应,由10 - 11易位(TET)双加氧酶家族催化gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,将5-甲基胞嘧啶(5mC)依次氧化为5-羟甲基胞嘧啶(5hmC)。gydF4y2Ba15gydF4y2Ba5-甲酰基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC)gydF4y2Ba18gydF4y2Ba。后两种衍生物可被DNA修复系统识别并修复为胞嘧啶,从而通过这一过程将5mC功能性地恢复为CgydF4y2Ba19gydF4y2Ba。TET蛋白在调节DNA甲基化和细胞表观遗传状态中的关键作用刺激了对其在发育和疾病中许多重要细胞过程中的功能的深入研究gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。gydF4y2Ba
在TET家族的三个成员中,TET1在ESCs中含量最多gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba。一些研究已经产生了Tet1功能丧失的小鼠ESCsgydF4y2Ba22gydF4y2Ba,gydF4y2Ba24gydF4y2Ba或Tet1基因敲除小鼠gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba。然而,在这些研究中报告的表型有明显的变化,从未能保持多能性gydF4y2Ba在体外gydF4y2Ba24gydF4y2Ba在分化中扭曲谱系承诺gydF4y2Ba22gydF4y2Ba,早期胚胎致死率gydF4y2Ba26gydF4y2Ba或正常发育gydF4y2Ba25gydF4y2Ba海马神经发生受损gydF4y2Ba27gydF4y2Ba。高变异性表型可能与小鼠遗传背景和育种史有关gydF4y2Ba26gydF4y2Ba。小鼠表型冲突及人TET1在人成纤维细胞向神经元的表观遗传重编程中的重要作用gydF4y2Ba28gydF4y2Ba促使我们研究TET1在人类中丢失的后果。在本研究中,我们使用CRISPR/Cas9系统通过灭活TET1的催化活性来生成TET1缺陷的H9 hESCsgydF4y2Ba29gydF4y2Ba。缺乏tet1的hESCs维持多能性,但在无形态因子条件下向神经外胚层和神经元的分化受损。PAX6启动子上的5hmC水平显著降低,人类神经外胚层发育的关键调控因子PAX6的表达也显著降低gydF4y2Ba30.gydF4y2Ba。在TET1缺陷hESCs中,TET1催化结构域的过表达挽救了hESCs中5hmC水平的缺陷和分化过程中PAX6的表达。与此一致的是,来自tet1缺陷hESCs的畸胎瘤显示PAX6表达显著降低,但含有神经管样结构。该研究揭示了TET1在hESCs向神经外胚层和神经元分化过程中的关键功能。gydF4y2Ba
结果gydF4y2Ba
crispr介导的H9 hESCs中TET1失活gydF4y2Ba
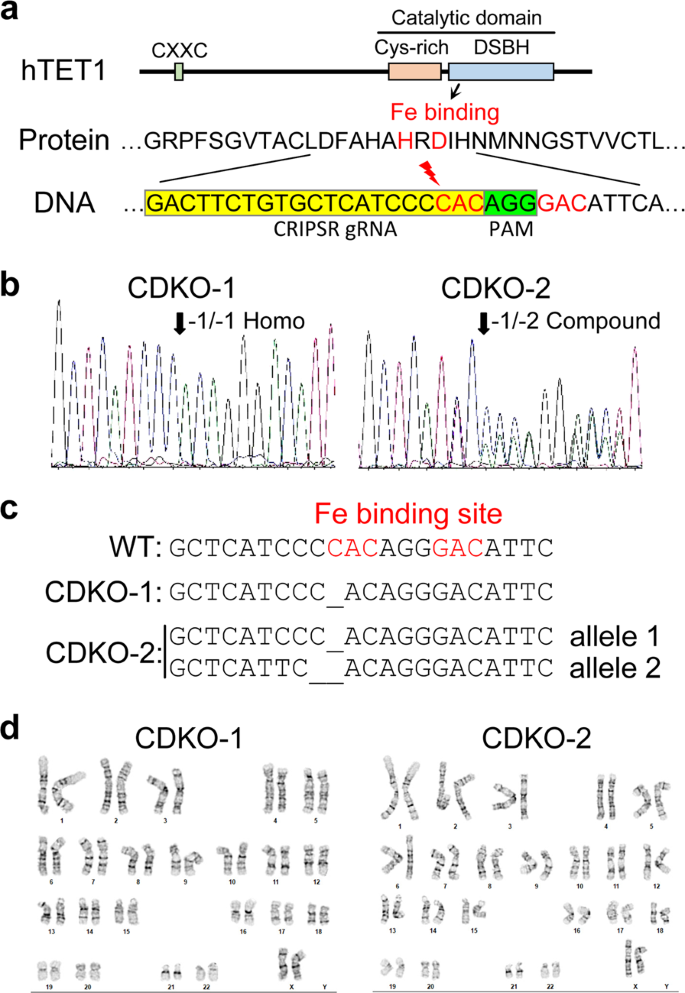
因为TET1的催化活性需要铁结合gydF4y2Ba15gydF4y2Ba,我们设计了一种引导RNA,在人类TET1催化结构域的第一个铁结合位点之前引入双链断裂(图2)。gydF4y2Ba1gydF4y2Ba)。CRISPR/ cas9介导的基因靶向H9 hESCs后,获得了两个独立的克隆,TET1的每个等位基因都有一个frame shift突变。一个克隆(CDKO-1)在TET1的每个等位基因的第一个铁结合位点上携带了1个碱基对(bp)的纯合缺失(图2)。gydF4y2Ba1 b, cgydF4y2Ba),产生一个帧移位突变,在下游24bp处产生一个停止密码子。另一个克隆(CDKO-2)在TET1的一个等位基因上缺失1bp,在另一个等位基因上缺失2bp(图2)。gydF4y2Ba1 b, cgydF4y2Ba),分别在下游24 bp和20 bp处产生停止密码子。两系突变H9 hESCs核型正常(图2)。gydF4y2Ba1 dgydF4y2Ba)。gydF4y2Ba
H9 hESCs中TET1催化结构域的crispr介导突变。(gydF4y2Ba一个gydF4y2Ba)通过CRISPR/Cas9在第一个铁结合位点前引入双链断裂,诱导TET1基因的非同源末端连接。(gydF4y2BabgydF4y2Ba)从两个hESC克隆(CDKO-1和CDKO-2)的基因组DNA中扩增的PCR产物测序痕迹显示,每个克隆的两个等位基因都有帧移位突变。(gydF4y2BacgydF4y2Ba)克隆PCR产物测序显示CDKO-1克隆纯合缺失1 bp, CDKO-2克隆复合杂合缺失1 bp和2 bp。移码突变破坏铁结合位点和下游催化结构域。(gydF4y2BadgydF4y2Ba)两个TET1突变克隆的核型正常。gydF4y2Ba
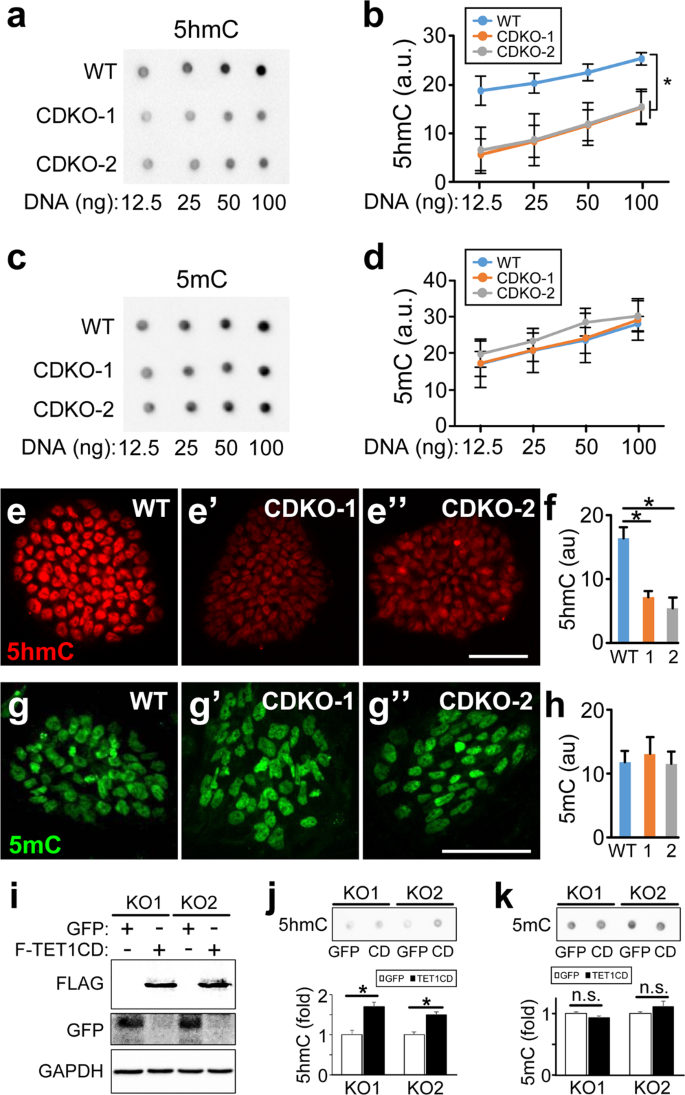
为了研究TET1突变对DNA甲基化和羟甲基化的影响,我们对野生型(WT)和两种H9突变系的基因组DNA进行了点印迹分析,并对5-羟甲基胞嘧啶(5hmC)和5-甲基胞嘧啶(5mC)抗体进行了检测。在两个突变系中,5hmC水平显著降低,约为野生型H9水平的30%(图2)。gydF4y2Ba2 a, bgydF4y2Ba(CDKO-1为30%±7%,CDKO-2为34%±10%,由含有12.5 ng DNA的点的强度计算)。这种减少比在Tet1缺陷小鼠ESCs中观察到的更严重,其中60%的5hmC仍然存在gydF4y2Ba22gydF4y2Ba,gydF4y2Ba25gydF4y2Ba。H9 hESCs中TET1突变未引起5mC水平的显著变化(图2)。gydF4y2Ba2 c, dgydF4y2Ba),这与之前关于缺乏Tet1的mESCs的研究一致gydF4y2Ba25gydF4y2Ba。在人类多能干细胞中,5mC占总胞嘧啶的8%,而5hmC仅占总胞嘧啶的0.12%gydF4y2Ba31gydF4y2Ba。因此,即使5hmC水平显著降低,也可能不会导致其前体5mC数量的显著变化。免疫染色证实5hmC水平显著降低(图2)。gydF4y2Ba2 e, fgydF4y2Ba)和不变的5mC水平(图2)。gydF4y2Ba2 g hgydF4y2Ba)在两个TET1突变系中,与野生型H9 hESCs相比。gydF4y2Ba
tet1缺陷hESCs中5hmC水平降低。(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)点吸(gydF4y2Ba一个gydF4y2Ba)及量化(gydF4y2BabgydF4y2Ba)在WT和tet1缺陷hESCs中表达5hmC。gydF4y2Ba*gydF4y2BapgydF4y2Ba< 0.001,对学生的gydF4y2BatgydF4y2Ba-test, n = 3。(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)点吸(gydF4y2BacgydF4y2Ba),并在WT和tet1缺陷hESCs中定量检测5mC。未经任何影像处理的圆点印迹的完整图像显示于(gydF4y2Ba一个gydF4y2Ba)及(gydF4y2BacgydF4y2Ba)。(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba) 5hmc染色(gydF4y2BaegydF4y2Ba-gydF4y2Bae”gydF4y2Ba)及量化(gydF4y2BafgydF4y2Ba)在WT (gydF4y2BaegydF4y2Ba)和tet1缺陷(e '和e ") hESCs。*gydF4y2BapgydF4y2Ba< 0.001,学生gydF4y2BatgydF4y2Ba-test, n = 5。(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba) 5mC染色(gydF4y2Bag-g”gydF4y2Ba)及量化(gydF4y2BahgydF4y2Ba)在WT (gydF4y2BaggydF4y2Ba)和tet1缺乏(gydF4y2Bag’gydF4y2Bag”gydF4y2Ba)为。比例尺,100µm。(gydF4y2Ba我gydF4y2Ba,-gydF4y2BakgydF4y2Ba)用表达GFP或flag标记TET1催化结构域(F-TET1CD)的慢病毒感染TET1突变体hESC系KO1和KO2。总细胞裂解液用指定抗体(gydF4y2Ba我gydF4y2Ba)。从这些细胞中分离的基因组DNA用抗5hmC (gydF4y2BajgydF4y2Ba)或5mC (gydF4y2BakgydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.05,对学生的gydF4y2BatgydF4y2Ba-test, n = 4。gydF4y2Ba
TET1催化5mC氧化为5hmC的能力取决于催化结构域(CD)。gydF4y2Ba15gydF4y2Ba。TET1是一个具有13个外显子的大基因,编码2136个氨基酸的蛋白质。因此,我们通过突变催化结构域使TET1失活。为了测试TET1的催化活性是否对我们观察到的表型有重要意义,我们使用慢病毒在两个TET1突变hESC系(CDKO1和CDKO2)中过表达flag标记的TET1催化结构域(FLAG-TET1CD)。FLAG-TET1CD过表达(图。gydF4y2Ba2我gydF4y2Ba)显著增加了两个突变hESC系的5hmC水平(图2)。gydF4y2Ba2 jgydF4y2Ba),而不会显著改变5mC水平(图2)。gydF4y2Ba2 kgydF4y2Ba)。gydF4y2Ba
TET1缺乏不影响hESCs的自发分化gydF4y2Ba
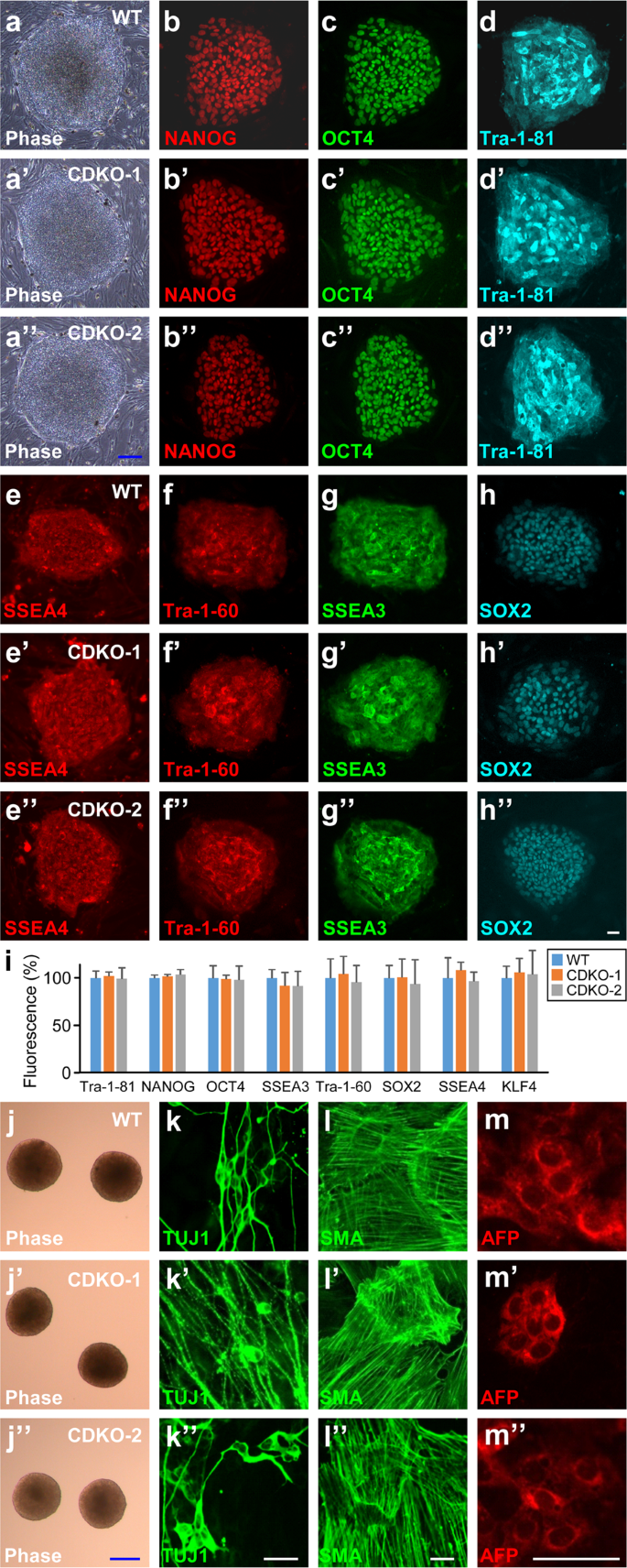
缺乏tet1的hESCs表现出正常的启动状态,如野生型H9细胞(图2)。gydF4y2Ba3一gydF4y2Ba”)并表达多能性标记,如NANOG(图2)。gydF4y2Ba3 bgydF4y2Ba), OCT4(图4)。gydF4y2Ba3碳碳gydF4y2Ba), Tra-1-81(图。gydF4y2Ba3 d dgydF4y2Ba”),SSEA4(图。gydF4y2Ba3 egydF4y2Ba”),Tra-1-60(图。gydF4y2Ba3 fgydF4y2Ba), SSEA3(图。gydF4y2Ba3 g-ggydF4y2Ba)和SOX2(图2)。gydF4y2Ba3高度差gydF4y2Ba),其程度与H9相似,荧光强度的定量显示(图2)。gydF4y2Ba3我gydF4y2Ba)。缺乏tet1的hESCs在无bFGF的悬浮培养中形成了形态正常的胚状体(EBs)。gydF4y2Ba3 j jgydF4y2Ba”)。在含血清培养基中的自发分化中,缺乏tet1的EBs产生了所有三个胚层的细胞,如TUJ1gydF4y2Ba+gydF4y2Ba外胚层细胞(图2)gydF4y2Ba3 k次方gydF4y2Ba”),SMAgydF4y2Ba+gydF4y2Ba中胚层细胞(图2)gydF4y2Ba3 l-lgydF4y2Ba”)及法新社gydF4y2Ba+gydF4y2Ba内胚层细胞(图2)gydF4y2Ba3 mmgydF4y2Ba),和野生型H9一样有效。gydF4y2Ba
tet1缺陷hESCs维持多能性。(gydF4y2Ba-ⅰgydF4y2Ba)相衬图像(gydF4y2Ba一个gydF4y2Ba-gydF4y2Ba一个gydF4y2Ba”)和指示多能性标记物的免疫染色(gydF4y2BabgydF4y2Ba-gydF4y2Bah”gydF4y2Ba)野生型(gydF4y2Baa -gydF4y2Ba)或tet1缺乏(gydF4y2Ba一个- h”gydF4y2BaH9 hESCs。每种条件下至少从五个独立菌落中定量荧光强度,并根据WT (gydF4y2Ba我gydF4y2Ba)。(gydF4y2Baj-m”gydF4y2Ba)野生型(gydF4y2Baj-mgydF4y2Ba)或tet1缺乏(gydF4y2Baj 'gydF4y2Ba-gydF4y2Ba米gydF4y2Ba”gydF4y2Ba) H9 hESCs在含血清培养基中通过胚状体自发分化(gydF4y2Baj j”gydF4y2Ba外胚层标记TUJ1 (gydF4y2BakgydF4y2Ba-gydF4y2Bak”gydF4y2Ba)、中胚层标记物SMA (gydF4y2BalgydF4y2Ba-gydF4y2Bal”gydF4y2Ba)和内胚层标志物AFP (gydF4y2Ba米gydF4y2Ba-gydF4y2Bam”gydF4y2Ba)。蓝条,100µm;白色条,25µm。gydF4y2Ba
TET1缺乏并不影响SMAD抑制剂诱导的定向神经分化gydF4y2Ba
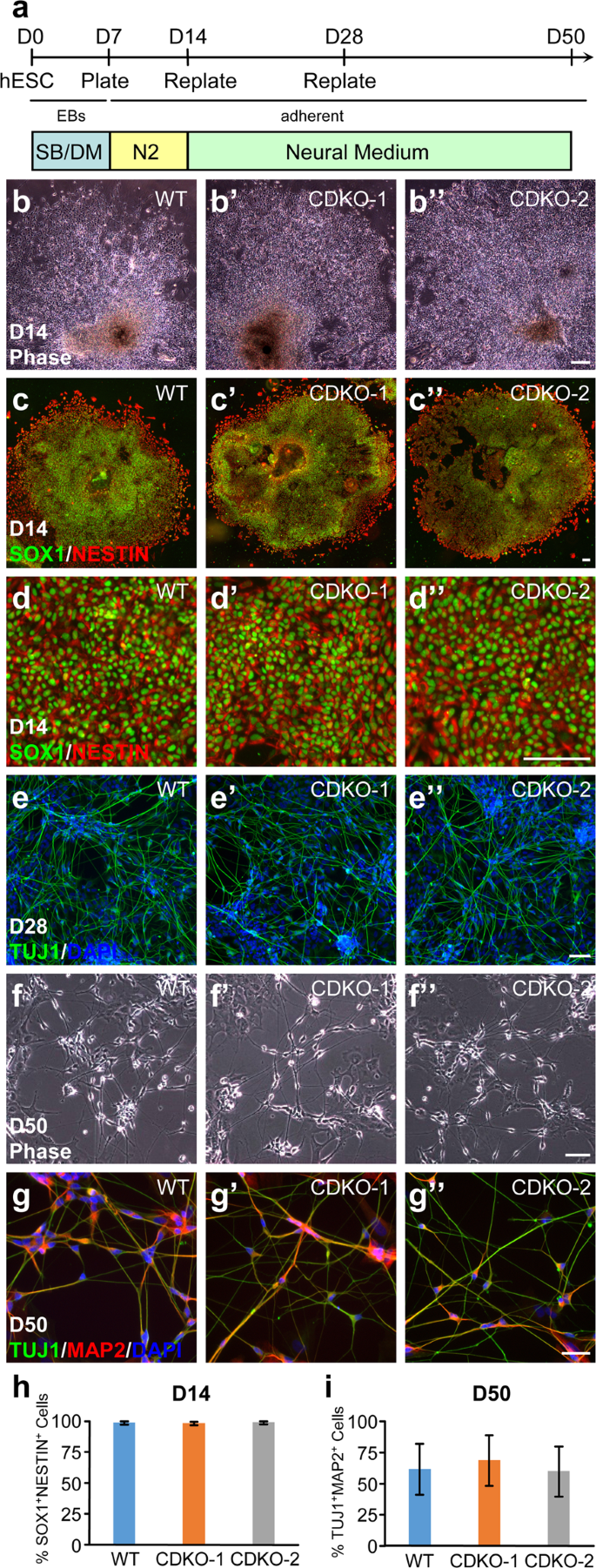
SB431542 (SB)和dorsomorphin (DM)抑制SMAD通路驱动hESCs向神经谱系分化gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba。由于先前在mESCs中的研究表明Tet1缺乏会损害神经外胚层的分化,我们将野生型H9和两个Tet1缺陷突变系分化为EBs,用10µM SB431542和5µM Dorsomorphin处理7天,然后在DMEM/F12中添加N2培养7天(图2)。gydF4y2Ba4gydF4y2Ba)。在分化的第14天,观察到形态上难以区分的神经外胚层细胞集落(图2)。gydF4y2Ba4 bgydF4y2Ba”)。这些菌落以非常相似的程度统一表达神经外胚层标记物SOX1和NESTIN(图2)。gydF4y2Ba4 c - dgydF4y2Ba”)。定量分析显示,三种细胞系中SOX1和NESTIN双阳性细胞百分比无显著差异(图2)。gydF4y2Ba4 hgydF4y2Ba)。神经外胚层细胞在神经培养基中的进一步分化(图2)。gydF4y2Ba4gydF4y2Ba)生成TUJ1gydF4y2Ba+gydF4y2BaWT和TET1突变系第28天的细胞(图2)。gydF4y2Ba4 egydF4y2Ba”)。在分化第50天,所有3个培养系都含有正常形态的神经元(图2)。gydF4y2Ba4 fgydF4y2Ba”),同时表达成熟神经元标志物MAP2和泛神经标志物TUJ1(图2)。gydF4y2Ba4 g-ggydF4y2Ba”)。在3个培养系中,MAP2和TUJ1双阳性细胞的百分比没有显著差异(图2)。gydF4y2Ba4我gydF4y2Ba)。gydF4y2Ba
双重SMAD抑制下tet1缺陷hESCs的正常神经分化。(gydF4y2Ba一个gydF4y2Ba)两种SMAD抑制剂SB431542 (SB)和dorsomorphin (DM)的神经分化方案示意图。EB,胚状体。N2, N2补充物。(gydF4y2BabgydF4y2Ba-gydF4y2Bad”gydF4y2Ba)相衬图像(gydF4y2BabgydF4y2Ba-gydF4y2BabgydF4y2Ba”gydF4y2Ba)和神经系标记物SOX1和NESTIN (gydF4y2BacgydF4y2Ba-gydF4y2Bad”gydF4y2Ba)在D14从指示的hESC系中提取eb衍生菌落。染色的代表性菌落(gydF4y2BacgydF4y2Ba-gydF4y2Bac”gydF4y2Ba)被放大(gydF4y2BadgydF4y2Ba-gydF4y2Bad”gydF4y2Ba相应的)。(gydF4y2BaegydF4y2Ba-gydF4y2Bae”gydF4y2Ba)泛神经标志物TUJ1在D28的免疫染色。(gydF4y2BafgydF4y2Ba-gydF4y2Bag”gydF4y2Ba)相衬图像(gydF4y2BafgydF4y2Ba-gydF4y2Baf”gydF4y2Ba)和TUJ1和MAP2的免疫染色(gydF4y2BaggydF4y2Ba-gydF4y2Bag”gydF4y2Ba)在D50成熟神经元。(gydF4y2BahgydF4y2Ba) SOX1的定量gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba神经外胚层细胞在D14从3个独立的实验。(gydF4y2Ba我gydF4y2Ba) TUJ1的定量gydF4y2Ba+gydF4y2BaMAP2gydF4y2Ba+gydF4y2BaD50时的成熟神经元。bar, 100µm。gydF4y2Ba
TET1缺乏会影响hESCs在无形态源状态下的神经分化gydF4y2Ba
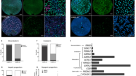
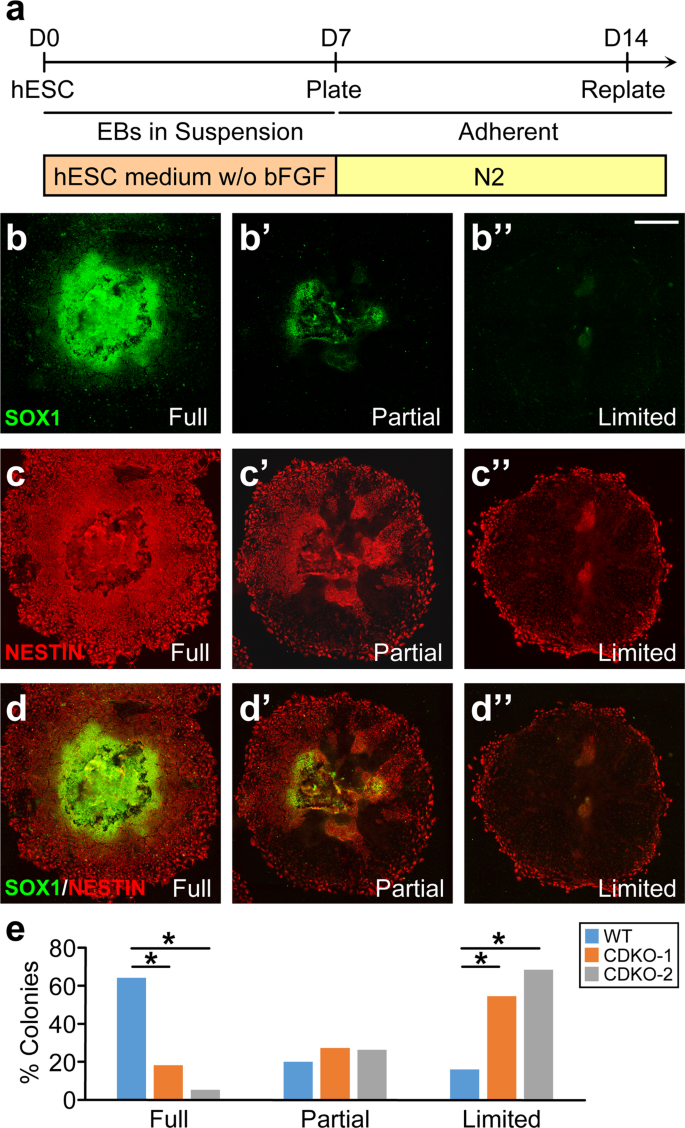
双重SMAD抑制引导hESCs到神经外胚层gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba我们在无形态因子条件下检测了TET1缺陷hESCs的分化,以了解TET1突变是否会影响hESCs的内在分化程序。将H9或TET1突变型hESCs分离成单细胞,在不含bFGF的hESC培养基中聚集于Aggrewells中,悬浮培养7天,再在N2培养基中贴壁培养7天(图2)。gydF4y2Ba5gydF4y2Ba)。在第14天,EB形成的每个集落含有不同百分比的SOX1和NESTIN双阳性神经外胚层细胞,反映了不同集落神经外胚层承诺的完整性。我们根据菌落中SOX1和NESTIN双阳性细胞占所有细胞的百分比将这些菌落分为三组,标准如下(图1)。gydF4y2Ba5罪犯gydF4y2Ba”)。将百分比大于70%的群体分配为“满”(图2)。gydF4y2Ba5罪犯gydF4y2Ba),其中20% - 70%被分配到“Partial”(图2)。gydF4y2Ba5 b - c的gydF4y2Ba),少于20%的归为“有限”(图2)。gydF4y2Ba5 b“- d”gydF4y2Ba)。TET1缺乏显著降低了“完整”菌落的百分比,增加了“有限”菌落的百分比,而“部分”菌落的百分比没有显著改变(图2)。gydF4y2Ba5 egydF4y2Ba)。gydF4y2Ba
无形态因子条件下tet1缺陷hESCs神经分化早期的损伤。(gydF4y2Ba一个gydF4y2Ba胚状体(EB)在无形态因子条件下从第0天到第14天向早期神经谱系分化的方案。N2, N2补充物。(gydF4y2Ba罪犯”gydF4y2Ba)根据SOX1的百分比将神经上皮菌落分为三种类型gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba单个群体内所有细胞中的细胞,代表神经谱系承诺的完整性。有一个SOX1的完整菌落gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba百分比>70% (gydF4y2Ba罪犯gydF4y2Ba用于分离通道和合并图像);部分带有SOX1的菌落gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba百分比介乎20-70% (gydF4y2Bab”gydF4y2Ba-gydF4y2Bad 'gydF4y2Ba);数量有限,有SOX1的菌落gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba百分比<20% (gydF4y2Bab”gydF4y2Ba-gydF4y2Bad”gydF4y2Ba)。Bar, 500µm。(gydF4y2BaegydF4y2Ba) WT和H9 hESCs的两种tet1缺陷系在D14时形成的每种类型菌落的百分比。*gydF4y2BapgydF4y2Ba< 0.001;费雪的精确检验,每个细胞系n = 40个菌落。gydF4y2Ba
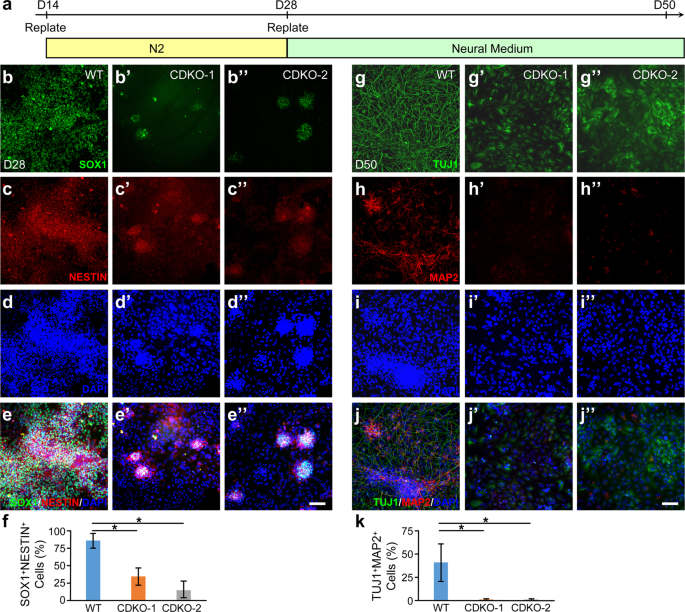
在N2培养基中复制并进一步分化至第28天,然后在神经培养基中复制至第50天(图2)。gydF4y2Ba6gydF4y2Ba)。第28天,野生型H9和TET1突变体hESCs的SOX1和NESTIN共染色(图2)。gydF4y2Ba6中”gydF4y2Ba)显示SOX1急剧下降gydF4y2Ba+gydF4y2Ba巢蛋白gydF4y2Ba+gydF4y2Ba与野生型相比,TET1突变系中的神经外胚层细胞(图2)。gydF4y2Ba6 fgydF4y2Ba)。第50天,用泛神经标记物TUJ1和成熟神经元标记物MAP2以及DAPI对细胞进行染色(图2)。gydF4y2Ba6 g-j”gydF4y2Ba)。从野生型H9分化出来的培养物含有大量具有复杂过程的神经元(图2)。gydF4y2Ba6克gydF4y2Ba),其中许多是MAP2阳性(图2)。gydF4y2Ba6小时gydF4y2Ba)。相比之下,两个TET1突变系产生了TUJ1gydF4y2Ba+gydF4y2Ba无神经元突起的细胞(图2)gydF4y2Ba6 g - g”gydF4y2Ba), MAP2无明显表达(图2)。gydF4y2Ba6 h - h”gydF4y2Ba)。对MAP2和TUJ1双阳性细胞进行定量分析,结果显示,野生型的MAP2和TUJ1双阳性细胞数量显著减少,分别为野生型的41±20%和TET1突变系的1±1%和1±1%(图2)。gydF4y2Ba6 kgydF4y2Ba)。gydF4y2Ba
缺乏tet1的hESCs在无形态因子的条件下不能分化为神经元。(gydF4y2Ba一个gydF4y2Ba)无形态源条件下神经上皮细胞向神经元分化的方法。N2, N2补充物。(gydF4y2Bab-fgydF4y2Ba)分化第28天,野生型(gydF4y2Ba抵扣gydF4y2Ba)或tet1缺乏(gydF4y2Bab - e”gydF4y2Ba) SOX1的H9 hESCs (gydF4y2Bab”gydF4y2Ba),巢(gydF4y2BacgydF4y2Ba- c”gydF4y2Ba),以及DAPI (gydF4y2Bad d”gydF4y2Ba)。合并图像(gydF4y2Bae”gydF4y2Ba)量化SOX1和NESTIN双阳性细胞在所有DAPI中的百分比gydF4y2Ba+gydF4y2Ba单元格(f)gydF4y2BapgydF4y2Ba< 0.001,学生gydF4y2BatgydF4y2Ba-test, n = 3。(gydF4y2Bag-kgydF4y2Ba)第50天,将野生型或tet1缺失型H9 hESCs分化的细胞进行泛神经标记物TUJ1 (gydF4y2Bag-g”gydF4y2Ba)、成熟神经元标志物MAP2 (gydF4y2Ba高度差”gydF4y2Ba),以及DAPI (gydF4y2Ba我”gydF4y2Ba)。合并图像(gydF4y2Baj j”gydF4y2Ba)量化MAP2和TUJ1双阳性神经元在所有DAPI中的百分比gydF4y2Ba+gydF4y2Ba细胞(gydF4y2BakgydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.001。学生的gydF4y2BatgydF4y2Ba-test, n = 3。bar, 100µm。gydF4y2Ba
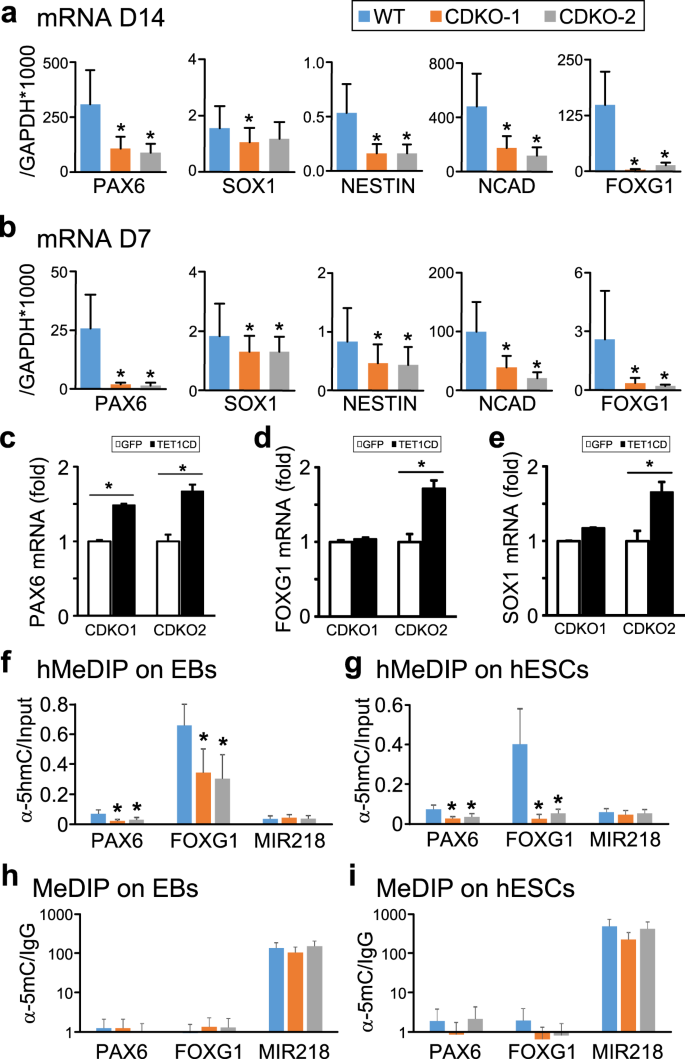
TET1缺乏降低PAX6的表达和PAX6启动子的羟甲基化gydF4y2Ba
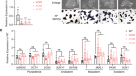
为了理解为什么TET1突变会损害hESCs向神经谱系分化的内在能力,我们测量了几种关键的神经分化早期标志物,如PAX6、SOX1、NESTIN、N-Cadherin和FOXG1在无形态因子条件下的分化过程中的表达水平。在D14时,除了SOX1的表达在一个TET1突变体中显著降低外,大多数这些标记基因的表达水平在两个TET1突变体中都显著降低。gydF4y2Ba7一个gydF4y2Ba)。它证实了神经谱系承诺的系统性缺陷。为了了解这些缺陷的起源,我们测量了这些基因在EBs中D7的表达,发现所有这些标记基因的表达都显著减少(图2)。gydF4y2Ba7 bgydF4y2Ba)。PAX6的表达减少最为明显,其在TET1突变体中的表达量比在WT突变体中的表达量少约20倍。gydF4y2Ba
tet1缺陷hESCs的神经分化受损伴随着PAX6启动子中5hmC含量的降低。(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba) qRT-PCR检测野生型(WT)或tet1缺陷(CDKO-1和CDKO-2) H9 hESCs在无形态源条件下分化的细胞中指示神经谱系标记物的表达水平(gydF4y2Ba一个gydF4y2Ba)及第7天(gydF4y2BabgydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.05,对学生的gydF4y2BatgydF4y2Ba-test, n = 3。(gydF4y2Ba一部gydF4y2Ba)用表达GFP或FLAG-TET1CD的慢病毒感染两种TET1突变hESC细胞系CDKO1和CDKO2,在无形态因子条件下进行分化。采用qRT-PCR分析分化第10天胚状体神经外胚层基因PAX6 (gydF4y2BacgydF4y2Ba), fox1 (gydF4y2BadgydF4y2Ba)及SOX1 (gydF4y2BaegydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.05,对学生的gydF4y2BatgydF4y2Ba-test, n = 6。(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba) hMeDIP测定在无形态因子条件下形成的EBs中PAX6、FOXG1或miR218(与早期神经分化无关的基因)启动子区域5hmC含量(gydF4y2BafgydF4y2Ba)或未分化hESCs (gydF4y2BaggydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.05,学生gydF4y2BatgydF4y2Ba-test, n = 3。(gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)在无形态因子条件下形成的EBs中PAX6、FOXG1或miR218启动子处5mC含量的MeDIP测定(gydF4y2BahgydF4y2Ba)或未分化hESCs (gydF4y2Ba我gydF4y2Ba)。gydF4y2Ba
为了检验这些基因的减少是否确实是由TET1催化活性的丧失引起的,我们在两条TET1缺陷hESCs (CDKO1和CDKO2)中,用慢病毒过表达flag标记的TET1催化结构域(TET1CD)或GFP(见图2)。gydF4y2Ba2我gydF4y2Ba)。这些hESCs是在无形态因子的条件下分化的。分化第10天胚状体中PAX6、FOXG1和SOX1等神经外胚层基因的表达水平在CDKO2中显著获救,在CDKO1中部分获救(图2)。gydF4y2Ba7汉英gydF4y2Ba)。CDKO1的部分拯救可能是由多种因素引起的,如随机基因组整合导致的病毒转基因的可变表达以及无形态源条件对细胞分化的随机影响。gydF4y2Ba
PAX6作为主转录因子,在hESCs分化和早期人类发育过程中启动神经外胚层命运承诺gydF4y2Ba30.gydF4y2Ba我们检测了PAX6启动子的羟甲基化是否受到TET1突变的影响。采用hMeDIP法,用抗5hmc免疫沉淀第7天从EBs中分离的片段基因组DNA。采用qPCR检测免疫沉淀中PAX6启动子的含量。与野生型相比,来自TET1突变体的EBs中PAX6启动子中的5hmC水平显著降低(图2)。gydF4y2Ba7 fgydF4y2Ba)。与第14天FOXG1表达减少一致(图2)。gydF4y2Ba7一个gydF4y2Ba)和第7天(图2)。gydF4y2Ba7 bgydF4y2Ba), TET1突变体在EB期FOXG1启动子中的5hmC水平也显著降低(图2)。gydF4y2Ba7 fgydF4y2Ba)。作为对照,与早期神经分化无关的基因miR218启动子的羟甲基化未发现显著变化(图2)。gydF4y2Ba7 fgydF4y2Ba)。令人惊讶的是,与野生型H9相比,在TET1突变的未分化hESCs中,PAX6启动子和FOXG1启动子的羟甲基化程度降低。gydF4y2Ba7 ggydF4y2Ba)。MeDIP检测显示,EBs中PAX6启动子和FOXG1启动子上的5mC水平非常低,差异不显著(图2)。gydF4y2Ba7小时gydF4y2Ba)或未分化hESCs(图2)。gydF4y2Ba7我gydF4y2Ba)有或没有TET1突变。PAX6和FOXG1在野生型H9和TET1突变型hESCs中的表达水平过低,无法通过qRT-PCR可靠检测。gydF4y2Ba
tet1缺陷hESCs形成的畸胎瘤中PAX6和SOX1的表达降低gydF4y2Ba
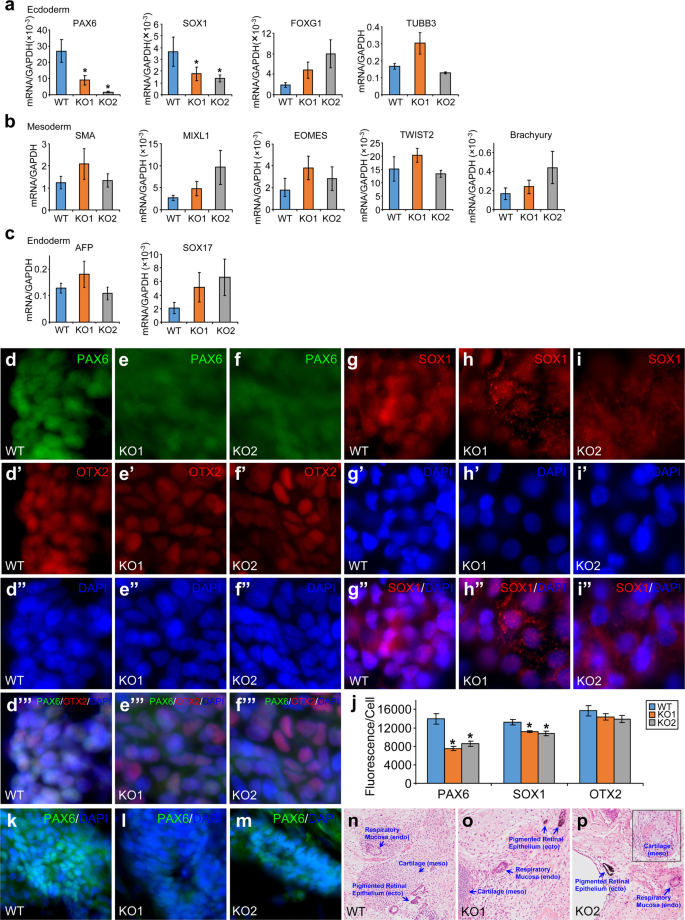
为了证实这些gydF4y2Ba在体外gydF4y2Ba结果显示,我们对两种tet1缺陷系及其亲代野生型H9 hESCs进行了畸胎瘤形成试验。在从这些畸胎瘤中分离的总RNA中,我们发现PAX6和SOX1的表达水平在两种tet1缺陷hESCs形成的畸胎瘤中显著降低(图2)。gydF4y2Ba8gydF4y2Ba)。其他外胚层基因如FOXG1和TUBB3的表达水平(图2)。gydF4y2Ba8gydF4y2Ba),中胚层基因(图2)。gydF4y2Ba8 bgydF4y2Ba)和内胚层基因(图2)。gydF4y2Ba8 cgydF4y2Ba)并没有因为TET1的缺失而显著改变。为了证实PAX6和SOX1的发现,我们对畸胎瘤的低温切片进行了免疫染色。PAX6水平(图2)。gydF4y2Ba8 d-fgydF4y2Ba, j)和SOX1(图1)。gydF4y2Ba8 g-jgydF4y2Ba)的荧光强度在两个tet1缺陷hESCs形成的畸胎瘤中确实显著降低。作为对照,在这些畸胎瘤切片中,OTX2的荧光强度没有显著差异(图2)。gydF4y2Ba8 d - f, jgydF4y2Ba)。尽管PAX6表达减少,PAX6gydF4y2Ba+gydF4y2Ba在两种tet1缺陷hESCs和亲代野生型H9 hESCs产生的畸胎瘤的低温切片中发现神经管样结构(图2)。gydF4y2Ba8 kmgydF4y2Ba)。这些畸胎瘤石蜡切片的H&E染色显示存在所有三个胚层的组织,包括来自神经外胚层的色素视网膜上皮(图2)。gydF4y2Ba8阻燃剂gydF4y2Ba)。它证实了tet1缺陷畸胎瘤中神经管样结构的形成。gydF4y2Ba
tet1缺陷hESCs形成的畸胎瘤中PAX6和SOX1的表达降低。(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba)外胚层标记基因表达量的定量RT-PCR测定(gydF4y2Ba一个gydF4y2Ba),中胚层(gydF4y2BabgydF4y2Ba),或内胚层(gydF4y2BacgydF4y2Ba)在tet1缺陷(KO1和KO2)或野生型(WT) H9 hESCs形成的畸胎瘤中分离的总RNA中表达。gydF4y2Ba*gydF4y2BapgydF4y2Ba< 0.05,与WT相比,n = 8-14。KO1和KO2之间无显著差异。(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba)对这些畸胎瘤进行低温切片检测PAX6、OTX2和DNA (gydF4y2Bad-f’”gydF4y2Ba)或SOX1和DNA (gydF4y2Ba胃肠道”gydF4y2Ba)。定量这些切片中PAX6、SOX1和OTX2细胞的平均荧光强度(gydF4y2BajgydF4y2Ba)。*gydF4y2BapgydF4y2Ba< 0.05,与WT相比,n = 12。KO1和KO2之间无显著差异。(gydF4y2BakmgydF4y2Ba) PAX6gydF4y2Ba+gydF4y2Ba畸胎瘤低温切片显示神经管样结构。(gydF4y2Ba阻燃剂gydF4y2Ba)畸胎瘤石蜡切片的H&E染色。星质,外胚层;内消旋,中胚层;endo内胚层。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们通过在其催化区域引入一个停止密码子,生成了tet1缺陷的H9 hESCs,将5hmC水平降低到野生型H9细胞的30%(图2)。gydF4y2Ba2gydF4y2Ba)。TET1缺乏在标记基因表达和hESCs在标准含血清条件下向所有三种胚层细胞分化的能力方面没有显著改变多能性(图2)。gydF4y2Ba3.gydF4y2Ba)和畸胎瘤形成分析(图2)。gydF4y2Ba8gydF4y2Ba)。因此,我们的研究与早期的研究一致,表明小鼠中Tet1的缺失不会显著损害多能性和发育gydF4y2Ba25gydF4y2Ba。gydF4y2Ba
相反,TET1缺乏会损害hESCs向神经外胚层分化的内在能力(图2)。gydF4y2Ba5gydF4y2Ba)和神经元(图2)。gydF4y2Ba6克ydF4y2Ba),处于无形态素状态。这种损伤伴随着PAX6和FOXG1在胚胎体分化第7天的表达显著降低,并在神经外胚层细胞中持续到第14天(图2)。gydF4y2Ba7 gydF4y2Ba)。在tet1缺陷畸胎瘤中证实PAX6和SOX1表达降低,但FOXG1不表达。gydF4y2Ba8gydF4y2Ba)。PAX6在多个独立实验中表达的持续下降更有意义,因为PAX6是早期人类胚胎中hESCs向神经外胚层分化和神经外胚层发育的关键调节因子gydF4y2Ba30.gydF4y2Ba。PAX6在hESCs中过表达可促使多能性向神经外胚层退出,而PAX6敲低可阻断hESCs的分化gydF4y2Ba30.gydF4y2Ba。在tet1缺失的hESC中,PAX6和FOXG1启动子处的5hmC水平显著降低(图1)。gydF4y2Ba7 ggydF4y2Ba),尽管PAX6和FOXG1在hESCs中的表达过低,无法可靠检测。因此,在tet1缺失的hESCs中,当退出bFGF使hESCs分化时,PAX6启动子上5hmC的减少会导致胚状体和神经外胚层中表达减少的基因。gydF4y2Ba
在两种SMAD抑制剂(SB431542和dorsomorphin)存在的情况下,tet1缺陷hESCs的分化不受影响(图2)。gydF4y2Ba4gydF4y2Ba)。一种可能性是,tet1缺陷hESCs中PAX6表达的减少可能不足以阻断双SMAD抑制所提供的强烈神经分化信号gydF4y2Ba33gydF4y2Ba。即使在双SMAD抑制剂存在的情况下,通过RNAi直接消蚀PAX6的表达也会阻断hESC向神经外胚层的分化gydF4y2Ba30.gydF4y2Ba。因此,tet1缺陷hESCs中PAX6启动子的低羟甲基化可能导致PAX6的表达降低,但不足以阻断双SMAD抑制驱动的神经分化。本研究通过生成TET1缺失的H9 hESCs,发现TET1在PAX6启动子的羟甲基化和PAX6的表达中发挥了关键作用gydF4y2Ba在体外gydF4y2Ba(无花果。gydF4y2Ba7 gydF4y2Ba),gydF4y2Ba在活的有机体内gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2Ba),因为PAX6对hESCs向神经外胚层的分化起到关键调节作用。TET1催化活性的丧失并未显著损害hESCs的多能性,但极大地损害了hESCs向神经外胚层分化的内在能力。事实上,TET1催化结构域的过表达挽救了5hmC水平上的缺陷(图2)。gydF4y2Ba2 i (kgydF4y2Ba)和神经分化(图2)。gydF4y2Ba7汉英gydF4y2Ba),进一步证明TET1催化5mC向5hmC转化的能力对于支持hESCs向神经外胚层的分化是重要的。人类TET1的功能gydF4y2Ba在活的有机体内gydF4y2Ba似乎更微妙,因为TET1缺乏并不能阻止畸胎瘤中神经管样结构和神经外胚层衍生物(如色素视网膜上皮)的形成,尽管PAX6表达显著降低(图6)。gydF4y2Ba8gydF4y2Ba)。其他混杂因素,如其他TET基因的存在和畸胎瘤形成试验的随机性,可能有助于观察。gydF4y2Ba
方法gydF4y2Ba
CRISPR质粒的构建gydF4y2Ba
TET1-CDKO CRISPR位点(GACTTCTGTGCTCATCCCCAC)是使用在线工具at设计的gydF4y2Bahttp://crispr.mit.edu/gydF4y2Ba。按照先前发表的方案,将相应的guild RNA序列克隆到pSpCas9(BB)-2A-GFP (PX458, Addgene)中gydF4y2Ba35gydF4y2Ba。利用Surveyor核酸酶试验(Integrated DNA technologies, IDT)在293T细胞中证实了该CRISPR位点和质粒的有效性。gydF4y2Ba
hESC培养和基因编辑gydF4y2Ba
如前所述,H9 hESCs在小鼠胚胎成纤维细胞(MEF)饲养细胞上培养gydF4y2Ba36gydF4y2Ba。简单地说,hESCs在MEF饲养器上在hESC培养基(DMEM/F12, 20% KOSR, 1倍NEAA, 1倍谷氨酰胺,1倍青霉素链霉素,4 ng/ml bFGF)中繁殖7天,用1 mg/ml疾病(Stemcell技术)分离成小团块,并以1:6的比例在新的MEF饲养器上重新播种。为了在TET1催化区域产生突变,将H9细胞培养在mTeSR1 (Stemcell technologies)培养基中的基质包被容器(Corning #354277)上gydF4y2Ba37gydF4y2Ba每隔4-5天用Accutase (Stemcell技术)作为单细胞传代。TET1-CDKO CRISPR质粒(10 μg)递送至1 × 10gydF4y2Ba6克ydF4y2Ba使用核因子2B (Lonza)和程序A23进行H9 hESCs悬浮。在基质上培养2天后,细胞分离成单细胞,用流式细胞仪进行GFP分选gydF4y2Ba+gydF4y2Ba细胞,在基质上播种,再培养10天。人工挑选单个H9菌落,分离培养为单个克隆。使用蛋白酶k从这些个体克隆中提取基因组DNA,通过PCR扩增TET1 CRISPR靶向位点两侧的400bp区域(引物见表)gydF4y2BaS1gydF4y2Ba),并对其进行测序,以鉴定至少有一个等位基因发生突变的克隆。将PCR片段克隆到TA载体上,进行测序,确定突变克隆的确切基因型。gydF4y2Ba
在含血清培养基中自发分化gydF4y2Ba
在MEF饲养细胞上培养7天后,用1 mg/ml酶解液将hESCs分离成中等大小的团块,转移到T25个未处理的培养瓶(Nunc)中,在EB培养基(DMEM/F12、20% KOSR、1倍NEAA、1倍谷氨酰胺、1倍青霉素和链霉素)中培养4天形成胚状体(EB)。Medium每隔一天更换一次。在传代后的前2天加入ROCK抑制剂(Y27632, 10µM)。然后将EBs接种于0.1%明胶包被板上,在含血清培养基(DMEM/F12, 10% FBS)中培养3周,然后对胚层特异性标记物进行免疫染色。gydF4y2Ba
神经分化gydF4y2Ba
在MEF饲养细胞上培养7天后,将hESCs与TryLE分离成单细胞。每孔添加2000个细胞至超低贴壁96孔圆底微孔板(康宁)中,用EB培养基培养细胞。前4天加入ROCK抑制剂(10µM)。在典型神经分化方案中加入两种smad抑制剂SB431542(10µM)和Dorsomorphin(5µM)gydF4y2Ba34gydF4y2Ba,但在无形态素条件下被省略。第7天,将EBs接种于基质包被板上,在N2培养基(DMEM/F12, 1倍N2补充物,1倍NEAA, 1倍青霉素/链霉素)中培养。第14天,用TryLE将细胞分离成单个细胞,在基质包被板上复制,在N2培养基中培养。为了进一步分化神经元,分离的细胞以2 × 10的倍率在聚鸟氨酸/基质包被板上复制gydF4y2Ba4gydF4y2Ba/厘米gydF4y2Ba2gydF4y2Ba神经培养基(Neurobasal, 1× B27补充剂,1×谷氨酰胺,1× NEAA, 1×青霉素/链霉素,20 ng/ml NGF, 20 ng/ml BDNF, 20 ng/ml GDNF), 2天后加入0.5 mM dcAMP和2.5µM DAPT。gydF4y2Ba
点印迹gydF4y2Ba
使用点印迹法测量5mC或5hmC水平,按照先前的方案进行gydF4y2Ba28gydF4y2Ba。简单地说,使用QIAamp DNA迷你试剂盒(Qiagen)提取hESCs的基因组DNA,在0.1 M NaOH中于100°C变性10 min,并用等体积的2 M冷乙酸铵(pH 7.2)中和。将每种样品稀释至所需浓度的3微升点在硝化纤维素印迹膜(Amersham, GE healthcare)上,并在风干后进行紫外线交联。膜在TBST (20 mM Tris, 150 mM NaCl, 0.1% Tween 20, pH 7.5)中短暂冲洗,与阻断液(3% BSA在TBST中)在室温下孵育1小时,然后与阻断液稀释的一抗在4°C下孵育过夜。第2天,膜在TBST中洗涤4次,每次洗涤15 min,与酶标二抗在阻断液中RT孵育1 h,再在TBST中洗涤4次。然后应用ECL底物(Pierce),并在ChemiDoc成像系统(Bio-rad)中记录和分析结果。gydF4y2Ba
定量rt - pcrgydF4y2Ba
使用Purelink RNA迷你试剂盒(Thermo Fisher)提取RNA,使用iScript cDNA合成试剂盒(Bio-rad)进行逆转录。在CFX96 Touch™Real-time PCR Detection System (Bio-rad)中使用iQ SYBR Green Supermix (Bio-rad)进行实时定量PCR。引物序列见表gydF4y2BaS1gydF4y2Ba。gydF4y2Ba
MeDIP/hMeDIP测定5mC或5hmC水平gydF4y2Ba
采用MeDIP/hMeDIP检测PAX6启动子上5mC或5hmC水平gydF4y2Ba38gydF4y2Ba。简单地说,用QIAamp DNA mini Kit (Qiagen)提取hESCs的基因组DNA,在100 mM Tris-HCl (pH 8.0)中稀释至300 ng/μl,用Sonic 300 dismemator (Fisher)在冰上破碎至200-600 bp。使用MeDIP/hMeDIP试剂盒(Active motif)进行免疫沉淀。在每个反应中,0.5 μg片段基因组DNA分别与4个抗5mC或5hmC的μg抗体在试剂盒提供的缓冲液中4°C孵育过夜,然后按照试剂盒说明书用Protein G磁珠沉淀。利用免疫沉淀物作为模板,对PAX6启动子或对照基因miR218的特异性DNA序列进行PCR扩增。按照试剂盒建议,以0.05 μg的基因组DNA片段作为输入。用于扩增免疫沉淀中基因组DNA片段的引物序列列于表中gydF4y2BaS1gydF4y2Ba。gydF4y2Ba
Lentivirus-mediated救援gydF4y2Ba
FUW-TetO-FLAG-human TET1 CD(催化结构域,4252-6411个核苷酸)按照前面的描述在293FT细胞中构建和包装gydF4y2Ba28gydF4y2Ba。用FUW-TetO-FLAG-hTET1CD或FUW-TetO-GFP(含M2rTA)感染CDKO1和CDKO2细胞,MOI为30,存在8 ng/ml聚胺。第二天用DMEM/F12洗涤细胞3次,在培养液中加入1 μg/ml DOX。细胞在1 μg/ml DOX的作用下继续培养3天。提取基因组DNA,用5mC或5hmC进行点印迹。部分细胞分裂生成EB,在含1 μg/ml DOX的无形态源条件下培养10 d。提取RNA进行qRT-PCR。gydF4y2Ba
免疫荧光gydF4y2Ba
如前所述进行免疫染色gydF4y2Ba36gydF4y2Ba。细胞用4%多聚甲醛在PBS中固定20分钟,用0.1% Triton X-100在PBS中渗透30分钟,在RT下用3% BSA在PBS中阻断60分钟,然后在4℃下用一抗孵育过夜,在RT下用二抗孵育2小时。本研究使用的抗体信息列于表中gydF4y2BaS2gydF4y2Ba。在徕卡AF6000倒置荧光显微镜上获取荧光图像。在每种条件下,使用5个独立的帧在10倍放大或5个单独的菌落手动进行细胞定量。gydF4y2Ba
畸胎瘤形成分析gydF4y2Ba
如前所述gydF4y2Ba36gydF4y2Ba将100万个hESCs(野生型H9、CDKO1或CDKO2 TET1突变型H9)以1:1的比例与胶原蛋白混合,制成~10µl的微球,移植到SCID小鼠每个肾脏的肾包膜下(C.B-Igh-1bIcrTac-Prkdcscid/Ros)。使用小鼠的两个肾脏,每个hESCs系使用三只小鼠。移植后2 ~ 3个月,各hESC细胞系均可见大肿瘤(约1cm)。解剖畸形体组织,一部分在Trizol中裂解提取总RNA,一部分在4%多聚甲醛中固定包埋,冷冻切片,第三部分在10%福尔马林中固定24 h,石蜡包埋,苏木精和伊红染色,进行组织学鉴定。畸胎瘤形成实验的所有动物实验均由Roswell Park综合癌症中心的小鼠肿瘤模型资源进行,并获得Roswell Park综合癌症中心机构动物护理和使用委员会的批准。所有动物实验均按照相关指南和规定进行。gydF4y2Ba
统计数据gydF4y2Ba
所有统计检验均在R 3.0 (The R Project for statistical Computing)中进行。误差条表示标准差(Standard deviation)。由于WT与CDKO1和WT与CDKO2是独立比较,因此分别进行了统计检验。在qRT-PCR实验中,配对学生的gydF4y2BatgydF4y2Ba采用-检验,尽量减少批次间差异的干扰。gydF4y2Ba
数据可用性gydF4y2Ba
本研究过程中产生或分析的所有数据都包含在这篇已发表的文章(及其补充信息文件)中,或应通讯作者要求向其提供。gydF4y2Ba
参考文献gydF4y2Ba
J. A.汤姆森。gydF4y2Ba等gydF4y2Ba。胚胎干细胞系来源于人类囊胚。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba282gydF4y2Ba, 1145-1147(1998)。gydF4y2Ba
狐狸,I. J.。gydF4y2Ba等gydF4y2Ba。干细胞治疗。利用分化多能干细胞作为疾病治疗的替代疗法。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba345gydF4y2Ba, 1247391,gydF4y2Bahttps://doi.org/10.1126/science.1247391gydF4y2Ba(2014)。gydF4y2Ba
多能和分化细胞的表观遗传修饰。gydF4y2Ba自然生物技术gydF4y2Ba28gydF4y2Ba, 1079 - 1088,gydF4y2Bahttps://doi.org/10.1038/nbt.1684gydF4y2Ba(2010)。gydF4y2Ba
李建军,李建军,李建军。水稻多能性和分化的表观遗传调控。gydF4y2Ba循环研究gydF4y2Ba115gydF4y2Ba, 311 - 324,gydF4y2Bahttps://doi.org/10.1161/circresaha.115.301517gydF4y2Ba(2014)。gydF4y2Ba
DNA甲基化和甲基胞嘧啶氧化在细胞命运决定中的作用。gydF4y2Ba细胞生物学的最新观点gydF4y2Ba25gydF4y2Ba, 152 - 161,gydF4y2Bahttps://doi.org/10.1016/j.ceb.2013.02.014gydF4y2Ba(2013)。gydF4y2Ba
Jones, p.a.和Takai, D. DNA甲基化在哺乳动物表观遗传学中的作用。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba293gydF4y2Ba, 1068 - 1070,gydF4y2Bahttps://doi.org/10.1126/science.1063852gydF4y2Ba(2001)。gydF4y2Ba
Irvine, R. A, Lin, I. G. & Hsieh, C. L. DNA甲基化对转录和组蛋白乙酰化有局部影响。gydF4y2Ba分子与细胞生物学gydF4y2Ba22gydF4y2Ba, 6689-6696(2002)。gydF4y2Ba
Razin, A.和Cedar, H. DNA甲基化和基因表达。gydF4y2Ba微生物学检查gydF4y2Ba55gydF4y2Ba, 451-458(1991)。gydF4y2Ba
基因表达的表观遗传调控:基因组如何整合内在和环境信号。gydF4y2Ba自然遗传学gydF4y2Ba33gydF4y2Ba(5), 245 - 254,gydF4y2Bahttps://doi.org/10.1038/ng1089gydF4y2Ba(2003)。gydF4y2Ba
Rose, N. R.和Klose, R. J.了解DNA甲基化和组蛋白赖氨酸甲基化的关系。gydF4y2Ba生物化学与生物物理学报gydF4y2Ba1839gydF4y2Ba, 1362 - 1372,gydF4y2Bahttps://doi.org/10.1016/j.bbagrm.2014.02.007gydF4y2Ba(2014)。gydF4y2Ba
玛格丽特,R. & Reinberg, D.染色质结构与表观遗传信息的遗传。gydF4y2Ba自然评论。遗传学gydF4y2Ba11gydF4y2Ba, 285 - 296,gydF4y2Bahttps://doi.org/10.1038/nrg2752gydF4y2Ba(2010)。gydF4y2Ba
Ng, H. H.和Bird, A. DNA甲基化和染色质修饰。gydF4y2Ba遗传学与发育的最新观点gydF4y2Ba9gydF4y2Ba, 158-163(1999)。gydF4y2Ba
刘,J。gydF4y2Ba等gydF4y2Ba。斑马鱼和猪早期胚胎发生过程中DNA 6mA的大量甲基化。gydF4y2Ba自然通讯gydF4y2Ba7 gydF4y2Ba, 13052,gydF4y2Bahttps://doi.org/10.1038/ncomms13052gydF4y2Ba(2016)。gydF4y2Ba
哺乳动物的DNA甲基化。gydF4y2Ba冷泉港生物学展望gydF4y2Ba6克ydF4y2Baa019133,gydF4y2Bahttps://doi.org/10.1101/cshperspect.a019133gydF4y2Ba(2014)。gydF4y2Ba
Mamta Tahiliani, k.p.k.,gydF4y2Ba等gydF4y2Ba杨文华,刘建军,李建军,等。5-甲基胞嘧啶在哺乳动物DNA中转化为5-羟甲基胞嘧啶。《科学》(纽约)(2009)。gydF4y2Ba
r.b.罗斯巴赫。gydF4y2Ba等gydF4y2Ba。TET1是一个新蛋白家族的成员,在急性髓系白血病中融合到含有t的MLL (10;11)(q22;q23)。gydF4y2Ba白血病gydF4y2Ba17gydF4y2Ba, 637 - 641,gydF4y2Bahttps://doi.org/10.1038/sj.leu.2402834gydF4y2Ba(2003)。gydF4y2Ba
吴霞,张勇。tet介导的活性DNA去甲基化:机制、功能及其他。gydF4y2Ba自然评论。遗传学gydF4y2Ba18gydF4y2Ba, 517 - 534,gydF4y2Bahttps://doi.org/10.1038/nrg.2017.33gydF4y2Ba(2017).gydF4y2Ba
伊藤。gydF4y2Ba等gydF4y2Ba。Tet蛋白可将5-甲基胞嘧啶转化为5-甲酰基胞嘧啶和5-羧基胞嘧啶。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba333gydF4y2Ba, 1300 - 1303,gydF4y2Bahttps://doi.org/10.1126/science.1210597gydF4y2Ba(2011)。gydF4y2Ba
他,Y. F.。gydF4y2Ba等gydF4y2Ba。tet介导的5-羧基胞嘧啶在哺乳动物DNA中的形成及其被TDG切除。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba333gydF4y2Ba, 1303 - 1307,gydF4y2Bahttps://doi.org/10.1126/science.1210944gydF4y2Ba(2011)。gydF4y2Ba
谭磊,施永刚。Tet家族蛋白与5-羟甲基胞嘧啶在发育和疾病中的作用。gydF4y2Ba发展(剑桥,英国)gydF4y2Ba139gydF4y2Ba, 1895 - 1902,gydF4y2Bahttps://doi.org/10.1242/dev.070771gydF4y2Ba(2012)。gydF4y2Ba
吴辉,张勇。Tet蛋白介导的5-甲基胞嘧啶氧化的机制和功能。gydF4y2Ba基因与发育gydF4y2Ba25gydF4y2Ba, 2436 - 2452,gydF4y2Bahttps://doi.org/10.1101/gad.179184.111gydF4y2Ba(2011)。gydF4y2Ba
Koh, k.p。gydF4y2Ba等gydF4y2Ba。Tet1和Tet2调节小鼠胚胎干细胞中5-羟甲基胞嘧啶的产生和细胞谱系的分化。gydF4y2Ba干细胞gydF4y2Ba8gydF4y2Ba, 200 - 213,gydF4y2Bahttps://doi.org/10.1016/j.stem.2011.01.008gydF4y2Ba(2011)。gydF4y2Ba
Verma N。gydF4y2Ba等gydF4y2Ba。TET蛋白保护人类胚胎干细胞的二价启动子免于从头甲基化。gydF4y2Ba自然遗传学gydF4y2Ba50gydF4y2Ba, 83 - 95,gydF4y2Bahttps://doi.org/10.1038/s41588-017-0002-ygydF4y2Ba(2018)。gydF4y2Ba
弗罗伊登伯格,j.m.。gydF4y2Ba等gydF4y2Ba。tet1依赖性5-羟甲基胞嘧啶水平的急性缺失会损害LIF/Stat3信号传导并导致胚胎干细胞身份的丧失。gydF4y2Ba核酸类gydF4y2Ba40gydF4y2Ba, 3364 - 3377,gydF4y2Bahttps://doi.org/10.1093/nar/gkr1253gydF4y2Ba(2012)。gydF4y2Ba
迟到了,先生。gydF4y2Ba等gydF4y2Ba。Tet1对于维持多能性是必不可少的,它的丧失与胚胎和出生后的发育是相容的。gydF4y2Ba干细胞gydF4y2Ba9gydF4y2Ba, 166 - 175,gydF4y2Bahttps://doi.org/10.1016/j.stem.2011.07.010gydF4y2Ba(2011)。gydF4y2Ba
Khoueiry, R。gydF4y2Ba等gydF4y2Ba。TET1在移植后小鼠胚胎中的谱系特异性功能。gydF4y2Ba自然遗传学gydF4y2Ba49gydF4y2Ba, 1061 - 1072,gydF4y2Bahttps://doi.org/10.1038/ng.3868gydF4y2Ba(2017).gydF4y2Ba
张,r.r.r。gydF4y2Ba等gydF4y2Ba。Tet1调节成人海马神经发生和认知。gydF4y2Ba干细胞gydF4y2Ba13gydF4y2Ba, 237 - 245,gydF4y2Bahttps://doi.org/10.1016/j.stem.2013.05.006gydF4y2Ba(2013)。gydF4y2Ba
江,H。gydF4y2Ba等gydF4y2Ba。细胞周期和p53阻断了人成纤维细胞向多巴胺能神经元的直接转化。gydF4y2Ba自然通讯gydF4y2Ba6克ydF4y2Ba, 10100,gydF4y2Bahttps://doi.org/10.1038/ncomms10100gydF4y2Ba(2015)。gydF4y2Ba
琮、L。gydF4y2Ba等gydF4y2Ba。使用CRISPR/Cas系统的多重基因组工程。gydF4y2Ba科学(纽约,纽约州)gydF4y2Ba339gydF4y2Ba, 819 - 823,gydF4y2Bahttps://doi.org/10.1126/science.1231143gydF4y2Ba(2013)。gydF4y2Ba
张X。gydF4y2Ba等gydF4y2Ba。Pax6是人类神经外胚层细胞命运的决定因子。gydF4y2Ba干细胞gydF4y2Ba7 gydF4y2Ba, 90 - 100,gydF4y2Bahttps://doi.org/10.1016/j.stem.2010.04.017gydF4y2Ba(2010)。gydF4y2Ba
Le, T., Kim, K. P, Fan, G. & Faull, K. F.一种同时定量生物样品中DNA甲基化和羟甲基化水平的灵敏质谱法。gydF4y2Ba学生物化学肛门gydF4y2Ba412gydF4y2Ba, 203 - 209,gydF4y2Bahttps://doi.org/10.1016/j.ab.2011.01.026gydF4y2Ba(2011)。gydF4y2Ba
Tchieu, J。gydF4y2Ba等gydF4y2Ba。人类PSCs分化为所有主要外胚层谱系的模块化平台。gydF4y2Ba干细胞gydF4y2Ba21gydF4y2Ba, 399-410 e397;gydF4y2Bahttps://doi.org/10.1016/j.stem.2017.08.015gydF4y2Ba(2017).gydF4y2Ba
钱伯斯,s.m.。gydF4y2Ba等gydF4y2Ba。通过双重抑制SMAD信号实现人ES和iPS细胞的高效神经转换。gydF4y2Ba自然生物技术gydF4y2Ba27gydF4y2Ba, 275 - 280,gydF4y2Bahttps://doi.org/10.1038/nbt.1529gydF4y2Ba(2009)。gydF4y2Ba
Shi, Y., Kirwan, P.和Livesey, F. J.人类多能干细胞向大脑皮层神经元和神经网络的定向分化。gydF4y2BaNat ProtocgydF4y2Ba7 gydF4y2Ba, 1836 - 1846,gydF4y2Bahttps://doi.org/10.1038/nprot.2012.116gydF4y2Ba(2012)。gydF4y2Ba
Ran, f.a.。gydF4y2Ba等gydF4y2Ba。使用CRISPR-Cas9系统的基因组工程。gydF4y2BaNat ProtocgydF4y2Ba8gydF4y2Ba, 2281 - 2308,gydF4y2Bahttps://doi.org/10.1038/nprot.2013.143gydF4y2Ba(2013)。gydF4y2Ba
江,H。gydF4y2Ba等gydF4y2Ba。帕金控制来自诱导多能干细胞的人类中脑多巴胺能神经元的多巴胺利用。gydF4y2Ba自然通讯gydF4y2Ba3.gydF4y2Ba, 668,gydF4y2Bahttps://doi.org/10.1038/ncomms1669gydF4y2Ba(2012)。gydF4y2Ba
路德维希,t.e.。gydF4y2Ba等gydF4y2Ba。人胚胎干细胞的非饲养培养。gydF4y2Ba自然方法gydF4y2Ba3.gydF4y2Ba, 637 - 646,gydF4y2Bahttps://doi.org/10.1038/nmeth902gydF4y2Ba(2006)。gydF4y2Ba
Mohn, F, Weber, M, Schubeler, D.和Roloff, T. C.甲基化DNA免疫沉淀(MeDIP)。gydF4y2Ba分子生物学方法(Clifton, N.J.)gydF4y2Ba507gydF4y2Ba55 - 64,gydF4y2Bahttps://doi.org/10.1007/978-1-59745-522-0_5gydF4y2Ba(2009)。gydF4y2Ba
致谢gydF4y2Ba
本工作得到了布法罗蓝天计划(J.F.)、美国国立卫生研究院NS102148 (J.F.)、纽约州卫生部系统合同C30290GG (H.L.)和中国国家自然科学基金项目81520108010 (B.Z.)的部分支持。我们感谢罗斯威尔公园综合癌症中心小鼠肿瘤模型资源的Bryan Gillard, Ellen Karasik, Barbara Foster和Michael Moser对畸胎瘤形成的分析。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
H.L.和j.f.:概念/设计;h.l., i.s., B.Z.和j.f.:稿件的撰写和最终审定;h.l., z.h., h.j., j.p., i.s., j.q.:数据的收集,分析和组合。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
李浩,胡忠,姜浩。gydF4y2Baet al。gydF4y2BaTET1缺乏损害人胚胎干细胞向神经外胚层的无形态因子分化。gydF4y2BaSci代表gydF4y2Ba10gydF4y2Ba, 10343(2020)。https://doi.org/10.1038/s41598-020-67143-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41598-020-67143-xgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba