摘要gydF4y2Ba
严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)是冠状病毒病-19 (COVID-19)的病原体。迄今为止,已报告的COVID-19病例超过1.43亿例,全球死亡率为2.13%。目前,还没有获得许可的治疗方法来控制SARS-CoV-2感染。血红素加氧酶-1 (HO-1)是一种抑制炎症反应和减少氧化应激的细胞保护酶,其抗病毒作用已在几种病毒感染中进行了研究。为了确认HO-1是否抑制SARS-CoV-2感染,我们评估了一种有效且安全的HO-1诱导剂hemin在SARS-CoV-2感染中的抗病毒活性。我们发现血红素有效地抑制了SARS-CoV-2的复制(选择性指数:249.7012)。此外,利用表达载体瞬时表达HO-1也能抑制病毒在细胞中的生长。游离铁和胆绿素是HO-1催化血红素的代谢副产物,也能抑制病毒感染。此外,血凝素间接增加了已知限制SARS-CoV-2复制的干扰素刺激蛋白的表达。总之,研究结果表明,血红素诱导的HO-1在体外有效抑制了SARS-CoV-2。 Therefore, HO-1 could be potential therapeutic candidate for COVID-19.
介绍gydF4y2Ba
自中国武汉首次报告新型冠状病毒病(COVID-19)疫情以来,全球累计报告病例超过1.43亿例,目前全球死亡率为2.13%gydF4y2Ba1gydF4y2Ba。COVID-19是由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的,主要症状包括发烧、干咳、胸痛、疲劳,少数病例还会出现头痛、头晕、腹痛和腹泻gydF4y2Ba2gydF4y2Ba。迄今为止,针对人类免疫缺陷病毒(HIV)、流感病毒、埃博拉病毒、肝炎病毒、巨细胞病毒(CMV)和单纯疱疹病毒有效的抗病毒药物已被用于治疗COVID-19;然而,由于对病毒的治疗效果不一,尚未批准用于治疗COVID-19的特异性药物gydF4y2Ba2gydF4y2Ba。因此,由于COVID-19在全球范围内的快速传播,不仅需要开发新的疫苗,还需要考虑先前已知的抗病毒药物是否可以抑制SARS-CoV-2的复制gydF4y2Ba3.gydF4y2Ba。gydF4y2Ba
血红素加氧酶-1 (HO-1),由gydF4y2BaHmox1gydF4y2Ba是一种细胞保护酶,可以抑制炎症反应,减少氧化应激gydF4y2Ba4gydF4y2Ba。血红素、CoPP-9和穿心莲内酯可诱导HO-1表达gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba。HO-1将血红素催化成一氧化碳、胆绿素和铁,这些物质也被认为可以抑制各种病毒的增殖gydF4y2Ba8gydF4y2Ba。HO-1也被证明与干扰素(IFN)调节因子3相互作用,独立于其酶活性,激活I型IFN反应,抑制甲型流感病毒感染gydF4y2Ba9gydF4y2Ba。血红蛋白是具有代表性的HO-1诱导剂,对包括甲型肝炎病毒在内的多种病毒具有抗病毒作用gydF4y2Ba5gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba。用其他化学物质诱导HO-1对乙型和丙型肝炎病毒、埃博拉病毒、艾滋病毒、登革热病毒、寨卡病毒和人类呼吸道合胞病毒具有抗病毒活性gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba。最近的研究讨论了HO-1作为SARS-CoV-2候选抗病毒药物的适用性gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba。gydF4y2Ba
在本研究中,我们主要使用血红蛋白诱导HO-1表达,导致体外SARS-CoV-2复制减少。我们还试图确定HO-1抗病毒作用的基本机制,以及其酶和非酶功能。gydF4y2Ba
结果gydF4y2Ba
血红素诱导HO-1及抗sars - cov -2活性gydF4y2Ba
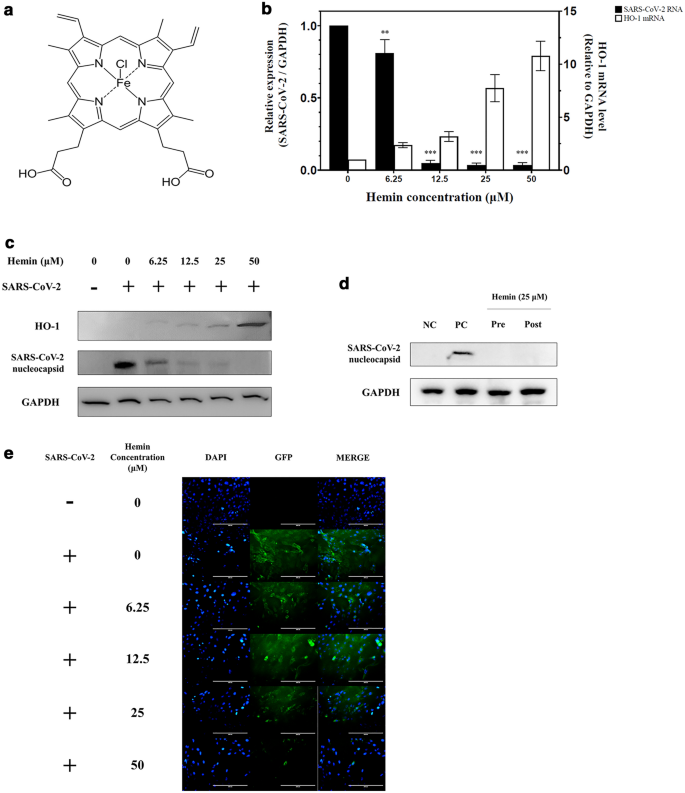
用不同浓度的血红蛋白预处理Vero76细胞1 h,然后感染SARS-CoV-2。感染后24 h采集细胞,分析细胞内病毒RNA或病毒蛋白含量。如预期的那样,用血红蛋白预处理(图2)。gydF4y2Ba1gydF4y2Baa)以剂量依赖的方式成功地增加了HO-1 mRNA和蛋白质的含量(图2)。gydF4y2Ba1gydF4y2Bab, c). Hemin也显示出对SARS-CoV-2的抗病毒活性。Hemin以剂量依赖的方式诱导SARS-CoV-2 RNA和病毒核蛋白含量的消耗(图2)。gydF4y2Ba1gydF4y2Bab, c)。因此,血红素浓度的逐渐增加导致HO-1 mRNA和蛋白质合成的增加,同时导致SARS-CoV-2 RNA和核衣壳蛋白的消耗(图2)。gydF4y2Ba1gydF4y2Bab, c).进行添加时间实验以确定病毒复制被抑制的时间点。在病毒感染前1小时用hemin预处理组监测其效果,以确定病毒感染是否在进入期被抑制。在治疗后感染病毒,然后用血红蛋白治疗2 hpi的组中,监测效果,以确定病毒进入细胞后,在细胞内复制阶段病毒复制是否受到抑制。在两组中都观察到病毒复制受到抑制,表明血红素处理可以在细胞内复制阶段抑制病毒(图2)。gydF4y2Ba1gydF4y2Bad).免疫荧光试验(IFA)(图4)。gydF4y2Ba1gydF4y2Bae)显示含SARS-CoV-2刺突蛋白的细胞数量随着血红蛋白浓度在24 hpi时的增加而减少。gydF4y2Ba
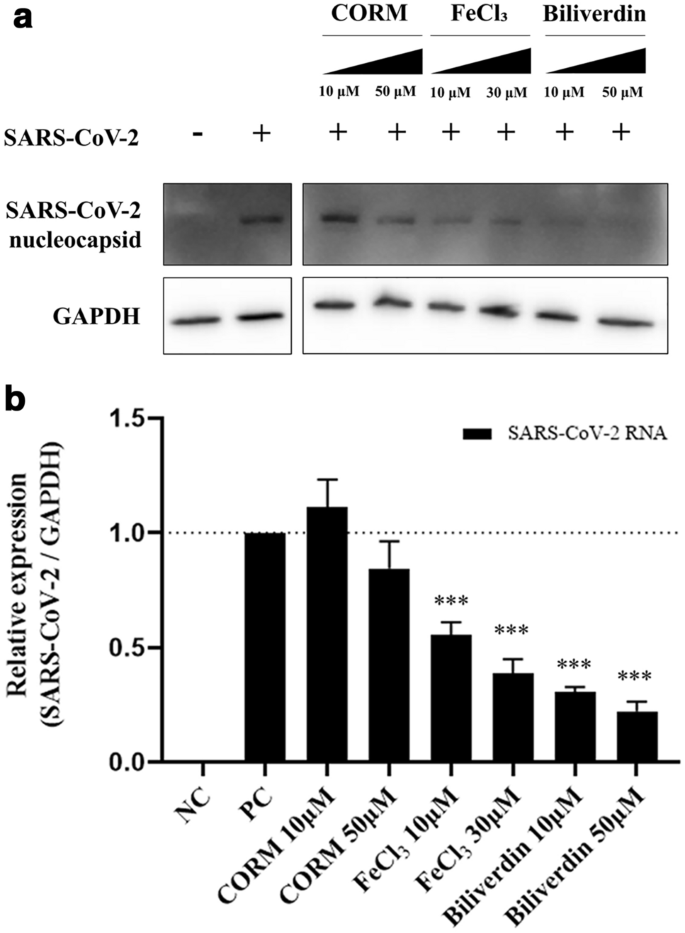
不同浓度血红蛋白诱导Vero76细胞中SARS-CoV-2 RNA和HO-1表达的变化(gydF4y2Ba一个gydF4y2Ba血红蛋白的结构。血红素的分子式为CgydF4y2Ba34gydF4y2BaHgydF4y2Ba32gydF4y2BaClFeNgydF4y2Ba4gydF4y2BaOgydF4y2Ba4gydF4y2Ba。(gydF4y2BabgydF4y2Ba用不同浓度的血凝素或不加血凝素处理感染SARS-CoV-2菌株NCCP43326(感染多重度(MOI): 0.001)的Vero76细胞24 h。随着血红素浓度的升高,HO-1 mRNA表达量与预期一致升高,SARS-CoV-2 RNA表达量随之降低。(gydF4y2BacgydF4y2Ba不同血红素浓度下HO-1和SARS-CoV-2核衣壳蛋白表达的变化。随着血红素浓度的增加,HO-1蛋白带宽度增加,病毒蛋白含量降低。与管家蛋白GAPDH水平的比较表明,在本实验中使用的细胞数量相同(也见补充图2)。gydF4y2BaS4gydF4y2Ba一个)。gydF4y2BadgydF4y2Ba)血红蛋白的加入时间实验。预处理组(Pre)将Vero76细胞用hemin预处理1 h,然后感染SARS-CoV-2。治疗后组(Post),细胞感染SARS-CoV-2后,用血红蛋白处理2 h;NC(阴性对照):模拟对照组,PC(阳性对照):仅感染SARS-CoV-2。(另见附图。gydF4y2BaS4gydF4y2Bab) (gydF4y2BaegydF4y2BaSARS-CoV-2刺突蛋白的细胞分布。经不同浓度血红蛋白预处理的Vero76细胞感染SARS-CoV-2 (MOI: 0.001)。感染24 h后进行SARS-CoV-2刺突蛋白免疫荧光检测(IFA);绿色荧光:SARS-CoV-2刺突蛋白;蓝色荧光:细胞核DAPI染色。用荧光显微镜分析IFA的结果。原装放大倍率:× 200。数据以至少三个独立实验的平均值±标准差表示。**gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
体外细胞毒性及有效血红蛋白浓度gydF4y2Ba
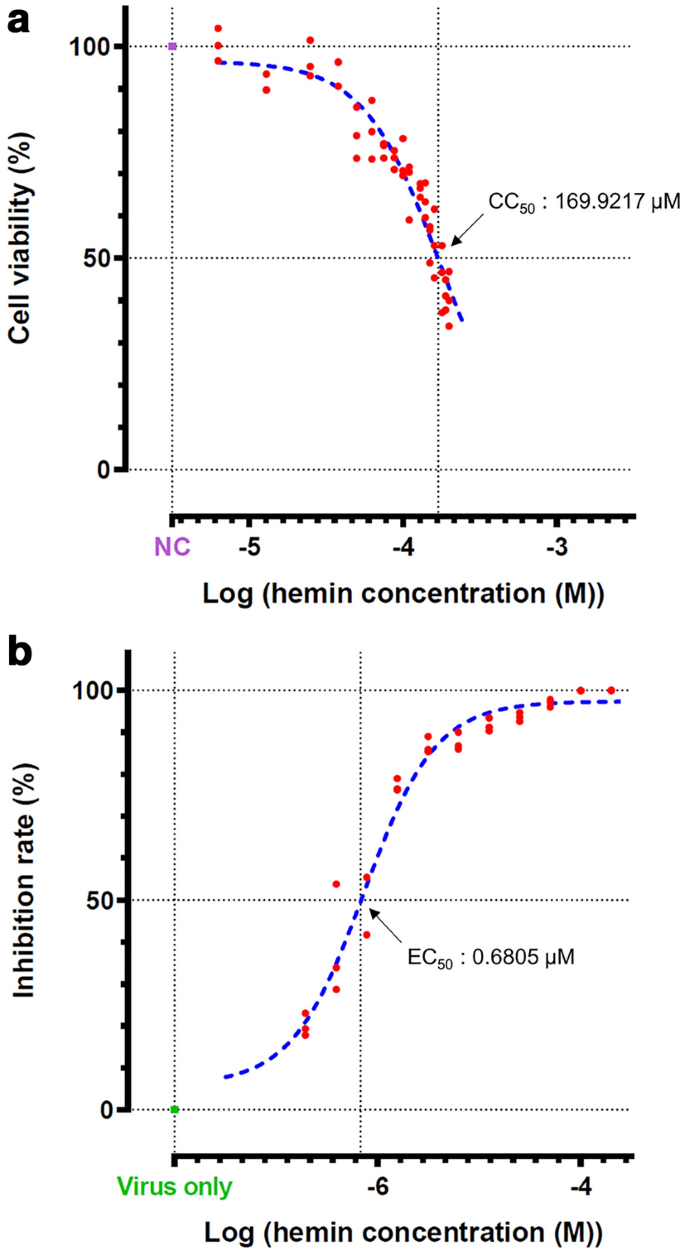
由于hemin对SARS-CoV-2具有抗病毒作用,我们进行了细胞毒性试验,以确认病毒载量的减少是否归因于其细胞毒性。细胞连续稀释血红素,2天后比较细胞存活率。根据细胞毒性结果,将50%的细胞毒性浓度(CCgydF4y2Ba50gydF4y2Ba)为169.9217 μM(图2)。gydF4y2Ba2gydF4y2Baa).有效浓度为50% (EC)gydF4y2Ba50gydF4y2Ba感染后2天(dpi)通过测量上清液中的病毒RNA滴度来计算细胞毒性。欧共体gydF4y2Ba50gydF4y2Ba血红素抑制病毒生长的浓度为0.6805 μM(图2)。gydF4y2Ba2gydF4y2Bab).血红素的选择性指数(SI)约为249.701gydF4y2Ba1gydF4y2Ba)。这些结果表明血红素作为一种治疗药物是安全有效的。gydF4y2Ba
HO-1过表达可减弱SARS-CoV-2复制gydF4y2Ba
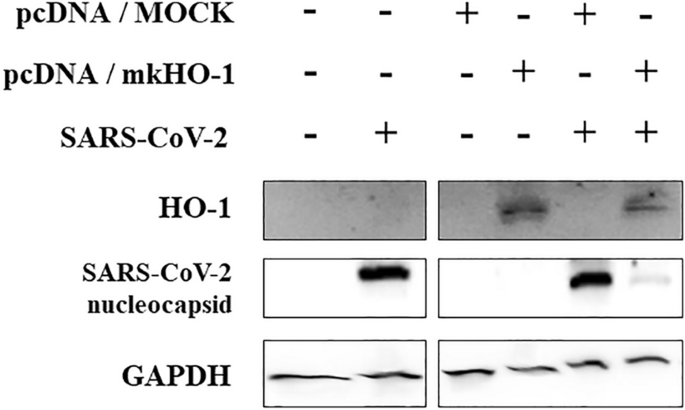
利用基因合成技术构建猴HO-1基因pcDNA 3.1(+)载体(GeneBank登录号:XM028827760),瞬时表达外源HO-1 (pcDNA/ mho -1)。将pcDNA/ mkho1和空pcDNA 3.1(+)载体(pcDNA/MOCK)转染Vero76细胞。猴HO-1蛋白在CMV启动子pcDNA/ mho -1下在Vero76细胞中表达。转染2天后,细胞被SARS-CoV-2感染。24 hpi时收获细胞,检测HO-1蛋白表达。如图所示。gydF4y2Ba3.gydF4y2Ba在转染pcDNA/ mkho1的细胞中明显检测到HO-1,而在转染pcDNA/MOCK的细胞中未检测到HO-1。正如之前的结果所观察到的,HO-1的短暂过表达抑制了SARS-CoV-2的复制。gydF4y2Ba
HO-1过表达抑制SARS-CoV-2增殖。将克隆到pcDNA 3.1(+)载体或空pcDNA 3.1(+)载体对照中的猴HO-1基因转染Vero76细胞。监测GAPDH的表达,以确认等量的细胞被装载(也见补充图。gydF4y2BaS4gydF4y2Bac)。gydF4y2Ba
HO-1催化血红素代谢产物对SARS-CoV-2具有抗病毒作用gydF4y2Ba
已知HO-1对血红素的催化作用产生游离铁、胆绿素和一氧化碳(CO)作为代谢物gydF4y2Ba17gydF4y2Ba。我们用CO释放分子(CORM,诱导CO生成)FeCl处理Vero76细胞gydF4y2Ba3.gydF4y2Ba(诱导游离铁生成)和胆绿素。将处理后的细胞感染SARS-CoV-2,并评估病毒的复制能力。免疫印迹和qPCR结果显示gydF4y2Ba3.gydF4y2Ba和胆绿素以剂量依赖性的方式显著抑制SARS-CoV-2 RNA和核衣壳蛋白的表达,而CORM则没有(图2)。gydF4y2Ba4gydF4y2Baa, b).此外,三种化学物质CORM, FeClgydF4y2Ba3.gydF4y2Ba和胆绿素未在Vero76细胞中观察到(补充图2)。gydF4y2BaS1gydF4y2Ba)。这些结果表明,由HO-1催化血红素产生的游离铁和胆绿素可以抑制SARS-CoV-2的复制。gydF4y2Ba
HO-1代谢产物的抗病毒作用。证实了一氧化碳、铁离子和HO-1产生的胆绿素对SARS-CoV-2增殖的抑制作用。用CORM(释放一氧化碳)处理,FeClgydF4y2Ba3.gydF4y2Ba在SARS-CoV-2感染前1 h检测胆绿素。感染后24小时,(gydF4y2Ba一个gydF4y2Ba) western blot(也见补充图。gydF4y2BaS4gydF4y2BaD)及(gydF4y2BabgydF4y2Ba) qPCR比较病毒蛋白和RNA含量的变化。***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
HO-1对SARS-CoV-2的非酶活性抗病毒作用gydF4y2Ba
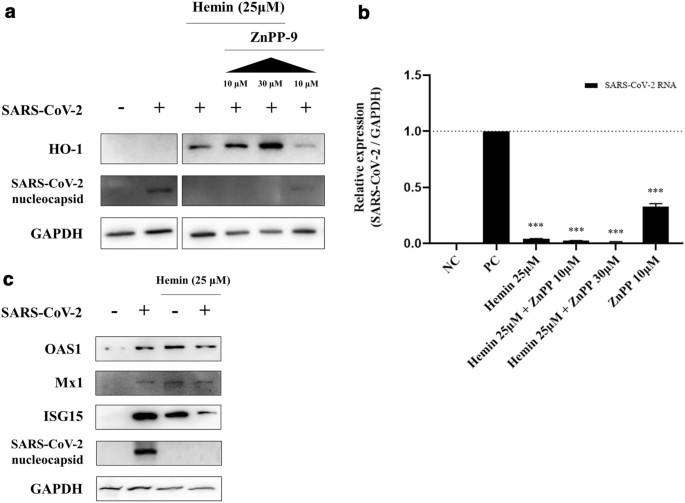
为了确定HO-1的抗病毒活性是否仅与其酶活性相关,我们将HO-1酶活性抑制剂锌原卟啉-9 (ZnPP-9)与血红蛋白一起或单独处理细胞。与单独使用hemin相比,hemin和ZnPP-9同时处理细胞时,观察到SARS-CoV-2 RNA和蛋白质含量的降低幅度更大。gydF4y2Ba5gydF4y2Baa, b)。相反,用HO-1特异性的短干扰RNA (siRNA)短暂敲除HO-1的表达可显著消除HO-1对SARS-CoV-2的抗病毒作用。gydF4y2BaS2gydF4y2Ba)。这些结果表明,抑制HO-1的酶活性并不会降低HO-1的抗病毒活性。此外,我们观察到在10 μM ZnPP-9单独处理的细胞中,HO-1的表达水平较低,并且抑制了SARS-CoV-2的复制(图2)。gydF4y2Ba5gydF4y2Baa, b).已有研究表明,ZnPP-9降低HO-1酶活性,但增加HO-1蛋白的表达。ZnPP-9上调HO-1蛋白可通过IFN途径间接促进抗病毒状态gydF4y2Ba8gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。我们证实血红素诱导的HO-1表达可以促进ifn刺激基因(ISG)蛋白(OAS1、Mx1和ISG15)的表达。在SARS-CoV-2感染细胞、血红素处理细胞和经血红素处理的SARS-CoV-2感染细胞中,OAS1、Mx1和ISG15蛋白的产生均增加(图2)。gydF4y2Ba5gydF4y2Bac).虽然在没有血红蛋白的情况下,在感染SARS-CoV-2的细胞中产生了三种ISG蛋白,但检测到了病毒核衣壳蛋白(图2)。gydF4y2Ba5gydF4y2Bac)。然而,在感染SARS-CoV-2并用血红蛋白处理的细胞中,三种ISG蛋白均有表达,且未检测到病毒核衣壳蛋白(图2)。gydF4y2Ba5gydF4y2Bac).这表明在病毒诱导下产生的isg不能充分抑制SARS-CoV-2的复制。gydF4y2Ba
通过ISG诱导的抗病毒效果,而不是血红素的酶促作用。选择性HO-1酶活性抑制剂ZnPP-9对SARS-CoV-2感染的影响用/不加hemin或ZnPP-9处理Vero76细胞。血红素浓度为25 μM。ZnPP-9不能逆转hemin诱导的HO-1抗病毒作用。(gydF4y2Ba一个gydF4y2Ba)即使在没有hemin的情况下,ZnPP-9也能诱导HO-1蛋白的表达(也见补充图。gydF4y2BaS4gydF4y2BaE)及(gydF4y2BabgydF4y2BaHO-1的诱导也抑制了病毒的复制。(gydF4y2BacgydF4y2Ba) SARS-CoV-2和血红蛋白诱导ISG(另见补充图。gydF4y2BaS4gydF4y2Baf, g).只有在SARS-CoV-2感染下才能诱导ISG蛋白的表达;然而,ISG蛋白不能完全抑制病毒复制。血凝素也诱导了ISG蛋白的表达,抑制了病毒的复制。***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
讨论gydF4y2Ba
目前有几种抗病毒疗法用于治疗病毒感染,其中一些已被发现对COVID-19有效gydF4y2Ba2gydF4y2Ba,gydF4y2Ba19gydF4y2Ba。目前正在研究病毒RNA聚合酶抑制剂(remdesivir/favipiravir)、病毒蛋白合成抑制剂(利托那韦/洛匹那韦)、病毒进入抑制剂(羟氯喹/氯喹)和免疫调节剂(nitazoxanide/伊维菌素)的抗病毒作用;然而,HO-1的抗病毒作用,特别是对SARS-CoV-2的抗病毒作用尚未得到彻底研究gydF4y2Ba19gydF4y2Ba。已知HO-1通过其副产物表现出细胞保护和抗炎活性,这些作用可能有助于调节各种疾病中的炎症gydF4y2Ba20.gydF4y2Ba。已报道了HO-1对呼吸道病毒(包括流感病毒和呼吸道合胞病毒)的免疫调节和抗病毒特性gydF4y2Ba8gydF4y2Ba。最近发表的一篇研究文章假设,血红素诱导的HO-1可能通过刺激抗炎途径来控制SARS-CoV-2感染gydF4y2Ba16gydF4y2Ba。然而,作者没有提供HO-1对SARS-CoV-2抗病毒活性的证据。gydF4y2Ba
在这项研究中,我们首次证明了HO-1可以在体外系统中抑制SARS-CoV-2的复制。我们使用了高效的HO-1诱导剂hemin,这是一种含铁的卟啉,众所周知,它可以诱导HO-1表达,副作用率低gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba。结果表明,在6.25 μM (gydF4y2BaPgydF4y2Ba< 0.01),浓度大于12.5 μM (gydF4y2BaPgydF4y2Ba< 0.001)有效诱导HO-1表达,并在24 hpi内显著抑制病毒复制。当使用CoPP-9或穿心莲内酯治疗病毒感染的细胞时,观察到类似的抗病毒结果。即使在病毒进入细胞后用血凝素处理,病毒蛋白表达仍被抑制,这一事实表明血凝素可能能够在细胞内复制阶段抑制病毒复制,类似于瑞德西韦gydF4y2Ba23gydF4y2Ba。然而,最近的一项研究表明,血红素诱导的HO-1不能抑制SARS-CoV-2感染gydF4y2Ba24gydF4y2Ba。他们证明了细胞培养上清液中病毒RNA水平不变,而我们确定了用血红蛋白处理后细胞中病毒RNA和病毒蛋白的减少。我们和他们研究结果的矛盾可能是由于实验条件和方法不同造成的。gydF4y2Ba
血红蛋白具有细胞保护作用和低细胞毒性。在商业上,hemin的名称为PANHEMATIN®,于1983年获得美国食品和药物管理局批准,其安全性得到保证gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba。在这项研究中,CCgydF4y2Ba50gydF4y2Ba血红素(hemin)值约为169.9217 μM,为细胞毒性指标gydF4y2Ba50gydF4y2Ba值约为0.6805 μM,表示使病毒RNA载量降低50%的药剂浓度。CCgydF4y2Ba50gydF4y2Ba价值大约是欧盟的249.7012倍gydF4y2Ba50gydF4y2Ba值,SI为249.7012。与其他fda批准的化学品相比,血红素的SI表明其作为治疗剂的安全性和有效性gydF4y2Ba25gydF4y2Ba。gydF4y2Ba
为了确定HO-1对SARS-CoV-2抗病毒活性的特异性,我们通过表达载体过表达猴HO-1。在转染猴HO-1基因表达载体的Vero76细胞中成功表达了HO-1,并证实了细胞对SARS-CoV-2复制的抑制作用。这意味着抗病毒作用可能归因于HO-1,而不仅仅是血红素的卟啉作用,它可以阻断病毒的进入,就像在HIV抑制的情况下观察到的那样gydF4y2Ba26gydF4y2Ba。为了研究HO-1抗病毒作用的机制,我们用CORM、FeCl处理细胞gydF4y2Ba3.gydF4y2Ba和胆绿素,以评价HO-1分解血红素代谢副产物的抗病毒作用。这些代谢物已被证明对几种病毒具有抗病毒作用gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba。在我们的研究中,用FeCl处理细胞gydF4y2Ba3.gydF4y2Ba或胆绿素,而不是CORM,显著降低了SARS-CoV-2 RNA和蛋白质滴度(gydF4y2BaPgydF4y2Ba< 0.001),表明HO-1的酶促作用抑制了病毒的生长。然而,当用hemin和选择性HO-1酶活性抑制剂ZnPP-9处理细胞时,对SARS-CoV-2复制的抑制并未逆转。这些结果与siRNA敲除实验不同,siRNA敲除实验抑制了HO-1蛋白的表达,逆转了SARS-CoV-2的抑制。这表明HO-1的抗病毒活性可能是由其酶活性以外的其他作用诱导的。虽然已知ZnPP-9抑制HO-1的酶促作用,但它诱导HO-1蛋白的表达,如我们的结果所示(图2)。gydF4y2Ba5gydF4y2Ba一)gydF4y2Ba18gydF4y2Ba。表达的HO-1通过与IFN调节因子3相互作用间接帮助建立抗病毒状态,从而促进ISGs OAS1、Mx1和ISG15的表达gydF4y2Ba8gydF4y2Ba。I型IFNs (IFN-α和IFN-β)和III型IFNs (IFN-λ)通过ISG蛋白表达对SARS-CoV-2提供有效的抗病毒免疫gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba。然而,在较高的病毒载量下,SARS-CoV-2的复制比抗病毒干扰素反应更快gydF4y2Ba33gydF4y2Ba。在这些条件下,IFN反应不能限制病毒复制,并可能诱发炎症反应,从而引起组织损伤gydF4y2Ba31gydF4y2Ba。在本研究中,我们证明了虽然SARS-CoV-2感染在24 hpi时诱导细胞中ISG蛋白的表达,但病毒的增殖已经完成(图2)。gydF4y2Ba5gydF4y2Bac). HO-1可以促进IRF3磷酸化和核易位,IRF3介导的途径似乎与早期诱导ISG蛋白和抑制SARS-CoV-2复制有关gydF4y2Ba6gydF4y2Ba。gydF4y2Ba
综上所述,血红蛋白在体外对SARS-CoV-2感染有较好的控制作用。hemin处理细胞诱导HO-1表达,通过铁和胆绿素等代谢物直接抑制SARS-CoV-2复制,并通过ISG蛋白间接抑制。HO-1诱导的两种抗病毒机制似乎在体外抑制病毒生长。我们相信这些发现将对COVID-19治疗药物的开发做出重大贡献。gydF4y2Ba
方法gydF4y2Ba
细胞系、病毒和化学物质gydF4y2Ba
Vero76细胞从韩国细胞系库获得,并在含有5% CO的气氛中,在Dulbecco 's modified Eagle 's培养基(DMEM)中添加10%热灭活胎牛血清(FBS, Gibco)gydF4y2Ba2gydF4y2Ba37℃。SARS-CoV-2 S株(NCCP43326)来自国家病原体培养库。Vero76细胞感染NCCP43326的倍数为0.001。将接种病毒的细胞保存在添加2% FBS的DMEM中。氯高铁血红素,FeClgydF4y2Ba3.gydF4y2Ba、CORM、穿心莲内酯、CoPP-9和ZnPP-9购自Sigma-Aldrich,胆绿素购自Cayman Chemical Company。gydF4y2Ba
细胞毒性试验gydF4y2Ba
血红素、CORM-3、FeCl的细胞毒性gydF4y2Ba3.gydF4y2BaMTT法检测Vero76细胞对胆绿素的影响。将Vero76细胞以1 × 10的比例接种于96孔板的每孔中gydF4y2Ba4gydF4y2Ba细胞/。24 h后,连续用血红素处理细胞48 h。去除上清后,加入MTT (5 mg/mL)和新鲜无血清培养基,在5% CO气氛中孵育gydF4y2Ba2gydF4y2Ba37℃。3 h后,加入150 μL的二甲亚砜进行增溶。用分光光度计读板,在540nm处观察活细胞。细胞毒性按CC进行分析gydF4y2Ba50gydF4y2Ba使用未经处理的细胞作为100%活力对照进行比较。gydF4y2Ba
逆转录定量聚合酶链反应(RT-qPCR)gydF4y2Ba
使用RNeasy Mini RNA分离试剂盒(Qiagen)从细胞裂解液中提取细胞内病毒RNA和mRNA,根据制造商的说明使用Patho Gene-spin DNA/RNA试剂盒(内含子)提取上清中的病毒RNA。RT-qPCR采用One Step TB Green®PrimeScript™RT-PCR试剂盒(Takara)和Light Cycler仪器(Roche)进行。利用含有M基因靶序列的质粒DNA生成的标准曲线计算病毒GE拷贝数。病毒基因组拷贝数除以gydF4y2BaGAPDHgydF4y2Ba计算每个细胞所含病毒数,并利用2gydF4y2Ba−ΔΔCtgydF4y2Ba方法。所有实验重复三次以获得可靠的结果。使用的引物序列如下:gydF4y2Ba
sars - cov - 2m基因:正向引物,5 ' -GGYTCTAARTCACCCATTCA-3 ';反向引物,5 ' -TGATACTCTARAAAGTCTTCATA-3 '。gydF4y2BaHO-1gydF4y2Ba:正向引物,5 ' -CTTCAAGCTGGTGATGGC-3 ';反向引物,5 ' -TGGAGCCGCTTCACATAG-3 '。gydF4y2BaGAPDHgydF4y2Ba:正向引物,5 ' -GAAATCCCATCACCATCTTCCAGG-3 ';反向引物,5 ' - GAGCCCCAGCCTTCTCCATG-3 '。gydF4y2Ba
短干扰RNA (siRNA)转染gydF4y2Ba
为了瞬时敲除HO-1,将Vero76细胞以6 × 10的剂量接种于6孔板中gydF4y2Ba5gydF4y2Ba根据制造商的说明,使用Lipofectamine RNAiMax转染试剂转染30 pmol ho -1特异性siRNA (AM16708,检测ID 11152, Thermo Fisher Scientific)或对照siRNA (AM4611, Thermo Fisher Scientific)。siRNA转染1天后,用SARS-CoV-2感染细胞或用25 μM血红蛋白处理细胞。gydF4y2Ba
Western blot分析gydF4y2Ba
接种24 h后,用PBS洗涤细胞3次,收获细胞。细胞裂解使用2× laemmli样品缓冲液(S3401, Sigma), 95°C煮沸。然后将细胞裂解液离心(9000 ×gydF4y2BaggydF4y2Ba1分钟),上清液上载于sds -聚丙烯酰胺凝胶。电泳后,将分离的蛋白转移到硝化纤维素膜上,在含0.05% Tween 20 (PBS- t)的PBS溶液中,用5%脱脂牛奶在4℃下封闭过夜。膜用抗ho -1抗体(SAB1405949, Sigma)、抗gapdh抗体(ab8245, Abcam)或抗sars - cov - 2n抗体(GTX632269, GeneTex)在2.5%脱脂牛奶pbs - t中室温处理1小时。每轮用PBS-T洗涤3次,每次洗涤10分钟,用标记有辣根过氧化物酶的二抗在2.5%脱脂牛奶-PBS-T溶液中处理1小时,每轮用PBS-T洗涤3次,每次洗涤10分钟。使用SuperSignal™West Pico PLUS化学发光底物(Sigma)对蛋白条带进行可视化。gydF4y2Ba
IFAgydF4y2Ba
用IFA法检测SARS-CoV-2刺突蛋白。在24 hpi时,去除上清,用4%多聚甲醛在PBS中固定细胞,在25℃下固定10分钟。将固定的细胞用冰冷的PBS洗涤三次。为检测细胞内病毒蛋白,用含0.5% Triton X-100的PBS对细胞进行透性处理10分钟。透性处理后,每轮PBS洗涤3次,每次5分钟。然后用1%牛血清白蛋白(BSA)在PBS-T中在25℃下阻断细胞30分钟。接下来,将抗sars - cov -2刺突蛋白抗体(GTX632604, GeneTex)用1% BSA稀释PBS-T,将被阻断的细胞作为一抗,在25°C的湿室中处理1小时。一抗反应结束后,将溶液滗出,在PBS中洗涤3次,每次洗涤5分钟。对于二抗反应,细胞用Alexa Fluor 488结合的抗小鼠IgG抗体在PBS-T中与1% BSA在25℃下黑暗处理1小时。随后,将溶液倒入,在PBS中洗涤细胞3次,每次洗涤5分钟。用4′,6-二氨基-2-苯基吲哚进行反染色。gydF4y2Ba
统计分析gydF4y2Ba
实验至少进行三次,数据以均数±标准差表示。绘制了剂量-反应曲线,并绘制了学生的gydF4y2BatgydF4y2Ba采用PRISM 8.0.1 (GraphPad Software)软件进行检验。差异被认为是显著的gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2Ba
数据可用性gydF4y2Ba
本研究中产生或分析的所有数据都包含在这篇发表的文章(及其补充信息文件)中。gydF4y2Ba
参考文献gydF4y2Ba
COVID-19地图-约翰霍普金斯冠状病毒资源中心。gydF4y2Bahttps://coronavirus.jhu.edu/map.htmlgydF4y2Ba。gydF4y2Ba
Frediansyah, A., Tiwari, R., Sharun, K., Dhama, K. & Harapan, H. COVID-19抗病毒药物:关键综述。gydF4y2Ba中国。论文。全球健康gydF4y2Ba9gydF4y2Ba, 90-98(2021)。gydF4y2Ba
拉班,a.a.。gydF4y2Baet al。gydF4y2BaSARS-CoV-2/COVID-19以及开发潜在疗法和疫苗以应对新出现的大流行病毒a的进展综述。gydF4y2BaInfezMedgydF4y2Bahttps://doi.org/10.20944/preprints202004.0075.v1gydF4y2Ba(2020)。gydF4y2Ba
Grochot-Przeczek, A, Dulak, J. & Jozkowicz, A. Haem氧化酶-1:在生理和病理中的非规范作用。gydF4y2Ba中国。科学。gydF4y2Ba122gydF4y2Ba, 93-103(2012)。gydF4y2Ba
血红素激活通过血红素氧合酶-1诱导改善HIV-1感染。gydF4y2Baj . Immunol。gydF4y2Ba176gydF4y2Ba, 4252-4257(2006)。gydF4y2Ba
妈,L。L。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1激动剂CoPP通过irf3介导的IFN-α/β的产生抑制流感病毒的复制。gydF4y2Ba病毒学gydF4y2Ba528gydF4y2Ba, 80-88(2019)。gydF4y2Ba
李,j.c.。gydF4y2Baet al。gydF4y2Ba穿心术内酯通过p38 MAPK/Nrf2途径上调血红素加氧酶-1在人肝癌细胞中发挥抗丙型肝炎病毒活性。gydF4y2BaBr。j .杂志。gydF4y2Ba171gydF4y2Ba, 237-252(2014)。gydF4y2Ba
Espinoza, J. A. González, P. A. & Kalergis, A. M.血红素氧合酶-1对抗病毒免疫的调节作用。gydF4y2Ba点。j .分册。gydF4y2Ba187gydF4y2Ba, 487-493(2017)。gydF4y2Ba
妈,L。L。gydF4y2Baet al。gydF4y2Ba鲁丙酮酸衍生物YZH-106通过激活血红素加氧酶-1介导的干扰素反应抑制流感病毒复制。gydF4y2Ba自由·拉迪奇。医学杂志。地中海。gydF4y2Ba96gydF4y2Ba, 347-361(2016)。gydF4y2Ba
黄,H。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1诱导剂血红素对埃博拉病毒感染的治疗潜力。gydF4y2Ba咕咕叫。Immunol趋势。gydF4y2Ba17gydF4y2Ba, 117(2016)。gydF4y2Ba
肖,S。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1是猪繁殖与呼吸综合征病毒感染的抗病毒因子,其过表达可抑制病毒的体外复制。gydF4y2Ba小红伞。Res。gydF4y2Ba110gydF4y2Ba, 60-69(2014)。gydF4y2Ba
金,D.-H。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1在体外对甲型肝炎病毒具有抗病毒活性。gydF4y2Ba制药学gydF4y2Bahttps://doi.org/10.3390/pharmaceutics13081229gydF4y2Ba(2021)。gydF4y2Ba
卡拉穆尼,c.e.。gydF4y2Baet al。gydF4y2Ba寨卡病毒破坏血红素加氧酶-1抗病毒活性。gydF4y2Ba病毒gydF4y2Ba11gydF4y2Ba, 2(2018)。gydF4y2Ba
埃斯皮诺萨,j.a.。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1在感染过程中调节呼吸道合胞病毒的复制和肺部发病机制。gydF4y2Baj . Immunol。gydF4y2Ba199gydF4y2Ba, 212-223(2017)。gydF4y2Ba
氯喹和羟氯喹作为抗疟药和抗病毒药物对抗SARS-CoV-2:血红素因子。gydF4y2Bahttps://doi.org/10.31219/osf.io/8d6xvgydF4y2Ba(2020)。gydF4y2Ba
Rossi, M., Piagnerelli, M., Van Meerhaeghe, A., Zouaoui Boudjeltia, K.血红素加氧酶-1 (HO-1)细胞保护通路:新冠病毒病(COVID-19)诱导的细胞因子风暴综合征的潜在治疗策略。gydF4y2Ba地中海。假设gydF4y2Ba144gydF4y2Ba科学通报,110242(2020)。gydF4y2Ba
为什么血红素需要被分解成铁、胆绿素IXα和一氧化碳?gydF4y2BaAntioxid。氧化还原信号。gydF4y2Ba6gydF4y2Ba; 819-824(2004)。gydF4y2Ba
杨,G。gydF4y2Baet al。gydF4y2Ba原卟啉锌对HO-1诱导和细胞凋亡的独特作用。gydF4y2Ba血gydF4y2Ba97gydF4y2Ba, 1306-1313(2001)。gydF4y2Ba
Kausar, S。gydF4y2Baet al。gydF4y2Ba综述:抗病毒药物的作用机制。gydF4y2BaInt。j . Immunopathol。杂志。gydF4y2Ba35gydF4y2Ba, 205873842110026(2021)。gydF4y2Ba
Ryter, S. W.和Choi, A. M. K.靶向血红素氧化酶-1和一氧化碳的治疗性炎症调节。gydF4y2BaTransl。Res。gydF4y2Ba167gydF4y2Ba, 7-34(2016)。gydF4y2Ba
巴鲁查,a.e。gydF4y2Baet al。gydF4y2Ba首次在人体中证明血红素加氧酶-1在人体中的药理激活。gydF4y2Ba中国。杂志。其他。gydF4y2Ba87gydF4y2Ba, 187-190(2010)。gydF4y2Ba
h·L·邦科夫斯基。gydF4y2Baet al。gydF4y2Ba美国急性卟啉症:来自卟啉症联盟的108名受试者的特征。gydF4y2Ba点。j .地中海。gydF4y2Ba127gydF4y2Ba, 1233-1241(2014)。gydF4y2Ba
王,M。gydF4y2Baet al。gydF4y2Ba瑞德西韦和氯喹在体外有效抑制新发新型冠状病毒(2019-nCoV)。gydF4y2Ba细胞Res。gydF4y2Ba30.gydF4y2Ba, 269-271(2020)。gydF4y2Ba
大师,S。gydF4y2Baet al。gydF4y2Ba血红素加氧酶-1诱导剂血红素不抑制SARS-CoV-2病毒感染。gydF4y2Ba生物医学。Pharmacother。gydF4y2Ba137gydF4y2Ba, 1-4(2021)。gydF4y2Ba
Touret F。gydF4y2Baet al。gydF4y2BaFDA批准的化学文库的体外筛选揭示了SARS-CoV-2复制的潜在抑制剂。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba中文信息学报,13093(2020)。gydF4y2Ba
杨建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。gydF4y2BaAntimicrob。代理Chemother。gydF4y2Ba46gydF4y2Ba中文信息学报,3917-3925 (2002)gydF4y2Ba
张。gydF4y2Baet al。gydF4y2Ba细胞保护酶血红素加氧酶-1抑制假狂犬病毒的体外复制。gydF4y2Ba前面。Microbiol。gydF4y2Ba11gydF4y2Ba, 412(2020)。gydF4y2Ba
曾志强。gydF4y2Baet al。gydF4y2Ba人血红素加氧酶1是一种潜在的抗登革病毒复制的宿主细胞因子。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 1-16(2016)。gydF4y2Ba
莱曼,E。gydF4y2Baet al。gydF4y2Ba血红素加氧酶1产物胆绿素通过增加抗病毒干扰素反应干扰丙型肝炎病毒复制。gydF4y2Ba肝脏病学gydF4y2Ba51gydF4y2Ba, 398-404(2010)。gydF4y2Ba
Mantlo, E, Bukreyeva, N., Maruyama, J., Paessler, S.和Huang, C. I型干扰素对SARS-CoV-2感染的抗病毒活性。gydF4y2Ba小红伞。Res。gydF4y2Ba179gydF4y2Ba中文信息学报,104811(2020)。gydF4y2Ba
Iwasaki, A. I型和III型干扰素的诱导、信号传导、逃避和应用:抗击COVID-19。gydF4y2Ba细胞宿主微生物gydF4y2Ba27gydF4y2Ba中文信息学报,870-878(2020)。gydF4y2Ba
Martin-Sancho, L。gydF4y2Baet al。gydF4y2BaSARS-CoV-2细胞限制的功能景观。gydF4y2Ba摩尔。细胞gydF4y2Bahttps://doi.org/10.1016/j.molcel.2021.04.008gydF4y2Ba(2021)。gydF4y2Ba
奇马拉,n.r.r。gydF4y2Baet al。gydF4y2Ba抗病毒反应的大小和时间决定了SARS-CoV-2在感染早期的复制。gydF4y2BamedRxivgydF4y2Bahttps://doi.org/10.1101/2021.01.22.21249812gydF4y2Ba(2021)。gydF4y2Ba
致谢gydF4y2Ba
本研究由韩国农林科技规划与评价研究所(IPET)通过农业、食品和农村事务融合技术培养创新全球领袖计划(或项目)支持,由农业、食品和农村事务部(MAFRA)资助(320005042SB0a0)。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
d - h - k和i - s - c构思、设计和验证了整个研究。h - s - a、h - j - g、d - y - k和j - h - k参与了实验的准备和实施。J.-B.L S.-Y.P。,C.-S.S S.-W.L S.-D.H,林祖嘉和I.-S.C.监督实验。d - h - k和i - s - c撰写了主要手稿并准备了所有数据。南卡罗莱纳州为收购提供资金。所有作者审阅了最终稿件并批准了提交。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
金,DH。,Ahn, HS., Go, HJ.et al。gydF4y2Ba血红素作为新候选物通过血红素加氧酶-1诱导治疗COVID-19。gydF4y2BaSci代表gydF4y2Ba11gydF4y2Ba, 21462(2021)。https://doi.org/10.1038/s41598-021-01054-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41598-021-01054-3gydF4y2Ba
这篇文章是由gydF4y2Ba
穿心莲内酯通过上调血红素加氧酶-1在人气道上皮细胞中发挥抗呼吸道合胞病毒活性,而不依赖于干扰素反应gydF4y2Ba
分子生物学报告gydF4y2Ba(2023)gydF4y2Ba
血红素加氧酶1与中重度COVID-19患者脓毒症发展的关系:一项单中心、回顾性观察性研究gydF4y2Ba
欧洲医学研究杂志gydF4y2Ba(2022)gydF4y2Ba
重组腺病毒表达的犬干扰素lambda 3对犬冠状病毒、犬细小病毒和犬瘟热病毒的抗病毒活性gydF4y2Ba
兽医研究通讯gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba