摘要
在病毒大流行中,需要进行一些重要的测试才能成功地控制病毒并降低感染的严重程度。在这些测试中,抗体中和能力测试对于评估通过疫苗接种获得的人群免疫力以及测试为对抗感染而制造的抗体的治疗价值至关重要。在这里,我们报告了一种灵敏的技术来检测针对SARS-CoV-2病毒的各种抗体的相对中和强度。我们使用明亮、光稳定、无背景、荧光上转换的纳米颗粒与SARS-CoV-2受体结合域结合作为幻影病毒粒子。涂有血管紧张素转换酶2 (ACE-2)蛋白的玻璃底板模拟靶细胞。当样品中不存在中和性IgG抗体时,颗粒会以高亲和力与ACE-2结合。相反,中和抗体可以防止颗粒附着在ace -2包被的底物上。一个由定制的共聚焦显微镜组成的原型系统被用来量化颗粒附着在基板上。灵敏度可达4.0 ng/ml,动态范围为1.0 ~ 3.2 ng/ml\ \ upmu \ ()克/毫升。这将与市售试剂盒的19 ng/ml灵敏度进行比较。
介绍
COVID-19大流行表明,配备适当工具的研究人员如何能够将科学进步迅速转化为医疗保健的改善,例如快速病毒基因组测序1,快速抗原增殖2,3.,抗体4,5,6,7,8,9核酸检测10,11,快速测定新的蛋白质结构12以及基于稳定版本的病毒刺突蛋白的疫苗13.在这种大流行中,预计疫苗接种将是控制感染迅速蔓延和随后住院治疗的主要工具。理想情况下,当每个接种疫苗的个体产生足够强度和特异性的抗体来中和病毒时,这种模式发挥最佳作用。在实践中,个体之间的差异、抗体的群体动态和病毒的频繁突变会迅速降低疫苗的有效性14,15,16.目前仍缺乏改进的大流行管理工具之一是一种快速、可靠的测定血清中是否存在中和抗体的方法。这将有助于决定重新接种疫苗的时机和计算群体免疫力,并将为不断增长的病毒变体库提供一个探针17.此外,作为抗体治疗方法而产生的实验室产生的抗体,需要用一种灵敏的试验来评估,以量化其中和潜力。
中和抗体的定义是它能够阻止病毒与易感细胞相互作用,从而导致感染18,19,20..中和抗体在接种疫苗两周后首次出现21,大致在同一时间,这种保护变得明显22.目前测量抗体中和水平的方法需要活细胞和完整的SARS-CoV-223或由装饰有SARS-CoV-2刺突蛋白的通用外壳组成的病毒样颗粒24并且在成本、专业知识和时间方面难以在更广泛的护理点使用。
近年来,生物单分子的荧光检测得到了广泛的应用25,26,27,28,29,30..然而,荧光染料的光漂白仍然是荧光读数的挑战。此外,单分子检测往往需要高分辨率显微镜和较长的采集时间,限制了其应用24,25,26,27,28,29,30..为了解决光漂白问题,使用镧系掺杂的上转换纳米粒子(UCNPs)作为荧光标记已被证明是有益的。例如,Farka等人使用UCNPs作为荧光标记,在25%的血清中检测前列腺特异性抗原,灵敏度为1.2 pg/ml (42 fM)31.UCNPs可以被红外激光激发,并在长时间曝光后保持稳定。此外,在宽视场照明配置中使用高功率激光器可以增加荧光信号并减少采集时间,从而导致更快的测量。研究表明,与市售的检测方法相比,使用高度稳定的UCNPs可以将上转化联免疫吸附试验(ULISA)的检测限(LOD)提高一个数量级30.,31.更灵敏的光学读数也可以提高这种生物测定的LOD32,33.这些单分子检测的进展正在推动灵敏度、特异性和LOD超越曾经在理论上可能的水平34,35,36.
在这里,我们展示了使用量子光学工具确定抗sars - cov -2抗体中和活性的安全、简单、低成本检测的概念验证。我们使用荧光UCNPs来测量抗体在阻止SARS-CoV-2受体结合域(RBD)与血管紧张素转换酶2 (ACE-2)结合方面的相对有效性。本研究提出的方法符合SARS-CoV-2中和抗体可以阻止病毒刺突蛋白RBD与ACE-2外结构域相互作用的原理37.对于使用的一个克隆抗体,我们计算出中点拐点(IC50)为12 ng/ml (80 pM), LOD为4 ng/ml (33 pM),定义为浓度低于平均阴性对照值两个标准差。
结果与讨论
上转换纳米颗粒型中和免疫测定试剂盒(UNIK)
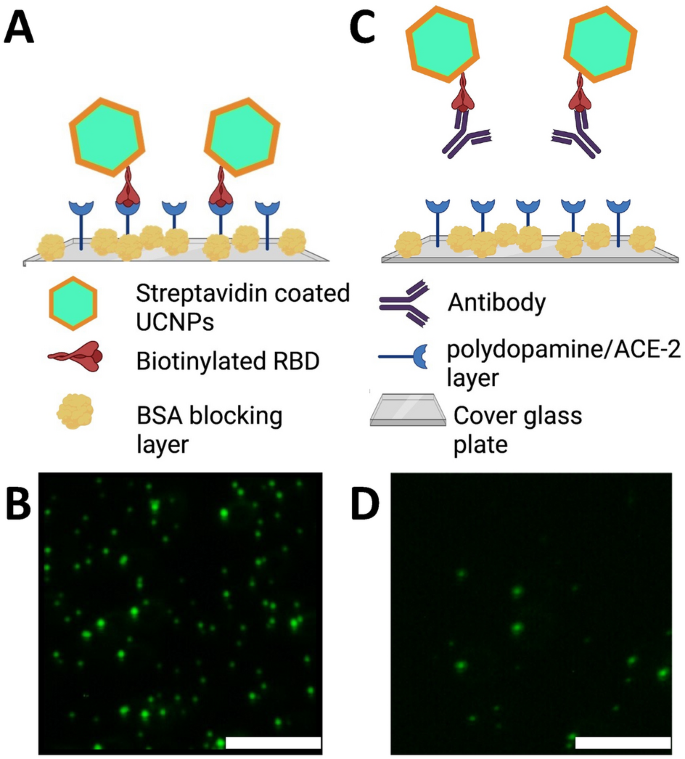
上转换纳米颗粒基中和免疫测定试剂盒(UNIK)的基本原理如图所示。1.该检测依赖于RBD和ACE-2蛋白之间的天然亲和力。为了充分利用这一特性,我们采用链霉亲和素共轭上转化纳米颗粒和生物素化RBD来制备上转化纳米颗粒幻影病毒粒子(UCPV)。如果样品中不存在抗体(或者样品中存在的抗体是非中和性的),则幻影病毒粒子将不受任何阻碍地与底物结合。因此,从这些样品中拍摄的图像将显示出高颗粒计数(图2)。1A、B)。另一方面,如果抗体有效中和RBD,则会阻碍幻影病毒粒子与ACE-2的结合,从而在图像中观察到较低的颗粒计数(图2)。1C,D),与不存在抗体的阴性对照样品相比,如图所示。1A、B。
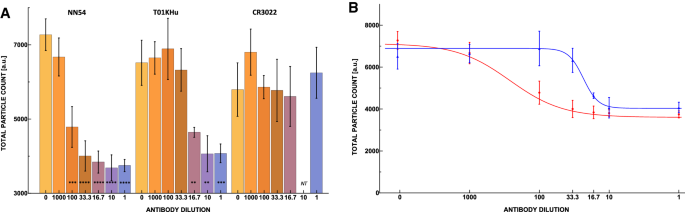
(一个)中和抗体克隆NN54(左)和T01KHu(中)对非中和但结合的抗体克隆CR3022(右)的中和活性,表示为每个倒数稀释因子的3次重复平均10个图像的总颗粒计数。最高浓度为3.23\ \ upmu \ ()克/毫升。每个条形图都标有等价物p值星号标识。NT表示未经测试。(B)中和抗体NN54(红色)和T01KHu(蓝色)数据拟合的4参数logistic曲线。NN54和T01KHu的IC50分别为12 ng/ml (80 pM, 1:9 9 9稀释倍数)和138 ng/ml (933 pM, 1:23稀释倍数)。计算NN54和T01KHu的Hill系数分别为1.148和4.0836,见IC50和Hill系数”。
ACE-2/聚多巴胺包被板的评价
玻璃底板涂覆ACE-2/聚多巴胺混合物。通过测定ACE-2与小鼠IgG Fc标记的SARS-CoV-2 RBD的结合情况来评估ACE-2的活性。用Alexa flu633山羊抗小鼠抗体检测RBD。荧光光谱见附图S4(B, D, E, H)。为了确保非特异性结合或自身荧光信号最小化,进行了几次对照实验(补充图)S4).补充图S4A为阳性对照试验,用ACE-2/聚多巴胺混合物包被,然后用5% BSA溶液阻断(补充资料)。下一层是带小鼠Fc标签的RBD,用山羊抗小鼠抗体Alexa flu633检测。补充图S4B为638 nm激光获得的Alexa荧光光谱。这个光谱清楚地显示了这个样品的阳性。补充图S4C为阴性对照试验,不孵育带有Fc标签的RBD,而孵育1\ \(\倍)PBS作为阴性对照样本。补充图S4D显示了用638 nm激光从该样品中获得的Alexa荧光光谱。这个频谱清楚地显示了这个样本的负性,因为只有背景读出信号。补充图S4E为缺失Alexa flu633山羊抗小鼠抗体的对照样品。由于在这些测量中,激发激光是638 nm激光,因此有可能从板上的任何元素产生自动荧光背景。为了检查是否有自体荧光,我们准备了这个样品并扫描了它。补充图S4F为补充图中样品用638 nm激光获得的Alexa荧光光谱S4E.该频谱清楚地显示了该样本的负性,因为只有背景读出信号。所以,底片上其他元素发出的自动荧光信号很小。补充图S4G为缺失ACE-2蛋白的对照试验。该板涂有1\ \(\倍)PBS和聚多巴胺,然后用5% BSA阻断。本试验的目的是测量RBD与小鼠Fc标签和次级Alexa荧光偶联抗体复合物在ace -2包被板上的非特异性结合程度。补充图S4H为补充图中638 nm激光获得的Alexa荧光光谱S4G.该光谱显示该样品的小背景。然而,在补充图中显示了积极的信号S4B大约是这个背景的16倍大。
非特异性结合
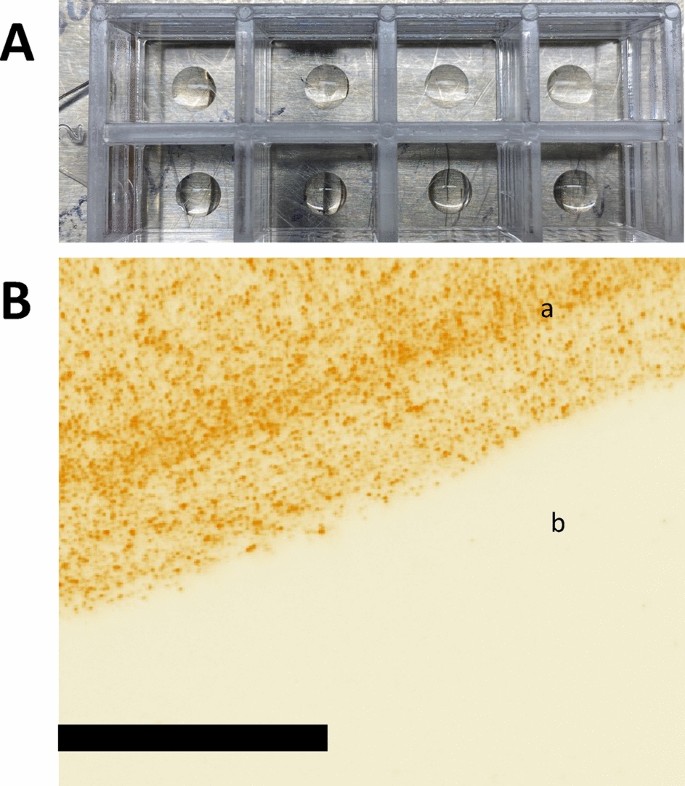
使用任何类型的板进行生物测定的问题之一是非特异性结合。幻影病毒粒子与ace -2包被板之间的非特异性结合会增加背景信号,从而降低LOD和灵敏度。带正电荷的多多巴胺分子可以在没有ACE-2和RBD参与的情况下与幻影病毒粒子结合。此外,印版涂层或ucpv上的任何缺陷都会增加非特异性结合。为了评估这一点,我们制备了ACE-2/聚多巴胺包被板和1 × PBS/聚多巴胺包被板,都用5% BSA阻断,以表明幻影病毒粒子只有在ACE-2蛋白与聚多巴胺混合并镀在底物上时才能与底物结合。为了测试颗粒与ACE-2包被板的亲和性,并与空白和封闭板(未使用抗体)进行比较,我们对包被区域的边缘进行了成像(通过在玻璃板上粗糙标记和包被区域干燥后的咖啡环效应找到边缘的位置)。数字2A表示10\ \ upmu \ ()聚多巴胺/ACE-2蛋白包被。由于每口井只有一定的区域被覆盖,我们预计只能在被覆盖的区域找到颗粒。数字2B显示幻影病毒粒子粒子与包被区域之间的结合非常高,而一侧的未包被区域未显示UCPV与阻塞的空白玻璃盖层之间的非特异性结合(有效成像面积为145)\ \ upmu \ ()M乘145\ \ upmu \ ()米)。
我们还用聚多巴胺和PBS混合物包被板,并用5% BSA阻断缓冲液阻断,以研究聚多巴胺和ucpv之间可能出现的非特异性结合(补充图)S5).基于ucpv和聚多巴胺之间没有亲和力的假设,我们预计在这些板上看到非常低的颗粒计数。补充图S5显示同一样品的三个不同区域的三幅图像,从涂层区域的中心拍摄,图像中只有少数颗粒可见(有效成像面积为145)\ \ upmu \ ()M乘145\ \ upmu \ ()m).颗粒在图像的暗背景上显示为衍射受限的小绿点。这些结果(图1)2及补充资料S4和S5)证明了ACE-2包被区域与UCPV的结合是由RBD与ACE-2蛋白之间的天然亲和力特异性引起的。值得注意的是,这些非特异性结合是由于底物和颗粒的表面缺陷,以及颗粒和底物的蛋白质涂层完整性造成的。例如,过度超声(这是UCPV准备程序的一个步骤;(参见补充材料)会损坏和变性纳米颗粒的蛋白质涂层,要么是由于过度加热,要么是由于纳米颗粒小瓶内的浴声发生器产生的高压波。优化每一步并注意这些细节可以减少非特异性结合的数量。
IC50和Hill系数
为了测试ucpv对抗体的中和能力,我们对抗体克隆NN54、T01KHu和CR3022进行了连续稀释,并将等量的抗体稀释液与等量浓度的ucpv混合(表1)1).计算稀释后,每个板上的最终样品体积与所有样品的ucpv浓度相同。但每个样品中抗体的浓度不同(即每个样品中颗粒与抗体的比例不同)。表格1显示每个数据点的最终抗体浓度。
根据制造商的中和抗体NN54数据表,对该抗体进行的基于elisa的中和检测试剂盒显示平均IC50点(定义见下文)为0.857 nM (0.129)\ \ upmu \ ()g / ml)38.对于中和抗体T01KHu,制造商报告的最低IC50点为0.1\ \ upmu \ ()克/毫升39.对于CR3022,有报道称该抗体不能阻断RBD与ACE-2蛋白的结合40.
当前工作中的IC50点定义为通过拟合四参数logistic函数估计的信号计数为(最大计数-最小计数)/2的浓度:
在哪里Y是总数,一个是最小计数,B是最大计数,浓缩的在使用的抗体浓度中,集成电路50是计数为50%时的抗体浓度hc为希尔系数(见拟合函数的补充资料)。
计算得出NN54和T01KHu的IC50点分别为12 ng/ml (80 pM)和138 ng/ml (933 pM)。3.分别B)。该检测还能够在抗体与ucpv相互作用的背景下区分抗体各自的希尔系数。希尔系数已被用来衡量多价结合体系的协同性41,42.在剂量-响应曲线中,计算得到NN54和T01KHu的Hill系数分别为1.148和4.0836。与NN54相比,T01KHu的结合更接近于多配体相互作用。这些参数是通过使用在线工具(补充材料)将4参数逻辑函数拟合到数据集来计算的。37.因此,我们可以根据抗体与ucpv结合的强度(IC50)和协同性(希尔系数)来区分抗体。
数字3.A,B显示随着抗体浓度的增加,中和抗体NN54和T01KHu的有效性。他们还表明,非中和克隆CR3022不能阻止ucpv与ACE-2涂层板结合。该方法可以在不使用酶增强的情况下,高灵敏度地区分IC50点,并确定具有较高亲和力的抗体。该实验还显示了这两种抗体的Hill系数的差异,这表明T01KHu是一个多配体相互作用,而NN54似乎是一个单配体相互作用。
在比较图中的结果时应该谨慎。3.有其他来源报告的结果,例如抗体和测试制造商报告的结果。例如,NN54的制造商报告了两种不同中和试验对同一抗体的两个ic50。在其中一个国家,他们报告的IC50平均值为1.41\ \ upmu \ ()g/ml从涉及293T/ACE-2细胞的中和试验中获得38.这些细胞被假型荧光素酶rssars - cov -2刺突感染,并改变中和抗体的浓度,观察有多少细胞未被刺突感染38.在另一项测试中,他们报告的IC50为0.129\ \ upmu \ ()g/ml用抑制剂筛选ELISA试剂盒测定。正确的IC50值是多少这个问题似乎无关紧要,因为这些测试的参数不同,它们的目标也不同。简而言之,每次测试都针对一定的动态范围和特定的LOD进行优化。
例如,要了解测试参数如何与LOD相互作用,可以注意蛋白质配体复合物与总蛋白质分子的比率(\θ(\ \)值)。为了简单起见,我们可以假设ACE-2是我们测试中的蛋白质,UCPV是配体。酶促反应和RBD在中和酶联免疫吸附试验中的结合相当于我们试验中的UCPV。蛋白质配体复合物与总蛋白质的比例,\θ(\ \),为(见补充材料证明):
在哪里\θ(\ \)是蛋白质分子与配体结合的比率。\ ((PL), [P] _ {t}, [L] _ {t} \),\ (K_ {d} \)分别为蛋白质-配体复合物的总浓度,蛋白质的总浓度,配体的总浓度,蛋白质和配体的解离常数。的浓度\ ([L] _ {t} \)当\θ= 0.5 (\ \)(IC50浓度)可由式(2)和简单代数
可以看出,现实中的IC50浓度取决于两个参数。一个是总蛋白质浓度,另一个是\ (K_ {d} \)价值。用情商。3.,对于我们的分析更复杂的情况,我们可以推导出抗体浓度的以下关系(见补充材料以证明)
在哪里\ ([UCPV] _{总}\)为UCNP总浓度,[ACE]为ACE-2蛋白总浓度,\ (K_ {d} ^ {(1)} \)为UCPV与ACE-2的解离常数,\ (K_ {d} ^ {(2)} \)为UCPV与中和抗体之间的解离常数。在我们的工作中,只有UCPV浓度和ACE-2浓度可以被控制和操纵来降低IC50浓度。补充图S7显示了\(\离开了。[b]\右| _{\text {IC50}}\)作为ACE-2浓度的函数,对于不同UCPV浓度值。可以看出,我们需要最大化底物上ACE-2蛋白的量,同时将UCPV浓度优化到尽可能低的量。合理地说,通过减少ucpv,我们减少了完全阻断它们所需的抗体数量,而通过最大化ACE-2蛋白,我们增加了在底物上捕获的未阻断ucpv的数量。
在像ELISA这样的测试中,降低RBD浓度意味着更少的实际RBD - ace复合物将在以后被检测到(通过抗配体二抗和酶促增强,荧光染料等)。由于LOD是一个任意的选择,我们可以为这个简单的例子选择IC50浓度,我们可以得出结论,不同的测试涉及不同数量的蛋白质浓度,并且针对特定的动态范围和不同的LOD进行了优化。
敏锐的观察者可能会问:对于NN54和T01KHu抗体,为什么制造商报告的ic50浓度相似,为0.129\ \ upmu \ ()G /ml和0.1\ \ upmu \ ()分别g / ml。补充图S8这说明了各公司得出类似结果的原因。当我们开始\([P]_{t}=19\text {nM}\),\(K_{d}=1\text {nM}\)和\([P]_{t}=1\text {nM}\),\(K_{d}=10\text {nM}\),我们看到这两种情况的IC50浓度是相同的,显然,我们假设的是不同的\ (K_ {d} \)值。制造商测试条件的差异可能是他们相似结果的原因。
从两个重要因素来看,英国的优势是显而易见的。首先,它可以区分两种不同中和抗体的IC50浓度和Hill系数。第二,虽然检测限(LOD),定义节。2.8)是UCPV浓度、抗体与UCPV亲和力以及UCPV与ACE-2亲和力的函数\ (K_ {d} \)值,如式。4),其LOD比引用的商业测试好一个数量级,其中报道的最佳LOD为19 ng/ml43.我们的研究结果表明,适当优化UCPV的浓度,同时最大化每个UCNP的RBD数量(120:1)和最大化底物上的ACE-2蛋白可以提高LOD。这是因为我们可以检测到单分子结合,因此我们可以将UCPV浓度降低到如此低的量,以至于需要较低浓度的中和抗体来阻断它们,而UCPV仍然可以被检测到(如式2所述)。4).LOD对的依赖\ (K_ {d} \)S. Zhang等人也得出了相同的结论。36.如Eq所示。4,在英国的LOD中起作用的因素是\ (K_ {d} \)UCPV与ACE-2蛋白之间的比值;\ (K_ {d} \)UCPV与抗体、UCPV总浓度、ACE-2蛋白总浓度之间的比值。最好为每个特定的分析推导出这样的方程,以最大限度地提高LOD。
的量子描述\θ(\ \)
有可能给出一个“量子”(即离散和概率)替代前一节对蛋白质-配体结合过程的纯代数处理\ (P + L \ rightleftharpoons PL \).基本思想是观察人口n蛋白质配体复合物PL作为一个可以取离散值的随机变量\ (n = 0, 1, \ ldots \).它的概率分布\ \ {p_n \} \ ()随着时间的推移向平衡分布演化,由于竞争反应的产生(单位增加)n当一个人P和一个l结合在一起形成PL)和死亡(单位减少n当一个人PL解离)。这种模型在概率论中被称为生-死过程44.生灭形式论在激光量子理论中得到了大量的应用,特别是在获得光子统计方面45.
更详细地说,我们假设一个州的出生率n来\ (n + 1 \)的\(\lambda _{n}=\alpha (a-n)(b-n)\)还有死亡率n来\ \ (n - 1)的\(\mu _{n}=\beta n\).在这里\α> 0 (\ \)和\ \(β> 0 \)起到结合和解离速率常数的作用,而一个和b表示的初始种群P和l,这就像n都被限制为整数,但不像n是精确指定的(不是概率的)。然后是概率\ (p_n \)是由微分方程决定的吗
我们对平衡行为感兴趣,所以我们寻求的是的稳态解5,即给出的概率分布\ \(压裂{dp_ {n}} {dt} = 0 \),也就是
与\ (p_ {0} \)由归一化决定\(\sum _{n} p_{n} = 1\).给定的出生率和死亡率\ \(λ_ {n} \)和\(μ_ {n} \ \),6可以用概率生成函数来描述吗
在哪里\ (f {0} _ {2} \)是一个广义超几何函数。的预期人口PL平衡时为
在考虑数值计算时,最好使用cast8变成了一种更符合参数连续性的形式。为此,我们使用了超几何函数的恒等式46, Eq. 16.2.3]得到
在哪里\ (_1F_1 \)为Kummer的合流超几何函数。借助另一个身份46, Eq. 13.2.39]我们终于有了
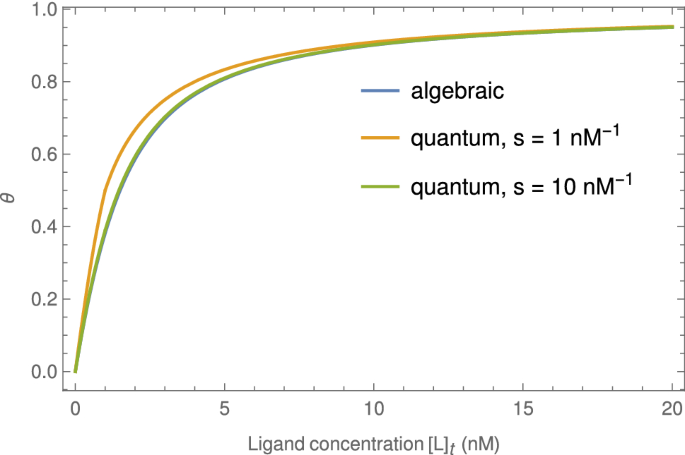
当数值计算时,这个表达式与质量作用定律的非概率处理非常吻合2(见图。4).为了使比较准确,我们应该进行替换\(a\rightarrow s [P]_t\),\ (b \ rightarrow s [L] _t \),\(\beta /\alpha \右箭头s K_d\)在10,在那里年代是将单位浓度转化为分子数的常数。原则上年代是阿伏伽德罗常数和实验体积的乘积,尽管在实践中\θ(\ \)的小值已经令人满意了年代.
抗体浓度在IC50,\(\离开了。[b]\右| _\text {IC50}\),可以通过模拟上一节的计算,但使用10而不是2表达平衡蛋白配体浓度。其结果与代数结果难以区分(见补充资料中的图)。在实践中\(\离开了。[b]\右| _\text {IC50}\)在使用时必须使用数值查找根例程10,作为方程\(θ_1 = 1/2 \ \)不适合封闭形式的解决方案。
ucpv浓度优化
在中和试验中,如UNIK,抗原浓度起着重要作用。在这项工作中,RBD是抗原,它与UCNP预结合。实验中RBD的浓度取决于两个因素,每个UCNP结合的RBD的数量和UCPV的最终工作浓度。文献报道了几种优化ucnp -蛋白偶联物的方法30.,31.我们决定将UCNP上的RBD数量固定在每1个UCNP上120个RBD,并优化所得到的ucpv的浓度31.数字S3给出了本实验的浓度优化结果。在0.1之间\ \ upmu \ ()G /ml和1\ \ upmu \ ()g/ml,每张图像的平均颗粒数变化迅速,随ucpv浓度的增加而增加。在这个区域,对于我们使用的RBD与UCNP的比例,我们具有最大的灵敏度。由于中和抗体的存在,UCPV浓度的轻微下降将导致图像中可计数颗粒的可测量变化。
Non-neutralizing抗体
区分一种结合但不中和感染性的抗体与一种真正中和性的抗体是很重要的,后者将提供对感染的直接保护。在克隆CR3022的情况下,它的结合不会阻断ACE-2蛋白特异性RBD上的结合位点40.在单独的实验中,将CR3022 IgG抗体系列稀释液与ucpv混合并进行测试(见补充资料中的描述)。结果如图2所示。3.A,表明在所有这些稀释度下,每次扫描的平均颗粒计数与对照样品保持相对接近(无统计学意义;p值\(\ > 0.1\),参见补充资料)。在这项工作中,我们将中和活性定义为抗体在ACE-2蛋白结合的位置与RBD结合。因此,CR3022不是一种中和抗体40.
检出限
本试验的检出限(LOD)定义为阴性对照标准偏差低于阴性对照平均计数两倍的浓度43.使用该定义和校准曲线,我们估计了该试验对两种中和抗体的LOD,详见补充材料。NN54和T01KHu的LOD估计为0.004\ \ upmu \ ()G /ml和0.128\ \ upmu \ ()分别g / ml。此外,基于p每个数据点的值,我们可以得出0.00323之间有统计学意义的结论\ \ upmu \ ()克/毫升(p值0.19)和0.0323\ \ upmu \ ()克/毫升(p值0.0034)。因此,在实践中,可以假设NN54的检测限为0.0323\ \ upmu \ ()克/毫升。对于T01KHu,首先在0.0968之间观察到统计学显著性\ \ upmu \ ()克/毫升(p值0.71)和0.196\ \ upmu \ ()克/毫升(p值0.0065),因此,该抗体的检出限可假定为0.196\ \ upmu \ ()克/毫升。
分析可修改性
根据SARS-CoV-2变体或其他病毒物种进行调整后,也可能进行其他变化。为了修改该试验,可以将其他SARS-CoV-2变体的RBD放在颗粒上,并将ACE-2蛋白放在底物上。对于每个RBD变体,也可以使用具有不同荧光发射的多种上转换纳米颗粒类型。例如,我们可以共轭NaYF\ (_4 \)携带SARS-CoV-2 RBD α变体和NaYF的Yb/Tm颗粒(激发峰在980 nm,发射波段在375 nm和450 nm左右)\ (_4 \)携带SARS-CoV-2 RBD δ变体的Yb/Er颗粒(激发峰在980 nm,发射波段在550 nm和650 nm左右)。因此,我们可以同时测试针对两种病毒变体的抗体。这是我们未来学习计划的一部分。
结论
我们已经证明,UNIK可以有效地用于测定COVID-19抗体的中和活性。结果表明,通过适当的优化,我们可以检测到SARS-CoV-2病毒的抗体。通过考虑蛋白质-配体结合模型,我们推导出了50%相对颗粒数时抗体浓度的表达式,并确定了影响检测限的重要参数。尽管检测限取决于UCPV的浓度以及抗体和UCPV的亲和力,如在NN54和T01KHu抗体的情况下所见,我们报告该试验的最低检测限为4 ng/ml (27 pM,为中和抗体克隆NN54计算)。纸质ELISA检测COVID-19抗体报告为9.00 ng/\ \ upmu \ ()L(即9.00美元)\ \ upmu \ ()G /ml)检出限47.开曼化学公司的一种现成的商业中和试验报告LOD为19 ng/ml43.使用血清样本评估该检测方法的性能,以及使用人类恢复期血浆测量受试者工作特征曲线(ROC曲线),以及上述检测方法的其他变化是我们未来研究的主题。我们还表明,在定义LOD时必须谨慎,因为两个测量参数取决于各种因素,导致即使在相同条件下使用不同样品也会产生不同的LOD。
方法
除非另有说明,本节中的所有培养步骤均在室温下进行。
上转化纳米粒子幻影病毒粒子(UCPV)的制备方法如下:简单地说,链霉亲和素包被的上转换纳米颗粒是从Creative Diagnostics购买的(所有材料的零件号列在补充材料表中)S1).它们被稀释成200\ \ upmu \ ()L,浓度0.5 mg/ml,超声10分钟。然后10\ \ upmu \ ()加入1份0.2 mg/ml生物素化RBD,在旋涡混合器上低速静置1小时。随后,通过离心洗涤颗粒3次,用新鲜的实验缓冲液替换上清,超声10分钟(关于超声和颗粒洗涤的更具体细节见补充资料)。然后,将ucpv稀释至0.4\ \ upmu \ ()G /ml,体积为4ml,用0.2无菌过滤\ \ upmu \ ()M醋酸纤维素注射器过滤器,并保持在4\(^{\保监会}\)C直到使用。在补充资料中有关于如何选择ucvp浓度的更多细节。
ucpv浓度优化如下:我们制备了4种不同浓度的ucpv (0.1\ \ upmu \ ()0.4 g / ml,\ \ upmu \ ()g / ml, 1\ \ upmu \ ()10 g / ml,\ \ upmu \ ()G /ml),并按如下方法将其镀在封闭板上。本实验未使用抗体。随后,我们为每个浓度拍摄了5张图像,对颗粒进行计数,并对每张图像的数量取平均值。结果见附图S3.
为了制备Nunc Lab-Tek II盖玻璃板,我们将0.75 mg/ml ACE-2蛋白与2 mg/ml聚多巴胺溶液按1:1的比例混合(详见补充资料),并将溶液镀在盖玻璃板孔上。培养皿孵育2小时,放在潮湿室中防止干燥。然后用测定缓冲液(1)洗涤4次\ \(\倍)PBS, 0.5% BSA, 0.1%吐温-20),用5% BSA溶液(1\ \(\倍)PBS, 5% BSA, 0.1% -20), 1小时。然后用实验缓冲液再次洗涤4次,并立即使用。在补充资料中有更多关于板材验证的细节说明。
为了进行基于纳米颗粒的上转换中和免疫测定,制备了不同浓度的抗体(表2)1).然后,10\ \ upmu \ ()每一种浓度的L分别加入一个单独的300\ \ upmu \ ()L = 0.4\ \ upmu \ ()g/ml UCVP溶液,放在混合器上静置1小时。然后,将每个UCPV和抗体混合物分别添加到制备好的Nunc Lab-Tek II 8孔板的单独孔中,孵育1小时。孵育后,用实验缓冲液洗涤4次,保持在4\(^{\保监会}\)C直到测量。此过程对3种不同的抗体重复3次。
为了计算板上纳米颗粒的数量,使用定制的共聚焦显微镜获得每个孔的10张图像(系统的详细信息见补充材料)。然后,在图像中观察到作为亮点的颗粒(图2)。1B,D),计数并记录每种抗体的每次终浓度(表2)1),使用Mathematica软件中的定制程序。每个数据点的10张图像的计数对该抗体的3次重复进行平均。有关如何拍摄和处理这些图像的更多细节可在补充材料中找到。
参考文献
Munnink, b.b.o。et al。快速SARS-COV-2全基因组测序和分析,为荷兰公共卫生决策提供依据。Nat,地中海。26, 1405-1410(2020)。
Scohy,。et al。快速抗原检测作为新冠肺炎诊断一线检测手段效能不高。j .中国。性研究。129科学通报,104455(2020)。
Yamayoshi, S。et al。covid-19快速抗原检测的比较。病毒12, 1420(2020)。
李,Z。et al。IGM-IGG联合抗体快速诊断SARS-COV-2的研制及临床应用J. Med. Virol。92中文信息学报,1518-1524(2020)。
彭,T。et al。提高横向流动法检测SARS-COV-2的灵敏度达成。理论物理。列托人。117科学通报,120601(2020)。
李,F。et al。基于纸张的即时免疫测定:最新进展和新趋势。Biotechnol。睡觉。39, 107442(2020)。
你,M。et al。使用双色上转换纳米颗粒的家用荧光侧流条带平台用于心衰的敏感和定量预后。ACS Nano11, 6261 - 6270。https://doi.org/10.1021/acsnano.7b02466(2017).
他,W。et al。基于上转换纳米颗粒的横向流动免疫分析法用于牙周炎的即时诊断。传感器,执行器B,化学。334, 129673(2021)。
横向流动免疫分析法的六十年:从确定代谢标志物到诊断covid-19(2020)。
巴苏,一个。et al。在纽约市某学术机构用病毒运输介质运输的鼻咽拭子和干鼻拭子进行雅培新冠肺炎快速核酸扩增试验j .中国。Microbiol。58中文信息学报,e01136-20(2020)。
Tahamtan, A.和ardebi, A.实时RT-PCR检测covid-19:影响结果的问题。专家Rev. Mol. Diagn。20., 453-454(2020)。
Fowler, C. A, Tian, F, Al-Hashimi, H. M. & Prestegard, J. H.利用剩余偶极偶联快速测定蛋白质折叠。J.摩尔生物学。304(2000)。
Tan, t。K。et al。一种利用spycatcher聚合SARS-COV-2刺突蛋白受体结合域的covid-19候选疫苗可诱导有效的中和抗体反应。Commun Nat。12, 1-16(2021)。
王,Z。et al。MRNA疫苗诱导的SARS-COV-2抗体和循环变体。自然592, 616-622(2021)。
陈,r.e.。et al。SARS-COV-2变异对单克隆和血清衍生多克隆抗体中和的抗性Nat,地中海。27, 717-726(2021)。
王,P。et al。SARS-COV-2变异体1.351和1.1.1的抗体耐药性。7.自然593, 130-135(2021)。
勃固,。et al。MRNA-1273疫苗诱导的抗SARS-COV-2变体抗体的持久性科学373(6561), 1372-1377(2021)。
穆鲁阿托,a.e。et al。用于covid-19诊断和疫苗评估的高通量中和抗体测定Commun Nat。11, 1-6(2020)。
泰勒,p.c.。et al。中和单克隆抗体用于治疗covid-19。Nat, Rev. immuno1。https://doi.org/10.1038/s41577-021-00542-x(2021)。
库马尔,g.v., Jeyanthi, V.和Ramakrishnan, S.抗体治疗covid-19的简要综述。新的微生物,新的感染。35中文信息学报,100682(2020)。
M. J.穆里根。et al。描述covid-19 RNA候选疫苗(bnt162b1)在18-55岁成人中的安全性和免疫原性的1/2期研究:中期报告medRxiv(2020)。https://www.medrxiv.org/content/early/2020/07/01/2020.06.30.20142570.https://www.medrxiv.org/content/early/2020/07/01/2020.06.30.20142570.full.pdf。
www.pfizer.com/news。辉瑞和biontech完成covid-19候选疫苗的3期研究,达到所有主要疗效终点。https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine.
徐,M。et al。一种对所有四种血清型登革热病毒具有治疗潜力的强效中和抗体。NPJ疫苗2, 1-10(2017)。
Holzmeister, P., Acuna, G. P., Grohmann, D.和Tinnefeld, P.突破光学单分子检测的浓度极限。化学。Soc。牧师。43, 1014-1028(2014)。
张勇和Noji, H.数字生物检测:理论、应用和前景。分析的化学。89, 92-101(2017)。
单分子传感器:定量分析的挑战与机遇。Angew。化学。Int。艾德。55中文信息学报,11354-11366(2016)。
邵,Y.和Mirkin, m.v.微移液管电极伏安法。分析的化学。70, 3155-3161(1998)。
Tessler, L. A, Reifenberger, J. G. & Mitra, R. D.用固相单分子计数对复杂混合物中的蛋白质进行定量。分析的化学。81中文信息学报(英文版),2009)。
耆那教徒,一个。et al。利用单分子下拉探测细胞蛋白复合物。自然473, 484-488(2011)。
Hlavaček,。et al。竞争性上转化联免疫吸附法灵敏检测双氯芬酸。分析的化学。88, 6011-6017(2016)。
Farka, Z., Mickert, M. J., Hlaváček, A., Skládal, P. & Gorris, H. H.,单分子上转换联免疫吸附测定法,扩展动态范围,用于诊断性生物标志物的敏感检测。分析的化学。89, 11825-11830(2017)。
Rajil, N。et al。新型冠状病毒抗体和病毒颗粒的光纤-纳米光子检测方法纳米光子学10, 235 - 246。https://doi.org/10.1515/nanoph-2020-0357(2021)。
Akama, K, Shirai, K. & Suzuki, S.基于酪胺信号放大系统的无微滴数字酶联免疫吸附测定。分析的化学。88, 7123-7129(2016)。
Hulme, e.c.和Trevethick, m.a.平衡配体结合分析:验证和解释。Br。j .杂志。161, 1219-1237(2010)。
Karlsson, M.测定gyrolab生物微流体中抗体亲和力和动力学结合常数[j](博士论文)(2008)。
张,S., Garcia-D 'Angeli, A., Brennan, J. P. & Huo, Q.预测酶联免疫吸附试验(Elisa)和生物分析技术的检出限。分析师139, 439-445(2014)。
Renn, A., Fu, Y., Hu, X., Hall, M. D.和Simeonov, A.有效的中和抗体管道带来击败SARS-COV-2的希望。趋势杂志。科学。41中文信息学报,815-829(2020)。
创造性的诊断。Nn54 datasheet(2021)。https://www.creative-diagnostics.com/sars-cov-2-spike-neutralizing-antibody-278083-144.htm.
赛默飞世尔科技公司。T01khu datasheet(2021)。https://www.thermofisher.com/antibody/product/SARS-CoV-2-Spike-Protein-RBD-Antibody-clone-T01KHu-Recombinant-Monoclonal/703958.
元,M。et al。SARS-COV-2和SARS-COV受体结合域中高度保守的隐性表位。科学368, 630-633(2020)。
Worstell, n.c., Krishnan, P., Weatherston, j.d.和Wu, h - j。结合协同作用的问题:gm1样神经节苷-霍乱毒素b亚基结合研究使用纳米立方为基础的脂质双分子层阵列。《公共科学图书馆•综合》11, 1-17(2016)。
希尔系数,剂量-响应曲线和变构机制。j .化学。医学杂志。3., 37-44(2010)。
开曼群岛的化学物质。商业中和试验(2021年)。https://www.caymanchem.com/product/502070/sars-cov-2-neutralizing-antibody-detection-elisa-kit.
樵夫,W。概率论及其应用概论(威利,纽约,1957)
史高丽,M. O.和兰姆,W. E.光学脉泽的量子理论,I:一般理论。理论物理。牧师。159, 208 - 226。https://doi.org/10.1103/PhysRev.159.208(1967)。
NIST数字数学函数库.http://dlmf.nist.gov/。版本:20121-09-15 1.1.3。http://dlmf.nist.gov/(埃德·奥利弗,f.w.jet al。).
Kasetsirikul, S。et al。纸基Elisa法检测SARS-COV-2人源抗体。分析师145, 7680-7686(2020)。
致谢
作者感谢Jane Pryor、Arash Azizi和Sahar Delfan的有益讨论。S.E.由Herman F. Heep和Minnie Belle Heep德州农工大学捐赠基金支持,该基金由德州农工基金会持有/管理。
资金
这项研究得到了美国空军科学研究办公室(奖励号)的支持。FA9550-20-1-0366 DEF),海军研究办公室(奖励号:N00014-20-1-2184),罗伯特·韦尔奇基金会(资助号:A-1261, A-1547),国家自然科学基金(批准号:PHY-2013771, PHY-1820930, ECCS-2032589),国家卫生研究院(奖励号:R03AI139650和R21AI149383),以及阿卜杜勒阿齐兹国王科技城(KACST)。
作者信息
作者及单位
贡献
N.R东南部。,B.W.N H.J.W, Z.Y, R.W.B, A.V.S, P.R.H, M.O.S.概念化实验。N.R.建立显微镜,准备样品,获取数据,并处理数据。S.E.处理了数据。N.R王新宏。,B.W.N沃特,H.J.W, Z.Y, R.W.B, A.V.S, P.R.H,犯罪手法写的手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Rajil, N., Esmaeili, S., Neuman, B.W.et al。量子光学免疫测定:基于上转换纳米粒子的COVID-19中和测定。Sci代表12, 1263(2022)。https://doi.org/10.1038/s41598-021-03978-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-021-03978-2