文摘
发展替代等温扩增分析包括多个横向位移放大(MCDA)可能解决速度和可移植性的局限性SARS-CoV-2实时PCR (rt - PCR)方法检测。我们开发了一个小说SARS-CoV-2 MCDA测定和比较其速度和灵敏度loop-mediated等温扩增(灯)和rt - pcr。两个MCDA化验针对SARS-CoV-2 N基因和ORF1ab设计。最快的时间检测和敏感性MCDA灯相比,rt - pcr使用DNA标准和转录RNA。对于N基因,MCDA速度比灯和rt - pcr 10和20分钟,最快时间分别在5.2分钟rt - pcr检测灵敏度最高的检测极限10张/µl相比MCDA(100册/µl)和灯(500册/µl)。ORF1ab, MCDA和灯有类似的最快速度在9.7和8.4分钟时间检测,分别。灯是ORF1ab更敏感的检测/ 50份µl相比MCDA(500册/µl)。总之,不同的核酸扩增方法提供不同的优势。SARS-CoV-2 MCDA是最快的核酸扩增方法,rt - pcr是最敏感的。这些优势应该考虑在确定最合适的核酸扩增方法对不同的应用程序。
介绍
快速、便携、高度敏感的化验控制COVID-19大流行至关重要。Real-time-PCR (rt - pcr)检测的金标准SARS-CoV-2遗传物质1。然而,rt - pcr需要训练有素的人员,先进的设备和较长的试验时间不适合大规模社区筛查。其他测试开发包括依赖IgM /免疫球蛋白抗体的血清学检测需要~ 5天出现症状出现后使其不适合快速的早期检测2。
替代的发展包括loop-mediated等温核酸扩增方法放大(灯)可能提供改进的速度,SARS-CoV-2检测的敏感性和可移植性3。另一个等温核酸扩增方法,调用多个横向位移放大(MCDA)使用10个引物,而不是六个,还被认为有更高的灵敏度和速度比灯但尚未发达SARS-CoV-2检测4,5。
尽管增加的速度和灵敏度从等温扩增方法,没有研究直接比较了这三种不同的核酸扩增的速度和灵敏度的方法。因此,我们开发了一个MCDA化验SARS-CoV-2检测和比较它的速度和对现有的灯和rt - pcr方法。
方法
MCDA目标基因选择
确定目标基因高度保守的区域和一个合适的GC-content MCDA, 1216 SARS-CoV-2基因组存入GISAID(所有可用的完整,较低的高覆盖率的基因组(> 29000个基点)覆盖国旗排除直到3月26日,2020)6一致反对SARS-CoV-2参考基因组:NC_045512.2使用傲慢的(v4.3.6) -ctgs国旗和默认设置(https://github.com/tseemann/snippy)。滑动窗口的方法被应用于确定保存300个基点windows与GC含量> 43%,SNP数量低,和较低的总SNP数量(总单核苷酸多态性与SNP被定义为菌株的数量在一个特定的窗口)。三个300个基点守恒的区域被确定和选择MCDA引物设计有两个地区ORF1ab (NC_045512.2: 515 - 831和12968 - 13288年),一个的N基因(NC_045512.2: 28345 - 28647)。
MCDA引物设计
对于每个区域,4套MCDA引物设计如前所述5。每个引物组由2 cross-primers (CP1 / CP2), 2位移引物(F1、F2)和6扩增引物(C1、C2、D1、D2 R1 / R2)(补充表1)。非特异性引物结合评估对14使用BLASTN non-SARS-CoV-2冠状病毒用于羊肉等。7人类基因组(hg19)和其他11个常见的细菌和病毒的呼吸道病原体/微生物物种。
制备DNA / RNA的标准
对于每个区域,~ 500 bp基因片段ORF1ab (NC_045512.2: 416 - 931和12869 - 13388年)和N基因(NC_045512.2: 28246 - 28747)是合成一个额外的100个基点和下游的目标地区(ThermoFisher)(补充表2)。每一个片段包含T7启动子转录和M13适配器放大。7合成基因片段的DNA标准准备ORF1ab(100000、10000、5000、1000、500、250和100册/µl)在八个DNA标准准备N基因(100000,10000,5000,1000,500,250,100和10册/µl)。
合成基因的RNA, 1 pg一夜之间,碎片被转录在37°C使用T7 RNA聚合酶(σ)。一夜之间DNA消化使用涡轮进行了DNA免费工具(ThermoFisher)和进一步处理DNase我(内),直到所有的DNA被移除的痕迹。完整的DNA切除后确认每一轮DNase治疗用rt - pcr SensiFAST SYBR工具包(Bioline)和F1 / R1 MCDA引物(补充表1)。转录RNA是连续稀释和使用作为输入。因为RNA转录的数量低于250 pg /µl限制量子位HS RNA的检测试验(ThermoFisher),输入RNA拷贝数不能确定。因此,最低可检测稀释被用于敏感性的比较。
初始评估MCDA底漆集和等温扩增温度的优化
MCDA反应进行使用WarmStart灯(DNA和RNA)工具包(内),包含一个WarmStart RTx逆转录酶和Bst2.0聚合酶同时逆转录和等温扩增。南极不耐热的UDG也添加在每个反应防止结转污染。
每个引物,引物组合包含:3.3μM F1和F2, 6.67μM C1和C2, 10μM R1, R2, D1和D2和20μM CP1和CP2使用。标准脱盐纯化引物被用于初步评估和优化测试而高效液相色谱纯化引物被用于对灯和rt - pcr检测灵敏度和速度的比较。
每个MCDA底漆的初始评价集,10µl反应是使用,包含:5µl 2×WarmStart大师,0.2µl 50×荧光染料,1.2µl MCDA引物混合,0.2µl 1 u /µl南极不耐热的UDG(内),0.7 dUTPµl 10毫米,1.7µl H2O和1 1000年µl复制/µl DNA模板(最终反应浓度= 100 DNA复制/µl)。每个MCDA引物在反应的最终浓度为0.4μM F1和F2, 0.8μM C1和C2, 1.2μM R1, R2, D1和D2和2.4μM CP1 CP2。特异性MCDA底漆集也被评估使用净化人类基因组DNA(σ)和微生物群落DNA标准(Zymo研究)。MCDA反应进行在一式三份的Rotor-Gene Q(试剂盒)与等温扩增60°C, 63°C或65°C的1 h和实时荧光检测每隔60年代,紧随其后的是酶失活在95°C 5分钟和最后一个融化曲线从50°C - 99°C,以确保正确MCDA产品。
比较MCDA,灯和rt - pcr
比较速度和灵敏度的检测极限MCDA,灯和rt - pcr引物发表针对同一SARS-CoV-2 MCDA ORF1ab (NC_045512.2: 416 - 931)和N (NC_045512.2: 28246 - 28747)地区(补充表使用1)。灯,两套发表底漆Zhang et al。3针对同一地区作为我们MCDA比较。rt - pcr,没有合适的引物对目标相同的ORF1ab地区出版,因此只有国立卫生研究所提交的引物,泰国对N基因比较8。引物都是HPLC-purified等级。
MCDA,灯和rt - pcr检测三个独立运行(生物复制)使用相同的DNA / RNA整除。每次运行包含3技术复制。检测极限定义为最高稀释所有9复制生物复制(3×3技术复制)被检测到。
减少运行之间变化,10µl MCDA灯反应是建立和执行同时在相同的运行。MCDA反应是如上所述。灯,每10µl反应包含:5µl 2×WarmStart大师混合(内),0.2µl 50×荧光染料(内),0.2µl 1 u /µl南极不耐热的UDG(内),0.7µl dUTP 10毫米,1µl灯引物混合,1.9µl H2O和1µl DNA / RNA模板。每个灯引物组合包含16µM工厂检验计划和毕普2µM F3和B3和4µM低频和磅。每个灯引物的最终浓度在反应中是1.6µM工厂检验计划和毕普0.2µM F3和B3和0.4µM低频和磅。MCDA灯进行等温扩增65°C如上所述。N基因扩增的正常化荧光阈值线设置背景荧光在0.2以上MCDA和灯。对于ORF1ab MCDA和灯,正常荧光阈值线是0.4高背景荧光。检测时间MCDA和灯的时间被定义为荧光强度通过阈值线。
使用DNA模板,rt - pcr 10µl反应包含5µl SensiFAST探针No-ROX混合(Bioline), 0.5µl rt - pcr引物组合(40µM F和R, 10µM探针),3.5µl H2O和1µl DNA模板。最后每个rt - pcr引物和探针的浓度在反应中是2µM F R和0.5µM调查。2分钟的循环条件95°C,紧随其后的是45 95°C的周期15秒,30秒55°C。
与核糖核酸rt - pcr模板,10µl反应是建立包含5µl SensiFAST探针No-ROX一步混合(Bioline), 0.5µl底漆组合(40µM F和R, 10µM探针),0.1µl逆转录酶(Bioline), 3.4µl H2O和1µl RNA模板。逆转录在45°C进行20分钟后跟rt - pcr扩增DNA的如上所述。
比较rt - pcr的速度,循环阈值(Ct)是使用以下方程转化为时间:时间= (Ct×50年代)+ 120年代。rt - pcr检测所需时间的计算是基于循环条件(45 s每循环+ 120年代最初持有)和斜坡率Rotor-gene问每个周期(5 s)。转子的斜坡率基因问15°C / s取暖和20°C / s冷却根据制造的技术信息(https://www.qiagen.com/us/resources/download.aspx?id=2120af5e - 8 - daf - 4184 b277 aeb6ef5bbc05&lang=it -)。
结果
发展MCDA SARS-CoV-2检测化验
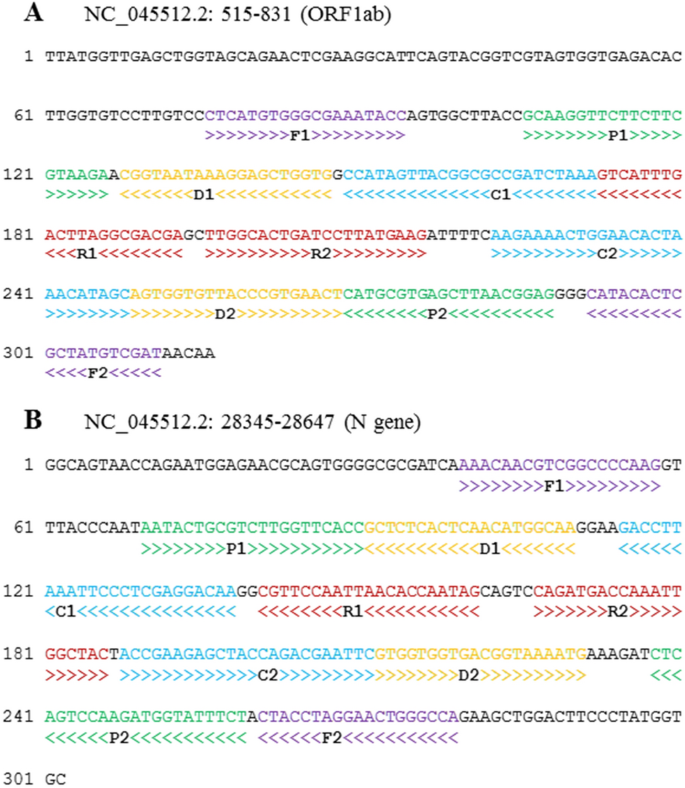
三个300个基点守恒的区域适合MCDA引物设计确认从1216 SARS-CoV-2菌株的基因组比对。1和2两个区域,指定地区,属于ORF1ab基因在NC_045512.2位置分别为515 - 831和12968 - 13288人。一个地区,地区指定为3,对应的N-gene NC_045512.2位置28345 - 28647。四个MCDA底漆为每个地区集设计和评估(补充表1)。
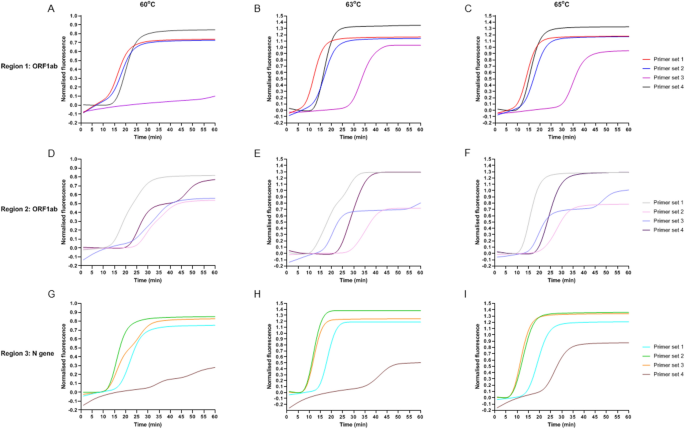
每个MCDA在3等温扩增引物组最初测试温度(60°C, 63°C和65°C)开始使用1000 DNA复制/反应作为模板。见图。1,不管使用底漆集,最慢的放大观察时间60°C。放大在63°C和65°C相似和65°C被选为等温扩增的温度。
保持MCDA检测的鲁棒性与单核苷酸多态性可能影响MCDA引物结合和扩增效率,引物组从两个不同的地区选择进一步开发双化验。放大的区域2为所有底漆集(图是最慢的。1D-F)相比,区域1和3,15 - 25分钟在65°C之间。底漆集区域2中也有非常高的技术复制之间的变化(数据没有显示)。因此地区2被撤进一步评估。
最快地区3 N基因的扩增引物组2紧随其后引物组3(图。1胃肠道)。引物组1和4是最慢的地区3,因此进一步测试淘汰。我们还观察到引物组2引物组相比有更严格的技术复制3(数据未显示),因此地区3组引物2被选为我们的最终MCDA底漆为进一步的敏感性和特异性检测。
在区域1,引物组3与荧光出现在最慢的~ 35分钟(无花果。1C)。这个引物组从进一步考虑删除。引物组1是最快的引物扩增区域1和区域选择包容在我们MCDA化验。
因此,最后引物组选择MCDA SARS-CoV-2检测是区域1 (ORF1ab)引物组1和区域3 (N基因)引物组2(无花果。2)。两个引物组没有非特异性扩增时对人类和微生物群落的基因组DNA进行测试。
灵敏度和检测比较MCDA,灯和rt - pcr
灵敏度和速度MCDA,灯和rt - pcr是比较两个SARS-CoV-2基因。N基因(区域3),检测由MCDA一直快于灯,通过10 ~ 13分钟,对于大多数DNA稀释(表进行测试1)。平均检测时间MCDA最快是5.2分钟在10000册/µl灯15分钟。MCDA也有更高的灵敏度和检测极限在100册/µl而灯是500册/µl。这个检测极限是相当于一个rt - pcr Ct值的32.4和30.3,分别。更多的零星的检测对于高稀释也观察到MCDA相比灯。MCDA也显著高于rt - pcr为低稀释~ 20分钟和10分钟更高的稀释。在10000张/µl, rt - pcr的检测时间是23分钟。然而,rt - pcr的灵敏度最高的检测极限10份/ 1复制/µlµl和零星的放大。类似的结果也观察到使用RNA模板rt - pcr是最敏感的技术,检测RNA在106稀释。为MCDA, RNA稀释检测到最低的是104,只有零星的检测灯稀释。
ORF1ab,灯更敏感比MCDA检测极限的50张/µl和有更多的零星的检测在高稀释(表2)。的检测极限MCDA 500册/µl。灯也略高于MCDA ~ 1 - 3分钟的浓度高于检测极限。最快的时间检测ORF1ab灯为8.4分钟而MCDA 9.7分钟。
讨论
我们的研究结果表明,MCDA是最快的核酸扩增法检测SARS-CoV-2 N基因的检测,检测速度5分钟。然而,这取决于目标基因和内设计的引物设计灯ORF1ab化验3表现出类似的速度相当于MCDA ORF1ab化验。
rt - pcr SARS-CoV-2仍然是最敏感的核酸扩增方法检测相比MCDA和灯。这一结果与先前的灯在协议SARS-CoV-2化验显示rt - pcr有更大的敏感性9,10。的检测极限MCDA N基因测定100册/µl或一个等价的N基因平均Ct值为32.4(表1)。平均rt - pcr Ct值324年临床COVID-19一系列疾病严重程度的样本被发现31.15 Singanayagam et al。11而在Passomsub et al。12中值N基因在唾液样本和鼻咽癌Ct值/喉咙样品分别为31.8和30.5,分别。这表明我们MCDA试验有可能检测SARS-CoV-2但敏感性较低,比较符合我们使用合成模板。此外,羊肉等。7发达COVID-19灯试验检测极限的0.08成品或一个等价的rt - pcr Ct值的30.3和能够验证他们的灯试验在19/20积极临床COVID样本。我们MCDA试验增加了灵敏度和速度与灯相比,表明MCDA为类似的应用程序有可能灯有更好的灵敏度和速度。
为MCDA,这个研究首次直接基准的速度和灵敏度MCDA rt - pcr对同一目标。以前MCDA只研究凝胶PCR相比4,不同的rt - pcr基因的目标13,14或使用rt - pcr的灵敏度结果以前在其他研究报告4,5(100张不同的研究可能不是等价由于吸量的差异,不同的方法用来测量核酸浓度(Nanodrop vs量子位)或不同机器校准,等等)。为了基准不同的核酸技术,我们使用和推荐相同的反应体积,同一台机器,同样的DNA标准和整除,尽可能相同的运行是用来比较。
本研究发现,不同的核酸扩增方法提供不同的优势,这应该是认为这取决于应用程序。rt - pcr是最敏感的方法测试和应该保持SARS-CoV-2检测的金标准。然而,便携式的性质和速度MCDA使它适合设置,rt - pcr是太慢了。虽然最快时间检测MCDA ~ 5分钟,MCDA放大应该执行至少20分钟,以确保可靠的结果负样本而对rt - pcr,当前放大时间,不包括逆转录,是30 - 40分钟。此外,逆转录和放大MCDA和灯可以同时发生。这消除了需要按顺序执行最初的20分钟逆转录步骤之前所需的rt - pcr扩增,使MCDA更快。因此,据估计,总时间保存使用MCDA相比,rt - pcr是30 - 40分钟。MCDA的另一个优点是,它使用相同的Bst聚合酶和逆转录酶作为灯,更强比rt - pcr Taq聚合酶抑制剂15。灯已被证明放大SARS-CoV-2 RNA提取使用简单的提取过程如沸腾16,17,18。因此,预计MCDA也可以用来检测SARS-CoV-2 RNA提取使用这些相同的过程。
MCDA(和其他等温扩增方法)比rt - pcr不敏感,使它的吸引力进一步开发它作为临床诊断测试。然而,这些方法可能存在的情况下是有用的,如病毒RNA含量高和样品的快速筛查。的比色染料代替荧光染料可以进一步简化MCDA快速筛查。进一步的研究在各种设置需要确定MCDA和其他等温核酸的方法可以提供一个优势在特定的环境下快速周转时间测试或测试简单是至关重要的。
数据可用性
所有生成的数据或分析在本研究中包括发表的这篇文章(及其补充信息文件)。
引用
科曼,v . M。et al。2019年的小说《冠状病毒检测实时rt - pcr (2019 - ncov)。欧元。Surveill。25,2000045。https://doi.org/10.2807/1560 - 7917. es.2020.25.3.2000045(2020)。
郭,L。et al。分析早期体液反应诊断新型冠状病毒病(COVID-19)。中国。感染。说。71年,778 - 785 (2020)。
张,Y。et al。快速分子检测SARS-CoV-2使用比色灯(COVID-19)病毒RNA。MedRxiv。https://doi.org/10.1101/2020.02.26.20028373(2020)。
王,Y。et al。快速和敏感等温核酸序列的检测由多个横向位移放大。科学。代表。5,11902年。https://doi.org/10.1038/srep11902(2015)。
张X。,Payne, M., Wang, Q., Sintchenko, V. & Lan, R. Highly sensitive and specific detection and serotyping of five prevalent沙门氏菌由多个cross-displacement放大型。j·摩尔,成岩作用。22,708 - 719 (2020)。
蜀,y &白云镇j . GISAID:全球共享所有流感数据从项目愿景变为现实。欧元。Surveill。22,30494年。https://doi.org/10.2807/1560 - 7917. es.2017.22.13.30494(2017)。
羊肉、l E。,Bartolone, S. N., Ward, E. & Chancellor, M. B. Rapid detection of novel coronavirus/Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) by reverse transcription-loop-mediated isothermal amplification.《公共科学图书馆•综合》15,e0234682-e0234682。https://doi.org/10.1371/journal.pone.0234682(2020)。
世界卫生组织。分子诊断化验COVID-19:汇总表可用的协议。https://www.who.int/publications/m/item/molecular-assays-to-diagnose-covid-19-summary-table-of-available-protocols(2020)。
Nagura-Ikeda, M。et al。镇定的唾液的临床评价定量一(RT-qPCR),直接RT-qPCR、反向transcription-loop-mediated等温扩增,和快速诊断COVID-19抗原测试。j .中国。Microbiol。58,e01438-20。https://doi.org/10.1128/JCM.01438-20(2020)。
李,j . y . H。et al。验证单步、单管反转录loop-mediated等温扩增试验SARS-CoV-2 RNA的快速检测。j . Microbiol地中海。69年,1169 - 1178 (2020)。
Singanayagam,。et al。传染性和关联时间与rt - pcr循环阈值在COVID-19的情况下,英格兰,2020年1月至5月。欧元。Surveill。25,2001483。https://doi.org/10.2807/1560 - 7917. es.2020.25.32.2001483(2020)。
Pasomsub E。et al。唾液样本作为一种非侵入性的冠状病毒的诊断疾病的标本2019:横断面研究。Microbiol。感染。中国。https://doi.org/10.1016/j.cmi.2020.05.001。(2020)。
王,Y。et al。建立和应用程序的多个横向位移放大加上nanoparticle-based横向流生物传感器测定的检测肺炎支原体。前面。细胞。感染。Microbiol。9,325年。https://doi.org/10.3389/fcimb.2019.00325(2019)。
赵,F。et al。建立和应用程序的多个横向位移放大加上横向fow生物传感器(MCDA-LFB)视觉和快速检测白色念珠菌在临床样本。前面。细胞。感染。Microbiol。9,102年。https://doi.org/10.3389/fcimb.2019.00102(2019)。
金子,H。,Kawana, T., Fukushima, E. & Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances.学生物化学j。Biophys。方法70年,499 - 501 (2007)。
这,v . l . D。et al。一个比色RT-LAMP试验在临床样品检测SARS-CoV-2 LAMP-sequencing RNA。科学。Transl。地中海。12,7075年。https://doi.org/10.1126/scitranslmed.abc7075(2020)。
Ganguli,。et al。快速SARS-CoV-2等温扩增和便携式检测系统。Proc, Nat。学会科学。美国的一个。117年,22727年。https://doi.org/10.1073/pnas.2014739117(2020)。
Lalli, m·A。et al。从唾液微生物的快速检测和extraction-free SARS-CoV-2比色逆转录loop-mediated等温扩增。中国。化学。https://doi.org/10.1093/clinchem/hvaa267(2020)。
资金
这项工作是由新南威尔士大学研究基金会资助。
作者信息
作者和联系
贡献
RL构思。LDWL进行了实验,分析结果并起草了手稿。议员执行MCDA目标选择和爆炸。XZ和设计了MCDA引物。所有作者提供了重要的修订手稿。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
补充信息
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
并L.D.W.佩恩,M。张,X。et al。小说的发展和比较多个横向位移放大(MCDA)化验与其他SARS-CoV-2检测核酸扩增方法。Sci代表111873 (2021)。https://doi.org/10.1038/s41598 - 021 - 81518 - 8
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 021 - 81518 - 8