摘要
我们的目的是在新加坡的一个大型移民工人队列中测试鼻咽唾液和自我给药鼻(SN)拭子与鼻咽(NP)拭子对COVID-19检测的敏感性。我们还测试了下一代测序(NGS)在诊断COVID-19中的效用。唾液、NP和SN拭子采集自出现急性呼吸道感染的受试者、他们的无症状室友,以及2020年6月在社区护理机构接受隔离的先前确诊病例。所有样本均采用RT-PCR检测。对30份样本进行了基于SARS-CoV-2扩增子的NGS和系统发育分析。我们招募了200名受试者,其中91名和46名分别进行了两次和三次测试。唾液、NP、SN阳性率分别为62.0%、44.5%、37.7%。在所有样本类型的感染早期,周期阈值(Ct)值较低。唾液检测阳性比例高于NP和SN拭子。我们发现NGS的病毒基因组覆盖率与SARS-CoV-2的Ct值之间存在很强的相关性。 Phylogenetic analyses revealed Clade O and lineage B.6 known to be circulating in Singapore. We found saliva to be a sensitive and viable sample for COVID-19 diagnosis.
介绍
2019年11月,严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)在中国武汉出现1此后引发了全球大流行,截至2020年9月1日,COVID-19确诊病例超过2500万例,死亡85万人2。自2020年1月23日报告首例病例以来,新加坡已记录了56,000多例病例和27例死亡,其中大多数病例是居住在拥挤宿舍的移民工人3.。
急性冠状病毒病2019 (COVID-19)主要通过逆转录聚合酶链反应(RT-PCR)检测病毒遗传物质来诊断。然而,考虑到SARS-Cov-2的三种主要传播方式,即接触、飞沫和气溶胶途径,建议采用不同类型的样本进行检测4。在新加坡和其他几个国家,鼻咽拭子是收集用于检测的标本的主要手段5,6。然而,NP拭子的收集过程可能会引起不适,需要训练有素的医护人员来执行。
在许多方面,唾液和自行鼻腔拭子是COVID-19筛查的理想样本。两者都可以安全收集,不需要训练有素的工作人员。唾液用于COVID-19检测的效用已在多个地区和国家进行了测试7,8,9,10,11,12,13,14,15。目前发表的大多数研究涉及相对较少的受试者。一项荟萃分析表明,唾液充其量只是稍微不那么敏感或与其他样本(包括NP拭子)相似16。然而,需要注意的是,唾液是一种复杂的生物混合物,它可以由唾液腺分泌物、龈沟液、痰液和/或粘膜渗出液组成,根据收集方法的不同,其比例也不同。一些研究只测试了口腔分泌物11,12,另一些则明确测试了带有口咽分泌物的“后口咽”或“深喉”唾液7,8,9,10,其余的则未透露13,14,15,16。
我们的目的是使用RT-PCR检测在新加坡一大群农民工中测试“鼻口咽”唾液和SN拭子与NP拭子的敏感性。此外,我们还使用基于rna扩增子的直接下一代测序(NGS)来验证低水平SARS-CoV-2信号的检测,并确定测试样本的系统发育。
方法
研究人群
受试者于2020年6月2日至26日从两个地点招募:一个是5400张床位的专用宿舍,农民工被安置在容纳7-20名工人的大房间里;另一个是社区护理设施(CCF),被诊断患有COVID-19但不需要紧急住院治疗的农民工被送往隔离和监测。CCF的所有受试者都是先前确诊的病例(通过RT-PCR),而宿舍的受试者分为两组——(1)出现急性呼吸道感染(ARI)症状的农民工;(2)新确诊病例无症状室友。
道德声明
根据新加坡《传染病法》,卫生部医疗服务主任批准了这项研究17。根据本法,在发生重大疫情时,署长可要求获取其认为适当或必要的对国家公共卫生有重大益处的信息或样本(包括人体样本)17。所有参与者都获得了知情同意,所有方法均按照新加坡生物医学研究指南和法规进行。
样品收集
来自专用宿舍的外来务工人员出现ARI,由医务站的医生进行评估,并决定是否需要诊断NP棉签进行COVID-19检测。那些需要NP拭子的工作人员立即被邀请参与研究,并在同意的情况下获得同意。
对于SN拭子的收集,参与者被指示将拭子(约1厘米)插入鼻孔(一次一个),头部轻微向后倾斜,并围绕鼻壁以圆周运动旋转拭子3次。然后将拭子插入收集管。在收集鼻咽唾液样本时,参与者被要求微微向后倾斜头部,清理喉咙和鼻子,并将唾液吐到收集瓶中。重复上述步骤,直到达到所需的体积(2ml)。关于“鼻口咽”唾液收集,教学视频(英文视频链接:https://youtu.be/4jGrJUbjBBs),然后在训练有素的研究人员的监督下收集这些样本。
对于来自CCF和宿舍新诊断病例的无症状室友的同意受试者,NP拭子收集程序由训练有素的研究人员执行。同一坐位采集SN拭子和唾液样本。
在可能的情况下,每隔2 - 3天对每个受试者进行最多三次测试,以便比较不同样品在不同时间内的灵敏度。来自专用宿舍的受试者在第一轮测试中所有三个样本的测试结果均为阴性,无需重新测试。如果前两轮的所有样本均为阴性,则不重新检测CCF的受试者。
作为常规临床检测的一部分,ARI患者的NP拭子被干燥地放入冷却盒中送到新加坡总医院(SGH)分子实验室。将其他受试者的NP拭子和自我给药鼻拭子放入3ml病毒运输介质中,同时在转移到Lucence之前,将最多2ml唾液收集在含有2ml病毒RNA稳定液(safe - sample stabilization fluid, Lucence, Singapore)的容器中。所有样品均在同一天内处理。这两个服务实验室都是美国病理学家学院(CAP)认可的,Lucence是美国病理学家协会(clia)许可的。
实验室检测
在SGH使用自动化cobas 6800系统(Roche, Branchburg, NJ, USA)在自动化cobas 6800系统上进行RT-PCR,结果根据制造商的规格推断。送往Lucence实验室的NP和唾液样本经基因援助生物技术公司(GeneAid Biotech Ltd)提取RNA (200 μL),并根据美国亚特兰大疾病控制与预防中心国家免疫和呼吸疾病中心病毒疾病部公布的引物,采用实验室开发的RT-PCR检测(CDC-LDT)进行检测18唾液和SN拭子使用Fortitude 2.1试剂盒(MiRXES, Singapore)进行检测。基于合成的SARS-CoV-2基因组(Twist Bioscience),确定CDC-LDT的分析检出限为每个反应25个拷贝。以样品总量的0.4-0.85%加入二硫苏糖醇(DTT)对唾液进行预处理,涡旋,室温孵育15 min。室温下处理后可明显增溶,处理后立即提取RNA。
在确定基于ngs的SARS-CoV-2检测的性能规格的初始阶段,选择了有限数量的样品。包括唾液和SN拭子样本,以证明从病毒RNA稳定液中收集的样本中提取的RNA的兼容性。选择了30个样本,包括高病毒载量和低病毒载量样本,以及两种RT-PCR检测结果不一致的样本。30份样本中,6份为同一时间点的唾液和SN拭子样本配对组,3份为不同时间点的6份样本(4份唾液,2份SN拭子)。剩余的18份样本包括来自个体患者的10份唾液、7份SN拭子和1份NP拭子样本。
基于SARS-CoV-2扩增子的NGS使用330对引物产生覆盖整个病毒基因组的扩增子(大小范围为130-178 bp)(除了最终polyA尾部上游的前25个碱基和30个碱基),以建立直接来自样本的工作流程。为了排除其他序列相关病毒的潜在非特异性扩增,所有扩增子都被证实与sars相关冠状病毒(假设不存在于流通中)之外的sarbecovirus具有有限的相似性。通过对本研究的5个阴性(RT-PCR)样本、11个社区检测的NP拭子阴性样本和10个无模板对照(NTC)进行NGS检测,确定NGS检测阳性的阈值覆盖率(%)。对于具有完整病毒基因组的样本(100%覆盖率≥1 ×覆盖率),进行系统发育分析,根据序列变异确定谱系。
统计方法
我们使用频率/百分比和中位数/四分位数范围来描述我们的数据。我们使用kappa统计和一致性百分比来评估抽样方法之间的可比性。所有统计计算均采用STATA 13.1 (StataCorp, Texas, USA)。
结果
我们招募了200名受试者,其中宿舍149人,CCF 51人。从专用宿舍招募了45名ARI受试者和104名无症状密切接触者,在CCF招募了51名确诊的COVID-19受试者(诊断时无症状8名)(表1)1).
在200名受试者中,分别有91人和46人完成了第二轮和第三轮测试,共进行了337组测试(表2)2).由于covid -19阳性的外来务工人员迅速从宿舍转移到CCFs,除了一名来自宿舍现场的受试者外,所有人都没有完成计划的检测。无症状受试者诊断至第一轮检测的中位时间为0天(范围0 - 6天),症状出现至第一轮检测的中位时间为5.5天(范围0 - 28天)。
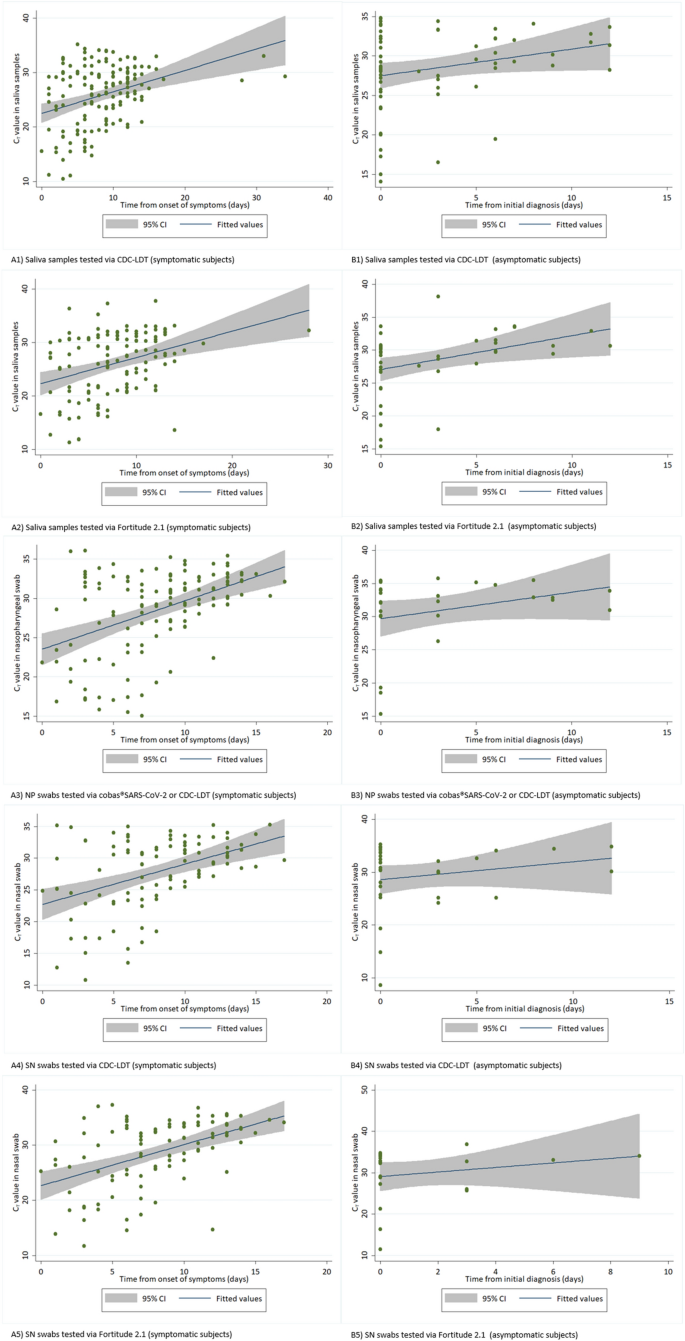
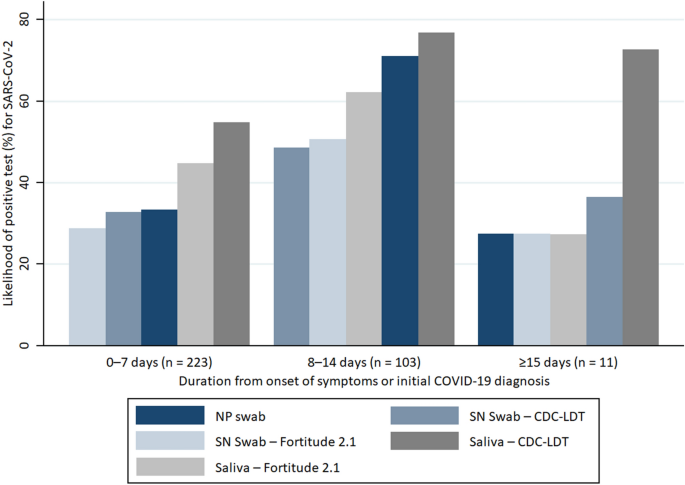
通过CDC-LDT检测唾液阳性209例(62.0%),坚毅2.1检测唾液阳性167例(49.6%),cobas - SARS-CoV-2或CDC-LDT检测NP拭子阳性150例(44.5%),CDC-LDT检测SN拭子阳性127例(37.7%),坚毅2.1检测SN拭子阳性119例(35.3%)。在所有样本类型的感染早期,周期阈值(Ct)值较低,主要是有症状的感染,可以更好地估计疾病的发作(图2)。1).从初次诊断后第1周和第2周收集的样本中,唾液检测阳性的可能性高于NP和SN。在有症状的受试者中,任何样本中SARS-CoV-2检测阳性的百分比都超过了症状出现的14天,或者在无症状的受试者中,从初步诊断开始,尽管通过CDC-LDT检测的唾液中,这一比例不太显著(图2)。2).
在63份低Ct值(< 30)的NP阳性拭子(两种检测指标中较低的结果)中,分别有62份(98.4%)和61份(96.8%)唾液呈阳性,而通过CDC-LDT和Fortitude 2.1检测SN拭子分别有57份(90.5%)和60份(95.2%)同时呈阳性。87份高Ct值(≥30)的NP阳性拭子中,唾液阳性77份(88.5%)、64份(73.6%),SN阳性49份(56.3%)、48份(55.2%)。当CDC-LDT检测的唾液Ct值较低(< 30)时,其他样本一致性阳性的可能性也很高——76.9%的NP拭子、64.0%的CDC-LDT拭子和62.6%的坚韧2.1拭子检测的SN拭子同时阳性。然而,当Ct值较高(≥30)时,只有41.9%的NP拭子、30.7%的CDC-LDT拭子和27.4%的坚韧2.1拭子与CDC-LDT检测的唾液样本同时呈阳性。
不同采样点检测结果的一致性较好,CDC-LDT检测NP和SN拭子的kappa统计量为0.616(一致性为81.3%),CDC-LDT检测NP和坚韧2.1检测SN拭子的kappa统计量为0.675(一致性为84.3%),唾液和NP检测CDC-LDT检测0.537(一致性为76.2%),唾液坚韧2.1检测NP和CDC-LDT检测NP的kappa统计量为0.602(一致性为80.1%)。唾液检测(87.2%)和SN拭子检测(91.0%)的一致性极好,kappa统计量分别为0.745和0.806。
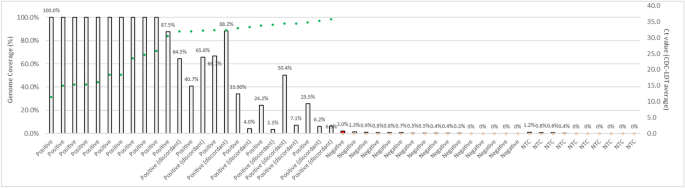
在NGS检测的30份样本(唾液、NP和SN拭子)中,NGS检测的病毒基因组覆盖率与SARS-CoV-2的Ct值有很强的相关性。10个样本显示100%覆盖率(7个独特的受试者)(图2)。3.).10份样本(4份唾液,6份SN拭子)2项RT-PCR检测结果不一致(CDC-LDT阳性,Fortitude阴性),NGS检测呈阳性。7例受试者高覆盖率唾液样本中SARS-CoV-2病毒RNA序列的系统发育分析显示,进化支为O,符合GISAID命名法19和B.6系的穿山甲命名法20.。
新一代测序(NGS)的病毒基因组覆盖率(%)与SARS - CoV-2的周期阈值(Ct)之间的相关性NGS是检测临床样本中低水平SARS-CoV-2病毒的灵敏方法,基因组覆盖率(%)与RT-PCR测定的Ct值相关。采用NGS对30份样本(17份唾液、11份SN拭子和1份NP拭子)进行检测。10份RT-PCR检测结果不一致的样本(4份唾液,6份SN拭子)经NGS证实为阳性(基因组覆盖率中位数为29.7%,范围为3.3-88.2%)。基因组覆盖率(%)定义为SARS-CoV-2基因组具有bb10 ×覆盖深度的比例。通过分析本研究的5个阴性(RT-PCR)样本、11个社区检测的阴性NP拭子样本和10个无模板对照(NTC),确定NGS阳性判断的阈值覆盖率(%)。阈值确定为检测到5个扩增子,对应于SARS-CoV-2基因组的约1.7%的覆盖率。在5份阴性(两种RT-PCR方法)唾液样本中,1份唾液样本被NGS(红色条)称为阳性,基因组覆盖率为2.0%。该样本来自于同时采集RT-PCR阳性NP拭子和鼻拭子样本的患者,这增加了在NGS上检测到低水平信号的可能性。图中绿色圆圈表示检测结果为阳性(通过titude 2.1和CDC-LDT RT-PCR检测或同时检测)的样本的Ct值,而SARS-CoV-2(通过RT-PCR检测)和NTC检测结果为阴性的样本则用开放圆圈表示。 Average Ct values (of 2 targets) or single Ct value (when only 1 target was detected) from the CDC-LDT assay are plotted on the secondary axis.
讨论
我们的研究与多篇支持唾液作为COVID-19筛查和诊断替代样本的已发表论文一致7,8,9,10,11,12,13,14,15少数人的唾液被证明比相应的NP拭子更敏感8,9,13尽管Leung等人的结果(95名受试者,53.7%唾液对47.4% NP拭子)没有统计学差异8。有几个原因可以解释研究中的这种差异,包括从鼻腔和口咽分泌物中富集,那里的病毒载量可能更高8,9或更大的样本收集量,其中收集约10毫升唾液进行测试13。采取措施将偏差和错误降至最低——由训练有素的医护人员进行np拭子测试,在cap认可的实验室进行环境测试(无污染证据),在同一实验室对大多数样本进行测试,在提取RNA之前用二硫苏糖醇预处理唾液样本,以解决唾液样本粘度问题,这可能导致假阴性。
有趣的是,在本研究中使用不同的RT-PCR试剂盒导致了不同的唾液检测阳性率,这可能是临床实验室的一个重要考虑因素,在临床诊断中应该部署更敏感的实验室方案,而不是对低患病率人群进行大规模筛查。需要更多的验证来证实这一发现。
然而,与唾液和NP拭子相比,SN拭子在诊断COVID-19方面的敏感性较低。虽然与唾液收集相比,它更方便,更节省时间,并且与NP拭子相比,引起的不适更少,但明显较低的灵敏度应阻止其在可以收集其他样本类型的情况下使用。
在我们的研究中,NGS提供了高效的SARS-CoV-2全基因组图谱,用于直接从临床样品中进行系统发育分析,而无需培养。NGS检测灵敏度极好,阈值为1.7%的基因组覆盖率或5个扩增子靶点,证实所有检测到的CDC-LDT阳性。其他研究小组报告了NGS的高灵敏度,检测限在5%基因组覆盖率或每mL 84个基因组当量的阈值之间21或至少5个SARS-CoV-2检测目标22。系统发育结果与该病毒属于已知在新加坡和印度地理区域流行的一种病毒类型(进化支O,谱系B.6)一致。
我们的工作有几个限制。首先,研究人群仅限于无症状或病情轻微的中青年男性。结果不能外推到其他人群(例如,儿科),在这些人群中,显然需要替代NP拭子的样本类型。其次,我们没有充分延长随访测试,以确定大多数受试者唾液病毒脱落何时停止,尽管这在其他研究中已经进行了探讨7,10。第三,我们没有测试从鼻口咽和口腔单独获得的唾液之间的差异(如果有的话),尽管从生物学上讲,后者会导致COVID-19诊断的敏感性较低16。
总之,我们的研究增加了支持唾液作为COVID-19诊断敏感且侵入性较小的样本的证据,并进一步定义了鼻口咽分泌物的作用以及不同RT-PCR试剂盒在提高检测灵敏度方面的影响。在我们的研究中,SN拭子的效果都不如唾液拭子和NP拭子。我们的研究还为支持NGS在具有挑战性的样品中进行敏感的COVID-19分子诊断提供了证据。这种NGS工作流程还可以为接触者追踪等公共卫生决策提供直接来自样本的系统发育分析。
改变历史
2021年6月9日
参考文献
世界卫生组织。新型冠状病毒(2019-nCoV)疫情报告(2020)。https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200121-sitrep-1-2019-ncov.pdf。查阅2020年9月1日。
Worldometer。2019冠状病毒大流行(2020)。https://www.worldometers.info/coronavirus/#countries。查阅2020年9月1日。
新加坡卫生部。COVID-19疫情报告(2020)。https://covidsitrep.moh.gov.sg/。查阅2020年9月1日。
Priyanka, Choudhary, O. P, Singh, I.和Patra, G. SARS-CoV-2的气溶胶传播:未解决的悖论。旅行医学。感染。说。37, 101869(2020)。
杨,B. E.。et al。新加坡SARS-CoV-2患者的流行病学特征及临床病程《美国医学会杂志》。https://doi.org/10.1001/jama.2020.3204(2020)。
疾病控制和预防中心。关于冠状病毒(COVID-19)的实验室信息。在疾病控制和预防中心(2020)。https://www.cdc.gov/coronavirus/2019-ncov/lab/guidelines-clinical-specimens.html。2020年7月15日发布。
K.K.-W。et al。SARS-CoV-2感染期间后口咽唾液样本病毒载量和血清抗体反应的时间分布:一项观察性队列研究《柳叶刀》。感染。说20., 565-574(2020)。
梁恩成,周文昌,李明强,赖仁伟,等。深喉唾液在SARS-CoV-2检测中的替代诊断标本类型。J. Med. Virol。https://doi.org/10.1002/jmv.262(2020)。
黄世远。et al。后口咽唾液检测严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)。中国。感染。说。71, 2939年。https://doi.org/10.1093/cid/ciaa797(2020)。
郑,S。et al。2020年1 - 3月浙江省SARS-CoV-2感染患者的病毒载量动态和疾病严重程度:回顾性队列研究BMJ369, m1443(2020)。
Azzi, L。et al。唾液是检测SARS-CoV-2的可靠工具。j .感染。81, 45 - 50(2020)。
Williams, E., Bond, K., Zhang, B., Putland, M.和Williamson, D. a .唾液作为检测SARS-CoV-2的无创标本。j .中国。Microbiol。https://doi.org/10.1128/JCM.00776-20(2020)。
威利,a.l。et al。唾液对COVID-19患者SARS-CoV-2检测的敏感性高于鼻咽拭子。MedRXiV。https://doi.org/10.1101/2020.04.16.20067835(2020)。
贾马尔,a.j.。et al。鼻咽拭子和唾液检测严重急性呼吸综合征冠状病毒的敏感性中国。感染。说。https://doi.org/10.1093/cid/ciaa848(2020)。
Nagura-Ikeda, M。et al。RT-qPCR、直接RT-qPCR、RT-LAMP和快速抗原检测检测自采唾液诊断COVID-19的临床评价j .中国。Microbiol。https://doi.org/10.1128/JCM.01438-20(2020)。
琼贝尔,L. M.。et al。唾液作为COVID-19诊断测试的候选者:一项荟萃分析前面。地中海。https://doi.org/10.3389/fmed.2020.00465(2020)。
新加坡法规在线,新加坡政府。传染病法。第137章(1977)。
疾病控制和预防中心。研究仅使用2019-nCoV实时RT-PCR引物和探针。在疾病控制和预防中心(2020)。https://www.cdc.gov/coronavirus/2019-ncov/lab/rt-pcr-panel-primer-probes.html。2020年7月15日发布。
Han, A. X, Parker, E., Scholer, F., Maurer-Stroh, S.和Russell, C. A.基于线性整数规划(PhyCLIP)的系统发育聚类。摩尔。杂志。另一个星球。36中文信息学报,1580-1595(2019)。
兰姆伯特,一个。et al。协助基因组流行病学的SARS-CoV-2谱系动态命名建议Microbiol Nat。https://doi.org/10.1038/s41564-020-0770-5(2020)。
希莱尔,b.g. S。et al。基于全基因组测序的快速、低成本、高灵敏度的SARS-CoV-2诊断方法。BioRxiv。https://doi.org/10.1101/2020.04.25.061499(2020)。
博亚尔,r.c.。et al。基于covid - seq下一代测序的SARS-CoV-2高通量检测及遗传流行病学研究BioRxiv。https://doi.org/10.1101/2020.08.10.242677(2020)。
致谢
我们要感谢苏瑞福公共卫生学院的S Siva Ranjini和Lenny Indrawati;上海医院肝胆胰及移植外科;伍德兰健康校园;以及新加坡武装部队医疗队,为专门建造的宿舍和CCF的工作提供支持和便利。我们也非常感谢参与这项研究的外来务工人员的支持和耐心,并承认他们因COVID-19而经历的不确定性和困难。
资金
这项工作得到了樟宜机场集团的资助。Fortitude 2.1工具包由新加坡科学技术研究局A* accelerate诊断开发中心(DxD Hub)提供。研究发起人在研究的设计、实施、分析或撰写过程中没有任何作用。
作者信息
作者及单位
贡献
L.Y.H.和M.H.T.构思了这个项目,并获得了资金。I.B.T, l.t.e.c和s.h.c促进了操作和站点设置。L.Y.H.和A.K.J.T.招募研究参与者,收集数据和样本。Y.C C.Y.C。,Z.Y.W L.L.E.O K.S.C.和M.H.T.分析了样本。l.y.h.、a.k.j.t.、M.H.T.和Y.C.进行了数据和统计分析。l.y.h., Y.C.和M.H.T.起草了手稿。所有作者都参与了审稿和编辑工作。
相应的作者
道德声明
相互竞争的利益
Yukti Choudhury, Chae Yin Cher, Zi Yi Wan和Min Han Tan是Lucence的员工和附属机构。Y.C.和M.H.T.是Lucence的股东;M.H.T.是Lucence的董事。Lucence的附属实体是某些相关诊断专利申请的申请人。y.c., C.Y.C.和/或M.H.T.是其中一些专利申请的指定发明人。在本研究期间,论文中讨论的下一代测序方法(SG App. No. 10202007270P)和唾液检测方法(SG App. No. 10202007826S)正在申请专利。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
Teo, a.k.j., Choudhury, Y., Tan, I.B.et al。唾液比鼻咽拭子或鼻拭子对无症状和轻度COVID-19感染的诊断更敏感。Sci代表11, 3134(2021)。https://doi.org/10.1038/s41598-021-82787-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-021-82787-z
这篇文章是由
次氯酸灭活口腔病原体和sars - cov -2替代物
BMC口腔健康(2023)
在三次接种的卫生保健工作者的染色体突破感染的保护和病毒载量轨迹的相关性
自然通讯(2023)
追踪ΦX174在牙科诊所产生气溶胶过程中噬菌体的传播
临床口腔调查(2023)
自行采集非刺激唾液、口腔拭子和鼻咽拭子标本检测SARS-CoV-2
临床口腔调查(2022)
西班牙巴塞罗那参加暑期学校的儿童唾液中对SARS-CoV-2的抗体转化率
BMC医学(2021)