文摘
罕见变异影响宿主防御病原体可能参与COVID-19严重程度和可能有助于解释中青年患者的致命的结果。我们的目的是报告中罕见的遗传变异的存在某些基因,通过使用全外显子组测序,COVID-19选择组的患者在65年需要插管或导致死亡(n = 44)。为此,不同的etiopathogenic机制探讨了使用基因prioritization-based分析哪些基因参与免疫反应,免疫缺陷或血液凝固进行了研究。我们发现44不同变体的兴趣,在29个不同的患者(66%)。其中一些变异以前称为致病性,位于基因主要参与免疫反应。网络分析,包括42与候选基因变异,显示三个主要组件,包括25高度相互关联的基因与免疫反应相关基因和两个额外的网络由富含碳水化合物代谢和DNA代谢和修复过程。总之,我们发现候选人变异可能影响COVID-19结果在我们的患者群。还需要进一步的研究来确认最终的角色目前描述的遗传变异研究COVID-19严重性。
介绍
自第一冠状病毒疾病爆发在2019年(COVID-19)大流行,在2.43亿例COVID-19已确认,超过610万人死亡(https://coronavirus.jhu.edu,最后一次访问2022年3月)。SARS-CoV-2感染显示高inter-individual临床变化,从无症状到致命的结果1。最重要的威胁生命的因素是年龄,增加的风险的关键疾病人超过65岁2。其他已知的危险因素被男性和有并发症,如高血压、糖尿病和心血管、肾或呼吸道疾病3,4。然而,这些危险因素并不完全解释为什么看似健康的年轻人和中年人现在严重COVID-19急性呼吸窘迫综合征(ARDS)引起暴发性疾病在某些情况下。
遗传背景提出了作为候选因子来解释一些COVID-19 inter-individual变化观察到的严重性。最近,不同的全基因组关联研究(GWAS)已经确定了几个位点与易感性增加有关SARS-CoV-2感染和严重的疾病5,6,7这些位点包括基因I型干扰素(IFN)信号通路(IFNAR2, DPP9或OAS1-3)、自身免疫(TYK2在肺功能)或(FOXP4)。然而,前相关变异显示低奇怪的比率被认为是预测生物标志物的COVID-19严重性5,6,7。
除了常见的变异检测,罕见变异影响宿主防御病原体可能参与COVID-19严重程度和可能有助于解释中青年患者的致命的结果。事实上,先天性免疫缺陷感染易感性增加生产和/或感染复发(如原发性免疫缺陷或N-glycosylation缺陷),可能会加剧SARS-CoV-2感染过程中8,9,10。浓缩在13个基因功能丧失(LoF)变异属于I型干扰素信号通路已经被报道在危及生命的COVID-19肺炎患者11虽然这一发现还没有被复制12。此外,toll样受体7 (LoF遗传变异TLR7),这是关键的单链RNA病毒的识别和培育抗病毒反应,有关在年轻男性更严重的结果,没有并发症13,14,15,16。
除了ARDS、血栓形成、凝血障碍成为关键SARS-CoV-2感染的并发症17,18,19。事实上,海拔高度相关的血栓性肺动脉栓塞是一种最常见的实验室发现,尤其是在危重病人20.。此外,不同的研究表明ABO血型的影响组织的风险SARS-CoV-2感染和/或疾病的严重程度21。在这方面,证明了ABO血型在血管内稳态表型和功能的影响22被建议作为一个解释的报道,COVID-19严重程度之间的关联和ABO血型组。因此,致病基因变异改变蛋白质凝固系统的功能也可能影响COVID-19决议。
根据这些证据,我们的目标是识别罕见的基因变异与COVID-19严重程度有关。为此,我们选择一组的患者在65年经历了一个非常严重的结果定义为需要插管或导致死亡和受到全外显子组测序。不同的etiopathogenic机制进行了探讨利用基因prioritization-based分析中,超过800个基因参与免疫反应,免疫缺陷或血液凝固进行了研究。
结果
临床和人口特征
共有44无关的严重患者COVID-19)需要插管,无创通气支持或没能活下来SARS-CoV-2感染被纳入本研究。总共16个病人(36%)没有生存,他们中的大部分接受侵入性通气支持(插管,44%),31%的人收到了完全非侵入性通气支持(表1)。平均年龄是46岁,患者主要是男性(70%,表1)。大部分患者(86%)的欧洲血统,除了7混在美国和一个病人从另一个种族。这群如预先存在的疾病的主要临床特点和COVID-19管理总结在表1。最常见的并发症是肥胖(定义为身体质量指数> 33公斤/米2;39%)、高血压(18%)、呼吸系统疾病(16%)和oncohematological祖先(14%)。每个病人的详细临床资料中提供补充表1。
识别候选人变体
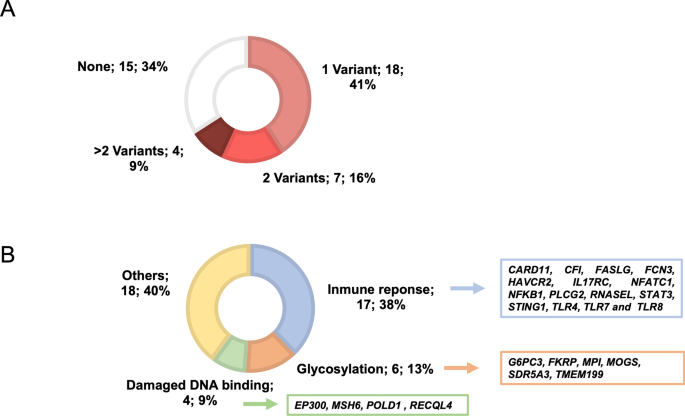
我们发现44不同变体的兴趣位于42基因。这些变量被确定在29个病人,其中11携带2个或更多的候选人在不同的基因变异(无花果。1关于致病因素),可用数据,从公共数据库(加器和致病性注释ClinVar和HGMD补充表中)进行了总结2。总共12(26%)以前称为变体可能致病或被认为是强有力的证据显示可能致病后ACMG标准(表2)。
确定变异的百分之三十八(n = 17日15个不同的变异和1变种中发现2例)位于15个基因参与免疫反应(无花果。18 B)。这些候选基因变异被发现的一种常染色体显性遗传模式(如PLCG2,RNASEL,TLR4或STAT3)、6变种基因中发现了一个常染色体隐性遗传模式(CFI,FCN3,HAVCR2和IL17RC)和三个变体中确定x连锁基因(TLR7,TLR8和G6PD)。发现LoF变体TLR7被发现在一个30岁男性病例分析中最近报道是谁16。p。一个rg378* variant onIL17RC没有描述的公共数据库(GnomAD23,ExAc24或1000基因组计划25),发现在两个无关的病人从我们的队列(加2.3%)。病人携带的基因变异。Ser755Cys位于TLR8基因也是半合的致病性变异G6PD(XL)基因和不显示已存在的并发症或风险因素时SARS-CoV-2感染(补充表1)。此外,死者的一个病人,临床诊断为原发性免疫缺陷(FJD_0728);进行的一个变体STAT3基因(p.Asn175His),除了隐性致病变种之一SRD5A3基因(表2)。
总共6个候选人变异(14%)被发现在糖基化的先天性疾病相关的基因(G6PC3,FKRP,MPI,mog,SDR5A3和TMEM199)和另外四个变量(9%)被发现在受损的DNA结合基因(EP300,MSH6,POLD1和RECQL4)。这10个变异,确定隐性基因,进行杂合现象的8例(表2)。
此外,两个变量相关的基因中发现了凝固(PLAU)和心血管风险(LDLR)在两种不同情况下(表2)。这两种情况需要插管和发展严重的并发症在SARS-COV-2感染(补充表2)。病人带着LDLR变体也杂合的一个变种CFI。
网络分析与候选基因变体
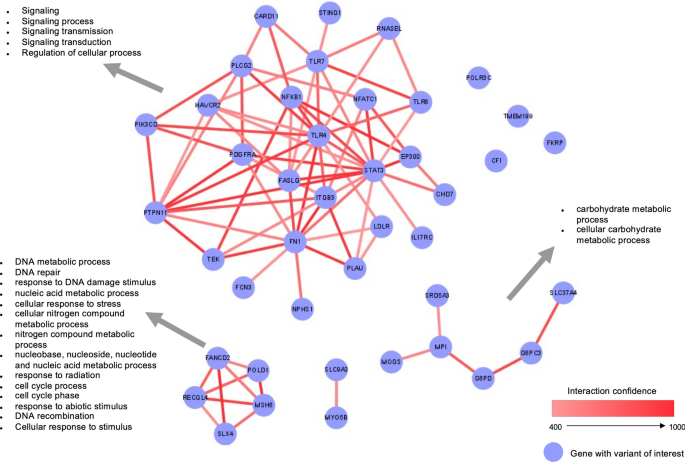
网络分析,包括与候选基因变异(补充表3),进行检测功能之间的交互。网络(图。2)显示三个主要组件。第一个组件由25高度相互关联的基因,15参与免疫反应和丰富相比在细胞信号网络的其余部分(图。2)。两个额外的网络组件,一个由6基因和富含碳水化合物代谢和第三个组件5基因富集在DNA代谢和修复过程中,相比其他网络。
讨论
理解inter-individual COVID-19临床变化有重要意义的识别高危患者,临床决策和个性化治疗的发展。在目前的研究中,一群年轻和中年患者严重COVID-19选择基因研究,其中44兴趣已发现的不同变体。正如预期的那样,大多数的检测到变异(40%)是由基因编码的免疫反应,直接相关的基因面板用于探索性研究是丰富的几种途径,包括额外的免疫基因比先前的研究报道11,13。
先天免疫是早期抗病毒反应的关键;因此,LoF相关基因的变异可能影响免疫反应的出现也改变了适当的间隙感染的适应反应9,26,27。从这个意义上讲,致病性罕见变异在13个候选基因参与TLR3和IRF7-dependent I型干扰素通路显示SARS-CoV-2严重感染的风险更高,这就可以解释3.5%的严重情况11。然而,这些初步结果没有复制在后续研究12,28。在我们的研究中,我们没有发现任何LoF变体在这13个基因,但我们发现七个可能致病变种在其他基因免疫反应直接相关(干扰素通路,主要)。我们已经证实了的存在TLR7男性的变体也参与最近发表的一项研究16,患有非常严重的COVID-19和没有相关并发症和感染的危险因素。因此,我们的研究结果支持遗传筛查TLR7变异的年轻人在没有预先存在的条件下防止生物标志物,有助于患者的临床管理的子集。更多,我们发现两个变量在其他toll样受体(通常)基因,TLR4(Chr9)和TLR8(ChrX),在两个男性50岁以下需要插管。值得注意的是,通常在先天反应是至关重要的其为病原体识别的分子模式从不同的微生物29日,被TLR3 7和8 RNA病毒的主要传感器30.。
此外,近40%的变异在目前的研究中发现位于免疫反应基因,其中一些高概率的不宽容,杂合的LoF变异(pLI≥0.9)31日;因此,单个LoF变异可能会导致严重的临床表型由于haploinsufficiency基因等CARD11,STAT3或NFKB1(pLI = 1,每个)。除了等位基因的剂量,受试者携带相同基因型可以显示变量表现性和其他常见或罕见的遗传变异可能修改单基因变异的外显率(多基因风险)32。从这个意义上说,30%的病人进行多个感兴趣的变体。甚至更多,其他知名COVID-19危险因素,如年龄、并发症或环境因素可能会影响单基因变异外显率最终观察表型33。
此外,我们发现5例(11%)携带杂合变异体基因相关糖基化的缺陷。先天性缺陷的糖基化(CDG)是一组罕见疾病主要是由隐性基因引起的34。CDG的临床表现包括神经系统、心血管和血液参与和复发性感染,等等35。和出血并发症的风险增加血栓事件与凝血因子异常糖基化36血栓形成是COVID-19最重要的并发症之一。因此,患者携带有缺陷的副本可能会经历更严重的SARS-CoV-2感染导致免疫反应的糖基化的重要性35。相比之下,ACE2广泛蛋白质糖基化的,先前的研究表明,细胞减少阻碍N-glycan SARS-CoV-2条目和O-glycan形成37。因此,很难得出结论的影响这些有缺陷的变异的糖基化状态monoallelic运营商和那些变异SARS-CoV-2间隙的影响。
此外,四个基因变异被发现在受损的DNA结合和集群包括三种基因(POLD1,MSH6和REQL4),除了SLX4和FANCD2在网络分析中发现。有证据表明,衰老是部分积累引起的DNA损伤38COVID-19和严重程度的病态,一直与细胞衰老,特别是老年人39。此外,过早衰老细胞可能是由病毒感染引起40;因此,COVID-19致病性变异患者受损的DNA结合基因更有可能培养细胞衰老和严重COVID-19。
有趣的是,其中一个候选人目前发现的变异是规范拼接的促凝剂通路的关键球员,PLAU,之前已经与出血失调有关,串联重复的基因与魁北克血小板障碍(MIM # 601709)主导模式。因此,我们可以假设这种变异可能影响血栓形成决议,作为报废证明先前模型41和推断的重要作用PLAU自然血栓决议的纤溶功能42。抗凝和纤溶发现了基因表达显著下调COVID-19肺的病人相比,控制43。因此,COVID-19患者功能的丧失PLAU基因可能更容易患血栓性的事件。此外,我们发现的一个变体LDRL基因,归类为不确定的意义与家族性高胆固醇血症的变种44。胆固醇代谢受损患者可以显示COVID-19严重后果的风险更高由于血胆脂醇过多的亲密关系,代谢综合征,和心脏病45。因此,变异诱发血胆固醇等LDLR致病性变异可能赋予COVID-19遭受严重疾病的风险更高,即使没有其他相关并发症46。
我们的研究也有一些局限性。首先,我们有一个有限的样本大小。尽管Stop_Coronavirus招募3500多组,严格的截止年龄(< 65年)和结果(只有非常严重COVID-19)让我们选择那些病人显示一个极端表型队列。第二,我们只分析了编码区;因此,我们可能错过了第二个致病基因(深intronic区域或基因拷贝数异变)monoallelic病人可以帮助我们解释COVID-19结果。除此之外,加上检测遗传变异的影响,有必要考虑的可能的额外效果既存状况相关COVID-19严重性在病人的结果。
总之,我们在非常严重的COVID-19描述性研究病人报道罕见变异的存在等某些生物学途径的免疫反应。此外,两个额外的信号通路被发现包括在碳水化合物的新陈代谢和DNA修复基因。还需要进一步的研究来确认最终的角色在本研究描述的变异COVID-19严重性。
患者和方法
主题和临床数据
病例系列研究是由选择子组的患者从西班牙STOP_Coronavirus (n = 44)47群,其中包括3500多名COVID-19病人,从第四医院(三个从马德里和一个从穆尔西亚)。极端表型选择从我们STOP_Coronavirus队列使用类似的设计之前的病例系列研究13。入选标准是中青年患者(65岁),确认测试SARS-CoV-2感染ARDS(幸存者或死亡)。西班牙STOP_Coronavirus队列中提供了更多信息补充方法。病例回顾性和前瞻性的从3月到2020年5月,随访至2020年12月。SARS-CoV-2感染证实了一个积极的聚合酶链反应(n = 41)和/或血清学试验(n = 3,免疫球蛋白和IgM阳性)。COVID-19患者从四个医院在西班牙:医院Fundacion吉梅内斯·迪亚兹(HUFJD)大学医院郡主艾琳娜(HUIE)和大学医院12 de Octubre大学(H12O)在马德里,和医院Clinico穆尔西亚用作de la Arrixaca大学(HVAM)。
临床数据获得HUFJD和HUIE从病人的电子病历使用batch-based复杂查询,然后回顾和由两个医生和两个临床研究人员手工精制。H12O HVAM,临床研究人员收集的数据手动电子医疗记录。临床信息主要包括人口统计数据、并发症、COVID-19症状,实验室发现,治疗,相关并发症COVID-19, ICU招生,结果(补充表1)。描述性统计(平均值和SD)计算主要临床和人口统计数据(表1)。
本研究的研究伦理委员会批准HUFJD, HVAM H12O。只要有可能,患者提供书面或口头知情同意参与这项研究。由于卫生紧急状态,每个中心的研究伦理委员会的要求知情同意放弃STOP_Coronavirus队列。所有样本消除识别信息(pseudonymized)和临床数据管理按照国家法律和制度的要求。
祖先推理
主成分分析(PCA)基于variance-standardized关系矩阵是用来推断每个病人的祖先和分类他们选中的祖先之一组(混在美国,欧洲,非洲和东亚)使用一组1000个基因组样本人口(阶段3)作为参考。对主成分分析中,我们使用以前收集的基因数据从我们的队列(未发表)获得与应用生物系统公司™Axiom™西班牙生物阵列(COL32017 1217,热费希尔科学Inc .),其中包含758740个变异。PCA进行使用叮铃声软件1.9版48。
亲属关系测试
评估亲属关系,我们使用以前收集的基因数据从我们的队列2获得与应用生物系统公司™Axiom™西班牙生物阵列(COL32017 1217,热费希尔科学Inc .),其中包含758740个变异。常染色体snp(加> 5%)修剪叮铃声3使用一个窗口1000标记,80步长和r20.1。131937个独立的子集snp是用来评估亲属(IBD)估计在叮铃声3。只有一个人从每一对个人PI_HAT > 0.25(二级亲属)显示Z0, Z1,和Z2相干模式(根据理论上预期值为每个亲缘级别),被删除。
全外显子组测序分析
DNA是隔绝EDTA-collected外周血样本使用一个自动化的DNA提取器(BioRobot EZ1,试剂盒GmbH)。DNA样本受到图书馆建设使用SureSelect人类所有外显子V6(美国安捷伦科技,圣克拉拉,CA)和Novaseq 6000测序仪器(Illumina公司、圣地亚哥、钙、美国),遵循制造商的协议。Paired-end读取2×150个基点生成每样提供一个目标覆盖率最低100×,总覆盖12 GB /样品。
韦斯分析我们内部维护生物信息学应用管道使用bwa v0.7.1749映射到GRCh37 / hg19人类基因组组装、gatk v4.2.0 HaplotypeCaller50对单核苷酸变异调用和硬过滤(SNP_filter: QD(深度)质量< 2.0,MQ(映射质量)< 40.0,MQRankSum <−12.5, ReadPosRankSum <−8.0, INDEL_filter: QD < 2.0, ReadPosRankSum <−20.0)。注释进行使用VEP r10351。可以看到更多的细节在github库https://github.com/TBLabFJD/VariantCallingFJD罗梅罗和应用程序相同的工具等。52。
单变量分析
搜索候选人变异参与严重COVID-19的病理生理学,我们使用一个候选人虚拟基因小组总结补充表4。候选基因小组包括330个基因主要参与I型干扰素免疫,原发性免疫缺陷,和基因有关凝固(面板1)。此外,234个额外基因选择使用COVID-19小组发表在PanelApp严重程度和易感性53,通过选择只有green-labelled基因(面板2)。除此之外,其他功能相关的基因包括通过使用我们GLOWgenes优先级方法(www.glowgenes.org)使用板1和2的564个基因作为种子集。300强优先选择基因作为面板3 (补充方法)。因此,总共有864个基因(564名候选人和300年由GLOWgenes)包含在最后的面板。
的PriorR v.2.1包(https://github.com/TBLabFJD/PriorR)是用于过滤和优先级。变异是过滤根据未成年人等位基因频率(加)< 0.01人口数据库(1000人基因工程25外显子组聚合财团(ExAc)24聚合,基因组数据库23(GnomAD)]。同义,intronic和非编码变异被排除在分析之外。ClinVar(ncbi.nlm.nih.gov / clinvar /)和人类基因突变数据库54(HGMD)被用来确定变异之前报道的致病性和那些形容可能良性/良性变异被丢弃。错义变异的影响评估使用一些预测工具(丹55,FATHMM56,GERP + +57轻轨58,M-CAP59,CADD60,MutationTaster61年,MutationAssessor62年,PhyloP63年,Polyphen2_HDIV64年,Polyphen2_HVAR64年,PROVEAN65年,RadiaISVM66年,筛选67年,SiPhy68年等)。规范和经典之中使用5预测(MaxEntScan剪接变体进行了评估69年,人类拼接仪70年拼接网站类似finder71年,NNSPLICE72年,GeneSplicer73年)使用特软件(互动Biosoftware、鲁昂、法国)。优先考虑的潜在致病性变异是评估使用Varsome工具74年后ACGM标准75年。
网络分析与候选基因变体
基因携带至少一个候选人的变体(补充表3)提交给数据库v11.5字符串76年和交互与一个字符串组合得分≥400下载一个文件(. tsv)总之表格文本输出格式从出口选项卡。Cytoscape77年版本3.4.0用于可视化。集群被定义为子图与任何两个节点(基因)通过边连接到对方,而不是连接到其他节点的图,这通常称为网络组件和一个集群的最极端的版本。我们应用宾果78年Cytoscape应用占了富集分析提取基因本体论(去)生物过程方面比较他们的注释在每个集群的集群的网络包括基因不分组。网络中的代表,字符串评分相结合,代表了交互的信心,是用来描述基因之间的边缘。功能丰富,每集群被选为罗斯福< 0.05。
数据可用性
和/或使用的数据集分析在当前研究可以从相应的作者以合理的要求。
引用
卡萨诺瓦,J.-L一样。苏,h . C。,COVID Human Genetic Effort. A global effort to define the human genetics of protective immunity to SARS-CoV-2 infection.细胞181年,1194 - 1199 (2020)。
奥德利米。et al。死亡率和免疫的SARS-CoV-2模式。自然590年,140 - 145 (2021)。
杨,J。et al。并发症的患病率及其影响的病人感染SARS-CoV-2:系统回顾和荟萃分析。Int。j .感染。说。94年,91 - 95 (2020)。
Debnath, M。,Banerjee, M. & Berk, M. Genetic gateways to COVID-19 infection: Implications for risk, severity, and outcomes.美国实验生物学学会联合会J。34,8787 - 8795 (2020)。
严重Covid-19 GWAS集团et al。全基因组关联研究的严重covid-19呼吸衰竭。心血管病。j .地中海。383年,1522 - 1534 (2020)。
COVID-19宿主基因倡议。映射COVID-19的人类基因结构。自然https://doi.org/10.1038/s41586 - 021 - 03767 - x(2021)。
Pairo-Castineira E。et al。在COVID-19重要疾病的遗传机制。自然591年,92 - 98 (2021)。
Meyts,我。et al。先天性免疫缺陷患者的冠状病毒疾病2019:一个国际研究。j .过敏中国。Immunol。147年,520 - 531 (2021)。
郭,a·J。,Mentzer, A. & Knight, J. C. Host genetics and infectious disease: New tools, insights and translational opportunities.Nat,启麝猫。22,137 - 153 (2021)。
Delavari, S。et al。SARS-CoV-2大流行对原发性免疫缺陷患者的影响。j .中国。Immunol。41,345 - 355 (2021)。
张,问。et al。先天性I型干扰素免疫致命COVID-19患者。科学370年,1 - 10 (2020)。
Kosmicki, j . A。et al。Pan-ancestry exome-wide协会分析COVID-19结果586157人。点。j .的嗡嗡声。麝猫。108年,1350 - 1355 (2021)。
van der, c。I。et al。存在基因变异在年轻男性严重COVID-19。《美国医学会杂志》324年,663 - 673 (2020)。
Fallerini C。et al。协会的toll样受体7变种有危及生命的COVID-19疾病在男性:发现一个嵌套病例对照研究。Elife10,1 - 10 (2021)。
Solanich X。et al。遗传筛查TLR7变异与严重COVID-19和先前健康的年轻人。前面。Immunol。12719115 (2021)。
浅野,T。et al。x连锁隐性TLR7不足~ 1%与致命COVID-19 60岁以下的男性。科学。Immunol。610 (2021)。
Bussani, R。et al。持久性病毒RNA, pneumocyte合胞体和血栓形成先进COVID-19病理学标志。EBioMedicine61年103104 (2020)。
Katneni, K。et al。凝血障碍和血栓形成严重的COVID-19感染:微血管的焦点。Thromb。Haemost。120年,1668 - 1679 (2020)。
南·k . & Insel p . a .炎症和血栓形成在COVID-19病理生理学:Proteinase-activated和purinergic受体为司机和候选人的治疗目标。杂志。牧师。101年,545 - 567 (2021)。
理查森,S。et al。呈现的特点、并发症和结果5700名患者住院COVID-19在纽约地区。《美国医学会杂志》323年,2052 - 2059 (2020)。
Pendu, j·L。,Breiman, A., Rocher, J., Dion, M. & Ruvoën-Clouet, N. ABO Blood Types and COVID-19: Spurious, anecdotal, or truly important relationships? A reasoned review of available data.病毒13,1 - 10 (2021)。
斯托,s r·斯托& c·p·生物角色的ABH和刘易斯histo-blood组抗原第二部分:血栓形成,心血管疾病和代谢。Vox唱歌。114年,535 - 552 (2019)。
Karczewski, k . J。et al。从141456年的变异突变约束谱量化人类。自然581年,434 - 443 (2020)。
Karczewski, k . J。et al。ExAC浏览器:显示参考数据信息从超过60000的外显。核酸Res。45D840-D845 (2017)。
克拉克,l . 1000人基因工程。演示文稿https://doi.org/10.1001/jama.299.7.755-d(2013)。
Sette, a &•克罗蒂s适应性免疫SARS-CoV-2 COVID-19。细胞184年,861 - 880 (2021)。
哈难,N。,Doud, R. L., Park, I.-W., Jones, H. P. & Mathew, S. O. The many faces of innate immunity in SARS-CoV-2 infection.疫苗9596 (2021)。
Povysil G。et al。罕见的I型干扰素免疫基因功能丧失变异不是严重COVID-19有关。j .中国。投资。131年15 (2021)。
川崎t & Kawai toll样受体信号通路。前面。Immunol。5461 (2014)。
Nazmi,。,Dutta, K., Hazra, B. & Basu, A. Role of pattern recognition receptors in flavivirus infections.病毒Res。185年32-40 (2014)。
列克,M。et al。分析蛋白质编码基因变异人类60706年。自然536年,285 - 291 (2016)。
C大调,a . C。et al。多基因背景修改单基因的外显率为一级基因组变异的条件。Commun Nat。113635 (2020)。
古德里奇,j·K。et al。外显率的决定因素和变量表达能力在77184年单基因代谢状况外。Commun Nat。123505 (2021)。
Peanne, R。et al。先天性疾病的糖基化(CDG):君在何处?。欧元。j .地中海,麝猫。61年,643 - 663 (2018)。
Verheijen, J。、Tahata年代。Kozicz, T。,Witters, P. & Morava, E. Therapeutic approaches in congenital disorders of glycosylation (CDG) involving N-linked glycosylation: an update.麝猫。地中海。22,268 - 279 (2020)。
凡克,S。et al。围产期和糖基化的早期婴儿先天性疾病的症状。点。j .地中海,麝猫。一个161年,一个,578 - 584 (2013)。
杨问。et al。抑制SARS-CoV-2病毒阻断N -和O-glycan精化。Elife961552 (2020)。
舒马赫,B。,Garinis, G. A. & Hoeijmakers, J. H. J. Age to survive: DNA damage and aging.趋势麝猫。24,77 - 85 (2008)。
Nehme, J。,B或ghesan, M., Mackedenski, S., Bird, T. G. & Demaria, M. Cellular senescence as a potential mediator of COVID-19 severity in the elderly.衰老细胞19e13237 (2020)。
马丁内斯,我。et al。诱导的DNA双链断裂由人类呼吸道合胞体病毒和细胞衰老。毒性7,427 - 442 (2016)。
辛格,我。et al。血栓未能解决在urokinase-type纤溶酶原激活物gene-knockout老鼠:救援通过正常骨骨髓来源的细胞。循环107年,869 - 875 (2003)。
D 'Alonzo, D。,De Fenza, M. & Pavone, V. COVID-19 and pneumonia: a role for the uPA/uPAR system.药物。今天25,1528 - 1534 (2020)。
桅杆,a E。et al。SARS-CoV-2抑制抗凝和纤溶在肺癌基因表达。Elife10330 (2021)。
阿隆索,R。et al。基因家族性高胆固醇血症的诊断使用dna芯片的基础平台。中国。物化学。42,899 - 903 (2009)。
Grasselli G。et al。风险因素与死亡率相关COVID-19在重症监护病房患者在伦巴第,意大利。JAMA实习生。地中海。180年,1345 - 1355 (2020)。
Vuorio,。Raal F。,Kaste, M. & Kovanen, P. T. Familial hypercholesterolaemia and COVID-19: A two-hit scenario for endothelial dysfunction amenable to treatment.动脉粥样硬化320年53-60 (2021)。
Lopez-Rodriguez, R。et al。男性雄激素受体polyQ等位基因和COVID-19严重性:复制研究。MedRvixhttps://doi.org/10.1101/2022.03.25.22271678(2022)。
常,C . C。et al。第二代叮铃声:上升到更大的挑战和更丰富的数据集。Gigascience47 (2015)。
李,h &杜宾,r .快速和准确的短阅读符合burrows - wheeler变换。生物信息学25,1754 - 1760 (2009)。
府绸,R。等。比例精确的基因变异发现成千上万的样品。BioRxiv(2018)。
麦克拉伦、W。et al。运用变异效果预测。基因组医学杂志。17122 (2016)。
罗梅罗,R。et al。评估管道的DNA变异检测可以指导再分析协议增加诊断遗传疾病的比率。地中海NPJ基因组。77 (2022)。
马丁,a。R。et al。PanelApp大佬专家知识建立共识诊断基因面板。Nat,麝猫。51,1560 - 1565 (2019)。
斯滕森,p D。et al。人类基因突变数据库:对遗传变异的综合库数据用于医学研究,基因诊断和下一代测序研究。嗡嗡声。麝猫。136年,665 - 677 (2017)。
广,D。,Chen, Y. & Xie, X. DANN: A deep learning approach for annotating the pathogenicity of genetic variants.生物信息学31日,761 - 763 (2015)。
Shihab, h·A。et al。预测功能、分子和表型氨基酸替换使用隐马尔科夫模型的后果。嗡嗡声。Mutat。3457 - 65 (2013)。
达维多夫,e . V。et al。识别人类基因组的高分数在选择性约束使用GERP + +。公共科学图书馆第一版。医学杂志。6e1001025 (2010)。
春,s & Fay, j . c .识别三个人类基因组内的有害突变。基因组Res。19,1553 - 1561 (2009)。
Jagadeesh这位,k。et al。M-CAP消除大多数变异临床外显高灵敏度的不确定的意义。Nat,麝猫。48,1581 - 1586 (2016)。
Rentzsch, P。威滕,D。,Cooper, G. M., Shendure, J. & Kircher, M. CADD: Predicting the deleteriousness of variants throughout the human genome.核酸Res。47D886-D894 (2019)。
施瓦兹,j . M。,Cooper, D. N., Schuelke, M. & Seelow, D. MutationTaster2: Mutation prediction for the deep-sequencing age.Nat方法。11,361 - 362 (2014)。
Reva, B。,一个ntipin, Y. & Sander, C. Determinants of protein function revealed by combinatorial entropy optimization.基因组医学杂志。8R232 (2007)。
波拉德,k . S。,Hubisz, M. J., Rosenbloom, K. R. & Siepel, A. Detection of nonneutral substitution rates on mammalian phylogenies.基因组Res。20.,110 - 121 (2010)。
Adzhubei, i。et al。预测方法和服务器损害错义突变。Nat方法。7,248 - 249 (2010)。
崔y & Chan A . p . PROVEAN web服务器:一个工具来预测氨基酸替换的功能效果和indels。生物信息学31日,2745 - 2747 (2015)。
咚,C。et al。比较和整合deleteriousness预测方法产生SNVs全部外显子组测序研究。嗡嗡声。摩尔,麝猫。24,2125 - 2137 (2015)。
Kumar P。,Henikoff, S. & Ng, P. C. Predicting the effects of coding non-synonymous variants on protein function using the SIFT algorithm.Protoc Nat。4,1073 - 1081 (2009)。
加伯,M。et al。利用偏置替换模式识别小说限制元素。生物信息学25i54 - 62 (2009)。
Eng, L。et al。模剪接变异ATM基因的编码和非编码区域:最大熵估计的接头连接的优势。嗡嗡声。Mutat。23,67 - 76 (2004)。
Desmet F.-O。et al。人类拼接仪:一个在线生物信息学工具来预测剪接信号。核酸Res。37e67-e67 (2009)。
Houdayer C。et al。剪接分析分子诊断指南来自一组327年硅/联合体外研究BRCA1和BRCA2变体。嗡嗡声。Mutat。33,1228 - 1238 (2012)。
瑞茜·m·G。,Eeckman, F. H., Kulp, D. & Haussler, D. Improved splice site detection in genie.j .第一版。医学杂志。4,311 - 323 (1997)。
Pertea m . GeneSplicer:剪切位点预测的新计算方法。核酸Res。29日,1185 - 1190 (2001)。
Kopanos C。et al。VarSome:人类基因组变异搜索引擎。生物信息学35,1978 - 1980 (2019)。
理查兹,S。et al。标准和指导方针的序列变异的解释:联合一致推荐的美国大学医学遗传学和基因组学和分子病理学协会。麝猫。地中海。17,405 - 424 (2015)。
Szklarczyk D。et al。字符串数据库2011年:功能的蛋白质交互网络,全球一体化和得分。核酸Res。39,1 - 10 (2011)。
香农,P。et al。Cytoscape:软件环境生物分子相互作用网络的集成模型。基因组Res。13,2498 - 2504 (2003)。
Maere, S。,Heymans, K. & Kuiper, M. BiNGO: A Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks.生物信息学21,3448 - 3449 (2005)。
确认
我们感谢病人对他们慷慨的贡献。我们感谢FJD-Biobank的合作,注册在Registro Nacional de Biobancos (B.0000647)支持的ISCIII身份PT20/00141)和BIOBANC-MUR,登记在“Registro Nacional de Biobancos (B.0000859)支持的ISCIII (PT20/00109项目),IMIB-Arrixaca和Consejeria de Salud de la CARM。
资金
这项工作得到了学院祝您健康卡洛斯三世,西班牙科学创新部(COVID-19研究电话,COV20/00181)联合欧洲区域发展基金(菲德尔,来实现欧洲)和爱丝特雷娜·德莱万特S.A.和Colabora女性协会。CIBERer (Centro de Investigacion en红德已经患有Raras)是由研究院祝您健康卡洛斯III.R.L-R。和M.dP.V。COV20/00181赞助的项目。贝拉,点和B。一个。are supported by the Miguel Servet (CP17/00006, CP16/00116) and Juan Rodes (JR17/00020) programs, respectively, of the Instituto de Salud Carlos III, co-financed by the European Regional Development Fund (FEDER). R.R. is supported by a postdoctoral fellowship of the Comunidad de Madrid (2019-T2/BMD-13714) and G.N.-M. by a contract of the Comunidad de Madrid (PEJ-2020-AI/BMD-18610).
作者信息
作者和联系
财团
贡献
R.L.-R。,m。和C.A. contributed to the conception of the study. J.R.-H., M.E.P.-T., M.B.-S., E.M., E.P.-A., E.G.-N. and C.A. provided samples and clinical data. R.L.-R., J.R.-H., M.C., B.A., P.M. and C.A. reviewed the clinical data and classify patients in severity categories. P.M., G.N.-M. and R.R. performed the bioinformatic analysis. R.L-.R., M.C., M.d.P.V., B.A.and C.V. contributed to the acquisition and interpretation of the genetic data. All authors contributed to the review and approval of the final version of the manuscript.
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Lopez-Rodriguez, R。,Del Pozo-Valero, M., Corton, M.et al。罕见的潜在致病变种在65岁以下的主题非常严重或致命COVID-19。Sci代表1210369 (2022)。https://doi.org/10.1038/s41598 - 022 - 14035 - x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 022 - 14035 - x