摘要
血管紧张素II型受体(AT1)的拮抗作用可改善实验性创伤性脑损伤(TBI)后的神经功能并减轻脑损伤,其部分原因可能是间接血管紧张素II型受体(AT2)刺激增强的结果。在实验性脑病理模型中,AT2刺激通过抗炎、血管扩张和神经再生机制被证明具有神经保护作用。我们最近证实了TBI后AT2的上调,这表明了一种保护机制。本研究通过高剂量和低剂量的选择性AT2激动剂化合物21 (C21)对创伤后(TBI后5天)AT2激活的影响进行了研究,与载体处理的对照组进行了比较。在两种剂量的C21和对照组之间,tbi诱导的损伤程度没有差异。然后,我们测试了at2敲除动物在实验性TBI后的继发性脑损伤。创伤后24小时和5天,at2缺陷小鼠的损伤体积和神经系统结果与野生型对照小鼠相似。因此,与AT1拮抗作用相比,AT2调节不影响损伤后5天内TBI的初始病理生理机制,这表明AT2在创伤性脑损伤的早期阶段仅起很小的作用。
介绍
在工业化国家,创伤性脑损伤(TBI)是与创伤相关的死亡和残疾的最常见原因1.在原发性损伤之后,脑炎症等机制会导致进一步的(继发性)脑损伤2.越来越多的证据表明,内在的中央肾素-血管紧张素系统(RAS)参与各种脑病理生理,包括脑外伤3..RAS效应肽血管紧张素II (AngII)主要结合到两个G蛋白偶联跨膜受体,即血管紧张素II受体1型(AT1)和2型(AT2)。ras介导的血管收缩和炎症是由AngII与AT1结合产生的4.最近的研究表明,阻断AT1可改善实验性TBI后的神经预后,减少继发性脑损伤5,6,7.我们之前的数据表明,在TBI后的头几天,在病灶周围组织中也存在创伤后AT2的上调5,这可能与保护性修复机制的启动有关8.事实上,已知通过AT2的RAS信号通路介导其抗炎和神经再生功能9.在各种脑损伤中上调10,11,12,13,14,15,16, AT2激活可能抵消AT1介导的病理过程17,18.因为降低AT1活性会增强AT2激活19, AT1拮抗剂的神经保护特性实际上可能与AT2功能的增强有关。Iwai等人报道了AT2敲除小鼠的梗死面积增加和神经损伤(AT2−/ y永久性大脑中动脉闭塞(MCAO)后20..此外,在AT2−/ y同时在AT2拮抗下,AT1阻断在减小梗死面积和改善神经系统预后方面效果较差,这表明间接AT2刺激是AT1抑制介导的保护的基础17.AT2后的信号转导涉及神经营养型酪氨酸激酶受体1 (NTRK1)和细胞外信号调节激酶1和2,以及蛋白激酶B和脑源性神经营养因子(BDNF)。10,21,22,23.
用AT2激动剂肽长期治疗小鼠被证明可以改善闭头TBI后恢复的解剖和功能标记24Schwengel等人发现,mcao后使用非肽特异性和选择性AT2激动剂化合物21 (C21)治疗小鼠可降低死亡率和神经损伤25,总结于26.这些结果表明AT2激活可能是一种治疗TBI的新方法。在本研究中,我们旨在阐明TBI背景下AT2激活的意义。
为此,我们研究了AT2在小鼠TBI后继发性脑损伤、脑炎症和神经系统结果中的作用,方法是:(1)用高剂量或低剂量C21治疗小鼠,并将结果与载体治疗小鼠进行比较;(2)分析at2敲除与野生型小鼠TBI后相同的结果。我们还分析了细胞因子和神经营养因子的基因表达,以阐明可能涉及的潜在分子机制。
材料与方法
动物
在第一项(药理学)研究中,使用了C57Bl6N成年雄性小鼠(Charles River Laboratory, Sulzfeld, Germany);在第二项(AT2击倒)研究中,AT2−/ y(Agtr2tm1a Wtsi (EUCOMM))和野生型幼崽(WT;at₂+ / y;C57Bl6N背景)。研究经德国莱茵兰-普法尔茨州动物护理和伦理委员会批准,按照美因茨约翰内斯·古登堡大学的机构指南(协议编号:23177-07 / G07-1-021和23177-07 / G13-1-046)进行,并符合reach指南。动物被置于受控的光照和环境条件下(12小时暗/光循环,23±1°C, 55%±5%相对湿度),实验前后均可自由获得食物(Altromin,德国)和水。
实验性创伤性脑损伤
动物用七氟醚(体积4%)和空气混合物(40% O)麻醉260% N2)透过口罩。直肠温度通过反馈控制加热垫保持在37°C恒定(Hugo Sachs, March-Hugstetten, Germany)。如前所述,实验性脑损伤是由控制性皮质撞击(CCI)引起的27.简单地说,动物的头部被固定在一个立体定向框架(Kopf Instruments, Tujunga, LA, USA)和一个大的开颅术(4 × 4毫米2)在右侧顶叶皮层上方矢状线、子宫壁线、冠状线和颞肌插入之间进行。定制制作的气动冲击器(L. Kopacz, Mainz, Germany)垂直放置于脑表面,冲击器尖端(直径3毫米)位于开颅术的中间。冲击参数为:速度7.5 m/s;持续时间,200毫秒;脑穿深1.5 mm(研究I)和1.0 mm(研究I验证性研究和研究II)。CCI后立即用常规组织胶(histoacryyl;Braun-Melsungen, Melsungen,德国)和丝线缝合。将动物随机分为三组,分别随访15 min(主损伤)、24 h(损伤后1天,1dpi)或cci后120 h(损伤后5天,5dpi)。15分钟组的动物在加热垫上保持麻醉,直到它们的大脑被移除;手术结束时,其他组动物分别置于单独的笼子中,在加热至33°C、湿度为35%的培养箱中恢复6 h (IC8000;德国德尔格)。
术中,采用改良的NIBP系统(RTBP 2000;肯特,美国),如前所述28.此外,在CCI前(训练阶段)8天和CCI后4天,每天测量血压。采样速率为100 Hz (a /D转换器:PCI 9112;Adlink科技,台湾;PC软件:Dasylab 5.0;measX,德国)和离线分析(Flexpro 6.0, Weisang,德国)的收缩压。围手术期用直肠温度探头测量体温(Physitemp;克里夫顿,新泽西州,美国)。
实验小组
研究一:cci后5天选择性AT2激动剂C21治疗的效果
WT小鼠随机(n= 9/组)至每日腹腔注射低- (0.03 mg/kg;LD)或高- (0.1 mg/kg;HD)剂量C21或对照物(0.9%生理盐水)。TBI后30 min开始注射,每24 h重复一次,直到第4天。将CCI组的皮质细胞因子和神经营养因子基因表达与naïve(未手术)组的皮质细胞因子和神经营养因子基因表达进行比较(n = 4)。为了区分原发性和继发性损伤,一组WT小鼠(n= 8)麻醉,进行CCI, tbi后15 min处死,然后取出大脑,分析原发性损伤体积。然后在一项验证性研究中重复了研究方案I,使用修改的CCI设备设置(见上文),共8只动物/组。
研究二:at2敲除小鼠与WT小鼠的TBI
at₂−/ y和at₂+ / y分别于TBI后24 h (n = 12/组)和5 d (n = 6/组)随访。在TBI前后进行神经学评估。在随访期结束时,切除脑组织,用免疫组织学检查脑损伤体积和激活的小胶质细胞/巨噬细胞,通过实时定量聚合酶链式反应(qPCR)定量细胞因子和神经营养因子的表达。为了区分原发性和继发性损伤,一组WT小鼠(n= 6)和一组AT2——/ y老鼠(n= 5)被麻醉,进行CCI,然后在tbi后15分钟牺牲,此时移除大脑并分析原发性损伤体积。
神经系统评估
神经系统预后由神经系统严重程度评分(NSS)决定29,在研究一中),采用改进的NSS (mNSS7(在研究II中),以及CCI前1天和CCI后24、72和120小时的体重。
在研究一中,为了计算NSS,一般行为、警觉性、运动能力和平衡能力被分为10个不同的任务。每个任务的评分从0(正常)到1(失败任务)。手术前一天,所有动物都进行了NSS测试。健康的动物必须以0分或1分通过测试才能被纳入研究。
在第二项研究中,使用了不同年龄的小鼠。因此,我们应用改良的NSS (mNSS)对神经状态有更具体的区分7.神经学结果由mNSS确定,在Tsenter et al.(2008)之后进行了修改。29在CCI前1天,以及CCI后24、72和120小时,由一名研究人员盲视分组分配。计算mNSS7一般行为、警觉性、运动能力和平衡能力被分为10个不同的任务。每个任务的得分从0(正常)到3(失败任务)。mNSS范围从0(健康)到16(严重受损)点7,29,30.(表1).
继发性脑损伤的组织学评价及免疫组化
为了进行组织评估,解剖后的大脑被冷冻在干冰粉中,并保存在- 20°C。然后用低温恒温器(HM 560 Cryo-Star;赛默飞世尔科学公司,德国)。第一张幻灯片根据Mouse Brain Library中bregma + 3.14 mm对应的第一个section定义(www.mbl.org).16个教派。(10µm)以500µm的间隔收集并放置在Superfrost +™载玻片上(赛默飞世尔科学公司)。在甲酚紫染色切片中,使用计算机化图像分析系统(Delta Pix Insight;Maalov,丹麦)由一名对群体分配视而不见的调查人员所做。按0.5 [mm] ×(载玻片面积1 [mm]2+滑块2面积[mm .2+ 16号幻灯片面积[mm .2])5.为了对活化的小胶质细胞/巨噬细胞进行免疫组化染色,冷冻切片固定在磷酸盐缓冲盐水中的多聚甲醛中,与阻断血清孵育,然后与抗电离钙结合接合分子-1(兔抗小鼠,抗iba -1抗体;Wako Chemicals, Neuss,德国,目录号:#019 - 19741)。切片清洗,用生物素偶联抗体(山羊抗兔IgG;默克公司;Darmstadt,德国),并使用Vectastain Elite ABC试剂盒(Vector Laboratories, Burlingame, CA, USA)根据制造商的说明进行处理。图像在20倍放大下拍摄(Axiovert, Zeiss, Germany)。两名研究人员使用ImageJ(美国国立卫生研究院)随机盲法,在小波束−1.28 mm处计数阳性细胞总数(+)。具有适当形态和外观的iba1免疫标记细胞31被鉴定为激活的小胶质细胞/巨噬细胞,并在0.52 × 0.65 mm的感兴趣区域(ROI)进行评估2在病灶附近的皮质组织中。
基因表达分析
脑组织样本在组织冷冻切片过程中切除。收集病变和病灶周围组织(右上象限)以及相应的对侧皮层组织(左上象限)的样本,在液氮中快速冷冻,并在−80°C保存。qPCR方法如前所述7,32.使用特定引物7,33,34(表2),计算BDNF、生长相关蛋白43 (GAP43)、NTRK1、NTRK2、转化生长因子β (TGFβ)、白细胞介素1β (IL1β)和IL6的绝对拷贝数,然后与亲环素A (PPIA)的绝对拷贝数进行归一化。34.
数据评价和统计分析
所有实验都是随机的,由研究人员对治疗组进行盲法(基于计算机的随机化)。为了确定所需的样本量,采用G∗权力35是否使用了主要变量,主要终点,以前发表的研究中的病变体积数据5,36.因此,基于这些研究的数据,本文进行了先验幂分析,以确定d 1.75的效应量,具有实际的标准统计幂(1−β)为0.95,显著性水平(α)为0.05,每组的样本量为n= 7。为了有足够的功率,我们决定有更大的样本量(n= 8 - 12,每组)。但由于AT2敲除小鼠数量不足,在5天组中,样本量仅为6只。因此,这些结果必须仔细考虑。使用GraphPad Prism 8统计软件(GraphPad Software Inc., La Jolla, CA, USA)进行统计分析。数据分布采用Shapiro-Wilks检验。两个独立组之间的参数和非参数数据的比较使用Welch-t分别为Wilcoxon秩和检验。对于mNSS的统计分析,我们使用Kruskal-Wallis检验对排名进行方差分析,并使用Dunn 's检验对多重比较进行校正。在本多臂平行组随机试验中,对于多个独立组的比较,如果通过了Shapiro-Wilk正态检验,则采用单向方差分析(one way ANOVA)和事后Holm-Šidák比较检验(所有组间比较)。为了评估同一动物重复测量(体重、收缩压)的组间差异,应用重复测量(RM)双向方差分析(双因素重复)(因素:治疗和时间),然后进行Šidák的多重比较检验。当重复测量数据集中存在缺失值且不可能进行双向方差分析时,使用混合效应模型使用限制性极大似然(REML)方法与Holm Šidák的多重比较检验分析重复测量数据。的值p< 0.05为显著性。数据以均数和标准差(均数±标准差)表示。
伦理批准
该研究经德国莱茵兰-普法尔茨州动物护理和伦理委员会批准,按照美因茨约翰内斯·古登堡大学的机构指南(协议编号:23177-07/G07-1-021和23177-07/ G13-1-046)进行。
发表同意书
所有作者都阅读并批准了最终的手稿。
结果
生理参数
全麻小鼠CCI后15min测定围手术期动脉血气(n= 6)与血气分析仪ABL800 Basic (Radiometer Medical ApS, Brønshøj,丹麦)进行了平行研究,该研究已由Timaru-Kast等人于2012年发表。33pH: 7.32±0.04,p一个O2: 272±21 mmHg, p一个有限公司2: 48±4 mmHg。数据显示,在我们标准化的麻醉和手术设置中,数值是稳定的,在正常的生理范围内33.在本研究中,所有组的手术期间体温都在生理水平内。
高剂量c21处理小鼠CCI后2 h血压下降
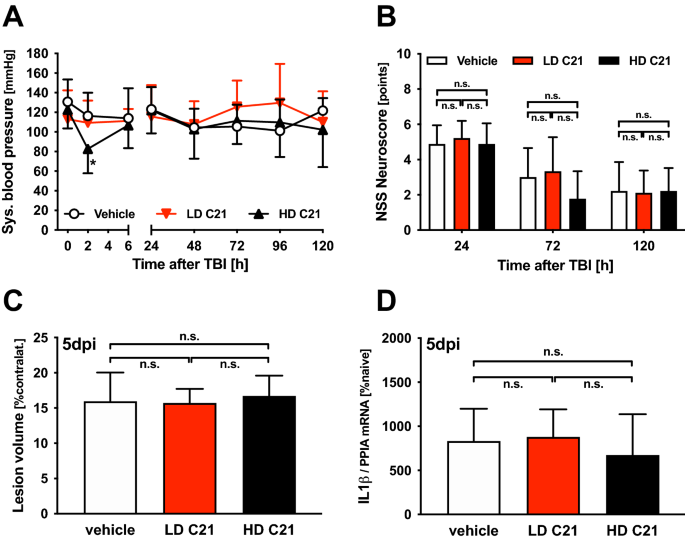
在脑损伤后2、6、24、48、72、96和120 h,分别测量术中(时间点0)、麻醉中和术后清醒动物的收缩压。虽然LD组血压没有明显变化,但与药物治疗组相比,HD组在CCI后2小时血压显著降低(82±24 mmHg)(116±24 mmHg;p= 0.0353)。然而,没有治疗x时间对血压的相互作用,治疗组之间没有发现其他差异。空白组平均收缩压为115±24 mmHg, LD组为116±28 mmHg, HD组为107±27 mmHg(图2)。1一个)。
AT2激活与C21对血压、神经转转率、损伤体积和脑炎症的影响:载体处理的WT小鼠(n= 9;(0.03 mg/kg;LD C21;n= 9;红色),或高剂量(0.1 mg/kg;高清C21;n= 9;黑色)的C21;数据以均数±标准差表示;不显著。(一个)创伤周收缩压(麻醉时时间点0,清醒动物术后):虽然载药组和LD组血压无明显变化,但与载药组相比,HD组CCI后2 h血压有有限下降(*p= 0.035)。在随后的时间点,这些值在生理水平内,与治疗无关。(BNSS:所有治疗组TBI后1天(24小时),神经损伤均显著增加,随后几天均有显著改善。与对照组相比,两种剂量的C21治疗均不影响神经预后。(C)脑损伤后5天的脑损伤体积(损伤后5天,dpi;为了排除水肿的影响,数据以对侧半球%表示,与原发病变(p< 0.05;见结果部分);然而,治疗组之间没有差异。(D) TBI后5天(5 dpi),与载体治疗相比,两种剂量的C21激活AT2均不影响细胞因子IL1β的瘤周基因表达。
C21治疗对脑外伤后的神经预后和体重无影响
根据NSS,所有组在tbi后第1天神经损伤显著增加,随后几天有显著改善。然而,LD组和HD组的神经系统结果与载体治疗小鼠无显著差异(图2)。1B).此外,所有组的体重发展相似。在CCI后第1天体重下降后,整个观察期间体重显著增加(对照组、低剂量和高剂量C21治疗小鼠的体重分别为19.7±1.8、19.7±1.5和20.1±1.8 g,对照为20.1±0.7*、20.7±1.7*和21.0±1.3* g,对照为第5天)p< 0.05;表格3.).与第1天(第4天)相比,C21处理小鼠的体重增加更早。然而,与载体处理小鼠相比,两种剂量的C21在任何时间点都不影响体重(表21)3.).
在另一组小鼠的验证性研究中,采用相同的治疗方案,但CCI设置降低,病变体积连续缩小45%,TBI后第1、3和5天,c21治疗组和载体治疗组的NSS无差异(NSS:载体:4±3,3±2,1±2;Ld: 4±2,4±2,2±2;HD:分别为3±2、2±2、1±1分)。
C21治疗对病变体积无影响
CCI后15 min测定原发病灶体积(对侧半球9.2%±1.2%)。CCI后5天,病变体积与原发病变体积相比显著增大(p< 0.05);而正常组、LD组、HD组对侧半球容积分别为15.9%±4.1%、15.7%±2.0%、16.7%±2.9%;无花果。1C)。正如初始研究发现的那样,改变CCI设备设置的验证性研究也显示组间无显著变化(对照组、LD和HD对侧半球容积分别为9.9%±1.9%、9.4%±1.9%和8.9%±1.9%)。
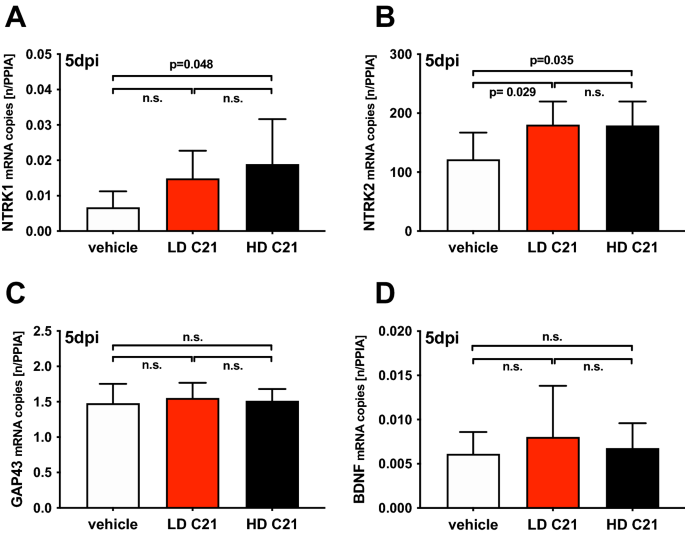
C21处理后,神经营养因子受体基因表达上调,而神经营养因子和细胞因子表达不受影响
与naïve小鼠相比,TBI后5天,通过qPCR评估,细胞因子IL1β、神经营养因子受体NTRK1和NTRK2以及神经营养因子GAP43和BDNF的瘤周基因表达水平升高(p< 0.05)。C21治疗不影响IL1β(图2)。1D).神经营养因子受体NTRK1的剂量依赖性上调(仅在HD组;p= 0.048)和NTRK2 (LD组和HD组;p= 0.029和p= 0.035;无花果。2A, B,被发现。然而,神经营养因子GAP43和BDNF的基因表达在对照小鼠和LD-或hd组小鼠之间没有显著差异。(无花果。2C, D)。
AT2敲除与WT小鼠无显著差异
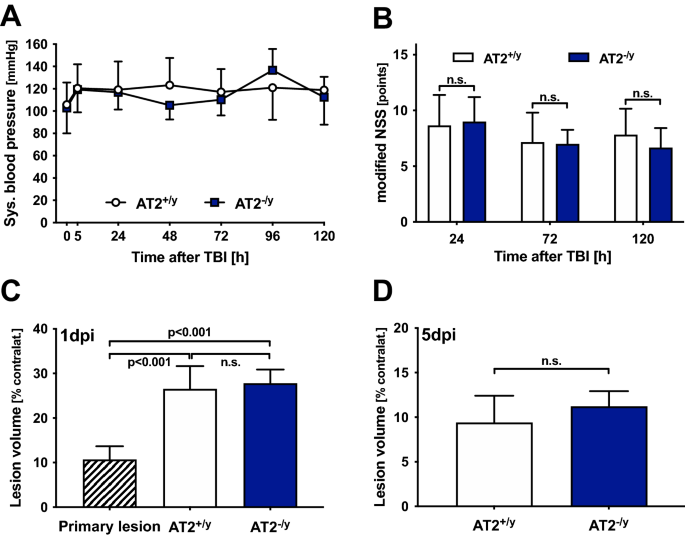
at2下调小鼠和WT小鼠的收缩压在生理水平内,无显著差异(图2)。3.一个)。
AT2缺乏不影响血压、神经结局和损伤体积:AT2缺乏小鼠(AT2−/ y;24小时:n= 12;5天:n= 6;蓝色)与年龄匹配的WT小鼠(AT2+ / y;24小时:n= 12;5天:n= 6;白色)。数值以平均值±标准差表示;不显著。(一个)围术期收缩压:时间点0为全麻CCI后立即的术中测量,术后以下时间点测量均在清醒动物中进行。这些值在生理规范范围内,AT2之间没有差异−/ y和at₂+ / y动物。(B)两组间CCI后mNSS无显著性差异−/ y和at₂+ / y动物。(C),(D)脑损伤体积(为排除水肿影响,数据以对侧半球%表示):TBI后15min评估原发病变,AT2之间无差异+ / y和at₂−/ y动物。C:创伤后24天损伤体积继发性显著增加(损伤后1天,1dpi;p< 0.001)在AT2中无差异+ / y与AT2相比−/ y老鼠。(D): TBI后5天(5dpi), AT2之间的病变体积无差异+ / y和at₂−/ y老鼠。
研究二采用mNSS检测神经状态。两组间mNSS评分差异无统计学意义+ / y和at₂−/ y组织;然而,在CCI 24小时后,神经损伤显著增加,随后在接下来的几天内,所有组的神经损伤都逐渐改善(图。3.B).使用年龄匹配的AT2缺失型和野生型的一窝交配小鼠。两组患者在颅脑损伤后5天内体重从颅脑损伤前开始持续下降。而AT2缺乏对脑外伤后体重减轻无影响(37.8±6.7 * . 41.2±5.7,36.3±7.2* . 39.3±5.6*,35.1±6.5*)#Vs. 37.8±5.5*#34.7±7.0*#Vs. 37.5±5.1*#AT2中的g+ / y与at₂——/ y分别在损伤前、损伤后1天、3天和5天的时间点;*p与脑外伤前相比< 0.05;#p与CCI后第1天相比< 0.05)。AT2的主要损伤体积−/ y(9.0%±1.5%对侧半球)和AT2+ / y(12.2±3.2%)对侧半球差异无统计学意义(CCI后15 min)。因此,两组的主要损伤体积一起显示。与TBI后15分钟测量的原发损伤体积相比,TBI后24小时因继发性损伤而导致的损伤体积显著增加(原发损伤体积,对侧半球10.7%±3.0%;继发性损伤体积,对侧半球(WT) 26.6%±5.1%;二次损伤体积,27.8%±3.1%对侧半球(AT2−/ y))。由于疤痕组织的形成,与cci后24小时相比,AT2中第5天的病变体积减小+ / y和at₂−/ y(对侧半球10.4%±2.1%和11.2%±1.7%)+ / y和at₂−/ y分别)。cci后的时间点均未表现出组间差异(图。3.C, D)。
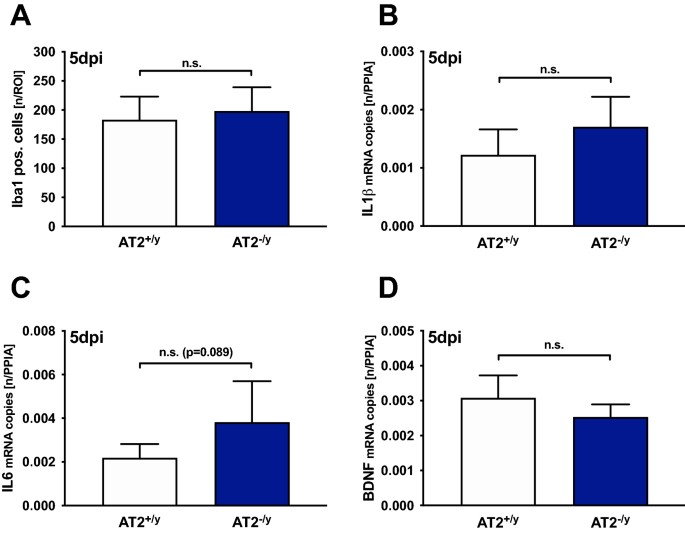
我们使用抗iba -1免疫组化方法,在CCI后5天评估了病灶周围ROI (0.52 × 0.65 mm)的小胶质细胞/巨噬细胞数量,作为小胶质细胞激活的代理2).在病变邻近区域而不是病变区域内测量IBA-1的基本原理是,在病变内部,组织基本上被破坏,小胶质细胞/巨噬细胞几乎不存在。然而,在病灶周围区域,小胶质细胞/巨噬细胞活跃。病灶周围iba -1免疫标记的小胶质细胞/巨噬细胞数量与未损伤的对侧半球相应部位相比显著增加。然而,在病灶周围和相应的对侧区域,AT2之间的结果相似+ / y和at₂−/ y组(病灶周围:183±40**和198±41** n/ROI,对侧:78±7和69±7 n/ROI, **p与对侧相应区域相比,AT2 < 0.001+ / y和at₂−/ y分别;无花果。4A).此外,IL1β和IL6的基因表达(图;4B,C)在AT2间无显著差异+ / y和at₂−/ y外伤后5天。未检测到其他基因(TGFβ, GAP43和BDNF;无花果。4D)显示敲除组和WT组之间有显著差异。NTRK1/2表达在各组间无差异。
讨论
一些研究表明,TBI后阻断AT1具有持续的保护作用5,37以及AT2在缺血性卒中中的神经保护作用17,25,38脊髓损伤10还有神经再生15.尽管脑缺血与外伤性脑损伤在病理生理上有相似之处39到目前为止,非肽选择性AT2激动剂C21在TBI后的治疗潜力仅是少数研究的主题。然而,尽管看起来有成功的潜力,在我们的TBI小鼠CCI模型中,我们发现通过反复应用高剂量和低剂量的C21直接刺激AT2在TBI后5天内没有产生任何显著的神经保护。因此,作为概念证明,我们研究了AT2敲除对我们的模型系统的影响,同样没有发现差异。令人惊讶的是,目前的数据与我们之前的假设相矛盾,即AT2刺激在TBI后具有神经保护作用。事实上,我们的方案和显示AT2刺激保护的TBI模型之间存在显著差异。每种可能的TBI模型都有其固有的优点和缺点,在选择啮齿动物TBI模型时需要根据研究的假设和设计进行充分的考虑40.在一项闭合性头部损伤研究中,Umschweif及其同事通过AT2肽激动剂CGP42112A治疗,证实了病变大小的减小和功能恢复的改善24.闭式颅脑损伤模型旨在复制震荡性颅脑损伤的生物力学和病理生物学41,42.标准化动压坠重装置对闭合颅骨和加减速损伤的冲击主要是弥漫性脑损伤41,43,44,45,46.另一方面,CCI是一种非常常见的模型,用于模拟伴有皮质挫伤、脑水肿、颅内压升高和脑血流量减少的局灶性TBI41,47.小鼠CCI模型可以非常精确地控制创伤的机械成分。通过精确调整撞击速度和深度,有可能产生一个明确的、局灶性的皮质损伤,并具有较高的重现性41,48.为了排除过大的创伤性脑损伤的可能性,即AT2激活的假定保护作用可能会减弱,我们在一项验证性研究中重复了目前的研究,减少了冲击器尖端的脑穿透,除此之外,相同的CCI设置和治疗方案。这种CCI设置的改变可以减少脑损伤。然而,与载体处理的小鼠相比,高剂量和低剂量C21激活AT2仍然对病变大小没有影响。尽管CCI设置相同,但由于星形胶质细胞重组,坏死和凋亡细胞及碎片被吞噬,TBI后5天的损伤体积小于TBI后24 h49,50.CCI除了使病灶体积扩大外,还导致小胶质细胞活跃,病灶周围小胶质细胞数量较CCI后相应对侧未损伤区域增加51,52,并与假小鼠相应的大脑区域进行比较53.除了不同的TBI模型,与Umschweif等人不同的是,本研究的重点是TBI后的早期阶段,以及使用NSS的运动损伤和行为而不是认知结果29.
与其他相关研究的一个主要区别是我们使用了C21。我们选择非肽AT2激动剂C21的原因是,肽替代品CGP42112A具有不利的药代动力学特性,例如非常快速的降解。它必须持续使用24因此,在过去,它从未被认为可以用于临床54.本研究的目的之一是模拟临床治疗,作为TBI后AT2激活的可能治疗机会14,54,55,56.因此,我们使用具有更佳药代动力学特征的非肽AT2激动剂C21作为tbi后重复治疗(CCI后30分钟开始),其潜力在进一步的研究中发展为可能的新的药理学概念10.C21的at2特异性已在多项研究中得到证实10,25,55,57.选择两种剂量C21的决定是基于已显示对缺血性脑损伤、脊髓和心脏损伤具有保护作用的剂量。0.03 mg/kg/天C21的剂量已被证明对心脏有保护作用,并减少左冠状动脉闭塞后的全身炎症58在美国,较高剂量(0.3 mg/kg/天)的C21并不能增强心脏保护作用58.在最近的一项啮齿动物脑缺血研究中(MCAO后1.5-3小时),显示在再灌注时用C21 (0.03 mg/kg)进行i.p.治疗,降低了凋亡和氧化标志物,增加了神经营养因子活性,减少了炎症和梗死面积,改善了24小时的行为结局,而不影响血压59.在本研究中,我们的C21剂量是根据Schwengel等人的小鼠研究选择的。25,其中在AT2中评估MCAO后卒中后C21治疗的效果−/ y和at₂+ / y老鼠。研究表明,与对照治疗相比,0.03 mg/kg/天C21显著改善了MCAO后的生存和神经系统结局,尽管它对AT2中风后96 h的梗死大小没有影响+ / y老鼠25.与载体处理的WT小鼠相比,c21处理的脑梗死周围皮层BDNF及其受体NTRK2和GAP43的表达显著增加25.因此,基于这些数据,我们决定使用两种剂量(0.03和0.1 mg/kg/天)来减少剂量不足的可能性,并研究剂量-反应关系。
通过血脑屏障(BBB)和脑组织中C21的可用性对于C21的有效性是重要的。的确,缺乏TBI后脑组织中C21效应位点浓度的测量,是本研究的一个局限性。在naïve啮齿动物中,注射ipp后,最近的浓度分析显示,只有极少的C21通过完整的血脑屏障60,61.然而,缺血性中风后,在注射0.03 mg/kg的ipp后30分钟,大脑皮层和纹状体内的C21水平显著升高61.一些研究表明,血脑屏障的通透性在急性和亚急性期达到峰值,随后缺血性卒中后血脑屏障的通透性逐渐降低62.创伤性脑损伤的啮齿动物模型显示血脑屏障对白蛋白和其他高分子量蛋白质的渗透性在损伤后4-6小时和2-3天达到峰值63,64.在我们目前的模型中,有一个明显的血脑屏障中断,在CCI后6-24小时达到高渗透性峰值,正如Luh和同事之前所显示的那样32.在人类创伤性脑损伤中,血脑屏障紊乱可在创伤后数天至数年被检测到65.在这些发现的基础上,我们假设,由于创伤后受损血脑屏障的通透性增加和重复治疗,在本研究中,损伤脑组织中存在足够高的C21受体刺激AT2的效应位点浓度55.
在最近的一项初步小鼠cci研究中,C21 (0.03 mg/kg, i.p.;与生理盐水相比),在tbi后1小时和3小时进行治疗66在tbi后24小时,NSS得到改善,il - 1β等炎症标志物减少。然而,在这项初步研究中没有测量病变体积。在最近的一项研究中,我们证明了在TBI后的前6小时,IL1β的表达增加5.然而,C21在TBI后5天不影响IL1β表达。
此外,在本研究中,主要终点病变体积不受C21治疗的影响。这与最近关于脊髓损伤的研究一致10以及脑缺血。Schwengel和同事注意到卒中后C21治疗降低了死亡率和神经损伤,但对梗死面积没有影响25.因此,AT2激活与C21可能对继发性脑损伤的扩大没有影响。Lee和同事在小鼠脑缺血模型(MCAO)中显示了AT2肽激动剂CGP42112的神经保护作用,减少了梗死体积,而非肽C21的治疗未能表现出保护特性,对神经元存活没有影响67在体外葡萄糖剥夺模型中。作者发现,与肽AT2激动剂CGP42112不同,相似浓度范围的C21没有保护作用68.然而,本研究的重点是研究C21在小鼠TBI后活化AT2的可能体内效应,该剂量在早期啮齿动物模型中已被证明具有保护作用25,43,59.我们不相信在本研究中剂量不足是一个问题,尽管相对缺乏以往的数据可以借鉴。与正常对照组相比,HD组TBI后神经营养受体NTRK1和NTRK2表达升高,血压降低2小时,这可能证明了C21的活性。然而,在大多数时间点,血压没有改变。这与几项研究一致,这些研究表明C21治疗没有或只有轻微的血压变化69,70.
因此,不同的TBI模型(闭头TBI vs CCI)和不同的AT2激动剂(肽vs C21)可能导致不同的结果。我们的负面结果引起了几个问题。物质或应用方案的限制可能导致未能在模型中检测到对结果测量的积极影响。C21预处理可能会有不同的结果。因此,在使用C21进行实验后,为了排除剂量不足或错误的应用时机,我们决定在没有额外处理的情况下分析AT2敲除小鼠,作为概念证明。我们研究了CCI后24小时和5天AT2缺乏的影响,但在脑损伤、神经炎症和神经学方面没有差异。
我们的阴性结果,特别是在AT2敲除小鼠中的阴性结果,可能的原因是AT2可能具有非保护性的促炎作用。Ruiz-Ortega等研究人员证实AngII通过AT1和AT2增加大鼠平滑肌细胞促炎核因子κ b (NF-κB)的激活71,72.虽然NF-κ b介导的转录主要通过AT1发生,但AT2激活增强了NF-κ b - dna结合和NF-κ b介导的细胞因子转录71.此外,在at1敲除小鼠中,AngII刺激可以证明NF-κB的增加。然而,阻断AT2可导致NF-κB在这些小鼠中的表达下降71,72,73,74.此外,Wolf还研究了参与NF-κB激活的AngII受体亚型,在各种细胞系中证明AngII通过AT2受体刺激诱导NF-κB激活75.Sabuhi用CGP42112A测试了AT2激活对肥胖Zucker大鼠和瘦Zucker大鼠炎症和氧化应激的影响。虽然AT2激活降低了肥胖大鼠的炎症和氧化应激标志物,但它增加了瘦大鼠的炎症和氧化应激标志物。这些结果表明,AT2受体可能根据体重或体重相关因素具有促进或抗炎作用76.此外,先前的研究表明,AT2激活的神经保护主要是由伴随的AT1拮抗介导的17,67.然而,本研究的目的是探讨AT2的作用,考察C21激活AT2在TBI急性期的影响。然而,在TBI病理生理学中,AT2激活是否具有神经保护作用,同时伴有AT1抑制,这一问题必须在未来的研究中解决。
总之,相对于AT1抑制的研究5在CCI模型中,选择性AT2激活C21并没有减少脑损伤。因此,目前的结果表明,TBI后早期AT1抑制的神经保护特性并不是由于AngII增强了AT2的激活。然而,AT2有助于修复过程的神经保护特性可能在TBI后的后期出现。
结论
最近的一些研究表明,抑制AT1可以改善实验性TBI后的神经预后,减少继发性脑损伤。越来越多的证据表明,at2介导的保护机制可能有助于AT1抑制的保护效力。在本研究中,首次评估了CCI后AT2激活对神经预后、脑炎症和病变体积的影响。目前的数据不能证实AT2激活的保护作用,AT2缺乏也不会影响TBI后5天内的脑损伤。这提示AT2在TBI早期可能起次要作用。目前的结果进一步表明,AT1抑制的神经保护特性不是由于在TBI后的最初5天内,在早期阶段AngII对AT2的增强激活。需要进一步的研究来评估TBI后C21激活AT2的后续影响。
数据可用性
在当前研究期间生成和/或分析的数据集可根据合理要求从通信作者处获得。
参考文献
Langlois, j.a., Rutland-Brown, W. & Wald, m.m.创伤性脑损伤的流行病学和影响:简要概述。J.头部创伤康复。21, 375-378(2006)。
Morganti-Kossmann, m.c., Rancan, M, Otto, V. I, Stahel, p.f. & Kossmann, T.创伤性脑损伤后脑炎症的作用:一个重新审视的概念。冲击16, 165-177(2001)。
脑血管紧张素II:新进展,未回答的问题和治疗机会。细胞摩尔,神经生物学。25, 485-512(2005)。
血管紧张素II AT(1)受体阻滞剂改善炎症应激:对治疗大脑疾病的有益作用。细胞。摩尔。一般人。32, 667 - 681。https://doi.org/10.1007/s10571-011-9754-6(2012)。
Timaru-Kast, R。et al。延迟抑制血管紧张素II受体1型可减少继发性脑损伤,改善实验性脑损伤后的功能恢复*。暴击。保健医疗。40, 935 - 944。https://doi.org/10.1097/CCM.0b013e31822f08b9(2012)。
Villapol, S., Balarezo, M. G., Affram, K., Saavedra, J. M. & Symes, A. J.创伤性脑损伤后血管紧张素II受体阻塞的神经修复。脑j。https://doi.org/10.1093/brain/awv172(2015)。
Timaru-Kast, R。et al。血管紧张素II受体1堵塞限制了老年动物脑损伤后的脑损伤,并改善了脑损伤后的功能结局,尽管AT1表达的年龄依赖性降低。前面。衰老>。11, 18岁。https://doi.org/10.3389/fnagi.2019.00063(2019)。
Loane, d.j. & Faden, a.i.创伤性脑损伤的神经保护:转化的挑战和新兴的治疗策略。趋势杂志。科学。31, 596 - 604。https://doi.org/10.1016/j.tips.2010.09.005(2010)。
萨姆纳,C。et al。神经系统疾病中肾素-血管紧张素系统的保护臂。中国。Exp。杂志。杂志。40, 580 - 588。https://doi.org/10.1111/1440-1681.12137(2013)。
Namsolleck, P。et al。at2受体刺激通过上调BDNF表达增强脊髓损伤后轴突可塑性。一般人。说。51, 177 - 191。https://doi.org/10.1016/j.nbd.2012.11.008(2013)。
Bottari, s.p., de Gasparo, M, Steckelings, u.m. & Levens, n.r.血管紧张素II受体亚型:特征、信号机制和可能的生理意义。前面。Neuroendocrinol。14, 123 - 171。https://doi.org/10.1006/frne.1993.1005(1993)。
Wruck, c.j.。et al。一种新型膜相关高尔基蛋白对血管紧张素AT2受体转运的调控。Arterioscler。Thromb。Vasc。医学杂志。2557 - 64。https://doi.org/10.1161/01.ATV.0000150662.51436.14(2005)。
Laflamme, L., Gasparo, M., Gallo, J. M., Payet, m.d. & Gallo-Payet, N.血管紧张素II诱导NG108-15细胞中AT2受体的神经突生长。被AT1受体抵消的作用。j .沸腾。化学。271, 22729-22735(1996)。
Gendron, L., Payet, m.d. & Gallo-Payet, N.血管紧张素II的2型受体和神经元分化:从观察到机制。J. Mol.内分泌。31, 359-372(2003)。
Reinecke, K。et al。血管紧张素II加速体内大鼠坐骨神经的功能恢复:AT2受体和转录因子NF-kappaB的作用。FASEB J.关。出版。联盟。Soc。实验医学杂志。17, 2094 - 2096。https://doi.org/10.1096/fj.02-1193fje(2003)。
Gendron, L., Oligny, J. F., Payet, m.d. & Gallo-Payet, N. Rap1/B-Raf在NG108-15细胞中血管紧张素II AT2受体信号通路中不依赖amp循环的参与。生物。化学。278, 3606 - 3614。https://doi.org/10.1074/jbc.M202446200(2003)。
李,J。et al。血管紧张素AT2受体对脑缺血所致神经元损伤的保护作用。美国实验生物学学会联合会J。19, 617-619(2005)。
堀内,M.,秋下,M.,曹,V. J.血管紧张素II型2受体在心血管系统中的研究进展。高血压33, 613-621(1999)。
周建平,周建平,周建平。血管紧张素II AT(1)受体拮抗剂抗脑缺血作用的机制。细胞摩尔,神经生物学。26, 1099-1111(2006)。
自制,M。et al。血管紧张素II型2受体刺激对局灶性脑缺血的可能抑制作用。循环110, 843-848(2004)。
Porrello, E. R., Delbridge, L. M. & Thomas, W. G.血管紧张素II型2 (AT2)受体:一个神秘的七跨膜受体。Biosci前面。(里程碑式的Ed)14, 958-972(2009)。
Plouffe, B., Guimond, m.o, Beaudry, H. & Gallo-Payet, N.酪氨酸激酶受体在血管紧张素II AT2受体信号通路中的作用:参与神经突生长和NG108-15细胞中p42/p44mapk激活。内分泌学147, 4646 - 4654。https://doi.org/10.1210/en.2005-1315(2006)。
Hashikawa-Hobara, N。et al。坎地沙坦西西提通过PI3K-Akt通路改善果糖诱导胰岛素抵抗大鼠血管紧张素II型2受体介导的神经突生长。糖尿病61, 925 - 932。https://doi.org/10.2337/db11-1468(2012)。
Umschweif G。et al。血管紧张素受体2型激活诱导创伤性脑损伤后神经保护和神经新生。神经治疗学Soc。Exp。神经病治疗11, 665 - 678。https://doi.org/10.1007/s13311-014-0286-x(2014)。
Schwengel, K。et al。血管紧张素at2受体刺激可改善实验性卒中小鼠的生存和神经预后。J. Mol. Med(伯尔)94, 957 - 966。https://doi.org/10.1007/s00109-016-1406-3(2016)。
Bennion, d.m., Steckelings, u.m. & Sumners, C.缺血性中风中AT2受体激动剂的神经保护。中国。科学。(Lond)。132, 1055 - 1067。https://doi.org/10.1042/CS20171549(2018)。
格里默特,e.v.et al。纤溶酶原激活物抑制物-1通过损害创伤性脑损伤后纤维蛋白溶解增强损伤。安。神经。85, 667 - 680。https://doi.org/10.1002/ana.25458(2019)。
Thal, s.c. & Plesnila, N.小鼠手术麻醉时术中血压和动脉pCO的无创监测(2)。J.Neurosci.Methods159, 261-267(2007)。
Tsenter, J。et al。小鼠创伤性脑损伤后恢复的动态变化:损伤严重程度对t2加权MRI异常以及运动和认知功能的影响。j .创伤25, 324-333(2008)。
塔尔,s。C。et al。抑制蛋白酶体糖皮质激素受体降解恢复外伤性脑损伤后地塞米松介导的血脑屏障稳定。暴击。保健医疗。41, 1305 - 1315。https://doi.org/10.1097/CCM.0b013e31827ca494(2013)。
多纳特,C. K.,斯科特,G.,绅士,S. M. &萨斯特,M.创伤性脑损伤中的小胶质细胞激活。前方衰老神经科学。9, 208年。https://doi.org/10.3389/fnagi.2017.00208(2017)。
Luh C。et al。抑制肌球蛋白轻链激酶可减少创伤性脑损伤后脑水肿的形成。j . Neurochem。112, 1015 - 1025。https://doi.org/10.1111/j.1471-4159.2009.06514.x(2010)。
Timaru-Kast, R。et al。年龄对小鼠脑损伤后脑水肿形成、继发性脑损伤及炎症反应的影响《公共科学图书馆•综合》7, e43829。https://doi.org/10.1371/journal.pone.0043829(2012)。
Timaru-Kast, R., Herbig, E. L., Luh, C., Engelhard, K. & Thal, S. C.年龄对小鼠急性脑损伤后定量PCR基因表达的影响。j .创伤https://doi.org/10.1089/neu.2014.3784(2015)。
Faul, F., Erdfelder, E., Buchner, A. & Lang, A. G.使用G* power 3.1的统计功率分析:相关和回归分析的检验。Behav。研究方法41, 1149-1160, doi:https://doi.org/10.3758/BRM.41.4.1149(2009)
Timaru-Kast, R。et al。血管紧张素II受体1堵塞限制了老年动物脑损伤后的脑损伤,并改善了脑损伤后的功能结局,尽管AT1表达的年龄依赖性降低。前方衰老神经科学。11, 63年。https://doi.org/10.3389/fnagi.2019.00063(2019)。
Villapol, S。et al。坎地沙坦是一种血管紧张素II AT(1)受体阻滞剂和ppar - γ激动剂,可减少损伤体积,改善小鼠创伤性脑损伤后的运动和记忆功能。Neuropsychopharmacol。掉了。出版。点。大学Neuropsychopharmacol。37, 2817 - 2829。https://doi.org/10.1038/npp.2012.152(2012)。
麦卡锡,c。et al。脑卒中后启动的血管紧张素II型2受体刺激可引起清醒大鼠的神经保护。高血压60, 1531 - 1537。https://doi.org/10.1161/HYPERTENSIONAHA.112.199646(2012)。
创伤性脑损伤的病理生理学。Br。j . Anaesth。99, 4 - 9日。https://doi.org/10.1093/bja/aem131(2007)。
创伤性脑损伤的啮齿动物模型:方法和挑战。方法分子生物学。1462, 29-46。https://doi.org/10.1007/978-1-4939-3816-2_3(2016)。
Cernak, I.头部创伤动物模型。NeuroRx2, 410 - 422。https://doi.org/10.1602/neurorx.2.3.410(2005)。
Umschweif G。et al。热适应小鼠创伤性脑损伤后的神经保护包括诱导神经发生和血管紧张素受体2型信号的激活。j . Cereb。血流量代谢关闭。j . Int。Soc。Cereb。血液流动代谢34, 1381 - 1390。https://doi.org/10.1038/jcbfm.2014.93(2014)。
Flierl,文学硕士。et al。落锤装置致小鼠闭合性头部损伤模型。Protoc Nat。4, 1328 - 1337。https://doi.org/10.1038/nprot.2009.148(2009)。
陈勇,Constantini, S., Trembovler, V., Weinstock, M. & Shohami, E.小鼠闭合性头部损伤的实验模型:病理生理学、组织病理学和认知缺陷。j .创伤13, 557 - 568。https://doi.org/10.1089/neu.1996.13.557(1996)。
Berkner, J. Mannix, R. & Qiu, J.临床前环境中的创伤性脑损伤。方法分子生物学。1462, 11-28。https://doi.org/10.1007/978-1-4939-3816-2_2(2016)。
Cernak, I., Stoica, B., Byrnes, K. R. Di, G. S. & Faden, a.i .细胞周期在中枢神经系统创伤病理生物学中的作用。细胞周期4, 1286-1293(2005)。
史密斯,D. H。et al。小鼠旁矢状面控制的皮层冲击模型:认知和组织病理学效应。j .创伤12, 169 - 178。https://doi.org/10.1089/neu.1995.12.169(1995)。
法登,a。et al。一种新型环化二肽在小鼠可控皮质撞击损伤后的神经保护和促智作用。j . Cereb。血流量代谢关闭。j . Int。Soc。Cereb。血液流动代谢23, 355 - 363。https://doi.org/10.1097/01.WCB.0000046144.31247.33(2003)。
陈毅,陈永华。星形胶质细胞与脑损伤。j . Cereb。血流量代谢关闭。j . Int。Soc。Cereb。血液流动代谢23, 137 - 149。https://doi.org/10.1097/01.WCB.0000044631.80210.3C(2003)。
Fitch, M. T., Doller, C., Combs, C. K., Landreth, G. E. & Silver, J.神经胶质瘢痕和进行性空化的细胞和分子机制:中枢神经系统创伤后炎症诱导继发性损伤的体内和体外分析。j . >。掉了。j . Soc。>。19, 8182-8198(1999)。
克莱默,t.j.。et al。在急性实验性创伤性脑损伤中,调节性T细胞的减少增加了T细胞脑浸润、反应性星形胶质细胞增生和干扰素- γ基因的表达。j .神经炎症16, 163年。https://doi.org/10.1186/s12974-019-1550-0(2019)。
克莱默,t.j.。et al。纠正:在急性实验性创伤性脑损伤中,调节性T细胞耗竭增加T细胞脑浸润、反应性星形胶质细胞增生和干扰素- γ基因表达。j .神经炎症16, 176年。https://doi.org/10.1186/s12974-019-1577-2(2019)。
门泽尔,L。et al。Progranulin可预防外伤性脑损伤后的过度轴突损伤和星形胶质细胞增生。神经胶质65, 278 - 292。https://doi.org/10.1002/glia.23091(2017)。
Steckelings,密歇根大学et al。血管紧张素II型2受体刺激的过去、现在和未来。肾素-血管紧张素-醛固酮系统。JRAAS11, 67 - 73,https://doi.org/10.1177/1470320309347791(2010)。
Steckelings,密歇根大学et al。非肽at2受体激动剂。咕咕叫。当今。杂志。11, 187 - 192。https://doi.org/10.1016/j.coph.2010.11.002(2011)。
湾,Y。et al。第一种选择性非肽AT2受体激动剂的设计、合成和生物学评估。医学。化学。47, 5995 - 6008。https://doi.org/10.1021/jm049715t(2004)。
Namsolleck, P., Recarti, C., Foulquier, S., Steckelings, u.m . & Unger, T. AT(2)受体与组织损伤:治疗意义。咕咕叫。Hypertens。代表。16, 416年。https://doi.org/10.1007/s11906-013-0416-6(2014)。
Kaschina E。et al。血管紧张素II型2受体刺激:心肌梗死肾素-血管紧张素系统治疗干扰的新选择?循环118, 2523 - 2532。https://doi.org/10.1161/CIRCULATIONAHA.108.784868(2008)。
Alhusban,。et al。化合物21在大脑中促进血管生成,并导致缺血性中风后的持续恢复。j . Hypertens。33, 170 - 180。https://doi.org/10.1097/HJH.0000000000000364(2015)。
Shraim, N。et al。微孔液相色谱-紫外检测研究了化合物21(一种非肽能AT(2)受体激动剂)在大鼠体内通过纹状体。j . >。冰毒。202, 137 - 142。https://doi.org/10.1016/j.jneumeth.2011.06.009(2011)。
本尼恩博士。et al。血管紧张素II AT2受体激动剂化合物21在缺血性中风中的保护作用:鼻脑传递方法。中国。科学。(Lond)。132, 581 - 593。https://doi.org/10.1042/CS20180100(2018)。
Moisan,。et al。实验性中风后微血管可塑性:分子和MRI研究。Cerebrovasc说38, 344 - 353。https://doi.org/10.1159/000368597(2014)。
巴斯卡亚,M. K., Rao, A. M., Dogan, A., Donaldson, D. & Dempsey, R. J.大鼠创伤性脑损伤后皮层和海马血脑屏障的双相开放。>。列托人。226, 33-36。https://doi.org/10.1016/s0304 - 3940 (97) 00239 - 5(1997)。
Baldwin, B. A. & Sukhchai, S.脑室内注射CCK可减少猪的操作性糖摄入量。杂志。Behav。60, 231 - 233。https://doi.org/10.1016/0031 - 9384 (95) 02211 - 2(1996)。
汤姆金斯,O。et al。创伤后癫痫的血脑屏障破坏。j .神经。Neurosurg。精神病学79, 774 - 777。https://doi.org/10.1136/jnnp.2007.126425(2008)。
化合物21,直接AT2R激动剂,诱导IL-10并抑制创伤性脑损伤小鼠的炎症反应。Neuromolecular地中海。https://doi.org/10.1007/s12017-021-08687-7(2021)。
李,S。et al。血管紧张素受体2型激动剂脑缺血后体外和体内的神经保护作用。Exp Transl。中风地中海。416。https://doi.org/10.1186/2040-7378-4-16(2012)。
Bosnyak, S。et al。血管紧张素多肽与AT1和AT2受体新配体的相对亲和力。中国。科学。(Lond)。121, 297 - 303。https://doi.org/10.1042/CS20110036(2011)。
Bosnyak, S。et al。非肽激动剂化合物21刺激血管紧张素AT2受体,在有意识的自发性高血压大鼠中引起血管抑制作用。Br。j .杂志。159, 709 - 716。https://doi.org/10.1111/j.1476-5381.2009.00575.x(2010)。
Hilliard, L. M. Mirabito, K. M. & Denton, K. M.揭示血管紧张素AT2受体作为男性和女性高血压治疗靶点的潜力:我们所知道的和我们仍然需要发现的。中国。Exp。杂志。杂志。40, 542 - 550。https://doi.org/10.1111/1440-1681.12067(2013)。
Ruiz-Ortega, M。et al。血管紧张素II在血管平滑肌细胞中通过AT(1)和AT(2)激活核转录因子kappaB:分子机制中国保监会,Res。86, 1266-1272(2000)。
Ruiz-Ortega, M., Lorenzo, O., Ruperez, M. Suzuki, Y. & Egido, J.血管紧张素II在正常大鼠的主动脉和AT1敲除小鼠的血管平滑肌细胞中激活核转录因子- kappab。Nephrol。拨号。移植。16(增刊1)27-33(2001)。
铃木Y。et al。炎症与血管紧张素II。Int。学生物化学j。细胞生物。35, 881-900(2003)。
Ruiz-Ortega, M, Lorenzo, O, Ruperez, M, Blanco, J. & Egido, J.正常大鼠全身输注血管紧张素II激活肾脏中的核因子- kappab和AP-1: AT(1)和AT(2)受体的作用。点。j .分册。158, 1743-1756(2001)。
“未走的路”:血管紧张素II型2受体在病理生理学中的作用。Nephrol。拨号。移植。17, 195-198(2002)。
Sabuhi, R., Ali, Q., Asghar, M., Al-Zamily, N. R. & Hussain, T.血管紧张素II AT2受体在炎症和氧化应激中的作用:在瘦Zucker大鼠和肥胖Zucker大鼠中的相反作用。点。j .杂志。肾杂志。300, f700 - 706。https://doi.org/10.1152/ajprenal.00616.2010(2011)。
确认
作者要感谢Dana Pieter和Tobias Hirnet提供的出色技术支持。本文中的一些数据来自Andreas Garcia Bardon的博士论文和Ralph Timaru-Kast的教授论文(Habilitation),这两篇论文都提交给了德国美因茨的Johannes Gutenberg大学医学院。
资金
由Projekt DEAL启动和组织的开放获取资金。这项研究得到了德国美因茨约翰内斯·古登堡大学医学中心(Stufe 1)的资助。
作者信息
作者及隶属关系
贡献
R.T.-K。:corresponding author, developed the study conception and design, conducted data acquisition, analysis and interpretation, supervised the experiments, wrote and revised the main manuscript and prepared the figures. A.G.B.: performed experiments, data acquisition, analysis and interpretation and made substantial contribution to conception and design, wrote parts of the manuscript. C.L.: involved in data acquisition, analysis and interpretation, made substantial contribution to conception and design. S.P.C.-C.: performed experiments, data acquisition, analysis and interpretation, made substantial contribution to conception and design, wrote parts of the manuscript. P.S.: performed experiments, conducted data acquisition, analysis and interpretation. E-V.G.: conducted data acquisition, analysis and interpretation, made substantial contribution to conception and design, revised the manuscript critically T.K.: conducted data acquisition, analysis and interpretation, revised the manuscript. A.S.: conducted data acquisition, analysis and interpretation, revised the manuscript. U.M.S.: provided AT2 agonist C21, revised the manuscript critically and contributed important intellectual content. S.C.T.: senior author, planned and supervised the study, conducted data interpretation, made substantial contribution to conception and design, corrected and prepared the figures, revised the manuscript critically. All authors read and approved the final manuscript.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Timaru-Kast, R, Garcia Bardon, A, Luh, C。et al。AT2激活对实验性创伤性脑损伤雄性小鼠早期脑损伤无影响。Sci代表12, 14280(2022)。https://doi.org/10.1038/s41598-022-18338-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-18338-x
这篇文章被引用
早期DNase-I治疗延缓成年小鼠创伤性脑损伤后的继发性脑损伤
科学报告(2023)