文摘
抗Covid-19缺乏治疗的选择导致了当前全球大流行。尽管有效疫苗的出现,发展广谱抗病毒治疗仍然是一个重大挑战,抗菌的光动力疗法(aPDT)可能发挥作用,尤其是在感染的早期阶段。aPDT鼻孔的亚甲蓝(MB)和非热能的光已成功用于灭活细菌和病毒的病原体在围手术期的设置。在这里,我们调查的影响MB-aPDT灭活人类betacoronavirus OC43 SARS-CoV-2体外和理论水平COVID-19临床试验测试,在不同的设置,可行性,技术可行性,短期疗效的方法。aPDT产生失活6-Logs体外,以RT-qPCR和传染性试验。从photo-physics角度来看,体外结果表明,响应不依赖于病毒本身,激发潜在使用aPDT当地销毁SARS-CoV-2及其变体。在临床试验中我们观察到的变量影响病毒RNA在nasal-swab样品评估RT-qPCR归因于aPDT-induced RNA碎片导致falsely-elevated计数。然而,在临床病毒传染性鼻孔棉签减少90%的样本和检测不到70%的样本。这是第一个演示基于定量临床病毒性传染性MB-aPDT测量是一个安全、方便地传递和有效的一线技术,可以减少当地SARS-CoV-2病毒载量。
介绍
在过去的两年半,有一个紧急的和正在进行的挑战找到新的和有效的选项来治疗和预防SARS-CoV-2病毒的传播。缺乏具体和有效的抗病毒方法导致了目前的大流行,全球超过六百万人死亡。尽管有效疫苗的快速发展,新的突变继续出现和广谱抗病毒疗法需要降低免疫逃逸的风险由SARS-CoV-2变异以及未来的呼吸道病原体1。
SARS-CoV-2 RNA中已发现了一系列大小的气溶胶粒子呼出在正常潮汐呼吸2,3。气溶胶模型表明,多样性最高的单位组织表面积对这种病毒感染发生的鼻子4。此外,鼻腔上皮ACE2表达最高,主SARS-CoV-2结合位点。在感染的早期阶段,病毒效价最高的一直在测量鼻子相比其他地区呼吸道5,6,7。这些研究强调的鼻子所扮演的重要角色SARS-CoV-2最初的感染和传播,激励调查有针对性的早期鼻治疗。
抗菌光动力治疗(aPDT),光动力失活(PDI)或photodisinfection (PDF),使用光激活否则无毒敏化灭活病原体和显示效率对范围广泛的微生物包括革兰氏阳性和阴性细菌8,9,10、真菌11、寄生虫12,13,14,15,16和病毒17,18,19,20.,21,22,23,24,25,26,27。治疗病毒感染使用aPDT历史悠久的临床研究可以追溯到单纯疱疹病毒28,29日。它可以迅速(< 1分钟),有效杀死(灭活> 5日志)包膜和非包膜病毒通过高水平的氧化应激产生病毒膜,病毒衣壳蛋白和病毒核酸的g c碱基对18。一种稳定的亚甲蓝(MB)可以有效地激活局部非热能的红光产生激发单重态氧(~ 670海里),主要负责杀病毒的氧化损伤。在人类乳头状瘤病毒中的应用和相关感染已被广泛研究20.,21。aPDT也被用于治疗血液制品(Theraflex、Macopharma、法国),包括对抗HIV30.,额外的研究疱疹、甲型肝炎、B和C19人类细小病毒、腺病毒、肠道病毒、巨细胞病毒和。
鼻MB-aPDT最初被开发为peri-operative细菌非殖民化(公元前Steriwave、水中精灵生物医学,加拿大),并经临床验证在高风险手术的情况下,导致显著降低手术部位感染率31日。治疗是无害的,没有重大不良事件指出超过60000患者超过9年32。随着SARS-CoV-2病毒最初在鼻子和不知情的无症状携带者,可以通过利用MB-aPDT作为低风险和容易申请当地鼻治疗可能是一个介入的阿森纳应对这次大流行。在评估其潜在的,重要的是量化的水平SARS-CoV-2失活不仅在体外,还在clinically-representative体内场景。这一概念暗示了作者和评论文章33,34,35,36然而,Svyatchenko et al。37首次证明了量化传染性试验有限数量的样品(N = 16),可以利用aPDT SARS-CoV-2体外的灭活。最近工作体外Arentz和冯·海德38已经证实抗冠状病毒特别是SARS-CoV-2 aPDT的潜力。随后,Schikora et al。39第一个针对COVID-19 aPDT临床研究报道。本试验仅利用临床疾病进展的端点和死亡率,减少显示(i)的严重疾病,住院和ICU招生(2.6%比19%),(2)衰减的疾病进展(97%比81%)和(3)减少死亡率(0.7%比3.3%)。然而,它没有提供定量信息的光动力效应在临床病毒本身。因此,补充和连接这些报告,我们提出:(i)控制体外研究使用MB-mediated aPDT模型对人类betacoronavirus OC43和SARS-CoV-2 (ii)的第一个MB-aPDT临床试验早期Covid-19病毒失活与定量数据来衡量RT-qPCR和传染性分析和(iii)的可行性上执行MB-aPDT Covid-19患者在各种医疗保健和社区设置。
结果
体外MB-aPDT HCov-OC43
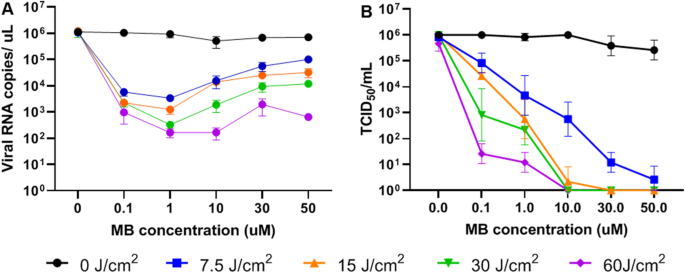
由于初始patient-derived供应有限的样本包含SARS-CoV-2病毒和有限的访问三级生物安全水平的实验室设施,dose-ranging研究控制光辐照和光敏剂交付使用人类betacoronavirus (HCoV-OC43),一个临床相关biosafety-level-2冠状病毒。RT-qPCR分析显示减少病毒载量的10倍4(“4-Logs”)当执行aPDT 30厘米−2670海里的曝光孵化后10分钟1μM MB和60厘米−2在1 - 10μM MB。然而,众所周知,病毒失活通过aPDT可以诱发RT-qPCR可能无法检测到的损害,导致低估治疗的效果,是看到的,例如,在最近的一项研究对丙型肝炎的MB-aPDT19在肺移植的设置。这可能是因为aPDT只破坏病毒capside和/或导致RNA分裂产生积极的rt - pcr的信号。虚假提升RT-qPCR计数。因此,传染性化验也进行测量病毒感染细胞的能力和复制后治疗。这更多的临床相关指标证明6日志的失活。化验的结果在图中做了总结。1单独的影响很小,显示光敏剂(暗毒性)和系统性的光敏剂,light-dose依赖性。之间没有显著差异被认为点灯,photosensitizer-only和不做控制。然而,所有组aPDT处理与对照组相比有更显著的病毒失活(P < 0.05)。
体外MB-aPDT SARS-CoV-2
六patient-derived样本包含SARS-CoV-2通用传输媒体MB-aPDT对待。显著减少病毒载量的~ 2日志以RT-qPCR被观察到在所有样本处理MB +光(图。2一)相对于对照组(P < 0.05)。MB-only和点灯控制中可观察到没有区别,除了一个示例(# 3)但是低病毒载量检测预处理成为治疗后检测不到MB或光。样品# 1和# 4也分析传染性和在这两种情况下的可衡量的传染性未经处理的样品(图中就被淘汰了。2B)。缺乏传染性反映病毒感染细胞的能力(损失的细胞病理效应,CPE),阻止其复制,进一步表明后处理RT-qPCR信号并不代表功能的病毒。
在体外评估中使用的原始数据可从相应的作者在合理的请求。
临床试验
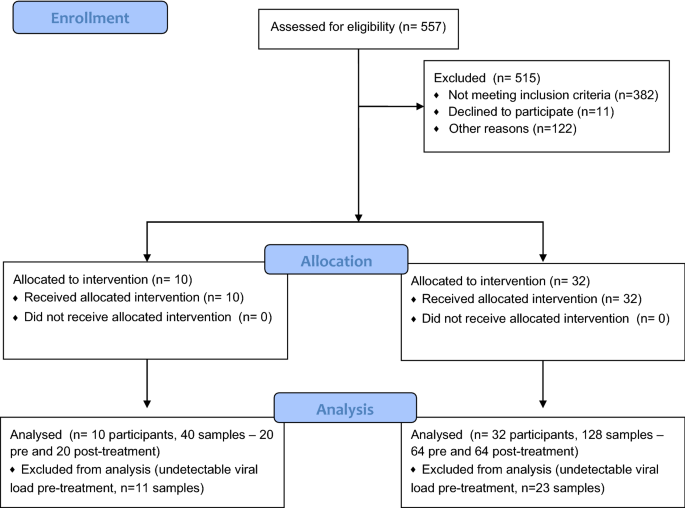
42岁的患者加入这项研究积极Covid-19诊断(14 - 94 y, 20岁男,18岁女性,4没有性陈述)18症状(流程图,图。3)。这项研究是在6进行不同的设置:ICU (N = 1),住院病房(N = 6),门诊Covid诊所(N = 5),在主体的汽车(N = 17),住院康复医院(N = 10)或病人的家门廊(N = 3)。程序是由外科医生(N = 11),外科居民(N = 18),病房护士(N = 4)和一个ER护士(N = 7)。在aPDT过程都接受过培训,包括预处理和后处理鼻抽汲和MB和光线的应用。治疗是简单的管理环境和所有病人耐受良好,无不适,并发症或副作用的报道。总治疗时间,包括预处理和后处理鼻抽汲和MB-aPDT应用10 - 15分钟。氧气是暂时在一个ICU病人允许程序。两个技术问题出现在使用激光在其推荐的操作环境。首先,在执行多个与激光治疗最初在一个无菌袋,过热导致暂停交付。这是解决通过移除袋,消毒激光之间的会话。第二,与一个主题在冬季户外低温治疗影响的操作激光和光交付必须暂停5分钟。没有遇到其他技术问题。
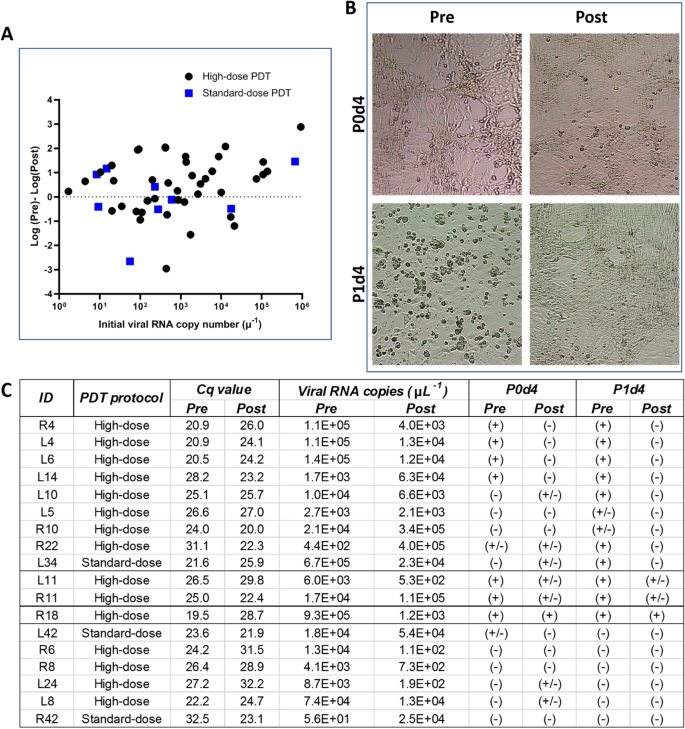
图4总结了预处理和后处理PCR结果从受试者接受标准(72厘米−2,N = 10个参与者,40个样品前+后处理)和高剂量aPDT J(144厘米−2参与者,N = 32, 128个样本前+后处理),独立策划每个鼻孔的数据。样本的百分之四十(N = 34/84)为阴性SARS-CoV-2鼻预处理拭子。虽然这些病人都是通过临床诊断为COVID-19 +鼻咽的测试,他们最初的COVID +测试结果之间的延迟和招聘研究可能改变了可检测出的病毒载量前鼻孔。aPDT导致病毒载量下降64% (27/42,P = 0.07)和44% (4/9,P = 0.57)的治疗使用高剂量和标准aPDT鼻孔,分别。减少病毒载量在38% > 90%(16/42)的鼻孔大剂量aPDT对待。
尽管RT-qPCR已知收益率有限精度aPDT后对治疗的反应,这是一个重要的预处理措施量化存在SARS-CoV-2棉签传染性分析之前,由于预处理高病毒载量增加感染试验的成功。
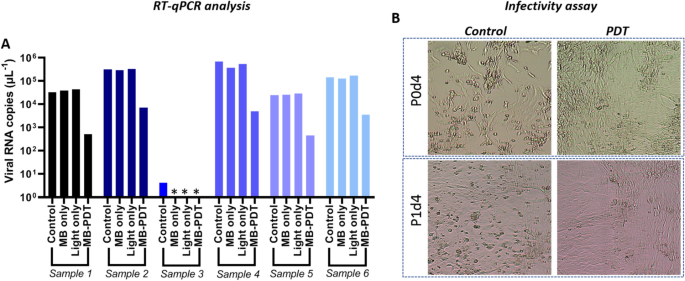
传染性试验的结果显示在无花果。4B, C。由于有限的三级设备访问,代表样本选自那些Cq < 32预处理(n = 18)。有有限的病毒载量水平在这些样本,上层清液从P0d4文化中删除,添加到新维罗- 76即食文化管第二CPE评价(P1d4)。以这种方式使病毒复制增加测定的准确性。
鼻孔处理144 J厘米−2,积极发现传染性在47%(7/15)的样品评估后4 d文化(P0d4)。在这个计算,减少或检测不到感染被认为在86% (P < 0.05, 6/7) aPDT后样品。第二评估P1d4, 66%(10/15)的样本积极的预处理和aPDT治疗传染性减少90% (9/10,P < 0.05),这些样品和完全灭活病毒(在试验的敏感性)70% (7/10,P < 0.05)。四的预处理样品4 d后变得更加传染性孵化,而没有一个治疗后的样品。虽然只有一小群患者接受光剂量越低,的三个样品预处理和后处理的样本显示在P1d4传染性。
这些传染性数据确认RT-qPCR SARS-CoV-2确实低估aPDT的功效:例如,样本L14 Cq = 28.2预处理和更高的病毒载量(Cq = 23.2) post-aPDT,而相应的post-aPDT传染性病毒化验显示,无法检测到的水平的活跃。
所有数据生成和分析在临床试验中发表文章和它的补充材料。
讨论
Photodisinfection亚甲蓝和非热能的光mechanistically-robust,安全,健康Canada-approved体内临床过程,已成功用于杀死细菌和病毒的病原体,其中包括鼻孔32。一般来说,aPDT设置显示的高功效病毒失活;它是低风险,无毒,方法,快速、可重复的、容易使用最少的培训。aPDT这里有证明是有效的在人类冠状病毒灭活体外和临床场景的基础上建立和定量微生物端点。这是第一次研究证明通过客观和定量临床减少病毒载量测量MB-aPDT是安全的,容易传递,有效的一线技术,可以减少当地SARS-CoV-2病毒载量。指出aPDT会导致RNA碎片和虚假提升RT-qPCR计数,这个研究还把人的注意力吸引到了需要利用传染性的病毒反应指标的研究光动力治疗,支持早期的发现丙型肝炎在器官移植的设置19。
如上所示,Schikora et al。39对COVID-19第一aPDT临床研究报道,使用临床终端显示积极的反应,但没有直接病毒学测量和统计分析。最近的工作由Svyatchenko et al。37雇佣一个传染性试验州立E6细胞表明aPDT能有效地杀死SARS-CoV-2体外,细胞生存能力不是妥协,但只使用两个不同的光剂量和光敏剂浓度和小样本大小。Arentz和冯·海德38,同样显示了aPDT的潜力在牛冠状病毒(BCoV)和SARS-CoV-2体外使用低剂量的MB和一系列光剂量由激光或LED来源。这里,系统光和光敏剂在全方位使用剂量,与反应来衡量RT-qPCR和传染性化验。aPDT被证明灭活HCoV-OC43 6-Logs体外,以RT-qPCR和HCT-8传染性试验的细胞。此外,aPDT对样本进行体外COVID-19病人显示显著减少Cq价值观和100%病毒失活的传染性试验。aPDT是同样有效的在两个不同的人类冠状病毒凸显了非特异性治疗的效果,因此,其潜在对抗当前的和未来的冠状病毒变体。
SARS-CoV-2检测阳性受试者的临床试验显示,后立即aPDT, nasal-swab样本的78%降低了病毒载量以RT-qPCR,放大和量化特定RNA基因序列。然而,一个重要的警告,是生成的活性氧在aPDT主要破坏病毒囊膜,暴露了RNA的环境,反过来,RNA片段,所以能给假高PCR计数。这种效应可能是出现在一些临床样本的大量增加Cq观察样本non-infective aPDT但后治疗。我们包括样品R22和R42传染性试验(,尽管病毒载量以RT-qPCR大幅增加,显示有限没有传染性后处理)专门确认rt - pcr的局限性决定aPDT的影响。然而,RT-qPCR测试仍然是有用的,因为它保证SARS-CoV-2的存在的样本,这样负面的预处理患者可以从随后的传染性审查测试,考虑到有限的三级生物安全水平的实验室资源。传染性的更重要的发现是,减少90%的样品后鼻内aPDT,探测不到70%的人使用一个标准化的分析州立- 76细胞。在访问和资源限制,BSL3设施也改善这将使更全面的传染性在今后的试验中测试。
一个实际的挑战在这个上下文中的临床研究发展大流行是访问和招募患者早期COVID-19积极分子试验。SARS-CoV-2发现主要在上呼吸道感染后的第一个五天,这将是理想的时间鼻孔aPDT(或多个扩展上oral-nasopharyngeal)。我们招募了积极的鼻咽癌患者COVID-19诊断拭子但感染的时间是未知的,所以一些受试者招募研究检测不到RT-qPCR SARS-CoV-2水平基于anterior-nares拭子。额外的挑战与大流行期间招聘和病毒载量患者之间的高可变性(甚至在同一个病人鼻孔之间)动机的一个重复测量研究设计比较预处理和后处理拭子,而不是使用一个单独的摘要(或假)对照组。因此,预处理拭子担任病人(鼻孔)具体控制和我们报告只有减少病毒载量和失活,而不是试图评估任何临床或长期的结果,为一个单独的未经处理的对照组是必要的。建议未来的研究的焦点,但可能存在的挑战对可行性的获得足够的样本大小,因为很难得到病人同意其中一只胳膊表示没有治疗。
虽然这些实用的限制影响了样本大小可用在这项研究中,获得的知识是有用的对这些临床试验需要如何设计和执行。与当前普遍获得快速检测,检测和治疗环境内部招聘将促进试验注册,允许aPDT首先证实感染后立即治疗。除了展示的潜力MB-aPDT减少和灭活Covid-19 intra-nasally,本原理临床研究已经证明的可行性提供aPDT在不同的设置,这是翻译的关键临床实践,包括:icu,门诊诊所,长期护理设施,房屋和车辆。技术基础设施和专业人员的最小要求是重要的因素在未来的传播形态,包括在偏远和资源缺乏的地区。
由于样本容量,我们不能断定是否减少治疗时间从8分钟到4分钟通常用于peri-surgical细菌非殖民化(144 vs。72 J厘米2光剂量)为了方便治疗交付将导致疗效降低。治疗时间越长时间在所有高剂量组的受试者耐受性良好。然而,数据表明功效较低的光剂量水平,激励进一步调查来确定最佳临床光剂量/治疗时间aPDT SARS-CoV-2的上下文中。
虽然这里没有评估,进一步潜在用途aPDT是保护acutely-exposed医务工作者(重症呼吸治疗师,等,麻醉医师,紧急和ICU工作人员)。这种“鼻子卫生”最终可能被用作第一道防御SARS-CoV-2(或其他呼吸道病原体)灭活病毒的感染可能发生前鼻孔:SARS-CoV-2据报道出现在10 - 12天前鼻孔前更广泛肺传播6。这种策略也可能限制传播高危医务工作者从SARS-CoV-2 aerosol-generating手术的病人。潜在的好处是以毁灭性影响临床专家在中国接触SARS-CoV-2病人插管期间。可行的报告SARS-CoV-2气溶胶中发现超过3 h强调这个问题的重要性40,41。
额外角色在限制的传播aPDT SARS-CoV-2以外的医院环境也可以设想,如预防性与高危人群个人工作,如在长期护理设施。在这种情况下重要的是要注意,许多研究表明,没有证据表明aPDT-induced阻力42,43,44,45,46可以不执行,这样重复photodisinfection失去功效。此外,aPDT病毒失活的机理不是蛋白特异性,表明它应该是同样有效的新变体:这是目前正在接受调查。
最后,我们正在研究方法光敏剂和光交付方法交付aPDT除了包括鼻咽和口腔的鼻孔。这种方法将在今后的试验中被评估,以确定的潜在好处在减少恢复时间SARS-CoV-2总数的通过降低上呼吸道病毒载量,从而允许本机免疫系统抗击病毒和细胞因子风暴的风险最小化。这种广谱治疗上呼吸道的一个更大的区域代表一个潜在的低成本选择病毒,细菌和真菌呼吸道感染。
结论
MB-aPDT被发现是有效的在人类冠状病毒灭活,HCoV-OC43 SARS-CoV-2,体外衡量RT-qPCR传染性化验,达到6日志的失活。在理论水平的临床试验,MB-aPDT COVID-19治疗早期阶段的调查。RT-qPCR能够识别SARS-CoV-2在样本的存在,虽然它不是精确测量aPDT响应。Cell-infectivity测量显示病毒减少90%的样品,完全失活在单个会话aPDT 70%。此外,本研究表明aPDT本地减少的可行性和灭活COVID-19处于早期阶段以最小的基础设施在不同的环境中。据我们所知,这是第一个aPDT临床试验与病毒学COVID-19量化通过RT-qPCR和传染性试验。这些有前途的结果表明可能对COVID-19 aPDT作为小说工具,激励未来的更大的试验,包括短期和长期的临床结果。如果成功,这将是重要的不仅在当前SARS-CoV-2大流行,而且其他未来的细菌或病毒传染性疾病在一个安全的和便宜的地方/区域非特异性治疗可以快速应用。
材料和方法
体外study-Betacoronavirus OC43
病毒传播
人类Betacoronavirus (HCoV-OC43 vr - 1558)和人类细胞系HCT-8 (HRT-18)从美国购买类型文化收藏。细胞培养的RPMI补充10%胎牛血清和保存在37°C和5%孵化器有限公司2。他们转移到T25烧瓶在80 - 90%融合病毒传播和感染,如下。细胞与PBS洗两次。病毒,稀释1毫升的RPMI(无酚红)和补充2%的边后卫,添加到细胞,然后举行33°C和5%的公司2。时收集上层的细胞病变效应(CPE)进展通过单层的80%。上层清液中的病毒载量量化了rt - pcr和病毒滴定用标准的方法47。
MB-aPDT
106TCID50(半数组织培养感染量)500μL RPMI 1640(罗斯威尔公园纪念研究所介质)补充热灭活胎牛血清无酚红了24-well盘子一式三份。亚甲蓝(西格玛奥德里奇)浓度的0.1,1、10、30或60μM添加和盘子孵化前10分钟光照射,使用一个定制的LED(发光二极管)数组与660 nm的峰值波长和输出功率密度30 mW厘米−2。一系列的光能量密度调查(7.5、15、30和60厘米−2)通过改变辐照时间从4到33分钟。控制包括点灯,MB-only并没有治疗。所有条件都复制一式三份(总共180个样本)。后立即治疗,样本连续稀释和冷冻rt - pcr和传染性分析。添加MB之后,所有的细胞都保持在最小的环境光。
rt - pcr分析
使用RNAdvance病毒RNA分离XP工具包(贝克曼库尔特)按制造商的协议。HCoV-OC43 RNA分析RT-qPCR用2×10µl反应一步法rt - pcr反应混合液(一起Biotek), 2.5µl RNA的提取和底漆/探针集膜蛋白基因(:ATGTTAGGCCGATAATTGAGGACTAT 300海里;牧师:AATGTAAAGATGGCCGCGTATT 300海里;调查:Cy5-CATACTCTGACGGTCACAAT, 200海里)48或N基因(:CGATGAGGCTATTCCGACTAGGT, 450海里;牧师:CCTTCCTGAGCCTTCAATATAGTAACC 450海里;调查:HEX-TCCGCCTGGCACGGTACTCCCT, 100海里)49。样本分析在BioRad CFX384实时PCR系统使用以下设置:50°C为30分钟,95°C 3分钟,然后45 95°C的周期为3年代和60°C 30年代,紧随其后的是荧光检测。量化病毒拷贝数,标准曲线生成使用SARS-CoV-2或HCoV-OC43合成RNA(扭Biosci)标准。
传染性试验
50000一夜之间HCT-8细胞培养与RPMI 96孔板的边后卫(5%)。病毒滴定进行如下。10毫升HCoV-OC43 MB-aPDT处理样品,和相应的控制,连续稀释(范围101-10年6)和添加到每个包含90μL RPMI媒体的边后卫(2%)。盘子被保存在33°C和5%孵化器有限公司24天。他们然后用低温甲醇洗两次PBS和固定15分钟。免疫荧光试验被Owczarek等进行了描述。50。为此,固定细胞被洗两次与PBS permeabilized 0.5% Triton x - 100在室温下10分钟。permeabilizer移除,这些细胞被孵化一夜之间有5%的牛血清白蛋白(BSA)。与PBS洗涤后,主anti-HCoV-OC43抗体(MAB9012,默克公司)稀释1:1000 3% BSA添加2 h。细胞然后用二次孵化AlexaFluor-labeled山羊anti-mouse IgG抗体(热费希尔科学)1 h和观察共焦荧光显微镜(488 nm激发,530海里检测)。
体外study-SARS-Cov-2
MB-aPDT治疗
Patient-derived冠2剂(积极性经rt - pcr)被播种在24-well板块(50μL /) 400μL DMEM无酚红。MB是500毫升的添加到最后一卷,10μM浓度。每个板进行了辐照后10分钟孵化使用相同的LED光源提供30厘米−2。控制包括点灯,MB-only并没有治疗。
PCR分析
SARS-CoV-2 RNA (Orf1ab)被孤立的如上所述和分析使用TaqMan-based RT-qPCR 2019 - ncov:实时荧光rt - pcr工具包BGI如前所述51。短暂,10µl反应卷包含2.5µl RNA的提取进行了分析使用BioRad CFX384实时PCR系统根据制造商的推荐的循环条件。
传染性试验
样本量化与Cq RT-qPCR值< 32被送到一个三级生物安全水平的实验室(Roy Romanow省级实验室,萨斯喀彻温省卫生行政部门,雷吉娜,加拿大)传染性试验。为此,病毒培养液是维罗- 76添加到即食文化管和保存在37°C和5%孵化器有限公司21 h。一毫升RM-02重新喂料介质(Quidel[诊断混合动力车]10 - 320500)与2%的边后卫,抗生素和TPCK-treated胰蛋白酶(1.0µg /毫升样品Cq值≤25岁或16µg /毫升样品与Cq值> 25;ThermoFisher科学)被添加到每个管和CPE (P0d4)的细胞被监控。100年第四天post-inoculationµl上层清液的删除和添加到一个新的现成的维罗- 76培养管第二CPE (P1d4)评估。这使得病毒复制的化验和增加其感染能力在第二。同样重要的是确定的CPE看到的是真正的病毒复制,而不是样本有关。这种方法所需样本病毒载量较低,提高了分析精度。
临床试验
研究设计
这个协议是新宁保健科学中心研究伦理委员会批准的(# 2069)在临床试验和注册。政府,2020/11/04 NCT04615936 NasalPDF0001)。
所有程序进行了按照道德标准委员会负责的人体实验(机构和国家)。知情同意是获得所有科目。对于18岁以下的参加者,同意了从父母或法定监护人。参与者招募了2020年10月和2021年5月之间。研究协议中提供的补充材料。所有与会者都14岁以上,有症状或无症状SARS-CoV-2提出,积极分子检测SARS-CoV-2在前面< 11天(4.2±3.4天)。预处理的研究利用一个重复测量设计拭子担任病人(鼻孔)特定的控制和比较测量通过RT-qPCR和传染性病毒载量检测后处理。
治疗
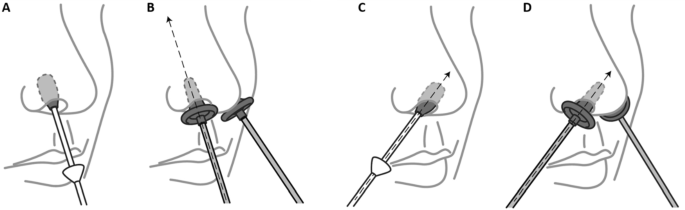
健康Canada-approved Steriwave系统(水中精灵生物医学,温哥华BC,加拿大)是用来提供MB-aPDT前鼻孔20.。知情同意后,参与者(N = 42)被要求吹鼻子鼻子分泌减少。最初的拭子进行深层清洁。第二个拖把被用来收集预处理样品(步骤1,无花果。5)。MB(0.01%)应用使用棉签每个鼻孔(步骤2,无花果。5)。一个器连接到一个双通道光纤器连接到670纳米二极管激光器(300 mWcm2)被同时进两个鼻孔(步骤3,无花果。5(图)指向中线的鼻子。5B)辐照后,MB中时,第二道光剂量与定位器是指向前鼻孔口袋通过改变鼻器(图的角度。5D)。立即治疗,第三个棉签收集(步骤4,无花果。5)。治疗前后样本立即冷冻盐水和储存在−80°C。rt - pcr和传染性分析遵循同样的协议在上面的体外研究。两个光剂量调查:high-PDT剂量,144厘米−2(N = 32)和标准剂量的72厘米−2这是临床上用于术前鼻非殖民化(N = 10)。
统计分析
统计分析了使用GraphPad棱镜设备上装。体外研究使用双向方差分析比较。临床试验、病毒载量和后处理在每个鼻孔比较使用Wilcoxon配对符号秩检验。二项测试是用于分析传染性试验数据。在所有情况下,值为P < 0.05被认为是具有统计学意义。
引用
曹:j . &格伦·j·s .材料科学方法发展的广谱抗病毒疗法。Nat。板牙。19,813 - 816 (2020)。
刘,Y。et al。空气动力学分析,在两个武汉SARS-CoV-2医院。自然582年,557 - 560 (2020)。
侯,y . J。et al。SARS-CoV-2反向遗传学显示变量在呼吸道感染梯度。细胞182年,429 - 446。e14灯头(2020)。
布斯,t·F。et al。检测空气严重急性呼吸道综合征(SARS)冠状病毒和环境污染在非典爆发单位。j .感染。说。191年,1472 - 1477 (2005)。
安,j . H。et al。鼻纤毛细胞是主要目标SARS-CoV-2复制COVID-19的早期阶段。j .中国。投资。131年33岁(2021年)。
邹,L。et al。SARS-CoV-2上呼吸道标本感染患者的病毒载量。心血管病。j .地中海。382年,1177 - 1179 (2020)。
Sungnak, W。et al。SARS-CoV-2条目因素一起鼻上皮细胞中高度表达的先天免疫基因。Nat,地中海。26,681 - 687 (2020)。
傅,X。,Fang, Y. & Yao, M. Antimicrobial photodynamic therapy for methicillin-resistant金黄色葡萄球菌感染。生物医学。Int >,2013年1 - 9 (2013)。
baillie gifford, K。et al。Photoinactivation分枝杆菌体外和一个新的小鼠模型的本地化牛结核分枝杆菌BCG-induced肉芽肿性感染。Antimicrob。代理Chemother。50,1828 - 1834 (2006)。
胡,X。,Huang, Y.-Y., Wang, Y., Wang, X. & Hamblin, M. R. Antimicrobial photodynamic therapy to control clinically relevant biofilm infections.前面。Microbiol。91299 (2018)。
Carmello, j . C。et al。使用photodithazine治疗口腔念珠菌病?介导的光动力治疗体内。《公共科学图书馆•综合》11e0156947 (2016)。
Lustigman, s &驻大肠光敏失活恶性疟原虫在人类红细胞酞菁。输血36,543 - 546 (1996)。
史密斯,t . g . &实物地租k.c.失活恶性疟原虫光动力激发的heme-cycle中间体源自delta-aminolevulinic酸。j .感染。说。190年,184 - 191 (2004)。
巴普蒂斯塔,m . s . &温赖特,m .光动力抗菌化疗(协议)用于治疗疟疾、利什曼病和锥虫病。布拉兹。j .地中海,杂志。Res。44,1 - 10 (2011)。
巴博萨,a·f·S。et al。反鲁兹锥体影响光动力抗化疗使用吩噻嗪衍生物作为敏化。激光医疗,科学。35,79 - 85 (2020)。
Gottlieb, P。et al。失活的鲁兹锥体trypomastigote形式在血液组件与酞菁的光动力治疗。Photochem。Photobiol。62年,869 - 874 (1995)。
Belousova, i M。et al。光动力的包膜病毒失活蛋白血浆准备通过固相fullerene-based光敏剂。Photodiagn。Photodyn。其他。11,165 - 170 (2014)。
Casteel, m . J。Jayaraj, K。、金、。,Ball, L. M. & Sobsey, M. D. Photoinactivation of hepatitis A virus by synthetic porphyrins.Photochem。Photobiol。80年,294 - 300 (2004)。
Galasso, M。et al。灭活丙型肝炎病毒在供体肺性常温体外肺灌注期间使用光疗法。Commun Nat。101 - 12 (2019)。
李,D。et al。治疗HPV infection-associated低品位与宫颈上皮内瘤5-aminolevulinic acid-mediated光动力治疗。Photodiagn。Photodyn。其他。32101974 (2020)。
温,l . Y。,Bae, S.-M., Do, J. H., Park, K.-S. & Ahn, W. S. The effects of photodynamic therapy with photodithazine on HPV 16 E6/E7 associated cervical cancer model.j .卟啉酞菁15,174 - 180 (2011)。
Rywkin, S。et al。新型酞菁血红细胞集中的光能病毒失活。Photochem。Photobiol。60,165 - 170 (1994)。
Eickmann, M。et al。失活的三个新兴viruses-Severe急性呼吸系统综合症冠状病毒,克里米亚-刚果出血热病毒和尼帕病毒在血小板集中通过紫外线C在等离子体光和亚甲蓝+可见光。Vox唱115年,146 - 151 (2020)。
弗洛伊德,r。,Schneider, J. E. & Dittmer, D. P. Methylene blue photoinactivation of RNA viruses.抗病毒Res。61年,141 - 151 (2004)。
Wong t.w。et al。亚甲基blue-mediated光能作为新型消毒剂肠病毒71失活。j . Antimicrob。Chemother。65年,2176 - 2182 (2010)。
Fryk, J·J。et al。登革热、基孔肯雅病毒在等离子体有效灭活治疗后与亚甲蓝和可见光。输血56,2278 - 2285 (2016)。
流行的,h . M。et al。失活的黄热病病毒治疗后血浆与亚甲蓝和可见光和紫外线治疗后血小板浓缩液C。输血59,2223 - 2227 (2019)。
温赖特,当地使用光动力治疗病毒性疾病的治疗。Int。j . Antimicrob。代理21,510 - 520 (2003)。
Kharkwal, g B。沙玛,美国K。、黄、y y。,Dai, T. & Hamblin, M. R. Photodynamic therapy for infections: Clinical applications.激光Surg.地中海。43,755 - 767 (2011)。
霍洛维茨,b &驻,大肠努力减少病毒传播的风险通过病毒失活。安。地中海。32,475 - 484 (2000)。
情节剧电影,d . M。希科克,J。,一个ndersen, R., Loebel, N. G. & Wilson, M.Photodisinfection疗法:感染控制的关键技术。卷。13。(2020)。
布莱斯,E。et al。鼻photodisinfection和洗必泰纸巾减少手术部位感染:一个历史对照研究和倾向分析。j . Hosp.感染。88年,89 - 95 (2014)。
Kipshidze, N。,Yeo, N. & Kipshidze, N. Photodynamic therapy for COVID-19.Nat,光子。14,651 - 652 (2020)。
法律,年代。,Lo, C., Han, J., Leung, A. W. & Xu, C. Photodynamic therapy with curcumin for combating SARS-CoV-2.Photodiagn。Photodyn。其他。34102284 (2021)。
多,p V c。et al。系统回顾:光动力治疗的抗病毒治疗处理SARS-CoV-2潜在的指导。Photodiagn。Photodyn。其他。34102221 (2021)。
Sanchez de Araujo h &费雷拉,f .量子点与光动力治疗COVID-19治疗。量子Eng。378 (2021)。
Svyatchenko,诉。尼克诺夫,s D。Mayorov, a P。,Gelfond, M. L. & Loktev, V. B. Antiviral photodynamic therapy: Inactivation and inhibition of SARS-CoV-2 in vitro using methylene blue and Radachlorin.Photodiagn。Photodyn。其他。33102112 (2021)。
海德,Arentz, j . & von der周宏儒。评估基于亚甲蓝的光动力失活(PDI)和胞内B-CoV SARS-CoV2病毒在不同光源下体外作为新的地方的基础治疗策略Covid19感染的早期阶段。Photodiagn。Photodyn。其他。37102642 (2022)。
Schikora D。,Hepburn, J. & Plavin, S.引文:减少病毒载量的非侵入性的光动力治疗COVID-19感染的早期阶段。(2020)。
van Doremalen, N。et al。气溶胶和表面稳定性SARS-CoV-2 SARS-CoV-1相比。心血管病。j .地中海。382年,1564 - 1567 (2020)。
帕特尔,z . M。et al。信:内窥镜底颅底手术的预防措施在COVID-19大流行。神经外科87年E66-E67 (2020)。
塔瓦雷斯,。et al。抗菌光动力治疗:研究细菌复苏的可行性和潜在的治疗后发展的阻力。3月的药物8,91 - 105 (2010)。
科斯塔L。et al。评价抗性发展可行性恢复,无包膜病毒aPDT周期重复后。抗病毒Res。91年,278 - 282 (2011)。
朱里奥,j . & Olimpia c .病原微生物的失活光动力技术:机械方面和角度的应用程序。AntiInfect。代理地中海。化学。6,119 - 131 (2007)。
Al-Mutairi, R。,Tovmasyan, A., Batinic-Haberle, I. & Benov, L. Sublethal photodynamic treatment does not lead to development of resistance.前面。Microbiol。91699 (2018)。
Maisch, t .抵抗细菌的抗菌光能失活。Photochem。Photobiol。科学。14,1518 - 1526 (2015)。
兰伯特,F。,Jacomy, H., Marceau, G. & Talbot, P. J. Titration of human coronaviruses, HcoV-229E and HCoV-OC43, by an indirect immunoperoxidase assay.摩尔。生物方法。454年,93 - 102 (2008)。
Vijgen, L。et al。一步的发展,实时、定量逆转录酶聚合酶链反应的绝对定量分析人类冠状病毒OC43和229 e。j .中国。Microbiol。43,5452 - 5456 (2005)。
范·艾尔登l . j . R。et al。频繁的检测人类冠状病毒的呼吸道感染患者临床标本中使用一种新的实时逆转录酶聚合酶链反应。j .感染。说。189年,652 - 657 (2004)。
Owczarek, K。et al。早期的事件在人类冠状病毒OC43进入细胞。科学。代表。87124 (2018)。
皮尔森,j . D。et al。SARS-CoV-2间接和直接RT-qPCR检测方法的比较。性研究。J。1899 (2021)。
确认
的支持(Steriwave激光和包)是由水中精灵生物医学提供。我们感谢Aoife麦克纳利、卡特琳米尔纳Etinosa Oliogu,维托桑切斯和拉维Tuazon援助与临床研究。
资金
BCW安大略省COVID-19快速研究基金会(CW)。
作者信息
作者和联系
贡献
概念化:漫画,B.C.W.、石油醚Methodology: C.W., B.C.W., L.P., R.B., A.L., J.L., R.M., J.P., D.T., J.W., J.W. Funding acquisition: C.W., B.C.W., R.B., J.L., J.W. Project administration: C.W. Supervision: C.W., B.W. Writing-original draft: L.P., C.W., B.C.W. Writing-review & editing: C.W., B.C.W., L.P., R.B., A.L., J.L., R.M., J.P., D.T., J.W., J.W.
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
补充信息
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
皮雷,L。,Wilson, B.C., Bremner, R.et al。平移SARS-CoV-2鼻光能消毒的可行性和有效性。Sci代表1214438 (2022)。https://doi.org/10.1038/s41598 - 022 - 18513 - 0
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 022 - 18513 - 0
本文引用的
针对SARS-CoV-2介导的光动力中和单线态氧
光化学与光生物学的科学(2023)