摘要
己糖激酶2 (Hxk2)酿酒酵母是一种双功能己糖激酶,作为糖酵解酶和参与葡萄糖抑制基因的转录调节。葡萄糖抑制的缓解伴随着Hxk2在丝氨酸15处的磷酸化,这被归因于蛋白激酶Tda1。为了探索Tda1在Hxk2磷酸化之外的作用,在蛋白质组学上的后果TDA1通过差异凝胶电泳(2D-DIGE)对野生型和Δ型进行比较tda1删除突变。为了进一步解决葡萄糖抑制/解抑制的可能后果,在2%和0.1% (w/v)葡萄糖的条件下生长。在上面显示至少两倍增强或减弱荧光的共八个蛋白质点TDA1用质谱法检测和鉴定缺陷。除了预期的Hxk1外,在斑点身份中还有两种己糖激酶1 (Hxk1)的变形形式。结合2D-DIGE的靶向蛋白质组学分析证明了这一点TDA1是Hxk2和Hxk1丝氨酸15磷酸化所不可缺少的。鉴定出36个葡萄糖浓度依赖蛋白斑点。提出了一种改进斑点定量的简单方法,将斑点近似为旋转对称固体,并提供了关于Hxk1和Hxk2的数量及其丝氨酸15磷酸化形式在高糖和低糖生长条件下的新数据。Δ的tda1缺失突变体在高糖或低糖条件下或在替代碳源下生长均无变化。此外,蔗糖酶活性,作为葡萄糖解抑制的报告,没有显著改变。相反,有人认为Tda1参与了氧化应激反应。
简介
真核生物已经发展出折衷的调节网络来维持体内平衡。葡萄糖代谢在这些网络中具有核心作用,因为葡萄糖是ATP再生和合成代谢的关键底物,以及细胞内还原电位的保存1,2.己糖激酶不仅通过己糖磷酸化催化葡萄糖代谢的第一步,而且还参与葡萄糖的传感和信号传递2,3..
的酿酒酵母(酿酒酵母)基因组编码三种已知的己糖激酶:两种不同调控的己糖激酶同工酶Hxk1和Hxk2,它们可以磷酸化多酚糖和酮糖,葡萄糖激酶Glk1,它是醛己糖特有的4,5.Hxk2是在高糖条件下生长的主要己糖激酶6.在高浓度葡萄糖的存在下,细胞质Hxk2的一部分被转移到细胞核,在那里它作为Mig1抑制因子复合物的一部分参与多个基因的抑制(“葡萄糖抑制”)。其中包括SUC2编码可抑制转化酶的基因7担任葡萄糖抑制的记者8,9.
Hxk2从细胞质到细胞核的转运受丝氨酸15的Hxk2磷酸化调控10,11,是保守的n端序列motif (K7- m16).该基序对于Hxk2在细胞质和细胞核之间的穿梭至关重要10.在低葡萄糖条件下,核Hxk2被认为在丝氨酸15处磷酸化11,12由Tda113,14并在其磷酸化状态下与Xpo1出口蛋白结合,出口到细胞质中15.结果,葡萄糖抑制得到缓解(“葡萄糖解抑制”)。当葡萄糖浓度升高时,胞质丝氨酸15磷酸化的Hxk2被Glc7/Reg1磷酸蛋白磷酸酶复合物去磷酸化10,16并通过α/β-导入蛋白(Kap60/Kap95)途径导入细胞核10.
和Hxk2一样,Hxk1也是一种磷蛋白12.当删除HXK2基因只是部分地影响葡萄糖的抑制,它被完全取消了额外的缺失HXK13.,17.Hxk1和Hxk2都表现出高度的相似性,n端有24个相同的氨基酸,包括丝氨酸1518.因此,Hxk1的丝氨酸15也是一个可能的磷酸化位点,而Hxk2激酶是一个可能的磷酸化候选位点。
Tda1已被证明是直接磷酸化Hxk2的激酶13,14.然而,根据体外实验的结果,也有报道称Snf1是直接的Hxk2激酶10.虽然当前研究的主要目标是全面分析Tda1在参与Hxk2磷酸化之外的作用,但它也旨在通过使用独立的方法确定或进一步支持先前确定的Tda1作为体内Hxk2磷酸化不可或缺的激酶。为此,选择了采用二维差分凝胶电泳(2D-DIGE)的系统蛋白质组学方法来比较野生型和相应的Δ的蛋白质组tda1高、低糖条件下均缺失突变体。同时,本研究的实验设计允许揭示响应不同葡萄糖浓度的蛋白质组学变化。
结果
BY4742野生型与Δtda1缺失突变株的蛋白质组学比较分析
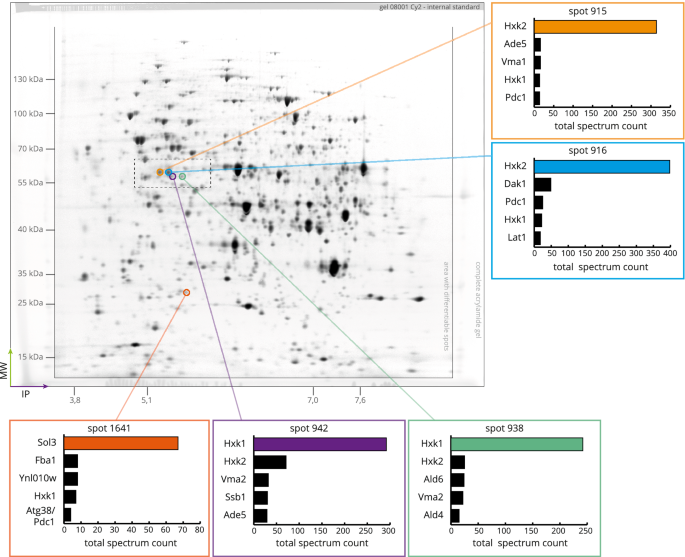
为了研究Tda1的功能及其在Hxk2丝氨酸15磷酸化中的作用,通过2D-DIGE进行了比较蛋白质组学分析,对比了野生型和Δtda1缺失突变体。使用生长培养基中不同的初始葡萄糖浓度(分别为0.1%或2% (w/v),低糖或高糖条件)来观察野生型和Δtda1缺失突变体的葡萄糖抑制或解抑制。一种蛋白质,其细胞内的数量因反应而改变TDA1基因缺失随后被称为aTDA1端依赖蛋白质。葡萄糖浓度依赖蛋白是指细胞内量随生长培养基中不同初始葡萄糖浓度(0.1%或2% (w/v))而变化的蛋白质。实验设计和完整的生长方案描述在实验程序部分。2D-DIGE实验允许在总共10个凝胶中分离、检测和完全匹配1953个蛋白质点,每个凝胶有3个荧光颜色通道(Melanie软件)。从所产生凝胶的荧光扫描中可以看到这样一个通道的例子,如图所示。1.8个点被确定为TDA1-依赖于Melanie软件的分析,并通过使用DeCyder软件作为第二种独立的数据分析方法进行验证。一个点被称为TDA1-依赖或葡萄糖浓度依赖,即斑点体积随测试条件至少发生因子2的变化(折叠变化≤0.5或≥2),且变化显著(q值≤5%)。光点体积是光点区域上的综合荧光强度。用方差分析(ANOVA)确定显著性(详见实验程序部分)。相互作用的效果,其中现货量的变化由于TDA1基因缺失在高糖或低糖条件下不同,以及葡萄糖无关的斑点体积变化,由于TDA1对基因缺失进行研究。斑点942是唯一一个显示出显著相互作用效应的斑点,但它也表现出葡萄糖无关的斑点体积变化TDA1基因缺失,其他七个也一样TDA1端依赖斑点。
的识别TDA1通过对比BY4742野生型和∆tda1使用2D-DIGE进行缺失突变蛋白组。用2D-DIGE分离50µg Cy2标记的内标物。荧光扫描的cy2通道显示在凝胶的完整尺寸中。为每一个TDA1样品从制备的2d -凝胶中切除,在盲法实验中,通过LC/ ESI-MS /MS进行分析。对每个点进行两次分析(不同的凝胶,不同的MS运行)的总频谱计数进行了汇总,排除了仅发现一次的蛋白质身份。对于5个点,图中描述了5种具有最高光谱计数的蛋白质。图中的彩色条表示决定斑点身份的蛋白质。虚线矩形表示为补充图而放大的区域。S1.请注意,所呈现的凝胶图像是为了说明目的而编辑的,并且只有包含分离蛋白的区域以优化的对比度呈现。有关原始图像数据,请参阅在线补充:DOI:https://doi.org/10.17605/OSF.IO/7AEQC.
为了鉴定形成已识别斑点的蛋白质,所有八种样本TDA1从制备的2d -凝胶中切除依赖点,通过LC/ ESI-MS /MS分析,鉴定为Hxk1, Hxk2, 6-磷酸葡萄糖内酯酶(Sol3), v型质子atp酶(Vma2)的B亚基和dnaj样蛋白1 (Djp1)。术语点同一性是指蛋白质的质谱分析结果TDA1-依赖或葡萄糖浓度依赖的斑点,很可能代表aTDA1-依赖蛋白或葡萄糖浓度依赖蛋白数字1显示了明确识别的点的位置,对于每个点,特征是样品中含有的五种蛋白质达到了最高的光谱计数。表格1总结数据TDA1依赖的斑点和蛋白质。斑点913、944和945的斑点身份不能明确地缩小到一个蛋白质。斑点913和944显示出单独的最大值,被确定为单独的斑点,但它们非常接近斑点915,被确定为Hxk2。斑点945显示出Vma2和Djp1的高光谱计数。补充图。S1为tda1依赖点的位置,在点的身份上存在模糊性。现场识别的完整数据集可在DOI:https://doi.org/10.17605/OSF.IO/7AEQC.
己糖激酶Hxk1和Hxk2分别在多个位点被发现。不同的等电点,尽管这些点的分子量相似,表明存在翻译后修饰,其中磷酸化似乎很有可能。在下面,除非另有说明,己糖激酶磷酸化或未磷酸化是指丝氨酸15的磷酸化。
在TDA1缺失后,915位点的体积和磷酸化Hxk2的数量急剧减少,而916未磷酸化Hxk2的体积和数量则增加。类似地,对Hxk1也有同样的观察。磷酸化Hxk1的斑点体积减少,而未磷酸化Hxk1的斑点体积增加。当Sol3的用量增加一倍以上时,含有Vma2和Djp1的斑点体积减小。对比褶皱变化,p值和斑点体积的视觉比较TDA1-依赖点和所有其他观测点均可在补充图中得到。S2.预测和基于实验数据插值的各点的等电点(IP)和分子量(MW)可在DOI:https://doi.org/10.17605/OSF.IO/7AEQC.
Hxk1和Hxk2丝氨酸15磷酸化状态的测定
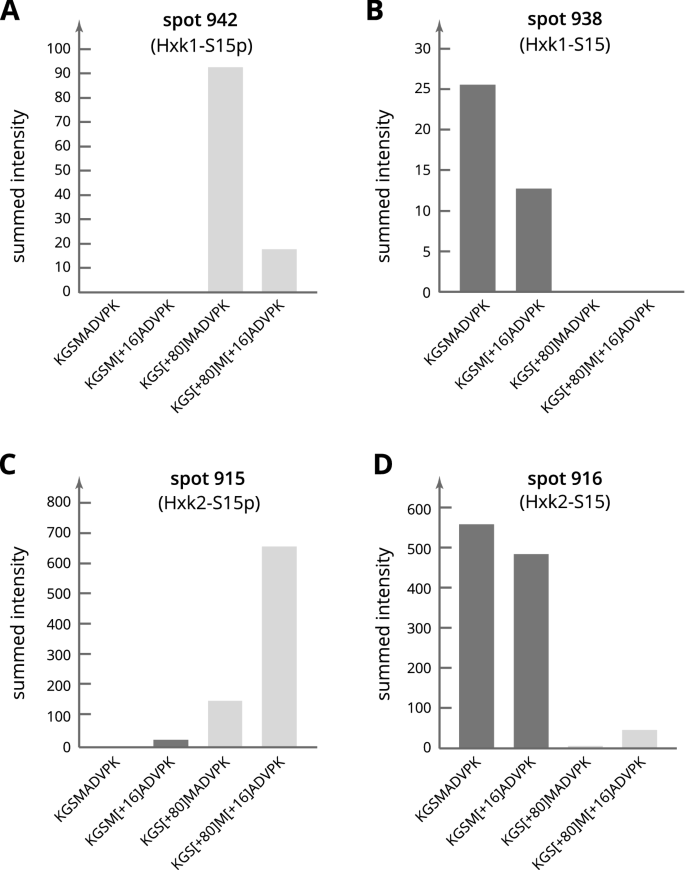
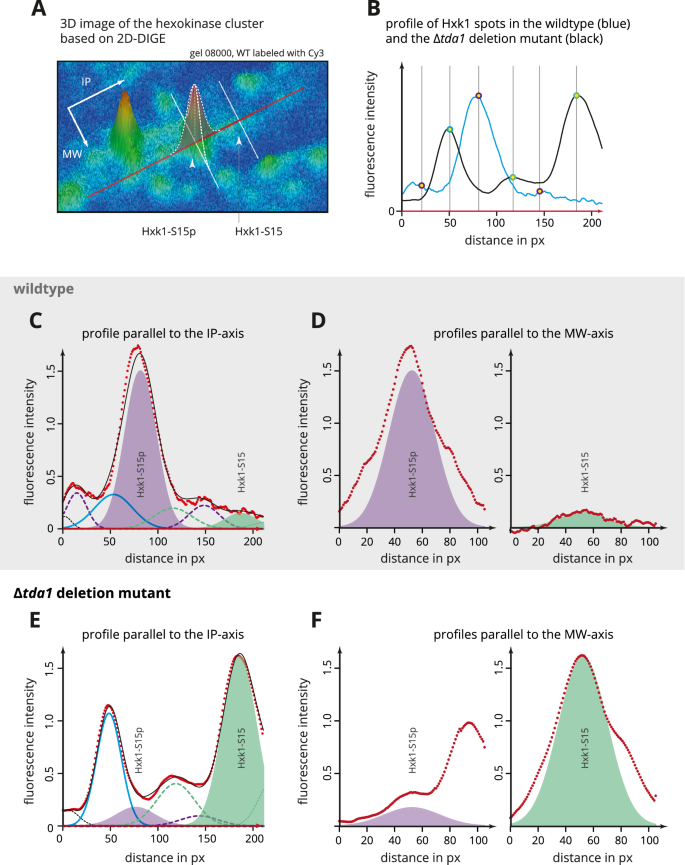
点938和942 (Hxk1)和点915和916 (Hxk2)的发散IP值立即表明存在翻译后修饰(见图)。1对于现货位置)。特别是在Hxk2的情况下,在葡萄糖限制期间观察到丝氨酸15磷酸化11,12这似乎是一种可能。考虑到分别由Hxk1和Hxk2组成的两对点的相似模式,以及两种己糖激酶的n端24氨基酸相同,我们假设丝氨酸15磷酸化也可能发生在Hxk1上。为了验证这些假设,n端胰蛋白酶己糖激酶肽K13GSMADVPK21通过使用平行反应监测(PRM)方法的靶向蛋白质组学分析进行了专门检查(图。2).除了寻找丝氨酸的磷酸化(S[+ 80]),还考虑了蛋氨酸(M[+ 16])可能的氧化,这是一种在电泳凝胶中存储的蛋白质中发现的常见人工修饰。正如预期的那样,位点916几乎完全含有未磷酸化的多肽,而位点915主要含有携带磷酸丝氨酸15的多肽。在942位点,只有磷酸化肽存在。在938位点,该肽的浓度很低,仅检测到未磷酸化的肽,而未检测到磷酸化的肽。有关MS/MS离子列表,请参阅在线补充:DOI:https://doi.org/10.17605/OSF.IO/7AEQC.PRM的全部数据在线提供在PRoteomics identification (PRIDE)数据库中,项目id: PXD029824。
己糖激酶同工酶Hxk1和Hxk2的定量分析
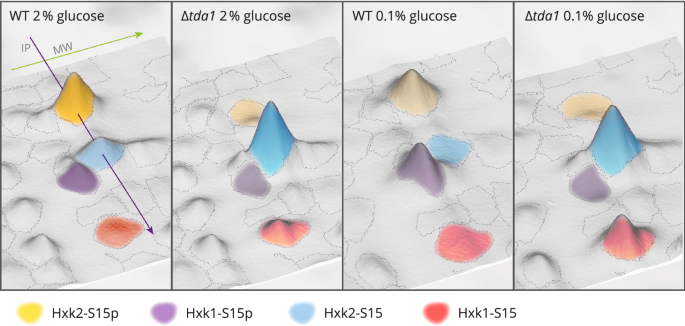
区分这两种己糖激酶及其磷酸化状态的能力,首次提供了通过测量各自点的体积,以差异化的方式量化这两种同工酶不同分子种类的可能性。数字3.提供了对2D-DIGE点景观和代表Hxk1和Hxk2数量的体积的直观理解.
在优化了光斑分离和扫描参数后,首先采用高度自动化的荧光测量作为定量手段。假设四个主要己糖激酶点的荧光代表了野生型和Δ中两种己糖激酶的总量tda1高、低糖条件下缺失突变体。令人惊讶的是,如补充图所示。S3时,己糖激酶的总量在很大程度上与生长条件无关。假设总量正态分布,在初始葡萄糖浓度为0.1%或2% (v/w)下生长的野生型细胞的己糖激酶总量变化超过30%的原假设可以在95%的置信水平上被拒绝。
为了最大限度地减少由于背景荧光或差点边界检测而导致测量不准确的可能性,建立了一种简单的基于模型的定量方法(详见实验程序部分)。除在Melanie软件中分析得到的现场体积进行初步定量外,还将该方法应用于己糖激酶同工酶Hxk1和Hxk2的定量。补充图。S4显示了基于Melanie软件分析的两种己糖激酶的相对数量。数字8说明了基于模型量化的原理,以一种具有代表性的凝胶上的Hxk1斑点为例,最后,应用基于模型量化确定的Hxk1和Hxk2的相对量如图所示。4.
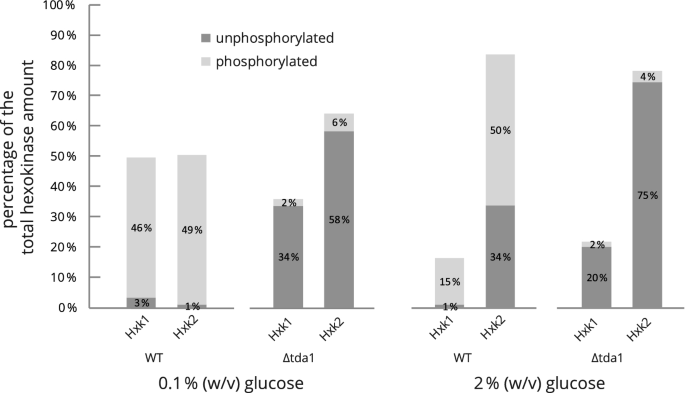
己糖激酶同工酶Hxk1和Hxk2的相对定量。基于2D-DIGE荧光数据,测量了野生型和Δ型中己糖激酶的相对数量tda1在不同初始葡萄糖浓度(0.1%或2% (w/v))下细胞生长后,通过基于模型的定量获得缺失突变蛋白组(详见实验程序部分)。对含有己糖激酶的主要斑点(915、916、938、942)的2D-DIGE荧光扫描计算得到的斑点体积通过计算几何平均值平均,并表示为四个斑点体积总和的百分比。从总己糖激酶量100%的偏差是由舍入显示值到最近的整数引起的。见图。3.对于现场景观的印象作为量化的依据。
而所有四个主要己糖激酶点的总和体积没有明显变化(补充图。S3)时,两种己糖激酶的分布随葡萄糖浓度的变化而发生显著变化。在低葡萄糖条件下生长的野生型中,Hxk1和Hxk2的含量大致相同;然而,在高糖条件下,Hxk2占主导地位,约占84%。有趣的是,在野生型中,绝大多数Hxk1在高糖和低糖条件下都被磷酸化。同样,在低糖条件下,未磷酸化的Hxk2几乎不存在,但在高糖条件下,约40%的酶未磷酸化。在TDA1在缺失菌株中,两种己糖激酶同工酶丝氨酸15位点的磷酸化几乎完全丧失,与生长培养基中的葡萄糖浓度无关,表明TDA1对Hxk1和Hxk2的磷酸化都是必要的。
蛋白质受葡萄糖利用率的调节
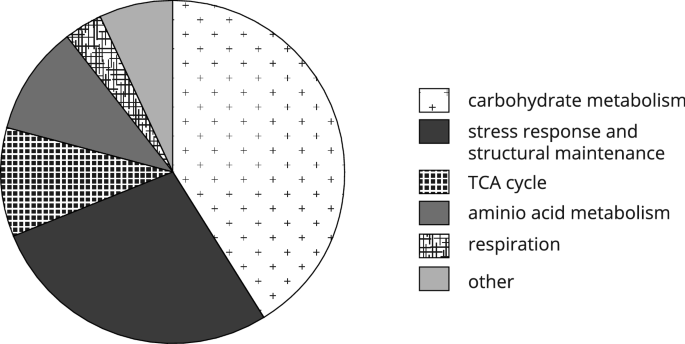
选择2D-DIGE实验的实验设置的主要目的是揭示可能的相互作用TDA1功能和葡萄糖代谢。然而,这种相互作用仅在含有Hxk1-S15p的942位点被检测到。然而,所选择的设置也允许检测几种仅归因于不同葡萄糖浓度的蛋白质组学变化。LC/ ESI-MS /MS共鉴定出36个糖浓度依赖点,28个不同的糖浓度依赖蛋白。已确定地点的完整清单载于补充表S1.2D-DIGE凝胶上的光斑位置见补充图。S5.现场识别的完整数据集可在DOI:https://doi.org/10.17605/OSF.IO/7AEQC对28种检测到的葡萄糖浓度依赖蛋白进行了分类,以提供受影响细胞功能的总体概述。结果如图1所示。5表明约40%的检测到的葡萄糖浓度依赖蛋白参与碳水化合物代谢,而约四分之一的检测到的蛋白质已知在应激反应和结构维护中履行功能。
转化酶活性的生长分析和测定
Hxk2蛋白n端结构域的研究,该结构域包含一个核定位序列10包括丝氨酸15磷酸化位点,导致了关于该结构域在葡萄糖信号传导中的作用的不同结果17,19,20.,21,22,23.这一争议也提出了Hxk2丝氨酸15磷酸化是否参与葡萄糖信号传导的问题。如果葡萄糖信号的调节依赖于己糖激酶磷酸化,磷酸化的消除通过TDA1缺失可能会损害这种信号。信号信号受损的一个可能的迹象,因此,对环境的适应效率可能较低,可能是细胞生长受损。然而,野生型与Δ型的生长无显著差异tda1在高糖条件下可以检测到缺失突变体(补充图。S6).在低血糖情况下,仅相差小于25分钟(p≈0.0032),不到达到OD的总生长时间中值(≈21.5 h)的2%6001,被观察到。为了证明相等性,人们可以详细说明95%置信区间(Wilcoxon匹配对符号秩检验;GraphPad Prism 7)的生长时间,直到达到OD600在高糖和低糖条件下,Of 1显示了生长差异0的偏差,最小低于1小时。这些事实表明,在本研究中使用的酵母菌菌株和测试的条件下,丝氨酸15磷酸化可能对葡萄糖信号并不特别重要。
在未观察到相关的葡萄糖生长差异后Δtda1缺失突变体,近距离观察生长对蔗糖和转化酶活性。尽管Hxk2中的丝氨酸15被丙氨酸取代,但葡萄糖仍被完整地抑制,此前已有报道(15,19)。在本研究中,用表达天然己糖激酶酶的细胞研究了Hxk1和Hxk2丝氨酸15磷酸化的缺失,也研究了葡萄糖解抑制。如果Hxk2的磷酸化是分解Mig1抑制因子复合物的先决条件,葡萄糖抑制所必需的,如前所假设的那样24,人们会认为Δ的解压抑功能受损tda1导致蔗糖生长减少的缺失突变体。有趣的是,在Δ中,蔗糖的增长并没有显示出任何葡萄糖抑制受损tda1缺失突变体(补充图;S7).野生型和Δ的转化酶活性tda1在YPD培养基中培养4小时的缺失突变细胞在2% (w/v)葡萄糖下同样受到抑制,在0.1% (w/v)葡萄糖下表现出相同水平的活性(补充图)。S8).
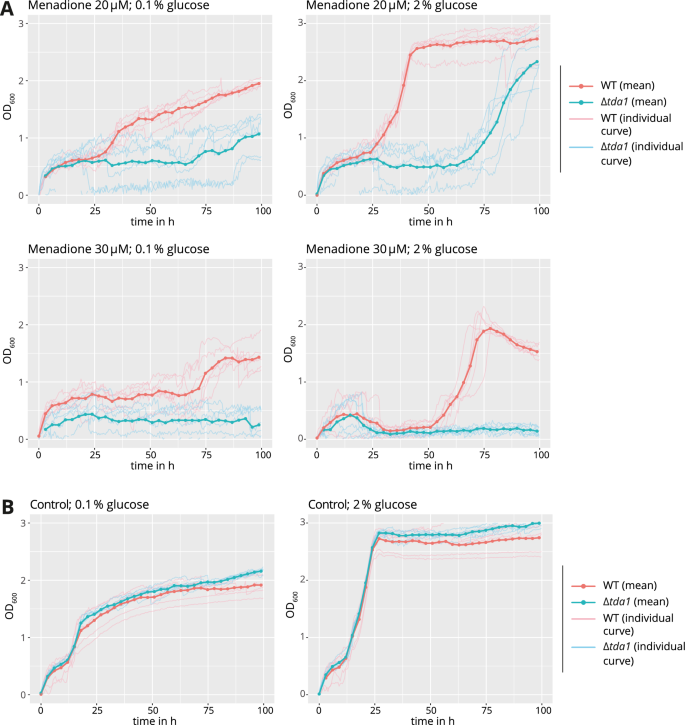
以探索其他可能的生长条件下的生理功能TDA1从表型上看,在96孔板中进行了生长分析,解决了Δtda1在氧化应激增加的条件下,缺失突变体的生长将受到损害,正如先前对H2O2在高通量实验中25.甲萘醌,已知会产生氧化应激26在不同浓度下进行了测试。以浓度依赖的方式,甲萘醌导致延迟期延长(图。6A,B),据此Δtda1突变型比野生型受影响更严重。这些数据提示Tda1参与氧化应激反应。
讨论
对TDA1缺失作出反应的蛋白质调控
蛋白质磷酸化和去磷酸化是共价修饰的一种普遍机制,它允许细胞调节其蛋白质的结构和功能特性、亚细胞定位和复合物的形成。大约50%的代谢蛋白酿酒酵母是否被磷酸化27,28,29,包括己糖激酶Hxk1和Hxk212.在目前的探索性研究中,蛋白质组学和功能的后果TDA1缺乏酿酒酵母研究的目的也是为了独立验证Tda1对Hxk2丝氨酸15磷酸化的体内意义。的磷酸化酿酒酵母在丝氨酸15位点的Hxk2有四个已知的主要后果:(i)单体-同型二聚体平衡向单体物种倾斜30., (ii) ATP增强底物亲和力和抑制作用31(iii)酶活性较高31,以及(iv)磷酸酶从细胞核转位到细胞质10.先前的研究表明,蛋白激酶Tda1可能是Hxk2磷酸化的原因13,14.
来自野生型和各自的蛋白质Δtda1在高糖或低糖条件下培养的缺失突变体分别诱导葡萄糖抑制和解抑制,进行2D-DIGE。八个被确认的TDA1依赖于荧光的斑点与其他所有斑点的区别在于丰度变化强烈,变化显著性高,而在动态范围边缘没有一个斑点表现出极端的荧光强度(补充图)。S2).通过质谱分析,斑点鉴定为己糖激酶2和己糖激酶1、v型质子atp酶(Vma2)、dnaj样蛋白1 (Djp1)和6-磷酸葡萄糖内酯酶(Sol3)的推测蛋白形式(表2)1).
在Hxk1和Hxk2之外鉴定的蛋白质中,Vma2代表了液泡atp酶外周V1复合体的非催化亚基,在对酵母缺失文库的筛选中显示出对高o有保护作用2损害32.Charoenbhakdi等人的一项研究也表明v - atp酶在氧化应激反应中的作用。33在调节细胞壁应激反应和预防内源性氧化应激方面发挥作用。Djp1是j蛋白/Hsp40共同伴侣家族中一个丰富但特征不明确的成员,参与靶向线粒体前体蛋白以及过氧化物酶体蛋白的导入34,35.除了关于Vma2和Djp1的详细功能的其余问题,还必须考虑到944点(Vma2)和945点(Vma2和Djp1)靠近相邻的己糖激酶点。因此,口译需要非常谨慎。探测到的丰度变化可能部分归因于这些邻近的斑点。例如,干扰可能是由未检测到的翻译后修饰引起的,导致Hxk1或Hxk2的一部分改变2d -凝胶上的位置。位点1641中的6-磷酸葡萄糖内酯酶Sol3被明确鉴定,并催化磷酸戊糖途径的第二步36,在氧化阶段,生成d -核酮糖5-磷酸和NADPH。除其他功能外,NADPH是对抗氧化应激所必需的。
只有一个位点被鉴定为葡萄糖浓度和基因型的互作效应。考虑图中所示的数据。4对942位点与磷酸化Hxk1的相互作用效应进行了评估,其相互作用效应可以解释为:对于野生型,随着整体Hxk1的降低,葡萄糖利用率的增加导致磷酸化Hxk1的减少,并且大多数酶以磷酸化形式存在。然而,TDA1的缺失消除了Hxk1的磷酸化,因此不能再观察到上述磷酸化的Hxk1的减少。因此,TDA1缺失会影响由于葡萄糖可用性而导致的丰度变化。
低数量的tda1依赖蛋白
的数量TDA1本研究中鉴定出的依赖于-的蛋白含量非常低,这可能反映了所选择的2D-DIGE方法的局限性。例如,ip值低于3和高于10的蛋白质,如组蛋白(包括组蛋白H3,之前已被证明可被Tda1磷酸化37),在选定的等电聚焦设置下无法检测到。Δ中Tda1的缺失tda1通过2D-DIGE也没有观察到突变,可能是由于每个细胞的拷贝数自然较低,或者由翻译后修饰引起的分裂成多个点,每个点都低于检测限。的数量少的另一个原因TDA1-依赖蛋白可以作为折叠变化和显著性的任意选择的临界值。然而,与其反对后一种解释,不如看看补充图中的火山图,这些值的选择似乎非常合适。S2.此外,最近的一项调查TDA1依赖蛋白通过采用SILAC方法(S. Seiferheld, Technische Universität Dresden,未发表数据)没有发现额外的蛋白质的丰度改变。尽管SILAC不能很容易地检测到2D-DIGE可以检测到广泛的翻译后修饰,而且高度同源的蛋白质异构体如Hxk1和Hxk2的区分可信度较低,但该方法通常更敏感。因此,Tda1可能具有非常特殊的功能,在目前蛋白质组学研究中所使用的条件下,可能与生存相关,因此不会在蛋白质水平上引起广泛的全球细胞变化。
蛋白质受葡萄糖利用率的调节
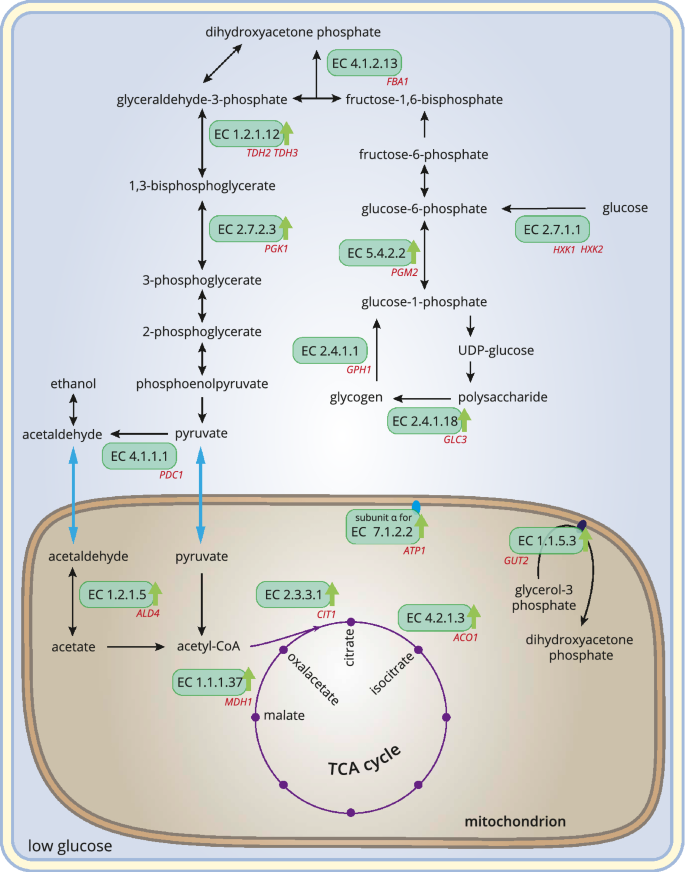
2D-DIGE的实验设置允许研究蛋白质组学变化,这些变化可归因于生长介质中不同的葡萄糖可用性。28种蛋白质的丰度取决于高糖或低糖条件,而大多数蛋白质的上调是对低糖条件下生长的反应(补充表S1).不足为奇的是,许多葡萄糖浓度依赖的蛋白质在碳水化合物代谢中发挥作用,参与TCA循环和呼吸的蛋白质数量增加。由于2D-DIGE无法提供已识别蛋白质功能的直接信息,因此衍生生理过程的每个模型在某种程度上都必须保持推测性和主观性。然而在Fig。7试图提供一个图形概述,确定葡萄糖浓度依赖蛋白参与碳水化合物代谢,TCA循环和呼吸。
TDA1在Hxk1和Hxk2丝氨酸15磷酸化中的作用
而现有数据证明Tda1负责丝氨酸15磷酸化Hxk213,14在美国,这并非没有争议10,17,38,39因为蛋白激酶Snf1也被报道实现了这一功能10Hxk2的核质易位在Δ中未发生改变tda1缺失突变体10.Tda1在Hxk1磷酸化中的作用尚未被研究。而肽K的磷酸化13GSMADVPK21在高糖条件下生长的酵母细胞的tryptryptryptryptryptryptryptryptryptryptryppeptide和phosphop肽富集蛋白提取物中,先前已确定酶的缺失严重影响TDA140,由于各自胰蛋白酶肽的氨基酸序列是相同的,因此不可能将肽明确地分配到一个或两个己糖激酶上。在目前的研究中,位置TDA12d凝胶上的己糖激酶依赖点允许在翻译后修饰的质谱分析之前区分Hxk1和Hxk2。n端己糖激酶肽(K13- k21)证实丝氨酸15磷酸化Hxk1和Hxk2(图。2).关于Δtda1在缺失突变体中,磷酸化己糖激酶斑点的荧光信号在背景噪声范围内(图2)。3.),一方面强化了这一点TDA1是Hxk2丝氨酸15磷酸化所必需的,另一方面提供了证据TDA1也是Hxk1丝氨酸15磷酸化所必需的。
己糖激酶同工酶Hxk1和Hxk2的定量分析
研究了两种己糖激酶同工酶在磷酸化和未磷酸化形式下的相对数量。然而,挑战是相邻斑点对凝胶的干扰,荧光图像中的背景噪声程度和自动斑点边界检测的缺陷。这些问题是通过优化点分离和建立基于模型的定量方法,描述在实验程序部分。尽管基于模型的方法在一定程度上消除了常见的全自动量化软件的不准确性,但观察者的任意判断仍有引入偏差的风险。然而,在目前的工作中,使用Melanie软件进行自动化量化的结果总体上与可能更准确的基于模型的量化所获得的结果一致。在补充评论中更详细地讨论了基于模型的量化。
如图所示。3.而且4,TDA1缺失消除了Hxk1和Hxk2丝氨酸15位点的磷酸化,仅测量到磷酸化形式的极少量相对量,很可能是由于剩余的点重叠和背景噪声。一个温和的TDA1在低糖条件下,Hxk1的相对含量明显下降。Oh等人的最新数据。37确定组蛋白H3是Tda1激酶的进一步靶点。Tda1磷酸化组蛋白H3的苏氨酸1137,苏氨酸11磷酸化的组蛋白H3富集于HXK1营养匮乏的染色体位点,可能增加其转录37,41.这可能解释了Hxk1含量的减少TDA1删除。
此外,本研究表明,在高糖条件下生长的野生型中,Hxk2是主要的己糖激酶,而在低糖条件下,Hxk1和Hxk2的存在量相似。这些结果在很大程度上与葡萄糖限制开始后不到60分钟内的mRNA水平研究的调查一致,显示Hxk1 mRNA水平急剧增加,而Hxk2 mRNA水平急剧下降6.在本研究中,与mRNA数据相比,在蛋白质水平上观察到的变化相对温和。因此,我们可以假设早先报道的葡萄糖剥夺的短期反应6就像本研究中在低葡萄糖条件下观察到的那样,Hxk1和Hxk2的总量保持在接近恒定的水平,并且由两种己糖激酶组成。据报道,葡萄糖激酶mRNA水平在葡萄糖剥夺后上调6.在本研究中没有发现葡萄糖激酶丰度随葡萄糖浓度变化的证据,这可能是由于生长时间相当长,通过2D-DIGE检测不到蛋白质,或者蛋白质和mRNA水平可能不一定相关42,43.
关于己糖激酶磷酸化,在高糖条件下生长的野生型细胞显示只有约60%的Hxk2处于磷酸化状态,而在低糖条件下高达98%的Hxk2被磷酸化。这与之前的发现一致13.在体外,磷酸化导致Hxk2的单体化,进而导致底物亲和力的增加和更高的酶活性10,31.因此,如果Hxk2磷酸化在低糖条件下提高了葡萄糖利用效率,这似乎是合理的。然而,这样的假设没有考虑到从Hxk2向酶活性低得多的Hxk1的整体转变44在葡萄糖限制下。这有可能,在一个恒定的整体葡萄糖磷酸化活性,如所述酿酒carlsbergensis45,观察到的Hxk1和Hxk2数量和磷酸化的变化促进了产生的葡萄糖-6-磷酸的不同利用。在低糖条件下,葡萄糖-6-磷酸可能更少地指向糖酵解,而更多地指向其他代谢途径,如磷酸戊糖途径,从而产生更多的NADPH。这种机制可能有助于保护细胞免受呼吸增加时的氧化应激,并与Tda1在氧化应激反应中的功能一致,如下所述。强调在这方面进一步研究的重要性,Hxk1和Hxk2数量和磷酸化影响葡萄糖代谢通量的假设可能提供了一个目的论上的解释酿酒酵母两种己糖激酶具有不同的磷酸化程度,不同的活性以及可能与其他蛋白质不同的相互作用。
Tda1在葡萄糖抑制/解抑制中的作用
先前的数据表明,葡萄糖抑制依赖于磷酸酶Glc7及其调节因子Reg146, Hxk2是这两个因子的靶点10,16.Hxk2或Hxk1是葡萄糖抑制所必需的3.,17,47,并且在高糖利用率下的生长与己糖激酶磷酸化降低之间的相关性已被描述12.由于Glc7逆转Hxk2丝氨酸15磷酸化,人们可能期望Tda1作为拮抗激酶参与葡萄糖解抑制。蛋白激酶Snf1是葡萄糖解抑制所必需的48,最近,Oh等人。37据报道,Tda1活性通过snf1依赖的丝氨酸483和苏氨酸484磷酸化上调。Hxk2在Δ磷酸化snf1缺失突变体显著减少13,和Δsnf1缺失突变体表现出明显的呼吸生长受损49.
评估体能可能的变化TDA1在相同的蛋白质组学比较生长条件下,通过2D-DIGE监测细胞生长(补充图。S6).而TDA1Hxk1和Hxk2在丝氨酸15处的磷酸化被取消,几乎没有观察到任何生长差异。这一有趣的发现表明,无论是Tda1还是Hxk1或Hxk2丝氨酸15磷酸化都可能不是葡萄糖解抑制所必需的。这一事实也得到了支持,即蔗糖上的生长(补充图。S7)以及野生型和Δ型的转化酶活性tda1缺失突变体(补充图;S8)差异显著,通过2D-DIGE进行的蛋白质组学比较几乎没有产生任何相互作用TDA1基因缺失会影响葡萄糖可用性改变的蛋白质组学结果。总之,虽然Glc7和Snf1都影响Hxk2的丝氨酸15磷酸化,但这似乎不是促进葡萄糖抑制/解抑制的机制。一个模型似乎是可以想象的,低量的己糖激酶在细胞核中组成性地存在,允许它们参与葡萄糖抑制。大量的Hxk2往返于细胞核,这与酶的丝氨酸15磷酸化状态有关10相反,这可能是一种不同机制的表现,其功能也受葡萄糖可用性的调节。
Tda1在抗氧化应激中的可能作用
生长试验(图;6)的研究结果表明,Tda1的功能可能与氧化应激的拮抗机制有关。当甲萘醌浓度高到足以损害野生型Δtda1缺失突变体从滞后期向日志期过渡缓慢。报道的蛋白质组的后果TDA1也与Tda1在氧化应激防御中的作用相一致。
的TDA1在本研究中,己糖激酶和6-磷酸葡萄糖内酯酶Sol3都能通过磷酸戊糖途径利用葡萄糖,磷酸戊糖途径是NADPH再生的主要途径50作为键减少等效。此前已有研究证实Hxk2及其丝氨酸15磷酸化参与控制细胞周期、线粒体功能、抗氧化应激和时间寿命51.在Phosphopep数据库中27,40的反应中,具有最大折叠变化的磷酸肽TDA1缺失属于Gtt3和Hxk1或Hxk2。Gtt3在本研究中未被发现,据报道它很可能与谷胱甘肽代谢有关52.另一方面,在Phosphopep数据库中,Sol3并不是Tda1的已知靶标27,40.后者的发现以及仅在2d凝胶上的一个点上识别出Sol3与Sol3作为Tda1底物的作用不一致。此外,观测到的Sol3数量增加了2.5倍TDA1缺失与抗氧化应激能力下降并不一致,因为磷酸戊糖途径酶丰度的增加可能会通过增加NADPH的可用性来增强抗氧化应激能力。NADPH是几种对抗氧化应激机制的关键底物53,并且已经证明酿酒酵母能够通过将葡萄糖重定向到磷酸戊糖途径来增加NADPH的产生54.一种机制进一步下游的己糖激酶和组蛋白H3磷酸化由Tda1,可能补偿缺陷氧化应激反应Δtda1缺失突变体,似乎是观察到的Sol3丰度增加的最可能的解释。
综上所述,Tda1的一个重要功能可能是整合对抗氧化应激需求增加的信号,如葡萄糖缺乏,并且可能通过重定向葡萄糖代谢通量(由于已糖激酶磷酸化以及Hxk1和Hxk2平衡的转移)来确保NADPH的充分可用性。本研究提供了Hxk1和Hxk2相对数量的新数据,以及这两种酶的丰度和磷酸化变化,取决于在高糖或低糖条件下的生长。它提供了一种简单易行的斑点定量新方法,证实了Tda1在Hxk2丝氨酸15磷酸化过程中的不可缺少性,并确定了Hxk1作为蛋白激酶Tda1的进一步可能靶点。Tda1在葡萄糖抑制/解抑制中的关键参与被证明是不可能的,而在氧化应激反应领域的功能的各种线索被发现。需要进一步的研究来调查本研究中新产生的假设,以了解氧化应激反应如何与Tda1和己糖激酶磷酸化作为其主要功能之一的机制联系,为什么酿酒酵母真正提供了两个己糖激酶,为什么他们TDA1-依赖的磷酸化反应因葡萄糖的可用性而异。
实验程序
2D-DIGE实验设计及原理
为了提供一个系统的比较Δtda1野生型酵母蛋白组,目前研究采用2D-DIGE方法。作为统计规划和实验设计的基础,参考文献中的2D-DIGE数据集。55,该研究使用了与本研究中应用的方法类似的实验方法,但进行了调查乳酸菌(Kluyveromyces lactis),进行分析,以获得可预期的技术和生物学变异的估计。技术变异性可以通过2D-DIGE方法非常有效地降低,与生物变异性相比显得微不足道。评价蛋白质组的变化TDA1分别在0.1%和2% (w/v)葡萄糖浓度下进行删除,采用方差分析进行统计分析。然而,对FDR校正的成对t检验进行了保守的计划,该方法已在Ref中使用。55.已知的遗传和物理相互作用有141种TDA1根据生物网格数据库562018年1月。与此类相互作用潜在靶向蛋白的5159个开放阅读框(Saccharomyces Genome Database)相比,前者为2.73%。因此,我们假设Δ中97.27%的蛋白质不受影响tda1删除突变。用R的大小估计样本量。fdr,规划数据的第90个百分位的标准偏差(参考文献中的2D-DIGE数据集)。55),并为k . lactis考虑在0.1%或2% (w/v)葡萄糖条件下生长的JA6野生型菌株,在至少5个2D-DIGE凝胶中所有斑点都匹配。我们选择了5%的错误发现率和80%的期望幂。在生物学意义上,斑点体积的因子2变化被认为是相关的。通过组合四种细胞培养物的蛋白质提取物,并分析每种条件下的5个池(野生型和突变型,每个池的初始葡萄糖浓度为0.1%或2% (w/v)),可以达到每次比较所需的估计样本量约为20个细胞培养物。每种条件的20个培养物按时间排序,分为4组。4个组中的每一个培养物被随机分配到一个池中。对于四种不同的条件,培养是并行生长的,每种条件都对池使用相同的分配。对野生型和Δtda1缺失突变蛋白组池被分离在同一个2d -凝胶上。在补充图。S9,提供了池化过程的图形概述。对于凝胶间的比较,按照2D- dige实验的习惯,使用内部标准(详细信息,参见2D差异凝胶电泳小节)。
菌株
S288C相关酿酒酵母菌株为野生型(WT) BY4742 [MATα,他的3Δ1,低浓缩铀2Δ0,lys2Δ0,ura3Δ0]和Δtda1缺失突变体(Δ)tda1) BY4742Δtda1(垫α,his3Δ1,leu2Δ0,lys2Δ0,ura3Δ0,tda1::KanMX4变体。该缺失突变体是通过测序开始和结束的连接区域来验证的TDA1迷人的录音带。
2D-DIGE细胞培养
不同菌株的细胞生长在含有0.69% (w/v)酵母氮基(YNB)的培养基D中,不含氨基酸(补充尿嘧啶20 mg/l)和氨基酸(l -精氨酸20 mg/l、l -组氨酸30 mg/l、l -异亮氨酸60 mg/l、l -亮氨酸60 mg/l、l -赖氨酸40 mg/l、l -蛋氨酸20 mg/l、l -苯丙氨酸60 mg/l、l -苏氨酸50 mg/l、l -色氨酸40 mg/l)。液体培养在200 rpm和30°C下搅拌。
首先,将细胞散布在含有YPD培养基(1% (w/v)酵母提取物,2% (w/v)蛋白胨,2% (w/v)葡萄糖)含2.5% (w/v)琼脂的平板上,在30°C下培养72小时。随后将细胞在5 ml的起始外径的预培养物中培养600在2% (w/v)葡萄糖(预培养1)下进行15.5小时,然后进行10ml,开始OD6000.06,在2% (w/v)葡萄糖下培养8小时(预培养2)。第二次预培养进行离心(3500 g, 5分钟,30°C),用添加0.1%或2% (w/v)葡萄糖的D培养基洗涤,与主培养物相匹配。主培养开始于OD600在100毫升中D(500毫升带钢盖的烧瓶)中生长。细胞在OD处采集600在1到1.5之间离心(3500克,5分钟,2°C),用水清洗两次,冷冻并保存在−80°C。为了防止细胞进入静止生长,从20% (w/v)的原液中添加50%的起始葡萄糖量到以0.1% (w/v)的初始葡萄糖浓度生长的主培养物中600达到约0.3和0.6,从而补偿了葡萄糖的消耗。
2D差凝胶电泳
将冷冻酵母细胞悬浮在每克湿细胞群4ml 2D-DIGE裂解缓冲液(Tris/HCl 30 mM,尿素7 M,硫脲2 M, 4% (w/v) CHAPS, DTT 10 mM, 1 ×蛋白酶抑制剂混合物,pH 9.1)中,并使用法国®压力细胞压机(4次,20.000 psi)进行破坏。如文献所述,进行进一步的治疗。55.一个用于2D-DIGE图像匹配和标准化斑点体积计算的内部标准,包括本研究中所有分析的蛋白质组以及Δ的蛋白质组的等量蛋白质snf1从所使用的野生型中衍生的缺失突变体(菌株BY4742Δsnf1,由S. Seiferheld, Technische Universität Dresden进行的单独研究分析)。所有三株(WT, Δtda1和Δsnf1缺失突变体)分别在高糖和低糖条件下分别在20个培养物中培养,因此120个单独培养物的蛋白质组对内部标准有贡献。cydye荧光标记,样品制备等电聚焦和IPG带的复水化,如文献所述。55.用氰化物染料Cy2标记内标。为避免标记偏倚,分别用Cy3和Cy5标记部分野生型和部分突变型蛋白质组。选择用于非线性IPG条带的固定化pH梯度(IPG)缓冲液pH 3-10来匹配IPG条带(24 cm, pH 3-10,非线性)。等电聚焦(IEF)使用etan IPGphor 3设备(GE Healthcare, Munich, Germany)在20°C下进行。执行以下程序:线性梯度从0到150 V / 3 h,线性梯度到300 V / 3 h,线性梯度到1000 V / 3 h,线性梯度到10,000 V / 3 h, 10,000 V恒定为95,000 Vh, 500 V恒定直到进一步使用。电流限制在50 μA /条。SDS-PAGE前进行了两个平衡步骤。每一步在平衡缓冲液(Tris/HCl 50 mM,尿素6 M, 20% (v/v)甘油,2% (w/v) SDS, pH 8.8)中进行30分钟,第一步补充130 mM DTT,第二步补充135 mM碘乙酰胺。SDS-PAGE采用1 × 200 × 255 mm尺寸的梯度凝胶,丙烯酰胺指数范围为9 - 13.5%。 The gels were cast after setting the constant volume in the mixing chamber to 80 ml (initial concentration of 13.5% acrylamide) and prefilling the Ettan DALTsix Gel Caster (GE Healthcare, Munich, Germany) with 140 ml gel solution (13.5% acrylamide). The reservoir chamber contained the gel solution with 8.7% acrylamide. Electrophoresis was executed with an Electrophoresis Power Supply EPS 601 (GE Healthcare, Munich, Germany) at 25 °C with 80 V, 1 W of power per gel and an amperage limit of 10 mA per gel for the first hour and 500 V, 13 W of power per gel and an amperage limit of 40 mA per gel until completion.
图像采集和数据分析
使用Typhoon 9410可变模式成像仪(GE Healthcare, Munich, Germany)扫描二维凝胶,图像分辨率设置为50 μm。Cy2的激发波长为488 nm/520 nm, Cy3的激发波长为532 nm/580 nm, Cy5的激发波长为633 nm/670 nm。通过应用Melanie 2-D凝胶分析软件版本9.1.1 (Genebio,日内瓦,瑞士),简称Melanie软件,和DeCyder 2-D差分分析软件版本7.0 (GE Healthcare,慕尼黑,德国),简称DeCyder软件,对获取的图像进行分析,以便用不同的生物信息学方法验证结果。使用Melanie软件进行的分析需要手动校准凝胶图像,而斑点检测是完全自动化的,不需要手动更改以避免偏差。利用Melanie软件提供的比值归一化函数进行归一化。选择归一化设置,根据强度进行斑点滤波,剔除荧光强度低于最大荧光强度50%的斑点,并计算归一化因子作为体积比(归一化过程中包含的每个斑点的图像体积除以归一化参考图像中的体积)的中位数。将内部标准图像纳入归一化过程。关于规范化的更多细节可以在软件文档中找到。在R软件中进行基于对数变换现货体积的统计分析57.DeCyder中的分析使用生物变异分析模块进行人工修改,然后导出数据并在R中进行分析,类似于对Melanie软件导出的数据进行分析。采用方差分析(ANOVA)检验统计学意义。试验采用2 × 2析因设计,两因素区分基因型(WT或Δ)tda1),二为培养时的初始葡萄糖量(0.1%和2% (w/v)葡萄糖)。调整p-values用于多重比较,Benjamini和Hochberg的方法58,将错误发现率设置为最大5%。P-由Benjamini-Hochberg程序校正多次比较的值58被称为q值。前面提到的斑点体积因子2变化作为蛋白质组学变化生物学相关性的判据,是基于测量折叠变化的2D-DIGE荧光数据计算得出的。折叠变化定义为条件1下得到的所有重复点体积的几何平均值除以条件2下得到的所有重复点体积的几何平均值。假设TDA1分别考虑了影响蛋白质丰度(独立于葡萄糖浓度)的缺失和葡萄糖浓度影响蛋白质丰度(独立于基因型)的假设,因此没有对ANOVA固有的多重测试进行额外校正。以折叠变化≤0.5或≥2作为相关蛋白质量变化的截断点。为TDA1-依赖时,0.1%或2% (w/v)葡萄糖必须达到临界值;对于葡萄糖浓度依赖性,仅考虑野生型的折叠变化。
当用Melanie软件分析得到的结果与用DeCyder软件分析得到的结果不一致时,手工检查斑点。首先,当只有一种分析(DeCyder或Melanie软件)的q值低于或等于0.05的截断值时,当斑点检测在两种分析或两种分析中都是可信的时,不考虑斑点。当它在只有一个分析中是合理的,则考虑该分析的q值。其次,当仅在DeCyder中满足≤0.5或≥2的严格折叠变化截断值,且检测可信时,认为该斑点代表aTDA1当Melanie软件中的折叠变化至少满足约≤0.53或≥1.9的5%松散截断值时,则为-依赖或葡萄糖浓度依赖蛋白质。否则,用Melanie软件的数据计算的折叠变化优先。的分类TDA1在Melanie和DeCyder软件中,依赖于-的点是一致的。根据Melanie软件的数据发现,其中8个位点与葡萄糖浓度有关,但DeCyder软件并没有合理地识别出来。因此,这些斑点是通过人工复查确认的。在DeCyder进行的分析中,有两个点仅满足葡萄糖依赖的标准,但由于折叠变化与Melanie软件计算的折叠变化的边际差异而被纳入,基于此,仅满足松散的截断。除了36个纳入的葡萄糖浓度依赖点之外,DeCyder软件中发现的14个点被归类为假阳性,因为DeCyder软件中不可信的斑点检测或Melanie软件中不符合葡萄糖浓度依赖的标准,在Melanie软件中斑点检测是可信的。这些斑点被忽略了。在这项工作中,专门使用Melanie软件分配的现货编号。
2D-DIGE斑点中蛋白质的质谱鉴定
的样本TDA1 -从装载1mg内标的制备2d凝胶中切除葡萄糖浓度依赖性斑点,用考马斯亮蓝G-250胶体染色。在切除之前,将斑点模式与内部标准荧光图像进行视觉比较,以允许正确的斑点定位。通过LC/ ESI-MS /MS进行蛋白鉴定。
用胰蛋白酶和肽提取的凝胶消化基本上是如上所述进行的59.样品采用Ultimate 3000 LC-System、捕集柱2 cm × 75µm Acclaim C18 3µm和分馏柱15 cm × 75µm Acclaim C18 2µm进行液相色谱分离(均为美国沃尔瑟姆的赛默飞世尔科学公司)。用溶剂A(2%乙腈,0.1%甲酸水溶液)捕集(10分钟),线性梯度(5分钟,溶剂A + 0-60%溶剂B(60%乙腈,0.1%甲酸水溶液))进行分离。使用LTQ-Orbitrap XL ETD (Thermo Fisher Scientific, Waltham, USA), MS R = 60,000, MS/MS = Iontrap(低分辨率)进行数据依赖采集(8个最密集的肽信号)。不进行电荷态反褶积和脱同位素。所有MS/MS样品均使用Mascot (version 2.6.0, Matrix Science, London, UK)进行分析,假设消化酶为胰蛋白酶。自定义搜索数据库(基于SwissProt 2018/07选择的数据库)酿酒酵母, 8034项),包括污染物和使用过的化学品。吉祥物的片段离子质量耐受性为0.60 Da,亲本离子耐受性为10.0 ppm。在Mascot中,半胱氨酸的氨基甲基化被指定为固定修饰。蛋氨酸的氧化和n端乙酰化被指定为可变修饰。使用Scaffold (version 4.8.5, Proteome Software Inc., Portland, USA)验证基于MS/MS的肽和蛋白质鉴定。如果通过Scaffold Local FDR算法能够以大于95.0%的概率建立肽识别,则接受肽识别。如果蛋白质鉴定的概率大于99.0%并且包含至少2个已鉴定的多肽,则接受蛋白质鉴定。蛋白质概率由蛋白质先知算法分配60.含有相似多肽且不能单独根据MS/MS分析进行区分的蛋白质被分组以满足简约原则。总频谱计数61是为了获得每个被鉴定的蛋白质构成的总蛋白质量在一个点的近似值。两种分析的总光谱计数(分开的凝胶;单独的盲法质谱实验)对每个点进行相加,排除只在一次分析中发现的蛋白质,并根据这个总和对蛋白质进行排序。当一个蛋白质的光谱计数超过该蛋白质中第二丰富蛋白质计数的两倍时,该蛋白质被认为是斑点恒等式。否则,将最丰富的蛋白质的频谱计数相加,直到达到该点的两种分析中所有蛋白质总频谱计数的至少50%。所有对这个总和有贡献的蛋白质都被认为是斑点特征。所有已识别蛋白质的完整数据集在线提供:DOI:https://doi.org/10.17605/OSF.IO/7AEQC.
平行反应监测测定Hxk1和Hxk2丝氨酸15磷酸化状态
从制备2d凝胶中取出的点样品,装入1mg内标,用胶体考马斯亮蓝G-250染色,在100mm碳酸氢铵/乙腈(1/1,v/v)缓冲液中染色,并通过添加ms级乙腈(100%)进一步脱水。二硫键在10mm二硫苏糖醇中在55°C下还原30分钟,在50mm碘乙酰胺中进一步烷基化,在25°C下黑暗30分钟。样品在37°C下用测序级胰蛋白酶(Promega, Madison, USA)消化过夜。消化后,通过在25mm碳酸氢铵、25mm碳酸氢铵/乙腈(1/1,v/v)、5%甲酸和5%甲酸/乙腈(1/1,v/v)缓冲液中连续孵育,从凝胶点中提取肽。样品最后真空干燥,溶解于30 μ l 0.05%三氟乙酸和1% (v/v)乙腈水中。LCMS设置由Dionex Ultimate 3000 RSLC色谱系统(Thermo Fisher Scientific, Waltham, USA)组成,配置为柱切换模式。流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈水溶液。负载相为0.05%三氟乙酸和1%乙腈水溶液。LC系统使用Waters BEH C18(1.7µm颗粒)100µm × 10 cm分析柱(Waters, Milford, USA)。加载柱由Waters Symmetry C18 5 μ m 180 × 20 mm (Waters, Milford, USA)组成。 Samples were separated by a gradient ranging from 10% (v/v) B to 40% B in 7 min. Data acquisition was performed by a Q-Exactive HF (Thermo Fisher Scientific, Waltham, USA) operated in parallel reaction monitoring mode (PRM). The peptide K13GSMADVPK21它的丝氨酸15磷酸化形式以及这些多肽的氧化蛋氨酸版本被靶向。通过分离窗口为1 m/z的四极子选择目标肽,在HCD细胞中以归一化碰撞能量为25进行碎片化,在200 m/z下以60,000分辨率的orbitrap对片段离子进行分析。MS数据由Skyline软件处理62提取所有相关b和y片段离子的信号,包括磷酸化的中性损失(H3.阿宝4)和甲磺酸基(CH3.SOH)与蛋氨酸氧化损失有关。
MW和IP的实验测定
在二维凝胶上分离用于一维电泳的预染色标记蛋白(PageRuler™Prestained Protein Ladder, Fermentas, St. Leon-Rot, Germany),并使用Melanie软件将其分子量映射到其坐标。得到的值对用R (nls Gauss-Newton算法)中的三次多项式拟合,以计算现场MW值。等电点的测定是通过近似使用的24厘米非线性IPG条的制造商提供的pH值测量特征(GE医疗集团,慕尼黑,德国)进行的,该函数被缩放到实际的点坐标,以最佳匹配用于二维电泳的标记蛋白样本(Sigma-Aldrich, Taufkirchen,德国)。这些标记蛋白用Cy3和Cy5标记。
通过基于模型的量化优化了现场体积测量
为了在蛋白质水平上测量己糖激酶数量的变化,除了在Melanie软件中实现的定量方法之外,还应用了一种基于二维荧光图像中通过具有高斯曲线轮廓的旋转对称固体对斑点景观建模的程序(图2)。8).在这一程序开始时,荧光扫描被加载到图像处理包斐济63(ImageJ版本5.12p)使用Bio-Formats插件(版本5.9.2),并将图像裁剪到含有蛋白质斑点的区域。在导出剖面数据之前,应用2像素平均滤波器来平滑高频噪声,而不改变整体荧光。采用滑动抛物线算法(35 px)去除低频背景荧光,减去靠近待分析斑点的无斑点区域的平均强度。在IEF维度上,斑点重叠较大,但山峰更容易区分,因此选择了通过两个已识别斑点的最大值的直线定义的斑点景观剖面,该直线大约平行于IEF分离轴。将剖面数据导入R中,进行可视化,确定局部极值,如图所示。8B。
基于模型的斑点量化的说明。该程序进行,以获得酵母蛋白质组中相对己糖激酶浓度的定量信息酿酒酵母举例说明,使用通过分离荧光标记的野生型和Δtda1在初始葡萄糖浓度为0.1% (w/v)时,细胞生长后提取的缺失突变蛋白。(一个)将BY4742野生型蛋白质组在己糖激酶点区域的荧光扫描部分可视化为3D景观。所描绘的区域大致对应于图中虚线矩形所包围的区域。1.该景观的横截面形成强度剖面,并通过斐济图像处理包获得。分别平行于IP或MW轴的红色和两条白线说明了这些剖面的基线方向。轮廓被建模为高斯曲线的和。(B)显示了野生型(蓝线)和Δ的Hxk1点沿IP轴的荧光强度分布图tda1缺失突变体(黑线)。黄色的点标记的峰值被认为代表个别点,因此由一个高斯曲线每个建模。黄色圆点的边线颜色与对应的高斯曲线的颜色相匹配(C- - - - - -F).垂直灰线标记点位置选择作为初始值用于拟合算法。荧光数据示于(一个)及(B)被建模为高斯曲线的和。(C)及(E)显示了将模型拟合野生型和Δ的Hxk1斑点荧光强度分布图后得到的单个高斯曲线tda1缺失突变蛋白组。对于Hxk1的主要斑点,将曲线下的区域着色(Hxk1- s15p:紫色;Hxk1-S15:绿色)。蓝色曲线所在的点包含Hxk2。红点代表每个像素的荧光强度测量,覆盖的黑色细曲线是拟合模型的近似值。显示于(D)及(F),计算出的高斯曲线绘制在平行于MW轴的测量荧光强度曲线上,以评估在二维上的拟合。同样,红点代表测量值;彩色区域是由模型得到的高斯曲线下的面积。
该模型采用Levenberg-Marquardt算法对剖面数据进行拟合,由高斯求和函数组成。每个函数由三个需要估计的参数确定,一个用于曲线峰值的高度,一个用于中心的位置,一个用于控制宽度。模型的起始值和边界值在所有重复中计算相同。整个模型首次拟合了野生型蛋白质组的荧光数据。一旦估计出高斯曲线的中心位置,这些位置被用作初始中心位置,以将模型拟合到Δ的荧光数据tda1缺失突变蛋白组。这些中心位置的固定公差Hxk1为500µm, Hxk2为250µm。根据一条曲线的三个参数,计算出曲线最大值附近相应旋转固体的体积。实现上述过程的脚本可在DOI:https://doi.org/10.17605/OSF.IO/7AEQC.每个点和条件的结果体积通过计算几何平均值平均,然后表示为含有己糖激酶的四个主要点(915,916,938,942点)总和的百分比。
TDA1缺失及葡萄糖浓度对细胞生长的影响分析
细胞生长随OD的增加而增加600在2D-DIGE实验的细胞培养过程中。设计的条件是保持细胞在指数生长状态,直到收集它们进行蛋白质组分析。因此,指数曲线可以拟合到测量的光密度和培养物有外径的时间点600可以计算出。统计测试,比较野生型和Δtda1缺失突变体,使用Wilcoxon's符号秩检验。
甲萘醌对细胞生长的影响分析
的后果TDA1在不同的条件下,研究了与甲萘醌诱导的氧化应激抗性相关的缺失。细胞在30℃的A培养基(YNB 0.69% (w/v), casamino acids 0.2% (w/v), KOH 150 mg/l, l -色氨酸20 mg/l,尿嘧啶20 mg/l,碳源和其他添加剂)中生长,在FLUOstar OPTIMA微孔板分析仪(BMG LABTECH, Offenburg, Germany)中,配备96孔BRANDplates®pureGrade(黑色),通过测量OD来监测生长600在此之前,从YPD板(YPD培养基+ 2.5% (w/v)琼脂)中提取细胞,在培养基A中培养5ml,开始OD6000.15,用2% (w/v)葡萄糖浸泡6小时。随后,将这些细胞转移到11 ml培养基A中,开始OD6000.01,并且已经生长到它们的固定阶段。将细胞离心(3500 g, 5 min, 30°C),在无碳源的A介质中重悬2次,取OD值600调整为0.08。在200 μl的培养基中分别接种5 μl的细胞悬液,分析其生长情况。甲萘醌溶于70% (v/v)乙醇。在分析的培养物中,包括对照组,乙醇的最终量调整为0.3% (v/v)。
转化酶测定
将YPD板上的细胞悬浮在5 ml YPD培养基中,培养16 h至指数生长期,离心收集(3500 g, 5 min, 30°C),重悬在YP培养基(1% (w/v)酵母浸膏,2% (w/v)蛋白胨)中,转移到10 ml添加0.1%或2% (w/v)葡萄糖的YP培养基中。生长开始于OD600浓度为0.15,持续4小时。培养物在200 rpm和30°C下搅拌。蔗糖酶活性的测定基本上如上所述64.
生物化学及材料
使用以下物质:cydye (Cy2, Cy3, Cy5), IPG条带(pH 3-10,非线性),IPG缓冲液(pH 3-10,非线性IPG条带),DeStreak试剂,覆盖液和蛋白酶抑制剂混合物,来自GE Healthcare(慕尼黑,德国);卡尔罗斯(卡尔斯鲁厄,德国)的过氧二硫酸铵和磷酸;丙烯酰胺/双丙烯酰胺溶液(37,5:1;30%), glycine, Tris和AEBSF来自AppliChem (Darmstadt, Germany);德国Fermentas (St. Leon-Rot, Germany);尿素和RC DC蛋白检测试剂盒,Bio-Rad(慕尼黑,德国);来自Serva(海德堡,德国)的考马斯亮蓝G-250和o-Dianisidine;BD生物科学公司(Franklin Lakes, USA)的蛋白胨和酵母提取物;氨基酸、葡萄糖和酵母氮基来自ForMedium(诺福克,英国);Platinum®Pfx DNA聚合酶来自Invitrogen (Waltham, USA); Taq DNA Polymerase with Buffers for Enhanced Amplification and Wizard SV Gel and PCR Clean-Up System from Promega (Madison, USA); N,N-dimethylformamide and dipotassium hydrogen orthophosphate from Merck (Darmstadt, Germany); thiourea from Merck (Darmstadt, Germany) or Sigma (Taufkirchen, Germany); PageRuler™ prestained protein ladder from Thermo Fisher Scientific (Waltham, USA); HCl and glycerol from VWR International (Darmstadt, Germany); Peroxidase from Roche Diagnostics (Mannheim, Germany). Other reagents used were purchased from Sigma (Taufkirchen, Germany).
数据可用性
Melanie软件项目文件和所有2D-DIGE荧光扫描,每个点的预测和观测IP和MW,辅助基于模型的量化脚本,用于质谱点识别的聚合数据以及使用PRM的靶向蛋白质组学分析的MS/MS离子列表已保存在开放科学框架平台上,DOI:https://doi.org/10.17605/OSF.IO/7AEQC.质谱点识别的其他主要数据已在线存入PRIDE数据库,项目id: PXD037135。PRM的全部数据也在线存入PRIDE数据库,项目id为PXD029824。用于插值观测到的IP值的IPG条带pH梯度数据是GE医疗集团的财产,可由他们自行决定提供。其他原材料可按要求提供。
缩写
- 酿酒酵母:
-
酿酒酵母
- k . lactis:
-
克鲁维酵母菌属lactis
- 2 d-dige:
-
二维差凝胶电泳
- 方差分析:
-
方差分析
- 罗斯福:
-
错误发现率
- Hxk1:
-
己糖激酶同工酶1酿酒酵母
- Hxk1-S15p:
-
己糖激酶同工酶1酿酒酵母在丝氨酸15处磷酸化
- Hxk1-S15:
-
己糖激酶同工酶1酿酒酵母,丝氨酸15未磷酸化
- Hxk2:
-
己糖激酶同工酶2酿酒酵母
- Hxk2-S15p:
-
己糖激酶同工酶2酿酒酵母在丝氨酸15处磷酸化
- Hxk2-S15:
-
己糖激酶同工酶2酿酒酵母,丝氨酸15未磷酸化
- IEF:
-
等电点聚焦
- 知识产权:
-
等电点
- 兆瓦:
-
分子量
- OD600:
-
光密度为600nm / 1cm
- YNB:
-
酵母氮基
参考文献
酵母生长发育的营养控制。遗传学192, 73-105(2012)。
Rolland, F., Winderickx, J. & Thevelein, J. M.葡萄糖在真核细胞中的感应机制。学生物化学的发展趋势。科学。26, 310-317(2001)。
己糖激酶II作为酵母中碳分解代谢抑制的关键酶的遗传和生化证据。Mol. Gen. Genet。178, 633-637(1980)。
Maitra, P. K. A .葡萄糖激酶酿酒酵母.生物。化学。245, 2423-2431(1970)。
Colowick, s.p.己糖激酶。的酶9, 1-48(1973)。
Herrero, P. Galíndez, J., Ruiz, N., Martínez-Campa, C. & Moreno, F.转录调控酿酒酵母HXK1, HXK2和GLK1基因。酵母11, 137-144(1995)。
德温德,J. H., Crauwels, M., Hohmann, S., Thevelein, J. M. & Winderickx .酵母糖激酶在建立分解代谢抑制状态中糖感的差异需求。欧元。学生物化学j。241, 633-643(1996)。
美国食糖利用的管制酿酒物种。j . Bacteriol。169, 4873-4877(1987)。
特朗布利,r.j.酵母中的葡萄糖抑制酿酒酵母.摩尔。Microbiol。6, 15-21(1992)。
Fernández-García, P., Peláez, R., Herrero, P. & Moreno, F.酵母己糖激酶2的磷酸化调节其核浆穿梭。生物。化学。287, 42151-42164(2012)。
Kriegel, t.m, Rush, J., Vojtek, a.b, Clifton, D. & Fraenkel, d.g.体内己糖激酶2的磷酸化位点酿酒酵母.生物化学33, 148-152(1994)。
Vojtek, A. B. & Fraenkel, D. G.酵母己糖激酶磷酸化。欧元。学生物化学j。190, 371-375(1990)。
角,S。et al。蛋白激酶Ymr291w/Tda1在葡萄糖信号通路中是必不可少的酿酒酵母己糖激酶同工酶ScHxk2磷酸化水平。生物。化学。290, 6243-6255(2015)。
Kettner, K。et al。酿酒酵母基因YMR291W/TDA1介导体内己糖激酶同工酶2丝氨酸15位点的磷酸化。2月。586, 455-458(2012)。
Peláez, R., Herrero, P. & Moreno, F.酵母己糖激酶2蛋白的核输出需要Xpo1 (Crm1)依赖通路。生物。化学。284, 20548-20555(2009)。
Alms, G. R., Sanz, P., Carlson, M. & Haystead, T. A. Reg1p靶向蛋白磷酸酶1去磷酸化己糖激酶II酿酒酵母:描述磷酸酶亚基对酵母蛋白质组的影响。EMBO J。18, 4157-4168(1999)。
Vega, M., Riera, A., Fernández-Cid, A., Herrero, P. & Moreno, F.己糖激酶2是酵母细胞内葡萄糖传感器,维持Mig1蛋白抑制复合体的结构和活性。生物。化学。291, 7267-7285(2016)。
联合,T. U. UniProt: 2021年的通用蛋白质知识库。核酸测定。49, d480-d489(2021)。
Herrero, P., Martínez-Campa, C. & Moreno, F.己糖激酶2蛋白参与蔗糖抑制SUC2基因必需的调控dna -蛋白复合物酿酒酵母.2月。434, 71-76(1998)。
Ma, H., Bloom, L. M., Dakin, S. E., Walsh, C. T. & Botstein, D.己糖激酶II的15个n端氨基酸在体内功能中不是必需的:对己糖激酶II的截断形式的分析酿酒酵母.蛋白质5, 218-223(1989)。
Mayordomo, I. & Sanz, P.己糖激酶PII:酵母中的结构分析和葡萄糖信号酿酒酵母.酵母18, 923-930(2001)。
Peláez, R., Herrero, P. & Moreno, F.酵母己糖激酶的功能域2。物化学。J。432, 181-190(2010)。
Randez-Gil, F., Sanz, P., Entian, K. D. & Prieto, J. A.碳源依赖性己糖激酶PII磷酸化及其在酵母葡萄糖信号响应中的作用。细胞生物学。18, 2940-2948(1998)。
Ahuatzi, D., Riera, A., Peláez, R., Herrero, P. & Moreno, F. Hxk2调节Mig1的磷酸化状态,从而调节其核质分布。生物。化学。282, 4485-4493(2007)。
布朗,j.a.。et al。酵母基因功能的定量表型分析。摩尔。系统。医学杂志。https://doi.org/10.1038/msb4100043(2006)。
酵母的氧化应激反应酿酒酵母.酵母14, 1511-1527(1998)。
Bodenmiller B。et al。用于模式生物系统水平研究的蛋白质磷酸化位点数据库。生物科技Nat。》。26, 1339-1340(2008)。
奥利维拉,a.p.。et al。酵母菌中枢代谢的酶磷酸化调节。摩尔。系统。医学杂志。8, 623(2012)。
Farriol-Mathis, N。et al。Swiss-Prot知识库中翻译后修饰的注释。蛋白质组学4, 1537-1550(2004)。
Behlke, J。et al。己糖激酶2酿酒酵母:体内丝氨酸-14磷酸化对寡聚体结构的调控。生物化学37, 11989-11995(1998)。
Golbik, R。et al。己糖激酶2的磷酸转移酶活性调控酿酒酵母通过对丝氨酸14的修饰。生物化学40, 1083-1090(2001)。
欧腾,C. E., Falk, R. L. & Culotta, V. C.保护高氧毒性所需的细胞因子酿酒酵母.物化学。J。388, 93-101(2005)。
Charoenbhakdi, S., Dokpikul, T., Burphan, T., Techo, T. & Auesukaree, C.液泡htext上标+ atp酶保护酿酒酵母细胞对抗乙醇诱导的氧化和细胞壁应激。达成。环绕。Microbiol。82, 3121-3130(2016)。
Hettema, e.h.。et al。胞质dnaj样蛋白Djp1p专门参与过氧化物酶体蛋白的输入。J.细胞生物学。142, 421-434(1998)。
汉森,k.g.et al。内质网表面检索途径在酵母中保护线粒体膜蛋白的导入。科学361, 1118-1122(2018)。
斯坦福,博士。et al。涉及tRNA核输出和碳水化合物代谢的酵母溶胶蛋白的劳动分工。遗传学168, 117-127(2004)。
哦,。et al。酵母Nuak1在低糖胁迫下通过AMPK和CK2信号通路的合作磷酸化组蛋白H3苏氨酸11。eLifehttps://doi.org/10.7554/eLife.64588(2020)。
Kriegel, t.m., Kettner, K., Rödel, G. & Sträter, N.己糖激酶2在葡萄糖信号通路中的调节功能酿酒酵母.生物。化学。291, 16477(2016)。
莫雷诺,F., Vega, M. & Herrero, P.核己糖激酶2作为葡萄糖传感器酿酒酵母.生物。化学。291, 16478(2016)。
Bodenmiller B。et al。磷酸蛋白组学分析揭示了酵母中激酶和磷酸酶扰动的相互关联的系统范围的反应。科学。信号3., rs4-rs4(2010)。
Oh, S., Suganuma, T., Gogol, M. M. & Workman, J. L.组蛋白H3苏氨酸11被Sch9和CK2磷酸化通过控制营养应激反应调节时间寿命。eLifehttps://doi.org/10.7554/eLife.36157(2018)。
吉琪,罗雄,杨,王志强,王志强。酵母蛋白与mRNA丰度的相关性研究。细胞生物学。19, 1720-1730(1999)。
Maier, T., Güell, M. & Serrano, L.复杂生物样品中mRNA和蛋白质的相关性。2月。583, 3966-3973(2009)。
拉撒路,n.r.,拉梅尔,a.h., Rustum, Y. M. & Barnard, e.a.酵母己糖激酶。一、纯酶的制备。生物化学5, 4003-4016(1966)。
Fernández, R., Herrero, P., Gascón, S. & Moreno, F.木糖诱导的己糖激酶PII活性降低,使碳分解代谢抑制转化酶合成的抗性酿酒carlsbergensis.拱门。Microbiol。139, 139-142(1984)。
Tu, J. & Carlson, M. REG1结合蛋白磷酸酶1型和调节葡萄糖抑制酿酒酵母.EMBO J。14, 5939-5946(1995)。
罗志刚,李志刚,李志刚酿酒酵母与己糖磷酸化直接相关的己糖激酶PI和PII。欧元。学生物化学j。199, 511-518(1991)。
Neigeborn, L. & Carlson, M.通过葡萄糖抑制影响SUC2基因表达调控的基因酿酒酵母.遗传学108, 845-858(1984)。
McCartney, r.r., Garnar-Wortzel, L., Chandrashekarappa, d.g. & Schmidt, m.c.激活环内磷酸化对Snf1激酶活性的激活和抑制。Biochim。Biophys。学报1864, 1518-1528(2016)。
酵母代谢中的NADP(H)氧化还原偶。安东尼·范·列文虎克52, 411-429(1986)。
Barbosa, a.d, Pereira, C, Osório, H., Moradas-Ferreira, P. & Costa, V.神经酰胺激活蛋白磷酸酶Sit4p通过调节己糖激酶2磷酸化控制寿命,线粒体功能和细胞周期进程。细胞周期15, 1620-1630(2016)。
萨曼塔,M. P.和梁。预测蛋白质功能的冗余在大规模蛋白质相互作用网络。Proc。国家的。学会科学。美国。One hundred., 12579-12583(2003)。
谷胱甘肽/谷胱甘肽和硫氧还蛋白系统在酵母生长和应激条件下的反应中的作用。摩尔。Microbiol。39, 533-541(2001)。
Ralser, M。et al。碳水化合物通量的动态改道是对抗氧化应激的关键。生物。6, 10(2007)。
伴侣,N。et al。葡萄糖抑制中己糖激酶缺乏的蛋白质组学和功能后果克鲁维酵母菌属lactis.细胞蛋白质。13, 860-875(2014)。
明显,C。et al。BioGRID:交互数据集的通用存储库。核酸测定。34, d535-d539(2006)。
r。C。队。R:统计计算的语言和环境.(R统计计算基金会:维也纳,奥地利,2018).athttps://www.R-project.org/.
Benjamini, Y. & Hochberg, Y.控制错误发现率:一种实用而强大的多重测试方法。J. R.统计社爵士。B Stat. Methodol。57, 289-300(1995)。
舍甫琴科,A., Tomas, H., Havli, J., Olsen, J. V. & Mann, M.蛋白和蛋白质组质谱表征的凝胶消解。Protoc Nat。1, 2856-2860(2006)。
Nesvizhskii, a.i, Keller, A, Kolker, E. & Aebersold, R.用串联质谱鉴定蛋白质的统计模型。分析的化学。75, 4646-4658(2003)。
刘,H., Sadygov, R. G. & Yates, J. R.鸟枪蛋白质组学中相对蛋白质丰度的随机抽样和估计模型。分析的化学。76, 4193-4201(2004)。
麦克林B。et al。Skyline:用于创建和分析目标蛋白质组学实验的开源文档编辑器。生物信息学26, 966-968(2010)。
Schindelin, J。et al。斐济:生物图像分析的开源平台。Nat方法。9, 676-682(2012)。
Harkness, t.a. & Arnason, t.g.一种测量分泌转化酶活性的简化方法酿酒酵母.物化学。杂志。https://doi.org/10.4172/2167-0501.1000151(2014)。
布劳内,j.m.。et al。二维凝胶电泳图像分析中的斑点定量:不同方法的比较和一种新的复合拟合算法的提出。BMC Bioinf。15, 181(2014)。
Luhn, S., Berth, M., Hecker, M. & Bernhardt, J.使用标准位置和图像融合从二维凝胶电泳图像集合创建蛋白质组图。蛋白质组学3., 1117-1127(2003)。
确认
我们要特别感谢Thomas M. Kriegel (Technische Universität Dresden, Medizinische Fakultät Carl Gustav Carus,生理化学研究所,01307 Dresden, Germany)发起本研究并在其实现过程中给予支持。我们还要感谢Sebastian Seiferheld (Technische Universität Dresden, Medizinische Fakultät Carl Gustav Carus,生理化学研究所,01307 Dresden, Germany),他帮助实现了本工作中使用的2D-DIGE程序,并提供了他尚未发表的研究结果TDA1依赖蛋白,采用SILAC方法。我们感谢Gerhard Rödel (Technische Universität Dresden, Institute for Genetics, 01062 Dresden, Germany)提供实验室设备和技术支持。
资金
资金由德累斯顿工业大学医学院(H.M.)的Else Kröner-Promotionskolleg提供。由Projekt DEAL启动和组织的开放获取资金。CMCB的分子分析-质谱分析设施得到了欧洲区域发展基金(ERDF/EFRE)(合同100232736)和德国联邦教育和研究部(BMBF)(项目“Unternehmen区域”,赠款03Z2ES2) (M.G.)的慷慨资助。
作者信息
作者及隶属关系
贡献
h.m.:概念化,方法论,软件,调查,数据管理,写作-初稿,可视化;a.l.:调查,写作-评论和编辑;g.d.:数据策划、写作评论与编辑;m.g.:调查,数据策划,写作-评论和编辑;k.k.:概念化,方法论,写作-评论与编辑,监督。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Müller, H., Lesur, A., Dittmar, G.;et al。的蛋白质组结果TDA1缺乏酿酒酵母蛋白激酶Tda1是Hxk1和Hxk2丝氨酸15磷酸化所必需的。Sci代表12, 18084(2022)。https://doi.org/10.1038/s41598-022-21414-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21414-x