摘要
克隆造血(CH)在老年人中普遍存在,并与血液恶性肿瘤和心血管疾病有关。尽管原子弹幸存者患这些疾病的风险随着辐射剂量的增加而增加,但辐射暴露与CH之间的因果关系尚不清楚。本研究研究了3-Gy全身照射后12-18个月的小鼠辐射暴露是否诱发CH。我们发现辐射相关的外周血髓细胞和红细胞分布宽度(RDW)增加。骨髓和非造血组织细胞的深度测序显示,在12只辐照小鼠中,有11只在造血系统中出现了反复发生的体细胞突变,而在6只未辐照小鼠中没有发生体细胞突变。辐照小鼠的变异等位基因频率(VAFs)为> 0.02,平均每只小鼠为5.8;> 0.1的VAFs突变和/或缺失普遍存在。对两只辐照小鼠的造血干/祖细胞进行检查发现,在同一个克隆和多个独立克隆中共存着几种突变,这些克隆提供60-80%的骨髓核细胞。我们的结果表明,大量CH的发展是由于辐射暴露。此外,我们还描述了辐射诱导的CH突变。
简介
随着人类年龄的增长,骨髓(BM)中数量有限的造血干/祖细胞(HSPCs)容易发生克隆扩张,导致大量后代血细胞进入周围细胞,这一过程被称为克隆造血(CH)。至少有10-20%的70岁及以上的人患CH,与血液恶性肿瘤和非癌症疾病(包括心血管疾病)的风险增加有关。1,2.CVD的发病机制是由克隆扩增的具有突变的HSPCs产生的促炎髓系细胞的增加DNMT3A而且TET23.,4,5.
从理论上讲,每个人在50岁之前都普遍患有风湿性关节炎6但只有一小部分老年人在被广泛接受的0.02变异等位基因频率(VAF)阈值处表现出白细胞克隆扩增1,4.因此,启动或促进CH的决定性因素,特别是暴露于不同剂量电离辐射的细胞外部因素,也必须加以评估。在原子弹爆炸幸存者中,外周血细胞中经常检测到克隆染色体畸变,这表明在辐射暴露后经常出现克隆扩增的血细胞7.外周血单核细胞的数量、心血管疾病的风险和恶性血液病的发生频率与原子弹幸存者的辐射剂量成正比8,9.这些发现表明,辐射相关的CH增加了单核细胞的产生和心血管疾病的风险。癌症放射治疗的研究表明,辐射暴露与CH之间存在显著的相关性10,11,12,但其因果关系和潜在机制仍有待充分阐明。因此,在本研究中,我们评估了辐射暴露对小鼠模型中CH发育和血细胞分布的影响。我们在小鼠中对辐射诱导的CH进行了表征,这可能有助于理解在辐射暴露个体中,辐射暴露后很长时间内,CH与血液恶性肿瘤和炎症性非癌症疾病风险增加有关。
方法
动物
我们使用(C57BL6产生HPRTdup -绿色荧光蛋白× C3H/HeJ) F1小鼠13,它们是雌性的混血儿产生HPRTdup -绿色荧光蛋白和雄性C3H/HeJ (Japan SLC, Inc, Shizuoka, Japan)小鼠,进行活体分离产生HPRT在存活状态下,通过诱导GFP表达检测到突变细胞。43只小鼠(19只雄性和24只雌性)在6周龄时使用x射线发生器CP-160对全身进行3-Gy (Gy)辐照(Faxitron Bioptics, Tucson, AZ, USA;160kv, 6.2 mA, 0.5 mm Al和0.21 mm Cu滤波器;56 keV实际能量)和一台AE-1322剂量计(Ouyo Giken, Inc.,日本东京),剂量率为0.8 Gy/min。11只小鼠(7只雄性4只雌性)未接受辐射并作为对照。这些小鼠被安置在辐射效应研究基金会(RERF)的一个特定的无病原体设施中。考虑到之前的一项研究,我们认为这个相对高的剂量(3 Gy)可能有效地诱导CH的体细胞突变和发展14其中2 gy照射诱导(C57BL6 × C3H/HeJ) F1小鼠骨髓细胞10%染色体畸变;我们预期3 Gy辐照比2 Gy辐照能更有效地诱导突变。虽然这些小鼠被用来描述克隆细胞群产生HPRT突变,GFP表达水平在辐照后没有显著增加(数据未显示)。在实验分析前,gy照射小鼠死亡7只3只,非照射小鼠死亡0只(照射后平均14.5个月),剩下36只辐照小鼠和11只非辐照小鼠进行分析。用含有10%二甲基亚砜的胎牛血清(HyClone, Cytiva)在冷冻管中重悬BM细胞,并在液氮中冷冻保存。将冷冻保存的细胞在37°C的水浴中快速解冻,用含有10%胎牛血清的RPMI1640冷培养基(Nacalai tesque, Inc., Kyoto, Japan)洗涤两次,用于DNA提取或分选实验。小鼠实验得到了RERF实验动物护理委员会(No. 2020-01)的批准,并按照1996年美国国立卫生研究院指南以及RERF和arrival动物实验指南进行。
血细胞分析
使用在0或3gy全身照射后12-18个月收集的静脉血样本评估血细胞剖面。使用血液自动分析仪XN-1000 (Sysmex, Kobe, Japan)测量红细胞分布宽度(RDW)。我们列举了淋巴细胞(非髓细胞;定义为CD41−CD11b−)、粒细胞(CD41−CD11b+Ly6C低)和ly6c含量高的单核细胞(CD41−CD11b+Ly6C高)去除1 μg/mL DAPI (Invitrogen)染色的死亡细胞后,使用MACSQuant X流式细胞仪(Miltenyi Biotec, Bergisch Gladbach, Germany)和FlowJo软件(TreeStar, Ashland, OR, USA),如图所示。S1.相应抗体购自BioLegend (San Diego, CA, USA;APC CD11b目录号为101212,PerCP-cyanine 5.5 CD41目录号为133918,PE Ly6C目录号为128007)。
测序分析
我们使用辐照雄性小鼠(N = 12)的BM细胞,进行全外显子组深覆盖测序(500×),以确定复发性体细胞突变(VAF > 0.02)的CH。其中8只小鼠RDW值较高(20.9 ~ 15.1),4只小鼠RDW值较低(14.8 ~ 14.2),分别选取8只和4只小鼠进行测序分析,研究高RDW辐照小鼠是否会发生CH。对照组雄性小鼠(N = 7)也进行测序分析。使用QIAamp DNA血液微型试剂盒(Qiagen, Hilden, Germany)从股骨的BM细胞中提取DNA,并送到Macrogen, Inc. (Seoul, Korea),使用SureSelect XT试剂(Agilent Technologies, Santa Clara, CA, USA)进行文库制备,并在Illumina NextSeq平台(San Diego, CA, USA)上进行测序。使用Burrows-Wheeler对齐-最大精确匹配算法将序列读取(fastq)映射到小鼠参考基因组(mm10),然后使用SAMtools对读取进行排序和索引15,16.使用markduplates (Picard)工具识别和删除聚合酶链反应扩增子的重复读取17.使用GATK4包MuTect2鉴定单核苷酸变异(SNVs)或小插入或删除17,以未辐照的对照鼠为参照。为了确认结果,我们使用我们之前对年轻成年C57BL6/C3H F1小鼠全基因组测序的结果(生物样本id, SAMD00164355, SAMD00164356, SAMD00164357, SAMD00164358, SAMD00164359,和SAMD00164360,在DDBJ Sequence Read Archive中注册;https://www.ddbj.nig.ac.jp/dra/index-e.html)作为另一个参考。根据> 0.35的高VAF排除疑似种系变异。也就是说,只对VAF为0.02-0.35的变量进行进一步评估1,4.在大多数小鼠中检测到的≤5个reads支持的变异被过滤掉,以减少伪影。利用SnpEff对遗传变异的影响进行注释和预测18.
检测到的体细胞突变的频率通过使用BM细胞的剩余DNA进行靶向扩增子测序(Illumina MiSeq,平均深度30000)验证,引物扩增包含突变序列的区域。使用Nextera XT Index Kit (Illumina)附加双指标和测序适配器。通过对BM、脾脏、胸腺、尾巴、肾脏、肝脏、大脑、甲状腺和睾丸组织的DNA进行靶向测序,还评估了这些体细胞突变的组织特异性。
细胞分选和HSPC菌落形成
使用从两只雄性小鼠分离的BM细胞,测定CD3中的突变频率+T细胞,CD19+B细胞,Gr-1+粒细胞,Ter119+红细胞数量。在筛选单一血统的造血菌落中也测定了突变频率−本来就+c - kit+CD34−CD150+CD48因子−长期造血干细胞(HSCs)和谱系−本来就+c - kit+CD34+多能祖细胞(MPPs)进入96孔板(补充图。S2)19,20..这些细胞在37°C和5% CO的MethoCult FG M3434培养基(STEMCELL Technologies, Vancouver, Canada)中形成菌落2为14天。从BioLegend(目录编号100308 PE CD3, 115519 PE-cyanine7 CD19, 103432 APC-cyanine7 CD48, 115922 PerCP-cyanine5.5 CD150, 127623 APC-cyanine7 Gr-1, 108108 PE Sca-1, 116222 PE-cyanine7 Ter119)或Invitrogen(卡尔斯巴德,CA, USA;PE-cyanine7 CD3为25-0031-82,APC CD19为17-0193-80,FITC CD34为11-0341-82,APC c-Kit为17-1171-83,PE-cyanine7 Gr-1为25-5931-82),使用FACSAria II细胞分选机(BD Biosciences, Franklin Lakes, NJ, USA)在剔除DAPI染色的死亡细胞后对细胞进行分类。通过靶向扩增子测序检测体细胞突变的频率。
统计分析
主要结果是比较两组辐照和未辐照小鼠CH的患病率(具体来说,是反复发生的体细胞突变的数量)。基于SAS 9.4 (SAS Institute, Inc., Cary, NC, USA)的精确泊松回归,对每一个非ch嵌合、ch相关嵌合或ch相关非嵌合突变(缺失、snv和多位点突变)在两组间突变患病率的差异进行检测。此外,多位点突变被定义为聚集的snv和插入或删除21.其他变量,包括淋巴细胞和髓细胞百分比,RDW,以及它们与辐射的关系,采用线性回归分析,并调整了小鼠的年龄(测量时的月龄)和性别。采用R版本4.1.2进行回归分析22,通过图形化检验各响应变量的异方差与残差。对每一个回归分析进行了breuch - pagan检验。P-值基于多元线性回归确定,采用加权最小二乘法定义权重,使方差较低的观测值被赋予更多的权重。
结果
血细胞概要文件
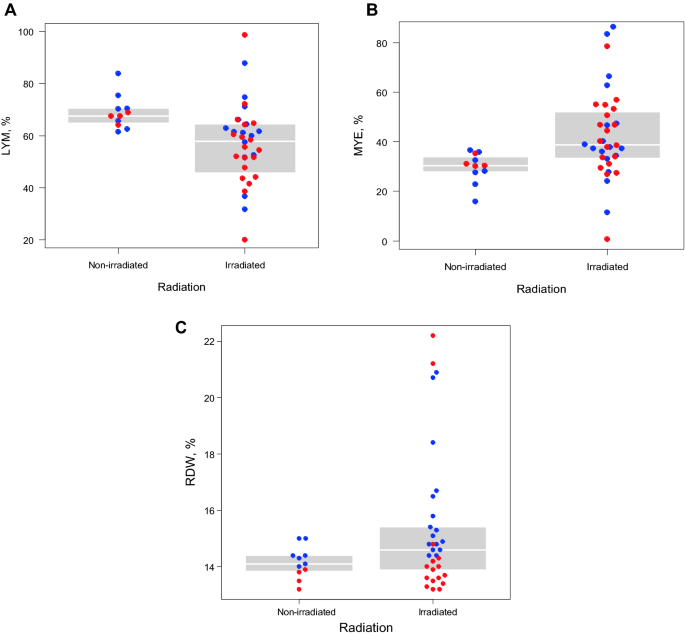
我们评估了6周龄时接受3 Gy x射线全身照射的小鼠血细胞的辐照相关变化。通过流式细胞术进行血细胞谱分析的代表性结果见补充图。S1.CD41的百分比−CD11b−3 Gy辐照后约16个月(18月龄),与未辐照的同龄小鼠相比,辐照小鼠的骨髓细胞(粒细胞+单核细胞)增加(图1)。1A、B;P两者均< 0.01)。周边红细胞的RDW值,已知相关的血液和心血管疾病和癌症的风险23以及CH患病率1在3 Gy照射后16个月小鼠中,也增加了。1C;P< 0.01)。
照射后12-18个月小鼠血细胞图谱。(一个)淋巴细胞(LYM)用流式细胞仪计数CD41−和CD11b−并将辐照小鼠(N = 36)与未辐照小鼠(N = 11)进行比较。LYM百分比差异显著(P< 0.01),校正年龄和性别后线性回归分析。蓝色和红色的点分别代表雄性和雌性动物。四分位之间的范围用灰色阴影区域表示。(B)用CD41评价外周血白细胞中髓细胞百分比(MYE, %)−和CD11b+包括低ly6c粒细胞和高ly6c单核细胞。同样的统计分析表明,暴露于辐射(N = 36)和未暴露于辐射(N = 11)的小鼠之间存在显著差异(P< 0.01)。(C)用血液自动分析仪测定照射后小鼠外周血红细胞的RDW值。由于取样误差,辐照小鼠缺少3个数据。照射组(N = 33)和未照射组(N = 11)小鼠RDW值差异显著(P< 0.01)。RDW,红细胞分布宽度。
BM中反复发生的体细胞突变的频率
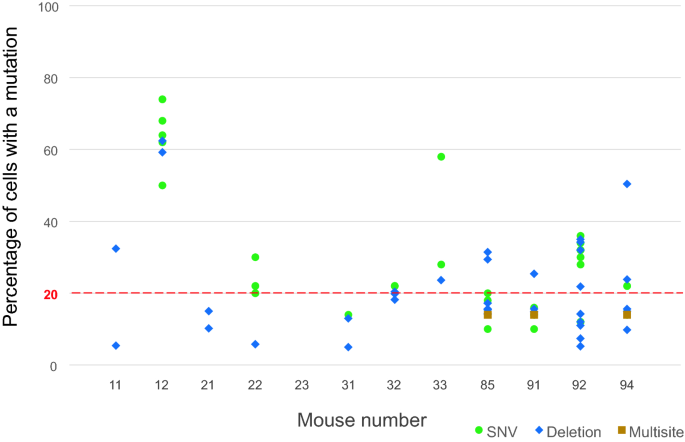
我们检查了12只辐照小鼠和6只未辐照对照小鼠的复发性体细胞突变,特别是VAF在0.02-0.35之间的突变。在高覆盖深度(500×)对BM细胞进行全外显子组测序,检测到复发突变。通过BM、脾脏、尾巴、大脑和睾丸DNA的靶向扩增子测序验证了候选体细胞突变。18只小鼠有79个体细胞突变1).含有这些突变的基因见补充表S1.我们将79个体细胞突变分为以下三组1:(1)在具有相似VAFs的造血和非造血组织中均检测到9个突变(提示嵌合突变起源于胚胎发生的早期阶段,而不是通过造血系统的大规模扩张);(2) 5个嵌合突变在非造血组织(如大脑和睾丸)中存在低VAFs,但在造血系统(BM和脾脏)中显著扩大;(3)其余65个突变仅在造血系统中发现。第一组受照射小鼠和对照组小鼠的突变在数量上没有差异(P= 0.2),而后两组被认为与ch相关的突变仅在辐照小鼠中观察到,且辐照小鼠与对照组小鼠之间的差异具有统计学意义(P= 0.1)和显著(P< 0.01),分别为第二组和第三组突变。12只辐照小鼠中有11只具有ch相关突变,9只具有VAF > 0.1突变,即BM中>的克隆细胞比例为20%(图1)。2),说明3 Gy辐射强烈促进了CH的发育。然而,ch相关突变的数量或VAFs(每只辐照小鼠的平均或最大值)与淋巴细胞或髓细胞百分比和RDW等血液学指标无显著相关性。
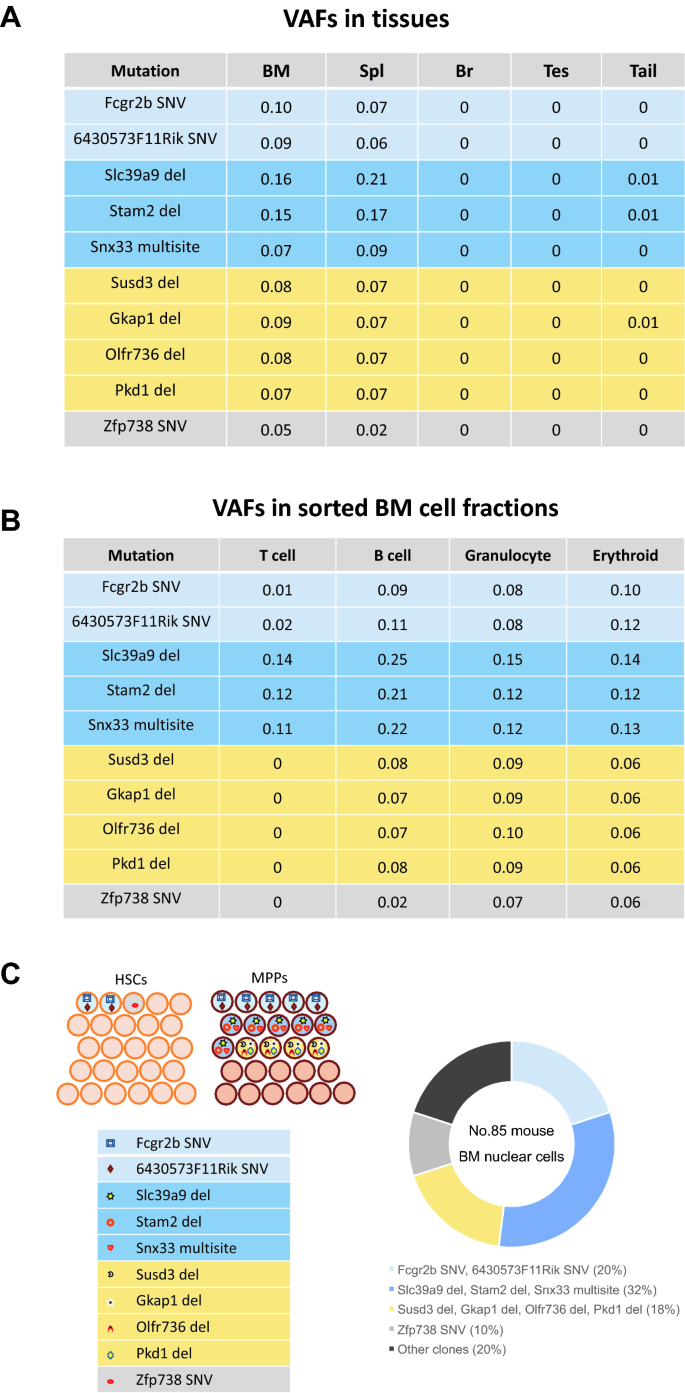
辐照小鼠BM细胞的克隆细胞百分比。通过将ch相关突变的VAFs加倍估计细胞百分比(N = 70,数值见补充表)S1),因为体细胞突变通常发生在二倍体细胞的染色体上。VAF为0.1相当于20%的细胞。多位点突变是聚集的snv和插入/删除。BM,骨髓;CH,克隆造血作用;SNV单核苷酸变异;VAF,变异等位基因频率。
复发性体细胞突变的特征
尽管在早期发育过程中出现并扩展到造血和非造血组织的突变不能归因于辐射暴露,但仅在造血系统中观察到的突变可能包括辐射诱导突变。65个造血特异性突变(见表)1)包括27个碱基取代,35个缺失和3个多位点突变,前两个在辐照小鼠中显著增加(P均< 0.01,表2).不同类型的单核苷酸取代的分布与大量人口相似1在老鼠实验中24,胞嘧啶到胸腺嘧啶(C→T)转变是最常见的变化(补充图。S3).相比之下,以前的人类CH研究报告的缺失和多位点突变的病例要少得多1,2.在35个缺失中,12个有1-3个核苷酸缺失;其余23个缺失有5-31个核苷酸缺失,其中8个缺失显示被删除序列与侧翼序列的微同源性(至少两个核苷酸)(补充表)S1).这种缺失和多位点突变与在受辐射照射的小鼠和人类中观察到的特征一致21,25,26,27.
血细胞谱系和HSPC菌落的复发性体细胞突变
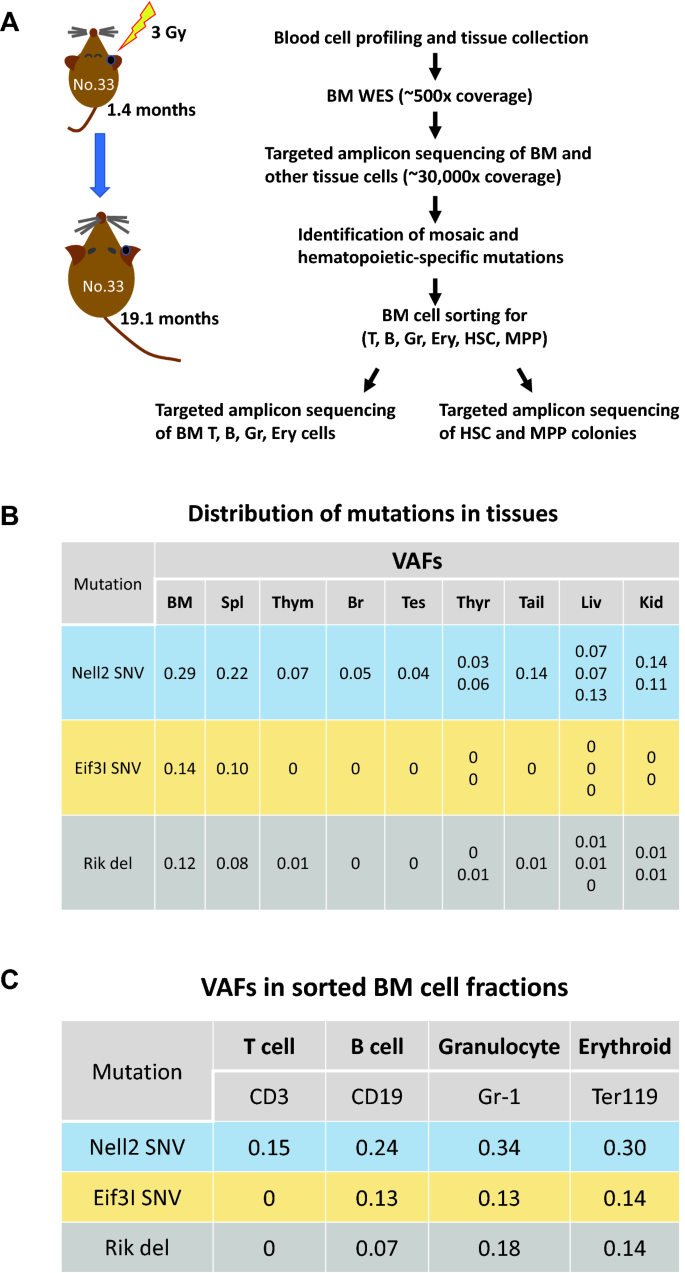
在辐照小鼠中,尽管每只小鼠的复发突变数量从2到16不等,但在同一只小鼠中发现的某些突变在每个检查的组织中表现出相似的VAF值(补充表)S1),表明它们出现在相同的细胞群中。为了研究突变的起源和在血细胞谱系中的分布,我们选择了两只没有恶性或非恶性症状的小鼠(编号33和85),分析了从其BM中分离的t细胞、b细胞、粒细胞和红系细胞的突变频率,以及从同一BM细胞的单细胞分离的造血干细胞和MPPs中获得的HSPC菌落的突变频率(图)。3.A).此外,总的来说,68%的排序HSC/MPPs产生了菌落,每只老鼠有40-52个菌落(56%的菌落)被测序。
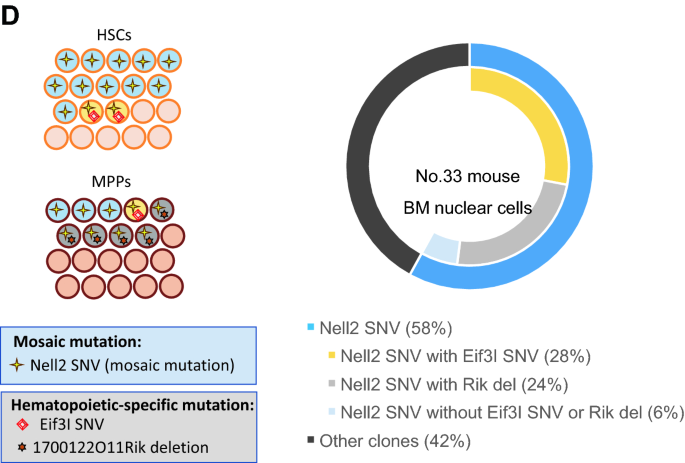
辐照小鼠(小鼠33)中几种组织、BM血细胞类型和HSPC菌落中ch相关突变的分布(一个) ch相关突变的实验过程示意图。(B根据大脑(Br)、睾丸(Tes)和甲状腺(Thyr)等几个非造血器官的VAFs, Nell2 SNV被认为在胚胎早期发生。Nell2 SNV也普遍存在于其他非造血的血液过滤组织,如尾巴、肝脏(Liv)、肾脏(Kid)、BM和淋巴组织、脾脏(Spl)和胸腺(Thym)。瑟尔和基德的两个单独的部分,丽芙的三个部分,以及其他组织的一个部分被检查了。Eif3I SNV和1700122O11Rik缺失(Rik del)在这些组织中分布有限(除Spl外)。(C在BM细胞中,B细胞、粒细胞和红系细胞中Nell2 SNV的频率高于T细胞。Eif3I SNV和Rik del在BM细胞中都很常见,尤其是在B细胞、粒细胞和红系细胞中。(D简化图(左图)显示在造血干细胞和MPPs的造血集落中,Eif3I SNV和1700122O11Rik del与Nell2 SNV共存。右图描绘了照射后小鼠33的BM核细胞中由复发突变定义的克隆种群的估计比例。克隆细胞百分比通过将BM中突变的VAFs增加一倍来估计,它们的包含关系由3个克隆突变在HSPC菌落中的分布得出。BM,骨髓;CH,克隆造血作用;HSPC,造血干/祖细胞;SNV单核苷酸变异;VAF,变异等位基因频率。
为了研究由于CH的发展而导致的嵌合体突变是如何在血细胞系之间扩展的,我们评估了t细胞、b细胞、粒细胞或红系细胞系以及有三种复发突变的小鼠33的20个HSC或20个MPP集落中的VAFs,其中包括一种嵌合体突变(补充表)S2).位于染色体(chr) 15 (Nell2基因)核苷酸位置95,432,868的SNV被认为起源于早期胚胎发生,因为它出现在非造血组织中,如大脑、睾丸和甲状腺(图1)。3.B).其在BM中的VAF为0.29,表明胚胎突变克隆占BM核细胞的58%。在这只小鼠的BM细胞亚群中,VAF为0.15、0.24、0.34、0.30的Nell2 SNV分别出现在t细胞、b细胞、粒细胞和红系细胞谱系中(图1)。3.C);20个hsc来源的克隆中有13个VAF约为0.5,20个mpp来源的克隆中有9个VAF约为0.5。3.D及补充表S2).另外两种突变——chr 15 (Eif3I基因)79,076,783位点的SNV和chr 17 (1700122O11Rik) 48,036,757位点的缺失——专门在造血细胞中发现,在BM中VAFs分别为0.14和0.12,在造血干细胞或MPPs中相互不同的细胞克隆中VAFs接近0.5(图)。3.D,左面板)。这些发现表明,携带Eif3I SNV和1700122O11Rik缺失的细胞是携带Nell2 SNV的细胞群中的两个独立亚群(图1)。3.D,右面板)。此外,Nell2 SNV在T细胞和非造血组织中存在水平相同,在B细胞和髓系细胞中扩增,而其他两种突变在B细胞、粒细胞和红系细胞中分布不同,但在T细胞和非造血组织中未检测到(图1)。3.B, C)。
在85只具有10个复发突变的小鼠中,我们评估了血细胞谱系和26个HSC或26个MPP菌落突变的VAFs,以举例说明几个ch相关突变如何在同一克隆中共存(补充表)S2).这些突变均与造血有关,整个BM核细胞VAFs为0.05-0.16(图。4A),尽管在T细胞中没有检测到5个突变(图。4B).对这些HSC和MPP菌落中的VAFs的评估表明,至少有4个不同的HSPC群体具有两个SNVs(位于chr 1,位置170,961,340 [Fcgr2b]和chr 8,位置36,512,373 [6430573F11Rik])和3个突变(chr 12,位置80,649,329 [Slc39a9];chr 2,位置52,720,990 [Stam2];chr 9,位置56,918,333 [Snx33]), 4个突变(chr 13,位置49,239,072 [Susd3];chr 13,位置58,259,599 [Gkap1];chr 14,位置50,392,765 [Olfr736];chr 17,位置24,594,785 [Pkd1]),或一个突变(chr 13,位置67,673,456 [Zfp738])(图4)。4C,左面板)。同一HSPC菌落中突变的共存可能反映了辐射损伤后扩展的多个独立HSPC克隆,共同组成了整个BM核细胞群的80%(图1)。4C,右面板)。
另一只受照射的小鼠(小鼠85)的几种组织和BM血细胞类型中ch相关突变的分布。这只小鼠被以与小鼠33相似的方式照射,但在16月龄时评估CH的流行情况。(一个)所有这些都表明,突变在大脑和睾丸中无法检测到,而在尾巴中很少检测到。相反,它们在BM和脾脏中经常被检测到,表明造血特异性。(B)这些突变的VAFs在BM B细胞、粒细胞和红系细胞中为0.02-0.25。然而,有些在BM T细胞中检测不到或缺乏。(C) BM造血干细胞和MPPs的相同造血集落中共存几种突变,如相同颜色所示(左图);这些共存的突变分布在不同的细胞系中,频率相似一个而且B).右图描述了通过将BM中突变的VAFs翻倍估计的克隆种群比例,它们的排斥关系来自于HSPC菌落中具有不同突变集的克隆的分布。BM,骨髓;CH,克隆造血作用;HSPC,造血干/祖细胞;MPP,多能祖;VAF,变异等位基因频率。
讨论
我们检测到在3 Gy辐照后16个月辐照小鼠的造血组织中几乎全部出现复发性体细胞突变(VAF > 0.02),但在相同年龄的未辐照小鼠中没有出现1).大多数突变表现出辐射诱导的分子变化特征,清楚地表明辐射暴露诱导小鼠发生ch相关突变;由于小鼠的寿命很短,因此难以分析CH的扩张24.此外,3只gy照射的小鼠的外周血髓细胞数量和RDW值均显示出辐射相关的增加,这通常在原子弹辐射的幸存者和CH患者中观察到1,8,28.
本研究中观察到的CH有两个显著特征。首先,3只gy照射的小鼠有5.8个突变,平均VAF为> 0.02,其中约一半的小鼠VAF为> 0.1,表明CH大规模扩张。这与人类衰老相关CH中0.12-0.14的VAFs相当1,2但明显高于未照射小鼠的VAF < 0.0124.
其次,对两只辐照小鼠(编号33和85)的HSC和MPP菌落分析显示,不同分化阶段的HSPCs在同一菌落中同时存在多种突变(图。3.D和4C及补充表S2).小鼠33有两个独立克隆,一个同时存在于HSC和MPP克隆中,另一个存在于MPP但不存在于HSC克隆中,共占其BM核细胞的50%。小鼠85有4个独立克隆,一个在HSC和MPP克隆中,一个在HSC克隆中,另外两个在MPP克隆中,但不在HSC克隆和T细胞中,占其BM核细胞的80%。最近在一些老年人身上观察到具有独立突变的多个克隆的大规模扩展29.此外,可能的辐射诱导突变(缺失和多位点突变)在MPP中普遍存在,但在HSC克隆中不存在(图。3.D和4C),而这些突变中的大多数在T细胞以外的血细胞群中扩大(图5)。3.C和4B).尽管所分析的造血克隆数量有限,但可以假设辐射突变的MPPs主要扩展以重建辐射损伤的造血系统。这一假设可能在一定程度上得到了先前一项研究的支持,该研究表明,在5-氟尿嘧啶诱导的白细胞减少后,造血干细胞向MPPs的输出增强30..
确定的CH相关突变不包括在与衰老相关的人类CH中报告的有利突变1,2,31,如DNMT3A,TET2,ASXL1,TP53,JAK2,PPM1D在接受癌症放射治疗的CH病例中未发现突变12;因此,本研究中发现的突变可能不会直接促进CH的发生。然而,没有已知驱动突变的CH很普遍,这种突变的造血克隆的生长速度与有CH驱动突变的克隆的生长速度相似32.因此,本研究中发现的22个ch相关突变(补充表S1在辐射暴露后的应激和长期造血过程中,可能会对功能产生影响并潜在地带来选择性优势。另一种可能的机制是由于辐射暴露导致的CH促进,具有较少毒性或中性突变的细胞可能被选择用于长期造血。另外,CH发育中的中性漂移可能在辐射损伤后造血恢复中发挥关键作用。在中性漂移中,一些没有增殖优势的细胞可以随机扩张,这种随机效应会随着细胞池大小的减少而增强2.此前的一项研究表明,3 Gy的辐射暴露使HSPC池减少到约30%33表明后续HSPC增殖通过中性漂移向CH发展2.观察克隆突变从出现到扩展或消失的纵向轨迹,将揭示辐射诱导突变如何在辐射暴露后促进造血。
ch相关基因突变参与了CVD的发病机制34在CH病例中,较高的VAFs(通常为> 0.1)与发病率和死亡率的增加密切相关35.血液骨髓细胞数量和RDW的增加也是各种疾病(包括癌症和心血管疾病)的预后和死亡率的强预测因子23在原子弹爆炸幸存者中也观察到这种现象8,28.然而,在本研究中检测的辐照小鼠中,ch相关突变的VAFs与这些血液标志物之间没有显著的关联。这可能是因为检测的小鼠数量太少,无法充分评估辐射诱导CH的影响,也无法排除或调整其他病理生理过程的影响,如组织特异性炎症和衰老,对这些标记物的影响。本研究的另一个局限性是没有对克隆扩增细胞群的功能进行评估,这可以通过结合突变和突变HSPCs在单细胞水平上的转录组分析进行评估。通过使用越来越多的样本对突变及其功能进行精确评估,未来对辐照小鼠中大量CH的研究可以确定在癌症和非癌症疾病发展过程中,辐射暴露、CH和炎症增强之间的分子机制。
Nell2 SNV是本研究中发现的一种早期胚胎性SNV突变,在造血细胞中大量扩增;然而,这种膨胀是何时发生的仍然是未知的。我们最近开发了一种利用自发的从头突变重建早期胚胎细胞谱系的方法,该方法是通过对成人组织的深覆盖全基因组测序直接检测到的,基于嵌合突变之间的VAFs关系重建谱系36.使用这种方法,我们发现在早期小鼠胚胎(胃形成前)的每一个细胞分裂都会发生一个自发突变,而在胃形成后,其在胚胎组织之间的分布是不同的。HSPCs中Nell2 SNV的扩增可能发生在照射前。然而,这种SNV在胸腺中的VAF和在非造血器官中的一样小。3.B),在T细胞中比在其他血液细胞中低(图。3.C),提示扩大的HSPCs对辐射损伤后的t细胞重建没有太大的贡献。因此,该SNV可能在辐照后在HSPCs中扩大,并大量分布到B细胞和髓系细胞,尽管需要对辐照前后的VAF进行研究来证实这一假设。值得注意的是,单细胞分裂分辨率下的细胞谱系追踪有助于检测内源性基因组标记,以评估造血系统以外的各种组织中的克隆细胞扩张,这将揭示辐射诱导的克隆细胞扩张和随后的癌症和非癌症疾病的详细信息。
数据可用性
支持结论的数据可在原稿及其补充信息中找到。原始测序数据注册在DDBJ测序读取档案,注册号为DRA013660。本文还提供了源数据。
参考文献
贾斯瓦尔,S。et al。年龄相关克隆造血与不良结果相关。心血管病。j .地中海。371(26), 2488 - 2498。https://doi.org/10.1056/NEJMoa1408617(2014)。
辛克,F。et al。克隆造血,有或没有候选驱动突变,在老年人中很常见。血130(6), 742 - 752。https://doi.org/10.1182/blood-2017-02-769869(2017)。
柱身,J·J。et al。与TET2缺乏相关的克隆造血加快了小鼠动脉粥样硬化的发展。科学355(6327), 842 - 847。https://doi.org/10.1126/science.aag1381(2017)。
贾斯瓦尔,S。et al。克隆造血与动脉粥样硬化性心血管疾病的风险。心血管病。j .地中海。377(2), 111 - 121。https://doi.org/10.1056/NEJMoa1701719(2017)。
Abplanalp, w . T。et al。克隆造血驱动因子DNMT3A突变改变心力衰竭中的免疫细胞中国保监会,Res。128(2), 216 - 228。https://doi.org/10.1161/CIRCRESAHA.120.317104(2021)。
克隆造血:驱动干细胞克隆优势的机制。血136(14), 1590 - 1598。https://doi.org/10.1182/blood.2020006510(2020)。
Nakano, M。et al。估计在血液T淋巴细胞中引起克隆染色体畸变的造血或淋巴干细胞的数量。Radiat。Res。161(3), 273 - 281。https://doi.org/10.1667/rr3133(2004)。
吉田,K。et al。50年来辐射暴露和外周血单核细胞纵向变化:原子弹幸存者成人健康研究Br。j . Haematol。185(1), 107 - 115。https://doi.org/10.1111/bjh.15750(2019)。
清水,Y。et al。辐射暴露和循环系统疾病风险:1950-2003年广岛和长崎原子弹爆炸幸存者数据。BMJ340, b5349。https://doi.org/10.1136/bmj.b5349(2010)。
库姆斯,C . C。et al。治疗相关的克隆造血在非血液病癌症患者中是常见的,与不良的临床结果相关。细胞干细胞21(3), 374 - 382. - e374。https://doi.org/10.1016/j.stem.2017.07.010(2017)。
Boucai, L。et al。放射性碘相关的克隆造血在甲状腺癌中是常见的,并与降低生存率有关。j .中国。性。金属底座。103(11), 4216 - 4223。https://doi.org/10.1210/jc.2018-00803(2018)。
博尔顿,k . L。et al。癌症治疗塑造了克隆造血的适应度格局。Nat,麝猫。52(11), 1219 - 1226。https://doi.org/10.1038/s41588-020-00710-0(2020)。
野田佳彦。et al。建立带有GFP基因标记的HPRT基因部分重复的小鼠,并检测原位GFP阳性体细胞的逆转细胞。《公共科学图书馆•综合》10(8), e0136041。https://doi.org/10.1371/journal.pone.0136041(2015).
Nakano, M。et al。在子宫内或出生后不久照射的小鼠的淋巴细胞或骨髓细胞中,染色体畸变不存在。Radiat。Res。167(6), 693 - 702。https://doi.org/10.1667/RR0718.1(2007).
基于Burrows-Wheeler变换的快速、准确的短读对齐。生物信息学25(14), 1754 - 1760。https://doi.org/10.1093/bioinformatics/btp324(2009)。
李,H。et al。序列对齐/映射格式和sam工具。生物信息学25(16), 2078 - 2079。https://doi.org/10.1093/bioinformatics/btp352(2009)。
麦肯纳,。et al。基因组分析工具包:用于分析下一代DNA测序数据的MapReduce框架。基因组Res。20.(9), 1297 - 1303。https://doi.org/10.1101/gr.107524.110(2010)。
Cingolani, P。et al。用于注释和预测单核苷酸多态性影响的程序,SnpEff:在基因组中的SNPs黑腹果蝇应变w1118;iso-2;iso-3。飞6(2), 80 - 92。https://doi.org/10.4161/fly.19695(2012)。
小泽,M., Hanada, K., Hamada, H. & Nakauchi, H.通过单个cd34低/阴性造血干细胞进行长期淋巴造血重建。科学273(5272), 242 - 245。https://doi.org/10.1126/science.273.5272.242(1996)。
Sommerkamp, P。et al。小鼠多能祖细胞位于造血干细胞和祖细胞之间的间期。血137(23), 3218 - 3224。https://doi.org/10.1182/blood.2020007876(2021)。
佐藤晴Y。et al。辐照小鼠精原细胞和成熟卵母细胞后代诱导突变的特征。科学。代表。10(1), 37岁。https://doi.org/10.1038/s41598-019-56881-2(2020)。
R核心团队。R:统计计算语言和环境,https://www.R-project.org/(2017)。
Salvagno, G., Sanchis-Gomar, F., Picanza, A. & Lippi, G.红细胞分布宽度:一个具有多种临床应用的简单参数。暴击。启中国。实验室。科学。52(2), 86 - 105。https://doi.org/10.3109/10408363.2014.992064(2015).
陈德伟。et al。老年健康小鼠获得克隆造血突变。血https://doi.org/10.1182/blood.2021014235(2021)。
Uehara Y。et al。Ku70基因的缺失消除了x射线诱导的小鼠组织中小缺失lacZ突变。Radiat。Res。170(2), 216 - 223。https://doi.org/10.1667/RR1283.1(2008)。
莫顿,l . M。et al。切尔诺贝利事故后甲状腺乳头状癌的辐射相关基因组图谱。科学https://doi.org/10.1126/science.abg2538(2021)。
阿德沃耶,A. B.,林赛,S. J.,杜布洛娃,Y. E. &赫勒斯,M. E.电离辐射对哺乳动物种系突变诱导的全基因组影响。Commun Nat。https://doi.org/10.1038/ncomms7684(2015).
Yoshida, K, Misumi, M, Kusunoki, Y. & Yamada, M.原子弹幸存者辐射暴露几十年后红细胞分布宽度的纵向变化。Br。j . Haematol。193(2), 406 - 409。https://doi.org/10.1111/bjh.17296(2021)。
米切尔,E。et al。人类生命周期中造血的克隆动力学。自然606(7913), 343 - 350。https://doi.org/10.1038/s41586-022-04786-y(2022)。
布施,K。et al。体内干细胞不受干扰造血的基本特性。自然518(7540), 542 - 546。https://doi.org/10.1038/nature14242(2015).
皮奇,O,雷耶斯-萨拉查,I.,冈萨雷斯-佩雷斯,A. &洛佩兹-比加斯,N.发现克隆造血的驱动。Commun Nat。13(1), 4267。https://doi.org/10.1038/s41467-022-31878-0(2022)。
法布尔,m·A。et al。克隆造血的纵向动力学和自然史。自然606(7913), 335 - 342。https://doi.org/10.1038/s41586-022-04785-z(2022)。
Ariyoshi, K。et al。C3H/He小鼠骨髓组织中γ辐照对造血祖细胞存活和趋化因子家族基因诱导的年龄依赖性Radiat。Res。181(3), 302 - 313。https://doi.org/10.1667/RR13466(2014)。
李,J。et al。反馈回路:心血管疾病中炎症信号和克隆造血之间的相互作用。摩尔。杂志。代表。48(4), 3785 - 3798。https://doi.org/10.1007/s11033-021-06370-5(2021)。
Nowakowska m K。et al。克隆造血突变与临床结果的关系:一项系统综述和荟萃分析。点。j .内科杂志。https://doi.org/10.1002/ajh.26465(2022)。
内村,一个。et al。早期胚胎突变揭示了小鼠体细胞和生殖细胞谱系的动态。基因组Res。32(5), 945 - 955。https://doi.org/10.1101/gr.276363.121(2022)。
确认
作者感谢Kazuaki小山先生、Hiroko Nagamura女士、Mika Yamaoka女士和Yoshiko Kubo女士对实验的协助。我们也感谢俊重正明先生对变种呼叫的协助。辐射效应研究基金会(RERF;广岛和长崎)是一个由日本厚生劳动省(MHLW)和美国能源部(DOE)资助的公益基金会。这项工作得到了RERF研究协议1-08和CR155的支持。作者的观点不一定反映两国政府的观点。
作者信息
作者和联系
贡献
K.Y.和Y.K.设计了这项研究。k.y.、s.k.、m.t.、y.m.、a.n.和Y.K.进行了实验。y.s., A.U和M.M.分析了数据。廖曜生,梁龙骥A.U。规则,S.K, M.T。Y.M,蒋振声,Y.K.写手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
吉田,K,佐藤,Y,内村,A。et al。全身x射线照射后,小鼠造血系统中多个克隆体大量扩增。Sci代表1217276(2022)。https://doi.org/10.1038/s41598-022-21621-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21621-6